
2024 年第一季度财务业绩和公司最新情况 2024 年 5 月 6 日附录 99.2
本幻灯片演示文稿包括前瞻性陈述 2 本演示文稿包含经修订的 1995 年《私人证券诉讼改革法》所指的前瞻性陈述,包括但不限于以下方面的陈述:BioNTech 在 BioNTech 合作伙伴控制的地区销售 BioNTech 的 COVID-19 疫苗(称为COMIRNATY)的预期收入和净利润/(亏损),特别是这些数字的陈述派生出来的来自 BioNTech 合作伙伴提供的初步估计;BioNTech 的 COVID-19 疫苗以及 BioNTech 的研究药物(如果获得批准)的市场接受率和程度;对 COVID-19 疫苗需求预期变化的预期,包括订购环境的变化以及调整疫苗以应对新变种或亚谱系的预期监管建议;BioNTech 研发计划的启动、时间、进展、结果和成本,包括 BioNTech 的研发计划当前和未来的临床前研究,以及临床试验,包括关于启动、注册和完成研究或试验的时间以及相关准备工作和结果的可得性,以及监管批准和上市许可申请的时间和结果的声明;其他潜在注册试验的目标时间和数量,以及BioNTech可能启动的任何试验的注册潜力;与监管机构的讨论;BioNTech对知识产权的预期;收购BioNTech的影响InstaDeep Ltd.及其合作和许可协议;可持续疫苗生产和供应解决方案的开发、性质和可行性;以及BioNTech对收入、研发支出、销售、一般和管理费用以及运营活动资本支出的估计。在某些情况下,前瞻性陈述可以通过诸如 “将”、“可能”、“应该”、“打算”、“计划”、“目标”、“预期”、“相信”、“估计”、“预测”、“潜力”、“继续” 或这些术语的否定词或其他类似术语来识别,尽管并非所有前瞻性陈述都包含这些词语。本演示文稿中的前瞻性陈述基于BioNTech当前对未来事件的预期和信念,既不是承诺也不是保证。您不应过分依赖这些前瞻性陈述,因为它们涉及已知和未知的风险、不确定性和其他因素,其中许多因素是BioNTech无法控制的,可能导致实际业绩与这些前瞻性陈述所表达或暗示的结果存在重大不利差异。这些风险和不确定性包括但不限于:研发固有的不确定性,包括满足预期临床终点的能力、临床试验的开始和/或完成日期、监管机构提交日期、监管机构批准日期和/或启动日期,以及与临床前和临床数据(包括本新闻稿中讨论的数据)相关的风险,包括可能出现不利的新临床前、临床或安全数据,以及对现有临床前、临床或安全数据;临床数据的性质,有待持续的同行评审、监管审查和市场解释;BioNTech 与政府当局、私人健康保险公司和其他第三方付款人就其 COVID-19 疫苗的定价和承保范围谈判;COVID-19 疫苗初始剂量或加强剂量的未来商业需求和医疗需求;来自其他 COVID-19 疫苗的竞争或与 BioNTech 的其他候选产品相关的竞争,包括具有不同作用机制和不同制造的产品,以及分销限制,主要基于功效、成本、储存和分发的便利性、批准用途的广度、副作用特征和免疫反应的耐久性;候选产品获得和维持监管批准的时机以及 BioNTech 获得和维持监管批准的能力;BioNTech 的 COVID-19 疫苗预防新兴病毒变种引起的 COVID-19 的能力;BioNTech 及其对手管理和采购必要能源的能力;BioNTech 及其对手管理和采购必要能源的能力;BioNTech Tech 识别研究机会并发现和发现的能力开发研究药物;BioNTech 的第三方合作者继续与 BioNTech 的开发候选药物和研究药物相关的研发活动的能力和意愿;COVID-19 对 BioNTech 开发计划、供应链、合作者和财务业绩的影响;据称因使用 BioNTech 开发或制造的产品和候选产品而产生的不可预见的安全问题和潜在索赔;BioNTech 及其合作者的能力商业化和营销BioNTech的 COVID-19 疫苗及其候选产品(如果获得批准);BioNTech管理其开发和扩张的能力;美国和其他国家的监管发展;BioNTech有效扩大其生产能力和制造其产品和候选产品的能力;与全球金融体系和市场相关的风险;以及BioNTech目前未知的其他因素。您应查看BioNTech截至2024年3月31日的6-K表报告以及BioNTech随后向美国证券交易委员会提交的文件中 “风险因素” 标题下描述的风险和不确定性,这些文件可在美国证券交易委员会网站www.sec.gov上查阅。这些前瞻性陈述仅代表截至本文发布之日。除非法律要求,否则,如果出现新信息、未来发展或其他情况,BioNTech不打算或承担任何更新或修改本演示文稿中包含的任何前瞻性陈述的意图或责任。

财务业绩首席财务官延斯·荷尔斯泰因3 战略展望首席战略官瑞安·理查森4 管道更新 Özlem Türeci,联合创始人兼首席医疗官2 2024年第一季度要点联合创始人兼首席执行官乌格尔·萨欣1

1 2024年第一季度亮点 Ugur Sahin,创始人兼首席执行官

2024 年战略优先事项和 2024 年第一季度成就 5 1.与 Duality Biologics 合作;2 与罗氏集团成员基因泰克合作 3.与辉瑞合作。HER2 = 人类表皮生长因子受体 2;ADC = 抗体药物偶联物,HR = 激素受体;AACR = 美国癌症研究协会:mRNA = 信使核糖核酸;PDAC = 胰腺导管腺癌;NSCLC = 非小细胞肺癌;TROP2 = 滋养细胞表面抗原 2。在 AACR 上公布了 PDAC 中的 mRNA 癌症疫苗自体基因 cevumeran (BNT122) 2 和 NSCLC 的 BNT116 的临床数据任命安娜玛丽·哈内坎普为首席商务官从 7 月起在评估我们针对HR+/HER2-低乳腺癌的 HER2 ADC BNT323/DB-13031 的 HR+/HER2-Low 乳腺癌的 HER2 ADC BNT323/DB-13031 的三期临床试验中给药的第一位患者获得了 TROP2-ADC BNT325/DB-13051 治疗的快速通道认证铂耐药性卵巢上皮癌、输卵管癌或原发性腹膜癌推进2024/2025赛季适应变体的 COVID-19 疫苗3 临床肿瘤学领域的执行肿瘤学商业准备工作 COVID-19 领导层任命了全球商业集团的更多专业知识以推动首次全球产品发布已开始在美国开展商业业务的美国被任命为总经理
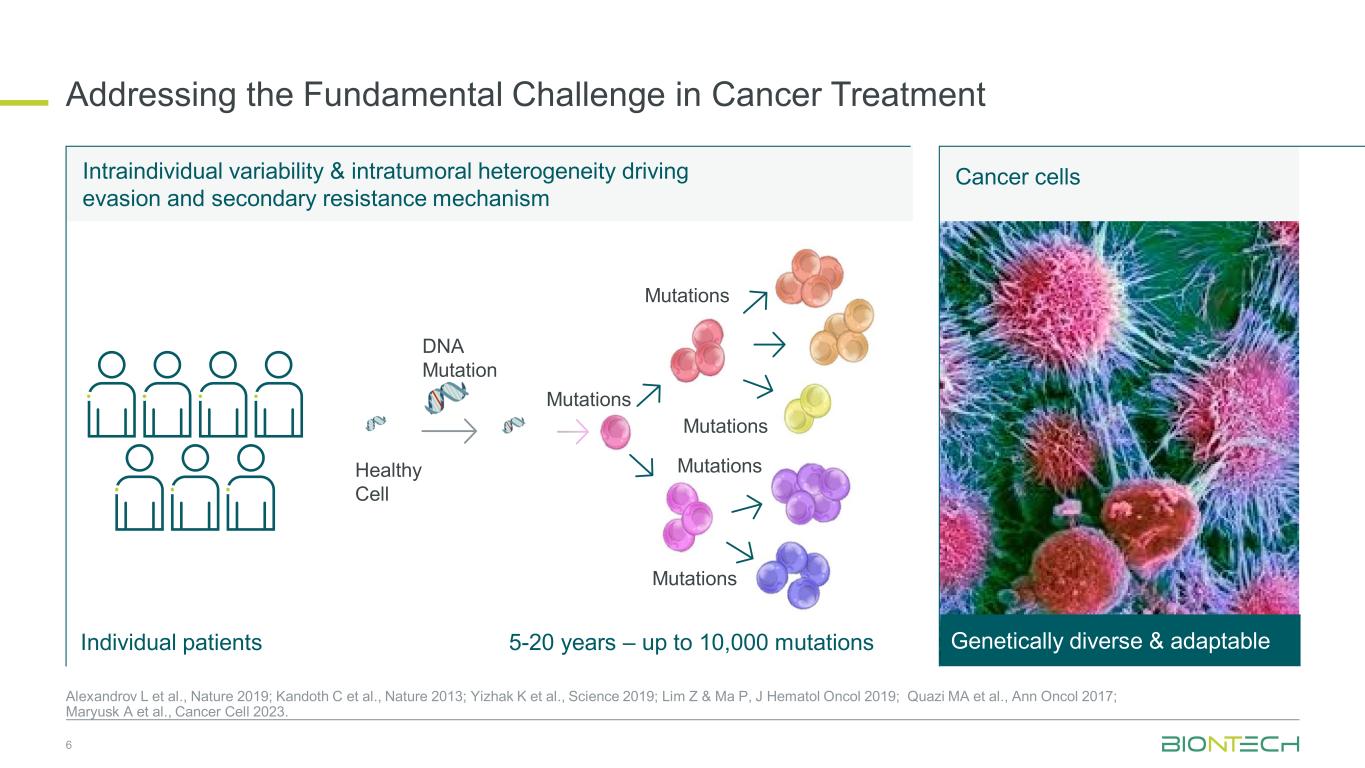
个体内变异性和肿瘤内异质性推动逃避和继发耐药机制应对癌症治疗的根本挑战癌细胞遗传多样性和适应性 5-20 年——多达 10,000 个突变 DNA 突变健康细胞突变突变个体患者 6 Alexandrov L 等人,2019 年;Kandoth C 等人,《自然》2013;Yizhak K 等人,Science 2019;Lim Z & Ma P,J Hematol Oncol 2019;Quazi MA 等人,Ann Oncol 2017;Maryusk A 等人,《癌细胞 2023》。

我们的 Oncology Approach 7 策略组合涵盖具有协同作用机制的化合物类别 • 免疫调节剂 • 靶向疗法 • 针对各种实体瘤和治疗阶段的个性化和现成的 mRNA 疫苗项目具有一流和/或一流潜力的项目独特的治疗组合目标解决癌症的连续性为癌症患者提供新疗法并建立新的治疗模式开辟新选择,将平台和疗法相结合
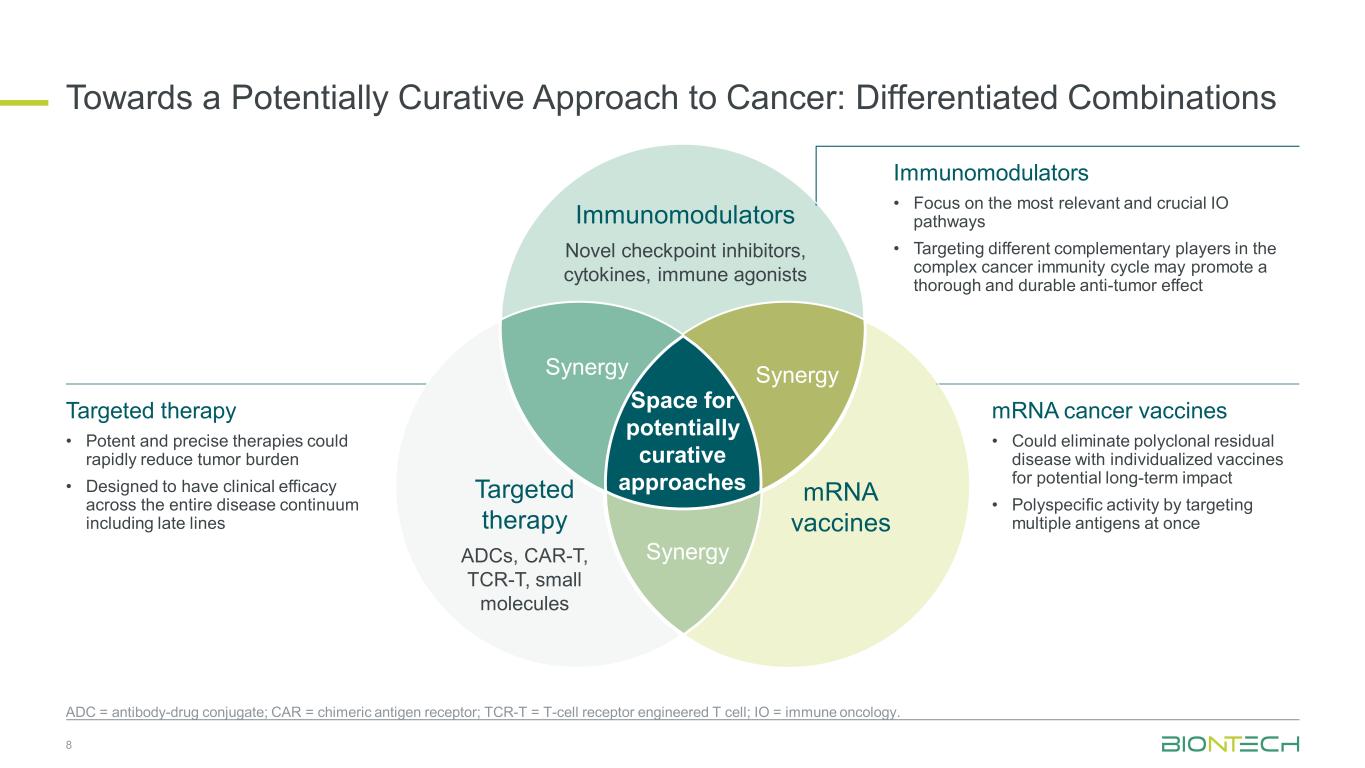
走向癌症的潜在治疗方法:差异化组合空间免疫调节剂新型检查点抑制剂、细胞因子、免疫激动剂 mRNA 疫苗靶向治疗 ADC、CAR-T、TCR-T、小分子 SynergySynergy 8 ADC = 抗体药物偶联物;CAR = 嵌合抗原受体;TCR-T = T 细胞受体工程的 T 细胞;IO = 免疫肿瘤学。免疫调节剂 • 专注于最相关和最关键的 IO 途径 • 在复杂的癌症免疫周期中针对不同的互补参与者可以促进全面而持久的抗肿瘤作用 mRNA 癌症疫苗 • 可使用个性化疫苗消除多克隆残留疾病,从而产生潜在的长期影响 • 通过同时靶向多种抗原进行多特异性活性靶向治疗 • 强效而精确的疗法可以迅速减轻肿瘤负担 • 旨在在包括晚期在内的整个疾病中具有临床疗效
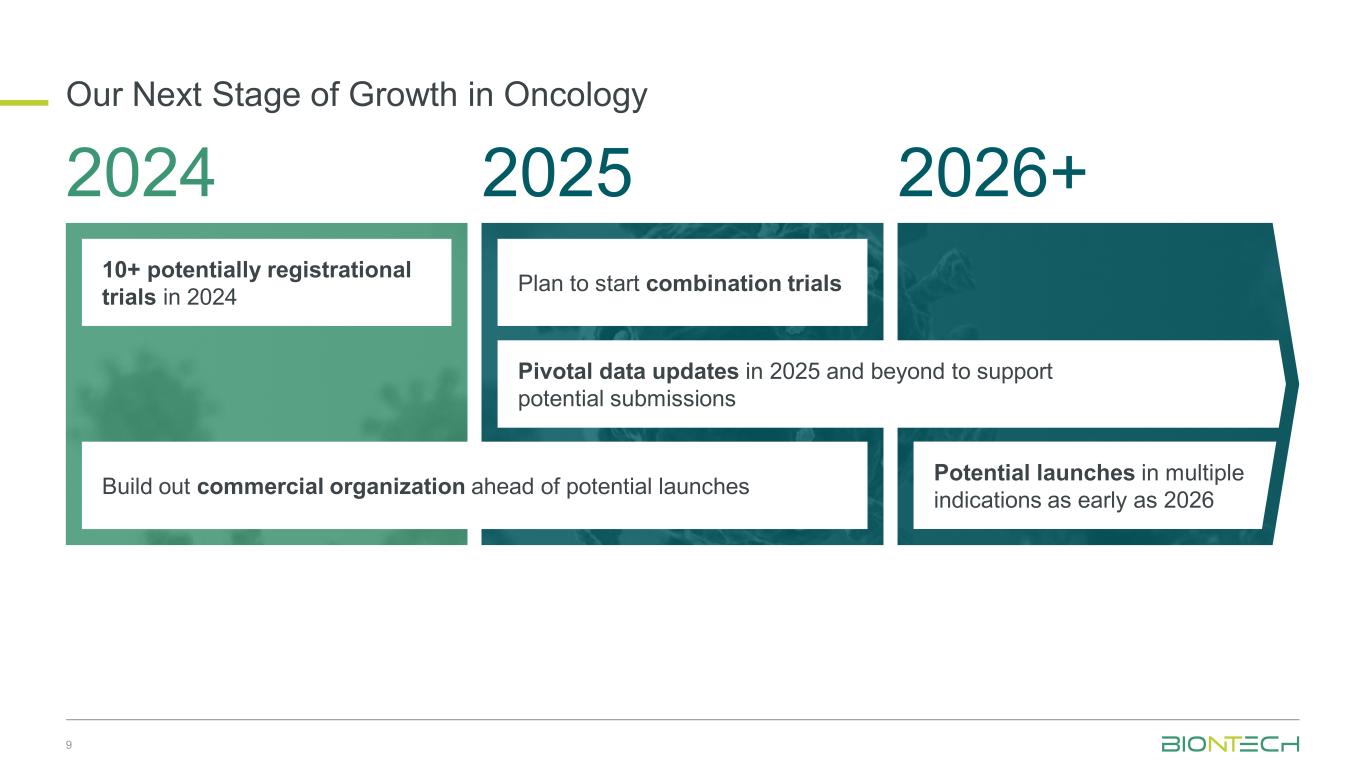
我们在肿瘤学领域的下一阶段增长9 2024 2025 2026+ 2024年有10多项可能注册的试验在可能的上市之前建立商业组织计划在2025年及以后的联合试验更新关键数据以支持可能的提交最早于2026年在多种适应症中推出

2 Pipeline Update Özlem Türeci,联合创始人兼首席医疗官
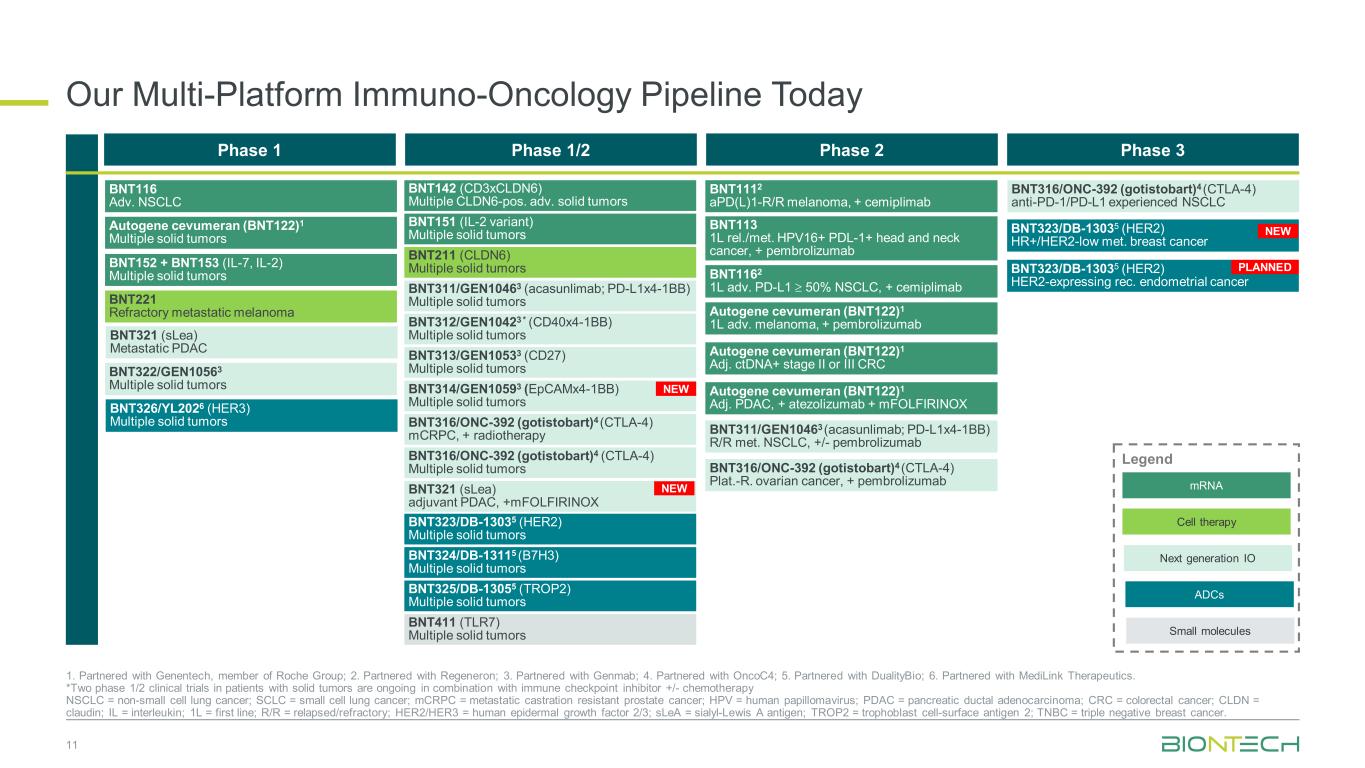
我们今天的多平台免疫肿瘤学产品线 11 1.与罗氏集团成员基因泰克合作;2.与 Regeneron 合作;3.与 Genmab 合作;4.与 onCOC4 合作;5.与 DualityBio 合作;6.与 MediLink Therapeutics 合作。*正在对实体瘤患者进行两项1/2期临床试验,联合免疫检查点抑制剂+/-化疗 NSCLC = 非小细胞肺癌;SCLC = 小细胞肺癌;mcRPC = 转移性去势抵抗性前列腺癌;HPV = 人乳头瘤病毒;PDAC = 胰腺导管腺癌;CLDN = 克劳丁;IL = internet 白蛋白;1L = 第一线;R/R = 复发/难治性;HER2/HER3 = 人类表皮生长因子 2/3;sleA = Sialyl-Lewis A 抗原;TROP2 = 滋养层细胞表面抗原 2;TNBC = 三倍乳腺癌阴性。1 期 1/2 期 2 期 3 期 BNT211 (CLDN6) 多发实体瘤 BNT311/GEN10463(acasunlimab;pd-l1x4-1bb)多发性实体瘤 BNT312/GEN10423 * (cd40x4-1bb) 多发实体瘤 BNT313/GEN10533 (CD27) 多发性实体瘤 BNT316/ONC-392 (gotistobart) 4 (CTLA-4) 多发性实体瘤 BNT151(IL-2 变体)多发实体瘤 BNT142 (CD3xcldn6) 多个 cldn6-poS. adv. 实体瘤 BNT325/DB-13055 (TROP2) 多发实体瘤 BNT316/ONC-392 (gotistobart) 4 (CTLA-4) 抗PD-1/PD-L1 经历过非小细胞肺癌 BNT323/DB-13035 (HER2) 多发性实体瘤 BNT323/DB-13035 (HER2) 多发性实体瘤 BNT323/DB-13035 (HER2) 多发性实体瘤 BNT323/DB-13035 (HER2) 多发性324/DB-13115 (B7H3) 多发性实体瘤 BNT323/DB-13035 (HER2) HR+/HER2-Low met. 乳腺癌 BNT116 Adv. NSCLC BNT152 + BNT153 (IL-7、IL-2) 多发实体瘤 BNT221 难治性转移性黑色素瘤 BNT321 (sLEA) 转移性 PDAC BNT322/GEN10563 多发实体瘤 Autogene cevumeran (BNT122) 1 多发性实体瘤 BNT322/GEN10563 多发实体瘤 BNT322/GEN10563 多发实体瘤 BNT322/GEN10563 多发实体瘤 BNT322/GEN10563 多发实体瘤 T314/GEN10593 (epcamx4-1BB) 多重实体瘤 mRNA 下一代 IO 细胞疗法 Legend 小分子 ADC BNT326/YL2026 (HER3) 多发性实体瘤 BNT311/GEN10463(acasunlimab;pd-l1x4-1BB)R/R metNSCLC,+/-pembrolizumab BNT1112 apD (L) 1-R/R 黑色素瘤,+ cemiplimab BNT113 1L rel/met。HPV16+ PDL-1+ 头颈部癌,+ pembrolizumab Autogene cevumeran (BNT122) 1 1L 晚期黑色素瘤,+ pembrolizumab Autogene cevumeran (BNT122) 1 Adv. ctDNA+ III 期或 III 期 CRC BNT1162 1L adv。PD-L1 ≥ 50% 非小细胞肺癌,+ cemiplimab Autogene cevumeran (BNT122) 1 Adj. PDAC,+ atezolizumab + mfolfirinox BNT316/ONC-392 (gotistobart) 4 (CTLA-4) Plat。-R. 卵巢癌,+ pembrolizumab BNT316/ONC-392(gotistobart)4(CTLA-4)mcRPC,+ 放射治疗 BNT411(TLR7)多发实体瘤 BNT321(sLEA)辅助PDAC,+mfolfirinox BNT323/DB-13035(HER2)表达 HER2 的推荐子宫内膜癌新增新品
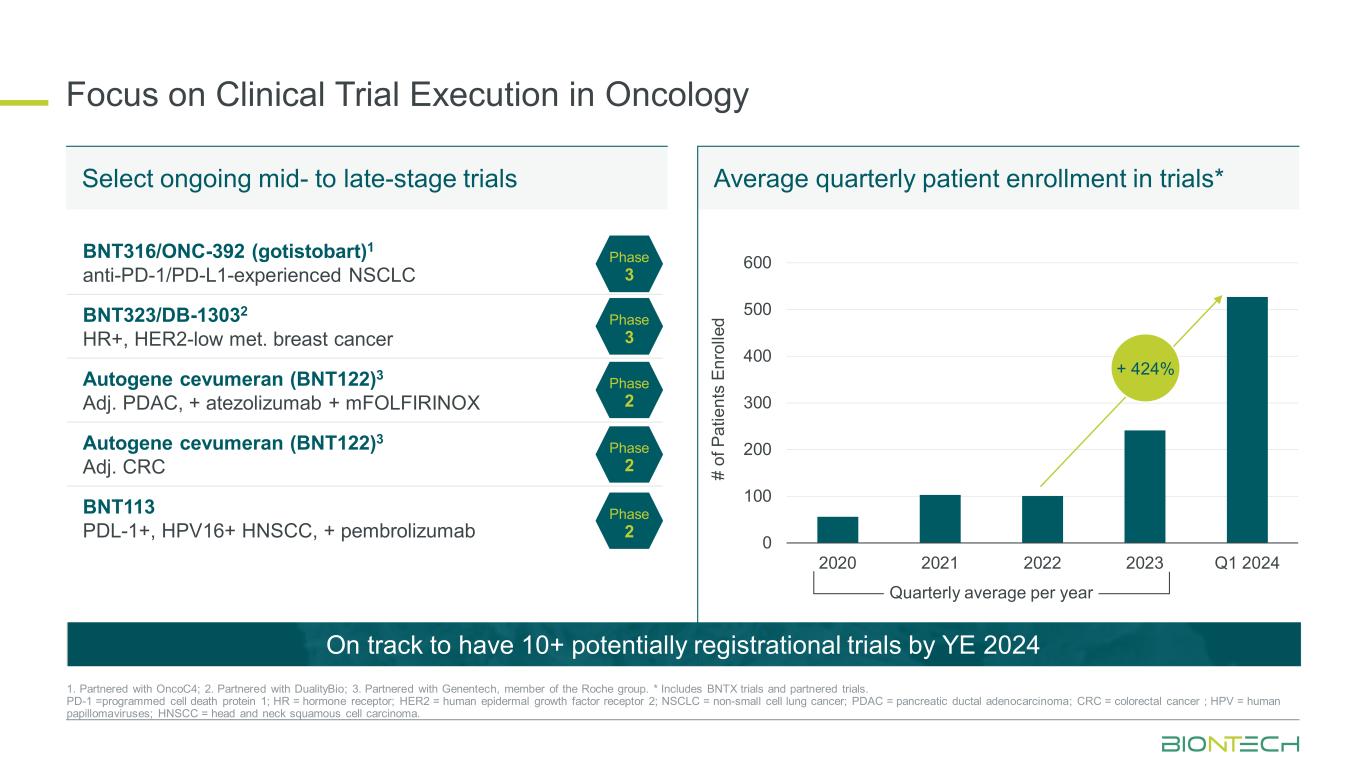
重点关注肿瘤学临床试验的执行 0 100 200 300 400 500 600 2020 2021 2023 年第一季度 + 424% BNT316/ONC-392(gotistobart)1 具有抗PD-1/PD-L1经验的非小细胞肺癌 BNT323/DB-13032 HR+,HER2-低甲基因乳腺癌 Autogene cevumeran (BNT122) 3 Adj.PDAC,+ atezolmab + mfolfirinox Autogene cevumeran (BNT122) 3 Adj. CRC BNT113 PDL-1+、HPV16+ HNSCC、+ pembrolizumab 第 3 期第 3 期第 2 阶段 2 期 1。与 onCOC4 合作;2.与 DualityBio 合作;3.与罗氏集团成员基因泰克合作。* 包括 BNTX 试验和合作试验。PD-1 = 程序性细胞死亡蛋白 1;HR = 激素受体;HER2 = 人类表皮生长因子受体 2;NSCLC = 非小细胞肺癌;PDAC = 胰腺导管腺癌;CRC = 结直肠癌;HPV = 人乳头瘤病毒;HNSCC = 头颈部鳞状细胞癌。选择正在进行的中后期试验每季度试验的患者入组人数*有望在2024财年之前进行10多项潜在注册试验的P at ie nt s En ro lle d 每年季度平均值
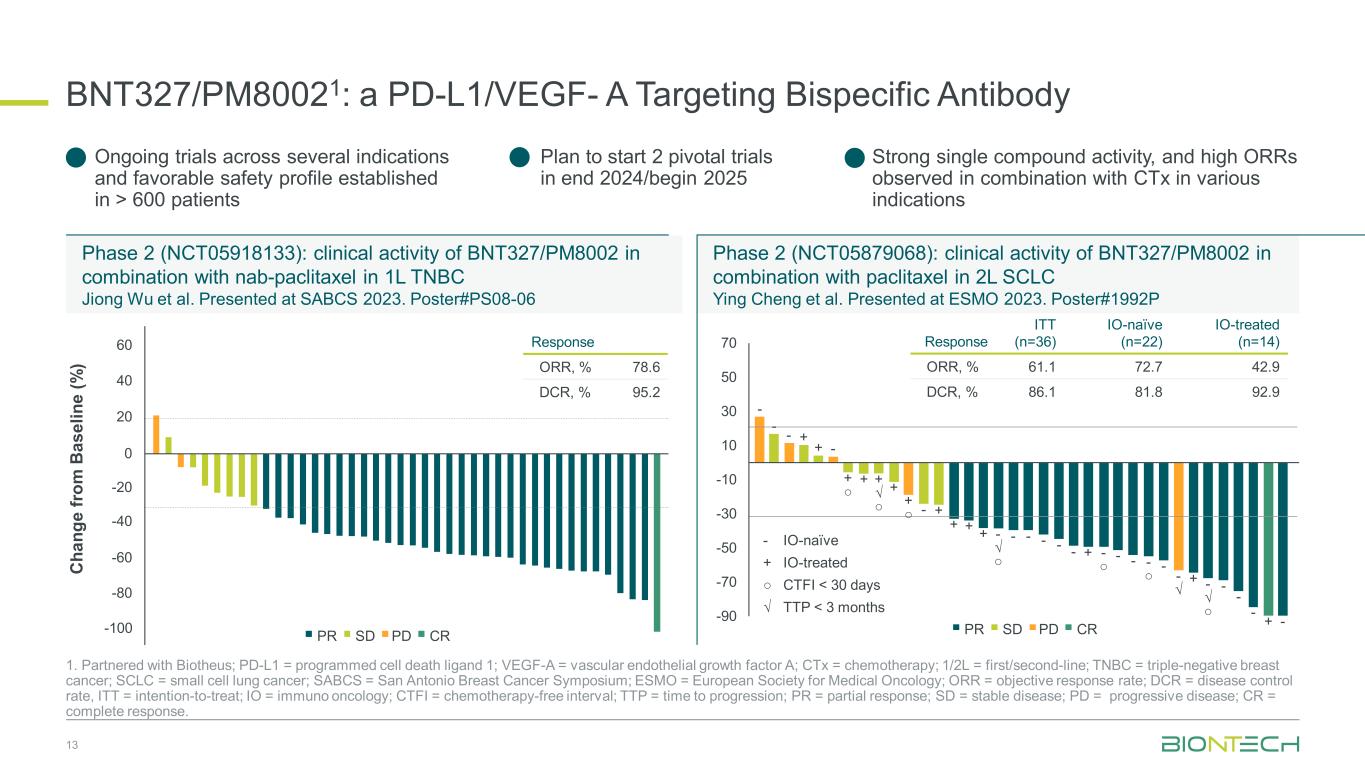
BNT327/PM80021:一种靶向双特异性抗体的 PD-L1/VEGF-A 13 1.与 Biotheus 合作;PD-L1 = 程序性细胞死亡配体 1;VEGF-A = 血管内皮生长因子 A;ctx = 化疗;1/2L = 一线/二线;TNBC = 三阴性乳腺癌;SCLC = 小细胞肺癌;SABCS = 圣安东尼奥乳腺癌研讨会;ESMO = 欧洲肿瘤内科学会;ORR = 客观反应率;DCR = 疾病控制率,ITT = 意图待治疗;IO = 免疫肿瘤学;CTFI = 无化疗间隔;TTP = 进展时间;PR = 部分反应;SD = 稳定疾病;PD = 进展性疾病;CR = 完全治疗回应。第 2 阶段(NCT05918133):BNT327/PM8002 与 nab-paclitaxel 联合用于 1L TNBC 的临床活性 Jiong Wu 等人。在 SABCS 2023 上展出。海报 #PS08 -06 第 2 阶段 (NCT05879068):BNT327/PM8002 与紫杉醇联合用于 2L SCLC 的临床活性 Ying Cheng 等人。在 ESMO 2023 上展出。海报 #1992P C ha ng e fr om b as el in e (%) -100 60 40 0 -20 -40 -80 20 -60 CRPDSDPR 回应 ORR,% 78.6 DCR,% 95.2---+-+ ○ + √ + √ + √---+ √----√-√-√-√-√-√-√-√--√--√--√--√--√--√---√--√---√---√---√---√---√---√---√---√---√---√---√---√---√---√---√---√---√--经过 IO-naieve + IO 治疗的 ○ CTFI 600 名患者计划在 2024 年底/2025 年初开始 2 项关键性试验,在各种适应症中与 ctX 联合使用时观察到的强大单一化合物活性和较高的 ORR CRPDSDPR -90 -70 -50 -30 -30 -10 10 30 50 70
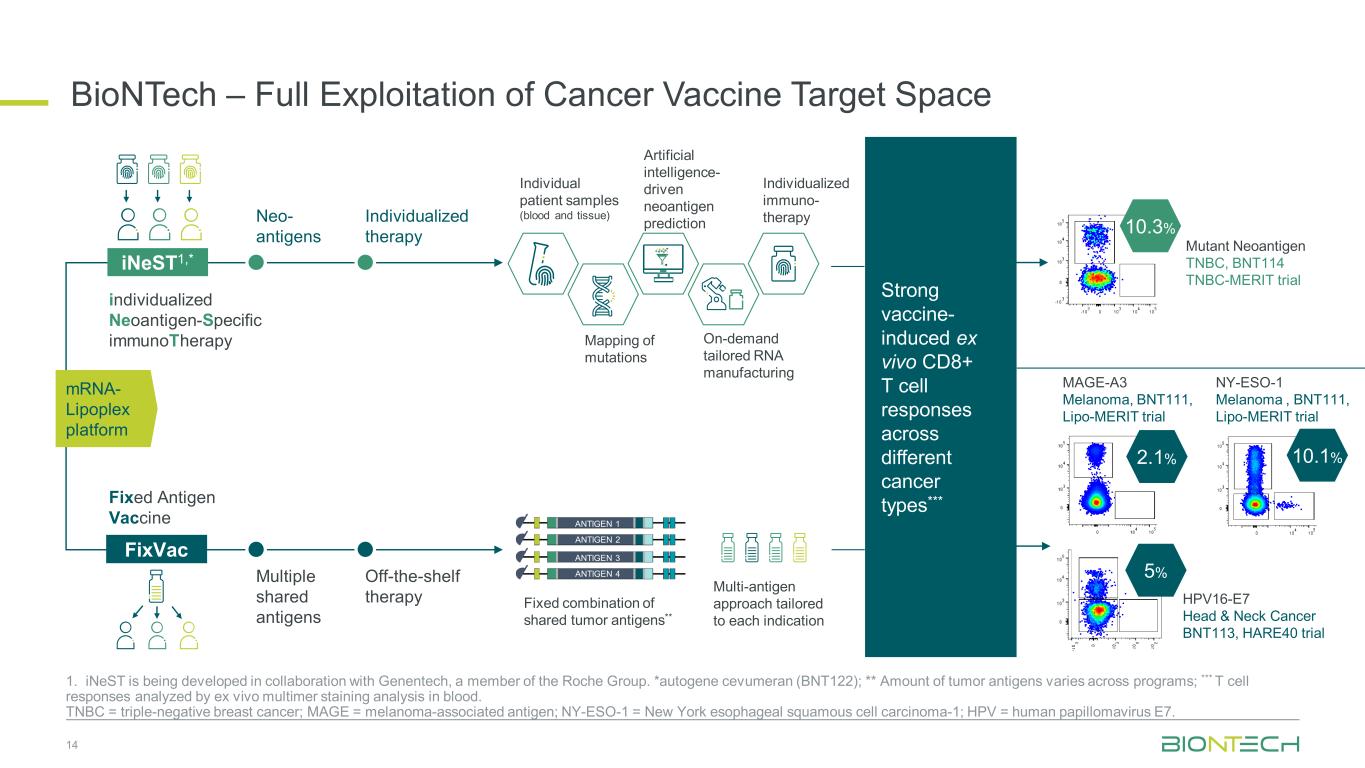
BioNTech — 全面利用癌症疫苗目标空间 14 1. iNEST 是与罗氏集团成员基因泰克合作开发的。*autogene cevumeran (BNT122);** 肿瘤抗原的含量因项目而异;*** 通过血液中的体外多聚体染色分析分析 T 细胞反应。TNBC = 三阴性乳腺癌;MAGE = 黑色素瘤相关抗原;NY-ESO-1 = 纽约食道鳞状细胞癌 1;HPV = 人乳头瘤病毒 E7。个体患者样本(血液和组织)人工智能驱动的新抗原预测按需定制 RNA 制造个性化免疫疗法突变图谱共享肿瘤抗原的固定组合**针对每种适应症量身定制的多抗原方法新抗原个性化治疗多种共享抗原现成疗法 inest1,* FIXVAC 个性化新抗原特异性免疫疗法固定抗原疫苗抗原 1 抗原 2 抗原 3 抗原 4 强疫苗-诱导不同体外 CD8+ T 细胞反应癌症类型*** 10.3% 10.1% HPV16-E7 头颈癌 BNT113、HARE40 试验突变新抗原 TNBC、BNT114 TNBC-MERIT 试验 5% MAGE-A3 黑色素瘤、BNT111、Lipo-Merit 试验 2.1% NY-ESO-1 黑色素瘤、BNT111、Lipo-Merit 试验 mRNA-Lipoplex 平台
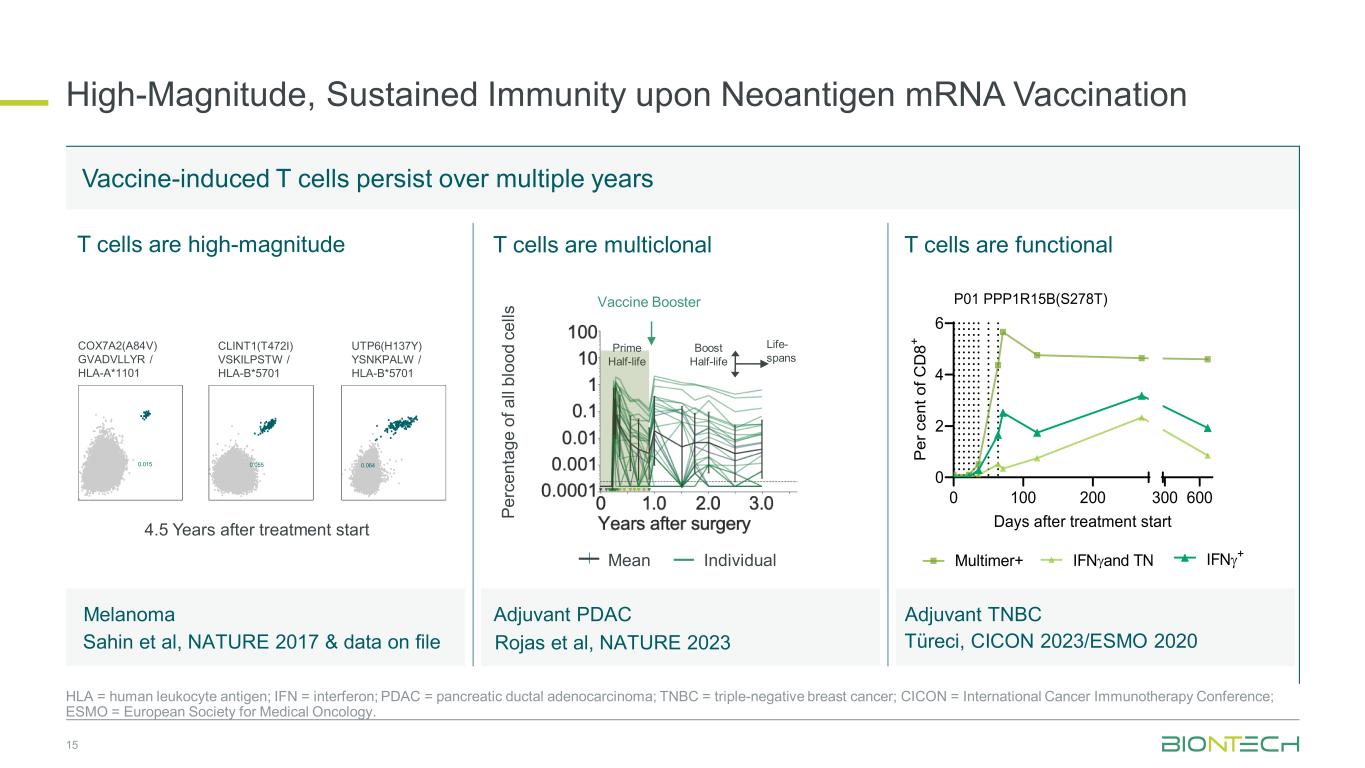
新抗原 mRNA 疫苗接种后的高强度、持续免疫力 15 HLA = 人类白细胞抗原;IFN = 干扰素;PDAC = 胰腺导管腺癌;TNBC = 三阴性乳腺癌;CICON = 国际癌症免疫疗法会议;ESMO = 欧洲肿瘤内科学会。TNBC 疫苗诱导的辅助性 T 细胞可存活多年 T 细胞为高强度 COX7A2 (A84V) GVADVLLYR/HLA-A*1101 CLINT1 (T472I) VSKILPSTW/HLA-B*5701 UTP6 (H137Y) YSNKPALW/HLA-B*5701 0.015 0.055 0.064 治疗开始后 4.5 年平均单个 T 细胞是多克隆 T 细胞功能正常 0 100 200 0 0 2 4 6 300 600 治疗开始后 P per c en t o f C D 8+ P01 PPP1R15B (S278T) 黑色素瘤 Sahin 等人,NATURE 2017 和档案中的数据 Azuvant PDAC Rojas 等人、NATURE 2023 Multimer+ IFNγ+ Prime 半衰期提升半衰期-跨度疫苗助推器 Pe rc en ta ge o a ll bl oo d ce lls Türeci,CICON 2023/ESMO 2020
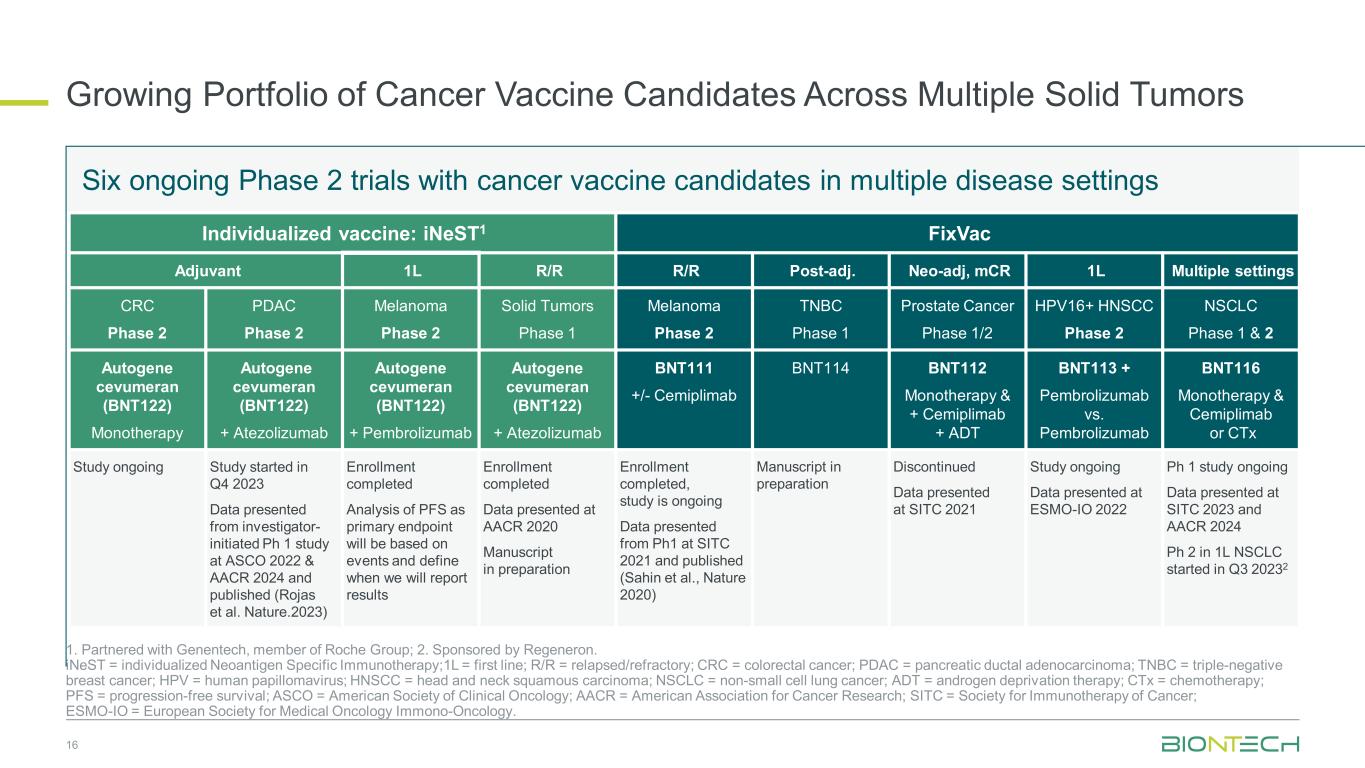
针对多种实体瘤的候选癌症疫苗组合不断增加 16 1.与罗氏集团成员基因泰克合作;2.由 Regeneron 赞助。iNEST = 个性化新抗原特异性免疫疗法;1L = 第一线;R/R = 复发/难治性;CRC = 结直肠癌;PDAC = 胰腺导管腺癌;TNBC = 三阴性乳腺癌;HPV = 人乳头瘤病毒;HNSCC = 头颈部鳞状癌;NSCLC = 非小细胞肺癌;ADT = 雄激素剥夺疗法;ctx = 化疗;PFS = 无进展存活率;ASCO = 美国临床肿瘤学会;AACR = 美国癌症研究协会;SITC = 癌症免疫疗法学会;ESMO-IO= 欧洲肿瘤内科学会免疫肿瘤学。正在进行六项针对多种疾病环境的候选癌症疫苗的二期试验。个体化疫苗:inest1 FixVac Azuvant 1L 复发后复发/R。neo-adj、mcR 1L 多种设置 CRC 2 期 PDAC 2 期黑色素瘤 2 期实体瘤 1 期黑色素瘤 2 期 TNBC 1 期前列腺癌 1/2 期 HPV16+ HNSCC 2 期 NSCLC 第 1 期和 2 期 Autogene cevumeran (BNT122) 单一疗法 Autogene cevumeran (BNT122) + Atezolizumab Autogene Autogene cevumeran (BNT122) + Pembrolizumab Autogene cevumeran (BNT122) + Atezolizumab BNT111 +/-Cemiplimab BNT114 BNT112 单一疗法 & + Cemiplimab + ADT BNT113 + Pembrolizumab 与 Pembrolizumab 对比 Pembrolizumab BNT116 正在进行的研究始于 2023 年第四季度的研究数据来自研究者在 ASCO 2022 和 AACR 2024 发起的 Ph 1 研究并发表(Rojas 等人Nature.2023) 注册已完成 PFS 作为主要终点的分析将基于事件并确定我们何时报告结果注册完成在 AACR 2020 上提交的手稿报名已完成,研究仍在进行中(Sahin 等人,《自然 2020》)准备中的手稿在 SITC 2021 上提供的已停产数据研究正在进行中 SITC 2021 Ph 1 上提供的数据正在进行的研究数据在 SITC 2023 和 2023 上呈现的正在进行的研究数据 1L NSCLC 中的 AACR 2024 Ph 2 于 2022 年第三季度开始

Autogene Cevumeran(BNT122)1在一项2期随机试验中与辅助性结直肠癌的观察等待进行了研究 17 1。与罗氏集团成员基因泰克合作。2.小谷等《自然 2023》,Nakamura 等人。ESMO 2023;3.安德烈 T 等人。J Clin Onc. 2015 CT = 计算机断层扫描;CRC = 结直肠癌;SoC = 标准护理;qxw = 每 X 周;ctDNA = 循环肿瘤 DNA;(m)DFS =(中位数)无病存活率;OS = 总存活率;RFS = 无复发存活率;TTR = 治疗失败时间。Autogene cevumeran (BNT122) 15 剂量:6×q1w、2×q2w、7×q6w 观察观察性等待辅助 SoC 化疗 12—24 周纳入标准手术切除的 II 期(高风险)或 III 期 CRC 筛查 1 ctDNA 状态(术后)筛选 2 疫苗制造的新抗原筛选 3 最终资格(ctDNA 阳性)n=164 R 1:1 生物标志物:不管 ctDNA 状态如何 BNT122(n=15)iNEST 制造 ≤20 个新表位探索性:BNT122 筛查 3 时复发疾病(n≤20)关键终点状态 • 首位患者剂量(随机队列):2021 年 12 月 • 正在进行的研究初级:无病存活率:RFS、TTR、TTF、OS ctDNA 状态变化 2 期、多站点、开放标签、随机、对照试验 (NCT04486378) 结直肠癌患者的历史疗效2、ctDNA+ 患者中 3 个 MDF:6 个月 5 年 DFS 率:第二阶段(高风险)~ 80%,第三阶段 ~ 66% 5-6% 年操作系统率:第二阶段(高风险)~ 88% ',第三阶段 ~ 76%

Autogene Cevumeran (BNT122) 1 在一项针对切除的 PDAC 18 1 的 SoC 的 2 期随机试验中进行了研究。与罗氏集团成员基因泰克合作;2.Conroy T. 等人JAMA 公司,2022年SoC = 护理标准;PDAC = 胰腺导管腺癌;(m)DFS =(中位数)无病存活率;(m)OS =(中位数)总存活率;FPD = 首例患者给药关键终点主要:DFS 率、操作系统、操作系统率和安全状态 • 招募中 • FPD 2023 年 10 月纳入标准 A 部分从血液和肿瘤中确定 ≥5 个新表位定制制造 BNT122 筛查样品 B 部分根据 IN/EX 标准确认患者资格 n=260 R 1:1 治疗阶段和给药时间表在研究期间,对患者进行监测按预定间隔直至PDAC复发、新癌症发生或不可接受的毒性(以先发生者为准)。手术后 6-12 周随机分组 Autogene cevumeran (BNT122) + atezolizumab + mfolfirinox mfolfirinox IMCODE003:第 2 阶段,开放标签、多中心、随机试验 (NCT05968326) • 切除余量 • 节点受累分层因素 mfolfirinox 单一疗法的历史疗效2 MDF = 21.4 个月,5 年 DFS = 26.1% mOS = 53.5 月,5 年操作系统 = 43.2% • PDAC 切除术患者 • 事先未对 PDAC 进行过全身抗癌治疗 • 手术后无疾病证据
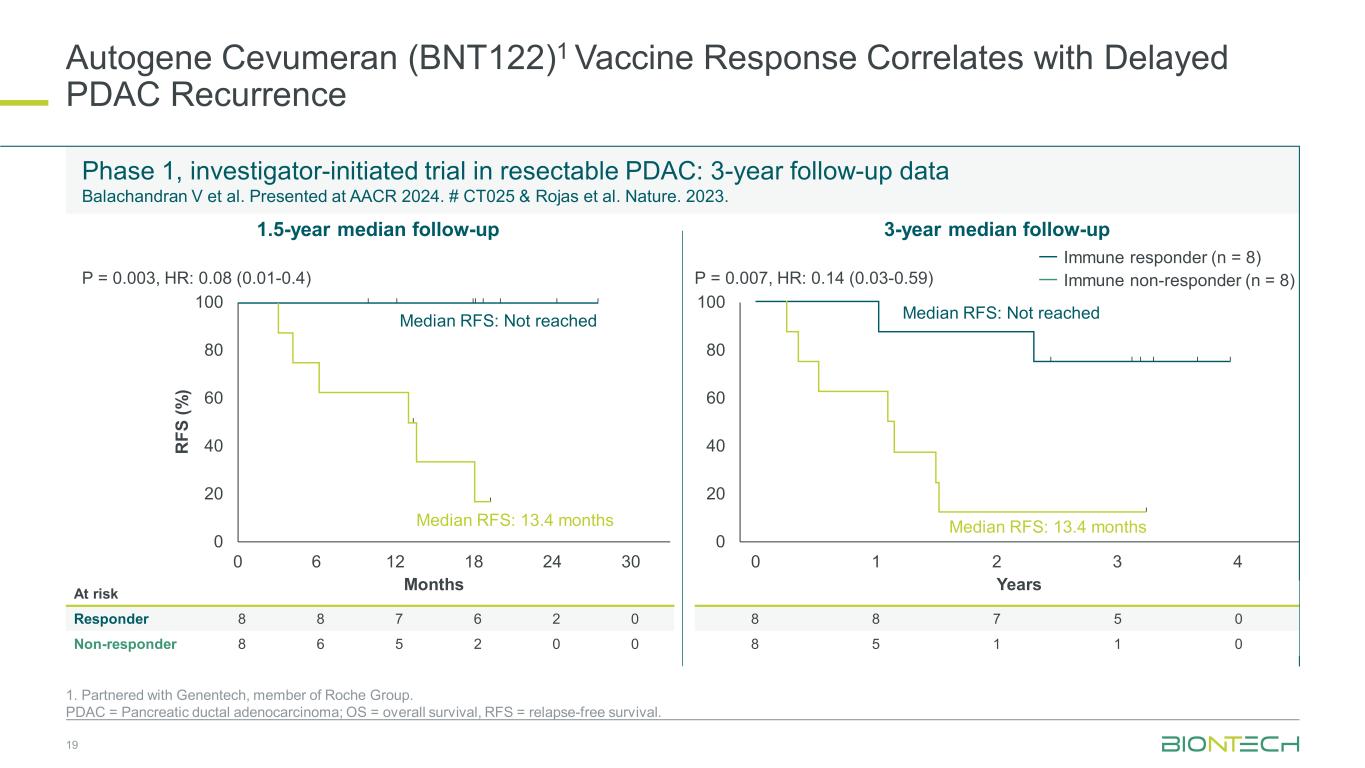
Autogene Cevumeran (BNT122) 1 疫苗反应与 PDAC 延迟复发相关 1.与罗氏集团成员基因泰克合作。PDAC = 胰腺导管腺癌;OS = 总存活率,RFS = 无复发存活率。第一阶段,研究者发起的可切除PDAC试验:3年随访数据Balachandran V等人。在 AACR 2024 上展出。# CT025 & Rojas 等人。自然。2023. 19 处于风险中的响应者 8 8 7 6 6 2 0 0 无反应者 8 6 5 2 0 8 8 7 5 0 1 1 0 1.5 年随访中位数 3 年随访中位数 0 20 40 60 80 100 R FS (%) 月 0 20 40 60 80 100 RFS (%) 月份 0 20 40 60 80 100 年 RFS 中位数:未达到中位数 RFS:13.4 个月免疫反应者 (n = 8) 0 6 12 18 24 30 0 1 2 3 4 中位数 RFS:未达到中位数 RFS:13.4 个月 P = 0.003,HR:0.08 (0.01-0.4) P = 0.007,HR:0.14 (0.03-0.59)
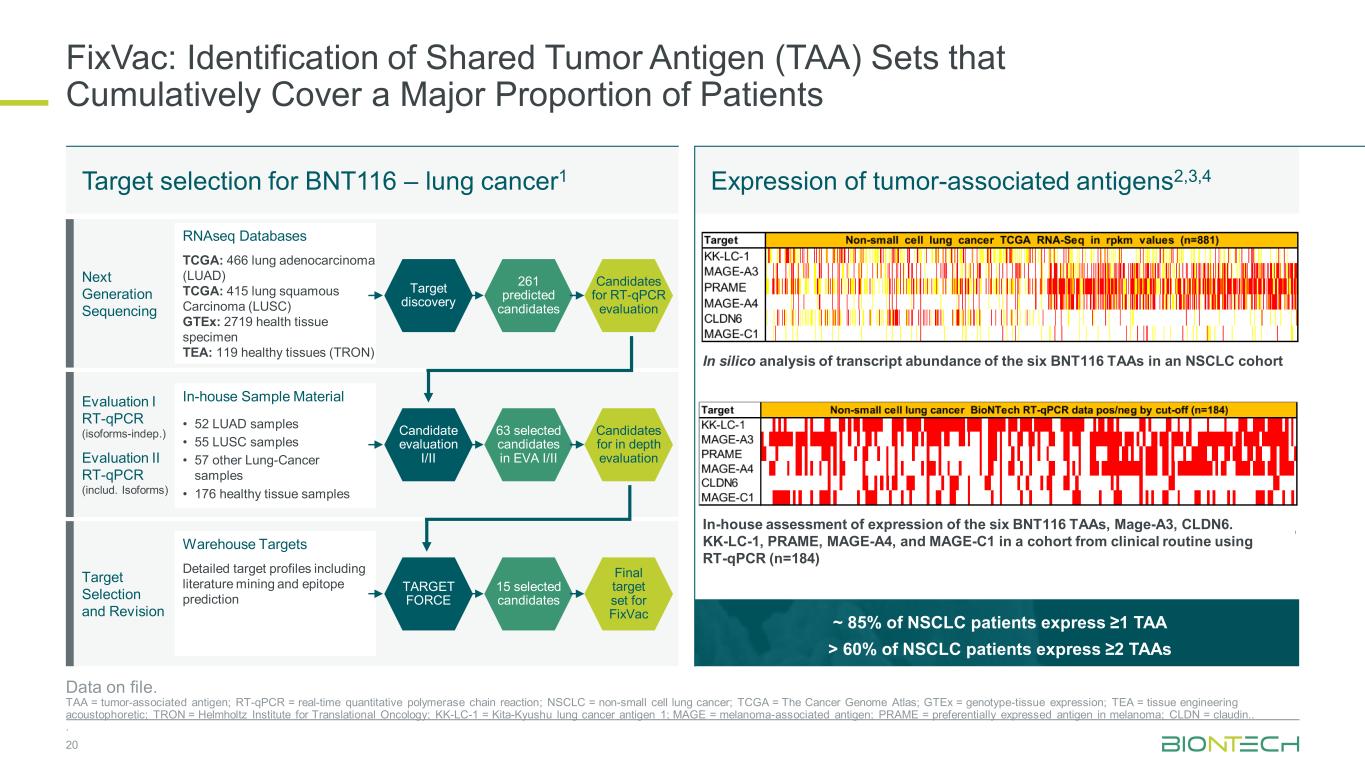
约 85% 的非小细胞肺癌患者表达 ≥1 TAA > 60% 的非小细胞肺癌患者表达 ≥2 个 TaaS FixVac:识别累积覆盖大部分患者的共享肿瘤抗原 (TAA) 集合 20 个存档数据。TAA = 肿瘤相关抗原;RT-qPCR = 实时定量聚合酶链反应;NSCLC = 非小细胞肺癌;TCGA = 癌症基因组图集;gTeX = 基因型组织表达;TEA = 组织工程声电泳剂;TRON = 亥姆霍兹肿瘤转化研究所;KK-LC-1 = 北九州肺癌抗原 1;MAGE = 黑色素瘤相关抗原;PRAME = 优先黑色素瘤中表达的抗原;CLDN = claudin..。BNT116 — 肺癌的靶点选择1 肿瘤相关抗原的表达2,3,4 下一代测序评估 I Rt-qPCR(同种型索引)评估二 Rt-qPCR(包括Isoforms)靶点选择和修订 RnaSeq 数据库 TCGA:466 个肺腺癌 (LUAD) TCGA:415 个肺鳞状癌 (LUSC) gTeX:2719 个健康组织标本 TEA:119 个健康组织 (TRON) 内部样本材料 • 52 个 LUAD 样本 • 57 个其他肺癌样本 • 176 个健康组织样本仓库目标详细目标概况,包括文献挖掘和表位预测目标发现候选评估 I/II TARGET FORCE RT-qPCR 评估候选物深度评估的候选对象 FixVac 的最终目标设定261 位预测候选人在 EVA I/II 中入选了 63 位候选人 15 位入选候选人对非小细胞肺癌队列中六种 BNT116 TAA 的转录丰度进行计算机分析。对六种 BNT116 TAA、Mage-A3、CLDN6 的表达进行了内部评估。使用 RT-qPCR 的临床常规队列中的 KK-LC-1、PRAME、MAGE-A4 和 MAGE-C1(n=184)

N = 130N = 130 BNT116:对非小细胞肺癌作为单一疗法和组合疗法的广泛评估 21 1.由 Regeneron 赞助;NSCLC = 非小细胞肺癌;FIH = 人类首例;PD-L1 = 程序性细胞死亡配体 1;TPS = 肿瘤比例分数;RECIST = 实体瘤反应评估标准;ECOG PS = 东部合作肿瘤学小组表现状况;DLT = 剂量限制毒性;ORR = 总体反应时间;DCR = 疾病控制率;DDC = 疾病控制时间;PDC = 疾病控制时间;PDC = 疾病控制时间;PDC = 疾病控制时间;PDC = 疾病控制时间;PDC = 疾病控制时间;PDC = 疾病控制时间;PDC = 疾病控制时间;PDC = 疾病控制时间;PDC = 疾病控制时间;PDC = 疾病控制时间;PDC = 疾病控制时间;PDC = 疾病控制时间 FS = 无进展存活率;OS = 总存活率;TEAE = 治疗紧急不良事件;SAE = 严重不良事件;CRT =放化疗。主要终点:第 1 周期 DLT 发生率,安全次要终点:ORR、DoR、DCR、DDC、PFS、OS OS 每 3 个月随访一次,治疗结束后最长 24 个月主要终点:ORR 次要终点:OS、PFS、DOR、TEAE、SAEs Luca-Merit-1:FIH、Open Label I 期试验,评估 BNT116 单独和联合用于 NSCLC 的安全性、耐受性和初步疗效 (NCT05142189) EmpowerVax-LUNG1:西米普利单抗联合使用 BNT116 对比塞米普利单抗在一线治疗晚期非小细胞肺癌伴有 PD 患者的 2 期研究-L1 ≥ 50% (NCT05557591) 纳入标准队列 1—4:不可切除(III 期)或转移(IV 期)非小细胞肺癌队列 5:CRT 队列 6 后不可切除(III 期)NSCLC 队列 6:可切除(诊断时为 II 或 III 期)NSCLC 队列 1、4 和 5:ECOG PS 0-2 队列 2、3 和 6:ECOG PS ≤1 关键纳入标准 • 未经治疗的晚期 NSCLC(IIIB 期、IIIC 或 IV 期鳞状或非鳞状非鳞状非小细胞肺癌,没有资格进行手术切除或明确化疗)• PD-L1 表达 TPS ≥ 50% • RECIST 1.1 至少有 1 个可测量的病变 • ECOG-PS ≤1 BNT116 +cemiplimab(n=20)(体弱患者)可选:从第 3 周期开始的 cemiplimab BNT116 单一疗法(n=30)Deme D. 等人。SITC. 2023。BNT116 + cemiplimab (n=20) (PD-L1 ≥ 50%),使用 PD-1 或 PD-L1 抑制剂作为第一线/调整后进行性疾病。Tx) BNT116 + 多西他赛 (n=20) Öven BB 等人。AACR。2024 年。BNT116 + cemiplimab(n=20)(并发 CRT 后)BNT116 + cemiplimab + 卡铂 + 紫杉醇(neoadj.therapy)> 手术 > BNT116+ 塞米普利单抗(辅助治疗)(n=20)1 2 3 4 5 6 R 1:1 手臂 A:塞米普利单抗手臂 B:BNT116 + cemiplimaplimab Arm B:+ cemiplimaplimaplimab b 最长 24 个月或直到疾病进展
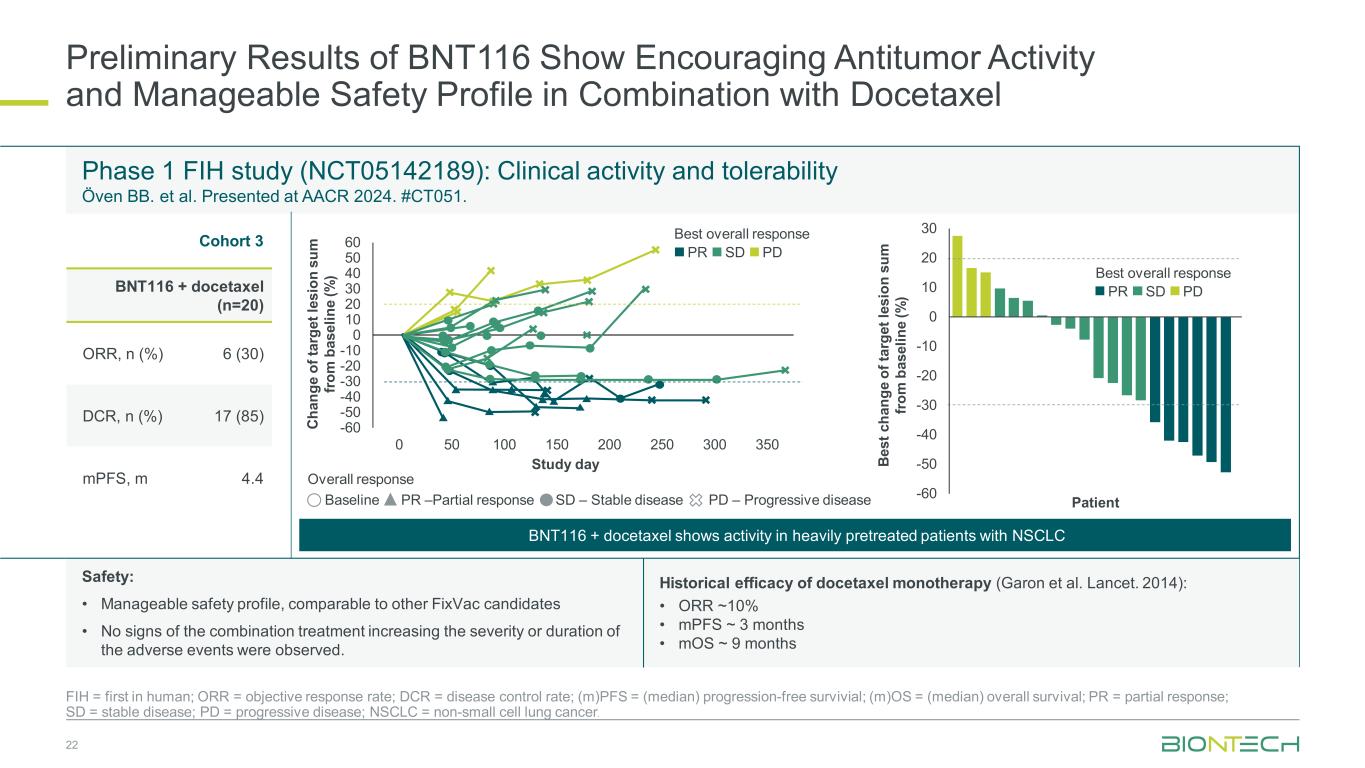
BNT116 的初步结果显示,与多西他赛联合使用的抗肿瘤活性令人鼓舞,安全性可控;ORR = 客观缓解率;DCR = 疾病控制率;(m)PFS =(中位数)无进展存活率;(m)OS =(中位数)总存活率;PR = 部分反应;PD = 进行性疾病;NSCLC = 非小细胞肺癌。1 期 FIH 研究(NCT05142189):临床活性和耐受性 Öven BB. 等人。在 AACR 2024 上展出。#CT051。队列 3 BNT116 + 多西他赛 (n=20) ORR,n (%) 6 (30) DCR,n (%) 17 (85) MPF,m 4.4 Ch 和 ge o f t ar ge t l le es io sum 从 m b as el in e (%) -60 -50 -40 -30 -20 -10 0 10 20 30 40 60 50 50 100 150 150 200 300 350 研究日总计反应最佳总体反应 PR SD PD Be st c ha ng e of ta rg et le si on s um from m m b as el in e (%) -60 -50 -40 -20 -10 0 10 20 30 最佳总体反应 PR SD PD BNT116 + 多西他赛在经过大量预处理的非小细胞肺癌患者中显示出活性基线 PR —部分反应 SD — 稳定疾病 PD — 进行性疾病患者多西他赛单一疗法的历史疗效(Garon 等人。《柳叶刀》。2014):• ORR ~ 10% • MPF 约 3 个月 • moS ~ 9 个月安全性:• 与其他FixVac候选药物相比,安全性可控 • 没有观察到联合治疗会增加不良事件严重程度或持续时间的迹象。

BioNTech 在 ASCO 2024 23 1.与 Genmab 合作;2.与 Biotheus 合作;3.与 MediLink 合作;4.与罗氏集团成员基因泰克合作。相关项目适应症研究 BNT311/ GEN1046 (acasunlimab) 1 2L 非小细胞肺癌 2 期 BNT327/PM80022 宫颈癌和耐铂卵巢癌 1/2 期 BNT327/PM80022 非小细胞肺癌 1/2 期 BNT326/YL2023 非小细胞肺癌和乳腺癌 1 期自体基因 cevumeran (BNT122) 4 结直肠癌流行病学研究 BNT211 生殖细胞肿瘤真实世界数据跨投资组合数据用于就进一步发展方向做出明智的决定

3 财务业绩 Jens Holstein,首席财务官
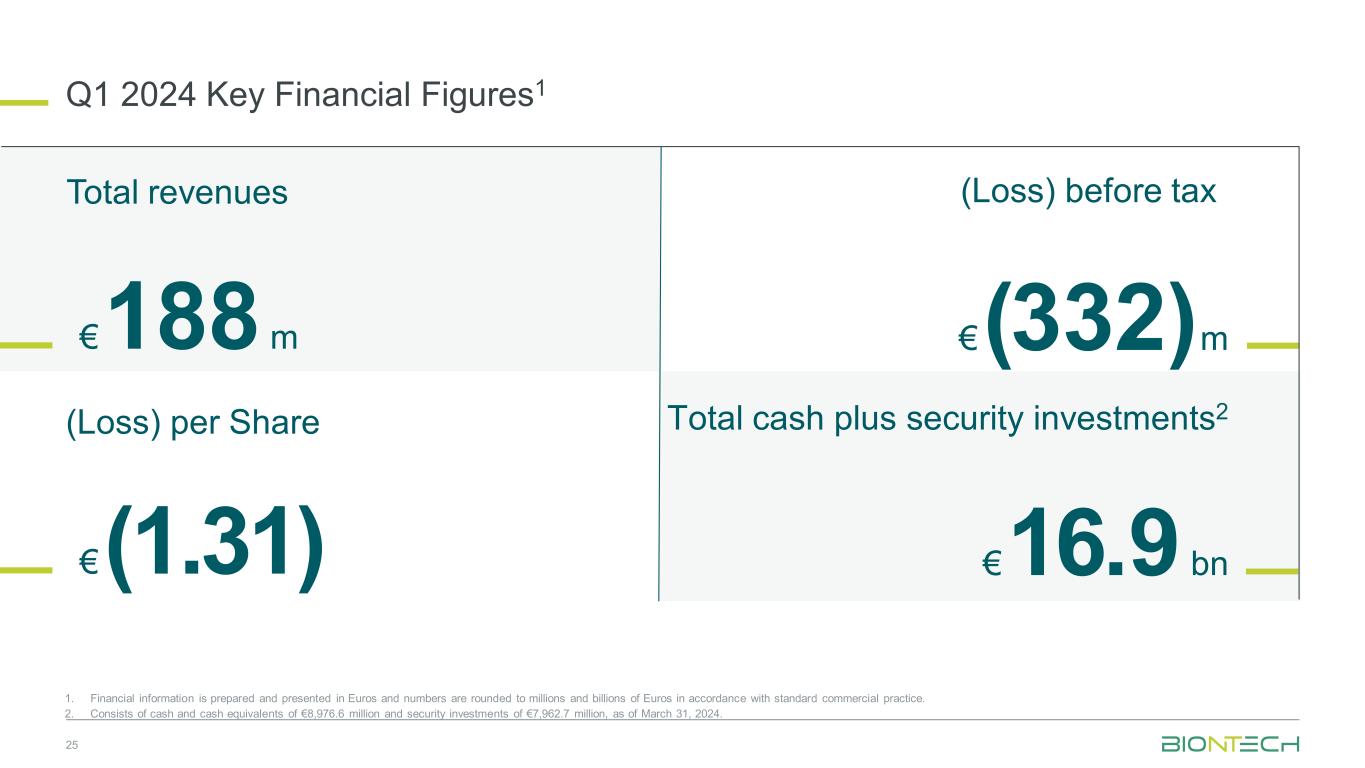
2024 年第一季度关键财务数据1 25 1.根据标准商业惯例,财务信息以欧元编制和列报,数字四舍五入到数百万亿欧元。2.截至2024年3月31日,包括89.766亿欧元的现金及现金等价物以及79.627亿欧元的证券投资。(亏损)税前(1.31)欧元(3.32)亿欧元1.88亿欧元每股总收入(亏损)169亿欧元现金总额加上证券投资2

2024 年第一季度财务业绩 26 1.数字已四舍五入,所列数字加起来可能与总数不精确,可能已在表格中进行了调整。合并损益表的列报方式已简化。2.BioNTech的利润份额是根据辉瑞和BioNTech共享的初步数据估算的,BioNTech于2024年5月6日提交的截至2024年3月31日的三个月的6-K表报告进一步描述了这一点。预计合作伙伴毛利润份额的任何变化都将得到预先确认。总收入包括 COVID-19 疫苗收入和其他收入,如BioNTech的6-K表报告所进一步描述的那样。3.对上一年度数字的调整涉及与某些法律诉讼相关的外部法律咨询费用,从一般和管理费用到其他运营费用,以反映内部报告的变化,也反映在外部报告中。(以百万欧元计,每股数据除外)1 2024 2023 年收入2 187.6 1,277.0 销售成本 (59.1) (96.0) 研发费用 (507.5) (334.0) 销售和营销费用 (15.6) (12.2) 一般和管理费用 (117.0) (111.8) 其他营业收入减去支出3 4.4 (68.6) 营业收入/ (亏损) (507.2) 654.4 财务收入减去支出 175.4 53.3 税前利润/(亏损)(331.8)707.7 所得税 16.7(205.5)期内利润/(亏损)(315.1)502.2 每股收益/(亏损)本期每股基本收益/(亏损)(1.31) 2.07 每股摊薄收益/(亏损)(1.31)2.05 截至3月31日的三个月截至3月31日的三个月(截至3月31日的三个月)

收入指导注意事项:收入敏感度主要取决于以下因素 • 预计Comirnaty将有大量销售的市场的疫苗接种率和价格水平 • 库存减记 • 与服务业务相关的预期收入,包括InstaDeep、JPT Peptide Technologies、IMFS以及德国疫情防备协议2024财年指南重申1 27 1。不包括尚不清楚和/或无法量化的外部风险,包括但不限于正在和/或未来的法律纠纷或相关活动的影响。2.在披露的范围内,数字包括从其他许可协议、合作或潜在并购交易中确定的影响,并可能根据未来发展而更新。与法律诉讼相关的外部法律咨询相关的预期支出不反映在销售和收购中,而是反映在2024财年的其他运营费用中。指导不包括正在进行或未来的法律纠纷或相关活动(例如判决或和解)的结果所产生的潜在付款,也可能受到其影响。4.该公司预计不会公布2024财年的正净收入数字,并预计Comirnaty2024年全球收入的大部分将在下半年录得。IMFS = BioNTech的2024财年创新制造服务指南2024财年收入总收入2500欧元至3,1亿欧元 2024财年支出、营业收入和资本支出4研发费用2 2,400 — 26亿欧元销售和收购支出3 7亿至8亿欧元运营活动的资本支出4亿至5亿欧元

4 战略展望首席战略官瑞安·理查森

COVID-19 疫苗市场动态和展望1 1.与辉瑞合作。2.须经监管部门批准。WHO = 世界卫生组织;ICMRA = 国际药品监管机构联盟;EMA = 欧洲药品管理局;VRBPAC = 疫苗及相关生物制品咨询委员会;ACIP = 免疫实践咨询委员会;FDA = 食品药品监督管理局。世卫组织/ICMRA和欧洲药品管理局收到了关于JN.1变体的建议 2024年5月预计在批准后不久推出和发货监测新变种规划:2024年夏末在80多个地区推出季节性疫苗2在选定地区开放私人市场大幅增加预充注射器剂量供应大幅增加疫苗开发可能获得美国食品药品管理局批准欧盟可能批准2024年7月下旬至2024年4月预计的VRBPAC菌株选择2024年6月预计ACIP建议29 预期监管机构提交的文件适应变异疫苗开发的时间表可能有所加快
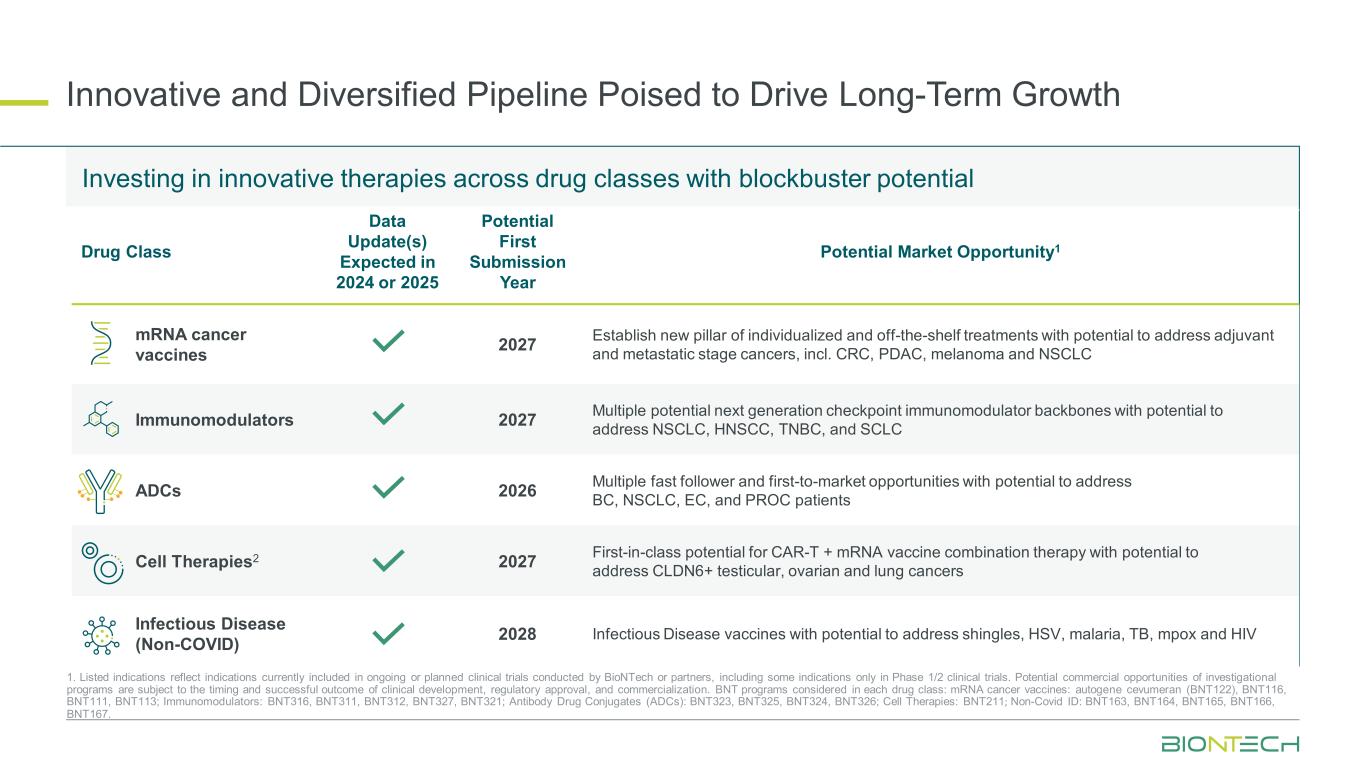
创新和多元化的产品线有望推动长期增长 1.列出的适应症反映了BioNTech或合作伙伴正在进行或计划进行的临床试验中目前包含的适应症,包括仅在1/2期临床试验中的某些适应症。研究项目的潜在商业机会取决于临床开发、监管批准和商业化的时机和成功结果。在每个药物类别中考虑的BNT项目:mRNA癌症疫苗:autogene cevumeran(BNT122)、BNT116、BNT111、BNT113;免疫调节剂:BNT316、BNT311、BNT312 BNT327、BNT321;抗体药物偶联物(ADC):BNT323、BNT325、BNT324、、;细胞疗法:;非冠状病毒ID:,,BNT326 BNT211 BNT163 BNT164 BNT165 BNT166 BNT167投资具有巨大潜力的药物类别数据更新的跨药物类别创新疗法预计在2024年或2025年潜在的首次提交年度潜在市场机会1 mRNA癌症疫苗 2027 建立新的个体化和现成治疗支柱,有可能解决辅助和转移阶段癌症,包括结直肠癌、PDAC、黑色素瘤和非小细胞肺癌免疫调节剂 2027 多种潜在的下一代检查点免疫调节剂有可能解决 NSCLC、HNSCC、TNBC 和 SCLC ADC 2026 多重快速关注者的骨干以及有可能解决不列颠哥伦比亚省、非小细胞肺癌、欧共体和PROC患者的首次上市机会 CELL Therapies2 2027 CAR-T + mRNA 疫苗联合疗法的首创潜力,有可能解决CLDN6+睾丸癌、卵巢癌和肺癌传染病(非COVID)2028 传染病疫苗,有可能解决带状疱疹、单纯疱疹病毒、疟疾、结核病、多痘和艾滋病毒
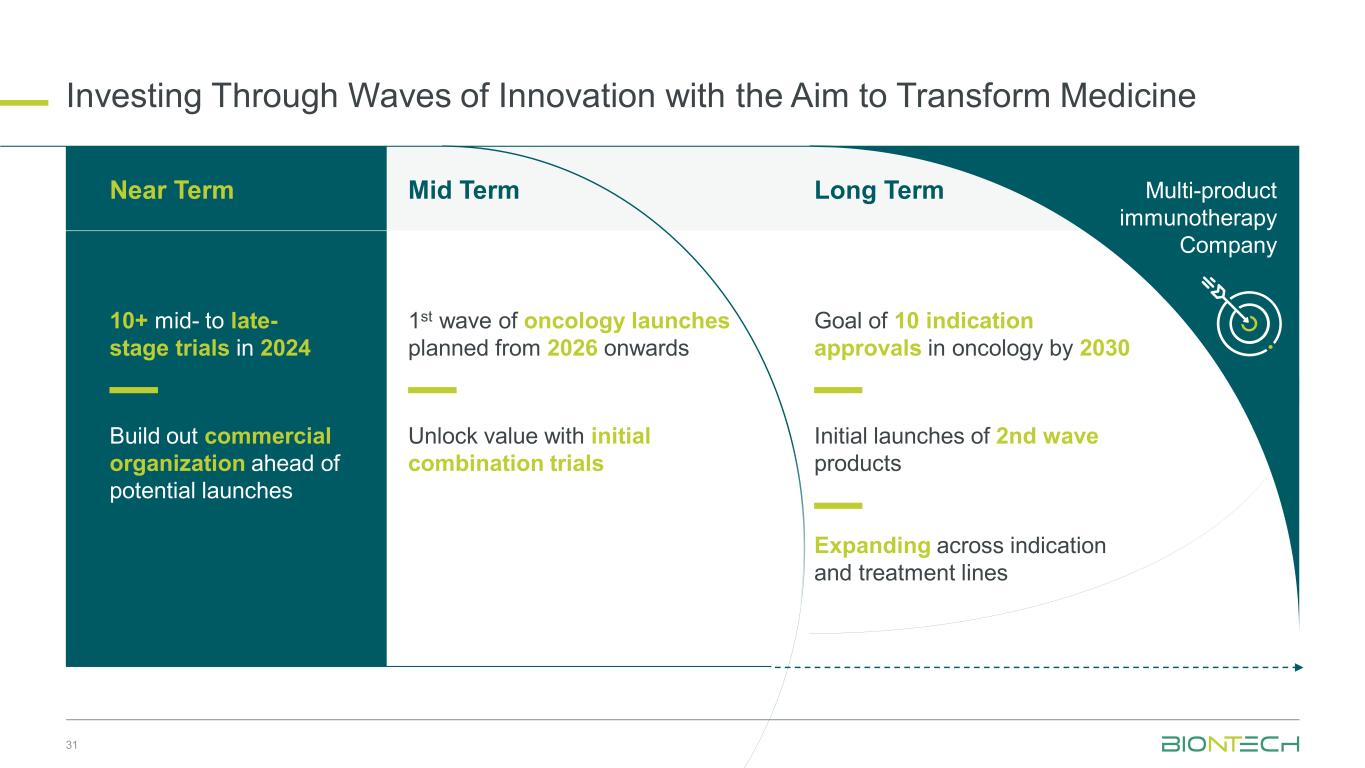
投资创新浪潮以实现医学转型 31 计划从2026年起推出第一波中期肿瘤学试验通过初始组合试验释放价值扩展到适应症和治疗系列的长期目标到2030年肿瘤学领域获得10个适应症的批准第二波产品多产品免疫疗法公司2024年10多项中期至晚期试验:短期在可能的发布之前建立商业组织

保存日期 2024 年 5 月 17 日年度股东大会创新系列:数字与人工智能 2024 年 10 月 1 日创新系列 2024 年 11 月 14 日

谢谢

附录

推进我们的管道:2024 年的精选数据里程碑 35 1.与 Genmab 合作;2.与 onCOC4 合作;3.与 DualityBio 合作;4.与 Biotheus 合作;5.与辉瑞合作。NSCLC = 非小细胞肺癌,R/R = 复发/折射物。项目适应症靶向里程碑肿瘤学 BNT311/GEN1046(acasunlimab)1 R/R met。NSCLC,+/-pembrolizumab 2 期数据 BNT312/GEN10421 多发实体瘤 ph1/2 扩张队列数据 BNT316/ONC-392(gotistobart)2 多发实体瘤 Ph1/2 扩张队列数据 BNT323/DB-13033 多发实体瘤 Ph1/2 扩张队列数据 BNT325/DB-13053 多发实体瘤 Ph1/2 数据 BNT327/ PM80024 多种实体瘤 2 期数据传染病 bnt162b25 COVID-19、Omicron XBB.1.5 单价疫苗 2/3 期数据 BNT1675 带状疱疹 1 期试验更新