
2024 年 5 月 ZYNLONTA R/R MZL 第二阶段 IIT 初始数据展览 99.2

2 前瞻性陈述本演示文稿及任何随附的口头陈述由ADC Therapeutics SA(“ADC Therapeutics”、“我们” 或 “我们”)编写,仅供参考,不用于任何其他目的。本演示文稿中包含的任何内容都不是,也不应被解释为主讲人或ADC Therapeutics或ADC Therapeutics的任何高管、董事、员工、代理人或顾问的建议、承诺或陈述。本演示文稿并不旨在包罗万象,也不包含您可能想要的所有信息。本演示和任何随附的口头陈述中提供的信息仅适用于截至本文发布之日。本演示文稿包含1995年《私人证券诉讼改革法》安全港条款所指的前瞻性陈述。在某些情况下,您可以通过诸如 “可能”、“假设”、“将”、“应该”、“将”、“期望”、“打算”、“计划”、“预期”、“相信”、“估计”、“预测”、“潜在”、“看起来”、“寻找”、“未来”、“继续” 或 “出现” 等术语来识别前瞻性陈述,尽管如此并非所有前瞻性陈述都包含这些识别词。前瞻性陈述受某些风险和不确定性的影响,这些风险和不确定性可能导致实际结果与所描述的结果存在重大差异。可能导致这种差异的因素包括但不限于:迈阿密大学研究人员启动的r/r MZL试验的未来时间和结果,以及获得监管部门批准或纳入NCCN概要的能力,我们对MZL市场机会的估计,公司更新后的公司战略的成功;2025年第四季度初的预期现金流,新的商业进入市场战略的有效性,来自新技术的竞争,该公司在美国增长 ZYNLONTA® 收入的能力各州;瑞典Orphan Biovitrum AB(Sobi®)有能力在欧洲经济区成功实现ZYNLONTA® 商业化,市场接受度、充足的报销范围和未来收入;国家药监局批准了Overland ADCT BioPharma提交的中国ZYNLONTA® 的BLA以及来自该产品的未来收入,我们的战略合作伙伴,包括三菱田边制药公司,有能力获得监管部门的批准外国司法管辖区的 ZYNLONTA®,以及未来从这些司法管辖区向我们支付的收入和付款的时间和金额合作伙伴关系;公司或其合作伙伴的研发项目或临床试验的时间和结果,包括LOTIS 5和7、ADCT 601和602以及佛罗里达州和MZL的IIT,以及对具有不同靶标、连接剂和有效载荷的某些实体瘤的早期研究;公司产品或候选产品的监管申报的时间和结果;美国食品和药物管理局或外国监管机构的行动;预计收入和支出;公司的进行业务发展或研究合作交易的能力;公司的债务,包括医疗保健特许权使用费管理以及Blue Owl和Oaktree设施,以及此类债务对公司活动施加的限制、遵守各种协议条款和偿还此类债务的能力以及偿还此类债务所需的大量现金;以及公司为其研究、开发、临床和商业活动获得财务和其他资源的能力。有关这些因素和其他可能导致实际业绩与前瞻性陈述中预期存在重大差异的因素的更多信息载于公司10-K表和10-Q表年度报告的 “风险因素” 部分以及公司向美国证券交易委员会提交的其他定期和当前报告和文件中。这些陈述涉及已知和未知的风险、不确定性和其他因素,这些因素可能导致实际业绩、业绩、成就或前景与此类前瞻性陈述中表达或暗示的任何未来业绩、业绩、成就或前景存在重大差异。公司提醒投资者不要过分依赖本文件中包含的前瞻性陈述。前瞻性陈述基于我们管理层的信念和假设以及管理层目前可获得的信息。无法保证将来会取得这样的结果。本演示文稿中包含的此类前瞻性陈述仅代表截至本次演讲之日。除非适用法律要求,否则公司明确表示不承担任何义务或承诺更新本演示文稿中包含的这些前瞻性陈述以反映我们预期的任何变化或此类陈述所依据的事件、条件或情况的任何变化。对任何此类前瞻性陈述的准确性不作任何陈述或保证(明示或暗示)。本演示文稿中包含的某些信息涉及或基于研究、出版物、调查和其他来自第三方来源的数据以及我们自己的内部估计和研究。尽管我们认为截至本演示文稿之日这些第三方来源是可靠的,但我们尚未独立核实,对于从第三方来源获得的任何信息的充分性、公平性、准确性或完整性,我们也没有做出任何陈述。此外,本演示文稿中包含的所有市场数据都涉及许多假设和局限性,无法保证此类假设的准确性或可靠性。最后,尽管我们认为自己的内部研究是可靠的,但此类研究尚未得到任何独立来源的证实。

3 据估计 3 — 4 K 2L+ MZL 患者在 US1 接受药物治疗;尽管患者取得了持久的反应,但
仍有大量未得到满足的医疗需求

4 MZL 市场概述和 ZYNLONTA 研究来源:1.Clarivate DRG(2022年)、《全球数据》(2017年)、Cerner Enviza CancerMpact(2023);2.NCCN指南;3.MAGNOLIA:ph2,r/r MZL 中的单臂,增强:ph3,在 r/r inHL 中随机分配 R2 与 R,GADOLIA:ph3 随机分配 benda vs benda + obin 在 r/r inHL 中,ACE-LY-003:ph2,第 2 部分(r/r MZL 队列)的第 3 部分 ph1b/2 单独或联合用于 B 细胞 NHL; 4.Alderuccio 等人,J Clin Oncol(2018),Alderuccio 等人,Am J Hematol(2019)。MZL 治疗和市场概述据估计 3 — 4 K r/r MZL 患者1 每年接受全身性抗癌方案治疗 NCCN 的首选药物除了 2L+2 CR 率的 BTKI 外,还包括所有线路的抗CD20治疗方案,对于2L+2 CR 率适中,对于 FDA 批准和 NCCN 首选药物(即

5 3L+ 当前的 MZL 治疗格局 LoT:治疗线。资料来源:1.Clarivate DRG(2022年)、《全球数据》(2017年)、Cerner Enviza CancerMpact(2023);2.NCCN 指南。LoT/流行病学1 治疗范例2 基于抗 CD20 的方案 BTKI 基于抗 CD20 的方案 BTKI 基于抗 CD20 的方案 T 细胞介导疗法 (AXI-cel) 抗CD20 的方案 BTKI 每年接受治疗的患者数量 0.8 — 1.3 K 2L 每年接受治疗的患者数量 2.2 — 3.2 K 1L 每年接受治疗的患者数量 5.5 — 6.5 K 关注领域
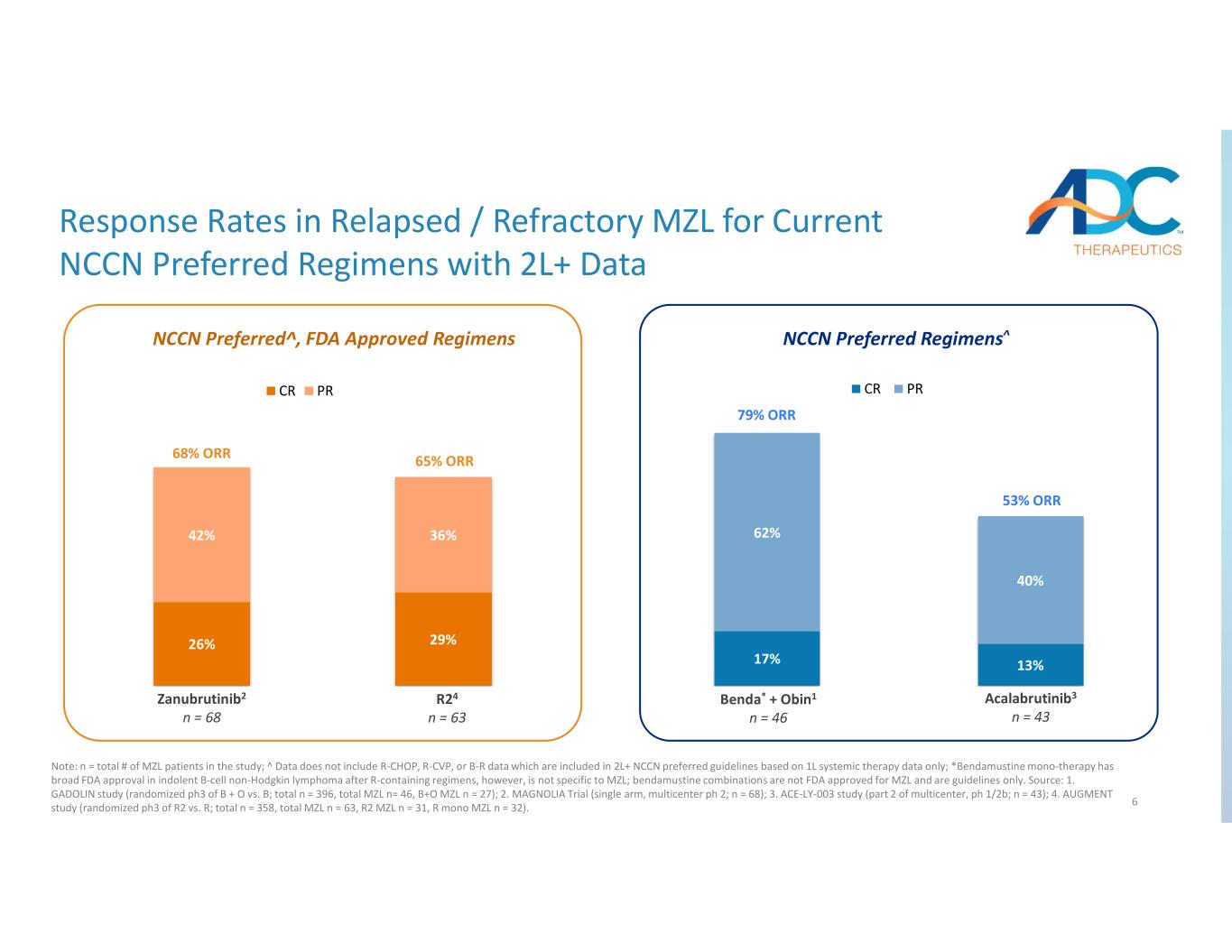
6 17% 13% 62% 40% Benda + Obin1* n=46 Acalabrutinib4 n=43 CR PR 26% 29% 42% 36% Zanubrutinib2 n=68 R25 n=63 CR PR NCCN 优先方案^ 68% ORR 65% ORR 53% ORR Zanu r tinib2 n 68 24 n 63 n be * + Obin1 n 46 Acalabrutinib3 n 43 n 43 当前 NCCN 首选方案 2L+ 的复发/难治性 MZL 的反应率注:n = 研究中 MZL 患者总数;^ 数据不包括仅基于 1L 全身治疗数据的 2L+ NCCN 首选指南中包含的 R-CHOP、R-CVP 或 B-R 数据;*苯达莫司汀单一疗法在含R的治疗方案后的惰性B细胞非霍奇金淋巴瘤中获得了美国食品药品管理局的广泛批准,但它并不特定于MZL;苯达莫司汀组合未获美国食品药品管理局批准用于MZL,仅是指导方针。来源:1.GADOLIN 研究(B + O 与 B 的随机 ph3;总计 n = 396,总计 MZL n= 46,B+O MZL n = 27);2.MAGNOLIA 试验(单臂,多中心 ph 2;n = 68);3.ACE-LY-003 研究(多中心第 2 部分,ph 1/2b;n = 43);4.AUGMENT 研究(R2 与 R 的随机 ph3;总计 n = 358,总计 MZL n = 63,R2 MZL n = 31,R mono MZL n = 32)。

7 评估隆卡妥昔单抗在复发/难治MZL中的安全性和有效性的第二阶段,开放标签,研究来源:1。UTX-TGR-205 研究(两个单臂队列;总计 n = 710,总计 MZL n = 69)。临床设计 R/R MZL 先前使用过 ≥ 1 系全身疗法 Loncastuximab 150 μg/kg(第 1 天,+/-3 天)CT/MRI 或 FDG-PET/CT 基于 PET 耐受性 Loncastuximab 75 μg/kg(第 1 天 +/3 q 21 天)CT/MRI 或 FDG-PET/CT 骨髓 CT/MRI 或 FDG-PET/CT 基于筛查周期 1 — 2 周期 3 — 6 30 天的 PET 耐受度的 CT 研究结束/随访通过影像学确认 CR 没有影像学研究概述原假设是 H0: P≤P0,备选假设是 Ha: P≥P1 最佳的 CR 率据报道,umbralisib在研究开始时使用单一药物复发MZL——在接受治疗的69名患者中为16%1。根据这一估计,在原假设下,我们假设CR率(P)为16%(P0)预计CR率将增加15%,导致CR率达到31%或更高。因此,根据替代假设,拟议治疗的CR率为31%(P1)一项针对50名在先前进行全身治疗(clinicaltrials.gov ID:NCT05296070)后复发/难治MZL患者的多机构研究(clinicaltrials.gov ID:)目前正在注册2个站点,扩大到5个地点20名患者的徒劳性分析研究理由
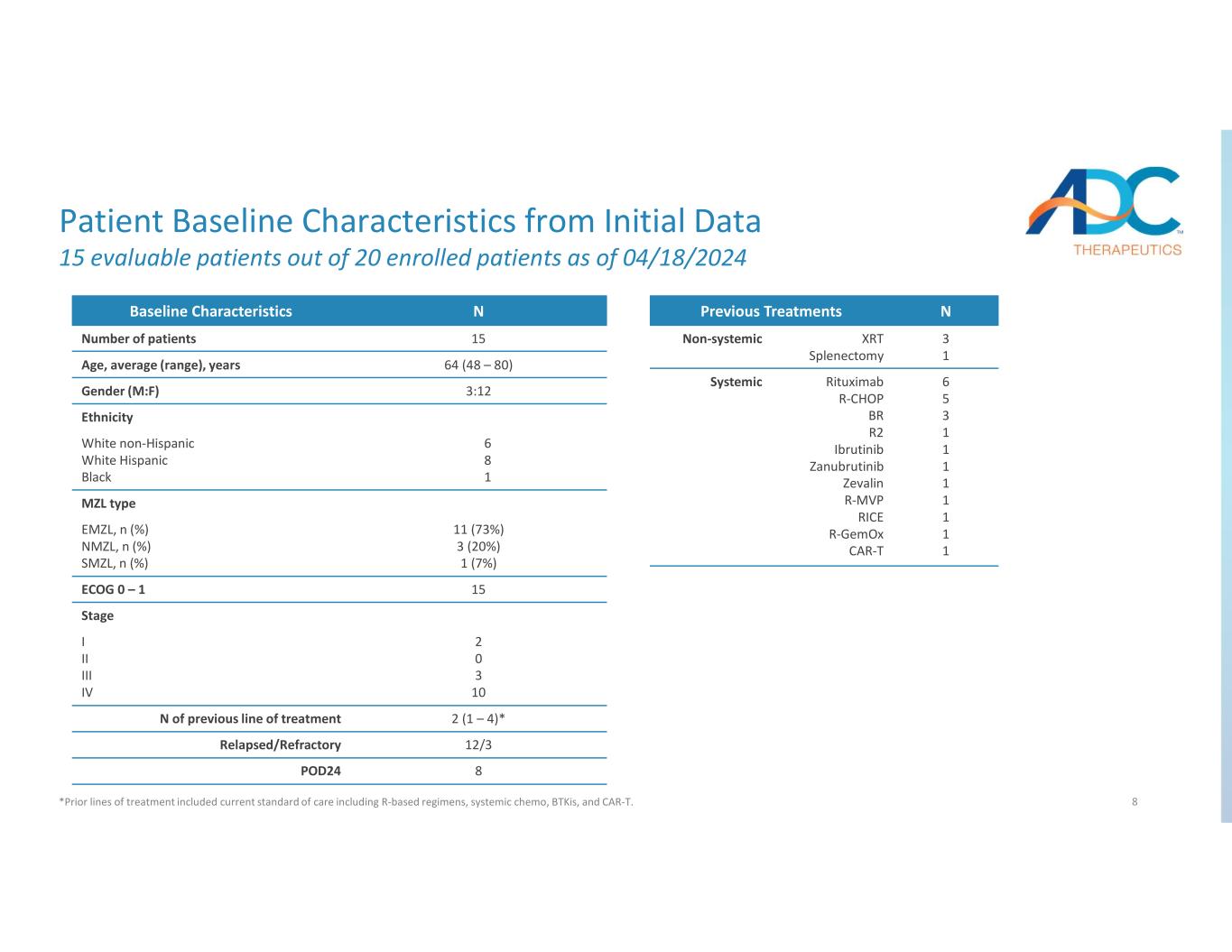
8 个患者基线特征截至2024年4月18日,在20名入组患者中,有15名可评估的患者 *先前的治疗路线包括当前的护理标准,包括基于R的治疗方案、全身化疗、BTKI和CAR-T。nBaseline 特征 15 患者人数 64 (48 — 80) 年龄、平均值(范围)、年龄 3:12 性别(男:F)种族 6 8 1 白人非西班牙裔白人西班牙裔黑人 MZL 11 型 (73%) 3 (20%) 1 (7%) EMZL、n (%) SMZL、n (%) 15ECOG 0 — 1 阶段 2 0 3 10 I II II IV 2 (1) (1) — 4) *先前治疗路线的 N 12/3复发/难治性 8POD24 n先前的治疗 3 1 XRT 脾切除术非全身性 6 5 3 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 BR R2 依鲁替尼 Zabrutinib Zavalin R-MVP RICE r-gemox CAR-T 系统性
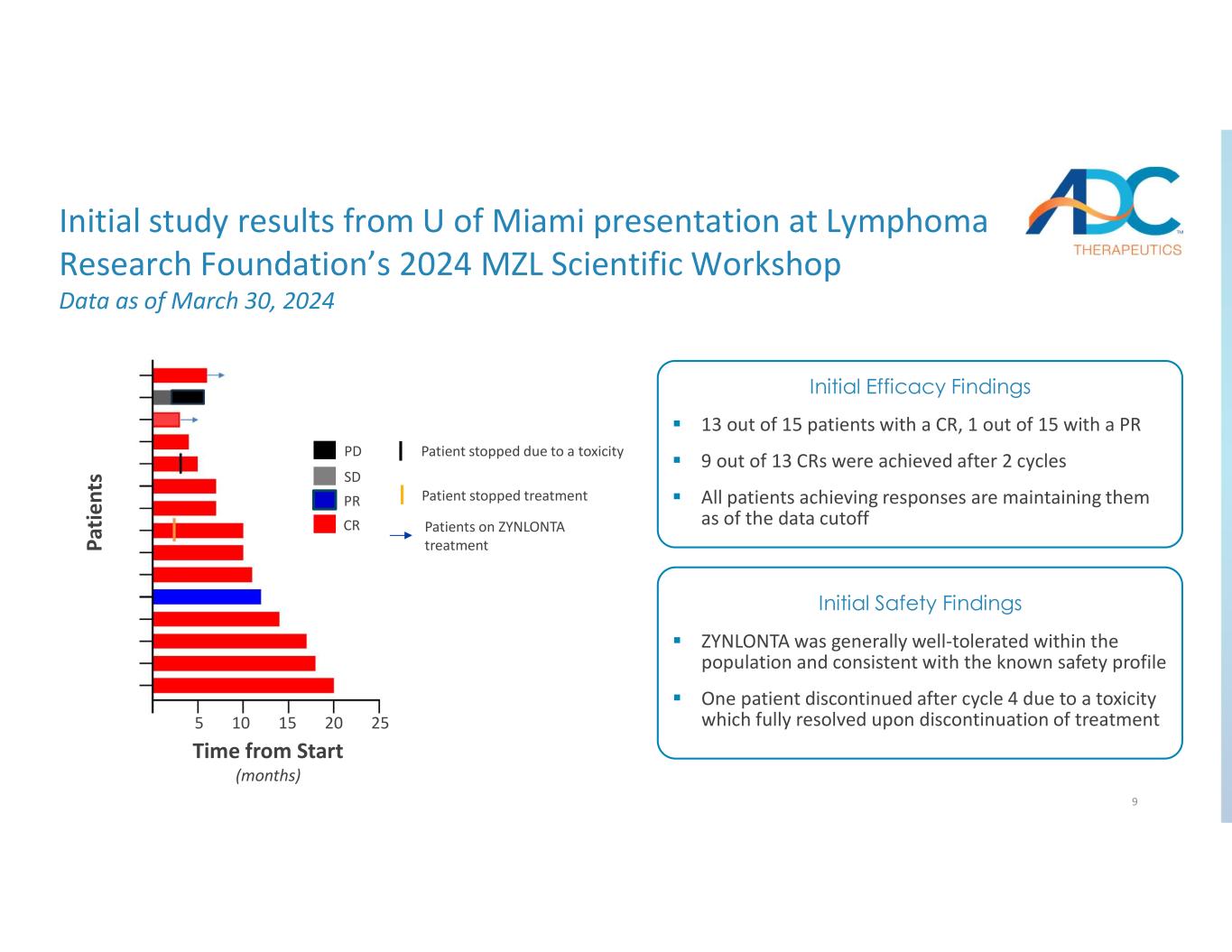
9 个 PR CR PD SD 患者接受了 ZYNLONTA 治疗患者停止治疗患者因毒性停止治疗 15 名患者中有 13 名患有 CR,15 名患者中有 1 名 PR 13 个 CR 中有 9 个是在两个周期后获得的。所有获得反应的患者截至数据截止日期均保持不变。初步疗效发现 ZYNLONTA 在人群中普遍耐受性良好,与已知的安全状况一致。一名患者在第 4 周期后因毒性而停药停止治疗后完全解决初步安全性调查结果初步迈阿密大学在淋巴瘤研究基金会 2024 年 MZL 科学研讨会上发表的研究结果截至 2024 年 3 月 30 日的数据 Pa time nt s 起始时间(月)5 10 15 20 25
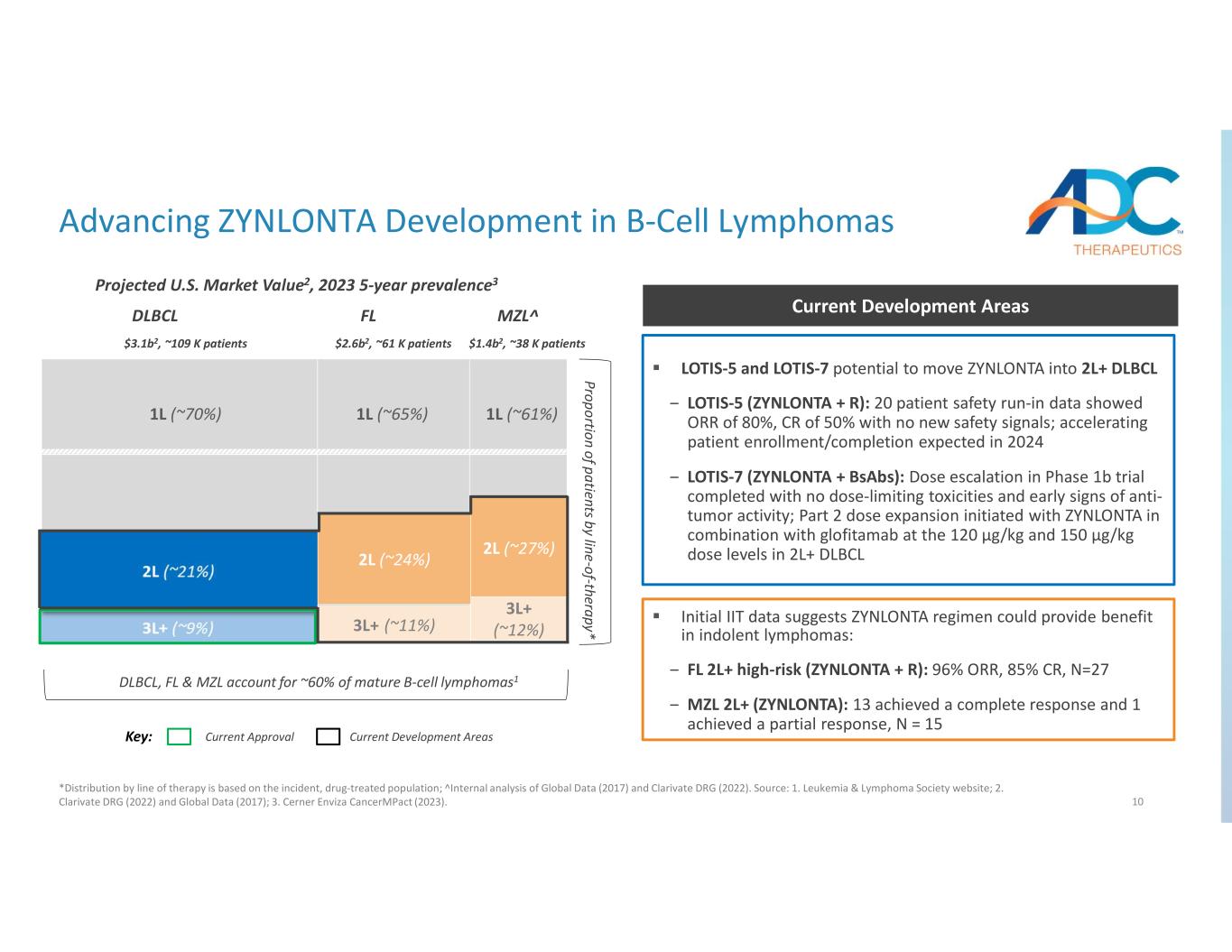
10 按疗法划分的患者比例* DLBCL、FL 和 MZL 占成熟 B 细胞淋巴瘤的约 60% 1 1L (~ 70%) 1L (~ 65%) 1L (~ 61%) MZL^FLDLBCL 关键:当前批准推进ZYNLONTA在B细胞淋巴瘤中的开发领域*按疗法分布,按发病率、药物治疗人群划分;全球数据(2017 年)和 Clarivate DRG(2022年)的内部分析。资料来源:1.白血病和淋巴瘤协会网站;2.Clarivate DRG(2022年)和全球数据(2017年);3.Cerner Enviza CancermPact (2023)。2L (~ 24%) 2L (~ 27%) 3L+ (~ 12%) 预计美国市值2,2023 年 5 年流行率3 LOTIS-5 和 LOTIS-7 有可能使 ZYNLONTA 进入 2L+ DLBCL-LOTIS-5 (ZYNLONTA + R):20 名患者安全磨合数据显示 ORR 为 80%,CR 为 50%,没有新的安全信号;预计在 2024 年加快患者入组/完成速度 LOTIS-7(ZYNLONTA + BSABs):1b 期试验的剂量递增已完成,没有剂量限制毒性和抗肿瘤活性的早期迹象;第 2 部分剂量扩展由ZYNLONTA启动在 2L+ DLBCL 当前开发区联合使用 120 µg/kg 和 150 µg/kg 剂量水平的 glofitamab 初步数据表明,ZYNLONTA 方案可以为惰性淋巴瘤带来益处:− FL 2L+ 高风险(ZYNLONTA + R):96% ORR,85% CR,N=27 — MZL 2L+(ZYNLONTA):13 取得了完全的缓解和 1 人获得部分缓解,N = 15 $3.1b2,~10.9 K 名患者 2.6b2,~61 K 名患者 1.4b2,约 38 K 名患者 1.4b2 美元,约 38 K 名患者
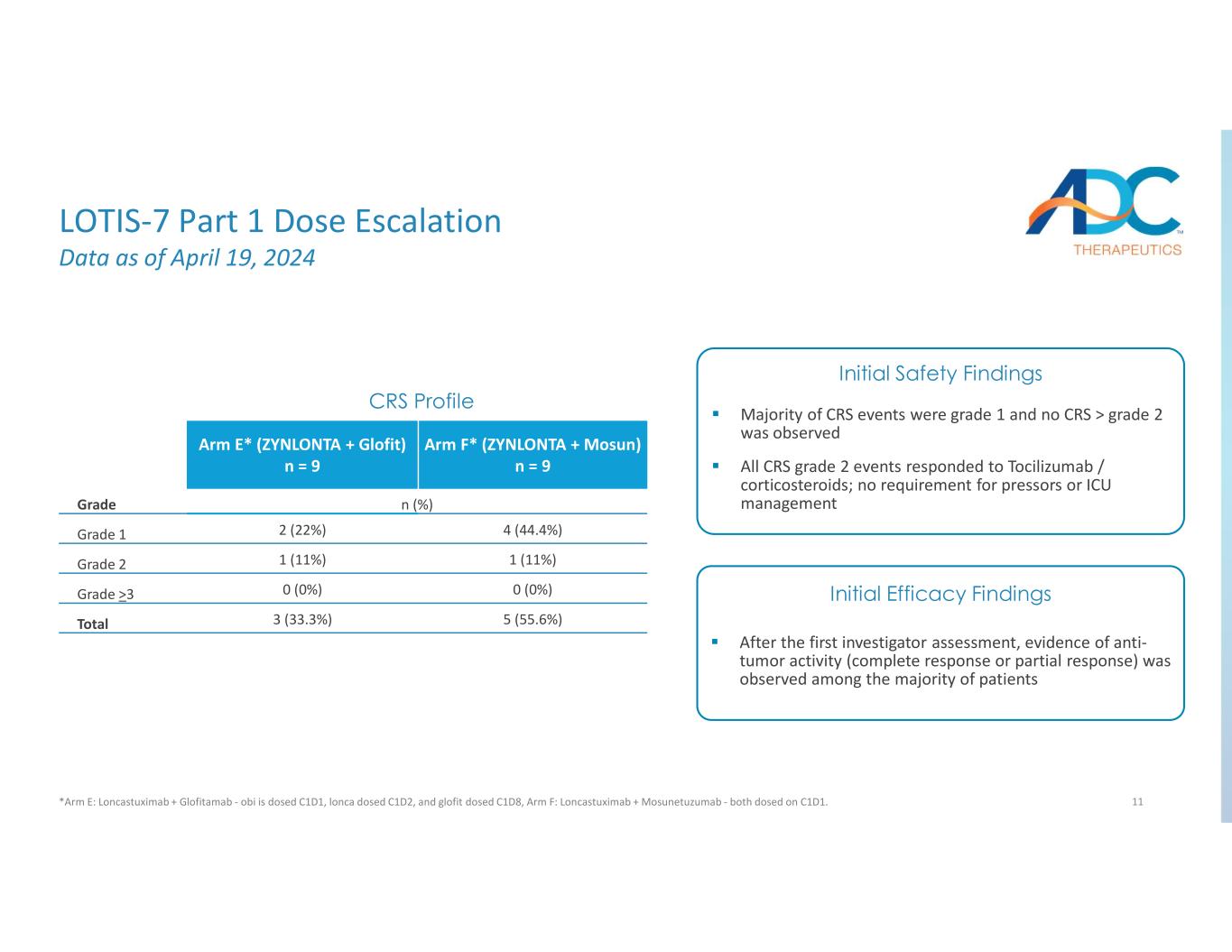
11 Arm F* (ZYNLONTA + Mosun) n = 9 Arm E* (ZYNLONTA + Glofit) n = 9 n (%) 4 级 (44.4%) 2 (22%) 1 (11%) 1 (11%) 2 级 0 (0%) 0%) >3 5 (55.6%) 3 (33.3%) CRS 总体概况首次评估后调查人员证据在大多数患者中观察到抗肿瘤活性(完全反应或部分反应)大多数CRS事件为1级,未观察到CRS >2级所有CRS 2级事件均对托珠单抗/皮质类固醇有反应;无需加压剂或重症监护病房管理初步安全性发现初步疗效调查结果 LOTIS-7 第 1 部分剂量递增数据截至 2024 年 4 月 19 日 *Arm E:Loncastuximab + Glofitamab——obi 的剂量为 C1D1,lonca的剂量为 C1D2,glofit 的剂量为 C1D8,Arm F:Loncastuximab + Mosunetuzumab — 均在 C1D1 上给药。
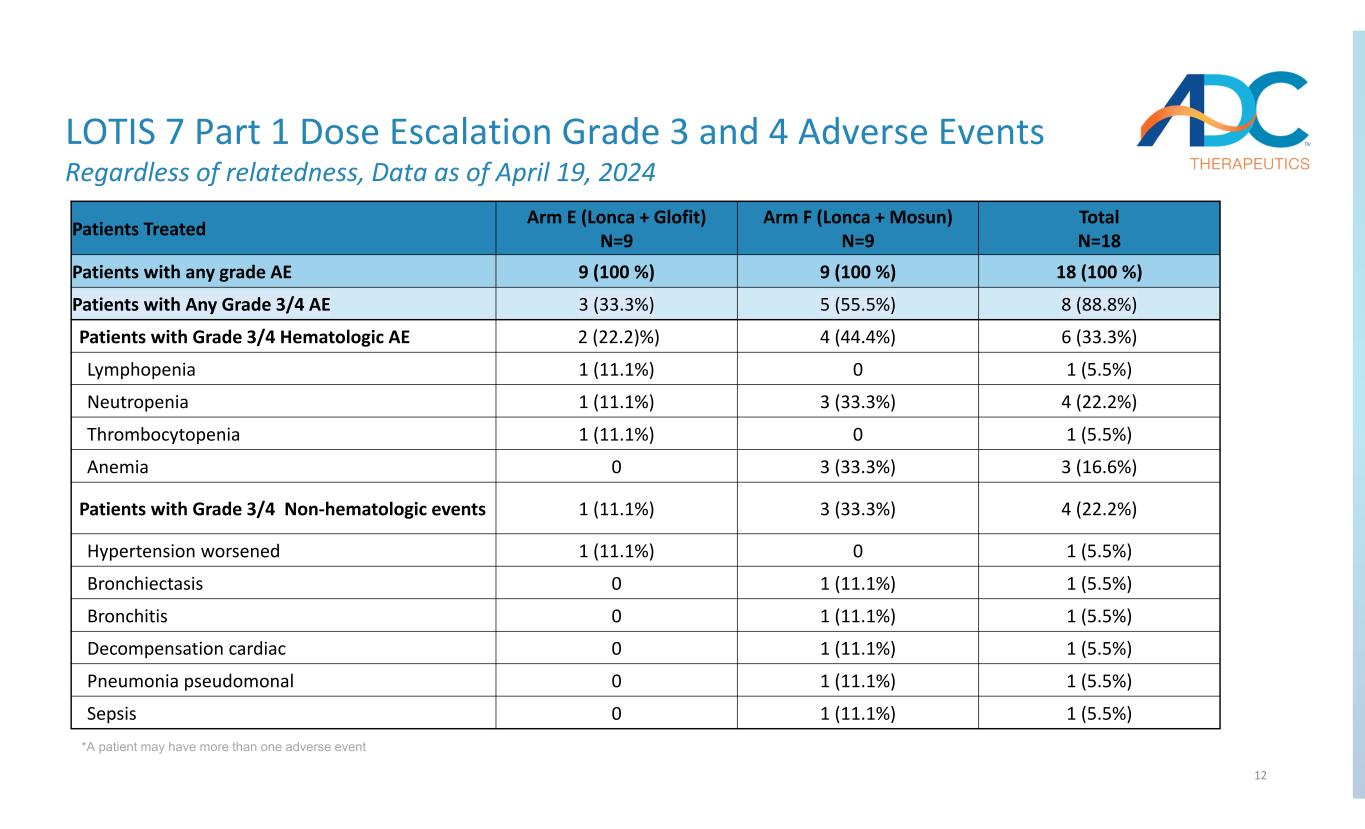
12 LOTIS 7 第 1 部分剂量递增 3 级和 4 级不良事件无论相关性如何,数据截至 2024 年 4 月 19 日 *患者可能有多个不良事件总计 N=18 Arm F(Lonca + Mosun)N=9 组 E(Lonca + Glofit)N=9 接受治疗的患者 18 (100%) 9 (100%) 任何等级 AE 8 (88.8%) 5 (55.5%) 3 (33.3%) 任何等级 3/4 的患者 AE 6 (33.3%) 4 (44.4%) 2 (22.2)%) 3/4 级血液学 AE 1 的患者 (5.5%) 01 (11.1%) 淋巴细胞减少症 4 (22.2%) 3 (33.3%) 1 (11.1%) 1 (11.1%) 中性粒细胞减少症 1 (5.5%) 01 (11.1%) 血小板减少症 3 (16.6%) 3 (33.3%) 0 贫血 4 (22.2%) 3(33.3%) 1 (11.1%) 有 3/4 级非血液学事件的患者 1 (5.5%) 01 (11.1%) 高血压恶化 1 (5.5%) 1 (11.1%) 0 支气管扩张 1 (5.5%) 1 (11.1%) 0 支气管炎 1 (5.5%) 1 (11.1%) 0 肺炎假体 1 (5.5%) 1 (11.1%) 0 肺炎假单元 1 (5.1%) 0 5.5%) 1 (11.1%) 0 败血症
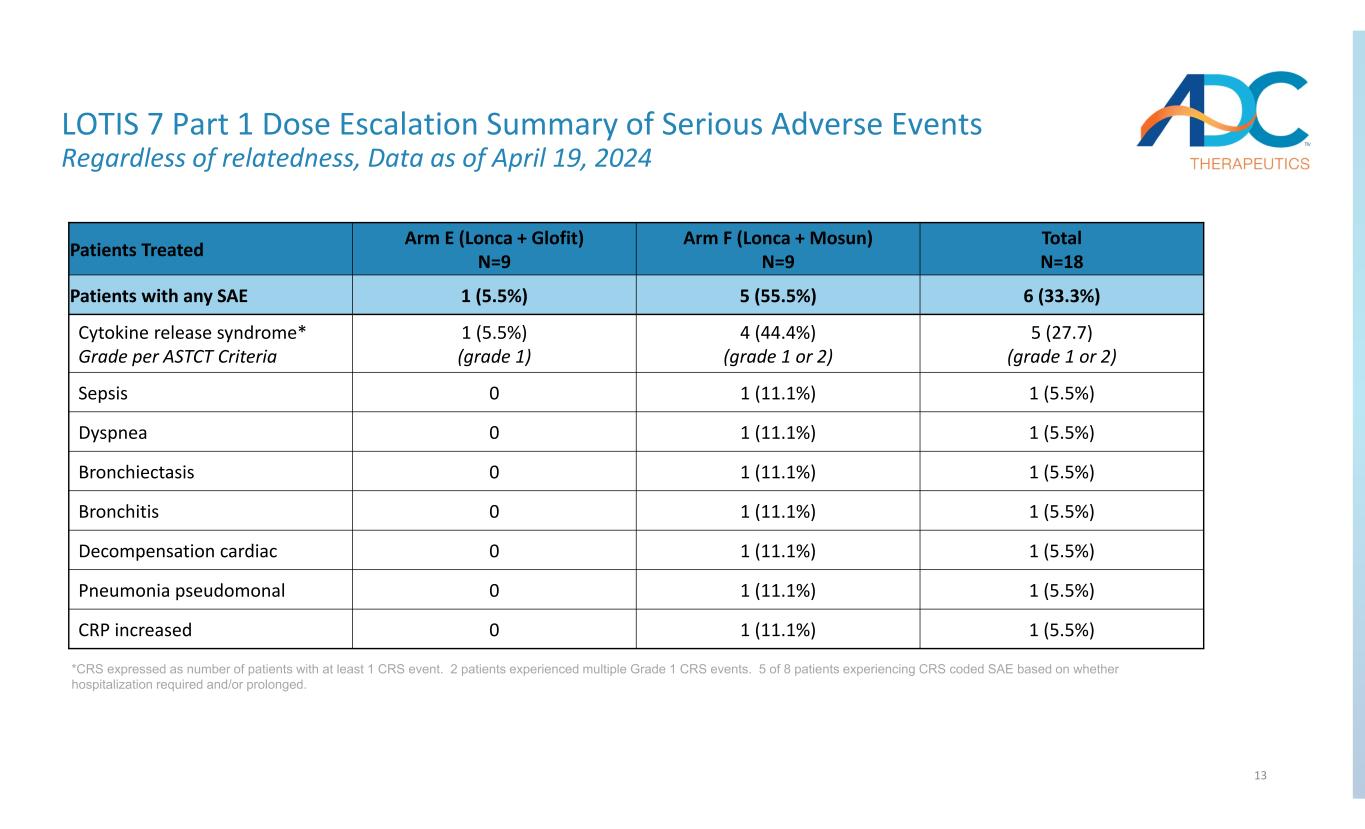
13 LOTIS 7 第 1 部分严重不良事件剂量递增摘要无论相关性如何,截至2024年4月19日的数据 *CRS 表示为至少发生 1 次 CRS 事件的患者人数。2 名患者经历了多次 1 级 CRS 事件。根据是否需要和/或延长住院,8 名患者中有 5 名出现了 CRS 编码 SAE 的患者。总数 N=18 组 F (Lonca + Mosun) N=9 组 E (Lonca + Glofit) N=9 接受治疗的患者 6 (33.3%) 5 (55.5%) 1 (5.5%) 任何 SAE 5 (27.7)(1 级或 2 级)4(44.4%)(1 级或 2 级)1(5.5%)1(5.5%)细胞因子释放综合征的患者* 按 ASTCT 评级标准 1 (5.5%) 1 (11.1%) 0 败血症 1 (5.5%) 1 (11.1%) 0 呼吸困难 1 (5.5%) 1 (11.1%) 0 支气管扩张 1 (5.5%) 1 (11.1%) 0 支气管炎 1 (5.5%) 1 (11.5%) 1 (11.5%) 0 肺炎假单胞菌 1 (5.5%) 1 (5.5%) 1 (11.5%) 1 (5.5%) 1 (11.5%) 1 11.1%) 0CRP 增加