
PROGRESS 患者投资者电话会议 2024 年 4 月 29 日附录 99.1

2 前瞻性陈述本演示文稿包括这些幻灯片的任何印刷或电子副本、演讲者的演讲、任何演示和问答环节中传达的信息,以及演示中或与演示文稿相关的任何文件或材料,包含适用证券法(包括经修订的1995年私人证券诉讼改革法)所指的前瞻性陈述。这些陈述可以用 “可能”、“将”、“可能”、“应该”、“期望”、“计划”、“预测”、“打算”、“相信”、“估计”、“预测”、“项目”、“潜力”、“继续”、“目标” 等词语或其他与X4的预期、战略、业务、计划或意图相关的类似术语或表述来识别。前瞻性陈述包括但不限于暗示或明示的陈述,内容涉及X4对XOLREMDI开始计划推出、上市和商业化的期望,XOLREMDI已在美国获准用于12岁及以上的WHIM综合征患者;X4计划在该指标中商业推出XOLREMDI,包括计划通过PantherX Rare在美国商业上市;X4相信其已做好商业上市准备 XOLREMDI;XOLREMDI 在治疗中的潜在益处 [A 或 B];WHIM综合征的潜在患者人数和XOLREMDI的潜在市场;完成商用药品制造的预期时机;以及我们业务的使命和目标。本演示文稿中的任何前瞻性陈述均基于管理层当前的预期和信念。这些前瞻性陈述既不是对未来业绩的承诺也不是保证,并且受到各种风险和不确定性的影响,其中许多风险和不确定性是X4无法控制的,这可能导致实际业绩与这些前瞻性陈述中设想的结果存在重大差异,包括以下风险:X4在美国的XOLREMDI的推出和商业化努力可能不成功,X4可能无法在我们预期的水平或时机上创造收入在支持我们所需的水平或时机上目标;WHIM综合征患者人数、未满足的额外治疗选择需求以及XOLREMDI的潜在市场可能比我们预期的要小得多;XOLREMDI可能无法达到我们预期的临床益处、临床用途或市场接受度,或者我们可能会遇到影响我们商业化工作成功的报销相关或其他与市场相关的问题;我们可能在任何阶段遇到XOLREMDI的不良事件,对商业化产生负面影响化;X4 建立和维持有效销售的能力以及任何批准产品的营销组织或合适的第三方替代品;作为一个组织,X4缺乏药品销售、营销或分销方面的经验;X4的其他候选产品;X4可能探索XOLREMDI的更多机会和适应症;X4正在进行的XOLREMDI临床试验的临床数据的预期可用性、内容和时机;临床试验的临床试验设计和注册以及潜在的治疗益处,包括当前的设计一种潜力评估XOLREMDI治疗某些慢性中性粒细胞减少性疾病的3期临床试验及其预计将于2024年上半年启动;患者患病率;市场机会;以及X4的资本使用和其他财务业绩,包括其财务状况。由于许多因素,实际事件或结果可能与本演示文稿中包含的任何前瞻性陈述所表达或暗示的事件或结果存在重大差异,包括但不限于获得和维持监管部门批准的风险,包括但不限于潜在的监管延迟或拒绝;临床前研究、临床试验和临床开发的启动和完成所固有的不确定性;试验和研究可能延迟且可能无法产生令人满意结果的风险;临床前研究或早期临床试验的结果无法预测以后的临床试验结果;临床试验的初始或中期结果可能无法预测试验最终结果或未来试验结果的风险;测试或使用我们的产品和候选产品所产生的潜在不良安全影响;患者患病率、市场或机会估计可能不准确的风险;总体宏观经济和地缘政治状况对X4业务的影响;与 X4 相关的风险筹集额外资金的能力;与对X4持续经营能力的重大怀疑相关的风险;预期或现有竞争的变化;监管环境的变化;如果获得批准,与X4成功销售mavorixafor的能力相关的风险;意外诉讼或其他争议;与合作者结盟的需要可能会阻碍或延迟我们的开发和商业化努力或增加我们的成本;我们的业务可能会受到不利影响,我们的成本可能会受到不利影响如果我们的任何关键合作者未能做到这一点,则增加履行其义务或终止合作;我们正在进行和计划中的活动所需的内部和外部成本以及由此对支出和现金使用的影响可能高于预期,这可能会导致我们比预期的更快地使用现金,或更改或缩减我们的部分计划,或两者兼而有之;以及其他风险和不确定性,包括X4向美国证券交易所提交的10-K表年度报告中题为 “风险因素” 的部分中描述的风险和不确定性委员会 (SEC) 于 2024 年 3 月 21 日以及 X4 提交的其他文件中不时与美国证券交易委员会合作。除非法律要求,否则X4没有义务更新本演示文稿中包含的信息以反映新的事件或情况。本演示文稿中包含的某些信息涉及或基于从第三方来源获得的研究、出版物、调查和其他数据以及X4自己的内部估计和研究。尽管X4认为截至本演示文稿之日这些第三方来源是可靠的,但它尚未独立核实,也没有对从第三方来源获得的任何信息的充分性、公平性、准确性或完整性做出任何陈述。最后,尽管X4认为自己的内部研究是可靠的,但此类研究尚未得到任何独立来源的验证或验证。X4 是各种商标、商品名称和服务标志的所有者。本演示文稿中出现的某些其他商标、商品名称和服务标志是第三方的财产。仅为方便起见,本演示文稿中提及的商标和商品名称不带有® 和 TM 符号,但此类提及不应被解释为表明其各自所有者不会在适用法律的最大范围内主张其相关权利。

欢迎和概述 Paula Ragan,博士,总裁兼首席执行官标签亮点和支持临床数据 Christophe Arbet-Engels,医学博士,首席医学官商业发布战略与执行马克·鲍德里,首席商务官结论和问答
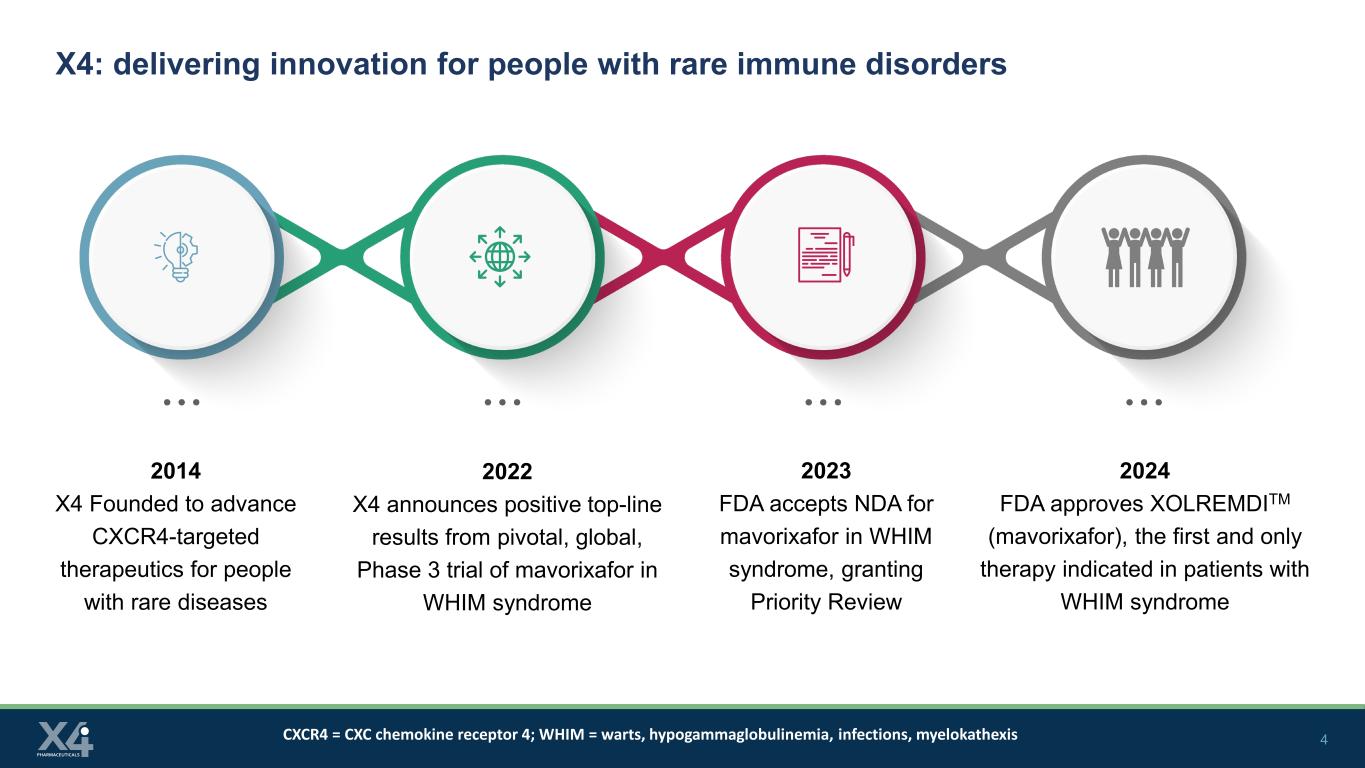
4 X4:为罕见免疫疾病患者提供创新 2014 X4 成立,旨在推进针对罕见疾病患者的CxCR4靶向疗法 2022 X4 宣布马沃里沙福治疗WHIM综合征的关键性全球性3期临床试验取得积极成果 2023 美国食品药品管理局接受马沃里沙福治疗WHIM综合征的保密协议,批准2024年美国食品药品管理局批准了XOLREMDITM(mavorixafor),这是第一个,也是唯一的 WHIM 综合征患者需要治疗 CXCR4 = CXC 趋化因子受体 4;WHIM = 疣、低丙种球蛋白血症、感染、骨髓病变

现已获得 FDA 批准!(zôl-rm-dee)

6 终身影响2 慢性先天性疾病通常出现在儿童时期,中位诊断年龄为5.5岁,与普通人群相比预期寿命较低3,4 由于败血症、不可逆器官损伤、复发性肺炎和某些癌症 WHIM 综合征是一种原发性免疫缺陷和慢性中性粒细胞减少性疾病1 超罕见人群5 根据2019年、2020年的X4市场研究,估计美国至少有1,000人。异质表现2 最常见的特征是:根据包括儿科(65%)和成人(35%)患者在内的66名WHIM综合征患者的国际队列,只有不到四分之一的患者出现WHIM缩写中的所有四种表现(疣、低丙种球蛋白血症、感染和骨髓病变)。中性粒细胞减少(98%)反复感染(92%)低丙种球蛋白血症(65%)参考文献:1.Dale DC、Firkin F、Bolyard AA 等人,Blood。2020;136 (26): 2994-3003。2.Geier CB、Ellison M、Cruz R 等人,J Clin Immunol。2022;42 (8): 1748-1765;3.Dotta L、Notarangelo L、Moratto D 等J Allergy Clin Immunol. 2019;7 (5): 1568-1577;4.Beaussant Cohen S、Fenneeau O、Plouvier E 等Orphanet J Rare Dis.2012;7:71;5.存档的数据。X4 制药公司,2024 年。疣(40%)
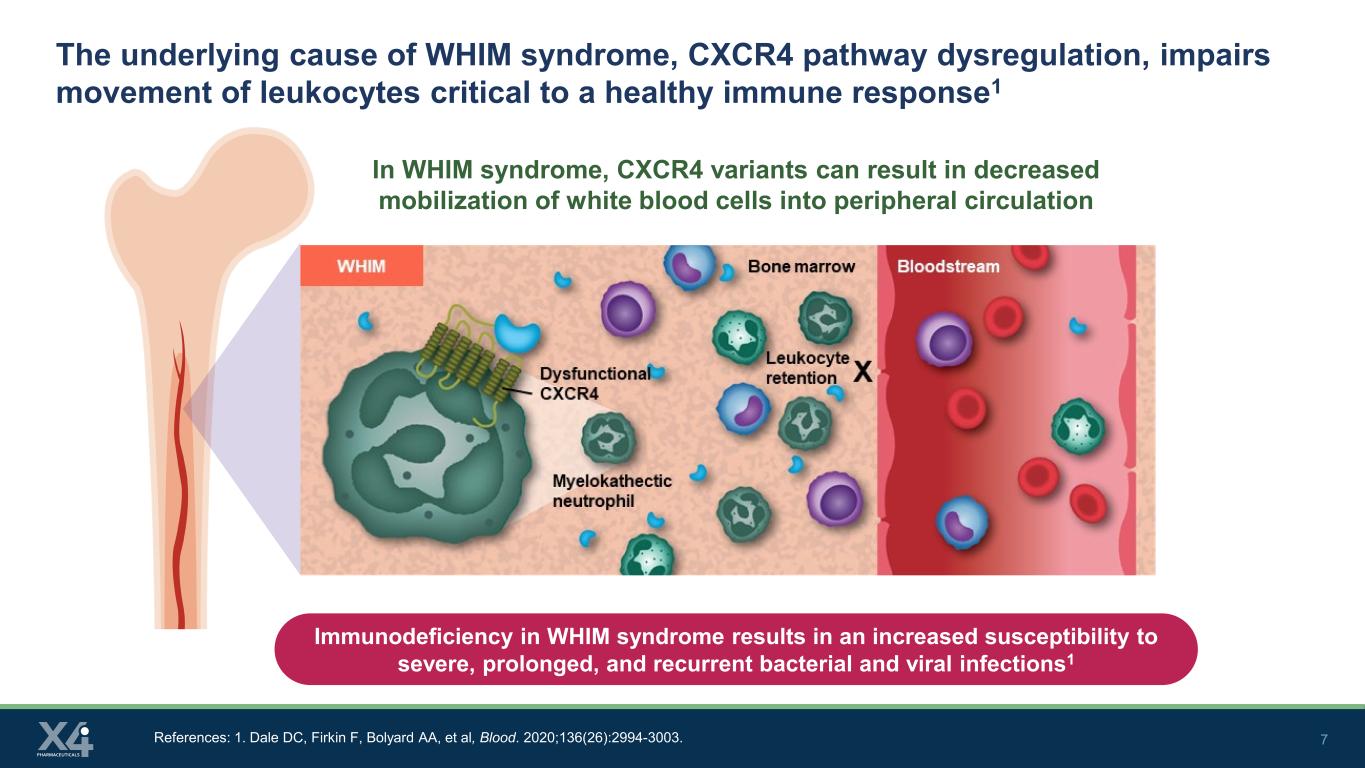
7 WHIM 综合征的根本原因,即 CXCR4 通路失调,会损害对健康免疫反应至关重要的白细胞的运动1 淋巴细胞在 WHIM 综合征中,CXCR4 变体可能导致白细胞在外周循环中的动员减少。参考文献:1.Dale DC、Firkin F、Bolyard AA 等人,Blood。2020;136 (26): 2994-3003。WHIM 综合征中的免疫缺陷会增加对严重、长期和复发的细菌和病毒感染的易感性1
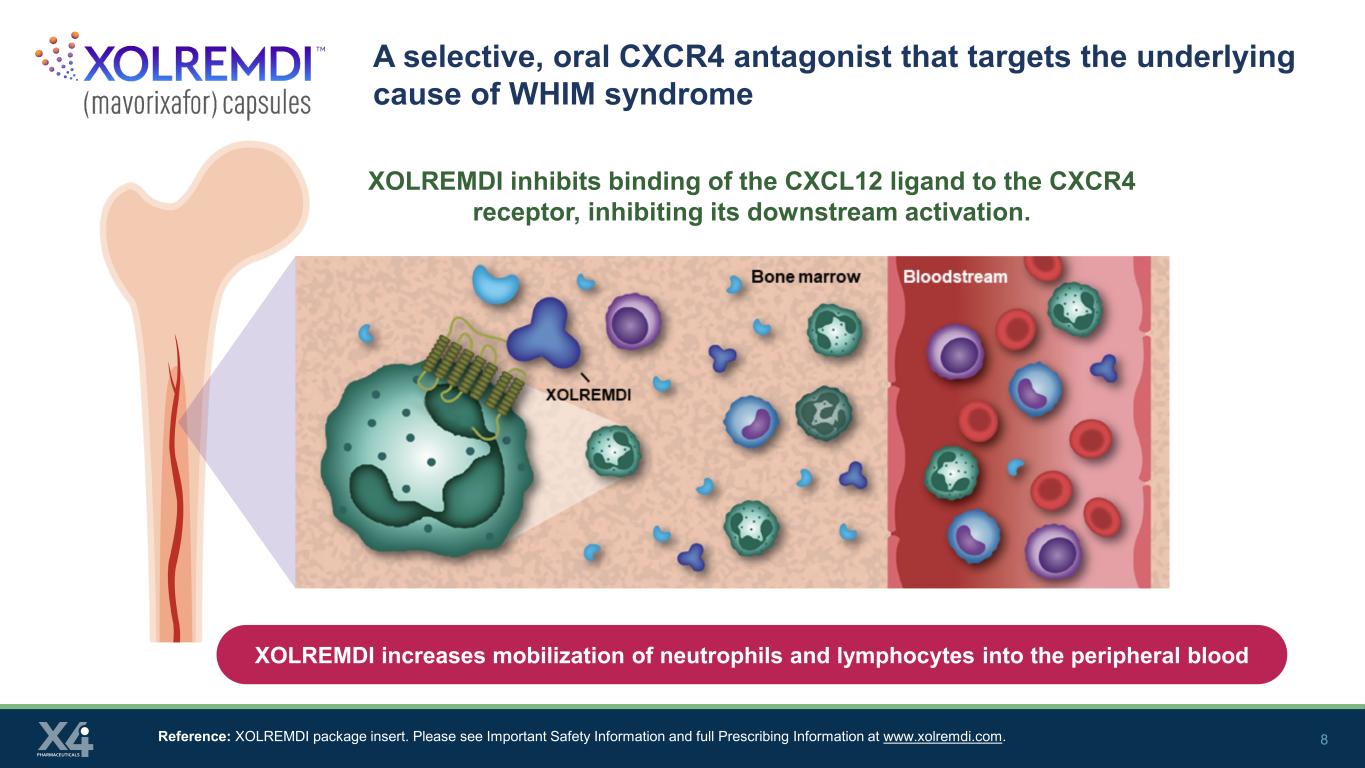
8 一种靶向 WHIM 综合征根本原因的选择性口服 CXCR4 拮抗剂参考文献:XOLREMDI 包装说明书。请在www.xolremdi.com上查看重要安全信息和完整的处方信息。XOLREMDI 抑制 CXCL12 配体与 CXCR4 受体的结合,抑制其下游激活。XOLREMDI 可增加中性粒细胞和淋巴细胞在外周血中的动员

标签亮点和支持临床数据 Christophe Arbet-Engels,医学博士,首席医学官

10 到目前为止,WHIM 综合征的治疗方法尚未解决其根本原因参考文献:1.Dale DC、Firkin F、Bolyard AA 等人,Blood。2020;136 (26): 2994-3003;2.Geier CB、Ellison M、Cruz R 等人,J Clin Immunol。2022;42 (8): 1748-1765;3.Kiss C、Connoley D、Connelly K 等人,抗生素,2022 年 1 月 11 日 (1):62;4.X4 2024 年 3 月研究;74 个 HCP(44 名免疫学家和 30 名 HEM/ONC)。G-CSF:粒细胞集落刺激因子;iViG:静脉注射免疫球蛋白。抗生素和抗病毒药物 • 未特别适用于WHIM综合征 • 没有足够且对照良好的试验评估WHIM综合征患者的安全性和有效性1,2 • G-CSF和IvIG与繁琐的给药有关 • 长期使用抗生素与发生抗微生物药物耐药性 (AMR) 和累积不良事件风险相关的3 • 73%的受访HCP(n=74)对WHIM中的抗生素耐药性感到担忧 IM 综合征患者4 g-CSFIVIG 对症治疗

11 XOLREMDITM(mavorixafor)美国标签亮点适应症声明 XOLREMDI 获准用于 12 岁及以上患有 WHIM 综合征(疣、低丙种球蛋白血症、感染和骨髓病变)的患者,以增加循环中的成熟中性粒细胞和淋巴细胞的数量。禁忌症与高度依赖 CYP2D6 的药物一起使用。盒装警告无剂量和给药体重 >50 kg 的患者:400 mg,口服,每日一次,体重 ≤50 kg 的患者:300 mg,口服,每日一次,剂型和强度胶囊:100 mg mavorixafor 参见幻灯片 15 了解产品标签上的不良反应摘要。请在www.xolremdi.com上查看重要安全信息和完整的处方信息。

12 4WHIM 是迄今为止最大的 WHIM 综合征的 3 期临床试验 XOLREMDI 是在一项全球随机、双盲、安慰剂对照的 3 期试验中进行的,对 31 名 WHIM 综合征患者进行的主要终点 • 绝对中性粒细胞计数 (ANC) 的改善,以次要终点时平均高于 500 个细胞/μL 的 ANC 阈值来衡量 • 绝对淋巴细胞的改善细胞数 (ALC) 以在 13、26、39 和 52 周时平均超过 ALC 阈值 1000 个细胞/μL 来衡量 • 复合终点:分析总感染分数(发生率、严重程度)和总疣变化评分基线访问 XOLREMDI(N = 14)>50 kg:400 mg QD ≤50 kg:200 mg QD 安慰剂(N = 17)主要终点评估了开放标签扩展(OLE)研究人群中约 90% 的持续性 • 成人和青少年(12 至
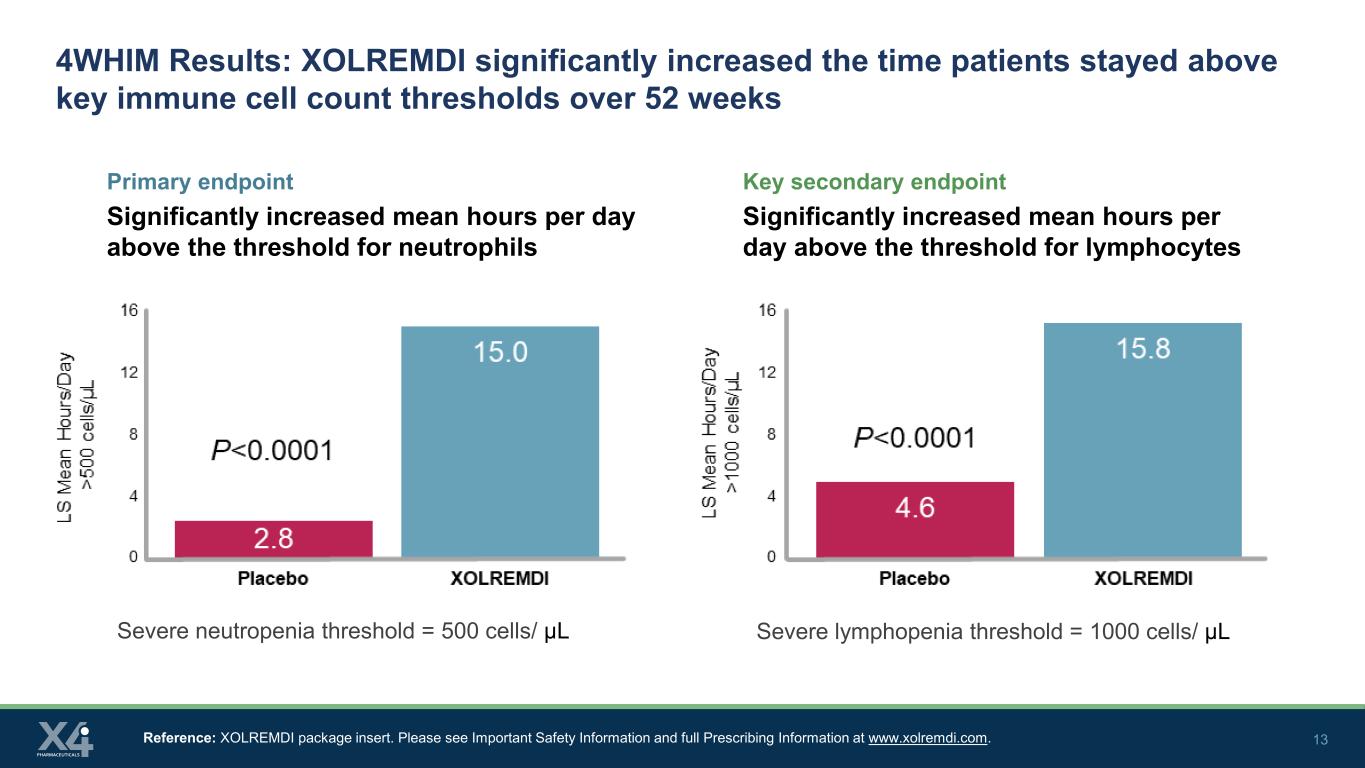
13 4WHIM 结果:XOLREMDI 显著延长了患者在 52 周内保持在关键免疫细胞数量阈值以上的时间主要终点显著增加每天平均小时数高于中性粒细胞阈值的关键次要终点显著增加淋巴细胞阈值以上的每日平均小时数参考:XOLREMDI 包装说明书。请在www.xolremdi.com上查看重要安全信息和完整的处方信息。严重中性粒细胞减少阈值 = 500 个细胞/μL 严重淋巴细胞减少阈值 = 1000 个细胞/μL
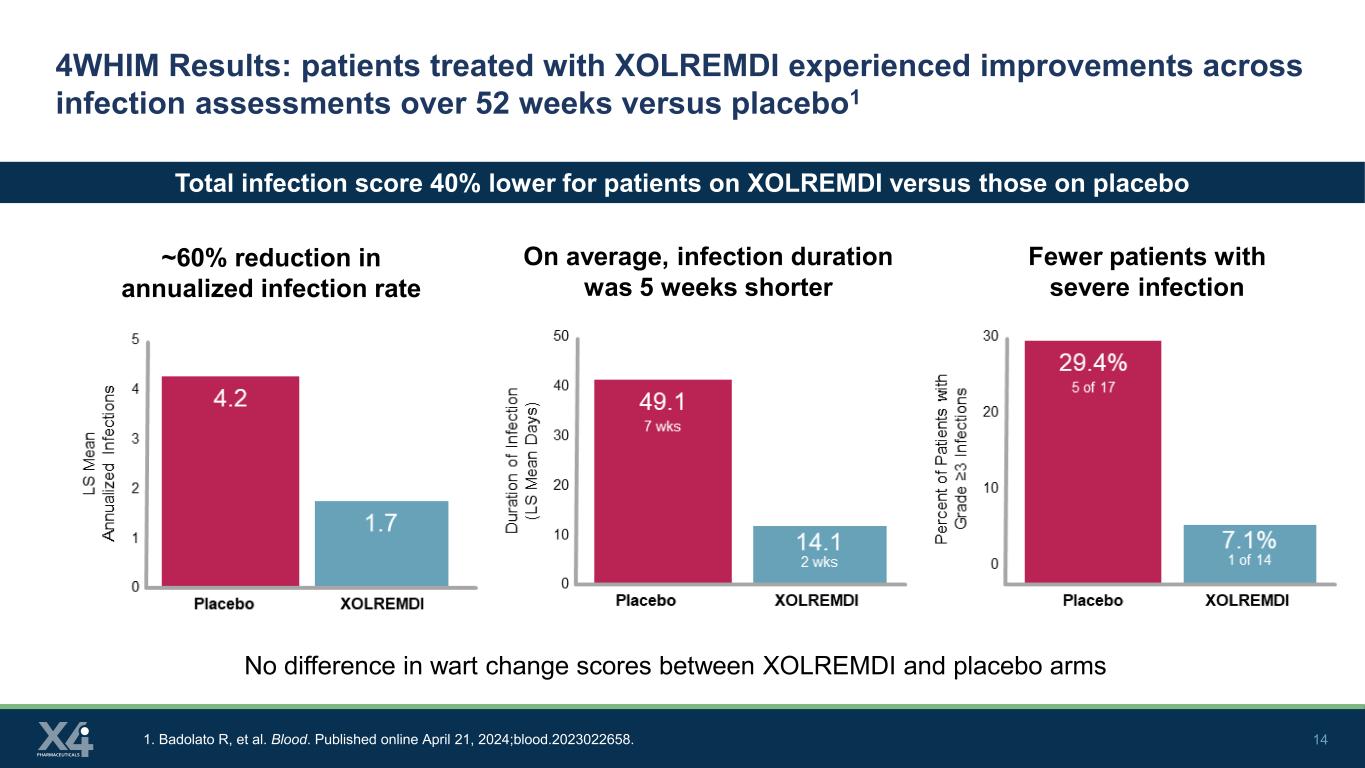
14 4WHIM 结果:与安慰剂相比,接受XOLREMDI治疗的患者在感染评估中在52周内得到了改善1,年化感染率降低了约60% 1。Badolato R 等人血。2024 年 4 月 21 日在线发布;blood.2023022658。严重感染患者减少平均而言,感染持续时间缩短了5周,服用XOLREMDI的患者的总感染分数比服用安慰剂的患者低40% XOLREMDI和安慰剂组之间的疣变评分没有差异
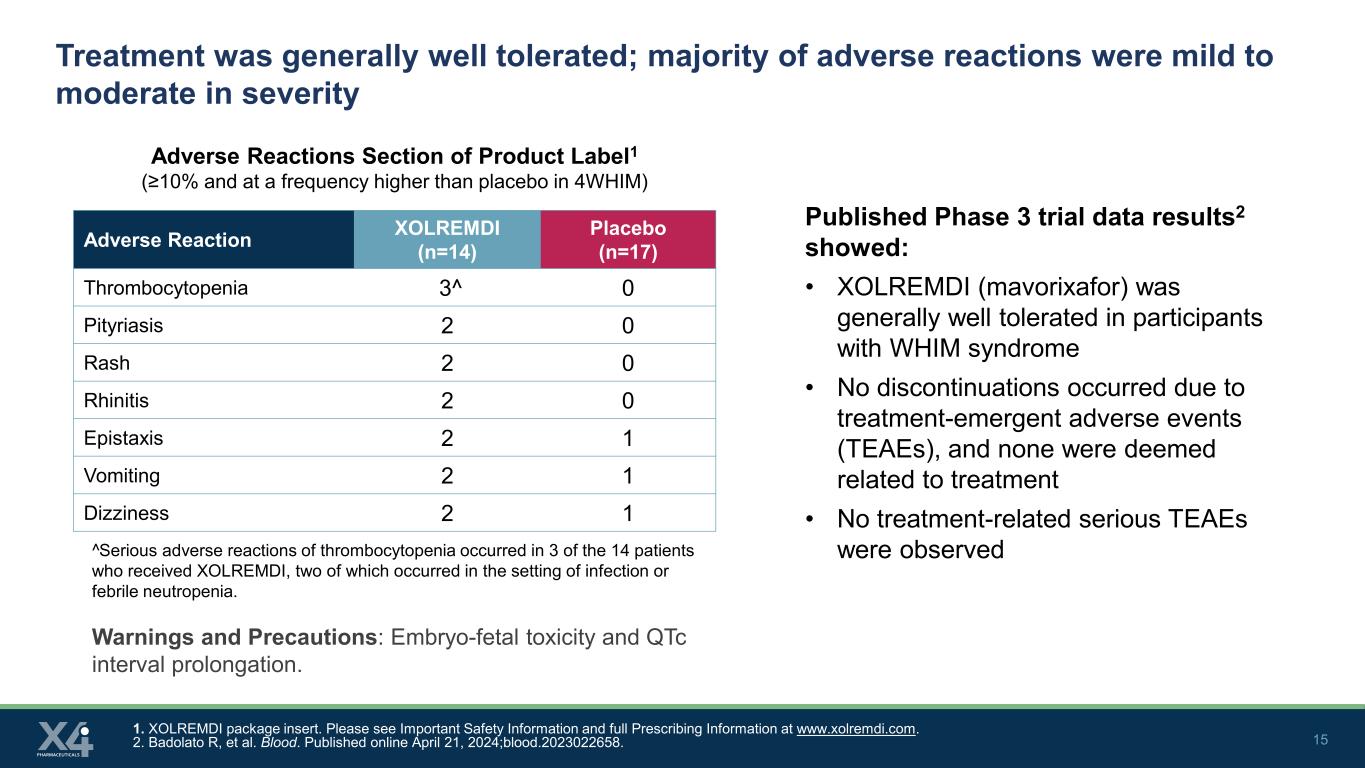
15 治疗的耐受性总体良好;大多数不良反应严重程度为轻度至中度产品标签1的不良反应部分(≥ 10%,频率高于4WHIM中的安慰剂)1。XOLREMDI 包装说明书。请在 www.xolremdi.com 上查看 “重要安全信息” 和 “完整处方信息”。2.Badolato R 等人血。2024 年 4 月 21 日在线发表;blood.2023022658。不良反应 XOLREMDI (n=14) 安慰剂 (n=17) 血小板减少症 3^ 0 糠疹 2 0 皮疹 2 0 鼻炎 2 0 鼻炎 2 1 呕吐 2 1 头晕 2 1 已公布的 3 期试验数据结果2显示:• XOLREMDI(mavorixafor)对WHIM综合征参与者的耐受性总体良好 • 没有停药由治疗紧急不良事件 (TEAE) 引起,无一被认为与治疗有关 • 未观察到与治疗相关的严重不良反应^在接受XOLREMDI治疗的14名患者中,有3例出现了严重的血小板减少不良反应,其中两例发生在感染或发热性中性粒细胞减少的背景下。警告和注意事项:胚胎毒性和 QtC 间隔延长。

商业发布战略与执行首席商务官马克·巴尔德里

17 商业策略概述:有针对性的教育、参与和准入就WHIM综合征进行教育提供诊断支持参与关键医学会议目标血液学家和免疫学家沟通有针对性的MOA和临床概况推动相关患者的采用和吸收缓解准入障碍提供全套患者支持服务帮助患者在整个治疗过程中支持患者诊断将XOLREMDI确立为WHIM综合征的护理标准获得广泛准入利用敏捷的商业广告团队将执行 X4 的首次产品发布会

18 推出创新罕见病药物的合适领域团队以使命为导向,以患者为中心:为历史上得不到充分服务的人群提供新疗法团队专业知识 • 罕见疾病空间/血液学和免疫学 • 支持罕见疾病的诊断 • 了解患者旅程 • 向新市场推出疗法 • 与医生、思想领袖和患者权益组织建立社区关系从知名稀有和超罕见组织招募的现场团队共计250多年的成功经验在商业发布中
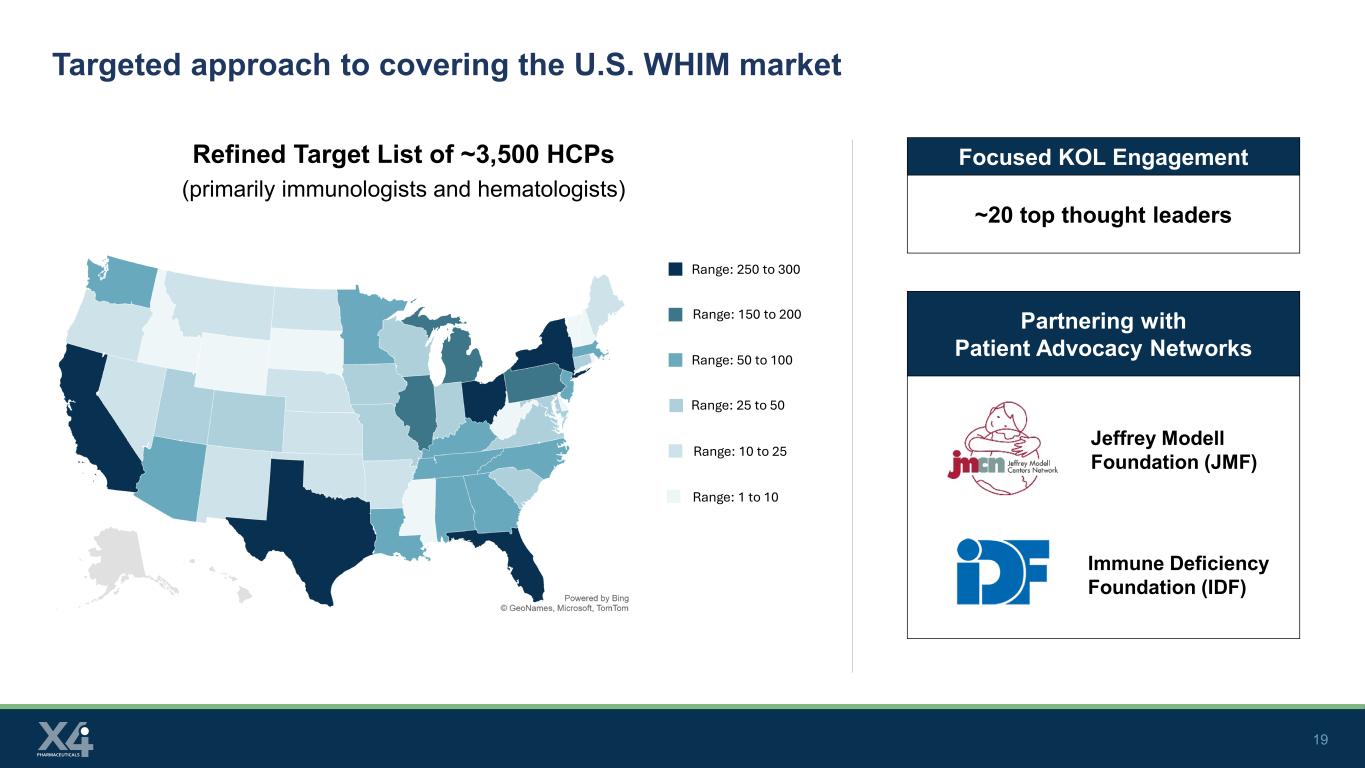
19 与患者权益网络合作覆盖美国WHIM市场的有针对性的方法约3500名HCP(主要是免疫学家和血液学家)的精简目标清单杰弗里·莫德尔基金会(JMF)免疫缺陷基金会(IDF)范围:250至300范围:150至200范围:50至100范围:10至25范围:1至10位重点KOL参与度~20位顶级思想领袖

20 个医疗保健提供者正在寻求针对WHIM综合征的靶向疗法,这是一种负担沉重且需求未得到满足的严重疾病 HCPs 上诉/关注的驱动者对以下方面印象特别深刻:• 感染减少 • 治疗的靶向性 • HCP的口服配方认为 WHIM 综合征是一种严重的免疫疾病,可能出现长期并发症 92% HCP 调查认为 WHIM 综合征的靶向有效疗法的未得到满足的需求很高 89% 的人对当前的选择不满意用于治疗 WHIM 综合征的症状 76% 显示未贴标XOLREMDI 概况,所有关键专业的 HCP 对处方的兴趣都很高,平均得到 9 分(满分 10 分)来源:X4 Pharmicals HCP 从 2024 年 2 月(N = 29 个 HCP)和 2024 年 3 月(N = 74 个 HCP)的市场研究和测试

21 项经济援助计划 • 经济援助产品包括针对符合条件的患者的快速启动、自付援助、过渡计划和患者援助计划,患者支持专业药房流程,并由临床药剂师填写 XOLREMDI 处方,可用于:• 回答有关治疗的问题 • 提供有关潜在副作用的信息 • 确认治疗剂量和任何调整 x4ConnectTM 帮助符合条件的患者了解保险范围、事先授权要求和经济援助计划,以提供帮助支持访问 X4Connect 护理协调员 • 调查承保范围并帮助浏览事先的授权、上诉和经济援助选项 X4 护士教育工作者 • 向患者及其护理人员提供有关 XOLREMDI 和 WHIM 综合征的教育和可用资源 X4Connect 专业药剂师 • 就患者的 XOLREMDI 处方提供咨询

22 XOLREMDI 通过有针对性的创新解决未满足的高需求年度价格*反映了价值 • 每日 >50 kg = 400 mg 的患者 = 每年 496,400 美元 • 患者≤50 kg = 每日 300 mg = 每年 372,300 美元可能解决高疾病负担和增强患者免疫功能的相关方面显著疗效和安全性特征针对超罕见患者群体的靶向突破性疗法首款也是唯一一款经美国食品药品管理局批准的针对WHIM综合征的疗法致力于提供创新解决方案通过 X4 提供支持和教育Connect 和 PantherX Rare 适用于所有符合条件的患者,通过合作、有针对性的教育和对早期诊断的支持,帮助团结 WHIM 综合征社区 XOLREMDI 针对 CXCR4 失调,这是 WHIM 综合征的根本原因 * 批发收购成本 (WAC);假设完全合规

23 兑现XOLREMDI(mavorixafor)支持患者诊断的承诺将XOLREMDI确立为WHIM综合征的护理标准获得广泛普及

[设计:请使用新的分隔滑梯]结论 Paula Ragan,博士总裁兼首席执行官
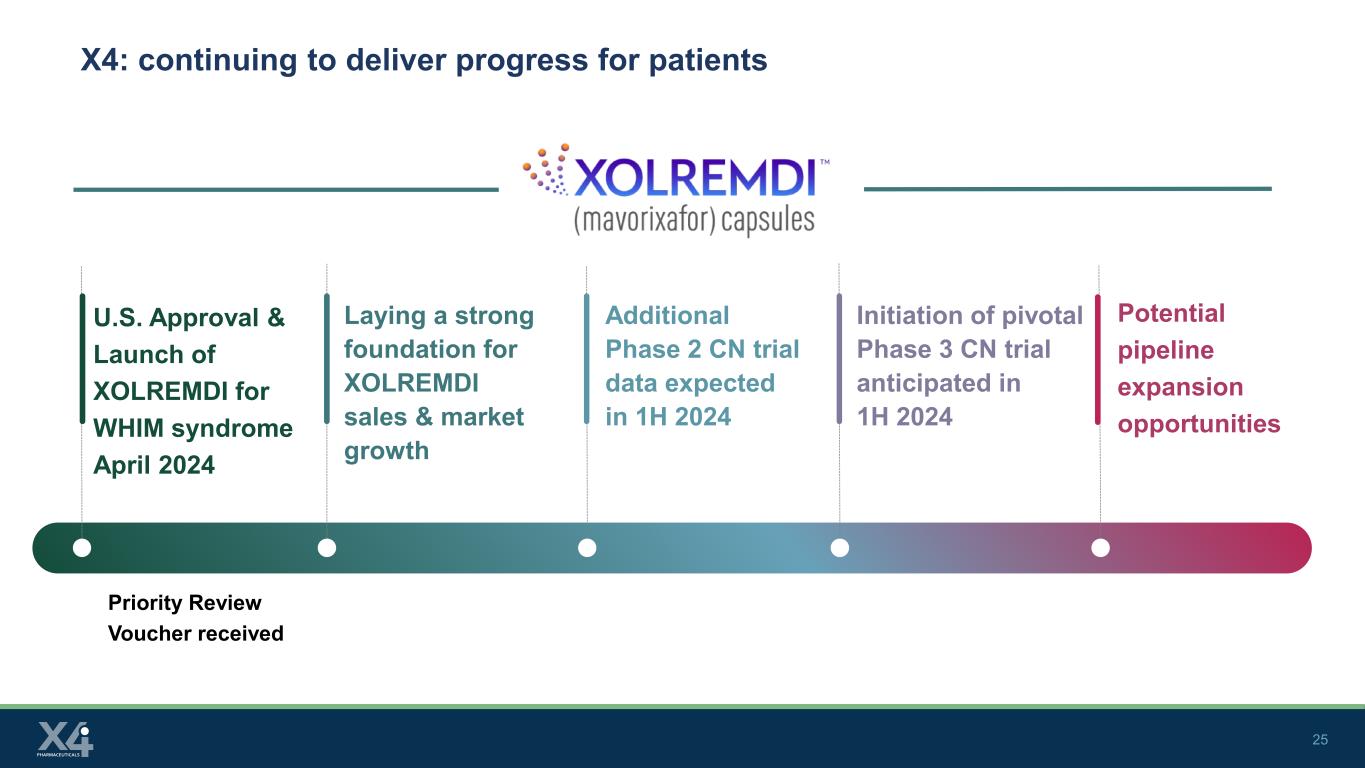
25 X4:继续为患者带来进展优先审查凭证获得美国批准并于2024年4月推出用于WHIM综合征的XOLREMDI为XOLREMDI的销售和市场增长奠定坚实基础额外的2期CN试验数据预计将于2024年上半年启动关键的3期CN试验潜在的管道扩张机会

考特尼,患有 WHIM 综合症