| 2023 年 12 月纳斯达克:NRBO 2024 年 2 月 1 日 neuroBO 制药公司 |
| 2 前瞻性陈述 本演示文稿可能包含1995年《私人证券诉讼改革法》所指的前瞻性陈述。前瞻性陈述包括所有不只与历史或 当前事实相关的陈述,可以通过使用 “相信”、“期望”、“预期”、“可能”、“将”、“应该”、“寻求”、“大约”、“打算”、“项目”、“计划”、“估计” 或这些词语的否定词或 其他类似术语(以及其他类似术语)来识别提及未来事件、条件或情况的词语或表达)。前瞻性陈述是关于未来事件的预测、预测和其他陈述 ,这些陈述基于当前的预期和假设,因此受风险和不确定性的影响。这些前瞻性陈述包括有关我们当前和未来候选产品的市场规模和潜在增长机会 、资本要求和收益用途、临床开发活动、临床试验的时间表和结果、监管机构申报以及其当前和未来候选产品的潜在监管批准 和商业化的陈述。许多因素可能导致未来的实际事件与本新闻稿中的前瞻性陈述存在重大差异,包括但不限于与我们执行商业战略的能力相关的风险 ;监管机构申报的时间表;通过我们当前和未来候选产品的开发步骤获得监管部门批准的能力; 实现与东亚科技公司许可协议的好处的能力。Ltd.,包括对NeuroBo未来财务和经营业绩的影响;我们的合同制造商、临床研究合作伙伴 和其他参与开发我们当前和未来候选产品的合作;我们的候选产品与任何其他与其联合治疗的产品之间的潜在负面相互作用;我们 及时启动和完成临床试验的能力;我们为临床试验招募受试者的能力;我们是否收到临床试验的结果试用是与临床前和先前 临床试验的结果一致;与许可协议相关的已知和未知成本的影响,包括与许可协议相关的任何诉讼或监管行动的成本;适用法律或法规变更的影响; 我们是否能够恢复对纳斯达克上市要求的遵守;以及我们的股票价格变动对许可协议条款和任何未来筹款的影响。这些前瞻性陈述 基于我们目前获得的信息以及我们当前的计划或预期,并受许多已知和未知的不确定性、风险和其他重要因素的影响,这些因素可能导致我们的实际业绩、 业绩或前瞻性陈述所表达或暗示的成就。我们截至2022年12月31日的 10-K表年度报告的 “风险因素” 部分以及我们向美国证券交易委员会提交的其他文件中详细描述了这些因素和其他重要因素。 尽管我们可能会选择在未来的某个时候更新此类前瞻性陈述,除非法律要求,但我们不承担任何更新此类前瞻性陈述的义务,即使随后发生的事件导致我们的观点发生变化。尽管我们 认为此类前瞻性陈述中反映的预期是合理的,但我们无法保证此类预期会被证明是正确的。不应将这些前瞻性陈述视为 代表我们截至本演示之后的任何日期的观点。 本演示文稿还可能包含独立方和我们对市场规模以及有关我们行业的其他数据所做的估算和其他统计数据。这些数据涉及许多假设和 限制,提醒您不要过分重视此类估计。此外,对我们未来表现以及我们经营所在市场的未来表现的预测、假设和估计 必然受到高度的不确定性和风险的影响。 |
| 3 强大的领导团队 管理团队 Hyung Heon Kim,首席执行官 Robert Homolka,临床运营高级副总裁 Stephen Harrison,医学博士,咨询首席医学官 金成真,药剂师,企业战略总监 ▪ 拥有超过20年的并购、融资和公司治理经验 ▪ 在东亚集团 拥有超过10年的许可、并购和合规经验 ▪ 曾任东亚ST和东亚社会集团总法律顾问/高级副总裁 ▪BA Soonghsil University,JD 华盛顿大学法学院 ▪ 在 Dong-A ST 从事药物发现研究超过 25 年 ▪ 专门研究糖尿病、肥胖、MASH、免疫介导疾病 ▪ 博士,梨花女子大学药学院 rpH ▪ Adiso Therapeutics 临床运营高级总监 ▪ 夏尔/武田制药临床运营总监 ▪ 阿斯利康 实验试验管理总监 ▪ MASH/NAFLD 临床试验专家,约 300 名同行评审 ▪出版物 ▪ 牛津大学肝病学客座教授 ▪ 密西西比大学医学博士 ▪ Col(退休)美国,MC ▪ 拥有 35 年以上的财务经验 ▪ 与生命科学投资者和分析师合作超过 20 年 ▪ 内瓦卡尔公司、布雷本制药公司、Aerocrine AB 和 Furiex 制药公司的首席财务官 ▪ 马里兰大学学士学位,印第安纳大学工商管理硕士 ▪ 在 Dong-A ST 制药行业工作了 18 年以上 ▪ 公司团队负责人规划 ▪ 糖尿病专业临床试验研究经理 ▪ 业务发展经理 |
| 4 引人注目的投资机会 通过新一代疗法瞄准MASH和肥胖症的投资机会 ▪ 旨在通过多个短期价值创造里程碑来增加股东价值 • DA-1241 ✓ 开放IND治疗MASH和2型糖尿病 ✓ 积极招募假定为MASH 的受试者进入2a期 ✓ 已完成的SAD和MAD研究(针对健康志愿者和T2D受试者) } • DA-1726 ✓ 开放肥胖症治疗新药申请 ▪ 得到战略合作伙伴兼主要股东东-A ST 的支持 ▪ 嗯 DA-1241截至2023年第三季度末,资本化为2580万澳元现金。现金流进入2024年第四季度 ▪ 探索超越传统资产许可的战略机会 |
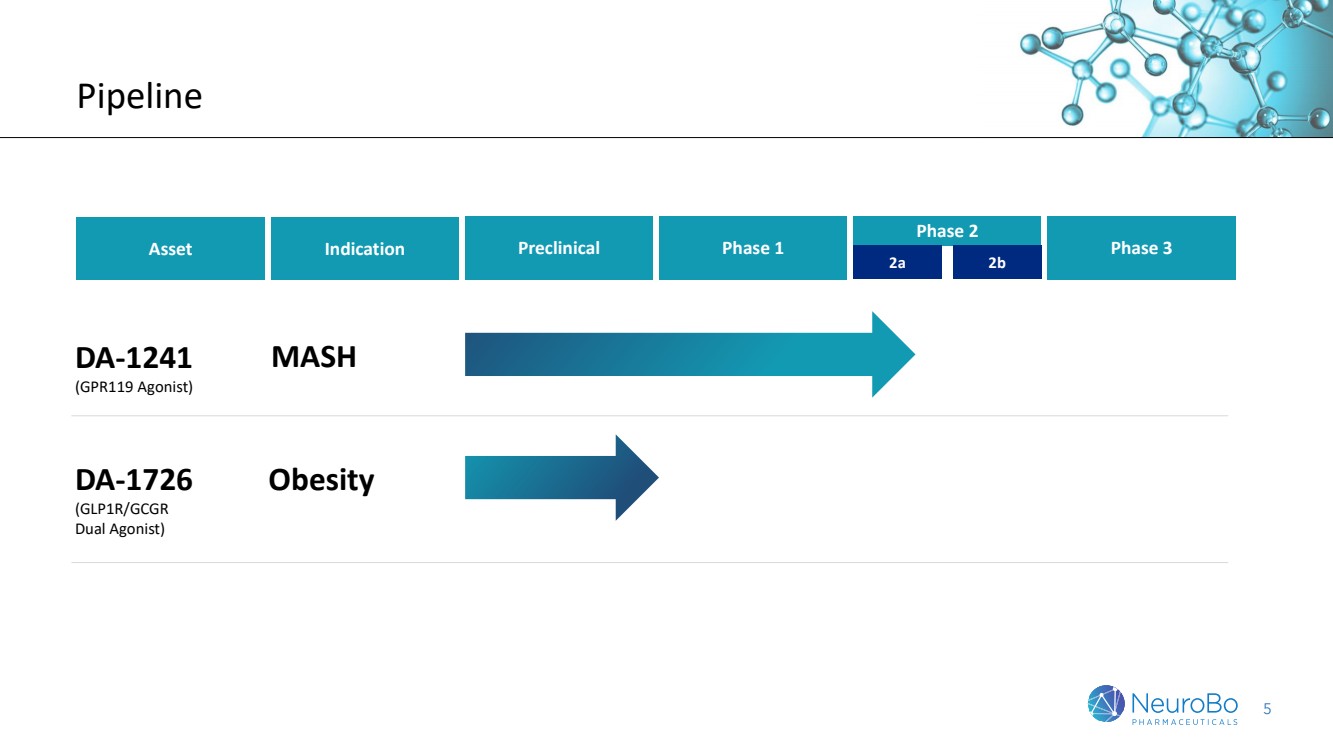
| 5 Pipeline Asset 临床前 1 期 2 期 DA-1241(GPR119 激动剂) DA-1726(GLP1R/GCGR 双激动剂) 2b 肥胖 适应症 3 期 MASH 肥胖 |
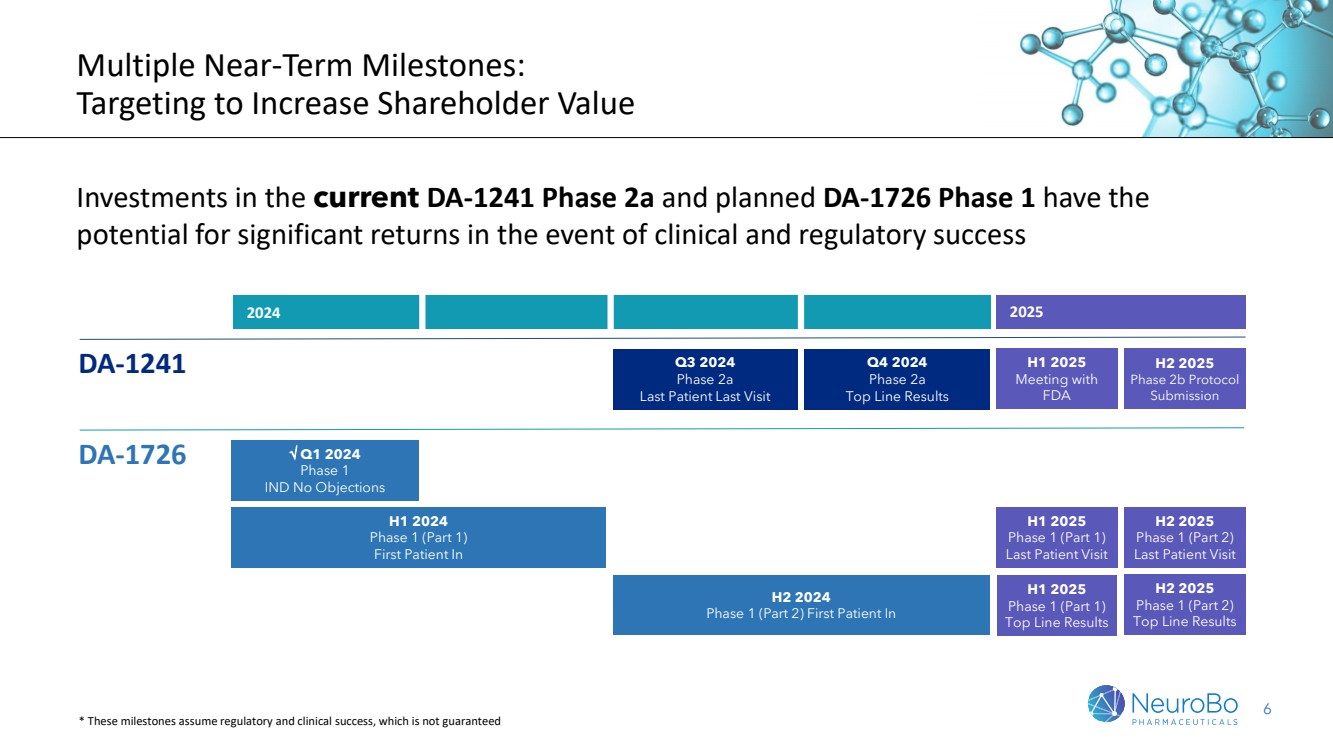
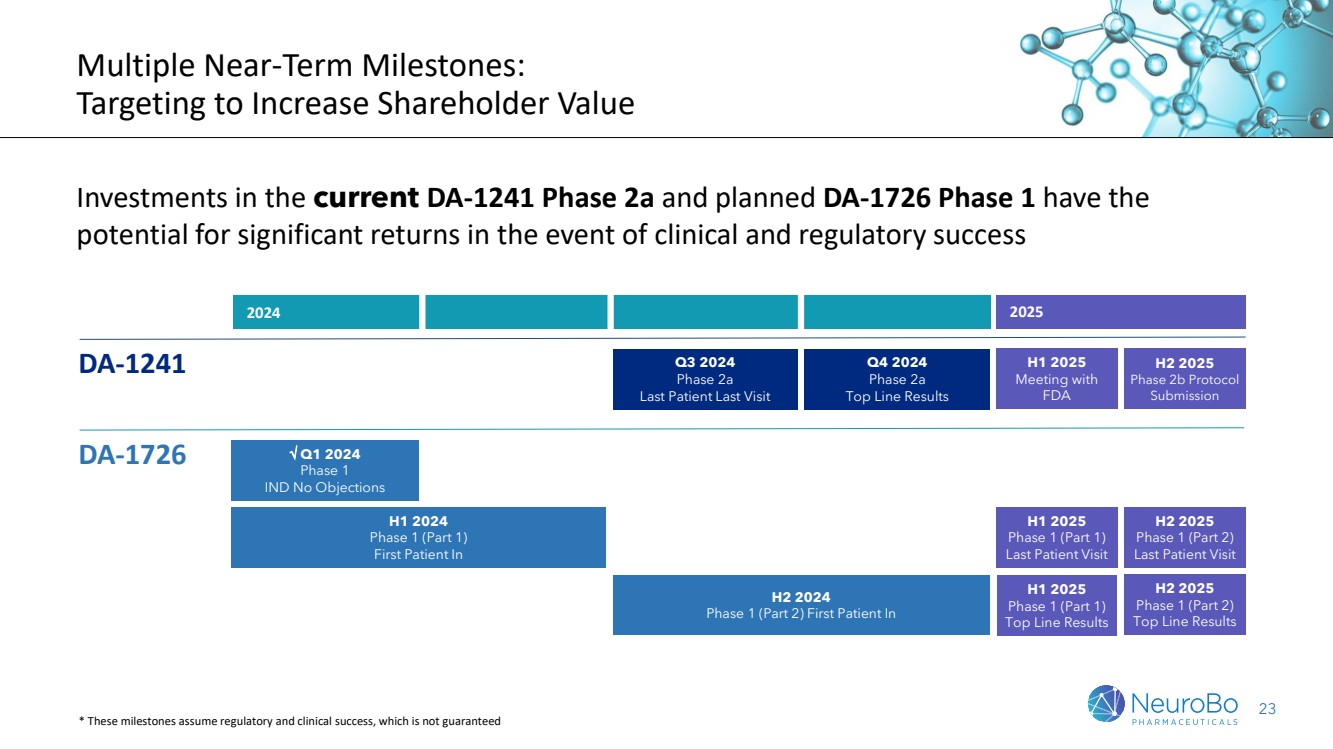
| 6 多个短期里程碑: 以增加股东价值为目标 如果在临床和监管方面取得成功,对当前 DA-1241 第 2a 阶段和计划中的 DA-1726 第 1 阶段的投资有可能获得可观的回报 2025 年上半年与 2025 年下半年第 2b 期协议 2025 年下半年第 2b 期协议 提交 {2a br} DA-1241 2024 年第三季度第 期最后一次就诊 第四季度 2024 年 2a 期 主要结果 2024 年第一季度第 1 阶段 IND 无异议 DA-1726 2025 年上半年第 1 阶段(第 1 部分) 最后一次患者就诊 2024 年上半年第 1 阶段(第 1 部分) 第一位患者br} 2024 年下半年第 1 阶段(第 2 部分) 2025 年上半年第 1 阶段(第 1 部分)的首位患者 2025 年下半年第 1 阶段(第 2 部分)的首位患者 2025 年下半年第 1 阶段(第 2 部分) 上次患者就诊 * 这些里程碑假设监管和临床成功,但不能保证 |
| 2023 年 12 月纳斯达克:NRBO 7 DA-1241 口服上市,潜在的 同类首创 GPR119 激动剂用于 MASH 的治疗 |
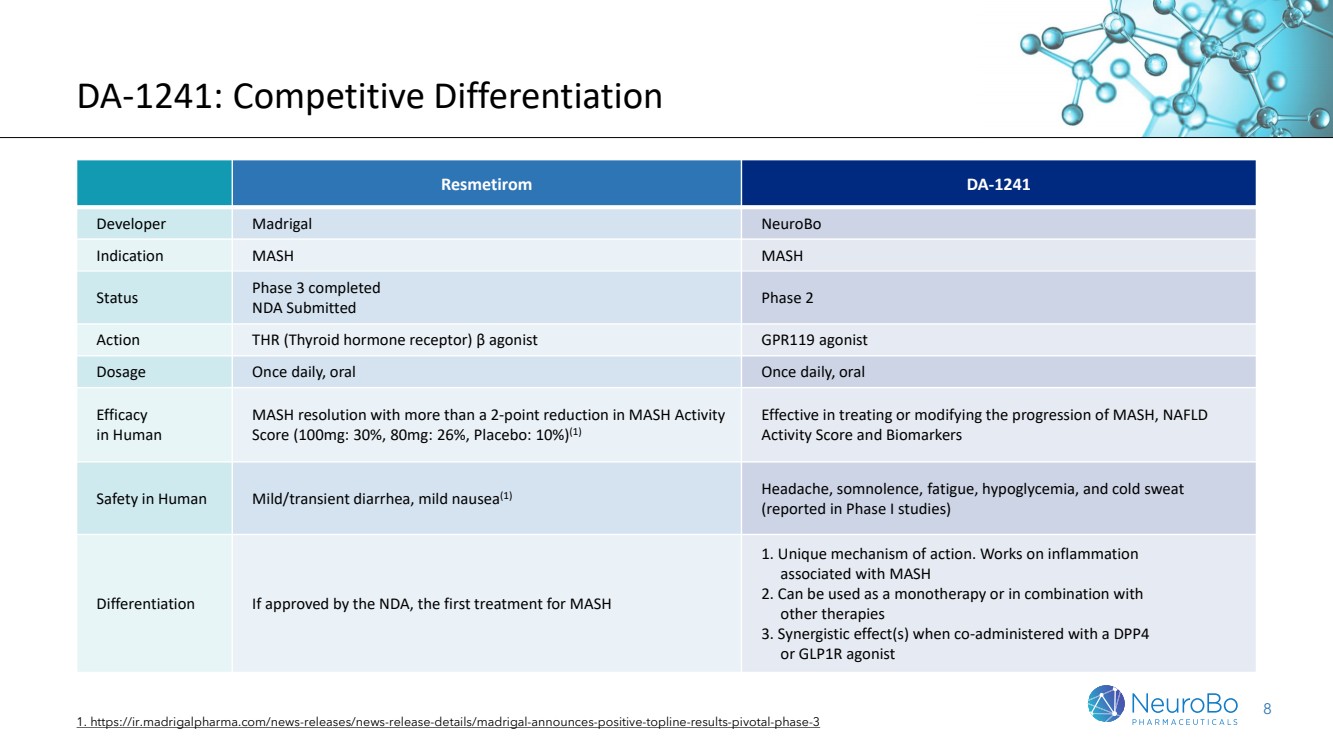
| 8 DA-1241:竞争差异化 1. https://ir.madrigalpharma.com/news-releases/news-release-details/madrigal-announces-positive-topline-results-pivotal-phase-3 Resmetirom DA-1241 开发者 Madrigal NeuroBO 适应症 MASH 状态第 3 阶段已完成 NDA 已提交第 2 阶段行动 THR(甲状腺激素受体)β 激动剂 GPR119 激动剂 剂量 剂量每日一次,口服 功效 对人体 MASH 分辨率降低 2 个百分点以上 ASH 活性 评分(100 毫克:30%,80 毫克:26%,安慰剂:10%)(1) 有效治疗或修改 MASH、NAFLD 活性评分和生物标志物的进展 人类轻度/短暂性腹泻、轻度恶心 (1) 头痛、嗜睡、疲劳、低血糖和冷汗 (在 I 期研究中报告) 分化如果获得 NDA 的批准,则是 MASH 的首种治疗方法 1。独特的作用机制。适用于与 MASH 2 相关的炎症 。可用作单一疗法或与 其他疗法 联合使用。与 DPP4 或 GLP1R 激动剂共同给药时的协同效应 |
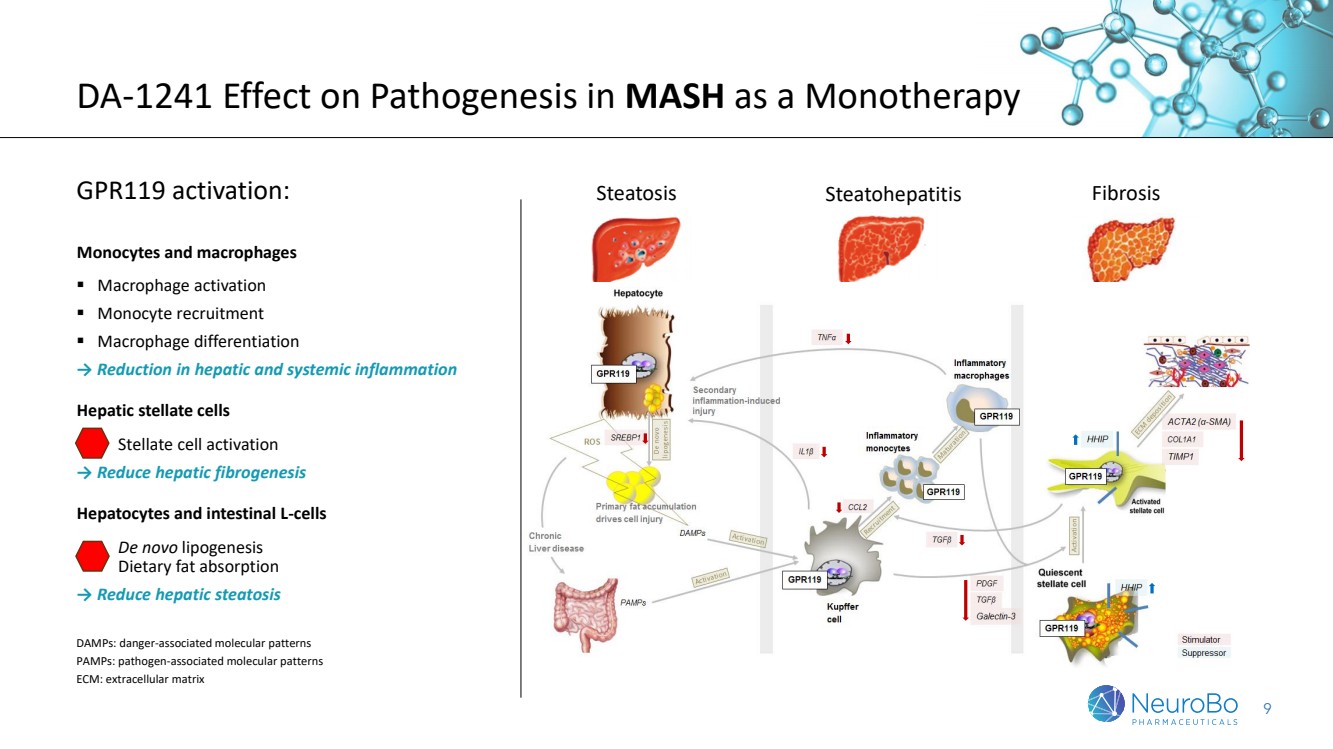
| 9 DA-1241 对单一疗法 MASH 发病机制的影响 GPR119 激活: 单核细胞和巨噬细胞 ▪ 巨噬细胞激活 ▪ 单核细胞招募 ▪ 巨噬细胞分化 → 减少肝和全身炎症 肝星状细胞 星状细胞激活 → 减少肝纤维化 肝细胞 肝细胞 和肠道 L 细胞 从头脂肪生成 膳食脂肪吸收 → 减少肝脏脂肪变性 脂肪变性脂肪肝纤维化 dampS:与危险相关的分子模式 PAMpS:与病原体相关的分子模式分子模式 ECM:细胞外基质 |
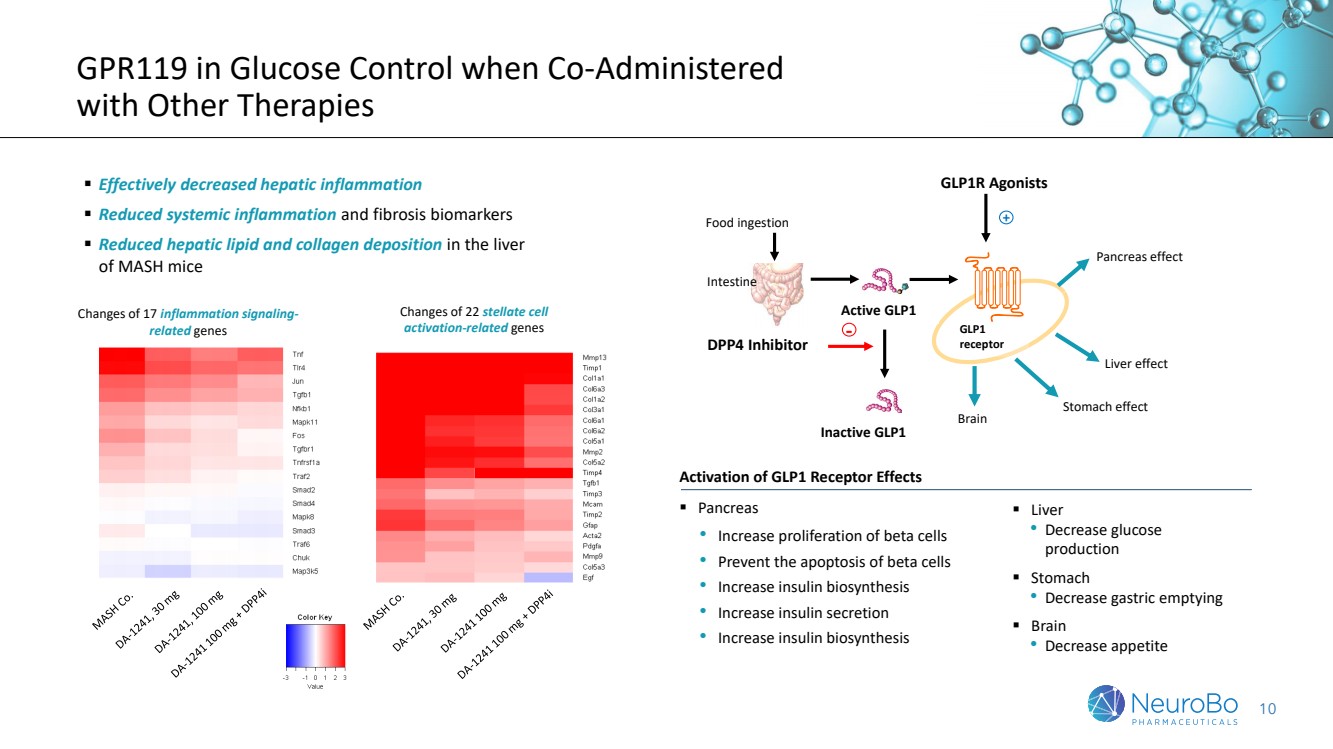
| 10 GPR119 与其他疗法 共同使用可控制血糖 ▪ 有效减少肝炎症 ▪ 减少全身性炎症和纤维化生物标志物 ▪ 减少 MASH 小鼠肝脏脂质和胶原蛋白沉积 激活 GLP1 受体效应 。胰腺 • 增加 β 细胞增殖 • 防止细胞凋亡 β 细胞 • 增加胰岛素生物合成 • 增加胰岛素分泌 • 增加胰岛素生物合成 肝脏效应 胰腺效应 肠道 活性 GLP1 无活性 ▪GLP1 DPP4 抑制剂 + - GLP1R 激动剂 GLP1 受体 胃部效应 大脑 食物摄入 22 个星状细胞 激活相关基因的变化 17 个炎症信号相关基因的变化 ▪ 肝脏 • 降低葡萄糖 产生 胃 } • 减少胃排空 ▪ 大脑 • 降低食欲 ▪ |
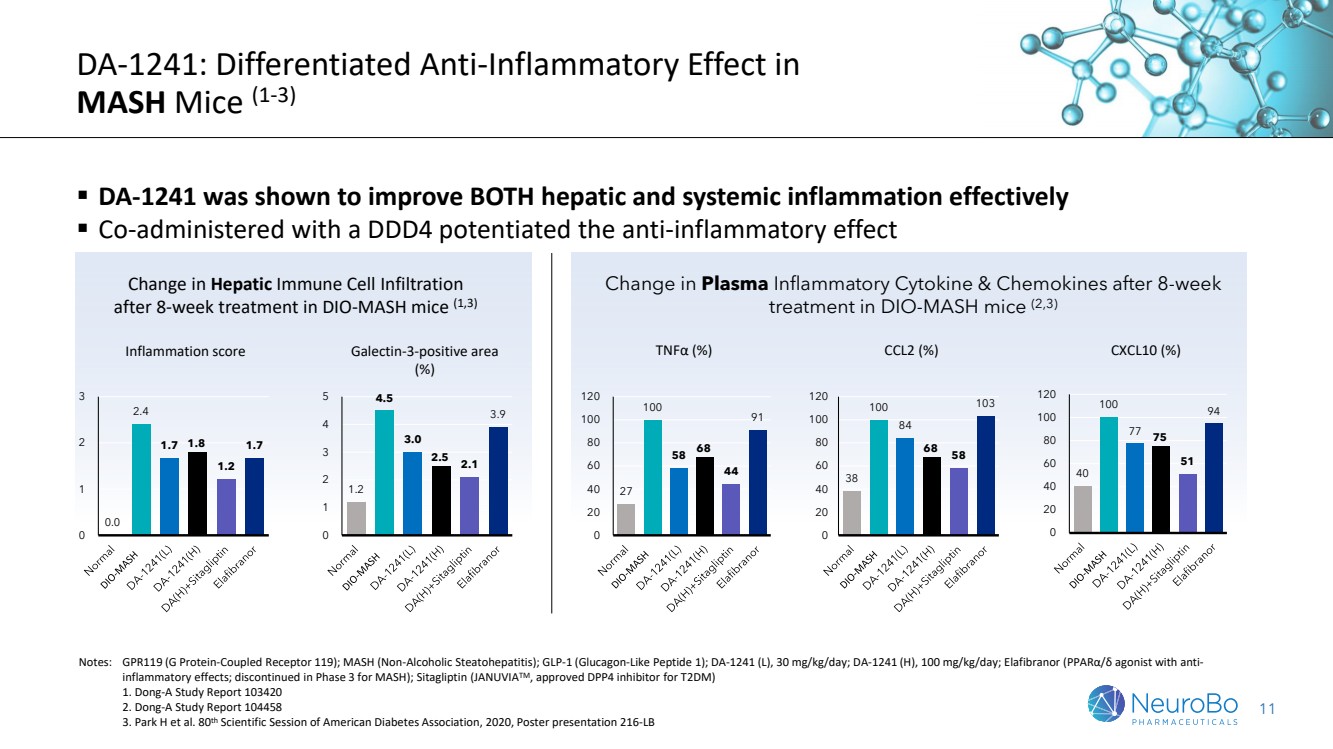
| 11 DA-1241: MASH 小鼠的差异化抗炎作用 (1-3) ▪ DA-1241 被证明可以有效改善肝脏和全身炎症 ▪ 与 DDD4 共同施用增强了抗炎作用 38 100 84 68 58 103 0 20 40 60 80 100 120 DIO-MASH 小鼠治疗 8 周 后血浆炎性细胞因子和趋化因子的变化 (2,3) CCL2 (%) 27 100 58 68 44 91 0 20 40 60 80 100 120 TNFα (%) 40 100 77 75 51 94 0 20 40 60 80 100 120 CXCL10 (%) 1.2 4.5 3.0 2.1 3.9 0 1 2 3 4 5 半乳凝集素-3 阳性区域 (%) 1.2 4.5 3.0 2.1 3.9 0 1 2 3 4 5 半乳糖凝集素-3 阳性区域 (%) br} 注意事项:GPR119(G 蛋白偶联受体 119);MASH(非酒精性脂肪性肝炎);GLP-1(胰高血糖素样肽 1);DA-1241(L),30 mg/kg/天;DA-1241(H),100 mg/kg/天;Elafibranor(具有抗炎作用的PPARα/激动剂;在 MASH 第 3 期停产);西格列汀(JANUVIATM,获批 DPPT T2DM 的 4 抑制剂) 1.东亚研究报告 103420 2.东亚研究报告 104458 3.Park H 等人。美国糖尿病协会第 80 届科学会议,2020 年,海报演讲 216-LB DIO-MASH 小鼠治疗 8 周后肝免疫细胞浸润 的变化 (1,3) 0.0 2.4 1.7 1.7 1.8 1.7 1.7 1.7 1.7 1 2 3 炎症评分 |
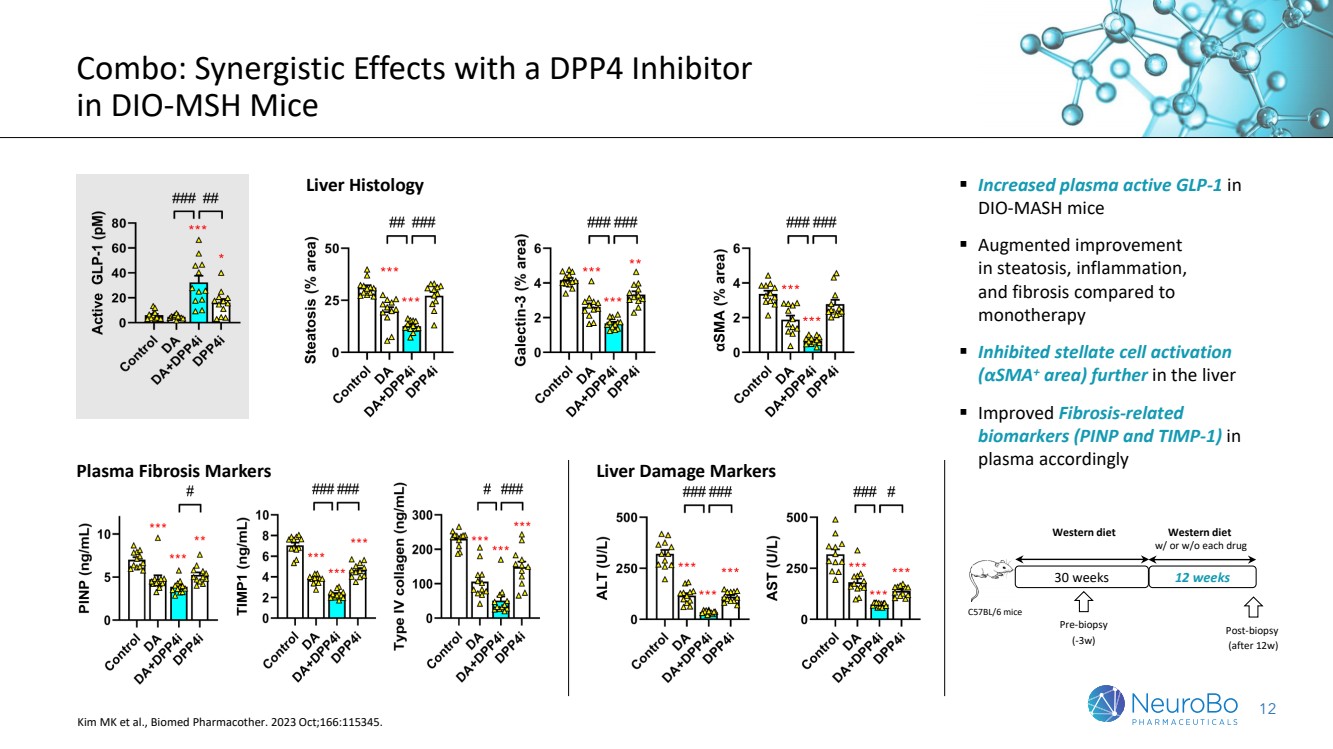
| 12 组合:使用 DPP4 抑制剂 对 DIO-MSH 小鼠产生协同作用 ▪ 增加 DIO-MASH 小鼠血浆活性 GLP-1 ▪ 与 单一疗法 相比 单一疗法 受到抑制 (αSMA+ 区域)在脂肪变性、炎症、 和纤维化方面的改善增强 ▪ 进一步抑制肝脏中的星状细胞激活 (αSMA+ 区域) br} ▪ 相应改善了 血浆中与纤维化相关的 生物标志物(PINP 和 TIMP-1) C57BL/6 小鼠 12 周 西方饮食 含或不含每种药物 30 周 活检前 (-3w) 活检后 (12 周后) 西方饮食 肝脏组织学 血浆纤维化标志物肝损伤标志物 Kim MK 等人,Biomed Pharmacother。2023 年 10 月;166:115345。 |
| 13 DA-1241:正在进行的 2a 期 MASH 支持用作单一疗法 研究设计 研究概述 ▪ 一项多中心、随机、双盲、安慰剂对照、平行的 2a 期临床试验,旨在评估 DA-1241 对假定为非酒精性脂肪性肝炎 主要终点的受试者的疗效和安全性 ▪ 丙氨酸转氨酶 研究设计 的受试者的疗效和安全性 ▪ 2 部分研究 • 第 1 部分:DA-1241 50mg、DA-1241 100mg、安慰剂 • 第 2 部分:DA-1241 100mg + 西格列汀 100mg,安慰剂 受试者数量 ▪ 大约 90 名受试者有假定 MASH 地点 ▪ 美国大约 25 个中心 入组(计划中)▪ 2023 年 8 月 FPI ▪ LPLV 2024 年 6 月 ▪ DA-1241 改变了 OB-Mash 小鼠体内 MASH 的进展 ▪ 探索通过纤维扫描和 MRI 探索与 DBR 共同给药测量的改良生物标志物(CCL2、TNFA 和 TIMP1)、肝脂含量、 和刚度 PP4 抑制剂 ▪ 识别有效减轻肝炎症的能力 ▪ 探索减少全身性炎症和纤维化生物标志物的能力 ▪ 减少肝脂和胶原蛋白沉积在 OB-Mash 小鼠中 注意:FPFV(首次患者首次就诊);LPO(患者最后一次就诊) |
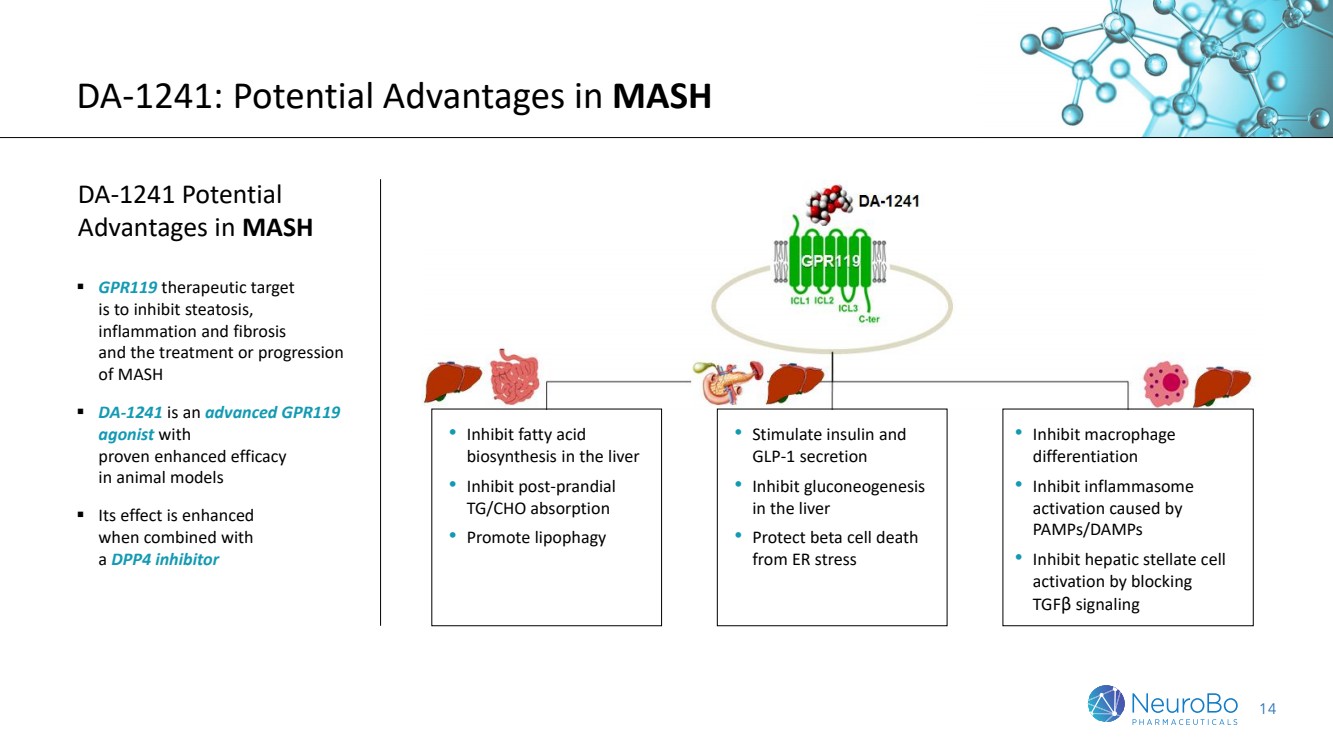
| 14 DA-1241:MASH DA-1241 的潜在优势 MASH ▪ GPR119 治疗靶标 的潜在优势是抑制脂肪变性、 炎症和纤维化 以及 MASH ▪ DA-1241 的治疗或进展 是一种先进的 GPR119 激动剂, 在动物模型中经证实具有增强疗效 ▪ 其效果增强 结合 一种 DPP4 抑制剂 • 抑制肝脏中脂肪酸 的生物合成 • 抑制餐后 TG/CHO 吸收 • 促进脂肪吞噬 • 刺激胰岛素和 GLP-1 分泌 • 抑制肝脏中的糖异生 • 保护 β 细胞死亡 免受 ER 压力 • 抑制巨噬细胞 分化 • 抑制 PAMPS/damps 引起的炎症体 激活 • 通过阻断 TGFβ 信号传导抑制肝星状细胞 激活 |
| 2023 年 12 月纳斯达克:NRBO 15 DA -1726 一种用于 肥胖治疗的新型 GLP1R/GCGR 双激动剂 |
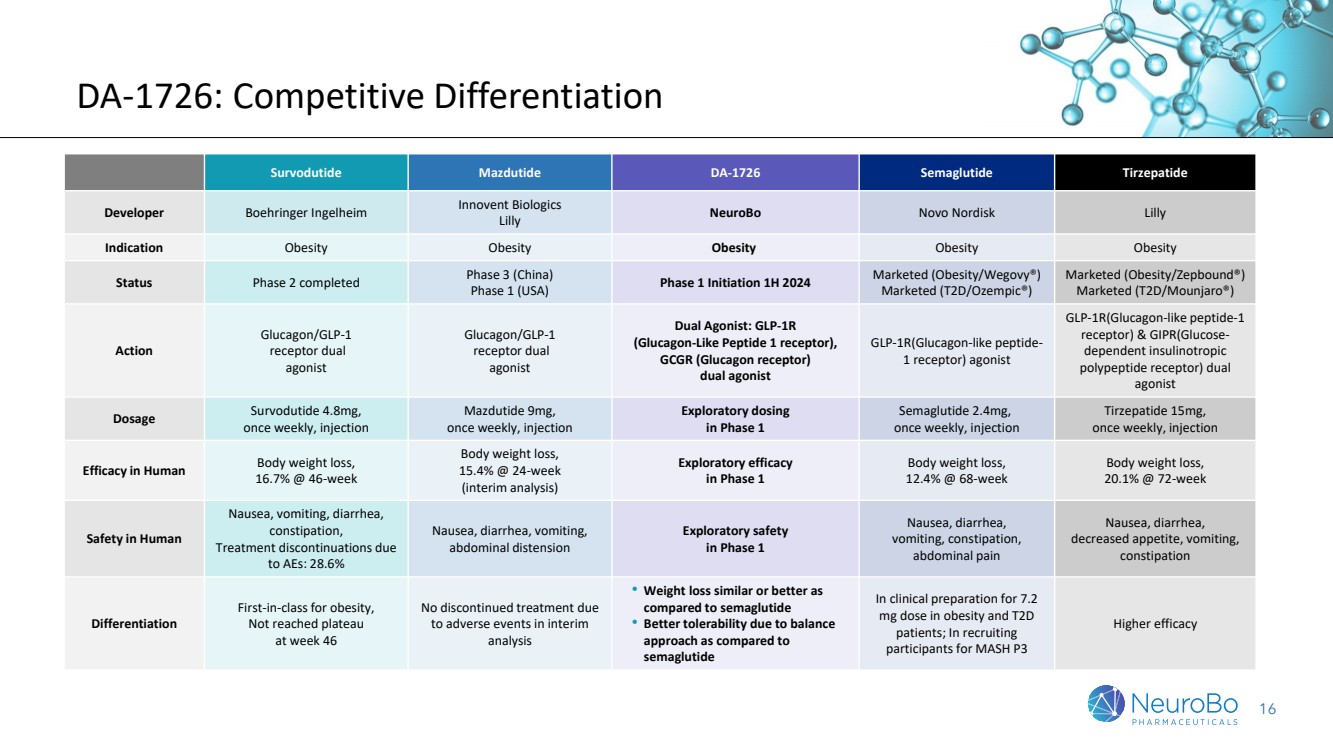
| 16 DA-1726:竞争差异化 Survodutide Mazdutide DA-1726 Semaglutide tirzepatide 开发商 Boehringer Ingelheim Innovo Innovo Novo Nordisk Lilly 适应症肥胖肥胖肥胖 第二阶段已完成第三阶段(中国) 第一阶段(美国)启动2024年上半年上市(肥胖/肥胖)Wegovy®) 上市 (T2D/Ozempic®) 上市(肥胖/Zepbound®) 上市(T2D/Mounjaro®) 动作 胰高血糖素/GLP-1 受体双 受体双 激动剂 双激动剂:GLP-1R (胰高血糖素样肽 1 受体)、 GCGR(胰高血糖素受体) 双激动剂 GLP-1R(胰高血糖素样肽 1 受体)激动剂 GLP-1R(胰高血糖素样肽 1 受体)和 GIPR(葡萄糖依赖性促胰岛素促胰岛素 多肽受体)双 激动剂 剂量 Survodutide 4.8mg, 每周一次,注射 Mazdutide 9mg, 每周一次,注射 探索性剂量 在 1 期索马鲁肽 2.4mg, 每周一次,注射 人体减肥功效, 16.7% @ 46-7% week 减肥, 15.4%@ 24 周 (中期分析) 第 1 阶段体重减轻的探索性疗效 , 12.4% @ 68 周 体重减轻, 20.1% @ 72 周 人体安全 恶心、腹泻、 便秘, 因为 至 AE 而停止治疗:28.6% 恶心、腹泻、呕吐, 腹胀 第 1 阶段的探索性安全 恶心、腹泻、 呕吐、便秘、 腹痛 恶心、腹泻、 食欲减退、呕吐、 便秘 差异 肥胖症的同类首选, 未达到高原 第 46 周在中期 分析中没有因不良事件而中止治疗 • 与西玛鲁肽 相比,体重减轻与 相似或更好 • 与 semaglutide 相比具有更好的耐受性,用于肥胖和 T2D 患者 7.2 mg 剂量的临床准备;为 MASH P3 招募 参与者时更高的疗效 |
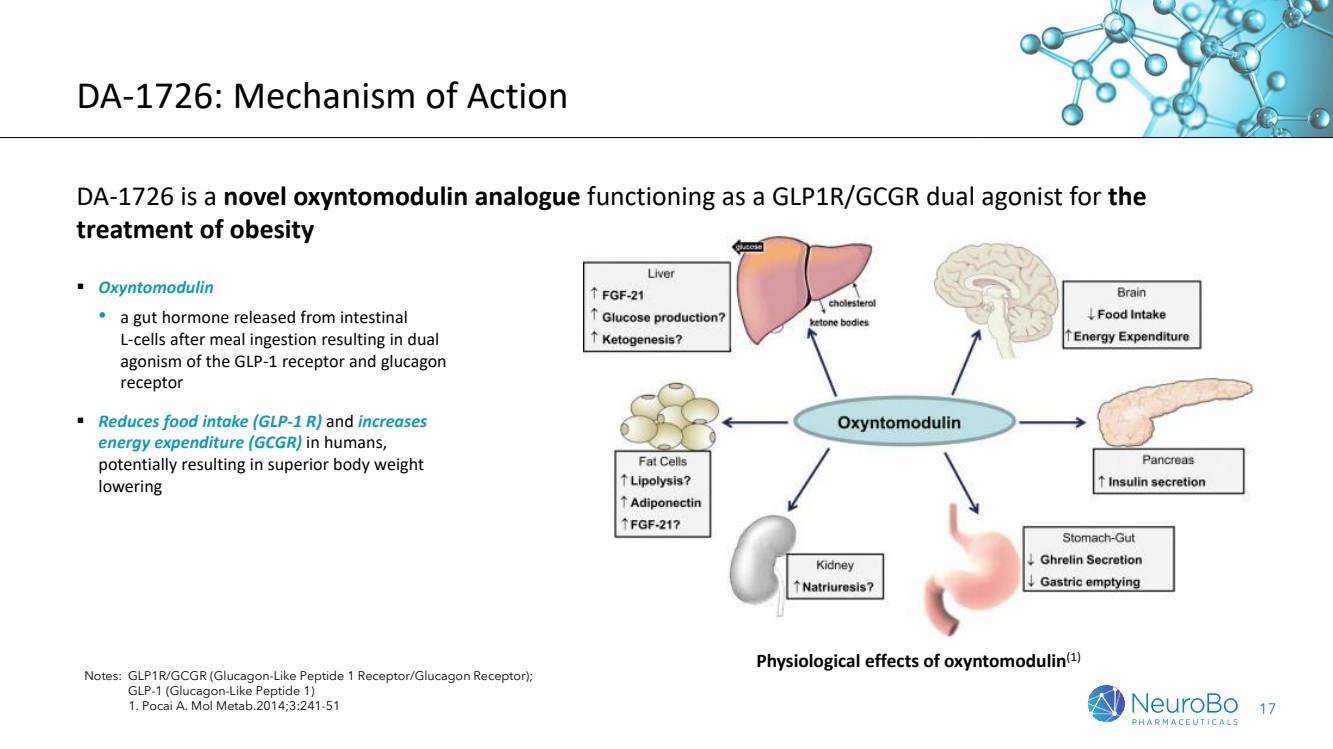
| 17 DA-1726:作用机制 DA-1726 是一种新型的氧调节素类似物,作为 治疗肥胖症的 GLP1R/GCGR 双重激动剂 注意:GLP1R/GCGR(胰高血糖素样肽 1 受体/胰高血糖素受体); GLP-1(胰高血糖素样肽 1) 1。Pocai A. Mol Metab.2014;3:241-51 ▪ Oxyntomodulin • 进餐后肠道 L 细胞释放的一种肠道激素,导致 GLP-1 受体和胰高血糖素 受体的双重激动 受体 受体 受体 双激动作用 ▪ 减少人类的食物摄入 (GLP-1 R) 并增加 能量消耗 (GCGR), 可能导致优异的效果体重 降低 oxyntomodulin 的生理作用 (1) |
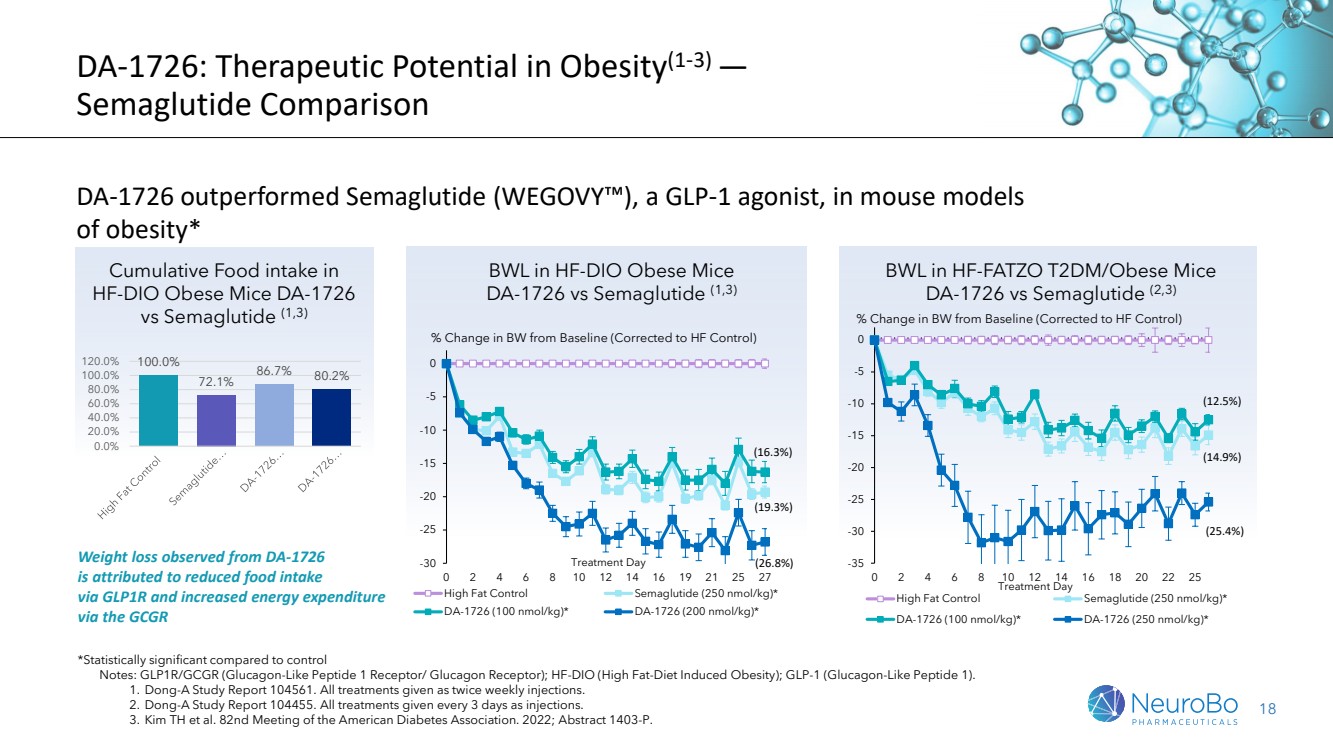
| 18 DA-1726:肥胖的治疗潜力(1-3)— 索玛鲁肽对比 在小鼠肥胖模型中,DA-1726 的表现优于 GLP-1 激动剂索玛鲁肽(WEGOVY)* 与对照组相比,具有统计学意义 注:GLP1R/GCGR(胰高血糖素样肽 1 受体/胰高血糖素受体);HF-DIO(高)脂肪饮食诱发的肥胖);GLP-1(胰高血糖素样肽 1)。 1。东亚研究报告 104561。所有治疗均为每周注射两次。 2。东亚研究报告 104455。所有治疗均以注射的形式每3天进行一次。 3。Kim TH 等人。美国糖尿病协会第 82 次会议。2022年;摘要 1403-P。 100.0% 72.1% 86.7% 80.2% 0.0% 20.0% 40.0% 80.0% 100.0% 100.0% 从 DA-1726 中观察到的体重减轻归因于通过 GLP1R 减少食物摄入 以及通过 GCGR 增加能量消耗 HF-DIO 肥胖小鼠的 BWL DA-1726 与 Semaglutide (1,3) 体重与基线相比的百分比变化(修正为 HF 对照组) -30 -25 -15 -10 -5 0 0 2 4 6 8 10 12 14 16 19 21 25 27 治疗日 高脂控制西玛鲁肽(250 nmol/kg)* DA-1726(100 nmol/kg)) * DA-1726 (200 nmol/kg) * (16.3%) (19.3%) (26.8%) (26.8%) BL 在 HF 中-FATZO t2DM/肥胖小鼠 DA-1726 与 Semaglutide (2,3) 体重与基线相比的百分比变化(修正为 HF 对照组) -35 -30 -25 -15 -5 0 0 2 4 6 8 10 12 14 16 18 20 25 治疗日 高脂控制索玛鲁肽(250 nmol/kg)* DA-1726 (100 nmol/kg) * (100 nmol/kg) mol/kg) * DA-1726 (250 nmol/kg) * (12.5%) (14.9%) (25.4%) HF-DIO 肥胖小鼠 DA-1726 与 Semaglutide (1,3) 的累积食物摄入量 |
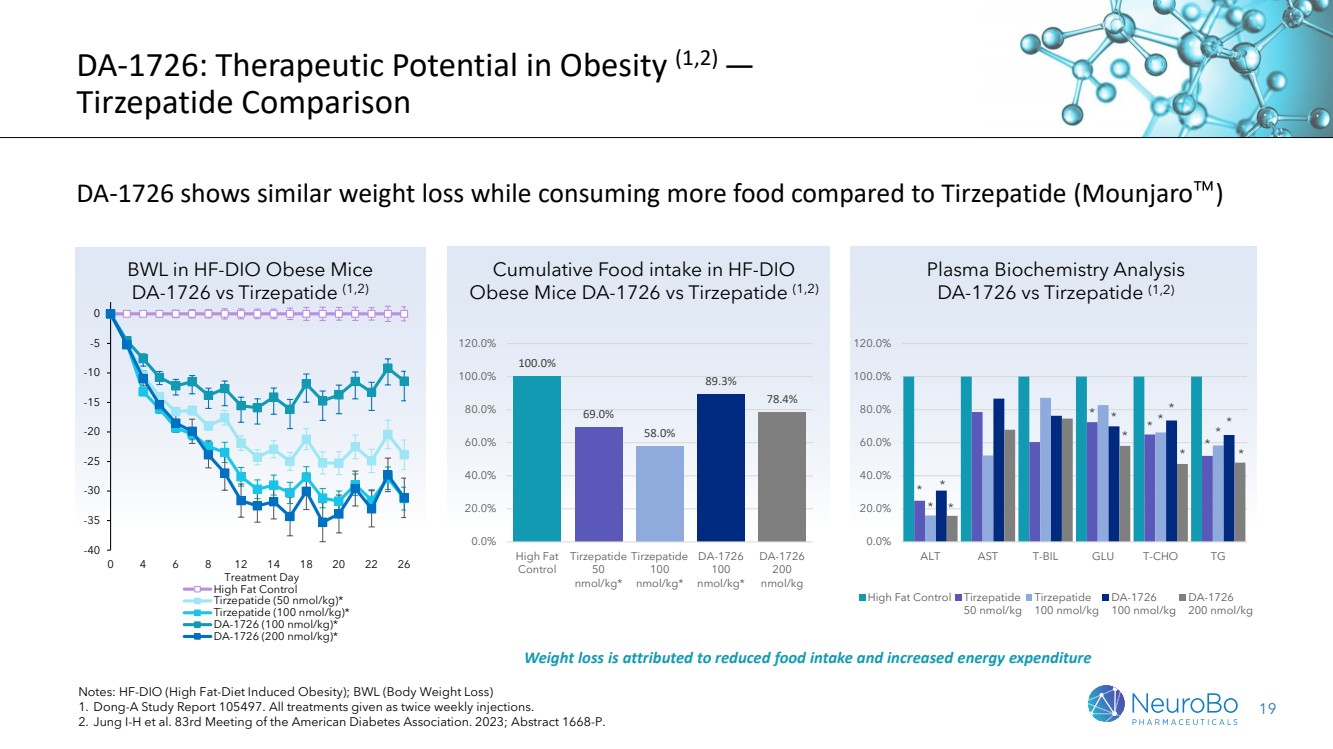
| 19 DA-1726:肥胖的治疗潜力(1,2)— 替塞帕肽比较 DA-1726 与替塞帕肽(Mounjaro)相比,在食用更多食物的同时显示出类似的体重减轻 注:HF-DIO(高脂饮食诱发的肥胖);BWL(减肥) 1。东亚研究报告 105497。所有治疗均为每周注射两次。 2。Jung I-H 等人。美国糖尿病协会第 83 次会议。2023 年;摘要 1668-P。 减肥归因于食物摄入量减少和能量消耗增加 肥胖小鼠 DA-1726 与替塞帕肽 (1,2) 血浆生物化学分析 DA-1726 与替塞帕肽 (1,2) -40 -35 -30 -25 -15 -10 -5 0 0 4 6 8 12 14 18 20 22 26 治疗日 } 高脂控制 噻塞帕肽(50 nmol/kg)* 替塞帕肽(100 nmol/kg)* DA-1726(100 nmol/kg)* DA-1726(200 nmol/kg)* 100.0% 69.0% 89.3% 78.4% 78.4% 0.0% 20.0% 40.0% 60.0% 80.0% 100.0% 120.0% 120.0% 高脂肪 对照 替塞帕肽 50 nmol/kg* Tirzepatide 100 nmol/kg* DA-1726 100 nmol/kg* DA-1726 200 nmol/kg * * * * * * * * * * * * * * * * * * * * * * * * {br * * * * 0.0% 20.0% 40.0% 60.0% 80.0% 100.0% 120.0% ALT AST T-BIL GLU T-CHO TG 高脂控制替塞帕肽 50 nmol/kg Tirzepatike de 100 nmol/kg DA-1726 100 nmol/kg DA-1726 200 nmol/kg 200 nmol/kg BWL 在 HF-DIO 肥胖小鼠中 DA-1726 与替塞帕肽 (1,2) |
| 20 DA-1726:评估 PK/PD 和安全性的 1 期研究 研究理由 ▪ 深入了解人体各种剂量水平的安全性和耐受性。 ▪ 与配对喂养组相比,减肥效果更好,这表明体重减轻在很大程度上归因于激活 GLP-1 导致食物摄入量减少 ▪ 在能量消耗方面优于配对喂养组和对照组(继发于胰高血糖素激活) 与批准的肥胖产品相比,减肥效果可能更好 注意:MAD(多重上升剂量);SAD(单次上升剂量);PK(药代动力学);PD(药效学); FPFV(首次患者首次就诊);LPLV(患者最后一次就诊)。▪ 第一阶段 研究概述 ▪ 由两部分组成的研究 • 第 1 部分 — 单一递增剂量研究 • 第 2 部分 — 多剂量递增剂量研究 人群 ▪ 肥胖 受试者数量 ▪ 这两项研究的大约 100 名受试者 地点 ▪ 美国 |
| 2023 年 12 月纳斯达克:NRBO 21 财务 和 市值 |
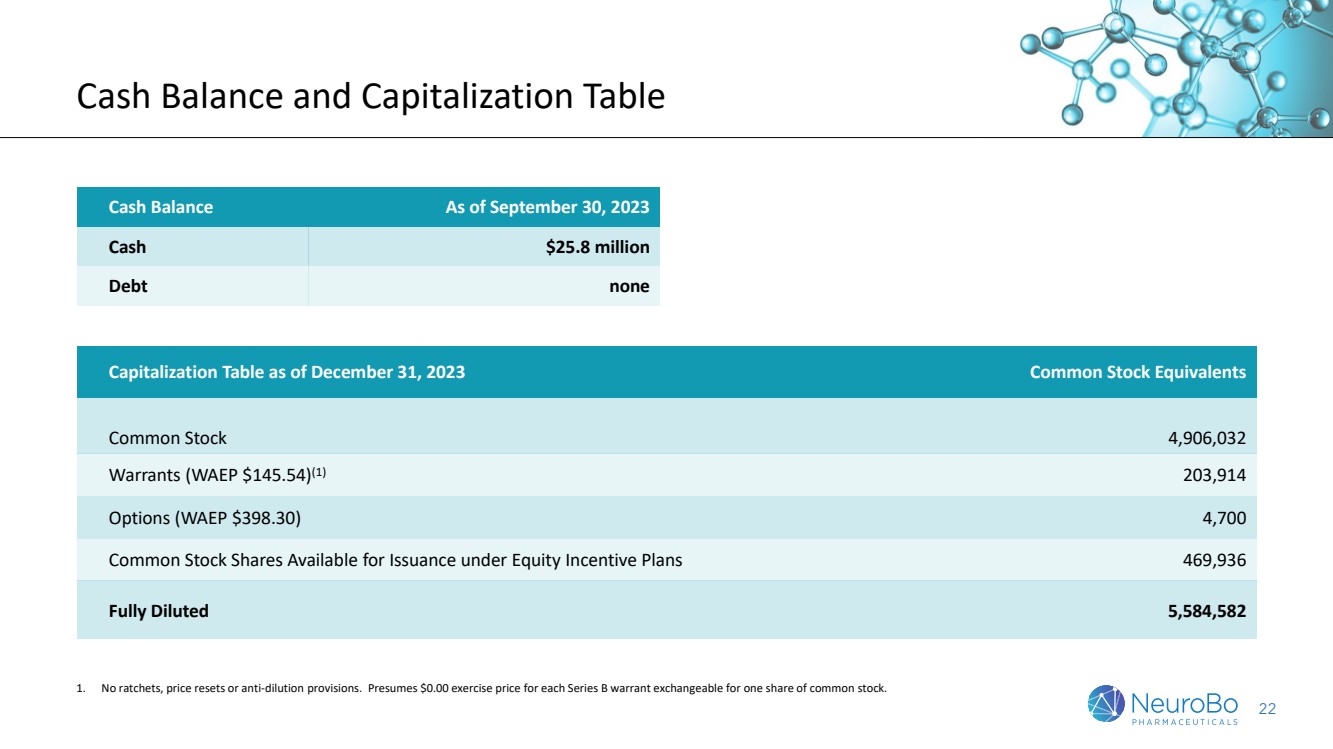
| 22 现金余额和资本表 截至2023年9月30日的现金余额为2580万美元现金 截至2023年12月31日的无 资本表普通股等价物 普通股4,906,032份认股权证(WAEP 145.54美元)(1)203,914份期权(WAEP 398.30美元)4,700股普通股可在股权激励计划下发行的4,700股普通股 469,36股完全稀释 5,584,582 1.没有棘轮、价格重置或反稀释条款。假设每份B系列认股权证的行使价为0.00美元,可兑换成一股普通股。 |
| 23 多个短期里程碑: 以增加股东价值为目标 如果在临床和监管方面取得成功,对当前 DA-1241 第 2a 阶段和计划中的 DA-1726 第 1 阶段的投资有可能获得可观的回报 2025 年上半年与 2025 年下半年 2025 年下半年 2b 期协议 提交 {2a br} DA-1241 2024 年第三季度第 期最后一次就诊 第四季度最后一次就诊 2024 年 2a 期 主要结果 2024 年第一季度第 1 阶段 IND 无异议 DA-1726 2025 年上半年第 1 阶段(第 1 部分) 最后一次患者就诊 2024 年上半年第 1 阶段(第 1 部分) 第一位患者br} 2024 年下半年第 1 阶段(第 2 部分) 2025 年上半年第 1 阶段(第 1 部分)的首位患者 2025 年下半年第 1 阶段(第 2 部分)的首位患者 2025 年下半年第 1 阶段(第 2 部分) 上次患者就诊 * 这些里程碑假设监管和临床成功,但不能保证 |
| 2023 年 12 月纳斯达克:NRBO 24 投资 论文 |
| 25 Compelling Investment Opportunity Targeting MASH and Obesity with a Pipeline of Next Generation Therapeutics ▪ Aiming to Increase Shareholder Value through Multiple, Near-Term, Value Creating Milestones • DA-1241 ✓ Open IND for Treatment of MASH and Type 2 Diabetes ✓ Actively recruiting into a Phase 2a for DA-1241 in subjects with presumed MASH ✓ Completed SAD and MAD studies (in healthy volunteers and subjects with T2D) • DA-1726 ✓Open IND for Treatment of Obesity ▪ Backed by Strategic Partner and Major Shareholder, Dong-A ST ▪ Well Capitalized With $25.8 million in Cash at the end of Q3 2023. Cash runway into Q4 2024 ▪ Exploring Strategic Opportunities to Out-License legacy assets |
| December 2023 NASDAQ: NRBO 26 Thank You! Investor Contacts: Rx Communications Group Michael Miller +1 917.633.6086 mmiller@rxir.com NeuroBo Pharmaceuticals Marshall Woodworth +1 919.749.8748 marshall.woodworth@neurobopharma.com |