附录 99.1

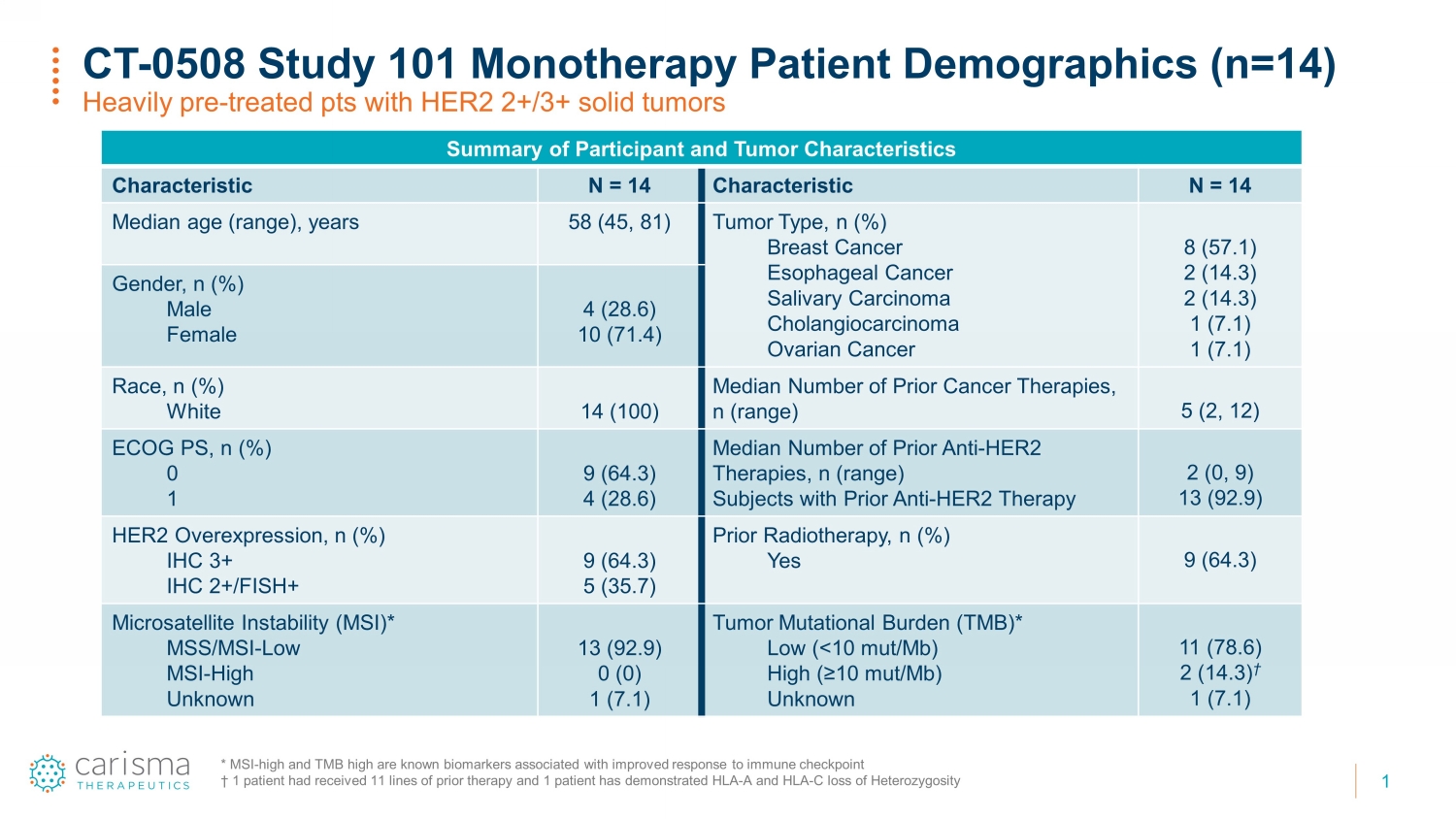
1 CT-0508 研究 101 单一疗法患者人口统计 (n=14) HER2 2+/3+ 实体瘤的预治疗患者和肿瘤特征摘要 N = 14 特征 N = 14 中位年龄(范围),58 岁(45、81)肿瘤类型,n(%)乳腺癌食管癌唾液癌胆管癌卵巢癌 8 (57.1) 2 (14.3) 2 (14.3) 1 (7.1) 1 (7.1) 性别,n (%) 男性女性 4 (28.6) 10 (71.4) 种族,n (%) 白人 14 (100) 先前癌症治疗的中位数,n(范围)5 (2, 12) ECOG PS,n (%) 0 1 9 (64.3) 4 (28.6) 中位数先前的抗 HER2 疗法数量,n(范围)先前接受抗 HER2 治疗的受试者 2 (0, 9) 13 (92.9) HER2 过度表达,n (%) IHC 3+ IHC 2+/FISH+ 9 (64.3) 5 (35.7) 先前接受放射治疗,n (%) 是 9 (64.3) 微卫星不稳定性 (MSI) * MS/MSI-低 MSI-高未知 13 (92.9) 0 (0) 1 (7.1) 肿瘤突变负担 (TMB) * 低 (

2024 年 4 月 9 日 40.7% 的目标病变在至少 1 次扫描中减小了大小解剖学位置在至少 1 次扫描中治疗后减少的肿瘤病变频率乳房 1/1 (100%) 肝 4/5 (80%) 肺部 1/7 (14.3%) 淋巴结 4/8 (50%) 其他 1/4 (25%) 皮肤/皮下 0/2 (0%) 所有病变 11/27 (40.7%) 个体靶病变的最佳变化按解剖部位划分:按解剖部位减少目标病变:每列代表单个靶肿瘤病变,而不是患者。

3 CT-0508/ Pembro Sub-研究:方案 1 级患者人口统计学与第 1 组和第 2 组一致受试者和肿瘤特征摘要特征 N = 3 中位年龄(范围),62 岁(50、73)肿瘤类型,n(%)乳腺癌食管癌卵巢癌 1(33.3)1(33.3)性别,n(%)男性女性 1 (33.3) 2 (66.7) 种族,n (%) 白人 3 (100.0) 既往癌症治疗的中位数,n(范围)6 (5, 7) ECOG PS,n (%) 0 1 0 (0.0) 3 (100.0) 先前抗 HER2 疗法的中位数,n(范围)既往接受反 HER2 治疗的受试者 4 (0, 5) 2 (66.7) HER2 过度表达,n (%) IHC 3+ IHC 2+/FISH+ 2 (66.7) 1 (33.3) 先前接受过放射治疗,n (%) 是 2 (66.7) 微卫星不稳定性 (MSI) * MSS/MSI-低 MSI-高 3 (100.0) 0 (0) 肿瘤突变负担 (T0) MB) * 低 (

4 CT-0508/ Pembro Sub-研究:耐受性良好,无剂量限制毒性,与 CT-0508 单一疗法 CT-0508 单一疗法组 1:分馏剂量 CT-0508 单一疗法组 2:Bolus 剂量 CT-0508 + Pembrolizumab 方案 1 接受治疗的患者 N=9 (%) N=5 (%) N=3 (%) 1 任何治疗——急诊 AES (TEAE) 9 (100) 5 (100) 3 (100) 1 级-2 4 (44) 2 (40) 1 (33) 3-4 5 (56) 3 (60) 2 (66) 与 CT 相关的任何 TEAE-0508 8 (89) 4 (80%) 3 (100) 与 pembrolizumab 相关的任何 TEAE N/A N/A (133%) 任何治疗——急诊 SAE (TESAE) 4(44) 3 (60) 3 (100) 任何与 CT 相关的 TeSAE-0508 2 2 (22) 2 (40) 3 (100) 任何与 pembrolizumab 相关的 TeSAE N/A 0 (0) 细胞因子释放综合征 (CRS) 6 (67) 6 (67) 1-2 6 (67) 3 (60) 2 (67) 3 (67) 3 (67) 3 (67) 3 (67) 3 (67) 3 (60) 2 (67) 3 (67) 3 (67) 3 (67) 3 (67) 0 (0) 0 (0) 0 (0) 免疫效应细胞相关神经毒性综合征 (ICANS) 0 (0) 0 (0) 0 (0) 1。在pembrolizumab 2之前,联合研究的3名患者中有2名在CT后0508接受了皮质类固醇治疗。所有与CT-0508相关的TeSAE都是因监测2级CRS或2级输液反应而住院的。CT-0508 与单一疗法和与 pembrolizumab 联合使用之间的安全性相似没有严重的 CRS 或 ICANS

5 CT-0508/ Pembro Sub-研究:方案级别 1(n=3)摘要前两名患者在服用 pembrolizumab 患者类固醇之前接受皮质类固醇治疗 HER2 状态其他治疗详情患者 1 是 PD IV 期乳腺癌 HER2 2+ • 在 CT 后 G2 CRS 输液后接受地塞米松治疗,pembrolizumab 给药前患者 2 是 PD IV 期卵巢癌 HER2 3+ • 在 pembrolizumab 给药之前,由于 G3 输液反应,在 CT — 0508 输注后,使用甲基泼尼松龙治疗• 三重 HLA I 类杂合性丧失(HLA-肿瘤基因组中 A、B 和 C 缺失)。患者 3 没有 SD(每两个靶病变中就有一个减少了约 46%)IV 期食管癌 HER2 3+ • 由于与治疗无关的医疗问题错过了派姆罗利珠单抗的早期周期(第二次输液)• 由于出现新大脑,患者出现脑转移并在 RECIST 1.1 周取得进展有关皮质类固醇和 CT 的更多信息-0508 • 全身性皮质类固醇有可能逆转 CT-0508 的活性。• 根据体外研究,皮质类固醇会导致 CT-0508 细胞死亡。• 类固醇是在 CT-0508 后给予的,pembrolizumab 之前。

6 CT-0508/ Pembro Sub-研究:患者案例研究患者 #3: HER2+ 食管腺癌有 6 条先前治疗线路且对 Enhertu 患者有难治性 3 — 先前的治疗开始时间结束时间最佳总体反应 1 新辅助卡铂/紫杉醇 2019 年 2 月 2019 年 4 月 CR 2 辅助电容、奥沙利铂、曲妥珠单抗 11 月 2020 年 11 月 2020 年未知 3 氟尿嘧啶、亚叶酸、奥沙利铂、曲妥珠单抗 2020 年 12 月 2021 年 4 月 PR 4 氟尿嘧啶、曲妥珠单抗 2021 年 5 月 2021 年 3 月 SD 5 紫杉醇、拉穆西鲁单抗、曲妥珠单抗、图卡替尼 2022 年 5 月 SD 6Enhertu 2023 年 2 月 2023 年 4 月 PD * BOR:最佳总体反应 CR:完全缓解;PR:部分缓解;SD:稳定疾病;PD:进行性疾病癌症类型:IV 期食管腺癌 (EAC),HER2 3+ 既往病史:6 种先前疗法;最近一线:在 EAC 的 Pembrolizumab 临床研究中在 2 个月内实现了 PD 和 DC 'd Enhertu 的 BOR*: • EAC 对 pembrolizumab 单一疗法有耐药性(KEYNOTE 180)• ORR 5% • PFS 1.5 个月 • Pembrolizumab 在 PDL1+ EAC 中没有显示出 SOC 化疗的生存益处(KEYNOTE 181)
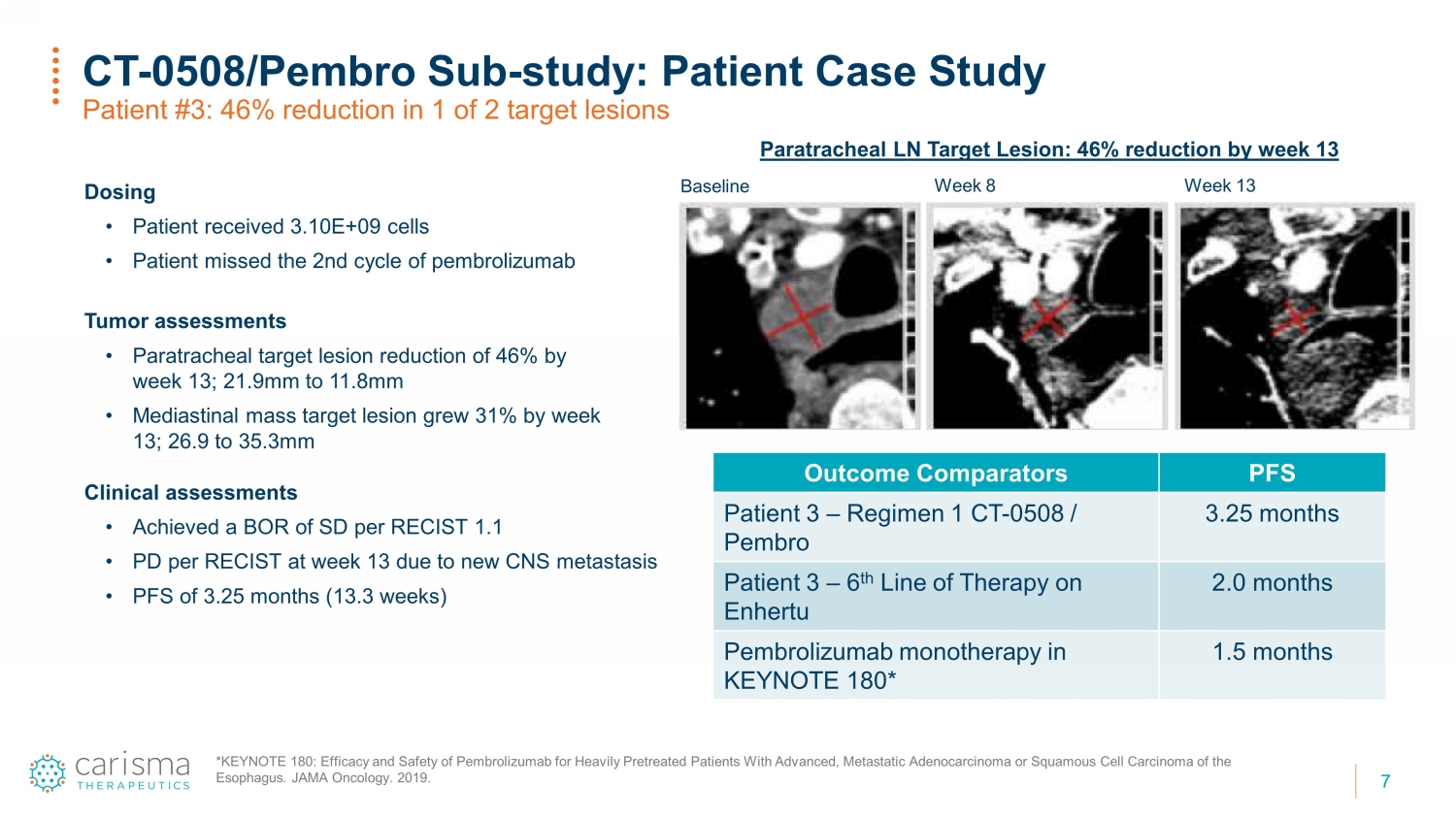
7 CT-0508/ Pembro Sub-研究:患者案例研究患者 #3:2个目标病变中有1个病变减少了46% paratracheal LN目标病变:到第13周基线第8周给药减少46% • 患者接受了3.10E+ 09细胞 • 患者错过了派姆罗利珠单抗肿瘤评估的第二个周期 • 到第13周旁气管的目标病变减少了46%;21.99mm 至 11.8mm • 第 13 周纵隔质量目标病变增长了 31%;26.9 至 35.3mm 预后比较器 PFS 患者 3 — 方案 1 CT — 0508/Pembro 3.25 个月 Enhertu 2.0 个月患者 3 — 第 6 条治疗线Pembrolizumab 单一疗法将在 KEYNOTE 180* 1.5 个月中播出 *KEYNOTE 180:Pembrolizumab 对晚期转移性腺癌或食道鳞状细胞癌患者进行大量预处理的疗效和安全性。JAMA Oncology。2019。临床评估 • 每次 RECIST 的 BOR 为 1.1 • 由于新的中枢神经系统转移,每次 RECIST 的 PD 在第 13 周达到 PD • PFS 为 3.25 个月(13.3 周)
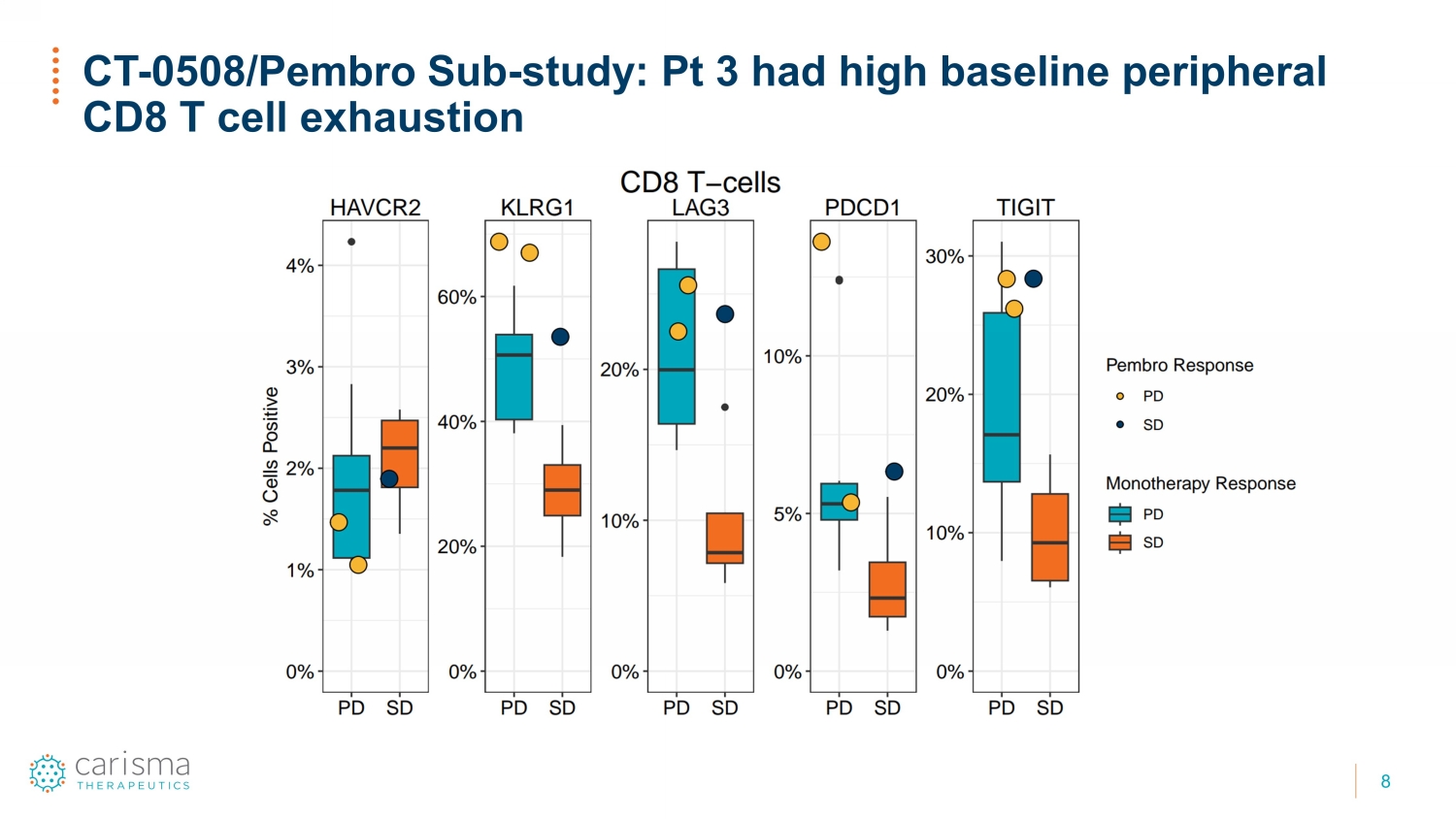
8 CT-0508/ Pembro Sub-研究:Pt 3 的外周 CD8 T 细胞衰竭基线较高
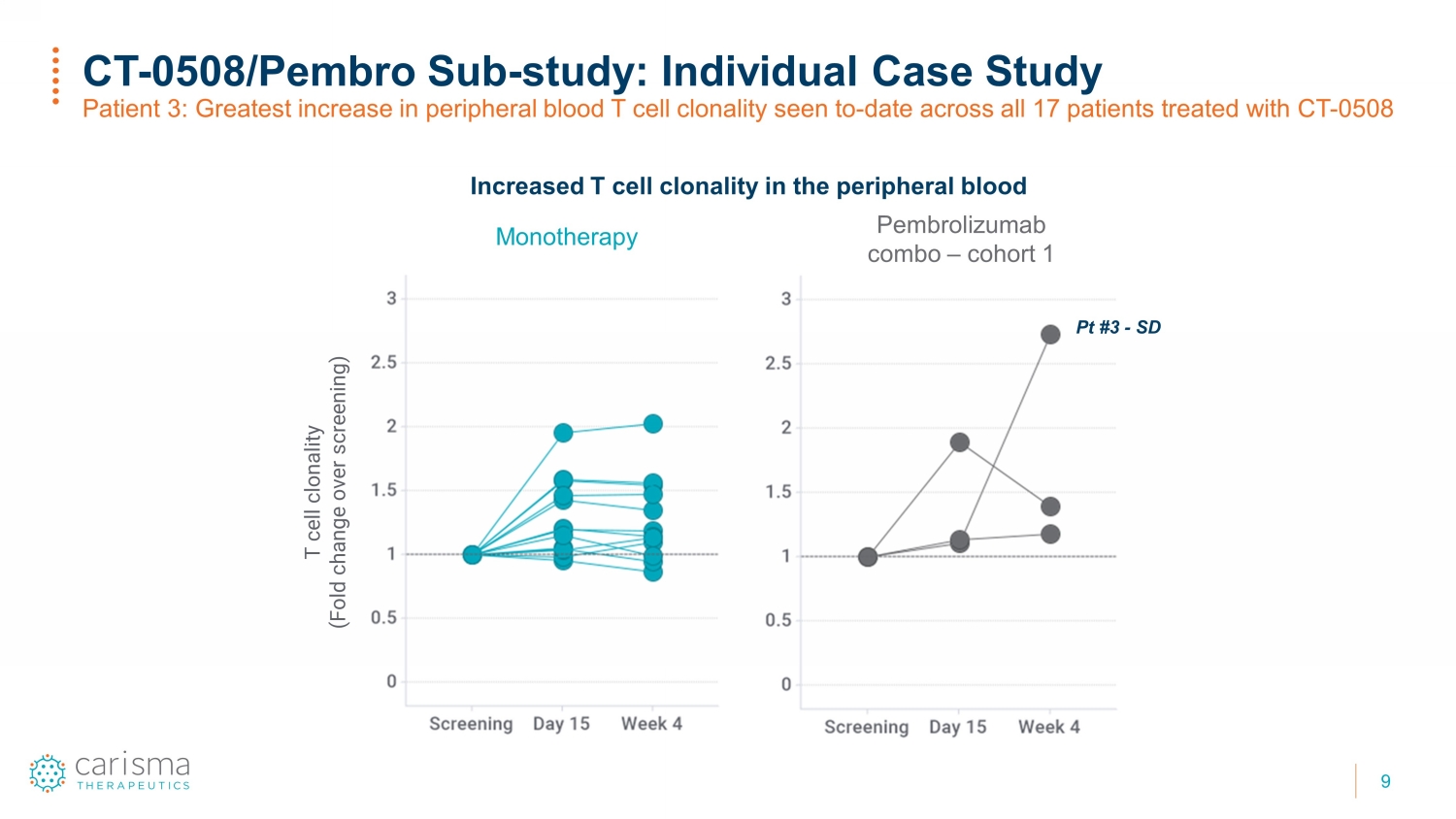
9 CT-0508/ Pembro Sub-研究:个体案例研究患者 3:在所有17名接受CT治疗的患者中,迄今为止外周血T细胞克隆性增幅最大-0508 外周血 T 细胞克隆性增加(与筛查相比折叠的变化)单一疗法 Pt #3-SD Pembrolizumab 组合——队列 1