
附录 99.1

2024 年 4 月 9 日研究投资者活动

2 我们的英国实验室

3 议程 ▪ 业务动态 ▪ 我们的研究策略 ▪ 我们的平台 ▪ 主要候选人 ▪ 前瞻性 ▪ 闭幕词 ▪ 问答

4 前瞻性陈述本演示文稿及任何随附的口头陈述由ADC Therapeutics SA(“ADC Therapeutics”、“我们” 或 “我们”)编写,仅供参考,不用于任何其他目的。本演示文稿中包含的任何内容都不是,也不应被解释为演讲者或ADC Therapeu tics或ADC Therapeutics的任何高管、董事、员工、代理人或顾问的建议、承诺或陈述。本演示文稿并不旨在包罗万象,也不包含您可能想要的所有信息。本礼物中提供的信息,即图标和任何随附的口头陈述仅在发布之日发言。本演示文稿包含1995年《私人证券诉讼改革法》安全港条款所指的前瞻性陈述。在某些情况下,您可以通过诸如 “可能”、“假设”、“将”、“应该”、“将”、“期望”、“打算”、“计划”、“预期”、“相信”、“估计”、“预测”、“潜在”、“看起来”、“寻找”、“未来”、“继续” 或 “出现” 或否定这些术语或类似的表达方式,尽管并非所有前瞻性陈述都包含这些识别词。前瞻性陈述受某些风险和不确定性的影响,这些风险和不确定性可能导致实际结果与所描述的结果存在重大差异。可能导致这种差异的因素包括但不限于:Zynlonta2024年第一季度的实际投资地点、2025年第四季度的预期现金流、公司针对具有不同靶标、连接剂和有效载荷的某些实体瘤的早期研究计划的时机和成功;新商业进入市场战略的有效性、来自新技术的竞争、公司在美国增加ZYNLONTA® 收入的能力;瑞典 Orphan Biovitrum AB (Sobi®) 有能力在欧洲经济中成功商业化 ZYNLONTA®地区和市场接受度、充足的报销范围和未来收入;国家药监局批准了由Overland ADCT Bi oPharma提交的中国ZYNLONTA® Bi oPharma提交的BLA及其未来收入;我们的战略合作伙伴,包括三菱田边制药公司;ZYNLONTA® 在外国司法管辖区获得监管批准的能力,以及未来收入和向我们付款的时机和谅解备忘录此类伙伴关系;公司或其合作伙伴的研发项目或临床的时间和结果试验包括LOTIS 5和7、ADCT 601和602以及佛罗里达州和MZL的IIT;公司产品或候选产品的监管申报的时间和结果;FDA或外国监管机构的行动;预计的收入和支出;公司进行业务发展或研究合作交易的能力;公司的债务,包括医疗保健特许权使用费管理和蓝猫头鹰和橡树设施,以及限制通过此类债务对公司的活动造成损失,遵守各种协议的条款,偿还此类债务和偿还此类债务所需的大量现金;以及纽约州公司为其研究、开发、临床和商业活动获得财务和其他资源的能力。有关这些因素和其他可能导致实际业绩与前瞻性陈述中预期的因素不同的其他信息载于公司10-K表年度报告的 “风险因素” 部分以及公司向美国证券交易委员会提交的其他定期和当前报告以及文件中。这些陈述涉及已知和未知的风险、不确定性和其他因素,这些因素可能导致实际结果、业绩、成就或前景与此类前瞻性陈述所表达或暗示的任何未来业绩、业绩、成就或前景存在重大差异。该公司提醒投资者不要过分依赖本文件中包含的前瞻性陈述。前瞻性陈述基于我们管理层的信念和假设以及管理层目前可获得的信息。无法保证将来会取得这样的结果。本演讲中所载的此类前瞻性陈述仅代表截至本次演讲之日。除非适用法律要求,否则公司明确表示不承担任何义务或承诺更新本演示文稿中包含的这些前瞻性陈述以反映我们期望的任何变化或此类陈述所依据的事件、条件或情况的任何变化。对于任何此类前瞻性陈述的准确性,不作任何陈述或保证(明示或暗示)。本演示文稿中包含的某些信息涉及或基于第三方来源的研究、出版物、调查和其他数据以及我们自己的内部估计和研究。尽管我们认为截至本演示文稿之日这些第三方来源是可靠的,但我们尚未独立核实,对于从第三方来源获得的任何信息的充分性、公平性、准确性或完整性,我们也没有做出任何陈述。此外,本演示文稿中包含的所有市场数据都涉及许多假设和局限性,无法保证此类假设的准确性或可靠性。最后, 尽管我们认为自己的内部研究是可靠的, 此类研究尚未得到任何独立人士的证实,因此urc e.

5 释放强大的 ADC 产品组合的潜在价值 DLBCL:弥漫性大 B 细胞淋巴瘤;FL:滤泡性淋巴瘤;MZL:边缘区淋巴瘤;NSCLC:非小细胞肺癌;ALL:急性淋巴细胞白血病。短期-中期、中长期血液学产品组合实体瘤产品组合 ZYNLONTA ▪ 在 3L+ DLBCL 中最大化 ZYNLONTA ▪ 寻求将 ZYNLONTA 扩展到早期的 DLBCL 和其他惰性淋巴瘤(例如 FL、MZL)作为首选单剂和组合药物 ZYNLONTA + 利妥昔单抗(LOTIS-5)YNLONTA + 双特异性 (LOTIS-7) ADCT-602 (CD22) ▪ 逐步增加和扩大 r/r ALL ADCT-601 (AXL) 的 1 期剂量 ▪ 优化肉瘤、胰腺和 NSCLC 下一代 ADC 中的单一药物和/或组合扩张剂量 ▪推进研究型 ADC 产品组合 — 基于差异化 exatecan 的有效载荷和新型亲水性连接剂 − 靶向 Claudin-6、napi2b、PSMA、ASCT2 ▪ 继续使用一系列有效载荷、连接剂和偶联技术对未公开靶标进行研究

6 ADC Therapeutics Business Update ▪ 与2023年第四季度相比,2024年第一季度的ZYNLONTA收入预计将连续增长中位数至个位数百分比 ▪ 学术和社区环境持续增长商业绩效管道进展 ▪ LOTIS-7已批准剂量递增,没有DLT,没有ICAN,也没有或低等级的CRS ▪ ADCT-601针对AXL注册胰腺患者;优化剂量和时间表企业更新 ▪ 2024 年有多种数据催化剂,预计现金流将持续到 2025 年第四季度 ▪ 积极寻求合作伙伴关系实体瘤项目

7 议程 ▪ 业务动态 ▪ 我们的研究策略 ▪ 我们的平台 ▪ 主要候选人 ▪ 前瞻性 ▪ 闭幕词 ▪ 问答

8 ADC Therapeutics:ADC 领域的先驱和领导者经验丰富的团队 ADC Pioneer Rouby Pipeline Commercial——ADC 领域的先驱者,拥有专业的端到端能力寻求扩展 FDA 批准的 ZYNLONTA®,2 种处于临床开发阶段的新型化合物以及自 2015 年以来提交的多个 IN D 一系列有效载荷、连接剂和偶联化学可实现具有更高治疗指数的下一代强效抗药的设计多学科可选性由经验丰富的行业资深人士组成的团队
9 高未满足患者需求靶点的重点研究策略适合 ADC 方法的高发病率、高未满足需求和高化疗用量的肿瘤具有特异性、高度表达且有效内化的优化 ADC 设计平台采用经过验证的毒素、连接剂和偶联化学设计的优化 ADC 设计平台
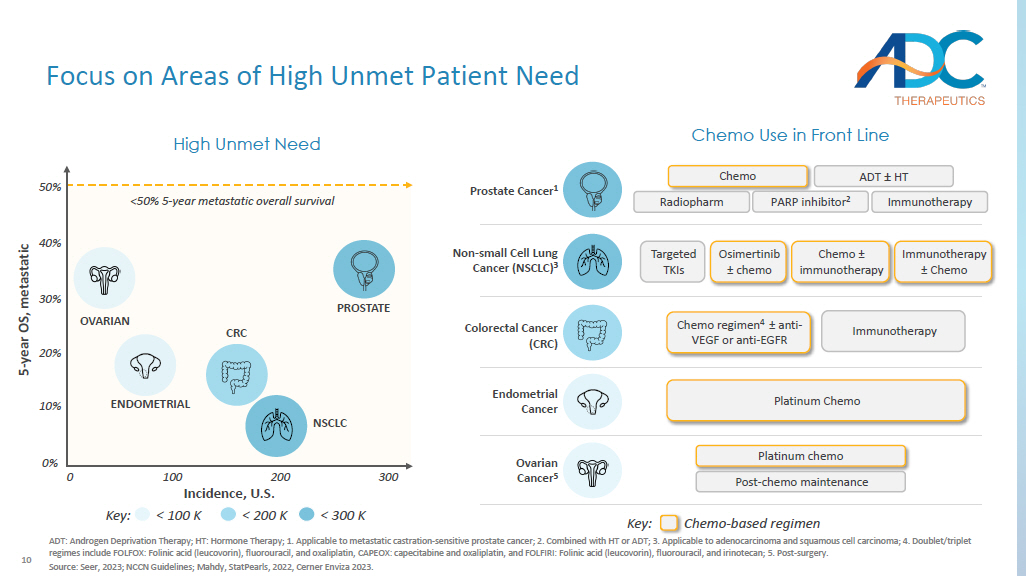
10 关注高未得到满足的患者需求领域 ADT:雄激素剥夺疗法;HT:激素疗法;1.适用于转移性去势——敏感性前列腺癌;2.C 与 HT 或 ADT 相结合;3.适用于腺癌和鳞状细胞癌;4.二联/三联疗法包括 FOLFOX:亚叶酸(亚叶酸)、氟尿嘧啶和奥沙利铂、CAPEOX:卡培他滨和奥沙利铂,以及 F OLF IRI:亚叶酸(亚叶酸(亚叶酸)、氟尿嘧啶和伊立替康;5.手术后。资料来源:Seer,2023 年;NCCN 指南;Mahdy,StatPearls,2022年,Cerner Enviza 2023。发病率,美国 5 年操作系统,前线前列腺癌中的转移性化疗 1 化疗 ADT ± HT 免疫疗法 radiopharm PARP 抑制剂 2 子宫内膜癌铂化疗卵巢癌 5 铂化疗后维护结直肠癌 (CRC) 免疫治疗方案 4 ± 抗血管内膜或抗 EGFR 高未满足需要前列腺子宫内膜卵巢癌非小细胞肺癌 NSCLC 0% 10% 20% 30% 非小细胞肺癌 (NSCLC) 3 靶向 TKI 奥美替尼 ± 化疗 ± 免疫疗法 ± 免疫疗法 ± 化疗 ± 化疗 ± 化疗 ± 化疗 0 100 200 300 关键:
11 确定适合 ADC 方法的靶标内化特性组织特异性膜表达一种可被循环的 ADC 识别的膜结合抗原仅或主要在肿瘤细胞上表达,但在正常组织中很少见或低表达于抗原特异性抗体结合后内化,这样 ADC 可以在肿瘤细胞中内化

12 优化 ADC 设计 1.基于 cynomolgus monkey 的临床前数据。Peptide Spacer Adaptor Linker Toxin (s) TOXIN 近期关注先导候选药物中的依沙替康毒素:x 经临床验证且毒性分布已知的毒素 x 卓越的治疗指数支持在临床环境中使用 ADC 剂量大于 5 mg/kg 的策略 1 偶联近期关注铰链半胱氨酸-先导候选药物中的偶联反应:x 大多数批准的 ADC 中使用的经过验证的偶联方法 x 高均质 DAR 可通过 IgG 实现修饰 x 在血浆 LINKER/PEPTIDE SPACER 中高度稳定近期关注新型、高稳定性、亲水性连接剂:x包括经临床验证的可分解的 Val-Ala-PABC 连接剂,可无痕释放 exatecan x 使用新型肽间隔剂抵消依沙替康的疏水性
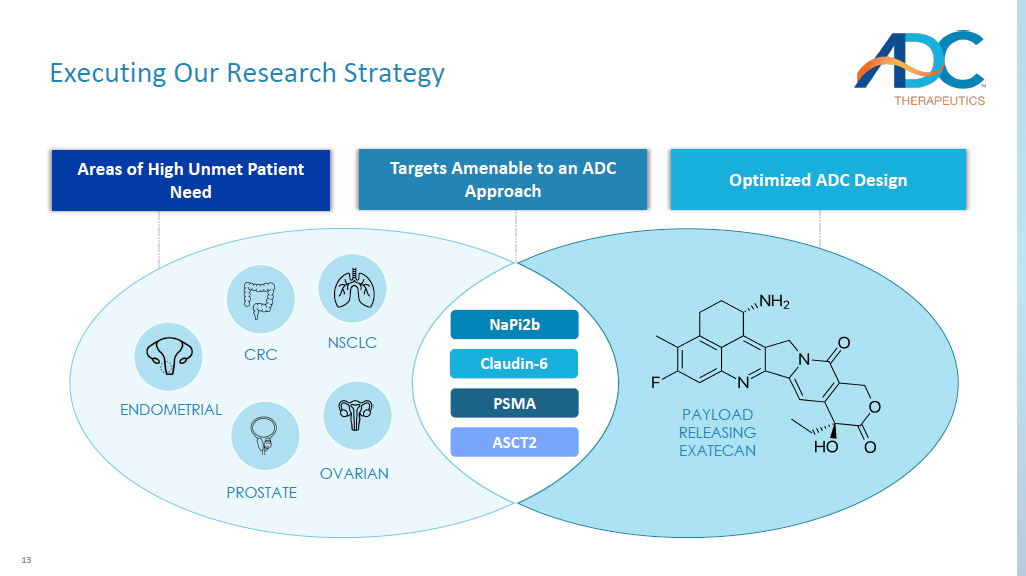
13 执行我们的研究策略 napi2b Claudin-6 PSMA ASCT2 NSCLC 卵巢有效载荷释放 EXATECAN 前列腺子宫内膜结直肠癌高未得到满足的患者需要优化 ADC 设计目标,适合 ADC 方法

14 氨基酸转运蛋白酶促糖蛋白粘附蛋白磷酸转运蛋白目标描述 NSCLC 结直肠癌血红素恶性肿瘤前列腺癌 NSCLC 卵巢癌子宫内膜癌 NSCLC 卵巢癌子宫内膜癌关注的肿瘤类型 Exatecan Exatecan Exatecan Exatecan 毒素有效载荷新型、亲水性、蛋白酶可切割新型、亲水性、蛋白酶可切割新型、亲水、可分解蛋白酶的新型、亲水性、可分解蛋白酶的 Linker 体外表征体内功效 NHP 毒理学体外表征体内功效正在进行的体外表征体外功效 NHP 毒理学体外表征体内功效 NHP 毒理学临床前数据药物-候选药物 (2024) IND-启用 IND-启用阶段开发具有高治疗指数的差异化药物一种与Exatecan偶联的新型亲水性、高度稳定的蛋白酶-可分解的连接物注:1 IND授权研究通常平均持续约18个月(候选人被选中后 13 — 24 个月);NHP:否 n-人类灵长类动物。napi2b Claudin-6 PSMA ASCT2
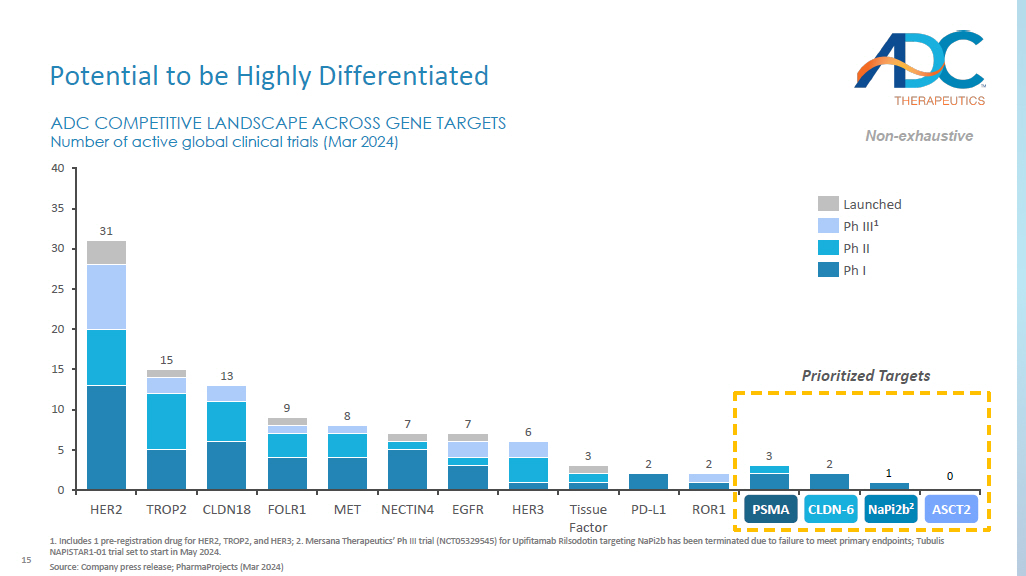
15 高度差异化的潜力 1.包括 1 种 HER2、TROP2 和 HER3 的注册前药物;2.由于未能达到主要终点,Mersana Therapeutics针对Napi2b的Upifitamab Rilsodotin的Ph III试验(NCT05329545)已终止;Tubulis NAPISTAR1-01试验定于2024年5月开始。来源:公司新闻稿;PharmaProjects(2024 年 3 月)优先目标 2 2 0 5 10 15 20 25 30 35 40 1 0 ADC 各基因靶标的竞争格局活跃的全球临床试验数量(2024 年 3 月)HER2 TROP2 CLDN18 FOLR1 MET NECTIN4 表皮生长因子 HER3 组织因子 PD-L1 ROR1 PSMA CLDN6 napi2b^ ASCT2 31 15 13 9 8 7 7 6 3 2 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 已推出 Ph III 1 Ph II Ph II 非-详尽无遗的 napi2b 2 ASCT2 CLDN-6 PSMA
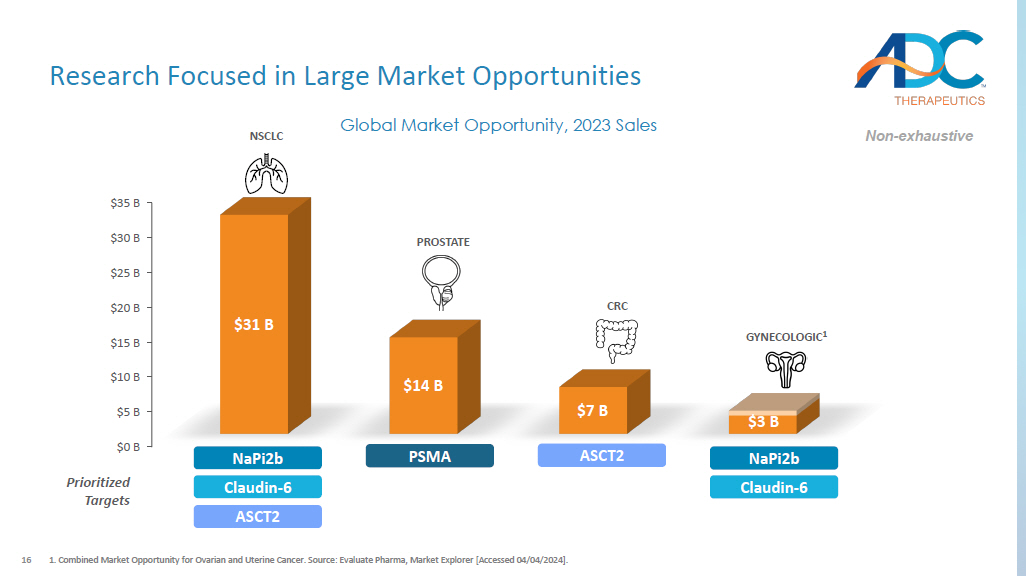
16 以大型市场机会为重点的研究 1.卵巢癌和子宫癌的综合市场机会。来源:《评估制药》,《市场浏览器》 [2024 年 4 月 4 日访问]. 0亿美元 50亿美元100亿美元 150亿美元 200亿美元 250亿美元 300亿美元 350亿美元 310亿美元 140亿美元70亿美元全球市场机会,2023年销售额30亿美元前列腺妇科 1 CRC NSCLC PSMA NAPI2B Claudin-6 ASCT2 ASCT2 Napi2B Claudin-6 个优先目标非详尽无遗
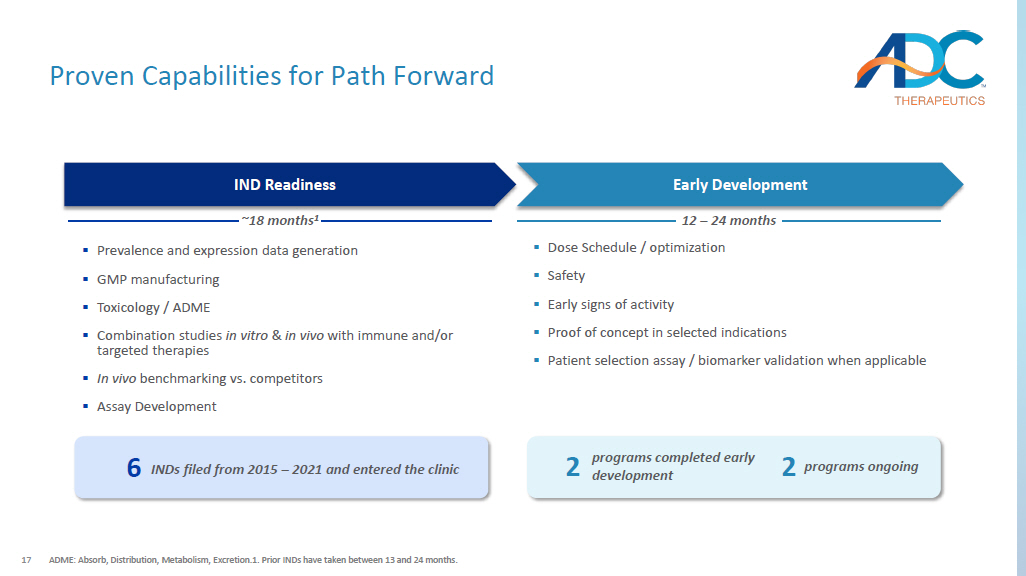
17 种经过验证的 Path Forward ADME 功能:吸收、分布、代谢、排泄。1.之前的 IND 历时 13 到 24 个月。▪ 剂量表/优化 ▪ 安全性 ▪ 活性的早期迹象 ▪ 特定适应症的概念验证 ▪ 患者选择分析/生物标志物验证(如果适用)▪ 流行率和表达数据生成 ▪ GMP 制造 ▪ 毒理学/ADME ▪ 体外和体内与免疫和/或靶向疗法的联合研究 ▪ 与竞争对手的体内基准测试 ▪ 检测开发 IND 于 2015 年至 2021 年提交并进入诊所 6 个项目正在进行中 2 个项目已完成早期开发 2 ~18 个月 1IND 准备 12 — 24 个月的早期开发

18 议程 ▪ 业务动态 ▪ 我们的研究策略 ▪ 我们的平台 ▪ 主要候选人 ▪ 前瞻性 ▪ 闭幕词 ▪ 问答
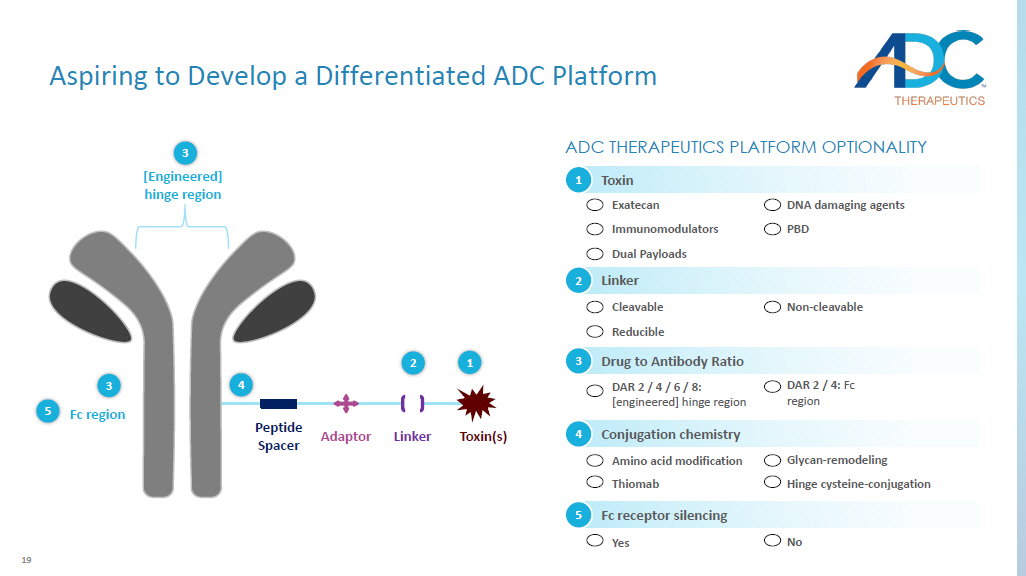
19 肽间隔适配器 Linker Fc 区域 [精心设计 ]铰链区域毒素 ADC 治疗平台可选性 3 3 5 4 2 1 DAR 2/4/6/8: [工程设计]铰链区药物与抗体比例 3 DAR 2/4:Fc 区域 Fc 受体沉默是 5 否可分解还原连接器 2 不可分解的氨基酸修饰硫卓抗偶联化学 4 聚糖-重塑铰链半胱氨酸-偶联毒素 1 Exatecan 免疫调节剂双有效载荷 DNA 损伤剂 PBD 渴望开发差异化 ADC 平台
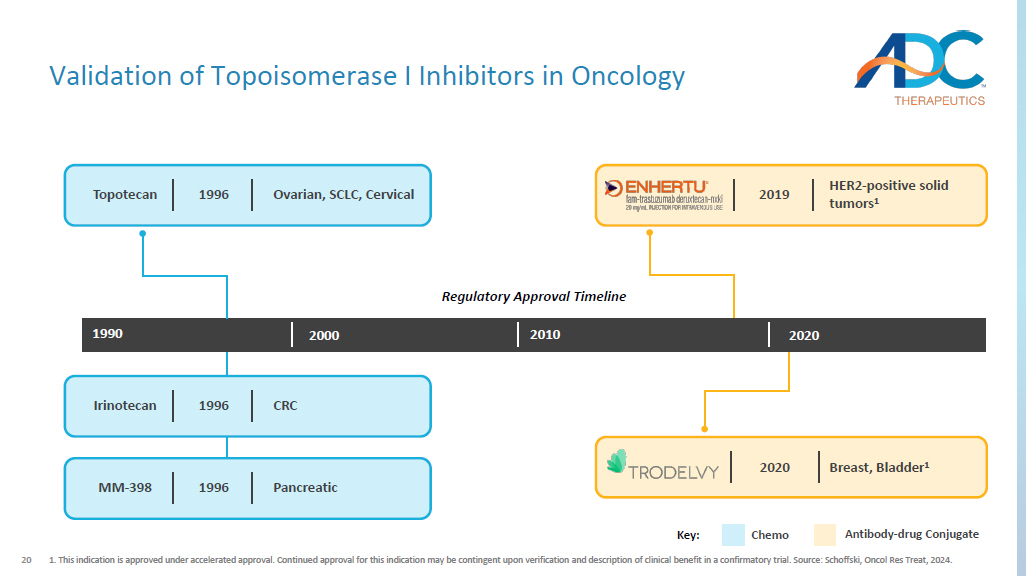
20 肿瘤学拓扑异构酶 I 抑制剂的验证 1.该适应症在加速批准后获得批准。该适应症的持续批准可能取决于确认性试验中对临床益处的验证和描述。来源:Schoffski,Oncol Res Treat,2024. 1990 2000 2010 2020 年 Topotecan 卵巢、SCLC、子宫颈 1996 MM-398 胰腺 1996 年 Irinotecan CRC 1996 HER2-阳性实体瘤 1 2019 乳房、膀胱 1 2020 关键:化疗抗体——药物偶联物监管批准时间表

21 基于 Exatecan 的新型 ADC 平台 Val-Ala-PABC Exatecan = PL2202 ▪ 与 dxD 和其他经批准的 Topo1 抑制剂相比具有优异的治疗指数 1 — cynomolgus monkey 的临床前数据支持患者服用 ADC 剂量大于 5 mg/kg 的策略 — 可与标准护理相结合 ▪ 没有间质性肺病 (ILD) 的迹象,这是一种与 dxD 1 相关的严重不良事件 ▪ 旁观者效应增强与 dxD 1 的效力 ▪ 不是 pGP 底物;增强了细胞内存在感 ▪ 新型亲水、高度稳定、可分解蛋白酶的连接剂 — 可实现无痕exatecan 的发布 — 抵消了 exatecan 的疏水性 Exatecan 平台的关键优势 1.内部分析。

22 议程 ▪ 业务更新 ▪ 我们的研究策略 ▪ 我们的平台 ▪ 主要候选人 — Napi2b — Claudin-6 — PSMA — ASCT2

23 Napi2b:经过验证的 ADC 目标来源:Wagner 等人,Pflugers Arch(2014);Yin 等人,《癌症免疫》(2008 年);Banerjee 等人,《癌症治疗修订版》(2023 年);Gryshkova 等人,Exp Oncol(2009),《PLOS One》(2013);弗拉森科娃等人,《生物分子》(2021);Nurgalieva等人,《生物化学生物物理学》(2021年);Rubinfeld等人,《临床癌症研究》(2015年);ADC疗法内部研究。Napi2b 概述:膜——局部磷酸转运蛋白 ▪ 在细胞磷酸盐稳态调节中起核心作用 ▪ 通过破坏磷酸盐稳态来诱导肿瘤发生作用:x 临床验证的靶点理由:支气管上皮顶端部位肠、肝脏、睾丸和肺的表达水平低正常组织分布肿瘤表达谱非小细胞肺癌(N =30)~ 80% 阳性率 ~ 80% 56% 阳性卵巢 (N =70) 子宫内膜 (N =45) ~ 81% 阳性
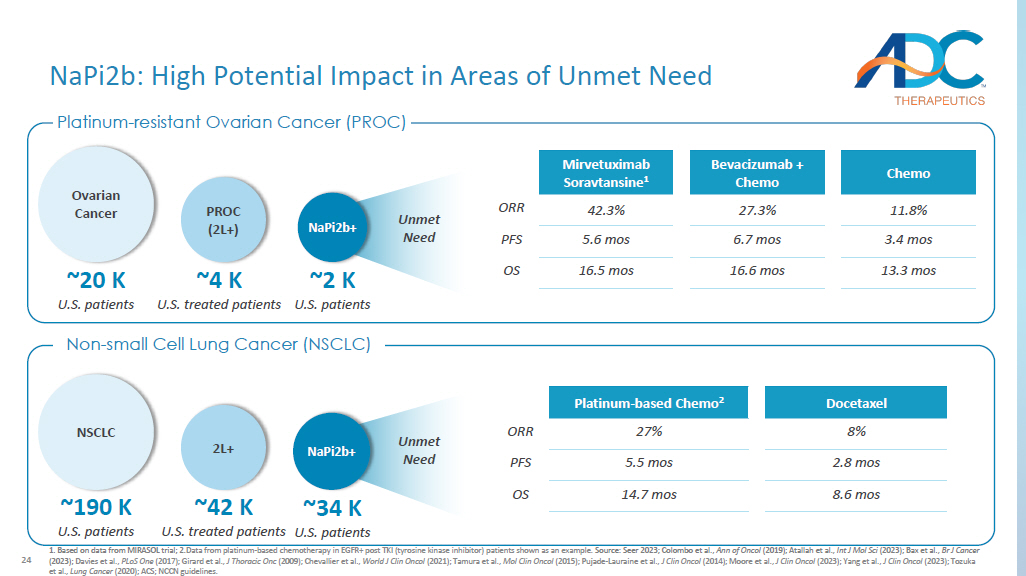
24 1.基于 MIRASOL 试验的数据;2.以TKI(酪氨酸激酶抑制剂)患者EGFR+(酪氨酸激酶抑制剂)患者中铂基化疗的数据为例。资料来源:Seer 2023;Colombo 等人,Ann of Oncol(2019);Atallah 等人,Int J Mol Sci(2023);Bax 等人,Br J Cancer(2023);Davies等人,PLoS Onc(2017);Girard 等人,J Thoracic Onc(2009);Chevallier 等人,World J Clin Oncol(2021);田村等人等人,Mol Clin Oncol(2015);Pujade-Lauraine等人,J Clin Oncol(2014);Moore等人,J Clin Oncol(2023);杨等人,J Clin Oncol(2023);户冢等人,肺癌(2020);ACS;NCCN指南。铂耐药性卵巢癌 (PROC) 非小细胞肺癌 (NSCLC) 未满足的需求 napi2b:在需求未得到满足的领域产生巨大潜在影响 ~4 K 美国接受治疗的患者 PROC (2L+) ~2 K 美国患者 napi2b+ ~20 K 美国患者卵巢癌 NSCLC ~190 K 美国患者 ~42 K 美国患者 2L+ ~34 K 美国患者 napi2b+ + 未满足的需求多西他赛铂基化疗 2 8% 27% ORR 2.8 mos 5.5 mos PFS 8.6 mos 14.7 mos OS Chemo Bevacizumab + Chemo Mirvetuximab Soravtansine 1 11.8% 27.3% 42.3% ORR 3.4 mos 6.7 mos 5.6 mos PFS 13.3 mos 16.6 mos 16.5 mos 16.5 mos OS

25 napi2b-PL2202 活性(临床前)状态 Napi2b-特异性人源化单克抗体 x 高效内化 x Fc-沉默;减轻靶标-独立毒性 Exatecan Payload x 在对 Topo-1 抑制剂(例如 NSCLC)敏感的肿瘤中经过临床验证遗传性偶联 6 DAR >10 TI 1 A 差异化 Napi2b-ADC DAR:药物抗体比率;TI:治疗指数;1.根据 cynomolgus monkey 的最大耐受剂量 (MTD) /小鼠的最小有效剂量 (MED) 计算。2.内部 Ana lys 是。来源:公司网站;会议演讲。已停产资产 ▪ 内化程度降低的抗体与我们的抗体的主要区别 ▪ 给出 MMAE 有效载荷 Lifastuzumab Vedotin (Lifa),具有周围神经病变和中性粒细胞减少的风险 ▪ 狭窄的治疗指数 2 Upifitamab Rilsodotin (uPRI) ▪ 治疗指数与 uPRI 相比有所改善,但低于 Napi2b-PL2202 2 XMT-1592
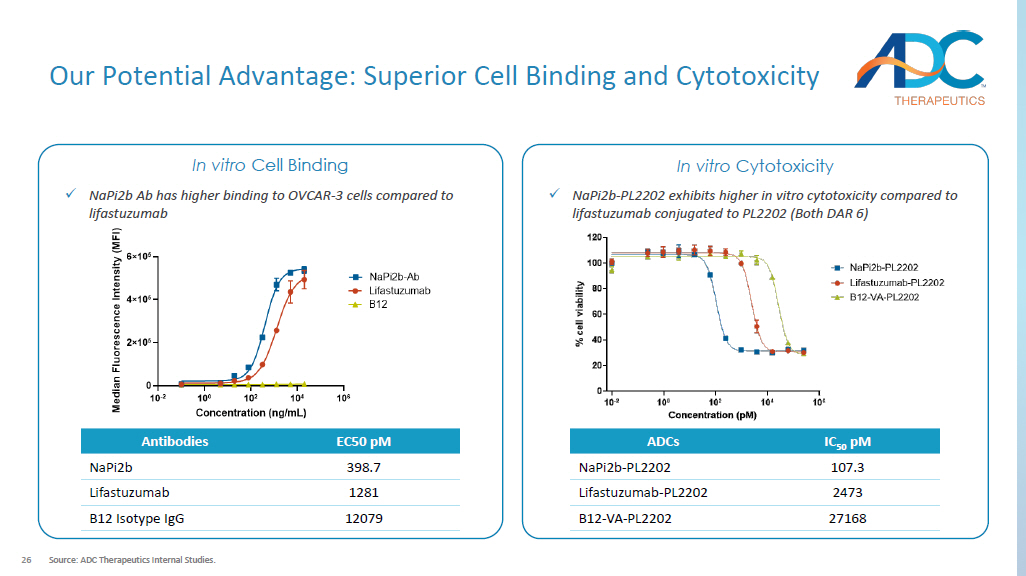
26 我们的潜在优势:卓越的细胞结合和细胞毒性来源:ADC Therapeutics内部研究。IC 50 pM ADC 107.3 napi2b-PL2202 2473 Lifastuzumab-PL2202 27168 B12-VA-PL2202 x napi2b Ab 与 OVCAR 的结合率更高——与 lifastuzumab EC50 pM 抗体相比 3 个细胞 398.7 napi2b 1281 Lifastuzumab 12079 B12 同型 IgG x napi2b-PL2202 在体外表现更高与利法妥珠单抗偶联与 PL2202(均为 DAR 6)相比的毒性体外细胞结合体外细胞毒性
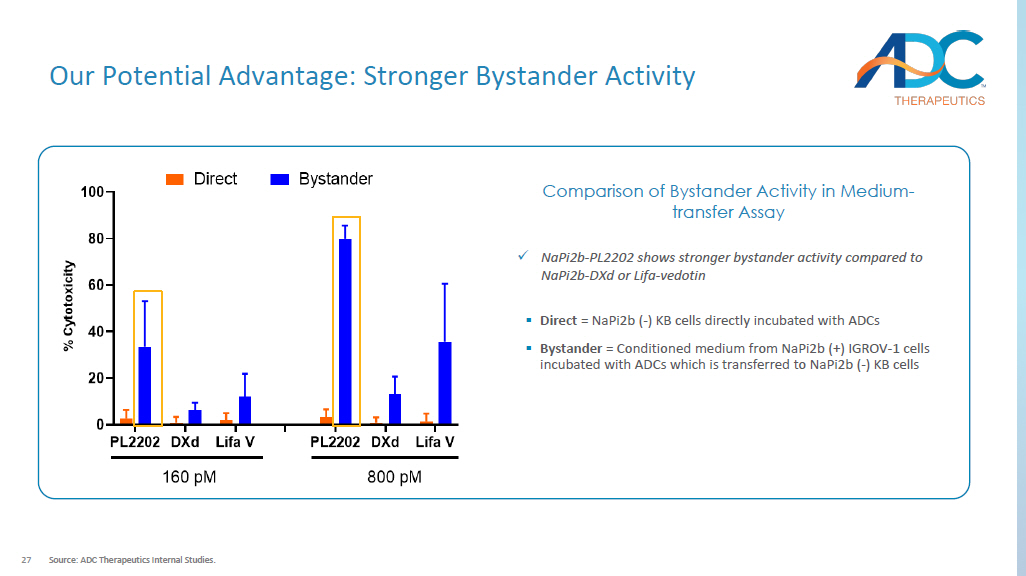
27 我们的潜在优势:更强的旁观者活性来源:ADC Therapeutics 内部研究。x napi2b-PL2202 与 Napi2b-dxD 或 Lifa 相比,旁观者活性更强-vedotin ▪ Direct = napi2b (-) KB 细胞直接孵育在 ADC 中孵育 ▪ 旁观者 = 来自 Napi2b (+) IGROV 的条件培养基-1 个细胞用转移的 ADC 孵育到 Napi2b (-) KB 细胞介质转移测定中旁观者活性的比较
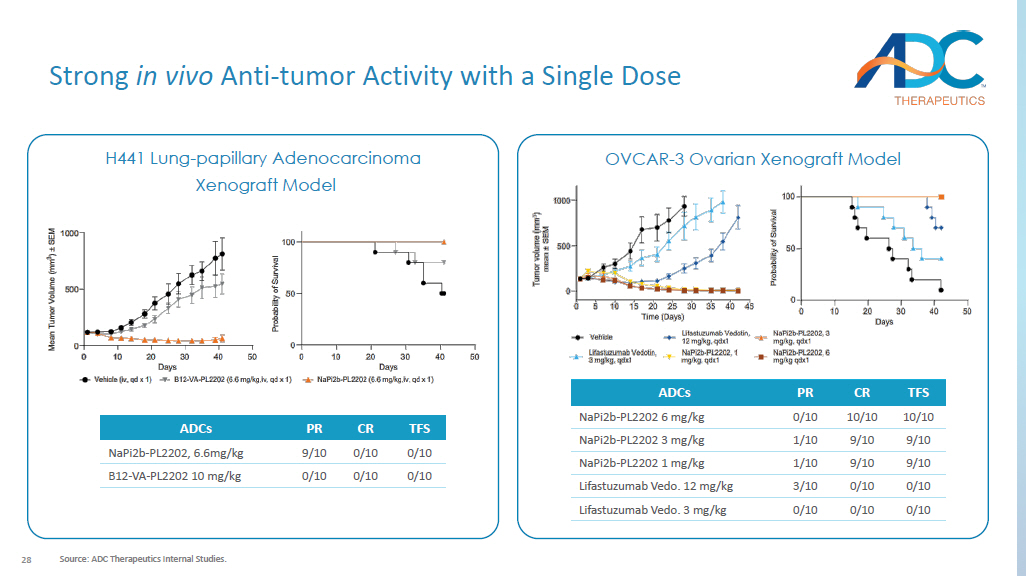
28 单剂量 H441 肺乳头腺癌异种移植模型具有很强的体内抗肿瘤活性来源:ADC Therapeutics 内部研究。OVCAR-3 卵巢异种移植模型 TFS CR PR ADC 0/10 0/10 9/10 napi2b-PL2202,6.6mg/kg 0/10 0/10 0/10 B12-VA-PL2202 10 mg/kg TFS 10 10/10 0/10 Napi2b-PL2202 6 mg/kg 9/10 9/10 1/10 napi2b-PL2202 3 mg/kg 9/10 9/10 9/10 1/10 napi2b-3 mg/kg 9/10 9/10 9/10 1/10 napi2b-3 mg/kg 9/10 9/10 9/10 1/10 napi2b-PL2202 1 mg/kg 0/10 0/10 3/10 Lifastuzumab Vedo。12 mg/kg 0/10 0/10 0/10 0/10 Lifastuzumab Vedo。3 mg/kg

29 ▪ 对大鼠进行单次静脉注射 Napi2b-PL2202 后的 PK(n=3/组)▪ 线性 TK,t½ 为 12.9-15 天 ▪ 游离 exatecan,表现 t½ 为 9.5 天 ▪ 耐受高达 300 mg/kg 静脉注射,雄性大鼠的临床病理学和组织病理学检查结果稳定良好 ▪ 好——耐受性高达 40 在第 1 天和第 22 天给药 mg/kg 静脉注射,雄性 cynomolgus 猴的临床病理和组织病理学检查结果微乎其微 ▪ 在 80 mg/kg 的更高剂量水平下,剂量限制毒性是退化/胃肠道再生,拓扑异构酶抑制剂的已知类别效应 ▪ 线性 TK,t½ 约为 7-10 天 40 mg/kg napi2b ADC 43 n=3 1 22 80 mg/kg napi2b ADC 6 n=2 1 5 n=1 来源:ADC Therapeutics 内部研究。
相信 TI 的30个理由:治疗指数;IHC:免疫组织化学;ADME:吸收、分布、代谢、排泄。资料来源:《永恒研究中的ADC疗法》。具有高潜在冲击力的经过验证的靶标 x 膜结合抗原 x 高效内化 x 在 NSCLC 和卵巢癌中高度特异性表达 x 使用 ADC 方法进行临床验证 Path Forward ▪ 体外和体内与免疫和/或靶向疗法的联合研究 ▪ 体内基准对照与竞争对手 ▪ Napi2b IHC 测定开发 ▪ 释放机会的差异化方法 x 具有高 TI 的优化 ADC 设计 x 单剂量抗肿瘤活性的强大抗肿瘤活性对抗卵巢癌和肺癌异种移植模型 x 稳定且耐受性良好-对大鼠和 cynomolgus 猴均有良好的耐受性 x 与 Lifa 相比,Ab 内化率更高 x 更高的肿瘤-特异性细胞毒性 x 在低得多的剂量下肿瘤回归率更高 x 与 Lifa 和 dxD 相比,旁观者杀伤力更强
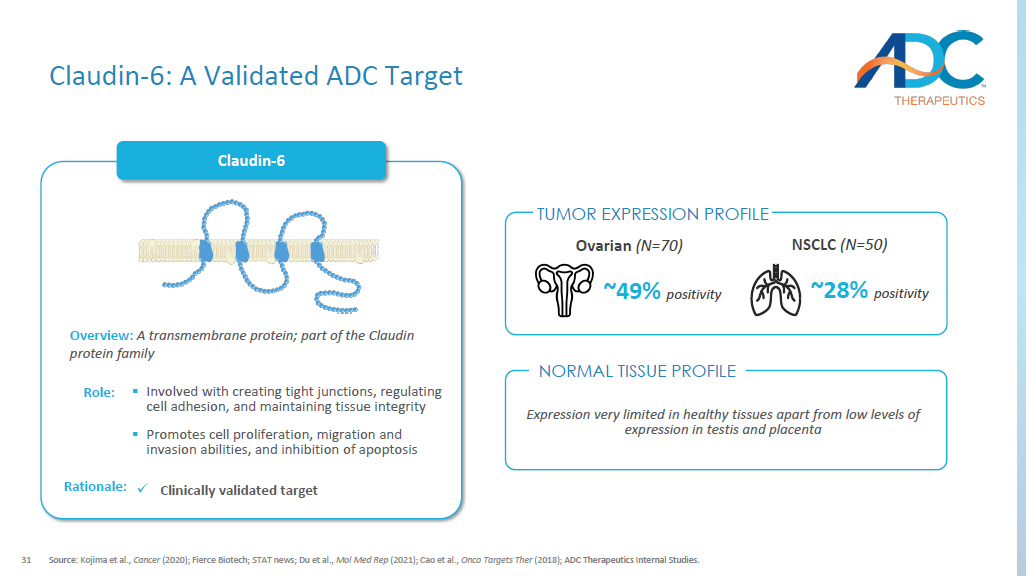
31 资料来源:小岛等人,《癌症》(2020年);Fierce Biotech;统计局新闻;杜等人,Mol Med Rep(2021年);Cao等人,Onco的目标是他们(2018年);ADC Therapeutics内部研究。Claudin-6 概述:一种跨膜蛋白;Claudin 蛋白家族的一部分 ▪ 参与形成紧密连接、调节细胞粘附和维持组织完整性 ▪ P 促进细胞增殖、迁移和侵袭能力以及抑制细胞凋亡作用:x 经临床验证的靶点理由:NSCLC(N =50)~ 28% 阳性率 ~ 49% 卵巢(N =70)在健康组织中的表达非常有限除了睾丸和胎盘中的低表达水平外 Claudin-6:经过验证的 ADC 靶标正常组织分布肿瘤表达概况
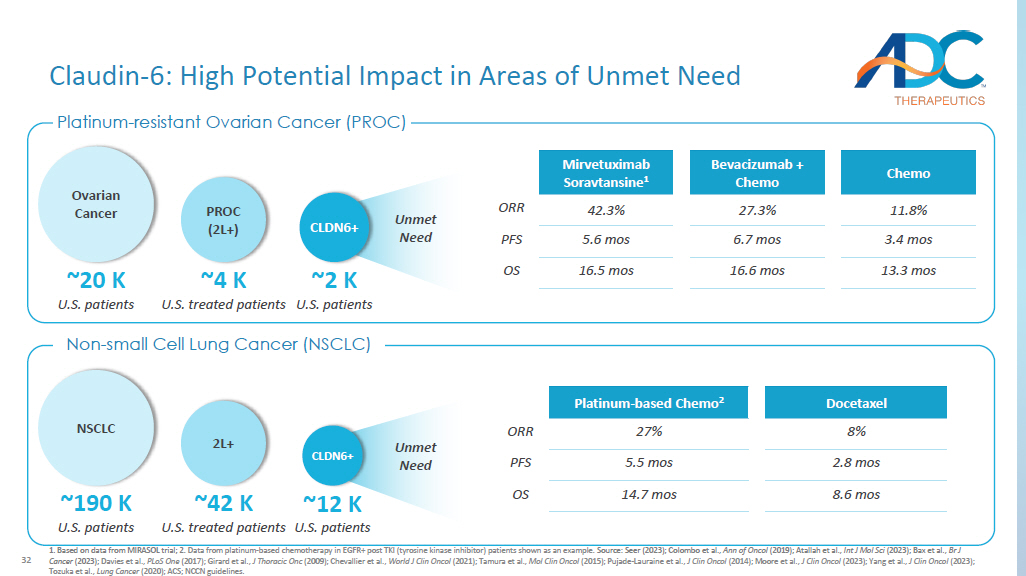
32 1.基于 MIRASOL 试验的数据;2.以TKI(酪氨酸激酶抑制剂)患者EGFR+(酪氨酸激酶抑制剂)患者中铂基化疗的数据为例。资料来源:Seer(2023);Colombo等人,Ann of Oncol(2019);Atallah 等人,Int J Mol Sci(2023);Bax 等人,Br J Cancer(2023);戴维斯等人,PLoS Onc(2017);Girard 等人,J Thoracic Onc(2009);Chevallier等人,《世界临床大全》(2021年);田村等人,Mol Clin Oncol(2015);Pujade——Lauraine等人,J Clin Oncol(2014);Moore等人,J Clin Oncol(2023);杨等人,J Clin Oncol(2023);户冢等人,肺癌(2020);ACS;NCCN指南。多西他赛铂基化疗 2 8% 27% 27% ORR 2.8 mos 5.5 mos PFS 8.6 mos 14.7 mos OS ~4 K 美国接受治疗的患者 PROC (2L+) ~20 K 美国患者卵巢癌 ~2 K 美国患者 CLDN6+ Chemo Bevacizumab + Chemo Mirvetuximab Soravtansine 1 11.8% 27.3% 42.3% ORR 3.4 mos 5.6 mos pfs 13.3 mos 16.6 mos 16.5 mos 16.5 mos OS 未满足的需求 Claudin-6:在需求未得到满足的领域产生巨大潜在影响 NSCLC ~190 K 美国患者 ~42 K 美国患者 2L+ ~12K 美国患者 CLDN6+ 铂耐药卵巢癌 (PROC) 非小细胞肺癌 (NSCLC) 未满足的需求

33 GB01-VA-PL2202 资产名称活性(临床前)状态人源化 Claudin-6 mAb 抗体 x 高效内化 x Fc-沉默;减轻靶标-独立毒性 Exatecan Payload x 在对 Topo-1 抑制剂(例如 NSCLC)敏感的肿瘤中经过临床验证 geneity Conjugation 6 DAR >10 TI 1 A 差异化 Claudin-6-ADC DAR:药物抗体比率;1.根据 cynomolgus monkey 的最大耐受剂量 (MTD) /小鼠的最小有效剂量 (MED) 计算。2.内部 Ana lys 是。来源:公司网站;会议演讲。内化程度降低的竞争对手 Asset ▪ 抗体与 GB01 ▪ MMAE 有效载荷的主要区别是 MDR1 底物 ▪ 给定 MMAE 有效载荷时存在周围神经病变和中性粒细胞减少的风险 TORL-1-23
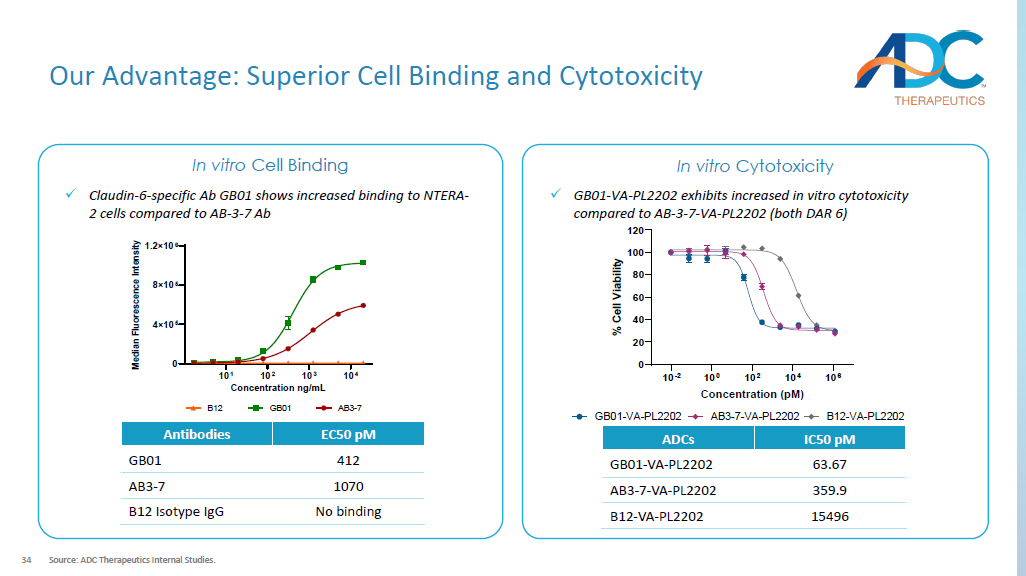
34 我们的优势:卓越的细胞结合和细胞毒性来源:ADC Therapeutics 内部研究。10 -2 10 0 10 4 10 6 0 20 40 60 80 100 120 浓度 (pM)% C e l l v i b i l i l i t y AB3-7-VA-PL2202GB01-VA-PL2202 B12-VA-PL2202 IC50 pM ADCs 63.67 GB01-PL2202 359.9 AB3-7-VA-PL2202 15496 B12-VA-PL2202 EC50 pM 抗体 412 GB01 1070 AB3-7 无结合 B12 同型 IgG 体外细胞结合体外细胞毒性 10 1 10 2 10 3 10 4 0 5 8×10 5 1.2×10 5 1.2×10 6 浓度 ng/mL M e d i a n f l u o r e s c e n c e n c e n c e n t e n c e n t AB3-7GB01B12 x Claudin-6-特异性 Ab GB01 与 AB-3-7 Ab x GB01 相比,与 NTERA-2 个细胞的结合增加-3-7 Ab x GB01-VA-VA-与 AB-3-7-VA-PL2202(均为 DAR 6)相比,PL2202 表现出更高的体外细胞毒性
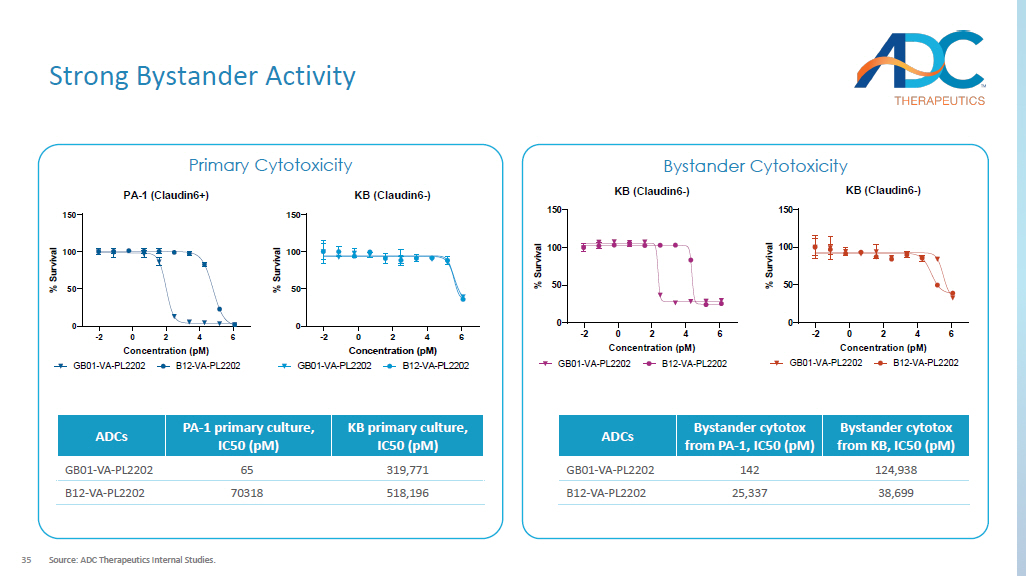
35 强劲的旁观者活动来源:ADC Therapeutics内部研究。主要细胞毒性旁观者细胞毒性 -2 0 2 4 6 0 50 100 150 PA-1 (Claudin6+) 浓度 (pM)% S u r v i v a l GB01-VA-PL2202 B12-VA-PL2202 -2 0 2 4 6 0 50 150 KB (Claudin6-) 浓度 (pM)% S u r v i v a l GB01-VA-PL2202 KB 初级培养,IC50 (pM) PA-1 初级培养,IC50 (pM) ADC 319,771 65 GB01-VA-PL2202 518,196 70318 B12-VA-PL2202 -2 0 2 4 6 0 50 100 150 KB (Claudin6-) 浓度 (pM)% S u r v i v a l GB01-VA-PL2202 B12-VA-PL2202 旁观者细胞毒素来自 KB、IC50、IC50 B12-VA-PL2202(pM) ADC 124,938 142 GB01-VA-PL2202 38,699 25,337 B12-VA-PL2202
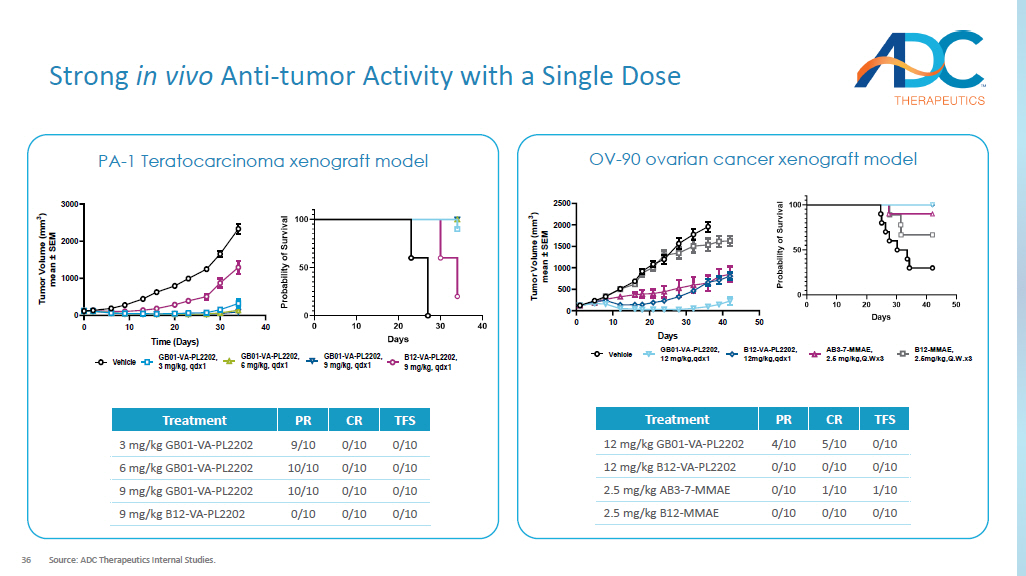
36 单剂量具有很强的体内抗肿瘤活性来源:ADC Therapeutics 内部研究。0 10 20 30 40 0 1000 2000 3000 时间(天)T u m o r v o l u m e (m m 3) m e a n ± S E M 载体 GB01-VA-PL2202,3 mg/kg,qdx1 GB01-VA-PL2202,6 mg/kg,qdx1 GB01-VA-PL2202,9 mg/kg,qdx1 B12-VA-PL2202,qdx1,qdx1 FS CR PR 治疗 0/10 0/10 9/10 3 mg/kg GB01-VA-PL2202 0/10 0/10 10/10 6 mg/kg GB01-VA-PL2202 0/10 0/10 10/10 9 mg/kg GB01-VA-PL2202 0/10 0/10 0/10 9 mg/kg B12-VA-PL2202 PA-1 卵巢畸胎癌异种移植模型 OV-90卵巢癌异种移植模型 0 10 20 30 40 50 0 500 1000 1500 2500 天 T u m o r v o l u m e (m m 3) m e a n ± S E M 车辆 GB01-VA-PL2202,12 mg/kg,qdx1 B12-VA-PL2202,12mg/kg,qdx1 AB3-7-MMAE,2.5 mg/kg,Q.Wx3 TFS CR PR 治疗 0/10 5/kg 4/10 12 mg/kg GB01-VA-PL2202 0/10 0/10 0/10 12 mg/kg B12-VA-PL2202 1/10 1/10 0/10 2.5 mg/kg AB3-7-MMAE 0/10 0/10 0/10 2.5 mg/kg B12-MMAE 0/10 0/10 2.5 mg/kg B12-MMAE 0/10 0/10 2.5 mg/kg B12-MMA B12-MMAE

37 稳定且耐受性良好-Cynomolgus Monkeys DLT:剂量限制毒性;胃肠道:胃肠道。来源:ADC Therapeutics 内部研究。▪ 良好——耐受性高达 40 mg/kg 静脉注射,几乎没有临床病理学发现 ▪ 60 mg/kg 时,DLT 在胃肠道发生退行/再生,这与拓扑异构酶抑制剂的已知类别效应一致 ▪ ADC 表现出线性 PK,t½ 约为 8.5 — 10 天 ▪ 在整个给药周期内均可检测到游离依西替康,有明显的刺激性 ½ of 5.5 — 8 天 40 mg/kg Claudin-6 ADC 43 n=3 1 22 20 mg/kg Claudin-6 ADC 43 n=3 1 22 30 mg/kg Claudin-6 ADC 7n=3 60 mg/kg Claudin-6 ADC 1

相信 TI 的38个理由:治疗指数;IHC:免疫组织化学;ADME:吸收、分布、代谢、排泄。资料来源:《永恒研究中的ADC疗法》。经过验证的具有高潜在冲击力的靶标 x 膜结合抗原 x 高效内化 x 在卵巢癌和 NSCLC 中高度特异性表达 x 使用 ADC 方法进行临床验证 ▪ 体外和体内与免疫和/或靶向疗法的联合研究 ▪ 体内基准对照与竞争对手 ▪ Claudin-6 IHC 分析开发 ▪ 在发明准备方面取得进展释放机会的差异化方法 x 具有高 TI x 高细胞内吸收率的优化 ADC 设计 x 具有高 TI x 高细胞内吸收率的优化 ADC 设计 x 肿瘤退化率高,反应快 x 强对卵巢癌异种移植模型单剂量的抗肿瘤活性 x 稳定且耐受性良好 x 强烈的旁观者杀灭活性
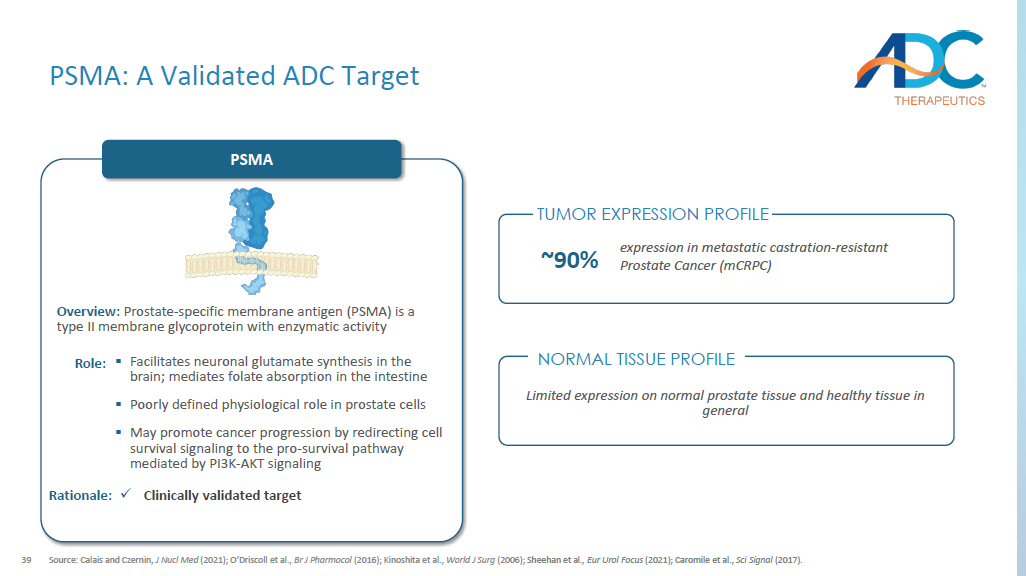
39 PSMA:经过验证的ADC目标来源:Calais和Czernin,J Nucl Med(2021年);O'Driscoll等人,Br J Pharmocol(2016年);Kinoshita等人,《世界杂志》(2006年);Sheehan等人,《Eur Urol Focus》(2021年);Caromile等人,《信号科学》(2017年)。PSMA 概述:前列腺特异性膜抗原 (PSMA) 是一种具有酶促活性的 II 型膜糖蛋白 ▪ 促进大脑中神经元谷氨酸合成;介导肠道叶酸吸收 ▪ 前列腺细胞的生理作用定义不明确 ▪ 可能通过将细胞存活信号重定向到 PI3K-AKT 信号传导介导的促生存途径来促进癌症进展:x 临床验证的靶点理由:有限表达在正常的前列腺组织和一般健康组织上,转移性去势中约有 90% 的表达-耐药性前列腺癌 (mcRPC) 正常组织分布肿瘤表达谱

40 PSMA:对未满足需求领域的巨大潜在影响 1.先前的雄激素受体途径抑制剂(ARPI)治疗;2.mcRPC治疗模式可能在不久的将来更新(psmaFore试验正在进行中);3.表示 PSA 回复率;4.标准护理(SoC)不包括化疗、免疫疗法、镭-223(223Ra)和在研药物。资料来源:加来和切尔宁,J Nucl Med(2021年);Sartor等人,N Engl J Med(2021年);Pal等人,Urol Clin North Am(2013年);诺华新闻稿(2023年10月);OnClive;NCCN指南。Docetaxel Pluvicto + SoC 4 Pluvicto 1,2 Enzalutamide 42% 51% 51% 54% 3 ORR 7.2 mos 8.7 mos 12.0 mos 8.3 mos PFS 17.5 mos 15.3 mos 18.4 mos 操作系统转移性去势耐药性前列腺癌 (mcRPC) ~16 K 美国接受治疗的患者 mcPRC (2L+) ~290 K 美国患者前列腺癌 ~14 K 美国患者 PSMA+ 未获治疗需要
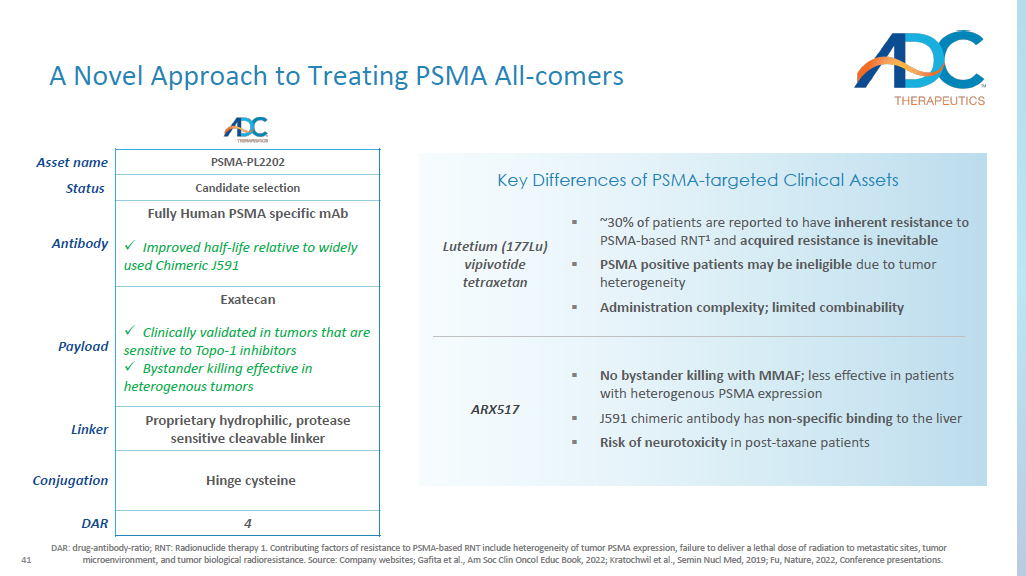
41 DAR:药物-抗体-比例;RNT:放射性核素疗法 1。对基于 PSMA 的 RNT 产生耐药性的促成因素包括肿瘤 PSMA 表达的异质性、未能向转移部位提供致命剂量的辐射、肿瘤微环境和肿瘤生物放射抵抗。来源:公司网站;Gafita等人,Am Soc Clin Oncol Educ Book,2022年;Kratochwil等人,Semin Nucl Med,2019年;Fu,Nature,2022年,会议演讲。PSMA-PL2202 资产名称候选物选择状态全人源性 PSMA 特异性单克抗体 x 与广泛使用的 Chimeric J591 Exatecan Payload 相比,半衰期有所改善 x 在对 Topo-1 抑制剂敏感的肿瘤中经过临床验证 x 旁观者杀伤对异源性肿瘤有效专有亲水性、蛋白酶敏感的可分解连接剂 Linker Hinge 半胱氨酸偶联物 4 DAR PSMA的关键区别——靶向临床资产 ▪ 否使用 MMAF 杀死旁观者;对异源 PSMA 表达患者的效果较差 ▪ J591 嵌合抗体与肝脏具有非特异性结合 ▪ 紫杉烷后期患者存在神经毒性风险 ARX517 ▪ 约 30% 的患者据报告对基于 PSMA 的 RNT 1 具有固有的耐药性,获得性耐药性是不可避免的 ▪ PSMA 阳性患者可能由于肿瘤异质性而没有资格 ▪ 给药复杂性;l 有限的可组合性 Lutetium (177Lu) vipivotide tetraxetan 一种全新的 PSMA 治疗方法
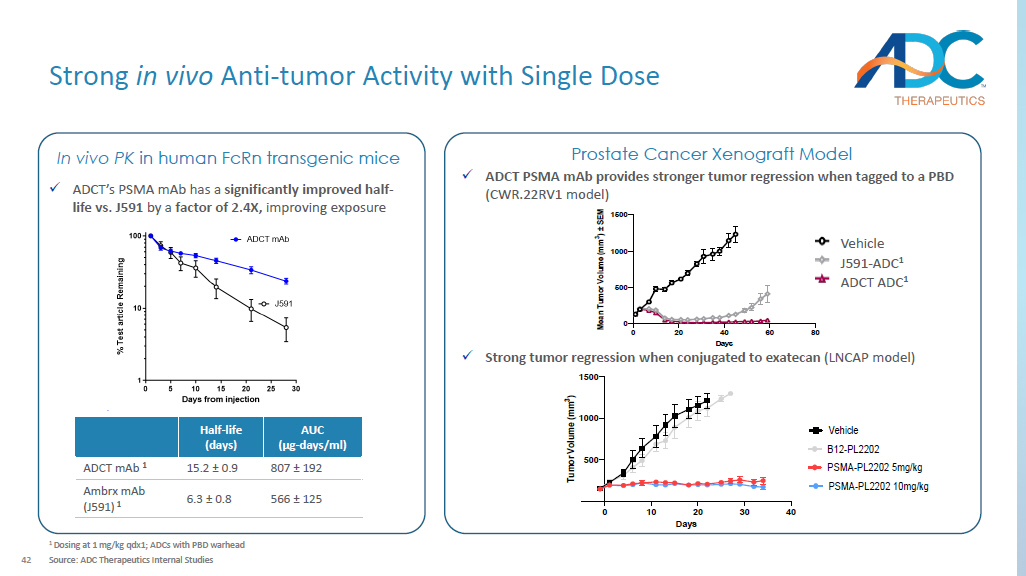
42 单剂量 1 剂量时体内抗肿瘤活性强 qdx1;带有 PBD 弹头的 ADC 来源:ADC Therapeutics 内部研究 AUC(µg-天/ml)半衰期(天)807 ± 192 15.2 ± 0.9 ADCT 1 566 ± 125 6.3 ± 0.8 Ambrx maB (J591) 1 x ADCT 的 PSMA 单抗有显著改善与J591相比,半衰期提高了2.4倍,提高了人类 fcRN 转基因小鼠的体内 PK x ADCT PSMA maB 标记为 PBD(CWR.22RV1 模型)前列腺癌异种移植模型 0 20 40 60 80 0 500 1000 1500 天 M e a nT u m o r V o l u m e (m m 3) ± S E M 车辆 J591-SG3249 0.6 mg/kg 2A10-SG3249 0.6 mg/kg ADCT ADC 1 J591-ADC 1 车辆 0 10 20 30 40 500 1000 1500 天 T u m o r o l u m e (m m 3) B12-PL2202 PSMA-PL2202 10mg/kg 车辆 PSMA-PL2202 5mg/kg x 与埃塞康结合时出现强烈肿瘤回归(LNCAP 模型)

相信 TI 的 43 个理由:治疗指数;ADME:吸收、分布、代谢、排泄。资料来源:ADC Therapeutics内部研究。具有高潜在影响的经过验证的靶标 x 膜结合抗原 x 高效内化 x 在前列腺癌中高度特异性表达 x 通过 ADC 方法进行临床验证 Path Forward ▪ 完成候选筛选工作 ▪ 体外和体内与免疫和/或靶向疗法的联合研究 ▪ 与竞争对手进行体内基准对比 ▪ 解锁机会的差异化方法 x 在旁观者活性强的情况下治疗所有来者的机会 x PSMA 单抗偶联时出现的强烈肿瘤回归到exatecan x 使用基于喜树碱的衍生物制剂进行验证,用于治疗 PC,靶向 B7-H3 x Superior mAb 与 AMBRX 的 J591 对比 X 完全人源单抗,半衰期显著改善 x 与 PBD 结合后肿瘤回归更强
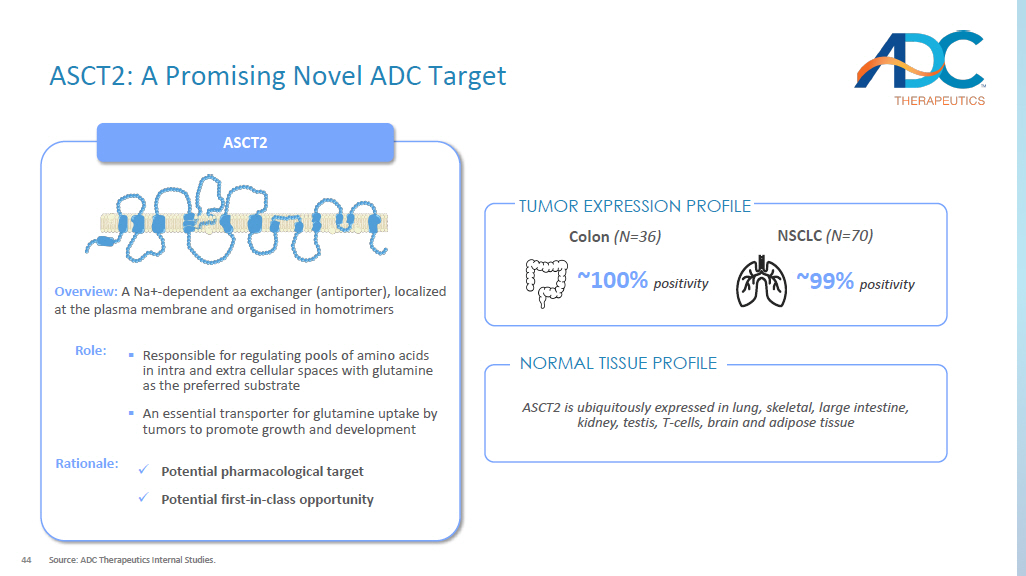
44 ASCT2:有前途的新型 ADC 靶点来源:ADC Therapeutics 内部研究。ASCT2 ASCT2 在肺、骨骼、大肠、肾脏、睾丸、T 细胞、大脑和脂肪组织中无处不在地表达。概述:一种 Na+ 依赖性 aa 交换剂(反向转运蛋白),局限于质膜并以同质三聚体组成 ▪ 以谷氨酰胺为首选底物,负责调节细胞内和细胞外空间中的氨基酸库 ▪ 肿瘤吸收谷氨酰胺以促进生长的必需转运蛋白和发育作用:x 潜在的药理靶标 x 潜在的同类首创机会理由:NSCLC(N=70)~ 99% 阳性 ~ 100% 阳性结肠 (N=36) 正常组织分布肿瘤表达谱
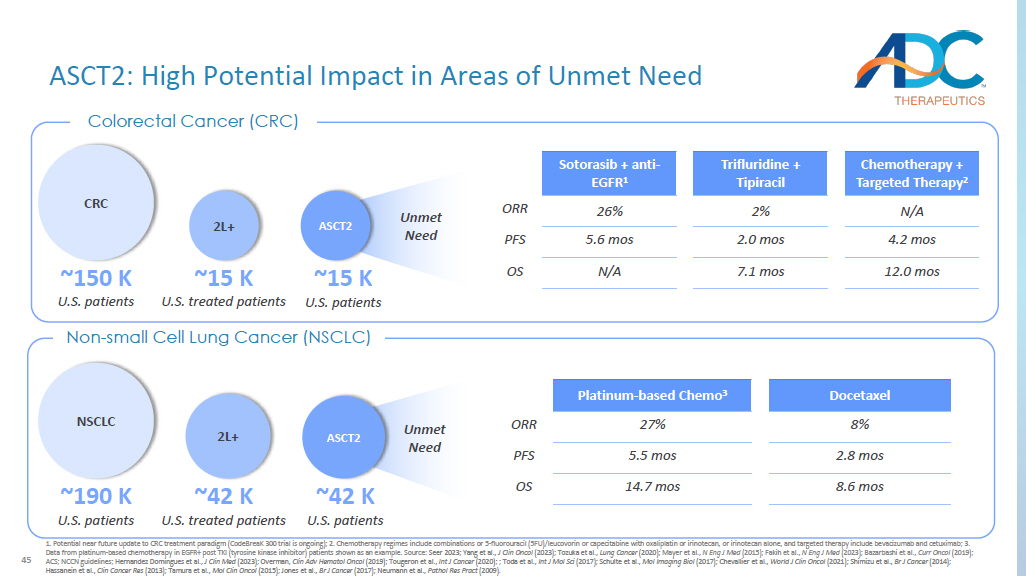
45 ASCT2:对未满足需求领域的巨大潜在影响 1.结直肠癌治疗模式可能在不久的将来更新(CodeBreak 300试验正在进行中);2.化疗方案包括将5-氟尿嘧啶(5FU)/leucovorin或capecitabine与oxa liplatin或伊立替康联合或单独使用伊立替康,靶向治疗包括贝伐珠单抗和西妥昔单抗;3.以TKI(酪氨酸激酶抑制剂)患者EGFR+(酪氨酸激酶抑制剂)患者中铂基化疗的数据为例。资料来源:Seer 2023;Yang 等人,J Clin Oncol(2023);户冢等人,《肺癌》(2020);Mayer 等人,N Eng J Med(2015);Fakih 等人,N Eng J Med(2023);Bazarbashi 等人,Curr Oncol(2019);ACS;NCCN 指南;Hernandez Domingues 等人,J Clingues 等人 In Med(2023);Overman,Clin Adv Hematol Oncol(2019);Tougeron 等人,《国际癌症杂志》(2020);户田等人,《Int J Mol Sci》(2017);Schulte 等人,《Mol Imaging Biol》(2017);Chevallier 等人,《World J Clin Oncol》(2021);清水等人,Br J Cancer(2014));Hassanein 等人,《临床癌症研究》(2013);田村等人,MolClin Oncol(2015);琼斯等人,Br J Cancer(2017);诺伊曼等人,《病态研究实践》(2009)。结直肠癌 (CRC) 多西他赛铂基化疗 3 8% 27% ORR 2.8 mos 5.5 mos PFS 8.6 mos 14.7 mos OS NSCLC ~190 K 美国患者 ~42 K 美国患者 2L+ ~42 K 美国患者 ASCT2 非小细胞肺癌 (NSCLC) 未满足的需求 ~15K 美国患者 ~15 K 美国患者 ASCT2 未满足的需求化疗 + 靶向疗法 2 三氟尿嘧啶 + 替吡拉西布 + 抗表皮生长因子 1 N/A 2% 26% ORR 4.2 mos 2.0 mos 2.0 mos 2.0 mos 5.6 mos PFS 12.0 mos 7.1 mos N/A 操作系统

46 潜在的 ASCT2 类首创 ADC DAR:药物抗体比例;1.根据 cynomolgus monkey 的最大耐受剂量 (MTD) /小鼠的最小有效剂量 (MED) 计算。ASCT2-PL2202 资产名称活性(临床前)状态 ASCT2-特异性 mAb 抗体 x Fc-沉默缓解靶标-独立毒性 Exatecan Payload x 在对 Topo-1 抑制剂(例如 NSCLC、CRC)敏感的肿瘤中经过临床验证(例如,NSCLC、CRC)专有亲水性、蛋白酶敏感的可裂解连接剂 Linker Hinge cysteine x 位点-特异性偶联可消除异质性偶联 6 DAR >10 TI 1

47 血红素和实体瘤中的强细胞表面结合来源:ADC Therapeutics 内部研究体外细胞表面结合 -4 -2 0 2 4 6 0 100000 20000 300000 400000 500000 1180B2 Log 10 (ng/ml) M F I (M e d i a n F I T C-A) OVCAR-3 G-402 Raji MOLM-13 HT 拷贝号 ± SEM 细胞系 329284 ± 233 OVCAR-3 332584 ± 3628 MOLM-13 220235 ± 2673 Raji 182175 ± 746 G-402 103427 ± 56 HT 180B2 EC50 (ng/ml) 细胞系组织学 475 OVCAR-3 卵巢 1317 HT-29 结肠 725 G-402 肾脏 10407 MOLM-13 白血病 10995 拉吉淋巴瘤

48 单剂量实体瘤具有很强的体内抗肿瘤活性 PR:部分回归;CR = 完全回归;TFS = 无肿瘤幸存者。资料来源:ADC Therapeutics内部研究。OVCAR-3(卵巢癌)异种移植模型 0 5 10 15 20 25 30 35 40 45 0 400 1200 1200 1600 天 M e a n T u m o r v o l u m e (m m 3) ± S E M Vehicle 1180B2-VA-PL2202,6.6 mg/kg,qdx1 1180B2-VA-PL2202,10 mg/kg,qdx1 B12-VA-PL2202,10 mg/kg,qdx1 1180b2-dxD,15 mg/kg,qdx1 1180b2-dxD,15 mg/kg,qdx1 1180b2-dxD,15 mg/kg,qdx1 1180b2-dxD,15 mg/kg,qdx1 1180b2-dxD,dx1 TFS CR PR 治疗 9 9 1 6.6 mg/kg ASCT2-PL2202 6 6 4 10 mg/kg ASCT2-PL2202 8 9 1 15 mg/kg ASCT2-dxD 1 1 1 1 B12-VA-PL2202 10 mg/kg CTG-0860 NSCLC PDX 型号 0 5 10 15 20 25 30 45 50 50 0 1000 3000 天 M e a n T u m o r v o l u m e (m 3) ± S E M 车辆 (iv, qd x 1)) 1180B2-VA-PL2202(10 mg/kg,iv,qd x 1)B12-VA-PL2202(10 mg/kg,iv,qd x 1)TFS CR PR 治疗 0 0 1 10 mg/kg ASCT2-PL2202 0 0 0 10 mg/kg B12-VA-PL2202 ASCT2-PL2202, ASCT2-PL2202, ASCT2-dxD, ASCT2-PL2202,

49 单剂量血液学 PR 具有较强的体内抗肿瘤活性:部分回归;CR = 完全回归;TFS = 无肿瘤幸存者。资料来源:ADC Therapeutics内部研究。MOLM-13 (AML) 异种移植模型 Raji B(伯基特淋巴瘤)异种移植模型 TFS CR PR 治疗 2 5 1 10 mg/kg ASCT2-PL2202 0 0 0 10 mg/kg B12-VA-PL2202 TFS CR PR 治疗 10 10 0 10 mg/kg ASCT2-PL2202 0 0 0 10 mg/kg B12-VA-PL2202 ASCT2-PL2202 ASCT2,-PL2202,
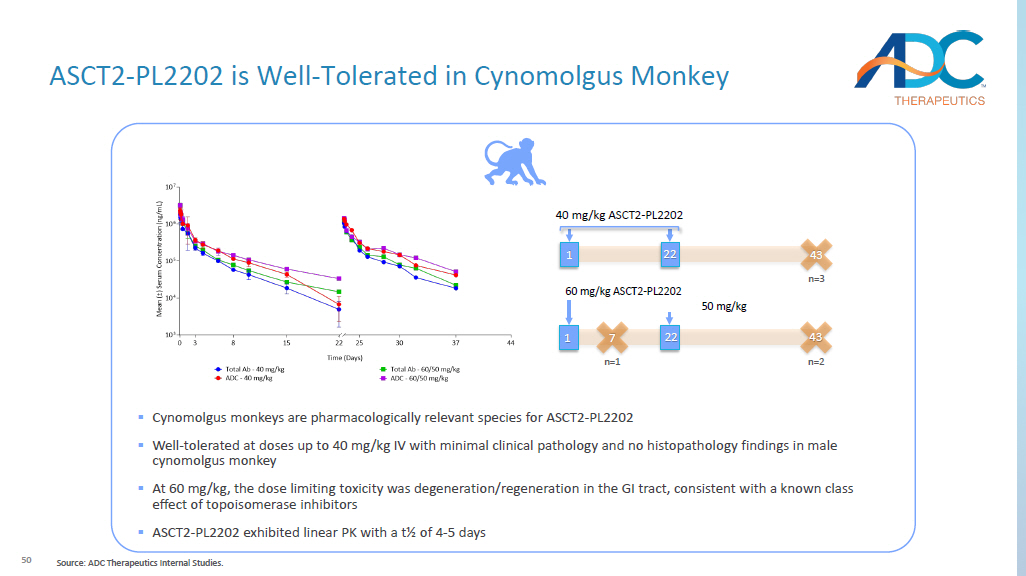
50 60 mg/kg ASCT2-PL2202 43 n=2 1 22 50 mg/kg 40 mg/kg ASCT2-PL2202 43 n=3 1 22 7 n=1 ▪ Cynomolgus 猴是药理学相关物种 ASCT2-PL2202 ▪ 好——耐受剂量高达 40 mg/kg 静脉注射,临床病理学表现极小,没有组织病理学发现 ▪ 60 mg/kg 时,剂量限制毒性是退化/再生胃肠道与拓扑异构酶抑制剂的已知类别效应一致 ▪ ASCT2-PL2202 表现出线性 PK,t½ 为 4-5 天 ASCT2-PL2202 很好——在 Cynomolgus 中耐受性良好猴子来源:ADC Therapeutics内部研究。

相信TI的51个理由:治疗指数;IHC:免疫组织化学;ADME:吸收、分布、代谢、排泄。资料来源:《永恒研究中的ADC疗法》。具有高潜在影响力的前景靶标 x 膜结合抗原 x 高效内化 x 在非小细胞肺癌、结直肠癌和血液系统恶性肿瘤中高度表达 Path Forward ▪ 完成候选筛选工作 ▪ 体外和体内与免疫和/或靶向疗法的联合研究 ▪ ASCT2 IHC 分析开发 ▪ 在临床试验准备方面取得进展释放机会的差异化方法 x 具有高 TI 的优化 ADC 设计 x 卵巢、非小细胞肺癌单剂量体内抗肿瘤活性强,以及血液学异种移植和 PDX 模型 x 稳定且良好-对食虫猴有耐受性

52 议程 ▪ 业务动态 ▪ 我们的研究策略 ▪ 我们的平台 ▪ 主要候选人 ▪ 前瞻性 ▪ 闭幕词 ▪ 问答
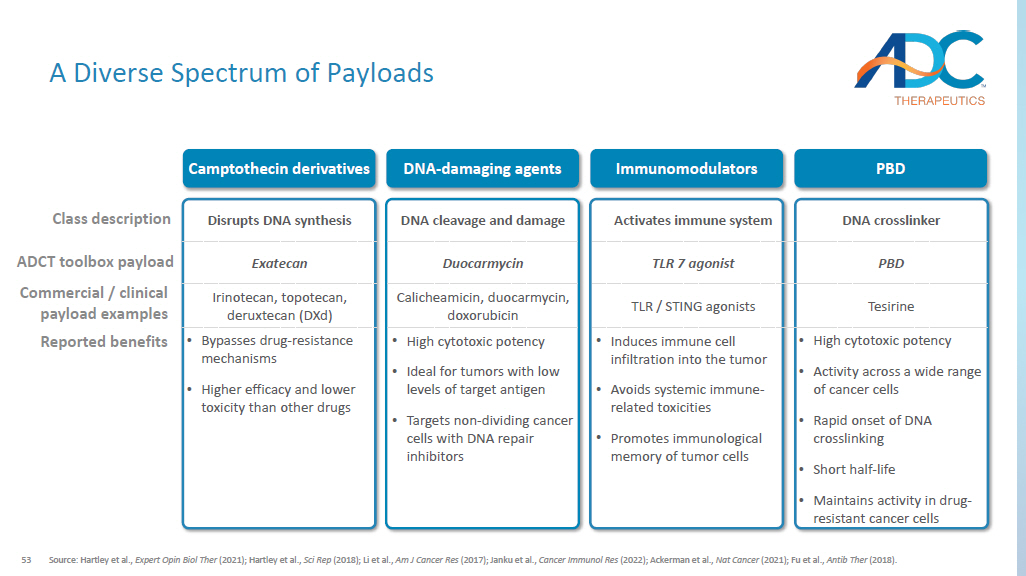
53 多种有效载荷类别描述商业/临床载荷示例报告的益处 DNA-破坏剂免疫调节剂 PBD DNA 交联剂激活免疫系统 DNA 裂解和损伤干扰 DNA 合成 PBD TLR 7 激动剂 Duocarmycin Exatecan Tesirine TLR TLR TLR 7 激动剂 Duocarmycin Exatecan Tesirine TLR/STING 激动剂 Calicheamicin、duocarmycin、duocarmycin、Irteinobicin 拓扑替康、德鲁替康 (dxD) • 细胞毒性效力高 • 对多种癌细胞具有活性 • DNA 交联起效快 • 半衰期短 • 维持药物活性-耐药性癌细胞 • 诱导免疫细胞浸润肿瘤 • 避免全身免疫相关毒性 • 促进肿瘤细胞的免疫记忆 • 细胞毒性效力高 • 非常适合靶抗原水平低的肿瘤 • 使用 DNA 修复抑制剂靶向非分裂癌细胞 • 绕过药物耐药机制 • 比其他药物更高的疗效和更低的毒性来源:Hartley 等人,专家 Opin Biol Ther(2021);哈特利等人,《科学代表》(2018);李等人,《Am J Cancer Res》(2017);Janku等人,《癌症免疫研究》(2022年);Ackerman 等人,Nat Cancer(2021);Fu 等人,Antib Ther(2018)。ADCT 工具箱有效载荷
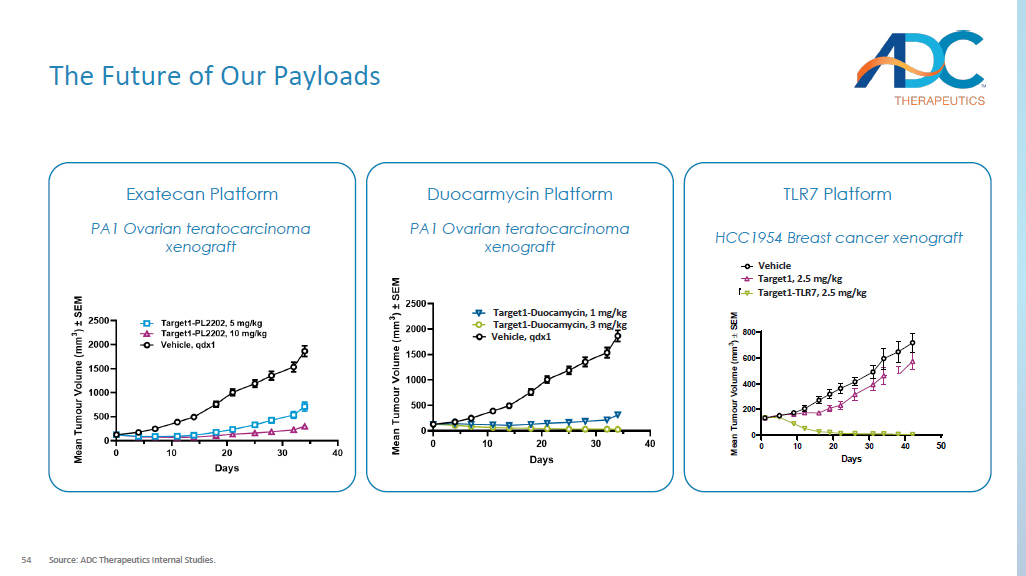
54 我们有效载荷的未来来源:ADC Therapeutics内部研究。Exatecan Platform PA1 卵巢畸胎癌异种移植 TLR7 平台载体靶标1,2.5 mg/kg 靶标1-TLR7,2.5 mg/kg 50 HCC1954 乳腺癌异种移植多卡霉素平台 PA1 卵巢畸胎癌异种移植靶标1-多卡霉素,3 mg/kg 载体,qdx1
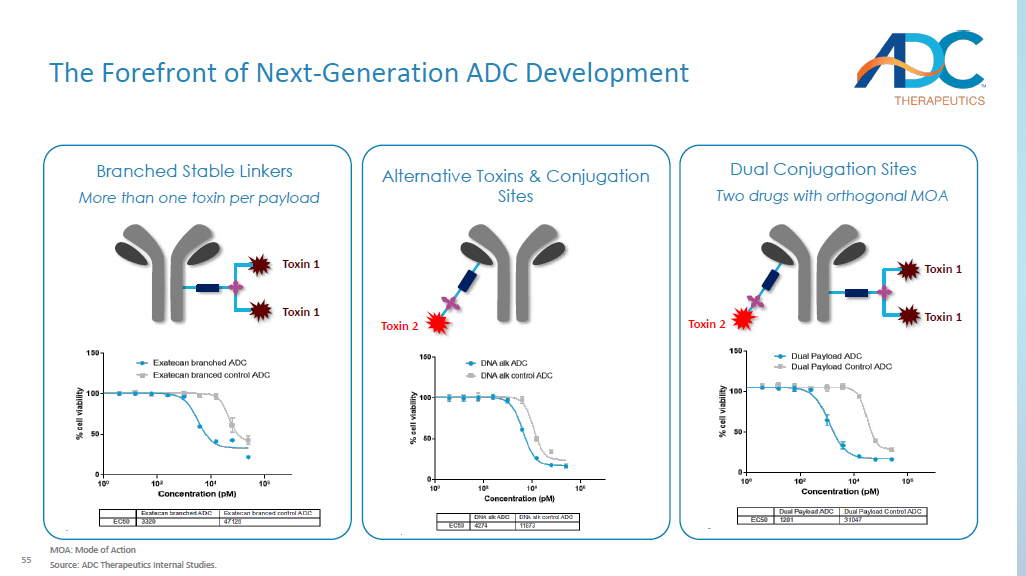
55 下一代 ADC 开发的最前沿分支稳定连接物双偶联位点每有效载荷有多种毒素 1 毒素 1 毒素 1 替代毒素和偶联位点毒素 2 毒素 2 毒素 1 毒素 1 毒素 1 两种具有正交位点的药物 MOA: 作用模式来源:ADC Therapeutics 内部研究。

56 议程 ▪ 业务动态 ▪ 我们的研究策略 ▪ 我们的平台 ▪ 主要候选人 ▪ 前瞻性 ▪ 闭幕词 ▪ 问答
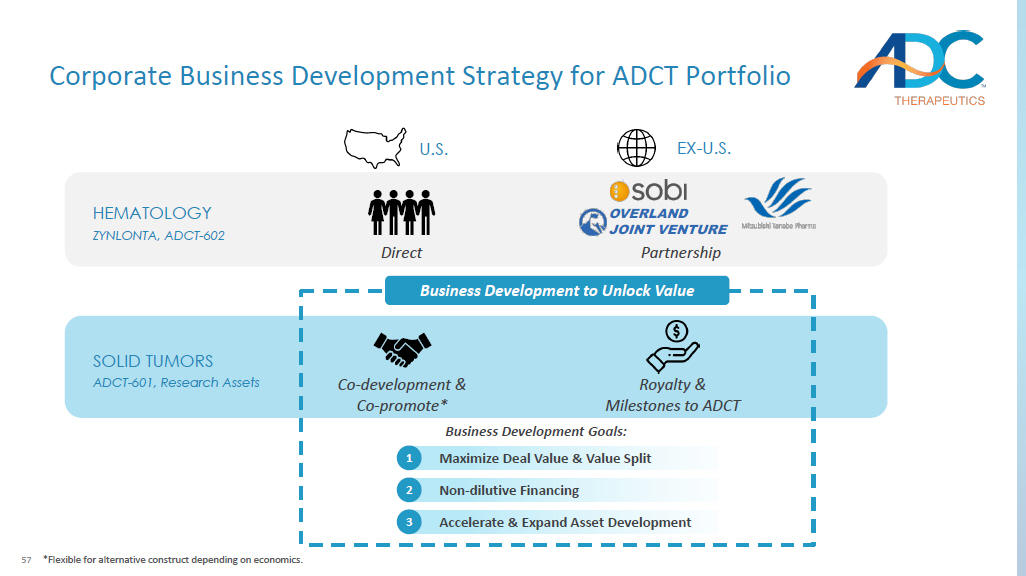
57 HEMETOLOGY ZYNLONTA,ADCT-602 SOLID ZONUMAS ADCT-601,研究资产业务发展以解锁价值业务发展目标:美国EX-美国公司开发与公司-推广*特许权使用费和ADCT的里程碑加速和扩大资产开发 3 非稀释性融资 2 最大化交易价值和价值分割 1 直接伙伴关系 *视经济状况而定,可灵活采用替代结构。OVERLAND 合资企业ADCT投资组合的业务发展战略

58 闭幕摘要 ▪ ADC领域的先驱,拥有经批准的产品和多种临床资产 ▪ 处于下一代ADC开发的最前沿,在选择最佳靶向部分、连接剂和有效载荷以建立治疗窗口方面有着良好的记录 ▪ 主要临床前候选药物建立在基于exatecan的新型、专有平台之上 ▪ 差异化的exatecan平台设计,使所有药物的体内疗效均可重复,治疗指数高我们的临床前候选药物 ▪ 肿瘤对患者的潜在影响很大满足未得到满足的医疗需求 ▪ 通过内部开发和创新合作加速和扩大多种变革性ADC疗法开发的难得机会

问与答

附录
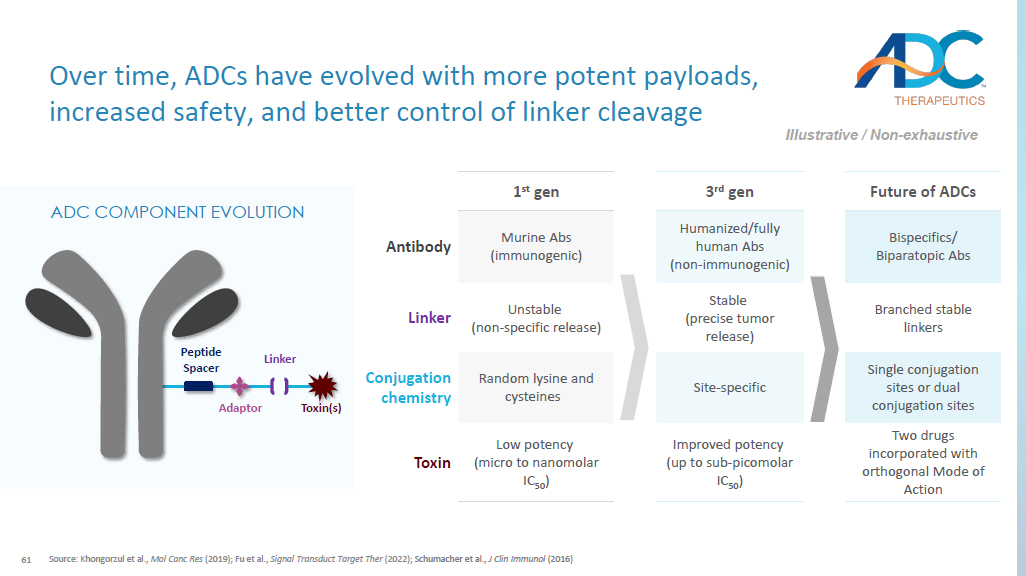
61 ADC 的未来第 3 代第 1 代双特异性/双侧偶联位点人源化/全人体 Abs(非免疫原性)Murine Abs(免疫原性)抗体分支稳定连接物稳定(精确的肿瘤释放)不稳定(非特异性释放)Linker 单一偶联位点或双偶联位点-特异性随机赖氨酸和半胱氨酸偶联化学两种采用正交模式的药物作用提高效力(最高可达亚皮摩尔 IC 50)低效力(微至纳摩尔 IC 50)毒素来源:Khongorzul 等人,Mol Canc Res(2019);Fu 等人,信号转导目标 Ther(2022年);Schumacher等人,J Clin Immunol(2016)随着时间的推移,ADC不断发展,有效载荷更强,安全性更高,连接器裂解得到更好的控制示意性/非详尽的ADC组件演化肽间隔器适配器连接器毒素

62 Exatecan的每项计划都有抗体药物偶联物本身的物质成分申请,有效期较长。-Claudin的许可物质组合物专利保护(独家)——6种抗体美国、欧盟、中国、日本——基础到期时间为2041年5月,可能延期至2046年5月 2041 2042 2045 专有亲水性链接剂技术基础到期日 10/2044 关键专利组合 2046 2043 2047 2048 2049 物质成分(基于 Exatecan 的 ADC)— Napi2b、Claudin-6、PSMA、ASCT2 美国、欧盟、中国和日本 — 基准到期 10/2044 或 12/2044扩展至 10/2049 或 12/2049

63 监管排他性监管数据保护 ▪ 自批准之日起 12 年,儿科可能延长 6 个月 ▪ 自批准起 10 年 ▪ 8 年再审查期,儿科检查期可能延长 2 年
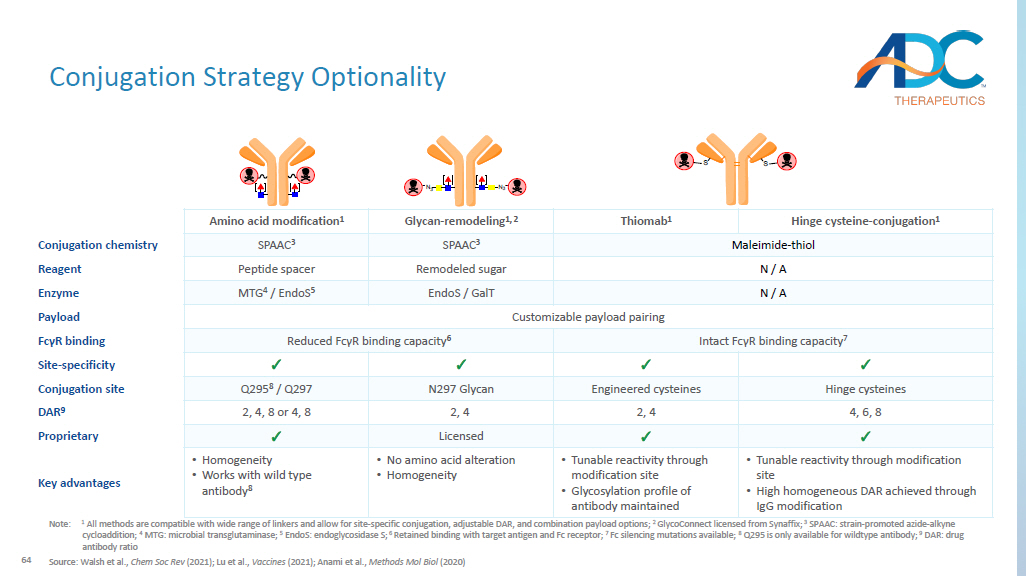
64 企业偶联策略可选性注:1 所有方法均与多种连接剂兼容,并允许位点特异性偶联、可调整的 DAR 和组合有效载荷选项;2 GlycoConnect 获得 Synaffix 许可;3 SPAAC:菌株——促进叠氮——炔烃环加成;4 MTG:微生物谷氨酰胺转氨酶;5 ENDOS:内糖苷酶 S;6 保留与靶抗原的结合和 Fc 受体;7 种 Fc 沉默突变可用;8 Q295 仅适用于野生型抗体;9 DAR:药物抗体比率来源:Walsh 等人,Chem Soc Rev (2021);Lu 等人,《疫苗》(2021);Anami 等人,方法 Mol Biol(2020)铰链半胱氨酸-偶联 1 Thiomab 1 聚糖-重塑 1,2 氨基酸修饰 1 马来酰亚胺-硫醇 SPAAC 3 偶联化学 N/A 重塑糖肽间隔试剂 N/A EndoS/GalT MTG 4/EndoS 5 酶可定制有效载荷配对有效载荷完整 Fc γR 结合能力 7 降低 Fc γR 结合力 6 Fc γR 结合 ✓ ✓ ✓ ✓ 位点-特异性铰链半胱氨酸工程半胱氨酸 N297 聚糖 Q295 8/Q297 偶联位点 4、6、8、8、4、8 或 4、8 DAR 9 ✓ ✓已授权 ✓ 专有 • 通过修饰位点可调反应性 • 通过 IgG 修饰实现高均质 DAR • 通过修饰位点可调反应性 • 保持抗体的糖基化特征 • 无氨基酸改变 • 同质性 • 同质性 • 可与野生型抗体配合使用 8 主要优势 mtGase F Endo-S N 3 N 3 Amine-PEG (3u)-azide mtGase Amine-PEG (3u) amine-PEG (3u)-azide mtGase Amine-PEG (3u) amine-PEG (3u) Azide mtGase Amine-PEG (3u)-叠氮化物 N 3 N 3 DBCO-DBCO-

65 多种连接剂工具箱来源:Alas等人,J Med Chem(2022年);Lu等人,Int J Mol Sci(2016);Sheyi等人,《制药》(2022年);Su等人,《Acta Pharm Sin B》(2021年);Dal Corso等人,《生物偶联化学》(2017年)不可分割的连接剂可分解的连接剂——葡萄糖醛酸盐蛋白酶/肽酶谷胱甘肽裂解触发结构硫醚或马来酰亚胺己酰基 β-葡萄糖醛酸-PABC Val-Ala-PABC S-S Linker 序列溶酶体溶酶体内切体/溶酶体有效载荷释放位置 ✓✓ ✓✓ ✓✓ ✓ 血浆稳定性 — ✓ ✓✓ 细胞内释放 ✓✓特异性 — ✓ ✓ — 无痕 — ✓ ✓ ✓ 旁观者效应