
® THERAPEUTICS 开创性用于自身免疫的 mRNA 细胞疗法 2024 年 4 月 C A R T E S I A N T H E R A P E U T I C S 附录 99.1

前瞻性陈述披露就本通知而言,以下的 “演示文稿” 是指并包括随后的幻灯片、Cartesian Therapeutics, Inc.(“公司”)管理层成员或任何人代表他们对幻灯片的口头陈述、该口头陈述之后的任何问答环节、本文档的硬拷贝以及在该口头陈述中分发或与之相关的任何材料。前瞻性陈述本演示文稿中关于公司未来预期、计划和前景的任何陈述,包括但不限于有关公司预期现金资源和现金流的陈述、公司预计手头现金、公司剩余A系列无表决权可转换优先股的转换、公司的内部制造能力、RNA Armory® 利用多种模式实现对工程细胞进行精确控制和优化的潜力,Descartes-08、Descartes-15、Descartes-33和该公司其他候选产品治疗重症肌无力、系统性红斑狼疮或任何其他疾病的潜力、正在进行和计划中的临床试验、研究和数据读取的预期时间或结果、美国食品药品管理局对公司监管申报的审查的预期时间或结果、公司进行临床的能力试验和临床前研究、任何监管申报的时间或提交、研发选择的预期时间或结果候选产品、公司完成任何预期协议和许可并实现其预期收益的能力、公司能够开发的治疗模式的新颖性、公司为满足未满足的医疗需求而开发的任何疗法的潜力、公司建立和维持其战略合作伙伴关系的能力、参与公司临床试验和其他包含 “预测”、“相信”、“继续” 字样的声明可以”、“估计”、“期望”、“假设”、“打算”,”可能”、“计划”、“潜力”、“预测”、“项目”、“应该”、“目标”、“将” 和类似表述构成1995年《私人证券诉讼改革法》所指的前瞻性陈述。由于各种重要因素,包括但不限于以下因素,实际结果可能与此类前瞻性陈述所示结果存在重大差异:临床试验(包括概念验证试验)的启动、完成和成本所固有的不确定性,包括不确定的结果;来自正在和未来临床试验的数据的可用性和时机以及此类试验的结果;特定临床试验的初步结果是否可以预测该试验的最终结果;以及是否早期临床试验的结果将表明以后的临床试验结果、根据对非人类受试者的研究结果预测对人体进行的研究结果的能力、公司RNA Armory® 技术未经证实的方法、患者入组的潜在延迟、公司候选产品的不良副作用、其依赖第三方进行临床试验、公司无法维持其现有或未来的合作、许可或者合同关系,它的无法保护其专有技术和知识产权,监管部门批准可能延迟,可用资金足以满足其可预见和不可预见的运营费用和资本支出需求,公司的经常性运营亏损和负现金流,公司普通股价格的大幅波动,与地缘政治冲突和流行病相关的风险以及公司最新年度报告的 “风险因素” 部分中讨论的其他重要因素 10-K 表格以及10-Q表格的季度报告以及公司向美国证券交易委员会提交的其他文件中。此外,本演示文稿中包含的任何前瞻性陈述仅代表公司截至其发布之日的观点,不应以此作为其后任何日期的观点。除非法律要求,否则公司明确表示不打算更新本演示文稿中包含的任何前瞻性陈述。2

3 家处于临床阶段的公司开创了旨在将细胞疗法的覆盖范围扩大到自身免疫的mRNA细胞疗法 • mRNA细胞疗法产品线旨在在门诊环境中更可靠、更安全地给药,而不会造成淋巴消耗 • Descartes-08:在针对重症肌无力(MG)患者的2a期研究中,潜在的首创mRNA CAR T细胞(CAR-T)显示出深刻而持久的临床反应 • 全资GL MP 制造旨在实现以迭代方式快速优化流程多种预期的短期催化剂 1.183亿美元截至2023年底;预计将为目前计划于2026年下半年开展的运营提供资金预计将通过第三阶段和多个其他临床项目为MG中的Descartes-08的持续临床开发提供资金 PRO FORMA CASH RESOURCES* • MG的2b期头条数据预计将于2024年中期启动 • 预计于2024年下半年启动其他自身免疫适应症的研究 DESCARTES-08 • 下一代 mRNA CAR-T 候选药物 • IND 已获批准,第一阶段的首次人体规划活动正在进行中 DESCARTES-15 *反映作为2023年11月融资的一部分,通过先前宣布的两笔延迟和解付款获得4000万美元,该融资发生在2024年1月和2024年2月 CAR、嵌合抗原受体 SLE、系统性红斑狼疮

经验丰富的管理团队将领导未来的mRNA细胞疗法公司 Matthew Bartholomae 总法律顾问 Metin Kurtoglu,医学博士,首席技术官米洛斯·米利科维奇,医学博士首席营销官布莱恩·戴维斯首席财务官 Chris Jewell,博士 cso Carsten Brunn,博士,副总裁,Quality 4 董事会成员 Patrick Zenner 董事尼珊·德席尔瓦,总经理蒂莫西·斯普林格,博士主任蒂莫西·巴拉贝董事迈克尔·辛格,医学博士,博士主任 Carrie S. Cox 董事长 Murat Kalayoglu,医学博士,博士主任
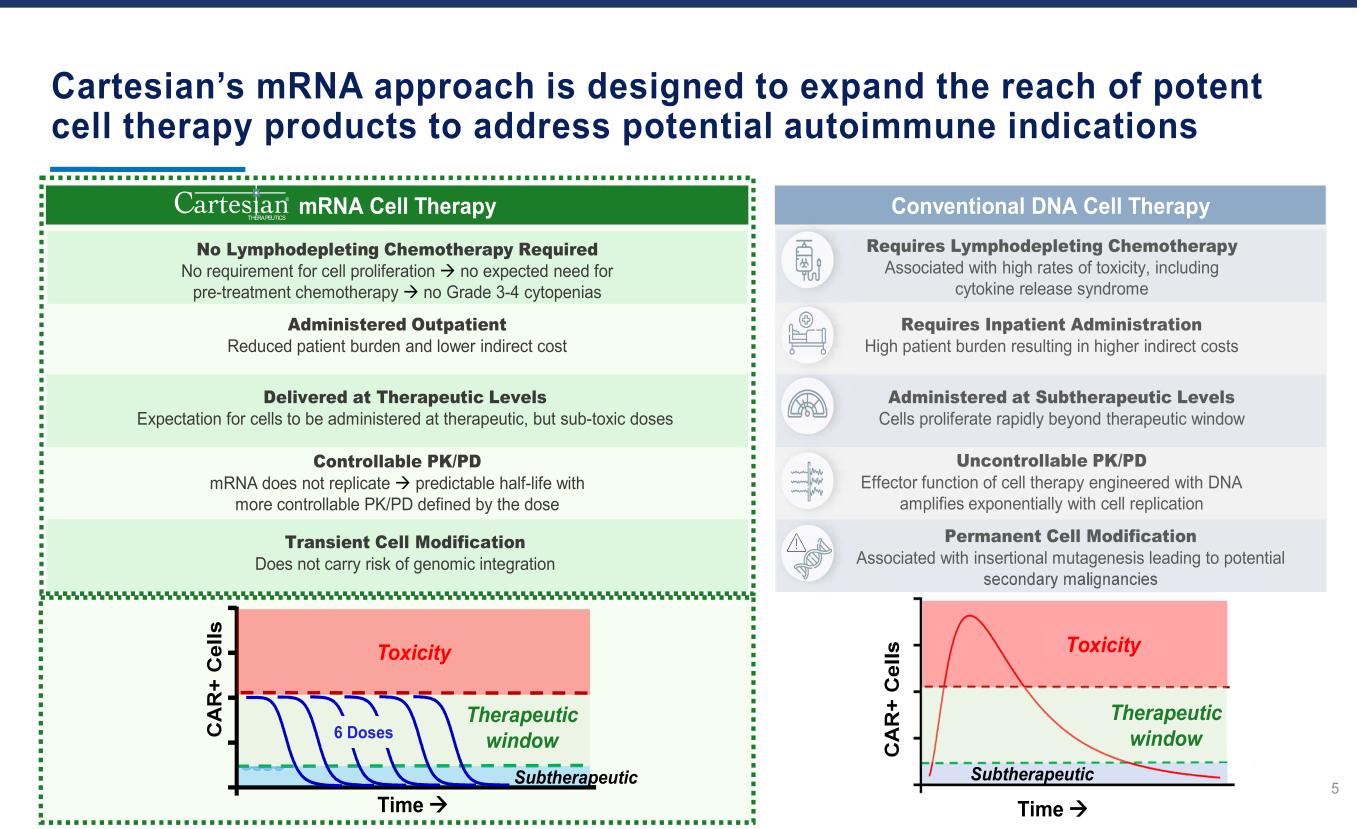
Cartesian的mRNA方法旨在扩大强效细胞疗法产品的覆盖范围,以应对潜在的自身免疫适应症 5 需要淋巴消耗化疗,与高毒性率相关的淋巴消耗化疗,包括细胞因子释放综合征传统的DNA细胞疗法永久细胞修饰与插入诱变相关的永久细胞修饰导致潜在的继发性恶性肿瘤由DNA设计的细胞疗法的PK/PD Effector功能随着亚治疗水平的细胞复制而呈指数级放大。评分快速超出治疗窗口需要住院管理患者负担过高导致间接费用增加亚治疗窗口毒性时间 mRNA 细胞疗法无需淋巴消耗化疗无需细胞增殖预期无需预治疗无 3-4 级细胞减少短暂细胞修饰不存在基因组整合的风险可控的 PK/PD mRNA 无法复制可预测的半衰期,PK/PD 由治疗水平预期的剂量定义用于以治疗方式给药但毒性剂量为亚毒剂量给药门诊减轻患者负担和降低间接成本毒性 6 剂量治疗窗口 Subtherapeutics Time® THERAPEUTICS

全资管线针对自身免疫性疾病 SLE、系统性红斑狼疮 * 正在进行骨髓瘤剂量递增研究 mRNA MSC、用 mRNA LN 转染的间充质干细胞、淋巴结资产适应症发现/临床前 1 期 2 期关键笛卡尔-08 自体 mRNA CAR-T 重症肌无力 SLE、其他自身免疫性疾病 Descartes-15 Autologos Ous mRNA CAR-T 自身免疫性疾病* Descartes-33 异基因 mRNA MSC 自身免疫性疾病原位 LN 转染未公开 6
® THERAPEUTICS 7 Descartes-08 被认为是针对自身免疫性疾病临床开发的首款mRNA CAR-T,通过转染具有抗BCMA car编码的自体CD8+ T细胞而设计的典型批次在大约 3 周内进行输注,重症肌无力的 2a 期阳性数据凸显了获得深度持久反应的潜力美国食品药品管理局对全身性重症肌无力的孤儿称号

Descartes-08 专为双重作用而设计,精确靶向参与一系列自身免疫性疾病的两个关键 BCMA+ 细胞群 8 多个自身免疫性疾病片段涉及 PCS/等离子体细胞和 PDC 的致病贡献,包括风湿学、肾脏病学、神经病学和其他选择性删除 PCS/血浆细胞和 PDC,如果成功,可能会创建差异化细胞治疗平台 PLASMA CELLS (PCs) 和 PLASM MABLASTS • Descartes-08 靶向的 PC、等离子体细胞和增生 B 细胞只占一小部分 B 细胞 • 这些细胞完全负责分泌致病性自身抗体 • 在自身免疫期间,自身抗体会攻击宿主组织并驱动炎症 PLASMACYTOID 树突状细胞 (PDC) • Descartes-08 设计靶向的 PDC 是抗原呈递细胞的罕见子集 • 这些细胞分泌高水平的细胞因子(即 I 型自身激素),在许多人体期间会导致炎症和组织损伤免疫性疾病 • 自身免疫患者(例如系统性红斑狼疮)的PDC升高并干扰最佳治疗 • Descartes-08 的设计目的是靶向 BCMA,一种在浆细胞/等离子细胞和浆细胞类树突状细胞 BCMA、B 细胞成熟抗原上表达的表面抗原
® THERAPEUTICS Descartes-08 的初始适应症:重症肌无力 • 影响美国和欧盟超过 120,000 名患者 • 以虚弱为特征:四肢、呼吸道、眼部、面部肌肉 • 护理标准包括长期使用免疫抑制剂,通常有毒性:• 进行性疾病,在没有免疫抑制剂的患者中,有1/3会致命 • 较新的药物包括补体抑制剂和抗FCRN mCRN mCRN ABS,必须长期给药以维持反应 • 许多自身免疫性疾病的发病机制相似;涉及发作由 T 细胞和 B/等离子体细胞自身 9

对Descartes-08注射MG(NCT04146051)的2期研究()观察到所有剂量均安全且耐受性良好 10 患者符合资格 • MG-ADL > 6 • MGFA II-IV 类 • 输液前 8 周以上的稳定药物剂量 • 开始使用笛卡尔-08 后不允许进行免疫抑制剂和血浆置换 IvG 和血浆置换,患者预计能够在治疗期间继续接受治疗接收 Descartes-08 细胞制造平台可耐受大多数标准的免疫抑制疗法第 1 部分确定安全剂量 (n = 3) 完成第 2 部分确定最佳给药时间表(n = 11)Complete1 第 3 部分第 2b 阶段比较笛卡尔-08和安慰剂(n = 30)注册 1 继续招收服用 musk MG 的患者和原本不符合第 3 部分 MG-ADL、重症肌无力日常生活活动量表 MGFA、美国重症肌无力基金会每周六次输液导致观察到深度、持久的反应安慰剂的受试者工程过继细胞疗法的对照试验
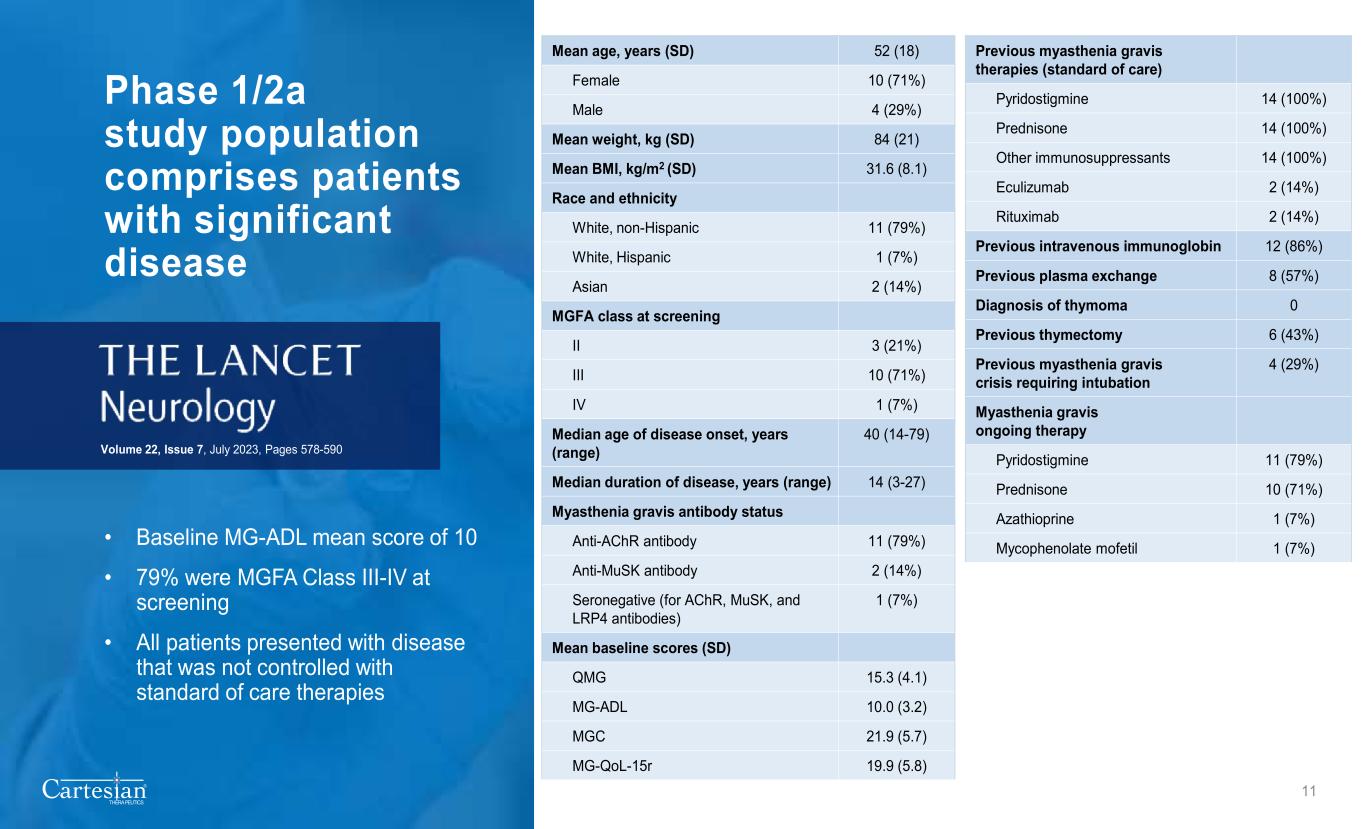
® THERAPEUTICS 1/2a 期研究人群包括患有重大疾病的患者 • 基线 MG-ADL 平均分为 10 • 筛查时有 79% 的 MGFA III-IV 类 • 所有患有未通过标准护理疗法控制的疾病的患者 22 卷,第 7 期,第 578-590 页 11 页平均年龄,年龄 (SD) 52 (18) 女性 10 (71%) 男性 4 (29%) 平均体重,kg (SD) 84 (21) 平均体重指数,kg/m2 (SD) 31.6 (8.1) 种族和族裔白人、非西班牙裔 11 (79%) 白人、西班牙裔 1 (7%) 亚裔 2 (14%) 亚裔 2 (14%) MGFA 等级 II 3 (21%) IV 10 (71%) IV 1 (7%)发病年龄中位数,年份(范围)40(14-79)发病时间中位数,年份(范围)14(3-27)重症肌无力抗体状态抗 ACHR 抗体 11 (79%) 抗麝香抗体 2 (14%) 血清阴性(对于 AchR、musK 和 LRP4 抗体)1 (7%) 平均基线评分 (SD) QMG 15.3 (4.1) MG-ADL 10.0 (3.2) MGC 21.9 (5.7) mg-qol-15R 19.9 (5.8) 先前的重症肌无力疗法(标准护理)吡哆司汀 14(100%)泼尼松 14(100%)其他免疫抑制剂 14(100%)依库珠单抗 2(14%)利妥昔单抗 2(14%)先前的静脉注射免疫球蛋白 12 (86%)既往血浆置换 8 (57%) 胸腺瘤的诊断 0 先前的胸腺切除术 6 (43%) 之前需要插管的重症肌无力危象 4 (29%) 重症肌无力持续治疗吡啶司汀明 11 (79%) 泼尼松 10 (71%) 硫唑嘌呤 1 (7%) Mycophenolate mofetil 1 (7%)
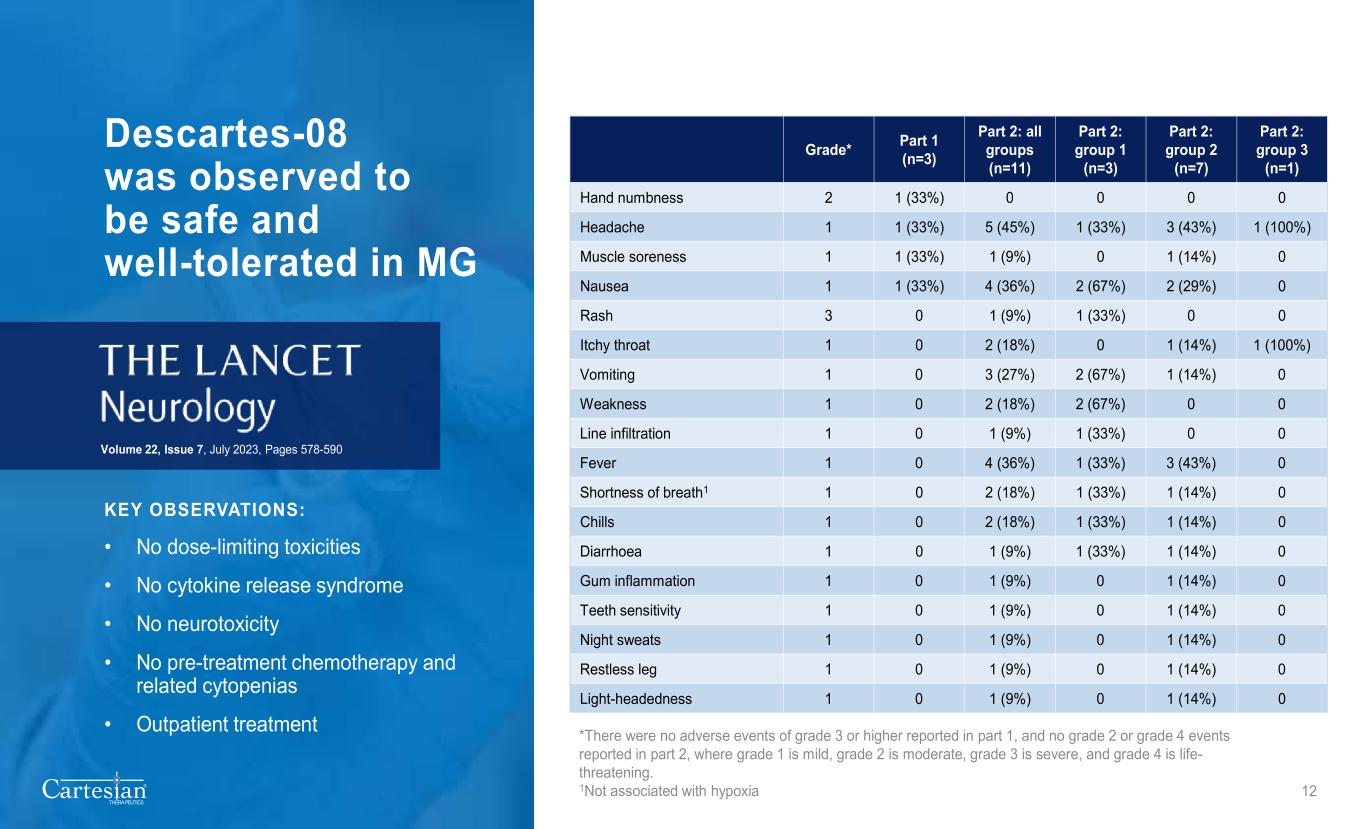
MG 中观察到® THERAPEUTICS Descartes-08 安全且耐受性良好:• 无剂量限制毒性 • 无细胞因子释放综合征 • 无神经毒性 • 无治疗前化疗和相关细胞减少症 • 门诊治疗第 22 卷,第 7 期,2023 年 7 月,第 578-590 页 12 级* 第 1 部分(n=3)第 2 部分:所有组(n=11)第 2 部分:组 1 (n=3) 第 2 部分:第 2 组 (n=7) 第 2 部分:第 3 组 (n=1) 手部麻木 2 1 (33%) 0 0 0 0 头痛 1 1 (33%) 5 (45%) 1 (33%) 3 (43%) 1 (100%) 1 (100%) 1 (9%) 0 恶心 1 1 (33%) 4 (36%) 4 (36%)%) 2 (67%) 2 (29%) 0 皮疹 3 0 1 (9%) 1 (33%) 0 0 0 喉咙发痒 1 0 2 (18%) 0 1 (14%) 1 (100%) 1 (100%) 呕吐 1 0 3 (27%) 2 (67%) 1 (67%) 1 (67%) 0 发烧 1 (33%) 0 0 4 (36%) 1 (33%) 3 (43%) 0 呼吸急促1 1 0 2 (18%) 1 (33%) 1 (14%) 0 寒战 1 0 2 (18%) 1 (33%) 1 (14%) 0 腹泻 1 0 1 (9%) 0 腹泻 1 0 1 (9%) 1 (9%) 0 腹泻 1 0 1 (9%) 0 (14%) 0 牙齿敏感度 1 0 1 (9%) 0 1 (14%) 0 盗汗 1 0 1 (9%) 0 1 (14%) 0 腿部不安 1 0 1 (9%) 0 1 (9%) 0 1 (14%) 0 1 (14%) 0 轻度头晕 1 0 1 (9%) 0 *没有第 1 部分报告了 3 级或以上的不良事件,第 2 部分未报告 2 级或 4 级事件,其中 1 级为轻度,2 级为中度,3 级为重度,4 级为危及生命。1 与缺氧无关
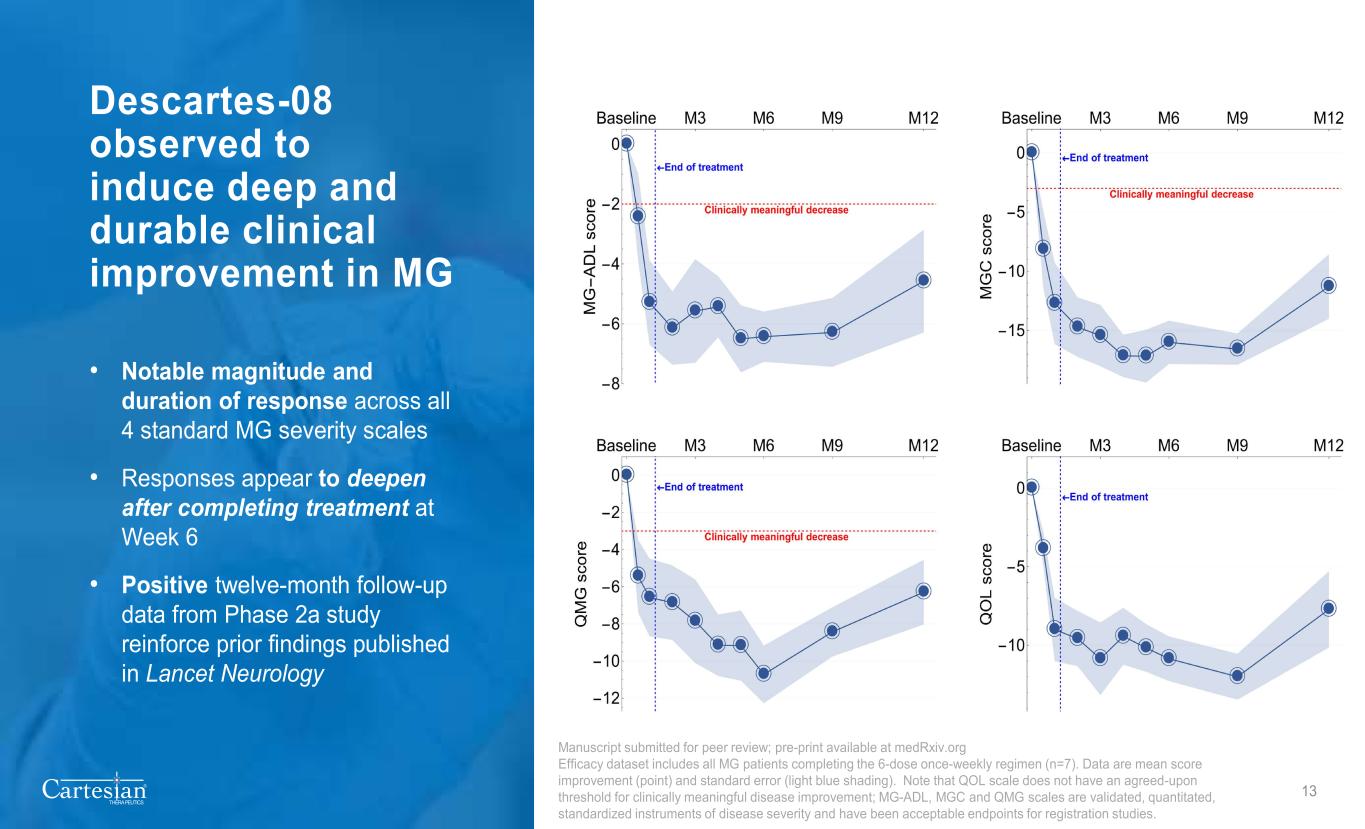
® THERAPEUTICS Descartes-08 观察到可促进 MG 的深层而持久的临床改善 • 在所有 4 个标准 MG 严重程度表中均有显著的缓解幅度和持续时间 • 第 6 周完成治疗后,反应似乎有所加深 • 2a 期研究的十二个月积极随访数据强化了先前发表在《柳叶刀神经病学 13》手稿中提交同行评审的发现;Medrxiv.org 疗效数据集的预印本包括所有每周一次完成 6 剂量疗程的 MG 患者 (n=7)。数据是平均分数改善(分数)和标准误差(浅蓝色阴影)。请注意,QOL量表没有商定的具有临床意义的疾病改善阈值;MG-ADL、MGC和QMG量表是经过验证、定量的标准化疾病严重程度仪器,是注册研究的可接受终点。
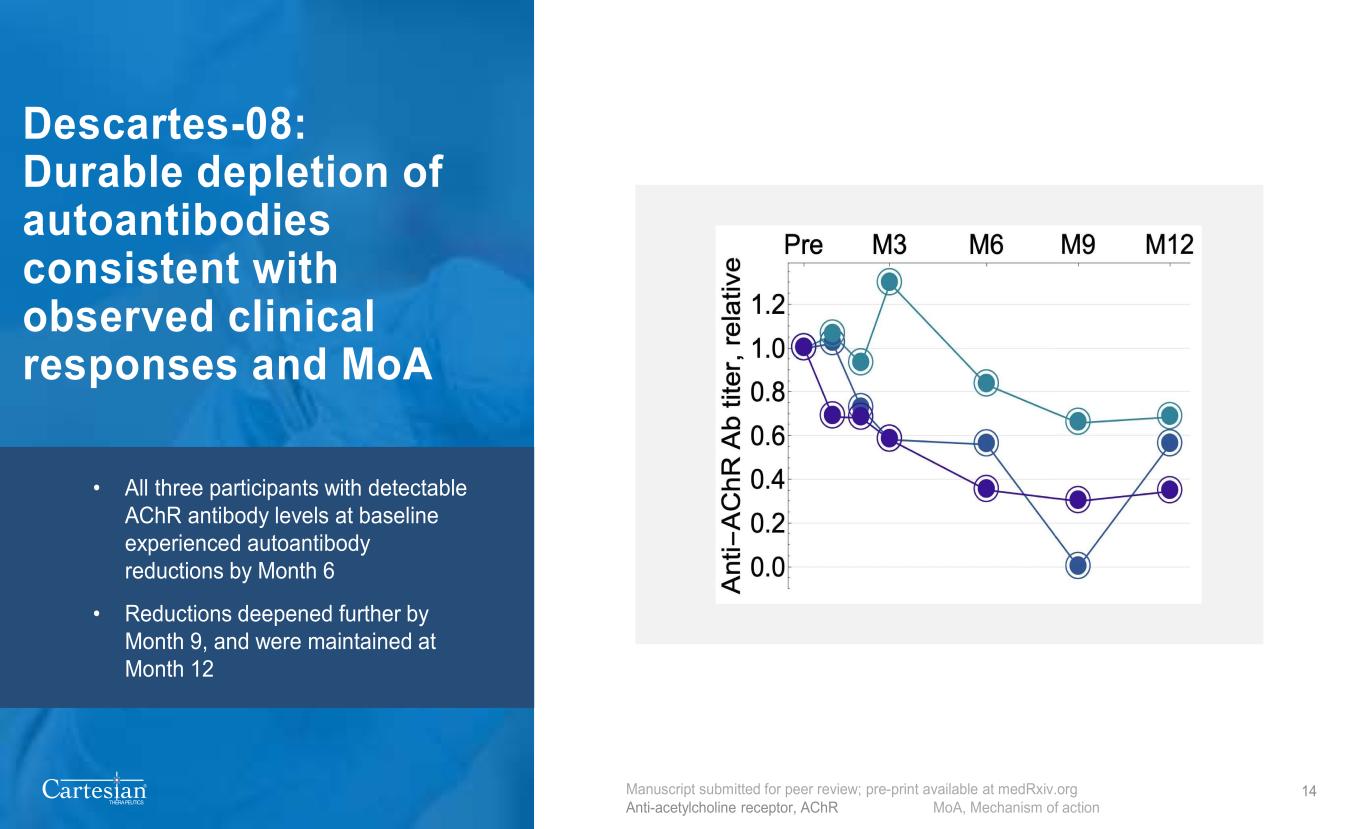
® THERAPEUTICS 14 Descartes-08:与观察到的临床反应和备忘录相一致的自身抗体持续耗尽 • 在基线时具有可检测到的 AchR 抗体水平的所有三名参与者在第 6 个月都经历了自身抗体降低 • 到第 9 个月降幅并维持在第 12 个月提交同行评审的手稿;预印本可在medrxiv.org 抗体受体、AchR MoA、作用机制上获得

® THERAPEUTICS 15 Descartes-08 再治疗导致 MG 特异性临床评分迅速下降 • 接受治疗的患者临床评分迅速改善,症状表达降至最低提交供同行评审的稿件;预印本可在Medrxiv.org上查阅

知情同意/筛查(第 -61 至 -12 天)筛查(第 -60 天至 -11 天)白细胞分离和细胞处理(第 -59 天至 -10 天)笛卡尔-08(第 1、8、15、22、29、36 天)安慰剂(第 1、8、15、22、29、36 天)随访第 57 天(± 7 天)第 85*(± 7 天)第 113 天(± 7 天)天) 第 6 个月(± 2 周)第 9 个月(± 2 周)第 12 个月(± 2 周)笛卡尔-08(交叉第 1、8、15、22、29、36 天)随访交叉第 57 天(± 7 天)交叉日 85*(± 7 天)交叉日 113(± 7 天)交叉第 6 个月(± 2 周)交叉第 9 个月(± 2 周)交叉第 9 个月(± 2 周)交叉第 9 个月(± 2 周)交叉日第 12 个月 (± 2)周) 对Descartes-08进行2b期随机、安慰剂对照、双面掩盖的研究正在进行中,预计将在2024年中期取得主要结果计划治疗约30名患者的主要终点 • 在第85天达到次要目标的MG复合应答者的比例(降低分数)•安全性和耐受性•量化笛卡尔-08在1年的临床效果•QMG,MG QoL 15R,MG ADL和 MG PIS(从基线更改为第 85 天)• 比较笛卡尔-08与安慰剂对MG量表(从基线变为第85天)对跨界患者的影响Descartes-08 16 随机分配 MG QMG、定量 MG 分数 MG QOL15R、MG 生活质量 15 次修订版 MG ADL、MG 日常生活活动 MG PIS、MG 干预后状态

探索Descartes-08在系统性红斑狼疮(SLE)中的潜力 17 • 对多达30名中度至重度多难治性系统性红斑狼疮且未受累中枢神经系统的成年人进行开放标签研究 • 旨在评估Descartes-08对系统性红斑狼疮患者的安全性、耐受性和制造可行性 • 次要目标包括系统性红斑狼疮临床活动的标准衡量标准:• 系统性红斑狼疮疾病活动指数(2000)SLEDAI-2K) • 医生全球评估 (PGA) • 系统性红斑狼疮响应者指数 (SRI) • 不列颠群岛狼疮评估小组(BILAG) 基于复合狼疮评估 (BICLA) 筛查(-60 至 -15 天)白细胞置换和细胞处理(第 -59 至 -14 天)2-3 周 Descartes-08(第 1、8、15、22、29、36 天)安全/反应评估(第 50 天)随访(第 3、6、9、12 个月)IND 批准的 2024 年上半年第 2 期研究进展顺利

探索Descartes-08在自身抗体相关自身免疫性疾病(AAAD)中的其他应用后续步骤 • 安全性和耐受性 • 量化笛卡尔 08 在 1 年内的临床效果 • QMG、MG QoL 15R、MG Composite 和 MG PIS(从基线更改为第 85 天)(从基线改为第 85 天)(从基线改为第 85 天)对跨服患者的影响(从基线改为第 85 天)从安慰剂到 Descartes-08 18 61 岁男性 DPPX 抗体阳性 AIR、结肠炎、脑炎耐受泼尼松、利妥昔单抗、硼替佐米、iViG;5/5 呈阳性疾病相关自身抗体预治疗后:视力得到临床显著的两线改善;5种自身抗体中有3种无法检测出在自身免疫性视网膜炎(AIR)患者中观察到潜在的显著笛卡尔08相关改善测试预治疗第2个月4个月 6个月视力 20/60 20/40 20/40 20/40 20/40 碳酸酐酶 II Ab +--NP* Tubulin Ab--NP* Tubulin Ab--NP* Tubulin Ab-+--NP* PKM2 Ab +--NP* Aldolase Ab + + + + NP* 烯醇酶 Ab + + + NP* *NP — 未执行 • 临床数据表明 Descartes-08 可能导致临床益处以及与疾病相关的自身抗体的消失,这表明可能存在其他自身免疫适应症 DPPX、二肽基肽酶样蛋白 6 iVIG、静脉注射免疫球蛋白
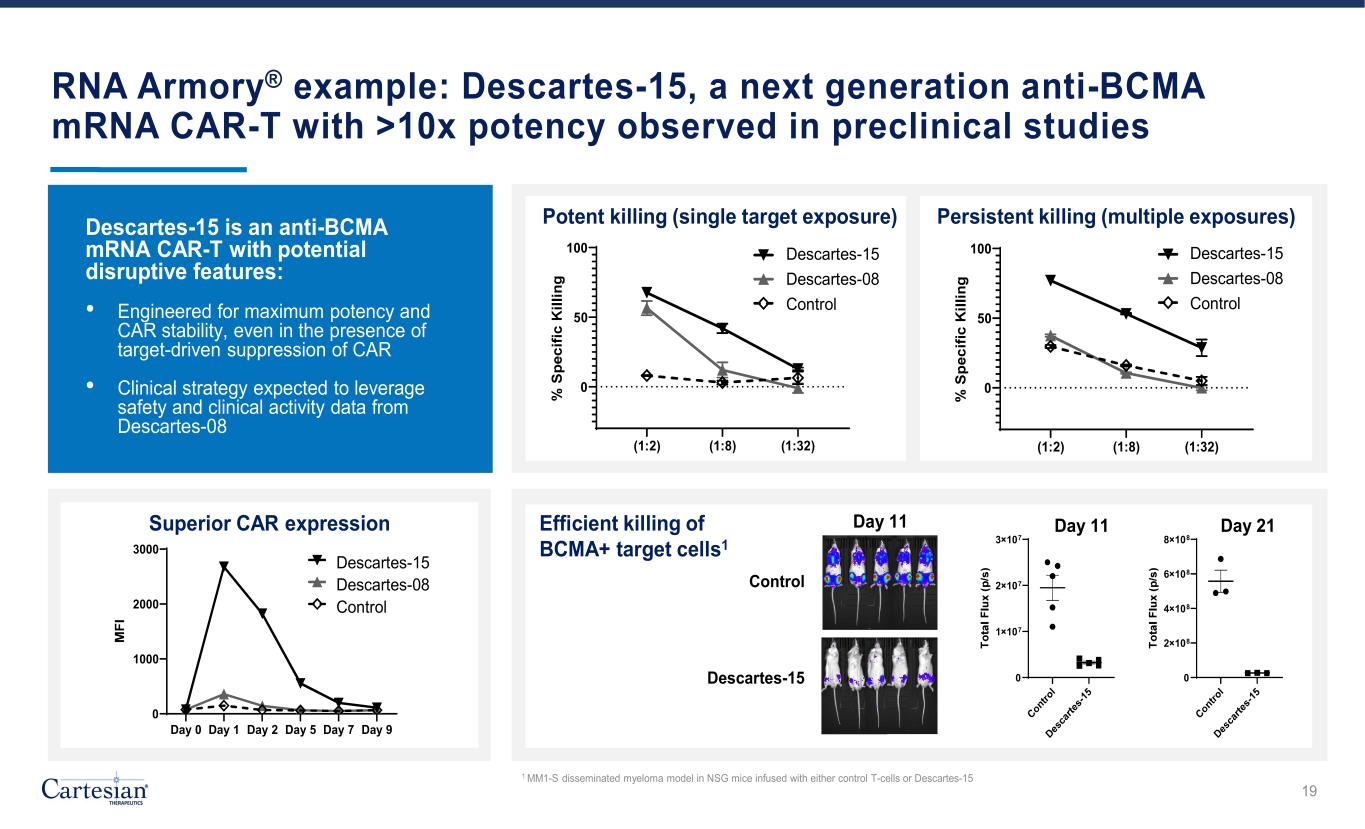
RNA Armory® 示例:Descartes-15,下一代抗 BCMA mRNA CAR-T,在临床前研究中观察到的效力超过 10 倍强效杀死(单靶暴露)(1:2) (1:8) (1:32) (1:32) (1:32) (1:32) (1:32) (1:32) (1:32) (1:32) (1:32) (1:32) (1:32) (1:32) (1:32) (1:32) (1:32) (1:32) (1:32) (1:32) (1:32) (1:32) (1:32) (1:32) (1:32) (1:32) 0 50 100 Vehicle EP escartes-08 escartes-15 Control Descartes-15 是一款反 BCMA mRNA CAR-T,具有潜在的颠覆性特征:• 即使在靶向抑制 CAR 的情况下,也能实现最大效力和汽车稳定性 • 临床 DC-15 DC-08 DC-15 DC-08该策略预计将利用来自笛卡尔 08 第 0 天第 1 天第 2 天第 5 天第 7 天 9 0 1000 2000 3000 DC-15 DC-08 车辆 EP escartes-08 escartes-15 Control Superior CAR 表情 0 2×108 4×108 6×108 8×108 第 21 天控制笛卡尔-15 0 1×107 3×107 第 11 天 21 天高效杀死 BCMA+ 细胞目标 s1 第 11 天 1 在注入对照 T 细胞或 Descartes-15 的 NSG 小鼠身上的 MM1-S 播散性骨髓瘤模型 19

® THERAPEUTICS 20 内部制造增强了对产品质量、生产计划和成本的控制 cGMP 细胞制造 ISO14644 认证的无菌设施,配备专用 QMS cGMP mRNA 合成临床级 mRNA 生产质量控制内部化验验证和批次发布 MSC 细胞库第 1271 部分,经过 FDA 审查的 HumSC 收集和储存流程开发流程通过超过 200 次 cGMP 运行进行了优化

全资内部制造:20,000 平方英尺最先进的 cGMP 设施所有权质量控制和生产时间表灵活地快速适应流程或需求的变化成本效益临床和商业制造规模能力支持管道成熟和未来增长 cGMP,目前的良好生产规范工厂位于马里兰州弗雷德里克

平台通过三种模式提供潜在的开发机会:自体、异基因和原位 22 自体 mRNA CAR-T • Descartes-08 • Descartes-15:在临床研究中观察到的效力超过 10 倍的下一代抗 BCMA mRNA CAR-T 异基因 mRNA MSC • Descartes-33 rLn:原位淋巴结转染 • 未公开的计划

成熟的管道为多种催化剂提供了潜力 23 MG Descartes-08 在 SLE Descartes-08 中添加了 Indicat 离子 Descartes-15 预计将在 2024 年中期报告第 2b 阶段数据计划在 2024 年上半年启动第二阶段计划在 2024 年下半年启动其他自身免疫适应症的篮子研究 IND 获得批准,人体第一阶段规划活动正在进行中。预计资金将支持笛卡尔的开发 08 至第 3 阶段,并推进其他项目

® THERAPEUTICS 强劲的财务状况有望支持管道完成关键里程碑

® THERAPEUTICS P I O N E E R I N G M R N A C E L L T H E R A P I E S Pipeline 旨在将细胞疗法的覆盖范围扩大到自身免疫性 M A T U R I N G P I P E L I N E W I T E X P E C T E D D E D D N E A R-T E R M C A T A T A L Y S 经过验证的牵头项目,DescartecarteS-08,预计将在年中提供第 2b 阶段的数据 C A S H R E E S O U R C E X P E C T E D T O F U N D O P E R A T I O N S I N T O 2 H 2 0 2 6 预计将在第 3 阶段支持 Descartes-08 并推进其他项目 E X P E R I E N C E D L E A D E R S H I P T E A M® THERAPEUTICS 专注于纪律严明投资并为股东和患者创造价值

® THERAPEUTICS 开创性自身免疫的 mRNA 细胞疗法 C A R T E S I A N T H E R A P E U T I A N T H E R A P E U T I C S