附录 99.1

2024 年 3 月公司演讲

重要声明和免责声明本演示文稿由InflarX
N.V.(“InflarX” 或 “公司”)编写。本演示仅供参考,不构成卖出要约或购买证券要约的邀请。
购买或出售任何证券时不得依赖本演示文稿,也不得解释为投资建议。前瞻性陈述本新闻稿包含前瞻性陈述。除历史事实陈述以外的所有陈述均为
前瞻性陈述,通常用 “可能”、“将”、“应该”、“期望”、“计划”、“预期”、“可能”、“打算”、“目标”、“项目”、“估计”、“预测”、“潜在” 或 “继续” 等术语来表示。
前瞻性陈述出现在本新闻稿的多个地方,可能包括有关我们的意图、信念、预测、展望、分析和当前预期的陈述,除其他外,涉及 COVID-19 患者和美国医院对 GOHIBIC(维洛贝利单抗)作为 COVID-19 治疗药物的接受程度以及医疗/保健机构和其他第三方组织的相关治疗建议、我们成功商业化的能力以及 GOGO的接受程度 HIBIC(维洛贝利单抗)作为治疗方法COVID-19 患者和美国医院或我们的其他候选产品的 COVID-19;我们对患者群体规模、市场
机会、承保范围和报销、GOHIBIC(维洛贝利单抗)在其批准或授权适应症或维洛贝利单抗和任何其他候选产品中的临床用途的预期,在 EUA
下以及未来获准用于商业用途的情况下美国或其他地方;我们成功实施InflarX承诺计划的能力,成功的我们未来对维洛贝利单抗治疗 COVID-19 和其他
使人衰弱或危及生命的炎症适应症(包括 PG)和任何其他候选产品(包括 INF904)的临床试验,以及此类临床结果是否会反映先前进行的临床前研究和临床
试验的结果;我们候选产品的临床前研究和临床试验的时机、进展和结果,以及关于启动和完成研究或试验及相关准备工作的时间安排、进展和结果工作,时期在
试验结果公布期间,此类试验的成本和我们的总体研发计划;我们与监管机构就临床试验结果和潜在的监管机构批准
途径进行的互动,包括我们向维洛贝利单抗提交的MAA申请和提交GOHIBIC(维洛贝利单抗)的生物制剂许可申请,以及我们获得和维持维洛贝利单抗全面监管批准的能力或 GOHIBIC
(vilobelimab)用于任何适应症;无论是 FDA、EMA 还是任何类似的适应症外国监管机构将接受或同意我们临床试验的数量、设计、规模、进行或实施,包括此类试验的任何拟议主要终点或
次要终点;我们对维洛贝利单抗任何批准适应症范围的期望;我们利用专有的抗C5a和C5ar技术发现和开发治疗
补体介导的自身免疫和炎症性疾病疗法的能力;我们保护、维持和执行我们对维洛贝利单抗和任何产品的知识产权保护其他候选产品以及此类保护的范围;我们的制造
能力和战略,包括我们制造方法和工艺的可扩展性和成本以及制造方法和工艺的优化,以及我们继续依赖现有第三方
制造商的能力,以及我们聘请更多第三方制造商参与我们计划的未来临床试验、维洛贝利单抗和成品GOHIBIC(vilobelimab)的商业供应的能力;我们对开支的估计,
持续亏损、未来收入、资本要求以及我们对额外融资的需求或获得额外融资的能力;我们对因在临床测试候选产品或
任何商业销售获得批准而产生的责任索赔进行辩护的能力;如果我们的任何候选产品获得监管部门的批准,我们遵守和履行持续义务和持续监管概览的能力;我们遵守寻求上市批准和商业化的
颁布和未来立法的能力;我们的未来成长和能力竞争,这取决于我们留住关键人员和招聘更多合格人员;我们的竞争地位,以及我们在开发C5a和C5ar抑制剂或我们的行业方面与竞争对手相关的发展和
预测;以及我们向美国证券交易委员会提交的定期文件中 “风险因素” 标题下描述的风险、不确定性和其他因素。这些
声明仅代表截至本新闻稿发布之日,涉及已知和未知的风险、不确定性和其他重要因素,这些因素可能导致我们的实际业绩、业绩或成就与前瞻性陈述所表达或暗示的任何未来
业绩、业绩或成就存在重大差异。鉴于这些风险、不确定性和其他因素,您不应过分依赖这些前瞻性陈述,除非法律要求,否则即使将来有新的信息,我们也没有
义务更新这些前瞻性陈述。

重要声明和免责声明信息和来源本演示文稿中包含的某些信息
涉及或基于从第三方来源获得的研究、出版物、调查和其他数据以及InflarX自己的内部估计和研究。尽管InflarX认为截至本演示之日,这些第三方来源
是可靠的,但它尚未独立核实,也没有对从第三方来源获得的任何信息的充分性、公平性、准确性或完整性做出任何陈述。此外,本演示文稿中包含的所有
市场数据都涉及许多假设和局限性,无法保证此类假设的准确性或可靠性。此外,尽管我们认为自己的内部研究是可靠的,但
此类研究尚未得到任何独立来源的证实。Avacopan 数据我们尚未在临床试验中对 Avacopan 与 INF904 进行正面比较,但已将公布的 Avacopan 数据与我们 INF904 1 期临床试验的数据进行了比较。为了进行临床前研究(仓鼠中性粒细胞减少症研究),我们合成了Avacopan并进行了并排比较。尽管我们认为这种与 Avacopan 的比较是有用和恰当的,但本演示文稿中此项比较以及与 Avacopan 的其他比较的
值可能有限,因为它们并非来自正面交锋试验,而是来自根据不同协议在不同地点和
不同时间进行的试验。如果没有正面交锋的数据,我们无法对 INF904 和 Avacopan 做出比较主张。关于InflarX InflarX GmbH(德国)和InflarX Pharmicals Inc.(美国)是InflarX N.V.
(合称 “InflarX”)的全资子公司。InflarX(纳斯达克股票代码:IFRX)是一家生物技术公司,通过应用其专有的抗C5a和抗C5ar技术来发现、开发和商业化补体激活因子C5a及其受体C5ar的同类首创、强效的
和特异性抑制剂。C5a 是一种强大的炎症介质,参与各种炎症性疾病的进展。InflarX 的主要候选产品
vilobelimab 是一种新型的、静脉注射的、同类首创的抗 C5a 单克隆抗体,可选择性地与游离 C5a 结合,并在
不同适应症的多项临床研究中显示出改善疾病的临床活性和耐受性。InflarX成立于2007年,该集团在德国耶拿和慕尼黑以及美国密歇根州安娜堡设有办事处和子公司。欲了解更多信息,请访问 www.inflarx.com。

利用 C5a/C5AR 控制 I&I 空间中的炎症 inflarX
亮点独特的靶向补体 c5a/C5AR,这是一种经过验证的机制和炎症级联的关键部分,包括:同类首创的高效抗 C5a 单克隆抗体(维洛贝利单抗 + 第二代 IFX-2)同类最佳
潜在口服 C5ar 抑制剂 INF904:解决上市比较物的局限性(在I期研究中,血浆PK分布和抑制潜力有明显区别)药物管道中有可能进军多个大型市场免疫皮肤病学和更广泛的 I&I 有针对性的开发重点是免疫皮肤病学,InflarX 可以推动更大市场的管道价值,拥有强大的核心知识产权和医疗用途知识产权覆盖范围 Vilobelimab 正处于 PG
的后期开发阶段,由于美国或欧洲尚未获得批准的药物 INF904,无法在科罗拉多州立大学和美国的大型市场显示出药物研发潜力;预计将于 2024 年开始二期开发大幅上行空间具有合作选择的专有药物的I&I中可能出现其他
适应症强劲的平衡拥有足够的现金来资助运营至少 2026 年,并推进项目以实现下一个里程碑科罗拉多州立大学
在取得临床和监管成功方面有良好往绩的团队 [慢性自发性荨麻疹。HS [化脓性汗腺炎]。PG [坏疽性脓皮病]。I&I [炎症和免疫学]。第 4 页

免疫皮肤病学领域的重大机遇第 5 页有可能瞄准几个
具有吸引力的、价值超过十亿美元的商业市场 inflarX 已经确定了 INF904 可以有力满足的未满足的医疗需求。基于作用机制、临床前和临床数据,C5a/C5AR 发挥作用的有力理由确立了
终点,具有 INF904 可能获得临床优势并被证明是差异化竞争对手 INF904 是一种没有已知安全隐患的口服药物,潜在的广泛治疗指数作为 C5ar 拮抗剂,INF904在差异化途径上起作用,免疫皮肤病领域目前任何其他治疗方法都无法解决的 MoA 建立了专家网络和内部试验专业知识对某些免疫皮肤病中 c5ar 抑制的强大知识产权覆盖率为何选择免疫皮肤病学
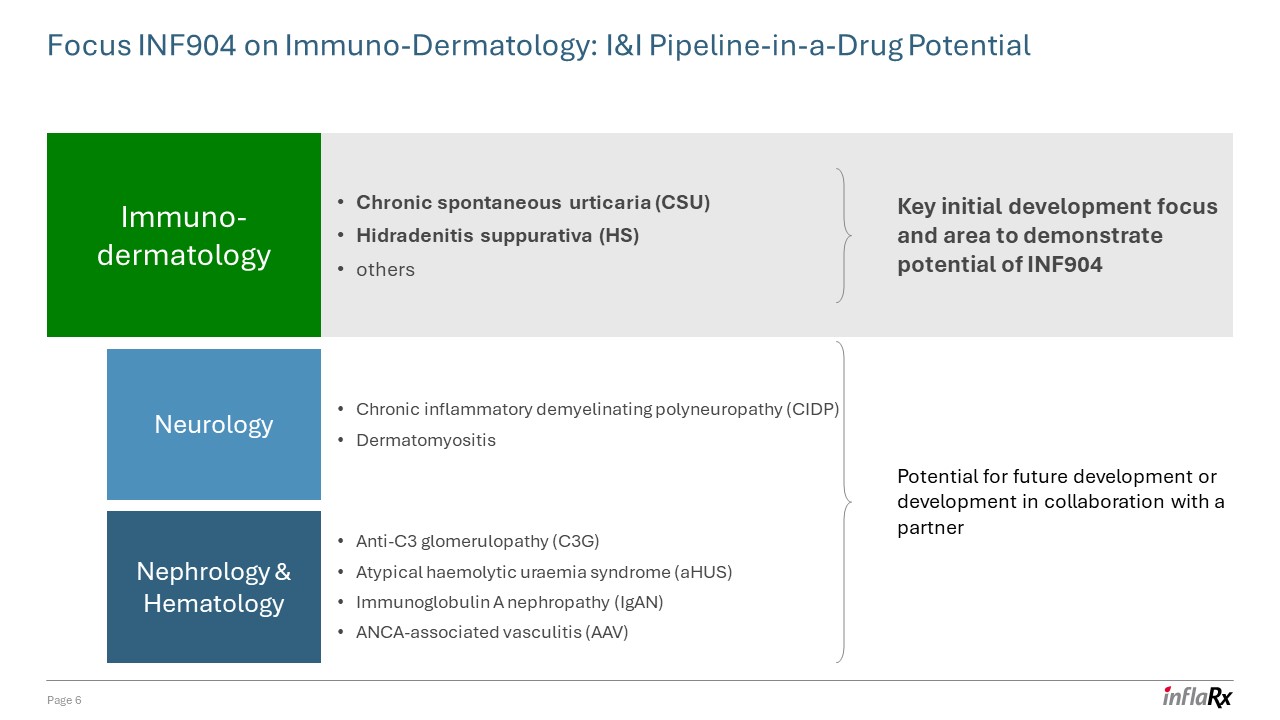
展示了
INF904 潜力的关键初步开发重点和领域与合作伙伴合作进行未来开发或开发的潜力免疫皮肤病学神经病学肾脏病学和血液学慢性自发性荨麻疹 (CSU) 化脓性汗腺炎 (HS) 其他慢性
炎性脱髓鞘性多发性神经病 (CIDP) 皮肤肌炎抗 C3 肾小球病 (C3G) 非典型性溶血性尿毒血症综合征 (AHU) 免疫球蛋白 A 肾病 (IGaN) ANCA 相关血管炎 (AAV) 第 6 页关注 INF904 关注
免疫皮肤病学:I&I Pipeline-in-a-in-A-药物潜力
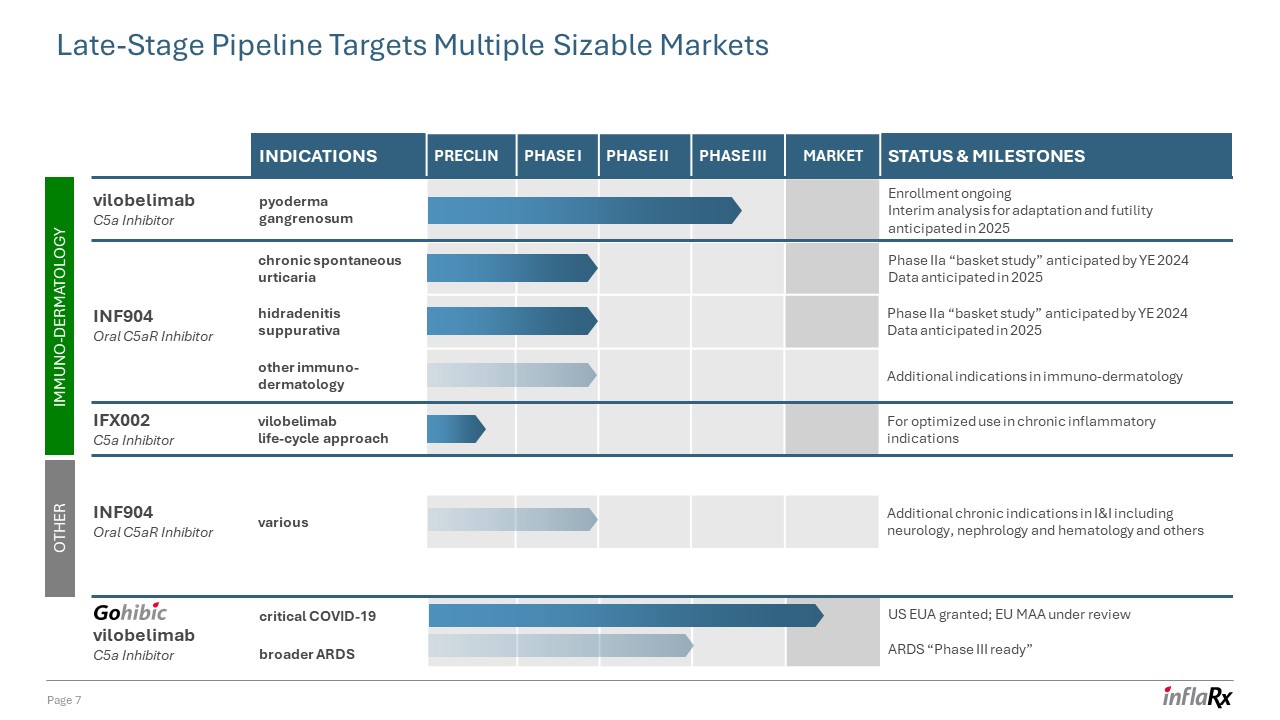
第 7 页后期产品线瞄准多个规模庞大的市场 vilobelimab C5a
抑制剂 IFX002 C5a 抑制剂 INF904 口服 C5ar 抑制剂免疫皮肤病学 vilobelimab C5a 抑制剂其他 INF904 口服 C5ar 抑制剂慢性自发性荨麻疹在 2024 年之前的 IIa 期 “篮子研究” 数据
预计在 2025 年适应症 preclin I 期二期三期市场现状和里程碑坏疽性脓皮病注册正在进行中期分析预计将在2025年对适应性和无效性进行关键 COVID-19 更广泛
ARDS 美国欧盟获得批准;欧盟 MAA 在综述 ARDS 化脓性汗腺炎 “III 期就绪” IIa 期 “篮子研究” 预计于 2025 年发布数据其他免疫皮肤病学其他适应症
免疫皮肤病学其他适应症 vilobelimab 生命周期方法用于优化慢性炎症适应症的各种其他慢性适应症,包括神经病学、肾脏病学和血液学等
维洛贝利单抗 [C5a 单克隆抗体]INF904 [口服 C5ar 抑制剂]c5a/c5ar:炎症级联中的一个
战略地位
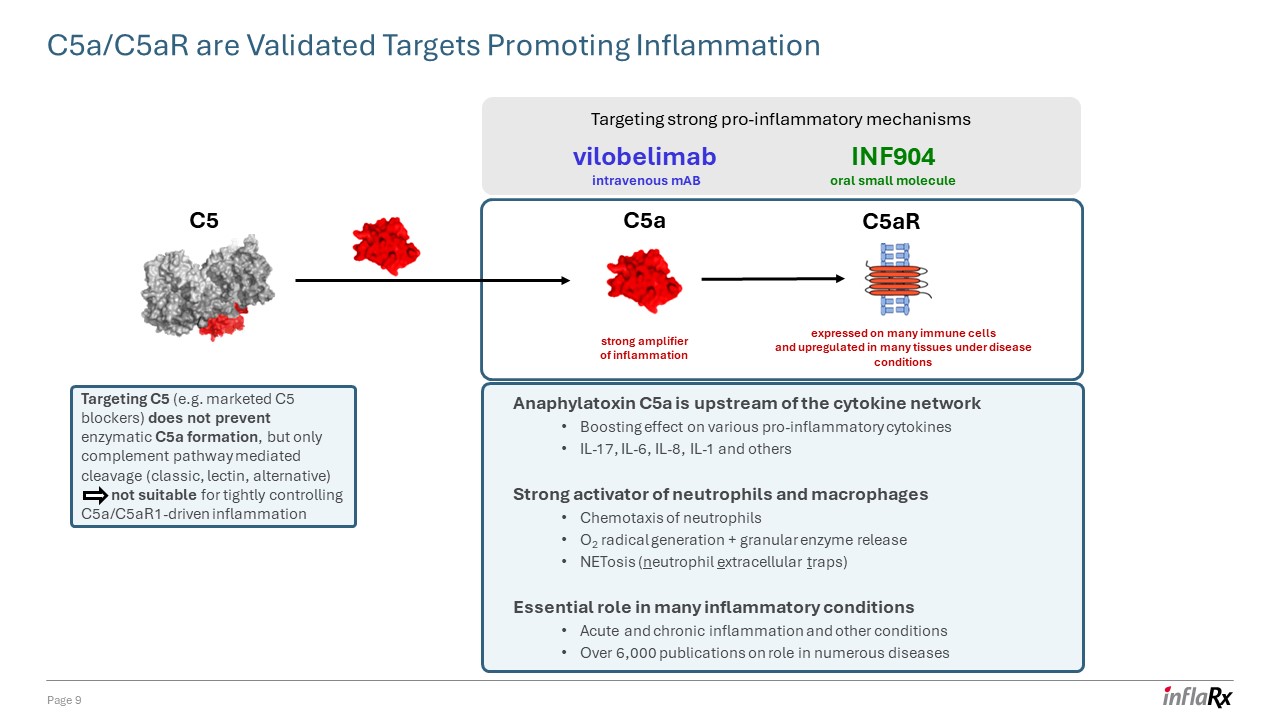
过敏毒素 C5a 是细胞因子网络的上游对各种
促炎细胞因子 IL-17、IL-6、IL-8、IL-1 等的增强作用中性粒细胞和巨噬细胞的强效激活剂 O2 自由基生成 + 颗粒酶释放 netosis(中性粒细胞外陷阱)在许多炎症性疾病中必不可少的
作用急性和慢性炎症和其他病症 6,000 多篇关于在多种疾病中的作用的出版物 c5a/c5ar 是经过验证的促进炎症的靶标第 9 页 c5a
炎症的强放大器 C5aR 在许多免疫细胞上表达,在疾病条件下在许多组织中上调。靶向强大的促炎机制 vilobelimab 静脉注射 mAb INF904 口服小分子靶向 C5(例如上市的 C5 阻滞剂)不能阻止 C5a 的形成,只能阻断补体途径介导的裂解(经典、凝集素、替代品)不适合严格控制 C5A/C5AR1 驱动的炎症 C5

维洛贝利单抗治疗溃疡性坏疽性脓皮病 (PG)
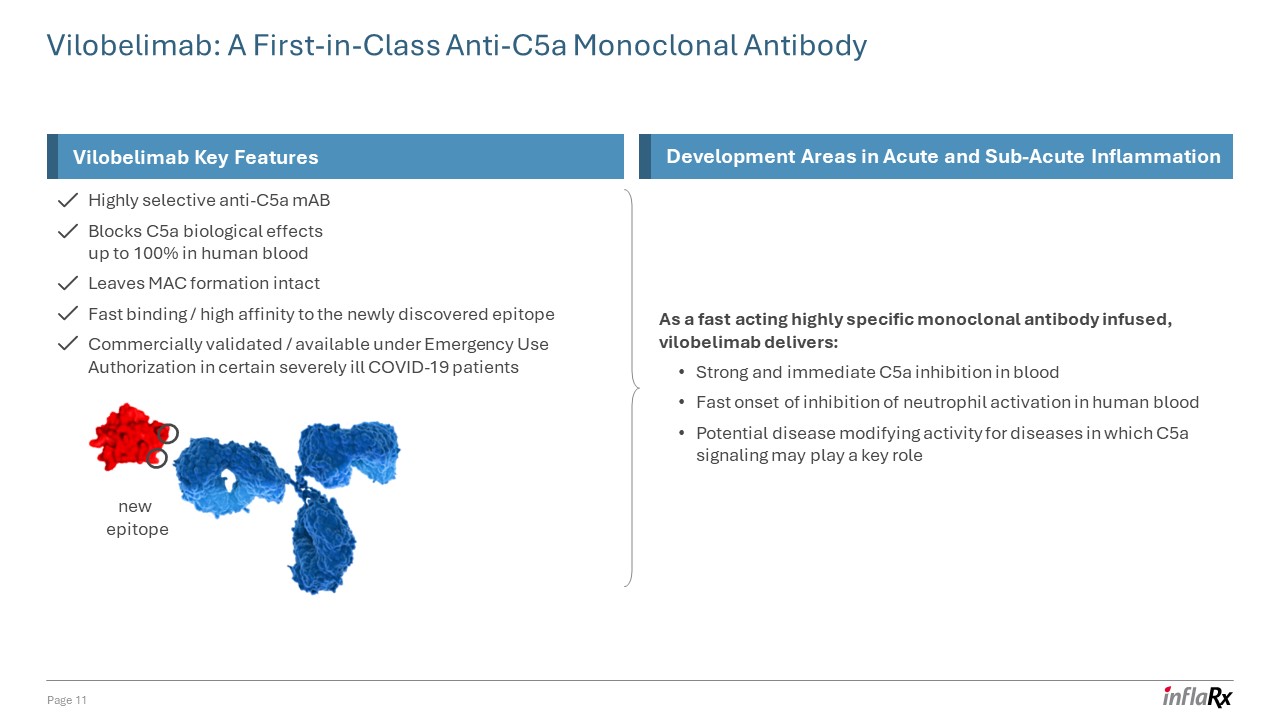
高选择性抗 C5a 单抗可阻断人体
血液中高达 100% 的 C5a 生物学效应 MAC 形成完好无损与新发现的表位快速结合/高度亲和力经商业验证/在紧急使用授权下可用于某些重症 COVID-19 患者 Vilobelimab:同类首创
抗 C5a 单克隆抗体第 11 页新表位维洛贝利单抗急性和亚急性关键特征开发领域炎症作为一种注入速效的高特异性单克隆抗体,维洛贝利单抗可提供:强效而即时的 C5a
血液中的抑制作用快速开始抑制人体血液中中性粒细胞的激活 C5a 信号传导可能起关键作用的疾病的潜在疾病改变活性

PG:未满足需求量高的自身免疫性疾病第 12 页 PG 概述和未满足的
需求临床特征 PG 是一种罕见但可能危及生命的皮肤疾病,可导致慢性、难以治疗的伤口患者经常患有其他自身免疫性疾病,例如溃疡性结肠炎、类风湿关节炎
和血液系统疾病患者疼痛严重、愈合时间长、频繁复发发病率和市场潜力罕见——估计美国和欧洲有多达 50,000 名患者受到影响。巨大的市场潜力
— 根据已进行的市场研究预计溢价当前的治疗和医疗需求美国或欧盟目前未批准任何药物对于不太严重的病例,可以使用局部或病变内治疗,包括局部使用类固醇在进展迅速的病例中使用
的全身免疫抑制疗效报告不一;经常出现治疗持续时间长和复发情况使用维洛贝利单抗治疗的有力理由:PG 与中性粒细胞皮肤有关
浸润受影响区域和病变,可能由 C5a 触发

PG 伤口液中的 C5a 水平与 netosis 相关 PG 的病因
被认为与免疫系统失调,特别是中性粒细胞功能改变有关。有证据表明,补体激活和 C5a 在疾病发展中起着重要作用:
PG 患者伤口液中检测到高 C5a 水平 C5a 水平与伤口液中的弹性蛋白酶水平密切相关,a Netosis 标记 c5a/C5ar 轴激活可能是 PG C5a 中神经毒的关键驱动因素在控制中性粒细胞
PG 发病机制中诱发神经毒症:C5a/C5ar 轴的潜在作用 Page 13 Con c5a(20 nM;1 小时)细胞外 DNA 染色 Wang 等人 2024。J 投资 Derm. 144;TW = 创伤伤口

PG IIa 期无安全性或耐受性问题,药物剂量依赖性
活性第 14 页临床反应高剂量组的靶溃疡闭合率和临床缓解率最高(86%)在治疗结束时或最后一次给药当天的 17 名患者中,有 9 名患者报告了临床缓解 (PGA
≤ 1) 的临床缓解 (PGA
≤ 1),另外 1 名患者报告的临床反应 (PGA ≤ 3)) 7 名患者报告略有改善 (PGA = 4) (41%) 安全性未观察到输液相关反应对于 2 名患者,相关的 SAE 为
报告丹毒导致住院(申办方认为无关联)延迟超敏反应导致皮疹观察到的AE分布与患者的基础疾病相一致未检测到剂量相关不良反应III期
已启动基于FDA孤儿药的反馈和快速跟踪状态美国食品药品管理局孤儿药状态 EMA
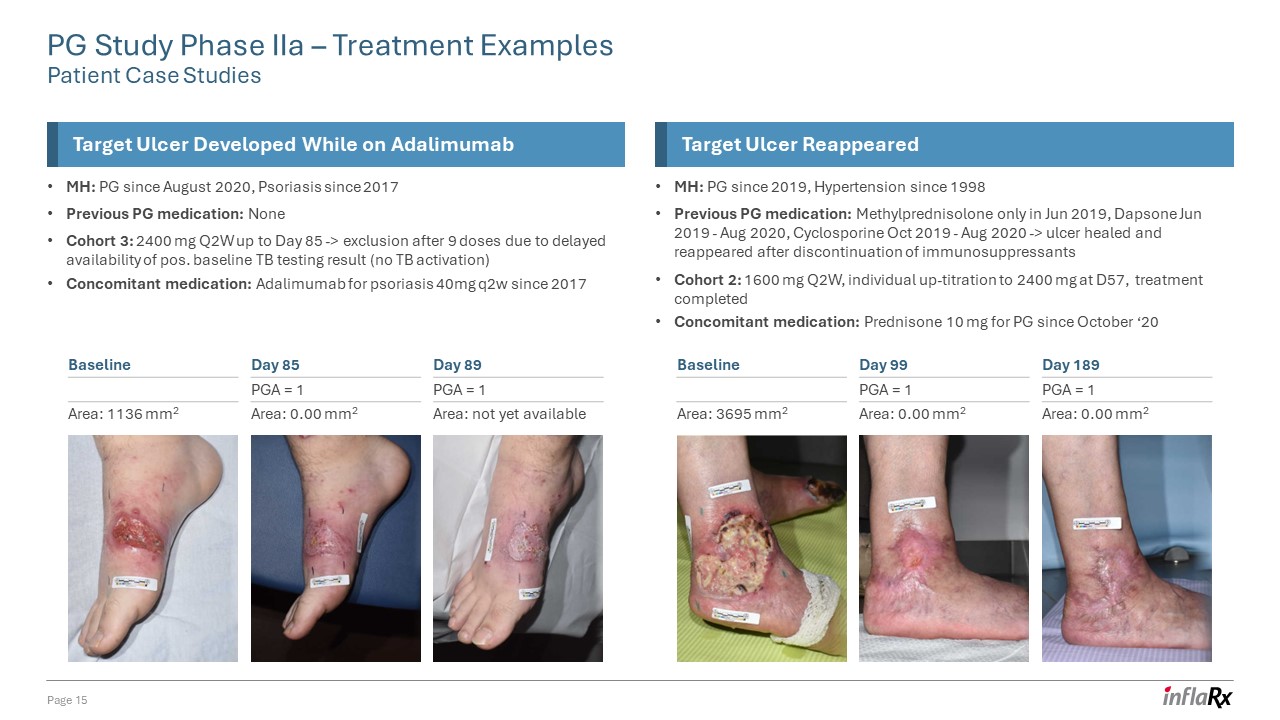
PG 研究 IIa 期 — 治疗示例患者案例研究第 15 页目标
溃疡在服用阿达木单抗时出现的溃疡 MH:PG 自 2020 年 8 月起,牛皮癣之前的 PG 药物:无队列 3:2400 mg Q2W 至第 85 天-> 由于基线结核检测结果延迟出现
(未激活结核)伴随药物:阿达木单抗用于 85 天-> 由于基线结核检测结果延迟可用,9 剂后被排除在外(未激活结核病)伴随药物:阿达木单抗用于银屑病 40mg q2w 自 2017 年起目标溃疡再次出现 MH:PG 自 2019 年起,高血压自 1998 年起先前的 PG 药物:甲基泼尼松龙仅在 2019 年 6 月,氨苯砜 2019 年 6 月至 2020 年 8 月,环孢素 2019 年 10 月至 2020 年 8 月-> 停用免疫抑制剂后溃疡愈合并再次出现队列 2:1600 mg Q2W,个人在 D57 时向上滴定至 2400 mg,治疗完成伴随用药:自20年10月起用于PG的泼尼松 10 mg 第 89 天 PGA = 1 区域:尚未上市基准面积:1136 mm2 天 85 PGA = 1 区域:mm2 第 189 天 PGA = 1 区域:0.00 mm2 基准面积:3695 mm2 第 99 天 PGA = 1 区域:0.00 mm2

PG III 期研究设计:预计于 2025 年进行中期分析第 16 页治疗:
26 周随访:12 周安全随访泼尼松逐渐减少泼尼松逐渐减少随机化 vilobelimab 2400 mg Q2W(13 剂量)EOT(W 26)安全随访患者水平停止标准进展(任何时间)或
在规定的时间点没有改善 22 20 18 16 14 12 10 0 2 4 6 8 安慰剂 Q2W(13 剂量)24 周剂量 26 Arm 1 Arm 2 Arm 2 n 大约 = 15 n 大约 = 15 n 中期分析*设定大小调整或
徒劳的规则总数患者将在 50 — 100 之间进行调整** 主要终点:完全闭合目标溃疡自适应设计 * 除独立数据安全监测委员会外均为失明 /**盲中期分析筛查后
随机分组比率调整为 2:1(Arm 1 至组 2)
INF904:具有一流潜力的口服高选择性 C5ar 抑制剂
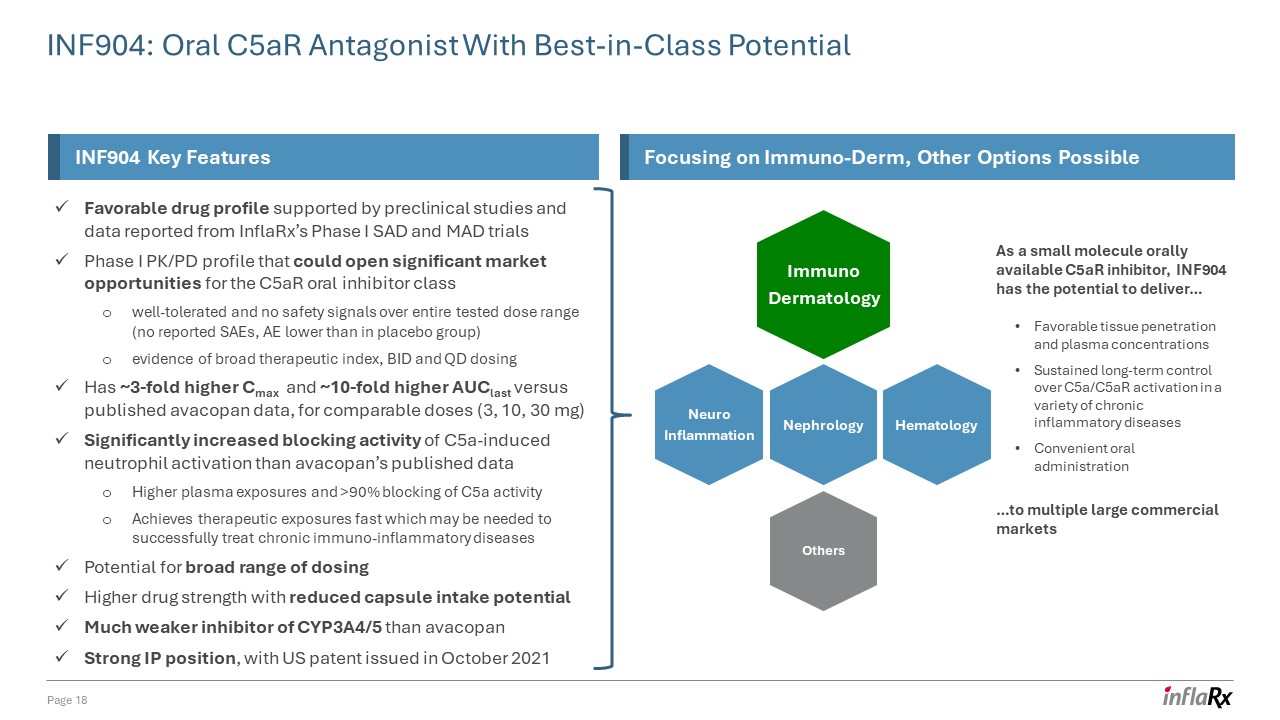
INF904:具有一流潜力的口服 C5AR 拮抗剂第 18 页 INF904 关键
特征重点关注免疫皮肤,其他选择可能的临床前研究和 InflarX I 期 SAD 和 MAD 试验 I 期 PK/PD 概况报告的数据支持了良好的药物特征,这可能会为耐受性良好、在整个测试剂量范围内没有安全信号的 C5ar 口服抑制剂类别开辟巨大的市场机会(未报告 SAE),AE 低于安慰剂组)有广泛的治疗指数、BID 和 QD 剂量高出约 3 倍
Cmax 和 ~相似剂量(3、10、30 mg),AucLast 与已公布的 avacopan 数据相比高 10 倍,C5A 诱导的中性粒细胞激活的阻断活性比 avacopan 公布的数据显著增加血浆暴露量和
> 90% 阻断 C5a 活性快速获得成功治疗慢性免疫炎症性疾病可能需要的治疗暴露范围广泛的可能性减少胶囊摄入量更高的药物强度
潜在的CYP3A4/5抑制剂比avacopan强劲的知识产权地位弱得多, 美国专利于2021 年 10 月免疫皮肤科神经炎症其他肾脏病血液学作为一种小分子口服可用的 C5aR
抑制剂,INF904 有可能提供... 良好的组织穿透力和血浆浓度持续长期控制各种慢性炎性疾病中的 C5a/C5ar 激活便捷的口服给药... 到
多个大型商业市场
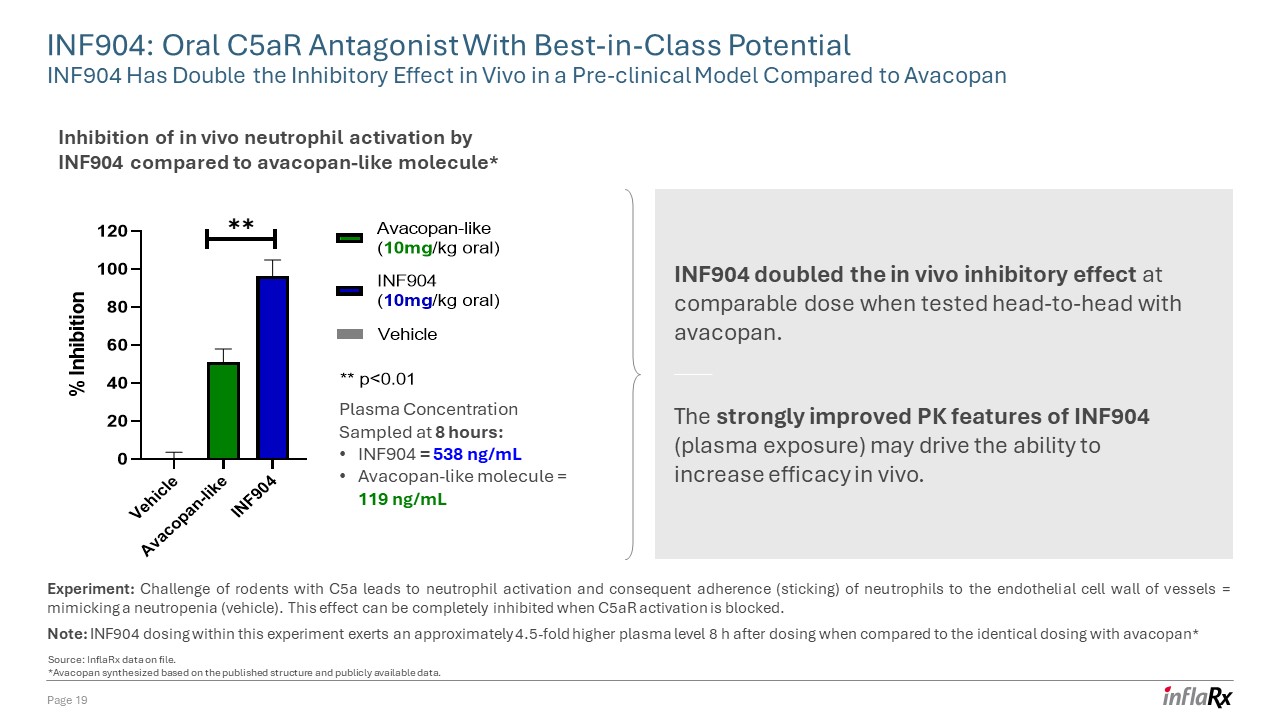
INF904:具有一流潜力的口服 C5ar 拮抗剂 INF904 在临床前模型中的体内抑制作用是 Avacopan 的两倍第 19 页与 avacopan 样分子相比 INF904 抑制体内中性粒细胞激活* 实验:使用 C5a 的啮齿类动物挑战会激活中性粒细胞
,进而导致中性粒细胞粘附(粘连)到血管内皮细胞壁=模仿中性粒细胞减少症(载体)。当阻止 C5ar 激活时,此效果可以完全抑制。注意:与 8 小时采样的相同剂量相比,本实验中的 INF904 剂量
在给药 8 小时后施加的血浆水平高出大约 4.5 倍* 血浆浓度:INF904 = 538 ng/mL Avacopan 样分子 = 119 ng/mL INF904 在与阿瓦可潘正面交锋测试时,在同等剂量下,
的体内抑制效果翻了一番。INF904(血浆暴露)PK特征的显著改善可能会推动提高体内疗效的能力。来源:存档的 InflarX 数据。*Avacopan
根据已发布的结构和公开的数据合成。
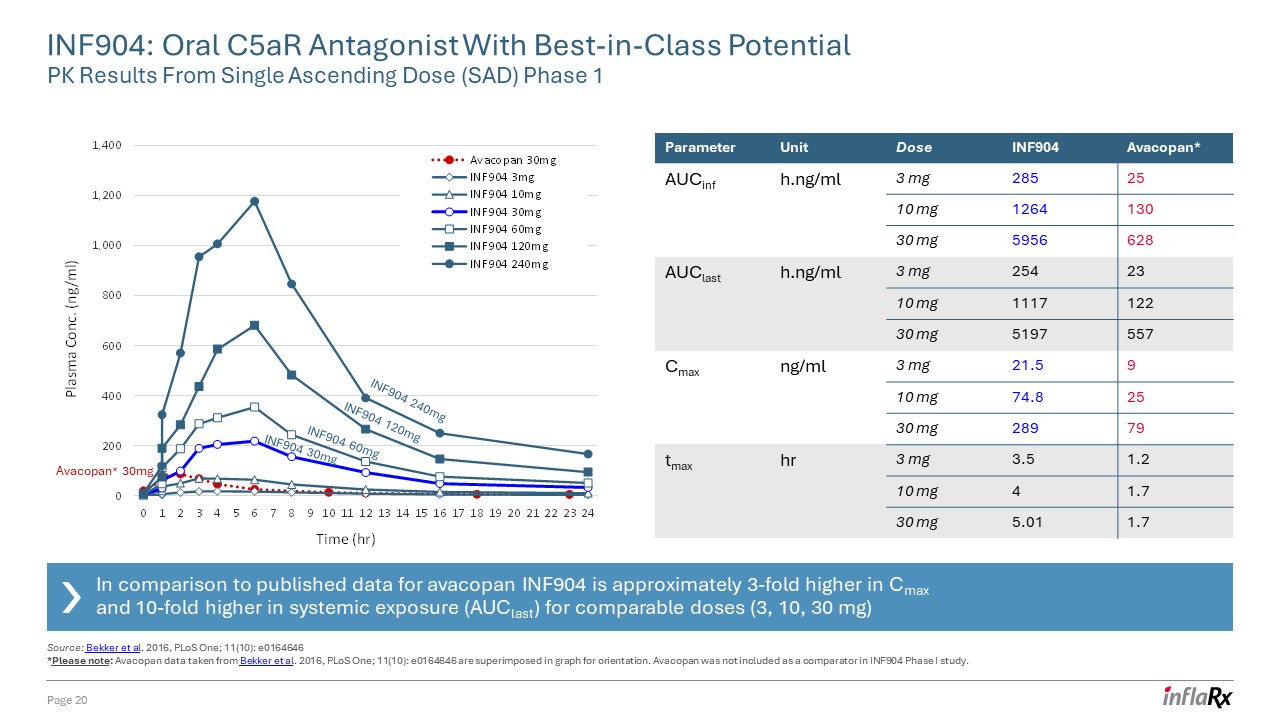
INF904:单一
升序剂量 (SAD) 第 1 阶段 1 页 20 参数单位剂量 INF904 Avacopan* aucinF h.ng/ml 3 mg 285 25 10 mg 1264 130 30 mg 5956 628 aucLast h.ng/ml 3 mg 254 23 10 mg 1117 122 30 mg 5197 557 cmax ng/ml 3 mg 5197 cmax ng/ml 3 mg 595 628 auclast h.ng/ml 3 mg 254 23 10 mg 1117 122 30 mg 5197 557 cmax ng/ml 3 mg 5197 557 cmax ng/ml 3 mg 591.5 9 10 mg 74.8 25 30 mg 289 79 tmax hr 3 mg 3.5 1.2 10 mg 4 1.7 30 mg 5.01 1.7 INF904 240mg INF904 60mg INF904 30mg INF904 120mg Avacopan* 30mg INF904 240mg INF904 60mg INF904 30mg INF904 120mg 来源:Bekker
等人 2016,PloS One;11 (10):e0164646 *请注意:Avacopan取自 Bekker 等人 2016 年,PLoS One;11 (10): e0164646 的数据叠加在图表中以确定方向。INF904 I 期研究中未将阿瓦可潘列为比较物。
与已公布的 avacopan 数据相比,在可比剂量(3、10、30 mg)下,INF904 的 Cmax 值高出大约 3 倍,全身暴露 (AucLast) 高出 10 倍
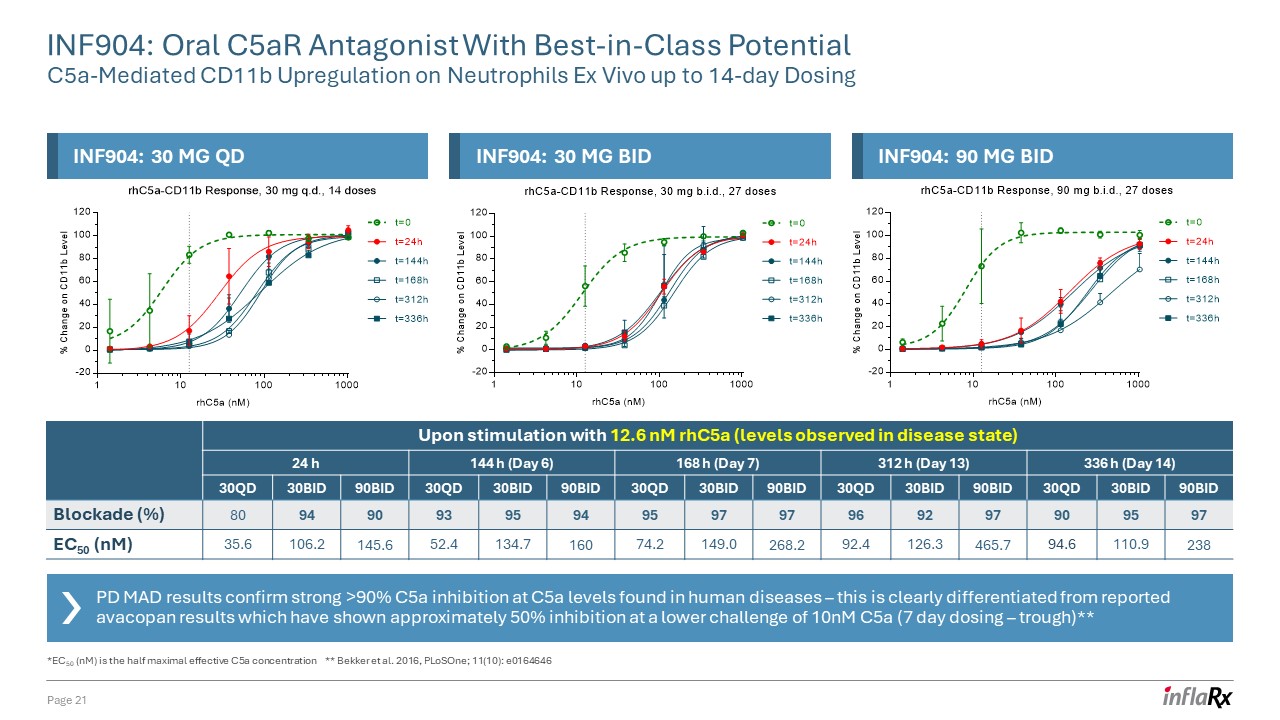
PD MAD 结果证实,在人类
疾病中发现的 C5a 水平下,C5a 的抑制力超过 90% ——这与报告的阿瓦可潘结果有明显区别,后者显示,在 10nM C5a(7 天给药 — 低谷)的较低挑战下,抑制率约为 50% ** 在使用 12.6 nM rHC5a(疾病
状态观察到的水平)刺激后 24 h 144 h(第 6 天)168 h (第 7 天) 312 小时(第 13 天)336 小时(第 14 天)c5a (nM) 30QD 30BID 90BID 30QD 30BID 90BID 30QD 30BID 90BID 30QD 30BID 90BID 30BID 90BID 30BID 30BID 90BID 30BID 90BID 30BID 90BID 30BID 90BID 30BID 90BID 30BID 30BID 90BID 30BID 90BID 30BID 30BID 90BID 30BID 90BID 30BID 30BID 90BID 30BID 30BID 90BID 30BID 30BID 90BID 30BID 30BID 90BID 30BID 30BID 90106.2 145.6 52.4 134.7 160 74.2 149.0 268.2 92.4 126.3 465.7 94.6 110.9 238 INF904:口服 c5ar 拮抗剂,具有一流潜力 C5A 介导的 CD11b
对体外中性粒细胞的上调剂量长达 14 天第 21 页 *EC50 (nM) 是半最大有效 C5a 浓度 ** Bekker 等人. 2016,plosOne;11 (10):e0164646 INF904:30 mg QD INF904:30 mg BID INF904:90 mg BID:90 mg BID

第 22 页投资 INF904 开发第 IIa 期预计将于 EOY
2024 年开始 IIa 初始阶段 — 展示了 INF904 开放标签 PK/PD “篮子研究” 的初始疗效信号 CSU 和 HS 的 4 周治疗期初始疗效信号 CSU 和 HS 已确定
终点计划对至少 3 种不同剂量进行安全和 PK/PD 评估预期催化剂 IIa 期将于 2024 年 EOY 阶段开始预计将在2025年发布IiA数据更大规模和更长期的IIb期研究预计将于2025年开始

用于慢性自发性荨麻疹 (CSU) 的 INF904

在科罗拉多州立大学 C5ar 信号传导中开发 INF904 的有力理由以独立于 IgE 的方式参与
组胺释放。越来越多的科学证据表明,C5ar 信号传导以独立于 IgE 的方式参与科罗拉多州立大学肥大细胞和嗜碱性粒细胞的组胺释放。这种机制可能对科罗拉多州立大学中描述的两种内型发挥
重要作用:I 型(IgE 介导)和 IiB 型(IgG 自身抗体介导)尽管目前有抗组胺和抗 IgE 疗法等治疗选择,但估计这些患者中大约 30-60% *仍无反应或无症状。对于那些目前疗法得不到充分治疗的人来说,INF904 可能是一种便捷的口服治疗选择。据估计,到2032年,科罗拉多州立大学的市场潜力将超过30亿美元** * Metz 等
al,Clin Rev Allerny Immunol。2020 年;59 (1):38—45。** GlobalData 和 Leerink 分析师报告第 24 页

慢性自发性荨麻疹 (CSU) CSU 概述和未满足的需求临床
的特点是一种免疫介导的慢性炎症性皮肤病,其炎症级联失调使患者容易出现症状发展:荨麻疹/轮状体虚弱且剧烈瘙痒超过 6 周,通常
与血管性水肿相关疾病负担很高,会影响睡眠、心理健康、生活质量和生产力学校和工作中的并发症包括特应性疾病、抑郁症、自身免疫和甲状腺
疾病流行病学估计患病率约为普通人群的1%,其中20%的人群出现症状超过5年,20至40岁的受影响最大,女性受影响的人数是男性的2倍当前
治疗和医疗需求第二代抗组胺药等疗法对大量患者无效抗Ig-E疗法和免疫抑制剂等选项也不能充分为科罗拉多州立大学人群提供服务 Page
25
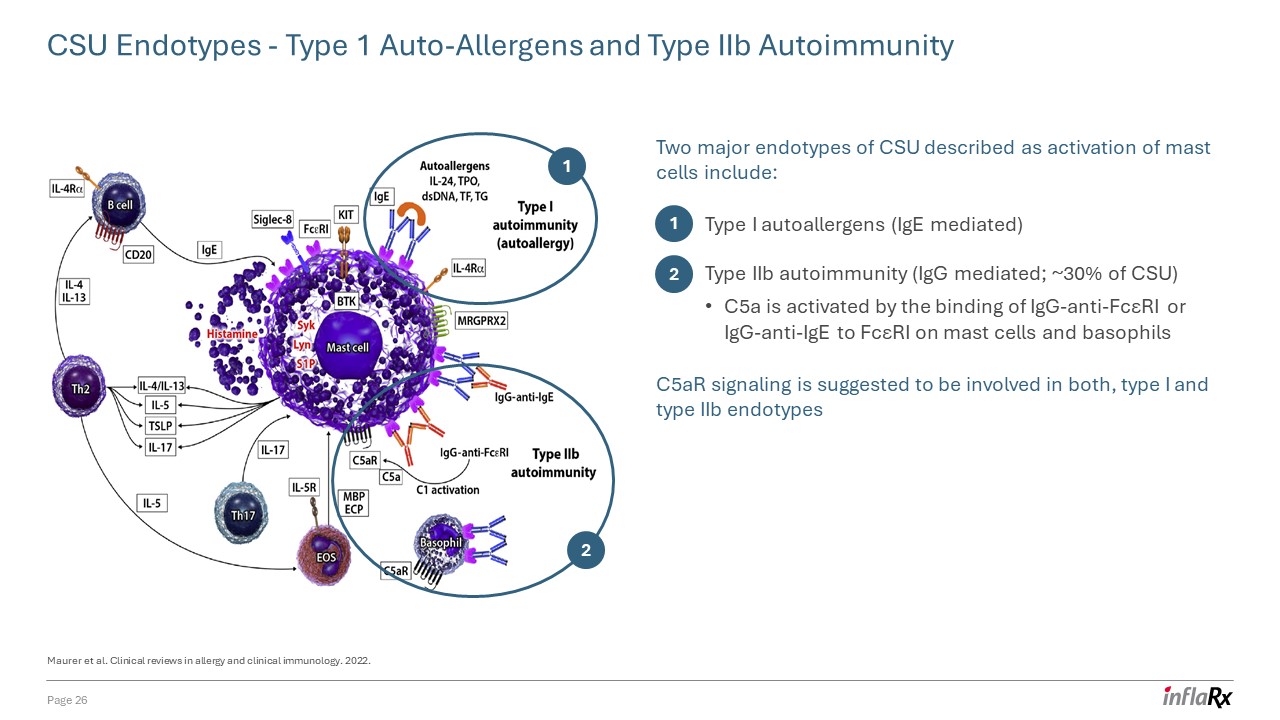
科罗拉多州立大学内型——1 型自身过敏原和 IIb 型自身免疫被描述为肥大细胞激活的科罗拉多州立大学的两种主要
内型包括:Maurer 等人。过敏和临床免疫学临床综述。2022. 1 2 I 型自身过敏原(IgE 介导)IiB 型自身免疫(IgG 介导;约 30% 的 CSU)C5a 被
通过肥大细胞上的 Igg-Anti-FCRe或 IgG-Anti-IgE 与 FcμRI 结合来激活,嗜碱性粒细胞 C5ar 信号传导同时参与 I 型和 IIb 型内型 1 2 第 26 页
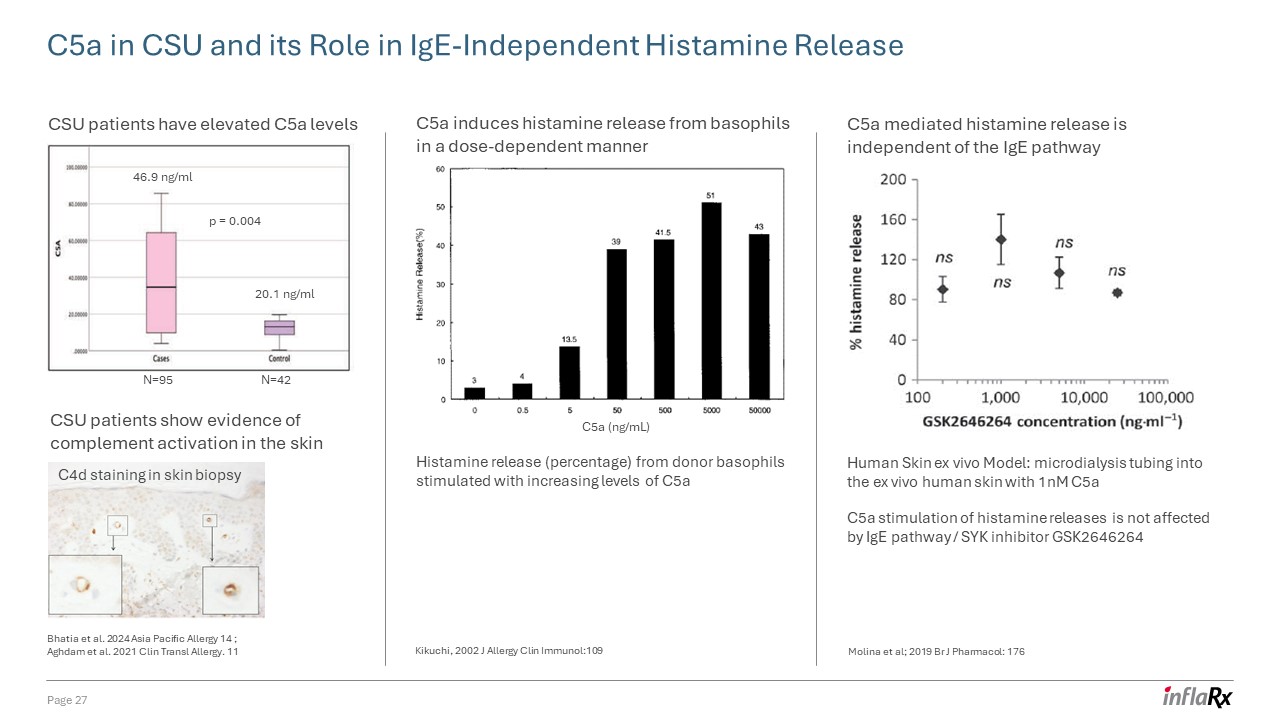
科罗拉多州立大学中的 C5a 及其在不依赖于 IgE 的组胺释放中的作用第 27 页科罗拉多州立大学
患者显示出皮肤补体激活的证据 c5a 水平升高 46.9 ng/ml 20.1 ng/ml 20.1 ng/ml N=95 N=42 p = 0.004 c4d 染色皮肤活检 C5a (ng/mL) C5a 诱导嗜碱性粒细胞释放组胺
剂量依赖性方式 C5a 介导的组胺释放水平升高刺激供体嗜碱性粒细胞的组胺释放(百分比)与 IgE 通路无关 C5a 对组胺释放的刺激不受 IgE
途径/SYK抑制剂 GSK2646264 人体皮肤体外模型:使用 1nM c5a 的微透析管进入体外人体皮肤 Bhatia 等人 2024 年亚太过敏 14;Aghdam 等人。2021 年 Clin Transl 过敏。11 菊池,2002 年 J 过敏
临床免疫学:109 Molina 等人;2019 年 Br J Pharmacol:176

C5A 诱导的组胺释放对两者都很重要,IgE 依赖途径和
IgE 独立途径 C5a/C5ar 以独立于 IgE 的方式促进组胺释放,抗 IgE 刺激后(> 20% HR)抗 IgE 刺激阴性。激活凝血通路
(组织因子)可能会放大科罗拉多州立大学中 C5a 的产生 [TF]释放)除了从科罗拉多州立大学患者身上分离出来的自体抗体触发嗜碱性粒细胞外,C5a 刺激还会导致剂量依赖性组胺释放 c5a 刺激从科罗拉多州立大学患者身上分离的嗜碱性粒细胞 c5a 刺激导致
剂量依赖性组胺释放 Matsubara 等人。Front Immunol 2022,13。第 28 页

科罗拉多州立大学 INF904 的开发第 29 页结论:C5ar 信号传导参与科罗拉多州立大学肥大细胞/嗜碱性粒细胞的
组胺释放。这种 C5A 介导的组胺释放独立于 IgE 途径,被认为在科罗拉多州立大学的两种亚型中都起作用 C5ar 抑制是一种新的作用机制
(MoA),以满足未满足的医疗需求作为口服强效的 C5ar 抑制剂,科罗拉多州立大学的 INF904 非常适合在科罗拉多州立大学进行开发

INF904 用于化脓性汗腺炎 (HS)

需要在 HS 新机制中开发 INF904 的有力理由,需要新的
机制来更全面地解决该疾病。例如,中度至重度活性引流疾病患者目前获得批准的治疗选择有限,这些治疗方案已被证明对他们有效,而且已知在许多情况下,使用经批准的抗肿瘤坏死因子α或抗 IL17 药物治疗
的反应会随着时间的推移而减弱 HS 患者更倾向于口服药物而不是注射(和手术切口)。) * INF904 是一种口服 C5ar 抑制剂
,具有: 一种抑制已知 C5a 诱导的对免疫细胞中性粒细胞激活和组织积累的作用的作用机制,包括诱导 NetoSis,这些机制被认为参与 HS 进展
,特别是 HS 病变形成的临床证据表明,阻断 C5a/C5ar 途径会降低 HS 的病变数量。患者全身暴露的剂量范围广 HS 的市场潜力是
极具吸引力,预计到2032年市场规模将超过39亿美元** * Willems,D.,EL. Hinzpeter、Van der Zee、H.H. 等。患者 16,153—164 (2023) ** GlobalData 和 Leerink /古根海姆分析师报告第 31 页

化脓性汗腺炎(HS)HS 概述和未满足的需求临床特征一种
慢性、复发性、使人衰弱的中性粒细胞驱动的炎性疾病,其特征是脓肿、结节和带有化脓性或血迹分泌物的排水隧道(DT),可爆发并导致
疤痕偏向于腋下、凹槽等间部位与严重细菌感染、严重生活质量障碍和功能障碍相关的臀部和乳房下部位流行病学在美国和欧盟的流行病学流行病学流行病学流行病学流行率为估计为 0.7%-1.2% 尽管估计值差异很大,但我们估计仅在美国就有超过20万名中度至重度HS患者当前的治疗和医疗需求当前的治疗包括疼痛管理、
抗生素、皮质类固醇和生物制剂当前批准的疗法显示出对大量患者的疗效随着时间的推移而减弱。此外,主动引流
疾病的受影响患者存在大量未得到满足的医疗需求。第32页
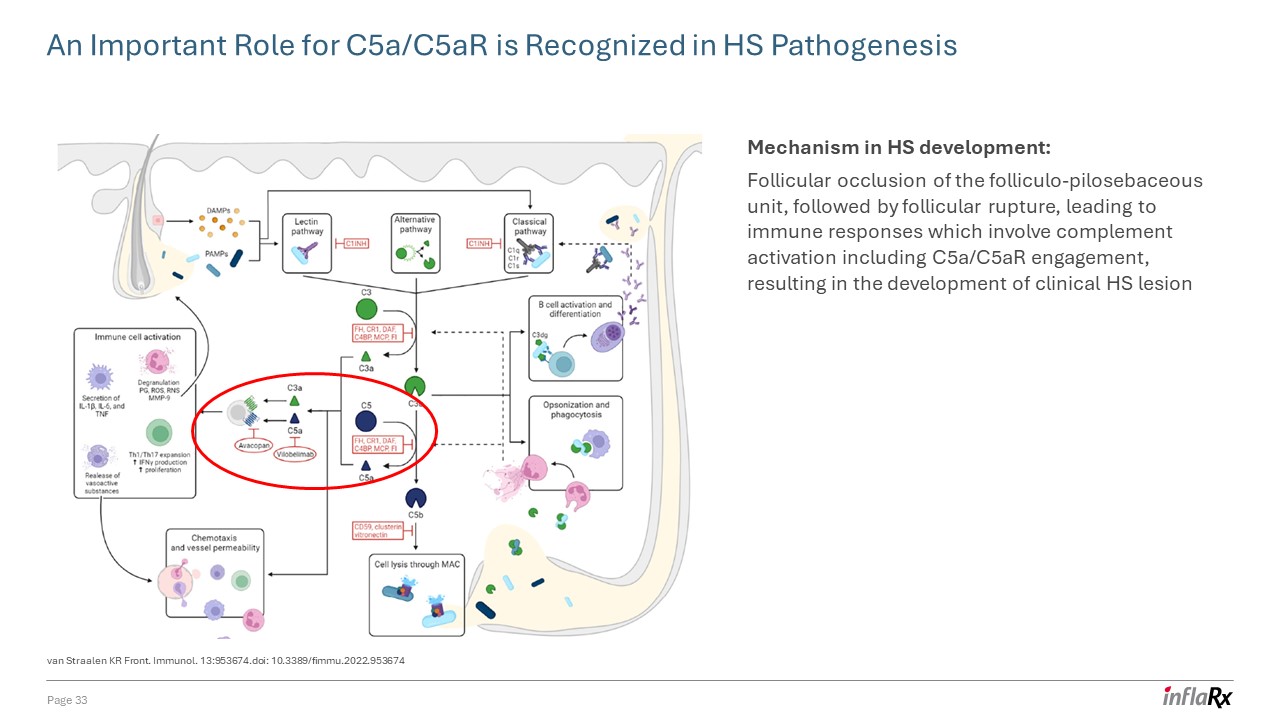
Straalen KR
Front 在 HS 发病机制中认识到 C5a/C5ar 的重要作用。Immunol. 13:953674. doi:10.3389/fimmu.2022.953674 HS 发育的机制:毛囊-毛囊皮脂腺单元的滤泡闭塞,然后是滤泡破裂,导致免疫反应,包括补体激活
,包括 C5a/C5AR 参与,导致临床 HS 病变的发展第 33 页

第 34 页在 HS HS 患者中开发抗 C5A/C5AR 的有力理由
C5a 升高,这是一种主要的中性粒细胞激活剂,可被抗 C5A/C5AR 阻断 Kanni 等人,2018 年 HS 患者补体激活显著,C5a 水平升高 C5a/C5ar 激活是 HS 患者
血浆的关键中性粒细胞激活剂 Guo 等人 2019 年 8 月美国专利号10,376,595 来源:InflarX 内部存档数据 HS 患者血浆强烈刺激健康供体血液中的中性粒细胞激活:添加
可以完全阻断这种作用:维洛贝利单抗(抗 C5A 抗体)和 INF904(抗 C5AR 抑制剂)14 名健康对照组和 54 名 HS 患者血浆中 C5a 的浓度。P 值表示患者与对照组之间的显著差异。

增强所有疾病阶段的 HS 患者活检中的 C5ar 染色第
35 页 c5ar1 染色 HF:毛囊 S:化脓性 Hurley I 期患者,伴有大量深层皮肤和皮下化脓性脓肿炎症,周围毛囊伴有角化过度。c5ar1 染色阳性 —
中性粒细胞 T:隧道 R:隧道破裂 PEH:银屑病表皮增生 Hurley II 期患者,隧道形成和隧道破裂区域,上皮被中性粒细胞片包围。c5ar1 染色阳性 —
中性粒细胞 T:隧道 G:肉芽肿 F:纤维化 Hurley III 期患者,伴有隧道形成,周围有肉芽肿性炎症,伴有异物巨细胞。C5ar1 染色阳性 — 中性粒细胞、组织细胞和巨型
细胞 H&E 染色 Van Straalen 等人,2022年。Front Immunol 21

C5a/C5ar 信号传导在 HS 中的作用的临床证据第 36 页 Vilobelimab
(抗 C5a 单抗)SHINE IIb 期研究针对中度重度 HS 患者得出了各种疗效信号,包括总体炎症病变减少 * 在 SHINE 中,严格控制 C5a 水平的
患者 dT 降低幅度更高 * 从中吸取的关键经验教训:需要更高剂量的维洛贝利单抗来充分控制 c5a/C5ar 信号传导并提高减轻病变的功效 Avacopan(口服 C5ar 抑制剂)标准剂量
在 30 mg BID 中,在 HiSCR 的重度 HS 患者(Hurley III)中检测到了 p 值阳性疗效信号,第 12 周出现了与安慰剂组的明显分离 ** 注意:在 ANCA 血管炎患者中,阿瓦科潘的稳定水平仅在 3 个月左右才报告达到 *** 30 mg BID 给药方案可能太低了,无法进行充分的 HS 治疗阿瓦可潘的延迟积累可能阻碍了疗效的早期发作 *
文件中的InflarX数据 **数据来自Chemocentryx在10月28日发表的AURORA试验结果报告2020 年:注意:总体结果尚未统计。所有中度至重度 HS 患者(主要终点)的 hiSCR 均显著 *** 数据来自 avacopan NDA 申报的
ANCA 相关血管炎
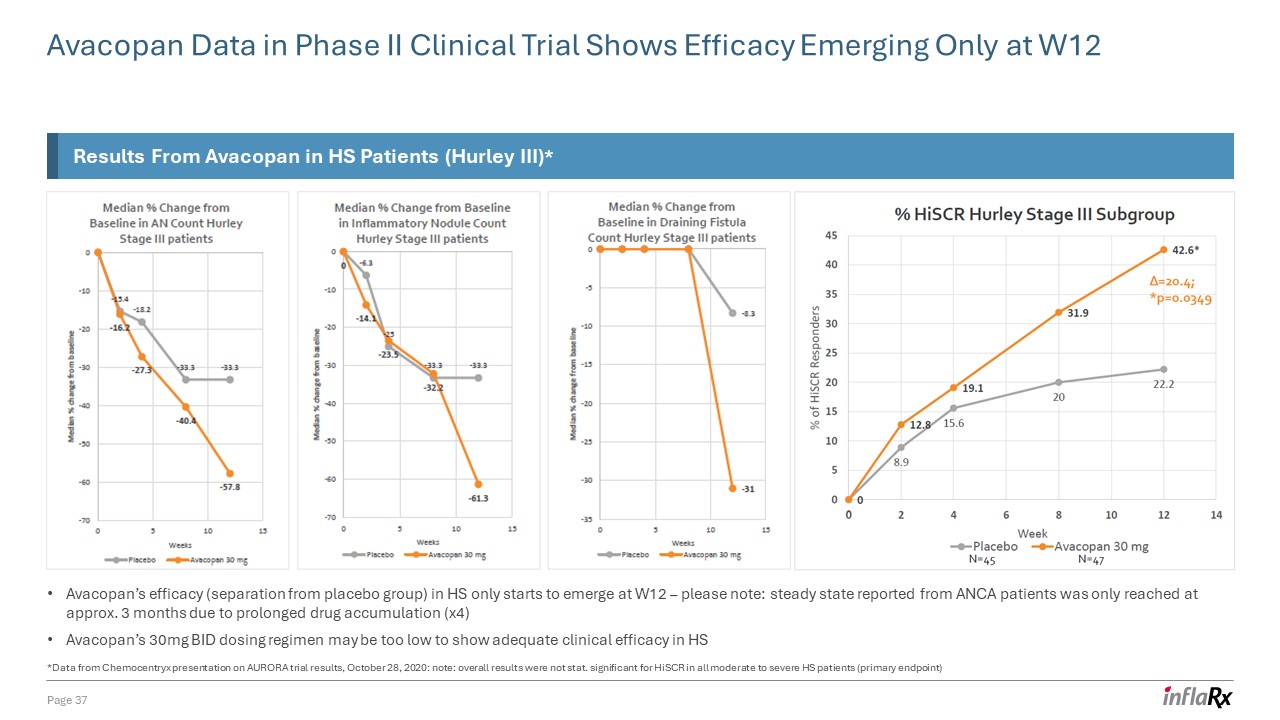
二期临床试验中的 Avacopan 数据显示,疗效仅在 W12 页出现
37 个 Avacopan 对 HS 患者的结果(Hurley III)* Avacopan 在 HS 中的疗效(与安慰剂组分离)仅在 W12 开始显现——请注意:由于
药物积累时间延长 (x4) Avacopan 的 30mg,ANCA 患者报告的稳定状态仅在 3 个月左右达到 BID 给药方案可能太低,无法在 HS 中显示出足够的临床疗效 *数据来自 Chemocentryx 在 AURORA 试验结果上的报告,2020 年 10 月 28 日:注意:总体结果不是stat.
对所有中度至重度 HS 患者(主要终点)的 HisCR 意义重大
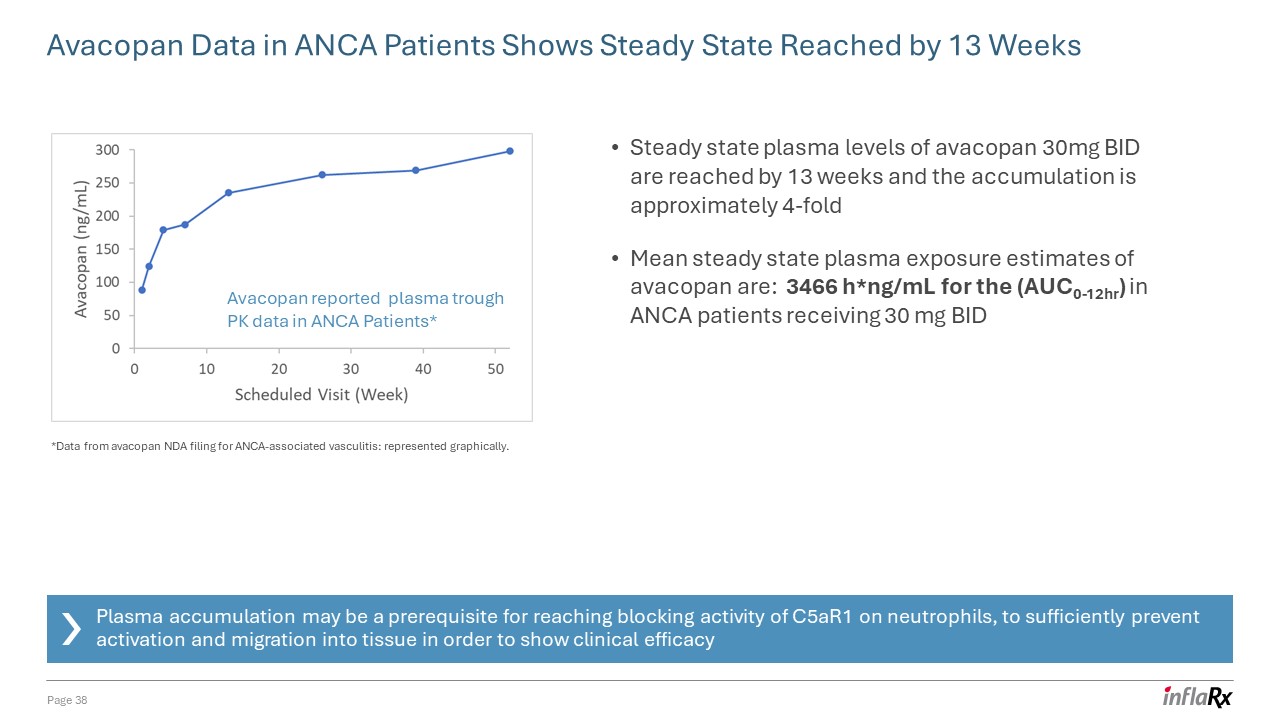
ANCA 患者的 Avacopan 数据显示,在 13 周内达到稳定状态第
38 页 Avacopan 报告了 ANCA 患者的血浆槽 PK 数据* 在 13 周内达到了稳态血浆水平 BID,累积量约为 4 倍 avacopan 的平均稳定状态血浆暴露量估计为:
3466 H*ng/mL,对于接受 30 mg 的 ANCA 患者(AUC0-12HR)BID 血浆积累可能是中性粒细胞达到 c5ar1 阻断活性的先决条件,足以防止激活和迁移到组织中,以
显示临床疗效 *来自 avacopan NDA 申请的 ANCA 相关血管炎的数据:以图形方式表示。

Vilobelimab* 和 Avacopan** 为 HS 患者的疗效提供证据 page
39 结论:C5ar 在 HS c5a/C5ar 信号通路抑制中的作用已在 HS 患者中产生疗效信号,需要严格控制 C5ar 信号传导才能实现最佳疗效 —
剂量对于 HS 很重要!INF904 作为口服 C5AR 抑制剂处于理想地位,具有优化 PK/PD 特征,可满足 HS 患者现有的高未满足的医疗需求 * 来源:InflarX 存档数据。** 来源:Chemocentryx
在 AURORA 试验结果上发表的数据,2020 年 10 月 28 日

Gohibic (vilobelimab) 危急 COVID-19 和 ARDS

Gohibic 的紧急使用授权 (EUA) 第 41 页 Gohibic
(vilobelimab) 尚未获得批准,但已获美国食品和药物管理局根据欧盟*授权紧急使用,用于在接受 IMV 后的 48 小时内开始治疗住院成人 COVID-19,或欧洲 EMA/
CHMP 正在审查 ECMO** MAA,与美国食品药品管理局关于未来 BLA 的讨论仍在进行中提交授权是根据一项针对危重病人、机械通气的 COVID-19 患者进行的 III 期临床试验结果授予的,其中 Gohibic 治疗减少了
与安慰剂相比,死亡率下降了23.9%。Gohibic是第一种获得授权的靶向C5a的治疗药物,是炎症宿主反应的潜在关键参与者Gohibic已由InflarX在美国根据EUA推出:组建一支经验丰富且高度专注的商业团队,提高不同医疗保健参与者的知名度建立强大的供应链,允许不间断地向美国医院供应戈希比奇(维洛贝利单抗)* GOHIBIC
的紧急用途仅限于在宣布有正当理由批准紧急用途的情形的有效期内获得授权根据该法案第 564 (b) (1) 条(21 U.S.C. §
360bbb-3 (b) (1),在 COVID-19 疫情期间的药品和生物制品,除非声明终止或授权提前撤销 ** IMV = 侵入性机械通气,***ECMO = 体外膜氧合欲了解更多重要的安全信息,请访问
www.gohibic.com
电子邮件:IR@inflarx.com 电话:+49-3641-508180 传真:
+49-3641-508181 www.inflarx.com Inflarx.com Inflarx N.V. Winzerlaer Str. 207745 德国耶拿