

通过卓越的视力增益改变患者预后公司介绍 | 2024 年 4 月纳斯达克(OPT);澳大利亚证券交易所(OPT.AX)附录 99.1

免责声明本演示文稿包括有关Opthea有限公司(ABN 32 006 340 567)(“Opthea” 或 “公司”)及其关联公司和子公司(统称为 “Opthea集团”)活动的一般背景信息。本演示截止日期为 2024 年 4 月 3 日(除非此处另有说明)。本演示文稿中包含的信息为摘要信息,并不声称完整,也不包含潜在投资者或买方在评估可能对Opthea的投资或收购Opthea证券时可能需要的有关Opthea集团的所有重要信息。本演示文稿中的信息如有更改,恕不另行通知。Opthea集团的任何成员或Opthea集团任何成员(均为Opthea一方,合为Opthea各方)的任何董事、高级职员、员工、顾问、代理人或代表均无义务更新或更正本演示文稿。本演示文稿包含美国联邦证券法所指的前瞻性陈述,涉及重大风险和不确定性。除历史事实陈述外,本演示文稿中包含的所有陈述,包括有关公司在开发产品的治疗和商业潜力和预计市场机会规模、未来机会的可行性、未来的市场供需、临床试验下完成患者入组的预期时间和营收数据的时机、我们的战略、未来运营、未来财务状况、未来收入、预计成本、管理层前景、计划和目标的陈述,是前瞻性陈述。“预期”、“相信”、“估计”、“预期”、“打算”、“可能”、“计划”、“预测”、“项目”、“目标”、“潜在”、“将”、“可能”、“应该”、“继续” 等词语以及类似的表述旨在识别前瞻性陈述,尽管并非所有前瞻性陈述都包含这些识别词。实际上,我们可能无法实现前瞻性陈述中披露的计划、意图或预期,您不应过分依赖我们的前瞻性陈述作为对未来事件的预测。实际业绩或事件可能与我们在前瞻性陈述中披露的计划、意图和预期存在重大差异。本演示文稿中包含的前瞻性陈述反映了我们目前对未来事件的看法,除非适用法律要求,否则我们没有义务更新任何前瞻性陈述。请参阅Opthea于2023年9月28日向美国证券交易委员会提交的20-F表年度报告以及未来向美国证券交易委员会提交的其他文件中列出的信息,包括风险因素,以了解可能导致实际业绩与前瞻性陈述中的预测存在重大差异的关键因素,包括与以下相关的风险:未来资本需求、药物疗法的开发、测试、生产、营销和销售、监管的风险和潜在损失监管部门的批准、正在进行的证明索齐尼伯西普安全性、耐受性和治疗疗效的临床研究、对Opthea3期临床试验数据一旦揭露的额外分析、3期临床试验患者入组和临床研究机构的完成时间、合同制造商和劳动力成本、知识产权保护以及其他可能影响公司未来运营和财务业绩的一般性因素。本演示文稿包括我们从行业出版物和研究、第三方进行的调查和研究中获得的统计数据和其他行业和市场数据,以及我们自己对潜在市场机会的估计。本演示文稿中使用的所有市场数据都涉及许多假设和局限性,提醒您不要过分重视此类数据。行业出版物和第三方的研究、调查和研究通常表明,他们的信息是从被认为可靠的来源获得的,尽管它们不能保证此类信息的准确性或完整性。我们对候选产品的潜在市场机会的估计包括基于我们的行业知识、行业出版物、第三方研究和其他调查的几个关键假设,这些假设可能基于少量样本,可能无法准确反映市场机会。尽管我们认为我们的内部假设是合理的,但没有独立来源证实了这些假设。本演示文稿中包含的信息不构成投资或金融产品建议(也不是税收或法律建议),也无意用作做出投资决策的依据。该演示文稿仅供参考,不是澳大利亚法律或任何其他司法管辖区的法律规定的招股说明书或其他披露文件,也不包含招股说明书或其他披露文件中要求披露的所有信息。本演示文稿中提供的信息可能与为任何证券要约而准备的任何披露文件中提供的信息存在重大差异。它没有考虑到任何特定投资者的投资目标、财务状况、税收状况或需求,在决定一项投资是否适当时应考虑这些因素。您必须考虑自己的投资目标、财务状况和需求,并进行自己的独立调查和查询,包括就本演示文稿中包含的信息获取适用于您所在司法管辖区的税务、法律、财务或其他专业建议。收件人不应依赖此演示来考虑任何特定交易的优点。本演示文稿可能包含第三方的商标和商品名称,这些商标和商品名称是其各自所有者的财产。本演示文稿中使用的第三方商标和商品名称属于相关所有者,使用并不代表任何Opthea集团的赞助、批准或关联。

首创的 VEGF-C/D TRAP 旨在与标准护理抗血管内皮生长因子-A 疗法的物质成分和使用方法相结合的专利有效期至 2034 年;Sozinibercept 有望成为 15 年多来首款改善视觉效果的产品满足高未满足需求的产品两项大型关键试验正在进行的大型市场机会湿性年龄相关性黄斑变性(湿性 AMD)是美国视力丧失的主要原因老年人,尽管广泛使用,但仍影响了美国和欧洲约350万名患者抗血管内皮生长因子-A的护理标准COAST入组已于2024年2月完成;ShoRe估计,第二季度 CY2024(截至2024年4月3日入组率为96%)两项试验的头条数据预计在2025财年中期卓越的先导资产2b期显示出优越性,具有良好的耐受性,在具有成熟临床实践的不断增长的市场中,Sozinibercept有可能改善数百万湿性AMD患者的视力 Sozinibercept 专为与任何抗血管内皮生长因子-A 联合使用而开发;不是与任何批准的疗法竞争 MOA — 作用机制;SOC — 护理标准 *专利期限延长、数据和市场排他性(生物学为 12 年)专有技术

经验丰富的领导团队专业知识和往绩对视网膜社区产生积极影响 Fred Guerard,PharmD,MS 首席执行官彼得·朗首席财务官梅根·鲍德温博士,MAICD 创始人、首席创新官兼执行董事朱迪思·罗伯逊首席商务官 Arshad M. Khanani,医学博士,硕士,FASRS管理合伙人,Sierra Eye Associates临床研究总监兼奖学金主任,以及内华达大学里诺医学院临床教授管理团队首席临床医学顾问顾问委员会 Charles C. Wykoff,医学博士,德克萨斯州视网膜顾问研究主任,研究和临床试验委员会主席,美国视网膜顾问蒂姆·杰克逊,博士,医学博士,FrcoPhth 国家卫生服务局,伦敦国王医院学院医院顾问,纽约大学医学院临床专业医学博士,纽约玻璃体视网膜黄斑顾问合伙人

尽管使用标准护理抗血管内皮生长因子-A疗法进行治疗,但大多数患者的视力效果并不理想 *根据随机对照临床试验数据;> 45% 的患者在最佳矫正视力(BCVA)方面未能实现≥2条线的改善;持久液体:SD-OCT ≥ 300 µM 或时域OCT ≥ 250 µM 1 Mettu PS,等。Prog Retin Eye Res. 2021 尽管接受了抗血管内皮生长因子-A 疗法*的治疗,但在 12 个月以上的时候视力会进一步丧失,黄斑积液会持续存在 > 60% > 45% 大多数患者无法达到 20/40 的视力大多数患者无法恢复日常活动,例如开车或阅读
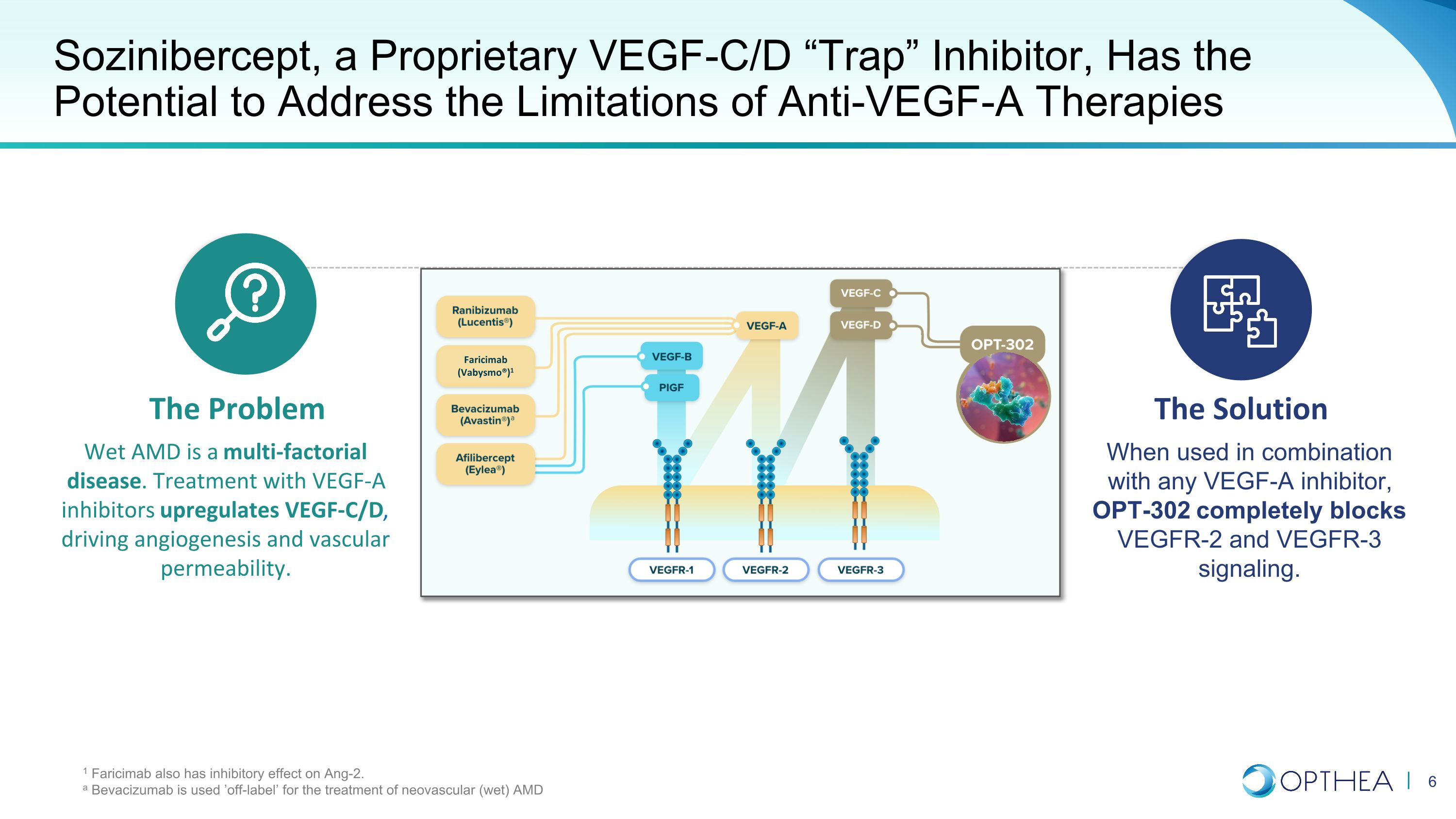
Sozinibercept 是一种专有的 VEGF-C/D “Trap” 抑制剂,有可能解决抗血管内皮生长因子-A 疗法的局限性。问题湿性 AMD 是一种多因素疾病。使用 VEGF-A 抑制剂治疗可上调 VEGF-C/D,从而推动血管生成和血管通透性。当与任何 VEGF-A 抑制剂联合使用时,OPT-302 可完全阻断 VEGFR-2 和 VEGFR-3 信号传导。1 法里西单抗还对 Ang-2 有抑制作用。贝伐珠单抗被 “标签外” 用于治疗新生血管(湿性)AMD 法里西单抗(Vabysmo®)1
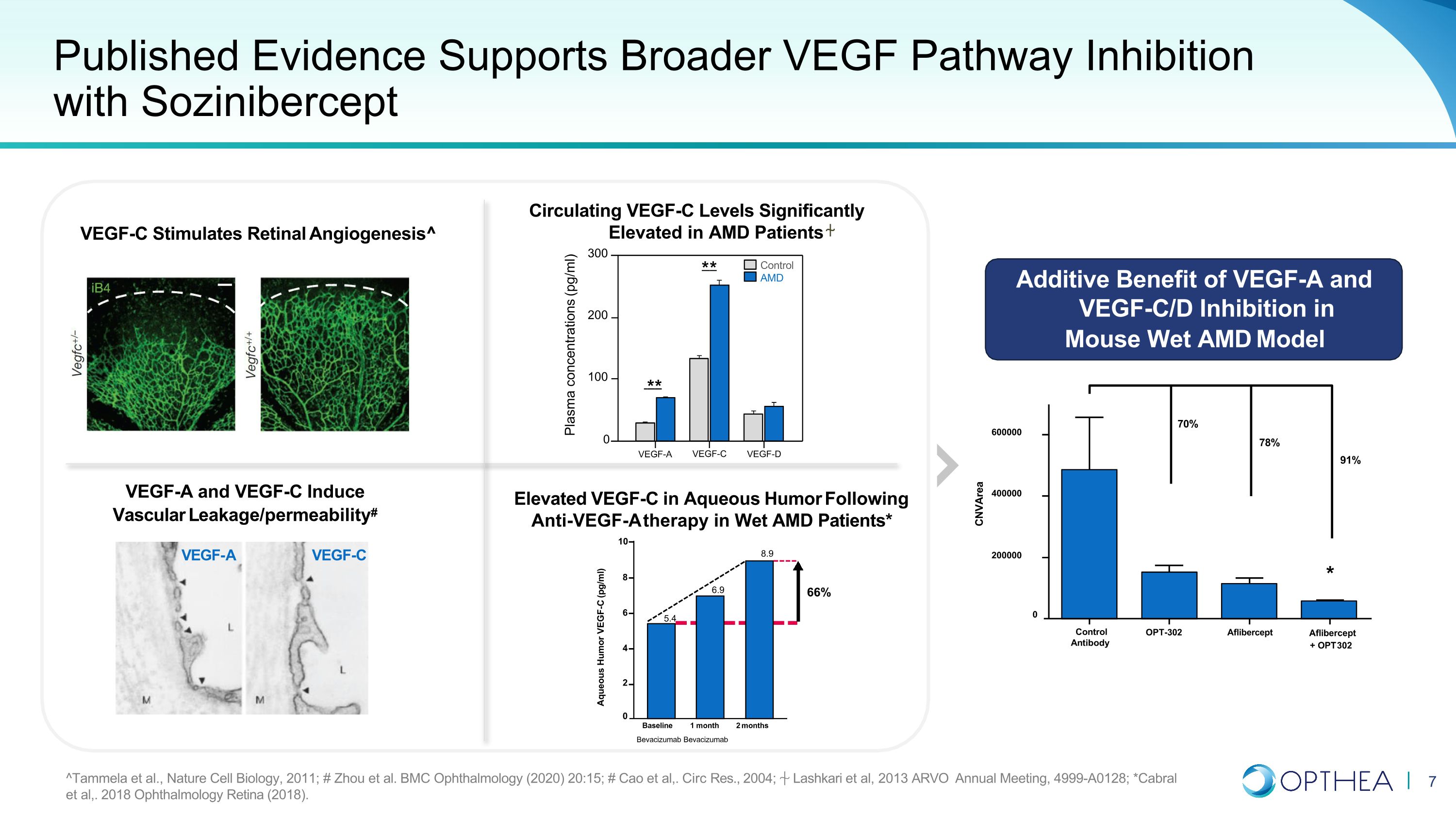
已发表的证据支持使用索齐尼伯西普 VEGF-A 和 VEGF-C 可更广泛地抑制血管内皮生长因子通路 # VEGF-C VEGF-C 刺激视网膜血管生成^ AMD 患者循环血管内皮生长因子-C 水平显著升高湿性 AMD 患者接受抗 VEGF-A 治疗后血管内皮生长因子-C 升高* VEGF-A 和 VEGF-C/D Ind的附加益处小鼠湿式 AMD 模型中的抑制作用 **** 控制 AMD 血浆浓度 (pg/ml) 300 200 100 0 对照抗体 OPT-302 Aflibercept Aflibercept + OPT 302 CNVArea 70% 78% 91% * 0 200000400000 600000 水性幽默 VEGF-C (pg/ml) 10 8 66% 6 5.4 6.9 8.9 4 2 0 基线 1 个月 2 个月 Bevacizumab bevacizumab ^Tammela 等人,《自然细胞生物学》,2011 年;# Zhou 等人BMC 眼科 (2020) 20:15; # Cao 等人,.Circ Res.,2004 年;Lashkari 等人,2013 年 ARVO 年会,4999-A0128;*Cabral 等人,2018 年眼科视网膜(2018)。VEGF-A VEGF-C VEGF-D
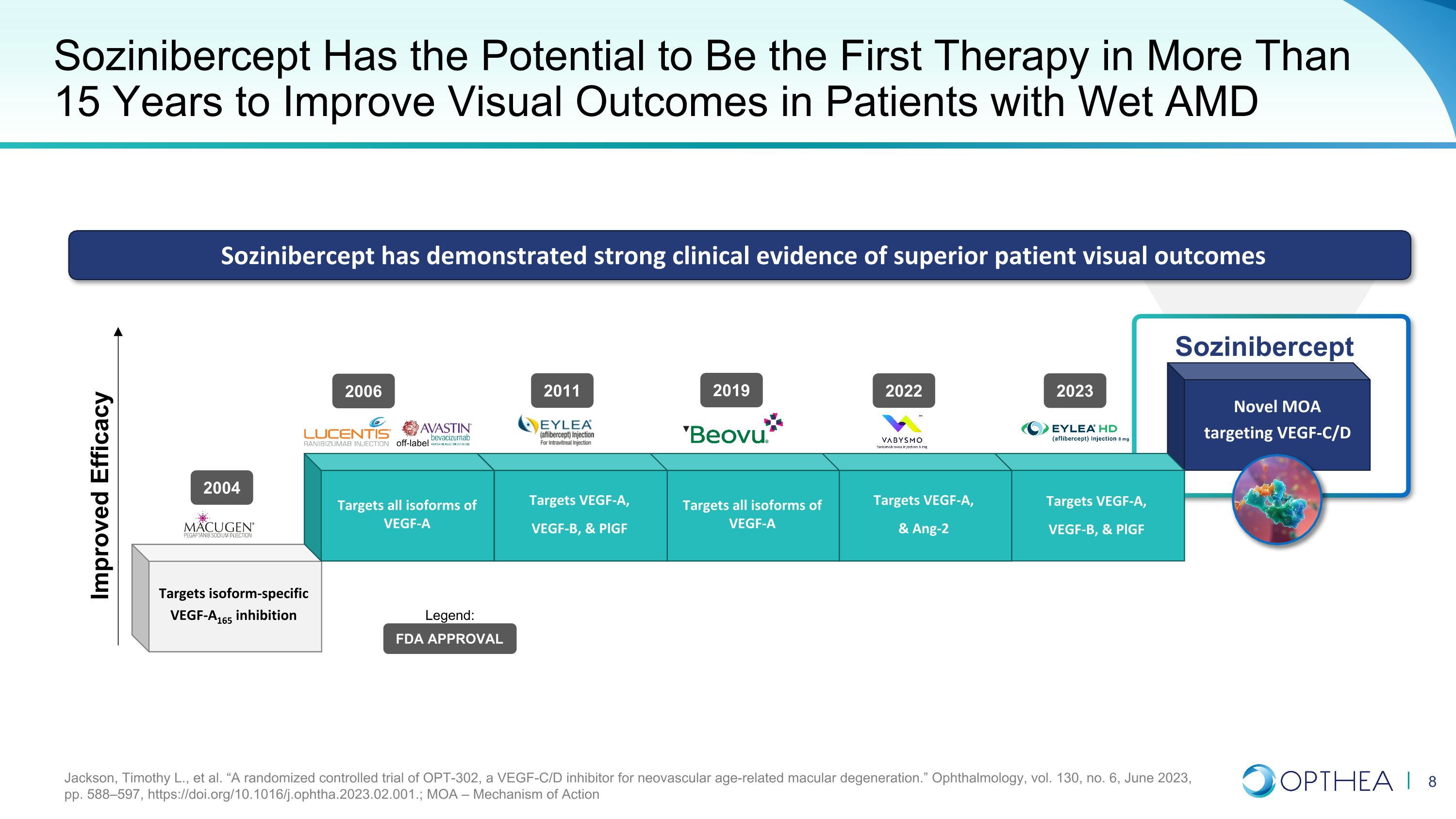
针对 VEGF-C/D 的新型 MOA Sozinibercept 靶向 VEGF-A、VEGF-B 和 pLGF 靶向 VEGF-A 和 Ang-2 靶向 VEGF-A 的所有亚型 Sozinibercept 有望成为 15 年来首种改善湿性 AMD 患者视觉效果的疗法。靶向 VEGF-A 靶向所有异构体的 VEGF-A、VEGF-B 和 pLGF 靶向 VEGF-A 靶向所有亚型 VEGF-A VEGF-A165 抑制剂 Sozinibercept 已显示出强有力的临床证据,表明患者视觉效果优异 2004 年 2006 年 2011 年 2022 年 FDA 未经标签批准传奇:Jackson、Timothy L. 等“一项针对新生血管年龄相关性黄斑变性的 VEGF-C/D 抑制剂 OPT-302 的随机对照试验。”《眼科学》,第 130 卷,第 6 期,2023 年 6 月,第 588—597 页,https://doi.org/10.1016/j.ophtha.2023.02.001。;MOA — 2023 年行动机制 2019
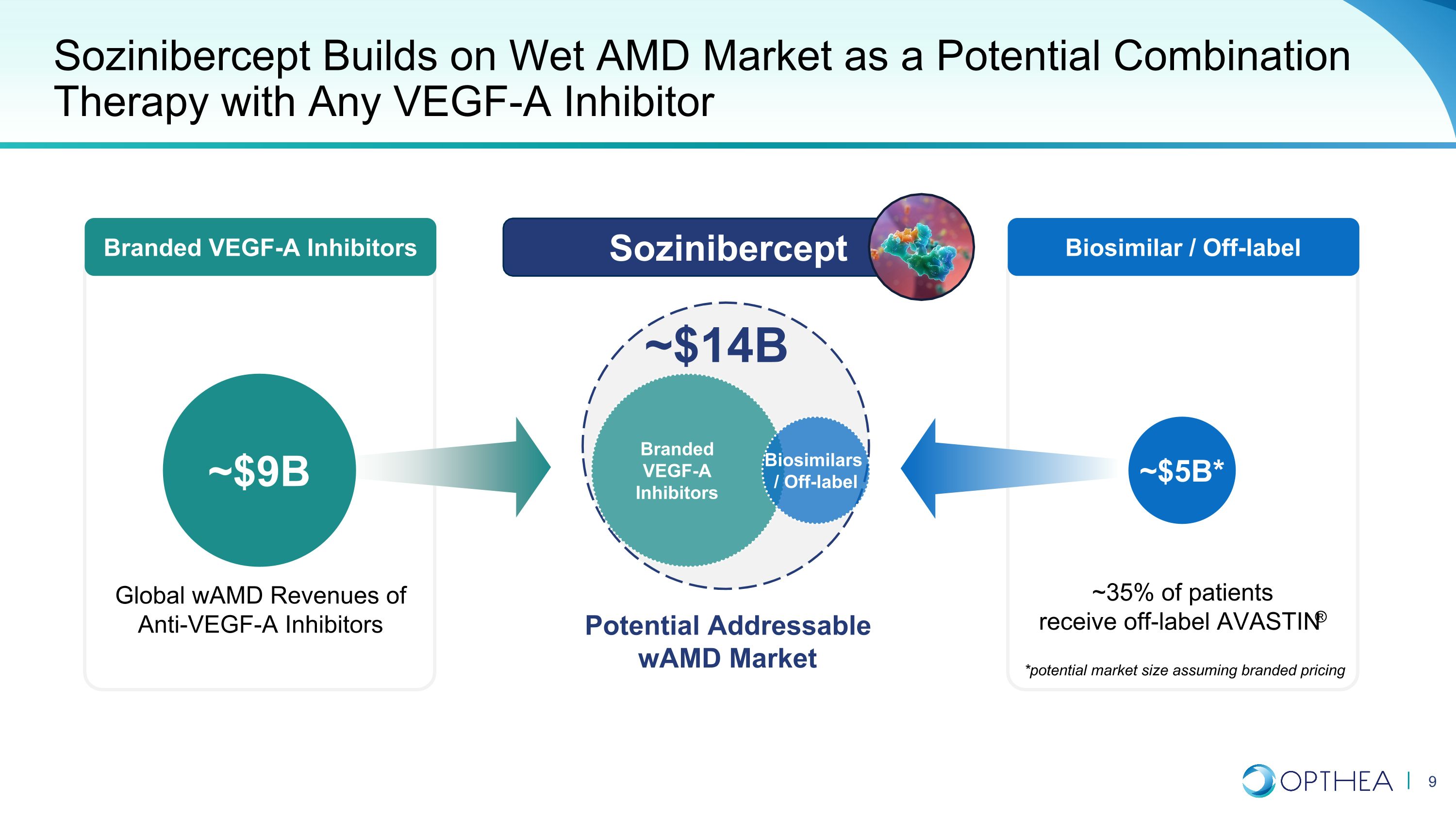
品牌VEGF-A抑制剂Sozinibercept建立在湿性AMD市场上,是任何VEGF-A抑制剂的潜在联合疗法,潜在的WamD市场约为90亿美元~50亿美元* Sozinibercept *潜在的市场规模(假设品牌定价)~35%的患者获得标签外的AVASTIN® 全球WAMD的抗VEGF-A抑制剂收入约140亿美元品牌VEGF-A抑制剂生物仿制药生物仿制药/非标签生物仿制药/标签外
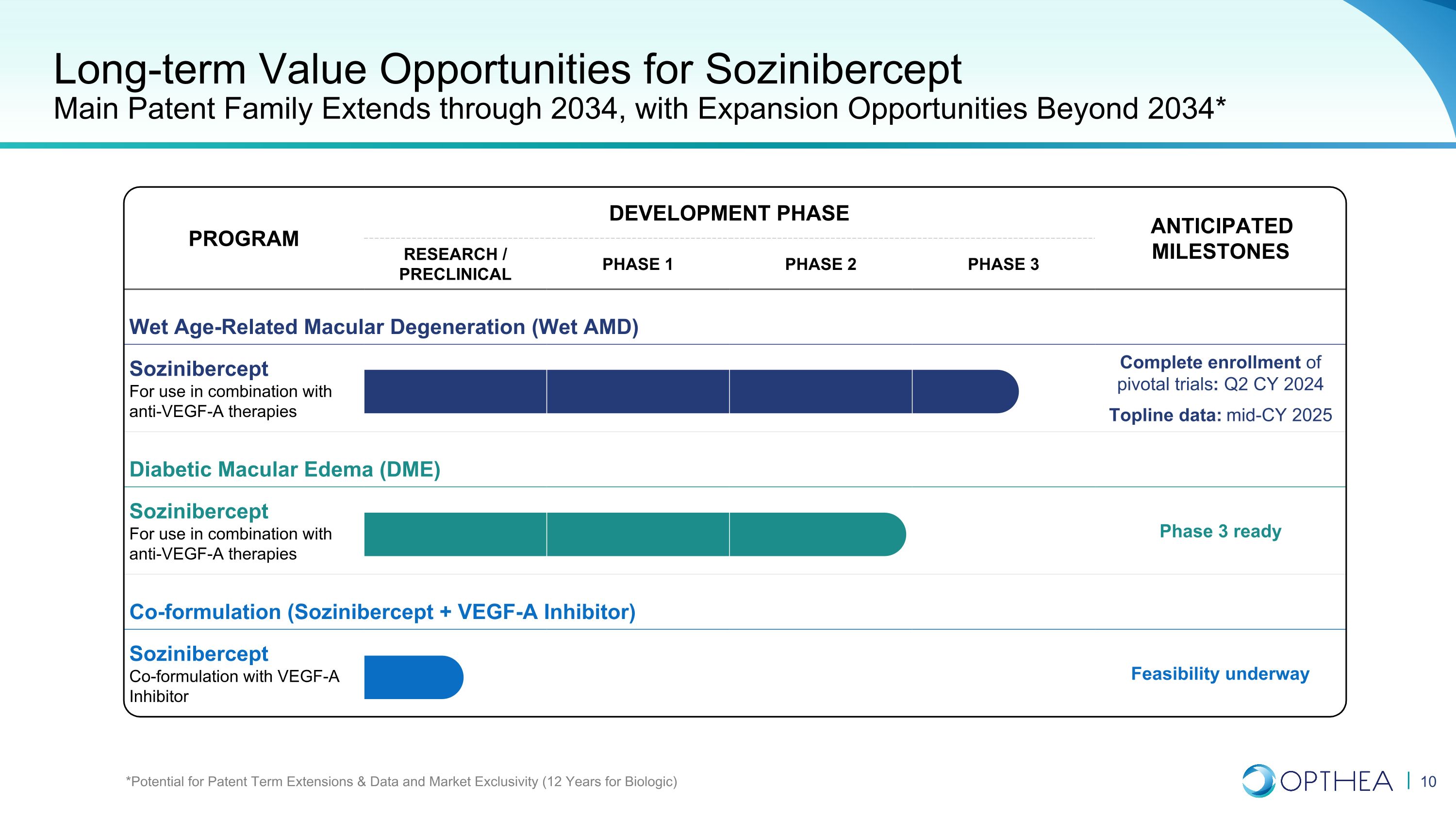
项目开发阶段预期里程碑计划研究/临床前第一阶段第二阶段第三阶段预期里程碑湿性年龄相关性黄斑变性(Wet AMD)Sozinibercept 与抗血管内皮生长因子-A疗法联合使用完成关键试验的注册:2024财年第二季度主要数据:2025年中期糖尿病黄斑水肿(DME)Sozinibercept 与抗血管内皮生长因子-A疗法联合使用,第三阶段准备就绪(Sozinibercept + VEGF-A 抑制剂)Sozinibercept 与 VEGF-A 抑制剂的联合配方正在进行可行性长期价值SoziniberceptMain专利家族的机会将延续到2034年,扩张机会延至2034年* *专利期限延长、数据和市场排他性的潜力(生物学为12年)
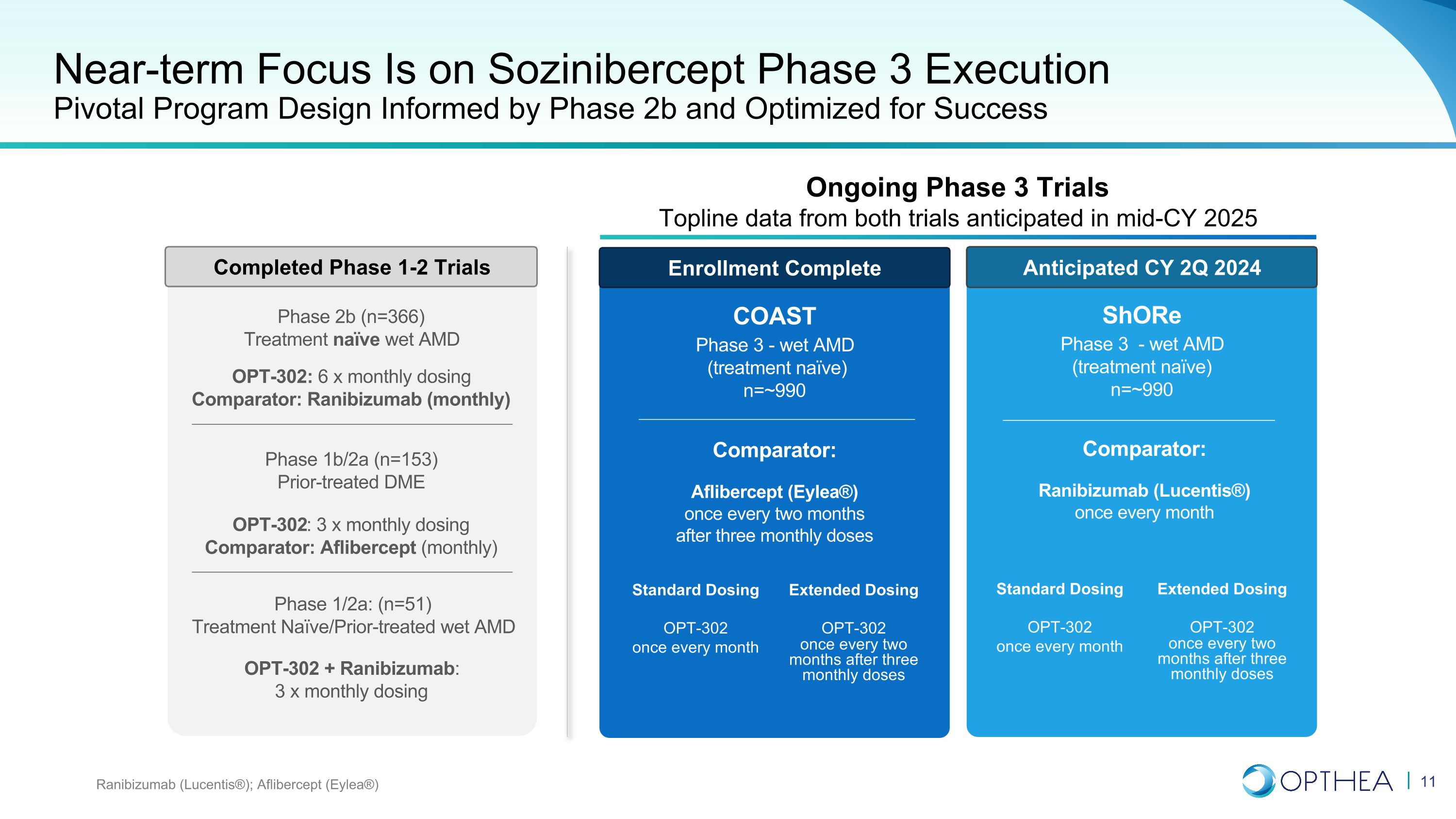
近期重点是索齐尼伯西普第三阶段的执行关键项目设计以2b期为依据,经过优化以取得成功雷尼珠单抗(Lucentis®);Aflibercept(Eylea®)COAST 3期——湿法AMD(治疗未成熟)n=~990 比较器:Aflibercept(Eylea®)在三个月给药后每两个月一次 Shore 第三阶段——湿式 AMD(治疗无效)ve) n=~990 比较器:雷尼珠单抗(Lucentis®)每月一次标准剂量 OPT-302 每月一次延长剂量 OPT-302 在三个月剂量后每两个月一次标准剂量 OPT-302 每月一次延长剂量OPT-302 在三个月给药后每两个月一次 1/2a 阶段:(n=51)先前治疗的湿式 AMD OPT-302 + 雷尼珠单抗:3 x 月剂量 OPT-302:3 x 月剂量比较器:Aflibercept(每月)第 1b/2a 阶段(n=153)先前治疗的 DME OPT-302:6 x 月剂量比较器:雷珠单抗(每月)第 2b 阶段(n=153)366) 预计 2024 财年第二季度完成 1-2 期试验正在进行中 3 期试验 Topline 数据预计将于 2025 财年中期完成
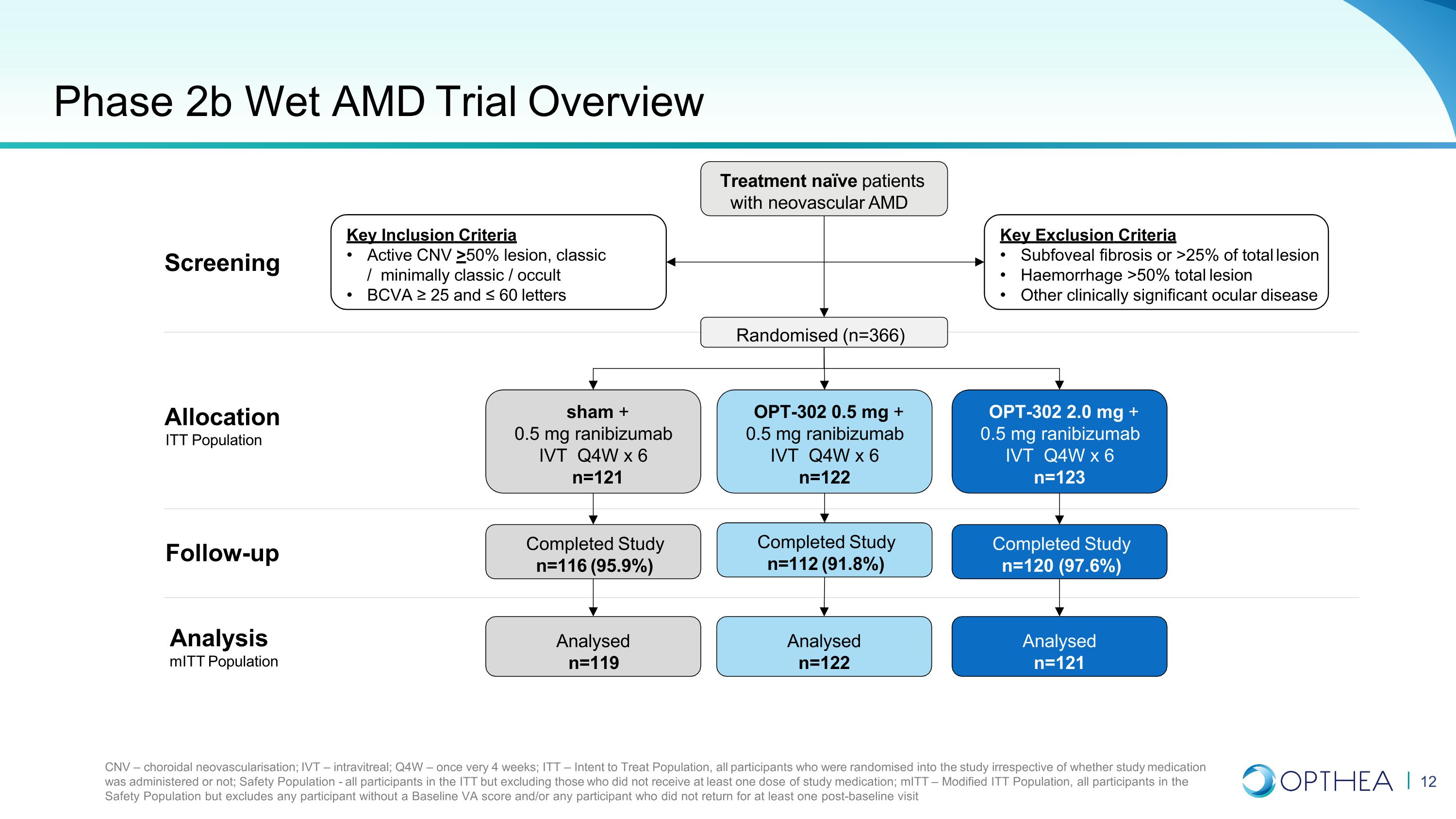
2b 期 Wet AMD 试验概述治疗新生血管 AMD 的天真患者关键排除标准中央凹下纤维化或病变总数的 25% 出血 > 50% 总病变其他具有临床意义的眼部疾病关键纳入标准 Active CNV > 50% 病变,经典/最低限度经典/隐性 BCVA ≥ 25 和 ≤ 60 个字母 CNV — 脉络膜新生血管;IVT — 静脉注射 itreal;Q4W — 每 4 周一次;ITT — 意向治疗人群,无论是否使用研究药物,所有参与者都被随机分配到研究中;安全性人群——ITT的所有参与者,但不包括未接受至少一剂研究药物的参与者;MitT — 修改后的ITT人群,安全人群中的所有参与者,但不包括任何没有基线 VA 评分的参与者和/或任何没有返回至少一次基线后就诊的参与者随机随访(n=366)OPT-302 0.5 mg + 0.5 mg 兰珠单抗 IVT Q4W x 6 n=122 sham + 0.5 mg ranibizumab IVT Q4W x 6 n=122 sham + 0.5 mg ranibizumab sham + 0.5 mg ranibizumab IVT Q4W x 6 n=121 OPT-302 2.0 mg + 0.5 mg ranibizumab IVT Q4W x 6 n=123 已完成研究 n=112 (91.8%) 已完成研究 n=112 (91.8%) 已完成研究 n=116 (95.9%)已完成的研究 n=120 (97.6%) 已分析 n=122 已分析 n=119 已分析 n=121 分析 MitT 人口分配 ITT 人群筛查

2b 期主要和次要终点选择预先指定的子组主要终点关键次要终点第 24 周 BCVA 与基线相比的平均变化第 24 周与基线相比增加 ≥ 15 个字母的患者比例第 24 周中心亚场厚度 (CST) 从基线到第 24 周的变化视网膜内和视网膜下积液的变化安全性和耐受性主要是经典病变、最低经典病变和隐性病变(分层因子)视网膜心绞痛在基线时检测到/未检测到肿瘤增生 (RAP) 息肉脉络膜基线时检测到/未检测到血管病变 (PCV)
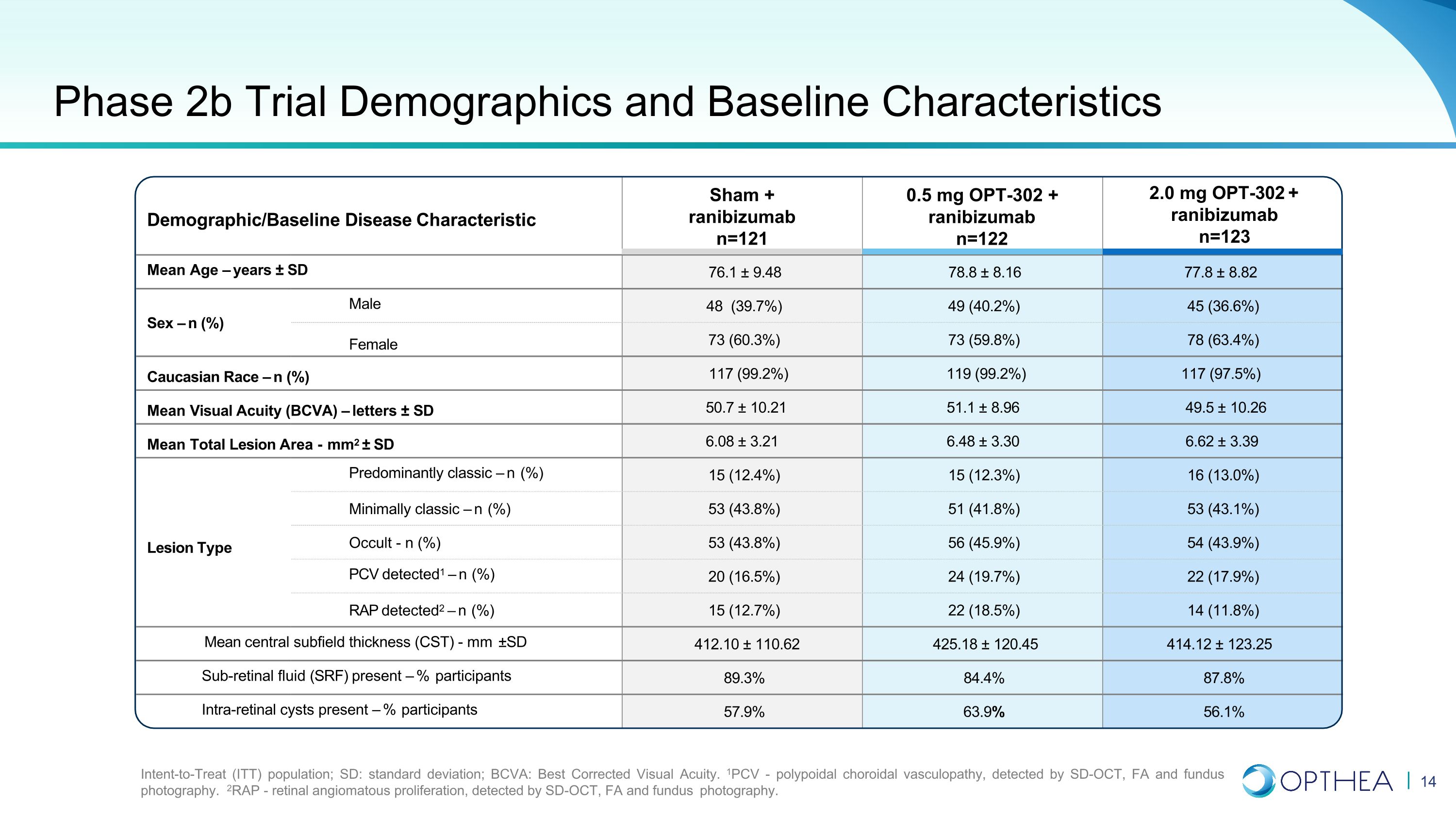
人口统计/基线疾病特征 2.0 mg OPT-302 + 雷尼珠单抗 n=123 平均年龄 — 岁 ± SD 76.1 ± 9.48 ± 8.16 77.8 ± 8.82 性别 — n (%) 男性 48 (39.7%) 49 (40.2%) 45 (36.6%) 女性 73 (59.8%) 78 (63.4%) 高加索种族 — n (%) 49 (40.2%) 45 (36.6%) 女性 73 (59.8%) 78 (63.4%) 高加索种族 — n (%) 117 (99.2%) 119 (99.2%) 117 (97.5%) 平均视力 (BCVA) — 字母 ± SD 50.7 ± 10.21 51.1 ± 8.96 49.5 ± 10.26 平均总病变面积-mm2 ± SD 6.08 ± 3.21 6.48 ± 3.39 以经典为主 — n (%) 15 (12.4%) 15 (12.3%) 16 (13.0%) 最低限度经典 — n (%) 53 (43.8%) 51 (41.8%) 53 (43.1%) 病变类型隐匿性-n (%) 53 (43.8%) 56 (45.9%) 54 (43.9%) 检测到的聚氯乙烯病毒1 — n (%) 20 (16.5%) 24 (19.7%) 22 (17.9%) 检测到 RAP 2 — n (%) 15 (12.7%) 22 (18.5%) 14 (11.8%) 平均中心子场厚度 (CST)-mm ±SD 412.10 ± 110.62 425.62 425.62 425.62 18 ± 120.45 414.12 ± 123.25 存在视网膜下积液 (SRF) — 参与者百分比 89.3% 84.4% 87.8% 存在视网膜内囊肿 —% 参与者 57.9% 63.9% 56.1% 2b 期试验人口统计学和基线特征意向治疗 (ITT) 人群;SD:标准差;BCVA:最佳矫正视力。1PCV-息肉脉络膜血管病变,通过 SD-OCT、FA 和眼底摄影检测。2RAP-视网膜血管瘤增生,通过 SD-OCT、FA 和眼底摄影检测。Sham + 雷尼珠单抗 n=121 0.5 mg OPT-302 + 雷珠单抗 n=122
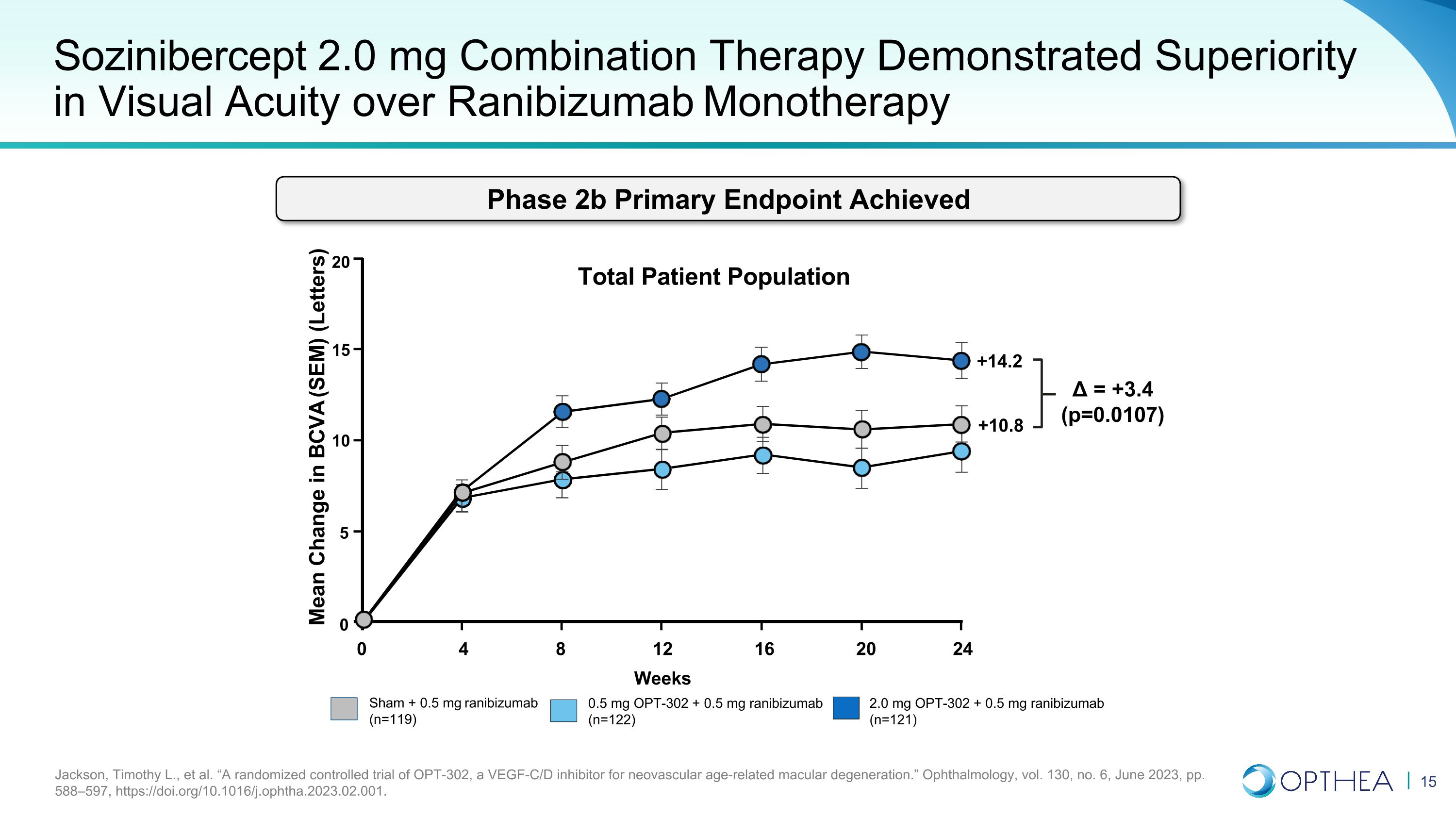
Sozinibercept 2.0 mg 联合疗法在视力方面显示出优于雷珠单抗单一疗法 Jackson、Timothy L. 等人“一项针对新生血管年龄相关性黄斑变性的 VEGF-C/D 抑制剂 OPT-302 的随机对照试验。”《眼科学》,第 130 卷,第 6 期,2023 年 6 月,第 588—597 页,https://doi.org/10.1016/j.ophtha.2023.02.001。Sham + 0.5 mg 雷尼珠单抗 (n=119) 2.0 mg OPT-302 + 0.5 mg 雷尼珠单抗 (n=121) 0.5 mg OPT-302 + 0.5 mg 雷尼珠单抗 (n=122) BCVA (SEM) 的平均变化 (字母) = +3.4 (p=0.0107) 20 15 10 5 0 0 4 8 16 20 24 12 周患者总人群 +14.2 +10.8 期 2b 主要终点已实现
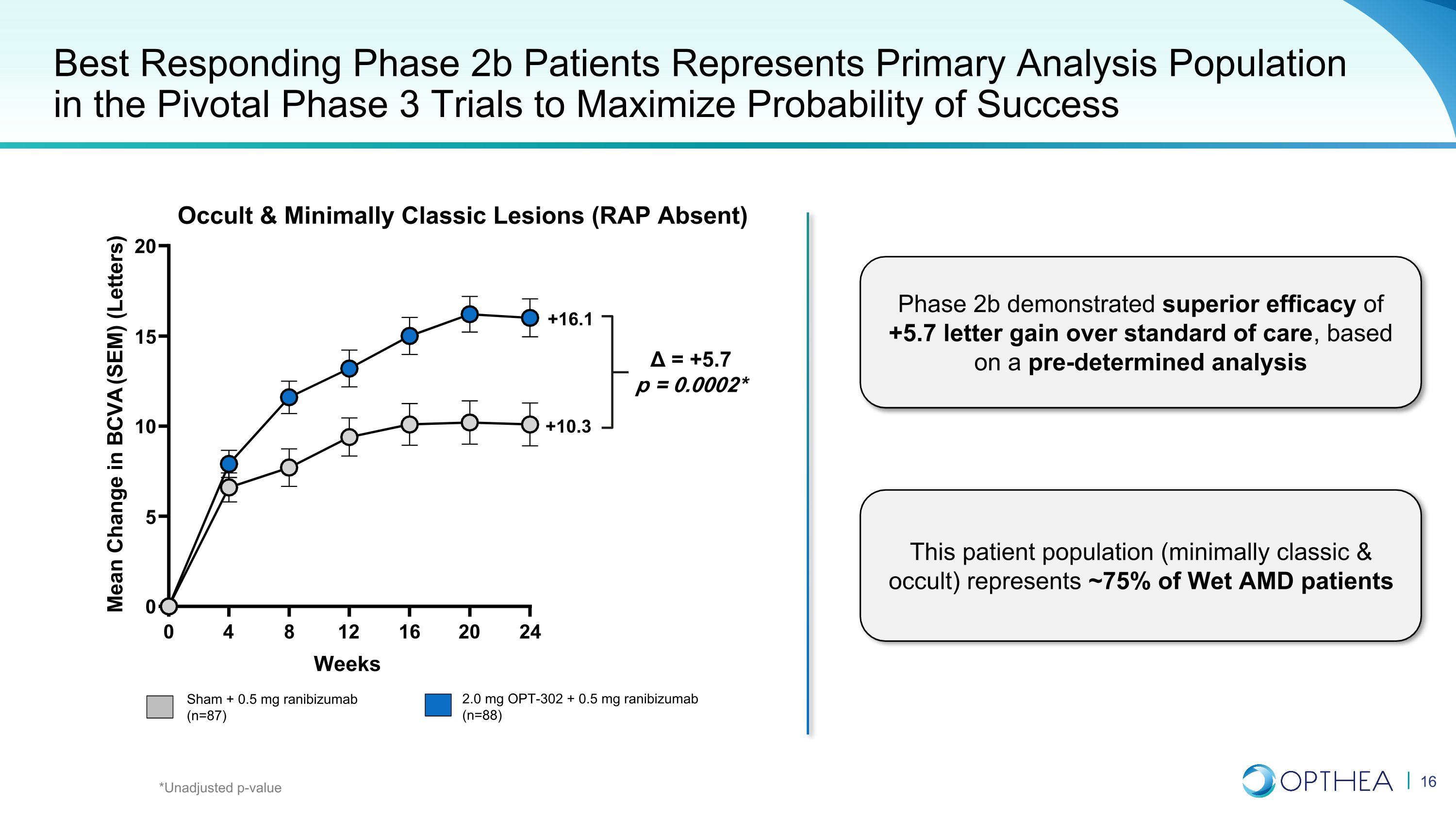
反应最佳的2b期患者代表了最大成功概率的关键3期试验的主要分析人群 Sham + 0.5 mg 雷尼珠单抗(n = 87)2.0 mg OPT-302 + 0.5 mg 雷尼珠单抗(n=88)+10.3 +16.1 = +5.7 p = 0.0002* 隐秘和最低经典病变(RAP 不存在)*未经调整的 p 值的 2b 期表现出优于+5.7 字母增益的疗效护理标准,基于预先确定的分析该患者群体(最低限度经典和隐秘性)约占湿性AMD患者的75% 0 4 8 12 16 20 24 0 5 10 15 20 24 0 5 10 15 20 Weeks M e a n c ha n g e i n B C V A (S E M) (l e t t e r s) BCVA (SEM) 的平均变化(字母)

试验:治疗:患者人数:88 87 240 信函中的基线 BCVA:50.5 50.5 53.7 对照组在类似病变类型的患者群体中在第 24 周表现优于 MARINA 试验 OPT 2B +Ran 0.5 q4w +Ran 0.5 q4w Ran 0.5 q4w Ran 0.5 q4w OPT-302 + 雷珠单抗雷尼珠单抗 OPT 2B MARINA 是一项三期注册试验。不同试验的基准 BCVA 值各不相同。随机分配到治疗组的患者人数(n,下表)。最佳矫正视力(BCVA)与基线相比的平均变化,如ETDRS字母(条形顶部)所示。与标准护理相比,+5.7 字母增益 MARINA BCVA 在第 24 周与基线相比的平均变化 — OPT-302 2b 期与 MARINA 试验的隐匿性病变和最低限度经典病变
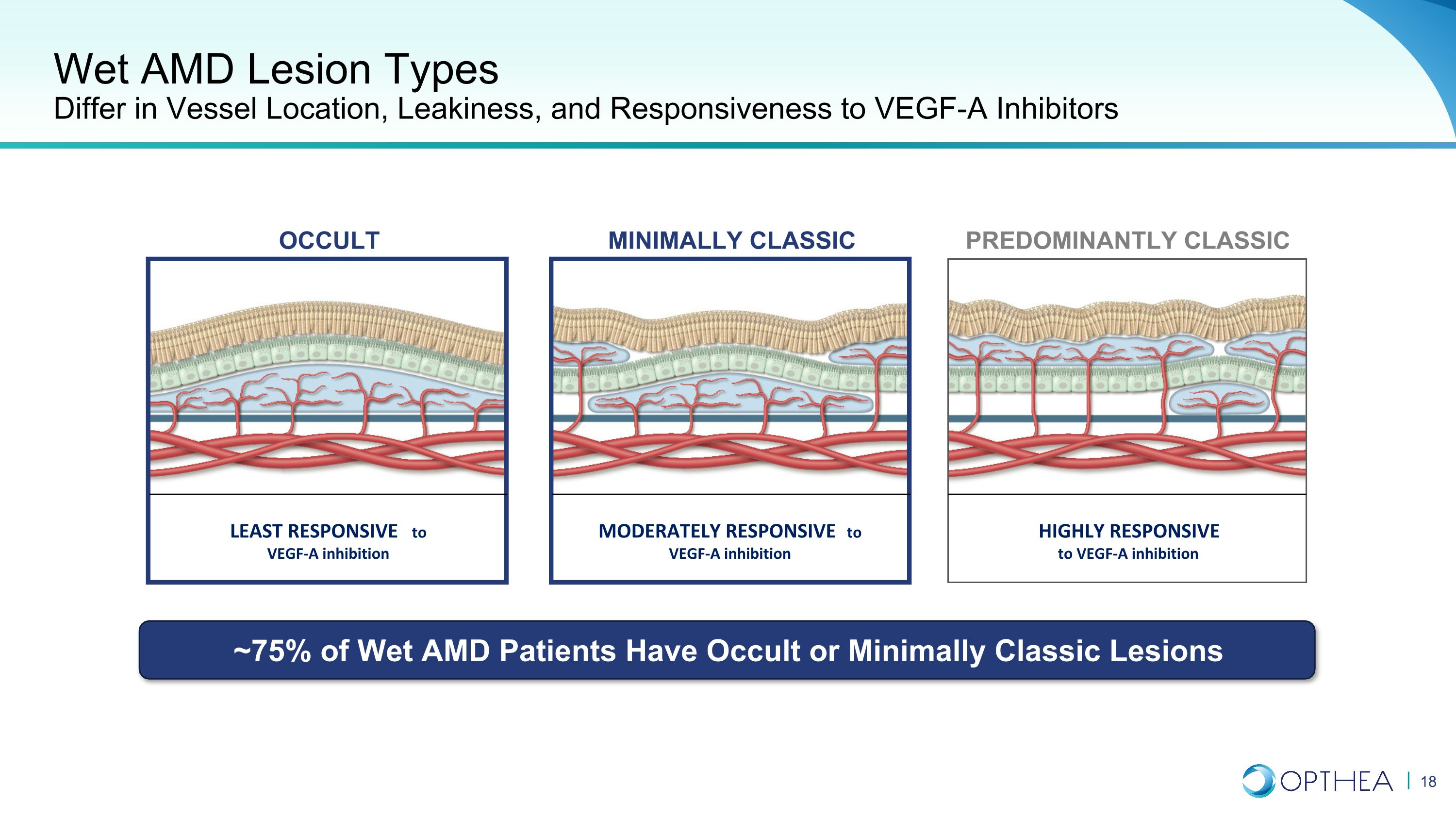
湿性 AMD 病变类型在血管位置、渗漏和对 VEGF-A 抑制剂的反应方面有所不同,对 VEGF-A 抑制反应最小 VEGF-A 抑制反应适度对 VEGF-A 抑制反应高度反应主要是经典的微型经典隐性病变 ~ 75% 的湿性 AMD 患者有隐性或微型经典病变
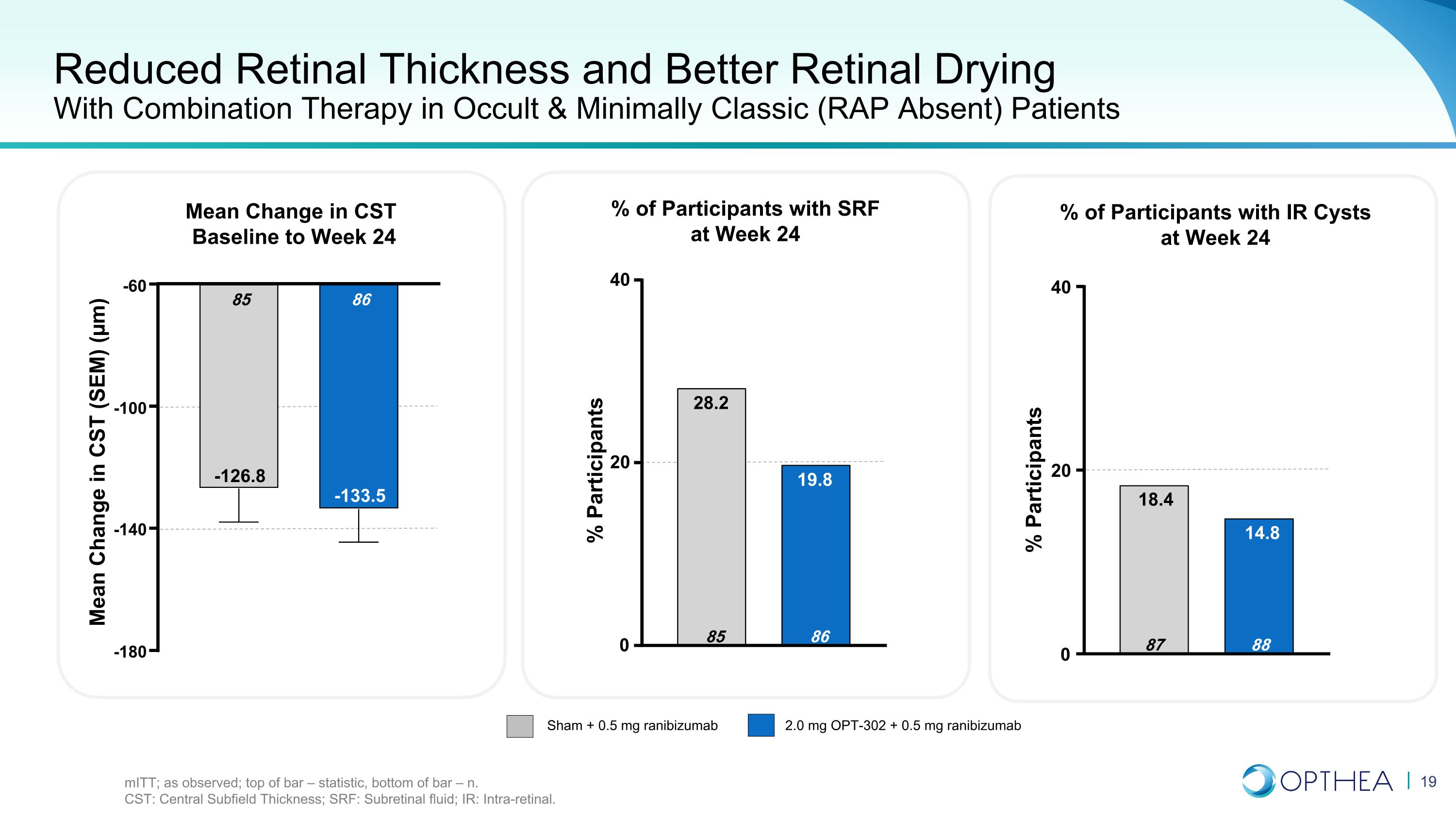
对隐匿和最低限度经典患者(无RAP)患者采用联合疗法,视网膜厚度降低,视网膜干燥效果更好意味着CST基线变化至第24周 Sham + 0.5 mg OPT-302 + 0.5 mg ranibizumab 2.0 mg + 0.5 mg ranibizumab 受试者百分比第 24 周有 SRF 的参与者 24% 受试者 -180 -140 -100 -60 86 -133.5 85 85 -126.8 CST 的平均变化 (SEM) (µm) 0 20 40 88 14.8 87 18.4 0 20 40 86 19.8 85 28.2% 参与者 miTT;如观测所见;柱顶部 — 统计数据,条形底部 — n. CST:中央子场厚度;SRF:视网膜下部液体;IR:视网膜内。
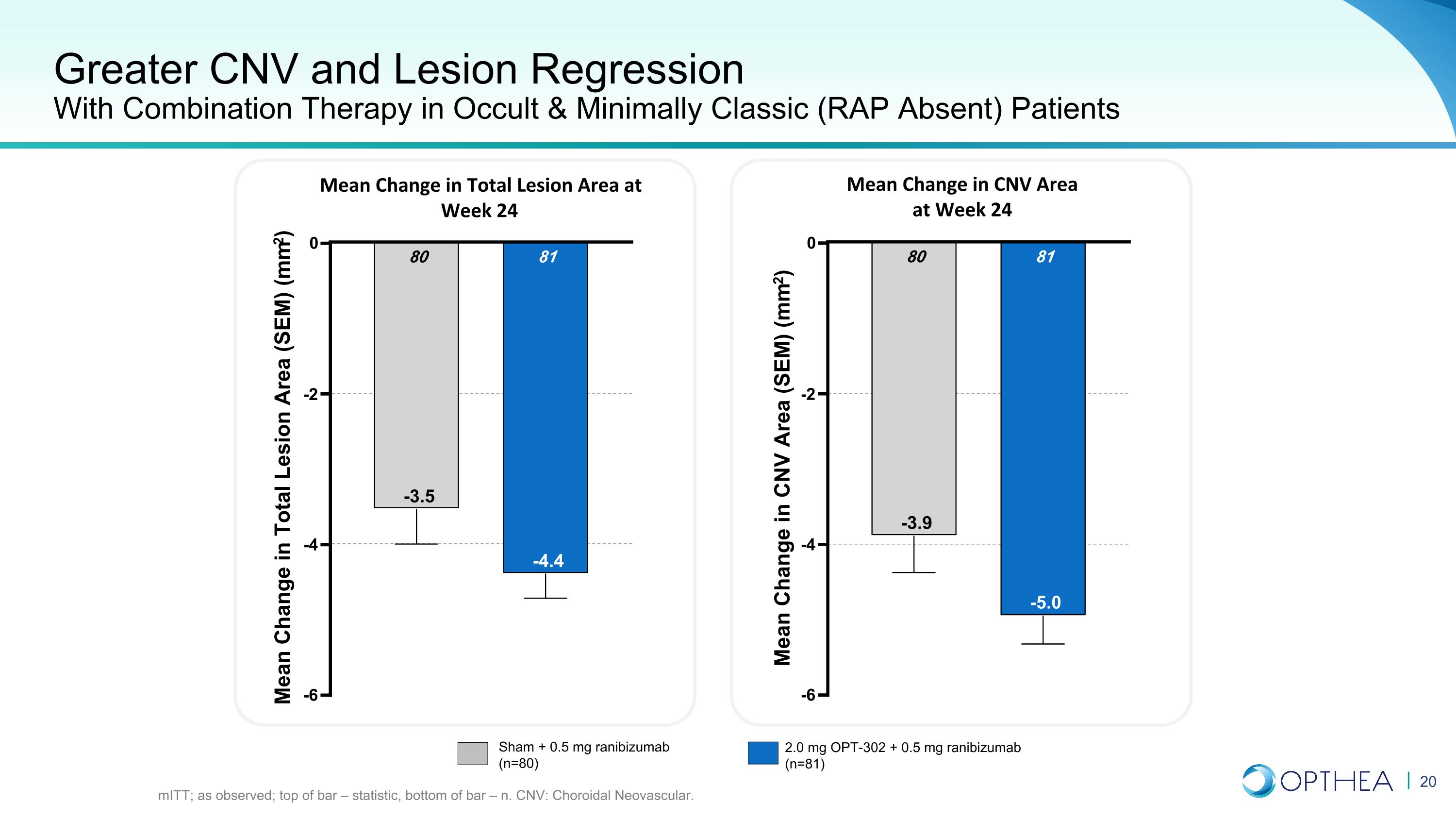
在隐匿和最低限度经典(无RAP)患者中使用联合疗法提高CNV和病变回归率 mitT;如观察;条形顶部 — 统计数据,柱底部 — n. CNV:脉络膜新生血管。第 24 周总病变面积的平均变化 24 周 CNV 面积的平均变化 -6 -4 -2 0 81 -4.4 80 -3.5 总病变面积 (SEM) 的平均变化 (mm2) -6 -4 -2 0 81 -5.0 80 -3.9 CNV 面积 (SEM) (mm2) Sham 的平均变化 + 0.5 mg 雷尼珠单抗 (n=80) 2.0 mg OPT-302 + 0.5 mg ranibizumab (n=81)
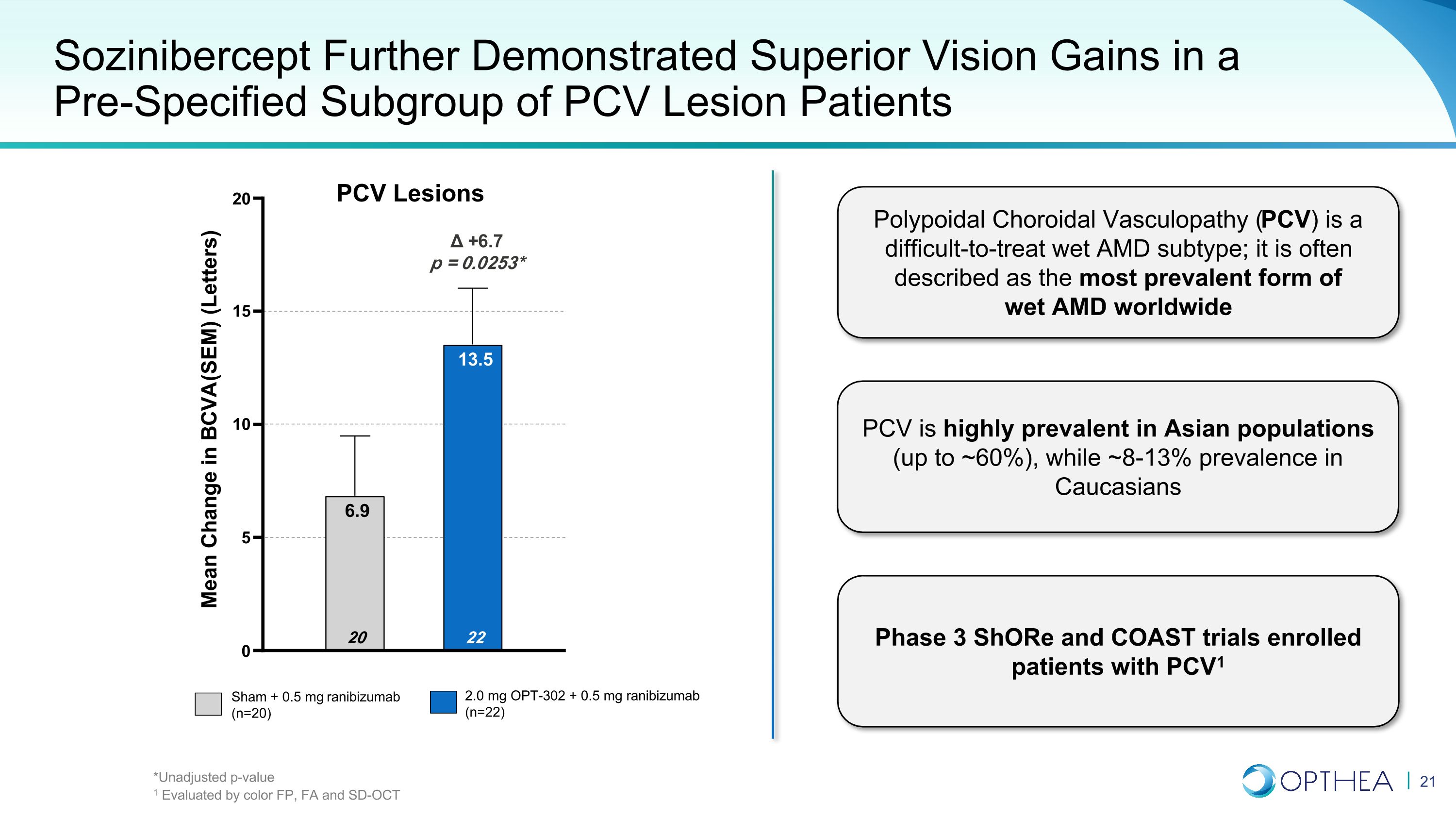
索齐尼伯西普在预先指定的肺炎病毒病变患者亚组中进一步显示出优异的视力增益 Sham + 0.5 mg 雷尼珠单抗(n=20)2.0 mg OPT-302 + 0.5 mg 雷尼珠单抗(n=22)+6.7 p = 0.0253* 0 5 10 15 20 22 13.5 20 6.9 BCVA(SEM)(信件)息肉类脉络膜血管病变的平均变化(字母))是一种难以治疗的湿性AMD亚型;它通常被描述为全球最普遍的湿性AMD形式。PCV在亚洲人群中非常普遍(高达约60%),而在高加索人群中,约8-13%的患病率为3期Shore和COAST试验招收的患者PCV1 PCV 病变 *未调整的 p 值 1 按颜色 FP、FA 和 SD-OCT 进行评估
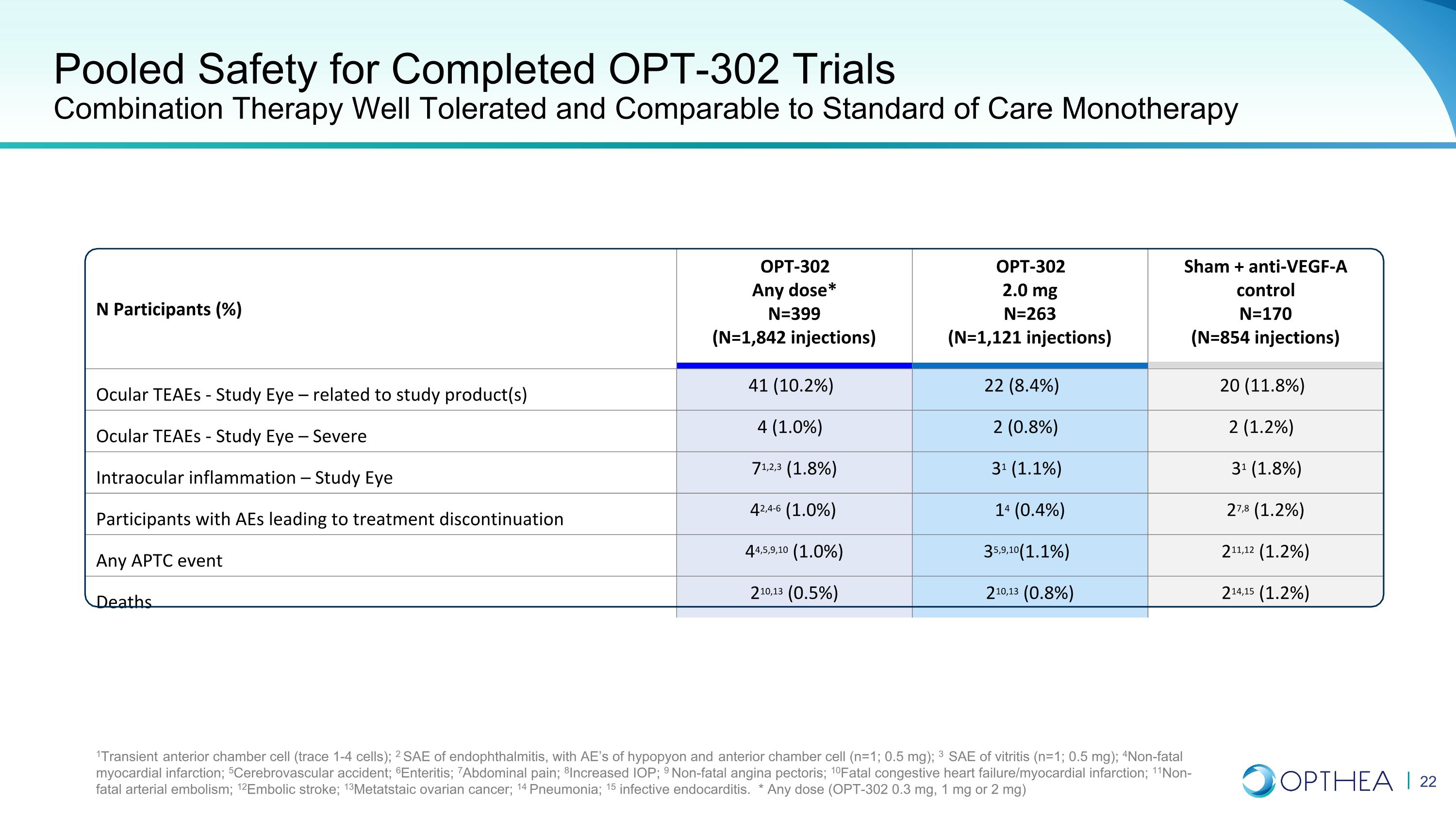
已完成的 OPT-302 试验的合并安全性组合疗法耐受性良好,可与标准单一疗法相媲美 N 名参与者 (%) OPT-302 任何剂量* N=399(N = 1,842 次注射)OPT-302 2.0 mg N=263(N = 1,121 次注射)Sham + 抗 VEGF-A 对照 N=170(N = 854 次注射)Ocular TEAES-研究之眼 — 与研究产品相关 41 (10.1) 2%) 22 (8.4%) 20 (11.8%) 眼部 TEAES — 研究眼部 — 重度 4 (1.0%) 2 (0.8%) 2 (1.2%) 眼内炎症 — 研究眼睛 71,2,3 (1.8%) 31 (1.1%) 31 (1.8%) 31 (1.8%) AE 导致中止治疗的参与者 42,4-6 (1.0%) 14 (0.4%) 27,8 (1.2%) 任何 APTC 事件 44,5,9,10 (1.0%) 35,9,10 (1.1%) 211,12 (1.2%) 死亡 210,13 (0.5%) 210,13 (0.8%) 214,15 (1.2%) 1瞬时性前房细胞(痕量 1-4 细胞);2 眼内炎的 SAE,伴有 AE 垂体和前房细胞(n=1;0.5 mg);3 SAE 玻璃体炎(n=1;0.5 mg);4非致命性心肌梗塞;5脑血管意外;6肠炎;7腹痛;8IOP 增加;9 非致命性心绞痛;10 致死性充血性心力衰竭/心肌梗塞;11非致命性动脉梗塞栓塞;12栓塞性中风;13变性卵巢癌症;14 肺炎;15 感染性心内膜炎。* 任何剂量(OPT-302 0.3 mg、1 mg 或 2 mg)
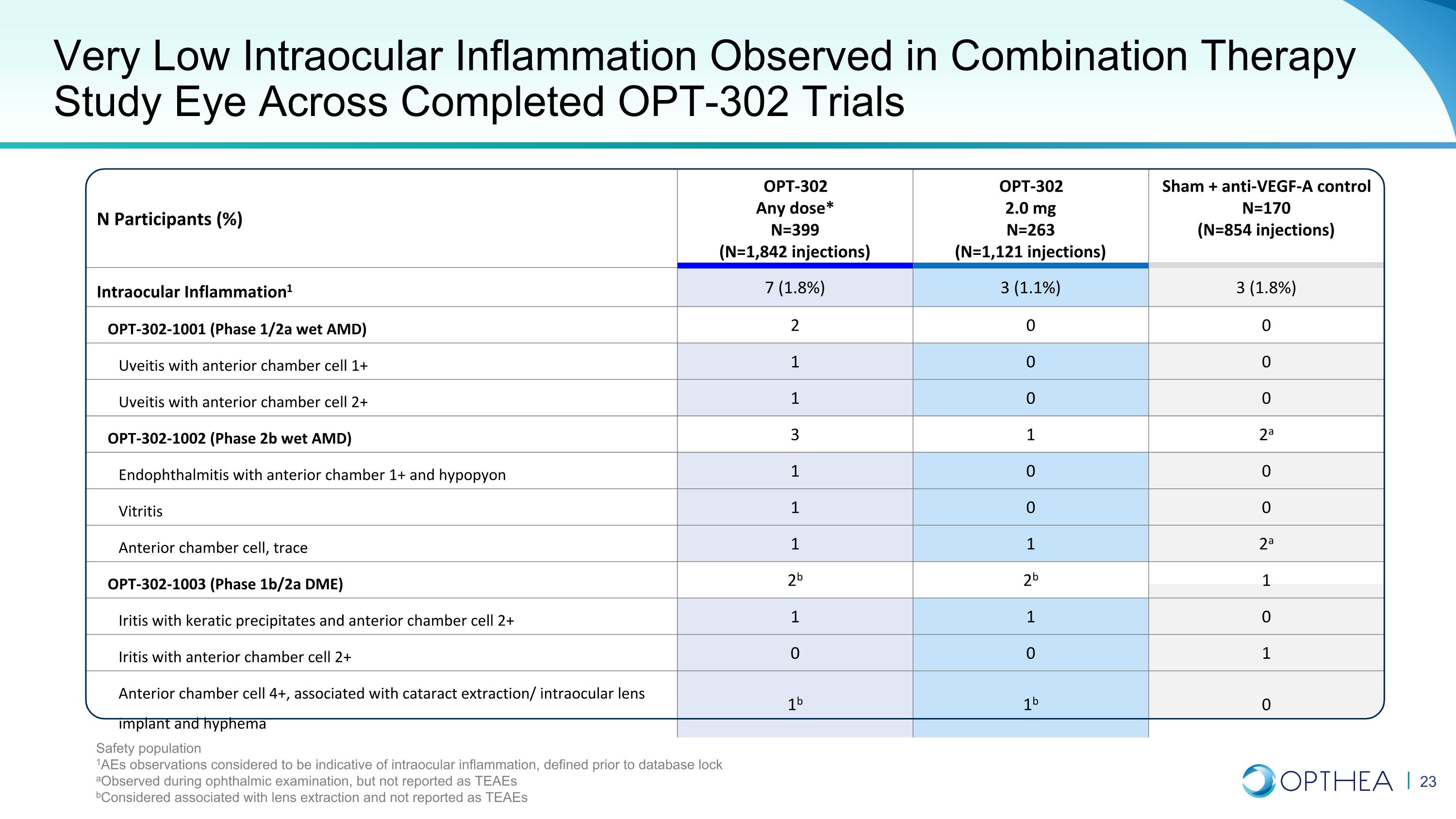
N 名参与者 (%) OPT-302 任意剂量* N=399(N=1,842 次注射)OPT-302 2.0 mg N=263(N=1,121 次注射)Sham + 抗 VEGF-A 对照 N=170(N=854 次注射)眼内炎症1 7(1.8%)3(1.8%)OPT-302-1001(1/2a 期湿式 AMD)2 0 0 伴前列的葡萄膜炎前房细胞 1+ 1 0 0 0 葡萄膜炎伴前房细胞 2+ 1 0 OPT-302-1002(2b 期湿性 AMD)3 1 2a 眼内炎伴前房 1+ 和垂体 1 0 0 0 玻璃体炎 1 0 0 0 前房细胞,痕迹 1 1 2a OPT-302-1003(期 1b/2a DME)2b 2b 1 虹膜炎伴有角膜沉淀物和前房细胞 2+ 1 1 0 虹膜炎伴前房细胞 2+ 0 0 1 前房细胞 4+,与白内障提取/人工晶状体植入和前房积血有关 1b 1b 0 联合疗法研究中观察到的极低眼内炎症在完成的 OPT-302 试验中观察到安全人群 1aE 的观察结果被认为表明眼内炎症,定义在眼科检查期间观察到的数据库锁定之前,但未报告为 TEAE b被认为与晶状体摘除有关,未报告为 TEAE

3期临床项目以2b期结果为依据,针对成功进行了优化分层初步分析首先在高响应的隐秘人群和最低限度经典人群(无RAP)中进行,其次是患者总群两项强有力的关键性试验,研究索齐尼伯西普与Eylea® 和Lucentis® 联合治疗的湿性AMD 3期患者,旨在支持广泛标签,可与任何VEGF-A抑制剂联合使用,适用于所有湿性AMD患者(治疗天真且事先接受过治疗)

第 3 阶段湿性 AMD 试验 COAST 和 Shore 进展顺利完成入组 CY2024 | Topline Data 2025 财年中期设计多中心、双面罩、随机 (1:1:1)、假对照治疗天真湿性 AMD 患者监管质量 ~ 90% 权力,5% I 型错误率每项试验样本量 ~990 名患者每组:2 mg sozinibercept q4w 和 q8w,或假对照比较器 2 mg Eylea® q8w(COAST)和 0.5 mg Lucentis® q4w(Shore)

第 3 阶段主要和次要终点第 52 周的主要疗效终点支持 BLA 提交的主要疗效终点主要次要终点(基线至第 52 周)第 52 周 BCVA 与基线的平均变化获得≥15 个字母的参与者比例脉络膜新生血管形成区域变化同时没有视网膜下积液和视网膜内囊肿的参与者比例
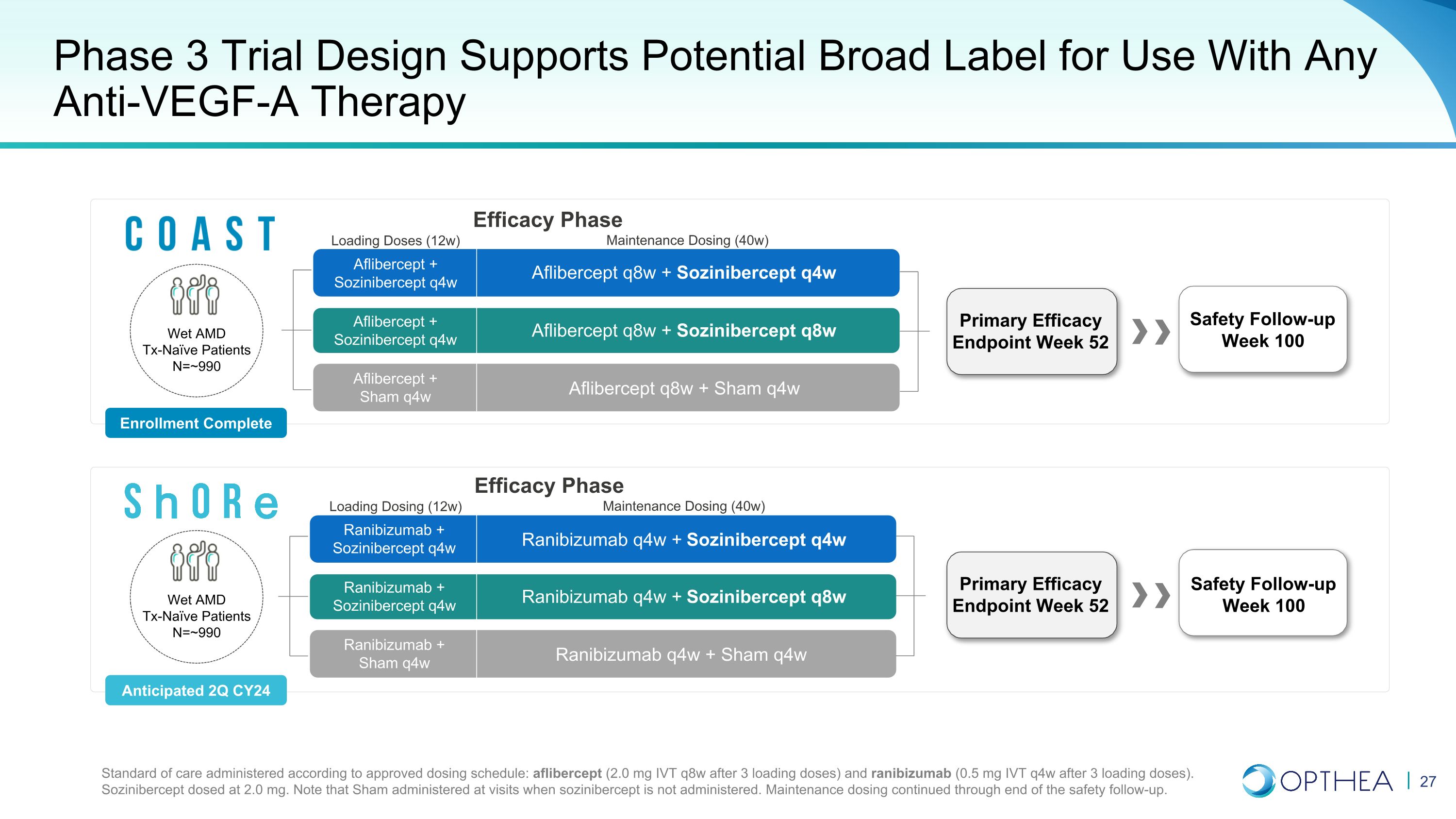
3期试验设计支持任何抗血管内皮生长因子-A疗法的潜在广泛标签雷尼珠单抗 q4w + 索兹尼伯西普 q4w q4w + Sham q4w 雷尼珠单抗 q4w + Sham q4w + Sozinibercept q4w q4w + Sozinibercept q4w q4w + Sozinibercept q4w q4w + Sozinibercept q4w aflibercept q8w + Sozinibercept q4w aflibercept q8w + Sham q4w Aflibercept q8w + Sozinibercept q8w 第 100 周安全随访根据批准的给药时间表给予的护理标准:阿立贝西普(3 次加载剂量后为 2.0 mg IVT q8w)和雷尼珠单抗(负载 3 剂后为 0.5 mg IVT q4w)。索齐尼伯西普的剂量为2.0 mg。请注意,Sham 在不服用 sozinibercept 的就诊时给药。维护剂量一直持续到安全后续行动结束。主要疗效终点第 52 周安全随访第 100 周 100 阿立贝西普 + 索兹尼伯西普 q4w Ablibercept q4w Ablibercept q4w Ablibercept + Sham q4w 雷尼单抗 + 索兹尼伯西普 q4w 雷尼伯西普 q4w Wet AMD Tx-Naieve 患者 =~990 人入组已完成预计 24 财年第二季度维持剂量 (40w) 加载剂量 (12w) 疗效阶段维持剂量 (40w) 加载剂量 (12w) 疗效阶段湿性 AMD Tx-Naieve 患者 N=~990
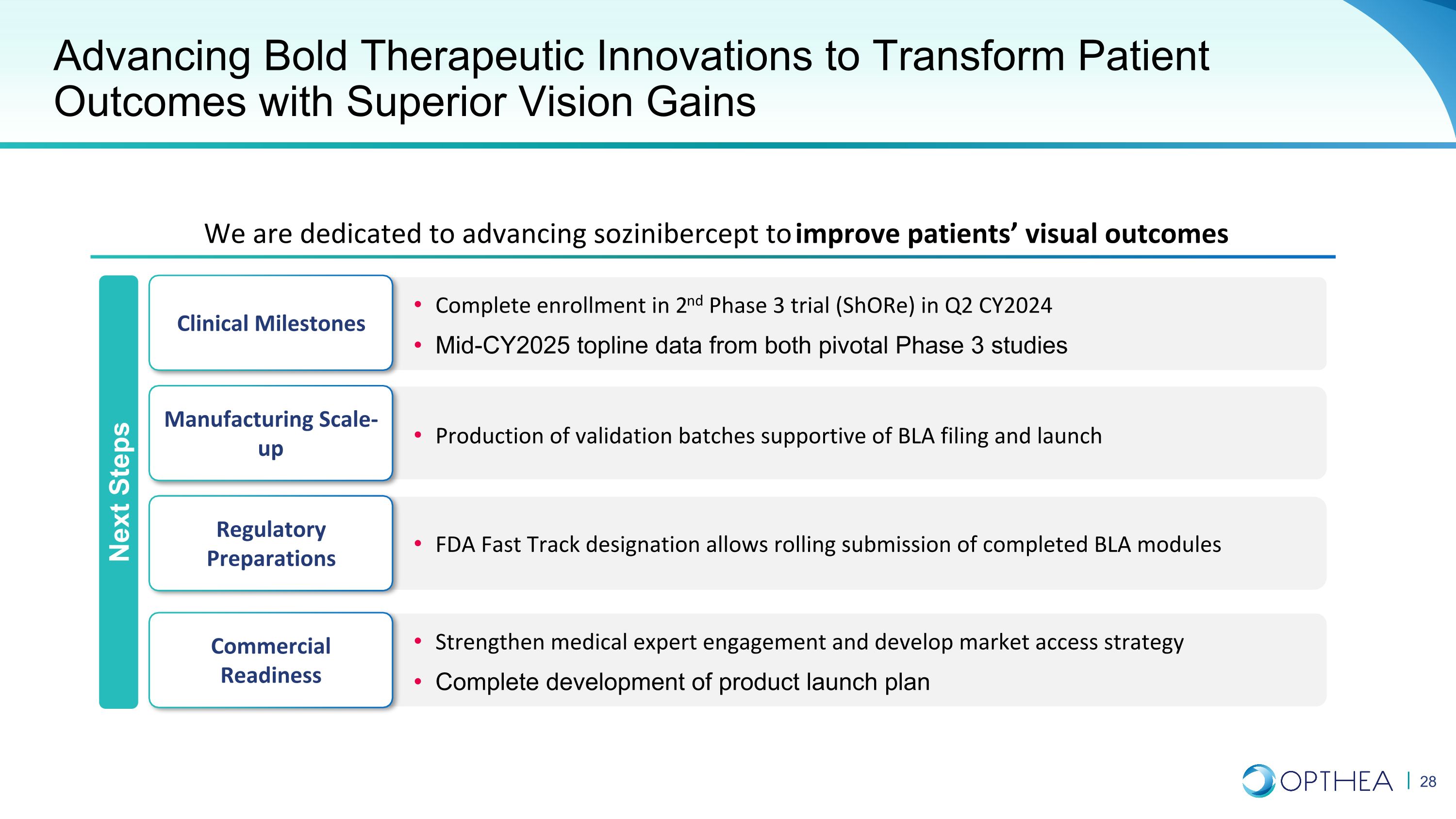
推进大胆的治疗创新,以卓越的视力增益改变患者预后我们致力于推进索齐尼伯西普以改善患者的视觉效果临床里程碑制造业扩大监管制剂商业准备工作在 CY2024 第二季度完成第二阶段三期试验 (Shore) 的注册来自两项关键的三期研究的头条数据 FDA Fast Track 指定允许滚动提交已完成的 BLA 模块生产支持 BLA 申请和启动的验证批次加强医学专家的参与并制定市场准入战略完成产品发布计划的制定后续步骤

财务快照和企业活动财务概览行情股票 OPT(澳大利亚证券/纳斯达克)流通股票16.628亿美元(普通股)/8,290万美元(美国存托证券等价物)现金/现金等价物1 1.571亿美元澳大利亚墨尔本办公室新泽西州普林斯顿开发融资协议(DFA)根据DFA获得的资金总额:1.7亿美元为sozinibercept的开发提供非稀释性资金 cept获得批准,还款分为固定付款和可变付款,占收入的7%,投资上限为4倍,如果临床试验未达到主要终点,则不欠任何款项或者如果未获得监管部门的批准 1 截至 2023 年 12 月 31 日

解决潜在约140亿美元市场中大量湿性AMD患者群体中未得到满足的提高疗效的医疗需求1 Sozinibercept不与任何经批准的以更好的视觉效果为目标的药物差异化组合方法竞争推动商业价值首先也是唯一一种具有新颖和高度差异化MOA的抗VEGF-A疗法表现出卓越视觉效果的疗法。仅在近期或长期的资产中,有可能根据湿式AMD浓缩处方的疗效来破坏治疗模式美国激发潜力通过精益和有针对性的组织实现自我商业化的机会 2 3 4 MOA — 行动机制

谢谢!投资者关系和业务部联系人:info@opthea.com OPTHEA.COM | @OptheaLimited 关注我们:X 和 LinkedIn 纳斯达克(OPT)| 澳大利亚证券交易所(OPT.AX)