

附录 99.2 恢复平衡。更新生活。2b 期 HARMONY 数据 演示:2024 年 3 月 4 日对肝硬化前 MASH 患者进行为期 96 周的依鲁西弗明 (EFX) 治疗的头条结果

前瞻性陈述本演示文稿和随附的 口头评论可能包含AkeroTherapeutics, Inc.(“我们”、“我们的”、“Akero” 或 “公司”)的 “前瞻性陈述”,这些陈述与我们的业务、运营和财务状况有关,包括但不限于当前的信念、预期和假设:我们的业务;未来的计划和战略,包括我们对治疗潜力和临床益处的 期望Efruxifermin(“EFX”),以及EFX的剂量、安全性和耐受性;我们的EFX发展计划,包括我们对EFX作为 基础MASH疗法潜力的信念;我们的临床前和临床结果,包括我们的安全性/耐受性、实验室措施和来自2b HARMONY研究和其他相关里程碑的活检数据;以及从中获得阳性结果的可能性 临床研究不一定能预测未来或正在进行的临床研究的结果;风险与竞争格局有关。诸如(但不限于)“期待”、“相信”、 “期望”、“预测”、“估计”、“打算”、“计划”、“将”、“应该” 和 “可以” 等词语以及类似的表达方式或词语可识别前瞻性 陈述。新的风险和不确定性可能会不时出现,因此不可能预测所有的风险和不确定性。除非法律要求,否则即使将来有新的信息,我们也没有义务公开更新这些前瞻性陈述,或者 更新实际结果可能与前瞻性陈述中预期的结果存在重大差异的原因。有关这些以及其他风险和不确定性以及其他 重要因素的讨论,其中任何一个都可能导致我们的实际业绩与前瞻性陈述中包含的有所不同,请参阅我们最近向美国证券交易委员会提交的10‐K表年度报告和 表10‑Q季度报告中题为 “风险因素” 的部分,以及对潜在风险、不确定性和其他重要因素的讨论我们随后向美国证券交易所 委员会提交的其他文件。本演示文稿中的所有信息均截至本文发布之日,除非法律要求,否则我们没有义务更新这些信息。本演示文稿中包含的某些信息涉及或基于研究、 出版物、调查和其他从第三方来源获得的数据以及公司自己的内部估计和研究。尽管该公司认为截至本演示文稿之日这些第三方来源是可靠的,但 它尚未独立核实,也没有对从第三方来源获得的任何信息的充分性、公平性、准确性或完整性做出任何陈述。此外,本演示文稿中包含的所有市场数据 都涉及许多假设和局限性,无法保证此类假设的准确性或可靠性。最后,尽管我们认为自己的内部研究是可靠的,但此类研究尚未得到任何 独立来源的证实。©2024 AKERO THERAPEUTICS。2

EFRUXIFERMIN (EFX):一种双价 fc-FGF21 融合蛋白 96 周 ≥1 阶段纤维化改善后显著效果混合纤维化纤维化和分辨率 MASH 分辨率改善 ©2024 AKERO THERAPEUTICS。3

HARMONY 试验设计:肝硬化前 (F2-F3) MASH 在 24 和 96 周进行肝组织学检查第 96 周主要分析第 24 周主要终点 •≥ 1 或 2 阶段纤维化改善且无恶化 •≥ 1 阶段纤维化改善 • MASH 解除且无纤维化恶化以及 MASH 无恶化 • 纤维化改善和 MASH 分辨率 • 第 24 周主要终点完全开启;不是全力支持 96 周终点 72 周长期随访 24 周安慰剂安慰剂 EFX 28mg EFX 28mg EFX 50mg EFX 50mg EFX 50mg EFX 50mg EFX 50mg 筛查第 24 周 96 周肝活检活检肝活检 ©2024 AKERO THERAPEUTICS。4 期 2b 筛查随机分组
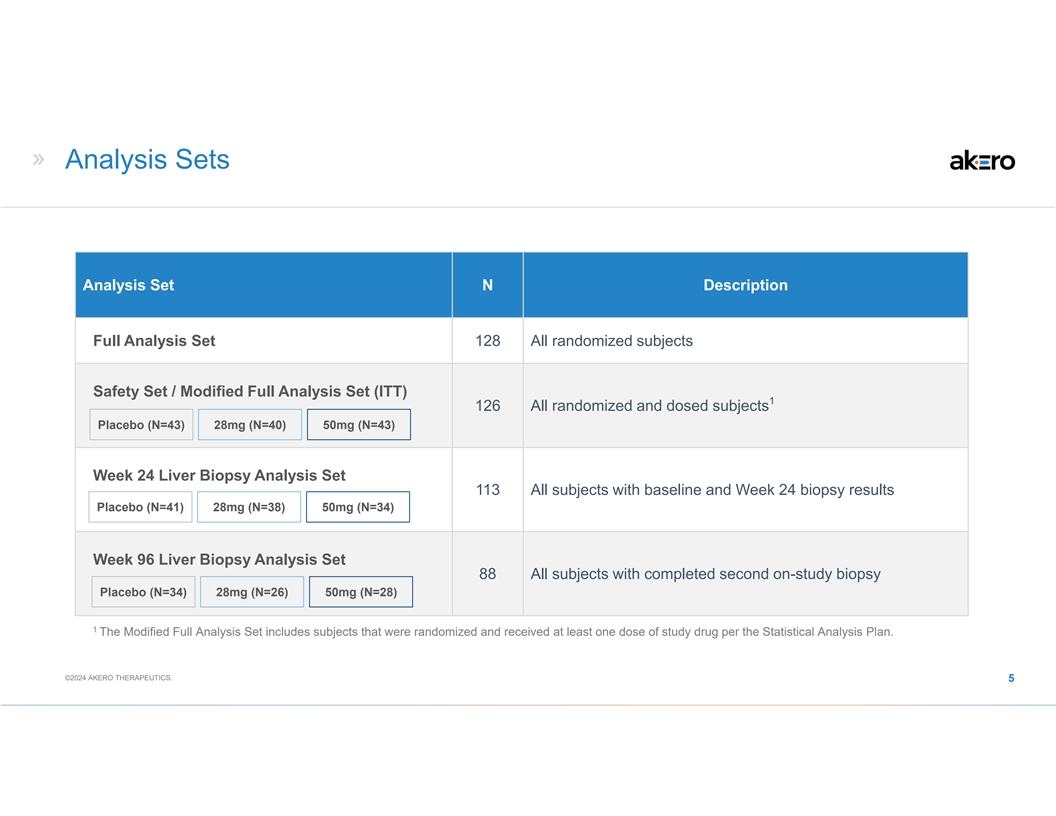
分析集分析集 N 描述完整分析集 128 全部 随机受试者安全套装/修改后的完整分析集 (ITT) 1 126 所有随机和给药受试者安慰剂 (N=43) 28mg (N=40) 50mg (N=43) 第 24 周肝活检分析集 113 所有具有基线和第 24 周活检结果的受试者安慰剂 (N=41) 28mg (N=38) 50mg (N=38) 50mg (N=34) 第 96 周肝活检分析套装 88 所有完成第二次研究活检的受试者安慰剂 (N=34) 28mg (N=26) 50mg (N=28) 1 修改后的完整分析套装包括随机分组并在 接受治疗的受试者根据统计分析计划,至少服用一剂研究药物。©2024 AKERO THERAPEUTICS。5

基线人口统计安慰剂 EFX 28mg EFX 50mg 参数(单位)(N = 43) (N = 42)(N = 43)年龄(岁)55 57 52 性别(% 女性)63 69 53 体重(kg)108 104 103 2 型糖尿病(%)65 76 70 1 纤维化阶段(% F3)70 64 63 基线时接受 GLP-1 治疗的患者比例(%)21 18 9 增强型肝纤维化 (ELF) 评分 9.8 9.7 9.8 2 Pro-C3 (μg/L)(第 2 代 ELISA)125 113 145 3 按 VCTE(FibroScan)得出的肝硬度(kPa)15 14 16 4 按 MRI-PDFF 得出的肝脂肪分数(%)17.1 18.5 17.5 MASLD 活性评分 (MAS) 5.4 5.1 5.6 丙氨酸氨基转移酶 (ALT) (U/L) 62 5063 天门冬氨酸氨基转移酶 (AST) (U/L) 57 42 52 1 2 3 4 所有患者纤维化阶段 2 (F2) 或 3 期 (F3);Procollagen 3 N 末端丙肽;振动控制瞬态弹性成像;磁共振成像质子密度脂肪 分数 ©2024 AKERO THERAPEUTICS。源数据:完整分析集 (FAS) 6

≥1 阶段纤维化改善,MASH 无恶化: 在第 96 周观察到 50 mg EFX 有统计学上的显著反应纤维化改善 ≥1 阶段,第 96 周 MASH 没有恶化初步分析 *** 80% 75% 60% 46% 40% 2 ITT 分析安慰剂 EFX 28mg EFX 50mg 24% (N=43) (N=43) 20% ** 19% 49% 2 所有缺失的活检均归咎为无反应者 0% ** p

≥1 阶段纤维化改善且无恶化 MASH: 持续、广泛和持久的反应纤维化改善 ≥1 阶段,MASH 在第 96 周没有恶化 1 2 第 24 周持续和新反应者中有 *** 80% 75% 3,5 安慰剂 EFX 28mg EFX 50mg (N=12) (N=12) 60% 新增 (n=10) 2 (40%) 10 (83%) 11 (92%) 46% 新增 (n=2) 40% 第 24 周无反应者的比例 4,5 在第 96 周有新反应 24% 持续安慰剂 EFX 28mg EFX 50mg 持续 20% (n=11) (n=10) (N=29) (N=14) (N=16) (n=6) 6 (21%)) 2 (14%) 10 (63%) Sust。(n=2) 0% 安慰剂 EFX 28mg EFX 50mg 1 3 在第 24 周进行第 96 周活检的受访者中 N=34 N=26 N=28 4 在第 24 周进行第 96 周活检的无反应者中 1 2 *** 5 响应者;第 96 周的响应者 p

EFX 纤维化改善情境:肝硬化前 MASH:纤维化改善≥1阶段 且MASH Efruxifermin Pegozafermin Denifanstat 瑞斯美替罗塞玛鲁肽曲塞肽舒沃杜肽2b期 (F2-F3) 2b期 (F2-F3) 2b 期 (F2-F3) 3 期 (F1-F3) 2b 期 (F2-F3) pH2b期 () pH2b期 b (F2-F3) Ph 2b (F1-F3) 96 Wks/ 66% F3 24 Wks/ 65% F3 52 Wks/ 65% F3 52 Wks/?% F3 52 Wks/ 62% F3 72 Wks/ 69% F3 52 Wks/?% F3 48 Wks/?% F3 共识阅读共识读数?阅读统计学综合共识读数 1 1 1 2 2 完成者完成者 ITT ITT *** *** 75% 46% 43% **** 41% 33% 32% ***** 26% *** 26% *** 24% *22% 24% * 22% 纤维化纤维化 18% 改善未有 14% 公开报道的这款 GLP-1R/GCGR 7% 双激动剂 安慰剂 28mg 50mg 安慰剂 15mg 30mg 安慰剂 50mg 安慰剂 80mg 100mg 安慰剂 0.2mg 0.4mg 所有剂量组 (N=34) (N=26) (N=28) (N=61) (N=61) (N=66) (N=81) (N=318) (N=316) (N=321) (N=321) (N=58) (N=59) (N=56)(N196) (N=295) 1 2 注:这些数据来自不同时间点的不同临床试验,有基线活检和研究结束活检;缺失活检归因于无反应者在试验设计和患者群体中的差异。因此, 无法进行跨试验比较 Pegozafermin——89Bio(2023)3月22日公司介绍;Denifanstat — Sagimet(2024)1月22日新闻稿;也没有进行过正面交叉临床试验。Resmetirom — Madrigal (2022) 12 月 19 日新闻稿;Semaglutide-Newsome 等人(2021)New Engl J Med 384、1113-* ** *** 24;替塞帕肽 — clinicaltrials.gov,NCT04771273;所有商标均为财产 p NCT04166773

2 阶段纤维化改善且 MASH 没有恶化:统计学上 两组 EFX 均观察到显著反应纤维化改善 2 阶段,MASH 在第 96 周没有恶化 1 初步分析 40% *** *** 31% 30% 20% 2 ITT 分析安慰剂 EFX 28mg EFX 50mg (N=40) (N=43) 10% **** 2% 23% 3% 2 活检缺失的受试者被归咎为无反应者 0% ** p

EFX 纤维化改善情境:肝硬化前 MASH:纤维化改善≥2阶段 且MASH Efruxifermin Resmetirom Semaglutide 2b 期(F2-F3)3 期(F1-F3)2b 期(F2-F3)96 Wks/66% F3 52 Wks/62% F3 72 Wks/69% F3 共识读者两位读者共识读者 1 2 2 完成者 ITT ITT ** ** 36% ** ** 31% 26% 22% 20% 仅改善纤维化(未报告 MASH 恶化)10% 8% 3% 3% 安慰剂 28mg 50mg 安慰剂 80mg 100mg 安慰剂 80mg 100mg 安慰剂 0.2mg 0.4mg(N = 34)(N = 26)(N = 28)(N = 318)(N = 321)(N = 58)(N = 58)(N = 58)(N = 58)(N = 58)(N = 58)(N = 58)(N = 58)(N = 58)(N = 58)(N = 58)(N = 58)(N = 58)(N = =59) (n=56) 1 2 注意:这些 数据来自不同时间点的不同临床试验,有基线活检和研究结束活检;缺失的活检归因于试验设计和患者群体中无反应者的差异。因此,无法进行跨试验 比较Pegozafermin-89Bio(2023)3月22日公司介绍;Denifanstat — Sagimet(2024)1月22日新闻稿;也没有进行过正面交叉临床试验。Resmetirom — Madrigal (2022) 12 月 19 日新闻稿;Semaglutide-Newsome 等人 (2021) New Engl J Med 384、1113-24 ** p

≥1 阶段纤维化改善,MASH 无恶化: 在 F3 患者中观察到 50 mg EFX 纤维化改善 ≥1 阶段,MASH 在第 96 周没有恶化 1 F3 纤维化子集 *** *** 68% 2 阶段 (n=8) 40% 2 阶段 (n=5) 14% 1 阶段 (n=5) 1 阶段 (n=3) 1 阶段 (n=1)) 安慰剂 EFX 28mg EFX 50mg N=22 N=15 N=19 1 *** 基线和第 96 周活检时为 F3 的患者 p

MASH 分辨率和纤维化无恶化:统计学上 两组 EFX 均观察到显著反应 MASH 分辨率且无纤维化恶化第 96 周 1 初步分析 70% ** ** 60% 57% 50% 40% 2 ITT 分析 30% 24% 安慰剂 EFX 28mg EFX 50mg 20% (N=40) (N=43) * 19% 40% 37% 10% 2 活检缺失的受试者被归咎为无反应者 0% * p

≥1 阶段纤维化改善和 MASH 分辨率:统计学上 在两个 EFX 组中均观察到显著的反应纤维化改善 ≥1 阶段和 MASH 分辨率 96 1 初步分析 60% ** *** 42% 40% 30% ** 42% 30% 2 ITT 分析安慰剂 EFX 28mg 28mg 20% (N=43) (N=43) 9% ** 10% 28% 35% 2 ITT 分析安慰剂 EFX 28mg 50mg 20% (N=43) (N=43) 9% ** 10% 28% 35% 2 受试者活检缺失被归咎为无反应者 0% ** p

非侵入性标志物的统计学显著下降反映 纤维化的组织学改善 LS 从基线到第 96 周的平均变化 ELF 评分 Pro-C3 (ng/mL) (GEN2 ELISA) 肝硬度 (kPa) 0.0 0 2 -0.1 -10 0 -0.2 -0.6 † -20 -17 -0.4 -30 -4 * -4.0 -40 -0.8 -6 †† -40 -0.7 -0.8 *-50 -8 -7.2 ** -0.8 ** -51 -1.0 -60 -10 安慰剂 EFX 28mg EFX 50mg 安慰剂 EFX 28mg EFX 50mg 安慰剂 EFX 28mg EFX 50mg 安慰剂 EFX 28mg EFX 50mg n=27 n=25 ** p

肝损伤标志物的统计学显著改善 持续到第 96 周 ALT AST LS 与基线的平均变化百分比 LS 平均变化百分比:50-63 U/L 基线:42-57 U/L 20% 10% 10% 0% 0% -10% ***** -20% *** -30% *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** -40% *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** -50% *** -50% *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** -60% -60% BL W8 W16 W24 W32 W40 W48 W56 W64 W72 W80 W88 W96 BL W8 W16 W24 W40 W48 W56 W64 W72 W80 W88 W80 W88 W96 安慰剂 28mg EFX 50mg EFX 安慰剂 28mg EFX 50mg EFX *** *** p

治疗紧急不良事件 (TEAE) 从基线到第 96 周安慰剂 EFX 28mg EFX 50mg TEAE 概述 (N=43) (N=40) (N=43) TEAE 导致死亡 0 (0%) 0 (0%) 0 (0%) a a b b 与药物相关的严重不良事件 (SAEs) 0 (0%) 1 (2%) c d d e, f 与药物无关的 SAE 4 (9%) 3 (8%) 6 (14%) G、h g、h i、j i、j 药物相关的 TEAE 导致停药 0 (0%) 4 (10%) 3 (7%) k、l k、l 非药物相关的 TEAE 导致停药 0 (0%) 0 (0%) 2 (5%) 最常见 (≥ 15%) 药物相关的 TEAE 安慰剂 EFBO X 28mg EFX 50mg 腹泻 7 (16%) 16 (40%) 16 (37%)恶心 5 (12%) 12 (30%) 14 (33%) 食欲增加 3 (7%) 7 (18%) 10 (23%) 10 (23%) 注射部位红斑 6 (14%) 8 (20%) 7 (16%) 注射部位瘀伤 2 (5%) 6 (15%) 3 (7%) a 28mg EFX,药物相关的 SAE(第 24 周后):胰腺炎(非 在影像学检查中确认并在 24 年内出院小时) b 50mg EFX,药物相关 SAE(之前曾报道):食管炎 c 安慰剂,非药物相关的 SAE(第 24 周后):(1)阑尾炎;(2)骨关节炎;(3)胸痛;非心脏性的;(4)缺氧 d 28mg EFX,非药物相关的 SAE(第 24 周后):(1)胃炎;(2)脚踝;下肢骨折(车祸);(3)冠状动脉痉挛;惊恐发作 e 50mg EFX,与药物无关 SAE(先前报道):(1)COVID-19 病毒感染;(2)面部水肿;(3)急性坏死性胰腺炎 f 50mg EFX,非药物相关的 SAE(第 24 周后):(1)非典型胸痛(非心脏辐射)背部;(2)急性胸痛;(3)急性呼吸衰竭 g 28mg EFX,药物相关不良反应导致 停药(先前曾报道):(1)食欲增加和体重增加;(2)腹泻;h 28mg EFX,药物相关不良反应导致停药(第 24 周后):(1)胰腺炎(SAE 上文报道);(2)腹泻 i 50 mg EFX,药物相关的 AE 导致停药(先前曾报道):(1)食道炎和呕吐;(2)恶心 j 50mg EFX,与药物相关的不良反应导致停药(第 24 周后):(1)腹泻 k 50mg EFX,非药物相关的 AE 导致停药 (先前报道):(1)淋巴结肿大 l 50mg EFX,与药物无关的 AE 导致停药(第 24 周后):(1)急性坏死性胰腺炎来源数据:安全套装 17 ©2024 AKERO THERAPEUTICS。

安全概述血压 • 第 96 周收缩压和舒张压与 安慰剂没有统计学差异 96 肝功能和止血标志物 1 2 3 • 保持稳定,包括血小板、胆红素、INR、MELD 和 CP 评分进展为肝硬化 • 各剂量组骨骼 矿物质密度 (BMD) 均衡 • HARMONY 中的大多数患者处于绝经后年龄,其中每年骨密度损失通常预计为1%至1.5% • 在第48周,腰椎和股骨 颈部区域与安慰剂相比没有显著变化 • 安慰剂组到第96周,腰椎骨密度增加了约1% • 在第96周,腰椎(均为EFX组,均为3-4%)和股骨颈区域( )与安慰剂相比显著降低

96 周后脂蛋白分布的改善 LS 从 基线到第 96 周的平均变化 (%) 甘油三酯 (% 变化) 非高密度脂蛋白 (% 变化) LDL (% 变化) 15% 10% 40% 8% 10% 10% 10% 10% 10% *5% 3% 3% 0% *-5% 0% 20% 18% -10% -5% -5% 10% *-15% 10% *15% -20% *** 5% 5% 30% 3% 0% *-5% 0% 20% -2% -15% -5% 10% *15% -20% *** -20% -10% -25% -10% 安慰剂 EFX 28mg EFX 50mg 安慰剂 EFX 28mg EFX 50mg 安慰剂 EFX 28mg EFX 50mg 安慰剂 EFX 28mg EFX 50mg 安慰剂 EFX 28mg EFX 50mg n=26 n=27 *** p
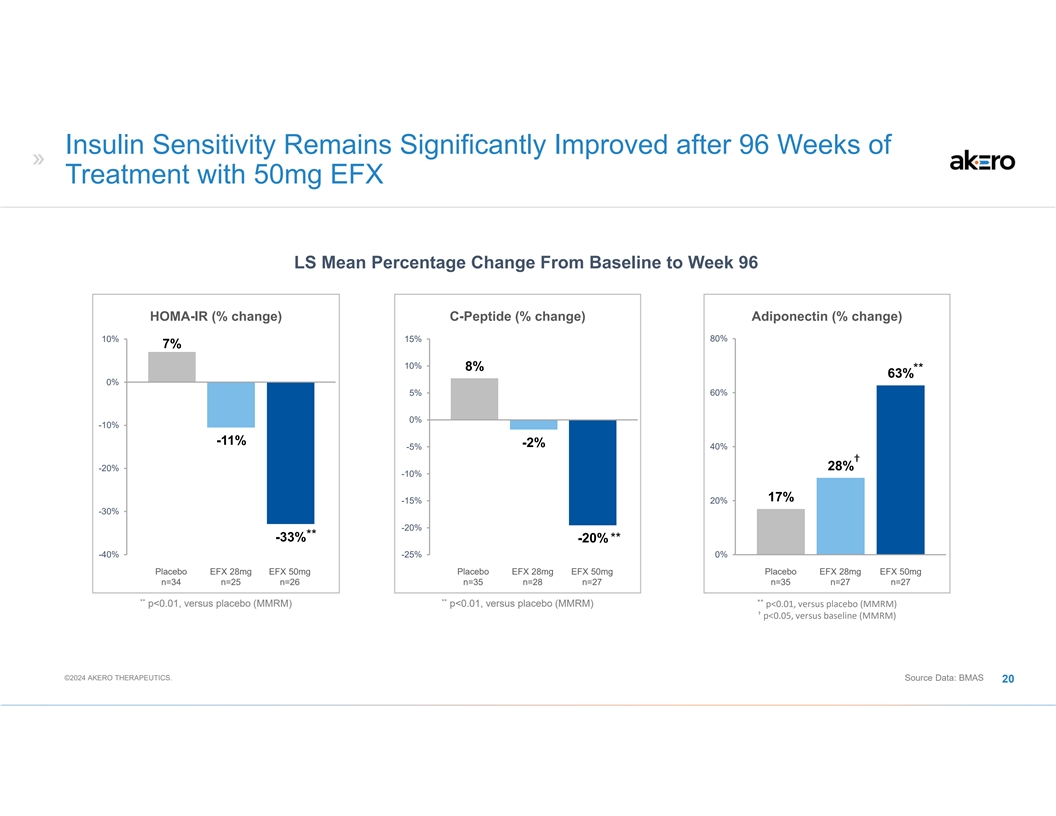
使用 50 毫克 EFX LS 治疗 96 周后,胰岛素敏感性仍显著改善 HOMA-IR(变化百分比)C 肽(% 变化)脂联素(% 变化)80% 10% 7% 10% 10% 10% 10% 8% ** 63% 0% 0% -10% -11% -2% 40% † 28% -20% -10% -10% -10% -10% -20% 20% -20% 20% -33% ** 63% 0% 0% -10% -11% -2% -20% ** -40% -25% 0% 安慰剂 EFX 28mg EFX 50mg 安慰剂 EFX 28mg EFX 50mg 安慰剂 EFX 28mg EFX 50mg 安慰剂 EFX 28mg EFX 50mg n=34 n=25 n=26 n=35 n=27 ** p
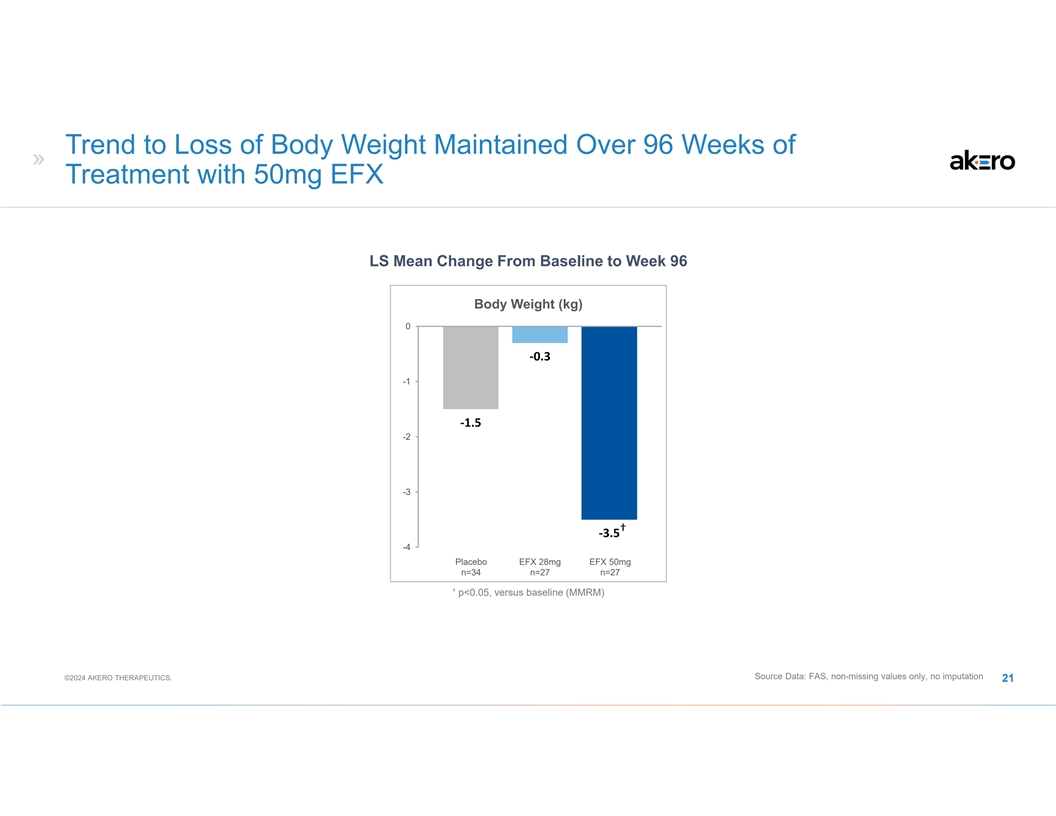
使用 50mg EFX LS 治疗 96 周内保持体重减轻的趋势从基线到第 96 周的平均体重变化 (kg) 0 ‐0.3 -1 -1 ‐1.5 -2 -3 † ‐3.5 -4 安慰剂 EFX 28mg EFX 50mg n=34 n=27 † p

要点:96 周后 50 毫克 EFX 史无前例的深度广泛耐用 晚期 24 周纤维化 ≥1 阶段转化为第 96 周 2 期改善纤维化反应者 F3 1 2 3 的非纤维化改善 4 5 名反应患者 *** 6 6 *** 75% 对 24% 36% 对 3% 63% 对 20% 92% 对 40% 68% 对 14%(50mg EFX 对比 14%)(50mg EFX 对比安慰剂)(50mg EFX 对比安慰剂)(50mg EFX 对比安慰剂)(50mg EFX 对比安慰剂)(50mg EFX 对比安慰剂)*** p

AKERO THERAPEUTICS 601 Gateway Boulevard 纳斯达克:AKRO 纳斯达克:AKRO 套房 350 加利福尼亚州南旧金山 94080