
Legend Biotech 公司介绍本演示文稿仅用于投资者关系
目的——不用于产品促销目的 2024 年 1 月

免责声明 3 本演示文稿仅用于投资者关系目的 — 不适用于
产品促销目的。本演示文稿由联想生物科技公司(“Legend Biotech” 或 “公司”)编写,仅供参考,不包含与公司有关的所有相关信息。本演示中讨论的药物和/或用途的
安全性和有效性尚未确定,除非先前从相关卫生
当局获得的上市许可中特别规定。此外,对于研究药物和/或用途,公司无法保证卫生当局的批准,也无法保证此类药物和/或用途将在任何国家上市。本
演示文稿中包含的某些信息以及本演示期间的口头陈述涉及或基于从第三方来源获得的研究、出版物、调查和其他数据,以及Legend Biotech自己的内部估计和研究。尽管Legend
Biotech认为截至本演示文稿之日这些第三方来源是可靠的,但它尚未独立核实
从第三方来源获得的任何信息的充分性、公平性、准确性或完整性,也没有做出任何陈述。尽管Legend Biotech认为其内部研究是可靠的,但此类研究尚未得到任何独立来源的证实。本演示文稿中关于未来预期、计划和前景的陈述,以及
以及有关非历史事实事项的任何其他陈述,均构成 1995 年《私人证券诉讼改革法》所指的 “前瞻性陈述”。这些声明包括但不限于与联想生物科技战略和目标有关的
声明;与CARVYKTI® 相关的声明,包括联想生物科技对CARVYKTI® 的预期,包括对CARVYKTI® 的生产预期;以及关于监管部门提交CARVYKTI® 的声明,以及向美国食品和药物管理局、欧洲药品管理局和其他监管机构提交此类文件的进展情况;以及临床试验的预期结果和时间;Legend Biotech 对 LB2102 及其潜在益处的期望;
Legend Biotech 的能力完成与诺华的许可交易以及该交易的潜在收益;联想生物对推进其产品线和产品组合的期望;以及联想生物技术
候选产品的潜在好处。“预期”、“相信”、“继续”、“可以”、“估计”、“预期”、“打算”、“可能”、“计划”、“潜在”、“预测”、“项目”、“应该”、“目标”、“将” 和类似的表述旨在识别
前瞻性陈述,尽管并非所有前瞻性陈述都包含这些识别词。由于各种重要因素,实际结果可能与此类前瞻性陈述所示的结果存在重大差异。
Legend Biotech的预期可能会受到以下因素的影响:新药产品开发所涉及的不确定性;意想不到的临床试验结果,包括对现有
临床数据或意想不到的新临床数据进行额外分析的结果;意想不到的监管行动或延迟,包括要求提供额外的安全性和/或有效性数据或对数据的分析,或一般的政府监管;由于我们的第三方
采取行动或未能采取行动而导致的意外延迟派对伙伴;联想生物的专利或其他专有知识产权保护面临挑战所产生的不确定性,包括美国
诉讼程序中涉及的不确定性;总体竞争;政府、行业、一般产品定价和其他政治压力;COVID-19 疫情的持续时间和严重程度以及为应对
不断变化的形势而采取的政府和监管措施;以及联想生物科技20-F表年度报告 “风险因素” 部分讨论的其他因素已归档2023年3月30日向美国证券交易委员会(SEC)提交了文件,联想生物科技向美国证券交易委员会提交的其他
文件。如果其中一种或多种风险或不确定性成为现实,或者基本假设被证明不正确,则实际结果可能与本演示文稿中描述的预期、认为、
估计或预期的结果存在重大差异。本演示文稿中包含的任何前瞻性陈述仅代表截至本演示文稿之日。Legend Biotech明确声明不承担任何更新任何前瞻性陈述的义务,无论是由于新信息、未来事件还是其他原因造成的。

Legend Biotech重点介绍核心技术:CAR-T,包括通用
CAR CAR-NK — T3 CARVYKTI® 的全球制造基地:3 本演示仅用于投资者关系目的 — 不用于产品促销目的 1 个美国基地 2 个欧盟(根特)工厂 4 1 诺华基地
(CMO)管道计划涵盖:血液系统恶性肿瘤现金和现金等价物、存款, 和短期投资5 1.与强生合作;2.请阅读处方信息以获取全部安全信息
:https://www.janssenlabels.com/package-insert/product-monograph/prescribing-information/CARVYKTI-pi.pdf;3. gamma delta T 细胞;4.欧盟和中国制造基地建设正在进行中;5.截至 2023 年 9 月 30 日上市产品:CARVYKTI®(ciltacabtagene autoleucel;cilta-cel)自成立以来已有 1,2 年了,是最早为 BCMA 蛋白设计 CAR-T 细胞的公司之一致力于研发的员工

CARVYKTI® 的吸收仍在继续 → 美国季度增长23%
主要是由以下因素推动的:成功的启动执行深化市场份额产能改善使美国活跃的治疗场所数量增加到64个 → 由于德国的推出,欧盟季度增长了300%。持续的市场渗透率、地域扩张和
人口是重要的增长动力和机会 CARVYKTI® 产品净销售额(百万美元)+176%的增长 vs
22 年第三季度美国欧盟 24 55 55 70 114 140 0 0 0 0 0 0 2 3 12 0 20 40 60 100 120 120 140 160 2022年第二季度第二季度第三季度2022年第四季度第一季度2023 年 2023 年第二季度 2023 年第三季度同比增长比 23 年第二季度增长美国 155% 23% 欧盟
N/A 300% 全球 176% 30% 本演示文稿仅用于投资者关系目的——不用于产品促销目的
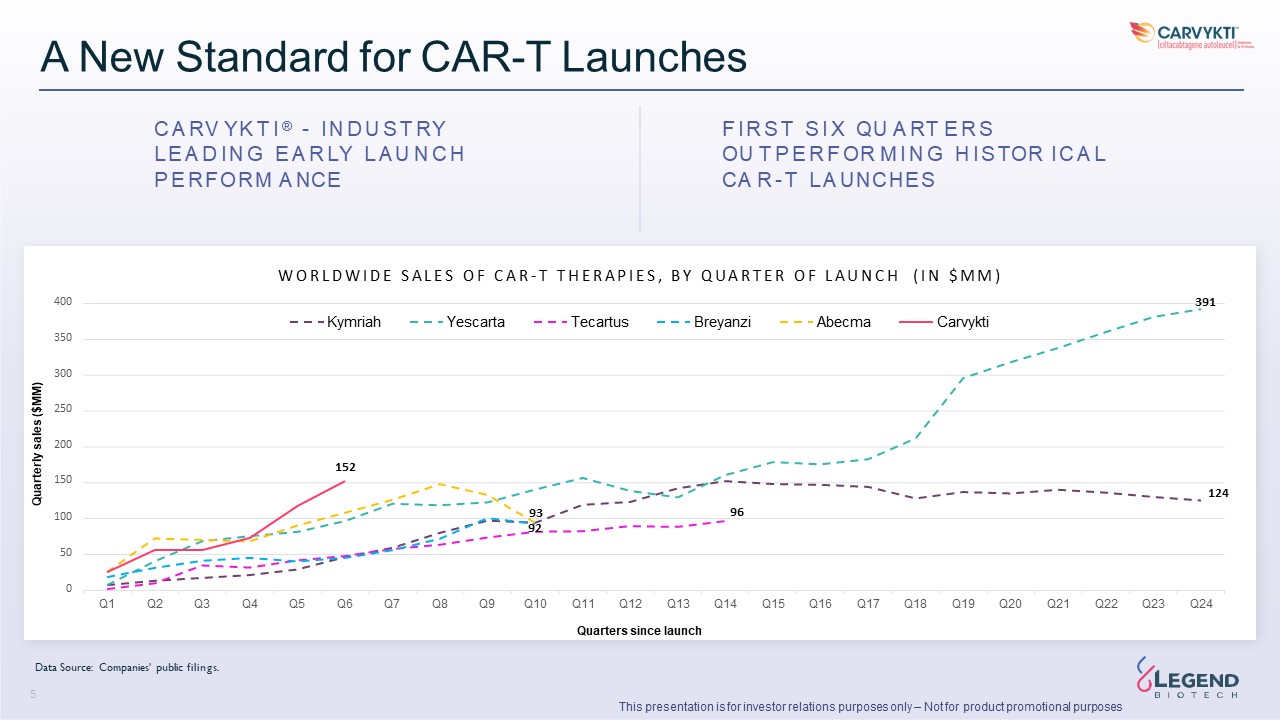
CAR-T 发布的新标准 C A RV YK T I®-I N D U S T RY L E A D I N G
E A R LY U U N C H P E REFORM A NICE F I X QUA RT A RT E R S OU T X QUA RT E R S OUT P E R S OU T P E X QUA RT E R S OUT P E R S OU T P E X QUA RT E R S OUT P E R S OU T P E R S OUT P E R S OU T P E R S OUT P E O M I N N G A L L CA R-T L A UNCHES 93 96 92 50 0 第 1 季度第 2 季度第 3 季度第 5 季度第 5 季度第 7 季度第 9 季度第 10 季度第 11 季度第 12 季度第 13 季度第 13 季度第 14 季度第 16 季度第 18 季度19 Q20 Q23 Q24 W O R L D W I D E S A L E S A L E S A L E S O F F C A R-T T H E R A P I E S,B Y Q U A R T E E R T E E O F L E A R-T T H E R A P I E S,B Y Q U A R T E E R T E E O F L A R-T T H E R A P I E S H(I 百万美元)400 391 Kymriah Yescarta Tecartus Tecartus Breyanzi Abecma Carvykti 350 300 250 200 152 152 150 自
推出以来的 124 个季度季度销售额(百万美元)数据来源:公司的公开文件。3 本演示文稿仅用于投资者关系目的,不用于产品促销目的

细胞疗法的先驱和领导者 3 本演示文稿仅用于投资者关系
目的——不用于产品促销目的

7 通过与强生的全球合作开发的细胞疗法制造专业知识的全面整合全球领导者
将 Legend 在细胞疗法领域的领导地位与强生*在全球药物开发方面的专业知识相结合,扩大美国和中国的制造能力
,在欧盟综合细胞疗法平台建设大型制造设施内部抗体生成和 CAR-T 特异功能筛选技术早期临床概念验证,与中国的关键人物合作,
美国和全球自体和异体平台可实现可持续增长和可扩展性,以满足未来的商业需求 KOL,主要意见领袖 *协议的法律实体是詹森
生物技术公司;合作成立于2017年12月,市场领先的多发性骨髓瘤 (MM) CAR-T 疗法 sbLA 和 II 型变体以支持标签扩展,已获美国食品药品管理局和欧洲药品管理局接受(PDUFA 目标行动日期为2024年4月5日)和EMA接受,
分别是第一项针对西尔塔-cel使用的随机3期研究支持该应用程序作为 2L 引人注目的 MM 计划和创新产品线,Cilta-cel 在临床试验中表现出持续深刻而持久的反应,
安全性可控的 3 期项目为释放早期系列 MM 适应症的价值提供了机会。其他针对血液学和实体瘤适应症的临床前/早期项目本
演示文稿仅用于投资者关系目的,不用于产品促销目的
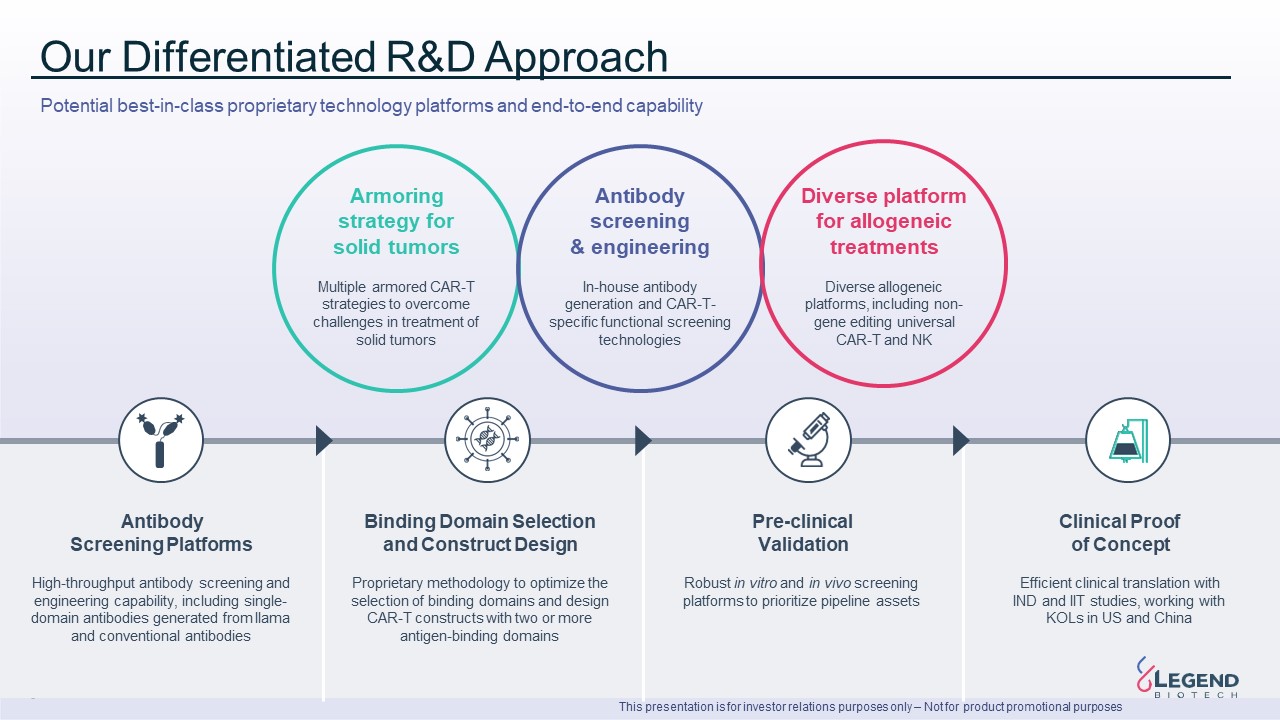
8 我们的差异化研发方法不同的异基因
治疗平台多样的异体平台,包括非基因编辑通用 CAR-T 和 NK 抗体筛选与工程内部抗体生成和 CAR-T 特异性功能筛选技术固体
肿瘤的装甲策略克服实体瘤治疗挑战的多种装甲CAR-T策略抗体筛选平台本演示文稿仅用于投资者关系目的——不用于产品促销目的高通量
抗体筛查和工程能力,包括源自美洲驼和常规抗体的单域抗体结合域选择和构造设计专有方法,可优化结合
结构域的选择以及设计具有两个或更多抗原结合结构域的CAR-T结构临床前验证强大的体外和体内筛选平台可优先考虑管道资产临床概念验证通过
IND 和IIT研究进行高效的临床翻译,与美国和中国的KOL合作潜在的同类最佳研究专有技术平台和端到端能力
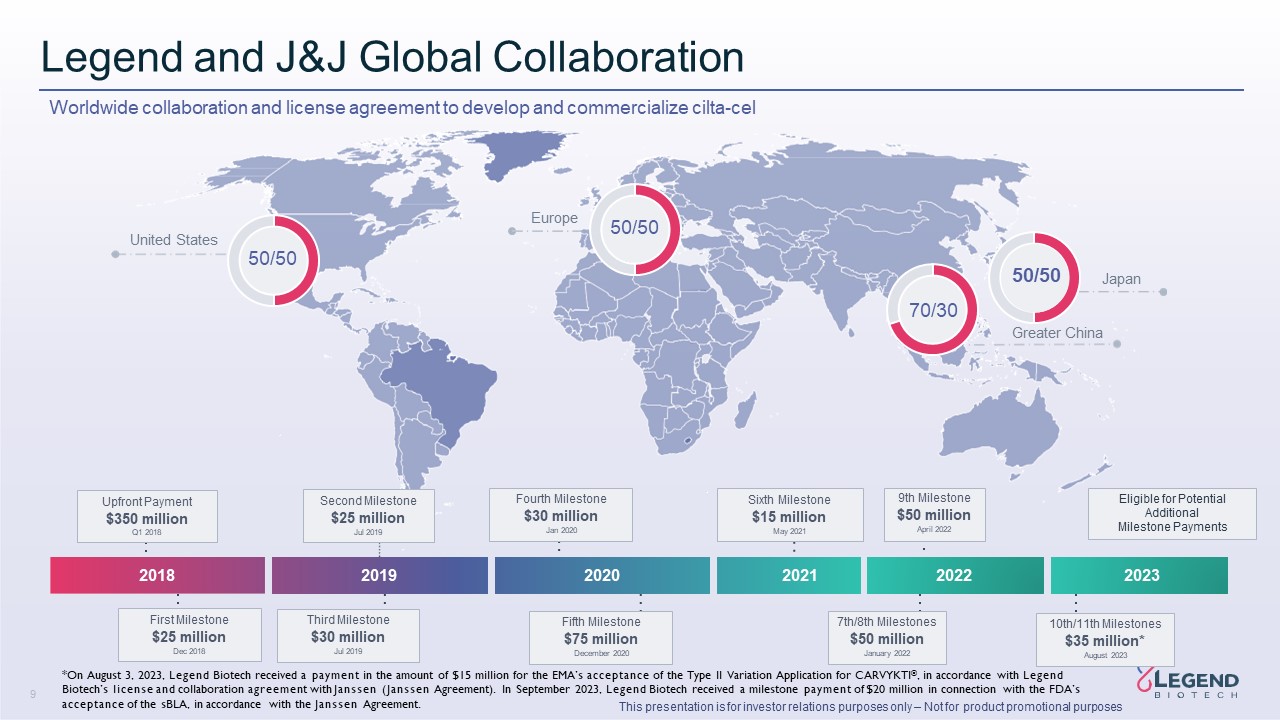
9 本演示仅用于投资者关系目的 — 不用于产品
促销目的 Legend 和 J&J 全球合作开发和商业化 cilta-cel 2023 2018 2019 2021 有资格获得潜在的额外里程碑付款第一
里程碑 2018 年 12 月 2,500 万美元第四里程碑 3,000 万美元第三里程碑 2019 年 7 月 2,500 万美元预付款 3.5 亿美元 2020 年 12 月 7,500 万美元第五个里程碑 7,500 万美元
第六个里程碑 5月1500万美元2021 50/50 美国欧洲日本 50/50 50/50 70/30 大中华区 7/8 里程碑 2022年1月9日里程碑 5000万美元 2022年4月 10/11日里程碑 3,500万美元* 2023年8月 *根据联想生物科技的许可和与Jans的
合作协议,2023年8月3日,联想生物收到一笔金额为1,500万美元的款项,用于EMA接受CARVYKTI® 的第二类变更申请(詹森协议)。2023年9月,联想生物收到一笔2,000万美元的里程碑式付款,这笔款项与美国食品药品管理局根据詹森协议接受sBLA有关。

全球制造足迹欧盟设施美国工厂中国
设施新泽西州力登南京 75 英亩新泽西州萨默塞特南京传奇中国管道项目临床供应场地和潜在的中国CARVYKTI® GMP 投产地运营潜力
CARVYKTI® 建设的未来商业用地正在进行美国/欧盟/日本/ROW 启动/ CARVYKTI® GMP运营商业用地美国/欧盟/日本Legend临床供应基地 Pipeline Programs Building E Ghent, Building, Building, E Building, Building, Building促销目的:比利时根特计划于2024年1月用于CARVYKTI® 临床生产的未来商业用地,预计将于2024年下半年实现商业化生产
CARVYKTI® 建设的未来商业用地正在进行中

扩大我们的制造能力诺华作为临床
供应首席营销官强生内部慢病毒设施*鉴于改善整体供应的独特挑战,将细胞疗法推向市场最先进的比利时根特的CARVYKTI® 制造设施方尖碑工厂已获得比利时联邦药品和保健品管理局
的临床供应制造许可等待地方当局的研究药品档案批准预计在生产 cilta-cel 根特用于临床用途
in2024 年 1 月以及 2024 年下半年的商业用途 13 本演示文稿仅用于投资者关系目的 — 不用于产品促销目的 J&J 瑞士的工厂目前正在内部生产慢性病毒
所有商用慢病毒
现已内部生产,我们实现了自给自足。预计强生将在2024年和2025年从美国和荷兰的工厂提供额外的慢病毒供应,分别在2023年第二季度与诺华签订了 CMO 协议于
有望在2024年上半年生产临床材料 *所有慢病毒设施均归强生所有。

与诺华签订的针对DLL3 Legend
的CAR-T疗法的许可协议于2023年11月13日宣布与诺华签订独家全球许可协议,以推进某些靶向DLL3的CAR-T疗法,包括小细胞肺癌的研究疗法 LB2102。Legend 于 2024 年 1 月 3 日宣布关闭
许可交易。符合预付条件的里程碑式付款高达10.1亿美元的可能使用诺华T-Charge™ 平台进行制造 DL3 开发和成本 → Legend 将在美国
开展 LB2102 的第 1 阶段 → 诺华将进行许可产品的所有其他开发加上净销售额的分级特许权使用费 13 本演示文稿仅用于投资者关系目的 — 不用于产品促销目的 1亿美元

我们的 Pipeline Global 美国中国 P R E C L I N I C A L P H A S E 2 P H A S E 3 P
H A S E 1 NSCLC (GPC3) 自体 *与强生制药公司詹森合作。†中国第一阶段的个人所得税。‡ IND 申请已获得美国食品和药物管理局的批准。§受与
诺华制药股份公司签订的独家许可协议的约束。根据许可协议,Legend Biotech将在美国进行 LB2102 的1期临床试验,诺华将对许可产品进行所有其他开发。正在调查的药物
和/或用途的安全性和有效性尚未确定。无法保证这些药物会获得卫生当局的批准或在任何国家上市,以用于正在调查的用途。此外,由于某些
项目仍然是机密的,因此某些候选人可能不包括在此列表中。ALL,急性淋巴细胞白血病;BCMA,B 细胞成熟抗原;DLL3,delta样配体 3;GPC3,glypican-3;GCC,鸟苷环化酶 C;HCC,肝细胞
癌;IIT,研究者发起的试验;MM,多发性骨髓瘤;ND,新诊断;NHL,非霍奇金淋巴瘤;NSCLC,非小细胞肺癌;RRMM,复发或难治性多发性骨髓瘤;SCLC,小细胞肺癌
癌。结直肠 (GCC) 自体 NHL† /ALL † (CD19 X CD20 X CD22) † 自体 NCT05318963 NCT05292898 MM† (BCMA) 异体 — CAR-T NCT05376345 RRMM (BCMA) LEGEND-2† 自体 NCT03090659 MM† (BCMA) 异体
CAR-NK NCT05498545 胃和食道及胰腺‡ (CLAUDIN 18.2)) Autologous NCT05539430 HCC† (GPC3) Autologous NCT05352542 RRMM (BCMA) * CARTIFAN-1 Autologus NCT03758417 RRMM (BCMA) * CARTITUDE-1 Autolous HCC† (BCMA) * Autolous HCC† (BCMA) * Autolous RRMM (BCMA) * Autologous HCC† (BCMA) * NCT03548207 CARTITUDE-2 NCT04133636 CARTITUDE-4 NCT04181827无意移植 1L CARTITUDE-5 自体 NCT04923893 NDMM (BCMA) * 符合移植资格 1L
CARTITUDE-6 自体 NCT05257083 SCLC‡ § (DLL3) 自体 NCT05680922 13 本演示文稿仅用于投资者关系目的 — 不用于产品促销目的

近期目标展望:2024 年及以后 → 继续提高制造
产能和效率 → 从根特工厂开始生产 → 在 24 年上半年完成 CARTITUDE-5 的注册 → 正在进行的 CARTITUDE-6 注册 → 推进早期管道计划 → 如果获得监管机构的批准,将推出基于 CARTITUDE-4 的来那度胺耐火原料 1-3 个先前生产线
适应症。PDUFA的目标行动日期是2024年4月5日。CHMP预计将在2024年第一季度发表意见 → 将CARVYKTI® 转向早期疗法;提高在美国的渗透率,
向全球市场扩张 → 关注血液学/肿瘤学领域未得到满足的医疗需求 → 开发具有转化潜力的疗法 → 通过较低的成本和可扩展的制造提高可及性 → 通过
利用外部合作建立全球强国长期增长战略 13 本演示文稿仅用于投资者关系目的——不用于产品促销目的