
美国
美国证券交易委员会
华盛顿特区,20549
表格
(标记一)
根据1934年《证券交易法》第13或15(D)条提交的年度报告 |
截至本财政年度止
或
根据1934年《证券交易法》第13或15(D)条提交的从 |
佣金文件编号
(注册人的确切姓名载于其章程)
(述明或其他司法管辖权 公司或组织) |
(税务局雇主 识别号码) |
501套房 |
|
(主要执行办公室地址) |
(邮政编码) |
注册人的电话号码,包括区号:(
根据该法第12(B)条登记的证券:
每个班级的标题 |
|
交易 符号 |
|
注册的每个交易所的名称 |
|
|
根据该法第12(G)条登记的证券:无
如果注册人是证券法第405条规定的知名经验丰富的发行人,请用复选标记表示。是☐
如果注册人不需要根据《法案》第13条或第15(d)条提交报告,请勾选复选标记。 是的 ☐
用复选标记表示注册人是否:(1)在过去12个月内(或注册人需要提交此类报告的较短时间内)提交了1934年《证券交易法》第13或15(D)条要求提交的所有报告,以及(2)在过去90天内一直遵守此类提交要求。
用复选标记表示注册人是否在过去12个月内(或在注册人被要求提交此类文件的较短时间内)以电子方式提交了根据S-T规则第405条(本章232.405节)要求提交的每个交互数据文件。
用复选标记表示注册人是大型加速申报公司、加速申报公司、非加速申报公司、较小的报告公司或新兴成长型公司。请参阅《交易法》第12b-2条规则中“大型加速申报公司”、“加速申报公司”、“较小申报公司”和“新兴成长型公司”的定义。
大型加速文件服务器 |
|
☐ |
|
加速文件管理器 |
|
☐ |
|
☒ |
|
规模较小的报告公司 |
|
||
|
|
|
|
新兴成长型公司 |
|
如果是一家新兴的成长型公司,用复选标记表示注册人是否已选择不使用延长的过渡期来遵守根据《交易所法》第13(A)节提供的任何新的或修订的财务会计准则。
用复选标记表示注册人是否提交了一份报告,证明其管理层根据《萨班斯-奥克斯利法案》(《美国联邦法典》第15编,第7262(B)节)第404(B)条对其财务报告的内部控制的有效性进行了评估,该评估是由编制或发布其审计报告的注册会计师事务所进行的。
如果证券是根据该法第12(B)条登记的,应用复选标记表示登记人的财务报表是否反映了对以前发布的财务报表的错误更正。
用复选标记表示这些错误更正中是否有任何重述需要对注册人的任何执行人员在相关恢复期间根据第240.10D-1(B)条收到的基于激励的补偿进行恢复分析。☐
用复选标记表示注册人是否是空壳公司(如《交易法》第12b-2条所定义)。是
i
在2023年6月30日,注册人最近完成的第二财政季度的最后一个工作日,注册人的非关联公司持有的有表决权和无表决权普通股的总市值约为美元,
截至2024年3月21日,注册人普通股的流通股数量为
以引用方式并入的文件
注册人关于其2024年股东年会的最终委托书的部分,将在截至2023年12月31日的财政年度结束后120天内提交给美国证券交易委员会,通过引用纳入本文第三部分。
II
目录表
|
|
页面 |
第一部分 |
|
|
第1项。 |
业务 |
7 |
第1A项。 |
风险因素 |
48 |
项目1B。 |
未解决的员工意见 |
111 |
项目1C。 |
网络安全 |
111 |
第二项。 |
属性 |
112 |
第三项。 |
法律诉讼 |
112 |
第四项。 |
煤矿安全信息披露 |
112 |
|
|
|
第II部 |
|
|
第五项。 |
注册人普通股市场、相关股东事项与发行人购买股权证券 |
116 |
第六项。 |
[已保留] |
116 |
第7项。 |
管理层对财务状况和经营成果的探讨与分析 |
117 |
第7A项。 |
关于市场风险的定量和定性披露 |
128 |
第八项。 |
财务报表和补充数据 |
128 |
第九项。 |
会计与财务信息披露的变更与分歧 |
129 |
第9A项。 |
控制和程序 |
129 |
项目9B。 |
其他信息 |
129 |
项目9C。 |
关于阻止检查的外国司法管辖区的披露 |
129 |
|
|
|
第三部分 |
|
|
第10项。 |
董事、高管与公司治理 |
131 |
第11项。 |
高管薪酬 |
131 |
第12项。 |
某些实益拥有人的担保所有权以及管理层和相关股东的事项 |
132 |
第13项。 |
某些关系和相关交易,以及董事的独立性 |
132 |
第14项。 |
首席会计费及服务 |
133 |
|
|
|
第四部分 |
|
|
第15项。 |
展示、财务报表明细表 |
134 |
第16项。 |
表格10-K摘要 |
137 |
3
关于前瞻性陈述的特别说明
本年度报告以Form 10-K或年度报告形式包含前瞻性陈述。我们打算将这些前瞻性陈述纳入修订后的1933年证券法第27A节(“证券法”)和修订后的1934年证券交易法第21E节(“交易法”)中包含的前瞻性陈述的安全港条款。除本年度报告中包含的有关历史事实的陈述外,本年度报告中包含的所有陈述,包括有关我们未来的经营业绩和财务状况、我们的现金、现金等价物和有价证券是否足以满足我们的运营费用和资本支出要求、我们作为持续经营企业的能力、业务战略、候选产品开发、预期产品、候选产品的批准、研发活动和成本、未来收入、我们业务计划的成功时间和可能性、管理计划和目标、临床试验的未来结果和时机、我们候选产品的治疗潜力以及我们候选产品的市场潜力的陈述,均为前瞻性陈述。这些陈述涉及已知和未知的风险、不确定性和其他重要因素,可能导致我们的实际结果、表现或成就与前瞻性陈述明示或暗示的任何未来结果、表现或成就大不相同。
在某些情况下,您可以通过“可能”、“将会”、“应该”、“预期”、“计划”、“预期”、“可能”、“打算”、“目标”、“项目”、“考虑”、“相信”、“估计”、“预测”、“潜在”、“将”或“继续”或这些术语的否定或其他类似表述来识别前瞻性陈述,尽管并不是所有前瞻性声明都包含这些词语。本年度报告中的前瞻性陈述仅为预测,主要基于我们目前对未来事件和财务趋势的预期和预测,我们认为这些事件和财务趋势可能会影响我们的业务、财务状况和运营结果。这些前瞻性陈述仅代表截至本年度报告之日的情况,可能会受到许多已知和未知的风险、不确定性和假设的影响,包括第一部分第1A项下所述的风险、不确定性和假设。本年度报告中的“风险因素”。由于前瞻性陈述本身就会受到风险和不确定性的影响,其中一些风险和不确定性是无法预测或量化的,有些是我们无法控制的,因此您不应依赖这些前瞻性陈述作为对未来事件的预测。我们的前瞻性陈述中反映的事件和情况可能无法实现或发生,实际结果可能与前瞻性陈述中预测的结果大不相同。此外,我们在一个不断发展的环境中运营。新的风险因素和不确定因素可能不时出现,管理层不可能预测到所有的风险因素和不确定因素。除非适用法律要求,我们不打算公开更新或修改本文中包含的任何前瞻性陈述,无论是由于任何新信息、未来事件、情况变化或其他原因。
如本年度报告所用,除非另有说明或上下文另有规定,否则所提及的“欧米茄”、“欧米茄治疗”、“公司”、“我们”、“我们”和“我们”是指欧米茄治疗公司及其子公司。
4
汇总风险因素
我们的业务面临许多风险和不确定性,包括第一部分第1A项所述的风险和不确定性。本年度报告表格10-K中的“风险因素”。在投资我们的普通股时,您应该仔细考虑这些风险和不确定性。影响我们业务的主要风险和不确定因素包括:
5
6
第一部分
项目1.业务.
概述
欧米茄治疗公司是一家临床阶段的生物技术公司,开创了一种新型可编程表观基因组mRNA药物。我们的omega平台利用表观遗传学的力量和我们对基因组结构的深刻理解,精确定位并可控制地调节转录前水平的基因表达,以治疗或治疗疾病。我们已经破译了人类基因组的三维结构。基因及其伴随的调控因子被组织成不同的、进化上保守的结构,称为绝缘基因组结构域,或IGD。IGD是基因调控和细胞分化的基本结构和功能单位,是自然界对基因表达的天然调控系统。大多数疾病是由IGD改变引起的基因表达异常引起的。Omega平台使我们能够系统地识别和验证数千个新的基于DNA序列的表观基因组“邮政编码”,这些“邮政编码”与IGD中的单个调控元件相关。我们称这些表观基因组靶标为EpiZips。我们理性地设计和设计我们的信使核糖核酸疗法,称为表观基因组控制器,或ECs,以针对EpiZips进行精确的表观基因组控制。这使我们能够精确地将基因调节到所需的表达水平,并控制表达的持续时间。通过这种方法,我们相信omega平台在一系列疾病和疾病中具有广泛的潜在适用性,包括那些历来无法药物治疗、难以治愈和难以治疗的目标。我们目前正在筹备的项目包括肿瘤学、再生医学和多基因疾病,包括免疫学和心脏新陈代谢疾病。
我们相信,omega平台提供的精确表观基因组控制具有广泛的治疗适用性和转化潜力,跨越:
7
我们的管道
我们目前正在筹备的项目包括以下项目:

知识产权与制造能力
通过我们自己的开发活动和麻省理工学院怀特黑德研究所或怀特黑德研究所的许可证,我们巩固了涵盖omega平台和我们的ECs的重要知识产权。我们还在发展内部和外部制造能力,包括评估建立我们自己的工厂的计划,以提供适当的规模和质量,以支持我们的EC的开发和商业化。
我们的战略
我们的目标是通过利用omega平台设计、开发、制造和商业化ECs,成为领先的可编程表观基因组药物公司。我们的愿景是通过选择性和安全地引导人类基因组在不改变天然DNA序列的情况下预先转录控制基因表达,来治疗和治愈严重的疾病。
我们的战略包括:
8
绝缘基因组结构域(IGD)的背景
表观遗传学是一种系统地控制生物体生命的方方面面的机制,从细胞生长和分化到细胞死亡。我们的团队已经了解了表观遗传学的通用操作系统,并建立了omega平台来复制大自然的基因控制方法,以获得治疗效益。IGD是理解这一操作系统的组织结构的关键,是基因控制和细胞分化的基本结构和功能单位。大约有15,000个IGD,涵盖了分布在我们23条染色体上的大约20,000个基因。它们普遍存在于每个细胞中,并且在进化上在物种内和大部分物种之间都是保守的。
细胞中的基因表达通常受高度多样化的调控元件的控制,如增强子、抑制子和启动子。这些调控元件是相对较短的DNA片段,充当蛋白质转录因子的结合部位,这些转录因子反过来招募其他蛋白质来激活目标基因的转录。目前的研究表明,基因及其相关的调节元件以模块化的方式存在于IGD中。IGD的染色体环结构确保了基因与其调控元件之间的相互作用与邻近的IGD和外部调控因子隔绝,这对于确保正常的细胞特异性基因调控至关重要。CCCTC结合因子、CTCF和粘附素复合体在IGD结构的形成和维持中起关键作用。粘附素是马达
9
这会挤压和扩大IGD环,而CTCF阻止粘连蛋白进一步挤压并充当锚,从而加强IGD之间的边界。
IGD的图形表示
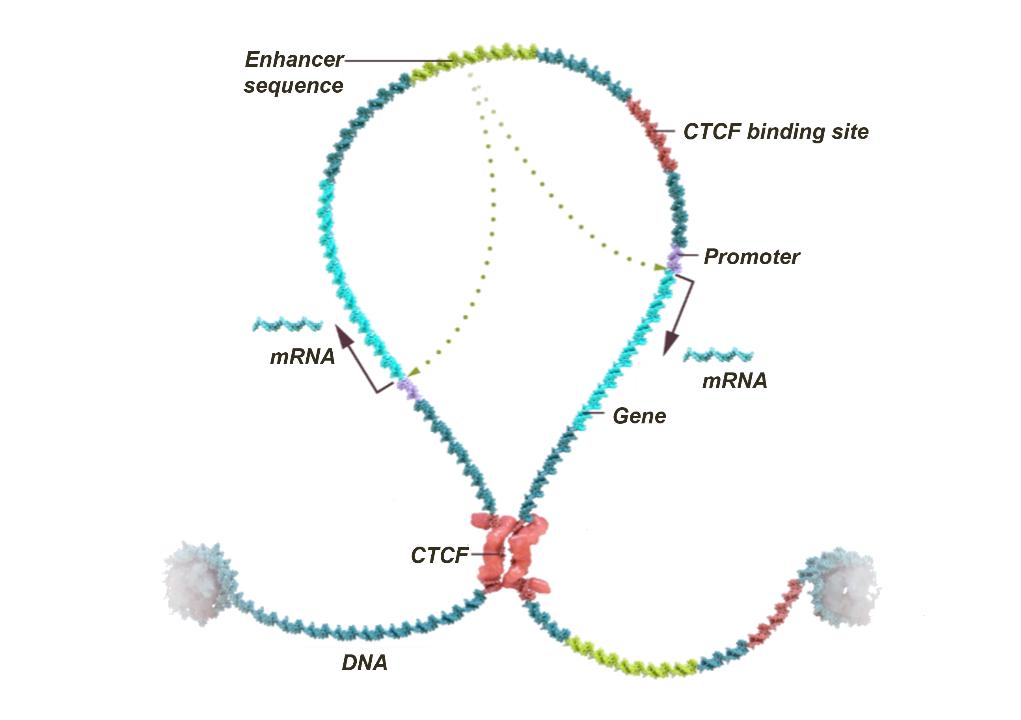
表观基因组控制器被设计成通过精确调控一个或多个IGD组分(EpiZip)来控制基因表达,从而影响特定IGD内的基因表达。
IGD或其边界的任何扰动都有可能导致其内部一个或所有基因的失调,从而导致一系列疾病状态。IGD的改变可以是结构性的,也可以是功能性的,包括锚-CTCF结合序列、基因启动子和增强子区域(包括超级增强子)的突变或中断。 例如,在包括乳腺癌、前列腺癌和肾癌在内的各种实体肿瘤以及白血病中都观察到了CTCF和粘附素编码序列的突变。例如,在一些癌症中,IGD边界的破坏可以重新连接环路相互作用,以包括被称为超级增强子的强大激活调控元件,以上调癌基因。IGD边界的表观基因组变化,例如DNA甲基化异常,可以改变CTCF结合,导致基因排斥或使IGD内的基因暴露于外部调控元件。这种破坏的病理证据已经在癌症(如胶质瘤)和遗传性人类疾病(如脆性X综合征)中被发现。
欧米茄平台
我们认为,omega平台代表了一种前所未有的方法,通过在不改变天然DNA序列的情况下精确控制基因表达,开发治疗疾病的表观遗传学基础的疗法。我们相信,我们的ECs能够精确定位并提供可控、可调和持久的效果,具有治疗多种疾病的潜力。
Omega平台建立在四个基本组件之上:
1. IGDS和EpiZip作为新药靶点的专利数据库
我们利用生物学优先的方法从与感兴趣的疾病迹象相关联的有效基因靶标开始进行靶标识别。我们使用专有算法和机器学习工具来挖掘我们自己的和
10
公共数据库,以开发目标IGD的全面概况,以了解它在患病州是如何调节失调的。我们综合这些信息来确定关键的治疗干预点,EpiZips,它是ECs的靶点,以达到预期的基因表达效果。通过这个过程,我们已经建立了一个数以千计的EpiZip和IGD的庞大文库,作为潜在的治疗靶点。
2. 针对疾病量身定做的可编程表观基因组mRNA药物
我们的内皮细胞是可编程的信使核糖核酸疗法,它表达由两个成分组成的融合蛋白--DNA结合域和表观基因组效应蛋白,如下图所示。DNA结合域被设计成以特定的EpiZip为靶标,具有精致的特异性。表观基因组效应蛋白旨在与细胞核内的DNA或DNA相关蛋白相互作用,如组蛋白和转录因子,以上调或下调基因表达并控制作用持续时间。
表观基因控制因子(EC)*

*信使核糖核酸药物在细胞核内以蛋白质形式表达
我们目前正在开发专利的锌指样蛋白和其他DNA结合域。对于表观基因组效应域,我们已经建立并将继续建立一个包含100多个单功能和多功能表观基因组效应域的文库,包括DNA修饰因子、组蛋白修饰因子和其他染色质重塑因子的自然发生和专有工程变体。
IGDS、EpiZip的初步鉴定以及针对特定靶基因的ECs的作用机制可以利用表观基因组控制器筛选来快速验证。我们的模块化设计方法使我们能够加快发现过程,识别基因靶点,并在可能短短几周内产生初步的主导ECs来调节它们。
3. 为靶向组织和细胞提供定制的工程药物
向适当的细胞和组织输送对于我们技术的成功应用至关重要。我们正在探索和创新多种交付方式。
11
我们选择了脂质纳米颗粒或LNP递送技术,在第三方临床试验中得到验证,用于我们的初始计划。目前,LNPs用于已获批准和正在开发的产品中。我们在交付配方方面拥有深厚的专业知识,并利用技术进步和既定的监管先例来开发我们自己的LNPs。我们正在将我们的内皮细胞作为信使核糖核酸,编码DNA结合域和表观基因组效应蛋白,封装在LNP中。我们的LNPs通常由4组分或5组分的分子组成,这些分子包裹着像mRNA这样的核酸,保护和运输有效载荷到体内的器官和组织,并促进它们被细胞摄取。我们相信我们的LNPs能够提供可重复使用的,非病毒的,体内递送到肝、肺、中枢神经系统、免疫细胞、关节和其他细胞和组织。一旦被细胞摄取,LNP就能使mRNA货物释放到细胞质中,在那里它被翻译成EC,EC又被运输到细胞核并与特定IGD中的靶向EpiZip结合。我们目前正在探索来自各种内部和外部来源的一系列阳离子和可电离LNP,并已开发出专有的LNP配方,已显示出特定和有效的体内临床前研究中的功能交付。我们还在扩展LNP交付技术之外的领域,并为我们未来的EC项目评估其他交付方式。
4. 业界领先的计算、生物和基因组专业知识
我们利用从我们的领先计划中收集的经过编纂的学习和见解来继续优化我们的平台,并为后续候选产品的发现和开发提供信息。我们还建立并继续增加我们的EpiZip和ECs知识库。我们采取合理和简化的方法来开发可编程的表观基因组药物,通过稳健和高效的靶标识别、验证、候选产品设计和优化,潜在地提供一条更快的临床路径。我们还在不断扩大我们的EpiZip和新的和专有的DNA结合域和表观基因组效应蛋白的目录,并使用计算方法来评估靶上和潜在的脱靶结合和活性,以最大限度地减少基因表达的无意变化。
计算基础
Omega平台利用新的生物学和表观遗传学,通过我们重要的计算能力,从治疗上控制基因表达和编程细胞状态。破译人类基因组的规则--一个由数十亿个核苷酸、数万个基因和多达100万个调控序列组成的规则,所有这些都可能在三维空间中相互作用--需要创造先进的专有算法和统计数据分析技术。我们的尖端计算工具建立在各种专有算法和深度学习技术的库上,使我们能够解释和预测IGD的位置、结构和功能。欧米茄平台提供的关键科学见解使人们能够跨治疗领域和适应症识别EpiZips。这么深硅片理解和可预测性还直接影响ECs的设计和快速工程,使我们能够以精致的特异性、可控的调节和作用持续时间来调节单个或多个基因。
我们通过广泛应用计算和数据优先的方法,将我们的计算技术应用于药物开发的整个连续体。我们运用了广泛的系统生物学和功能基因组学方法来识别相关的生物标记物。我们利用关键的翻译模型来验证作用机制,以加速开发并潜在地降低临床翻译的风险。组合优化技术和新的发现努力加快了交付和配方设计。这使我们能够快速扩大项目和制造规模,同时提高质量和成本。系统的数据捕获和自动化实现了实时的、数据驱动的决策,这进一步推动了我们并行加速多个程序的能力。
我们拥有一支高技能的计算团队,拥有深厚的专业知识和广泛的经验,支持omega平台。该团队开发所需的工具、功能和专门方法,以解决IGD生物学的复杂性、我们的ECS的设计和交付以及整个公司范围内计算和数据优先的理念的集成。我们正在不断发展和发展我们的计算团队和能力,以推动可编程表观遗传药物、制造和我们的数字基础的发现和开发方面的创新。
12
我们的发展计划
我们目前的管道是战略性地集中在肿瘤学,再生医学和多基因疾病,包括免疫学和心脏代谢疾病的开发项目。OMEGA平台在疾病过程中具有广泛的适用性,包括肿瘤形成、代谢失调、纤维化过程、免疫功能障碍、血管病理学和组织变性。 我们已经生成 硅片, 体外培养和体内我们有可能自己或通过合作将多个基因靶点的数据推进到临床。
肿瘤学
用于肝细胞癌的OTX-2002
我们正在开发OTX-2002来下调c-Myc的表达,c-Myc是一种癌基因,在超过50%的人类癌症中表达失调,经常与不良预后有关,作为晚期肝癌患者的潜在治疗方法。已证实c-Myc在肝肿瘤细胞增殖中起关键作用,并且在大多数肝细胞癌中表达上调。事实证明,直接针对c-Myc的药物开发具有挑战性,因为它的表达受到严格调控,而且它是一种缺乏小分子结合的特定活性部位的蛋白质。这意味着靶向c-Myc mRNA或蛋白不太可能是有效的,因为这两种方法都不能解决转录水平上的潜在失调。与其他更二元的下调基因表达的方法不同,内皮细胞可以精确地调节c-Myc的表达,足以杀死高度扩增的MYC扩增的癌细胞并推动肿瘤退化,而不需要健康的周围细胞,只需低水平的MYC就能正常发挥功能。
肝细胞癌是一种在慢性肝病环境中发展起来的原发性肝脏恶性肿瘤。它通常在病程较晚时被诊断出来,确诊后的中位生存期约为6至20个月。2017年,美国估计有89,950人患有肝癌和与肝相关的癌症。根据确诊的疾病阶段,目前的治疗方案包括手术切除、酪氨酸激酶抑制剂(TKI),如索拉非尼和兰瓦替尼,原位肝移植或射频消融,对于更晚期的患者,免疫检查点加抗血管内皮细胞生长因子联合治疗,或姑息治疗,如经导管动脉化疗或放射栓塞术、立体定向放射治疗或全身化疗。
当在一组肝癌细胞系中进行测试时,OTX-2002在基因组中精确定位的区域进行了表观遗传修饰,导致MYC mRNA和蛋白质水平降低,并推动了抗增殖作用。在利用皮下和原位小鼠异种移植肝癌模型进行的临床前研究中,OTX-2002显著抑制了小鼠的肿瘤生长,而对小鼠的体重变化没有显著影响。抗肿瘤活性与肿瘤中MYC蛋白水平的降低一致。此外,在体外和体内研究中,OTX-2002与目前治疗肝癌的标准药物lenvatinib或sorafenib相结合,与增强抑制肝癌肿瘤模型中的肿瘤生长有关。
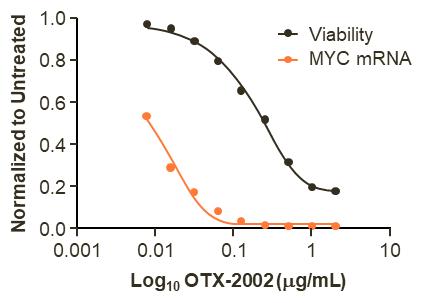
在OTX-2002在不同肝癌细胞系中的临床前研究中,OTX-2002下调了c-Myc的表达,我们观察到靶向肝细胞癌亚型的细胞活性丧失,观察了15天的影响。如下图所示,欧盟委员会50在肝癌细胞系中测量了在基线和最大反应之间提供50%反应的药物浓度。OTX-2002诱导c-Myc基因表达EC50平均值为0.013微克/毫升,当浓度为0.147微克/毫升时,细胞活力下降50%。
13
OTX-2002与表达和活性的剂量反应相关(体外)
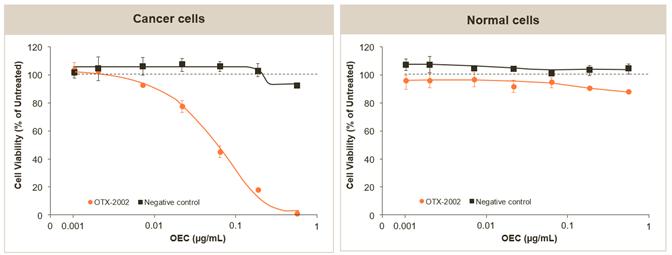
在另一项单独的OTX-2002在肝癌细胞系(Hep3B)的临床前研究中,我们证明了OTX-2002对癌细胞活力的选择性效应。如下图所示,在0.001到500 ng/mL的浓度范围内,用OTX-2002处理癌细胞会导致这些细胞的活力显著降低,而相反,当我们用OTX-2002处理正常细胞(健康的原代人肝细胞)时,我们没有看到对细胞活力的显著影响。
OTX-2002降低了肝癌癌细胞的活力,但不会降低健康的人肝细胞(体外培养)
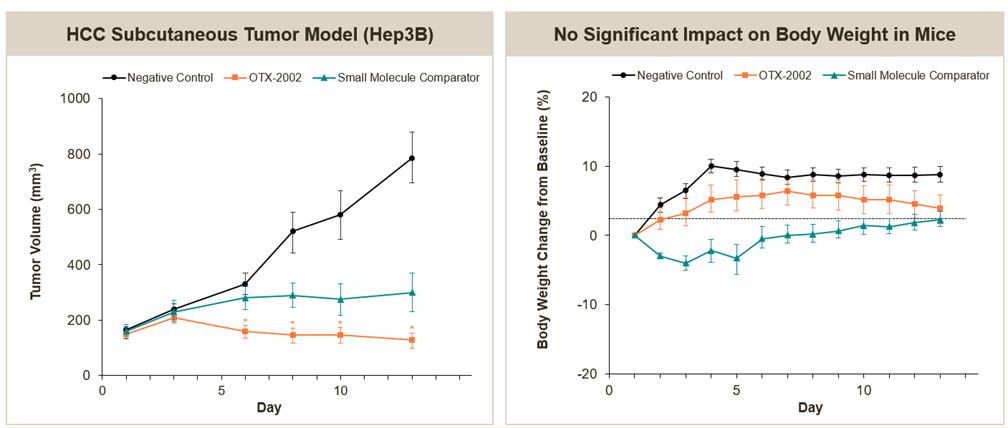
通过体内配制的LNPs递送的OTX-2002降低了含有人肝癌移植瘤的小鼠的肿瘤负担。在这项临床前研究中,我们在小鼠皮下肿瘤模型或小分子对照组中每隔五天给予3毫克/公斤的OTX-2002。
14
OTX-2002在肝癌皮下移植瘤模型中观察到的抗肿瘤活性,对体重没有显著影响(活体内)
*统计学意义与阴性对照比较,t检验p.
此外,我们观察到与索拉非尼相比,OTX-2002对含有人肝癌异种移植瘤的小鼠的肿瘤生长有同等的影响。OTX-2002每5天灌胃3 mg/kg或索拉非尼50 mg/kg,每日1次。用生物发光成像技术测量肿瘤生长情况。如下图所示,使用OTX-2002的治疗导致的发光降低与使用索拉非尼的治疗相当。服用OTX-2002的小鼠体重没有显著下降。服用索拉非尼的小鼠体重持续下降。在这项研究中,OTX-2002耐受性良好,没有观察到不良反应。
15
OTX-2002对人肝癌原位移植模型体内抗肿瘤活性及体重变化的观察)

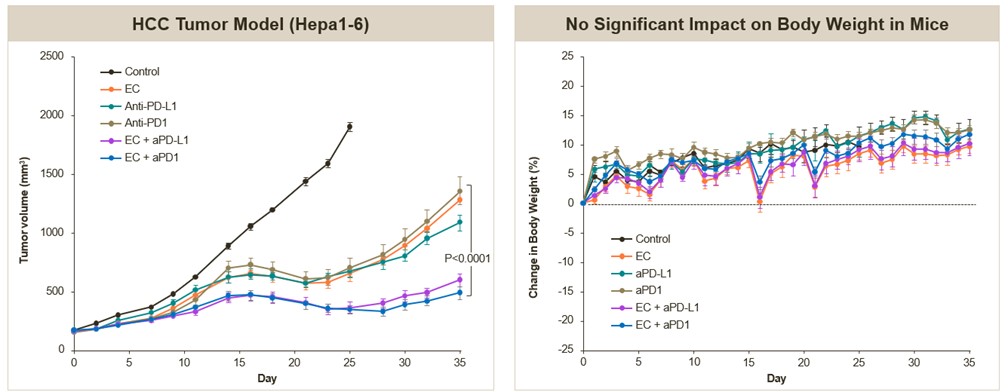
我们还观察到与检查点抑制剂,包括抗PD-1和抗PD-L1药物的联合疗效有统计学意义。在皮下肝癌模型(Hepa1-6)中对OTX-2002的小鼠替代物EC进行评估时,免疫能力组小鼠每5天给予1 mg/kg EC,每周给予10 mg/kg的抗PD1或抗PD-L1,EC与抗PD1或抗PD-L1的组合,或阴性对照。如下图所示,与阴性对照相比,联合治疗对肿瘤生长的抑制具有统计学意义上的显著意义,此外,与所有单一治疗组相比,对肿瘤生长的抑制在统计学上也具有显著意义。这两种组合的手臂耐受性都很好,在研究期间观察到对体重没有显著影响。
16
EC联合抗PD1或抗PDL1对人肝癌移植瘤模型的抗肿瘤活性及体重的影响(活体内)
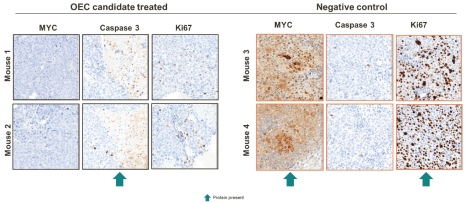
活体内OTX-2002通过配制的LNPs在小鼠皮下人肝癌模型中以每5天3 mg/kg的剂量治疗,导致了肿瘤负担的减少,并在细胞水平上显示了肿瘤中c-Myc表达和相关临床生物标志物的相关变化。如下图所示,对EC候选治疗和阴性对照肿瘤的组织学切片进行免疫组织化学分析体内上述研究表明,c-Myc蛋白在肿瘤中显著下调(以棕色染色消失表示),预期Ki67(肿瘤细胞增殖的生物标记物)下调,Caspase3(凋亡的一种生物标记物,一种程序性细胞死亡)上调。
肝细胞癌移植瘤模型中临床生物标志物的变化
2022年7月,我们宣布美国食品和药物管理局(FDA)批准了我们的研究新药(IND)申请,启动了OTX-2002的1/2期临床试验,这是OTX-2002治疗肝癌的首个人类临床试验。
2022年10月,我们宣布启动1/2期MYCHELANGELOTM我的临床试验。这项全球性研究正在评估OTX-2002的安全性、耐受性、药代动力学、药效学和初步的抗肿瘤活性,作为单一疗法(第1部分)和与标准护理疗法(第2部分)相结合,用于治疗复发或难治性肝细胞癌和其他已知与MYC癌基因有关的实体肿瘤类型。
17
2022年11月,我们宣布OTX—2002获得FDA授予孤儿药指定,用于治疗HCC。
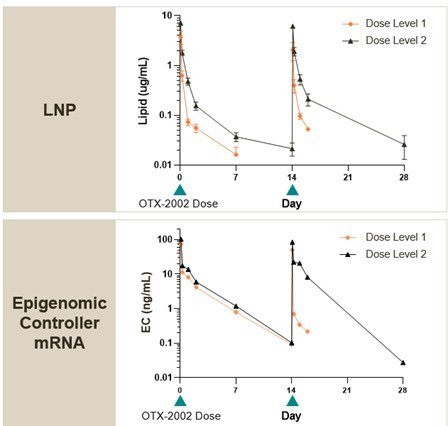
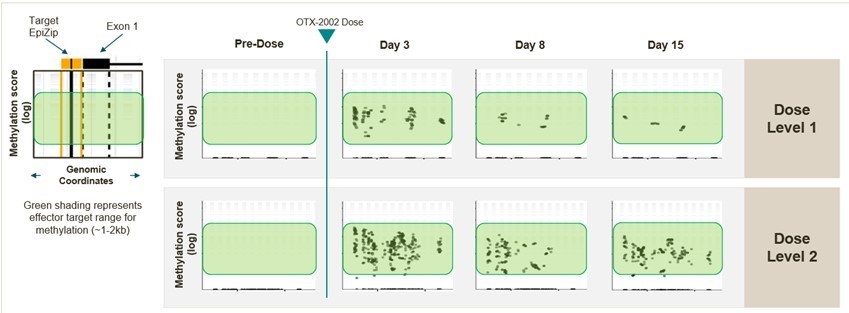
2023年9月,我们宣布了正在进行的1/2期MYCHELANGELO I试验(NCT05497453)的前两个剂量队列的初步临床数据,该试验目前正在美国和亚洲的临床地点进行。截至2023年9月18日的数据截止,共有8名患者每两周静脉注射0.02 mg/kg(剂量级别1,n=4)或0.05 mg/kg(剂量级别2,n=4)OTX-2002。通过检测细胞内游离DNA和胞外体mRNA水平,分析MYC细胞DNA甲基化和mRNA水平的变化。
截至数据截止点,试验前两个剂量水平的初步临床数据的主要亮点包括:
安全性和容错性:
药代动力学:
可预测的药代动力学,观察到药物产品的快速清除
翻译:
18
观察到MYC IGD中靶基因座高度特异性的靶参与和预期的表观遗传状态变化
观察到MYC mRNA快速、强劲和持久的下调

2024年1月,我们宣布在三名肝癌患者中完成剂量水平3(0.06 mg/kg)的剂量限制毒性(DLT)窗口。截至2024年3月24日的数据截止日期,共有11名患者接受了OTX-2002 0.02 mg/kg(剂量级别1,n=4)、0.05 mg/kg(剂量级别2,4)或0.06 mg/kg(剂量级别3,n=3)的静脉治疗,每两周一次。
截至数据截止日,前三个队列的中期数据显示:
19
OTX-2002:中期单一疗法总体反应摘要(截至2024年3月24日)
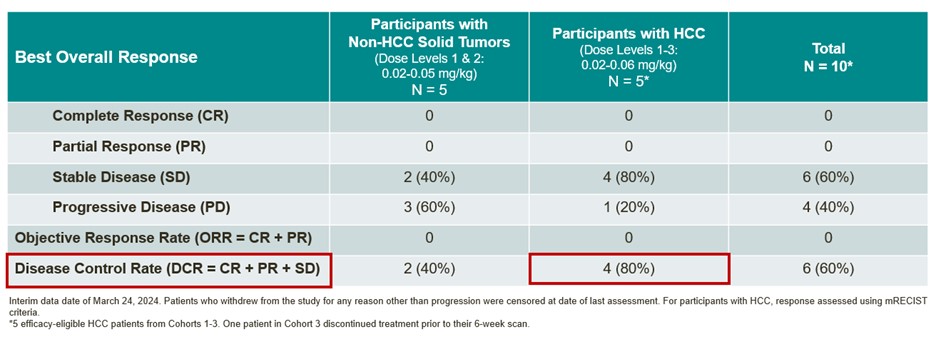
我们相信,这些中期数据为Omega建立了临床平台验证,突出了利用可编程的候选mRNA进行受控表观基因组调控的潜力,并支持表观基因组控制器作为下一类创新疗法的潜力。
基于这些令人鼓舞的中期数据,OTX-2002在单一治疗剂量升级方面继续取得进展,该公司目前正在以0.12毫克/公斤的剂量水平评估第4组中的肝癌患者。队列4于2024年3月初完成了28天的剂量限制毒性窗口。该公司预计将在2024年年中报告更多关于单一疗法剂量增加的最新临床数据。在确定推荐剂量后,该公司计划在2024年年中扩展到单一疗法和联合治疗环境。
治疗非小细胞肺癌的OTX-2101
2022年10月,我们宣布选择OTX-2101作为开发候选药物,以进入非小细胞肺癌治疗的IND使能研究. 大约50%的NSCLC肿瘤过表达c-Myc。我们正在开发OTX-2101来下调c-Myc并减少这种过度表达。非小细胞肺癌是最常见的肺癌类型,占所有肺癌诊断的84%,2020年美国约有192,200例新病例。非小细胞肺癌的五年生存率为24%。根据诊断时的疾病阶段,目前的治疗方案包括手术切除、光动力治疗(PDT)、激光治疗或近距离放射治疗、化疗、放射治疗、靶向治疗(例如,TKIs)和免疫治疗与其他治疗相结合。
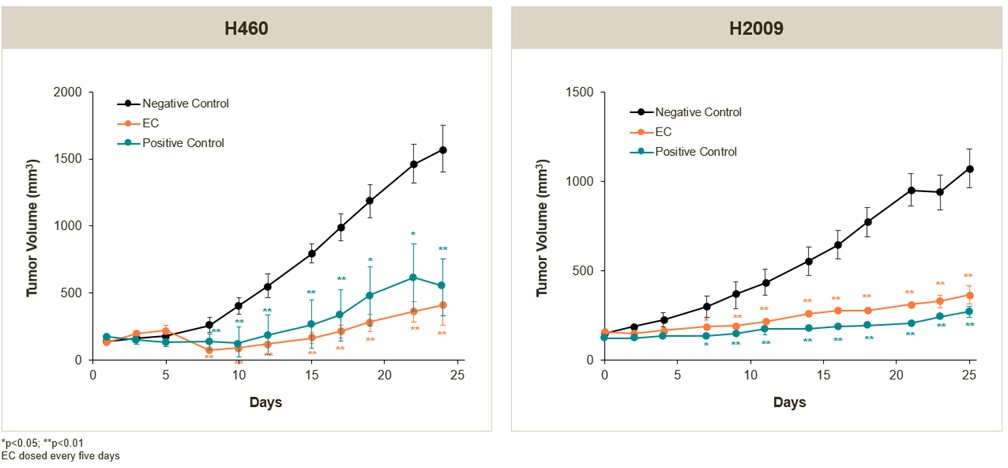
在临床前研究中,我们已经确定了在体外对一系列非小细胞肺癌细胞株表现出活性的EC候选者,表现出c-Myc下调伴随着细胞活力的丧失。重要的是,在体外临床前研究中,观察到这些候选EC对正常原代肺上皮细胞、成纤维细胞和内皮细胞的最小抗增殖作用。此外,在一项临床前研究中,当与临床相关的TKI联合治疗时,EC候选患者显示出对细胞增殖的协同效应(数据未显示)。我们还对两种非小细胞肺癌皮下移植模型进行了临床前研究。在这些研究中,我们每五天给小鼠服用一种EC候选者的3毫克/公斤。我们的MYC靶向EC候选治疗显示,在研究的剂量阶段,肿瘤大小在统计上显著减少,治疗小鼠的体重没有观察到减少。在这两项研究中,我们的EC治疗
20
候选者对肿瘤体积的影响与治疗标准(阳性对照)、用于治疗几种癌症的化疗药物相同,如下图所示。
H460和H2009非小细胞肺癌皮下移植模型中EC候选细胞的抗肿瘤活性(活体内)
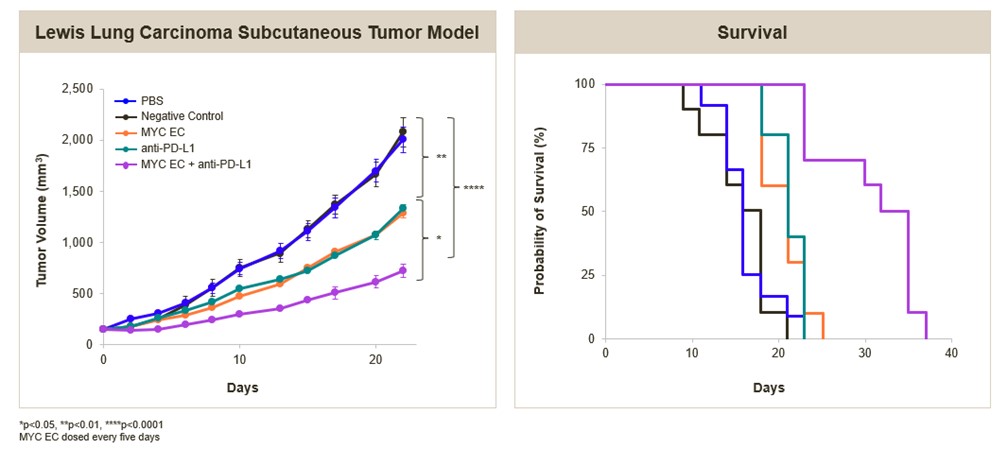
我们进一步评估了我们的MYC靶向EC在临床前与免疫检查点或EGFR抑制剂的联合设置。用MYC-EC加抗PD-L1抗体治疗NSCLC的同基因小鼠模型的抗肿瘤活性增强,如下所示。此外,在非小细胞肺癌人异种移植模型中,MYC-EC与EGFR抑制剂osimertinib联合使用,在体外协同降低了肿瘤细胞的活力,并显著增强了对肿瘤生长的抑制。
MYC靶向EC联合免疫检查点显着增强同基因小鼠NSCLC模型的抗肿瘤活性
21
MYC靶向EC与EGFR抑制剂的显著结合
增强人非小细胞肺癌移植瘤模型的抗肿瘤活性
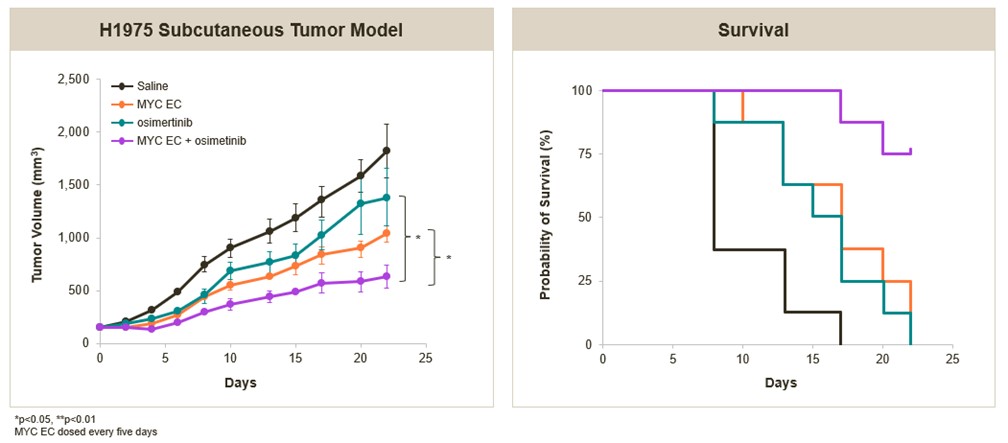
总的来说,这些发现进一步支持了OTX-2101治疗晚期非小细胞肺癌的潜力 作为单一疗法或与标准护理疗法相结合的环境。
包括免疫学在内的多基因疾病
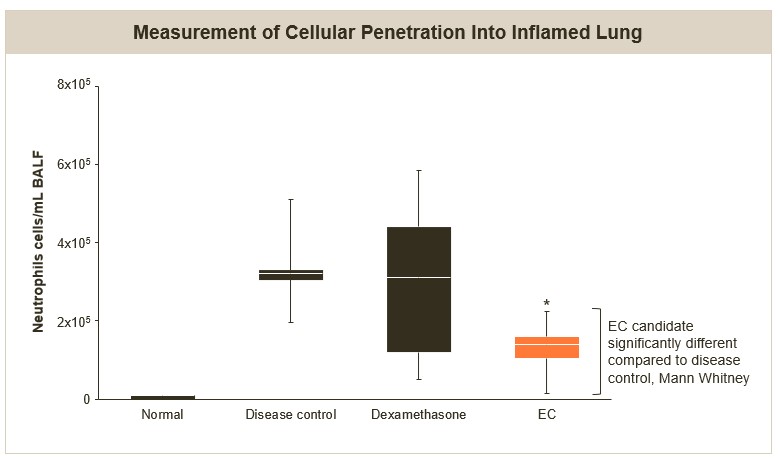
我们正在评估一种EC候选方案,以减少CXCL1、2和3以及IL-8基因簇在各种潜在适应症中的表达,包括炎症性肺部疾病,如中性粒细胞哮喘和急性呼吸窘迫综合征(ARDS),皮肤病和风湿病适应症,以及肿瘤学。CXCL基因簇的过度表达会产生趋化因子,吸引中性粒细胞,促进局部炎症。在ARDS的病例中,将炎症细胞募集到肺中的趋化因子在疾病发病机制中起着关键作用,ARDS患者肺细胞中CXCL1、2、3和IL-8基因簇的表达增加。ARDS是一种毁灭性的综合征,在美国的发病率约为20万,死亡率接近40%。
在一项针对人单核细胞CXCL1-8候选EC的临床前研究中,我们观察到在给药24小时后,CXCL1的基因表达下降了65%,CXCL1、CXCL2、CXCL3和CXCL8的基因表达与对照组相比下降了45%-60%。体外培养的人肺成纤维细胞经CXCL-EC处理后,培养上清液显示中性粒细胞迁移显著减少。
22
趋化因子基因的多基因IGD靶向导致中性粒细胞迁移显著减少(体外)
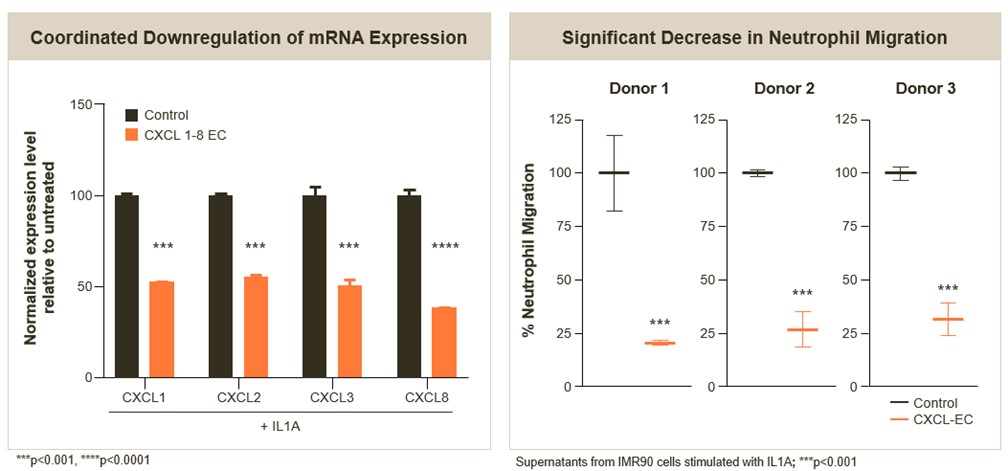
在ARDS动物模型的临床前研究中,我们观察到使用EC候选药物治疗后,肺部中性粒细胞浸润显著减少。分别于致炎前2小时和致炎后8小时分别给予3 mg/kg的候选EC致炎或10 mg/kg的地塞米松作为阳性对照。
ARDS模型中性粒细胞浸润减少(体内)
* p
23
再生医学
肝再生
我们正在开发EC候选者,旨在增加HNF4的表达转录主调节因子,作为一种潜在的方法来恢复严重肝功能障碍患者的肝细胞功能。HNF4通过控制对正常肝功能至关重要的蛋白质,如胆红素、白蛋白和代谢酶的表达,控制肝细胞和肝脏中其他细胞类型的发育、分化和动态平衡。在慢性肝病中,HNF4是下调的,这导致了肝功能衰竭的病理。研究表明,HNF4的表达增加即使是一小部分肝细胞也能恢复健康的肝功能。
2020年,慢性肝病和肝硬变是美国的主要死亡原因,死亡人数超过5万人。根据疾病的病因,治疗选择可能包括皮质类固醇、抗病毒药物或其他药物,最后的选择是肝移植。2019年,在美国,有超过1.3万人在等待肝脏移植,约12%的人在接受移植前死亡。
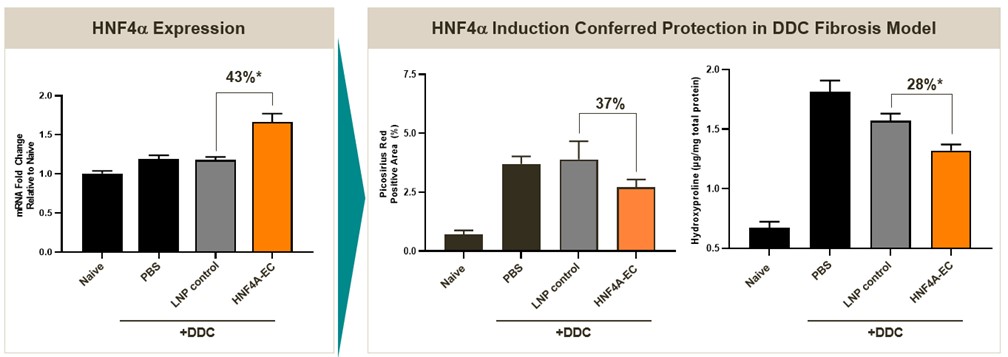
在初级健康人肝细胞的临床前研究中,单剂量使用我们的EC候选药物可诱导HNF4持续增加长达10天,我们认为这可能足以使CLD和ESLD患者的肝细胞恢复功能状态和恢复肝功能。我们还观察到,EC介导的hNF4α表达上调与临床相关纤维化基因在体外的表达减少相关,如下图所示。这些数据支持我们的EC候选者提出的治疗作用机制。
HNF4α靶向EC显著上调HNF4α表达和
在临床前模型中减少纤维化的关键指标
如下图所示,在体内临床前小鼠肝纤维化模型,用四氯化碳处理诱导肝细胞变性(标记CCL4如下图所示)。用我们候选EC的小鼠替代构建的治疗显示,在第31天和第38天,无论是每周给药一次还是两次,肝细胞变性的发生率都显著降低。
24
候选EC的小鼠代理构建改善了肝脏组织学(体内)
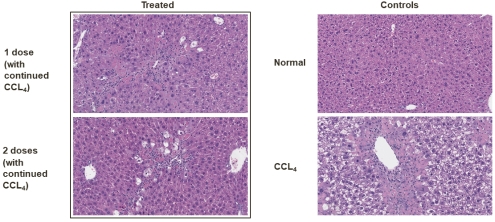
我们目前正在进行额外的体外培养和体内我们候选EC的药理、处方优化、疗效和初步安全性研究。
翻译数据
我们候选EC的临床翻译的一个关键因素是我们设计能够针对IGD并调节跨物种基因表达的EC候选。在临床前研究中,我们评估了HNF4的变化在非人类灵长类动物和移植并生长在用我们候选EC处理的小鼠(下图中标记为FRG Mouse)的人肝组织和用针对同源小鼠靶序列的EC候选处理的健康小鼠中表达。如下图所示,我们观察到HNF4在治疗上的上调。与对照组相比,结果显示小鼠增加了246%,非人类灵长类增加了68%,FRG小鼠增加了31%。我们相信,我们行动机制的这种翻译保真度支持我们继续发展我们的EC候选人和计划。
EC候选人在临床前研究中增加了HNF4α的表达(体内)

* p
25
交付数据
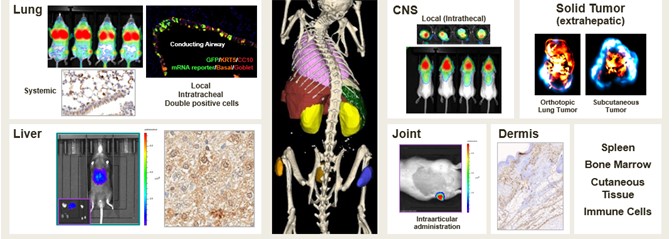
我们公司在信使核糖核酸药物的配方、递送和开发方面拥有丰富的内部专业知识。我们目前正在探索来自各种内部和外部来源的一系列LNP和非LNP配方,并已开发出专有配方,表明了具体和有效的体内在临床前研究中,我们的EC候选对象向许多治疗相关的细胞和组织类型提供功能,如下图所示。我们目前的递送制剂库可访问各种组织和细胞类型,包括肝脏(例如肝细胞、星状细胞、Kupffer细胞)和肺(例如内皮、肺泡、上皮)。利用交付的势头,我们还在提升我们的能力,以覆盖局部关节(例如滑膜层、软骨细胞、免疫细胞)、中枢神经系统(例如脊髓、脑)以及肿瘤(例如皮下、原位)。这些交付能力共同使我们能够发展和扩大我们的渠道。
内部开发努力开发专有LNPs并扩展到其他组织
制造业
我们认为制造能力、产能和控制的发展对我们的整体成功至关重要,特别是对我们满足开发时间表、控制运营成本以及为我们的平台技术和候选产品产生和保护知识产权的能力至关重要。正因为如此,我们选择了经过临床验证的制造和交付技术,我们拥有深厚的内部专业知识,与正在为疫苗开发和基因编辑领域的各种应用开发的技术类似。因此,我们能够利用我们自己的经验,以及以前和现在使用相同模式的产品所建立的技术改进和监管先例。
我们的内部流程和分析开发组织已经建立了足够规模的制造流程,以满足我们对药物物质和药物产品的研究和早期临床前开发需求。此外,我们聘请了在制造我们的药物物质和药品方面具有丰富经验的高技能第三方合同开发和制造组织(CDMO),以根据当前的良好制造规范(CGMP)大规模实施我们的制造工艺。我们已经与第三方CDMO建立了制造服务协议,以供应药物物质和药物产品,以满足我们对临床前研究、IND毒理学研究和临床试验的需求。我们预计未来几年将继续依赖第三方CDMO供应药品、药品和制成品。
对于我们的每一项治疗计划,我们都从外部合作和我们内部的LNP研发平台评估最佳的LNP交付选项。例如,对于我们的主导计划OTX-2002,我们从Acuitas Treateutics,Inc.或Acuitas获得了LNP技术的许可。Acuitas是一家拥有广泛LNP知识产权的公司,在合作和开发用于临床的LNP方面有着良好的记录。我们相信,我们与外部合作伙伴的合作将提供重要的配方和制造专业知识,
26
促进将cGMP标准下的LNP信使核糖核酸的制定过程转移给CDMO。我们还在聘请更多经验丰富的CDMO来生产我们的候选产品。
我们相信,通过我们的第三方CDMO和现有的内部设施,我们有足够的制造能力来满足我们目前的研究、临床前和临床材料需求。我们相信,目前在外部建立的制造能力,加上内部能力,将足以满足我们未来几年的预期需求。我们监测药品和药品生产的生产能力,并相信我们与CDMO的供应协议以及新材料供应的交货期将使我们能够获得额外的产能,以满足我们的预期需求。我们还相信,我们的产品可以规模化生产,并具有生产和采购效率,这将导致具有商业竞争力的成本。
竞争
作为一家初创阶段的生物技术公司,我们面临着来自制药和生物技术行业的各种公司的竞争。这场竞争既包括小公司,也包括拥有比我们自己更多的财务和技术资源以及更长的运营历史的大公司。我们还与学术、政府和私人研究机构的知识产权、技术和产品开发努力竞争。
我们的竞争对手可能比我们拥有更多的财务资源、成熟的市场地位、在研发、制造、临床前和临床测试、获得监管批准和报销以及营销批准的产品方面的专业知识。这些竞争对手还在招聘和留住合格的科学、销售、营销和管理人员、建立临床试验场地和临床试验的患者登记,以及在获取与我们的计划互补或必要的技术方面与我们竞争。规模较小或处于初创阶段的公司也可能成为重要的竞争对手,特别是如果它们与大公司建立合作安排的话。
影响我们开发的任何产品成功的关键竞争因素,如果获得批准,很可能是它们的有效性、安全性、便利性、价格以及政府和其他第三方付款人是否可以报销。如果我们的竞争对手开发和商业化比我们可能开发的任何产品更有效、副作用更少或更不严重、更方便或更便宜的产品,我们对任何候选产品的商业机会可能会减少或消失。我们的竞争对手也可能比我们更快地为他们的产品获得FDA或其他监管部门的批准,并可能比我们更快地将产品商业化。
我们希望与开发专注于基因表达控制的技术的公司竞争,这些公司使用各种技术,如CRISPR基因编辑、基因疗法、非编码RNA疗法和小分子表观遗传学。这些公司包括:Alnylam制药公司、比姆治疗公司、生物遗传公司、CRISPR治疗公司、Editas制药公司、Ionis制药公司、Intellia治疗公司、扬森制药公司、辉瑞和Sangamo治疗公司。
此外,虽然我们不知道还有其他公司开发表观基因组控制器和预先转录调控基因表达来治疗肝癌或非小细胞肺癌,但有几家公司正在开发使用基因表达控制来治疗肝癌或非小细胞肺癌的疗法,包括正在开发反义抑制剂的Ionis PharmPharmticals Inc.、阿斯利康、Alnylam PharmPharmticals Inc./歌礼制药和Bio-Path Holdings,Inc.正在开发siRNA抑制剂的Nitto Denko Corporation和SimaEconomics,Inc.正在开发微RNA模拟疗法的Intera Technologies B.V.,以及正在开发微RNA模拟疗法的Momotaro-gene Inc.和Genprex,Inc.。他们正在开发基因治疗方法,以及Mina治疗有限公司,该公司正在开发一种小型激活RNA疗法。
这些技术,以及其他形式,如小分子和生物制剂,可能被用来开发治疗候选药物,这些候选药物将与我们目前以及潜在的未来候选产品竞争。此外,我们预计我们开发的任何ECs都将在其目标适应症上与现有的治疗方法竞争。
知识产权
27
我们相信,我们的知识产权是一项战略性资产,有可能为我们提供竞争优势。我们努力保护对我们的业务具有重要商业意义的专有技术、发明和改进,包括追求、维护、捍卫和维护专利权,无论是内部开发的还是从第三方获得许可的。我们的政策和做法是通过各种方法保护我们的专有地位,包括在美国和美国以外的司法管辖区提交与我们的专有技术(例如,omega平台、ECs、交付和制造技术)、发明、改进和候选产品相关的专利申请,这些对我们业务的发展和实施非常重要。我们还依赖于与我们的专有技术和候选产品相关的商业秘密和技术诀窍。我们继续创新和寻求许可内的机会,以发展、加强和保持我们在表观遗传药物领域的专利地位。此外,我们还依赖数据独占性、市场独占性和专利期延长(如果有),并计划为我们的治疗产品寻求和依赖通过孤儿药物指定提供的监管保护。我们的商业成功在一定程度上可能取决于我们是否有能力为我们的技术、发明和改进获得并维护专利和其他专有保护;对我们的商业秘密保密;维护我们使用第三方拥有的知识产权的许可证;捍卫和执行我们的专有权利,包括我们的专利;以及在不侵犯有效和可执行的专利以及第三方其他专有权利的情况下运营。
我们全资拥有和授权的专利组合涵盖了omega平台的各个方面,包括制造、交付、ECS和我们的治疗计划。我们的专利组合还包括我们正在开发的候选产品。截至2023年12月31日,我们的专利组合由42个专利家族组成。这些家族中有4项美国专利,2项在欧洲和日本的外国专利,这些专利将于2037年或2038年到期。这些专利系列还包括38项未决的美国专利申请(包括临时和非临时申请),94项在澳大利亚、巴西、加拿大、中国、欧亚大陆、欧洲、香港、印度、日本、韩国、墨西哥、新西兰、新加坡、南非和台湾的未决外国专利申请,以及7项尚未进入国家阶段的拥有或授权中的专利合作条约申请。由我们专利组合中的未决专利申请颁发或声称具有优先权的任何美国或外国专利将在2037年至2044年之间到期,而不考虑任何可能的专利期限调整或延长,并假设支付所有适当的维护、续订、年金和其他政府费用。我们的目标是继续扩大我们的专利组合,以保护我们的专有技术(包括omega平台、ECs、交付和制造技术)、发明、改进以及当前和未来的候选产品。我们的专利组合目前包括一项授权专利,至少涵盖我们的一种候选产品。
我们的知识产权组合涵盖的产品和技术领域的更多细节如下所述。
欧米茄平台相关知识产权
我们的知识产权组合包括针对omega平台和交付技术的专有技术和专利权,这些技术是在内部开发的,由怀特黑德生物医学研究所(WIBR)和旗舰先锋创新公司或旗舰公司独家或联合独家授权。
我们omega平台技术的知识产权组合包括针对使用ECs的组合物和方法的专利权;通过靶向IGD上调或下调基因表达的方法和组合物;通过表观遗传效应、物理干扰物和遗传修饰剂靶向IGD调控基因表达的组合物;以及识别和询问IGD的方法。该产品组合广泛地涉及我们现有的候选产品和我们未来可能开发的产品,以及我们目标或未来可能目标的迹象。与我们的omega平台相关的知识产权包括我们拥有的专利申请。截至2023年12月31日,我们拥有两项临时美国专利申请,披露了从表观遗传上调节与omega平台相关的目标基因表达的某些方法。我们预计,这些未决申请(如果有)颁发的或声称拥有优先权的专利将于2044年到期,不包括任何专利期限调整或延长。
我们还从旗舰产品获得与我们的omega平台相关的专利和专利申请许可。截至2023年12月31日,我们在澳大利亚、巴西、加拿大、中国、欧亚大陆、欧洲、香港、印度、日本、韩国、墨西哥、新西兰、新加坡、韩国、澳大利亚、巴西、加拿大、中国、欧洲、香港、印度、日本、韩国、墨西哥、新西兰、新加坡、韩国、澳大利亚、巴西、加拿大、中国、欧洲、香港、印度、日本、韩国、墨西哥、新西兰、新加坡、韩国、墨西哥、新西兰、新加坡、韩国、澳大利亚、巴西、加拿大、中国、欧洲、香港、印度、日本、韩国、墨西哥、新西兰、新加坡、韩国
28
非洲和台湾与omega平台相关。我们预计,这些未决申请(如果有)颁发的专利或声称对其拥有优先权的专利将在2037年至2041年之间到期,不包括任何专利期限调整或延长。
我们还从WIBR获得与我们的omega平台相关的专利和专利申请许可。截至2023年12月31日,我们从WIBR获得授权一项美国专利,两项在欧洲和日本的外国专利,四项非临时的美国专利申请,以及在加拿大、中国、欧洲、香港、日本和墨西哥的11项外国专利申请,披露了与omega平台相关的目标基因甲基化调节的某些方法和组成。我们预计,这些未决申请(如果有)颁发的或声称拥有优先权的专利将于2037年或2038年到期,不包括任何专利期限调整或延长。
上述对我们专利权的描述不包括Acuitas拥有的、根据非排他性许可协议向Omega授予的专利和专利应用的权利,或者由日东电工公司(Nitto Denko Corporation,或Nitto)拥有并根据仅限于联合开发候选药物的独家许可协议向我们授予的专利和专利应用的权利。
与交付相关的知识产权
我们交付技术的专利组合包括针对LNP制剂、脂分子和细胞穿透性多肽组合物及其用途的专利申请。我们拥有与我们的交付技术相关的某些专利申请,并拥有来自旗舰公司的某些专利申请的许可。截至2023年12月31日,我们拥有7项美国临时专利申请,2项非临时美国专利申请,10项来自澳大利亚、加拿大、中国、欧洲、日本和韩国的外国专利申请,以及2项与交付技术相关的PCT专利申请。我们预计,这些未决申请(如果有)颁发的专利或声称对其拥有优先权的专利将在2041年至2044年之间到期,不包括任何专利期限调整或延长。截至2023年12月31日,我们还获得了旗舰专利One颁发的美国专利和一项与交付技术相关的非临时美国专利申请的授权。我们预计,这些未决申请(如果有)颁发的或声称拥有优先权的专利将于2037年到期,不包括任何专利期限调整或延长。
疾病相关知识产权
我们知识产权组合中与疾病相关的专利权为专门针对某些疾病和相关疾病状态的ECS提供了覆盖范围。我们的Lead计划的疾病相关专利申请包括下面描述的那些。下面描述的每一项与疾病相关的专利申请要么由我们全资拥有,要么由WIBR或旗舰公司独家或共同独家许可。
Myc
我们的OTX-2002计划针对的是c-Myc家族癌基因。我们已经开发出了下调c-Myc的内皮细胞,用于治疗肝癌。我们还设计了一个减少c-Myc表达的计划来治疗非小细胞肺癌。截至2023年12月31日,我们拥有三项与治疗c-Myc相关癌症的方法有关的临时美国专利申请。我们预计,要求优先于这些未决专利申请的专利(如果有)将于2044年到期,不包括任何专利期限的调整或延长。截至2023年12月31日,我们还从旗舰公司获得了一项美国临时专利申请,一项非临时美国专利申请,澳大利亚、巴西、加拿大、中国、欧亚大陆、欧洲、印度、日本、墨西哥、新西兰、新加坡、南非和台湾的17项外国专利申请,以及三项PCT申请,涉及EC物质的组成、c-Myc相关癌症的治疗方法和c-Myc表达的调节方法。我们预计,这些未决专利申请(如果有)颁发的专利或声称对其拥有优先权的专利将在2041年至2044年之间到期,不包括任何专利期限调整或延长。
CXCL1、2、3和IL-8
我们正在开发EC候选,以减少CXCL1、2、3和IL-8基因簇的表达。该计划旨在减少趋化因子的表达,这些趋化因子在广泛的炎症性疾病中过度表达,包括类风湿性关节炎、痛风、中性粒细胞哮喘和ARDS。截至2023年12月31日,我们在台湾获得了一项旗舰PCT专利申请和一项外国申请的授权,涉及
29
针对CXCL 1-3/IL-8免疫球蛋白的EC组合物,以及治疗包括类风湿性关节炎在内的炎症性疾病的方法。我们期待从这些未决的专利申请中获得或声称拥有优先权的专利,如果有, 到2043年到期,不包括任何专利期限的调整或延长。
HNF4a
我们的肝脏再生计划针对的是主要转录调控因子HNF4a。我们已经开发出可以增加HNF4表达的EC候选基因a以恢复严重肝功能障碍患者的肝细胞功能。截至2023年12月31日,我们在澳大利亚、加拿大、中国、欧洲、香港和日本拥有1项美国非临时专利申请和6项外国专利申请,涉及EC物质成分和治疗肝病的方法。我们预计,这些未决专利申请(如果有)颁发的专利或声称对其拥有优先权的专利将于2040年到期,不包括任何专利期限调整或延长。
其他疫区
除了我们上面列出的疾病计划外,我们还拥有与新的EC成分及其用于治疗额外疾病的专利申请,这些疾病将受益于基因表达的上调或下调。
截至2023年12月31日,我们在澳大利亚、加拿大、中国、欧洲、香港和日本拥有一项非临时性美国专利申请和六项外国专利申请,涉及神经疾病的组合物和治疗方法。我们预计,这些未决申请(如果有)颁发的或声称拥有优先权的专利将于2040年到期,不包括任何专利期限调整或延长。
截至2023年12月31日,我们在澳大利亚、加拿大、中国、欧洲、香港和日本拥有一项非临时美国专利申请和六项外国专利申请,涉及代谢紊乱的组合物和治疗方法。我们预计,从这些待决申请发布或要求优先权的专利(如有)将于2040年到期,不包括任何专利期限的调整或延长。
截至2023年12月31日,我们拥有一项临时美国专利申请,涉及通过调节目标基因的表达来治疗代谢紊乱的成分和方法。我们预计,由该待决申请颁发或声称具有优先权的专利(如果有)将于2044年到期,不包括专利期限调整或延长。
截至2023年12月31日,我们拥有三项临时美国专利申请,涉及通过调节目标基因的表达来治疗癌症的成分和方法。我们预计,任何声称优先于这些待决申请的专利(如果有)将于2044年到期,不包括任何专利期限的调整或延长。
截至2023年12月31日,我们在澳大利亚、加拿大、中国、欧洲、香港和日本拥有一项非临时性美国专利申请和六项外国专利申请,涉及炎症性疾病的组合物和治疗方法。我们预计,这些未决申请(如果有)颁发的或声称拥有优先权的专利将于2041年到期,不包括任何专利期限调整或延长。
截至2023年12月31日,我们拥有一项PCT专利申请,涉及脱发的组合物和治疗方法。我们预计,声称优先于这一待决申请的专利(如果有)将于2042年到期,不包括任何专利期限调整或延长。
截至2023年12月31日,我们拥有一项针对肝病治疗组合物和方法的临时美国专利申请。我们预计,声称优先于这一待决申请的专利(如果有)将于2044年到期,不包括任何专利期限调整或延长。
我们打算在开发新的平台技术和候选产品的同时,不断评估和完善我们的知识产权战略,并提交更多的专利申请。
30
许可协议
我们是许可协议的一方,根据这些协议,我们从第三方许可专利、专利申请和其他知识产权。许可的知识产权至少部分涵盖了通过靶向IGD来调节基因表达的方法和组合物。这些许可证对我们施加了各种勤勉和财务付款义务。我们预计未来将继续签订这些类型的许可协议。我们认为以下许可协议对我们的业务至关重要。
与旗舰产品签订许可协议
于2019年3月,吾等与旗舰公司订立一项协议或旗舰协议,据此,吾等(I)不可撤销及无条件地将吾等于“本公司成立”前构思的若干基础知识产权的所有权利、所有权及权益转让予旗舰公司,其定义为吾等完成B系列融资或吾等首席执行官(该等基础知识产权)受雇首日(以较早者为准)及(Ii)在该等基础知识产权项下从旗舰公司获得独家、全球性、有版税、可再许可及可转让的许可,以开发、制造及商业化任何产品或过程或其组件、开发、制造及商业化任何产品或过程或其组件、开发、制造及商业化任何产品或过程或其组件、开发、制造及商业化其制造和商业化将在旗舰协议有效期内侵犯至少一项基础知识产权的有效主张,而不是根据旗舰协议在治疗领域授予的许可。此外,旗舰公司不可撤销及无条件地将其于任何及所有声称拥有以下发明的专利的权利、所有权及权益转让予我们:(I)由旗舰先锋公司或旗舰管理公司单独构思,或由旗舰管理公司与我们共同构思;(Ii)在“本公司成立”后;及(Iii)根据与旗舰管理公司的某些管理协议或管理协议而进行的活动,或旗舰管理公司对我们事务的其他参与,但不包括基础知识产权。基础性IP尤其针对omega平台,包括通过靶向IGD来调节基因表达的一般方法和组合物(例如,EC)以及针对用于治疗各种疾病的特定靶点的特定组合物和方法,例如与MYC、CXCL1、CXCL2、CXCL3和IL-8中的一个或多个相关的疾病。我们在我们的omega平台和我们的候选治疗产品中利用旗舰协议授予的权利,包括我们针对调节MYC、CXCL1、CXCL2、CXCL3和IL-8中的一个或多个的治疗计划。截至2023年12月31日,基础IP预计将在2037年至2043年之间到期。授予基础知识产权的许可取决于我们遵守旗舰协议下的义务。我们在旗舰协议下的义务包括利用商业上合理的努力来开发和商业化许可产品和旗舰协议所要求的付款,包括许可产品净销售额的特许权使用费。根据旗舰协议,我们有责任按许可产品和司法管辖区按许可产品和司法管辖区向旗舰产品支付按许可产品净销售额较低的个位数百分比计算的使用费。我们单独负责基于基础IP开发的任何候选产品的临床开发。根据旗舰协议,旗舰公司保留仅出于非商业研究和开发目的在治疗学领域实施基础性知识产权的权利,并履行管理协议下的职责。
旗舰协议将于最后一个到期的许可使用费期限终止,该期限将在涵盖该许可产品的任何基础知识产权的最后一个有效索赔到期时终止,该期限将根据每个许可产品和每个司法管辖区的许可产品而终止。在任何司法管辖区的许可产品的许可使用费期限届满并全额支付旗舰协议项下该许可产品的所有欠款后,授予我们的许可将自动转换为该司法管辖区内该许可产品的非独家全额支付许可。为方便起见,我们有权在60天书面通知后终止旗舰协议的全部内容。任何一方在收到书面通知后30天内未得到纠正的重大违约行为,均可终止旗舰协议。此外,如果我们停止经营与旗舰协议中授予的权利有关的业务,旗舰可以(I)在30天内发出书面通知终止,(Ii)如果我们遭遇破产事件,在书面通知下终止,或(Iii)如果我们质疑任何基础知识产权的有效性、可专利性或可执行性或参与任何此类挑战,在书面通知后立即终止。如果旗舰确定我们没有采取商业上合理的努力在许可领域内的特定子领域开发许可产品并将其商业化,则在事先书面通知的情况下,旗舰有权终止该子领域中该许可产品的许可。然而,在这种情况下,如果旗舰公司批准了一份书面的开发和商业化计划,我们可以保留对此类许可产品和子领域的许可。
31
与WIBR签订独家和共同独家许可协议
2019年5月,我们与WIBR签订了独家许可协议,或WIBR独家协议。根据WIBR独家协议,我们在WIBR拥有或控制的某些专利权下获得了独家的、全球范围的、版税负担的、可再许可的许可,可以在人类和动物治疗和诊断领域进行研究、制造、制造、使用、销售、提供销售、租赁和进口产品,以及进行和已经进行许可的过程。WIBR独家协议下的许可专利主要针对IGD中调节基因表达的方法和组合物。
2019年5月,我们还与WIBR签订了共同独家许可协议,即WIBR共同独家协议。根据WIBR共同独家协议,我们获得了由WIBR拥有或控制的某些专利权项下的全球共同独家、有版税、可再许可的许可,可以研究、制造、制造、使用、销售、提供销售、租赁和进口产品,以及在人类和动物治疗和诊断领域进行和已经进行许可的过程。如果WIBR与共同独家被许可人之间的共同独家许可协议因任何原因在任何时间终止,我们在WIBR共同独家协议下的共同独家权利将成为独家。WIBR共同独家协议下的许可专利主要针对通过靶向IGD来调节基因表达的方法和组合物。WIBR独家协议和WIBR共同独家协议统称为WIBR协议。
根据WIBR协议,WIBR保留将许可专利用于研究、教学和其他教育目的(包括用于第三方赞助的研究)的权利,并向其他学术和非营利研究机构授予仅用于非商业研究、教学和其他教育目的的非独家许可。
根据WIBR协议授予我们的许可证受美国政府持有的某些先前存在的权利的约束。根据适用法律,美国政府保留与联邦研究资助产生的许可专利有关的某些权利。根据WIBR协议授予我们的许可还受制于与WIBR签订了特定赞助研究协议或SRA的特定第三方所拥有的某些先前存在的权利。提交一份计划,以供WIBR批准开发提议的产品,该计划的批准不得无理扣留。
根据WIBR独家协议,我们需要向WIBR支付中间五位数的年度许可证维护费。WIBR还有权为前三种获得许可的产品(不包括备份产品)获得总计高达170万美元的潜在临床和监管里程碑。对于我们、我们的附属公司或我们的分被许可人销售的许可产品,WIBR有权从许可产品的净销售额中获得较低的个位数百分比的版税,直到各国专利权到期或放弃为止。对于特定国家/地区的授权产品,我们有权获得这些版税的某些惯例减免和补偿。如果我们根据WIBR独家协议再许可我们开发或商业化许可产品的权利,WIBR有权从我们的再许可中获得从我们的再许可中获得的一定比例的非版税付款,从零到较低的两位数不等,这取决于执行该再许可时我们许可产品的开发阶段。
除非提前终止,否则WIBR独家协议将一直有效,直到所有许可专利权到期或放弃为止。在书面通知WIBR后,我们可以在我们方便的时候终止WIBR独家协议。任何一方可以因另一方未治愈的实质性违约而终止WIBR独家协议。如果欧米茄停止经营业务,WIBR也可能终止WIBR独家协议。根据WIBR独家协议,最后一项到期的专利如果发布,预计将于2038年到期。
32
根据WIBR共同独家协议,我们需要向WIBR支付低至中五位数的年度许可证维护费。WIBR还有权为前三种许可产品(不包括备份产品)获得总计高达190万美元的潜在临床、监管和再许可里程碑。对于我们、我们的附属公司或我们的分被许可人销售的许可产品,WIBR有权按许可产品的净销售额收取低于个位数百分比的版税,并从许可服务收入获得较低的个位数百分比版税,直到各国专利权到期或放弃为止。对于特定国家/地区的授权产品,我们有权获得这些版税的某些惯例减免和补偿。如果我们根据WIBR共同独家协议对我们开发或商业化许可产品的权利进行再许可,则WIBR有权就授予再被许可人在许可专利下的权利的每一项此类再许可协议获得五位数的年薪中位数。
除非提前终止,否则WIBR共同独家协议将一直有效,直到所有许可专利权到期或放弃为止。在书面通知WIBR后,我们可以在我们方便的时候终止WIBR共同独家协议。任何一方可以因另一方未治愈的实质性违约而终止WIBR共同排他性协议。如果我们停止经营我们的业务,WIBR也可以终止WIBR共同独家协议。根据WIBR共同独家协议,最后一项到期的专利如果发布,预计将于2037年到期。
在截至2023年12月31日和2022年12月31日的年度内,我们分别产生了20万美元和不到20万美元的费用,包括许可证维护费和里程碑付款。
与Acuitas达成的协议
开发和选择协议
2020年10月,我们和Acuitas达成了一项开发和期权协议,或Acuitas期权协议。根据Acuitas期权协议,双方同意联合开发将我们的基因调节疗法与Acuitas的LNPs相结合的某些产品。双方在其专有技术下向另一方授予了进行联合研究的全球非排他性、免版税许可。我们将根据Acuitas选项协议下的工作计划支付Acuitas的人员费用和进行研究所发生的外部费用。根据Acuitas期权协议,Acuitas授予我们选择权,根据Acuitas与LNP技术或Acuitas LNP技术相关的专利权和专有技术,获得与两个指定靶点(例如EC构建物)或保留靶标相关的非独家、全球、可再许可的许可,以开发和商业化一个或多个治疗产品,包括编码保留靶标的mRNA。对于每个选项和预留目标,我们有义务支付每年的技术访问费和目标预留和维护费,总金额为六位数,直到该等预留目标从预留目标列表中删除,或直到我们对该预留目标行使选择权。在行使第一个期权时,我们需要在执行第一个非排他性许可证后支付150万美元的期权行权费。在行使第二个期权时,我们需要在执行第二个非排他性许可证后支付175万美元的期权行权费。于截至2023年及2022年12月31日止年度内,吾等根据Acuitas期权协议分别产生总开支40万美元及190万美元,包括技术接入费、目标预订及维护费、Acuitas提供服务的成本、材料成本及可获偿还成本。
除非较早前终止,否则Acuitas期权协议将一直有效,直至(1)两项期权均已行使及(2)自生效日期起计三年,但吾等可选择将三年期限再延长两年。任何一方都可以因另一方未治愈的重大违约或在另一方破产或类似事件时终止Acuitas期权协议。在书面通知Acuitas后,我们可以在我们方便的时候终止Acuitas期权协议。根据Acuitas期权协议,最后一项到期的专利如果发布,预计将于2041年到期。
许可协议
2021年3月,我们行使了Acuitas期权协议下的第一个期权,并与Acuitas签订了非独家许可协议,或Acuitas许可协议。与签署Acuitas许可协议有关,我们产生了150万美元的期权行使费用。Acuitas根据Acuitas LNP技术向我们授予了非独家的、全球范围的、可再许可的许可证,用于研究、开发、制造和商业开发由我们的OTX-2002基因调节组成的产品
33
治疗学和针灸的LNPs。根据Acuitas许可协议,最后一项到期的专利如果发布,预计将于2041年到期。根据Acuitas许可协议,我们需要向Acuitas支付高达六位数的年度许可维护费,直到我们达到特定的发展里程碑。Acuitas有权获得总计高达1800万美元的潜在临床、监管和商业里程碑付款。对于我们、我们的附属公司或我们的再被许可人销售的每一种许可产品,Acuitas有权按许可产品在特定国家/地区的净销售额收取较低的个位数百分比版税,直到在该国家/地区发生以下最后一次情况:(I)涉及许可产品的所有许可专利权到期或放弃,(Ii)许可产品的任何法规排他性到期,或(Iii)许可产品首次商业销售起十年,或许可使用费期限。如果没有许可专利覆盖许可产品,或者如果我们被要求获得与LNP技术相关的第三方专利,我们有权对给定国家/地区的每个许可产品获得一定的版税减免和补偿。
除非提前终止,否则Acuitas许可协议将一直有效,直到最后到期的版税期限到期。任何一方在另一方破产或发生类似事件时,均可因另一方未治愈的重大违约行为而终止Acuitas许可协议。在书面通知Acuitas后,我们可以在方便的时候终止Acuitas许可协议。
与日立的协作和许可协议
于2022年10月,吾等与Nitto订立合作及许可协议(“Nitto协议”),根据该协议(其中包括),Nitto向吾等授予与其LNP交付技术有关的、由Nitto拥有或控制的所有知识产权(“Nitto许可IP”)下的独家、全球性、有版税、完全可转让及完全可再许可的许可。
根据日东协议的条款,我们向日东支付了100万美元的预付现金。我们还需要根据具体开发、监管和销售里程碑的实现情况,在未来向日东支付高达8300万美元的款项。我们还有义务根据许可产品的净销售额,在特定情况下按国家/地区向Nitto支付个位数的分级、个位数百分比的版税。
除非我们提前终止,否则当我们没有就许可产品向该国家的日东支付进一步的版税时,日东协议将逐个国家到期。在国家/地区许可产品的适用版税期限到期后,该许可将成为该国家/地区的许可产品的全额全额、免版税、永久和不可撤销的许可。任何一方在另一方未治愈的实质性违反日东协议的情况下终止日东协议,在另一方破产、资不抵债或某些类似事件发生的情况下,吾等可在任何时间以任何或没有任何理由终止日东协议。在截至2023年12月31日的年度内,我们记录了90万美元的研发费用,其中包括材料成本、日东提供服务的成本和可报销成本。
与诺和诺德公司达成研究合作协议
于2023年12月31日,我们与诺和诺德A/S(“诺和诺德”)、先锋药业08,Inc.(“PM SpinCo”)以及先锋药业(NN)、有限责任公司(“股东”)及PM(NN)探索公司(“PMCo NN”及PM SpinCo及股东,“PM实体”)签订了研究合作协议(“Novo RCA”),并就新研究合作协议中所载的若干条款与旗舰先锋药业(“旗舰”)的关联公司先锋药业(NN)、有限责任公司(“股东”)及PM(NN)探索公司(“PM实体”)订立了合作协议。根据Novo RCA的条款,我们向诺和诺德授予了独家的、有版税的、可转让的许可,有权对我们的某些知识产权授予分许可,以便在与PM实体达成一致的研发计划下进行研究和开发活动,该计划与产品候选或计划目标有关,用于预防、治疗或控制世界各地人类的心脏代谢性疾病,包括糖尿病。在执行Novo RCA方面,我们从Novo Nordisk收到了510万美元的不可退还预付款,预计到2027年将获得约2160万美元的成本补偿,以资助相关的研发活动。诺和诺德就授权产品和国家/地区支付许可使用费的义务将在授权产品在该国家/地区首次商业销售、适用于该授权产品的某些有效专利权利要求在该国家/地区最后一次到期、以及该授权产品在该国家/地区的监管排他性到期后最迟十年失效,但受以下条件限制
34
Novo RCA中规定的某些特许权使用费降低和逐步减少的条款。详情请参阅本年度报告结尾处综合财务报表附注内的附注11--合作协议。
政府监管
我们受到广泛的监管。我们预计我们的候选产品将作为生物制品受到监管。生物制品受《联邦食品、药品和化妆品法》、《公共卫生服务法》、《PHS法》以及其他联邦、州、地方和外国法规的监管。除其他事项外,《食品和药物管制法》和《小灵通法案》及其相应法规都对涉及生物制品的检测、制造、安全、功效、标签、包装、储存、记录保存、分销、报告、广告和其他促销活动进行管理。
美国生物制品开发过程
FDA在生物药物在美国上市之前所需的程序通常包括以下几个方面:
在人体上测试任何候选生物制品之前,候选产品进入临床前测试阶段。临床前试验,也称为非临床研究,包括对产品化学、毒性和配方的实验室评估,以及评估候选产品潜在安全性和活性的动物研究。临床前试验的进行必须符合联邦法规和要求,包括GLP。
临床研究赞助商必须将临床前试验的结果与生产信息、分析数据、任何可用的临床数据或文献以及拟议的临床方案一起提交给FDA,作为IND的一部分。即使在IND提交之后,一些临床前试验也可能继续进行。IND在FDA收到后30天自动生效,除非FDA在30天内将临床研究搁置。在这种情况下,IND赞助商和FDA必须在临床研究开始之前解决任何悬而未决的问题。FDA还可以在临床试验之前或期间的任何时候,出于安全考虑或不符合规定的原因,对候选生物制品施加临床限制。如果FDA强制临床暂停,试验可能不会在没有FDA授权的情况下重新开始,然后只有在FDA授权的条件下才能重新开始。
除了IND提交程序外,某些含有重组或合成核酸分子的细胞临床试验的赞助商,包括人类基因转移研究,也要接受评估
35
并由机构生物安全委员会或IBC进行评估,IBC是一个地方机构委员会,根据美国国立卫生研究院涉及重组或合成核酸分子的研究指南或NIH指南,审查和监督该机构使用重组或合成核酸分子的研究。IBC评估研究的安全性,并确定对公众健康或环境的任何潜在风险,这种审查可能会导致临床试验启动之前的一些延迟。虽然NIH指南不是强制性的,除非相关研究是在接受NIH重组或合成核酸分子研究资助的机构进行的或由其赞助的,但许多公司和其他不受NIH指南约束的机构自愿遵循这些指南。
临床试验涉及在合格调查人员的监督下,将候选生物制品给健康志愿者或患者服用,这些调查人员通常是不受研究赞助商雇用或控制的医生。临床试验是在详细说明临床研究的目标、给药程序、受试者选择和排除标准以及用于监测受试者安全性的参数的协议下进行的,包括确保在某些不良事件发生时临床研究将被停止的停止规则。每个方案和对方案的任何修改都必须作为IND的一部分提交给FDA。临床试验必须根据FDA包含GCP要求的规定进行和监测,包括要求所有研究对象提供知情同意。此外,每项临床研究都必须由独立的机构审查委员会或IRB进行审查和批准,该委员会位于或服务于将进行临床研究的每个机构。IRB负责保障研究参与者的福利和权利,并考虑参与临床试验的个人的风险是否降至最低,以及与预期利益相比是否合理等项目。IRB还批准知情同意书的形式和内容,该同意书必须由每个临床研究受试者或其法律代表签署,并必须监督临床研究直到完成。
人体临床试验通常分三个连续阶段进行,这些阶段可能重叠或合并:
批准后临床试验,有时称为4期临床试验,可能在首次上市批准后进行。这些临床试验用于从预期治疗适应症患者的治疗中获得额外经验,特别是用于长期安全性随访。
在临床开发的所有阶段,监管机构要求对所有临床活动、临床数据和临床研究调查人员进行广泛的监测和审计。详细说明临床试验结果的年度进展报告必须提交给FDA。书面的IND安全报告必须迅速提交给FDA、NIH和调查人员,以了解严重和意外的不良事件、其他试验的任何发现、实验室动物试验或体外培养试验表明对人类受试者有重大风险,或与方案或研究人员手册中列出的试验相比,严重可疑不良反应的发生率在临床上具有重要意义。赞助商必须在15个历日内提交IND安全报告,在赞助商确定该信息有资格报告后。赞助商还必须在赞助商首次收到信息后七个历日内,将任何意外的、致命的或危及生命的疑似不良反应通知FDA。FDA或赞助商或其数据安全监测委员会可以随时以各种理由暂停临床研究,包括发现研究对象或患者面临不可接受的健康风险。同样,如果一项临床研究不是按照IRB的要求进行的,或者如果候选生物制品与患者受到意想不到的严重伤害有关,IRB可以暂停或终止对其机构的临床研究的批准。
36
还有关于向公共注册机构报告正在进行的临床试验和已完成的临床试验结果的要求。FDA监管产品(包括生物制品)的临床试验赞助商必须注册并披露某些临床试验信息,这些信息可在www.Clinicaltrials.gov上公开获得。与产品、患者群体、调查阶段、研究地点和研究人员以及临床试验的其他方面相关的信息随后作为注册的一部分公开。赞助商也有义务在完成后讨论他们的临床试验结果。这些试验结果的披露可以推迟到正在研究的新产品或新适应症获得批准之后。
在临床试验的同时,公司通常完成额外的动物试验,还必须开发关于候选生物制品物理特征的额外信息,并根据GMP要求最终确定商业批量生产产品的工艺。为了帮助降低使用生物制品引入外来制剂的风险,PHS法案强调了对属性无法准确定义的产品进行制造控制的重要性。制造过程必须能够始终如一地生产高质量的候选产品批次,除其他外,赞助商必须开发测试最终生物制品的特性、强度、质量、效力和纯度的方法。此外,必须选择和测试适当的包装,并进行稳定性研究,以证明候选生物制品在保质期内不会发生不可接受的变质。
美国审查和批准流程
在完成候选生物制品的临床试验后,在生物制品的商业营销之前,必须获得FDA对BLA的批准。BLA必须包括产品开发、实验室和动物试验、人体试验、产品制造和成分的信息、建议的标签和其他相关信息。此外,根据儿科研究公平法或PREA,BLA或BLA的补充剂必须包含数据,以评估所有相关儿科亚群中声称的适应症候选生物制品的安全性和有效性,并支持该产品对安全有效的每个儿科亚群的剂量和给药。食品和药物管理局安全和创新法案(FDASIA)要求,计划提交药物或生物制品的营销申请的赞助商,如果该药物或生物制品包含新的有效成分、新的适应症、新的剂型、新的给药方案或新的给药途径,则必须在第二阶段会议结束后60天内或根据赞助商与FDA之间的协议提交初步儿科研究计划或PSP。
根据修订后的处方药使用费法案(PDUFA),每个BLA必须伴随着使用费。FDA每年调整PDUFA用户费用。在某些情况下,可以免除或减免费用,包括免除小企业首次提出申请的申请费。此外,对于被指定为孤儿药物的产品,不对BLAS评估使用费,除非该产品还包括非孤儿适应症。
在提交申请后60天内,FDA审查提交的BLA,以确定其是否在机构接受提交之前基本上完成。FDA可以拒绝提交其认为不完整或在提交时不能适当审查的任何BLA,并可能要求提供更多信息。在这种情况下,必须重新提交BLA以及附加信息。重新提交的申请在FDA接受备案之前也要进行审查。一旦提交的申请被接受,FDA就开始对BLA进行深入的实质性审查。FDA审查BLA,以确定建议的产品对于其预期用途是否安全有效,是否具有可接受的纯度概况,以及产品是否按照cGMP要求生产,以确保和保持产品的特性、安全性、强度、质量、效力和纯度。FDA可以将新型生物制品或提出安全性或有效性难题的生物制品的申请提交咨询委员会,通常是一个包括临床医生和其他专家的小组,以审查、评估和建议是否应该批准申请以及在什么条件下批准。FDA不受咨询委员会建议的约束,但它在做出决定时会仔细考虑这些建议。在生物制品审批过程中,FDA还将确定是否有必要制定风险评估和缓解战略,或REMS,以确保候选生物制品的安全使用。如果FDA得出结论认为需要REMS,则BLA的赞助商必须提交建议的REMS;如果需要,FDA将不会批准没有REMS的BLA。
37
在批准BLA之前,FDA将检查生产该产品的设施。FDA不会批准该产品,除非它确定制造工艺和设施符合GMP要求,并足以确保产品在所要求的规格内一致生产。此外,在批准BLA之前,FDA通常会检查一个或多个临床地点,以确保临床试验是按照IND研究要求和GCP要求进行的。
尽管提交了相关数据和信息,FDA可能最终决定BLA不符合其批准的监管标准并拒绝批准。从临床试验中获得的数据并不总是决定性的,FDA可能会以不同的方式解释数据,而不是申请者解释相同的数据。如果FDA决定不批准目前形式的BLA,FDA将发布一封完整的回复信,通常描述FDA确定的BLA中的所有具体缺陷。所确定的缺陷可能是微小的,例如,需要标签改变,或者是重大的,例如,需要额外的临床试验。此外,完整的回复信可以包括申请人可能采取的将申请置于批准条件下的建议行动。如果发出了完整的回复信,申请人可以重新提交BLA,解决信中确定的所有不足之处,或者撤回申请。
如果一种产品获得了监管部门的批准,这种批准可能会明显限于特定的疾病和剂量,或者使用的适应症可能会受到限制,这可能会限制该产品的商业价值。此外,FDA可能要求在产品标签中包括某些禁忌症、警告或预防措施。FDA可以以REMS的形式对产品的分销、处方或配药施加限制和条件,或以其他方式限制任何批准的范围。此外,FDA可能要求进行上市后临床试验,有时被称为第四阶段临床试验,旨在进一步评估生物制品的安全性和有效性,并要求进行测试和监督计划,以监测已商业化的批准产品的安全性。
FDA根据PDUFA商定的绩效目标之一是在提交申请之日起10个月内审查90%的标准BLAS,并在提交日期起6个月内审查90%的优先BLAS,从而做出审查决定。FDA并不总是达到其PDUFA标准和优先BLAS的目标日期,其审查目标可能会不时改变。如果FDA要求或BLA赞助商在PDUFA目标日期之前的最后三个月内提供关于提交材料中已经提供的信息的额外信息或澄清,则审查过程和PDUFA目标日期可延长三个月。
孤儿药物名称
根据《孤儿药法案》,FDA可以授予用于治疗罕见疾病或病症的药物或生物制剂孤儿称号,这种疾病或病症在美国影响不到20万人,或超过200人,在美国,没有合理预期开发和提供药物的成本用于此类疾病或病症的药物或生物制剂将从该药物或生物制剂在美国的销售中回收。在提交NDA或BLA之前,必须要求孤儿药指定。在FDA授予孤儿药指定后,该治疗剂的通用名称及其潜在的孤儿用途由FDA公开披露。孤儿药指定不会在监管审查或批准过程中带来任何好处,或缩短监管审查或批准过程的持续时间。
如果具有孤儿药物指定的产品随后获得了FDA对其具有此类指定的疾病的第一次批准,则该产品有权获得孤儿药物独家批准(或排他性),这意味着FDA可能不会批准任何其他申请,包括完整的NDA或BLA,以在七年内针对相同的疾病或状况销售相同的药物或生物药物,除非在有限的情况下,例如,显示出对具有孤儿药物排他性的产品的临床优势,或者FDA发现孤儿药物排他性持有人没有证明它可以确保获得足够数量的孤儿药物,以满足指定药物或生物药物所针对的疾病或状况的患者的需求。孤儿药物的排他性并不阻止FDA批准不同的药物或生物药物用于相同的疾病或条件,或相同的药物或生物药物用于不同的疾病或条件。指定孤儿药物的其他好处包括某些研究的税收抵免,以及免除NDA或BLA申请使用费。
指定的孤儿药物如果被批准用于比其获得孤儿指定的适应症更广泛的用途,则不得获得孤儿药物排他性。此外,在美国的独家营销权
38
如果FDA后来确定指定请求存在重大缺陷,或者如果制造商无法保证足够数量的产品来满足患有这种罕见疾病或疾病的患者的需求,则可能会失去国家。
加快开发和审查计划
FDA为合格的候选产品提供了一系列快速开发和审查计划。例如,Fast Track计划旨在加快或促进审查符合特定标准的新产品的过程。具体地说,如果候选产品旨在治疗严重或危及生命的疾病或状况,并显示出满足该疾病或状况未得到满足的医疗需求的潜力,则有资格获得快速通道认证。快速通道指定适用于候选产品和正在研究的特定适应症的组合。Fast Track候选产品的赞助商在产品开发期间有机会与审查团队进行更频繁的互动,一旦提交了保密协议或BLA,该产品可能有资格接受优先审查。快速通道候选产品也可能有资格进行滚动审查,在此情况下,FDA可以在提交完整申请之前滚动考虑NDA或BLA的审查部分,如果赞助商提供了提交NDA或BLA部分的时间表,FDA同意接受NDA或BLA的部分,并确定该时间表是可接受的,并且赞助商在提交NDA或BLA的第一部分时支付任何必要的用户费用。
打算治疗严重或危及生命的疾病或状况的候选产品也可能有资格获得突破性疗法指定,以加快其开发和审查。如果初步临床证据表明,一种产品单独或与一种或多种其他药物或生物制品联合使用,可能在一个或多个临床重要终点显示出比现有疗法有实质性改善,例如在临床开发早期观察到的实质性治疗效果,则该产品可以获得突破性的治疗指定。该指定包括Fast Track计划的所有功能,以及早在第一阶段就开始的更密集的FDA互动和指导,以及加快候选产品开发和审查的组织承诺,包括高级管理人员的参与。
任何提交FDA审批的药物或生物营销申请,包括具有快速通道指定和/或突破性治疗指定的候选产品,都可能符合FDA旨在加快FDA审查和批准过程的其他类型计划的资格,例如优先审查和加速批准。如果候选产品有可能在治疗、诊断或预防严重疾病或状况方面提供显著改进,则有资格优先审查该产品。对于新的分子实体NDA和原始的BLAS,优先审查指定意味着FDA的目标是在60天提交日期后的6个月内对上市申请采取行动(而标准审查下是10个月)。
此外,对于在治疗严重或危及生命的疾病或病症方面的安全性和有效性进行研究的候选产品,在确定候选产品对可合理预测临床益处的替代终点、或可比不可逆发病率或死亡率更早测量、可合理预测不可逆发病率或死亡率或其他临床益处的临床终点有效时,可加速批准,同时考虑到病情的严重性、稀有性或流行率以及可用或缺乏替代治疗。作为加速批准的条件,FDA通常会要求赞助商进行充分和良好控制的上市后临床研究,以验证和描述对不可逆转的发病率或死亡率或其他临床益处的预期影响。此外,FDA目前要求作为加速批准的条件预先批准宣传材料,这可能会对产品商业推出的时间产生不利影响。
2017年,FDA建立了一种新的再生医学高级疗法,或RMAT,作为其实施21世纪治疗法案的一部分。RMAT指定计划旨在满足21世纪治疗法的要求,即FDA促进任何符合以下标准的药物或生物的有效开发计划并加快审查:(I)药物或生物符合rmat的资格,其定义为细胞疗法、治疗性组织工程产品、人类细胞和组织产品或使用此类疗法或产品的任何组合产品,但有限的例外情况;(Ii)该药物或生物旨在治疗、修改、逆转或治愈严重或危及生命的疾病或状况;以及(Iii)初步临床
39
有证据表明,这种药物或生物制剂有可能解决此类疾病或状况未得到满足的医疗需求。RMAT指定提供了突破性治疗指定的所有好处,包括更频繁地与FDA举行会议,讨论候选产品的开发计划以及滚动审查和优先审查的资格。被授予RMAT资格的候选产品也可能有资格根据合理可能预测长期临床益处的替代物或中间终点,或依赖从大量临床试验地点获得的数据,包括通过将试验扩展到更多地点而获得加速批准。
快速通道指定、突破性治疗指定、优先审查、加速批准和RMAT指定不会改变批准的标准,但可能会加快开发或批准过程。即使一种产品符合这些计划中的一个或多个,FDA也可以在以后决定该产品不再符合资格条件,或者决定FDA审查或批准的时间段不会缩短。我们可能会适当地为我们的候选产品探索其中的一些机会。
审批后要求
生物制品受到FDA的普遍和持续的监管,其中包括与记录保存、不良反应报告、定期报告、产品抽样和分销以及产品的广告和促销有关的要求。在批准后,对批准的产品的大多数更改,如增加新的适应症或其他标签声明,都要经过FDA的事先审查和批准。对于任何上市的产品,也有持续的年度计划费用。生物制造商及其分包商被要求向FDA和某些州机构注册他们的工厂,并接受FDA和某些州机构的定期突击检查,以确保cGMP的合规性,这些机构对cGMP施加了某些程序和文件要求。对制造工艺的更改受到严格的监管,根据更改的重要性,可能需要FDA事先批准才能实施。FDA的规定还要求对任何偏离cGMP的情况进行调查和纠正,并提出报告要求。因此,制造商必须继续在生产和质量控制领域花费时间、金钱和精力,以保持遵守cGMP和其他方面的法规遵从性。
如果没有遵守监管要求和标准,或者如果产品上市后出现问题,FDA可能会撤回批准。后来发现产品存在以前未知的问题,包括预料不到的严重程度或频率的不良事件,或生产工艺,或未能遵守法规要求,可能会导致修订批准的标签以添加新的安全信息;实施上市后研究或临床研究以评估新的安全风险;或根据REMS计划实施分销限制或其他限制。除其他外,其他潜在后果包括:
FDA严格监管生物制品的营销、标签、广告和促销。一家公司只能根据FDA批准的标签的规定,提出与安全性和有效性、纯度和效力有关的声明。FDA和其他机构积极执行禁止推广非标签用途的法律法规。不遵守这些要求可能会导致
40
其中包括不良宣传、警告信、纠正性广告以及可能的民事和刑事处罚。医生可能会为合法获得的产品开具处方,用于产品标签中未描述的用途,以及与我们测试和FDA批准的用途不同的用途。这种标签外的使用在医学专科中很常见。医生可能会认为,在不同的情况下,这种非标签使用是许多患者的最佳治疗方法。FDA不规范医生在选择治疗时的行为。然而,FDA确实限制了制造商在产品标签外使用问题上的沟通。
生物仿制药与排他性
2009年《生物制品价格竞争与创新法》(BPCIA)为高度相似、或与FDA批准的参考生物制品互换的生物制品开辟了一条简短的审批途径。FDA已经发布了几份指导文件,概述了审查和批准生物仿制药的方法。生物相似性是指生物制品和参比制品在安全性、纯度和效力方面不存在临床上有意义的差异,通常通过分析研究、动物研究和临床研究来显示。互换性要求产品与参考产品生物相似,并且该产品必须证明在任何给定的患者中,它可以预期产生与参考产品相同的临床结果,对于多次给药的产品,在先前给药后,生物和参考生物可以交替或交换,而不会增加安全风险或相对于独家使用参考生物而降低疗效的风险。被证明与FDA批准的参考生物制品生物相似或可互换的产品可能部分依赖于FDA先前对待批准的参考产品的安全性和有效性的确定,这可能会减少获得批准将该产品推向市场所需的成本和时间。
根据BPCIA,生物相似产品的申请必须在参考产品首次获得FDA许可的四年后才能提交给FDA。此外,FDA对生物相似产品的批准可能要到参考产品首次获得许可之日起12年后才能生效。在这12年的独占期内,如果FDA批准竞争产品的完整BLA,包含申请人自己的临床前数据和来自充分和良好控制的临床试验的数据,以证明其产品的安全性、纯度和有效性,另一家公司仍可能销售该参考产品的竞争版本。BPCIA还为被批准为可互换产品的生物仿制药设立了某些排他性期限。在这个节骨眼上,还不清楚FDA认为“可互换”的产品是否真的会被受州药剂法管辖的药房所取代。
生物制品也可以在美国获得儿科市场的排他性。如果授予儿科专有权,将把现有的专有期和专利条款增加六个月。这一为期六个月的排他性从其他排他性保护或专利期结束时开始,可以根据FDA发布的此类研究的“书面请求”自愿完成儿科研究来授予。
美国以外的政府监管
我们的候选产品将受到美国以外的司法管辖区,特别是欧盟或欧盟实施的类似法律和法规的约束,其中可能包括,例如,临床试验、营销授权、上市后要求(包括安全监控、反欺诈和滥用法律)、企业合规计划的实施以及向医疗保健专业人员报告付款或其他价值转移。由于生物来源的原材料面临独特的污染风险,它们的使用在一些国家可能会受到限制。此外,对基因编辑技术、基因治疗、基因测试和基因研究的伦理、社会和法律方面的担忧可能会导致额外的法规限制或禁止我们可能使用的过程。
无论我们是否获得FDA对候选产品的批准,我们必须在候选产品在国外开始临床试验或上市之前获得相关监管机构的必要批准。管理临床试验、产品许可、定价和报销的要求和流程因国家而异。不遵守适用的外国监管要求,可能会受到罚款、暂停或撤销监管批准、产品召回、扣押产品、运营限制和刑事起诉等处罚。
41
非临床研究和临床试验
与美国类似,欧盟的非临床和临床研究的各个阶段都受到严格的监管控制。
进行非临床研究是为了证明新的化学或生物物质的健康或环境安全性。非临床(药物-毒理)研究必须遵守欧盟指令2004/10/EC中规定的良好实验室做法或GLP的原则(除非对某些特定医药产品--例如用于放射性标签目的的放射性药物前体--另有正当理由)。特别是,非临床研究,两者体外培养和体内必须按照GLP原则进行规划、执行、监测、记录、报告和存档,GLP原则为组织过程的质量体系和非临床研究的条件规定了一套规则和标准。这些普洛斯标准反映了经济合作与发展组织的要求。
在欧盟,医疗产品的临床试验必须符合欧盟和国家法规、国际协调会议(ICH)、良好临床实践指南(GCP)以及源于《赫尔辛基宣言》的适用法规要求和伦理原则。来自欧盟委员会的额外GCP指南,特别注重可追溯性,适用于高级治疗药物产品(ATMP)的临床试验。如果临床试验的发起人没有在欧盟内成立,它必须指定一个欧盟实体作为其法定代表人。发起人必须购买临床试验保险单,在大多数欧盟国家,发起人有责任向在临床试验中受伤的任何研究对象提供“无过错”赔偿。
欧盟与临床试验相关的监管格局最近发生了变化。欧盟临床试验条例,或称CTR,于2014年4月通过,废除了欧盟临床试验指令,于2022年1月31日生效。与指令不同,CTR直接适用于所有欧盟成员国,而不需要成员国进一步将其实施为国家法律。CTR通过临床试验信息系统显著协调了整个欧盟临床试验的评估和监督过程,该系统包含一个集中的欧盟门户和数据库。
虽然临床试验指令要求在进行临床试验的每个成员国提交单独的临床试验申请,或CTA,给主管国家卫生当局和独立的伦理委员会,很像FDA和IRB,但CTR引入了一个集中的流程,只要求提交一份多中心试验申请。CTR允许申办者向每个成员国的主管当局和伦理委员会提交一份提交文件,从而每个成员国做出一份决定。CTA必须包括(除其他外)试验方案和试验用药品申报资料的副本,其中包含有关试验用药品的生产和质量的信息。同时,协调委员会的评估程序也得到了统一,包括所有相关成员国的联合评估,以及每个成员国对与其本国领土有关的具体要求,包括道德规则的单独评估。每个成员国的决定通过集中的欧盟门户网站传达给申办者。一旦CTA获得批准,临床研究开发可以继续进行。
CTR预计将有三年的过渡期。正在进行的临床试验和新的临床试验将在多大程度上受到CTR的控制,这一点各不相同。(I)在2022年1月31日之前根据《临床试验指令》提交申请的临床试验,或(Ii)在2022年1月31日至2023年1月31日之间且赞助商选择适用《临床试验指令》的临床试验,在2025年1月31日之前仍受该指令管辖。在这一日期之后,所有临床试验(包括正在进行的临床试验)都将受到CTR条款的约束。
临床试验中使用的药物必须按照良好的制造规范或GMP进行生产。其他国家和欧盟范围的监管要求也可能适用。
营销授权
为了将我们未来的候选产品推向欧盟和许多其他外国司法管辖区,我们必须获得单独的监管批准。更具体地说,在欧盟,医药产品候选只能
42
在获得营销授权或MA后商业化。根据欧盟监管制度,要获得对研究用化学或生物产品的监管批准,我们必须提交营销授权申请,即MAA。这样做的过程,除其他外,取决于医药产品的性质。有两种类型的MA:
根据上述程序,EMA或欧盟成员国主管当局根据有关产品质量、安全性和有效性的科学标准,对产品的风险-效益平衡进行评估。
根据中央程序,环境评估评估的最长时限为210天,不包括时钟停顿。在特殊情况下,CHMP可能会在不超过150天(不包括时钟停顿)内对MAA进行加速审查。针对未得到满足的医疗需求并有望对公众健康产生重大影响的创新产品可能有资格获得一系列快速开发和审查计划,例如Prime计划,该计划提供的激励措施类似于美国的突破性治疗指定。2016年3月,EMA启动了一项倡议,即优先药物计划,或Prime计划,这是一项自愿计划,旨在加强EMA对针对未满足的医疗需求的药物开发的支持。它的基础是增加与开发有希望的药物的公司的互动和早期对话,以优化他们的产品开发计划,并加快他们的评估,以帮助他们更早地接触到患者。受益于Prime指定的产品开发人员有望有资格获得加速评估,但这不是保证。具有Prime称号的候选产品的赞助商将获得许多好处,包括但不限于,及早与EMA进行积极主动的监管对话,频繁讨论临床试验设计和其他开发计划要素,以及在提交档案后加快MAA评估。重要的是,CHMP的专职联系人和报告员在总理的早期就被任命了
43
促进EMA委员会层面对产品的理解的计划。最初的会议启动了这些关系,并包括EMA的一个多学科专家团队,以提供关于总体发展和监管战略的指导。
此外,在欧盟,在尚未获得所有必要的安全性和有效性数据的情况下,可能会授予“有条件”MA。有条件MA需满足生成缺失数据或确保增加安全措施的条件。有效期为一年,并须每年续期,直至符合所有条件为止。一旦提供了待审研究报告,它就可以成为“标准”MA。然而,如果条件没有在EMA设定的时间范围内得到满足,MA将停止更新。此外,在“特殊情况下”,如申请人能证明,即使产品已获批准并须经引入的特定程序后,仍无法提供有关产品在正常使用情况下的功效及安全性的全面数据,亦可能获发许可证。特别是当预期适应症非常罕见时,并且在目前的科学知识水平下,不可能提供全面的信息,或者当生成的数据可能违反普遍接受的伦理原则时,可能会出现这种情况。该MA接近于有条件MA,因为它仅适用于将被批准用于严重疾病或未满足的医疗需求的药品,并且申请人未持有授予MA所需的完整数据集。然而,与有条件的MA不同,申请人不必提供缺失的数据,也永远不必提供。虽然MA“在特殊情况下”是明确授予的,但每年对药品的风险-获益平衡进行审查,如果风险-获益比不再有利,则撤销MA。
根据上述程序,为了授予MA,欧洲市场管理局或欧盟成员国主管当局根据有关产品质量、安全性和有效性的科学标准,对产品的风险效益平衡进行评估。MA的初始期限为五年。在这五年后,授权可在重新评估风险-收益平衡的基础上无限期续期。
数据和营销排他性。
在欧盟,被授权营销的新产品候选产品或参考产品候选产品通常在MA时获得八年的数据独占权和额外两年的市场独占权。如果获得批准,数据专有期将防止仿制药或生物相似药的申请人在欧盟申请仿制药或生物相似药时,在自参考产品首次在欧盟获得授权之日起的八年内,依赖参考产品档案中包含的临床前和临床试验数据。市场排他期禁止成功的仿制药或生物相似申请者将其产品在欧盟商业化,直到参考产品在欧盟获得最初授权的10年后。如果在10年的头8年中,MA持有者获得了对一个或多个新的治疗适应症的授权,那么整个10年的市场专营期可能延长到最多11年,这些新的治疗适应症在授权之前的科学评估期间被认为与现有的疗法相比可以带来显著的临床益处。然而,不能保证产品会被欧盟监管机构视为新的化学/生物实体,产品可能没有资格获得数据排他性。
对于生物仿制药,即与参考医药产品相似但不符合仿制药定义的生物医药产品,有一个特殊的制度,例如,由于原材料或制造工艺的差异。对于这类产品,必须提供适当的临床前或临床试验的结果,EMA的指南详细说明了为不同类型的生物制品提供的补充数据的类型。对于复杂的生物制品,如基因或细胞疗法药物产品,没有这样的指导方针,因此这些产品的生物仿制药目前不太可能在欧盟获得批准。然而,EMA的指导意见指出,未来将根据当时获得的科学知识和监管经验来考虑这些建议。
儿科发展
在欧盟,未经授权的新药品候选的MAA必须包括在儿科人群中进行的研究结果,这符合与EMA的儿科委员会或PDCO商定的儿科调查计划或PIP。PIP规定了生成数据以支持正在寻求上市授权的药物的儿科适应症的时间和建议的措施。PDCO可以批准推迟实施PIP的部分或全部措施的义务,直到有足够的数据来
44
证明该产品在成人中的有效性和安全性。此外,当不需要或不适合提供儿科临床试验数据时,PDCO可以免除提供这些数据的义务,因为该产品可能对儿童无效或不安全,该产品预期用于治疗的疾病或状况仅发生在成人人群中,或者当该产品对儿科患者的现有治疗没有显著的治疗益处时。一旦在所有欧盟成员国获得MA,并将研究结果包括在产品信息中,即使在否定的情况下,该产品也有资格获得为期六个月的补充保护证书延期,或者,对于孤儿药品,批准将孤儿市场独占权延长两年。
孤儿医药产品
欧盟对“孤儿药品”的认定标准原则上与美国相似。在欧盟,如果赞助商能够证明:(1)该产品旨在诊断、预防或治疗危及生命或慢性衰弱的疾病;(2)或者(A)在提出申请时,这种疾病在欧盟的影响不超过10,000人中的5人,或者(B)如果没有孤儿身份带来的好处,该产品将不会在欧盟产生足够的回报,从而证明投资是合理的,则该产品可被指定为孤儿。以及(3)欧盟授权没有令人满意的诊断、预防或治疗这种疾病的方法,或者,如果有这种方法,该产品将对受该疾病影响的人有重大好处。
在欧盟,被指定为孤儿产品的申请必须在MAA之前提交。孤儿药物指定使一方当事人有权获得财政奖励,如减少费用或免除费用,并有权使用集中程序。在批准MA后,孤儿医疗产品有权获得批准的治疗适应症的十年市场专营期,这意味着在此期间,监管当局不能接受同一适应症的类似医疗产品的另一MAA,或批准MA或接受延长MA的申请。对于也符合商定的PIP的孤儿药品,市场专营期延长两年。任何补充保护证书不得根据有关孤儿症状的儿科研究予以延期。孤儿药物的指定不会在监管审查和批准过程中传递任何优势,也不会缩短监管审查和批准过程的持续时间。
但是,如果在第五年结束时确定该产品不再符合其获得孤儿药物目的地的标准,包括该疾病的流行率已超过门槛,或被判定该产品的利润足够高,不足以证明维持市场排他性是合理的,则可将十年市场排他性缩短至六年。在下列情况下,可随时批准另一种类似的孤儿医药产品:(I)第二申请人可以证明其产品虽然与授权产品相似,但更安全、更有效或在临床上更好,(Ii)申请人不能供应足够数量的孤儿医药产品,或(Iii)申请人同意第二次孤儿医药产品申请。一家公司可以自愿将一种产品从孤儿登记册中删除。
上述欧盟规则普遍适用于欧洲经济区,即EEA,由27个欧盟成员国加上挪威、列支敦士登和冰岛组成。
我们或我们的任何第三方合作伙伴,包括供应商、制造商和分销商,在授予MA之前和之后,未能遵守适用于进行临床试验、生产批准、医药产品的MA和此类产品的营销的欧盟和成员国法律,或未能遵守MA、医药产品的制造、法定医疗保险、贿赂和反腐败或其他适用的法规要求,可能会导致行政、民事或刑事处罚。这些处罚可能包括延迟或拒绝授权进行临床试验或批准MA、产品撤回和召回、产品扣押、暂停、撤回或更改营销授权、完全或部分暂停生产、分销、制造或临床试验、经营限制、禁令、吊销执照、罚款和刑事处罚。
英国脱欧与英国的监管框架
英国于2020年1月31日离开欧盟,之后根据欧盟-英国退出协议的条款,在过渡期内,现有的欧盟医药产品立法继续适用于英国。贸易与合作协议(TCA)是英国和欧盟达成的,
45
并于2021年1月1日起生效。TCA包括有关药品的具体条款,其中包括对药品生产设施的GMP检查和发布的GMP文件的相互承认,但并未预见英国和欧盟的药品法规将大规模相互承认。
通过二次立法转变为英国法律的欧盟法律继续作为“保留的欧盟法律”适用。然而,欧盟CTR等新立法将不适用。英国政府通过了一项新的《2021年药品和医疗器械法》,该法案将授权给国务大臣或一个适当的机构,以修订或补充医疗产品和医疗器械领域的现有法规。这使得今后可以通过二次立法的方式引入新的规则,目的是在解决人类药物、临床试验和医疗器械领域的监管差距和未来变化方面允许灵活性。
自2021年1月1日起,药品和医疗保健产品监管机构(MHRA)是英国独立的药品和医疗器械监管机构。作为北爱尔兰议定书的结果,北爱尔兰将适用不同于英格兰、威尔士和苏格兰的规则,包括大不列颠或GB;总的来说,北爱尔兰继续遵循欧盟的监管制度,但其国家主管机构仍将是MHRA。2023年2月27日,英国政府和欧盟委员会宣布了一项原则性的政治协议,以一套新的安排取代北爱尔兰议定书,即被称为《温莎框架》的安排。这一新框架从根本上改变了《北爱尔兰议定书》下的现有制度,包括英国对医药产品的监管。特别是,MHRA将负责批准所有运往英国市场(即英国和北爱尔兰)的医药产品,而EMA将不再在批准运往北爱尔兰的医药产品方面发挥任何作用。MHRA将为在英国销售的所有医药产品授予单一的英国范围的MA,使产品能够在英国各地以单一包装和单一授权销售。2023年3月24日,欧盟-英国联合委员会批准了温莎框架,因此英国政府和欧盟将制定立法措施,使其成为法律。2023年6月9日,MHRA宣布,温莎框架的药品方面将从2025年1月1日起适用。
MHRA已经对国家许可程序进行了改变,包括优先获得将使患者受益的新药的程序,包括150天评估和滚动审查程序。所有针对中央授权产品的现有欧盟MA将于2021年1月1日自动转换或取消为英国MA,仅在GB有效,免费,除非MA持有人选择退出。为了使用集中程序获得在整个欧洲经济区有效的并购,必须在欧洲经济区设立公司。因此,自英国退欧以来,在英国成立的公司不能再使用欧盟集中化程序,而是欧洲经济区实体必须持有任何集中式MA。在2024年1月1日之前,MHRA可能依赖于欧盟委员会关于批准新的(集中程序中的MA)的决定,以便更快地批准新的GB MA。新的国际认可框架将于2024年1月1日起实施,根据该框架,MHRA在决定新的GB MA的申请时,将考虑EMA和某些其他监管机构对MA的批准决定。
在英国,没有MA前的孤儿称号。相反,MHRA在审查相应的MA申请的同时审查孤儿指定申请。这些标准基本上是相同的,但都是为市场量身定做的,即英国而不是欧盟的这种疾病的流行率不能超过万分之五。如果被授予孤儿称号,期限或市场独占权将从该产品首次获得批准之日起以GB为单位设定。
其他医保法
制药公司受到联邦政府以及它们开展业务的州和外国司法管辖区当局的额外医疗监管和执法,并可能限制我们研究以及销售、营销和分销我们获得营销批准的任何产品的财务安排和关系。此类法律包括但不限于联邦和州反回扣、欺诈和滥用、虚假声明以及与药品定价和支付以及向医生和其他医疗保健提供者进行的其他价值转移有关的透明度法律和法规。违反任何此类法律或任何其他适用的政府条例可能导致重大处罚,包括但不限于行政、民事和刑事处罚、损害赔偿、罚款、返还、削减或
46
重组业务、诚信监督和报告义务,以解决不遵守规定、被排除在联邦和州医疗保健计划之外以及监禁的指控。
承保和报销
任何产品的销售在一定程度上取决于第三方付款人对该产品的承保范围,如联邦、州和外国政府医疗保健计划、商业保险和托管医疗组织,以及第三方付款人对该产品的报销水平。关于应提供的补偿范围和数额的决定是在逐个计划基础上作出的。这些第三方付款人正在越来越多地减少医疗产品、药品和服务的承保和报销。对于在医生监督下管理的产品,获得保险和适当的补偿可能特别困难,因为此类药物往往与较高的价格相关。此外,产品本身或使用该产品的治疗或程序可能无法单独报销,这可能会影响医生的使用。
美国政府、州立法机构和外国政府也继续实施成本控制计划,包括价格控制、对覆盖范围和报销的限制以及对仿制药替代的要求。采取价格控制和成本控制措施,以及在现有控制和措施的司法管辖区采取更具限制性的政策,可能会进一步限制任何产品的销售。减少任何产品的第三方报销或第三方付款人决定不承保产品可能会减少医生的使用量和患者对产品的需求,并对销售产生实质性的不利影响。
医疗改革
在美国,2010年3月颁布了《患者保护和平价医疗法案》,该法案经《医疗保健和教育和解法案》修订,统称为ACA,极大地改变了政府和私营保险公司为医疗保健提供资金的方式,并对制药业产生了重大影响。ACA包含了一些条款,包括那些管理联邦医疗保健计划的注册、补偿调整以及对欺诈和滥用法律的修改。例如,ACA:
自颁布以来,ACA的某些方面一直受到司法、行政和国会的挑战。2021年6月17日,美国最高法院驳回了几个州对ACA提出的最新司法挑战,但没有具体裁决ACA的合宪性。在最高法院做出裁决之前,总裁·拜登发布了一项行政命令,启动了2021年2月15日至2021年8月15日的特殊投保期,目的是通过ACA市场获得医疗保险。行政命令还指示某些政府机构审查和重新考虑限制获得医疗保健的现有政策和规则,包括重新审查包括工作要求的医疗补助示范项目和豁免计划,以及通过医疗补助或ACA获得医疗保险覆盖范围造成不必要障碍的政策。
自ACA颁布以来,还提出并通过了其他立法变化,包括每财年向提供商支付的医疗保险总额减少2%,由于新冠肺炎疫情,这一规定在2020年5月1日至2022年3月31日期间暂停。
47
此外,政府最近对制造商为其销售的产品设定价格的方式进行了更严格的审查,导致国会进行了几次调查,提出并颁布了旨在提高产品定价透明度的立法,审查定价与制造商患者计划之间的关系,以及改革政府计划对药品的补偿方法。政府也有可能采取更多行动来应对新冠肺炎疫情。美国个别州也越来越积极地实施旨在控制药品定价的法规,包括价格或患者报销限制、折扣、对某些产品准入和营销成本披露的限制以及透明度措施,在某些情况下,旨在鼓励从其他国家进口和批量购买。
我们预计未来将采取额外的州和联邦医疗改革措施,其中任何一项措施都可能影响联邦和州政府以及其他第三方支付者将支付的医疗产品和服务的金额。
数据隐私和安全
许多州、联邦和外国法律规范个人信息的收集、传播、使用、获取、保密和安全,包括与健康有关的信息。随着我们的业务和业务的增长,我们可能会受到美国联邦和州法律法规的制约或影响,这些法律法规管理与健康相关的个人信息和其他个人信息的收集、使用、披露和保护。此外,某些非美国法律管理个人数据的隐私和安全,包括与健康相关的数据,其中许多法律在很大程度上彼此不同,可能不会产生相同的效果,从而使合规工作复杂化。在适用的情况下,如果不遵守这些法律,可能会造成重大的民事和/或刑事处罚以及私人诉讼。隐私和安全法律、法规和其他义务不断演变,可能相互冲突,使合规工作复杂化,并可能导致调查、诉讼或行动,导致重大民事和/或刑事处罚以及对数据处理的限制。
员工
截至2023年12月31日,我们有93名全职员工和1名兼职员工。
企业信息
我们于2016年7月根据特拉华州法律注册成立,名称为VL42,Inc.
第1A项。RISK因子。
在评估我们的公司时,您应仔细考虑以下描述的风险和不确定性,以及本10-K年度报告中包含的所有其他信息,包括本公司的合并财务报表和本10-K年度报告末尾的相关附注。如果发生以下任何事件或事态发展,我们的业务、前景、经营业绩和财务状况可能会受到重大影响,我们普通股的交易价格可能会下降。下面描述的风险和不确定性并不是我们面临的唯一风险和不确定性。我们目前不知道或我们目前认为无关紧要的其他风险和不确定性也可能对我们的业务产生不利影响。
与我们的财务状况和资本要求有关的风险
我们的经营历史有限,且并无成功开发或商业化任何经批准的候选产品的历史,这可能使我们难以评估迄今为止业务的成功程度及评估未来可行性的前景。
我们是一家临床阶段的生物制药公司。到目前为止,我们的业务仅限于为公司提供资金和人员配备,开发我们的技术,以及确定和开发我们的候选产品。我们的前景必须考虑到生物制药公司在运营初期经常遇到的不确定性、风险、费用和困难。我们还没有证明有能力
48
进行或完成任何临床试验,获得市场批准,生产商业规模的产品,或进行成功的产品商业化所必需的销售和营销活动。因此,如果我们有更长的运营历史或成功开发、获得市场批准并将候选产品商业化的历史,对我们未来成功或生存能力的预测可能不会像应有的那样准确。此外,我们还可能遇到意想不到的费用、困难、并发症、延误等障碍。
随着我们继续发展业务,我们预计,由于各种因素,我们的财务状况和经营业绩将在每个季度和每年大幅波动,其中许多因素是我们无法控制的。因此,您不应依赖任何特定季度或年度的结果作为未来经营业绩的指标。
我们自成立以来已产生重大亏损,并预期于可见将来将产生重大额外亏损。
自成立以来,我们发生了重大的净亏损,包括截至2023年12月31日和2022年12月31日的年度净亏损分别为9740万美元和1.027亿美元。截至2023年12月31日,我们的累计赤字为3.346亿美元。此外,我们没有将任何产品商业化,也从未从产品销售中获得任何收入。我们几乎所有的财政资源都投入到研究和开发中,包括我们的临床前开发活动,以及准备和进行我们的候选产品的临床试验。
我们预计,在可预见的未来,随着我们寻求通过临床开发推进候选产品、继续临床前开发、扩大我们的研究和开发活动、开发新的候选产品、完成临床前研究和临床试验、寻求监管批准,并在获得监管批准的情况下将我们的产品商业化,我们预计将继续产生重大的额外净亏损。为了获得FDA批准在美国销售任何候选产品,我们必须向FDA提交生物制品许可证申请,或BLA,证明FDA满意地证明该候选产品对于其预期用途是安全有效的(S)。外国监管机构也实施了类似的要求。这一论证需要大量的研究和来自动物试验的广泛数据,这些试验被称为非临床或临床前研究,以及人体试验,被称为临床试验。此外,随着时间的推移,将候选产品推进到后续临床阶段的成本往往会大幅增加。即使在一个司法管辖区,将我们的任何候选产品推向市场批准的总成本也将是巨大的,而且很难准确预测。由于与药品开发相关的众多风险和不确定性,我们无法准确预测增加费用的时间或金额,或者我们何时或是否能够开始从产品商业化中产生收入,或实现或保持盈利。我们的支出也将大幅增加,如果或当我们:
49
未来亏损的数额以及我们何时(如果有的话)将实现盈利是不确定的。我们没有商业阶段的产品,在我们成功开发出一个或多个候选产品之前,不会从产品的商业销售中产生收入,并且可能永远不会从产品销售中产生收入。我们预期在可预见的将来将继续产生经营亏损和负现金流。该等经营亏损及负现金流量已并将继续对我们的股东权益及营运资金产生不利影响。
我们需要大量额外资金,但这些资金可能无法以可接受的条件提供,或根本无法提供。如果我们未能在需要时获得这些必要的资本,可能会迫使我们推迟、限制、减少或终止产品开发。
我们的业务自成立以来已产生大量开支。我们预计将继续产生大量费用,以继续进行临床前开发,启动和进行我们候选产品的临床开发,并继续确定新的候选产品。
除首次公开募股及2023年2月注册直接发售所得款项外,我们继续需要额外资金,以资助我们计划中的临床前开发及临床试验,并开发新的候选产品,我们可能会通过股权发售、债务融资、营销及分销安排及其他合作、战略联盟及许可安排或其他来源筹集资金。如果有的话,其他资金来源可能无法以优惠的条件获得。如果我们未能以可接受的条件成功筹集额外资金,我们可能无法启动或完成临床试验,或寻求FDA或任何外国监管机构的监管批准,我们的任何候选产品可能会被迫停止产品开发。此外,试图获得额外资金可能会分散我们管理层日常活动的时间和注意力,损害我们的发展努力。
截至2023年12月31日,我们现有的现金、现金等价物和有价证券将不足以为我们计划进行的所有努力提供资金。根据我们目前的运营计划,我们相信,截至2023年12月31日,我们的现金、现金等价物和有价证券将足以满足我们到2025年第一季度的运营费用和资本支出要求。这一估计是基于可能被证明是不正确的假设,我们可以比目前预期的更快地使用我们可用的资本资源。此外,如下所述,我们已经确定了关于我们作为一家持续经营的企业继续存在的能力的条件和事件。我们将需要大量的额外资金,以推出我们目前和任何未来的候选产品并将其商业化。此外,在我们的开发努力过程中可能会出现其他意想不到的成本。由于我们的大多数候选产品处于临床前开发阶段,而我们尚未进行任何临床试验,因此我们无法合理估计成功完成我们候选产品的开发和商业化所需的实际数量。此外,我们在主要金融机构的账户中保留了大部分现金和现金等价物,我们在这些机构的存款超过了保险限额。市场状况可能会影响这些机构的生存能力。如果我们维持现金和现金等价物的任何金融机构倒闭,不能保证我们能够及时或根本不能获得未投保的资金。任何无法获得或延迟获得这些资金的情况都可能对我们的业务和财务状况造成不利影响。
我们未来的资本需求取决于许多因素,包括:
50
我们不能肯定是否会以可接受的条件提供额外的资金,或根本无法确定。如果我们无法以我们可以接受的条款或及时筹集足够的额外资金,我们可能不得不大幅推迟、缩减或停止我们候选产品的开发或商业化或其他研发计划。
如果我们不能及时获得资金,我们可能会被要求大幅削减、推迟或停止我们的一个或多个研发计划或任何候选产品的商业化,或者无法根据需要扩大我们的业务或以其他方式利用我们的商机,这可能会对我们的业务、财务状况和运营结果产生重大影响。上述任何事件都可能严重损害我们的业务、前景、财务状况和经营结果,并导致我们的普通股价格下跌。
我们的经常性经营亏损令人对我们持续经营的能力产生重大疑问。
自成立以来,我们遭受了重大损失,从未从产品销售中获得收入或利润,也可能永远不会从产品销售中获得收入或利润。截至2023年12月31日,我们拥有7340万美元的现金和现金等价物以及有价证券。根据我们目前的运营计划,我们相信我们将有足够的资金履行到2025年第一季度的义务。然而,我们将需要筹集额外的资本来支持我们未来的运营,并继续作为一家持续经营的企业。不能保证我们将能够获得额外的资金,包括通过股票发行、债务融资、营销和分销安排以及其他合作、战略联盟和许可安排的组合,或以可接受的条件获得其他来源(如果有的话)。在我们通过未来的股权发行筹集额外资本的程度上,普通股股东的所有权权益将被稀释,这可能是严重的稀释。我们不能保证我们将能够获得任何或足够的额外资金,或者如果有的话,这些资金将以我们满意的条件获得。如果我们无法获得任何或足够的额外资金,不能保证我们将能够继续经营下去,我们将被迫推迟、减少或停止我们的产品开发计划,或考虑其他各种战略选择.
此外,这些因素使人对我们作为一家持续经营的企业继续下去的能力产生了极大的怀疑。对我们持续经营能力的极大怀疑可能会对价格产生实质性的不利影响
51
每股普通股,我们可能更难获得融资。如果现有或潜在的合作者出于这种担忧而拒绝与我们做生意,或者潜在投资者拒绝参与未来的任何融资,我们增加现金头寸的能力可能会受到限制。认为我们可能无法继续经营下去的看法可能会导致其他人因为担心我们履行合同义务的能力而选择不与我们打交道。
我们以持续经营为基础编制综合财务报表,考虑正常业务过程中的资产变现以及负债和承诺的清偿情况。我们的年度报告Form 10-K中包含的综合财务报表不包括任何调整,以反映公司可能无法在该等财务报表发布后一年内继续经营下去。如果我们无法继续经营下去,您可能会损失您在我们公司的全部或部分投资。
筹集额外资本可能会对我们的股东造成额外的稀释,限制我们的运营,要求我们放弃对我们的技术或候选产品的权利,并可能导致我们的股价下跌。
在此之前(如有的话),由于我们能够从产品销售中产生可观收入,我们可能会透过股权发售、债务融资、市场推广及分销安排及其他合作、策略联盟及授权安排或其他来源的组合,为我们的现金需求提供资金。此外,由于有利的市场条件或战略考虑,我们可能寻求额外的资本,即使我们相信我们有足够的资金用于我们目前或未来的经营计划。
在我们通过出售股权或可转换债务证券筹集额外资本的情况下,您的所有权权益将被稀释,这些证券的条款可能包括清算或其他对您作为普通股股东的权利造成不利影响的优惠。债务融资和优先股权融资(如有)可能涉及协议,其中包括限制或限制我们的运营、我们采取具体行动的能力,例如产生额外债务、进行资本支出、宣布股息、赎回我们的股票、进行某些投资以及从事某些合并、合并或资产出售交易等。如果我们通过与第三方的合作、战略联盟或营销、分销或许可协议筹集额外资金,我们可能会被要求放弃对我们的技术、未来收入来源或候选产品的宝贵权利,或以可能对我们不利的条款授予许可。如果我们无法在需要时通过股权或债务融资筹集额外资金,我们可能会被要求延迟、限制、减少或终止我们的产品开发或未来的商业化努力,或授予开发和营销我们原本希望自己开发和营销的候选产品的权利。
我们现有的和未来的任何债务都可能对我们的业务运营能力产生不利影响。
截至2023年12月31日,我们根据与太平洋西部银行(PWB)的经修订贷款及担保协议(贷款协议)有1900万美元的未偿还贷款。贷款协议之到期日为二零二七年九月三十日,可进一步延期至二零二八年九月三十日。该贷款于2023年9月30日开始偿还,每月偿还本金30万美元加利息,如果到期日不延长至2028年9月30日,则于2027年9月30日支付400万美元。贷款协议项下的未偿还结余按浮动年利率计息,该浮动年利率等于(i)当时有效的最优惠利率加0. 50%及(ii)5. 50%,自二零二一年十二月二十日起的首个月起每月到期。我们的未偿还债务(包括我们向PWB借款以外的任何额外债务)连同我们的其他财务责任及合约承诺可能会造成重大不利后果,包括:
52
我们拟以当时现有现金及现金等价物履行现时及未来的偿债责任。然而,吾等可能并无足够资金,亦可能无法安排额外融资以支付贷款协议项下到期款项或任何其他债务工具。未能付款或遵守贷款协议项下之其他契诺或该等其他债务工具可能导致违约事件及加速到期款项。例如,我们的贷款协议项下的肯定契约包括(其中包括)要求我们(以及我们促使我们的子公司)维持我们的合法存在和政府批准,交付某些财务报告和通知,维护适当的记录和账簿,及时归档和支付纳税申报表,维护库存和保险,并在PWB(有例外)和受控制协议约束的账户(有例外)中保留现金。根据贷款协议,发生合理预期会对我们的业务、营运、资产或状况造成重大不利影响的事件,即属违约事件。如果发生违约事件,而PWB加快到期款项,我们可能无法加快付款,贷款人可寻求强制执行担保该等债务的抵押品的担保权益。此外,贷款协议项下的契诺、我们的资产质押作为抵押品以及我们的知识产权的负质押可能会限制我们获得额外债务融资的能力.
我们没有创造任何产品收入,可能永远不会盈利。
我们的盈利能力取决于我们创造产品收入的能力。迄今为止,我们尚未产生任何产品收入,除非或直至我们成功完成临床开发,并获得监管部门批准,然后成功商业化,我们的候选产品。我们的大多数候选产品都处于临床前开发阶段,需要额外的临床前研究和临床开发、监管审查和批准、安全的生产供应、已建立的商业化销售能力、大量投资和充足的资金以及重大的营销努力,才能从产品销售中获得任何收入。我们创造产品收入的能力取决于多个因素,包括:
53
以上列出的许多因素超出了我们的控制范围,可能导致我们经历重大延误,或阻止我们获得监管部门的批准或将候选产品商业化。即使我们能够商业化我们的候选产品,我们可能不会在产品销售后很快实现盈利,如果有的话。如果我们无法通过销售候选产品产生足够收入,我们可能无法在没有持续资金的情况下继续运营。
与我们候选产品的发现、开发、临床前和临床试验以及监管批准相关的风险
我们的候选产品基于一种新技术,这使得很难预测临床前和临床开发以及随后获得监管部门批准的时间和成本。
我们的成功取决于OMEGA平台技术,这是一项新颖的技术。因此,很难准确预测我们的项目和候选产品在产品发现或识别、临床前研究和临床试验过程中可能遇到的临床前和临床开发挑战。此外,由于我们最近才开始对我们的管道候选产品进行临床试验,我们尚未能够评估我们的技术在人体中的安全性或有效性,并且我们开发的任何候选产品的治疗可能会产生我们目前无法预测的短期或长期影响。此外,动物模型可能不存在的一些疾病,我们选择在我们的计划中追求。鉴于我们技术平台的新颖性,无法保证临床前工作的长度、临床开发、FDA或类似的外国监管机构可能要求参加临床试验的患者数量,以确定我们候选产品的安全性和有效性、纯度和效力,或这些临床试验中生成的数据将被FDA或类似的外国监管机构接受,以支持上市批准。FDA和类似的监管机构可能需要比往常更长的时间来决定我们提交的任何生物制品许可申请、BLA或国外上市申请,并可能最终确定我们的候选产品没有足够的数据、信息或经验来支持批准。FDA或类似的外国监管机构也可能要求我们进行额外的上市后研究或实施风险管理计划,例如风险评估和缓解策略,或REMS或类似的风险管理措施,直到获得更多的候选产品经验。这些因素中的每一个都可能增加我们的预期开发成本,并延迟、阻止或限制我们候选产品的商业化范围。验证过程需要时间和资源,可能需要独立的第三方分析,并且可能不被FDA和类似的外国监管机构接受或批准。我们不能确定我们的方法将导致开发出可批准或可销售的产品,单独或与其他疗法结合。
此外,即使我们从计划的临床试验中获得数据,由于我们的项目中应用的OMEGA平台技术是新颖的,并且未经外部验证,我们的数据可能难以复制和/或容易被我们或其他人误解。表观基因组控制器提供了一种新的药物,尚未在临床试验中进行评估或获得监管批准。因此,我们可能需要为临床数据开发新的评估方法或指标,这可能会使数据分析变得更加困难,或者我们开发EC可能比其他治疗方法更耗时或成本更高。由于这些因素,我们很难预测候选产品开发的时间和成本,我们无法预测OMEGA平台技术或任何类似或竞争的表观遗传技术的应用是否会导致任何产品的识别、开发和监管批准。我们无法保证我们在未来遇到的与OMEGA平台技术或我们的任何研究项目相关的任何开发挑战不会导致重大延误或意外成本,也无法保证此类开发问题能够得到解决。这些因素中的任何一个都可能阻止我们完成临床前研究或我们可能发起的任何临床试验,或者阻止我们可能在及时或有利可图的基础上开发的任何候选产品商业化。
此外,FDA和其他监管机构的临床试验要求以及这些监管机构用来确定候选产品安全性和有效性的标准,根据潜在产品的类型、复杂性、新颖性、预期用途和市场而有很大不同。与其他更知名或经过广泛研究的治疗方式和方法相比,像我们这样的新产品候选产品的监管审批过程可能更昂贵,耗时更长。此外,随着我们正在开发新的
54
随着药物治疗的进展,FDA或类似的外国监管机构可能不会考虑临床试验终点以提供临床上有意义的结果的风险增加,由此产生的临床数据和结果可能更难分析。到目前为止,很少有基因治疗产品获得FDA和类似的外国监管机构的批准,这使得很难确定我们的候选产品在美国、欧盟或欧盟或其他司法管辖区获得监管批准需要多长时间或花费多少钱。此外,一个监管机构的批准可能不代表其他监管机构可能需要批准什么。
可编程表观遗传药物的监管要求已经演变,并可能在未来继续变化。例如,FDA在其生物制品评估和研究中心(CBER)内设立了组织和高级治疗办公室,以巩固对基因治疗和相关产品的审查,并设立了细胞、组织和基因治疗咨询委员会,为CBER的审查提供建议。除了FDA的监督和IRB的监督,根据美国国立卫生研究院(NIH)颁布的指导方针,基因治疗临床试验也受到机构生物安全委员会(IBC)的审查和监督,IBC是一个地方机构委员会,负责审查和监督该机构使用重组或合成核酸分子的研究。在任何机构开始临床研究之前,该机构的IRB及其IBC评估研究的安全性,并确定对公众健康或环境的任何潜在风险。虽然NIH指南不是强制性的,除非所述研究是在接受NIH资助的重组或合成核酸分子研究的机构进行或赞助,但许多公司和其他机构不受NIH指南约束,自愿遵循这些指南。此外,严重不良事件或其他人进行的候选基因治疗产品临床试验的进展可能导致FDA或其他监管机构对我们的临床试验启动临床暂停或以其他方式改变我们任何候选产品的批准要求。虽然FDA决定是否可以继续进行单个基因治疗方案,但审查过程和其他审查机构的决定可能会阻碍或推迟临床试验的启动,即使FDA已经审查了试验并批准了其启动。这些和其他监管审查机构、委员会和咨询小组及其颁布的要求和指南可能会延长监管审查过程,要求我们进行额外的临床前研究或临床试验,增加我们的开发成本,导致监管立场和解释的变化,延迟或阻止这些候选治疗的批准和商业化,或导致重大的批准后限制或限制。类似的要求适用于欧盟。欧洲药品管理局(EMA)有一个高级治疗委员会(CAT),负责评估高级治疗药品(ATMP)的质量、安全性和有效性。ATMP包括基因治疗药物、体细胞治疗药物和组织工程药物。CAT的作用是为ATMP候选人的上市许可申请准备一份意见草案,并提交给EMA。在欧盟,ATMP的制定和评估必须在欧盟相关准则的背景下加以考虑。EMA可能会发布有关基因治疗药物产品开发和上市许可的新指南,并要求我们遵守这些新指南。其他司法管辖区也存在类似复杂的监管环境,我们可能会考虑为候选产品寻求监管部门的批准,从而进一步使监管环境复杂化。
适用监管指南的变更可能会延长监管审查过程,要求我们进行额外的研究或试验,增加我们的开发成本,导致监管立场和解释的变化,延迟或阻止我们候选产品的批准和商业化,或导致重大的批准后限制或限制。在推进候选产品时,我们将被要求咨询监管机构并遵守适用的指导方针。如果我们未能这样做,我们可能会被要求推迟或停止该等候选产品的开发。该等额外流程可能会导致审阅及批准流程较我们预期的时间更长。由于监管审批程序的增加或更严格或对我们候选产品开发的进一步限制而导致的延误可能会带来高昂的成本,并可能对我们及时完成临床试验和将当前和未来候选产品商业化的能力产生负面影响。
在这类潜在的新药物中,没有表观基因组控制药物获得批准,并且可能永远不会因为其他人或我们的努力而获得批准。mRNA药物的开发具有巨大的开发和监管风险,因为这类新药物的新颖性和前所未有的性质。
作为一种潜在的新药物类别,到目前为止,还没有表观基因组控制药物获得FDA或其他监管机构的批准。由我们或我们的战略合作伙伴成功发现和开发表观基因组控制药物是高度不确定的,取决于许多因素,许多
55
其中一些不是我们或他们所能控制的。我们已经并将继续做出一系列商业决策,并承担一定的风险,以推进我们的开发努力和流水线,包括与信使核糖核酸技术、交付技术和制造工艺相关的决策,根据我们、我们的战略合作伙伴或其他人的进一步工作,这些决策可能被证明是不正确的。
我们在早期开发阶段看似有希望的药物可能无法推进,在临床前阶段或临床阶段经历延迟,经历临床搁置,或由于许多原因而无法上市,包括:
我们的研究药物目前是在LNP中配制和管理的。这些LNP可能会引起与LNP的成分相关的系统性副作用,其中一些可能还没有在人体上进行测试。LNPs的一个公认的局限性是在单次和重复给药时可能发生炎症反应,这可能会影响耐受性和治疗指数。因此,我们的特许和内部开发的专有LNP系统的设计具有高度的耐受性,并通过体内重复给药将与LNP车辆相关的毒性降至最低。虽然我们继续优化我们的LNPs,但不能保证我们的LNPs不会产生不良影响。我们研究药物的某些方面可能会引发来自mRNA或脂质的免疫反应,以及生物途径内的不良反应,或由于mRNA或LNP的降解,其中任何一种都可能导致我们的一项或多项临床前或临床研究中的重大不良事件。我们的LNP可以全部或部分地促进以下一种或多种反应:免疫反应、输液反应、补体反应、调理反应、抗体反应,包括IgA、IgM、IgE或IgG或其某种组合,或者与LNP相关的某些脂质或聚乙二醇组分对聚乙二醇类或聚乙二醇类的反应。这些类型的副作用中有许多已经在LNPs中广泛观察到。对于任何此类不良事件的根本原因,可能会产生不确定性,这将使我们很难在未来的临床试验中准确预测副作用,并将导致我们的计划显著延迟.
临床前开发是不确定的,特别是对于表观基因组控制器等新型药物,因此我们的临床前计划或开发候选项目可能会被推迟、终止或可能永远不会进入临床,其中任何一项都可能对我们的平台或我们的业务产生实质性的不利影响。
我们的大多数项目都处于临床前开发阶段。在我们可以为开发候选药物启动临床试验之前,我们必须完成广泛的临床前研究,包括支持IND的良好实验室实践,或GLP,以及美国以外的同等要求,毒理学测试。临床前发展是不确定的,包括由于所使用的疾病模型的可变性。我们可能不会确定具有将其推进到进一步临床前研究所需的治疗活性或安全性特征的开发候选药物,或者最初有希望的开发候选药物的临床前研究结果可能不支持进一步测试。我们还必须完成关于化学、制造和控制的广泛工作,或CMC,活动(包括产率、纯度和稳定性数据)将包括在任何IND或类似的外国文件中。表观基因组控制器等新型药物的CMC活动需要广泛的制造工艺和分析开发,这是不确定和漫长的。我们不能确定我们的临床前测试和研究的及时完成或结果,也不能预测FDA或其他监管机构是否会接受我们的临床前测试或我们提议的临床计划的结果,或者我们的临床前测试、研究和研究的结果
56
CMC活动最终将支持我们项目的进一步发展。因此,我们不能确保我们能够在我们预期的时间表上提交IND或类似的临床前计划申请,我们也不能确保IND或类似申请的提交将导致FDA或其他监管机构允许临床试验开始。
OTX-2002的临床开发可能会被推迟或终止,我们可能永远不会获得监管部门对OTX-2002的批准,这可能会对我们的平台或我们的业务产生实质性的不利影响。此外,临床开发需要大量的资本投资,这可能是我们无法支持的。我们在完成OTX-2002和我们的其他候选产品的开发和商业化过程中可能会产生不可预见的成本或遇到延迟,或者最终无法完成。
在获得FDA或其他类似外国监管机构批准销售我们的候选产品之前,我们必须完成临床前开发和广泛的临床试验,以证明我们候选产品的安全性和有效性。临床测试费用昂贵、耗时长,而且存在不确定性。一个或多个临床试验的失败可能发生在这个过程的任何阶段,临床前研究和早期临床试验的结果可能不能预测后来的临床试验的成功。此外,临床前和临床数据往往容易受到不同解释和分析的影响,许多公司认为他们的候选产品在临床前研究和临床试验中表现令人满意,但仍未能获得其药物的上市批准。
2022年7月,我们宣布FDA批准了我们的IND申请,启动了OTX-2002治疗肝癌的1/2阶段临床试验,这是第一次人类临床试验,该试验是根据MYCHELANGELO临床计划启动的。我们还没有为我们的任何候选产品启动或完成任何其他临床试验。我们不能保证我们的任何临床试验将按计划启动或进行,或按计划完成。我们也不能确定提交任何未来的IND或类似申请是否会导致FDA或其他监管机构(如果适用)允许未来的临床试验及时开始。此外,即使这些试验开始,也可能出现可能导致监管当局暂停或终止此类临床试验的问题。一个或多个临床试验的失败可能发生在测试的任何阶段,我们的临床试验可能不会成功。可能妨碍成功或及时启动或完成临床试验的事件包括:
57
此外,COVID—19大流行造成的干扰可能会增加我们在启动、登记、进行或完成已计划和正在进行的临床试验时遇到困难或延误的可能性。任何无法成功启动或完成临床试验的情况都可能导致我们增加成本或削弱我们从产品销售中产生收入的能力。临床试验的延迟还可能缩短任何获批产品享有专利保护的时间,并可能使我们的竞争对手在我们之前将产品推向市场,这可能会削弱我们成功将候选产品商业化的能力,并可能严重损害我们的业务。
临床试验必须按照FDA和其他适用监管机构的法律要求、法规或指南进行,并接受这些政府机构和临床试验所在医疗机构的伦理委员会或IRB的监督。如果临床试验被我们、数据安全监测委员会(DSMB)或FDA或任何其他监管机构暂停或终止,或者正在进行此类试验的机构的IRB暂停或终止其临床研究者和接受其审查的研究中心的参与,我们也可能遇到延误。此类监管机构可能因多种因素而暂停或终止临床试验,包括未能按照监管要求或我们的临床方案进行临床试验、FDA或其他监管机构对临床试验操作或试验中心的检查导致临床暂停、不可预见的安全问题或不良副作用,未能证明使用候选产品的益处,政府法规或行政措施的变化,或缺乏足够的资金继续临床试验。
此外,我们临床试验的首席研究员可能会不时担任我们的科学顾问或顾问,并获得与此类服务相关的报酬。在某些情况下,我们可能被要求向FDA或类似的外国监管机构报告其中一些关系。FDA或类似的外国监管机构可能会得出结论,我们与主要研究人员之间的财务关系造成了利益冲突或以其他方式影响了对该研究的解释。因此,FDA或类似的外国监管机构可能会质疑在适用的临床试验地点产生的数据的完整性,临床试验本身的效用可能会受到威胁。这可能会导致fda或类似的外国监管机构延迟批准或拒绝我们的营销申请,因为
58
这种情况可能是,也可能最终导致拒绝我们的一个或多个候选产品的上市批准。
延迟完成我们候选产品的任何临床试验将增加我们的成本,减慢我们候选产品的开发和批准过程,并延迟或潜在地损害我们开始销售产品和产生产品收入的能力。此外,许多导致或导致临床试验开始或完成延迟的因素也可能最终导致我们候选产品得不到监管批准。因此,我们临床试验的任何延误可能会缩短我们可能拥有商业化候选产品的独家权利的任何时间,而我们的竞争对手可能会在我们之前将产品推向市场,这可能会大大降低我们候选产品的商业可行性。任何此类事件都可能严重损害我们的业务、财务状况、经营业绩和前景。
此外,FDA和其他监管机构关于临床试验的政策可能会改变,可能会颁布额外的政府法规。例如,欧盟与临床试验相关的监管格局最近发生了变化。欧盟临床试验条例,或称CTR,于2014年4月通过,废除了欧盟临床试验指令,于2022年1月31日生效。虽然《临床试验指令》要求在进行临床试验的每个成员国向主管的国家卫生当局和独立的伦理委员会提交单独的临床试验申请(CTA),但CTR引入了一个集中的程序,只要求提交一份多中心试验的申请。CTR允许赞助商向每个成员国的主管当局和道德委员会提交一份文件,导致每个成员国做出一项决定。CTA的评估程序也得到了统一,包括由所有有关成员国进行联合评估,并由每个成员国单独评估与其领土有关的具体要求,包括道德准则。每个成员国的决定通过集中的欧盟门户网站传达给赞助商。一旦CTA获得批准,临床试验开发就可以继续进行。CTR预计将有三年的过渡期。正在进行的临床试验和新的临床试验将在多大程度上受到CTR的控制,这一点各不相同。(I)在2022年1月31日之前根据《临床试验指令》提交申请的临床试验,或(Ii)在2022年1月31日至2023年1月31日之间且赞助商选择适用《临床试验指令》的临床试验,在2025年1月31日之前仍受该指令管辖。在这一日期之后,所有临床试验(包括正在进行的临床试验)都将受到CTR条款的约束。我们和我们的第三方服务提供商(如CRO)遵守CTR要求可能会影响我们的开发计划。
目前尚不清楚英国将在多大程度上寻求将其法规与欧盟接轨。英国关于临床试验的监管框架源自现有的欧盟立法(通过次级立法落实到英国法律中)。2022年1月17日,英国药品和保健产品监管机构(MHRA)启动了为期8周的咨询,内容是重塑英国临床试验立法,具体目标是简化临床试验审批,支持创新,提高临床试验透明度,实现更大的风险比例,并促进患者和公众参与临床试验。MHRA于2023年3月21日公布了咨询结果,其中确认将更新现有立法。由此产生的立法变化尚未公布,最终将决定英国法规与(欧盟)CTR的一致程度。英国决定不将其法规与欧盟采用的新方法紧密结合,可能会对在英国进行临床试验的成本产生影响,而不是在其他国家。
如果我们在适应现有要求的变化或采用管理临床试验的新要求或政策方面进展缓慢或无法适应,我们的开发计划也可能受到影响。
FDA和类似的外国监管机构的监管审批过程漫长、昂贵、耗时,而且本质上是不可预测的。如果我们最终无法获得监管部门对我们的候选产品的批准,我们将无法产生产品收入,我们的业务将受到严重损害。
未经FDA批准,我们不得在美国商业化、营销、推广或销售任何候选产品。外国监管机构也实施了类似的要求。获得FDA和类似的外国监管机构批准所需的时间是不可预测的,但通常需要在临床试验开始后多年,并取决于许多因素,包括监管机构的相当大的酌情决定权。此外,批准政策、法规或获得批准所需的临床数据的类型和数量可能会在候选产品的临床开发过程中发生变化,并可能因司法管辖区而异。我们尚未获得监管部门的批准
59
任何在美国或任何其他司法管辖区的候选产品,我们未来可能寻求开发的任何候选产品都可能永远不会获得监管部门的批准。
在获得美国或其他地方的候选产品商业化批准之前,我们必须用来自严格控制的试验的大量证据证明这些候选产品是安全有效的、纯的和有效的,以满足FDA或其他监管机构的要求。即使我们认为候选产品的非临床或临床数据是有希望的,这些数据可能不足以支持FDA或其他监管机构的批准。FDA或其他监管机构也可能要求我们在批准前或批准后对我们的候选产品进行额外的临床前研究或临床试验,或者它可能反对我们的临床开发计划。
FDA或任何外国监管机构可以推迟、限制或拒绝批准我们的候选产品,或要求我们进行额外的非临床或临床试验,或出于多种原因放弃项目,包括但不限于以下原因:
此外,FDA和外国监管机构可能会改变他们的批准政策,并可能制定新的规定。例如,在欧盟委员会于2020年11月发起的欧洲药品战略倡议的背景下,欧盟药品立法目前正在进行全面审查。欧盟委员会关于修订与医药产品有关的几项立法文书的建议(可能缩短监管排他性期限、修订快速通道的资格等)。于2023年4月26日出版。拟议的修订仍有待欧洲议会和欧洲理事会的同意和通过。这些提案可能会在通过之前进行重大修改,预计在2025年初之前不会。然而,从长远来看,这些修订可能会对制药业和我们的业务产生重大影响。
这一漫长的审批过程,以及临床试验结果的不可预测性,可能会导致我们无法获得监管部门的批准,无法将我们的任何候选产品推向市场,这将严重损害我们的业务。
60
即使我们最终完成临床试验并获得BLA或我们候选产品的国外上市申请的批准,FDA或类似的国外监管机构也可能会根据成本高昂的额外试验(包括4期临床试验)和/或REMS或类似风险管理措施的实施情况批准。这可能是为了确保药物在批准后的益处大于其风险。FDA或类似的外国监管机构也可能批准候选产品,用于比我们最初要求的更有限的适应症或患者人群。在获得或无法获得适用监管批准方面的任何延迟将延迟或阻止该候选产品的商业化,并将对我们的业务和前景造成重大不利影响。
我们的候选产品可能与严重不良事件、不良副作用或具有其他可能导致其临床开发停止、阻止其监管批准、限制其商业潜力或导致重大负面后果的特性有关。
由我们的候选产品引起的不良事件或其他不良副作用可能导致我们、试验的任何DSMB或监管机构中断、延迟或停止临床试验,并可能导致标签限制性更强,或FDA或其他类似的外国监管机构延迟或拒绝监管批准。我们的试验结果可能揭示了副作用的严重程度和普遍性。在这种情况下,我们的试验可能会暂停或终止,FDA或类似的外国监管机构可能会命令我们停止进一步开发或拒绝批准我们的候选产品用于任何或所有目标适应症。药物相关副作用可能影响患者招募或入组患者完成试验的能力,或导致潜在的产品责任索赔。任何此类事件都可能严重损害我们的业务、财务状况、经营业绩和前景。
在临床试验进行期间,患者向研究医生报告其健康状况的变化,包括疾病、损伤和不适。通常,无法确定正在研究的候选产品是否导致了这些情况。当我们在更大、更长和更广泛的临床试验中测试我们的候选产品时,或者当这些候选产品获得监管机构批准后使用变得更广泛时,患者可能会报告在之前的试验中观察到的疾病、伤害、不适和其他不良事件,以及在之前的试验中没有发生或未被发现的情况。很多时候,副作用只有在研究产品在大规模临床试验中进行测试后才能检测到,或者在某些情况下,在获得批准后以商业规模提供给患者。
如果在临床开发过程中发生任何严重不良事件,任何候选产品或我们开发的产品的临床试验可能会暂停或终止,我们的业务可能会受到严重损害。治疗相关副作用也可能影响患者招募和入组患者完成试验的能力,或导致潜在的责任索赔。监管机构可以命令我们停止进一步开发或拒绝批准任何或所有目标适应症的任何候选产品。如果我们被要求推迟、暂停或终止任何临床试验,这些候选产品的商业前景可能会受到损害,我们从这些候选产品或我们开发的其他候选产品中产生产品收入的能力可能会被推迟或取消。
此外,如果我们的一个或多个候选产品获得上市批准,并且我们或其他人随后发现这些产品引起的不良副作用或不良事件,则可能导致许多潜在的重大负面后果,包括但不限于:
61
这些事件中的任何一种都可能阻止我们实现或保持对特定候选产品的市场接受度,如果获得批准,可能会严重损害我们的业务.
我们公司从未将候选产品商业化,在获得当前和未来候选产品的监管批准时可能会遇到延迟或意想不到的困难。
我们从未获得监管部门对任何候选产品的批准,也从未将其商业化。FDA可能会拒绝接受我们计划的任何或全部BLAS进行实质性审查,或者可能在审查我们的数据后得出结论,认为我们的申请不足以获得任何候选产品的监管批准。如果FDA不批准我们计划中的任何BLAS,它可能会要求我们进行额外的昂贵的临床试验、临床前研究或CMC研究,然后它才会重新考虑我们的申请。根据这些或FDA要求的任何其他研究的范围,我们提交的任何BLA或其他申请的批准可能会大幅推迟,可能会推迟几年,或者可能需要我们花费比可用的资源更多的资源。在获得监管批准方面的任何失败或拖延都将阻止我们将候选产品商业化、创造收入以及实现和维持盈利能力。FDA也有可能认为,如果进行并完成额外的研究,可能不足以批准我们提交的任何BLA或其他申请。类似的风险可能存在于外国司法管辖区。如果这些结果中的任何一个发生,我们可能会被迫放弃开发我们的候选产品,这将对我们的业务产生实质性的不利影响,并可能导致我们停止运营。我们在外国司法管辖区的申请也面临类似的风险。
如果我们在招募患者参加任何临床试验时遇到困难,我们的临床开发活动可能会被推迟或受到其他不利影响。
由于各种原因,我们可能会在临床试验中遇到患者登记的困难。根据临床试验方案及时完成临床试验,除其他事项外,取决于我们是否有能力招募足够数量的患者留在试验中,直到试验结束。患者的登记取决于许多因素,包括:
此外,我们计划的临床试验将与其他临床试验争夺与我们的候选产品具有相同治疗领域或类似领域的产品,这一竞争将减少我们可以使用的患者数量和类型,因为一些可能选择参加我们的试验的患者可能会选择参加由我们的竞争对手之一进行的试验。由于合格临床研究人员的数量有限,我们预计将在一些竞争对手使用的相同临床试验地点进行我们的一些临床试验,这将减少可供我们在这些临床试验地点进行临床试验的患者数量。
患者登记的延迟可能会导致成本增加,或者可能会影响我们正在进行和计划中的临床试验的时间或结果,这可能会阻止这些试验的完成或开始,并对我们推进候选产品开发的能力产生不利影响。
62
我们不时宣布或公布的临床试验的临时、“主要”和初步数据可能会随着更多患者数据的获得而发生变化,并受到审计和验证程序的影响,这可能会导致最终数据发生重大变化。
我们可能会不时公开披露我们的临床前研究和临床试验的初步或主要数据,这些数据基于对当时可用数据的初步分析,结果以及相关的发现和结论可能会在对特定研究或试验的相关数据进行更全面的审查后发生变化。作为数据分析的一部分,我们也会做出假设、估计、计算和结论,而我们可能没有收到或没有机会全面而仔细地评估所有数据。因此,一旦收到更多数据并进行充分评估,我们报告的主要或初步结果可能与相同研究的未来结果不同,或者不同的结论或考虑因素可能会使这些结果合格。顶线数据和初步数据仍须接受审计和核查程序,这可能导致最终数据与我们以前公布的顶线数据或初步数据有很大不同。因此,在最终数据可用之前,应谨慎看待顶线和初步数据。
我们还可能不时地披露我们的临床前研究和临床试验的中期数据。我们可能完成的临床试验的中期数据可能会受到这样的风险,即随着患者登记的继续和更多患者数据的获得,或者随着我们临床试验的患者继续进行其他治疗他们的疾病,一个或多个临床结果可能会发生实质性变化。初步或中期数据与最终数据之间的不利差异可能会严重损害我们的业务前景。此外,我们或我们的竞争对手披露中期数据可能会导致我们普通股的价格波动。
此外,包括监管机构在内的其他人可能不接受或同意我们的假设、估计、计算、结论或分析,或者可能以不同的方式解释或权衡数据的重要性,这可能会影响特定计划的价值、特定候选产品或产品的批准或商业化,以及我们公司的总体情况。此外,我们选择公开披露的有关特定研究或临床试验的信息通常是基于广泛的信息,您或其他人可能不同意我们确定的重要信息或其他适当信息包括在我们的披露中。如果我们报告的中期、顶线或初步数据与实际结果不同,或者如果包括监管机构在内的其他人不同意得出的结论,我们获得批准并将我们的候选产品商业化的能力可能会受到损害,这可能会损害我们的业务、经营业绩、前景或财务状况。
我们在确定和成功开发其他候选产品的努力中可能不会成功。
我们战略的一部分包括确定新的候选产品。Omega平台可能无法产生用于临床开发的候选产品,原因有很多,包括这些风险因素中讨论的原因,以及:
63
如果我们无法确定其他合适的候选产品并成功将其商业化,这将对我们的业务战略和财务状况产生不利影响。
我们已经从FDA获得了用于治疗肝癌的OTX-2002的孤儿药物指定,我们可能会在未来为更多的候选产品寻求孤儿药物指定,但我们可能无法获得此类指定或保持与孤儿药物指定相关的好处,包括市场排他性,这可能会导致我们的产品收入(如果有的话)减少。
包括美国在内的一些司法管辖区的监管机构可能会将旨在治疗相对较少患者群体的药物或生物制品指定为孤儿药物产品。根据《孤儿药品法》,如果一种药物或生物药物旨在治疗一种罕见的疾病或疾病,FDA可以将其指定为孤儿药物。在美国,罕见疾病或疾病的定义通常是指患者人数少于20万人,或者在美国患者人数超过20万人,而在美国,没有合理的预期可以从美国的销售中收回研发药物的成本。
在美国,孤儿药物指定使当事人有权获得经济激励,如税收优惠和用户费用减免。用于治疗罕见疾病的药物或生物制品的临床试验也可能获得赠款资金的机会,无论这些药物或生物制品是否被指定为孤儿使用。此外,如果一种被指定为孤儿药物的药物或生物制剂随后获得了针对其具有这种指定的疾病或状况的第一次上市批准,该产品有权享有七年的市场排他期,这使得FDA无法在此期间批准针对相同疾病或状况的同一药物的另一种营销申请,除非在有限的情况下。如果我们的竞争对手能够在我们之前获得孤立药物的独家专利权,对于与我们的候选产品构成“相同的药物”并治疗相同疾病或疾病的产品,我们可能在很长一段时间内无法让竞争对手的产品获得适用的监管机构的批准。
我们已经从FDA获得了治疗肝癌的OTX-2002的孤儿药物名称。我们可能会为我们未来的某些候选产品寻求孤儿称号。然而,我们可能无法成功获得这些药物的孤儿药物指定,并可能无法保持与孤儿药物指定相关的好处。即使我们为我们的任何候选产品获得了孤儿药物排他性,这种排他性也可能无法有效地保护这些候选产品免受竞争,因为不同的药物可以被批准用于相同的疾病,而孤儿药物的排他性并不阻止FDA批准相同或不同的药物用于另一种疾病或疾病。即使在一种孤儿药物被授予孤儿独家专利并获得批准后,如果FDA得出结论认为,后者在临床上更好,因为它被证明在很大一部分目标人群中更安全,更有效,或者对患者护理做出了重大贡献,则FDA随后可以批准随后针对相同疾病的相同药物的申请。此外,指定的孤儿药物如果被批准用于比其获得孤儿指定的适应症更广泛的用途,则不得获得孤儿药物排他性。此外,如果FDA后来确定指定请求存在重大缺陷,或者如果我们无法生产足够数量的产品来满足这种罕见疾病或疾病患者的需求,则可能会失去孤儿药物在美国的独家营销权。指定孤儿药物既不会缩短药物的开发时间或监管审查时间,也不会在监管审查或批准过程中给药物带来任何优势。
我们已投资并预期将继续投资于进一步提升欧米茄平台的研发工作。该等投资可能会影响我们的经营业绩,如果该等投资的回报低于我们的预期或发展缓慢,我们的收入和经营业绩可能会受到影响。
我们利用我们的技术能力来发现新的候选产品,自我们成立以来,我们已经并预计将继续投资于进一步增强omega平台的研究和开发工作。这些投资可能涉及大量时间、风险和不确定性,包括与这些投资相关的费用可能影响我们的利润率和经营业绩,以及此类投资可能不会产生相对于市场上其他选择的足够技术优势的风险,这反过来将影响收入,以抵消承担的债务和与这些新投资相关的费用。生物技术行业随着技术和产品的发展而迅速变化,这可能会使我们的平台识别和开发候选产品的能力低于其他技术和平台。我们认为,我们必须继续在omega平台上投入大量时间和资源,以保持和提高我们的竞争地位。如果我们不能实现这些预期的好处
64
如果这些好处的实现被推迟,或者如果我们的技术不能像我们预期的那样快速地加速药物发现进程,我们的收入和经营业绩可能会受到不利影响。
我们必须适应迅速和重大的技术变革,并对竞争对手推出的新产品和新技术做出反应,以保持竞争力。
除了利用我们的平台发现和开发我们自己的候选产品外,我们还与其他生物制药和制药公司合作发现和开发我们的ECs。围绕人工智能和精确药物设计的技术格局的特点是显著增强和不断发展的行业标准。因此,我们和我们的合作者的需求正在迅速发展。如果我们不适当地创新和投资于新技术,我们的平台可能会变得不那么有竞争力,我们的合作者可能会转向我们的竞争对手提供的新技术,或者自己从事药物发现。我们认为,由于我们的许多合作伙伴需要初始时间投资才能决定是否与我们合作,因此如果他们与竞争对手达成合作伙伴关系或合作协议,可能很难重新获得与此类合作伙伴的商业关系。如果不及时推出新的解决方案和技术改进,我们的产品可能会随着时间的推移而失去竞争力,在这种情况下,我们的竞争地位和经营业绩可能会受到影响。因此,我们将大量的努力和资源集中在开发和确定新技术和市场上,以进一步扩大和深化我们在药物发现和开发方面的能力和专业知识。例如,如果我们不能及时引入新的创新技术或解决方案,不能充分预测合作伙伴的需求,或者不能获得所需的市场接受度,我们的业务可能会受到影响,我们的经营业绩可能会受到不利影响。
我们候选产品的潜在市场机会可能比我们预期的要小,或者可能仅限于那些没有资格接受或未能通过先前治疗的患者,而且我们对目标患者群体流行率的估计可能不准确。
我们目前和未来的目标患者群体是基于我们对我们候选产品可能解决的某些类型癌症的发病率或流行率的信念和估计,这些估计来自各种来源,包括科学文献和临床调查。我们的预测可能被证明是错误的,潜在患者的数量可能会低于预期。即使我们的候选产品获得了相当大的市场份额,因为潜在的目标人群可能很少,如果没有获得监管部门对其他适应症的批准,包括将我们的候选产品用于一线和二线治疗,我们可能永远不会实现盈利。
癌症治疗的特点有时是一线治疗(一线、二线、三线等),FDA通常最初只批准一种或几种特定的治疗方法。当癌症被发现得足够早时,一线治疗有时足以治愈癌症或延长生命,而不需要治愈。当一线治疗证明不成功时,通常是化疗、抗体药物、肿瘤靶向小分子、激素治疗、放射治疗、手术或这些疗法的组合,二线治疗可能会被实施。二线治疗通常包括更多的化疗、放射、抗体药物、肿瘤靶向小分子或这些药物的组合。三线治疗可以包括化疗、抗体药物和小分子肿瘤靶向治疗、更具侵入性的手术形式和新技术。我们预计最初将寻求批准我们的一些候选产品作为第二或第三线疗法,用于治疗其他批准疗法失败的患者。随后,对于那些被证明是足够有益的候选产品,如果有的话,我们希望寻求批准作为二线疗法和潜在的一线疗法,但不能保证我们的候选药物即使被批准用于三线疗法,也会被批准用于二线或一线疗法。此外,在获得二线或一线治疗的批准之前,我们可能必须进行额外的临床试验。
我们可能会专注于可能被证明不成功的潜在候选产品,而我们可能不得不放弃开发其他可能被证明更成功的候选产品的机会。
我们可以选择将我们的努力和资源集中在最终被证明不成功的潜在产品候选上,或者授权或购买不符合我们财务预期的营销产品。因此,我们可能无法利用可行的商业产品或有利可图的市场机会,被要求放弃或推迟追求与其他候选产品或后来可能被证明具有更大商业潜力的其他疾病的机会,或通过合作放弃对这些候选产品的宝贵权利,
65
在保留独家开发和商业化权利对我们有利的情况下,许可或其他特许权使用费安排。如果我们无法确定其他合适的候选产品并成功将其商业化,这将对我们的业务战略和财务状况产生不利影响。
此外,我们的财力和人力资源有限,正将重点放在开发我们的主要候选产品上,因此,我们可能会放弃或推迟追求其他未来候选产品的机会,这些产品后来被证明具有更大的商业潜力。我们的资源分配决策可能会导致我们无法利用可行的商业产品或有利可图的市场机会。我们在当前和未来的研发计划以及其他特定适应症的未来候选产品上的支出可能不会产生任何商业上可行的未来候选产品。如果我们没有准确评估特定未来候选产品的商业潜力或目标市场,我们可能会通过合作、许可或其他版税安排放弃对这些未来候选产品有价值的权利,而在这种情况下,我们保留这些未来候选产品的独家开发权和商业化权利会更有利。
我们可能会寻求FDA的快车道、突破性和再生医学高级治疗指定。这些指定实际上可能不会导致更快的开发或监管审查或批准过程,而且它们也不能保证FDA批准我们可能开发的任何候选产品。
FDA的快速通道、突破性和再生医学高级疗法或RMAT计划旨在加快某些合格产品的开发,这些产品旨在治疗严重疾病和状况。如果候选产品用于治疗严重或危及生命的疾病,并且临床前或临床数据表明该产品有潜力解决该疾病未得到满足的医疗需求,则赞助商可能有资格获得FDA快速通道认证。如果一种候选产品旨在治疗一种严重或危及生命的疾病,并且初步临床证据表明,该候选产品可能在一个或多个临床重要终点显示出对现有疗法的实质性改善,则该候选产品可被指定为突破性疗法。如果产品候选是一种旨在治疗、修改、逆转或治愈严重或危及生命的疾病的再生医学疗法,并且初步临床证据表明该候选产品具有解决此类疾病未得到满足的医疗需求的潜力,则该候选产品可获得RMAT称号。虽然我们可能寻求快速通道、突破和/或RMAT认证,但不能保证我们将成功获得任何此类认证。即使我们确实获得了这样的认证,我们可能也不会经历比传统FDA程序更快的开发过程、审查或批准。快速通道、突破性认证或RMAT认证不能确保候选产品获得市场批准或在任何特定时间范围内获得批准。此外,如果FDA认为我们的临床开发项目的数据不再支持快速通道、突破性或RMAT指定,它可能会撤销该指定。快速通道、突破性和/或RMAT指定本身并不能保证符合FDA的优先审查程序。
即使我们的任何候选产品获得了FDA的批准,我们也可能永远不会在美国以外的地方获得批准或将此类产品商业化,这将限制我们实现其全部市场潜力的能力。
为了在美国以外的市场销售任何产品,我们必须建立并遵守其他国家关于安全性和有效性的众多和不同的监管要求。在一个国家进行的临床试验可能不会被其他国家的监管部门接受,一个国家的监管批准并不意味着将在任何其他国家获得监管批准。审批程序因国家而异,可能涉及额外的产品测试和验证以及额外的行政审查期限。寻求外国监管机构的批准可能会导致我们的重大延误、困难和成本,并可能需要额外的临床前研究或临床试验,这将是昂贵和耗时的。各国的监管要求可能有很大差异,可能会推迟或阻止我们的产品在这些国家推出。满足这些和其他监管要求是昂贵的、耗时的、不确定的,并且可能会出现意想不到的延迟。此外,我们未能在任何国家获得监管批准,可能会推迟或对其他国家的监管批准过程产生负面影响。我们没有任何候选产品在任何司法管辖区获得批准销售,包括国际市场,我们也没有在国际市场获得监管批准的经验。如果我们不遵守国际市场的监管要求,或未能获得并保持所需的批准,我们实现产品全部市场潜力的能力将受到损害。
66
即使当前或未来的候选产品获得上市批准,它也可能无法达到医生、患者、第三方支付者和医疗界其他人的市场接受程度,这是商业成功所必需的。
如果我们开发的任何当前或未来的候选产品获得了上市批准,但它可能无法获得医生、患者、第三方支付者和医疗界其他人的充分市场接受。如果我们开发的候选产品没有达到足够的接受程度,我们可能不会产生显著的产品收入,我们可能无法盈利。任何候选产品的市场接受程度,如果批准商业销售,将取决于许多因素,包括:
由于资金短缺或全球健康问题导致的FDA和其他政府机构的中断可能会阻碍他们招聘、保留或部署关键领导层和其他人员的能力,或者以其他方式阻止新产品或修改后的产品及时或根本无法开发、批准或商业化,这可能会对我们的业务产生负面影响。
FDA和外国监管机构审查或批准新产品的能力可能受到多种因素的影响,包括政府预算和资金水平、法规、法规和政策变化、FDA或外国监管机构雇用和保留关键人员以及接受用户费用支付的能力,以及其他可能影响FDA或外国监管机构履行日常职能能力的事件。因此,FDA和外国监管机构的平均审查时间近年来波动。此外,政府对资助研究和开发活动的其他政府机构的资助也要服从政治进程,而政治进程本身就是不稳定和不可预测的。FDA和其他机构(如EMA)在其搬迁至阿姆斯特丹和相关重组(包括人员变动)后的混乱也可能会减缓新药由必要政府机构审查和/或批准所需的时间,这将对我们的业务产生不利影响。例如,在过去的几年里,美国政府多次关闭,某些监管机构,如FDA,不得不解雇FDA的关键员工并停止关键活动。
另外,为了应对新冠肺炎疫情,美国食品药品监督管理局推迟了对国内外不同地点制造设施的大部分检查。尽管FDA已在可行的情况下恢复了对国内设施的标准检查操作,但FDA仍在继续监测和实施其检查活动的变化,以确保其员工及其监管公司的安全,以适应与新冠肺炎的发展,任何病毒的死灰复燃或新变种的出现都可能导致进一步的检查延误。美国以外的监管机构已经采取了类似的限制或其他政策措施来应对新冠肺炎疫情,他们的监管活动可能会出现延误,这可能会对我们的业务产生实质性的不利影响。如果政府长期停摆,或者如果全球健康问题继续阻碍或阻止FDA或其他监管机构进行定期检查、审查或其他监管活动,可能会严重影响FDA或其他监管机构及时审查和处理我们的监管提交的能力,这可能会对我们的业务产生重大不利影响。
我们的保险单很贵,而且只保护我们免受一些商业风险的影响,这让我们面临着重大的未投保债务。
67
我们不为我们的业务可能遇到的所有类别的风险投保。我们目前维护的一些政策包括一般责任、财产、汽车、雇佣惯例、工人补偿、环境责任以及董事和高级职员保险。
我们未来购买的任何额外产品责任保险可能不足以补偿我们可能遭受的任何开支或损失。此外,保险范围正变得越来越昂贵,未来我们可能无法以合理的成本或足够的金额维持保险范围,以保护我们免受责任造成的损失。如果我们的任何候选产品获得市场批准,我们打算购买包括商业产品销售在内的保险;然而,我们可能无法获得商业合理条款或足够金额的产品责任保险。成功的产品责任索赔或一系列索赔可能导致我们的股价下跌,如果判决超过我们的保险范围,可能会对我们的运营和业务业绩产生不利影响,包括阻止或限制我们开发的任何候选产品的开发和商业化。虽然我们的环境责任保险为生物或危险材料释放引起的索赔提供了一定的保障,但我们的财产、意外和一般责任保险政策明确不包括因生物或危险废物暴露或污染而引起的损害和罚款。因此,如果发生污染或伤害,我们可能会承担损害赔偿责任,或被处以超过我们资源的罚款,我们的临床试验或监管批准可能会被暂停。
作为一家上市公司经营,我们已经并将使我们更难获得董事和高级管理人员责任保险,并且我们可能需要接受更低的保单限额和覆盖范围,或承担更高的成本以获得相同或类似的覆盖范围。因此,我们可能更难吸引及挽留合资格人士加入我们的董事会、董事委员会或担任行政人员。然而,我们不知道我们是否能够维持现有的保险,并提供足够的保障。任何重大未投保负债可能要求我们支付大量款项,这将对我们的现金及现金等价物状况及经营业绩造成不利影响。
与医疗保健法和其他法律合规事项相关的风险
我们将受到广泛且代价高昂的政府监管。
我们的候选产品将受到广泛而严格的国内政府法规的约束,包括FDA、医疗保险和医疗补助服务中心(Centers for Medicare & Medicaid Services,简称CMS)、美国卫生与公众服务部(Department of Health and Human Services)、美国司法部(Department of Justice)、州政府和地方政府及其在美国境外的相应部门的监管。FDA监管药品的研究、开发、临床前和临床试验、生产、安全性、有效性、记录保存、报告、标签、包装、储存、批准、广告、促销、销售、分销、进口和出口。如果我们的产品在国外上市,它们也将受到外国政府的广泛监管,无论它们是否已经获得FDA对特定产品及其用途的批准。这种外国条例的要求可能与美国的相应条例相同或更高。
政府监管大幅增加了研发、制造和销售我们产品的成本和风险。监管审查和批准过程,包括每个候选产品的临床前测试和临床试验,是漫长的,昂贵的和不确定的。我们必须获得并保持监管授权,以进行临床前研究和临床试验。我们必须获得监管部门的批准,产品所使用的生产设施必须经过检查并符合法律要求。为了获得监管部门的批准,需要提交广泛的临床前和临床数据以及每个拟议治疗适应症的其他支持性信息,以确定产品在每个预期用途中的安全性和有效性、效价和纯度。开发和批准过程需要多年时间,需要大量资源,而且可能永远不会导致产品的批准。
即使我们能够获得对特定产品的监管批准,批准也可能限制该产品的指定医疗用途,否则可能会限制我们推广、销售和分销该产品的能力,可能要求我们进行代价高昂的上市后监督,和/或可能要求我们进行持续的上市后研究。对经批准的产品的材料更改,例如制造更改或修订的标签,可能需要进一步的监管审查和批准。一旦获得批准,任何批准都可能被撤回,例如,如果后来发现该产品存在以前未知的问题,例如以前未知的安全问题。
68
如果我们、我们的顾问、CDMO、CRO或其他供应商在监管过程中的任何阶段未能遵守适用的监管要求,此类不遵守可能导致(除其他外)申请的批准或已批准申请的补充延迟;拒绝监管机构,包括FDA或其他监管机构,审查待决的市场批准申请或批准申请的补充;警告信;罚款;进出口限制;产品召回或扣押;禁令;全部或部分停产;民事处罚;撤回先前批准的上市申请或许可证;FDA或其他监管机构针对政府合同的建议;和/或刑事起诉.
已颁布及未来的医疗保健立法及政策可能会增加我们获得候选产品的上市批准及商业化的难度及成本,并可能对我们的业务造成不利影响。
在美国、欧盟和其他司法管辖区,已经并预计将继续有许多立法和监管变更以及医疗保健系统的拟议变更,这些变更可能会阻止或延迟我们开发中的产品的上市批准,限制或监管涉及我们获得上市批准的任何候选产品的批准后活动,影响定价和报销,并影响我们销售任何此类产品的盈利能力。特别是,在美国联邦和州一级已经并将继续采取一些旨在降低医疗成本和提高医疗质量的举措。此外,经常采用新的法规和对现有医疗法规和条例的解释。
2010年3月,《患者保护和平价医疗法案》(Patient Protection and Affordable Care Act,简称ACA)颁布,极大地改变了政府和私营保险公司为医疗保健融资的方式。在ACA的条款中,对制药和生物技术行业最重要的条款包括:
自颁布以来,ACA的某些方面一直受到司法、国会和行政方面的挑战。2021年6月17日,美国最高法院驳回了几个州对ACA提出的最新司法挑战,但没有具体裁决ACA的合宪性。在最高法院做出裁决之前,总裁·拜登发布了一项行政命令,启动了2021年2月15日至2021年8月15日的特殊投保期,目的是通过ACA市场获得医疗保险。行政命令还指示某些政府机构审查和重新考虑其
69
限制获得医疗保健的现有政策和规则,包括重新审查包括工作要求的医疗补助示范项目和豁免计划,以及通过医疗补助或ACA获得医疗保险覆盖范围造成不必要障碍的政策。目前尚不清楚其他医疗改革措施将如何影响我们的业务。
此外,自ACA颁布以来,美国还提出并通过了其他立法修改。2011年8月,2011年《预算控制法》导致对医疗保险提供者的医疗保险支付总额减少,该法案于2013年4月生效,由于对该法规的后续立法修订,该法案将从本报告之日起一直有效到2031年,除非国会采取进一步行动。此外,2013年1月,2012年美国纳税人救济法签署成为法律,其中包括进一步减少向几种类型的提供者支付的医疗保险,包括医院、成像中心和癌症治疗中心,并将政府追回向提供者多付款项的诉讼时效从三年延长到五年。此外,作为更广泛的税收改革的一部分,孤儿药品税收抵免被减少。这些新法律或未来引入的任何其他类似法律可能会导致联邦医疗保险和其他医疗保健资金的进一步减少,这可能会对我们的客户以及我们的财务运营产生负面影响。
此外,支付方法可能会受到医疗保健立法和监管举措的影响。例如,合作医疗可以开发新的支付和交付模式,如基于结果的报销。此外,最近政府加强了对制造商为其销售产品定价的方式的审查,导致美国国会进行了几次调查,并提出并颁布了旨在提高药品定价透明度、降低联邦医疗保险下处方药成本以及审查定价与制造商患者计划之间关系的联邦立法。最近的一次是在2022年8月16日,《2022年通胀削减法案》(IRA)签署成为法律。除其他事项外,爱尔兰共和军要求某些药品的制造商与联邦医疗保险进行价格谈判(从2026年开始),价格可以谈判,但有上限;根据联邦医疗保险B部分和联邦医疗保险D部分实施回扣,以惩罚超过通胀的价格上涨(首次于2023年到期);并用新的折扣计划取代D部分覆盖缺口折扣计划(从2025年开始)。爱尔兰共和军允许卫生与公众服务部(HHS)秘书在最初几年通过指导而不是监管来实施其中许多规定。随着这些计划的实施,HHS已经并将继续发布和更新指导意见。2023年8月29日,HHS宣布了将接受价格谈判的前十种药物的清单,尽管联邦医疗保险药品价格谈判计划目前受到法律挑战。由于这一原因和其他原因,目前尚不清楚爱尔兰共和军将如何实施。此外,为了回应拜登政府2022年10月的行政命令,HHS于2023年2月14日发布了一份报告,概述了由医疗保险和医疗补助服务中心(CMS)创新中心测试的三种新模型,这些模型将对它们降低药品成本、促进可获得性和提高医疗质量的能力进行评估。目前还不清楚这些模型是否会在未来的任何医疗改革措施中使用。
美国的个别州也越来越多地通过立法并实施旨在控制药品和生物制品定价的法规,包括价格或患者报销限制、折扣、对某些产品准入的限制、营销成本披露和透明度措施,在某些情况下,旨在鼓励从其他国家进口和批量购买。法律规定的对第三方付款人支付金额的价格控制或其他限制可能会损害我们的业务、运营结果、财务状况和前景。此外,地区医疗当局和个别医院越来越多地使用招标程序来确定哪些药品和供应商将包括在他们的处方药和其他医疗保健计划中。这可能会减少对我们候选产品的最终需求,或者给我们的产品定价带来压力。
在欧盟,如果获得批准,类似的政治、经济和监管发展可能会影响我们将候选产品有利可图地商业化的能力。除了对价格和成本控制措施的持续压力外,欧盟或成员国层面的立法发展可能会导致显著的额外要求或障碍,这可能会增加我们的运营成本。在欧盟提供医疗服务,包括建立和运营医疗服务,以及药品的定价和报销,几乎完全是国家法律和政策的问题,而不是欧盟的法律和政策。在这方面,各国政府和保健服务提供者在提供保健服务以及产品定价和报销方面有不同的优先事项和办法。欧盟成员国可以自由限制其国家医疗保险制度提供报销的药品的范围,并控制供人使用的药品的价格和报销水平。一些司法管辖区实行正面清单和负面清单制度,在这种制度下,产品只有在政府同意报销价格后才能销售。
70
欧盟成员国可以批准药品的具体价格或报销水平,或者对负责将药品推向市场的公司的盈利能力采取直接或间接控制的制度,包括基于数量的安排、上限和参考定价机制。为了在一些欧盟成员国获得报销或定价批准,我们可能需要进行研究,将我们候选产品的成本效益与被认为是当地护理标准的其他疗法进行比较。其他欧盟成员国允许公司固定自己的药品价格,但监控公司的利润。总体上,医疗成本,特别是处方药的下行压力变得非常大。总体而言,大多数欧盟成员国的医疗预算限制导致相关医疗服务提供商对药品的定价和报销进行限制。再加上欧盟和国家对那些希望开发和营销产品的人不断增加的监管负担,这可能会阻止或推迟我们候选产品的上市审批,限制或监管审批后的活动,并影响我们将候选产品商业化的能力(如果获得批准)。
2021年12月13日,修订第2011/24/EU号指令的第2021/2282号卫生技术评估条例(HTA)获得通过。虽然该条例于2022年1月生效,但从2025年1月起才开始适用,在此期间将采取与实施相关的准备和步骤。该规定一旦适用,将根据有关产品分阶段实施。这项规定旨在促进欧盟成员国在评估包括新医药产品在内的卫生技术方面的合作,并为在这些领域进行联合临床评估的欧盟层面的合作提供基础。该法规将允许欧盟成员国在欧盟范围内使用通用的HTA工具、方法和程序,在四个主要领域进行合作,包括对对患者具有最大潜在影响的创新卫生技术进行联合临床评估,联合科学咨询,开发人员可以向HTA当局寻求建议,确定新兴卫生技术以及早发现有前景的技术,以及在其他领域继续开展自愿合作。个别欧盟成员国将继续负责评估卫生技术的非临床(例如,经济、社会、伦理)方面,并就定价和报销做出决定。
在美国和欧盟以外的市场,报销和医疗保健支付系统因国家而异,许多国家对特定产品和疗法设定了价格上限。
此外,在美国,已提出立法和监管建议,以扩大药品的批准后要求,并限制销售和促销活动。我们无法确定是否会颁布额外的立法变更,或者FDA的法规、指南或解释是否会变更,或者这些变更对我们候选产品的上市批准(如果有的话)可能产生什么影响。此外,国会对FDA批准程序的审查力度加大,可能会大大推迟或阻止上市批准,并使我们面临更严格的产品标签和上市后测试和其他要求。
我们无法预测美国、欧盟或任何其他司法管辖区未来立法或行政行动可能产生的政府监管的可能性、性质或程度。如果我们或我们可能接触的任何第三方缓慢或无法适应现有要求的变化或采用新的要求或政策,或者如果我们或该等第三方无法保持监管合规性,我们的候选产品可能会失去可能已获得的任何监管批准,我们可能无法实现或维持盈利。
如果我们的候选产品获得监管部门的批准,我们和他们将接受持续的监管审查以及重大的上市后监管要求和监督。
如果FDA或其他监管机构批准我们的任何候选产品,我们候选产品的制造过程、标签、包装、分销、不良事件报告、储存、广告、促销、进口、出口和记录保存将受到广泛和持续的监管要求。这些要求包括提交安全性和其他上市后信息和报告、注册,以及我们在批准后进行的任何临床试验中持续遵守cGMP和类似的外国要求和GCP。此外,生物制品制造商及其设施受到FDA和其他监管机构的持续审查和定期突击检查,以确保符合cGMP法规和类似的外国要求。如果我们或监管机构发现某一产品存在以前未知的问题,例如未预料到的严重程度或频率的不良事件,或该产品的制造设施存在问题,监管机构可对该产品、该制造设施或我们施加限制,包括要求召回或从市场上撤回该产品或暂停生产。此外,我们可能获得的任何监管批准
71
候选产品可能包含与特定年龄段的使用限制、警告、预防措施或禁忌症相关的重大限制,并可能包括繁重的批准后研究或风险管理要求。例如,FDA可能需要REMS才能批准我们的候选产品,这可能需要药物指南、医生培训和沟通计划或确保安全使用的其他要素,如受限分配方法、患者登记和其他风险最小化工具。
未能遵守适用的监管要求,我们可能会受到行政或司法制裁,包括:
任何该等事件的发生可能会抑制我们将候选产品商业化和产生收入的能力,并可能需要我们花费大量时间和资源作出回应,并可能产生负面宣传。
此外,FDA和其他监管机构的政策可能会发生变化,可能会颁布额外的政府法规,以阻止、限制或推迟对我们候选产品的监管批准。我们无法预测美国或国外未来的立法或行政或行政行动可能产生的政府监管的可能性、性质或程度。
如果我们对现有要求的变化或新要求或政策的采用反应迟缓或无法适应,或者如果我们无法保持监管合规,我们可能会失去我们可能获得的任何营销批准,我们可能无法实现或维持盈利能力。
美国的Hatch—Waxman法案为我们的每一个产品的一个选定专利提供了专利期延长的机会,专利期延长的长度(如果有的话)需经过美国专利商标局或美国专利商标局(USPTO)和FDA的审查和批准。
在美国,Hatch—Waxman法案允许每种产品的一项专利的正常到期日之后,专利期限最多延长五年,如果是治疗方法专利,则仅限于批准的适应症(或在延长期间批准的任何其他适应症)。专利期延长的长度通常计算为临床试验期的一半加上FDA审查BLA期间的整个时间,减去我们在这些时间内的任何延迟时间。此外,专利期限的延长也有一个限制,从药品批准起不得超过14年。因此,如果我们选择并获得最近提交和发布的专利的专利期限延长,我们可能无法获得可能的专利期限延长的全部利益。我们也可能因未能在适用期限内申请、未能在相关专利到期前申请或未能满足众多适用要求而根本无法获得专利期限延长。此外,适用机构,包括美国FDA和USPTO,以及其他国家的任何同等监管机构,可能不同意我们对此类扩展是否可用的评估,可能拒绝授予我们专利的扩展,或者可能授予比我们要求更有限的扩展。如果发生这种情况,我们的竞争对手可能能够通过参考我们的临床和临床前数据,在我们的专利到期后获得竞争产品的批准,并比其他情况更早地推出其产品。如果发生这种情况,可能会对我们产生产品收益的能力产生重大不利影响。
72
1997年,作为美国食品药品管理局现代化法案(FDAMA)的一部分,国会颁布了一项法律,为在儿童中进行药物研究的药品制造商提供奖励。该法律规定了六个月的排他性,以换取进行儿科研究,被称为儿科排他性条款。如果我们进行的临床研究符合FDAMA,我们可能会在任何监管数据独占期和我们的专利有效期延长期(如果收到的话)上额外获得6个月的期限。但是,如果我们选择不进行符合FDAMA的儿科研究,或者FDA不接受该研究,我们将不会获得额外的6个月的数据排他性延长或我们的专利期延长。
在欧盟,补充保护证书(SPC)可将专利期限延长至五年,以补偿监管审查期间损失的专利期限,如果临床试验数据是根据商定的儿科研究计划获得的,则可以延长(如果批准时有效)6个月。虽然所有欧盟成员国都必须提供SPC,但SPC必须在每个国家的基础上申请和批准。这可能导致申请和获得这些证书的费用高昂,各国的费用可能各不相同,或者根本不授予这些证书.
我们的业务运营以及与调查人员、医疗保健专业人员、顾问、第三方付款人、患者组织和客户的当前和未来关系将受到适用的医疗监管法律的约束,这可能会使我们受到处罚。
我们的业务运营以及当前和未来与调查人员、医疗保健专业人员、顾问、第三方付款人、患者组织和客户的安排,可能会使我们面临广泛适用的欺诈和滥用以及其他医疗保健法律法规。这些法律可能会限制我们开展业务的业务或财务安排和关系,包括我们如何研究、营销、销售和分销候选产品(如果获得批准)。这些法律包括:
73
确保我们的内部运营和未来与第三方的业务安排符合适用的医疗法律和法规,将涉及大量成本。政府当局可能会得出结论,我们的商业行为,包括我们与医生和其他医疗保健提供者的关系,其中一些人以股票或股票期权的形式为我们提供的服务获得补偿,如果获得批准,可能会影响我们候选产品的订购或使用,可能不符合当前或未来涉及适用欺诈和滥用或其他医疗保健法律和法规的现行或未来法规、法规、机构指导或判例法。如果我们的业务被发现违反了上述任何法律或可能适用于我们的任何其他政府法律和法规,我们可能会受到重大处罚,包括民事、刑事和行政处罚、损害赔偿、罚款、被排除在政府资助的医疗保健计划之外,如Medicare和Medicaid或其他国家或司法管辖区的类似计划,诚信监督,以及解决违规、交还、监禁、合同损害、声誉损害、利润减少以及削减或重组我们业务的指控的报告义务。如果我们预期与之开展业务的任何医生或其他提供者或实体被发现不遵守适用法律,他们可能会受到刑事、民事或行政制裁,包括被排除在政府资助的医疗保健计划和监禁之外,这可能会影响我们的业务运营能力。此外,防御任何此类行为都可能代价高昂,
74
这很耗时,而且可能需要大量的人力资源。因此,即使我们成功地抵御了任何可能对我们提起的此类诉讼,我们的业务也可能受到损害.
我们受政府法规和其他法律义务的约束,特别是与隐私、数据保护和信息安全有关的法律义务。实际或感知的未能遵守适用的数据保护、隐私和安全法律、法规、标准和其他要求,可能会对我们的业务、运营业绩和财务状况造成不利影响。
随着我们的运营和业务的增长,我们可能会受到新的或额外的数据保护法律法规的约束或影响,并面临监管机构的更多审查或关注。在美国,经2009年《经济和临床健康健康信息技术法案》修订的1996年《健康保险携带和责任法案》以及根据该法案颁布的法规,或统称为《健康保险法案》,其中包括与个人可识别健康信息的隐私、安全、传输和违规报告有关的若干标准。大多数医疗保健提供者,包括我们从其获取患者健康信息的研究机构,均须遵守根据HIPAA颁布的隐私和安全法规。吾等认为吾等目前并无被归类为HIPAA所涵盖实体或业务联营公司,因此不会直接受其规定或处罚所规限。然而,根据事实和情况,如果我们故意从一家受HIPAA覆盖的医疗保健提供者或研究机构接收个人可识别健康信息,而该等医疗保健提供者或研究机构未满足HIPAA对个人可识别健康信息披露的要求,我们可能面临重大刑事处罚。
某些州还通过了类似的隐私和安全法律法规,管理与健康有关的个人信息和其他个人信息的隐私、处理和保护。例如,2018年6月28日,加利福尼亚州颁布了加州消费者隐私法,简称CCPA,于2020年1月1日生效。CCPA为加州消费者创造了个人隐私权,增加了处理某些个人信息的实体的隐私和安全义务,要求向加州个人披露某些信息,赋予这些个人新的能力来选择不出售某些个人信息,并规定了对违规行为的民事处罚,以及针对增加了数据泄露诉讼的可能性和相关风险的数据泄露的私人诉讼权利。此外,加州隐私权法案(CPRA)于2023年1月1日生效,对CCPA进行了重大修订。它对涵盖的企业施加了额外的数据保护义务,包括额外的消费者权利程序、对数据使用的限制、对较高风险数据的新审计要求,以及选择退出敏感数据的某些用途。它还创建了一个新的加州数据保护机构,授权发布实质性法规,并可能导致加强隐私和信息安全执法。可能需要额外的合规性投资和潜在的业务流程更改。遵守这些众多、复杂且经常变化的法规是昂贵和困难的,不遵守任何隐私法或数据安全法或任何涉及挪用、丢失或其他未经授权处理、使用或披露敏感或机密患者、消费者或其他个人信息的安全事件或违规行为,无论是我们、我们的CRO之一还是其他第三方,都可能对我们的业务、财务状况和运营结果产生不利影响,包括但不限于:调查成本;重大罚款和处罚;补偿性、特殊、惩罚性和法定损害赔偿;诉讼;关于我们的隐私和安全实践的同意令;要求我们向受影响的个人提供通知、信用监控服务和/或信用恢复服务或其他相关服务;对我们的营业执照采取不利行动;声誉损害;以及禁令救济。其他州也通过了类似的法律,并将继续在州和联邦层面提出建议,这反映了美国倾向于更严格的隐私立法的趋势。这类法律的颁布可能会有相互冲突的要求,从而使合规具有挑战性。如果我们受到HIPAA、CCPA、CPRA或其他国内隐私和数据保护法律的约束或影响,因未能遵守这些法律的要求而承担的任何责任可能会对我们的财务状况产生不利影响。
我们在美国以外的活动可能会受到额外的合规要求的约束,并因不合规而产生额外的强制执行风险。例如,2018年5月25日,一般数据保护条例(GDPR)生效,对欧洲经济区内个人数据的处理提出了严格要求。例如,GDPR适用于治外法权,并要求我们向数据当事人进行详细披露,披露我们可以处理个人数据的法律依据,以获取收集和处理个人数据(包括临床试验数据)的有效同意,在大规模处理敏感个人数据(如健康数据)时任命数据保护主任,为数据当事人提供强大的权利,并采取适当的隐私管治,包括政策、程序、培训和数据审计。它还强制要求我们在与服务提供商签订合同时发出数据泄露通知和某些义务。GDPR规定,欧洲经济区国家可以制定自己的法律和法规
75
限制个人数据的处理,包括基因、生物特征或健康数据,这可能会限制我们使用和共享个人数据的能力,或者可能会导致我们的成本增加。必须遵守GDPR的公司面临更多的合规义务和风险,包括更强有力的数据保护要求的监管执法,以及如果不合规可能被处以高达2000万欧元或不合规公司全球年收入的4%的罚款,以金额较大者为准。除罚款外,违反GDPR还可能导致监管调查、声誉损害、下令停止/更改我们的数据处理活动、执行通知、评估通知(用于强制审计)和/或民事索赔(包括集体诉讼)。在其他要求中,GDPR监管将受GDPR约束的个人数据转移到未被发现对此类个人数据提供足够保护的第三国,包括美国,欧洲经济区和美国之间现有转移机制的有效性和持久性仍不确定。欧洲联盟法院(CJEU)的判例法规定,仅依靠标准合同条款--欧盟委员会批准的作为适当个人数据转移机制的标准合同形式--可能不一定在所有情况下都足够,转移必须在个案的基础上进行评估。2022年10月7日,总裁·拜登签署了一项关于加强对美国情报活动的保障措施的行政命令,引入了新的补救机制和具有约束力的保障措施,以解决CJEU对从欧洲经济区向美国转移数据提出的关切,并构成了2022年12月13日发布的新的欧盟-美国数据隐私框架(DPF)的基础。欧盟委员会于2023年7月10日通过了关于DPF的充分性决定,使DPF有效地成为根据DPF自我认证的美国实体的GDPR转移机制。DPF还为欧盟公民引入了一个新的补救机制,这解决了CJEU之前判决中的一个关键问题,可能意味着根据标准合同条款进行的转移在未来不太可能受到挑战。我们目前依赖欧盟标准合同条款和欧盟标准合同条款的英国附录,以及英国国际数据传输协议和DPF,在集团内和第三方转移方面,将个人数据转移到欧洲经济区以外和英国(包括美国)。我们预计,有关国际个人数据转移的现有法律复杂性和不确定性将继续存在。特别是,我们预计DPF充分性决定将受到挑战,向美国和更广泛的其他司法管辖区的国际转移将继续受到监管机构的加强审查。因此,我们可能不得不做出某些业务上的改变,我们将不得不在规定的时限内为现有的数据传输执行经修订的标准合同条款和其他相关文件。
此外,自2021年1月以来,我们必须遵守GDPR和英国GDPR,每个制度都有能力对违规行为处以最高2000万欧元(1750万英镑)或全球营业额4%的罚款。2023年10月12日,英国对DPF的延期生效(经英国政府批准),作为英国GDPR向根据英国延期至DPF进行自我认证的美国实体传输数据的机制。
我们不能向您保证,我们的CDMO、CRO或其他第三方服务提供商可以访问我们或我们的客户、供应商、试验患者和员工的个人身份信息和其他敏感或机密信息,我们对此负有责任,或者他们不会违反我们施加的合同义务,或者他们不会遭遇数据安全漏洞或尝试,这可能会对我们的业务产生相应的影响,包括违反我们在隐私法律和法规下的义务和/或反过来可能对我们的业务、运营结果和财务状况产生不利影响。我们不能向您保证,我们的合同措施以及我们自己的隐私和安全相关保障措施将保护我们免受与第三方处理、使用、存储和传输此类信息相关的风险。此外,我们或我们的合作者获得健康信息的患者,以及与我们共享此信息的提供者,可能拥有限制我们使用和披露信息的能力的法定或合同权利。我们可能需要花费大量资本和其他资源,以确保持续遵守适用的隐私和数据安全法律。声称我们侵犯了个人隐私权或违反了我们的合同义务,即使我们被发现没有责任,辩护也可能是昂贵和耗时的,并可能导致负面宣传,可能会损害我们的业务。如果我们或第三方CDMO、CRO或其他承包商或顾问未能遵守适用的联邦、州或地方监管隐私要求,我们可能会受到一系列监管行动的影响,这些行动可能会影响我们或我们的承包商开发和商业化我们的候选产品的能力,可能会损害或阻止我们能够商业化的任何受影响产品的销售,或者可能会大幅增加我们产品的开发、商业化和营销的成本和支出。任何威胁或实际的政府执法行动也可能产生负面宣传,并要求我们投入大量资源,否则这些资源可以用于我们业务的其他方面。越来越多地使用社交媒体可能会导致责任、数据安全遭到破坏或声誉受损
76
损坏。上述任何一项都可能对我们的业务、财务状况、经营结果和前景产生实质性的不利影响。
我们受到环境、健康和安全法律法规的约束,我们可能会承担与环境合规或补救活动有关的责任和巨额费用。.
我们的运营,包括我们的开发、测试和制造活动,都受到许多环境、健康和安全法律法规的约束。除其他外,这些法律和条例管制危险材料和生物材料的受控使用、处理、释放和处置以及登记册的维持,这些材料包括化学溶剂、人体细胞、致癌化合物、诱变化合物以及对生殖、实验室程序和接触血液传播病原体有毒性影响的化合物。如果我们未能遵守该等法律及法规,我们可能会受到罚款或其他制裁。
与从事与我们类似活动的其他公司一样,我们面临着当前和历史活动固有的环境责任风险,包括与释放或暴露于有害或生物材料有关的责任。环境、健康和安全法律法规正变得越来越严格。我们可能需要承担与未来的环境合规或补救活动有关的大量费用,在这种情况下,我们的第三方制造商的生产工作或我们的开发工作可能会中断或延迟.
我们和我们的员工越来越多地利用社交媒体工具作为内部和外部沟通的手段。
尽管我们努力监控不断发展的社交媒体沟通准则并遵守适用规则,但我们或我们的员工使用社交媒体沟通我们的候选产品或业务可能导致我们违反适用要求的风险。此外,我们的员工可能故意或无意地以可能不符合适用法律法规、我们的政策以及其他法律或合同要求的方式使用社交媒体,这可能导致监管执法行动、责任、导致商业秘密或其他知识产权的损失或导致我们员工、临床试验患者、客户、等人此外,社交媒体上关于我们或我们候选产品的负面帖子或评论可能严重损害我们的声誉、品牌形象和商誉。任何这些事件都可能对我们的业务、前景、财务状况和经营业绩产生重大不利影响,并可能对我们普通股的价格产生不利影响。
与商业化相关的风险
我们的发展工作还处于早期阶段。我们的大多数候选产品都处于临床前开发或发现阶段,我们已获得FDA批准,我们的IND申请OTX—2002,并已启动相关临床试验。如果有的话,我们要花很多年的时间才能将一个候选产品商业化。如果我们无法将候选产品推进临床开发、获得监管部门批准并最终将候选产品商业化,或在这方面遇到重大延误,我们的业务将受到重大损害。
我们的开发工作处于早期阶段,迄今为止,我们的研发工作集中在开发OMEGA平台,确定我们的初始目标疾病适应症和设计我们的初始EC。我们仅对部分项目进行了体内临床前研究,无法保证我们将对其他项目进行临床前体内研究。我们创造产品收入的能力,我们预计这将在很多年内实现,如果有的话,将在很大程度上取决于我们候选产品的成功临床开发和最终商业化,这可能永远不会实现。
在美国开始临床试验取决于FDA接受IND或外国监管机构接受类似的申请,并根据与FDA和其他监管机构的讨论最终确定试验设计。如果FDA或外国监管机构要求我们完成额外的临床前研究,或者我们被要求满足FDA或外国监管机构的其他要求,我们临床试验的开始可能会推迟。即使在我们收到并纳入来自这些监管机构的指导之后
77
当局、FDA或其他监管机构可能不同意我们已满足他们的要求以开始我们的临床试验,或改变他们对我们的试验设计或所选临床终点的可接受性的立场,这可能要求我们完成额外的临床前研究或临床试验,或施加比我们目前预期更严格的批准条件。
我们候选产品的商业化将需要额外的临床前和临床开发以及监管和营销批准。我们进行开发或获得上市批准的能力将取决于我们是否有足够的财政和其他资源来完成必要的临床前研究、IND启用研究或类似研究以及临床试验,以及成功入组和完成临床试验。
如果我们未能及时成功完成其中一项或多项活动或根本无法完成,我们可能会遇到重大延误或无法成功将我们可能开发的任何候选产品商业化,这将对我们的业务造成重大损害。如果我们的候选产品没有获得监管机构的批准,我们可能无法继续运营。
竞争对手的发展可能会使我们的产品或技术过时或缺乏竞争力,或者可能会缩小我们的市场规模。
我们的行业一直以来的特点是广泛的研究和开发努力,快速发展的技术,激烈的竞争和高度重视专有产品。随着新产品进入相关市场,以及先进技术的出现,我们预计我们的候选产品将面临激烈和日益激烈的竞争。我们面临着来自许多不同来源的潜在竞争,包括制药、生物技术和专业制药公司。学术研究机构、政府机构、公共和私营机构也是竞争性产品和技术的潜在来源。我们的竞争对手可能拥有或可能开发出更好的技术或方法,这可能为他们提供竞争优势。这些竞争对手中的许多也可能有已经批准或正在开发的治疗类别的化合物,我们的候选产品瞄准。此外,这些竞争对手中的许多人,无论是单独的还是与他们的合作者一起,可能会经营更大的研发项目,或者拥有比我们更多的财政资源,以及更丰富的经验:
如果这些竞争对手在我们推出更安全、更有效或更便宜的治疗药物之前进入市场,我们的候选产品,如果被批准商业化,可能无法销售或值得继续开发。制药行业的技术经历了迅速而重大的变革,我们预计这将继续下去。我们开发的任何化合物、产品或工艺在我们收回与其开发相关的任何费用之前可能会过时或不经济。我们候选产品的成功取决于产品功效、安全性、可靠性、可用性、时间、监管批准范围、接受度和价格等因素。我们成功的其他重要因素包括开发候选产品的速度、完成临床开发和实验室测试、获得监管部门的批准和生产,以及销售潜在产品的商业数量。
我们可能会面临来自表观遗传医学领域新进入者的竞争。我们还与许多使用其他技术的公司竞争,这些公司的目标是我们目前正在追求的相同适应症。我们预计我们的候选产品将与开发使用各种技术(如CRISPR基因编辑、基因疗法、非编码RNA疗法和小分子表观遗传学)的公司竞争,这些技术包括Alnylam制药公司、Beam治疗公司、Biogen公司、CRISPR治疗股份公司、Editas Medicine,Inc.、Ionis制药公司、Janssen制药公司、辉瑞和Sangamo治疗公司。即使获得批准并商业化,我们的候选产品也可能无法获得医院、医生或患者的市场接受。医院、医生或患者可能会得出结论,认为我们的产品不太安全或有效
78
吸引力不如现有药物。如果我们的候选产品因任何原因得不到市场的认可,我们的收入潜力将会减少,这将对我们的盈利能力产生实质性的不利影响。
我们的许多竞争对手拥有比我们多得多的资本资源、强大的候选产品渠道、成熟的市场地位,以及在研发、制造、临床前和临床测试、获得监管批准和报销以及营销批准的产品方面的专业知识。因此,我们的竞争对手可能会比我们更早实现产品商业化或专利或其他知识产权保护。规模较小或处于初创阶段的公司也可能成为重要的竞争对手,特别是通过与大型和成熟公司的合作安排。这些竞争对手还在招聘和留住合格的临床、监管、科学、销售、营销和管理人员、建立临床试验场地和临床试验患者登记,以及在获取与我们的计划互补或必要的技术方面与我们竞争。如果我们的竞争对手开发和商业化的产品比我们可能开发的任何产品更安全、更有效、副作用更少或更不严重、更方便或更便宜,或者会使我们可能开发的任何产品过时或不具竞争力,我们的商业机会可能会减少或消失。
我们的候选产品可能会比预期的更早面临竞争。
2009年《生物制品价格竞争与创新法》(BPCIA)为与FDA许可的参考生物制品生物相似或可互换的生物制品创建了一条简短的审批途径。根据BPCIA,生物相似产品的申请必须在参考产品首次获得FDA许可的四年后才能提交给FDA。此外,FDA对生物相似产品的批准可能要到该参考产品首次获得许可之日起12年后才能生效。在这12年的独占期内,如果FDA批准竞争产品的完整BLA,包含赞助商自己的临床前数据和来自充分和良好控制的临床试验的数据,以证明其产品的安全性、纯度和效力,另一家公司仍可能销售该参考产品的竞争版本。
我们相信,我们未来的任何根据BLA被批准为生物制品的候选产品都应该有资格获得12年的独家经营期。然而,由于国会的行动或其他原因,这一排他性可能会缩短,或者FDA不会将我们的候选产品视为竞争产品的参考产品,这可能会比预期更早地创造竞争机会。BPCIA的其他方面,其中一些可能会影响BPCIA的排他性规定,也是诉讼的主题。除美国外,各司法管辖区还为监管批准与早先批准的参考产品具有生物相似性的生物制品建立了简化的途径。例如,自2006年以来,欧盟已经建立了一条针对生物仿制药的监管途径。此外,一旦获得批准,生物相似物在多大程度上可以替代我们的任何一种参考产品,其方式类似于非生物制品的传统仿制药替代,将取决于一些仍在发展中的市场和监管因素。
我们候选产品的成功商业化将在一定程度上取决于政府当局和健康保险公司建立的保险范围、足够的补偿水平和定价政策。如果我们的候选产品未能获得或维持承保范围并获得足够的补偿,如果获得批准,可能会限制我们营销这些产品的能力,并降低我们创造产品收入的能力。
与新批准的产品的保险覆盖和报销有关的不确定性很大。在美国,第三方付款人,包括私人和政府付款人,如联邦医疗保险和医疗补助计划,在决定新药和生物制品的覆盖范围方面发挥着重要作用。我们能否成功地将我们的候选产品商业化,在一定程度上将取决于政府卫生行政部门、私人健康保险公司和其他组织为这些产品和相关治疗提供的保险范围和足够的补偿。政府当局和其他第三方付款人,如私人健康保险公司和健康维护组织,决定他们将支付哪些药物并建立报销水平。政府和私人付款人提供的保险范围和报销范围是大多数患者能够负担得起治疗费用的关键。
第三方付款人越来越多地对药品和服务的收费提出挑战,许多第三方付款人可能会拒绝为特定药物和生物制品提供保险和报销,因为有同等的仿制药、生物相似药物或更便宜的疗法可用。有可能一个
79
第三方付款人可能会认为我们的产品是可替代的,并且只会向患者报销价格较低的产品。对于在医生监督下管理的产品,获得保险和适当的补偿可能特别困难,因为此类药物往往与较高的价格相关。即使我们对我们的候选产品表现出更好的疗效或更好的管理便利性,现有第三方疗法的定价可能会限制我们对我们的候选产品收取的费用。这些付款人可能会拒绝或撤销特定产品的报销状态,或将新产品或现有市场产品的价格设定在太低的水平,使我们无法从我们对候选产品的投资中实现适当的回报。如果无法获得报销或仅限量报销,我们可能无法成功地将我们的候选产品商业化,也可能无法为我们的候选产品获得满意的财务回报。
在美国,第三方付款人,包括私人和政府付款人,如联邦医疗保险和医疗补助计划,在决定新药和生物制品的承保和报销范围方面发挥着重要作用。联邦医疗保险计划越来越多地被用作私人和其他政府付款人如何制定新药保险和报销政策的模式。然而,在美国的第三方付款人中,对于产品的覆盖和报销没有统一的政策。因此,产品的承保范围和报销范围因付款人而异。因此,承保范围的确定过程通常是一个耗时且昂贵的过程,需要我们为使用我们的候选产品单独向每个付款人提供科学和临床支持,但不能保证承保范围和足够的补偿将得到一致的应用或首先获得。一些第三方付款人可能需要预先批准新的或创新的药物疗法的承保范围,然后才会向使用此类疗法的医疗保健提供者报销。此外,关于报销的规则和条例经常变化,在某些情况下是在短时间内通知的,我们认为这些规则和条例可能会改变。我们目前无法预测第三方付款人将就我们的候选产品的承保范围和报销做出什么决定。
在美国以外,国际运营通常受到广泛的政府价格控制和其他市场监管,我们相信,欧盟和其他司法管辖区对成本控制举措的日益重视已经并将继续给我们候选产品的定价和使用带来压力。在许多国家,作为国家卫生系统的一部分,医疗产品的价格受到不同的价格控制机制的制约。其他国家允许公司自行定价医疗产品,但监督和控制公司利润。额外的外国价格管制或定价法规的其他变化可能会限制我们能够向我们的候选产品收取的费用。因此,在美国以外的市场,与美国相比,我们候选产品的报销可能会减少,可能不足以产生商业上合理的收入和利润。
此外,美国和海外的政府和第三方付款人加大力度限制或降低医疗成本,可能会导致这些组织限制新批准产品的覆盖范围和报销水平,因此,它们可能无法覆盖或为我们的候选产品提供足够的付款。我们预计,由于管理式医疗保健的趋势、医疗保健组织日益增长的影响力以及额外的立法变化,我们将面临与销售我们的候选产品相关的定价压力。总体上,医疗成本的下降压力变得很大,特别是处方药和生物制品以及外科手术和其他治疗。因此,对新产品的进入设置了越来越高的壁垒。
如果我们不能单独或与第三方合作建立销售、营销和分销能力,我们可能无法成功地将我们的任何候选产品商业化,如果获得批准,我们可能无法产生任何产品收入。
我们销售、营销或分销产品的人员或基础设施有限,而且作为一家公司,我们没有将候选产品商业化的经验。建立和维持这样一个组织的成本可能超过这样做的成本效益。
我们可能会建立自己的重点销售、分销和营销基础设施,以便在美国和世界各地的其他市场营销我们的候选产品(如果获得批准)。建立我们自己的销售、营销和分销能力涉及大量费用和风险,包括我们雇用、留住和适当激励合格人员、产生足够的销售线索、为销售和营销人员提供足够的培训以及有效管理分散在不同地理位置的销售和营销团队的能力。我们内部销售、市场营销和分销能力发展的任何失败或延迟都可能推迟任何产品的推出,这将对我们产品的商业化产生不利影响
80
候选人,如果批准的话。此外,如果我们招募销售队伍并建立营销能力的候选产品的商业发布因任何原因而推迟或没有发生,我们将过早或不必要地产生这些商业化费用。这可能代价高昂,如果我们不能留住或重新定位我们的销售和营销人员,我们的投资将会损失。
可能会阻碍我们将候选产品商业化的因素包括:
如果我们无法或决定不建立内部销售、市场营销和分销能力,或决定不为特定国家这样做,我们可能会寻求合作安排。如果我们追求合作安排,我们的销售将在很大程度上取决于合作者对产品的战略利益,以及合作者成功营销和销售产品的能力。
如果我们无法建立自己的销售团队或获得合作关系以促进我们的任何候选产品的商业化,我们可能被迫推迟候选产品的潜在商业化,或减少我们的销售或营销活动的范围。如果我们选择增加开支,为自己的商业化活动提供资金,我们将需要获得额外的资本,而这些资本可能无法以可接受的条件提供,或根本无法获得。我们可能会在较理想的较早阶段与合作者达成协议,我们可能会被要求放弃任何候选产品的权利或以其他方式同意对我们不利的条款,其中任何条款可能会对我们的业务、经营业绩和前景产生不利影响。
如果我们无法独立或与第三方合作建立足够的销售、营销和分销能力,我们将无法成功地将我们的其他候选产品商业化,可能无法盈利,并可能导致重大额外损失。我们将与许多目前拥有广泛和资金充足的营销和销售业务的公司竞争。如果没有内部团队或第三方的支持来执行市场营销和销售职能,我们可能无法成功地与这些较成熟的公司竞争。
此外,即使我们确实建立了足够的销售、营销和分销能力,但定价模式、供应链和交付机制等行业总体趋势的进展也可能偏离我们的预期。如果这些或其他行业趋势以我们没有预料到或我们没有准备好的方式改变,我们可能无法成功地将我们的候选产品商业化或盈利。
我们未来的增长可能在一定程度上取决于我们打入外国市场的能力,在那里我们将受到额外的监管负担和其他风险和不确定因素的影响。
我们未来的盈利能力可能在一定程度上取决于我们是否有能力将我们的候选产品在包括欧盟在内的国外市场商业化,我们可能依赖于与第三方的合作。在获得外国市场相关监管机构的监管批准之前,我们不被允许营销或推广我们的任何候选产品,我们可能永远不会获得任何候选产品的监管批准。为了在其他国家获得单独的监管批准,我们可能需要遵守这些国家/地区关于我们候选产品的安全性和有效性的众多不同监管要求,以及对我们候选产品的临床试验和商业销售、定价和分销等方面的监管要求,我们无法预测在这些司法管辖区能否成功。如果我们获得批准
81
如果我们的候选产品最终在国外市场实现商业化,我们将面临额外的风险和不确定性,包括:
我们候选产品的海外销售也可能受到政府管制、政治和经济不稳定、贸易限制和关税变化的不利影响。
如果我们的任何候选产品获得商业化批准,我们可能会选择性地与第三方合作,在美国以外的某些司法管辖区销售该产品。我们预计我们将面临与国际制药业务相关的额外风险,包括:
我们在这方面没有经验。此外,欧盟和许多欧盟成员国都提出了复杂的监管、税收、劳动力和其他法律要求,我们需要遵守这些要求。许多美国—总部位于欧洲的生物技术公司发现,在欧盟市场营销自己的产品是非常具有挑战性的。
某些法律和政治风险也是外国行动所固有的。在我们可能开展业务的某些国家,外国政府可能会将私营企业国有化,这是有风险的。在某些国家或地区,恐怖主义活动、政治动乱和战争,以及对这些活动的反应,可能对我们的行动构成比在美国更大的威胁。某些国家/地区的社会和文化规范可能不支持遵守我们的公司政策,包括那些要求遵守实质性法律和法规的政策。此外,我们可能开展业务的国家的总体经济和政治状况的变化对我们的财务业绩和未来增长构成风险。此外,需要确定在美国境外进行商业化的财务和商业上强大的合作伙伴,这些合作伙伴将遵守高度的制造和
82
我们要求的法律和监管合规标准对我们的财务业绩构成风险。随着我们在全球经营业务,我们的成功将在一定程度上取决于我们预测和有效管理这些风险和其他相关风险的能力。不能保证这些因素和其他与我们国际业务有关的因素的后果不会对我们的业务、财务状况或经营结果产生不利影响。
在一些国家,特别是欧盟,处方药的定价受政府控制。在这些国家,在获得药品上市许可后,与政府当局的定价谈判可能需要相当长的时间。为了在某些国家获得报销或定价批准,我们可能需要进行临床试验,比较我们候选产品与其他可用疗法的成本效益。如果我们的产品无法报销,或在范围或金额上受到限制,或者如果定价被设置在不令人满意的水平,我们的业务可能会受到损害,可能会受到重大损害。
针对我们的潜在产品责任诉讼可能会导致我们招致重大责任,并限制我们可能开发的任何产品的商业化。
在临床试验中使用我们的候选产品以及销售我们获得上市批准的任何产品,使我们面临产品责任索赔的风险。消费者、医疗保健提供者、制药公司或销售或以其他方式接触我们产品的其他人可能会对我们提出产品责任索赔。有时,在集体诉讼中,基于具有意外不良影响的产品做出了重大判决。如果我们不能成功地抵御产品责任索赔,我们可能会承担大量责任和费用,而这些费用可能不在保险范围内。此外,无论价值或最终结果如何,产品责任索赔可能导致:
未能以可接受的成本获得或保留足够的产品责任保险以防范潜在的产品责任索赔,可能会阻止或抑制我们单独或与公司合作者开发的产品的商业化。虽然我们计划购买临床试验保险,但我们的保单可能有各种除外条款,我们可能会受到我们没有承保范围的产品责任索赔。我们可能需要支付法院裁定的或在和解协议中协商的任何金额,这些金额超出了我们的承保范围或不在我们的保险范围内,并且我们可能没有或无法获得足够的资本来支付该等金额。即使我们与任何未来的公司合作者达成的协议使我们有权就损失获得赔偿,但在出现任何索赔时,此类赔偿可能无法提供或不充分。
与我们对第三方和制造业的依赖相关的风险
我们生产临床前或临床供应的EC候选药物的能力可能会受到限制,特别是在制造基于mRNA和LNP的治疗药物的需求增加的情况下,这可能会对我们的发展计划产生不利影响。
83
我们依赖第三方CDMO的信使核糖核酸疗法和脂质辅料,一种用作药物或其他活性物质的载体或媒介的脂质,来生产我们的临床前和临床供应的EC候选者。治疗新冠肺炎的疫苗包括信使核糖核酸疫苗和利用脂肪辅料的疫苗。美国食品和药物管理局已经批准了几种新冠肺炎疫苗。因此,对这些CDMO生产新冠肺炎疫苗的需求是前所未有的,而基于m RNA和lnP的疗法的产能是有限的,而且可能会受到制造设施和材料的潜力的进一步限制,这些设施和材料将根据1950年的《国防生产法》或同等的外国立法被征用,这可能会使我们计划中的临床试验所需的产品更难获得材料或制造槽。虽然我们正在努力为我们预期的临床前和临床开发获得足够的ECs供应,但我们可能会遇到供应限制和中断,因为制造商将供应新冠肺炎疫苗置于ECs之上。如果我们不能以合理的价格或及时或按我们希望的数量获得所需的供应,我们完成我们的EC候选人的开发,或者如果我们获得监管部门对我们的EC候选人的批准,将他们商业化的能力可能会受到实质性的不利影响。
我们的EC候选产品基于新技术,可能复杂且难以制造。我们可能会在制造、产品放行、保质期、测试、储存、供应链管理或运输方面遇到困难。
由于我们技术的新颖性以及在大规模生产方面的经验有限,我们可能会在制造、产品放行、保质期、测试、储存和供应链管理或运输方面遇到困难。这些困难可能是由于许多原因造成的,包括但不限于大规模生产批次的复杂性、设备故障、原材料和辅料的选择和质量、分析检测技术和产品不稳定性。因此,我们的EC候选药物的临床前或临床开发可能会被严重延迟,或者我们可能需要使用新配方的药物开始一项新的研究或试验。
产生包封在LNP中的mRNA编码EC候选物的过程是复杂的,并且如果不在良好控制的条件下开发和生产,可能会不利地影响药理学活性。此外,我们尚未以商业规模生产EC。我们可能会在扩大生产过程中遇到困难,从而可能影响临床和商业供应。
随着我们继续为我们的药品和药品开发生产工艺,我们对生产工艺的更改可能会反过来影响药品的规格和稳定性。我们生产工艺的改变可能会导致批量不合格,这可能会导致我们的临床前研究或任何临床试验的大幅延迟。我们的候选EC可能会被证明具有稳定性,从而导致最终批准的EC的保质期低于预期(如果有的话)。这带来了供应需求、浪费库存和更高的商品成本方面的风险。
我们的产品和产品中间体对温度非常敏感,我们可能会发现我们的任何或所有产品的稳定性低于预期。我们还可能发现运输条件对产品质量产生负面影响。这可能需要更改我们的一个或多个EC候选产品的配方或生产工艺,并导致临床或商业供应的延迟或中断。此外,与此类运输服务有关的费用以及供应商数量有限,也可能增加供应中断的额外风险。
我们的创新率很高,这已经导致并将继续导致高度的技术变化,这可能会对临床开发期间和之后的产品可比性产生负面影响。此外,技术变化可能会推动对新制造基础设施的变更、修改或采购的需求,.
在可预见的未来,我们将依赖第三方为我们的研究计划、临床前研究和临床试验制造和供应材料,我们与其中许多公司没有长期合同。这种对第三方的依赖增加了这样的风险,即我们将没有足够数量的此类材料,包括用于联合疗法、候选产品或我们可能开发和商业化的任何疗法的药物供应,或者我们无法以可接受的成本获得此类供应,这可能会推迟、阻止或损害我们的开发或商业化努力。
尽管我们继续评估开发我们自己的制造设施的计划,但我们预计至少在未来几年内,我们将依赖第三方为我们计划的临床试验以及临床前和临床开发生产材料。我们希望部分依赖第三方进行商业生产,如果有任何
84
我们的候选产品获得了市场批准。我们没有与我们目前用来提供临床前和临床材料的任何第三方制造商签订长期协议,我们以采购订单的方式购买任何所需的材料。其中某些制造商对我们的生产至关重要,无论这些制造商是否被我们的竞争对手抢走,或者无法以可接受的成本或质量获得数量,都可能延误、阻止或削弱我们及时进行临床前研究或临床试验的能力,并将对我们的开发和商业化努力产生实质性和不利影响。
我们预计,在可预见的未来,我们将继续部分依赖第三方制造商,为我们获得营销批准的任何候选产品提供商业供应。我们可能无法与第三方制造商维持或建立所需的协议,或无法以可接受的条款这样做。即使我们能够与第三方制造商达成协议,依赖第三方制造商也会带来额外的风险,包括:
我们不能完全控制我们的合同制造伙伴的制造过程的所有方面,并且依赖我们的合同制造合作伙伴遵守cGMP或类似的国外法规来制造我们的候选产品。第三方制造商可能无法遵守cGMP法规或美国以外的类似法规要求。如果我们的合同制造商不能成功地生产符合我们的规格和FDA或其他机构严格监管要求的材料,他们将无法确保和/或保持其制造设施的授权。此外,我们无法控制我们的合同制造商保持足够的质量控制、质量保证和合格人员的能力。如果FDA或类似的外国监管机构没有授权这些设施用于生产我们的候选产品,或者如果它在未来撤回任何此类授权,我们可能需要寻找替代制造设施,这将严重影响我们开发、获得营销批准或营销我们的候选产品的能力(如果获得批准)。我们或我们的第三方制造商未能遵守适用的法规,可能会导致对我们实施制裁,包括罚款、禁令、民事处罚、延误、暂停或撤回批准、吊销许可证、扣押或召回候选产品或药物、操作限制和刑事起诉,任何这些都可能对我们的候选产品或药物的供应造成重大不利影响,并损害我们的业务和运营结果。.
我们继续评估收购和建立我们自己的制造设施和基础设施的计划,以替代或补充依赖CDMO来制造我们的候选产品。任何建立我们自己的制造设施和基础设施的计划都将是昂贵和耗时的,我们可能不会成功。
85
我们可能会决定租用一家工厂来建造一座制造设施,作为替代方案,或作为我们依赖CDMO生产临床前和临床需要的药物物质的补充。如果签订租约,我们计划翻新和定制生产设施,以供我们使用。我们预计,建造我们自己的制造设施将为我们提供更好的临床前研究和临床试验材料供应控制,使工艺更改能够更快地实施,并允许更好的长期利润率。然而,作为一家公司,我们没有建造制造设施的经验,而且可能永远不会成功地建立我们自己的制造设施或能力。因此,我们还需要雇佣更多的人员来管理我们的运营和设施,并开发必要的基础设施,以继续我们候选产品的研发、制造和最终商业化(如果获得批准)。作为一家公司,我们没有建立、建造或最终管理制造设施的经验。如果我们没有选择正确的位置,或者如果我们没有签订租赁协议,或者我们没有以有效的方式完成计划的翻新和定制,或者没有招聘到所需的人员并总体上有效地管理我们的增长,我们候选产品的开发和生产可能会被削减或推迟。即使我们成功了,我们的制造能力也可能受到成本超支、意外延误、设备故障、劳动力短缺、自然灾害、电力故障和许多其他因素的影响,这些因素可能会阻止我们实现制造战略的预期好处,并对我们的业务产生实质性的不利影响。
此外,FDA和其他外国监管机构可能会要求我们在任何时间提交任何批次的经批准产品的样品,以及显示适用测试结果的协议。在某些情况下,FDA或其他外国监管机构可能会要求我们在相关机构授权发布之前不要分发大量产品。制造过程中的微小偏差,包括那些影响质量属性和稳定性的偏差,可能会导致产品发生不可接受的变化,从而导致批量故障或产品召回。批量失败或产品召回可能会导致我们推迟临床试验或产品发布,这可能会让我们付出高昂的代价,否则会损害我们的业务、财务状况、运营结果和前景。我们制造过程中的问题可能会限制我们满足临床和市场对我们产品的需求的能力。
我们还可能遇到雇用和留住操作我们的制造流程所需的经验丰富的科学、质量控制和制造人员的问题,这可能会导致生产延迟或难以保持符合适用的法规要求。
我们的制造工艺或设施中的任何问题都可能使我们成为潜在合作伙伴(包括较大的制药公司和学术研究机构)的吸引力较低的合作伙伴,这可能会限制我们获得更多有吸引力的开发项目.
作为一家管理制造设施的公司,我们没有经验。
经营我们自己的生产设施将需要大量资源,而我们没有作为一家公司管理生产设施的经验。部分由于缺乏经验,我们无法确定我们的生产计划是否会按时完成(如果有的话),或者我们自己的生产工厂为我们计划的临床试验生产候选产品是否会按时开始或完成(如果有的话)。部分由于我们缺乏经验,我们可能有不可接受或不一致的产品质量成功率和产量,我们可能无法保持足够的质量控制,质量保证和合格的人员。此外,如果我们将来将一个或多个候选产品从目前的CDMO切换到我们自己的生产设施,我们可能需要进行额外的临床前研究,以将我们的改良候选产品与早期版本连接起来。未能成功获得和运营我们计划中的生产设施可能会对我们候选产品的商业可行性产生不利影响。
我们或我们的第三方制造商可能无法成功地扩大我们候选产品的生产规模,以足够的质量和数量,这可能会损害我们候选产品的临床进展和商业化。
为了对我们的候选产品进行临床试验,并将任何获得批准的候选产品商业化,我们和我们的制造合作伙伴需要大量生产这些产品。然而,我们或他们可能无法及时或具有成本效益地成功提高我们的任何候选产品的制造能力,或者根本无法。此外,如上所述,在扩大活动期间可能会出现质量问题。如果我们或任何制造合作伙伴不能以足够的质量和数量成功地扩大我们的候选产品的生产规模,这些候选产品的开发、测试和临床试验可能会被推迟或不可行,以及任何由此产生的监管批准或商业推出
86
产品可能会延迟或无法获得,这可能会严重损害我们的业务。供应来源可能会不时中断,如果中断,就不能确定能否在合理的时限内以可接受的费用恢复(部分或全部)供应,或者根本不能恢复供应。如果我们无法获得或保持第三方制造来为我们的候选产品进行商业供应,或者以商业上合理的条款这样做,我们可能无法成功地开发和商业化我们的候选产品。
我们的候选产品中使用的脂肪辅料的供应商数量有限,我们的某些供应商对我们的生产至关重要。如果我们失去一家关键供应商,可能会对我们完成候选产品开发的能力产生实质性的不利影响。如果我们的任何候选产品获得监管部门的批准,我们将需要扩大脂肪辅料的供应,以便将它们商业化。
我们的候选产品的脂质赋形剂组分的供应商数量有限。我们也没有与所有脂质供应商签订长期供应协议。我们可能无法为候选产品的脂质赋形剂组分建立额外的供应来源,或可能无法以可接受的条款提供。
我们候选产品的脂质辅料供应商数量有限。如果有必要或需要从替代供应商处获取脂质辅料,我们可能无法以商业上合理的条款获取脂质辅料(如果有的话)。重新设计我们的制造工艺以与另一家公司合作也可能需要大量的时间和费用,而重新设计工艺可能会引发进行额外研究的需要,如可比性或桥接研究。此外,我们的某些供应商对我们的生产至关重要,这些供应商流失给我们的竞争对手或其他方面将对我们的发展和商业化努力产生重大不利影响。
我们依赖,并预计将继续依赖第三方进行我们临床前研究的某些方面,并将依赖第三方进行我们计划的临床试验。如果第三方未能根据GCP及时进行计划的临床试验,可能会延误或阻碍我们为候选产品寻求或获得监管批准或将其商业化的能力。
我们一直依赖并计划继续依赖第三方进行我们的临床前研究的某些方面,并将依赖第三方进行我们计划中的临床试验,并监测和管理我们正在进行的临床前和计划中的临床项目的数据。我们依赖这些方执行我们的临床前研究,并将依赖这些方执行我们计划的临床试验,并仅控制其活动的某些方面。尽管如此,我们有责任确保我们的每项研究和试验都按照适用的方案以及法律、监管和科学标准进行,我们对CRO和其他第三方的依赖并不免除我们的监管责任。我们和我们的CRO将被要求遵守GCP要求,这些要求是FDA和类似的外国监管机构针对临床开发中候选产品实施的法规和指南。监管机构通过定期检查试验申办者、主要研究者和试验中心来执行这些GCP。如果我们或我们的任何CRO或试验中心未能遵守适用的GCP,我们的临床试验中生成的临床数据可能被视为不可靠,FDA或类似的外国监管机构可能要求我们在批准上市申请之前进行额外的临床试验。我们不能向您保证,在特定监管机构检查后,该监管机构将确定我们的任何临床试验符合GCP法规。此外,我们的临床试验必须使用根据cGMP法规或美国境外类似的外国法规生产的产品进行。如果我们未能遵守这些法规,可能需要我们重复进行临床试验,这将延迟监管审批程序。
进行我们计划中的临床试验或临床前研究的任何第三方不是也不会是我们的员工,并且,除了我们与该等第三方达成的协议向我们提供的补救措施外,我们不能保证任何该等CRO、研究人员或其他第三方将为该等试验投入足够的时间和资源或按合同要求执行。如果这些第三方中的任何一方未能在预期的最后期限内完成、遵守我们的临床方案或满足监管要求,或以其他方式表现不合格,我们计划的临床试验可能会被延长、推迟或终止。此外,与我们签约的许多第三方也可能与其他商业实体有关系,包括我们的竞争对手,他们可能还在为这些实体进行临床试验或其他产品开发活动,这可能会损害我们的竞争地位。此外,我们计划的临床试验的首席研究人员可能会不时担任我们的科学顾问或顾问,并可能获得与此类服务相关的现金和现金等价物或股权补偿。如果这些关系和任何相关的补偿导致
87
如果我们认为或实际存在利益冲突,或FDA或类似的外国监管机构得出结论认为财务关系可能影响了试验的解释,在适用的临床试验地点生成的数据的完整性可能会受到质疑,临床试验本身的效用可能会受到威胁,这可能会导致我们向FDA提交的任何BLA或我们向外国监管机构提交的任何类似的外国监管申请被延迟或拒绝。任何这样的延迟或拒绝都可能阻止我们将候选产品商业化。
如果我们与该等第三方的任何关系终止,我们可能无法与其他第三方订立安排,或以商业上合理的条款订立安排。更换或增加额外的CRO、调查人员和其他第三方涉及额外的成本,需要管理时间和重点。此外,当新的CRO开始工作时,有一个自然的过渡期。因此,出现延误,这可能会严重影响我们满足预期临床前和临床开发时间表的能力。虽然我们谨慎管理与CRO、调查人员和其他第三方的关系,但无法保证我们将来不会遇到挑战或延误,或者这些延误或挑战不会对我们的业务、财务状况和前景造成重大不利影响。
我们与第三方合作开发我们的候选产品,并将其商业化。我们可能无法成功维护现有的协作关系以及建立和维护未来的协作关系,这可能会极大地限制我们成功开发和商业化我们的候选产品的能力。
我们已经签订了合作协议,未来可能会为我们候选产品的开发和商业化寻求其他合作关系。例如,2021年11月,我们与PM(CF)Explorations,Inc.签订了为期五年的合作协议;2022年10月,我们与日东电工公司签订了合作和许可协议;2023年12月,我们与诺和诺德A/S、先锋医药08公司和其他各方签订了研究与合作协议。根据这些和任何类似的未来与任何第三方的安排,我们已经或将有可能共享或有限地控制我们的合作者投入到我们可能寻求与他们共同开发的任何候选产品的开发或潜在商业化的资源的数量和时间。我们从与商业实体的这些安排中产生产品收入的能力将取决于我们的合作者成功履行这些安排中分配给他们的职能的能力。我们无法预测我们参与的任何合作的成功与否。涉及我们候选产品的协作给我们带来了以下风险:
88
我们在寻求与其他拥有更多财务、营销、销售、技术或其他业务资源的公司进行适当合作时,可能会面临激烈的竞争。生物技术和制药公司之间的业务合并也导致潜在合作者的数量减少。此外,谈判过程既耗时又复杂,我们可能无法及时、以可接受的条件谈判合作,甚至根本无法谈判。如果我们无法做到这一点,我们可能不得不减少我们正在寻求合作的候选产品的开发,或推迟其潜在的商业化,或缩小任何销售或营销活动的范围,或增加我们的支出,并自费进行开发或商业化活动。如果我们选择增加我们的支出,为我们自己的开发或商业化活动提供资金,我们可能需要获得额外的资本,这些资本可能无法以可接受的条件提供给我们,或者根本无法获得。如果我们没有足够的资金,我们可能无法进一步开发候选产品或将它们推向市场并产生产品收入。
如果我们或我们的协作者选择不行使根据协议授予的权利,或者如果我们或我们的协作者无法将候选产品成功集成到现有运营中,则我们可能无法实现现有或未来合作的好处。此外,如果我们与我们的任何合作者的协议终止,我们对该合作者授权给我们的技术和知识产权的访问可能会受到限制或完全终止,这可能会推迟我们利用合作者的技术或知识产权继续开发我们的候选产品,或者要求我们完全停止开发这些候选产品。我们也可能会发现更难找到合适的替代合作者或吸引新的合作者,我们的发展计划可能会被推迟,或者我们在商业和金融界的形象可能会受到不利影响。任何合作者也可能面临与产品开发、监管审批和商业化相关的许多风险,这些风险在本“风险因素”一节中有描述,而对我们合作者的任何负面影响都可能对我们产生不利影响。
89
我们的员工和独立承包商,包括主要调查人员、CDMO、CRO、顾问、供应商和我们可能从事的与研究、开发、监管、制造、质量保证和其他药品职能和商业化相关的任何第三方,可能会从事不当行为或其他不当活动,包括不遵守监管标准和要求,这可能会对我们的业务产生实质性的不利影响。
我们的员工和独立承包商,包括主要研究者、CDMO、CRO、顾问、供应商以及我们可能参与的与研究、开发、监管、制造、质量保证和其他制药职能和商业化有关的任何第三方的不当行为,可能包括故意、鲁莽或疏忽行为或违反以下规定的未经授权的活动:(i)FDA和其他类似监管机构的法律和法规,以及外国司法管辖区的类似医疗保健法律和法规,包括要求向这些机构报告真实、完整和准确信息的法律;(ii)制造标准;(iii)数据隐私、安全、欺诈和滥用以及其他医疗保健法律和法规;或(iv)要求报告真实、完整和准确的财务信息和数据的法律。具体而言,医疗保健行业的销售、营销和业务安排受到广泛的法律法规的约束,旨在防止欺诈、不当行为、回扣、自我交易和其他滥用行为。这些法律和法规可能限制或禁止各种定价、折扣、营销和促销、销售佣金、客户奖励计划和其他业务安排。受这些法律约束的活动还可能涉及不当使用或歪曲在临床前研究或临床试验过程中获得的信息、在临床前研究或临床试验中创建欺诈性数据或非法挪用药品,这可能导致监管制裁并对我们的声誉造成严重损害。我们并不总是能够识别和阻止员工和其他第三方的不当行为,我们为发现和防止此类活动而采取的预防措施可能无法有效控制未知或未管理的风险或损失,或保护我们免受政府调查或因未能遵守此类法律或法规而引起的其他行动或诉讼。此外,我们面临个人或政府可能指控此类欺诈或其他不当行为的风险,即使没有发生。如果针对我们提起任何此类诉讼,并且我们未能成功地保护自己或维护我们的权利,这些诉讼可能会对我们的业务和运营结果产生重大影响,包括施加重大民事、刑事和行政处罚、损害赔偿、罚款、剥夺财产、可能被排除参与医疗保险、医疗补助、医疗补助、其他美国联邦医疗保健计划或其他司法管辖区的医疗保健计划、诚信监督和报告义务,以解决不遵守指控、个人监禁、其他制裁、合同损害、声誉损害、利润和未来收入减少以及我们业务的缩减。
如果我们的CDMO以导致伤害或违反适用法律的方式使用有害和生物材料,我们可能会承担损害赔偿责任。
我们的研究和开发活动涉及我们的制造商对潜在危险物质的控制使用,包括化学和生物材料。我们的制造商受美国及其运营所在国家的联邦、州和地方法律法规的约束,管理医疗和危险材料的使用、制造、储存、搬运和处置。尽管我们相信制造商使用、处理、储存和处置这些材料的程序符合法律规定的标准,但我们不能完全消除医疗或危险材料造成的污染或伤害风险。由于任何此类污染或伤害,我们可能会承担责任,或者地方、城市、州或联邦当局可能会限制这些材料的使用并中断我们的业务运营。一旦发生事故,我们可能被要求承担损害赔偿责任或罚款,责任可能超出我们的资源范围。一般来说,我们不为医疗或危险材料引起的责任投保。遵守适用的环境法律法规代价高昂,当前或未来的环境法规可能会损害我们的研究、开发和生产努力,从而可能损害我们的业务、前景、财务状况或运营结果。
有关知识产权的风险
如果我们无法就我们的技术和候选产品获得、维护、执行和充分保护我们的知识产权,或者如果获得的专利或其他知识产权保护的范围不够广泛,我们的竞争对手可能会开发和商业化与我们相似或相同的技术和产品,我们成功开发和商业化我们的技术和候选产品的能力可能会受到不利影响。
90
我们依靠专利、商业秘密保护和保密协议的组合来保护我们的知识产权,并防止他人复制我们的候选产品,或其使用或制造,或任何和任何未来的候选产品,我们的成功在很大程度上取决于我们在美国和其他国家获得和维持有关候选产品的专利保护的能力。
专利申请程序昂贵、耗时且复杂,我们可能无法以合理成本或及时的方式提交、起诉、维护、执行或许可所有必要或可取的专利申请。虽然我们与有权访问我们研发成果的机密或专利方面的各方(例如我们的员工、CRO、顾问、科学顾问和其他承包商)签订了保密协议,但这些各方中的任何一方都可能违反协议并在提交专利申请前披露该等成果,从而危及我们寻求专利保护的能力。此外,科学文献中的发现发表往往落后于实际发现,美国和其他司法管辖区的专利申请通常要在申请后18个月才公布,有些专利申请在发布之前一直如此。因此,我们不能确定我们是第一个提出我们专利或待审专利申请中要求的发明的人,或者我们是第一个提出与发明或候选产品相关的专利申请的人。此外,如果我们在监管审批方面遇到延误,我们可以在专利保护下销售候选产品的时间可能会缩短。
专利在生物技术和制药领域的优势涉及复杂的法律、事实和科学问题,并且可能是不确定的。我们有可能在获得专利保护之前,无法确定我们的研发成果中可申请专利的方面。我们拥有的专利申请可能无法导致在美国或其他国家发布的专利,其权利要求涵盖我们的候选产品。我们无法保证已经找到与我们的专利和专利申请相关的所有潜在相关的现有技术,这可能会使专利无效或阻止专利从未决专利申请中发布。即使专利确实成功发布,即使这些专利涵盖了我们的候选产品,第三方也可能质疑这些专利的发明人、所有权、有效性、可转让性或范围,这可能导致这些专利被缩小或无效,或被认为不可执行。我们的未决和未来的专利申请可能不会导致发布保护我们的技术或候选产品或有效阻止他人将竞争性技术和候选产品商业化的专利。此外,我们提交的任何美国临时专利申请不符合资格成为已发布专利,除非我们在提交相关临时专利申请后的12个月内提交非临时专利申请。如果我们没有及时提交任何非临时专利申请,我们可能会失去关于临时专利申请的优先权日期以及临时专利申请中披露的发明的任何专利保护。
此外,即使它们没有受到挑战,我们的专利和专利申请也可能无法充分保护我们的知识产权,为我们的候选产品提供排他性,或阻止其他人围绕我们的主张进行设计。此外,不能保证第三方不会在不侵犯我们的专利的情况下创造类似或替代的产品或方法来实现类似的结果。这些结果中的任何一个都可能削弱我们阻止第三方竞争的能力,第三方竞争可能会对我们的业务产生不利影响。
如果我们持有的与我们的计划或候选产品相关的专利申请未能发布,如果我们当前或未来发布的专利的保护广度或强度受到威胁,或者如果它们未能为我们的候选产品提供有意义的排他性,可能会阻止公司与我们合作开发候选产品,或威胁我们将当前或未来候选产品商业化的能力。我们最近提交了几项涉及我们候选产品的专利申请。我们不能提供任何保证,如果有的话,将导致已颁发的专利、任何此类专利的广度,或任何已颁发的专利是否将被发现无效、不可强制执行或将受到第三方的威胁。任何对这些专利或我们拥有的任何其他专利的成功反对,都可能剥夺我们成功将我们可能开发的任何候选产品商业化所必需的权利。
专利的颁发并不确定其发明人、所有权、范围、有效性或可转让性,我们的专利可能会在美国和国外的法院或专利局受到质疑。此外,专利的颁发并不赋予我们实施专利发明的权利,因为第三方可能拥有阻止性专利,这可能会阻止我们销售我们的候选产品(如果获得批准),或实施我们自己的专利技术。
美国范围广泛的专利改革立法,包括2011年的《莱希-史密斯美国发明法》或《莱希-史密斯法案》,可能会增加我们知识产权的强度或可执行性的不确定性,以及保护它的成本。Leahy-Smith法案包括对美国专利的一些重大修改
91
法律,包括影响专利申请起诉方式和专利诉讼的条款。根据《莱希-史密斯法案》,美国从“先发明”转变为“先申请”制度,用于在要求同一发明的不同当事人提交两项或更多专利申请时,决定哪一方应被授予专利。这将要求我们在从发明到提交专利申请的过程中迅速前进,并勤奋地提交专利申请,但情况可能会阻止我们迅速提交或起诉关于我们发明的专利申请。《莱希-史密斯法案》还扩大了符合现有技术的披露范围。此外,如果第三方在2013年3月16日《Leahy-Smith Act》适用条款生效之前提交了专利申请,第三方可以在美国启动干预程序,以确定它是否是我们专利申请权利要求所涵盖的任何主题的第一个发明。我们还可能需要向美国专利商标局提交第三方预先发行的现有技术。
Leahy—Smith法案首次建立了新的程序来质疑美国已发布的专利,包括授予后审查、各方间审查和派生程序,这些程序是在美国专利商标局进行的对抗性程序,一些第三方一直在使用这些程序来取消竞争对手的已发布专利的选定或所有权利要求。对于优先权日为2013年3月16日或更晚的专利,我们所有的专利申请都有,第三方可以在专利发布后的9个月窗口内提交授权后复审申请。如果专利是在2013年3月16日之前提交的,可以在专利发布后立即提交双方审查申请。对于优先权日为2013年3月16日或更晚的专利,可以在提交授权后复审申请的9个月期限届满后提交各方复审申请。授予后复审程序可以基于任何质疑理由提起,而当事人之间的复审程序只能基于已发表的现有技术提出质疑。在美国专利商标局的这些对抗性诉讼包括在美国联邦法院诉讼中不推定美国专利有效性的情况下对专利要求进行复审。USPTO发布了一项最终规则,于2018年11月13日生效,宣布它现在将使用美国联邦法院目前使用的相同的权利要求构造标准来解释USPTO诉讼中的专利要求,这是所用词语的普通和普通含义。如果我们的任何专利在此类USPTO程序中受到第三方的质疑,我们不能保证我们将成功地为该专利辩护,这将导致我们丧失被质疑的专利权,包括丧失排他性,或者专利权利要求被缩小、无效或无法执行。这可能会限制我们阻止他人使用或商业化类似或相同技术和产品的能力,或限制我们的技术和产品候选专利保护期限。此类程序也可能导致大量成本,并需要我们的科学家和管理层大量时间,即使最终结果对我们有利。
由于上述所有情况,我们专利权的发行、范围、有效性、可转让性和商业价值高度不确定,这可能对我们的业务、财务状况、经营业绩和前景造成重大不利影响。
第三方可能获得或控制可能阻碍或限制我们技术或产品开发的知识产权。第三方对知识产权侵权、挪用或其他侵权行为的索赔可能会导致大量成本,或阻碍或推迟我们的开发和商业化努力。
我们的商业成功在一定程度上取决于我们避免实际和指控侵犯、挪用或以其他方式侵犯第三方的专利和其他专有权。在美国国内外,生物技术和制药行业中有大量涉及专利和其他知识产权的诉讼,包括专利侵权诉讼、干预、反对、复审、授权后和各方之间的审查程序,在美国专利商标局和在外国司法管辖区的类似诉讼,如在欧洲专利局或欧洲专利局的反对。在我们正在寻求开发候选者的领域中,存在着大量由第三方拥有的美国和外国颁发的专利和未决的专利申请。许多依赖知识产权的行业的公司,包括制药业,都利用知识产权诉讼作为一种手段,以获得相对于竞争对手的优势。随着生物技术和制药行业的扩张和专利的颁发,以及我们作为一家上市公司获得更高的知名度和市场曝光率,我们的候选产品可能会受到侵犯第三方专利权的指控的风险增加。一些索赔人可能拥有比我们多得多的资源,并可能比我们能够在更大程度上和更长时间内承受复杂的知识产权诉讼费用。此外,只专注于通过强制执行专利权来提取专利费和和解的专利控股公司可能会针对我们。
92
第三方可能声称我们未经授权使用其专有技术。可能有第三方专利或专利申请,声称物质成分、药物递送、制造方法或治疗方法与我们候选产品的使用或生产有关。我们不能保证我们的技术、产品、成分及其使用不会或不会侵犯、盗用或以其他方式侵犯第三方专利或其他知识产权。由于专利申请可能需要很多年的时间才能发布,因此目前可能有一些未决的专利申请,这些专利可能会导致我们的候选产品可能会侵犯我们的专利。此外,第三方可能在未来获得专利,并声称使用我们的技术侵犯了这些专利。已公布的待决专利申请可以在一定限制的情况下进行修改,以涵盖我们的候选产品或我们的候选产品的使用。专利权的范围在发布后仍受解释的限制,这取决于法律解释、专利中的书面披露和专利的申请历史。我们对专利或待审申请的相关性或范围的解释可能不正确,这可能会对我们营销候选产品的能力产生负面影响。为了在联邦法院成功地质疑美国专利的有效性,我们需要克服有效性推定。由于这一负担很高,要求我们提供明确和令人信服的证据证明任何此类美国专利要求的无效性,因此不能保证具有管辖权的法院会使任何此类美国专利的要求无效。如果任何第三方专利被具有管辖权的法院持有,涵盖我们任何候选产品的物质组成、我们任何候选产品的制造工艺或我们任何候选产品的使用方法,任何此类专利的持有人可能会阻止我们将此类候选产品商业化的能力,除非我们获得适用专利项下的许可。这些专利可能根本无法获得,或以商业上合理的条款获得,或直到这些专利到期为止。
提起诉讼或有争议的程序的法律门槛很低,因此,即使诉讼或程序成功可能性很低,也可能提起,并需要大量资源进行辩护。诉讼和有争议的程序也可能是昂贵和耗时的,我们在这些程序中的对手可能有能力投入更多的资源来起诉这些法律行动。如果我们的候选产品接近商业化,并且随着我们作为上市公司获得更大的知名度,卷入此类诉讼和诉讼的风险可能会增加。第三方可以根据现有专利或将来可能授予的专利对我们提出侵权索赔,无论此类索赔的价值如何。我们可能不知道与我们的技术和候选产品及其使用可能相关的所有知识产权,或者我们可能错误地得出第三方知识产权无效的结论,或者我们的活动和候选产品没有侵犯、盗用或以其他方式侵犯此类知识产权。因此,我们不确定我们的技术和产品候选人,或我们的开发和商业化,不会侵犯,盗用,或以其他方式侵犯任何第三方的知识产权。
对我们提出索赔的各方可能会获得禁令或其他公平救济,这可能会有效地阻止我们进一步开发和商业化我们的一个或多个候选产品和/或损害我们的声誉和财务业绩。对这些索赔的辩护,无论其是非曲直,都可能涉及巨额诉讼费用,并可能从我们的业务中大量转移管理层和员工资源。此外,可能会公布听证会、动议或其他临时程序或事态发展的结果,如果证券分析师或投资者认为这些结果是负面的,可能会对我们普通股的价格产生重大不利影响。如果针对我们的侵权索赔成功,我们可能必须支付巨额损害赔偿,包括故意侵权的三倍损害赔偿金和律师费、支付特许权使用费、重新设计我们的侵权产品、在涉及注册商标的索赔中重新命名我们的产品候选产品,或者从第三方获得一个或多个许可证,这些可能需要大量的时间和金钱支出,并且可能是不可能的或在技术上不可行的。此外,我们可能无法以商业上合理的条款或根本无法获得任何所需的许可证。即使我们能够获得许可,它也可能是非排他性的,从而使我们的竞争对手和其他第三方能够访问向我们许可的相同技术;或者,或者另外,它可能包括阻碍或摧毁我们在商业市场上成功竞争的能力的条款。上述任何一项都可能对我们的业务、财务状况、经营结果和前景产生实质性的不利影响。
专利条款可能不足以在足够的时间内保护我们在产品上的竞争地位。
任何个别专利的期限取决于授予该专利的国家的适用法律。在美国,只要及时支付所有维护费,专利的有效期通常为自其申请提交日起20年或最早要求的非临时申请日。在某些情况下可能会提供扩展
93
在这种情况下,专利的有效期是有限的,因此,它提供的保护也是有限的。考虑到新产品候选产品的开发、测试和监管审查所需的时间,保护这些候选产品的专利可能会在这些候选产品商业化之前或之后不久到期。对于有资格延长专利期限的专利,我们预计会在美国和其他国家/地区(如果有)寻求延长专利期限,但不能保证我们将获得我们寻求的任何专利期限延长,或任何此类专利期限延长将为我们提供任何竞争优势。
如果我们没有根据《哈奇-瓦克斯曼法案》在美国和外国根据类似的法律获得专利期延长,从而可能延长我们候选产品的营销排他性期限,我们的业务可能会受到损害。
在美国,涵盖FDA批准的药物或生物的专利可能有资格延长期限,旨在恢复在FDA进行的上市前监管审查过程中丢失的专利期。根据我们候选产品的FDA上市批准的时间、持续时间和条件,我们的一项或多项美国专利可能有资格根据1984年的《药品价格竞争和专利期限恢复法》或《哈奇-瓦克斯曼法案》(Hatch-Waxman Act)获得有限的专利期延长,该法案允许涵盖经批准产品的专利最多延长五年,作为对产品开发和FDA监管审查过程中失去的有效专利期的补偿。专利期限的延长不得超过自产品批准之日起14年的剩余期限,只能延长已批准的药品、其使用方法或者制造方法的权利要求。在欧盟,我们的候选产品可能有资格根据类似的法律延长期限。然而,在任一司法管辖区,如果我们未能在适用的最后期限内提出申请、未能在相关专利到期前提出申请或未能满足适用的要求,我们可能得不到延期。即使我们获准延期,延期的期限也可能比我们要求的要短。如果我们无法获得专利期延长,或者如果任何此类延长的期限少于我们的要求,我们可以对该产品行使专利权的期限实际上将缩短,我们的竞争对手可能会更快获得市场竞争产品的批准。由此导致的适用产品多年收入的减少可能是巨大的.
我们依赖于从别人那里获得许可的专有技术。如果我们失去现有的许可证,我们可能无法继续开发我们的候选产品。
我们依赖于专利、专有技术和专有技术,既有我们自己的,也有别人授权的。
我们在很大程度上依赖于我们与旗舰先锋创新V公司或旗舰公司Whitehead Institute for Biomedical Research(WIBR)、Acuitas Treateutics,Inc.(Acuitas Treateutics,Inc.)和Nitto Denko Corporation(Nitto)达成的协议,包括根据这些协议授予的许可证。这些许可证可能会在某些条件下终止。这些许可证的任何终止都可能导致重大权利的丧失,并可能损害我们将候选产品商业化的能力。
我们还可能在未来与其他方签订额外协议,包括许可协议,对我们施加尽职调查、开发和商业化时间表、里程碑付款、特许权使用费、保险和其他义务。我们亦有责任在指定时间内,就我们使用领域的特许产品达成若干发展里程碑。如果我们未能遵守我们对Flagship、WIBR、Acuitas、Nitto或我们任何其他当前或未来的许可人或合作者的义务,我们的交易对手可能有权终止这些协议,在这种情况下,我们可能无法开发、生产或销售这些协议涵盖的任何候选产品。这可能对根据任何此类协议开发的候选产品的价值产生不利影响。终止这些协议或减少或取消我们在这些协议下的权利可能会导致我们不得不谈判新的或恢复的协议,条件较差,或导致我们失去我们在这些协议下的权利,包括我们对重要知识产权或技术的权利。
我们依靠Flagship、WIBR、Acuitas和Nitto提交和起诉专利申请、维护专利以及以其他方式保护我们所授权的知识产权。我们可能对他们的活动或他们对可能与我们的授权知识产权有关的任何其他知识产权的使用或许可拥有有限的控制权。例如,我们无法确定这些许可方的此类活动将遵守适用的法律和法规,或将产生有效和可执行的专利和其他知识产权。
94
如果我们无法以商业上合理的条款或根本不能从第三方获得许可证,或未能履行我们在此类协议下的义务,我们的业务可能会受到损害。
我们必须使用第三方的专利或其他专有技术来商业化我们的产品。如果我们无法授权该等技术,或者我们被迫以不利的条款授权该等技术,我们的业务可能会受到重大损害。如果我们未来无法获得必要的许可,我们可能无法开发或商业化受影响的候选产品,这可能会对我们的业务造成重大损害,拥有或控制该等知识产权的第三方可能会寻求禁止我们销售的禁令,或要求我们承担支付版税和/或其他形式的补偿的义务。即使我们能够获得许可证,它也可能是非排他性的,从而使我们的竞争对手和其他第三方能够获得许可给我们的相同技术。第三方知识产权的许可或收购是一个竞争性的领域,几个更成熟的公司可能会采取策略,以许可或收购我们可能认为有吸引力或必要的第三方知识产权。这些成熟的公司由于其规模、资本资源以及更强的临床开发和商业化能力,可能比我们具有竞争优势。此外,认为我们是竞争对手的公司可能不愿意向我们转让或许可权利。
如果我们无法获得所需的第三方知识产权的权利或维持现有的知识产权,我们可能需要花费大量的时间和资源来重新设计我们的技术、候选产品或其制造方法,或开发或许可替代技术,所有这些在技术或商业基础上可能不可行。如果我们不能这样做,我们可能无法开发或商业化受影响的技术和候选产品,这可能会严重损害我们的业务、财务状况、经营业绩和前景。
此外,如果我们未能遵守我们在任何未来许可协议下的义务,我们的交易对手可能有权终止这些协议,在这种情况下,我们可能无法开发、生产或营销这些协议涵盖的任何产品,或可能被迫停止开发、生产或营销,或可能面临这些协议下的其他处罚。此类事件可能对根据任何此类协议开发的候选产品的价值产生重大不利影响。终止这些协议或减少或取消我们在这些协议下的权利,或限制我们在这些协议下的权利,当它符合我们的业务利益时,可能导致我们不得不谈判新的或恢复的协议,使我们失去我们在这些协议下的权利,包括我们对重要知识产权或技术的权利,或阻碍、延迟或禁止依赖此类协议的一个或多个候选产品的进一步开发或商业化。
虽然我们目前没有卷入任何相关诉讼,但我们可能会卷入保护或执行我们的专利或其他知识产权的诉讼,这可能是昂贵的、耗时的和不成功的。
您可能会侵犯、盗用或以其他方式侵犯我们或我们未来许可人的专利、商标、版权或其他知识产权。因此,我们可能需要向第三方提出侵权、盗用或其他与知识产权相关的索赔。为了打击侵权或其他未经授权的使用,我们可能需要在每个国家的基础上提出索赔,这可能是昂贵和耗时的,并分散了我们的管理和科学人员的时间和注意力。我们无法保证我们将有足够的财政或其他资源提交和追究此类索赔,这些索赔通常持续数年才结束。
我们的许可协议对我们对第三方侵权者强制执行许可专利的能力有一定限制。例如,就我们与WIBR签订的许可协议而言,我们不能针对先前与WIBR签订了赞助研究协议的某个第三方就该赞助研究协议所产生的发明实施许可专利。此外,关于WIBR共同独占协议,WIBR专利权共同独占授权给我们和另一个第三方。因此,我们不得向共同独占被许可人主张共同独占许可的专利权。
我们对第三方提出的任何索赔也可能促使这些当事人对我们提出反索赔,声称我们侵犯、挪用或以其他方式侵犯他们的知识产权。此外,在专利侵权诉讼中,此类当事人可以反诉我们声称的专利无效或不可执行,或两者兼而有之。在美国的专利诉讼中,被告声称无效或不可执行的反诉很常见。有效性质疑的理由可能是所谓的未能满足以下任何一项
95
几个法定要求,包括缺乏新颖性、明确性或不可使用性。不可执行性主张的理由可能是,与专利起诉有关的人在起诉期间向美国专利商标局隐瞒了相关信息,或做出了误导性声明。第三方可以向美国或国外的行政机构提出此类索赔,即使在诉讼范围之外也是如此。这类机制包括重新审查、授予后复审、当事各方复审、干预程序、派生程序,以及在外国法域的同等程序(例如,反对程序)。在法律上断言无效和不可执行之后的结果是不可预测的。
在任何此类诉讼中,法院可能会裁定我们的专利或我们许可的专利无效、不可执行和/或未被侵权,或者可能会以我们的专利不涵盖相关技术为由,狭义地驳回此类专利的权利要求或拒绝阻止另一方使用相关技术。任何诉讼或辩护程序的不利结果可能使我们的一项或多项专利处于无效、狭义解释或全部或部分不可执行的风险,可能使我们的专利申请处于无法颁发的风险,并可能限制我们针对这些方或其他竞争对手主张这些专利的能力,并限制或排除我们排除第三方制造和销售类似或竞争产品。同样,如果我们提出商标侵权索赔,法院可能会裁定我们主张的商标无效或不可执行,或者我们主张商标侵权的一方对有关商标拥有优先权利。在这种情况下,我们最终可能被迫停止使用这些商标,这可能会对我们的业务造成重大损害,并对我们的市场地位产生负面影响。
即使我们确定侵犯、盗用或其他侵犯我们知识产权的行为,法院也可以决定不对进一步此类行为发出禁令,而只判金钱损害赔偿,这可能是也可能不是足够的补救措施。此外,由于知识产权诉讼需要大量的发现,我们的部分机密信息可能会在此类诉讼中因披露而受到损害。还可以公布听证会、动议或其他临时程序或事态发展的结果。如果证券分析师或投资者认为这些结果是负面的,它可能会对我们的普通股的价格产生重大的不利影响。上述任何情况可能对我们的业务、财务状况、经营业绩及前景造成重大不利影响。
专利法的削弱以及美国和其他司法管辖区法院和其他当局的执法可能会影响我们保护专利的能力。
美国最高法院在过去几年的专利案件中发表了意见,许多人认为这些意见可能会削弱美国的专利保护,要么缩小在某些情况下可用的专利保护范围,要么认定某些类型的创新不具有专利性,要么以其他方式使专利在法庭上无效变得容易。此外,最近有人提议对美国和其他国家的专利法进行额外修改,如果这些修改被采纳,可能会影响我们为我们的专利技术获得专利保护的能力或我们执行我们的专利技术的能力。根据美国国会、美国法院、USPTO以及其他国家的相关立法机构和其他机构的未来行动,管理专利的法律和法规可能会以不可预测的方式发生变化,这将削弱我们获得新专利的能力,或削弱我们现有专利和我们将来可能获得的专利的能力。
一些外国法域的法律保护知识产权的程度不如美国,许多公司在外国法域保护和捍卫这些权利方面遇到了重大困难。如果我们在外国司法管辖区的知识产权保护方面遇到困难,或无法有效保护我们的知识产权,我们的业务前景可能会受到重大损害。例如,我们可以成为外国异议程序的一方,如EPO,或专利诉讼和其他程序在外国法院。如果是这样,启动和继续该等程序所产生的不确定性可能对我们在市场上的竞争能力造成重大不利影响。外国对抗诉讼的费用也可能很高,在许多外国法域,败诉方必须支付胜诉方的律师费。
获得和维护我们的专利保护有赖于遵守政府专利机构提出的各种程序、文件提交、费用支付和其他要求,如果不符合这些要求,我们的专利保护可能会减少或取消。
美国专利商标局、欧洲专利局和其他专利机构要求在专利申请过程中遵守一些程序、文件、费用支付和其他类似条款。周期性的
96
维护费、续期费、年金费和与专利和/或申请有关的各种其他政府费用将在专利和/或申请的有效期内分几个阶段支付给美国专利商标局和美国以外的各种政府专利机构。我们有系统提醒我们支付这些费用,我们聘请了一家外部公司,并依赖我们的外部律师向非美国的专利代理机构支付此类费用。虽然在许多情况下,根据适用的规则,可以通过支付滞纳金或通过其他方式纠正过失失效,但在某些情况下,不遵守规则可能导致专利或专利申请被放弃或失效,从而导致相关法域专利权的部分或全部丧失。在这种情况下,我们的竞争对手或其他第三方可能会以类似或相同的产品或技术进入市场,这可能会对我们的业务、财务状况、运营结果和前景产生实质性的不利影响。
我们可能无法在世界各地强制执行我们的知识产权。
在世界各地所有国家,申请、起诉和捍卫涵盖我们候选产品的专利将是非常昂贵的,即使在我们寻求知识产权保护的国家,这种保护也可能不及美国的保护范围。在某些国家,特别是发展中国家,对专利性的要求可能有所不同,允许的专利要求的广度可能不一致。此外,一些外国的法律对知识产权的保护程度并不像美国的联邦和州法律那样。如果有机会的话,涵盖我们在全球所有国家的候选产品的授权专利可能同样昂贵得令人望而却步。即使仅在我们开发或商业化候选产品的司法管辖区内进行专利授权或申请、起诉和保护,也可能过于昂贵或不切实际。竞争对手可能会在我们尚未获得专利保护或许可专利的司法管辖区使用我们和我们的许可方的技术来开发自己的产品,此外,可能会将其他侵权产品出口到我们和我们的许可方有专利保护的地区,但执法力度不如美国或欧盟。这些产品可能会与我们的候选产品竞争,我们或我们的许可方的专利或其他知识产权可能不有效或不足以阻止它们竞争。
此外,我们可能会决定放弃国家和地区专利申请,因为它们仍然悬而未决。每一个国家或地区专利的授予程序是一个独立的程序,可能导致申请被有关专利局驳回,而实质上类似的申请被其他人授予的情况。例如,相对于其他国家,中国对专利性的要求更高,特别是要求详细描述专利药品的医疗用途。此外,仿制药制造商或其他竞争对手可能会质疑我们或我们许可人的专利的范围、有效性或可转让性,要求我们或我们许可人参与复杂、冗长且昂贵的诉讼或其他程序。仿制药制造商可能会开发、寻求批准并推出我们产品的仿制药版本。同样常见的是,根据国家的不同,相同的候选产品或技术的专利保护范围可能会有所不同。
一些司法管辖区的法律没有像美国和欧盟的法律或法规那样保护知识产权,许多公司在这些司法管辖区保护和捍卫专有权方面遇到了重大困难。此外,某些国家的法律制度,特别是某些发展中国家的法律制度,不支持强制执行专利、商业秘密或其他形式的知识产权,特别是与生物技术产品有关的专利、商业秘密或其他形式的知识产权,这可能使我们难以阻止某些司法管辖区的竞争对手以侵犯我们的专有权的方式销售竞争产品。在外国司法管辖区强制执行我们的专利权的诉讼,无论是否成功,都可能导致巨额成本,并将我们的努力和注意力从我们业务的其他方面转移,此外还可能使我们或我们的许可人的专利面临被无效或狭义解释的风险,可能增加我们或我们的许可人的专利申请不颁发的风险,或者可能引发第三方对我们提出索赔。我们可能不会在我们发起的任何诉讼中获胜,而可能会向敌方支付损害赔偿或其他补救措施,这可能具有重大的商业意义。如果我们胜诉,判给我们的损害赔偿或其他补救措施(如果有的话)可能没有商业意义。因此,我们在世界各地执行我们的知识产权的努力可能不足以从我们开发或许可的知识产权中获得显著的商业优势。此外,虽然我们打算在我们预期的重要市场保护我们的知识产权,但我们不能确保我们能够在我们可能希望营销我们的候选产品的所有司法管辖区启动或保持类似的努力。因此,我们在这些国家保护我们的知识产权的努力可能不充分,这可能会对我们在所有预期的重要国外市场成功地将我们的候选产品商业化的能力产生不利影响。如果我们或我们的许可人在保护知识产权方面遇到困难,或被排除在有效保护知识产权之外
97
如果这些权利对我们在这些司法管辖区的业务非常重要,这些权利的价值可能会降低,我们可能会在这些司法管辖区面临额外的竞争。
在包括欧盟国家在内的一些司法管辖区,强制许可法强制专利所有者向第三方授予许可。此外,一些国家限制专利对政府机构或政府承包商的可转让性。在这些国家,专利所有人的补救措施可能有限,这可能会严重削弱该专利的价值。如果我们或我们的任何授权人被迫根据与我们业务相关的专利授予第三方许可,或如果我们或我们的授权人被阻止对第三方强制执行专利权,我们在该等司法管辖区的竞争地位可能会受到重大损害。
我们依靠我们的能力通过强制执行我们的专利来阻止他人竞争,但某些司法管辖区可能会要求我们向第三方授予许可。这种强制许可可以扩展到包括我们的一些候选产品,这可能会限制我们潜在的收入机会。
许多外国国家都有强制许可法,规定专利所有人在某些情况下必须向第三方授予许可。例如,通过直接立法或国际倡议,对救生产品和昂贵产品实行强制许可或威胁实行强制许可,在发展中国家日益流行。如果我们的一些候选产品获得上市批准,强制性许可证可能会扩大到包括他们,这可能会限制我们的潜在收入机会。因此,我们可能无法阻止第三方在美国和欧洲以外的某些国家实践我们的发明。竞争对手也可能在我们尚未获得专利保护的司法管辖区使用我们的技术来开发自己的产品,此外,如果我们执行我们的专利以阻止侵权活动的能力不足,则可能向我们有专利保护的地区出口侵权产品。这些产品可能与我们的产品竞争,我们的专利或其他知识产权可能不有效或不足以阻止它们竞争。在外国司法管辖区强制执行我们的专利权的诉讼,无论是否成功,都可能导致巨额成本,并转移我们的精力和资源,使我们的业务的其他方面。此外,虽然我们打算在存在专利权的主要市场保护我们的产品的知识产权,但我们无法确保我们能够在所有我们可能希望销售我们的产品的司法管辖区发起或维持类似的努力。因此,我们在这些国家保护知识产权的努力可能不够。
此外,一些国家限制专利对政府机构或政府承包商的可执行性。在这些国家,专利所有人可能仅限于金钱救济,如果政府是侵权者,则可能无法禁止侵权,这可能会大幅降低专利的价值。
我们的一些知识产权是通过政府资助的项目发现的,因此可能会受到联邦法规的约束,如"进军"权利,某些报告要求和美国的优先权。如果我们不允许我们的公司,遵守这些法规可能会限制我们的独家权利和我们与非美国制造商签订合同的能力。
美国联邦政府根据《贝赫—多尔法案》保留了在财政援助下产生的发明的某些权利。联邦政府为了自己的利益保留了一个“非排他性、不可转让、不可撤销、已付费的许可证”。《拜赫—多尔法》还为联邦机构提供了"进军权"。专利权允许政府在特定情况下要求专利权的承包人或继承人授予"非排他性、部分排他性或排他性许可"给"负责任的申请人",如果它确定(1)没有采取足够的措施使发明商业化并实现政府资助的技术的实际应用,(2)政府采取行动是满足公众健康或安全需要的,(3)政府采取行动是满足联邦法规下公众使用的要求的,或(4)我们未能满足联邦法规的要求。如果专利权人拒绝这样做,政府可以自行授予许可证。我们的一些许可专利受Bayh—Dole法案的条款约束。如果我们的许可人未能遵守《Bayh—Dole法案》的规定,他们可能会失去受该等规定约束的任何专利的所有权,这可能会影响我们在专利项下的许可权,以及我们阻止他人使用或商业化类似或相同的技术和产品的能力,或限制对我们的技术和产品的专利保护。
如果我们不能保护我们的商业秘密的机密性,我们的商业和竞争地位将受到损害。
98
除了专利提供的保护外,我们还依靠商业秘密保护和保密协议来保护不可申请专利或我们选择不申请专利的专有技术、难以实施专利的过程以及我们候选产品发现和开发过程中涉及专利未涵盖的专有技术、信息或技术的任何其他要素。然而,商业秘密可能很难保护。我们寻求保护我们的专有技术和流程,部分是通过与有权访问这些技术和流程的各方签订保密协议,例如我们的员工、CRO、顾问、科学顾问和其他承包商。我们不能保证我们已经与可能或曾经接触到我们的商业秘密或专有技术和流程的每一方达成了此类协议。此外,我们亦致力维护我们楼宇的实体安全,以及我们的资讯科技系统的实体和电子安全,以维护我们的资料和商业秘密的完整性和保密性。虽然我们对这些个人、组织和系统有信心,但协议或安全措施可能会被违反,我们的商业机密可能会被泄露,而我们可能没有足够的补救措施来应对任何此类违规行为。强制执行一方非法披露或挪用商业秘密的主张是困难、昂贵和耗时的,结果是不可预测的。此外,美国国内外的一些法院不太愿意或不愿意保护商业秘密。盗用或未经授权披露我们的商业秘密或其他机密专有信息可能会导致我们失去对商业秘密的保护,损害我们的竞争地位,并对我们的业务产生实质性的不利影响。我们可能需要与未来的商业伙伴、合作者、承包商和其他位于商业秘密被盗风险较高的国家的其他人分享我们的专有信息,包括商业秘密,包括通过私人或外国行为者的直接入侵,以及那些与国家行为者有关联或由国家行为者控制的人。此外,如果为维护我们的商业秘密或其他机密专有信息而采取的步骤被认为不充分,我们可能没有足够的追索权来对抗第三方挪用商业秘密或其他机密专有信息。
此外,我们不能保证竞争对手或其他第三方不会以其他方式获取我们的商业秘密和其他机密专有信息,或独立发现或开发实质上等同的技术和工艺。如果我们无法防止向第三方披露与我们的候选产品和技术相关的商业秘密和其他非专利知识产权,我们无法保证我们将获得任何此类可强制执行的商业秘密保护,我们可能无法在市场上建立或维持竞争优势,这可能对我们的业务、经营业绩和财务状况造成重大不利影响。
我们可能会受到以下指控:我们的员工、顾问或独立承包商错误地使用或披露第三方的机密信息;我们的员工错误地使用或披露其前雇主的所谓商业机密;或声称拥有我们视为我们自己的知识产权。
我们已经雇用,并可能在未来雇用,以前受雇于大学或其他生物技术或制药公司的个人,包括我们的竞争对手或潜在竞争对手。虽然我们努力确保我们的员工、顾问和独立承包商在其工作中不使用他人的专有信息或专门知识,但我们可能会受到声称我们或我们的员工、顾问或独立承包商无意中或以其他方式使用或披露知识产权的索赔,包括商业秘密或其他专有信息。任何此类个人的前雇主或其他第三方。诉讼可能是必要的,以抗辩这些索赔。如果我们未能就任何此类索赔进行辩护,除了支付金钱损失外,我们可能会失去宝贵的知识产权或人员,或我们聘请人员的能力,在上述任何情况下,这可能会对我们的业务造成不利影响。即使我们成功地为此类索赔辩护,诉讼也可能导致巨额成本,并分散管理层和其他员工的注意力。
尽管我们的政策是要求我们的所有员工和顾问将他们的发明转让给我们,但如果员工或顾问在为我们工作时使用他人拥有的知识产权,可能会出现关于相关或由此产生的专有技术和发明的权利的争议。我们也可能不能成功地与实际上构思或开发我们视为自己的知识产权的每一方达成这样的协议。知识产权的转让可能不是自动执行的,或者转让协议可能被违反,我们可能被迫向第三方提出索赔,或为他们可能对我们提出的索赔辩护,以确定我们认为是我们的知识产权的所有权。此类索赔可能会对我们的业务、财务状况、运营结果和前景产生实质性的不利影响。
99
我们的专有权利可能不足以保护我们的技术和候选产品,知识产权不一定能解决我们竞争优势面临的所有潜在威胁。
我们的知识产权所提供的未来保护程度是不确定的,因为知识产权具有局限性,可能无法充分保护我们的业务,或使我们能够保持竞争优势。以下示例是说明性的:
如果这些事件中的任何一个发生,都可能对我们的业务、财务状况、运营结果和前景产生实质性的不利影响。
与员工事务、管理增长相关的风险,以及与我们业务相关的其他风险
我们将需要扩大我们的组织,我们可能会在管理这种增长方面遇到困难,这可能会扰乱我们的运营。
随着时间的推移,我们的员工数量和业务范围将大幅增长,特别是在候选产品开发、监管和临床事务、医疗事务、法律、财务、销售、市场营销和分销领域。为了管理我们的增长活动,我们必须继续实施和改进我们的管理、运营和财务系统,并继续招聘和培训更多的合格人员。由于我们的财务资源有限,以及我们的管理团队在管理一家预期增长的公司方面经验有限,我们可能无法有效管理业务的扩张或招聘及培训额外的合资格人员。随着我们扩大,
100
在组织中,我们可能难以识别、雇用和整合新的人员。未来增长将对我们的管理层带来重大额外责任,包括:
此外,我们的管理层可能需要将不成比例的注意力从我们的日常活动中转移出来,并投入大量时间管理这些增长活动。我们可能无法有效地管理我们业务的扩展,这可能会导致我们的基础设施薄弱,导致操作错误、失去商业机会、员工流失,以及剩余员工的生产率下降。我们的预期增长可能需要大量的资本支出,并可能将财政资源从其他项目中转移出来,例如开发候选产品。如果我们的管理层不能有效地管理我们的增长,我们的费用可能会比预期的增长更多,我们创造和/或增长产品收入的能力可能会降低,我们可能无法实施我们的业务战略。我们未来的财务业绩以及我们开发和商业化我们的候选产品并有效竞争的能力,在一定程度上将取决于我们有效管理未来任何增长的能力。
目前,在可预见的未来,我们将在很大程度上依赖某些独立组织、顾问和顾问来提供某些服务,包括临床前和临床开发活动和制造。不能保证在需要时,独立组织、顾问和顾问的服务将继续及时提供给我们,也不能保证我们能找到合格的替代者。此外,如果我们不能有效地管理我们的外包活动,或者如果顾问提供的服务的质量或准确性因任何原因而受到影响,我们计划的临床试验可能会被延长、推迟或终止,我们可能无法获得监管机构对我们的候选产品的批准或以其他方式推进我们的业务。我们不能保证我们能够以经济合理的条件管理现有的顾问,或找到其他称职的外部承包商和顾问,或者根本不能保证。如果我们不能通过雇佣新员工和扩大顾问和承包商团队来有效地扩展我们的组织,或者我们不能有效地建造新的设施来适应这种扩展,我们可能无法成功地执行进一步开发和商业化我们的候选产品所需的任务,因此,我们可能无法实现我们的研究、开发和商业化目标。
与我们竞争合格人才和顾问的许多生物技术和制药公司,比我们拥有更多的财务和其他资源,不同的风险状况,以及更长的行业历史。如果我们不能继续吸引和留住高素质的人员和顾问,我们发现和开发候选产品并经营我们业务的速度和成功将是有限的。
如果我们失去了高管,无法招聘到合格的高管或其他关键人员,我们的业务可能会受到实质性的影响。
我们高度依赖我们的管理层,包括我们的首席执行官Mahesh Karande、我们的首席科学官Thomas McCauley、我们的首席财务官Joshua Reed和我们的首席医疗官严摩尔。由于我们的每一位高管都对我们的候选产品和我们的运营拥有专业知识,我们任何一位高管的服务损失都可能推迟我们候选产品的开发或对我们的业务运营产生不利影响。我们不为我们的任何高管投保关键人物人寿保险。一般而言,我们与行政人员的聘用安排并不妨碍他们随时终止受雇。
此外,我们未来的成功和增长将在一定程度上取决于我们员工和管理人员的持续服务,以及我们识别、聘用和留住更多人员的能力。更换关键员工和管理人员可能很困难或成本很高,而且可能需要较长的时间,因为我们行业中拥有成功开发、获得监管部门批准并将候选产品商业化所需的技能和经验的个人数量有限。从这个有限的人才库中招聘的竞争是激烈的,考虑到众多制药和生物技术公司之间的竞争,我们可能无法以可接受的条件招聘、培训、留住或有效激励关键人员。
101
类似的人员。我们还经历了对来自大学和研究机构的科学和临床人才的竞争。此外,我们依靠顾问和顾问,包括科学和临床顾问,帮助我们制定我们的研发和商业化战略。我们的顾问和顾问可能被我们以外的实体聘用,并可能根据与其他实体的咨询或咨询合同做出承诺,这可能会限制他们对我们的可用性。如果我们不能继续吸引和留住高素质的人才,我们开发和商业化候选产品的能力将受到限制。
我们的许多员工已经或即将成为我们的大量普通股或许多普通股期权。如果我们的员工持有的股票相对于股票的原始购买价格大幅升值,或者如果他们持有的期权的行权价格显著低于我们普通股的市场价格,我们的员工可能更有可能离开我们。
我们可能会进行收购或战略合作,这可能会扰乱我们的业务,导致我们的股东股权稀释,减少我们的财务资源,导致我们产生债务或承担或有负债,并使我们面临其他风险。
在未来,我们可能会进行交易,以获得其他业务、产品或技术,或者达成战略合作,包括许可。如果我们确实确定了合适的收购或合作,我们可能无法以有利的条件完成此类收购或合作,甚至根本无法完成。我们进行的任何收购或合作都可能不会加强我们的竞争地位,而且我们可能永远不会实现此类收购或合作的预期好处。我们可能会决定产生与收购相关的债务,或者向被收购公司的股东发行我们的普通股或其他股权证券,这将减少我们现有股东的所有权百分比。我们可能会因所收购业务或合作未发现的债务而蒙受损失,而这些债务不在我们可能从卖方或我们的合作伙伴那里获得的赔偿范围之内。此外,我们可能无法以有效、及时和无中断的方式将获得的任何人员、技术和运营成功整合到我们现有的业务中。收购或合作还可能分散管理层对日常职责的注意力,导致关键人员的流失,增加我们的费用,并减少我们可用于运营和其他用途的现金和现金等价物。我们无法预测未来收购或合作的数量、时间或规模,也无法预测任何此类交易可能对我们的经营业绩产生的影响。
针对我们的诉讼可能是昂贵和耗时的辩护,并可能导致额外的责任。
我们可能会不时受到法律程序和在正常业务过程中或其他方面出现的索赔的影响,例如第三方就商业纠纷提出的索赔,以及我们现任或前任员工提出的雇佣索赔。索赔也可以由各种其他各方或代表其他各方提出,包括政府机构、患者或股东。
任何涉及我们的诉讼都可能导致巨额成本,在运营上限制我们的业务,并可能分散管理层的注意力和资源,这可能会严重损害我们的业务、整体财务状况和运营结果。保险可能不包括现有的或未来的索赔,不足以完全赔偿我们的一个或多个此类索赔,或者继续以我们可以接受的条款提供保险。对我们提出的未投保或保险不足的索赔可能会导致意想不到的成本,从而对我们的运营结果产生不利影响。
与我们普通股相关的风险
我们普通股的市场价格可能会波动很大。
我们的股票价格可能会波动。由于这种波动,你可能无法出售你的普通股获利。我们普通股的市场价格可能受到许多因素的影响,包括:
102
103
此外,整个股票市场,纳斯达克全球精选市场,或纳斯达克,特别是生物技术公司,经历了极端的价格和交易量波动,往往与这些公司的经营业绩无关或不相称。广泛的市场和行业因素可能会对我们普通股的市场价格产生负面影响,无论我们的实际经营业绩如何。过去,证券集体诉讼往往是在公司证券市场价格波动的时期后对公司提起的。此类诉讼,如果提起,可能会导致巨额成本,并转移管理层的注意力和资源,这将损害我们的业务、财务状况和经营成果。
我们的执行官、董事和主要股东,如果他们选择一起行动,将继续有能力控制提交给股东批准的所有事项。
根据截至2023年12月31日的已发行普通股数量,我们的高管、董事和持有我们已发行普通股5%以上的股东及其各自的关联公司总共持有约71%的已发行有表决权股票。因此,如果这些股东选择共同行动,他们将能够控制或显著影响提交给我们股东批准的所有事项,以及我们的管理和事务。例如,这些股东将控制董事的选举、我们管理层的组成以及我们所有或几乎所有资产的任何合并、合并或出售的批准。这可能会阻止我们管理层的变动,或阻止您认为符合您作为我们股东之一的最佳利益的对我们普通股的主动收购建议或要约。
我们总流通股的很大一部分有资格在不久的将来向市场出售,这可能导致我们普通股的市场价格大幅下降,即使我们的业务表现良好。
在公开市场上出售我们普通股的大量股票,或者市场上认为持有大量股票的人打算出售股票,可能会降低我们普通股的市场价格。此外,持有合共24,284,625股本公司普通股的持有人有权在符合特定条件的情况下,要求吾等提交有关其股份的登记声明,或将其股份纳入吾等可为本身或其他股东提交的登记声明中,直至该等股份可根据规则144不受限制地出售,或直至权利根据吾等与该等股东之间的股东协议条款终止为止。我们还登记了根据我们的股权补偿计划可能发行的所有普通股,这些股票在发行后可以在公开市场自由出售,但受适用于关联公司的数量限制。
我们是一家“新兴成长型公司”,降低适用于新兴成长型公司的披露要求可能会降低我们的普通股对投资者的吸引力。
我们是一家“新兴增长型公司”,定义在2012年的“快速启动我们的商业创业法案”,或“就业法案”,并可能保持一个新兴增长型公司,直到(1)财政年度的最后一天;(a)我们的首次公开募股结束日期五周年后,(b)我们的年总收入至少为12.35亿美元,根据通货膨胀调整或(c)我们被视为一个大型加速申报人,这要求我们非关联公司持有的普通股的市场价值超过7亿美元,截至我们最近完成的第二财政季度的最后一个营业日,及(二)我们在过去三年内发行超过10亿元不可转换债券的日期。只要我们仍然是一家新兴增长型公司,我们就被允许并打算依赖于适用于非新兴增长型公司的其他上市公司的某些披露要求的豁免。这些豁免包括:
104
我们利用了本年度报告中减少的报告负担,并打算在未来继续这样做。特别是,如果我们不是一家新兴成长型公司,我们没有包括所有与高管薪酬相关的信息。我们无法预测,如果我们依赖这些豁免,投资者是否会发现我们的普通股吸引力下降。此外,《就业法案》规定,新兴成长型公司可以利用延长的过渡期来遵守新的或修订后的会计准则。这使得新兴成长型公司可以推迟采用这些会计准则,直到它们本来适用于私营公司。此外,即使我们不再有资格成为一家新兴成长型公司,我们仍可能有资格成为一家“较小的报告公司”,这将使我们能够利用许多相同的豁免披露要求,包括在我们的定期报告和委托书中减少关于高管薪酬的义务。如果一些投资者因此发现我们的普通股吸引力下降,我们的普通股交易市场可能会变得不那么活跃,我们的股价可能会下降或更加波动。
我们是一家“较小的报告公司”,适用于较小的报告公司的信息披露要求降低,可能会降低我们的普通股对投资者的吸引力。
我们被认为是一家“小型报告公司”。因此,只要我们仍然是一家规模较小的报告公司,我们有权依赖某些减少的披露要求,例如豁免提供三年经审计财务报表和高管薪酬信息。如果我们符合小型报告公司定义下的收入限制,我们符合小型报告公司的资格,那么我们将是一家“低收入小型报告公司”。根据2002年《萨班斯—奥克斯利法案》第404条或第404条,低收入规模的报告公司无需就其财务报告内部控制的有效性进行外部审计。这些豁免和减少披露可能会使投资者更难分析我们的经营业绩和财务前景。我们无法预测投资者是否会发现我们的普通股的吸引力下降,因为我们可能会依赖这些豁免。如果一些投资者发现我们的普通股吸引力下降,我们的普通股交易市场可能会不那么活跃,我们的股票价格可能会更不稳定。
由于我们以上市公司的身份经营,我们的成本持续增加,管理层将需要投入大量时间进行新的合规措施和企业管治常规。
作为一家上市公司,特别是在我们不再是一家新兴的成长型公司之后,我们继续产生大量的法律、会计和其他费用,这些费用在我们成为上市公司之前并没有发生。2002年萨班斯-奥克斯利法案、多德-弗兰克华尔街改革和消费者保护法、纳斯达克全球精选市场的上市要求以及其他适用的证券规则和法规对上市公司提出了各种要求,包括建立和维持有效的披露、财务控制和公司治理做法。我们的管理层和其他人员正在为这些合规倡议投入大量时间。此外,这些规则和法规将增加我们的法律和财务合规成本,并将使一些活动更加耗时和昂贵。例如,这些规章制度使我们获得董事和高级管理人员责任保险变得更加困难和昂贵,这反过来可能会使我们更难吸引和留住合格的董事会成员。
我们正在评估这些规则和条例,无法预测或估计我们可能产生的额外成本金额或此类成本的时间。这些规则和条例往往有不同的解释,在许多情况下是因为它们缺乏特殊性,因此,随着监管机构和理事机构提供新的指导意见,它们在实践中的适用可能会随着时间的推移而演变。这可能导致关于遵守事项的持续不确定性,以及不断修订披露和治理做法所需的更高成本。
根据2002年萨班斯-奥克斯利法案第404条或第404条,我们必须提交一份关于我们财务报告内部控制的管理层报告。然而,尽管我们仍然是一家新兴的成长型公司或一家低收入的较小的报告公司,我们将不会被要求包括由我们的独立注册会计师事务所出具的关于财务报告的内部控制的认证报告。为了在规定的期限内遵守第404条,我们正在进行记录和评估我们对财务报告的内部控制的过程,这既昂贵又具有挑战性。在这方面,我们需要继续提供内部资源,聘请外部顾问,通过详细的工作计划来评估和记录财务报告内部控制的充分性,继续采取步骤改进控制程序
105
适当时,通过测试验证此类控制是否按照文件规定运行,并实施财务报告内部控制的持续报告和改进流程。尽管我们做出了努力,但我们或我们的独立注册会计师事务所(如果适用)都无法在规定的时间框架内或根本无法得出结论,即我们对财务报告的内部控制是有效的,符合第404条的要求。我们可能会发现我们的财务报告内部控制存在重大缺陷或重大缺陷,我们可能无法及时或根本无法成功补救。未能纠正吾等发现的任何重大缺陷或重大弱点,或未能实施所需的新的或改进的控制措施,或在执行过程中遇到困难,均可能导致吾等未能履行我们的报告义务或导致我们的财务报表出现重大错报。如果我们发现一个或多个重大弱点,可能会导致金融市场因对我们财务报表的可靠性失去信心而产生不良反应。
如果我们未能保持对财务报告的有效内部控制和有效的披露控制程序,我们可能无法及时准确地报告我们的财务结果或防止欺诈,这可能会对投资者对我们公司的信心造成不利影响。
我们必须遵守SEC执行2002年《萨班斯—奥克斯利法案》第302和404条的规定,这些规定要求管理层在季度和年度报告中证明财务和其他信息,并提供年度管理层报告,说明我们对财务报告的内部控制的有效性。作为一家新兴增长型公司和一家低收入小型报告公司,我们的独立注册会计师事务所无需根据第404条证明我们对财务报告的内部控制的有效性,直到我们不再是一家新兴增长型公司或一家低收入小型报告公司。在此期间,倘我们对财务报告的内部监控发现重大弱点,我们的独立注册会计师事务所可能会发出不利的报告。
为符合上市公司的要求,我们已采取并将需要采取额外行动,例如实施新的内部监控和程序,以及增聘会计或内部审计人员。测试和维护内部控制可以转移我们管理层的注意力,从对我们业务运营很重要的其他事项上。此外,在评估我们对财务报告的内部控制时,我们可能会发现我们可能无法及时纠正的重大缺陷,以满足我们为遵守第404条要求而规定的适用期限。如果我们发现我们对财务报告的内部控制存在任何重大缺陷,或者我们无法及时遵守第404条的要求,或者声称我们对财务报告的内部控制是有效的,或者如果我们的独立注册会计师事务所在我们不再是新兴企业后无法就我们财务报告内部控制的有效性发表意见,投资者可能会对我们财务报告的准确性和完整性失去信心。因此,我们普通股的市场价格可能受到重大不利影响。
我们的披露控制和程序可能无法阻止或检测所有错误或欺诈行为。
我们须遵守经修订的1934年《证券交易法》或《交易法》的定期报告要求。我们正在继续完善我们的披露控制和程序,以提供合理的保证,确保我们必须在根据交易所法案提交或提交的报告中披露的信息被积累并传达给管理层,并在美国证券交易委员会规则和表格中指定的时间段内进行记录、处理、汇总和报告。我们相信,任何披露管制和程序,无论构思和运作如何周详,都只能提供合理而非绝对的保证,确保管制制度的目标得以达致。
这些固有的局限性包括这样的现实,即决策过程中的判断可能是错误的,故障可能因为简单的错误或错误而发生。此外,某些人的个人行为、两个或两个以上人的串通或未经授权超越控制,都可以规避控制。因此,由于我们的控制系统的固有限制,由于错误或欺诈而导致的错误陈述可能会发生,并且不会被发现。
如果证券或行业分析师不发表关于我们业务的研究或报告,或者如果他们对我们的股票发表不利或误导性的意见,即使我们的业务表现良好,我们的股价和交易量也可能下降。
106
我们普通股的交易市场将受到行业或证券分析师发布的关于我们或我们业务的研究和报告的影响。我们目前的研究范围有限,证券和行业分析师。如果任何报道我们的分析师下调我们的普通股评级,或对我们、我们的商业模式、我们的知识产权或我们的股票表现发表不利或误导性的意见,或者如果我们的目标临床前研究或临床试验和运营结果未能达到分析师的预期,我们的股价可能会下跌。如果其中一名或多名分析师停止对我们的报道或未能定期发布有关我们的报告,我们可能会失去在金融市场的知名度,进而导致我们的股价或交易量下跌。
我们修订和重述的公司注册证书和重述的章程以及特拉华州法律的规定可能会使收购我们的公司变得更加困难,这可能对我们的股东有利,并可能会阻止我们的股东试图更换或罢免我们目前的管理层。
我们的修订和重述的公司注册证书以及我们的修订和重述的章程中的规定可能会阻止、延迟或阻止股东认为有利的公司合并、收购或其他控制权变更,包括您可能会获得股份溢价的交易。这些条款还可能限制投资者将来可能愿意为我们普通股支付的价格,从而压低我们普通股的市场价格。此外,由于我们的董事会负责任命我们的管理团队的成员,这些条款可能会挫败或阻止我们的股东更换或罢免我们现有管理层的任何企图,使股东更难更换我们的董事会成员。除其他外,这些规定包括:
此外,由于我们是在特拉华州注册成立的,我们受特拉华州公司法第203条的规定管辖,该条款禁止持有我们已发行有表决权股票超过15%的人在交易日期后三年内与我们合并或合并,除非合并或合并以规定的方式获得批准。
107
我们修改和重述的公司注册证书指定特定的法院作为我们股东可能发起的某些诉讼的独家论坛,这可能会限制我们的股东获得有利的司法论坛处理与我们的纠纷的能力。
我们的修订和重述的公司注册证书规定,除非我们书面同意选择替代法院,否则特拉华州法院将是大多数涉及股东对我们提出索赔的法律诉讼的唯一和专属法院,但为执行《交易法》规定的任何责任或义务而提起的诉讼,或联邦法院有专属管辖权的任何其他索赔,(c)任何诉讼的管辖权以及特拉华州大法官法院因缺乏标的物管辖权而驳回,该诉讼可提交特拉华州的另一州或联邦法院审理。我们的修订和重述的公司注册证书还规定,除非我们书面同意选择替代法院,否则美国联邦地区法院应是解决根据《1933年证券法》(经修订)或《证券法》引起的诉讼原因的任何投诉的唯一法院。任何购买或以其他方式获得本公司股本股份的任何权益的人士或实体应被视为已通知并已同意本公司上述修订和重述的公司注册证书的规定。
我们相信,这项规定使我们受益,使特别是在解决公司纠纷方面经验丰富的首席法官或在解决证券法争议方面经验丰富的联邦法官在适用特拉华州法律方面更加一致,相对于其他论坛,以更快的时间表有效地管理案件,并保护免受多论坛诉讼的负担。然而,该条款可能会阻止对我们的董事、高级职员、雇员和代理人提起诉讼,因为它可能会限制任何股东在其认为有利于与我们或我们的董事、高级职员、雇员或代理人发生纠纷的司法论坛上提出索赔的能力,并导致股东提出索赔的成本增加。其他公司的公司注册证书中类似的法院选择条款的可适用性已在法律程序中受到质疑,并且,就针对我们提起的任何适用诉讼而言,法院可能会发现我们修订和重述的公司注册证书中所载的法院选择条款在此类诉讼中不适用或无法执行。如果法院认定我们修订和重述的公司注册证书中包含的法院选择条款在诉讼中不适用或不可执行,我们可能会在其他司法管辖区因解决该诉讼而产生额外费用,这可能会对我们的业务、财务状况或经营业绩造成不利影响。
我们使用我们的净经营亏损结转和其他税务属性来抵销未来应课税收入的能力可能会受到某些限制。
截至2023年12月31日,我们的美国联邦和州净营业亏损结转(NOL)分别为1.874亿美元和1.804亿美元,如果有的话,可以用来抵消未来的应税收入。截至2023年12月31日,我们还有联邦和州研发信贷结转,分别为1240万美元和490万美元。一般而言,根据修订后的1986年《国内税法》第382和383条或该法规,公司经历了“所有权变更”,通常定义为在三年的滚动期间,其股权所有权按价值计算的变化超过50个百分点,其利用变更前的NOL和其研发信贷结转以抵消未来应纳税所得额的能力受到限制。我们现有的NOL和研发信贷结转可能会受到之前所有权变更所产生的限制,如果我们发生所有权变更,我们利用NOL和研发信贷结转的能力可能会受到守则第382和383节的进一步限制。此外,根据守则第382和383条的规定,未来我们股权的变化,其中一些可能超出我们的控制范围,可能会导致所有权的变化。由于这些原因,即使我们实现了盈利,我们也可能无法利用NOL或研发信贷结转的很大一部分.
一般风险
我们的业务和运营可能会受到影响的信息技术系统故障,缺陷,或入侵,这可能会对我们的业绩造成重大影响。
我们的信息技术系统,以及我们的CRO和其他承包商和顾问的系统,都容易受到计算机病毒和其他恶意软件(例如,勒索软件)、未经授权的访问或其他网络安全攻击、自然灾害(包括飓风)、恐怖主义、战争、火灾以及电信或电气故障的故障或损坏。在我们正常的业务过程中,我们直接或间接地收集,
108
在我们的数据中心、我们的网络或第三方的数据中心和网络中存储和传输敏感信息,包括我们的临床试验受试者和员工的知识产权、机密信息、临床前和临床试验信息、专有业务信息、个人信息和与健康相关的信息。这些信息的安全处理、维护和传输对我们的运营至关重要。尽管我们采取了安全措施,但我们的信息技术和基础设施可能容易受到黑客或内部不良行为者的攻击,或因人为错误(例如,社会工程、网络钓鱼)、技术漏洞、渎职或其他中断而被攻破。随着来自世界各地的未遂攻击和入侵的数量、强度和复杂性的增加,安全漏洞或破坏的风险普遍增加,特别是通过网络攻击或网络入侵,包括计算机黑客、外国政府和网络恐怖分子。我们还可能面临更多的网络安全风险,因为我们对互联网技术的依赖以及我们远程工作的员工数量,这可能会为网络犯罪分子利用漏洞创造更多机会。我们可能无法预见所有类型的安全威胁,也可能无法针对所有这些安全威胁采取有效的预防措施。网络犯罪分子使用的技术经常变化,可能在启动之前不会被识别,并且可能来自各种各样的来源,包括外部服务提供商、有组织犯罪分支机构、恐怖组织或敌对的外国政府或机构等外部团体。即使我们确定了安全事件,我们也可能无法充分调查或补救事件或违规行为,因为攻击者越来越多地使用旨在规避控制、避免检测以及移除或混淆法医证据的工具和技术。我们不能向您保证,我们的数据保护努力和我们在信息技术方面的投资将防止我们的系统或我们的CDMO、CRO和其他承包商和顾问的系统出现重大故障、数据泄露或漏洞。
我们和我们的某些服务提供商不时受到网络攻击和安全事故。虽然我们认为我们迄今为止没有经历任何重大系统故障、事故或安全漏洞,但如果发生此类事件并导致我们的运营或关键第三方的运营中断,则可能会导致我们的候选产品开发计划、我们的运营,并最终导致我们的财务业绩受到重大影响。例如,已完成、正在进行或计划中的研究或试验中的临床前研究或临床试验数据的丢失可能导致我们的监管审批工作延迟,并显著增加我们恢复或复制数据的成本。如果任何中断或安全漏洞导致我们的数据或应用程序丢失或损坏,或不当披露个人、机密或专有信息,我们可能会承担责任,并延迟我们候选产品的进一步开发。任何此类重大安全漏洞都可能危及我们的信息技术系统,其中存储的信息可能被访问、公开披露、丢失或被盗。
任何此类信息的访问、披露或其他丢失都可能导致法律索赔或诉讼、保护个人信息隐私的法律责任和重大的监管处罚,此类事件可能会扰乱我们的运营、损害我们的声誉,并导致人们对我们和我们进行临床试验的能力失去信心,这可能会对我们的声誉造成不利影响,并推迟我们候选产品的临床开发。我们维持网络责任保险;然而,该保险可能不足以覆盖因我们的系统中断或被破坏而可能导致的财务、法律、商业或声誉损失。
我们或我们所依赖的第三方可能受到自然灾害或流行病的不利影响,我们的业务连续性和灾难恢复计划可能无法充分保护我们免受严重灾难的影响。
自然灾害或流行病可能严重扰乱我们的运营,并对我们的业务、运营结果、财务状况和前景产生重大不利影响。如果发生自然灾害、停电、大流行或其他事件,使我们无法使用全部或很大一部分总部,损坏关键基础设施,如我们所依赖的制造设施,或以其他方式中断运营,我们可能很难,甚至在某些情况下,不可能在很长一段时间内继续我们的业务。在发生严重灾难或类似事件时,我们现有的灾难恢复和业务连续性计划可能会被证明是不够的。由于我们的灾难恢复和业务连续性计划的有限性质,我们可能会产生大量费用,这可能会对我们的业务产生实质性的不利影响.
不稳定的市场和经济状况可能会对我们的业务、财务状况和股价产生严重的不利影响。
109
全球经济,包括信贷和金融市场,最近经历了极端动荡和混乱,包括流动性和信贷供应严重减少、利率和通货膨胀率上升、涉及银行和金融机构的危机、消费者信心下降、经济增长下降、失业率上升以及经济稳定的不确定性。如果股票和信贷市场继续恶化,或美国进入衰退,可能会使任何必要的债务或股票融资更难以及时或以优惠的条件获得,成本更高或更具稀释性。此外,我们的一个或多个CRO、供应商、CDMO或其他第三方供应商可能无法在经济衰退或衰退中幸存下来。因此,我们的业务、经营业绩和普通股价格可能会受到不利影响。
对环境可持续性和社会倡议的日益关注可能会增加我们的成本,损害我们的声誉,并对我们的财务业绩产生不利影响。
投资者、患者、环境活动家、媒体以及政府和非政府组织日益关注各种环境、社交及其他可持续性问题。我们可能面临压力,要求就影响我们的可持续发展事宜作出承诺,包括设计和实施与可持续发展有关的特定风险缓解策略措施。倘我们未能有效处理影响我们业务的环境、社交及其他可持续发展事宜,或设定及达致相关可持续发展目标,我们的声誉及财务业绩可能会受到影响。此外,即使我们能有效地解决该等问题,我们可能因执行可持续发展目标而增加成本,而成本可能不会因我们的声誉而被任何好处所抵销,这可能对我们的业务及财务状况造成不利影响。
此外,对环境、社会和其他可持续性问题的重视已经导致并可能导致通过新的法律和条例,包括新的报告要求。如果我们未能遵守新的法律、法规或报告要求,我们的声誉和业务可能会受到不利影响。
因为我们预计在可预见的未来不会对我们的普通股支付任何现金股息,资本增值(如果有的话)将是您唯一的收益来源。
我们从未宣布或支付任何现金股息我们的普通股。我们目前预计我们将保留所有可用资金和未来收益用于发展、运营和扩展我们的业务,并预计在可预见的将来不会宣派或支付任何现金股息。因此,我们普通股的资本增值(如果有的话)将是您在可预见的将来投资我们普通股的唯一收益来源。
我们可能会受到证券集体诉讼的影响。
过去,证券集体诉讼往往是在一家公司的证券市场价格下跌后对其提起的。这一风险与我们特别相关,因为生物技术公司近年来经历了大幅的股价波动。如果我们面临这样的诉讼,可能会导致巨额成本,并转移管理层的注意力和资源,这可能会损害我们的业务。
110
项目1B.未解决员工评论。
不适用。
项目1C。网络安全.
网络安全风险管理与策略
我们制定并实施了一项网络安全风险管理计划,旨在保护我们的关键系统和信息的机密性、完整性和可用性。我们的网络安全风险管理计划包括网络安全事件应对计划。
我们设计和评估我们的计划基于行业标准框架,如国家标准与技术研究所网络安全框架(NIST CSF)。 这并不意味着我们满足任何特定的技术标准、规范或要求,只是我们使用NIST CSF作为指导,帮助我们识别、评估和管理与我们业务相关的网络安全风险。
我们的网络安全风险管理计划已整合到我们的整体企业风险管理计划中,并共享适用于整个企业风险管理计划的通用方法、报告渠道和治理流程,以适用于其他法律、合规、战略、运营和财务风险领域。
我们的网络安全风险管理计划包括:
我们尚未从已知的网络安全威胁(包括之前的任何网络安全事件)中确定对我们产生重大影响或有合理可能对我们产生重大影响的风险,包括我们的运营、业务战略、运营结果或财务状况。有关详细信息,请参阅标题为“风险因素--如果发生信息技术系统故障、缺陷或入侵,可能会对我们的业绩产生重大影响时,我们的业务和运营可能会受到影响”一节。
网络安全治理
本公司董事会将网络安全风险视为其风险监督职能的一部分,并已委托审计委员会(“委员会”)监督网络安全和其他信息技术风险。该委员会监督管理层实施我们的网络安全风险管理计划。
委员会每年都会收到管理层关于我们网络安全风险的报告。此外,管理层在必要时向委员会通报任何重大网络安全事件以及任何影响较小的事件的最新情况。
委员会向董事会全体成员报告其活动,包括与网络安全有关的活动。董事会全体成员还听取管理层关于我们的网络风险管理计划的简报。董事会成员听取内部安全工作人员或外部专家关于网络安全主题的介绍,这是董事会关于影响上市公司的主题的继续教育的一部分。
111
我们的管理团队,包括首席财务官和数据和信息技术副总裁总裁,负责评估和管理我们来自网络安全威胁的重大风险。该团队对我们的整体网络安全风险管理计划负有主要责任,并监督我们的内部网络安全人员和我们聘请的外部网络安全顾问。我们管理团队的集体经验包括十多年领导网络安全监督和进行事件响应情景的桌面演练。
我们的管理团队通过各种手段监督预防、发现、缓解和补救网络安全风险和事件的工作,其中可能包括内部安全人员的简报;从政府、公共或私人来源(包括我们聘请的外部顾问)获得的威胁情报和其他信息;以及部署在信息技术环境中的安全工具产生的警报和报告。
项目2.财产.
2021年11月,我们与Are-MA Region No 94,LLC签订了一份租赁协议,租赁位于马萨诸塞州剑桥市查尔斯公园一号的办公和实验室总面积约89,246平方英尺。第一阶段租赁于2023年5月开始,第二阶段租赁于2023年8月开始。每一阶段的租赁期在每一阶段的租赁开始日期后15年结束,但须受某些延展权的限制。我们相信,我们的设施足以满足我们目前的需求,并会在需要时提供适当的额外空间。
项目3.法律专家cephalus。
我们不会受到任何实质性法律程序的约束。
项目4.矿山安全披露。
不适用。
关于我们的执行主管和董事的信息
下表载列截至本年报日期(表格10—K),本公司各行政人员及董事的姓名、年龄及职位:
名字 |
|
年龄 |
|
职位 |
行政人员 |
|
|
|
|
马赫什·卡兰德 |
|
51 |
|
董事首席执行官总裁 |
约书亚·里德 |
|
51 |
|
首席财务官 |
Thomas McCauley博士 |
|
55 |
|
首席科学官 |
Yan Moore,医学博士 |
|
57 |
|
首席医疗官 |
曾凌 |
|
55 |
|
首席法律和行政官 |
非雇员董事 |
|
|
|
|
克里斯蒂安·S Schade |
|
62 |
|
董事会主席 |
赖纳·博姆 |
|
63 |
|
董事 |
卢克·M·贝沙尔 |
|
65 |
|
董事 |
埃利奥特·M·利维医学博士 |
|
65 |
|
董事 |
约翰·门德林博士,J.D. |
|
64 |
|
董事 |
米歇尔·C·沃纳 |
|
48 |
|
董事 |
玛丽·T·塞拉 |
|
60 |
|
董事 |
Richard a.杨博士 |
|
69 |
|
董事 |
行政人员
112
马赫什·卡兰德自2019年6月以来,一直担任总裁兼首席执行官和我们的董事会成员。2018年4月至2019年3月,卡兰德先生担任总裁制药公司(随后的泽卡尼制药公司)的首席执行官兼首席执行官。2010年3月至2017年4月,卡兰德先生在诺华公司担任高级领导职务,包括美国肿瘤学副总裁兼特许经营主管、诺华非洲公司总裁和诺华公司埃及分公司总裁。卡兰德拥有宾夕法尼亚大学沃顿商学院的工商管理硕士学位。他还毕业于佐治亚理工学院和孟买大学,在那里他获得了工程学硕士学位,并在那里完成了工程学本科课程。我们相信,卡兰德先生丰富的生命科学和领导经验使他有资格在我们的董事会任职。
约书亚·里德自2022年5月以来一直担任首席财务官。在加入欧米茄之前,Reed先生于2018年7月至2022年5月担任Aldeyra Treeutics的首席财务官,负责财务、业务发展、投资者关系、合规、人力资源和信息技术。在Aldeyra任职期间,里德领导了多次融资,监督公司与现有和潜在投资者的互动,并管理公司财务流程的方方面面,包括提交给美国证券交易委员会的季度和年度报告。在加入Aldeyra之前,Reed先生在百时美施贵宝担任过各种责任日益增加的财务职务,最近的职务是2016年6月至2018年7月担任总裁副总裁和美国和波多黎各财务运营主管。在百时美施贵宝任职期间,里德先生还负责财务规划和分析,并参与了各种收购、资产剥离、联盟和合作协议的工作。在他职业生涯的早期,里德曾在摩根大通、瑞士信贷第一波士顿银行和大通曼哈顿银行任职。他目前还担任上市生物技术公司Scholar Rock的董事会成员和审计委员会主席。里德先生在罗格斯大学获得金融学学士学位,在密歇根大学罗斯商学院获得工商管理硕士学位。
Thomas McCauley博士,自2019年7月起担任我公司首席科学官。2018年9月至2019年7月,麦考利博士担任Macrolide PharmPharmticals(随后的Zikani治疗公司)首席科学官,并于2016年9月至2018年4月担任翻译生物公司(原Rana治疗公司)的首席科学官。2010年4月至2016年8月,麦考利博士担任夏尔制药副总裁兼全球非临床开发主管,期间他参与了夏尔的许多产品的开发和全球批准,包括治疗法布里病的Replagal®、治疗高谢病的Vprv®、治疗亨特综合征的Elaprase®、治疗遗传性血管性水肿的Firazyr®和治疗干眼症的XIIDRA®。麦考利博士拥有阿拉巴马大学伯明翰分校的博士学位,以及理学士和工程硕士学位。来自康奈尔大学。
Yan Moore,医学博士,自2022年1月起担任我公司首席医疗官。2018年9月至2021年12月,摩尔博士担任益普森制药肿瘤治疗区负责人高级副总裁。2016年9月至2018年9月,摩尔博士担任安基亚诺治疗公司(前身为BioCancell治疗公司)临床开发和研发部门的首席医疗官和高级副总裁。在他职业生涯的早期,摩尔博士在Ariad、赛诺菲、葛兰素史克和百时美施贵宝担任过多个职位,负责全球医疗事务和临床开发。作为一名临床医生,摩尔博士曾在萨皮尔医疗中心、梅尔医院和伊迪丝·沃尔夫森医疗中心工作过。摩尔博士在特拉维夫大学萨克勒医学院获得医学学位和医学学士学位,在德雷克塞尔大学勒博商学院获得工商管理硕士学位,并在哈佛商学院完成高级管理课程。
曾凌自2022年3月以来一直担任我们公司的首席法律和行政官。从2020年9月至2022年3月,曾女士最近在Dicerna PharmPharmticals担任首席法务官兼秘书,在那里她与其他高管、董事会及其委员会一起制定和实施公司战略、政策、合规和治理活动。2017年8月至2020年9月,曾女士在诺华制药担任集团并购法律部副主管,负责诺华集团的全球交易,包括所有业务部门和地区。在此之前,她曾在博世健康公司、Penwest制药公司和巴尔实验室公司担任过各种责任日益增加的法律行政职务。曾女士的法律生涯始于Cleary,Gottlieb,Steen和Hamilton,在此之前,她还曾在Alkermes Inc.和Leukosite Inc.担任研究员。曾女士在北京大学获得物理学理学学士学位,在布兰迪斯大学获得生物物理学理学硕士学位,并在乔治敦大学获得法学博士学位。
113
非雇员董事
克里斯蒂安·S Schade自2023年7月起担任本公司董事会成员,并自2023年8月起担任本公司董事会主席。沙德先生是一位经验丰富的高管,在私营和上市生物制药公司拥有30多年的经验,包括在几个高管职位上证明的领导力。他于2023年1月加入旗舰先锋,担任增长合伙人。2016年7月至2022年8月,总裁任阿普瑞亚治疗公司首席执行官。沙德自2016年以来一直担任Aprea治疗公司董事会成员,并于2020年9月至2023年8月担任董事会主席。在加入Aprea之前,他曾在Novira、Omthera制药公司和Medarex担任领导职务。除了行业专业知识外,Schade先生还从投资银行行业带来了广泛的企业融资和资本市场经验,曾在美林和摩根大通担任职务。自2006年以来,他一直在INCELA LifeSciences,Inc.(纳斯达克:IAT)的董事会任职。他拥有宾夕法尼亚大学沃顿商学院的工商管理硕士学位和普林斯顿大学的文学学士学位。我们相信,Schade先生在生物技术和投资银行行业的丰富领导经验使他有资格在我们的董事会任职。
赖纳·博姆自2022年9月以来一直担任我们的董事会成员。博姆先生为欧米茄带来了30多年的临床和管理经验。1988年至2017年,他在诺华制药股份公司及其前身CIBA-Geigy担任了多个高级管理职位,最近担任的是首席商业和医疗事务官。他是成功建立诺华肿瘤学公司的关键人物。他监督了全球不同地区许多轰动一时的品牌的推出和生命周期管理,其中包括肿瘤学领域的Femara、Zometa和Glivec,以及Cosentyx和Entresto以及免疫学和心血管疾病领域。在加入诺华公司之前,他曾在德国兹维法尔滕的精神病院担任部门负责人。博姆先生目前在Cellectis SA(纳斯达克市场代码:CLLS)、Humanigen Inc.(纳斯达克市场代码:HGEN)的董事会任职,并曾于2018年7月至2022年4月在北欧Nanovector S.A.的董事会任职。他拥有德国乌尔姆大学的医学学位和法国斯特拉斯堡校区席勒大学的工商管理硕士学位。最近,他开始在瑞士巴塞尔/伯尔尼/苏黎世大学攻读公共卫生硕士课程。我们相信,博姆先生在制药业的重要领导经验使他有资格在我们的董事会任职。
卢克·M·贝沙尔自2021年5月以来一直担任我们的董事会成员。贝沙尔先生在行政领导和首席财务官职位方面拥有30多年的经验,主要是在上市和私人持股的制药公司担任过。贝沙尔自2020年1月以来一直担任董事会主席,并自2018年10月以来担任上市免疫肿瘤学公司Protara Treeutics的董事会成员。2014年3月至2021年11月,公司被辉瑞公司收购,贝沙尔先生在这家上市的临床阶段免疫肿瘤学公司Trillium Treateutics Inc.担任董事。2015年5月至2021年9月,贝沙尔担任上市的领先临床阶段基因治疗公司Regenxbio,Inc.的董事会成员。在此之前,贝沙尔曾在2007年至2015年2月期间担任NPS PharmPharmticals,Inc.首席财务长总裁。NPS PharmPharmticals是一家专注于治疗罕见疾病的全球上市生物制药公司。在加入NPS制药公司之前,贝沙尔先生曾在2002年至2007年担任上市公司Cambrex Corporation的首席财务官总裁,该公司是一家上市的品牌和仿制药活性成分制造商和相关服务提供商。贝沙尔的职业生涯始于安达信会计师事务所,是一名注册会计师。贝沙尔在密歇根州立大学获得会计和财务管理学士学位,毕业于弗吉尼亚大学达顿商学院高管课程。我们相信,贝沙尔先生在制药业的丰富领导经验使他有资格在我们的董事会任职。
埃利奥特·M·利维医学博士,自2021年3月以来一直在我们的董事会任职。自2021年6月以来,利维博士一直在波士顿咨询集团担任高级顾问。利维博士于2014年9月至2020年6月担任安进全球发展部高级副总裁,于2020年6月至2021年5月担任研发战略及运营部高级副总裁。他还自2021年11月以来一直担任NuCana plc的董事会成员,自2023年4月以来担任Editas Medicine的董事会成员。利维博士在耶鲁大学获得医学博士学位,在耶鲁学院获得学士学位。我们相信,利维博士在该行业的丰富经验使他有资格在我们的董事会任职。
114
约翰·门德林博士,J.D.,自2020年1月以来一直担任我们的董事会成员。门德林博士目前是旗舰先锋公司的执行合伙人。从2018年1月到2019年2月,门德莱恩博士担任过Moderna公司企业和产品战略的总裁。从1996年到2017年,门德莱恩博士曾在多家生物技术公司担任过不同的高级管理和董事会职务,包括执行主席、首席执行官和总法律顾问,这些公司包括Affdium制药公司(被Debiamm Group收购)、Adnexus Treeutics(被BMS收购)、aTyr Pharma,Inc.或ATyr、Aurora Biosciences(被Vertex收购)和Fate Treateutics,Inc.。2011年至2017年,他还担任了aTyr的首席执行官。他的生物技术生涯始于史密斯-克莱恩和弗伦奇(现为葛兰素史克)。他目前担任Fate公司的董事会副主席,此前曾在Moderna、Mongraph、ATyr和Editas Medicine,Inc.的公开董事会任职。门德林博士拥有加州大学洛杉矶分校的生理学和生物物理学博士学位,加州大学黑斯廷斯法学院的法学博士学位,以及迈阿密大学的生物学学士学位。我们相信,门德林博士在生物技术行业的广泛科学经验和经验使他有资格在我们的董事会任职。
玛丽·T·塞拉自2019年6月以来一直担任我们的董事会成员。塞拉女士目前是私人拥有的免疫肿瘤学公司TriSalus生命科学公司(前身为Surefire Medical,Inc.)的首席执行官和总裁。2016年1月至2016年11月,塞拉女士担任Aegarie制药公司首席执行官和董事公司董事。2016年11月,Aegarie制药公司与QLT公司合并,成立Novelion治疗公司。直到2017年11月,Szela女士一直担任Novelion Treateutics Inc.的首席执行官和董事会成员。Szela女士于2013年4月至2015年8月担任抗生素开发公司Melinta Treateutics,Inc.的首席执行官和董事会成员。塞拉女士于1987年至2012年担任雅培的高级管理职位,包括2008年1月至2010年12月担任该公司美国制药业务的总裁。Szela女士曾担任下列上市公司的董事会成员:Kura Oncology,Inc.自2018年11月以来,Prometheus Biosciences自2021年3月至2023年6月,Coherus Biosciences自2014年7月至2021年8月,Alimera Sciences Inc.自2018年6月至2021年3月。塞拉女士获得了伊利诺伊大学的工商管理硕士学位和护理学士学位。我们相信,Szela女士在制药业的丰富领导经验使她有资格在我们的董事会任职。
Richard a.杨博士,自二零一七年八月起担任董事会成员。自1984年以来,他一直是怀特黑德研究所的成员和麻省理工学院的生物学教授。杨博士目前担任Syros Pharmaceuticals,Inc.的董事会成员。从2011年11月开始。2012年5月,他当选为国家科学院院士,2019年10月,他当选为国家医学院院士。杨博士获得了博士学位。耶鲁大学的分子生物物理学和生物化学博士。我们相信杨博士有资格在我们的董事会任职,因为他的科学专长。
米歇尔·C·沃纳,自2023年8月以来一直担任我们的董事会成员。她拥有20多年的生物制药经验,涵盖商业和研发职责,自2022年4月以来一直担任生物技术公司Alltrna的首席执行官和旗舰先锋公司的首席执行官兼合伙人。在担任现任职务之前,Werner女士于2020年7月至2022年4月在诺华肿瘤学担任全球特许经营主管、实体肿瘤主管,负责提供跨多种肿瘤的疾病领域战略,并领导业务发展工作。在加入诺华之前,她是阿斯利康的高级领导,担任过多个职位,包括2016年至2020年7月期间的全球血液学特许经营主管和美国肿瘤学主管。Werner女士之前在百时美施贵宝工作了10年,在美国和英国的销售、营销和市场准入方面担任过各种职务,在欧洲和全球的销售、营销和市场准入方面几乎只从事肿瘤学方面的工作。我们相信,Werner女士在制药业的丰富领导经验使她有资格在我们的董事会任职。
115
第II部
项目5.注册人的市场普通股、相关股东事项和发行人购买股权证券。
市场信息
我们的普通股自2021年7月30日起在纳斯达克全球精选市场公开交易,交易代码为OMGA。在此之前,我们的普通股没有公开市场。
持有者
截至2024年3月21日,我们的普通股约有79名登记持有者。实际股东的数量大于记录持有人的数量,包括作为受益者的股东,但其股票是由经纪人和其他被提名者以街头名义持有的。登记在册的股东人数也不包括其股份可能由其他实体以信托形式持有的股东。
股利政策
自成立以来,我们从未宣布或支付过普通股的任何现金股息。我们目前打算保留所有可用资金和任何未来收益,为我们业务的发展和扩张提供资金,我们预计在可预见的未来不会支付任何现金股息。未来宣布和支付股息的任何决定将由我们的董事会酌情决定,并将取决于当时的条件,包括我们的运营结果、财务状况、合同限制、资本要求、业务前景和我们的董事会可能认为相关的其他因素。
最近出售的未登记证券
在截至2023年12月31日的年度内,我们没有出售任何未登记的证券。
登记证券所得收益的使用
于二零二一年八月三日,我们完成首次公开发售(“首次公开发售”)。IPO中的股份的要约和出售是根据《证券法》根据表格S—1(文件号333—257794)登记的,该表格于2021年7月29日宣布生效。
我们首次公开募股所得款项净额约1.281亿美元已投资于资本保全投资,其中包括计息储蓄账户、短期和中期投资级证券、计息工具和美国政府证券。有关我们首次公开募股所得款项的计划用途的资料载于我们根据规则424(b)(4)于2021年8月2日向美国证券交易委员会提交的最终招股说明书的“所得款项用途”一节,该招股说明书中所述的我们首次公开募股所得款项净额余额的计划用途并无重大变化。
第六项。[已保留]
116
项目7.人AGEMENT对财务状况和经营成果的讨论和分析。
以下对本公司财务状况和经营结果的讨论和分析应与本年度报告10-K表格末尾的综合财务报表和相关附注一起阅读。本讨论和分析中包含的一些信息或本Form 10-K年度报告中的其他信息,包括与我们的业务计划和战略有关的信息,包括涉及风险和不确定性的前瞻性陈述。另请参阅本年度报告的Form 10-K中的“有关前瞻性陈述的特别说明”部分。
概述
欧米茄治疗公司是一家临床阶段的生物技术公司,开创了一种新型可编程表观基因组mRNA药物。我们的omega平台利用表观遗传学的力量和我们对基因组结构的深刻理解,精确定位并可控制地调节转录前水平的基因表达,以治疗或治疗疾病。我们已经破译了人类基因组的三维结构。基因及其伴随的调控因子被组织成不同的、进化上保守的结构,称为绝缘基因组结构域,或IGD。IGD是基因调控和细胞分化的基本结构和功能单位,是自然界对基因表达的天然调控系统。大多数疾病是由IGD改变引起的基因表达异常引起的。Omega平台使我们能够系统地识别和验证数千个新的基于DNA序列的表观基因组“邮政编码”,这些“邮政编码”与IGD中的单个调控元件相关。我们称这些表观基因组靶标为EpiZips。我们理性地设计和设计我们的信使核糖核酸疗法,称为表观基因组控制器,或ECs,以针对EpiZips进行精确的表观基因组控制。这使我们能够精确地将基因调节到所需的表达水平,并控制表达的持续时间。通过这种方法,我们相信omega平台在一系列疾病和疾病中具有广泛的潜在适用性,包括那些历来无法药物治疗、难以治愈和难以治疗的目标。我们目前正在筹备的项目包括肿瘤学、再生医学和多基因疾病,包括免疫学和心脏新陈代谢疾病。
自我们成立以来,我们已经产生了巨大的经营亏损。我们没有将任何产品商业化,也从未从产品销售中产生任何收入。我们将几乎所有的财政资源用于研究和开发,包括临床前开发活动,以及准备和启动候选产品的临床试验。迄今为止,我们主要以出售股本证券所得款项及贷款及抵押协议项下的借贷为营运提供资金。
截至2023年12月31日,我们拥有7340万美元的现金、现金等价物和有价证券。于2021年8月,我们完成首次公开发售(IPO),据此,我们发行及出售了8,300,976股普通股,其中包括900,976股,原因是承销商部分行使认购权,以每股17.00美元的公开发行价购买额外股份,总收益为1.411亿美元。在扣除承保折扣和佣金以及我们应支付的其他发售费用后,我们收到了大约1.281亿美元的净收益。2023年2月,我们完成了普通股的登记直接发售,据此,我们以每股5.78美元的收购价发行和出售了6920,415股普通股,在扣除估计发售费用后获得了约3970万美元的净收益。于2023年8月,吾等与Jefferies LLC(“Jefferies”)订立一项以Jefferies LLC(“Jefferies”)为销售代理的公开市场销售协议(“销售协议”),根据该协议,吾等可不时在2022年11月8日提交予美国证券交易委员会的S-3表格登记声明(文件编号333-268254)下的“在市场”或自动柜员机发售总值高达6,000,000美元的普通股,并于2022年11月18日宣布生效。于截至2023年12月31日止年度内,吾等并无根据销售协议出售任何普通股。
我们创造产品收入的能力将取决于我们一个或多个候选产品的成功开发、监管批准和最终商业化。在此之前,如果我们能够产生可观的产品收入,我们预计将通过股权发行、债务融资、营销和分销安排以及其他合作、战略联盟和许可安排或其他来源为我们的运营提供资金。我们可能不会以优惠的条件获得额外的融资来源,如果有的话。如果我们无法在需要时通过股权或债务融资筹集更多资金,我们可能会
117
被要求延迟、限制、减少或终止我们的产品开发或未来的商业化努力,或授予开发和营销我们原本更愿意自己开发和营销的候选产品的权利。
我们预计在可预见的将来,我们将继续承担重大的额外经营亏损,因为我们寻求通过临床开发推进候选产品,继续临床前开发,扩大我们的研发活动,开发新的候选产品,完成临床前研究和临床试验,寻求监管部门的批准,如果我们获得监管部门的批准,我们的产品商业化。我们的开支也将大幅增加,如果我们:
最新发展动态
于2023年12月31日,我们与诺和诺德A/S(“诺和诺德”)、先锋药业08,Inc.(“PM SpinCo”)以及先锋药业(NN)、有限责任公司(“股东”)及PM(NN)探索公司(“PMCo NN”及PM SpinCo及股东,“PM实体”)签订了研究合作协议(“Novo RCA”),并就新研究合作协议中所载的若干条款与旗舰先锋药业(“旗舰”)的关联公司先锋药业(NN)、有限责任公司(“股东”)及PM(NN)探索公司(“PM实体”)订立了合作协议。根据Novo RCA的条款,我们向诺和诺德授予了独家的、有版税的、可转让的许可,有权对我们的某些知识产权授予分许可,以便在与PM实体达成一致的研发计划下进行研究和开发活动,该计划与产品候选或计划目标有关,用于预防、治疗或控制世界各地人类的心脏代谢性疾病,包括糖尿病。在执行Novo RCA时,诺和诺德同意预付1000万美元的现金,在未来的开发和销售里程碑付款中至多支付5.22亿美元,以及授权产品净销售额的中高个位数到低两位数百分比的版税。这些付款将在我们和股东之间大致平均分配。2024年1月,我们收到了510万美元的预付现金。诺和诺德对授权产品和国家/地区支付版税的义务将在授权产品在该国家/地区首次商业销售、在该国家/地区适用于该授权产品的某些有效专利权利要求的最后一期到期以及该授权产品在该国家/地区的监管排他性到期之后的最晚十年内到期,但受Novo RCA中规定的某些许可使用费降低和逐步退出条款的限制。详情请参阅本年度报告结尾处综合财务报表附注内的附注11--合作协议。
118
发展计划
OTX—2002
于2022年7月,我们宣布美国食品药品监督管理局(“FDA”)批准我们的研究新药(“IND”)申请,以启动OTX—2002治疗肝细胞癌或HCC的I/II期首次人体临床试验。
在10月份 2022年,我们宣布了MYCHELANGELO I临床试验中的第一个患者。MYCHELANGELO I期试验旨在评估OTX-2002的安全性、耐受性、药代动力学、药效学和初步的抗肿瘤活性。OTX-2002是一种单一疗法(第1部分),与标准护理疗法(第2部分)相结合,用于治疗复发或难治性肝细胞癌和其他已知与MYC癌基因有关的实体肿瘤类型。这项研究预计将在美国、亚洲和欧洲的临床试验地点招募患者。
2022年11月,我们宣布OTX—2002获得FDA授予孤儿药指定,用于治疗HCC。
2023年3月,我们与罗氏公司签订了一项临床供应协议,作为我们1/2期MYCHELANGELO I临床试验的一部分,评估OTX-2002与罗氏公司的抗PD-L1疗法atezolizumab联合用于晚期MYC驱动的肝细胞癌患者。根据这项协议的条款,罗氏公司将提供阿特唑珠单抗,欧米茄公司将作为试验总体实施的一部分对合并进行评估。
2023年9月,我们宣布了正在进行的MYCHELANGELO I试验第一部分的最初两个剂量水平队列(n=8)的初步安全性、耐受性、药代动力学和翻译数据。在两种剂量水平的所有8名患者中,都观察到了高度特异的靶向接触和目标基因组位置上的预期表观遗传学变化,服用OTX-2002后,无细胞DNA MYC甲基化信号的强劲增加证明了这一点。这种对MYC的表观遗传调节转化为所有8名患者MYC表达的快速、有力和持久的下调,在服用OTX-2002的7天后,两种剂量水平的平均降幅约为55%。在这两种剂量水平下,OTX-2002总体耐受性良好,没有剂量限制毒性。基于这些初步数据,OTX-2002在单一治疗剂量递增方面继续取得进展。我们预计将在2024年年中报告单一疗法剂量上升的最新临床数据。此外,我们计划在2024年年中扩展到单一疗法和联合疗法。
OTX—2101
2022年10月,我们宣布选择OTX—2101作为第二个EC开发候选药物,以推进用于治疗非小细胞肺癌(NSCLC)的IND研究。.
其他欧共体项目
除了肝细胞癌和非小细胞肺癌,我们继续通过临床前研究推进欧米茄平台上的其他内皮细胞。
与宏观经济状况相关的重大风险和不确定性
全球经济,包括信贷和金融市场,最近经历了极端动荡和混乱,包括流动性和信贷供应严重减少、利率和通货膨胀率上升、涉及银行和金融机构的危机、消费者信心下降、经济增长下降以及经济稳定的不确定性。不稳定的市场及经济状况以及由流行病或国际政治动荡、战争及恐怖主义造成的进一步破坏,可能会对我们的业务、财务状况及经营业绩造成严重不利影响。
119
我们运营结果的组成部分
收入
到目前为止,我们还没有从产品销售中获得任何收入,在可预见的未来也不会从产品销售中获得任何收入。截至2023年12月31日,我们确认的收入是通过我们与PM(CF)Explorations,Inc.或PMCo的合作协议产生的,PMCo是旗舰公司的附属公司,于2021年11月签订,根据该协议,我们有权获得与我们进行的研究活动相关的费用补偿。
运营费用
研发费用
研发开支主要包括进行研发活动所产生的成本,包括:
我们按所发生的费用来支付研究和开发费用。根据对完成具体任务的进展情况的评价,确认研究和开发活动的费用。这些活动的付款基于个别协议的条款,这些条款可能与所发生的成本模式不同,并在我们的财务报表中作为预付或应计研究和开发费用反映出来。我们为将来收到的用于研发活动的商品或服务支付的不可退还的预付款被记录为预付费用,并在相关商品交付或提供服务时支出。
我们不会将与我们的发现工作、实验室用品和设施相关的成本(包括折旧或其他间接成本)分配给特定的项目,因为这些成本是跨多个项目和OMEGA平台分配的。我们使用内部资源主要用于开展我们的研究和发现活动,以及管理我们的临床前开发、工艺开发、生产和临床开发活动。这些员工跨多个项目和我们的技术平台工作,因此,我们不会按项目跟踪这些成本。
我们还在研发费用中计入一般咨询的某些关联方费用,以及与旗舰关联公司的设施成本和分租收入。
我们预计,随着我们继续进行当前的发现和研究计划,启动新的研究计划,继续进行候选产品的临床前开发,并对OTX—2002和我们的任何其他候选产品进行临床试验,我们的研发费用将继续增加。
一般和行政费用
一般及行政开支主要包括行政、财务、法律、人力资源、企业业务发展及行政职能人员的薪金及其他相关成本,如花红及福利,包括以股票为基础的薪酬。一般和行政费用还包括法律、专利、会计、信息技术、审计、税务、咨询服务、保险和设施相关费用的专业费用,其中包括直接折旧成本和设施租金和维护费的分配费用以及其他运营成本。
我们还包括与支付给旗舰公司的一般咨询费用以及代表我们产生的软件许可相关的某些相关费用和一般管理费用。此外,我们还包括与旗舰附属公司的设施成本和转租收入。
120
我们预计,随着我们继续支持我们的研发和候选产品的潜在商业化,我们的一般和管理费用在未来将会增加。我们还预计,与上市公司相关的费用将继续增加,包括会计、审计、法律、监管和税务合规服务的成本,董事和高级管理人员的责任保险成本,以及投资者和公关成本。
其他收入(费用),净额
利息收入(费用),净额
利息开支主要包括利息支付以及与我们的贷款和担保协议相关的债务贴现摊销。利息收入包括我们从有价证券及货币市场账户赚取的利息。
其他收入(费用),净额
其他收入(费用),净额主要包括已支付发票的汇兑损益,以及与经修订的贷款和担保协议相关的成功手续费义务的公允价值变化相关的重新计量损益。在结算前,我们的成功费用义务的公允价值的波动是基于每个报告期的重新计量。
行动的结果
截至二零二三年及二零二二年十二月三十一日止年度之比较
下表概述我们截至2023年及2022年12月31日止年度的经营业绩,以及该等项目的变动(以千美元计)及百分比。
|
|
截至十二月三十一日止的年度: |
|
|
增加额/ |
|
|
|
|
|||||||
|
|
2023 |
|
|
2022 |
|
|
(减少) |
|
|
更改百分比 |
|
||||
来自关联方的协作收入 |
|
$ |
3,094 |
|
|
$ |
2,073 |
|
|
$ |
1,021 |
|
|
|
49 |
% |
运营费用: |
|
|
|
|
|
|
|
|
|
|
|
|
||||
研发 |
|
|
77,169 |
|
|
|
81,167 |
|
|
|
(3,998 |
) |
|
|
(5 |
)% |
一般和行政 |
|
|
26,186 |
|
|
|
23,672 |
|
|
|
2,514 |
|
|
|
11 |
% |
总运营费用 |
|
|
103,355 |
|
|
|
104,839 |
|
|
|
(1,484 |
) |
|
|
(1 |
)% |
运营亏损 |
|
|
(100,261 |
) |
|
|
(102,766 |
) |
|
|
(2,505 |
) |
|
|
(2 |
)% |
其他收入(费用),净额: |
|
|
|
|
|
|
|
|
|
|
|
|
||||
利息收入,净额 |
|
|
2,810 |
|
|
|
222 |
|
|
|
2,588 |
|
|
NM |
|
|
其他收入(费用),净额 |
|
|
23 |
|
|
|
(157 |
) |
|
|
180 |
|
|
NM |
|
|
其他收入合计,净额 |
|
|
2,833 |
|
|
|
65 |
|
|
|
2,768 |
|
|
NM |
|
|
净亏损 |
|
$ |
(97,428 |
) |
|
$ |
(102,701 |
) |
|
$ |
(5,273 |
) |
|
|
|
|
NM--没有意义
收入
截至2023年12月31日的年度收入为310万美元,截至2022年12月31日的年度收入为210万美元,其中包括与2021年11月与PMCO签订的合作协议相关的研究费用的报销。
121
研发费用
在截至2023年12月31日的一年中,研发费用从截至2022年12月31日的8120万美元减少到7720万美元,减少了400万美元。400万美元的减少主要是由于外部研究成本减少了920万美元,外部制造成本减少了550万美元,咨询和专业费用减少了80万美元,实验室费用减少了60万美元,但与人员相关的费用增加了400万美元,其中包括支持业务增长的股票薪酬,以及设施和其他成本690万美元,这部分抵消了减少的费用。
一般和行政费用
在截至2023年12月31日的一年中,一般和行政费用增加了250万美元,从截至2022年12月31日的2370万美元增加到2620万美元。250万美元的增长主要是由通过专业人员和咨询费增加140万美元,设施和其他行政费用增加110万美元。
利息收入
截至2023年12月31日的年度的利息收入为280万美元,截至2022年12月31日的年度的利息收入为20万美元。利息收入净额增加260万美元,归因于在截至2023年12月31日的一年中,由于利率上升,有价证券和货币市场账户的利息收入增加。
其他费用,净额
其他支出,截至2023年12月31日的年度净收益不到10万美元,截至2022年12月31日的年度支出为20万美元。在截至2023年12月31日的一年中,其他收入净额的增加主要是由于处置固定资产的收益。
流动资金和资本资源
流动资金来源
自我们成立以来,我们已经产生了巨大的经营亏损。我们预计在可预见的将来将产生重大开支和经营亏损,因为我们支持我们的持续研究活动以及我们的项目和平台的开发。我们尚未将任何产品商业化,我们预计数年内不会产生产品收入(如果有的话)。迄今为止,我们的营运资金主要来自出售股本证券(包括我们的首次公开募股和注册直接发售)的所得款项,以及根据贷款和抵押协议借款。
于2021年8月,我们完成首次公开募股,据此,我们发行及出售8,300,976股普通股,包括部分行使承销商选择权以每股17. 00美元购买额外股份而发行的900,976股股份,所得款项总额为141. 1百万美元。扣除承销折扣、佣金及其他应付发行费用后,我们收到约1.281亿美元的所得款项净额。于2023年2月,我们完成了普通股的登记直接发售,据此,我们以每股5. 78美元的购买价发行及出售了6,920,415股普通股,并在扣除估计发售开支后获得了约3,970万美元的所得款项净额。
于2023年8月,吾等订立以杰富瑞为销售代理的销售协议,据此,吾等可不时根据我们于2022年11月8日提交予美国证券交易委员会的S-3表格登记声明(文件编号333-268254)发行及销售总值高达6,000,000美元的普通股,而于2022年11月8日提交予美国证券交易委员会的“在市场”或自动柜员机发售普通股,并于2022年11月18日宣布生效。根据销售协议,普通股的销售(如有)可在证券法第415(A)条定义的“按市场发售”的销售中进行,包括直接通过纳斯达克全球精选市场或在我们普通股的任何其他现有交易市场进行的销售,或向或通过做市商进行的销售。于截至2023年12月31日止年度内,吾等并无根据销售协议出售任何普通股。
122
现金流
下表概述我们于各呈列期间的现金来源及用途(以千计):
|
|
截至十二月三十一日止的年度: |
|
|||||
|
|
2023 |
|
|
2022 |
|
||
用于经营活动的现金净额 |
|
$ |
(91,510 |
) |
|
$ |
(98,515 |
) |
投资活动提供(用于)的现金净额 |
|
|
47,515 |
|
|
|
(18,060 |
) |
融资活动提供的现金净额 |
|
|
41,823 |
|
|
|
708 |
|
现金、现金等价物和限制性现金的净变化 |
|
$ |
(2,172 |
) |
|
$ |
(115,867 |
) |
经营活动
在截至2023年12月31日的12个月中,用于经营活动的净现金总额为9150万美元,而在截至2022年12月31日的12个月中,用于经营活动的净现金为9850万美元。营业现金流出减少700万美元,主要是由于在截至2023年12月31日的一年中确认的净亏损减少了530万美元。
投资活动
在截至2023年12月31日的一年中,投资活动提供的净现金总额为4750万美元,而截至2022年12月31日的一年,投资活动中使用的现金净额为1810万美元。投资活动提供的现金增加,主要是由于有价证券到期日收益增加,为2,880万美元,而有价证券购买量减少,为3,760万美元。
融资活动
截至2023年12月31日的年度,融资活动提供的现金净额主要包括我们在2023年2月登记的直接发售所得的3970万美元,扣除发行成本和租赁融资交易所得的260万美元。在截至2022年12月31日的一年中,融资活动提供的净现金包括行使股票期权的70万美元收益。有关销售-回租融资交易的更多信息,请参阅本年度报告末尾综合财务报表附注中附注9-承诺和或有事项中的保暖家具销售-回租。
贷款和担保协议
2018年3月9日,我们与太平洋西部银行(“PWB”)签订了一项贷款协议,初步借款800万美元,并于2019年9月30日(“第一修正案”)、2020年1月22日(“第二修正案”)、2020年12月30日(“第三修正案”)和2021年12月20日(“第四修正案”)进一步修订。
于2023年9月22日,吾等订立另一项贷款协议修正案(“第五修正案”),根据该修正案,普华永道将贷款到期日延长至2027年9月30日,惟于吾等于2024年12月31日或之前收到出售其股权证券所得至少5,000万美元现金收益及/或不可退还的前期战略伙伴关系收益后,贷款到期日可进一步延长至2028年9月30日。这笔贷款从2023年9月30日开始偿还,每月本金支付30万美元外加利息,如果到期日不延长到2028年9月30日,还将在2027年9月30日支付400万美元的结账。利息将继续按浮动年率厘定,以(I)较当时最优惠利率加0.50%及(Ii)5.50%两者中较大者为准。我们产生了15,000美元的债务发行成本,这笔成本被记录为对额外定期贷款的直接减少,并使用实际利率法在相关定期贷款的期限内作为利息支出的组成部分进行摊销。根据第五修正案的条款,我们必须根据第五修正案支付10万美元的成功费,此外,根据第四修正案,我们还必须支付20万美元的成功费义务。成功费用取决于是否实现了特定的流动性事件。我们确定,成功费用债务是一种独立的金融工具,在我们的综合资产负债表上被归类为负债,最初记录在
123
公允价值,每个报告期的公允价值变动在其他费用、综合经营报表净额和全面亏损中确认。这种债务的公允价值在每个报告期结束时重新计量,直到清偿债务为止。
此外,根据第五修正案,我们同意在任何时候与PWB保持至少500万美元的无限制现金余额,但在我们提前支付总计至少500万美元的未偿还贷款或贷款本金余额低于1000万美元时终止。
经修订的贷款协议下的借款以我们的几乎所有个人财产(我们的知识产权除外)为抵押。经修订的《贷款协议》没有任何金融契约;然而,我们必须遵守某些肯定和消极的契约,我们将一直遵守这些契约,直至到期。.
截至2023年12月31日,我们拥有7340万美元的现金、现金等价物和有价证券。我们预计,与我们正在进行的活动相关的费用将大幅增加,特别是在我们推进临床前活动并为OTX-2002和任何其他正在开发的候选产品进行临床试验的时候。此外,作为一家上市公司,我们将继续产生与运营相关的额外成本。我们的经营和资本开支的时间和数额将在很大程度上取决于:
我们相信,我们现有的现金、现金等价物和有价证券将使我们能够为2025年第一季度的运营费用和资本支出需求提供资金。然而,我们基于可能被证明是不正确的假设做出了这一估计,我们可以比预期更快地利用可用的资本资源。自成立以来,我们一直存在经常性亏损,预计在可预见的未来,我们将继续产生运营亏损,并在运营中使用现金。我们预计将通过股票发行、债务融资、营销和分销安排以及其他合作、战略联盟和许可安排或其他来源的组合来为我们未来的现金需求提供资金。资本市场的波动和美国的总体经济状况可能是筹集所需资金的重大障碍
124
因此,我们可能无法以可接受的条件获得必要的资金。这让人对我们作为一家持续经营的企业继续下去的能力产生了极大的怀疑。
合同义务
我们在正常的业务过程中与CRO、CDMO和其他第三方就临床前研究、测试和制造服务签订合同。这些合同通常不包含最低购买承诺,通常我们可以在书面通知后取消。取消时应支付的款项包括截至取消之日为止所提供服务的付款或发生的费用,包括我们服务提供商的不可取消的义务,在与CRO和CDMO达成某些安排的情况下,可能包括不可取消的费用。在合同被取消之前,不知道取消付款的金额和时间。
我们还与旗舰先锋创新V,Inc.、怀特黑德生物医学研究所、Acuitas和Nitto Denko Corporation签订了许可协议,根据这些协议,我们有义务支付潜在的里程碑付款、特许权使用费或两者兼而有之。这种付款取决于使用协议许可的知识产权的产品的开发,并取决于未来事件的发生;因此,这种潜在义务的时间和可能性无法确切地知道。
如前所述,我们根据经修订的贷款协议借入本金总额2,000万美元。根据经修订的贷款协议条款,我们有义务从2023年9月30日开始每月偿还30万美元的本金加利息,如果到期日不延长至2028年9月30日,我们有义务在2027年9月30日支付400万美元的结账款项。截至2023年12月31日,本金余额为1,900万美元。
我们拥有办公室和实验室,这些空间是根据2017年签订的不可取消租赁协议签订的,将于2024年9月到期。在剩余的租期内,我们每月的租赁费约为10万美元。2020年9月,该空间被完全转租给另外两个政党,这两个政党是旗舰品牌的附属公司。其中一份转租协议于2022年5月终止,另一份转租协议将于2024年9月到期。
2021年11月,我们与Are-MA Region No 94,LLC签订了一项租赁协议,租赁位于马萨诸塞州剑桥市第一街140号的办公和实验室空间,总面积约89,246平方英尺,邮编:02142。租期于2023年5月(第一期)及2023年8月(第二期)开始,租期于租约开始后十五年届满,但须受若干续期权利规限。租赁楼面的基本租金为每平方英尺116.00元,自首次支付租约租金一周年起,每年可向上调整当时租金的3%,并可根据我们使用某些租户改善津贴的情况,作出其他可能的调整。2023年7月,我们与旗舰公司的附属公司达成共享空间安排,转租位于马萨诸塞州剑桥市第一街140号的办公和实验室空间,以补充我们的增长计划。
关键会计政策和估算
我们管理层对我们财务状况和经营结果的讨论和分析是以我们的合并财务报表为基础的,这些报表是根据美国公认的会计原则或GAAP编制的。在持续的基础上,我们评估这些估计和判断,包括下面描述的那些。我们的估计是基于历史经验和我们认为在这种情况下合理的各种其他假设。这些估计和假设构成了对资产和负债的账面价值作出判断的基础,这些资产和负债的账面价值从其他来源看起来并不是很明显。实际结果和经验可能与这些估计大相径庭。
虽然我们的主要会计政策在本年度报告末尾的附注2--综合财务报表附注中的重要会计政策摘要中有更全面的描述,但我们认为以下会计政策对编制我们的综合财务报表所使用的判断和估计最为关键。
应计研究与开发费用
125
作为编制合并财务报表过程的一部分,我们需要估计我们应计的研究和开发费用。这一过程包括审查未结合同和采购订单,与我们的适用人员沟通,以确定代表我们执行的服务,并在我们尚未收到发票或以其他方式通知实际成本时,估计所执行的服务水平和服务产生的相关成本。我们的大多数服务提供商按照预定的时间表或在达到合同里程碑时向我们开出欠款发票,但也有一些需要预付款。我们根据我们当时所知的事实和情况,在合并财务报表中对截至每个资产负债表日期的应计费用进行估计。我们定期与服务提供商确认这些估计的准确性,并在必要时进行调整。预计应计研究和开发费用的例子包括支付给供应商的与临床前和临床开发活动有关的费用、与临床开发和研究活动有关的CRO以及与研究材料生产有关的CDMO。
我们根据与第三方服务提供商(包括代表我们提供、实施和管理临床前和临床研究的CRO和CDMO)的报价和合同,根据我们对收到的服务和花费的努力的估计来估计应计研发费用。这些协议的财务条款有待谈判,不同的合同各不相同,可能导致付款不均衡。在某些情况下,向我们的供应商支付的款项可能会超过所提供的服务水平并导致费用的预付款,在这种情况下,将根据预计实现的时间对费用进行当前或长期分类评估。在应计服务费时,我们估计将提供服务的时间段和每段时间的努力程度。如果服务的实际执行时间或努力程度与估计值不同,我们会相应地调整应计费用或预付费用的金额。尽管我们预计我们的估计不会与实际发生的金额有实质性差异,但我们对所提供服务的状态和时间相对于所提供服务的实际状态和时间的理解可能会有所不同,并可能导致在任何特定时期确认的增加或减少金额的估计发生变化。到目前为止,我们对应计研究和开发费用的先前估计没有任何重大调整。
近期发布的会计公告
吾等已审阅所有最近发布的会计声明,并已确定,除本年报末尾的综合财务报表附注中披露的附注2--主要会计政策摘要所披露外,该等准则将不会对吾等的财务报表产生重大影响,或不适用于吾等目前的业务。
新兴成长型公司和较小的报告公司地位
我们符合《2012年创业启动法案》(JumpStart Our Business Startups Act Of 2012)或《就业法案》(JOBS Act)所定义的“新兴成长型公司”的资格。因此,我们可能会利用特定的减少披露和其他适用于上市公司的其他报告要求。特别是,《就业法案》规定,新兴成长型公司可以利用延长的过渡期来遵守新的或修订的会计准则。我们已选择不“选择退出”延长的过渡期,这意味着当一项标准发布或修订时,如果它对上市公司或私人公司有不同的应用日期,我们可以在私人公司采用新的或修订的标准时采用新的或修订的标准,并可以这样做,直到我们(I)不可撤销地选择“选择退出”延长的过渡期或(Ii)不再具有新兴成长型公司的资格。
根据证券法和交易法的定义,我们也是一家“较小的报告公司”。只要(I)非关联公司持有的我们普通股的市值低于2.5亿美元或(Ii)我们在最近结束的会计年度的年收入低于1亿美元,并且非关联公司持有的我们普通股的市值低于7亿美元,我们就可以继续成为一家规模较小的报告公司。如果我们是一家较小的报告公司,当我们不再是一家新兴的成长型公司时,我们可能会继续依赖较小的报告公司可以获得的某些披露要求的豁免。具体地说,作为一家规模较小的报告公司,我们可能会选择在我们的Form 10-K年报中只公布最近两个财政年度的经审计财务报表,并减少了关于高管薪酬的披露义务,如果我们是新兴成长型公司,
126
较小的申报公司根据上文第(Ii)项的规定,我们将不需要获得由我们的独立注册会计师事务所出具的关于财务报告的内部控制的认证报告。
127
第7A项。量与质关于市场风险的披露。
我们是交易法规则12b-2中定义的较小的报告公司,不需要提供本项目7A所要求的信息。
项目8.财务报表和补充数据。
第8项所要求的财务资料载于本报告第F-1页开始。
128
项目9.和的更改在会计和财务披露问题上与会计师意见相左。
没有。
第9A项。控件和程序。
对控制和程序有效性的限制
在设计和评估我们的披露控制和程序时,管理层认识到,任何控制和程序,无论设计和操作多么良好,都只能为实现预期的控制目标提供合理的保证。此外,披露控制和程序的设计必须反映这样一个事实,即存在资源限制,要求管理层在评估可能的控制和程序相对于其成本的好处时作出判断。
对披露控制和程序的评价
截至2023年12月31日,我们的管理层在首席执行官和首席财务官的参与下,评估了我们的披露控制和程序(如《交易法》第13a-15(E)和15d-15(E)条所定义)的有效性。根据评估,我们的首席执行官和首席财务官得出结论,截至2023年12月31日,我们截至该日期的披露控制和程序在合理的保证水平下有效。
管理层关于财务报告内部控制的年度报告
我们的管理层负责建立和维持对财务报告的充分内部控制,如《交易法》第13a—15(f)条所定义的。我们的管理层根据Treadway Commission的赞助组织委员会发布的“内部监控—综合框架(2013年)”所载的标准,对财务报告内部监控的有效性进行评估。基于此评估,我们的管理层得出结论,截至2023年12月31日,我们对财务报告的内部监控有效。
由于“美国证券交易委员会”规则为“新兴成长型公司”设定了一个过渡期,因此本年度10-K表格不包括我们独立注册会计师事务所的认证报告。
财务报告内部控制的变化
在截至2023年12月31日的季度内,我们对财务报告的内部控制(根据《外汇法案》规则13a-15(F)和15d-15(F)的定义)没有发生重大影响或合理地可能对我们的财务报告内部控制产生重大影响的变化。
项目9B。其他信息.
(A)为了确保有足够的资源推进其领先计划,并最大限度地利用其平台创造短期和长期价值机会,该公司于2024年3月宣布了一项战略优先顺序。作为这一计划的一部分,该公司精简了组织并优化了研发工作和成本结构,以将其现金跑道延长至2025年第一季度。
(B)。最近,该公司与某些投资者就公开募股的可能性进行了秘密讨论。目前,鉴于目前的市场状况,本公司已决定不继续进行此类融资。该公司将继续评估其现金需求和业务前景,如果它认为市场状况有利,它可能会在未来寻求额外的融资。
(C)。在2023年第四财季,董事或交易法第16a-1(F)条所定义的官员,
项目9C。Disclo对于阻止检查的外国司法管辖区,这是肯定的。
129
不适用。
130
第三部分
项目10.董事、执行干事和公司治理。
商业行为和道德准则
我们已经通过了一份书面的商业行为和道德守则,该守则适用于我们的所有董事、高级管理人员和员工,包括我们的首席执行官、首席财务官、首席会计官或财务总监,或执行类似职能的人员。守则的最新版本可在我们网站ir.omegaTreateutics.com的投资者部分获得。我们打算在我们的网站上披露根据美国证券交易委员会或纳斯达克规则需要披露的对我们的代码的任何修改或豁免. 对本公司网站地址的引用并不构成对本公司网站所载或通过本网站提供的信息的引用,您不应将其视为本Form 10-K年度报告的一部分。
行政人员及董事
所要求的有关我们的执行人员和董事的信息 在本年度报告表格10-K第I部分的末尾,本项目10载于“有关本公司行政人员及董事的资料”的标题下。
第10项要求的其余信息将包括在我们提交给美国证券交易委员会或美国证券交易委员会的关于我们2024年股东年会的最终委托书中,标题为“公司治理”、“拖欠第16(A)条报告”(如果适用)和“董事会委员会”,并通过引用并入本文。
项目11.执行补偿。
第11条所要求的信息将包括在我们提交给美国证券交易委员会的关于我们2024年股东年会的最终委托书中,标题为“高管和董事薪酬”和“薪酬委员会联锁和内部人参与”(如果适用),并通过引用并入本文。
131
项目12.担保所有权若干实益拥有人及管理层及相关股东事宜。
根据股权补偿计划授权发行的证券(截至2023年12月31日)
计划类别 |
|
行使未偿还期权、认股权证及权利时将发行的证券数目 |
|
|
未偿还期权、权证和权利的加权平均行权价 |
|
|
股权补偿计划下未来可供发行的证券数量(不包括第一栏中的证券) |
|
|||
证券持有人批准的股权补偿计划 (1) |
|
|
8,780,737 |
(2) |
|
$ |
5.69 |
(3) |
|
|
4,019,697 |
(4) |
未经证券持有人批准的股权补偿计划 |
|
|
— |
|
|
|
— |
|
|
|
— |
|
总计 |
|
|
8,780,737 |
|
|
|
|
|
|
4,019,697 |
|
|
本第12项要求的其余信息将包括在我们提交给美国证券交易委员会的关于我们2024年股东年会的最终委托书中,标题为“某些受益所有者和管理层的担保所有权”,并通过引用并入本文。
项目13.某些关系和关联交易,以及董事的独立性。
第13条所要求的信息将包括在我们提交给美国证券交易委员会的关于我们2024年股东年会的最终委托书中,标题为“公司治理”和“某些关系和关联人交易”,并通过引用并入本文。
132
第14项.主体会计费用和服务费。
第14项要求的信息将包括在我们提交给美国证券交易委员会的关于我们2024年股东年会的最终委托书中,标题为“独立注册会计师事务所费用和其他事项”,并通过引用并入本文。
标准杆T IV
133
项目15. 附件、财务报表附表。
(a)(1)关于本报告所包括的财务报表的清单,见本年度报告第F—1页表格10—K的合并财务报表索引,该索引以引用的方式并入本项目。
(A)(2)由于财务报表附表不是必需的或不适用,或资料已列入合并财务报表或其附注,财务报表附表已被省略。
(A)(3)展品:
|
|
|
以引用方式并入 |
提交日期 |
随信存档/提供 |
||
展品 数 |
|
描述 |
表格 |
文件编号 |
展品 |
||
3.1 |
|
重述的公司注册证书。 |
8-K |
001-40657 |
3.1 |
08/03/2021 |
|
|
|
|
|
|
|
|
|
3.2 |
|
修订及重新编订附例。 |
8-K |
001-40657 |
3.1 |
12/11/2023 |
|
|
|
|
|
|
|
|
|
4.1 |
|
普通股证书样本。 |
S-1/A |
333-257794 |
4.2 |
07/26/2021 |
|
|
|
|
|
|
|
|
|
4.2 |
|
日期为二零二一年三月四日的经修订及重列投资者权利协议。 |
S-1/A |
333-257794 |
4.1 |
07/26/2021 |
|
|
|
|
|
|
|
|
|
4.3 |
|
经修订并重申的购买股票的认股权证,日期为2019年9月30日,以购买A系列优先股。 |
S-1/A |
333-257794 |
4.3 |
07/26/2021 |
|
|
|
|
|
|
|
|
|
4.4 |
|
股本说明。 |
10-K |
001-40657 |
4.4 |
03/10/2022 |
|
|
|
|
|
|
|
|
|
10.1# |
|
Omega Therapeutics,Inc.及其董事和官员。 |
S-1/A |
333-257794 |
10.8 |
7/26/2021 |
|
|
|
|
|
|
|
|
|
10.2# |
|
2021年奖励计划及其项下协议形式。 |
S-1/A |
333-257794 |
10.2 |
7/26/2021 |
|
|
|
|
|
|
|
|
|
10.3# |
|
2021年员工购股计划。 |
S-1/A |
333-257794 |
10.3 |
7/26/2021 |
|
|
|
|
|
|
|
|
|
10.4# |
|
非员工董事薪酬计划。 |
S-1/A |
333-257794 |
10.4 |
7/26/2021 |
|
|
|
|
|
|
|
|
|
10.5# |
|
Mahesh Karande和注册人之间的雇佣协议,日期为2021年7月25日。 |
S-1/A |
333-257794 |
10.17 |
7/26/2021 |
|
|
|
|
|
|
|
|
|
10.6# |
|
Thomas McCauley和注册人之间的雇佣协议,日期为2021年7月24日。 |
S-1/A |
333-257794 |
10.18 |
7/26/2021 |
|
|
|
|
|
|
|
|
|
10.7# |
|
Yan Moore与注册人签订的雇佣协议,日期为2021年12月12日。 |
10-K |
001-40657 |
10.8 |
3/10/2022 |
|
|
|
|
|
|
|
|
|
10.8# |
|
2022年3月18日,凌曾与注册人签订的雇佣协议。 |
10-Q |
001-40657 |
10.3 |
05/04/2022 |
|
|
|
|
|
|
|
|
|
10.9# |
|
Joshua Reed和注册人之间的雇佣协议,日期为2022年4月28日。 |
|
|
|
|
* |
|
|
|
|
|
|
|
|
10.10# |
|
理查德·A. Young and the Registrant,2016年11月7日。 |
10-K |
001-40657 |
10.9 |
03/10/2022 |
|
|
|
|
|
|
|
|
|
10.11# |
|
Richard A. Young and the Registrant,日期为2021年10月29日。 |
10-K |
001-40657 |
10.1 |
03/10/2022 |
|
|
|
|
|
|
|
|
|
134
10.12# |
|
Richard A. Young and the Registrant,2022年10月5日。 |
|
|
|
|
* |
|
|
|
|
|
|
|
|
10.13# |
|
理查德·A·杨和注册人之间的咨询协议修正案,日期为2023年10月6日。 |
|
|
|
|
* |
|
|
|
|
|
|
|
|
10.14 |
|
太平洋西部银行(n/k/a PacWest Bancorp)与注册人之间的贷款和担保协议,日期为2018年3月9日,于2019年9月30日、2020年1月22日和2020年12月30日修订。 |
S-1/A |
333-257794 |
10.1 |
07/26/2021 |
|
|
|
|
|
|
|
|
|
10.15 |
|
《贷款和担保协议第四修正案》,日期为2021年12月20日。 |
8-K |
001-40657 |
10.1 |
12/21/2021 |
|
|
|
|
|
|
|
|
|
10.16 |
|
贷款和担保协议第五修正案,日期为2023年9月22日。 |
8-K |
001-40657 |
10.1 |
09/22/2023 |
|
|
|
|
|
|
|
|
|
10.17 |
|
旗舰先锋创新V,Inc.与注册人之间的许可协议,日期为2019年3月12日。 |
S-1 |
333-257794 |
10.1 |
07/09/2021 |
|
|
|
|
|
|
|
|
|
10.18 |
|
旗舰先锋创新V,Inc.与注册人于2023年12月31日签订的与2019年3月12日的许可协议有关的书面协议 |
|
|
|
|
* |
|
|
|
|
|
|
|
|
10.19 |
|
怀特黑德生物医学研究所和注册人之间的独家许可协议,日期为2019年5月22日。 |
S-1 |
333-257794 |
10.1 |
07/09/2021 |
|
|
|
|
|
|
|
|
|
10.20 |
|
2019年5月22日,怀特黑德生物医学研究所和注册人之间关于研究合作的放弃、确认和协议,生效日期为2019年5月22日。 |
|
|
|
|
* |
|
|
|
|
|
|
|
|
10.21 |
|
怀特黑德生物医学研究所和注册人之间的共同独家许可协议,日期为2019年5月22日。 |
S-1 |
333-257794 |
10.1 |
07/09/2021 |
|
|
|
|
|
|
|
|
|
10.22 |
|
2019年5月22日,怀特黑德生物医学研究所和注册人之间关于研究合作的放弃、确认和协议,生效日期为2019年5月22日。 |
|
|
|
|
* |
|
|
|
|
|
|
|
|
10.23 |
|
Acuitas Treateutics,Inc.与注册者之间的开发和选项协议,日期为2020年10月5日,经修订。 |
S-1 |
333-257794 |
10.2 |
07/09/2021 |
|
|
|
|
|
|
|
|
|
10.24 |
|
Acuitas治疗公司与注册人之间的非独家许可协议,日期为2021年3月22日。 |
S-1 |
333-257794 |
10.2 |
07/09/2021 |
|
|
|
|
|
|
|
|
|
10.25 |
|
日东电工公司与注册人之间的合作和许可协议,日期为2022年10月12日。 |
10-K |
001-40657 |
10.20 |
03/01/2023 |
|
|
|
|
|
|
|
|
|
10.26 |
|
BMR-325 Vassar Street LLC与注册人之间的租赁协议,日期为2017年11月30日。 |
S-1/A |
333-257794 |
10.1 |
07/26/2021 |
|
|
|
|
|
|
|
|
|
135
10.27 |
|
欧米茄治疗公司和ARE-MA地区第94号,有限责任公司之间的租赁协议。 |
10-K |
001-40657 |
10.1 |
03/10/2022 |
|
|
|
|
|
|
|
|
|
10.28 |
|
欧米茄治疗公司和ARE-MA地区有限责任公司之间租赁的第一修正案,日期为2023年5月3日 |
10-Q |
001-40657 |
10.1 |
08/03/2023 |
|
|
|
|
|
|
|
|
|
10.29 |
|
欧米茄治疗公司和森达生物科学公司共享空间协议修正案,日期为2022年1月31日。 |
10-K |
001-40657 |
10.1 |
03/10/2022 |
|
|
|
|
|
|
|
|
|
10.30 |
|
共享空间协议,日期为2023年7月12日,由欧米茄治疗公司和隐喻生物技术公司签署。 |
8-K |
001-40657 |
10.1 |
07/13/2023 |
|
|
|
|
|
|
|
|
|
10.31 |
|
共享空间协议,日期为2023年7月11日,由Omega Therapeutics,Inc. Apriori Bio,Inc. |
8-K |
001-40657 |
10.2 |
07/13/2023 |
|
|
|
|
|
|
|
|
|
10.32 |
|
共享空间协议,日期为2023年7月12日,由Omega Therapeutics,Inc. Flagship Labs 89,Inc. |
8-K |
001-40657 |
10.3 |
07/13/2023 |
|
|
|
|
|
|
|
|
|
10.33 |
|
与诺和诺德公司(Novo Nordisk A/S,Pioneering Medicines 08,Inc.)签订的研究合作协议,Omega Therapeutics公司及其他各方,日期截至2023年12月31日 |
|
|
|
|
* |
|
|
|
|
|
|
|
|
10.34 |
|
Omega Therapeutics,Inc.于2023年8月3日签署了公开市场销售协议。Jefferies LLC |
8-K |
001-40657 |
10.1 |
08/03/2023 |
|
|
|
|
|
|
|
|
|
10.35 |
|
证券购买协议,日期为2023年2月22日,由Omega Therapeutics,Inc.其中的购买者, |
8-K |
001-40657 |
10.1 |
02/02/2023 |
|
|
|
|
|
|
|
|
|
21.1 |
|
注册人的子公司。 |
10-K |
001-40657 |
21.1 |
03/10/2022 |
|
|
|
|
|
|
|
|
|
23.1 |
|
德勤会计师事务所(Deloitte & Touche LLP),独立注册公共会计师事务所。 |
|
|
|
|
* |
|
|
|
|
|
|
|
|
31.1 |
|
根据规则13a-14(A)/15d-14(A)签发首席执行干事证书。 |
|
|
|
|
* |
|
|
|
|
|
|
|
|
31.2 |
|
根据细则13a-14(A)/15d-14(A)认证首席财务干事。 |
|
|
|
|
* |
|
|
|
|
|
|
|
|
32.1 |
|
根据《美国法典》第18编第1350条对首席执行官的证明。 |
|
|
|
|
** |
|
|
|
|
|
|
|
|
32.2 |
|
根据《美国法典》第18编第1350条对首席财务官的证明。 |
|
|
|
|
** |
|
|
|
|
|
|
|
|
97 |
|
与追回错误判给的赔偿有关的政策 |
|
|
|
|
* |
|
|
|
|
|
|
|
|
101.INS |
|
内联XBRL实例文档-实例文档不显示在交互数据文件中,因为XBRL标记嵌入在内联XBRL文档中。 |
|
|
|
|
* |
|
|
|
|
|
|
|
|
101.SCH |
|
内联XBRL分类扩展架构文档 |
|
|
|
|
* |
|
|
|
|
|
|
|
|
101.CAL |
|
内联XBRL分类扩展计算链接库文档 |
|
|
|
|
* |
|
|
|
|
|
|
|
|
136
101.DEF |
|
内联XBRL分类扩展定义Linkbase文档 |
|
|
|
|
* |
|
|
|
|
|
|
|
|
101.LAB |
|
内联XBRL分类扩展标签Linkbase文档 |
|
|
|
|
* |
|
|
|
|
|
|
|
|
101.PRE |
|
内联XBRL分类扩展演示文稿Linkbase文档 |
|
|
|
|
* |
|
|
|
|
|
|
|
|
104 |
|
封面交互数据文件(嵌入内联XBRL文档中) |
|
|
|
|
* |
*现送交存档。
**随函提供。
#表示管理合同或补偿计划。
已根据法规S—K第601(b)(10)(iv)项对本展品的部分(以图例表示)进行了编辑。
项目16.表格10-K摘要
没有。
137
签名
根据经修订的1934年《证券交易法》第13或15(D)节的要求,注册人已正式安排由正式授权的下列签署人代表其签署本报告.
|
|
Omega Therapeutics公司 |
|
|
|
|
|
日期:2024年3月28日 |
|
发信人: |
/S/Mahesh Karande |
|
|
|
马赫什·卡兰德 |
|
|
|
总裁与首席执行官 |
根据修订后的1934年《证券交易法》的要求,本报告已由以下注册人以登记人的身份在指定日期签署。
名字 |
|
标题 |
|
日期 |
|
|
|
|
|
/S/Mahesh Karande |
|
董事首席执行官总裁(首席执行官) |
|
2024年3月28日 |
马赫什·卡兰德 |
|
|
|
|
|
|
|
|
|
/S/约书亚·里德 |
|
首席财务官(首席财务官和首席会计官) |
|
2024年3月28日 |
约书亚·里德 |
|
|
|
|
|
|
|
|
|
Christian S. Schade |
|
董事会主席 |
|
2024年3月28日 |
克里斯蒂安·S Schade |
|
|
|
|
|
|
|
|
|
/s/Rainer Boehm |
|
董事 |
|
2024年3月28日 |
赖纳·博姆 |
|
|
|
|
|
|
|
|
|
/s/Luke M.贝沙尔 |
|
董事 |
|
2024年3月28日 |
卢克·M·贝沙尔 |
|
|
|
|
|
|
|
|
|
/s/艾略特M.征收 |
|
董事 |
|
2024年3月28日 |
埃利奥特·M·利维医学博士 |
|
|
|
|
|
|
|
|
|
/s/John Mendlein |
|
董事 |
|
2024年3月28日 |
约翰·门德林博士,J.D. |
|
|
|
|
|
|
|
|
|
/s/Mary T.塞拉 |
|
董事 |
|
2024年3月28日 |
玛丽·T·塞拉 |
|
|
|
|
|
|
|
|
|
/s/Michelle C. Werner |
|
董事 |
|
2024年3月28日 |
米歇尔·C·沃纳 |
|
|
|
|
|
|
|
|
|
/s/Richard A.年轻 |
|
董事 |
|
2024年3月28日 |
Richard a.杨博士 |
|
|
|
|
138
合并财务报表索引
独立注册会计师事务所报告 (PCAOB ID号 |
F-2 |
合并资产负债表 |
F-3 |
合并经营报表和全面亏损 |
F-4 |
合并股东权益报表 |
F-5 |
合并现金流量表 |
F-6 |
合并财务报表附注 |
F-7 |
F-1
独立注册人的报告注册会计师事务所
致欧米茄治疗公司的股东和董事会。
对财务报表的几点看法
我们审计了欧米茄治疗公司及其子公司(“本公司”)截至2023年12月31日和2022年12月31日的合并资产负债表、截至2023年12月31日的两个年度的相关综合经营报表和全面亏损、股东权益和现金流量以及相关附注(统称为“财务报表”)。我们认为,这些财务报表在所有重要方面都公平地反映了本公司截至2023年12月31日和2022年12月31日的财务状况,以及截至2023年12月31日的两个年度的经营结果和现金流量,符合美国公认的会计原则。
持续经营的企业
所附财务报表的编制假设该公司将继续作为一家持续经营的企业。正如财务报表附注1所述,本公司自成立以来经营所产生的经常性亏损、预期在可预见的未来持续经营亏损,以及需要筹集额外资本为其未来经营提供资金,令人对其作为持续经营企业的持续经营能力产生重大怀疑。附注1也说明了管理层在这些事项上的计划。财务报表不包括这种不确定性的结果可能导致的任何调整。
意见基础
这些财务报表由公司管理层负责。我们的责任是根据我们的审计对公司的财务报表发表意见。我们是一家在美国上市公司会计监督委员会(PCAOB)注册的公共会计师事务所,根据美国联邦证券法以及美国证券交易委员会和PCAOB的适用规则和法规,我们必须与公司保持独立。
我们是按照PCAOB的标准进行审计的。这些标准要求我们计划和执行审计,以获得关于财务报表是否没有重大错报的合理保证,无论是由于错误还是欺诈。本公司并无被要求对其财务报告的内部控制进行审计,我们也没有受聘进行审计。作为我们审计的一部分,我们被要求了解财务报告的内部控制,但不是为了对公司财务报告内部控制的有效性发表意见。因此,我们不表达这样的意见。
我们的审计包括执行评估财务报表重大错报风险的程序,无论是由于错误还是欺诈,以及执行应对这些风险的程序。这些程序包括在测试的基础上审查与财务报表中的数额和披露有关的证据。我们的审计还包括评价管理层使用的会计原则和作出的重大估计,以及评价财务报表的整体列报。我们相信,我们的审计为我们的观点提供了合理的基础。
/s/
三月28, 2024
自2020年以来,我们一直担任本公司的审计师。
F-2
Omega Therapeutics公司
巩固的基础喷枪床单
(单位为千,不包括每股和每股金额)
|
|
十二月三十一日, |
|
|
十二月三十一日, |
|
||
|
|
2023 |
|
|
2022 |
|
||
资产 |
|
|
|
|
|
|
||
流动资产: |
|
|
|
|
|
|
||
现金和现金等价物 |
|
$ |
|
|
$ |
|
||
有价证券 |
|
|
|
|
|
|
||
应收账款,应收关联方 |
|
|
|
|
|
|
||
应收账款 |
|
|
|
|
|
— |
|
|
预付费用和其他流动资产 |
|
|
|
|
|
|
||
流动资产总额 |
|
|
|
|
|
|
||
财产和设备,净额 |
|
|
|
|
|
|
||
经营性租赁使用权资产净额 |
|
|
|
|
|
|
||
受限现金 |
|
|
|
|
|
|
||
其他资产 |
|
|
|
|
|
|
||
总资产 |
|
$ |
|
|
$ |
|
||
负债和股东权益 |
|
|
|
|
|
|||
流动负债: |
|
|
|
|
|
|
||
应付帐款 |
|
$ |
|
|
$ |
|
||
应计费用 |
|
|
|
|
|
|
||
其他流动负债 |
|
|
|
|
|
|
||
租赁负债,流动 |
|
|
|
|
|
|
||
长期债务,流动部分 |
|
|
|
|
|
|
||
流动负债总额 |
|
|
|
|
|
|
||
非流动租赁负债 |
|
|
|
|
|
|
||
长期债务,净额 |
|
|
|
|
|
|
||
其他负债 |
|
|
|
|
|
|
||
总负债 |
|
|
|
|
|
|
||
|
|
|
|
|
|
|||
股东权益: |
|
|
|
|
|
|
||
优先股,$ |
|
|
|
|
|
|
||
普通股,$ |
|
|
|
|
|
|
||
额外实收资本 |
|
|
|
|
|
|
||
累计其他综合损失 |
|
|
( |
) |
|
|
( |
) |
累计赤字 |
|
|
( |
) |
|
|
( |
) |
股东权益总额 |
|
|
|
|
|
|
||
总负债和股东权益 |
|
$ |
|
|
$ |
|
||
附注是这些合并财务报表的组成部分。
F-3
Omega Therapeutics公司
综合业务报表离子与综合损失
(单位为千,不包括每股和每股金额)
|
截至十二月三十一日止的年度: |
|
|||||
|
2023 |
|
|
2022 |
|
||
来自关联方的协作收入 |
$ |
|
|
$ |
|
||
运营费用: |
|
|
|
|
|
||
研发 |
|
|
|
|
|
||
一般和行政 |
|
|
|
|
|
||
总运营费用 |
|
|
|
|
|
||
运营亏损 |
|
( |
) |
|
|
( |
) |
其他收入(费用),净额: |
|
|
|
|
|
||
利息收入,净额 |
|
|
|
|
|
||
其他收入(费用),净额 |
|
|
|
|
( |
) |
|
其他收入合计,净额 |
|
|
|
|
|
||
净亏损 |
$ |
( |
) |
|
$ |
( |
) |
普通股股东应占每股普通股净亏损,基本及摊薄 |
$ |
( |
) |
|
$ |
( |
) |
加权平均普通股用于普通股股东应占每股净亏损,基本和摊薄 |
|
|
|
|
|
||
综合损失: |
|
|
|
|
|
||
净亏损 |
$ |
( |
) |
|
$ |
( |
) |
其他全面收益(亏损): |
|
|
|
|
|
||
有价证券的未实现收益(亏损) |
|
|
|
|
( |
) |
|
综合损失 |
$ |
( |
) |
|
$ |
( |
) |
附注是这些合并财务报表的组成部分。
F-4
Omega Therapeutics公司
合并报表S托卡人权益
(单位为千,不包括份额)
|
|
普通股 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
股份 |
|
|
标准杆 |
|
|
额外的已缴费 |
|
|
累积的其他综合收益(损失) |
|
|
累计 |
|
|
共计 |
|
||||||
截至2022年1月1日 |
|
|
|
|
$ |
|
|
$ |
|
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
|
||||
发行普通股以换取行使的期权 |
|
|
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
|
|||
其他综合损失 |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
( |
) |
|
|
— |
|
|
|
( |
) |
基于股票的薪酬 |
|
|
— |
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
|
||
净亏损 |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
( |
) |
|
|
( |
) |
截至2022年12月31日 |
|
|
|
|
$ |
|
|
$ |
|
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
|
||||
发行用于登记直接发行的普通股,扣除发行成本 |
|
|
|
|
|
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
|
||||
发行普通股以换取行使的期权 |
|
|
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
|
|||
其他综合收益 |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
|
||
基于股票的薪酬 |
|
|
— |
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
|
||
净亏损 |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
( |
) |
|
|
( |
) |
截至2023年12月31日 |
|
|
|
|
$ |
|
|
$ |
|
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
|
||||
附注是这些合并财务报表的组成部分。
F-5
Omega Therapeutics公司
综合政治家现金流的TS
(单位:千)
|
|
截至十二月三十一日止的年度: |
|
|||||
|
|
2023 |
|
|
2022 |
|
||
经营活动 |
|
|
|
|
|
|
||
净亏损 |
|
$ |
( |
) |
|
$ |
( |
) |
对净亏损与经营活动中使用的现金净额进行的调整: |
|
|
|
|
|
|
||
折旧 |
|
|
|
|
|
|
||
债务发行成本摊销和债务贴现 |
|
|
|
|
|
|
||
经营性租赁使用权资产摊销 |
|
|
|
|
|
|
||
有价证券折价的增加 |
|
|
( |
) |
|
|
|
|
成功费义务公允价值变动 |
|
|
|
|
|
|
||
处置固定资产收益 |
|
|
( |
) |
|
|
— |
|
基于股票的薪酬费用 |
|
|
|
|
|
|
||
经营性资产和负债变动情况: |
|
|
|
|
|
|
||
应收账款,应收关联方 |
|
|
( |
) |
|
|
( |
) |
应收账款 |
|
|
( |
) |
|
|
|
|
预付费用和其他流动资产 |
|
|
|
|
|
( |
) |
|
其他资产 |
|
|
|
|
|
( |
) |
|
应付帐款 |
|
|
( |
) |
|
|
|
|
应计费用和其他流动负债 |
|
|
( |
) |
|
|
|
|
其他负债 |
|
|
|
|
|
( |
) |
|
用于经营活动的现金净额 |
|
|
( |
) |
|
|
( |
) |
投资活动 |
|
|
|
|
|
|
||
购置财产和设备 |
|
|
( |
) |
|
|
( |
) |
出售财产和设备所得收益 |
|
|
|
|
|
|
||
购买有价证券 |
|
|
( |
) |
|
|
( |
) |
有价证券到期日收益 |
|
|
|
|
|
|
||
投资活动提供(用于)的现金净额 |
|
|
|
|
|
( |
) |
|
融资活动 |
|
|
|
|
|
|
||
股权发行所得 |
|
|
|
|
|
— |
|
|
支付股权发行费用 |
|
|
( |
) |
|
|
— |
|
租赁融资收益 |
|
|
|
|
|
— |
|
|
偿还债务 |
|
|
( |
) |
|
|
— |
|
融资费用的支付 |
|
|
( |
) |
|
|
— |
|
根据股权激励计划发行普通股所得款项 |
|
|
|
|
|
|
||
融资活动提供的现金净额 |
|
|
|
|
|
|
||
现金、现金等价物和限制性现金净变化 |
|
|
( |
) |
|
|
( |
) |
现金、现金等价物和限制性现金--期初 |
|
|
|
|
|
|
||
现金、现金等价物和受限现金--期末 |
|
$ |
|
|
$ |
|
||
现金、现金等价物和限制性现金的对账 |
|
|
|
|
|
|
||
现金和现金等价物 |
|
$ |
|
|
$ |
|
||
受限现金 |
|
|
|
|
|
|
||
现金、现金等价物和限制性现金 |
|
$ |
|
|
$ |
|
||
现金流量信息的补充披露 |
|
|
|
|
|
|
||
支付利息的现金 |
|
$ |
|
|
$ |
|
||
补充披露非现金投资和融资活动 |
|
|
|
|
|
|
||
应付账款和应计账款所列财产和设备购置额 |
|
$ |
|
|
$ |
|
||
附注是这些合并财务报表的组成部分。
F-6
Omega Therapeutics公司
合并财务报表附注
1.业务性质及基础介绍
组织
Omega Therapeutics公司(the公司(“Company”或“Omega”)是一家临床阶段的生物技术公司,通过利用其OMEGA平台,开创了一种新型的可编程表观基因组mRNA药物的开发。OMEGA平台充分利用表观遗传学的力量,表观遗传学是控制基因表达和生物体生命的各个方面的机制,从细胞发生、生长和分化到细胞死亡。OMEGA平台能够控制基本的表观遗传过程,通过将异常基因表达恢复到正常范围而不改变天然核酸序列,纠正疾病的根本原因。本公司于2016年7月注册成立(“成立”)为特拉华州公司,其办事处位于马萨诸塞州剑桥市。
流动资金和持续经营
自成立以来,本公司已投入其几乎所有的资源,以建立其平台和推进其项目组合的发展,建立和保护其知识产权,开展研究和开发活动,组织和人员编制公司,业务规划,筹集资金,并为这些业务提供一般和行政支持。本公司面临生物技术行业早期临床阶段公司常见的风险和不确定性,包括但不限于与候选产品的成功研究、开发和制造相关的技术风险、候选产品的临床开发相关的风险、竞争对手开发新技术创新、对关键人员的依赖、专利技术的保护、遵守政府法规,并有能力获得额外的资金来资助运营。当前和未来的项目将需要大量的研究和开发工作,包括广泛的临床前和临床试验以及商业化之前的监管批准。这些努力需要大量额外资金、足够的人员和基础设施。即使该公司的药物开发努力是成功的,它是不确定何时,如果有的话,该公司将实现重大的收入从产品销售。
于二零二一年八月,本公司完成首次公开发售(“首次公开发售”),据此发行及出售
公司预计,其现金、现金等价物和有价证券为美元,
所附合并财务报表不包括这些不确定性的结果可能导致的任何调整。因此,综合财务报表的编制是基于假设本公司将继续作为一家持续经营的企业,考虑在正常业务过程中变现资产以及偿还负债和承诺。
F-7
与宏观经济状况相关的重大风险和不确定性
包括信贷和金融市场在内的全球经济最近经历了极端的波动和破坏,例如,流动性和信贷供应严重减少,利率和通货膨胀率上升,涉及银行和金融机构的危机,消费者信心下降,经济增长下降,以及经济稳定的不确定性。此外,不稳定的市场和经济状况,以及疫情或国际政治动荡、战争和恐怖主义造成的进一步破坏,可能会对我们的业务、财务状况和经营业绩产生严重的不利影响。
陈述的基础
所附综合财务报表乃根据美国公认会计原则(“公认会计原则”)编制。本附注中对适用指引的任何提及均指财务会计准则委员会(“FASB”)的“会计准则编纂”(“ASC”)和“会计准则更新”(“ASU”)中的权威公认会计原则。除非另有说明,本合同中的所有金额均以美元(“美元”)表示。
2.主要会计政策摘要
合并原则
随附的合并财务报表包括欧米茄治疗公司及其全资子公司欧米茄治疗安全公司的账目。欧米茄治疗安全公司是马萨诸塞州的一家子公司。所有公司间交易和余额都已在合并中冲销。
重新分类
公司将上一年度的关联方费用重新归类为研究和开发以及综合经营报表和全面亏损中的一般和行政费用,以符合本年度的列报方式。
预算的使用
按照公认会计准则编制合并财务报表要求管理层作出估计和假设,以影响截至报告期和报告期内资产、负债和费用的报告金额,以及或有资产和负债的披露。本公司根据过往经验及其认为在当时情况下合理的各种因素作出估计及假设。
这些综合财务报表所反映的重大估计和假设包括但不限于对物业和设备使用年限的选择、成功费用负债的公允价值、用于计算租赁负债的递增借款率、研发费用、关于收入确认和基于股票的薪酬的某些判断。实际结果可能与这些估计不同。估计数的变化反映在已知期间的报告结果中。
现金和现金等价物
现金包括随时可用的支票账户中的现金,现金等价物包括货币市场账户和自购买之日起原始到期日不超过三个月的所有高流动性投资。现金及现金等价物按成本入账,成本与公允价值大致相同。
有价证券
截至2023年12月31日,该公司的有价证券由公司债务证券组成,归类为可供出售,并按公允价值报告。可供出售债务证券的未实现收益和损失在实现之前作为股东权益累计其他全面损失的组成部分报告。在购买时产生的任何溢价或折扣将在票据有效期内摊销和/或增加利息收入和/或费用。已实现损益采用特定的确认方法确定,并作为构成部分计入其他费用净额。
这个该公司评估其有价证券时,除暂时性减值外,还会出现未实现损失。在评估有价证券的非暂时性价值下降时,公司会考虑以下因素:价值下降占原始成本的百分比有多大,市场持续时间有多长
F-8
价值由于投资总额低于其原始成本,本公司有能力及意向将投资保留一段时间,使公允价值及整体市况有足够的预期回升。如果对公允价值的任何调整反映了本公司认为是“非临时性”的投资价值的下降,本公司通过在综合经营报表和全面亏损中计入费用,将投资减少到公允价值。
受限现金
限制性现金是指为作为保证金签发的信用证提供的抵押品,该保证金与公司的办公室租赁有关。
信用风险集中
可能受到信用风险高度集中影响的金融工具主要包括现金、现金等价物和有价证券。该公司试图通过与高评级的金融机构合作,将与有价证券相关的风险降至最低,这些金融机构投资于本公司定义的广泛和多样化的金融工具。该公司制定了有关信用评级和到期日的指导方针,旨在保障本金余额和维持流动性。该公司根据其投资政策维持其基金,该政策定义了允许的投资,规定了信贷质量标准,并旨在限制对任何单一发行人的信贷风险。
担保和弥偿
在特拉华州法律允许的情况下,公司因与公司的关系或在公司担任的职位而发生的某些事件或事件,公司对其高级管理人员、董事、顾问和员工进行赔偿。截至2023年12月31日和2022年12月31日,该公司
财产和设备
财产和设备按成本减去累计折旧列报。折旧费用在每一类资产的估计使用年限内使用直线法确认,具体如下:
资产类别
|
预计使用寿命
|
计算机设备和软件 |
|
实验室设备和办公家具 |
|
租赁权改进 |
在报废或出售时,处置资产的成本和相关的累计折旧将从账目中扣除,任何由此产生的收益或损失都将计入运营亏损。修理费和维护费在发生时记入费用。
应计研究与开发费用
公司根据与第三方服务提供商的报价和合同估算应计研究和开发费用,第三方服务提供商包括代表公司供应、实施和管理临床前和临床研究的合同研究组织(“CRO”)和合同开发和制造组织(“CDMO”)。这些协议的财务条款有待谈判,不同的合同各不相同,可能导致付款不均衡。在某些情况下,向供应商支付的款项可能会超过所提供的服务水平,从而导致费用的预付,在这种情况下,将根据预期实现的时间对费用进行当前或长期分类评估。在应计服务费时,本公司估计将提供服务的时间段和每段时间需要花费的努力程度。如果实际执行服务的时间或努力程度与估计不同,公司将相应调整应计费用或预付费用的金额。
F-9
发债成本
与发行本公司长期债务有关的成本已被记录为债务的直接减值,并使用实际利息法在相关债务的寿命内作为利息支出的组成部分进行摊销。
成功费义务
经修订的与普华永道的贷款协议要求本公司于发生经修订的贷款协议所述的指定流动资金事件时支付成功费用(“成功费用责任”)。本公司认定,这项债务是独立的衍生工具。因此,成功费用债务在公司的综合资产负债表上被归类为负债,最初按公允价值记录,每个报告期的公允价值变动在其他费用、综合经营报表净额和全面亏损中确认。这种债务的公允价值在每个报告期结束时重新计量,直到清偿债务为止。
股权发行成本
该公司将与正在进行的股权融资直接相关的某些法律、专业会计和其他第三方费用作为递延发售成本,直至此类融资完成。在股权融资完成后,这些成本作为发行所产生的收益的减少计入股东权益。如果放弃计划的股权融资,递延发售成本将立即作为综合经营报表中的运营费用支出。有几个
长期资产减值准备
本公司评估其长期资产,主要包括物业及设备及经营租赁使用权减值资产,每当事件或情况变化显示该等资产的账面值可能无法收回时,该等资产便会进行评估。将持有和使用的资产的可回收性是通过将资产的账面价值与资产预期产生的未来未贴现现金流量进行比较来衡量的。如该等资产被视为减值,应确认的减值以该资产的账面价值超过该资产的公允价值的金额计量。有几个
租契
该公司拥有位于马萨诸塞州剑桥市的公司办公室和实验室空间的房地产租约。它确定一项安排在合同开始时是否包含租赁。经营租赁资产及负债于租赁开始日按租赁期内租赁付款的现值确认。租赁费用通常是固定的,并随着时间的推移逐步上升。浮动支付涉及公司使用或分享出租人与标的资产相关的运营成本,并确认为已发生。在确定租赁期限时,公司包括在合理确定其将行使该选择权时延长或终止租约的选择权。当隐含利率不容易确定时,公司使用其递增借款利率来计算租赁负债。租赁费用在租赁期内以直线法确认。
公允价值计量
公允价值被定义为在计量日市场参与者之间的有序交易中,为资产或负债在本金或最有利的市场上转移负债而收取或支付的交换价格。用于计量公允价值的估值技术必须最大限度地利用可观察到的投入,最大限度地减少使用不可观察到的投入。按公允价值列账的金融资产和负债应在公允价值层次的下列三个级别之一进行分类和披露,其中前两个级别被视为可见,最后一个级别被视为不可见:
F-10
收入确认
截至2023年12月31日确认的收入仅来自与PM(CF)Explorations,Inc.或PMCo的合作协议。本公司根据ASU 2014-09确认收入,与客户签订合同的收入(主题606)及其相关修正案,或统称为ASC 606。
在开始时,公司确定合同是否在ASC 606或其他主题的范围内。对于被确定为在ASC 606范围内的合同,当客户获得对承诺商品或服务的控制权时确认收入。确认的收入金额反映了本公司预期有权收取以换取该等商品及服务的代价。为实现该核心原则,本公司应用以下五个步骤:(i)识别与客户的合同;(ii)识别合同中的履约义务;(iii)确定交易价格;(iv)将交易价格分配至合同中的履约义务;及(v)在履约义务履行时确认收入。本公司仅在根据客户支付承诺代价的意向及能力而厘定收取所转让商品及服务的绝大部分代价时,才对合约应用五步模式。
合约中承诺的履约责任乃根据将转让予客户的货品及服务(该等货品及服务在合约的情况下可区分且可区分)识别。倘合约包括多项承诺货品及服务,则本公司应用判断以厘定承诺货品及服务在合约的情况下是否能够明确及明确。倘未能符合该等标准,则承诺货品及服务入账列作合并履约责任。
交易价格乃根据本公司向客户转让商品及服务而有权获得的代价厘定。倘交易价格包括可变代价,本公司根据可变代价的性质,采用预期价值法或最可能金额法估计应计入交易价格的可变代价金额。倘管理层判断,合约项下累计收益未来可能不会出现重大拨回,则可变代价会计入交易价格。任何估计(包括限制对可变代价的影响)于各报告期间评估任何变动。厘定交易价格需要重大判断。
如果合同包含单一履行义务,则将整个交易价格分配给该单一履行义务。包含多项履约义务的合同要求在相对独立的销售价格基础上将交易价格分配给每项履约义务,除非交易价格是可变的,并且符合完全分配给履约义务或构成单一履约义务一部分的不同服务的标准。将收到的对价根据相对独立的销售价格在单独的履约义务之间分配。
该公司在一段时间内或在某个时间点履行履约义务。在下列情况下,收入会随时间确认:(I)客户同时收取及消费实体业绩所提供的利益,(Ii)实体业绩创造或加强客户于资产创建或增强时所控制的资产,或(Iii)实体业绩并未产生可替代实体用途的资产,而实体有权强制执行迄今已完成的业绩付款。如果实体在一段时间内没有履行履行义务,则在某个时间点通过将承诺的货物或服务的控制权转移给客户来履行相关的履行义务。
如果对公司知识产权的许可被确定为有别于安排中确定的其他履行义务,公司将确认在许可转让给客户且客户可以使用许可并从中受益时分配给许可的对价收入。对于与其他承诺合并的许可证,公司利用判断来评估合并履行义务的性质,以确定合并履行义务是在一段时间内还是在某个时间点得到履行,如果
F-11
随着时间的推移,为确认收入而衡量进展的适当方法。本公司在每个报告期内评估进度指标,并在必要时调整业绩指标和相关收入确认。
在包括里程碑付款的每项安排开始时,公司评估达到里程碑的可能性,并使用最可能金额法估计交易价格中包含的金额。如果未来很可能不会发生重大的收入逆转,相关的里程碑价值将包括在交易价格中。不在本公司或被许可方控制范围内的里程碑付款被认为不可能实现,因此确认的收入受到限制,因为管理层无法断言收入不可能逆转。然后,交易价格按相对独立的销售价格分配给每一项履约义务,公司在履行合同项下的履约义务时确认收入。在随后的每个报告期结束时,本公司会重新评估实现该等里程碑的可能性和任何相关限制,并在必要时调整其对整体交易价格的估计。任何此类调整都以累积追赶为基础进行记录,这将影响调整期间的收入和收益。到目前为止,该公司还没有确认任何里程碑式的收入。
递延收入产生于盈利过程结束前收到的款项,在履行履约义务后确认为未来期间的收入。预期于未来十二个月内确认之递延收入分类为流动负债。
研发费用
研究和开发费用在发生时计入费用。研发支出包括进行研发活动所产生的成本,包括工资和奖金、股票薪酬、员工福利、设施成本、实验室用品、折旧、咨询费、技术许可成本、里程碑付款以及外部合同研发和制造费用。若干研究及发展活动的成本根据个别安排的条款确认,可能与已产生的成本模式不同,并在综合财务报表中反映为预付或应计研究及发展成本。未来将收到用于研究和开发活动的货物或服务的不可退还的预付款被记录为预付费用,并在相关货物交付或提供服务时支出。
基于股票的薪酬
该公司的股票薪酬计划允许向员工、董事和顾问授予激励性股票期权、非限制性股票期权、股票增值权、限制性股票奖励、限制性股票单位和其他基于股票的奖励。
本公司根据其公允价值,在综合经营报表中将所有给予员工和非员工的股票补偿确认为费用和全面亏损。对于股票期权奖励,公司使用布莱克-斯科尔斯期权定价模型估计公允价值。公司普通股的公允价值用于确定限制性股票奖励的公允价值。
布莱克-斯科尔斯期权定价模型需要基于某些主观假设的输入,包括(I)预期股价波动、(Ii)预期奖励期限、(Iii)无风险利率和(Iv)预期股息。由于首次公开招股前本公司普通股缺乏公开市场,以及缺乏足够的特定公司历史和隐含波动率数据,本公司根据一组具有代表性的上市公司的历史波动率计算预期波动率,这些上市公司具有与本公司相似的特征,包括产品开发阶段和生命科学行业重点。历史波动率是根据与预期期限假设相称的一段时间计算的。本公司采用的简化方法由
F-12
美国证券交易委员会工作人员会计公告第107号,股份支付,计算授予雇员和非雇员的期权的预期期限,因此,由于缺乏足够的历史数据,预期期限等于期权的归属期限和原始合同期限的算术平均值。无风险利率基于到期日与相关奖励的预期期限相称的美国国债。预期股息收益率假设为零,因为该公司从未支付过股息,目前也没有为其普通股支付任何股息的计划。
专利费用
与提交和起诉专利申请有关的所有与专利有关的费用都作为已发生的费用计入,因为专利将来没有替代用途。
所得税
本公司确认递延税项资产和负债为已包括在本公司综合财务报表和纳税申报单中的事件的预期未来税务后果。递延税项资产及负债乃根据财务报表账面值与现有资产及负债及亏损及贷记结转的税基之间的差额厘定,采用预期于差额拨回当年生效的制定税率。如果递延税项资产更有可能无法变现,则减去估值准备金。截至2023年12月31日至2022年,本公司已就其递延税项资产入账全额估值准备。本公司经审核后决定是否更有可能维持税务状况。如果不是更有可能持仓,则不会确认可归因于该持仓的任何好处。对于任何符合更有可能确认阈值的税务头寸,将确认的税收优惠计算为在或有事项解决后实现的可能性超过50%的最大金额。作为所得税拨备的一部分,该公司将与不确定的税收状况相关的利息和罚款计入。
综合损失
综合损失是指企业股东权益在一段时期内因非所有者来源的交易及其他事件和情况而发生的变化。综合亏损包括净亏损以及股东权益的其他变化,其中包括不包括在净亏损之外的某些权益变化。该公司其他全面亏损的唯一要素是其有价证券的未实现损益。
每股净亏损
普通股股东应占每股基本净亏损的计算方法为:普通股股东应占净亏损除以当期已发行普通股的加权平均数。普通股股东应占摊薄净亏损是通过调整普通股股东应占净亏损以根据稀释证券的潜在影响重新分配未分配收益来计算的。普通股股东应占稀释每股净亏损的计算方法是,普通股股东应占稀释净亏损除以当期已发行普通股的加权平均数,包括假设普通股等价物稀释影响的潜在稀释性普通股。
在公司报告普通股股东应占净亏损期间,普通股股东应占稀释每股净亏损与普通股股东应占基本每股净亏损相同,因为如果稀释性普通股的影响是反摊薄的,则不假设已发行稀释性普通股。该公司报告了截至2023年12月31日和2022年12月31日的年度普通股股东应占净亏损。
细分市场和地理信息
业务部门被定义为实体的组成部分,关于该实体的离散信息可供首席业务决策者或决策小组在决定如何分配资源和评估业绩时进行评价。CODM是公司的首席执行官。CODM将其业务视为一个专门在美国运营的运营部门,并对其业务进行管理。
F-13
最近通过的会计公告
2023年1月1日,本公司通过了会计准则更新第2016-13号,金融工具.信用损失:金融工具信用损失的测量(“ASU 2016-13”)。ASU 2016-13要求对金融资产的预期信贷损失进行衡量和确认。2019年4月,财务会计准则委员会(FASB)在ASU 2019-04年度内向ASU 2016-13做出澄清,主题326,金融工具—信用损失,主题815,衍生品和套期保值,主题825,金融工具的编码改进。该指导意见适用于2022年12月15日之后的财年。采用该准则对所附的合并财务报表无关紧要。
近期尚未采用的会计公告
2023年11月,FASB发布了ASU 2023-07,分部报告(主题280), 对可报告分部披露的改进。新标准要求加强对分部信息和重大分部费用的披露。它不会改变公共实体确定其经营部门的方式。ASU 2023-07适用于2023年12月15日之后开始的财年,以及2024年12月15日之后开始的财年内的过渡期,并允许提前采用。新标准应追溯适用于财务报表中列报的以前所有期间。该公司目前正在评估对其合并财务报表的影响。
2023年12月,FASB发布了2023-09,所得税(专题740),所得税披露的改进。新标准要求公共企业实体披露已缴纳所得税的信息、税率调节中的特定类别,以及符合量化门槛的调节项目的额外信息。该指南应在预期的基础上适用。对于公共业务实体,ASU 2023-08在2024年12月15日之后的财年生效,并允许提前采用。对于所有其他实体,该标准在2025年12月15日之后的年度期间有效。该公司目前正在评估对其合并财务报表的影响。
3.有价证券
下表汇总了该公司的有价证券(单位:千):
|
2023年12月31日 |
|
|||||||||
|
摊销成本 |
|
|
未实现亏损总额 |
|
|
公允价值 |
|
|||
公司债务证券 |
$ |
|
|
$ |
( |
) |
|
$ |
|
||
|
|
|
|
|
|
|
|
|
|||
|
2022年12月31日 |
|
|||||||||
|
摊销成本 |
|
|
未实现亏损总额 |
|
|
公允价值 |
|
|||
公司债务证券 |
$ |
|
|
$ |
( |
) |
|
$ |
|
||
有价证券之摊销成本乃就溢价摊销及到期日折让之累计作出调整。2023年12月31日则累计其他全面亏损结余仅包括与有价证券有关的活动。有
截至2023年12月31日在摊销成本基础收回之前,本公司不打算出售处于亏损状态的债务证券,也很可能不需要出售。结果,该公司确定它确实做到了
F-14
4.预付费用和其他流动资产
预付费用和其他流动资产包括以下内容(以千计):
|
|
十二月三十一日, |
|
|||||
|
|
2023 |
|
|
2022 |
|
||
临床发展 |
|
$ |
|
|
$ |
|
||
研发 |
|
|
|
|
|
|
||
设施 |
|
|
|
|
|
|
||
其他应收账款 |
|
|
|
|
|
|
||
保险 |
|
|
|
|
|
|
||
软件 |
|
|
|
|
|
|
||
其他 |
|
|
|
|
|
|
||
预付费用和其他流动资产 |
|
$ |
|
|
$ |
|
||
5.财产和设备,净额
财产和设备,净额由以下部分组成(以千计):
|
|
十二月三十一日, |
|
|||||
|
|
2023 |
|
|
2022 |
|
||
实验室设备 |
|
$ |
|
|
$ |
|
||
家具和固定装置 |
|
|
|
|
|
|
||
租赁权改进 |
|
|
|
|
|
|
||
计算机设备 |
|
|
|
|
|
|
||
在建工程 |
|
|
|
|
|
|
||
总资产和设备 |
|
|
|
|
|
|
||
减去累计折旧 |
|
|
( |
) |
|
|
( |
) |
财产和设备,净额 |
|
$ |
|
|
$ |
|
||
截至2023年及2022年12月31日止年度各年的折旧费用w作为$
6. 应计费用
应计费用包括以下各项(以千计):
|
|
十二月三十一日, |
|
|||||
|
|
2023 |
|
|
2022 |
|
||
员工相关费用 |
|
$ |
|
|
$ |
|
||
研究成本 |
|
|
|
|
|
|
||
专业和咨询费 |
|
|
|
|
|
|
||
制造成本 |
|
|
|
|
|
|
||
利息 |
|
|
|
|
|
|
||
其他 |
|
|
|
|
|
|
||
总计 |
|
$ |
|
|
$ |
|
||
7.定期贷款
于2018年3月9日,本公司与太平洋西部银行(“PWB”)订立贷款协议,初步借入美元,
于2023年9月22日,本公司订立贷款协议的另一项修订(“第五修订”),其中PWB将贷款到期日延长至
F-15
百万贷款于#年开始偿还。
此外,根据第五修正案,公司同意在任何时候与PWB保持至少$的余额,
贷款协议(经修订)项下的借款以公司的绝大部分个人财产(知识产权除外)作抵押。贷款协议(经修订)并无任何财务契诺;然而,本公司须遵守若干肯定及否定契诺,本公司将于到期前继续遵守该等契诺。
自.起2023年12月31日,$
|
|
十二月三十一日, |
|
|||||
|
|
2023 |
|
|
2022 |
|
||
本金 |
|
$ |
|
|
$ |
|
||
未摊销债务贴现 |
|
|
( |
) |
|
|
( |
) |
账面净额 |
|
$ |
|
|
$ |
|
||
本公司厘定债务之预期年期等于定期贷款之年期。负债部分之实际利率介乎m
|
|
截至十二月三十一日止的年度: |
|
|||||
|
|
2023 |
|
|
2022 |
|
||
合同利息支出 |
|
$ |
|
|
$ |
|
||
债务发行成本摊销和债务贴现 |
|
|
|
|
|
|
||
利息支出总额 |
|
$ |
|
|
$ |
|
||
于二零二三年十二月三十一日及二零二二年十二月三十一日,定期贷款的应计利息为 $
本公司须就其定期贷款偿还以下本金额(千元):
2024 |
|
$ |
|
|
2025 |
|
|
|
|
2026 |
|
|
|
|
2027 |
|
|
|
|
总计 |
|
$ |
|
F-16
8.金融工具公允价值
本公司现金及现金等价物及受限制现金的公允价值按市场报价计量;本公司有价证券的公允价值按截至报告日可直接或间接观察到的定价输入数据(非活跃市场报价)厘定。其他流动资产、应付账款及应计负债因其短期性质,于2023年及2022年12月31日与其公平值相若。本公司债务的账面值与其公允价值相若,由于其浮动利率接近市场利率。与贷款协议(经修订)相关的成功费责任包含不可观察输入数据,反映本公司本身的假设,其中于计量日期市场活动极少(如有),因此本公司的成功费责任使用不可观察输入数据按其公平值经常性基准计量。
本公司金融工具的公允价值概述于下表(千):
|
|
2023年12月31日 |
|
|||||||||||||
|
|
1级 |
|
|
2级 |
|
|
3级 |
|
|
总计 |
|
||||
金融资产 |
|
|
|
|
|
|
|
|
|
|
|
|
||||
货币市场基金 |
|
$ |
|
|
$ |
— |
|
|
$ |
— |
|
|
$ |
|
||
公司债务证券 |
|
|
— |
|
|
|
|
|
|
— |
|
|
|
|
||
总计 |
|
$ |
|
|
$ |
|
|
$ |
— |
|
|
$ |
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
金融负债 |
|
|
|
|
|
|
|
|
|
|
|
|
||||
成功费用义务 |
|
$ |
— |
|
|
$ |
— |
|
|
$ |
|
|
$ |
|
||
|
|
2022年12月31日 |
|
|||||||||||||
|
|
1级 |
|
|
2级 |
|
|
3级 |
|
|
总计 |
|
||||
金融资产 |
|
|
|
|
|
|
|
|
|
|
|
|
||||
货币市场基金 |
|
$ |
|
|
$ |
— |
|
|
$ |
— |
|
|
$ |
|
||
公司债务证券 |
|
|
— |
|
|
|
|
|
|
— |
|
|
|
|
||
总计 |
|
$ |
|
|
$ |
|
|
$ |
— |
|
|
$ |
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
金融负债 |
|
|
|
|
|
|
|
|
|
|
|
|
||||
成功费义务 |
|
$ |
— |
|
|
$ |
— |
|
|
$ |
|
|
$ |
|
||
根据与工务局签订的贷款协议的第四及第五修订,本公司须支付总额为美元的成功费用,
截至2023年12月31日,该公司确定
|
|
2023年12月31日 |
|
|
2022年12月31日 |
|
||
贴现率 |
|
|
% |
|
|
% |
||
预期实现流动性事件的时间(年) |
|
|
|
|
|
|||
实现流动性事件的概率 |
|
|
|
|
||||
下表提供本公司成功费责任的公允价值结转,其公允价值由第三级输入值(千)确定:
F-17
|
|
成功费 |
|
|
成功费 |
|
||
2023年1月1日的公允价值 |
|
$ |
|
|
$ |
— |
|
|
成功费债务的初始公允价值 |
|
|
— |
|
|
|
|
|
公允价值变动 |
|
|
|
|
|
|
||
2023年12月31日的公允价值 |
|
$ |
|
|
$ |
|
||
9.承付款和或有事项
租契
本公司拥有以下经营租约,其公司办公室和实验室位于马萨诸塞州剑桥市,.
瓦萨街325号
2017年,该公司签署了一份不可撤销的经营租赁协议,租赁其位于马萨诸塞州剑桥市Vassar Street 325号的办公空间,该协议将于2017年到期。 .公司必须支付财产税、保险费和正常维护费用。经营租赁包括租赁期内最低租金的预定固定递增。于二零一九年及二零二零年,本公司与本公司订立分租协议。
20 Acorn Park Drive
于2020年7月13日,本公司与Sail Biomedicines,Inc.订立共享空间安排(该安排),("Sail Bio",也称为Senda Biosciences,Inc. Kintai Therapeutics,Inc.在与LARONDE,Inc.合并之前)到
140 First Street(前身为One Charles Park)
2021年11月4日,本公司与ARE-MA地区第94号有限责任公司签订了一份租赁合同,租赁总额约为
2023年5月3日,该公司对租约进行了第一次修订,其中包括推迟部分物业的交付日期,将初始基本租金增加$
F-18
2023年7月11日,本公司签订了与Priori Bio,Inc.共享空间安排,并于2023年7月12日
截至2023年12月31日,经营性租赁使用权资产净值为$
使用权资产指本公司在租赁期内使用相关资产的权利,相关租赁负债指本公司因租赁产生的租赁付款的义务。使用权资产及相应负债均于租赁开始日期根据租赁期内租赁付款现值确认。由于本公司的租赁不提供隐含利率,本公司根据经修订的定期贷款(已完全抵押)的利率以及期限匹配的有担保市场利率估计增量借款利率。
下表汇总了截至年底的租赁费用的组成部分2023年12月31日和2022年12月31日(单位:千)。
|
|
截至的年度 |
|
|||||
|
|
2023年12月31日 |
|
|
2022年12月31日 |
|
||
经营租赁费用 |
|
$ |
|
|
$ |
|
||
可变租赁费用 |
|
|
|
|
|
|
||
租赁总费用 |
|
$ |
|
|
$ |
|
||
可变租赁费用通常包括公共区域维护费、水电费和财产税。截至2023年12月31日的年度, $
与本公司租赁有关的加权平均剩余租赁期及贴现率如下:
|
|
自.起 |
|
|||||
|
|
2023年12月31日 |
|
|
2022年12月31日 |
|
||
加权平均剩余租赁年限(年) |
|
|
|
|
|
|
||
加权平均贴现率 |
|
|
% |
|
|
% |
||
F-19
截至2023年12月31日及2022年12月31日止年度,有关本公司租赁的补充现金流量资料如下(以千计):
|
|
截至的年度 |
|
|||||
|
|
2023年12月31日 |
|
|
2022年12月31日 |
|
||
为计入租赁负债的金额支付的现金 |
|
$ |
|
|
$ |
|
||
以租赁负债换取的经营性租赁资产 |
|
$ |
|
|
$ |
|
||
截至2023年12月31日,截至12月31日止年度各年第一街140号及325号Vassar的估计最低租赁付款如下(以千计):
2024 |
|
$ |
|
|
2025 |
|
|
|
|
2026 |
|
|
|
|
2027 |
|
|
|
|
2028 |
|
|
|
|
此后 |
|
|
|
|
最低租赁付款总额 |
|
|
|
|
减去:推定利息 |
|
|
( |
) |
经营租赁负债现值 |
|
$ |
|
Thermo家具销售—回租
10.许可协议
Flagship Pioneering Innovations V,Inc.
2019年3月,本公司与Flagship Pioneering Innovations V,Inc.签订独家许可协议,根据该协议,本公司根据特定专利权获授予独家、全球性、含版税、可转授、可转让的许可证,以开发、生产和商业化特许产品(“旗舰许可证”)。根据旗舰牌照的条款,本公司有责任就本公司特许产品的净销售额支付低个位数百分比的特许权使用费。专利权使用费应由公司在每个国家支付,直至在该国家涵盖该许可产品的最后一项有效专利要求到期或放弃。本公司亦有义务偿还旗舰公司的专利申请费用。
特许权使用费乃视乎旗舰许可证下特许产品之销售而定。因此,当该等开支于销售开始时被视为可能及可估计,本公司将将特许权使用费开支入账列为其承担金额的销售成本。
怀特黑德生物医学研究所
在……里面2019年5月,本公司与怀特黑德生物医学研究所("WIBR")(本公司董事会成员之一的附属公司)订立独家许可协议,根据该协议,本公司根据特定专利权获授予独家、全球性、含版税、可转授权的许可,以研究、制造、使用、出售、出售要约,租赁和进口产品,并执行和已经执行许可程序(“WIBR独家许可证”)。根据WIBR独家许可证的条款,
F-20
公司支付了不退还的预付费,
于二零一九年五月,本公司亦与WIBR订立一份共同独家特许权协议,据此,本公司获授一份共同独家、全球性、附带版税、可再授权的特许权,以研究、制造、制造、使用、销售、出售要约、租赁及进口产品,以及执行及已执行获授权过程(“WIBR共同独家特许权”)。根据WIBR共同独家许可证的条款,该公司支付了不到美元的不可退还的预付费,
截至2023年12月31日及2022年12月31日止年度,本公司确认费用为美元
年度维护费将根据适用年度的所列金额每年入账列为开支。于确定可能发生里程碑付款后,到期金额将记录为研发费用。最后,特许权使用费及再授权非特许权使用费乃视乎获授权产品的销售或根据WIBR独家及共同独家授权协议的执行而定。因此,当该等费用在销售开始或执行分授权协议时被认为是可能和可估计的,本公司将累计特许权使用费和分授权非特许权使用费付款(如适用),以支付本公司承担的金额。
Acuitas Therapeutics公司
于二零二零年十月,本公司与Acuitas Therapeutics,Inc.订立开发及期权协议(“开发及期权协议”)。("Acuitas")。根据开发和选择协议的条款,双方同意共同开发某些产品,将公司的基因调节疗法与Acuitas的脂质纳米颗粒相结合。此外,根据开发和选择协议,本公司有权选择获得Acuitas与脂质纳米颗粒技术(“Acuitas LNP技术”)有关的专利和专门知识的非独家,全球范围内,可转授权的许可证,涉及两个特定目标(例如,EC构建体("保留靶标")以开发和商业化与这些靶标相关的一种或多种治疗产品。对于每个期权和保留目标,公司有义务支付每年的技术接入费和目标保留和维护费,总额为中低六位数,直至该保留目标从保留目标名单中删除或直至公司行使有关该保留目标的期权。倘本公司行使购股权,本公司将支付美元。
在……里面2021年3月,本公司行使发展及购股权协议项下的第一项购股权,并与Acuitas订立非独家许可协议,(“Acuitas许可协议”),根据该协议,本公司根据Acuitas LNP技术获得非独家的,全球性的,可转许可,以研究,开发,制造,并在商业上开发由该公司的基因调节疗法和Acuitas的脂质纳米颗粒组成的产品。就购股权行使而言,本公司产生了
F-21
费用期权行使费为美元,
截至2023年12月31日及2022年12月31日止年度,本公司录得共$
开发及期权协议项下的期权行使费于本公司于2021年3月行使第一个期权时记作研究及发展开支。此外,Acuitas产生的技术访问费、目标预订费和维护费、与FTE资金义务相关的费用以及开发和材料成本的报销在发生时计入研究和开发费用。年度维护费将根据适用年度的规定金额记为年度费用。一旦确定可能发生里程碑式的付款,应支付的金额将被记录为研发费用。截至2022年12月31日的年度,每年维护费为$
Nitto Denko Corporation
于2022年10月12日,本公司与Nitto Denko Corporation(“Nitto”)订立合作及许可协议(“Nitto协议”),据此(其中包括)Nitto授予本公司在Nitto拥有或控制的与其脂质纳米粒递送技术有关的所有知识产权下独家、全球性、附带版税、可完全转让及可完全再授权的许可。
根据Nitto协议的条款,本公司已预先支付现金$,
截至2023年12月31日止年度,本公司录得合共$
11.合作协议
PMCO
于2021年11月,本公司订立
F-22
已获得许可产品。经双方书面同意,可调整研究计划经费。此外,在PMCo被收购或出售的情况下,公司有权获得此类交易收益的一部分,但须按照协议的规定进行各种减免和支付其他金额.
本公司根据ASC 606对这一安排进行了评估,并得出结论,合同对手方PMCO是客户。本公司确定,研究活动和根据合作协议授予的独家许可被视为单一履约义务,因此,交易价格完全分配给单一履约义务。随着基本服务的履行和/或外部成本的产生,公司将随着时间的推移确认与单一履约义务相关的收入。
这个2023年12月31日的交易总价被确定为$
该公司确认资助的研究和协作收入为$
根据协议,如果PMCo被收购或出售,该公司有权获得部分销售收益。在每个报告期结束时,公司都会评估发生此类交易的可能性。截至2023年12月31日,该公司确定该交易的收益不可能被确认。
Nitto Denko Corporation
2022年10月12日,公司与日东公司签订了一项合作和许可协议,根据该协议,日东公司根据日东公司拥有或控制的与其脂质纳米颗粒输送技术相关的所有知识产权,向公司授予了独家的、全球范围的、承担特许权使用费的、完全可转让和完全可再许可的许可。见附注10的进一步讨论,许可协议.
诺和诺德
2023年12月31日,公司与诺和诺德A/S(“诺和诺德”)以及FLAGING的关联公司先锋药品08公司(以及协议中规定的某些条款,先锋药品(NN)、有限责任公司和PM(NN)探索公司)签订了研究合作协议。根据该协议的条款,该公司向诺和诺德授予了一个独家的、有版税的、可转让的许可证,有权对其某些知识产权授予多个级别的再许可,以便根据与预防、治疗或控制包括糖尿病在内的心脏代谢性疾病有关的产品候选或计划目标的商定研究和开发计划进行研究和开发活动。
2024年1月,公司收到了一笔不可退还的预付款#
该公司根据ASC 606对这一安排进行了评估,并得出结论,合同对手方诺和诺德是客户。该公司决定,研究活动和
F-23
根据协作协议授予的独家许可被视为单一的组合履行义务,因为它们无法区分。随着时间的推移,公司将使用输入法确认与单一履约义务相关的收入。根据输入法,完成进度是根据迄今产生的费用与履行义务完成时估计费用总额的比率来衡量的,公司认为这是衡量其在履行合并履行义务方面的进展情况的最佳方式。以成本为基础的收入确认输入法要求管理层对完成业绩义务所需的成本进行估计。在进行这种估算时,需要对与成本估算有关的假设进行评估。
截至2023年12月31日,交易总价确定为be $
12.优先股和普通股
于二零二一年,本公司董事会及股东批准本公司经修订及重列的注册证书,以(其中包括)
2023年2月,本公司完成了普通股的注册直接发行,据此发行和出售,
普通股持有人对每股普通股有一票表决权。在优先股持有人有权获得的所有优先股息全部支付的情况下,普通股持有人应有权从合法可用的资金中获得股息。如果公司发生任何自愿或非自愿清算、解散或清盘,在支付或准备支付公司所有债务和负债以及优先股持有人在清算中分配资产时有权获得的所有优先金额后,普通股持有人应有权按比例分享本公司可供分配的剩余资产。
截至2023年12月31日,本公司已预留总额,
13.股权激励计划
2017股权激励计划
2017年6月,公司董事会通过了2017年计划,该计划规定向公司员工和非员工授予合格激励性股票期权和不合格股票期权、限制性股票或其他奖励,用于发行或购买公司普通股股份。截至2023年12月31日,有几个
2017计划由本公司董事会或其委员会管理,但以本公司董事会已根据2017计划授予其权力或授权为限。行使价格、归属和其他限制由董事会酌情决定,但股票期权的每股行使价格不得低于
F-24
日期格兰特。根据2017年计划授予的股票期权到期
2021激励奖励计划
2021年7月,公司董事会通过了2021年计划,公司股东批准了该计划。2021年计划规定授予激励性股票期权、非法定股票期权、限制性股票奖励、限制性股票单位、股票增值权等基于股票的奖励,在IPO之后,所有基于股权的奖励都是根据2021计划授予的。该公司最初保留
本公司于综合经营报表及全面亏损中将股份补偿开支列作研发及一般及行政开支如下(千):
|
|
Year ended December 31, |
|
|||||
|
|
2023 |
|
|
2022 |
|
||
研发 |
|
$ |
|
|
$ |
|
||
一般和行政 |
|
|
|
|
|
|
||
基于股票的薪酬总支出 |
|
$ |
|
|
$ |
|
||
股票期权
授出购股权的柏力克—舒尔斯购股权定价模式所采用的假设如下:
|
|
Year ended December 31, |
|
|||||
|
|
2023 |
|
|
2022 |
|
||
预期波动率 |
|
|
|
|
||||
加权平均无风险利率 |
|
|
|
|
||||
预期股息收益率 |
|
|
|
|
||||
加权平均预期期限(年) |
|
|
|
|
|
|
||
F-25
截至2023年12月31日止年度,本公司股权激励计划项下的购股权活动概要如下:
|
|
|
|
|
加权 |
|
|
加权 |
|
|
集料 |
|
||||
|
|
数 |
|
|
平均值 |
|
|
合同 |
|
|
价值 (1) |
|
||||
截至2023年1月1日的未偿还款项 |
|
|
|
|
$ |
|
|
|
|
|
$ |
|
||||
授与 |
|
|
|
|
|
|
|
|
|
|
|
|
||||
已锻炼 |
|
|
( |
) |
|
|
|
|
|
|
|
|
|
|||
被没收 |
|
|
( |
) |
|
|
|
|
|
|
|
|
|
|||
过期 |
|
|
( |
) |
|
|
|
|
|
|
|
|
|
|||
截至2023年12月31日的未偿还债务 |
|
|
|
|
|
|
|
|
|
|
|
|
||||
已归属且预计将于2023年12月31日归属 |
|
|
|
|
|
|
|
|
|
|
|
|
||||
自2023年12月31日起可行使 |
|
|
|
|
$ |
|
|
|
|
|
$ |
|
||||
(1) 总内在价值计算为相关期权的行使价与截至2023年12月31日货币化期权的普通股估计公允价值之间的差额。.
于截至2023年及2022年12月31日止年度授出之购股权加权平均授出日期每股公平值为 $
截至2023年12月31日,有$
2021年员工购股计划
公司董事会于2021年7月通过了《员工购股计划》(以下简称《2021年员工持股计划》),并获得了公司股东的批准。2021年ESPP的目的是为符合条件的员工提供通过累积缴款购买公司普通股的机会。2021年ESPP允许参与者通过缴费(通常以工资扣除的形式)购买普通股,最高金额为管理人确定的合格薪酬。受制于某些其他限制,或除非管理员另有决定,参与者最多可购买
2021年ESPP规定,自2022年1月1日起至2031年1月1日(包括2031年1月1日)止的每个日历年的第一天,根据该计划可供发行的股票数量每年增加一次,增加的金额相当于(I)
截至2023年12月31日,本公司尚未根据2021年特别提款权计划完成发售期限。截至2023年12月31日,公司拥有
F-26
14.普通股股东应占每股净亏损
在本公司报告普通股股东应占净亏损的期间,由于潜在摊薄性证券的影响会产生反摊薄影响,故计算每股摊薄净亏损时不包括潜在摊薄性证券。因此,用于计算普通股股东应占每股基本和摊薄净亏损的普通股加权平均数是相同的。
下表概述本公司普通股股东应占每股基本及摊薄净亏损之计算(以千计,股份及每股金额除外):
|
|
截至十二月三十一日止的年度: |
|
|||||
|
|
2023 |
|
|
2022 |
|
||
分子: |
|
|
|
|
|
|
||
普通股股东应占净亏损 |
|
$ |
( |
) |
|
$ |
( |
) |
分母: |
|
|
|
|
|
|
||
基本普通股和稀释普通股的加权平均数 |
|
|
|
|
|
|
||
普通股股东应占每股普通股净亏损,基本及摊薄 |
|
$ |
( |
) |
|
$ |
( |
) |
本公司在计算普通股股东应占每股摊薄净亏损时,不包括以下潜在普通股(按期末未发行金额呈列),原因是包括该等潜在普通股将具有反摊薄影响:
|
|
截至12月31日, |
|
|||||
|
|
2023 |
|
|
2022 |
|
||
购买普通股的未偿还期权 |
|
|
|
|
|
|
||
15.所得税
美国联邦法定所得税率与公司有效所得税率的对账如下:
|
Year ended December 31, |
|
|||||
|
2023 |
|
|
2022 |
|
||
美国联邦法定所得税率 |
|
% |
|
|
% |
||
扣除联邦福利后的州所得税 |
|
|
|
||||
研发税收抵免 |
|
|
|
||||
不可扣除/不可征税的永久性项目 |
|
( |
) |
|
|
( |
) |
更改估值免税额 |
|
( |
) |
|
|
( |
) |
其他 |
|
|
|
|
|
||
有效所得税率 |
|
% |
|
|
% |
||
F-27
该公司递延税金的组成部分如下(以千计):
|
Year ended December 31, |
|
|||||
|
2023 |
|
|
2022 |
|
||
递延税项资产: |
|
|
|
|
|
||
净营业亏损结转 |
$ |
|
|
$ |
|
||
研发信贷结转 |
|
|
|
|
|
||
应计费用 |
|
|
|
|
|
||
基于股票的薪酬 |
|
|
|
|
|
||
无形资产 |
|
|
|
||||
IRC 174研发资本化 |
|
|
|
|
|
||
ASC 842租赁责任 |
|
|
|
|
|||
未实现损益 |
|
— |
|
|
|
||
递延税项资产总额 |
|
|
|
|
|
||
减去:估值免税额 |
|
( |
) |
|
|
( |
) |
递延税项资产,净额 |
|
|
|
|
|
||
递延税项负债: |
|
|
|
|
|
||
折旧 |
|
( |
) |
|
|
( |
) |
使用权资产 |
|
( |
) |
|
|
( |
) |
未实现损益 |
|
( |
) |
|
|
— |
|
递延税项负债总额 |
|
( |
) |
|
|
( |
) |
递延税金净额 |
$ |
— |
|
|
$ |
— |
|
该公司拥有
未来税收优惠的实现取决于许多因素,包括公司在净营业亏损结转期内产生应纳税收入的能力。根据国内税法的规定,本公司所有权的某些重大变化,包括出售本公司或因出售股权而导致所有权的重大变化,可能限制或未来可能限制结转的净营业亏损金额,该金额每年可用于抵销未来的应纳税收入。本公司尚未完成一项评估控制权是否已发生变更的研究,或自本公司成立以来,是否由于与此类研究相关的重大复杂性和成本以及未来可能出现额外的控制权变更而发生多次控制权变更。因此,本公司无法估计控制权变更对本公司未来利用净营业亏损和研发信贷结转的能力的影响。
截至2023年12月31日,该公司拥有
截至2023年12月31日和2022年12月31日,公司没有不确定的税务头寸。该公司将把与未确认的税收优惠相关的利息和罚款确认为所得税支出的一个组成部分。自成立以来,本公司并未就未确认的税务优惠记录任何利息或罚款。
该公司自成立以来的所有纳税年度都在美国和马萨诸塞州提交了所得税申报单。所有课税年度仍可由这些司法管辖区审核,作为结转
F-28
过去几年生成的属性可能会在未来期间进行调整。该公司目前没有受到美国国税局或任何其他税务机关的审查亚尔
16.关联方交易
于截至2023年12月31日止年度,关联方交易主要包括租金支付及可偿还开支,并由从关联方收取的分租收入抵销。
该公司的多数股权由旗舰公司持有,其持有的股份约为
2023年7月,本公司签订了
在……里面2020年9月,该公司转租了其瓦萨街325号工厂的整个空间,大约
F-29
于二零二零年七月,本公司与赛欧生物订立共用空间安排(该安排),
2019年9月,本公司转租了约
参见附注9所述的其他关联方交易, 承付款和或有事项,附注10,许可协议和附注11,合作协议.
17.雇员福利
2018年,本公司根据《国内税收法典》第401(k)条设立了一个固定供款计划,或401(k)计划。401(k)计划涵盖所有符合规定的最低年龄和服务要求的员工,并允许参与者在税前基础上推迟支付部分年度薪酬。2022年5月1日,
F-30