| 切实改善针对肺动脉高压过度增殖原因 的罕见 心肺疾病 患者的生活 2024 年 3 月纳斯达克:AVTE |
| 本演示文稿由Aerovate Therapeutics, Inc.(“我们”、“我们的”、“Aerovate” 或 “公司”)编写,仅供参考。此处列出的 信息并不声称完整,也不包含您可能想要的所有信息。除非另有说明,否则此处包含的声明均自本 演示之日起作出,并且本演示在任何情况下均不得暗示此处包含的信息在该日期之后的任何 时间是正确的,也不得对该信息进行更新或修订以反映随后可获得的信息或在本演示之日之后发生的变化。 以下演示文稿包含1995年《美国私人证券诉讼改革法》安全港条款所指的前瞻性陈述。 前瞻性陈述可以用 “预测”、“相信”、“可能”、“估计”、“预期”、“未来”、“目标”、“打算”、“展望”、“可能”、 “计划”、“潜力”、“预测”、“项目”、“寻求”、“战略”、“应该”、“将”、“将” 等词语来识别关于未来的时期。这些前瞻性陈述 包括但不限于有关Aerovate业务计划和目标的陈述;AV-101 的未来计划,包括对 计划临床试验的时机和成功、治疗潜力、临床益处和安全性的预期;公司的增长;AV-101 的潜在价值和市场;以及当前或将来 资本、支出和其他财务业绩的用途和需求。这些前瞻性陈述不是承诺或保证,涉及重大风险和 不确定性,是基于我们当前对未来状况的信念、预期和假设。由于前瞻性陈述与未来有关,因此它们 会受到固有的不确定性、风险和环境变化的影响,这些变化难以预测,其中许多是我们无法控制的。我们的实际业绩和 财务状况可能与前瞻性陈述中显示的有重大差异。因此,您不应依赖这些前瞻性陈述中的任何一项。 可能导致实际事件或结果与本 演示文稿中任何前瞻性陈述所表达或暗示的内容存在重大差异的因素包括但不限于与以下内容相关的风险和不确定性:COVID-19 疫情对公司业务、运营的影响、 患者入组和留存率、战略、目标和预期里程碑;AV-101 的治疗潜力,以及与启动、持续或 相关的时机 Aerovate 正在进行或计划中的成功AV-101 的临床试验;Aerovate 执行其战略的能力;临床前或临床研究的积极结果不一定能预测未来或正在进行的临床研究的结果;AV-101 可能无法成功开发和商业化; 美国和国外的监管发展;Aerovate 保护和维持其知识产权地位的能力;以及更全面地阐述的风险和不确定性 我们在10-Q表季度报告中标题为 “风险因素”,如以及我们随后向美国证券交易所 委员会(SEC)提交的文件中详述的其他风险。我们做出的任何前瞻性陈述仅基于我们目前可用的信息,并且仅代表截至发表之日的信息。我们 没有义务公开更新可能不时发表的任何前瞻性陈述,无论是书面还是口头陈述,无论是由于新的 信息、未来发展还是其他原因。 本演示文稿中包含的某些信息涉及或基于从第三方来源获得的研究、出版物、调查和其他数据,以及公司 自己的内部估计和研究。尽管公司认为截至本演示文稿之日这些第三方来源是可靠的,但它尚未独立核实 ,也没有对从第三方来源获得的任何信息的充分性、公平性、准确性或完整性做出任何陈述。此外,本演示文稿中包含的所有市场数据 都涉及许多假设和局限性,无法保证此类假设的准确性或可靠性。最后, 虽然我们认为自己的内部研究是可靠的,但此类研究尚未得到任何独立来源的证实。 2 免责声明;前瞻性陈述 |
| 经验丰富的管理团队 3 Ben Dake 博士 总裁兼创始人 • 企业家、癌症生物学家 和投资者 • 概念化的 AV-101 和 为 Aerovate Hunter Gillies、MB chB 首席医学官 提供了高达 7900 万美元的融资 • 领导了建立当前一线的吉利德 的 AMBITION 试验 br} PAH 联合疗法 • 在辉瑞和吉利德成功领导了 PAH 候选产品 的二期和三期试验 Ralph Niven 博士 首席开发官 • 在 转化医学和 方面拥有 25 年的丰富专业知识吸入剂型 • 管理 公共和私营 公司的实验和 临床开发,包括安进、 AIR 和诺华 首席执行官 Timothy Noyes • 在制药和 生物技术领域拥有 30 年的商业 经验,包括默沙东、 Genzyme、Proteon • 在制药和 生物技术领域拥有 30 年的商业 经验,包括默沙东、 Genzyme、Proteon • 广泛的上市规划 和商业发行 经验 George Eldridge 首席财务官 • 在 生物技术领域拥有 25 年的经验,曾在上市 和私营公司工作, 包括 Curis、Targanta、 Proteon • 丰富的背景 筹集私募资金、 首次公开募股和后续的 设置、投资 银行和并购 Timothy Pigot 首席商务官 • 在 生物技术和制药 领域拥有 25 年的经验 致力于推出一系列 产品和 将其商业化 • 在 PAH 监督美国 推出 Revatio 有10年的经验和 Leairis 分别在辉瑞 和吉利德科学任职, Susan Fischer 临床运营执行副总裁。 • 在 学术和 制药 行业拥有 20 年临床运营经验。 • 曾在 Syndax、EMD Serono、 Acetylon 建立/领导的 临床运营团队 Donna Dea 监管主管 • 在阿斯利康 有 35 年的制药 经验 • 20 年的全球监管 经验设计/ 实施战略,导致 获得批准 哮喘的治疗药物慢性阻塞性肺病、鼻炎等 Marco Verwijs 首席技术官 • 15 年药物开发经验 从 临床产品 开发到 商业上市 • 药物 产品扩大和 验证领域久经考验的领导者。 |
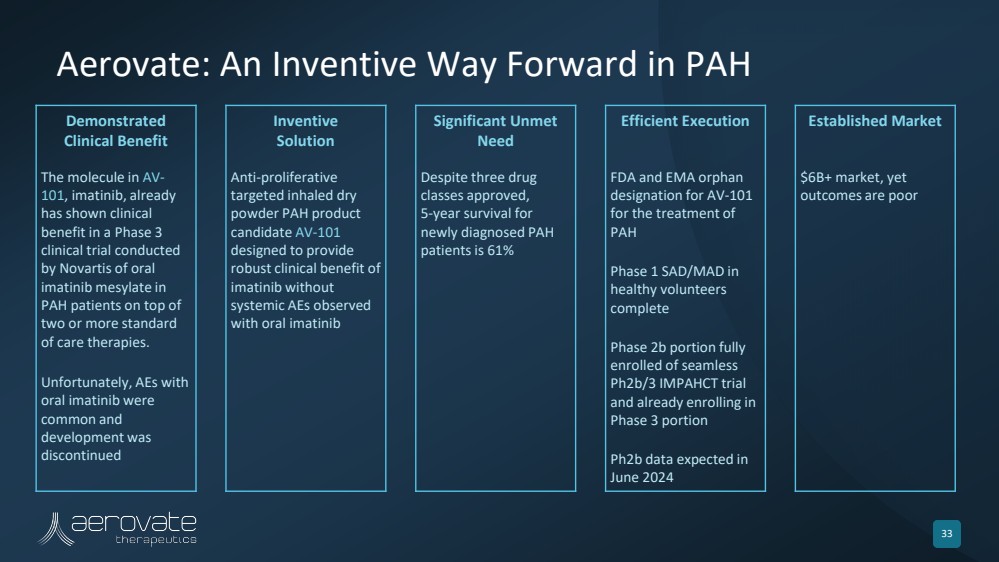
| Aerovate:PAH 4 的创新前进方向 已证明具有临床益处 创新性 解决方案 大量未得到满足 需求 高效执行已建立市场 在诺华口服 imatinib 进行的 三期临床试验中已显示出临床 益处在 两种或更多标准 护理疗法的基础上,对 PAH 患者进行甲磺酸盐。AV-101 不幸的是,服用 口服伊马替尼的抗体很常见, 的研发已停止 抗增殖 靶向吸入干粉 PAH 产品 候选药物 旨在提供 伊马替尼的强大临床益处 尽管有三种药物,但口服伊马替尼 仍观察到 类获得批准, 新诊断的 PAH 患者的 5 年存活率为 61% FDA 和 EMA 孤儿 将 AV-101 指定为 健康志愿者的 1 期 SAD/MAD 完成 完整 2b 期部分 AV-101br} 注册了无缝 ph2b/3 IMPAHCT 试验 并已报名参加 第 3 阶段 pH2b 数据,预计将在 2024 年 6 月 60亿美元以上的市场上发布,但是 结果不佳 |
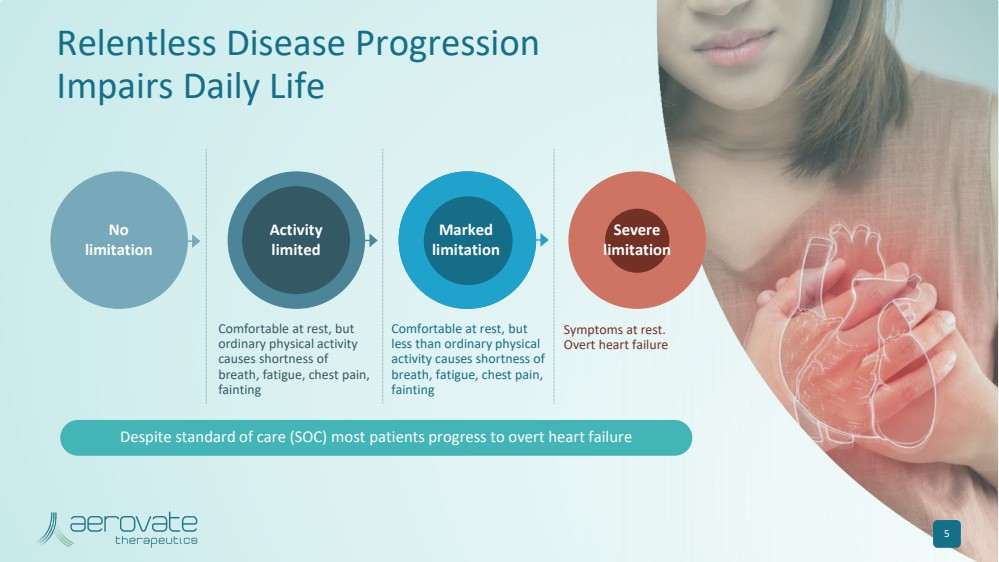
| 休息时很舒服,但是 普通的体育活动 会导致 呼吸急促、疲劳、胸痛、 昏厥 休息时舒服,但是 少于普通体力 活动会导致 呼吸急促、疲劳、胸痛、 昏厥 休息时的症状。 明显心力衰竭 没有 限制 持续的疾病进展 会损害日常生活 5 活动 有限 标记 限制 严重 限制 尽管有标准护理 (SOC),但大多数患者还是会出现明显的心力衰竭 |
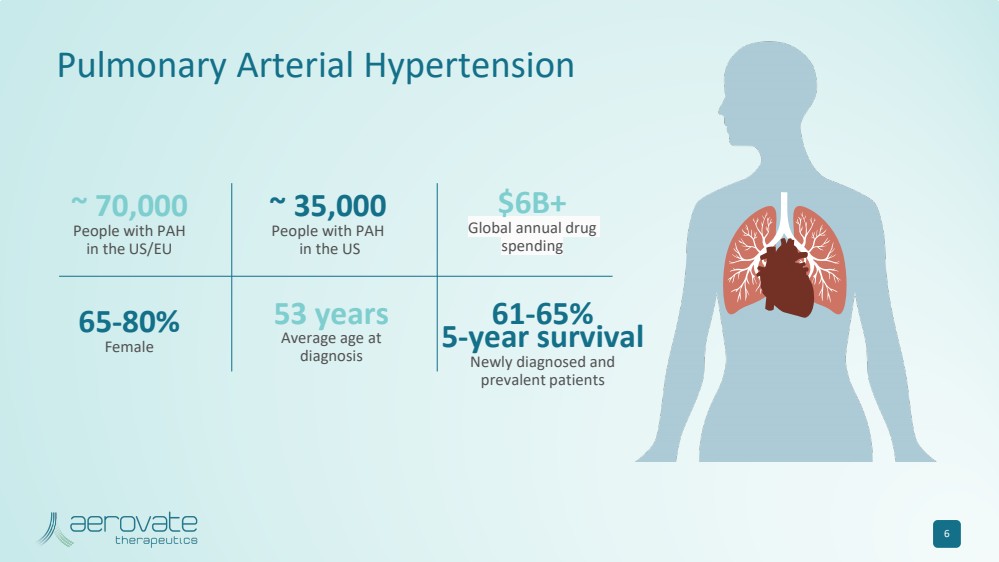
| 6 ~ 70,000 美国/欧盟 PAH 患者 ~ 35,000 名美国 PAH 患者超过 600 亿美元 全球年度药物 支出 65-80% 女 61-65% 5 年存活率 新诊断和 流行患者 53 岁 诊断时的平均年龄 肺动脉高压 |
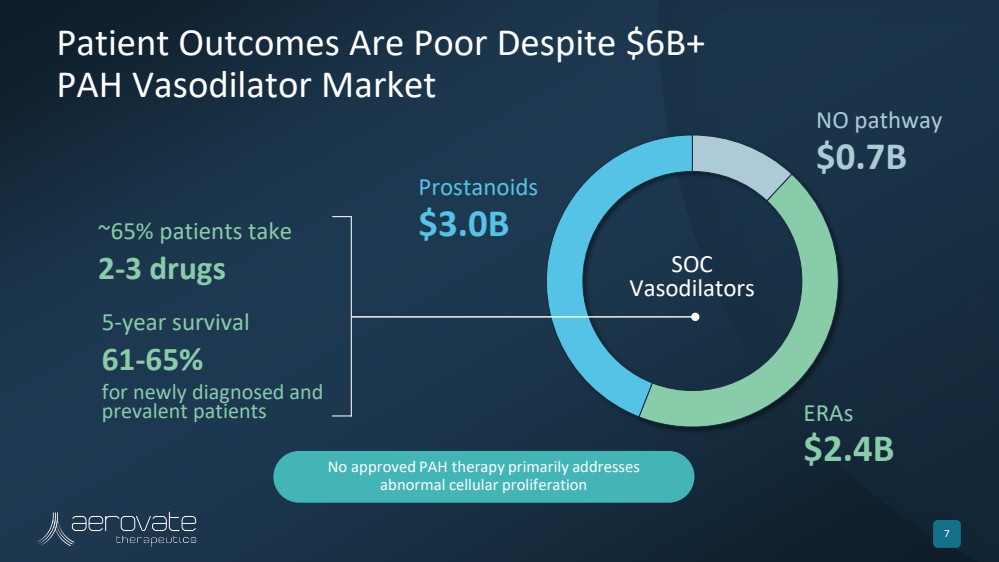
| 尽管有60亿美元以上 PAH 血管扩张剂市场 7 无路径 7亿美元 ERA 24亿美元 前列腺素 30亿美元 SOC 血管扩张剂 5 年存活率 新诊断和 流行患者 ~ 65 年存活率 5% 的患者服用 2-3 种药物 未获批准的 PAH 疗法主要解决 异常的细胞增殖 |
| 将伊马替尼从一种癌症 药物重塑为一种潜在的多环芳烃疗法 88 |
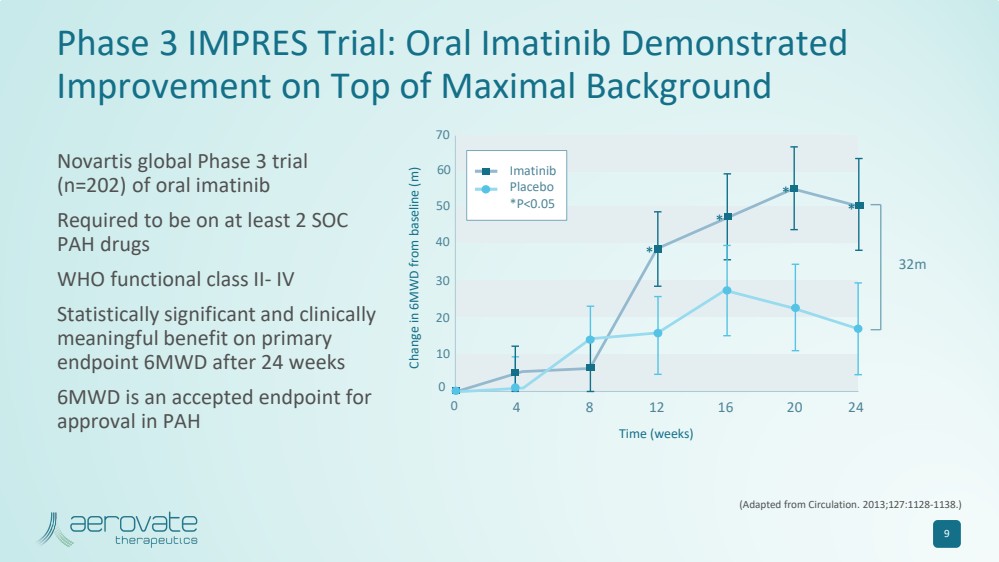
| 9 Impres 三期试验:口服伊马替尼在最大背景 的基础上显示 有所改善(改编自《循环》。2013;127:1128-1138。) 6MWD 与基线的变化 (m) 时间(周) 0 4 8 12 16 20 24 32m 0 10 20 30 40 50 60 70 * * * * * * * * 伊马替尼 安慰剂 *P |
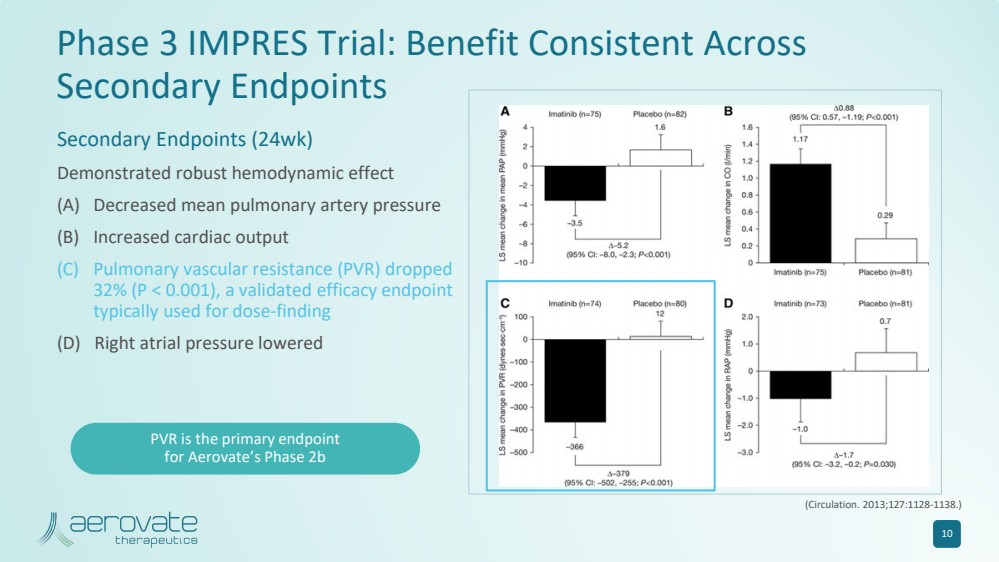
| IMPRES 3 期试验:在 次要终点受益一致 次要终点(24 周) 显示出强大的血液动力学效应 (A) 平均肺动脉压降低 (B) 心输出量增加 (C) 肺血管阻力 (PVR) 下降 32% (P |
| 伊马替尼 n=103 (%) 安慰剂 n=98 (%) 不良事件 + 100 (97) 94 (96) 恶心 57 (55) 23 (24) 外周水肿 45 (44) 20 (20) 腹泻 36 (35) 19 (19) 呕吐 31 (30) 10 (10) 周围眶水肿 30 (29) 7 (7) 头痛 25 (24) 22 (22) 呼吸困难 19 (18) 13 (13) 鼻咽炎 18 (18) 19 (19) 低钾血症 16 (16) 3 (3) 贫血 14 (14) 3 (3) 咳嗽 11 (11) 15 (15) } 疲劳 11 (11) 7 (7) 面部水肿 10 (10) 1 (1) 肌肉痉挛 10 (10) 2 (2) 伊马替尼 n=103 (%) 安慰剂 n=98 (%) 严重不良事件 + 45 (44)29 (30) 肺动脉高压恶化 6 (6) 8 (8) 贫血 7 (7) 1 (1) 呼吸困难 6 (6) 2 (2) 外周水肿 6 (6) 0 Presyncope 5 (5) 0 腹泻 3 (3) 2 (2) 设备相关感染 3 (3) 0 Syncope 1 (1) 5 (5)) 硬膜下血肿 * 2 (2) 0 口服伊马替尼引起的全身性不良事件 11(循环。2013;127:1128-1138。) * 在试验的长期延期部分中,另有6名 患者出现硬膜下 血肿。 + 在伊马替尼组中,如果个别不良事件发生在 10% 以上,则会显示这些不良事件。如果 发生在任一组 ≥3 名患者中,则显示个体严重不良事件。 |
| AV-101 PAH 的潜在靶向治疗 1212 |
| 13 AV-101 AV-101 是一种组合产品 由专有的干粉 伊马替尼配方组成,胶囊 由干粉吸入器 输送,旨在: • 将药物输送到肺部 • 限制全身暴露 • 易于给药 伊马替尼分子结构未经修改 |
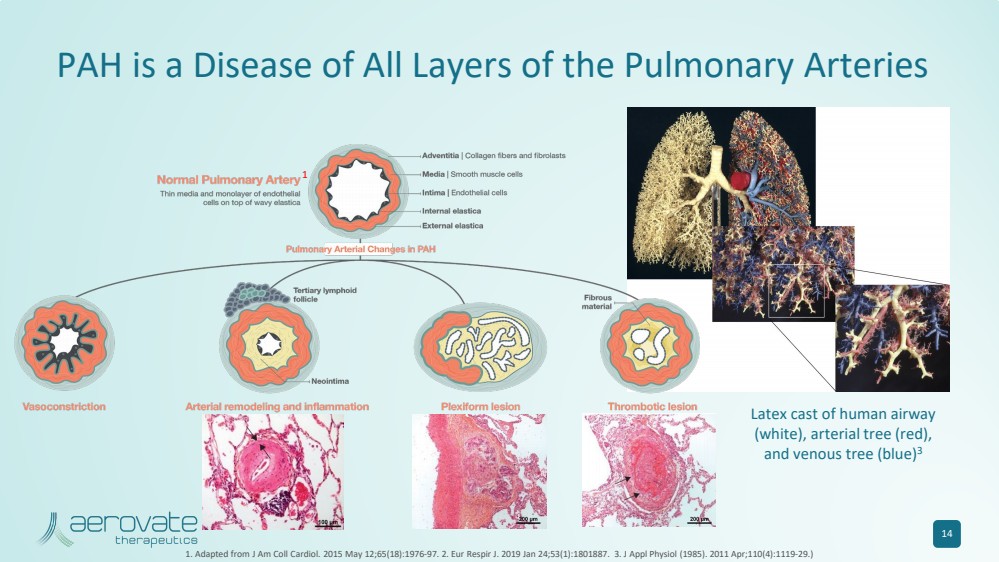
| PAH 是一种肺动脉各层的疾病 14 1.改编自 J Am Coll Cardiol。2015 年 5 月 12 日;65 (18): 1976-97。2.Eur Respir J. 2019 年 1 月 24 日;53 (1): 1801887. 3.应用生理学杂志 (1985)。2011 年 4 月;110 (4): 1119-29。) 人体气道 (白色)、动脉树(红色)、 和静脉树(蓝色)的乳胶模型 3 1 |
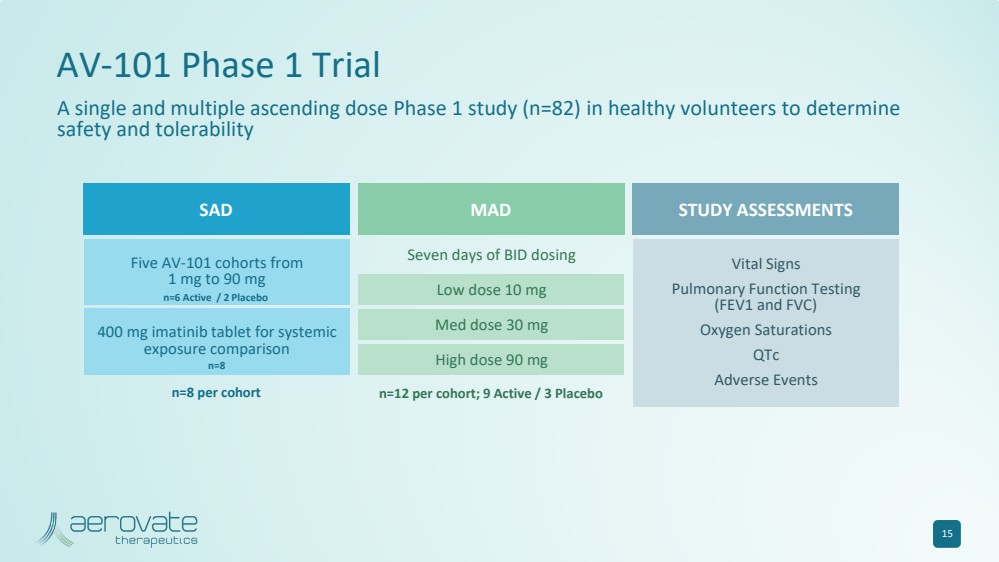
| 15 AV-101 第 1 期试验 一项针对健康志愿者的单剂量和多次递增剂量 1 期研究(n=82),旨在确定每个队列的 MAD n=12;9 活性/3 安慰剂 低剂量 10 mg 中剂量 30 mg 高剂量 90 mg BID 给药七天 SAD 研究评估 每个队列 五个 AV-101 队列从 1 mg 到 90 mg 400 mg 的伊马替尼片剂用于全身 暴露比较 生命体征 肺功能测试 (FEV1 和 FVC) 氧饱和度 不良事件 n=6 Active/2 安慰剂 n=8 |
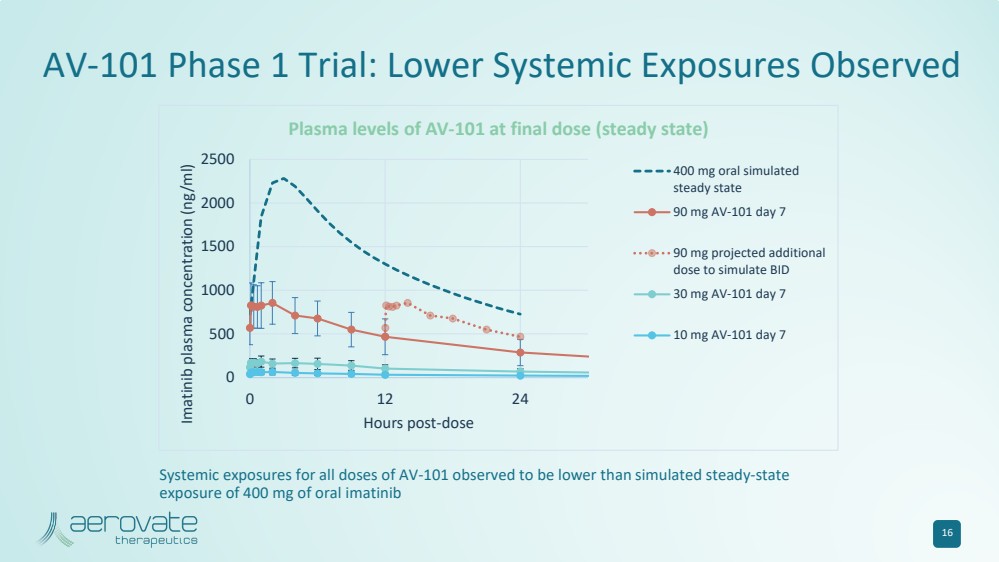
| 16 AV-101 第 1 期试验:观察到较低的全身暴露 0 500 1000 1500 2000 2500 0 12 24 伊马替尼血浆浓度 (ng/ml) 剂量后 AV-101 在最终剂量(稳定状态)时的血浆水平 400 mg 口服模拟 90 mg AV-101 第 7 天 90 mg 预计会增加 30 mg AV-101 第 7 天 10 天 mg AV-101 第 7 天观察到所有剂量 AV-101 的全身暴露量低于400 mg口服伊马替尼的模拟稳态 暴露量 |
| 17 AV-101 第 1 期耐受性概况 AV-101 总体耐受性良好 • 未报告严重不良事件 • 肺功能、氧 饱和度和 qtC 间隔没有变化 • 大多数不良反应轻度至中度 • MAD 90 mg 队列 第 1 天因呕吐而停药 • 最常见的 AE,咳嗽,为最大剂量和 } 限于给药后 30 分钟内 不良事件 n (%) 10 mg (n=8) 30 mg (n=9) 90 mg* (n=9) (n=9) (n=9) (n=9) (n=9) (n=9) (n=9) (n=9) (n=9) (n=9) (n=9) (n=9) (n=9) (n=9) 恶心--2 (22) 胸部不适--2 (22) 喉咙发炎-1 (11) 肌肉骨骼疼痛--2 (22) 单发性病例:呕吐(已停产)、消化不良、肌肉骨骼胸痛、 鼻塞、口咽痛、背痛、腹痛、Covid-19、Presyncope、 br} 丙氨酸氨基转移酶增加 *90mg 剂量以 9 x 10mg 胶囊的形式给药 |
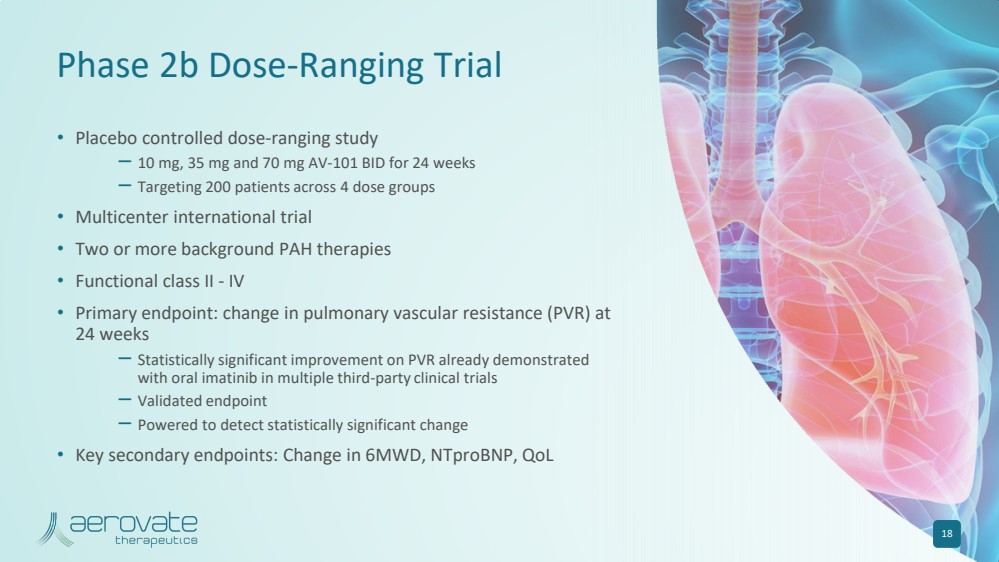
| 2b 期剂量范围试验 • 安慰剂对照剂量范围研究 — 10 mg、35 mg 和 70 mg AV-101 BID,持续 24 周 — 针对 4 个剂量组 200 名患者 • 两种或更多背景多环芳烃疗法 • 功能二类-IV • 主要终点: 24 的肺血管阻力 (PVR) 变化周 — 在多项第三方临床试验中,口服伊马替尼已证实 PVR 有统计学上的显著改善 — 经过验证的终点 — 可检测出具有统计学意义的显著结果更改 • 关键辅助终端节点:6MWD、ntproBNP、QoL 18 中的变化 |
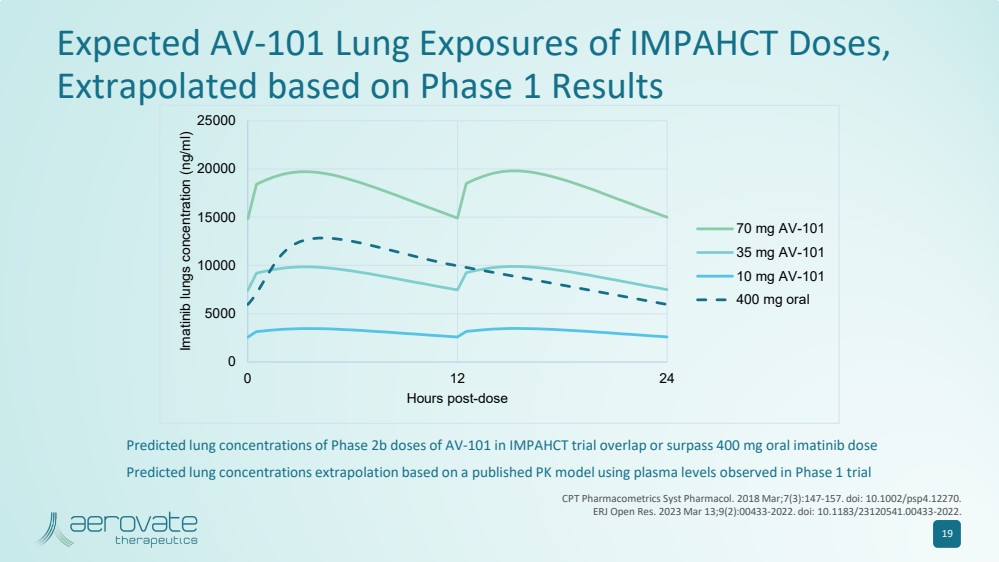
| 19 预计的 AV-101 肺部暴露量 IMPAHCT 剂量, 根据 1 期结果推断 0 5000 10000 15000 2500 25000 0 12 24 伊马替尼肺部浓度 (ng/ml) 70 mg AV-101 35 mg AV-101 10 mg AV-101 400 mg 400 mg 在 IMPAHCT 试验中 AV-101 的预计肺浓度重叠或超过 400 mg 口服伊马替尼剂量 基于已发布的 PK 模型,使用在 1 期试验 CPT Pharmacometrics Syst Pharmacol 中观察到的血浆水平推断出预测的肺浓度。2018 年 3 月;7 (3): 147-157。doi: 10.1002/psp4.12270。 ERJ 公开赛 2023 年 3 月 13 日;9 (2) :00433-2022. doi:10.1183/23120541.00433-2022。 |
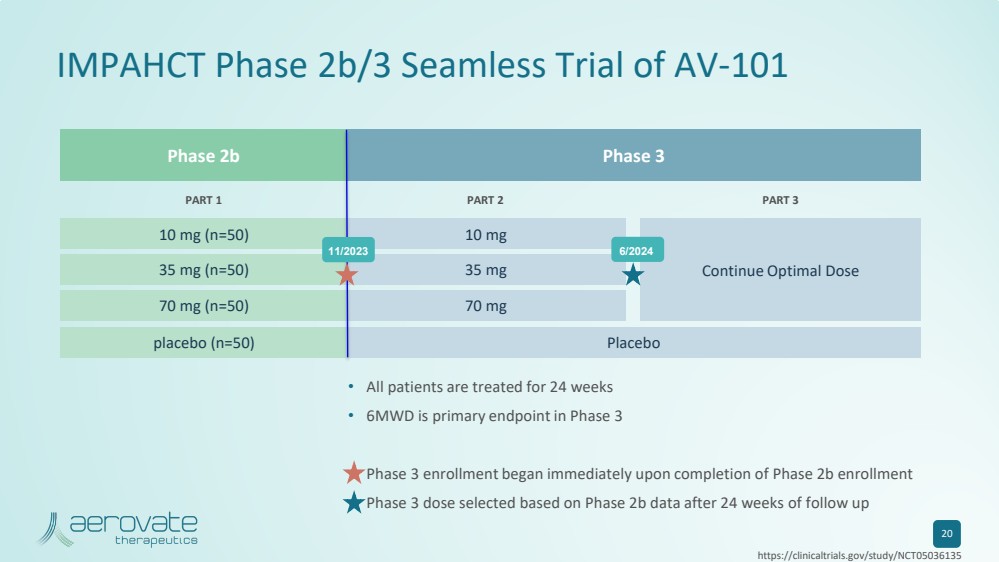
| 2b 期 3 期 IMPAHCT 2b/3 期无缝试验 AV-101 20 • 所有患者均接受了 24 周的治疗 • 6MWD 是 3 期的主要终点 • 第 3 期入组在 2b 期注册完成后立即开始 • 在随访 24 周后根据 2b 期数据选择的 3 期剂量 第 1 部分第 3 部分 10 mg (n=50) 35 mg (n=50) 35 mg (n=50) 35 mg (n=50) =50) 70 mg (n=50) 安慰剂 (n=50) 10 mg 35 mg 70 mg 70 mg 安慰剂 继续最佳剂量 11/2023 6/2024 https://clinicaltrials.gov/study/NCT05036135 |
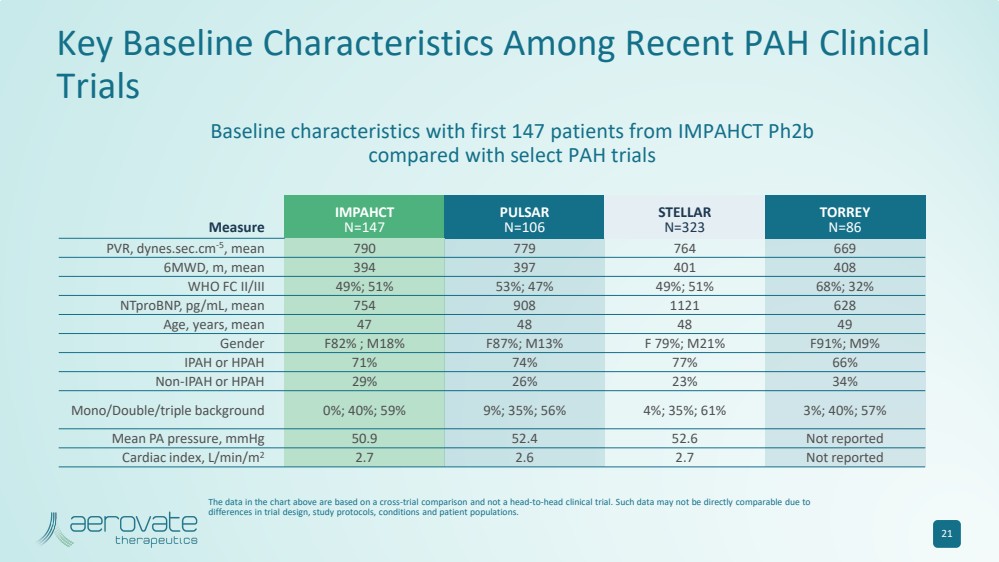
| 近期 PAH 临床 试验的关键基线特征 测量 IMPAHCT N=147 PULSAR N=106 STELLAR N=323 TORREY N=86 PVR,dynes.sec.cm-5,平均值 790 779 764 669 6MWD,m,平均值 394 397 401 408 WHO FC II/III 49%;51% 53%;47% 49%;51% 68%;32% ntproBNP,pg/mL,平均值 754 908 1121 628 年龄、年龄,平均值 47 48 48 49 性别 F 82%;M 18% F 87%;M 21% F 91%;M 9% IPAH 或 HPAH 71% 74% 77% 66% 非 IPAH 或 HPAH 29% 26% 23% 34% 单/双/三重背景 0%;40%;59% 9%;35%;56% 4%;35%;61%;3%;40%;57% 平均 PA 压力,mmHg 50.9 52.4 52.6 未报告 心脏指数,L/min/m2 2.7 2.7 未报告 与部分多环芳烃试验相比,IMPAHCT ph2b 的前147名患者的基线特征 21 上图中的数据基于跨试验比较,而不是头对头的临床试验。由于 试验设计、研究方案、条件和患者群体存在差异,此类数据可能无法直接比较。 |
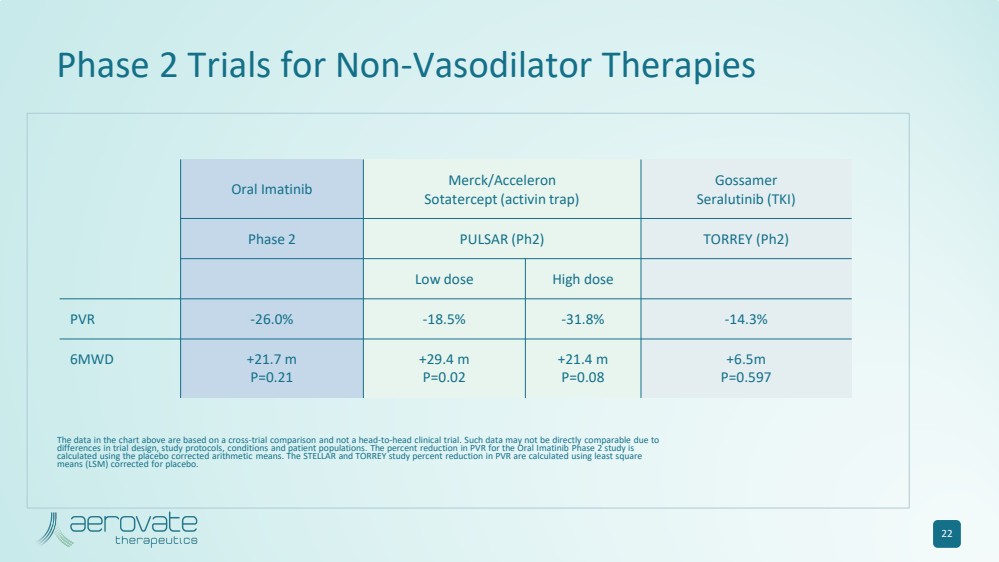
| 22 口服伊马替尼 Merck/Acceleron Sotatercept(激活素陷阱) Gossamer Seralutinib (TKI) 第 2 期 PULSAR (Ph2) TORREY (Ph2) 低剂量高剂量 PVR -26.0% -18.5% -14.3% 6MWD +21.7 m P=0.21 +29.4 m P=0.02 +21.4 m P=0.08 +6.5m P=0.597 非血管扩张疗法的二期试验 上图中的数据基于跨试验比较,而不是正面临床试验。由于试验设计、研究方案、条件和患者群体的差异,此类数据可能无法直接比较。口服伊马替尼2期研究的PVR降低百分比是使用安慰剂校正的算术方法计算的。STELLAR和TORREY研究的PVR降低百分比是使用安慰剂校正的最小二乘均值(LSM)计算得出的。 |
| AV-101:有可能成为理想的附加药物 • Al Launch,AV-101 有可能成为理想的附加药物* — 与当前疗法相结合,临床表现引人注目 — 简单易用 — 有可能成为未来护理标准的一部分 • 在目标人群中的潜在定位* — 在吸入和口服前列环素疗法之前 } — 对于偏爱吸入而不是注射的患者 以及不符合索他西普资格的患者 ,在索他西普之前 — 仍处于中度至高不良风险的患者尽管接受了索他西普和前列环素疗法 ,但结果 — 不耐受索他西普和前列环素疗法的患者 23 *假设数据和美国食品药品管理局的讨论支持美国食品药品管理局的批准并附有支持性标签 |
| AVTE 对当前和未来多环芳烃格局的看法以 丰富的经验、利益相关者的参与和市场研究为依据 • 由 PAH 专家和 PAH 患者组成的全球顾问委员会 • 与研究人员、KOL、PAH 治疗人员、护士、患者、权益协会的互动* • 稳健的市场研究 — 100 多项美国医生市场格局研究 (10 月) 2021) — 100 多位欧洲医师市场格局 研究(2022 年 6 月) — 150 多位美国医生联合需求研究帖子 Sotatercept 数据(2023 年 8 月) *个人互动只关注治疗格局,除非 通过适当的咨询协议寻求真正的建议 24 医学博士 Vizza 教授研究人员讨论 |
| PAH 治疗路径自 2005 年以来一直没有改变,疗效依然不佳 依普罗替尼波生坦安美利生坦西地那非他达拉非 前列环素途径内皮素途径一氧化氮途径 新诊断和流行患者 61%-65% 5 年存活率 更便捷的前列环素途径给药途径 输液吸入口服 更具侵略性的治疗方法 初始单一疗法前期联合疗法低风险治疗 为优化传统疗法付出重大努力路径 25 25 |
| Sotatercept 之外的未满足需求 STELLAR 试验表明 PAH 治疗 取得了重大进展... • 60% 的患者未达到多组分 改善措施 • 60% 的患者在简化的 风险模型中未达到低风险 • 70% 的患者没有改善功能类别 • 长期效果尚未完全确定 26 |
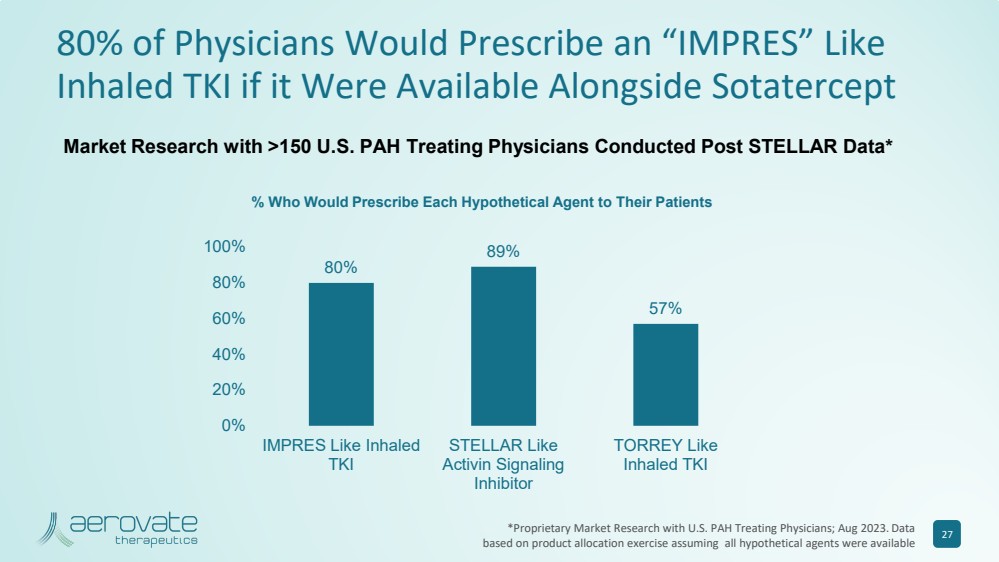
| 如果与 Sotatercept 80% 89% 57% 57% 57% 0% 20% 40% 40% 80% 100% 100% 100% 像吸入式 TKI STELLAR 一样 STELLAR 像 Activin Signaling 一样 40% 80% 100% 100% 像吸入 TKI STELLAR 一样 抑制剂 TORREY Like 吸入式 TKI 市场研究在 STELLAR 数据发布后,对超过 150 名美国多环芳烃治疗医生进行了市场研究* % 谁会给患者开每种假设药物的处方 27 *与美国多环芳烃治疗医生进行专有市场研究;2023 年 8 月。数据 基于产品分配活动,假设所有假设代理都可用 |
| AV-101:需求未得到满足,潜力巨大 28 定位 在前列环素 之前加入两种药物 在肠胃外 前列环素 ~ 35,000 名美国患者 接受多环芳烃治疗 我们估计 服用 2-3 种药物 ~ 65% (~2%) 2,750) |
| 积极的监管相互作用和反馈 监管相互作用已完成 • FDA 于 2020 年 1 月举行了 IND 前会议 • FDA 和 EMA 批准了用于治疗 PAH 的 AV-101 孤儿称号 • 2021 年 3 月收到 EMA 的科学建议 • FDA 和 EMA 于 2021 年 4 月结束了临床开发反馈 • 在 2b/3 阶段终点上调整了潜在的 NDA/MAA 提交的文件 29 |
| AV-101 至 2040+ 的知识产权保护 多项已颁发的涉及 AV-101 药物产品和使用方法的美国专利 • 专利覆盖范围至少延长至 2040 年 • 目前的美国专利在全球范围内延长 还有多项待处理的申请 • 其他气溶胶成分的申请 • 申请其他气溶胶成分 • 提交作用机理(成分无关) 为延长或提交新的审查而颁布的定期审查知识产权基于研究、 临床试验和 CMC 30 中的发现 |
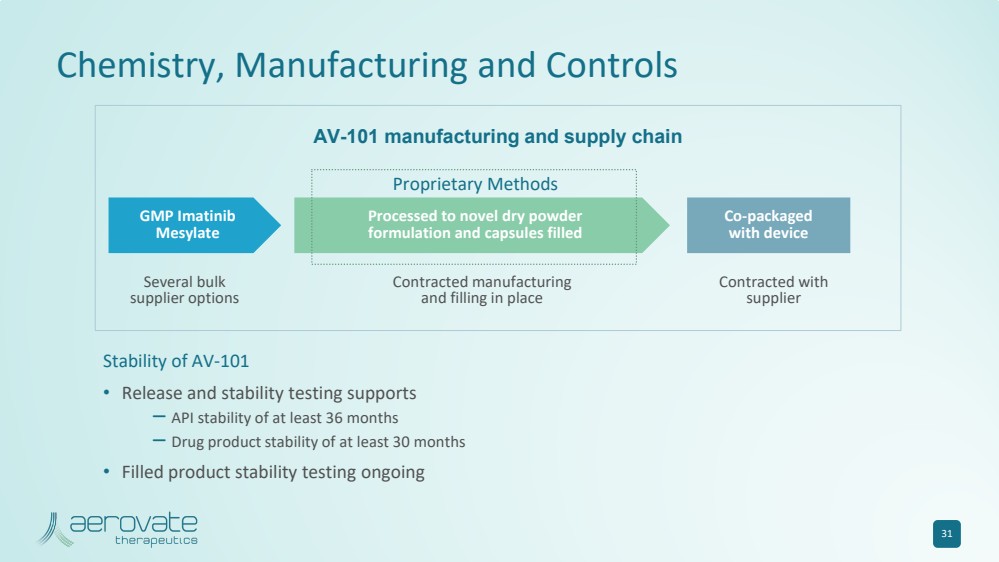
| AV-101 的化学、制造和控制 稳定性 • 释放和稳定性测试支持 — API 稳定性至少 36 个月 — 药品稳定性至少 30 个月 • 填充产品稳定性测试正在进行中 31 专有方法 几种批量 供应商选项 几种批量 供应商选项 和填充物 与 供应商 签约 AV-101 制造和供应链 br} GMP 伊马替尼 甲磺酸盐 加工成新型干粉 配方和用设备填充 联合包装 的胶囊 |
| 32 AV-101 Device and Delivery Performance AV-101 Device • Off-the-shelf commercial scale dry powder inhaler – No batteries, compressors or cords – No sterile vials containing solutions or suspensions – CE mark in EU and Device Master File registered with FDA • Designed for ease of use and convenience • Intended dosing of 2 capsules twice a day • Device replaced weekly AV-101 Delivery Performance • Consistently high delivered and fine particle dose • Ideal size and size distribution for lung penetration NOTE: Device in IMPAHCT was not used in Phase 1 trial, but delivery performance was assessed. |
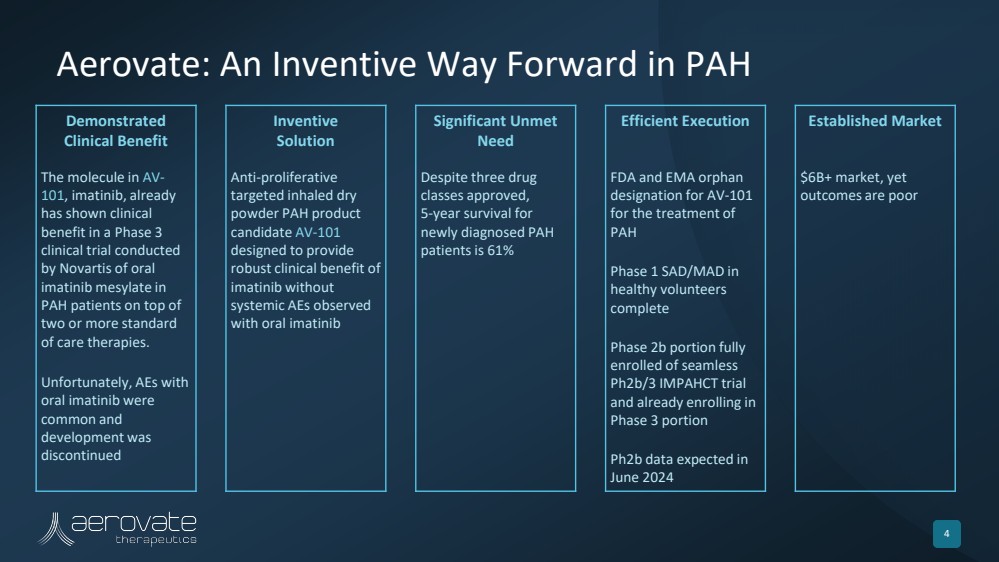
| Aerovate: An Inventive Way Forward in PAH 33 Demonstrated Clinical Benefit Inventive Solution Significant Unmet Need Efficient Execution Established Market The molecule in AV-101, imatinib, already has shown clinical benefit in a Phase 3 clinical trial conducted by Novartis of oral imatinib mesylate in PAH patients on top of two or more standard of care therapies. Unfortunately, AEs with oral imatinib were common and development was discontinued Anti-proliferative targeted inhaled dry powder PAH product candidate AV-101 designed to provide robust clinical benefit of imatinib without systemic AEs observed with oral imatinib Despite three drug classes approved, 5-year survival for newly diagnosed PAH patients is 61% FDA and EMA orphan designation for AV-101 for the treatment of PAH Phase 1 SAD/MAD in healthy volunteers complete Phase 2b portion fully enrolled of seamless Ph2b/3 IMPAHCT trial and already enrolling in Phase 3 portion Ph2b data expected in June 2024 $6B+ market, yet outcomes are poor |
| 3434 Thank you! |