

投资者演示文稿第 42 届摩根大通 年度医疗保健会议纳斯达克:ATRA 附录 99.1

前瞻性陈述本 演示和随附的口头陈述包含根据1995年《私人证券诉讼改革法》的安全港条款做出的前瞻性陈述。本演示文稿中包含的除历史事实陈述 以外的所有陈述,包括有关我们未来的经营业绩和财务状况、未来交易、业务战略、产品、候选产品、与监管机构的通信和讨论、 监管机构提交的文件、监管批准、临床前研究和临床试验以及我们的研发计划的启动、时间、进展和结果、EBV 与多发性硬化症之间的机制联系以及能力 的 ATA188 具体针对此类链接、销售、制造或以其他方式商业化我们的候选产品和产品的能力、研发成本、成功的时机和可能性、管理层对未来 运营的计划和目标、任何特许权使用费支付、我们为候选产品和产品获得和维持知识产权保护的能力,以及Atara为其计划运营提供资金的现金、现金等价物、短期投资的充足性,均为前瞻性陈述 Atara Biotherapeutics, Inc.(“Atara”)或 “公司”)。这些陈述涉及已知和未知的风险、不确定性和其他重要因素,这些因素可能导致我们的实际 业绩、业绩或成就与前瞻性陈述所表达或暗示的任何未来业绩、业绩或成就存在重大差异。在某些情况下,您可以通过前瞻性词语 来识别这些陈述,例如 “相信”、“可能”、“将”、“估计”、“继续”、“预期”、“打算”、“可能”、“会”、“项目”、 “预测”、“计划”、“期望”,或者这些词语的负数或复数或类似表述。这些前瞻性陈述受风险和不确定性影响,包括 Atara向美国证券交易委员会(SEC)提交的文件中讨论的风险和不确定性,包括 公司最近提交的10-K表和10-Q表定期报告的 “风险因素” 和 “管理层对财务状况和经营业绩的讨论和分析” 部分,以及其中以引用方式纳入的文件。这些风险和不确定性包括但不限于与昂贵而耗时的药品开发过程以及临床成功的不确定性相关的风险和不确定性 ;COVID-19 疫情以及乌克兰和中东战争,这可能会严重影响 (i) 我们的业务、 研究、临床开发计划和运营,包括我们在南加州、丹佛和临床试验场所的业务,以及第三方制造商的业务或运营,合同研究与我们开展业务的组织或 其他第三方,(ii)我们获得资本的能力,以及(iii)我们普通股的价值;未来和待定立法和法规的影响;我们的信息技术和通信 系统的使用和网络安全攻击;我们现金资源的充足性和对额外资本的需求,以及可能导致我们或我们行业实际业绩、活动水平、业绩或成就的其他因素与前瞻性预期存在重大差异声明。由于前瞻性陈述本质上受风险和不确定性的影响,其中一些是无法预测或量化的,有些是我们无法控制的,因此 您不应依赖这些前瞻性陈述作为对未来事件的预测。我们的前瞻性陈述中反映的事件和情况可能无法实现或发生,实际结果可能与前瞻性陈述中预测的 存在重大差异。除非适用法律要求,否则我们不计划公开更新或修改此处包含的任何前瞻性陈述,无论是由于任何新信息、未来事件、 情况变化还是其他原因。本演示文稿中包含的某些信息以及本演示期间的口头陈述涉及或基于从第三方来源获得的研究、出版物、调查和其他数据以及 Atara 自己的内部估计和研究。尽管Atara认为截至本演示之日这些第三方研究、出版物、调查和其他数据是可靠的,但它尚未独立核实,也没有以 的名义陈述从第三方来源获得的任何信息的充分性、公平性、准确性或完整性。此外,没有独立消息来源评估过Atara内部估计或研究的合理性或准确性,也不应 依赖本演示文稿中与此类内部估计和研究有关或基于此类内部估计和研究的任何信息或陈述。本演示文稿的内容受版权保护,版权将由 Atara 主张,未经 Atara 事先书面许可,不得复制 本演示文稿的任何部分、存储在检索系统中或以任何形式或任何方式传输。

第一家获得监管机构 批准的异基因T细胞免疫疗法的公司于2022年12月获得EMA的批准;BLA的申请预计将于2024年第二季度提交。扩大与皮尔法伯的全球tab-cel® 合作伙伴关系已于2023年12月结束近期里程碑, ATA3219,采用临床验证技术的异基因CD19 CAR T细胞狼疮肾炎IND申请预计将在2024年第一季度获得复发/难治性批准预计 2024 年下半年将有初步临床数据的 B-cell NHL 重点运营 活动和相关的战略重组将 Cash Runway 延续到2027年 ATARA是第一个发挥异基因T细胞疗法变革潜力的公司
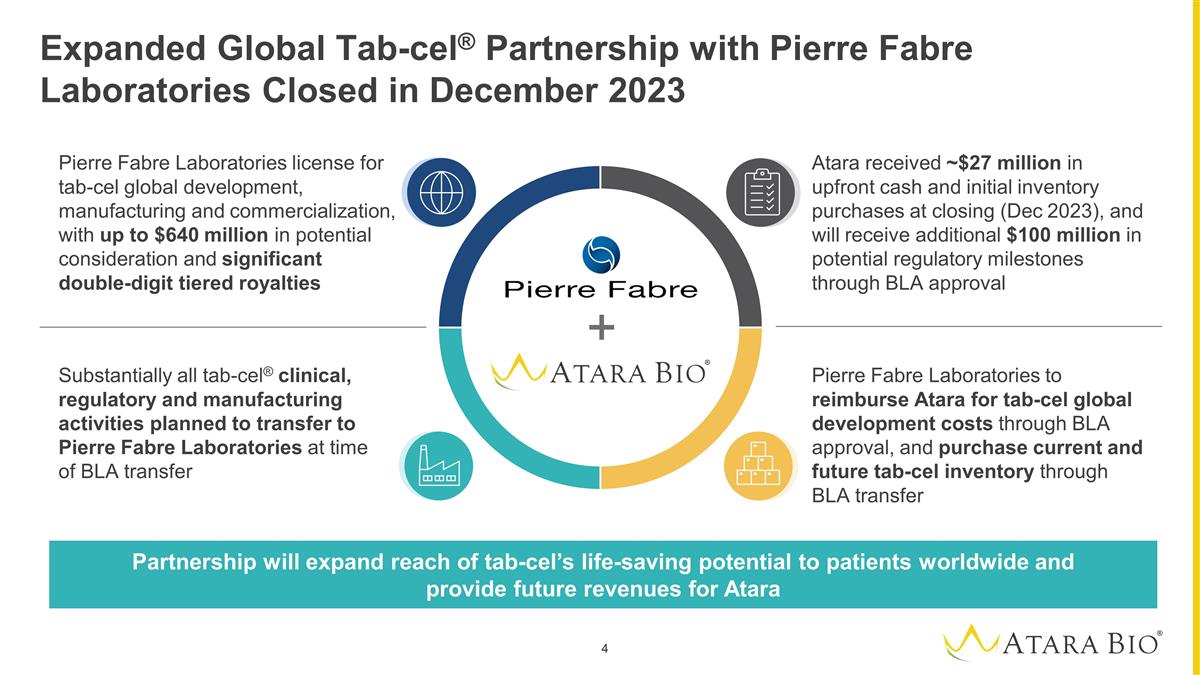
扩大与皮尔法伯实验室的全球 Tab-cel® 合作伙伴关系已于 2023 年 12 月结束 Pierre Fabre 实验室的 tab-cel 全球开发、制造和商业化许可证,潜在对价高达 6.4 亿美元,以及巨额的 两位数分级特许权使用费皮尔法伯实验室通过 BLA 批准向阿塔拉偿还 tab-cel 全球开发成本,并通过 BLA 转让购买当前和未来的 tab-cel 库存几乎所有 tab-cel® 临床、 监管和生产活动计划于在BLA转让时向皮尔法伯实验室转移Atara在收盘时(2023年12月)收到了约2700万美元的预付现金和初始库存购买,并将通过BLA批准获得额外的1亿美元潜在监管里程碑合作伙伴关系将扩大全球患者对tab-cel救生潜力的覆盖范围,并为Atara提供未来的收入

根据强大的临床档案,Tab-cel BLA有望在2024年第二季度提交BLA最新3期等位基因数据削减分析增强了人们对tab-cel BLA申报包的信心 49% ORR(p
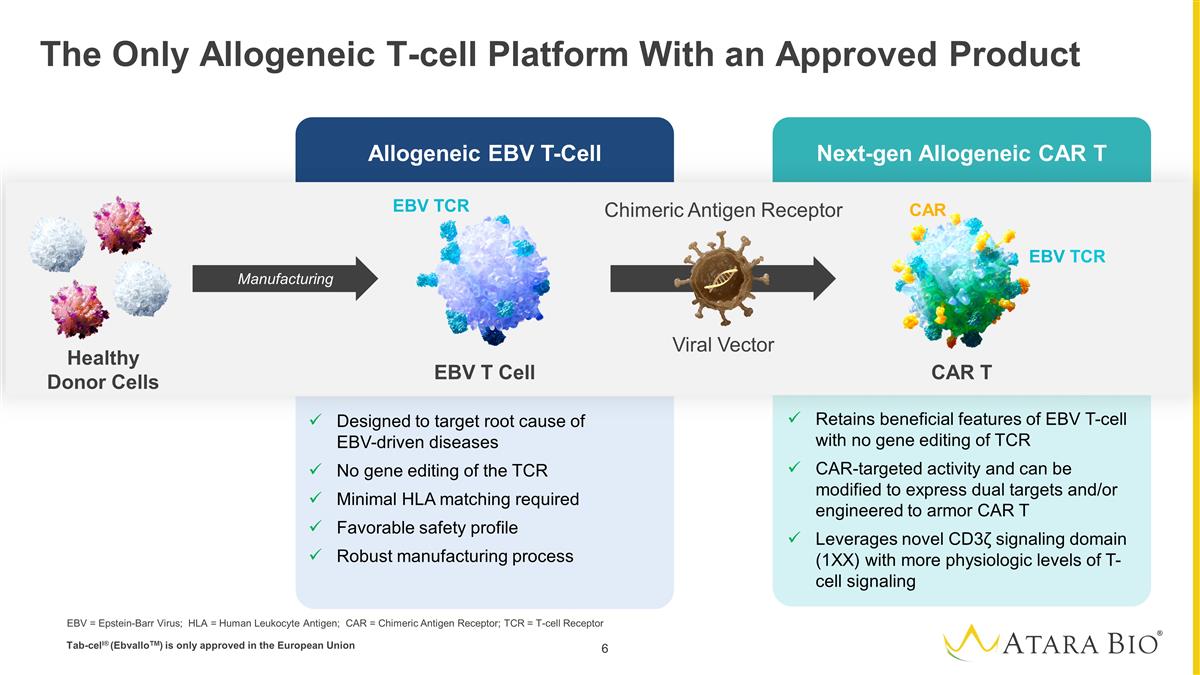
异基因 EBV T-Cell 下一代 Allogeneic CAR T 唯一获得批准产品的异体 T 细胞平台专为靶向 EBV 驱动疾病的根本原因而设计无需对 TCR 进行基因编辑 TCR 最低的 HLA 匹配要求良好的安全性配置稳健的制造工艺保留 EBV T 细胞的有益特征,可以修饰以表达双重靶标和/或设计成装甲 CAR T 杠杆新型 CD3信号域 (1XX) 具有更高生理水平的 T 细胞 信号 EBV T 细胞 CAR T Chimeric抗原受体 EBV TCR EBV TCR CAR 制造病毒载体健康供体细胞 EBV = 爱泼斯坦-巴尔病毒;HLA = 人类白细胞抗原;CAR = 嵌合抗原受体;TCR = T 细胞受体 tab-Cell® (ebVallotM) 仅在欧盟获得批准
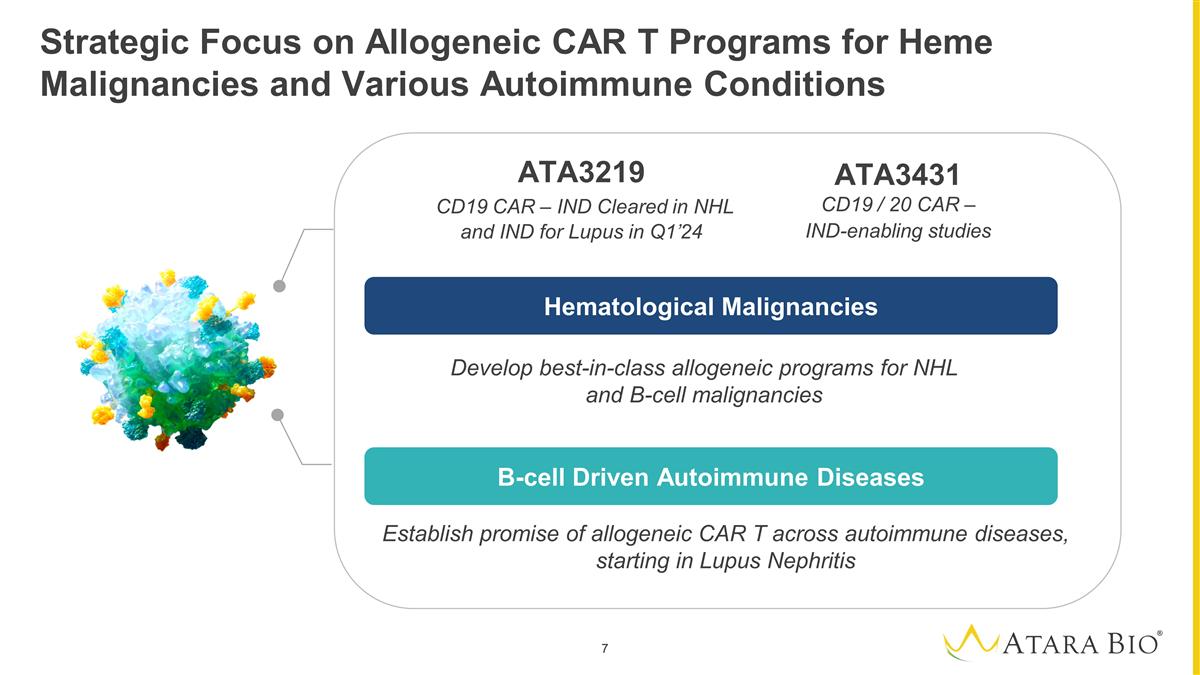
战略重点是针对血红素恶性肿瘤和各种自身免疫性疾病的异基因 CAR 项目制定一流的异基因计划针对 NHL 和 B 细胞恶性肿瘤确定同种异体 CAR T 在自身免疫性疾病中的希望,首先是狼疮肾炎 `` 血液学恶性肿瘤 B 细胞驱动的自身免疫性疾病 ATA3219 CD19 CAR — IND 在 NHL 和印度 24 年第一季度治疗狼疮 ATA3431 CD19/20 CAR — 支持 IND 的 研究
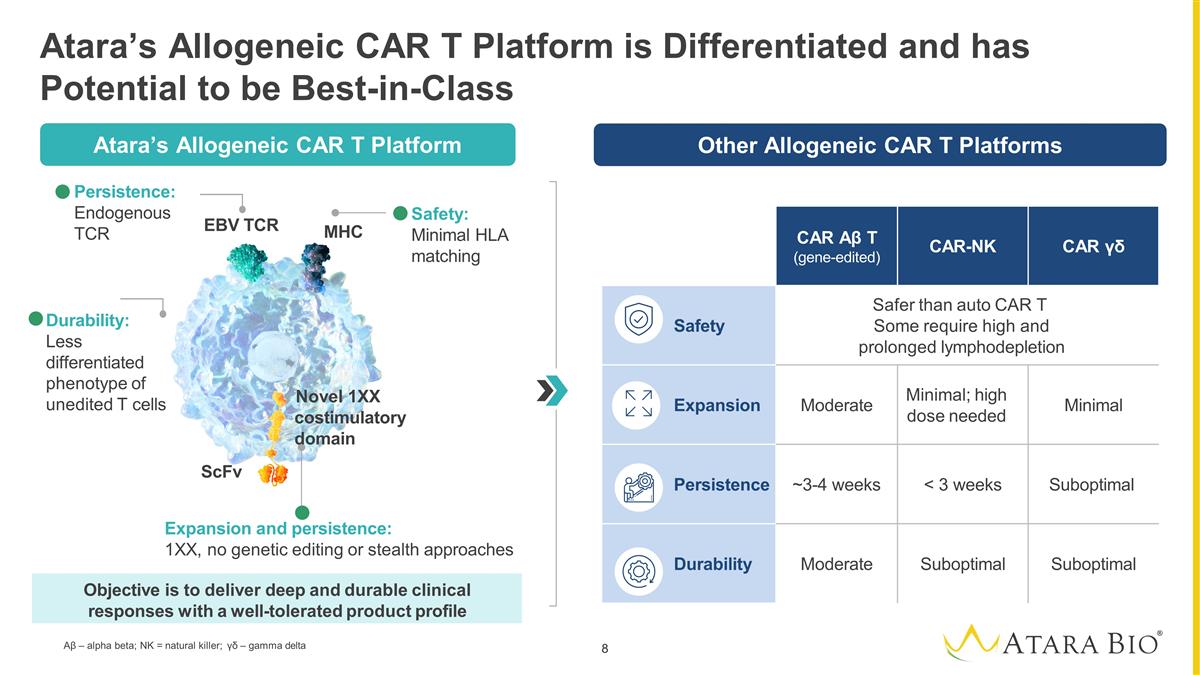
其他同种异体 CAR 平台 Atara 的异基因 CAR T 平台具有差异化特性,有可能成为一流的 CAR αβ T(基因编辑)CAR-NK CAR γβ 安全性比汽车 CAR T 更安全有些需要长期的淋巴消耗 膨胀量中等最小;需要高剂量最小持续时间 ~3-4 周

1。Park、JH 等海报 163A。ASH 2022. 2.Curran KJ 等人ASH 2023. 3.Barba、P 等人海报 439。ASH 2022. 9 项来自行业领导者的临床验证证实了我们的异基因 CAR T 平台 TAK-940 CD19 auto CAR T 的关键特性为 1XX 剂量等级 1 (25M),产生 ORR 89%,CR 78% (n=9) 1 Memorial Sloan Kettering 异基因 EBV CD19 CAR T 移植后患者的总存活率可达 3 年2 YTB323 富含 STEM 的汽车 CD19 CAR T 69% 耐用 CR (DL2 — 12.5M,n=30) 3 1 2 3 分化程度较低的 T 细胞耐久性 1XX 信号结构域扩展和持久性内源性 TCR 和最低限度 HLA 匹配持久性和安全性
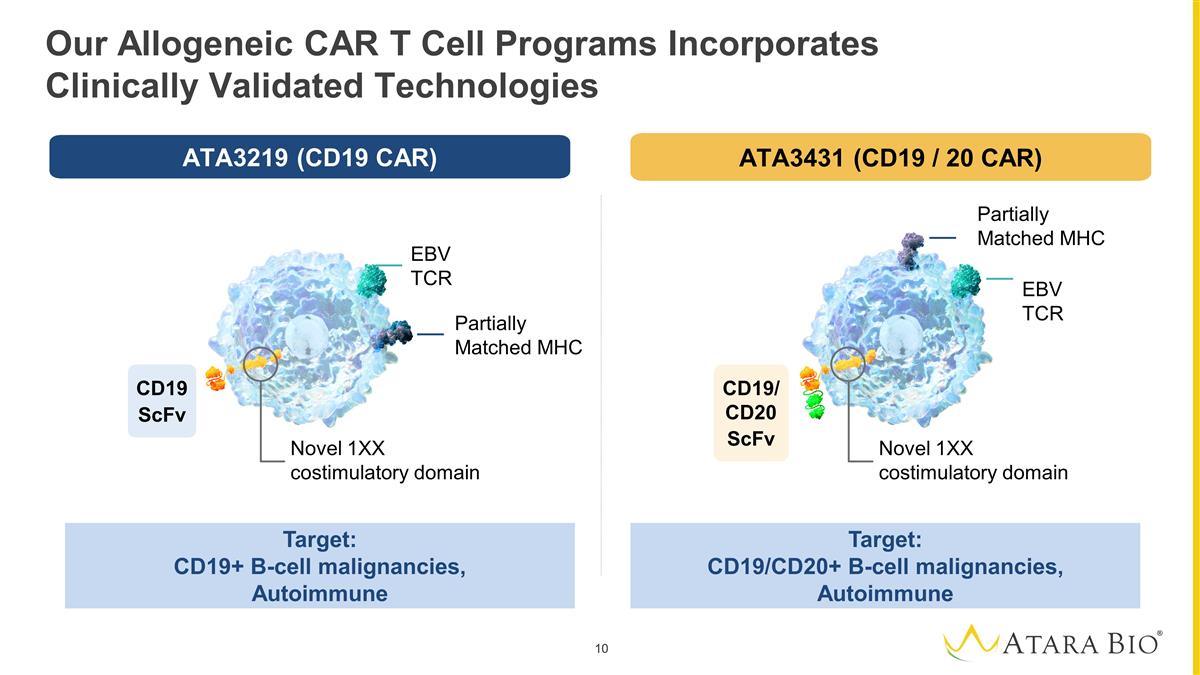
我们的同种异体 CAR T 细胞项目 采用临床验证的技术,靶向:CD19+ B 细胞恶性肿瘤,自身免疫靶标:CD19/CD20+ B 细胞恶性肿瘤,自身免疫性 EBV TCR 部分匹配 MHC 新型 1XX 共刺激结构域新型 1XX 共刺激结构域部分 匹配的 MHC EBV TCR CD19 scfV CD19/CD20 scfV ATA3219 (CD19 CAR) ATA3431(CD19/20 汽车)
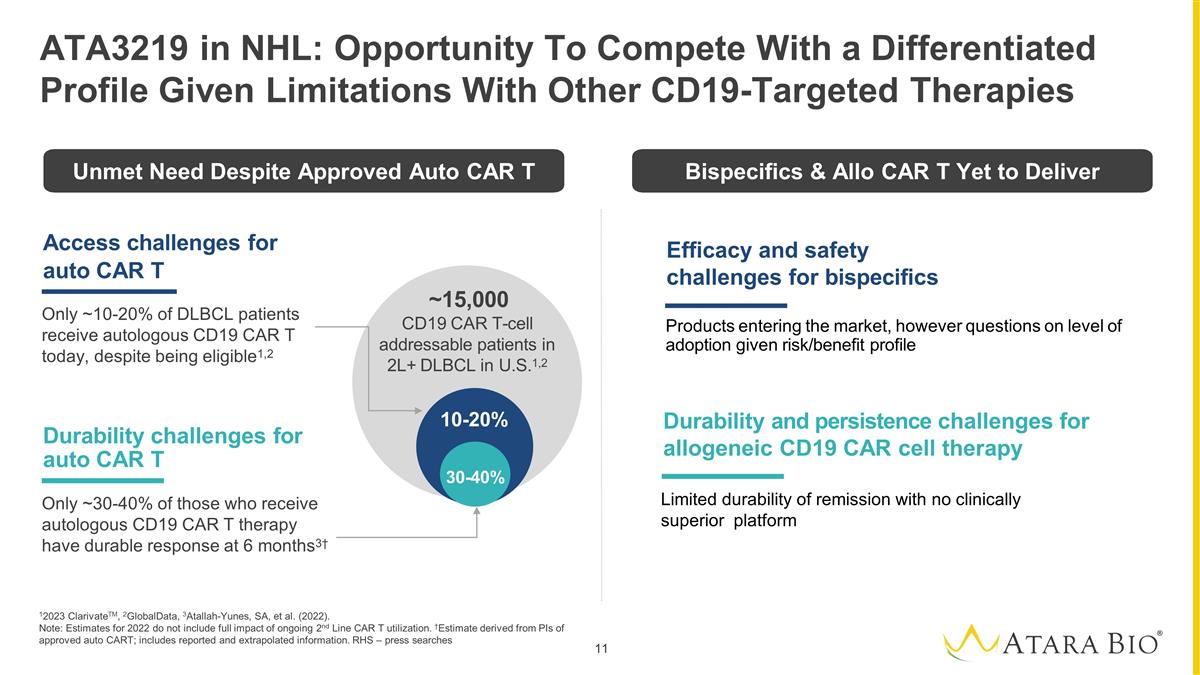
自动 CAR T 仅有大约 10-20% 的 DLBCL 患者尽管有资格接受自体 CD19 CAR T 治疗1,2 仅限自体 CAR T 的耐久性挑战 ~ 30-40% 接受自体 CD19 CAR T 疗法的患者在 6 个月时有持久的反应3† 10-20% 30-40% ~15,000 名美国2L+ DLBCL 患者中可寻址的 CD19 CAR T 细胞1,2 12023 ClarivateTM、2GlobalData、3Atallah-Yunes、SA 等(2022年)。注意:2022年的估计值不包括正在进行的二号线CAR T使用率的全部影响。†估计 源自批准的自动 CART 的 PI;包括报告和推断的信息。RHS — 媒体在 NHL 中搜索 ATA3219:鉴于其他 CD19 靶向疗法的局限性 的耐久性 和异体 CD19 CAR 细胞疗法的持续性挑战,双特异性产品进入市场的功效和安全性挑战,但是,鉴于风险/收益概况的采用水平存在问题尽管获得批准 Auto CAR 双特异体和 Allo CAR T 尚未提供有限的缓解耐久性没有临床上优越的平台

ATA3219 临床前数据 显示,在 NHL 中表达变异反应性低的 CD19 肿瘤细胞具有长期体内扩张、多功能表型和高效靶向 5 ATA3219:IND 获批,Atara 首个异基因 CAR T 1 的 1 期研究已开始。Park、JH 等海报 163A。ASH 2022.2.Stenger D 等人Blood 2020. 3.Barba、P 等人海报 439。ASH 2022.4.沙希德、S 等人海报在 ASH; 2023 上展出。5.Pham、C 等。摘要在 2023 年移植与细胞 疗法 (TCT) 会议上发表。临床上差异化程度较低的 T 细胞表型与改善和耐久的临床反应相关3 1XX 信号结构域与良好的反应率、耐久性和安全性1 保留 定义明确的内源性 TCR,对反应寿命至关重要2 原理证明:对前一代异体 CD19 靶向 CAR EBV T 细胞结构的学术临床研究显示,其总体存活时间可长达三年 12 名造血细胞移植后出现复发/难治性 B 细胞恶性肿瘤的患者4 2 1 3 Novel 1XX共刺激域 EBV TCR CD19 scfV 部分匹配 MHC 2 1 3 ATA3219:下一代现成的异基因 CD19-1XX CAR+ EBV T 细胞 采用了多种经过临床验证的技术
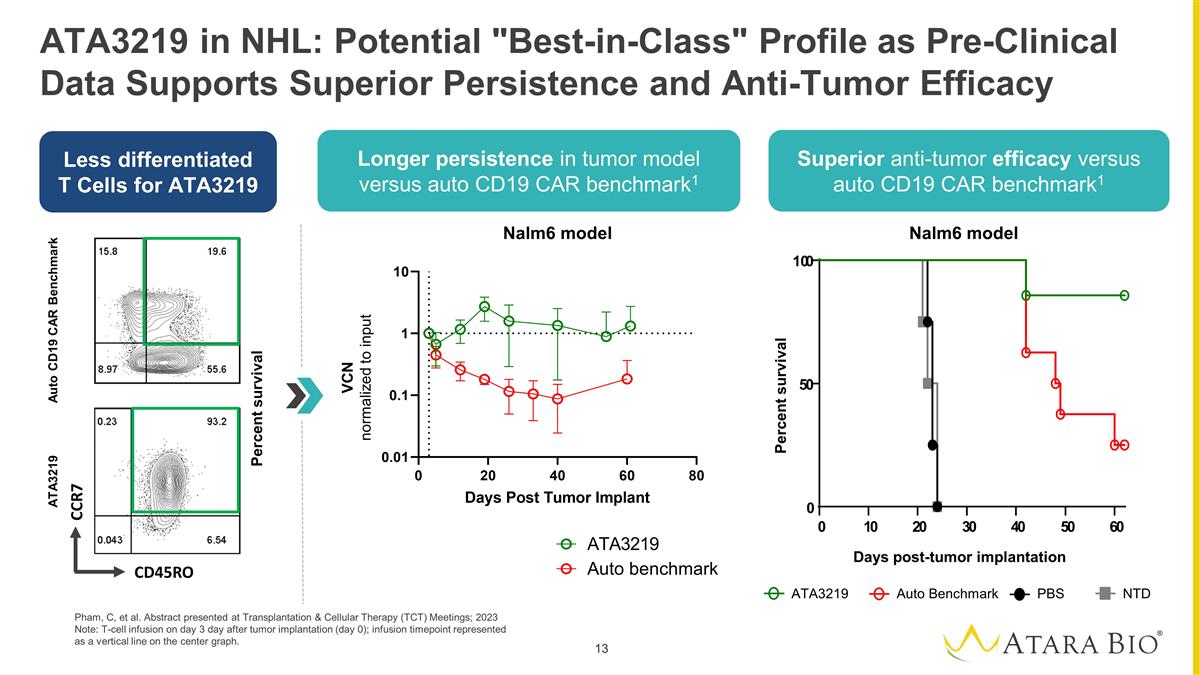
NHL 中的 ATA3219:潜在的 “同类最佳” 概况,因为临床前数据支持卓越的持久性和抗肿瘤功效 Pham、C 等人。摘要在移植与细胞疗法(TCT)会议上发表;2023 年注意:肿瘤 植入后的第 3 天(第 0 天)输注 T 细胞;输液时间点以中心图上的垂直线表示。ATA3219 差异化较小 T 细胞与自动 CD19 相比在肿瘤模型中的持续时间更长 CAR 基准测试1 与自动 CD19 相比具有卓越的抗肿瘤功效 CAR 基准1 Nalm6 模型 ATA3219 自动基准 PBS 肿瘤移植后存活天数存活百分比 0 1 0 2 0 3 0 4 0 0 6 0 0 0 0 0 VCN 标准化为输入 Auto CD19 CAR 基准 ATA3219 存活百分比 CR7 CD45RO Nalm6 模型

时间表计划在 24 年第一季度对狼疮 肾炎进行临床试验 ATA3219 在自身免疫领域的研究:在势头不断增长的领域,Atara 在狼疮肾炎领域迅速发展未得到满足的需求;护理标准和批准的产品疗效有限 概念验证自体 CAR T 学术研究的令人信服的验证(8/8 名患者在 CAR T 细胞生成 >1 年)Lupus1) 输液获得缓解和新兴行业数据 Novel Approach 尚无 B 细胞靶向异体产物 狼疮或自身免疫性疾病的临床数据在狼疮肾炎中使用 CD19 CAR T 的理由 ATA3219 在狼疮模型中药效强劲且特异性的 B 细胞耗竭,具有相关的细胞因子反应,分化程度较低 表型和 1XX 驱动细胞适应度可能导致快速和深度消耗 B 细胞的潜力安全性有限狼疮模型中的非特异性活性无需基因编辑 — 500 多名患有异基因 EBV T 细胞的 疾病患者具有丰富的安全经验 1XX 旨在减少炎症。许多其他自身免疫性疾病可能会从中受益ATA3219 1.血液 (2023) 142(补充 1):220。

ATA3431:现成的同种异体 CD19/CD20 CAR T 计划正在进行支持临床试验的研究进展美国血液学会于 2021 年12月举行的会议上公布的针对CD19和CD20的积极临床前数据降低了因CD19抗原丢失而复发的可能性, 据推测是CD19 CAR T治疗后出现耐药性或疾病复发的主要原因。靶向CD19和CD20提供潜在的增量疗效益处和 1XX 共刺激可增强持久性 Autologous CD19/CD20 双 CAR T 已显示出令人鼓舞的疗效和临床试验中的安全性(IMPT-314)ATA3431 临床前数据显示,基于强效的抗肿瘤活性、长期持久性和卓越的肿瘤生长抑制作用 EBV TCR 部分匹配的 MHC Novel 1XX 共刺激结构域 CD19/CD20 scfV Cha、S 等人。海报 4800。ATA3431:用于治疗 B 细胞恶性肿瘤的异体 CD19/CD20 双特异性 CAR EBV T 细胞。灰烬 2023。
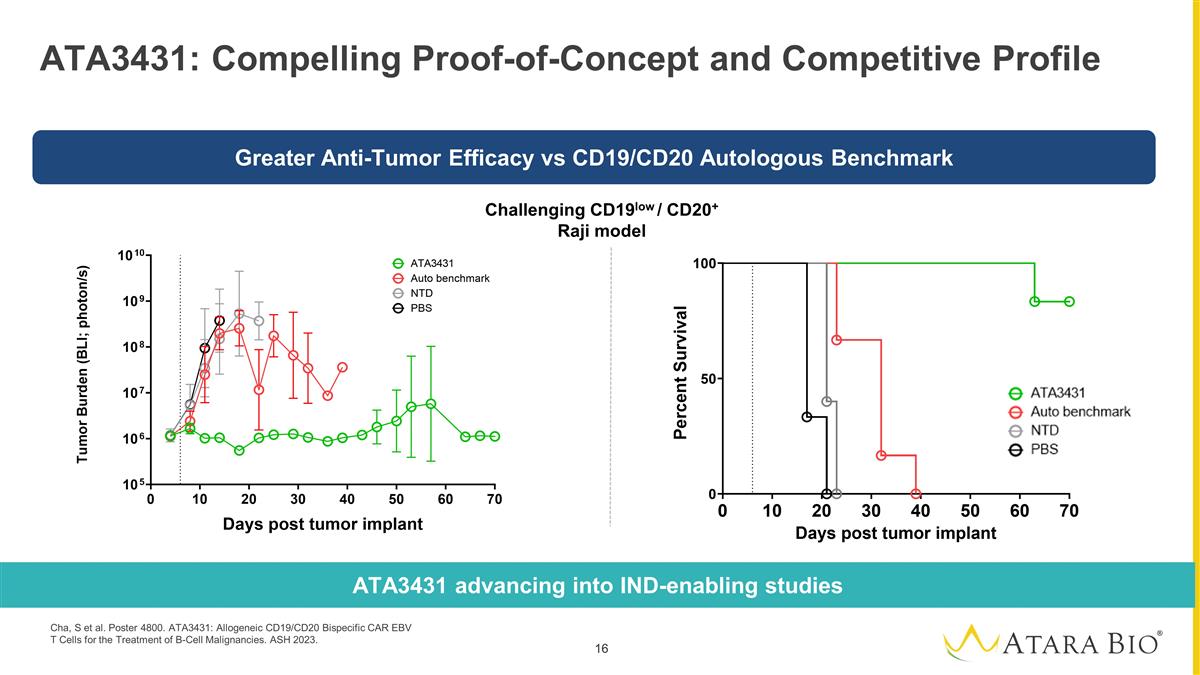
ATA3431:引人注目的 概念验证和竞争概况挑战 CD19low/CD20+ Raji 模型 ATA3431 进入支持临床试验的研究与 CD19/CD20 自体基准测试相比,抗肿瘤疗效更高 Cha、S 等人海报 4800。ATA3431:用于治疗 B 细胞恶性肿瘤的异体 CD19/CD20 双特异性 CAR EBV T 细胞。灰烬 2023。
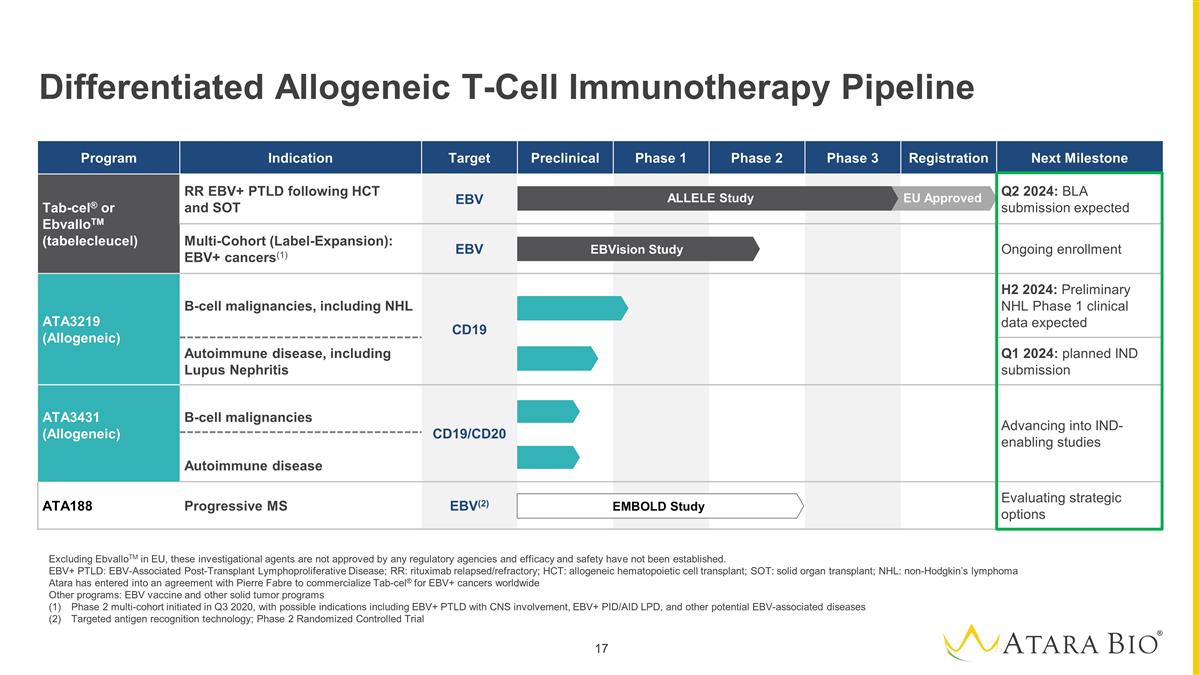
差异化异体T细胞 免疫疗法产品线不包括欧盟的ebvalloTM,这些研究药物未经任何监管机构的批准,疗效和安全性尚未确定。EBV+ PTLD:EBV 相关移植后淋巴细胞增生性疾病;RR: 利妥昔单抗复发/难治性;HCT:异基因造血细胞移植;SOT:实体器官移植;NHL:非霍奇金淋巴瘤 Atara 已与皮尔法伯达成协议,将用于EBV+癌症的Tab-Cel® 商业化 全球其他项目:EBV 疫苗和其他实体瘤项目 2 期多队列于 2020 年第三季度启动,可能的适应症包括受累中枢神经系统的 EBV+ PTLD、EBV+ PID/AID LPD 以及其他潜在的 EBV 相关疾病 靶向疾病抗原识别技术;2 期随机对照试验计划适应症目标临床前 1 期 2 期 3 期注册下一个里程碑 Tab-cel® 或 ebvalloTM(tabelecleucel)RR EBV+ PTLD 继 HCT 和 SOT EBV 第二季度之后:BLA 预计提交多队列(标签扩展):EBV+ 癌症(1)EBV 正在进行的入组 ATA3219(异基因)B 细胞恶性肿瘤肿瘤,包括 NHL CD19 H2 2024:NHL 1 期初步临床数据预计会出现自身免疫性疾病, 包括 2024 年第一季度狼疮肾炎:计划提交 IND ATA3431(异基因)B 细胞恶性肿瘤 CD19/CD20 进入支持临床试验的研究自身免疫性疾病 ATA188 进行性多发性硬化症 EBV (2) 评估战略选择 EMBOLD 研究 ebVision 研究 欧盟批准的等位基因研究

谢谢纳斯达克:ATRA