
正如 于2024年1月19日提交给美国证券交易委员会的文件
注册编号333-
美国 美国
证券交易委员会
华盛顿特区,20549
表格 S-1
注册 语句
在……下面
1933年《证券法》
AZITRA, Inc.
(注册人在其章程中指定的确切名称)
| 特拉华州 | 2834 | 46-4478536 | ||
(州或其他司法管辖区 公司(br}或组织) |
(主要 标准行业 分类 代码号) |
(I.R.S.雇主 标识 编号) | ||
商务园大道21号 布兰福德,CT 06405 (203) 646-6446 | ||||
(地址,包括邮政编码和电话号码,包括注册人主要执行办公室的区号)
弗朗西斯科·D·萨尔瓦
商务园大道21号
布兰福德,CT 06405
(203) 646-6446
(服务代理商的名称、地址(包括邮政编码)和电话号码(包括区号)
将 拷贝到:
Daniel K.Donahue,Esq. 格林伯格 Traurig,LLP Jamboree路18565号,500号套房 加利福尼亚州欧文,邮编:92612 (949) 732-6557 |
威廉·哈达德,Esq. 阿里夫 索托,Esq. VEnable 有限责任公司 西42街151号,49楼 纽约,邮编:10036 (212) 307-5598 |
建议向公众出售的大约 开始日期:在本注册声明生效后,在切实可行的范围内尽快开始。
如果根据《1933年证券法》第415条规定,本表格中登记的任何证券将以延迟或连续方式发售,请勾选下面的方框。
如果根据证券法下的规则462(B),本表格是为了注册发行的额外证券而提交的,请选中 下面的框,并列出相同产品的较早生效注册声明的证券法注册声明编号 。☐
如果此表格是根据证券法下的规则462(C)提交的生效后修订,请选中以下框并列出同一产品的较早有效注册声明的证券法注册声明编号。☐
如果此表格是根据证券法下的规则462(D)提交的生效后修订,请选中以下框并列出同一产品的较早有效注册声明的证券法注册声明编号。☐
用复选标记表示注册人是大型加速申报公司、加速申报公司、非加速申报公司、较小的报告公司、 还是新兴成长型公司。请参阅《交易法》第12b-2条规则中的“大型加速申报公司”、“加速申报公司”、“小型报告公司”和“新兴成长型公司”的定义:
| 大型 加速文件服务器☐ | 已加速 文件服务器☐ | 非加速 文件服务器 | 较小的报告公司 |
| 新兴的 成长型公司 | |||
如果 是一家新兴成长型公司,请用复选标记表示注册人是否已选择不使用延长的过渡期来遵守证券法第7(A)(2)(B)节规定的任何新的或修订的财务会计准则。☐
注册人在此修改本注册声明所需的一个或多个日期,以将其生效日期延后至注册人应提交进一步修订,明确声明本注册声明此后将根据修订后的1933年证券法第8(A)条生效,或直至注册声明于委员会根据上述第8(A)条决定的日期生效。
此初步招股说明书中包含的 信息不完整,可能会更改。在向美国证券交易委员会提交的注册声明宣布生效之前,这些证券不得出售。本初步招股说明书不是出售这些证券的要约,也不是在任何不允许要约或出售的州征集购买这些证券的要约。
| 初步招股说明书 | 有待完成 | 日期:2024年1月19日 |
最多可持有300万股普通股 股
最多 300,000,000份预筹资金认股权证,购买最多3,000,000股普通股

Azitra, Inc.
本次 为阿齐特拉公司3,000,000股普通股的正式公开发行,每股票面价值0.0001美元。最终的公开发行价格将由我们与此次发行的主承销商协商确定,本招股说明书中使用的最近市场价格可能不代表最终发行价格。
我们 还提供预资金权证或预资资权证,以购买3,000,000股我们的普通股给那些在此次发售中购买普通股的购买者 ,否则将导致购买者及其关联公司和某些关联方在本次发售完成后立即实益拥有我们普通股流通股的4.99%以上(或在购买者选择时,为9.99%),以取代普通股,否则将导致该购买者的实益所有权超过4.99%(或,在购买者的选择下,9.99%)我们已发行的普通股。每份预出资认股权证的收购价将等于本次发行中出售的普通股每股公开发行价减去每股预出资认股权证普通股的行使价0.001美元。预先出资的权证可立即行使,并可随时行使,直至所有预先出资的认股权证全部行使为止。 对于我们出售的每一只预先出资的认股权证,我们提供的普通股数量将一对一地减少 。
我们的普通股在纽约证券交易所美国交易所挂牌上市,代码为“AZTR”。2024年1月18日,我们普通股的收盘价为2.05美元。目前,发行的预融资权证还没有成熟的交易市场,我们预计不会有一个成熟的交易市场。 如果没有活跃的交易市场,预融资权证的流动性将受到限制。
根据美国联邦证券法,我们 是一家“新兴成长型公司”,并已选择遵守某些降低的上市公司报告要求。
投资我们的普通股涉及很高的风险。见标题为“”的部分风险因素从第 11页开始。美国证券交易委员会、美国证券交易委员会和任何国家证券委员会都没有批准或不批准这些证券,也没有确定本招股说明书是否属实或完整。任何相反的陈述都是刑事犯罪。
| 每股 | 每一份预先出资的认股权证 | 总计 | ||||||||||
| 公开发行价 | $ | $ | $ | |||||||||
| 承保折扣和佣金(1) | $ | $ | $ | |||||||||
| 扣除费用前的收益给我们 | $ | $ | $ | |||||||||
| (1) | 承销折扣和佣金不包括相当于向承销商支付的公开发行价的1% 的非负责任费用津贴。有关承销商赔偿的其他信息,请参阅第107页开始的“承保” 。 |
我们 已授予承销商代表45天的选择权,以购买最多450,000股额外普通股 普通股(和/或预先出资的认股权证,购买最多450,000股普通股作为替代),仅用于支付 超额配售(如果有)。
承销商预计在2024年左右将股票交付给买家。
ThinkEquity
本招股说明书的 日期为 ,2024年。

目录表
| 页 | |
| 行业和市场数据 | i |
| 招股说明书 摘要 | 1 |
| 产品 | 7 |
| 风险因素摘要 | 9 |
| 汇总 财务数据 | 10 |
| 风险因素 | 11 |
| 有关前瞻性陈述的警示性说明 | 36 |
| 商标、服务标志和商号 | 37 |
| 使用收益的 | 38 |
| 分红政策 | 39 |
| 大写 | 40 |
| 稀释 | 41 |
| 管理层对财务状况和经营结果的讨论和分析 | 42 |
| 生意场 | 51 |
| 管理 | 89 |
| 主要股东 | 96 |
| 证券说明 | 97 |
| 有资格在未来出售的股票 | 102 |
| 材料:美国联邦所得税对非美国持有者的影响 | 103 |
| 承销 | 107 |
| 法律事务 | 115 |
| 专家 | 115 |
| 此处 您可以找到详细信息 | 115 |
| 财务报表索引 | 116 |
您 应仅依赖此招股说明书中包含的信息。我们没有授权任何其他人向您提供与本招股说明书中包含的信息不同或不同于本招股说明书中包含的信息,我们对其他人可能 向您提供的任何其他信息不承担任何责任。如果有人向你提供了不同或不一致的信息,你不应该依赖它。我们不会在任何不允许要约或销售的司法管辖区 出售这些证券。您应假定本招股说明书中显示的信息仅在本招股说明书封面上的日期是准确的。自该日期以来,我们的业务、财务状况、 运营结果和前景可能发生了变化。
美国以外的任何司法管辖区均未 采取任何行动,允许公开发行我们的普通股或财产,或 在该司法管辖区分发本招股说明书。在美国以外的司法管辖区拥有本招股说明书的人必须告知自己,并遵守适用于该司法管辖区的有关此次发行和分发本招股说明书的任何限制。
如本招股说明书中所用,除非上下文表明或另有要求,否则“本公司”、“本公司”和“本公司”是指特拉华州的Azitra,Inc.。
行业和市场数据
本招股说明书,特别是“业务”部分,包含基于独立行业、政府和非政府组织出版物或其他公开信息的观察、统计数据、估计和预测,以及基于我们内部来源的其他信息。尽管我们相信本招股说明书中提及的第三方消息来源是可靠的,但与预测相关的估计涉及许多假设,受风险和不确定性的影响,并可能因各种因素而发生变化,包括在标题为“风险因素以及本招股说明书中的其他 。这些因素和其他因素可能会导致结果与独立各方和我们在估计中所表达的结果大不相同。
| i |
本招股说明书正文中的某些信息包含在独立行业的政府和非政府组织出版物中。 这些出版物的来源如下:
| ● | Stacy 和Belkaid研究阿波罗·斯泰西和亚斯明贝尔凯德,皮肤健康的微生物卫士。科学,2019年1月18日;第363(6424):227-228。 DOI:10.1126/cience.aat4326。PMID:30655428 | |
| ● | 哦 研究,周伟,Spoto M,Hardy R,Guan C,Fleming E,Larson PJ,Brown JS,oh J.宿主特有的进化和传播动力学 塑造了人体皮肤表皮葡萄球菌的功能多样性。牢房。2020年2月6日;180(3):454-470.e18。DOI:10.1016/j.cell。2020.01.006.epub 2020 1月30日。PMID:32004459;PMCID | |
| ● | 研究,Satoh TK,Mellett M,Meier-Schiesser B,Fenini G,Otsuka A,Beer HD,Rordorf T,Maul JT,Hafner J,Navarini AA,Contassot E,France LE。IL-36γ可通过抑制表皮生长因子受体/酪氨酸氨基转移酶抑制和痤疮皮肤杆菌的共生而引起皮肤毒性。J Clin Invest。 2020年3月2日;130(3):1417-1430。DOI:10.1172/JCI128678。PMID:31805013;PMC7269569 | |
| ● | Barbati研究,Netherton综合征在儿童中的管理和未来前景,Federica Barbati,Mattia Giovannini Teresa Orange,Lorenzo Lodi,Simona Barni,Elio Novembre,Ermanno Baldo,Mario Cristofolini,Stefano Stagi,Silvia Ricci,Francesca Mori,Cesare Filippeschi,Chiara Azzari和Giuseppe Indol,2021年5月儿科前沿 | |
| ● | 研究,Netherton综合征:病例报告和文献回顾,Joannie D.Sun,医学博士和Kenneth G.Linden,博士,医学博士,国际皮肤病杂志2006 | |
| ● | 孤儿网,Netherton综合征,孤岛:Netherton综合征 |
| II |
招股说明书 摘要
此 摘要重点介绍了本招股说明书中其他地方出现的某些信息。投资我们的普通股涉及高度的风险。由于它只是一个摘要,并不包含您在投资我们的普通股之前应考虑的所有信息 ,因此它的全部内容符合且应与本招股说明书中其他地方的更详细信息一起阅读 。在您决定投资我们的普通股之前,您应该仔细阅读整个招股说明书,包括从第11页开始的“风险 因素”以及本招股说明书中包含的财务报表和相关说明。
2023年5月17日,我们以7.1比1的比率进行了远期股票拆分。本招股说明书中的所有股份和股价信息已进行调整 ,以实施远期股票拆分。
我们 公司
我们 是一家早期临床生物制药公司,专注于使用工程 蛋白质和局部活性生物治疗产品开发精准皮肤病的创新疗法。我们已经建立了一个专利平台,其中包括一个微生物文库,该文库由大约1,500个独特的细菌菌株组成,可以筛选出独特的治疗特征。该平台得到了 人工智能和机器学习技术的增强,该技术可以分析、预测和帮助筛选我们的菌株库中类似药物的 分子。该平台还利用了一项获得许可的基因工程技术,可以转化以前在基因上难以处理的菌株。我们最初的重点是开发基因工程菌株。表皮葡萄球菌,或称表皮葡萄球菌,我们认为它是皮肤病治疗工程的最佳治疗候选物种。这种特殊的 物种在皮肤中展示了许多被很好描述的特性。截至本招股说明书发布之日,我们已在我们的 微生物库中确定了60多种不同的细菌,我们相信它们能够被改造成具有显著治疗效果的活生物体或工程蛋白质。
我们是基因工程细菌用于皮肤病治疗的先驱。我们的目标是利用我们的平台和内部微生物库细菌菌株来创造新的疗法,这些疗法要么是工程生物,要么是工程蛋白质或多肽,用于治疗皮肤病。我们最初的重点是开发我们目前的候选产品,包括:
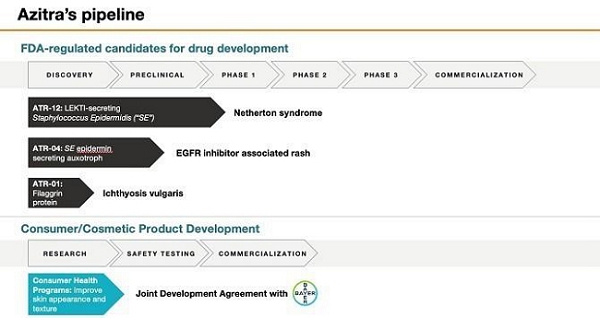
| ● | ATR-12, 一个转基因菌株表皮葡萄球菌对于治疗孤儿疾病Netherton综合征,这是一种慢性、有时是致命的皮肤疾病,估计每100,000人中约有1至9人受到影响,但由于与其他皮肤病相似而导致误诊,其发病率可能被低估了 。我们在2019年获得了美国食品和药物管理局(FDA)对ATR-12的儿科罕见疾病称号。2022年12月,我们提交了ATR-12在Netherton综合征患者中进行1b期临床试验的研究新药申请 或IND,2023年1月27日,我们收到FDA的通知 ,关于拟议的1b期临床试验,该研究可能会继续进行。我们于2023年12月开始了1b期临床试验,预计将在2024年下半年报告初步安全性结果。 | |
| ● | ATR-04, 一株转基因菌株表皮葡萄球菌用于治疗接受表皮生长因子受体抑制剂或EGFRi靶向治疗的癌症患者出现的丘疹丘疹。我们打算在2024年上半年之前将IND提交给正在接受EGFRi靶向治疗的某些癌症患者进行1b期临床试验。根据FDA对我们IND的批准,我们预计 将于2024年下半年开始我们的1b期临床试验。 | |
| ● | ATR-01, 一种用于治疗寻常型鱼鳞病的工程重组人微丝蛋白,这是一种慢性、干燥性(异常干燥)、鳞状皮肤 疾病,估计发病率和患病率为1/250,这表明美国的总患者人数为130万。我们计划在2024年完成销售线索优化和IND支持研究,以支持在2025年年中实现IND申报目标。 |
| 1 |
| ● | 我们和拜耳股份公司(Bayer AG)的消费品部门拜耳消费者关怀股份公司(Bayer Consumer Care AG)或国际生命科学公司拜耳(Bayer)根据联合开发协议(JDA)于2019年12月签订了 协议,目前正在研究和开发两种不同的细菌微生物菌株。根据JDA的条款,我们负责测试我们的细菌库 及其天然产品的关键临床前特性。在对数百个菌株进行筛选后,我们和拜耳选择了两个特定的菌株进行进一步开发。拜耳拥有授予这些菌株专利权的独家选择权。2020年12月,拜耳购买了800万美元的B系列优先股,这些优先股转换为我们普通股的1,449,743股 ,约占我们普通股流通股的12.0%。 |
我们 还与卡内基梅隆大学和弗雷德·哈钦森癌症中心或弗雷德·哈奇的团队建立了合作伙伴关系,这两个中心是美国两个主要的学术中心。我们与卡内基梅隆大学团队的合作利用了全基因组测序的力量。这一合作伙伴关系正在挖掘我们专有的细菌菌株库,以寻找新的类似药物的多肽和蛋白质。该团队开发的人工智能/机器学习技术根据微生物的基因序列预测微生物制造的分子。然后,该系统将预测结果与通过串联质谱学和/或核磁共振成像实际做出的产品进行比较,以完善未来的预测。这些预测可以与公开可用的2D和3D蛋白质数据库进行比较,以选择类似药物的结构。
我们 持有Fred Hutch的全球独家许可,允许其将其获得专利的SyngenicDNA微型环质粒或SyMPL技术用于基因工程的所有领域,包括发现、开发和商业化用于皮肤病的工程化微生物疗法和微生物衍生的多肽和蛋白质。我们正在利用我们许可的专利权来构建质粒,以进行以前从未实现过的基因转化 。我们与Fred Hutch的合作由微生物工程专家Christopher Johnston博士领导,他也是SyMPL技术的创新者。
拜耳 合作伙伴
2019年12月,我们与拜耳签订了联合开发协议(JDA),根据该协议,我们同意联合开发从我们的专有微生物文库中挑选出来的某些菌株。我们和拜耳已经同意在身份识别和在试管中和离体用于局部制剂的微生物菌株的表征,我们打算将其开发为潜在的非处方化妆品。拜耳在执行JDA时向我们支付了一次性付款,并同意偿还我们的 开发成本。2021年10月,拜耳扩大了期权协议,并向我们支付了额外表征工作的第二笔费用。 我们已授予拜耳一项选择权,可为JDA项下的开发活动 中的最多六种菌株获得独家使用费许可,包括任何相关专利权的独家使用费许可。拜耳有权选择在我们向拜耳交付JDA开发活动成果后的六个月内获得独家 许可权。在筛选 数百种菌株后,我们和拜耳选择了两种特定菌株进行体外和离体表征。
| 2 |
2020年9月,拜耳的风险投资集团Leaps by Bayer购买了800万美元的B系列优先股,将 转换为1,449,743股我们的普通股,约占我们普通股流通股的12.0%。
我们的 战略
除了我们的三个主要候选产品和与拜耳的合作之外,我们的目标是开发广泛的候选产品组合, 专注于扩展我们的精确皮肤病平台的应用。我们相信,我们已经在推动精准皮肤病生物制剂的开发方面确立了独特的地位。
我们 打算通过开发从我们的专利微生物库中挑选的约1,500种独特细菌菌株中挑选出来的基因工程 蛋白质,为精密皮肤病创造广泛的候选产品组合。我们的策略如下:
| ● | 打造可持续发展的精准皮肤科公司。我们的目标是打造一家领先的精准皮肤病公司,拥有可持续的候选产品流水线。为此,我们专注于快速推进我们目前的生物治疗候选活体管道,同时积极开发更多的候选产品。我们目前的每一款候选产品都是专有产品,都需要申请专利。我们预计,我们开发的大多数候选基因工程产品将有资格获得专利保护。 | |
| ● | 使我们的主要候选产品ATR-12和ATR-04通过临床试验。我们预计将在2024年下半年报告我们的ATR-12在Netherton综合征患者中的1b期临床试验的初步安全性结果,目前 计划在2024年下半年开始我们的ATR-04在某些接受EGFRi治疗的癌症患者中的1b期试验。 我们已经批准了ATR-12的IND,预计将在2024年上半年提交ATR-04的IND。 | |
| ● | 通过有选择地探索战略合作伙伴关系,最大限度地发挥我们精准皮肤病项目的潜力,从而拓宽我们的平台。 我们打算保留对我们所有核心技术和候选产品的重要权利。但是,我们将继续评估 战略合作伙伴可以帮助我们加快技术和候选产品开发的合作机会, 提供协同组合的途径,或提供专业知识,使我们能够扩展到不同类型皮肤病的治疗 。我们还可以通过有选择地授权技术或候选产品来扩大我们平台的覆盖范围。此外,我们还将考虑将我们的某些专有技术授权给那些我们没有追求的适应症和行业。我们相信,我们的基因工程技术和技术在医学领域之外具有适用性,包括化妆品以及清洁燃料和生物修复的产生。 | |
| ● | 利用我们的学术合作伙伴关系。我们目前与弗雷德·哈钦森癌症中心、耶鲁大学、杰克逊基因组医学实验室和卡内基梅隆大学的研究人员建立了合作伙伴关系。我们希望利用这些合作伙伴关系,并可能 扩大它们或形成其他学术合作伙伴关系,以支持我们的工程平台并扩大我们的研发渠道。 | |
| ● | 扩展 我们的其他潜在候选产品。除了我们的三个主要候选产品外,我们的目标是开发广泛的候选产品组合 ,专注于扩大我们的平台在精确皮肤病方面的应用。我们拥有专有平台 ,用于发现和开发精准皮肤病治疗产品。我们的平台围绕由大约1,500个独特细菌菌株组成的微生物文库构建,以筛选独特的治疗特征,并利用微生物 基因技术分析、预测和设计皮肤微生物产生的蛋白质、多肽和分子。我们对难处理的微生物物种进行基因工程的能力通过我们对SyMPL技术的独家许可得到了独特的利用。 |
| 3 |
我们的 知识产权
截至本招股说明书发布之日,我们拥有或独家许可了3项已颁发的美国专利、12项待决的美国专利申请、3项待决的PCT申请以及59项对我们的业务发展至关重要的其他外国专利和专利申请。
我们的 领导团队
我们 由我们的首席执行官Francisco D.Salva和我们的联合创始人兼首席运营官Travis Whitill领导,他们在生物技术公司的管理和医疗保健投资方面拥有超过35年的经验。萨尔瓦之前是Acerta Pharma的联合创始人,该公司在2016年的一次阶段性收购中以约63亿美元的价格出售给了阿斯利康。他还致力于Pharmacclics的扭亏为盈,随后在2015年以约210亿美元的价格出售给Abbvie。在此之前,萨尔瓦先生在生命科学风险投资领域工作了近十年。惠特菲尔先生是耶鲁大学的副教授兼兼职教授,在儿科和急诊医学系任职。作为一家专注于生物技术的风险投资基金Bios Partners的合伙人,他在风险投资领域度过了近十年的时间。他领导了许多赠款资助的项目,拥有近12项专利,并与人合著了60多份出版物。我们的董事会由生物技术行业的高级管理人员、科学家和投资者组成。
我们的竞争优势
我们是基因工程细菌用于皮肤病临床试验的先驱。我们已经建立了一个专有平台 ,其中包括一个微生物文库,该文库由大约1,500个独特的细菌菌株组成,这些菌株被筛选出治疗特性 以及候选主药。此外,我们还独家授权了一项新技术,该技术可能会使以前难以处理的细菌微生物进行遗传转化。生物技术中重组蛋白质工程的历史传统上被限制在20个物种以下。我们获得许可的技术使我们有可能对数千种微生物进行基因工程 来制造以前从未制造过的蛋白质和多肽。我们的管理团队在发现、开发、制造和商业化治疗药物方面拥有丰富的经验。我们领导团队的成员拥有由多家公司开发的专业知识,包括Pharmacclics、Acerta Pharma、Castle Creek Biosciences、Vyne Treateutics(FKA Menlo Treateutics)、Revance Treateutics、Biogen、Novartis和Connetics Corp.。
我们的 市场机会
我们 相信,在我们的每个潜在市场中都有大量的市场机会需要抓住。皮肤科市场本身在过去十年中显示出相当大的增长,预计还将继续增长。根据Vision Research的报告,皮肤科药物市场在2021年超过170亿美元,预计到2030年将以8.8%的复合年增长率增长。我们从我们的平台上推出的第一个候选产品 专注于Netherton综合征的孤儿适应症。根据Barbati和Sun的研究,我们 相信,到2030年年中,这款候选产品代表着2.5亿美元的潜在全球销售机会。我们的第二个候选产品 专注于由EGFR抑制剂引起的丘疹。我们相信,这款候选产品代表着到2030年全球销售额达10亿美元的潜在商机。我们打算针对的疾病有很好的特点,通常是单基因基因突变。此外,基因组测序时代在基因检测方面迎来了前所未有的进步。现在已经定义了100多种罕见皮肤病的分子病理生理学。
我们的 公司信息
我们 于2014年1月2日根据特拉华州法律注册成立。我们的主要执行办公室位于康涅狄格州布兰福德公园大道21 Business,邮编:06405,我们的电话号码是(203)646-6446。我们的网站地址是www.azitrainc.com。本招股说明书中包含或可通过本招股说明书访问的信息 未通过引用并入本招股说明书,您不应将本招股说明书中包含或可通过本网站访问的任何 信息作为本招股说明书的一部分或在决定是否购买 我们的普通股或预先出资的认股权证时考虑。
| 4 |
我们拥有美国和外国的注册商标,包括我们的公司名称。本招股说明书中提及的所有其他商标或商品名称 均为其各自所有者的财产。仅为方便起见,本招股说明书中的商标和商品名称均不使用符号®和™,但此类引用不应被解释为它们各自的所有者不会根据适用法律在最大程度上主张其权利的任何迹象。
我们可转换证券的私募
在我们2023年6月首次公开发行(IPO)之前,我们通过一系列私募我们的可转换优先股和可转换本票 将我们的业务资本化,总收益为3,900万美元,所有这些都在IPO完成后转换为我们的普通股总数8,951,526股。
首次公开募股
2023年6月,该公司完成首次公开募股,以每股5.00美元的价格向公众发行和出售1,500,000股普通股。该股于2023年6月16日在纽约证券交易所美国交易所开始交易,代码为“AZTR”。扣除承销折扣、佣金和其他发售费用后,本公司从是次发售中收到的净收益为650万美元。
更改我们的大写字母
2023年5月17日,我们修改并重述了我们的公司注册证书,以(I)将我们的法定普通股从1,950,000股 增加到100,000,000股,(Ii)我们的股本面值从0.10美元更改为0.0001美元,(Iii)我们的公司名称从“Azitra Inc.”更改为“Azitra,Inc.”。以及(Iv)对我们的已发行普通股进行7.1比1的远期股票拆分,或股票 拆分。
除本招股说明书另有注明外,本招股说明书内的所有股份及股价资料均已作出调整,以实施股票分拆。
作为一家新兴成长型公司的影响
JumpStart Our Business Startups Act(JumpStart Our Business Startups Act)或JOBS法案于2012年4月颁布,目的是鼓励在美国形成资本,并减轻符合“新兴成长型公司”资格的新上市公司的监管负担。 我们是JOBS法案所指的新兴成长型公司。作为一家新兴成长型公司,我们可能会利用某些豁免,使其不受各种公开报告要求的限制,包括:
| ● | 根据2002年《萨班斯-奥克斯利法案》第404条,要求我们对财务报告的内部控制由我们的独立注册会计师事务所 证明; | |
| ● | 与本招股说明书以及我们的定期报告和委托书中的高管薪酬披露有关的某些要求; | |
| ● | 要求我们对高管薪酬和任何金降落伞薪酬进行不具约束力的咨询投票;以及 | |
| ● | 能够推迟遵守新的或修订的财务会计准则,直到要求私营公司遵守新的或修订的财务会计准则。 |
我们 可以利用上面讨论的《就业法案》下的豁免,直到我们不再是一家新兴成长型公司。我们将保持 一家新兴成长型公司,直至(1)本财年的最后一天,我们的年收入为12.35亿美元或更多;(2)我们符合“大型加速申报公司”资格的日期,非关联公司持有至少7亿美元的股权证券;(3)在任何三年期间,我们发行了超过10亿美元的不可转换债券 ;或(4)在IPO五周年之后结束的财年的最后一天。
| 5 |
我们 可以选择利用《就业法案》下的部分(但不是全部)福利。我们已选择利用 上面讨论的所有其他豁免。因此,本文以及我们随后提交给美国证券交易委员会的文件中包含的信息可能与您从您持有股票的其他上市公司收到的信息不同。
有关与我们作为一家新兴成长型公司的地位相关的某些风险,请参阅本招股说明书中“风险 因素-与此次发行和持有我们普通股相关的风险--根据《就业法案》,我们是一家‘新兴成长型公司’,我们不能确定,降低适用于新兴成长型公司的披露要求是否会降低我们的普通股对投资者的吸引力。.”
作为一家较小的报告公司的影响
此外, 我们是S-K法规第10(F)(1)条所界定的“较小的报告公司”。较小的报告公司可能会利用某些减少的披露义务,其中包括仅提供两年的经审计财务报表。 我们仍将是一家较小的报告公司,直到本财年的最后一天:(1)截至该财年第二财季末,非关联公司持有的我们普通股的市值等于或超过2.5亿美元,或(2)在该已完成的财政年度内,我们的年收入 等于或超过1亿美元,且截至该财年第二财季结束时,非附属公司持有的我们普通股的市值等于或超过7亿美元。
| 6 |
产品
| 发行人 | Azitra, Inc. |
| 提供普通股 | 300万股 |
| 已发行预筹资权证 | 我们 还向某些购买者提供预先出资的 认股权证,以代替我们普通股的股份,购买我们普通股的3,000,000股,否则将导致该购买者的实益所有权超过4.99%(或者,在购买者选择时,我们普通股流通股的9.99%)。每一份预付资金认股权证将可行使 一股我们的普通股。本次发行还涉及在行使本次发行中出售的任何预先出资的认股权证后可发行的普通股。对于我们出售的每个预先出资的认股权证,我们提供的普通股数量将在一对一的基础上减少 。
每份预资金权证的收购价将等于本次发行中向公众出售的普通股每股价格减去0.001美元,而每份预资金权证的行使价将为每股0.001美元。
预付资金认股权证将可立即行使,并可随时行使,直至所有预付资金认股权证全部行使为止。若要更好地了解预融资认股权证的条款, 您应仔细阅读本招股说明书的“证券-预融资认股权证说明”部分。您还应 阅读预先出资认股权证表格,该表格作为注册说明书的证物存档,本招股说明书是其中的一部分。 |
| 本次发行后将发行普通股 | 15,097,643股(或15,547,643股,如果承销商购买额外股份的选择权已全部行使)普通股, 在每种情况下,假设我们提供的预资金权证不会出售,在出售预资金权证的程度上,将减少我们以一对一的基础提供的普通股数量。 |
| 超额配售 选项 | 我们 已授予承销商从本招股说明书发布之日起45天的选择权,可全部或部分行使一次或多次, 可额外购买最多450,000股普通股和/或额外450,000股预资金权证(占我们将在发售中提供的普通股和/或预资金权证总数的15%),仅用于超额配售, 如果有超额配售的话。 |
| 使用收益的 | 我们 估计,我们在此次发行中出售普通股将获得约510万美元的净收益,或 如果承销商全面行使其超额配售选择权,将获得约600万美元的净收益,假设公开发行 价格为每股2.05美元,这是我们普通股在纽约证券交易所于2024年1月18日最后公布的销售价格。 我们打算将此次发行的净收益与我们现有的现金和现金等价物一起用于临床试验和 产品开发、研发。临床制造以及营运资金和其他一般企业用途 。见标题为“”的部分收益的使用“在本招股说明书中,了解有关此产品中加工的预期用途的更完整说明。 |
| 交易 市场和代码 | 我们的
普通股在纽约证券交易所美国证券交易所挂牌上市,代码为“AZTR”。
我们不打算在纽约证券交易所美国证券交易所或任何其他国家证券交易所或国家认可的交易系统上上市预融资权证。如果没有活跃的交易市场,预融资权证的流动性将受到限制。 |
| 风险因素 | 投资我们的普通股涉及很高的风险。见标题为“”的部分风险因素从第11页和本招股说明书中的其他信息开始,讨论您在决定投资我们的普通股之前应仔细考虑的因素。 |
| 锁定 | 除某些例外情况外,我们 同意在本招股说明书发布之日起九十(90)天内,在未经代表事先书面同意的情况下,不得出售、要约、同意出售、合同出售、质押、质押、授予任何选择权,以直接或间接购买、卖空或以其他方式处置或对冲我们股本的任何股份,或 可转换为、可行使或可交换为股本股份的任何证券。关于我们的首次公开募股,我们的高级管理人员和董事同意,在未经代表事先书面同意的情况下,在2024年6月15日之前,不出售、要约、同意出售、合同出售、抵押、质押、授予任何购买选择权、进行任何卖空、或以其他方式处置或对冲我们股本的任何股份或任何可转换为、可行使或可交换的证券,直至2024年6月15日。见本招股说明书第 节,标题为承销“以获取更多信息。 |
| 7 |
本次发行后的已发行普通股数量以截至2024年1月12日的已发行普通股12,097,643股为基础 ,不包括:
| ● | 根据我们的2016股票激励计划或2016计划以及我们的2023股票激励计划或2023计划授予的1,288,255股我们的普通股可在行使已发行期权时发行,加权平均行权价为每股1.36美元; | |
| ● | 约323,736股我们的普通股可在行使已发行认股权证时发行,加权平均行权价为每股4.75美元; | |
| ● | 根据承销商的超额配售选择权,最多可发行450,000股我们的普通股(和/或购买最多450,000股我们的普通股的预筹资金认股权证 ); | |
| ● | 12,000股可在行使认股权证时发行,作为与此次发行相关的补偿的一部分 (如果全部行使超额配售选择权,最多138,000股),行使价为每股2.56美元(本次发行中出售的普通股每股假定公开发行价的125% );以及 | |
| ● | 242,345股我们的普通股为2016年计划下的未来赠款预留,1,960,000股我们的普通股为我们2023年计划下的未来 赠款预留。 |
除非我们另有说明或上下文另有要求,否则本招股说明书中的所有信息均假定如下:
| ● | 未行使上述未清偿认股权证或期权; | |
| ● | 不行使预付资金认股权证;以及 | |
| ● | 不行使承销商的超额配售选择权。 |
| 8 |
总结 风险因素
我们的业务面临许多风险,包括可能阻碍我们实现业务目标或对我们的业务、运营结果、现金流和前景产生不利影响的风险。您应仔细考虑下面讨论的风险,并在本节中进一步讨论 “风险因素“紧随本招股说明书摘要之后,再投资于我们的普通股或预筹资权证。
| ● | 我们 是一家早期临床生物制药公司,运营历史有限; | |
| ● | 我们 有重大运营亏损的历史,预计在可预见的未来将继续出现运营亏损; | |
| ● | 我们 预计我们将需要额外的资金来执行我们的业务计划和为运营提供资金,而这些额外的资金可能无法以合理的条款获得,或者根本无法获得; | |
| ● | 我们的微生物文库和基因工程平台的临床和商业用途是不确定的,而且可能永远不会实现; | |
| ● | 我们的候选产品处于早期开发阶段,因此将需要广泛的临床前和临床 测试; | |
| ● | 我们 将需要扩大我们组织的规模,我们在管理这种增长时可能会遇到困难; | |
| ● | 我们 目前没有销售和营销组织; | |
| ● | 我们 在可预见的未来将完全依赖第三方生产我们的候选产品用于商业销售; | |
| ● | 我们的业务模式包括可能将我们专有微生物文库或我们的候选产品的菌株外包给其他制药公司;然而,制药行业的技术许可是一个漫长的过程,并受到 我们无法控制的几个风险和因素的影响; | |
| ● | 我们的业务可能会受到关键人员流失的影响; | |
| ● | 如果对我们提起产品责任诉讼,我们可能会承担重大责任,并可能被要求限制我们候选产品的商业化 ; | |
| ● | 如果信息技术系统出现故障或安全漏洞,我们的业务运营可能会受到影响; | |
| ● | 我们面临着来自其他生物技术和制药公司针对医用皮肤病适应症的激烈竞争; | |
| ● | 我们的成功完全取决于我们是否有能力获得FDA和外国司法管辖区监管机构对我们候选产品的上市批准,我们打算在这些司法管辖区销售我们的候选产品,这一点无法得到保证; | |
| ● | 我们的 临床试验可能无法证明我们的候选产品或任何未来候选产品的安全性和有效性的实质性证据。 | |
| ● | 我们候选产品的临床前研究的结果可能无法预测未来的临床前研究或临床试验的结果; | |
| ● | 即使 如果我们的任何候选产品获得监管部门的批准,我们也可能无法成功地将该产品商业化 ,我们从其销售中获得的收入(如果有的话)可能是有限的; | |
| ● | 当前和未来的立法可能会增加我们获得候选产品上市批准并将其商业化的难度和成本 并影响我们可能获得的价格; | |
| ● | 保护我们的知识产权难度大,成本高,我们无法确保这些权利的保护; | |
| ● | 我们的 候选产品可能会侵犯他人的知识产权,这可能会增加我们的成本,延迟或阻碍我们的 开发和商业化努力; | |
| ● | 活跃、流动、有序的股票交易市场可能无法发展; | |
| ● | 未来增资可能会稀释您的所有权,并对我们的运营产生其他不利影响; | |
| ● | 我们股票的市场价格可能会受到波动和波动的影响; | |
| ● | 如果我们未能保持有效的财务报告内部控制制度,我们可能无法准确报告我们的财务业绩或防止舞弊; | |
| ● | 没有预先融资的权证市场,而且有一只权证预计不会发展; | |
| ● | 在本次发行中购买的预融资权证的持有者在行使认股权证并收购我们的普通股之前,将不享有普通股股东的权利; | |
| ● | 我们 根据《特拉华州一般公司法》(DGCL)第204条批准了某些公司行为;但是,不能保证不会对批准或相关公司行为的有效性提出质疑;以及 | |
| ● | 我们的章程文件和特拉华州法律可能会阻止股东认为有利的收购。 |
| 9 |
汇总 财务数据
以下表格汇总了我们的财务数据。您应该阅读此摘要财务数据以及标题为“管理层对财务状况和经营结果的讨论和分析以及我们的财务报表和相关说明, 包含在本招股说明书的其他部分。截至2022年和2021年12月31日的财政年度和截至2021年12月31日的财政年度的财务信息来自本招股说明书中其他部分包括的经审计的财务报表。截至2023年9月30日和2022年9月30日的9个月的财务信息来自本招股说明书中其他部分包含的未经审计的财务报表。未经审计的财务报表是按照与已审计财务报表相同的基础编制的。我们的管理层认为, 未经审计的财务报表反映了公平列报该等期间的财务状况和经营业绩所需的所有调整。我们的历史结果并不一定预示着未来可能取得的结果。
截至9个月 个月 9月30日 | 截至12月31日的年度 , | |||||||||||||||
| (单位为 千,不包括份额) | 2023 | 2022 | 2022 | 2021 | ||||||||||||
| 运营报表数据 | (未经审计) | (未经审计) | ||||||||||||||
| 收入 | $ | 596 | $ | 254 | $ | 284 | $ | 110 | ||||||||
| 净亏损 | $ | (8,830 | ) | $ | (6,634 | ) | $ | (10,680 | ) | $ | (8,940 | ) | ||||
| 每股基本和稀释后净亏损 | $ | (1.97 | ) | (8.25 | ) | $ | (12.74 | ) | $ | (11.20 | ) | |||||
| 2023年9月30日 | ||||||||
| (单位:千) | 实际 | 已调整为 (1) | ||||||
| 资产负债表数据: | (未经审计) | (未经审计) | ||||||
| 现金和现金等价物 | $ | 4,400 | $ | 9,527 | ||||
| 营运资本 | $ | 3,410 | $ | 8,537 | ||||
| 总资产 | $ | 7,490 | $ | 12,617 | ||||
| 额外实收资本 | $ | 51,475 | $ | 56,601 | ||||
| 股东权益总额 | $ | 5,332 | $ | 10,459 | ||||
| (1) | 调整后的 栏使本招股说明书提供的3,000,000股普通股 (和/或预先出资的认股权证,以购买最多3,000,000股我们的普通股作为替代)生效假设公开发行价为每股2.05美元,我们普通股在纽约证券交易所的最后一次报告销售价格是2024年1月18日,扣除承销折扣和佣金以及我们应支付的估计发行成本后的价格。 |
| 10 |
风险因素
对我们普通股的任何投资都有很高的风险。在您决定投资我们的普通股之前,您应仔细考虑下面描述的风险,我们认为 这些风险代表了我们业务的某些重大风险,以及本招股说明书中其他地方包含的信息。请注意,此处强调的风险并不是我们可能面临的唯一风险。 例如,我们目前未知的、我们目前认为不重要或不太可能发生的其他风险也可能影响我们的运营 。如果发生以下任何事件或实际发生我们目前未知的任何其他风险,我们的业务、财务状况和经营业绩可能会受到重大不利影响。在这种情况下,我们普通股的交易价格可能会下跌 ,您可能会损失全部或部分投资。
与我们的业务相关的风险
我们是一家处于早期阶段的临床生物制药公司,运营历史有限.
我们 是一家成立于2014年1月2日的早期临床生物制药公司,运营历史有限。除了有限的赠款和服务收入外,我们尚未 开始创收业务。到目前为止,我们的业务包括开发我们的专有微生物文库,鉴定、表征、基因工程和某些细菌种类的测试 以提供治疗效果,以及我们最初的候选产品的开发。我们有限的运营历史使潜在投资者很难评估我们的技术或未来的运营。作为一家早期临床生物制药公司,我们 面临与新业务相关的组织、融资、支出、并发症和延误所固有的所有风险。因此,您应该根据 公司在发展早期经常遇到的成本、不确定性、延误和困难来考虑我们的前景,特别是像我们这样的早期临床生物制药公司。潜在投资者应仔细考虑一家经营历史有限的公司将面临的风险和不确定性。尤其是, 潜在投资者应考虑到我们可能无法:
| ● | 成功 实施或执行我们的业务计划,或我们的业务计划是健全的; | |
| ● | 成功 完成临床前和临床试验,并获得监管部门对我们候选产品的营销批准; | |
| ● | 成功地 展示了我们的精准皮肤病候选产品与市场上现有产品之间的良好差异化; | |
| ● | 成功签约生产我们的临床药物产品,并建立商业药品供应; | |
| ● | 确保我们的候选产品获得市场排他性或足够的知识产权保护; | |
| ● | 吸引并保留一支经验丰富的管理和咨询团队;以及 | |
| ● | 在资本市场筹集足够的资金,以实现我们的业务计划,包括产品和临床开发、监管批准 和我们的候选产品商业化。 |
投资者 应根据发展中公司在竞争环境中遇到的不确定性来评估对我们的投资。 不能保证我们的努力会成功,也不能保证我们最终能够实现盈利。如果我们不能成功 执行上述任何一项,我们的业务可能不会成功,您的投资将受到不利影响。您必须准备好 失去所有投资。
我们 有重大运营亏损的历史,并预计在可预见的未来将继续运营亏损.
在截至2022年和2021年12月31日的财年中,我们分别净亏损1070万美元和890万美元,在截至2023年9月30日和2022年9月30日的9个月中,我们分别净亏损880万美元和660万美元。截至2023年9月30日,我们的累计赤字为4610万美元。此次上市完成后,我们预计将继续产生巨额费用而没有任何有意义的 收入,除非我们能够获得监管部门的批准并成功地将我们的至少一种候选产品商业化。 我们还认为,假设我们能够获得监管部门的批准,我们至少需要四到六年的时间才能从此次发售结束起获得第一批候选药物的监管部门批准。即使我们能够将我们的候选产品 商业化,也不能保证我们会产生可观的收入或实现盈利。
| 11 |
在我们将候选产品推向商业化的过程中,我们 预计会有大量的研究、监管和开发费用。因此,在可预见的未来,我们预计会遭受重大损失,而且这些损失还会增加。我们不确定 何时或是否能够实现或保持盈利。如果我们在未来实现盈利,我们可能无法在后续时期保持 盈利。未能实现并保持盈利可能会削弱我们维持运营的能力,并对我们的业务和筹集资金的能力产生不利影响。如果我们无法在合理的时间内产生正现金流, 我们可能无法进一步执行我们的业务计划或继续运营,在这种情况下,您可能会损失全部投资。
我们独立注册会计师事务所截至2022年12月31日的年度报告 指出,由于我们累积的赤字, 运营产生的经常性现金流和负现金流,我们是否有能力继续作为一家持续经营的企业存在很大的疑问。
我们 预计我们将需要额外的资金来执行我们的业务计划和为运营提供资金,而这些额外的资金可能无法以合理的条款或根本无法获得。
截至2023年9月30日,我们的总资产为750万美元,营运资本为340万美元。我们相信,此次发行的净收益,加上截至本招股说明书之日我们手头的现金,可能不足以支付我们至少在未来12个月内拟议的运营计划 。我们打算 通过各种融资来源寻求额外资金,包括出售我们的股权、我们技术的许可费以及与行业合作伙伴的合资企业。此外,我们将考虑当前业务计划的替代方案,使我们能够以较少的资本实现创收业务和有意义的商业成功。然而,不能保证这些资金将以商业上合理的条款获得,如果有的话。如果无法以令人满意的条款获得此类融资, 我们可能无法进一步执行我们的业务计划,并且可能无法继续运营,在这种情况下,您可能会失去全部投资。
我们的微生物文库和基因工程平台的临床和商业用途是不确定的,而且可能永远不会实现。
我们 构建了一个专有平台,其中包括一个微生物文库,该文库由大约1,500个独特的细菌菌株组成,可以 筛选独特的治疗特征。该平台通过人工智能、机器学习和遗传工程技术进行了扩展。到目前为止,我们的重点是开发基因工程菌株表皮葡萄球菌,我们认为它是皮肤病治疗工程的最佳治疗候选物种。然而,我们认为,基因工程表皮葡萄球菌是一种新颖且未经证实的治疗模式。我们最近启动了ATR-12的1b期临床试验,预计将在2024年第一季度招募第一名患者,并预计在2024年上半年提交ATR-04 1b期临床试验的IND申请。然而,截至招股说明书发布之日,我们已经测试和评估了我们的专有菌株表皮葡萄球菌此外,早期临床试验的成功并不能确保大规模临床试验的成功,也不能预测最终结果。即使在我们建议的1b期临床试验完成后,我们最初的候选产品也只会在一小部分患者身上进行测试。随着我们扩展到更大的临床试验,这些临床试验的结果可能不一定表明我们的候选产品或我们的产品的安全性和耐受性或有效性。在此之前,如果我们能够向FDA提供足够的临床证据来支持安全性、有效性、纯度和效力足以使FDA批准我们的专利产品的任何适应症的声明,我们的专有微生物文库和基因工程平台将 仍未得到证实。
| 12 |
我们的候选产品处于早期临床试验或临床前开发的早期阶段,因此它们将需要广泛的临床前和临床测试。临床前研究或早期临床试验的成功可能不代表未来临床试验的结果 ,我们不能向您保证任何正在进行的、计划中的或未来的临床试验将导致足够的结果 以获得必要的监管批准。
由于我们的候选产品处于早期临床试验或临床前开发阶段,因此需要广泛的临床前和临床测试。我们最近启动了ATR-12的1b期临床试验,预计将在2024年第一季度招募第一名患者,并预计在2024年上半年提交ATR-04 1b期临床试验的IND申请。然而,我们尚未对任何其他候选产品进行 有意义的临床前研究。临床前测试和早期临床试验的成功 不能确保以后的临床试验将产生相同的结果或提供足够的数据来证明候选产品的有效性和安全性。临床前研究和1b期临床试验主要是为了测试安全性,研究药代动力学和药效学,并了解不同剂量和时间表的候选产品的副作用。1b期临床试验也测试某种疾病对新疗法的反应如何。临床前研究和早期临床试验的成功并不确保以后的疗效试验将会成功,也不能预测最终结果。我们的候选产品可能无法在临床开发中显示出所需的安全性和有效性,尽管在临床前研究中取得了积极的结果,或者即使它们成功地通过了早期的临床试验。
此外,临床试验的设计可以确定其结果是否支持产品的批准,而临床试验设计中的缺陷可能在临床试验进展良好之前不会变得明显。作为一个组织,我们在设计临床试验方面的经验有限,可能无法设计和执行临床试验来支持监管部门的批准。制药和生物技术行业的许多公司都遭遇了重大挫折,包括在临床前测试和早期临床试验取得了令人振奋的结果后,仍未能在后期临床试验中取得成功。从临床前和临床活动中获得的数据可能会受到不同的解释,这可能会推迟、限制或阻止监管部门的批准。
此外, 我们无法确定是否或何时可能为我们的任何候选产品提交生物制品许可证申请或BLA以供监管部门批准,或任何此类BLA是否会被FDA接受审查,或任何BLA是否会在 审查后获得批准。即使我们的临床试验按计划完成,我们也不能确定他们的结果是否支持我们建议的适应症。 临床前试验和早期临床试验的成功并不能确保以后的临床试验也会成功,我们也不能 确保以后的临床试验的结果将复制以前的临床试验和临床前试验的结果。临床 试验过程可能无法证明我们的候选产品对于其建议的用途是安全有效的。此失败可能会 导致我们放弃某个候选产品,并可能延迟其他候选产品的开发。我们临床试验的任何延迟或终止都将延迟并可能阻止向FDA提交任何BLAS,并最终影响我们将候选产品商业化并创造产品收入的能力。
我们 将需要扩大我们组织的规模,我们在管理这种增长时可能会遇到困难.
随着我们的开发和商业化计划和战略的发展,我们将需要扩大员工和顾问/承包商的规模 。未来的增长将使管理层成员承担更多的责任,包括需要确定、招聘、维持、激励和整合更多的员工。此外,我们的管理层可能不得不将不成比例的 注意力从我们的日常活动中转移出来,并投入大量时间来管理这些增长活动。我们未来的财务业绩、我们将我们的候选产品和任何其他候选产品商业化的能力以及我们有效竞争的能力 在一定程度上将取决于我们有效管理未来增长的能力。
| 13 |
如果我们不能成功地吸引和留住高素质的人才,我们就可能无法成功地实施我们的业务 战略。此外,失去高级管理层的服务将对我们的业务前景造成不利影响.
我们的管理团队在药物开发和商业化的许多不同方面拥有专业知识。然而,我们在竞争激烈的制药行业中的竞争能力在很大程度上取决于我们能否吸引和留住高素质的管理、科学和医疗人员。当我们进一步开发我们的候选产品时,我们将需要招聘更多的人员。我们市场对技术人员的竞争非常激烈,而对经验丰富的科学家的竞争可能会限制我们以可接受的条件聘用和留住高素质人员的能力。尽管我们努力留住有价值的员工,但我们的管理、科学和医疗团队的成员可能会在短时间内终止与我们的雇佣关系。失去任何首席执行官或其他关键员工的服务,或我们无法聘用目标高管,可能会潜在地损害我们的业务、经营业绩或财务状况。 我们尤其认为,失去首席执行官的服务将对我们的业务产生实质性的不利影响。
与我们竞争人才的其他生物制药公司比我们拥有更多的财务和其他资源,不同的风险 概况,以及更长的行业历史。它们还可以提供更多样化的机会和更好的职业晋升机会 。这些特点中的一些可能比我们所提供的更吸引高素质的应聘者。如果我们不能 继续吸引和留住高素质的人才,我们开发和商业化候选产品的速度和成功将受到限制。
我们 目前没有销售和营销组织。如果我们无法建立令人满意的销售和营销能力,或无法获得第三方销售和营销关系,我们可能无法成功地将我们的任何候选产品商业化.
目前,我们没有销售或营销人员。在我们的一个或多个药物产品初步获得必要的监管批准后,我们计划在美国建立专注于将我们的开发计划商业化的能力, 我们的开发计划侧重于用于治疗皮肤病的活性生物治疗产品和重组蛋白,我们相信,在那里,我们目标适应症的患者群体 和医学专家足够集中,使我们能够通过有针对性的销售团队有效地推广我们的产品 。在商业化可能对我们来说资本效率较低的其他市场,我们可能会有选择地寻求与第三方的战略合作,以最大限度地发挥我们候选产品的商业潜力。在某些情况下,我们 可能会寻求我们的微生物文库或专利权的许可,或者达成联合开发安排。如果我们在招聘销售和营销人员、建立销售和营销基础设施或与第三方达成适当的合作安排方面不成功 ,我们将很难成功地将我们的候选产品商业化,这将对我们的业务、运营业绩和财务状况产生不利影响。
即使我们签订了第三方营销和分销安排,我们对这些第三方的销售、营销和分销活动的控制也可能是有限的,甚至没有控制权。我们未来的收入可能在很大程度上取决于这些第三方努力的成功。 在建立销售和营销基础设施方面,我们将不得不与资金雄厚的老牌制药公司和生物技术公司竞争,以招聘、聘用、培训和留住销售和营销人员。可能阻碍我们 建立内部销售组织或与第三方达成协作安排的因素包括:
| ● | 我们无法招聘和留住足够数量的有效销售和营销人员; | |
| ● | 销售人员无法接触或说服足够数量的医生为我们的任何候选产品开具处方; | |
| ● | 销售人员缺乏配套产品,这可能使我们相对于产品线更广的公司 处于竞争劣势;以及 | |
| ● | 与创建内部销售和营销组织相关的不可预见的成本和费用。 |
| 14 |
在可预见的将来,我们 将完全依赖第三方生产我们的候选产品用于商业销售, 如果这些第三方无法获得FDA或类似的外国监管机构的生产批准、无法向我们提供足够数量的候选产品或无法以可接受的质量水平或价格进行商业化,我们候选产品的商业化可能会被暂停、推迟或利润下降.
我们 不拥有或运营用于商业生产当前候选产品的制造设施。我们目前依赖 第三方合同制造商提供我们临床前研究和临床试验所需的所有原材料、制造设备和活性药物成分 。尽管我们能够在我们的康涅狄格州格罗顿工厂为我们的临床试验 生产成品,但我们将依赖第三方生产我们用于商业销售的成品。我们没有与这些第三方中的任何一方签订长期协议。我们目前也没有任何商业用品的合同关系。 我们打算与第三方合同制造商和一个或多个备份制造商达成协议,以供未来生产。 我们正在分析为我们开发的任何产品的未来开发和商业批量建立制造能力的可行性 。此类产品将需要在符合FDA和我们正在寻求批准的其他司法管辖区监管机构的要求的设施和工艺中生产。同时,如果我们的任何候选产品被批准商业化,我们将有义务依赖合同制造商进行临床前研究、临床试验和商业生产。
我们或任何合同制造商用于生产我们的原材料、制造设备、活性药物成分和成品的设施必须获得FDA或类似的外国监管机构的批准。此类批准将接受检查 ,检查将在我们向FDA或其他相关监管机构提交BLA后进行。在此之前, 如果我们建立了自己的制造工厂,我们将不会控制我们候选产品的制造过程,并且我们的原材料、制造设备、活性药物成分和成品的制造将完全依赖我们的合同制造合作伙伴遵守当前的良好制造规范或cGMP 。这些cGMP法规 涵盖与我们的候选产品相关的制造、测试、质量控制、储存、分销和记录保存的方方面面。 如果我们的合同制造商不能成功地生产出符合我们的规格和FDA或其他机构严格的监管要求的材料,我们将无法确保或保持对其制造设施生产的产品的监管批准 。如果FDA或类似的外国监管机构不批准这些设施来生产我们的候选产品,或者如果它在未来撤回任何此类批准,我们可能需要寻找替代制造设施,这可能会显著推迟我们的临床试验,并影响我们开发、制造、获得监管机构批准或营销我们的 候选产品的能力。同样,如果我们的任何合同制造商选择终止与我们的业务关系,我们也可能受到负面影响。
我们的合同制造商将接受FDA以及相应的州和外国机构的持续定期突击检查,以了解是否符合cGMP和类似的法规要求。我们无法控制我们的合同制造商遵守这些法规和标准的情况。如果我们的任何合同制造商未能遵守适用的法规,可能会导致对我们实施制裁,包括罚款、禁令、民事处罚、未能批准我们的任何产品上市 候选产品、延迟、暂停或撤回批准、无法提供产品、运营限制和刑事起诉, 任何这些都可能对我们的业务产生重大不利影响。此外,我们将无法控制我们的合同制造商保持足够的质量控制、质量保证和合格人员的能力。如果我们的合同制造商未能遵守或保持这些标准中的任何一项,可能会对我们开发、制造、获得监管机构批准或营销我们的任何候选产品的能力产生不利影响。
如果, 由于任何原因,这些第三方不能或不愿意履行我们的职责,我们可能无法找到替代制造商或配方商,也无法与他们达成有利的协议,我们不能确定任何此类第三方是否具有满足未来要求的制造能力 。如果这些制造商或任何成品药品替代制造商在各自的生产流程中遇到我们所需的原材料、制造设备、活性药物成分或成品的任何重大 困难,或者因任何原因而停止与我们的业务往来,我们的临床试验可能会出现重大延误 ,我们的任何候选产品的供应可能会出现重大中断,或者可能根本无法提供我们的候选产品 。
任何制造问题或失去一家代工制造商都可能对我们的运营造成中断,并导致开发和临床试验延迟和销售损失。此外,我们将依赖第三方提供生产我们的产品所需的原材料 候选产品。任何这种对供应商的依赖都可能涉及几个风险,包括可能无法获得关键材料,以及对生产成本、交付时间表、可靠性和质量的控制减少。供应商问题对我们的合同制造商之一的运营造成的任何意外中断都可能延迟我们的任何候选产品的发货,增加我们销售商品的成本,并导致临床试验延迟或销售损失。
| 15 |
我们的 业务模式包括可能将我们专有微生物文库或我们的候选产品的菌株授予其他 生物制药公司,然而生物制药行业的技术许可是一个漫长的过程,并受到几个我们无法控制的 风险和因素的影响,我们无法预测我们能否成功地超越我们的技术许可或建立新的许可关系所需的时间 。
我们的商业模式包括将我们的专有微生物文库或我们的候选产品 中的菌株潜在地外包或联合开发给其他生物制药公司。任何此类安排通常都会从我们的潜在合作伙伴或被许可方进行初步可行性测试和评估开始。假设可行性测试成功,我们将成功的测试转换为商业许可或联合开发协议的能力取决于许多风险和因素,其中许多风险和因素不在我们的控制范围之内,包括:
| ● | 制药行业成员普遍采用和采用新技术的速度; | |
| ● | 我们的潜在被许可方对营销皮肤科产品的经济效益进行的内部评估,该产品可能与我们的潜在合作伙伴或被许可方目前正在开发或商业销售的其他产品具有竞争力 ,而不考虑我们的技术或产品的感知 好处或优势; | |
| ● | 我们潜在合作伙伴/被许可方的内部预算和产品开发问题,包括他们将资本和人力资源投入我们的技术或产品的开发和商业化的能力;以及 | |
| ● | 我们的潜在合作伙伴/被许可方是否愿意接受我们对预付费用和持续版税的要求。 |
此外,我们认为,在许多情况下,我们的潜在合作伙伴或被许可方可能会与我们一起进行早期可行性测试,作为他们评估多种药物和药物输送方案的一部分,并在做出任何决定或承诺开发新药产品之前 。因此,即使我们的平台在早期可行性研究中成功,我们的潜在合作伙伴/被许可人 可能会出于与我们的技术性能无关的原因而决定不与我们签订许可协议。因此,我们 无法预测我们提议的许可模式将在多大程度上成功。
如果对我们提起产品责任诉讼,我们可能会承担大量责任,并可能被要求限制我们候选产品的商业化 .
由于我们候选产品的临床测试,我们 将面临潜在的产品责任风险,如果我们将任何候选产品商业化,我们还将面临更大的此类责任风险。例如,如果我们开发的任何产品(包括我们的任何候选产品)或我们在候选产品中使用的任何材料涉嫌造成伤害或在产品测试、制造、营销或销售过程中被发现 不适合,我们可能会被起诉。任何此类产品责任索赔可能包括对制造缺陷、设计缺陷、未能就产品固有危险发出警告、疏忽、严格责任和违反保修的指控。在美国,根据州消费者保护法,也可以对我们提出索赔。如果我们不能成功地针对产品责任索赔进行辩护,我们可能会承担巨额责任或被要求限制我们的候选产品的商业化 。即使成功地对这些索赔进行辩护,也需要我们使用大量的财务和管理资源。 无论案情如何或最终结果如何,责任索赔可能会导致:
| ● | 减少了对我们的任何候选产品或我们可能开发的任何未来产品的需求; | |
| ● | 损害我们的声誉。 | |
| ● | 未能获得监管部门对我们的候选产品的批准; | |
| ● | 退出我们临床试验的参与者 ; | |
| ● | 与我方相关诉讼辩护相关的费用 ; | |
| ● | 转移我们管理层的时间和资源; | |
| ● | 向试验参与者或患者发放巨额 金钱奖励; | |
| ● | 产品 召回、撤回或贴标签、营销或促销限制; | |
| ● | 无法将我们的部分或全部候选产品商业化;以及 | |
| ● | 我们股票的价值下跌了。 |
| 16 |
截至本招股说明书发布之日,我们投保的产品责任保险足以满足我们目前的临床测试和开发水平 。但是,在我们开始商业销售我们的初始产品时,我们将需要额外的产品责任保险。 我们无法以可接受的成本获得并保留足够的产品责任保险,以防范潜在的产品责任索赔。 我们开发的产品可能会阻止或阻碍其商业化。尽管我们将努力获得并维持我们认为足够的此类保险金额,但任何针对我们提出的索赔都可能导致法院判决或和解的金额不在我们的保险范围内,或者超出我们的保险范围。 我们的保险单也将有各种排除,我们可能会受到我们没有保险范围的产品责任索赔的影响。 因此,我们可能需要支付超出我们的承保范围限制或 不在我们的保险范围内的任何由法院裁决或在和解协议中协商的任何金额,并且我们可能没有或能够获得足够的资本来支付这些金额。
如果信息技术系统出现故障或安全漏洞,我们的业务运营可能会受到影响.
虽然我们认为我们已在内部信息技术和网络系统中实施了足够的安全措施,但我们的信息技术系统可能会受到安全漏洞、计算机病毒、自然灾害、恐怖主义和通信故障的影响。除了丢失专有信息和商业机密的可能性外,任何系统故障或安全漏洞都可能导致我们的运营中断。如果任何中断或安全漏洞导致不适当地披露我们的机密信息,我们的竞争地位可能会受到不利影响,并且我们可能会产生责任或额外成本来补救这些中断或安全漏洞造成的损害。
我们 面临其他生物技术和制药公司针对医用皮肤病适应症的激烈竞争,如果我们不能有效竞争,我们的经营业绩将受到影响。
皮肤病治疗市场竞争激烈,并受到重大技术发展的引领。我们预计,如果我们 成功获得监管部门对我们的候选药物的批准,我们将面临来自我们行业将推出的其他批准疗法或 药物的激烈竞争。即使其他品牌、仿制药或非处方药的效果较差,但基于成本或便利性,它可能会比我们的产品更快地被医生和患者采用。
与产品监管相关的风险
我们的成功完全取决于我们能否获得FDA和外国司法管辖区监管机构对我们候选产品的上市批准,我们打算在这些司法管辖区营销我们的候选产品,这一点无法得到保证。
我们 不被允许将我们的候选产品作为处方药产品在美国销售,直到我们获得FDA的BLA批准 ,或者在我们获得这些国家/地区的必要批准之前,我们不允许在任何外国销售我们的候选产品。在美国,FDA通常要求完成每种生物的临床试验以确定其安全性和有效性,并进行广泛的药物开发以确保其质量,然后才能批准BLA。在大量正在开发的生物制品中,只有一小部分 向FDA提交了BLA,最终获准商业化的就更少了。截至本招股说明书发布之日, 我们尚未向FDA提交BLA,也未向其他监管机构提交任何候选产品的类似申请。
我们的 成功取决于我们是否获得上述监管批准,而此类监管批准的发放是不确定的 ,并受到许多风险的影响,包括:
| ● | 此类 权威机构可能不同意我们的临床试验或我们的任何合作者的临床试验的数量、设计、规模、进行或实施; |
| 17 |
| ● | 此类 当局可能不同意我们对临床前研究或临床试验数据的解释,或使用作为我们当前或未来候选产品的前体的研究结果 ; | |
| ● | 毒理学研究的 结果可能不支持为我们的产品提交研究新药申请或IND或BLA 候选; | |
| ● | FDA或类似的外国监管机构或机构审查委员会可能不同意我们临床试验的设计或实施 ; | |
| ● | 我们 可能无法为我们的候选产品的安全性和有效性提供可接受的证据; | |
| ● | 我们临床试验的 结果可能不令人满意,或者可能不符合FDA、欧洲药品管理局或EMA或其他监管机构为我们的任何候选产品获得上市批准所要求的统计或临床意义水平 ; | |
| ● | 我们的候选产品在特定临床试验中的剂量可能不是最佳水平; | |
| ● | 我们临床试验中的患者可能会出现不良反应,原因可能与我们的候选产品有关,也可能不相关; | |
| ● | 从临床试验收集的数据可能不足以支持提交BLA或其他提交,或在美国或其他地方获得监管部门的批准; | |
| ● | FDA可能要求制定风险评估和缓解策略,或REMS,作为批准的条件; | |
| ● | FDA或类似的外国监管机构可能无法批准与我们签订临床和商业用品合同的第三方制造商的制造工艺或设施。 | |
| ● | FDA或类似的外国监管机构的审批政策或法规可能会发生重大变化,导致 我们的临床数据不足以批准我们的候选产品。 |
获得监管部门批准的过程非常昂贵,通常需要多年时间(如果最终获得批准的话),而且可能会根据涉及的候选产品的类型、复杂性和新颖性、寻求监管部门批准的司法管辖区以及监管机构的重大自由裁量权等因素而有很大差异。开发期间监管审批政策的变化、附加法规或法规的变更或提交的产品申请的监管审查的变更 可能会导致申请审批或拒绝的延迟。在一个司法管辖区获得监管批准并不一定意味着候选产品将在我们可能寻求批准的所有司法管辖区获得监管批准,但在一个司法管辖区未能获得批准可能会对我们在不同司法管辖区寻求批准的能力产生负面影响。由于上述原因或任何其他原因,如果我们的候选产品未能获得监管部门的批准,我们将无法将我们的候选产品 商业化,我们的创收能力将受到严重影响。
此外,FDA、EMA或其他监管机构还可能批准的候选产品的适应症少于或超过我们的要求,可能会对某些年龄段的使用限制、警告、预防措施或禁忌症施加重大限制,或者可能会根据昂贵的上市后临床试验或风险缓解要求的表现而批准。FDA、EMA或其他监管机构也可能不接受我们认为对于我们的候选产品成功商业化是必要或可取的标签声明。
2022年12月,美国国会颁布了一项新法律,即《2022年化妆品现代化监管法案》,简称MOCRA。MOCRA将要求化妆品制造商或进口商:确保其手头有其产品和成分的安全性证明;满足 增加的注册、记录保存和报告要求;在其标签上包括香料和过敏原信息;并准备满足FDA将颁布的良好制造规范要求。这些额外要求可能会影响预算 和时间表。
| 18 |
我们的临床试验可能无法证明我们的候选产品或任何未来候选产品的安全性和有效性的实质性证据 ,这将阻止、推迟或限制监管批准和商业化的范围.
我们的商业模式完全依赖于我们候选产品的成功开发、监管批准和商业化,而这可能永远不会发生。我们最近启动了ATR-12的1b期临床试验,预计将在2024年第一季度招募第一名患者,并预计在2024年上半年提交ATR-04 1b期临床试验的IND申请。然而,我们所有其他候选产品 都处于早期开发阶段,截至本招股说明书发布之日,除ATR-12和ATR-04之外,我们尚未对任何候选产品进行性能表征和动物试验。我们可能无法成功获得FDA或类似的外国监管机构的批准,开始ATR-04或我们的任何其他候选产品的临床试验。如果我们 没有获得目前计划的批准,我们预计开始任何候选产品的临床计划的时间将被延长,这种延长将增加我们的费用,推迟我们可能收到的任何收入,并增加我们对 额外资本的需求。此外,不能保证我们将获得开始人体临床试验的批准,或者,如果我们确实获得了批准,我们的临床试验将会成功,或者我们将继续临床开发,以支持任何适应症的批准 FDA或类似的外国监管机构。我们注意到,大多数候选产品从未达到临床开发阶段,即使是那些已经开始临床开发的产品,成功完成临床开发并获得监管部门批准的机会也很小。临床前和临床试验早期阶段的成功并不能确保以后的临床试验也会成功,临床试验的中期结果也不一定能预测最终结果。我们的一个或多个临床试验的失败可能发生在测试的任何阶段。在临床试验过程中或临床试验过程中,我们可能会遇到许多不可预见的事件,这些事件可能会推迟或阻止我们获得监管部门的批准或使我们的候选产品商业化。因此,我们的业务目前完全依赖于我们候选产品的成功开发、监管批准和商业化,而这可能永远不会发生。
我们候选产品的临床前研究的结果可能不能预测未来的临床前研究或临床试验的结果。
要获得上市和销售我们的任何候选产品所需的监管批准,我们必须通过广泛的临床前研究和临床试验证明我们的候选产品在人体内是安全、纯净和有效的。IND必须经过广泛的临床前研究(包括临床前实验室测试、动物实验和符合良好实验室规范的配方研究)才能提交FDA 并生效,这是在美国进行人体临床试验的先决条件。临床前研究的成功并不能确保以后的临床前研究或临床试验也会成功。生物技术和制药行业的一些公司在临床试验中遭遇了重大挫折,即使在早期的临床前研究中取得了积极的结果。这些挫折是由临床试验进行期间的临床前发现以及在临床试验中进行的安全性或有效性观察(包括以前未报告的不良事件)等原因造成的。临床试验的设计可以决定其结果是否支持产品的批准, 在临床试验进展良好之前,临床试验设计中的缺陷可能不会变得明显。此外,我们或我们的研究人员可能无法控制受试者是否遵守临床试验方案的重要方面。此外,临床前和临床数据往往容易受到不同解释和分析的影响。尽管在早期的研究中有任何潜在的有希望的结果,但我们不能确定我们不会面临类似的挫折。此外,我们的临床前动物研究结果可能不能预测后续人体临床试验的结果。临床试验中的候选产品可能无法显示出所需的药理特性或安全性和有效性特性,尽管已通过临床前研究取得进展。
如果我们在候选产品的临床前研究或临床试验中未能收到积极的结果,我们最先进的候选产品的开发时间表和监管批准以及商业化前景将相应地受到负面影响,我们的业务和 财务前景将受到负面影响。
| 19 |
对我们的任何候选产品进行任何针对任何适应症的必要研究的任何 终止或暂停,或开始或完成的任何延误都可能导致我们的成本增加,延迟或限制我们的创收能力,并对我们的商业前景产生不利影响 .
临床研究的开始和完成可能会因多种原因而推迟,包括与以下方面有关的延迟:
| ● | 该 FDA或类似的外国监管机构未能授予继续进行临床研究的许可并暂停临床研究; | |
| ● | 科目 临床试验未能以我们预期的速度入组或继续入组我们的试验; | |
| ● | a 制造我们的任何候选产品的设施,这些产品被FDA或其他政府或监管机构暂时订购 或因违反cGMP要求或其他适用要求或产品交叉污染而永久关闭 制造过程中的候选人; | |
| ● | 可能需要或希望对我们的制造流程进行的任何 更改; | |
| ● | 科目 为我们正在开发候选产品的适应症选择替代治疗,或参与竞争 临床研究; | |
| ● | 科目 发生重度或非预期药物相关不良反应; | |
| ● | 报告 对类似技术和产品进行的临床试验引起了安全性和/或有效性问题; | |
| ● | 第三方 临床研究者失去了进行我们的临床试验所需的执照或许可证,无法进行我们的临床试验 按照我们预期的时间表或采用与临床试验方案、cGMP要求或其他第三方一致的方法 未及时或准确地进行数据收集和分析; | |
| ● | 检查 FDA、类似的外国监管机构或IRB发现的违反监管规定的临床研究中心, 我们采取纠正措施,导致暂停或终止一个或多个研究中心或强制临床暂停 在整个研究中,或禁止我们使用部分或全部数据来支持我们的营销申请; | |
| ● | 第三方 承包商因违规而被FDA或其他政府或监管机构取消资格或暂停资格或处以其他处罚 法规要求,在这种情况下,我们可能需要寻找替代承包商,我们可能无法使用某些或任何 该等承办商为支持我们的市场推广申请而提供的资料; | |
| ● | 一个 一个或多个IRB拒绝批准、暂停或终止临床试验机构的研究,排除了额外的 受试者,或撤回其对试验的批准;与潜在的合同研究组织就可接受的条款达成协议, 或CRO和临床试验中心,其条款可能需要进行广泛的谈判,并且可能在不同的 CRO和试验中心; | |
| ● | 偏差 临床研究中心的试验方案或退出试验; | |
| ● | 添加 新的临床试验地点; | |
| ● | 该 CRO因任何原因无法执行任何临床试验;以及 | |
| ● | 政府 或监管延迟或需要暂停或终止试验的“临床暂停”。 |
产品 如果我们在测试或审批方面有延误,或者如果我们需要执行比计划更多的 或更大的临床研究,我们任何候选产品的开发成本都将增加。此外,法规要求和政策可能会发生变化,我们可能需要修改 研究方案以反映这些变化。修正案可能要求我们向FDA、类似的外国监管机构和IRBs重新提交我们的研究方案进行重新审查,这可能会影响该研究的成本、时间或成功完成。如果我们遇到 延迟完成,或者如果我们、FDA或其他监管机构、IRB或其他审查实体,或我们的任何临床研究站点暂停或终止我们对任何候选产品的任何临床研究,其商业前景可能会受到实质性的 损害,我们创造产品收入的能力将被推迟。完成临床试验的任何延误都将增加我们的成本, 减慢我们的开发和审批流程,并危及我们开始产品销售和创造收入的能力。任何此类 事件都可能严重损害我们的业务、财务状况和前景。此外,许多导致或导致临床研究终止或暂停,或临床研究开始或完成延迟的因素,最终也可能导致我们的候选产品被监管部门拒绝批准。此外,如果一项或多项临床研究被推迟,我们的竞争对手可能会 先于我们将竞争产品推向市场,而我们任何受影响的候选产品的商业可行性可能会显著 降低。
| 20 |
即使 如果我们的任何候选产品获得监管部门的批准,我们也可能无法成功地将该产品商业化。 我们从其销售中获得的收入(如果有)可能是有限的。
如果 被批准上市,我们候选产品的商业成功将取决于医疗 社区(包括医生、患者和医疗保健付款人)对每种产品的接受程度。市场对我们的任何候选产品的接受程度将 取决于许多因素,包括:
| ● | 演示 临床安全性和有效性; | |
| ● | 相对 方便性、给药负担和易于给药; | |
| ● | 任何不良影响的流行率和严重程度; | |
| ● | 医生为我们的候选产品开处方的意愿,以及目标患者群体尝试新疗法的意愿; | |
| ● | 我们的候选产品与竞争产品相比的功效 ; | |
| ● | 针对我们的候选产品可能获得批准的适应症,推出未来可能出现的任何新产品; | |
| ● | 新的 程序或疗法,可以减少我们的候选产品可能显示出效用的任何适应症的发生率; | |
| ● | 定价 和成本效益; | |
| ● | 在适用的治疗和疫苗指南中包括或省略我们的候选产品; | |
| ● | 我们自己或任何未来合作伙伴的销售和营销策略的有效性; | |
| ● | 监管部门批准的标签中包含的限制或警告; | |
| ● | 我们 有能力从政府医疗保健计划(包括Medicare和Medicaid、私人健康保险公司和其他第三方付款人)获得并保持足够的第三方保险或报销,或者获得政府 管理治疗药物定价和使用的机构的必要定价批准;以及 | |
| ● | 患者在没有第三方保险或报销或政府定价批准的情况下自付费用的意愿。 |
如果我们的任何候选产品获得批准,但没有获得医生、医疗保健付款人和患者的足够程度的接受,我们可能无法产生足够的收入,我们可能无法实现或维持盈利。我们努力让医疗界和第三方付款人了解我们的候选产品的好处,这可能需要大量资源,而且可能永远不会成功。
此外,即使我们获得了监管部门的批准,任何批准的时间或范围也可能会禁止或降低我们将候选产品成功商业化的能力。 例如,如果审批过程太长,我们可能会错过预期的市场机会,并使其他 公司有能力开发竞争产品或建立市场主导地位。我们最终获得的任何监管批准都可能是有限的,或者受到限制或审批后承诺的限制,从而使我们的候选产品在商业上不可行。例如, 监管机构可能会批准我们的任何候选产品的适应症少于或超过我们要求的范围,可能不会批准我们打算对任何候选产品收取的价格,可能会批准取决于昂贵的上市后临床试验的表现,或者可能批准我们的任何候选产品的标签不包括该适应症成功商业化所必需或需要的标签声明 。此外,FDA或类似的外国监管机构可以在批准上附加条件,或要求风险管理计划或风险评估和缓解战略(REMS),以确保药物的安全使用。 此外,如果产品不符合监管标准或在产品首次上市后出现问题,可能会撤回产品批准。上述任何一种情况都可能对我们的候选产品的商业成功造成实质性损害。
| 21 |
即使 如果我们的任何候选产品获得了市场批准,我们也将受到持续的义务和持续的监管 审查,这可能会导致大量的额外费用。此外,我们的候选产品可能受到标签和其他 限制并退出市场,如果我们未能遵守监管要求或 我们的候选产品遇到意想不到的问题,我们可能会受到处罚。
即使 如果我们的任何候选产品获得了监管部门的批准,FDA或外国同等机构仍可能对其指示用途或营销或批准条件施加 重大限制,或对可能 昂贵且耗时的审批后研究(包括4期临床试验)和上市后监测以监测安全性和 疗效施加持续要求。我们的候选产品还将遵守有关制造、标签、包装、存储、分销、安全监控、广告、促销、记录和报告不良事件及其他上市后信息的持续法规要求 。这些要求包括向FDA注册,以及对于我们在批准后进行的任何临床试验,继续遵守当前的良好临床实践法规或CCP。此外,药品制造商及其设施 要接受FDA和其他监管机构的持续审查和定期检查,以确保符合当前的cGMP、与质量控制、质量保证和相应的记录和文件维护相关的要求。
FDA有权要求将REMS作为BLA的一部分或在批准后进行,这可能会对批准的药物的分发或使用施加进一步的要求或限制,例如将处方限制在经过 专门培训的特定医生或医疗中心,将治疗限制为满足某些安全使用标准的患者,或要求患者测试、监测和/或在登记中登记。
对于与我们的候选产品相关的销售和营销活动,广告和促销材料除了遵守美国其他适用的联邦、州和地方法律以及其他国家/地区的类似法律要求外,还必须符合FDA的 规则。 在美国,向医生分发产品样本必须符合美国处方药 营销法的要求。根据更改的性质,申请持有人必须获得FDA批准才能更改产品和制造。 我们还可能通过我们的客户和合作伙伴直接或间接地受到各种欺诈和滥用法律的约束,包括但不限于美国反回扣法规、美国虚假索赔法案和类似的州法律,这些法律除其他外,还会影响我们拟议的销售、营销和科学/教育资助计划。如果我们参加了美国医疗补助药品回扣计划、美国退伍军人事务部的联邦供应时间表或其他政府药品计划,我们将受到有关报告和付款义务的复杂法律和 法规的约束。所有这些活动还可能受到美国联邦和州 消费者保护和不正当竞争法律的约束。在其他国家的许多这样的领域也存在类似的要求。
此外,如果我们的任何候选产品被批准用于特定用途,我们的产品标签、广告和促销 将受到监管要求和持续的监管审查。FDA严格监管关于处方药的促销声明。特别是,产品不得用于未经FDA批准的用途,如产品批准的标签中所反映的那样。如果我们的候选产品获得了市场批准,医生仍然可以合法地 以与批准的标签不一致的方式向他们的患者开出我们的产品。如果我们被发现推广此类 标签外使用,我们可能会面临重大责任和政府罚款。FDA和其他机构积极执行禁止推广标签外使用的法律和法规,被发现不当推广标签外使用的公司可能会受到重大制裁。联邦政府已对涉嫌不当促销的公司处以巨额民事和刑事罚款,并禁止几家公司从事标签外促销。FDA还要求公司 签订永久禁令的同意法令,根据这些法令,特定的促销行为将被改变或减少。
如果我们或监管机构发现候选产品存在以前未知的问题,例如未预料到的严重程度或频率的不良事件、生产产品的设施存在问题,或者我们或我们的制造商未能遵守适用的 监管要求,我们可能会受到以下行政或司法制裁:
| ● | 限制产品的销售或制造、从市场上召回产品或自愿或强制召回产品; | |
| ● | 发出警告信或无标题信; | |
| ● | 临床 坚持; | |
| ● | 禁制令或施加民事或刑事处罚或罚款; | |
| ● | 暂停或撤回监管审批; | |
| ● | 暂停任何正在进行的临床试验; | |
| ● | 拒绝批准我们提交的待决申请或已批准申请的补充申请,或暂停或吊销产品许可证批准 ; | |
| ● | 暂停或对运营施加限制,包括代价高昂的新制造要求;或 | |
| ● | 产品 扣押、扣押或拒绝允许进口或出口产品。 |
| 22 |
发生上述任何事件或处罚可能会抑制我们将候选产品商业化并创造收入的能力。 无论是在审批前还是审批后,不利的监管行动也可能导致产品责任索赔并增加我们的产品责任风险。
我们 也无法预测美国或国外未来的立法或行政 行动可能产生的政府监管的可能性、性质或程度,遵守此类监管可能代价高昂,并消耗大量财务 和管理资源。如果我们或任何未来的营销协作者或合同制造商缓慢或无法适应现有要求的变化或新要求或政策的采用,或者无法保持合规性,则可能会 延迟或阻止我们产品的推广、营销或销售,这将对我们的业务和运营结果产生不利影响。
在一个司法管辖区获得并保持对我们候选产品的监管批准并不意味着我们将在其他司法管辖区成功获得 我们候选产品的监管批准。
在一个司法管辖区获得并保持对我们的候选产品的监管批准并不能保证我们能够在任何其他司法管辖区获得或 维持监管批准,但在一个司法管辖区未能或延迟获得监管批准可能会对其他司法管辖区的监管审批流程产生负面影响。例如,即使FDA批准了候选产品的上市 ,外国司法管辖区的可比监管机构也必须批准该候选产品在这些国家/地区的制造、营销和推广。审批程序因司法管辖区而异,可能涉及与美国不同的要求和行政审查期限,包括额外的临床前研究或临床试验,因为在一个司法管辖区进行的临床研究 可能不会被其他司法管辖区的监管机构接受。在美国以外的许多司法管辖区,候选产品必须先获得报销批准,然后才能在该司法管辖区批准销售。在某些情况下,我们打算对产品收取的价格也需要审批。
获得外国监管批准并遵守外国监管要求可能会给我们带来重大延误、困难和 成本,并可能推迟或阻止我们的候选产品在某些国家/地区推出。如果我们未能遵守国际市场的监管要求和/或获得相应的营销批准,我们的目标市场将会减少 ,我们充分发挥候选产品市场潜力的能力将受到损害。
即使 虽然我们可以为候选产品申请孤儿药物指定,但我们可能无法获得孤儿药物营销排他性。
我们 认为,在某些情况下,我们的候选产品可能有资格获得FDA的孤立药物地位。不能保证FDA将批准我们的任何候选产品未来的任何孤儿药物指定申请,这将使我们没有资格获得 孤儿药物指定的额外排他性和其他好处。
根据《孤儿药品法》,FDA可以将用于治疗罕见疾病或疾病的药物授予孤儿药物称号,这种疾病或疾病通常是指在美国影响不到200,000人的疾病或疾病,因此没有合理的预期 在美国开发和提供治疗此类疾病或疾病的药物的成本将从产品的销售中收回 。在提交BLA之前,必须申请指定孤儿药物。在FDA批准孤儿药物指定后, FDA将公开披露治疗剂的身份及其潜在的孤儿用途。孤立产品命名不会 在监管审批过程中传达任何优势或缩短持续时间。除了可能的独占期 外,孤儿指定还使公司有资格在四年内每年获得高达650,000美元的赠款资金,以支付临床试验费用、临床研究费用的税收抵免,以及可能免除FDA申请用户费用。
| 23 |
如果具有孤儿称号的产品随后获得FDA对其具有孤儿称号的疾病或病症的第一次批准,则该产品有权获得孤儿药品排他性,这意味着FDA在七年内不得批准同一药物在同一适应症下销售的任何其他申请,除非在有限情况下,例如:(I)该药物的孤儿称号被撤销;(Ii)其上市批准被撤回;(Iii)孤儿排他性持有者同意批准另一申请人的 产品;(Iv)孤儿排他性持有者不能保证获得足够数量的药物;或(V)竞争对手的产品显示出相对于具有孤儿排他性的产品的临床优势。如果被指定为孤儿产品的药物获得了 比指定范围更广的适应症的上市批准,则该药物可能没有资格获得孤儿药物独家经营权。如果我们选择寻求此类申请,不能保证我们的任何候选产品在我们认为 可能符合条件的适应症中将获得孤儿药物指定。
当前的 和未来的立法可能会增加我们获得候选产品的上市批准并将其商业化的难度和成本 ,并影响我们可能获得的价格。
在 美国和一些外国司法管辖区,有关医疗保健系统的立法和法规更改以及拟议的更改 可能会阻止或推迟我们候选产品的上市审批,限制或规范审批后活动 ,并影响我们销售候选产品的盈利能力。已经提出了立法和监管建议,以扩大批准后的要求,并限制药品的销售和促销活动。我们不知道是否会颁布额外的立法变更,或FDA的法规、指南或解释是否会更改,或此类变更对我们候选产品的上市审批(如果有)可能产生什么影响。此外,美国国会对FDA审批过程的更严格审查可能会显著推迟或阻止上市审批,并使我们受到更严格的产品标签和上市后测试及其他要求的约束。
在美国,《联邦医疗保险现代化法案》(Medicare Modinization Act,简称MMA)改变了联邦医疗保险覆盖和支付药品的方式。立法扩大了老年人购买药品的医疗保险覆盖范围,并引入了基于药品平均销售价格的新报销方法。此外,这项立法授权Medicare Part D处方药计划使用处方,在这些处方中, 可以限制任何治疗类别涵盖的药物数量。由于这项立法和联邦药品覆盖范围的扩大,我们预计将会有更多的压力来控制和降低成本。这些降低成本的举措 以及该立法的其他条款可能会降低我们为候选产品提供的覆盖范围和价格,并可能严重 损害我们的业务。虽然MMA仅适用于Medicare受益人的药品福利,但私人付款人在设置自己的报销费率时通常遵循Medicare承保政策和支付限制,而MMA导致的任何报销减少 可能会导致私人付款人的付款减少类似的情况。
《患者保护和平价医疗法案》经2010年《医疗保健和教育负担能力协调法案》(或统称为ACA)修订,是一部全面的法律,旨在扩大医疗保险的可及性,减少或限制医疗支出的增长,加强针对欺诈和滥用的补救措施,为医疗保健和医疗保险行业增加新的透明度要求, 对医疗行业征收新的税费,并实施额外的医疗政策改革。出于报告目的,ACA修改了“制造商平均价格”的定义,这可能会增加对各州的医疗补助药品退税金额。该法律还对生产或进口品牌处方药产品的公司征收了一笔可观的年费。此外,2022年8月16日,总裁·拜登签署了2022年通胀削减法案,将个人在ACA市场购买医疗保险的增强补贴延长至2025年。从2025年开始,IRA还通过显著降低受益人的最大自付成本和创建新的制造商折扣计划来消除Medicare Part D计划下的“甜甜圈洞” 。目前尚不清楚这些挑战以及拜登政府的医疗改革措施将如何影响ACA和我们的业务。
| 24 |
此外,自ACA颁布以来,美国还提出并通过了其他立法修改。2011年,美国 国会颁布了《2011年预算控制法》或《预算控制法》,其中包括旨在减少联邦赤字的条款。预算控制法案导致从2013年开始对医疗保险提供者的支付减少2%, 由于随后对该法规的立法修订,该法案将在没有国会额外行动的情况下一直有效到2027年。然而, 根据CARE法案和后续立法,由于新冠肺炎大流行,这些削减将从2020年5月1日至2022年3月31日暂停。2013年1月,2012年《美国纳税人救济法》签署成为法律,其中包括减少向多家医疗服务提供者支付的医疗保险费用,并将政府向服务提供者追回多付款项的诉讼时效期限从三年延长至五年。这些新法律可能会导致联邦医疗保险和其他医疗保健资金的进一步减少,如果获得批准,这可能会对我们药品的客户以及我们的财务运营产生实质性的不利影响。如果政府支出进一步削减,预计的预算缺口也可能影响FDA等相关机构继续以当前水平运作的能力,这可能会影响相关机构及时审查和批准研发、制造和营销活动的能力,这可能会推迟我们开发、营销和销售任何候选产品的能力。 此外,任何影响Medicare、Medicaid或其他可能实施的公共资助或补贴医疗计划的重大支出削减,或可能对我们征收的任何重大税收或费用,作为任何更广泛的赤字削减努力的一部分 或对《预算控制法案》的立法替代,可能会对我们预期的产品收入产生不利影响。
此外, 最近,政府加强了对制造商为其商业产品定价的方式的审查。 美国国会最近进行了几次调查,提出并颁布了联邦和州立法,旨在提高药品定价的透明度,审查定价与制造商患者计划之间的关系,降低医疗保险下的药品成本,并改革政府计划的药品报销方法。2020年9月24日,FDA 发布了一项最终规则,为各州制定和提交来自加拿大的药物进口计划提供指导。此外,2020年11月20日,美国卫生与公众服务部(HHS)敲定了一项法规,取消了药品制造商对D部分下计划赞助商降价的安全港保护 直接或通过药房福利经理,除非 法律要求降价。该规则还为反映在销售点的降价创造了新的安全港, 也为药房福利经理和制造商之间的某些固定费用安排创造了安全港。2022年8月16日, 国会颁布了《2022年通胀削减法案》,其中包含多项与处方药成本有关的条款,包括对联邦政府价格谈判的要求、返点要求,以及对Medicare Part D投保人的自付支出上限。 在州一级,立法机构越来越多地通过立法并实施旨在控制药品和生物制品定价的法规,包括价格或患者报销限制、折扣、对某些产品准入的限制 以及营销成本披露和透明度措施,在某些情况下,旨在鼓励从其他国家进口和 批量购买。
2020年11月20日,卫生和公众服务部监察长办公室敲定了对联邦反回扣法规的进一步修改。根据《最终规则》,卫生与公众服务部监察长办公室根据《反回扣法规》为临床医生、提供者和其他人之间的某些协调护理和基于价值的安排增加了安全港保护,但取消了 制药商直接或通过药房福利经理对D部分下的计划赞助商降价的安全港保护,除非法律要求降价 。该规则还为反映在销售点的降价创造了新的安全港,以及为药房福利经理和制造商之间的某些固定费用安排创造了安全港。此规则(有例外情况)于2021年1月19日生效。我们将继续评估这些规则将对我们的业务产生什么影响(如果有的话)。CMS于2019年7月9日发布了最终规则, 要求处方药和生物制品的直接面向消费者的广告(可通过或根据Medicare或Medicaid付款)在广告中包括该药物或生物制品的批发采购成本或标价,如果该药品或生物制品的每月供应或通常疗程的批发价等于或大于35美元。违反这些要求的处方药和生物制品将被列入公共名单。任何采用的医疗改革措施 如果获得批准,可能会降低对我们产品的最终需求,或者给我们的产品定价带来压力。美国各个州也越来越积极地通过立法和实施法规来控制药品定价,包括价格或患者报销限制、折扣、对某些产品准入和营销成本披露的限制 以及透明度措施,在某些情况下,旨在鼓励从其他国家进口和批量采购。此外,地区医疗当局和个别医院越来越多地使用招标程序来确定哪些药品 以及哪些供应商将包括在其处方药和其他医疗保健计划中。我们预计未来将采取更多的州和联邦医疗改革措施。
| 25 |
在欧洲联盟或欧盟提供医疗保健,包括医疗服务的建立和运营以及药品的定价和报销,几乎完全是国家法律和政策的问题,而不是欧盟的法律和政策。各国政府和卫生服务提供者在提供卫生保健以及产品定价和报销方面有不同的优先事项和方法 。然而,总的来说,大多数欧盟成员国的医疗预算限制导致相关医疗服务提供商对药品的定价和报销进行了限制。再加上希望开发和营销产品的欧盟和国家监管机构的负担不断增加,这可能会阻止或推迟我们的候选产品的上市审批,限制 或监管审批后的活动,并影响我们将任何获得上市审批的产品商业化的能力。在美国和欧盟,都提出了立法和监管建议,以扩大审批后的要求,并限制 药品的销售和促销活动。我们不知道是否会颁布额外的法律变更, 或法规、指南或解释是否会更改,或此类更改对我们的候选产品的上市审批 可能会产生什么影响。
第三方保险和报销、医疗成本控制计划和治疗指导方针可能会限制我们未来的收入。
我们 能否成功营销我们的候选产品,部分取决于政府卫生行政部门、私人健康保险公司和其他组织为我们候选产品和相关治疗提供的报销水平。 我们的任何候选产品经常通过国家医疗保险计划下的报销计划销售的国家/地区 要求药品制造商和销售商在初始价格和任何后续价格上涨时获得政府批准。在某些国家,包括美国,政府资助和私人医疗保健计划可能会对价格施加巨大的间接压力。如果未批准足够的价格或覆盖范围 且无法获得报销或报销范围有限,我们可能无法销售我们的候选产品以盈利。越来越多的第三方付款人试图通过 可能影响我们产品开发的方式来控制医疗成本,包括:
| ● | 未能批准或者对保健品价格提出异议的; | |
| ● | 从价格较低的司法管辖区引入 再进口计划; | |
| ● | 限制新治疗产品的覆盖范围和报销金额; | |
| ● | 拒绝 或限制经监管机构批准但被第三方付款人视为试验性或调查性的产品的承保范围 ;以及 | |
| ● | 当批准的产品以未获得监管市场批准的方式使用时,拒绝提供保险。 |
我们与客户和付款人的关系受到适用的反回扣、欺诈和滥用以及其他医疗法律法规的约束, 如果违反这些法律法规,我们可能面临刑事制裁、民事处罚、被排除在政府医疗保健计划之外、合同损害、声誉损害以及利润和未来收入减少。
医疗保健 提供者、医生和其他人将在推荐和处方我们获得市场批准的任何产品时发挥主要作用。我们未来与第三方付款人和客户的协议可能使我们面临广泛适用的欺诈和滥用 和其他医疗法律法规,主要是在美国,这可能会限制我们营销、销售和分销我们获得营销批准的产品的业务或财务安排 和关系。根据 适用的医疗法律法规的限制,包括:
| ● | 联邦反回扣条例禁止在知情的情况下故意提供、支付、征求或接收任何形式的报酬,以换取或诱使(I)推荐某人,(Ii)提供或安排提供根据Medicare、Medicaid或其他政府计划可报销的物品或服务,或(Iii)购买、租赁或订购 或安排或建议购买、租赁或订购根据Medicare、Medicaid或其他政府计划可报销的任何物品或服务。个人或实体不需要实际了解法规或违反法规的具体意图 即可实施违规。此外,政府可断言,违反联邦《反回扣法规》而产生的包括物品或服务的索赔,就《虚假索赔法》而言,构成虚假或欺诈性索赔; |
| 26 |
| ● | 联邦虚假索赔法案对故意向联邦政府提出或导致向联邦政府提出虚假或欺诈性付款索赔或通过虚假陈述逃避、减少或隐瞒向联邦政府支付款项的义务的个人或实体实施民事处罚,并规定对举报人或准实体提起民事诉讼; | |
| ● | HIPAA 对执行诈骗任何医疗福利计划的计划或作出与医疗保健事项有关的虚假陈述 施加刑事和民事责任。与联邦反回扣法规类似,个人或实体不需要实际了解法规或违反法规的具体意图即可实施违规; | |
| ● | 联邦虚假陈述法禁止故意伪造、隐瞒或掩盖重大事实,或作出与提供或支付医疗保健福利、项目或服务有关的任何重大虚假陈述; | |
| ● | 根据ACA创建的《医生支付阳光法案》及其实施条例,要求药品、设备、生物制品和医疗用品的指定制造商 在Medicare、Medicaid或儿童健康保险计划下可获得付款的 除特定例外情况外,每年向CMS报告与向医生进行的付款或其他“价值转移 ”相关的信息。所有这类报告的信息都是公开的; | |
| ● | 类似的州和非美国法律法规,例如某些州的反回扣和虚假索赔法律,可能适用于任何第三方付款人(包括商业保险公司)报销的项目或服务;州法律,要求制药公司遵守 行业自愿合规指南和联邦政府颁布的适用合规指南,或以其他方式限制可能向医疗保健提供者和其他潜在转介来源支付的款项;州法律,要求药品制造商报告与向医生和其他医疗保健提供者支付和以其他方式转移价值或营销支出有关的信息;以及管理某些情况下健康信息隐私和安全的州法律,其中许多法律在很大程度上彼此不同,可能不具有相同的效果,从而使合规努力复杂化;以及 | |
| ● | 由CMS监管和HHS监察长办公室或美国司法部执行。 |
由于这些法律的广度以及法定例外和可用避风港的狭隘,我们 未来的一些商业活动可能会受到一项或多项此类法律的挑战。
确保我们与第三方的业务安排符合适用的医疗法律法规的努力将涉及 巨额成本。政府当局可能会得出结论,我们的业务实践可能不符合当前或未来涉及适用欺诈和滥用或其他医疗保健法律和法规的法规、法规或判例法。如果我们的业务 被发现违反了任何这些法律或任何其他可能适用于我们的政府法规,我们可能会受到重大的民事、刑事和行政处罚、损害赔偿、罚款、被排除在美国政府资助的医疗保健计划之外,如Medicare 和Medicaid,以及削减或重组我们的业务。如果我们希望与之开展业务的任何医生或其他提供者或实体被发现不符合适用法律,他们可能会受到刑事、民事或行政 制裁,包括排除在政府资助的医疗保健计划之外。
与我们知识产权有关的风险
保护我们的知识产权是困难和昂贵的,我们无法确保这些权利的保护。
我们的商业成功将在一定程度上取决于我们是否有能力在必要时针对第三方 挑战起诉和捍卫我们的专利权,并成功地针对第三方竞争对手实施这些专利权。生物技术公司的专利地位可能高度不确定,涉及复杂的法律、科学和事实问题,其中重要的法律原则仍未解决。 专利法或专利法解释的变化可能会降低我们知识产权的价值。因此, 我们无法预测在我们或我们的专利权许可人提交的任何专利申请中可能允许或可强制执行的索赔的广度 。我们持有或许可的与我们的微生物平台和相关技术相关的专利和专利申请 可能会受到第三方的挑战、无效或规避,并且可能无法保护我们免受具有类似产品或技术的竞争对手的影响。
| 27 |
由我们持有或授权给我们的专利权提供的未来保护程度是不确定的,因为法律手段只能提供有限的 保护,而可能无法充分保护我们的权利,使我们能够获得或保持我们的竞争优势,或为我们提供任何竞争优势。我们不能确定第三方拥有的任何专利申请不会优先于我们提交或我们持有许可权的专利申请,也不能确定我们不会卷入美国或外国专利局的干扰、反对或无效诉讼 。
此外, 如果我们对第三方提起法律诉讼,以强制执行涵盖我们任何候选产品的专利,被告 可以反诉该专利无效和/或不可强制执行。在美国的专利诉讼中,被告声称无效和/或不可执行的反诉是司空见惯的。质疑有效性的理由包括据称未能满足 几项法定要求中的任何一项,包括缺乏新颖性、明显或无法实施。不可执行性断言的理由包括 与专利起诉有关的人在起诉期间向美国专利商标局或USPTO隐瞒相关信息或做出误导性陈述的指控。第三方也可以向美国或国外的行政机构提出类似的索赔,即使在诉讼范围之外也是如此。这类机制包括复审、赠款后审查和外国司法管辖区的同等程序,例如反对程序。此类诉讼可能导致撤销或修改由我们持有或授权给我们的专利,使其不再涵盖我们的候选产品或竞争产品。在法律上断言无效和不可执行之后的结果 是不可预测的。例如,关于有效性,我们不能确定 没有无效的先前技术,而我们、我们专利权的任何许可人或专利审查员在起诉期间并不知道这一点。 如果被告胜诉,无效和/或不可强制执行的法律主张成立,我们将失去对我们任何候选产品的至少部分,甚至全部 专利保护。这种专利保护的丧失将对我们的业务产生实质性的不利影响。
我们 依靠专有技术和商业秘密来保护技术,特别是在我们认为专利保护不合适或 可以获得的情况下。然而,专有技术和商业秘密很难保护。虽然我们要求员工、学术合作者、顾问和其他承包商签订保密协议,但我们可能无法充分保护我们的商业秘密或其他专有或许可信息。通常,研究合作者和科学顾问有权发布数据和信息,而我们可能有权发布这些数据和信息。强制执行第三方非法获取和使用我们的任何商业秘密的声明是昂贵和耗时的 ,结果不可预测。此外,与专利相比,法院有时更不愿意保护商业秘密。此外,我们的竞争对手可以自主开发同等的知识、方法和诀窍。
如果 我们无法为我们的候选产品或我们的技术获得或维护专利保护或商业秘密保护,第三方 可能会使用我们的专有信息,这可能会削弱我们在市场上的竞争能力,并对我们创造 收入和实现盈利的能力产生不利影响。
我们的 候选产品可能会侵犯他人的知识产权,这可能会增加我们的成本,延迟或阻碍我们的开发和商业化努力。
我们的成功在一定程度上取决于避免侵犯他人的专有技术。制药业的特点是涉及专利和其他知识产权的诉讼频繁。识别可能与我们的专有技术相关的第三方专利权是困难的,因为专利搜索由于 专利之间的术语差异、数据库不完整以及难以评估专利权利要求的含义而不完善。此外,由于专利申请 在申请发布之前一直保密,我们可能不知道我们的任何候选产品或任何未来候选产品的商业化 可能会侵犯第三方专利。可能会有某些已颁发的专利和专利申请声称 我们可能需要获得许可才能对我们的任何候选产品进行研究、开发或商业化,而我们 不知道这些专利和专利申请是否可以按商业合理的条款获得许可,或者根本不知道。第三方提出的任何专利侵权索赔都将非常耗时,并且可能:
| ● | 结果 诉讼费用高昂; |
| 28 |
| ● | 转移我们技术人员和管理人员的时间和注意力; | |
| ● | 阻止我们将产品商业化,直到声称的专利到期或在法庭上最终被裁定无效或未被侵犯; | |
| ● | 要求我们停止或修改我们对该技术的使用和/或开发非侵权技术;或 | |
| ● | 要求 我们签订版税或许可协议。 |
第三方 可能拥有可能阻止我们的任何候选产品上市的专有权利。任何针对我们要求损害赔偿并试图禁止与我们的任何候选产品或我们的工艺有关的商业活动的专利相关法律诉讼都可能 使我们承担潜在的损害赔偿责任,并要求我们获得许可证才能继续制造或销售我们的任何候选产品或任何未来的候选产品。我们无法预测我们是否会在任何此类诉讼中获胜,也无法预测这些专利所需的任何许可证是否会以商业上可接受的条款提供(如果有的话)。此外,如果有必要,我们不能确定我们 是否可以重新设计我们的候选产品或任何未来的候选产品或流程,以避免侵权。因此, 司法或行政诉讼中的不利裁决,或未能获得必要的许可证,可能会阻止我们 开发和商业化我们的任何候选产品或未来的候选产品,这可能会损害我们的业务、财务状况和经营业绩。
我们 预计还有其他公司,包括主要的生物制药公司,在与我们推荐的候选产品竞争的领域开展工作,这些领域已经或可能导致提交可能被认为与我们的活动相关的专利申请。 如果我们要在法庭上挑战这些或任何已发布的美国专利的有效性,我们将需要克服适用于每一项已发布的美国专利的法定有效性推定 。这意味着,为了胜诉,我们必须就专利权利要求的无效性提出明确而令人信服的证据。如果我们要在USPTO的专利审判和上诉委员会的行政审判中质疑这些或任何已颁发的美国专利的有效性,我们将必须证明 权利要求是不可专利的,因为证据占优势。不能保证陪审团和/或法院会在侵权、有效性或可执行性问题上做出有利于我们的裁决。即使我们成功了,诉讼也可能导致巨额成本,并 分散管理层的注意力。
我们 可能会受到以下指控:我们错误地从竞争对手那里雇佣了一名员工,或者我们或我们的员工错误地使用了 ,或者泄露了他们前雇主的所谓机密信息或商业秘密。
由于 在我们的行业中很常见,我们将聘用以前在其他生物制药公司工作过的人员,包括我们的竞争对手或潜在竞争对手。虽然目前没有针对我们的索赔待决,但我们未来可能会受到索赔 ,即我们的员工或潜在员工对其前雇主负有持续义务(例如竞业禁止义务或非征集义务),或者我们的员工或我们无意或以其他方式使用或泄露其前雇主的商业秘密或 其他专有信息。可能有必要提起诉讼来抗辩这些指控。即使我们成功地对这些索赔进行了辩护,诉讼也可能导致巨额成本,并分散管理层的注意力。
与本次发行以及持有我们的普通股和/或预先出资的认股权证有关的风险
我们股票的市场价格可能会受到波动和波动的影响。你可能会失去全部或部分投资.
我们普通股的市场价格会随着各种因素的变化而大幅波动,其中一些因素是我们无法控制的。 自2023年6月我们的普通股在首次公开募股(IPO)中以每股5.00美元的价格出售以来,截至2024年1月12日,我们普通股的报道价格从5.18美元到0.92美元不等。我们在纽约证券交易所美国证券交易所的股票市场价格可能会因多种因素而波动,其中一些因素是我们无法控制的,包括, 但不限于:
| ● | 我们和我们的竞争对手的经营业绩和财务状况的实际变化或预期变化; |
| 29 |
| ● | 如果我们的股票由分析师跟踪,则更改 证券分析师的收益预期或推荐; | |
| ● | 市场对我们候选产品的接受度; | |
| ● | 他人开发技术创新或有竞争力的新产品; | |
| ● | 我们发布的技术创新或新产品公告 ; | |
| ● | 发布我们的候选产品的临床前或临床试验结果; | |
| ● | 我们未能实现公开宣布的里程碑; | |
| ● | 我们开发和营销新的或增强的产品的支出与这些产品的销售收入之间的延迟 ; | |
| ● | 与知识产权有关的发展,包括我们参与由我们提起或针对我们提起的诉讼; | |
| ● | 监管动态和监管当局关于批准或拒绝新产品或改装产品的决定; | |
| ● | 更改我们用于开发、获取或许可新产品、技术或业务的金额; | |
| ● | 更改我们用于推广候选产品的支出 ; | |
| ● | 我们出售或建议出售,或我们的大股东在未来出售我们的股票或其他证券; | |
| ● | 关键人员变动 ; | |
| ● | 我们或竞争对手的研发项目的成功或失败; | |
| ● | 我们股票的交易量;以及 | |
| ● | 一般经济和市场状况以及其他因素,包括与我们的经营业绩无关的因素。 |
这些 因素和任何相应的价格波动可能会对我们股票的市场价格产生重大不利影响,并导致我们的投资者遭受重大损失。在过去,在市场波动之后,上市公司股东经常提起证券集体诉讼。如果我们卷入证券诉讼,可能会给我们带来巨额成本,并将我们管理层的资源和注意力从我们的业务上转移出去。
本次发行中发行的预融资权证没有公开市场。
本次发行中发行的预融资权证没有成熟的公开交易市场,我们预计市场不会发展。此外,我们不打算申请在任何证券交易所或国家认可的交易系统(包括纽约证券交易所美国证券交易所)上市预融资权证。如果没有活跃的市场,预融资权证的流动性将受到限制。
在行使预付资权证后,我们 将不会收到任何有意义的额外资金。
每份预付资金认股权证将可予行使,直至其全部行使为止,并于行使时以支付名义现金购买价格的方式行使。 因此,我们将不会在行使预付资金认股权证时获得任何有意义的额外资金。
在本次发行中购买的预融资权证的持有人 将不享有普通股股东的权利,直到该等持有人行使该等认股权证并获得我们普通股的股份。
在预筹资权证的持有人在其行使时获得我们普通股的股份之前,该等预资资权证的持有人将不享有与该等预资金权证相关的本公司普通股股份的权利。在行使预先出资的认股权证后,该等持有人将只有权就记录日期在行使日期之后的事项行使普通股股东的权利。
我们普通股的重要持有者或实益持有者可能不被允许行使他们持有的预先出资的认股权证。
预先出资认股权证的持有人将无权行使任何预先出资认股权证的任何部分,而在行使该等权利后,将导致:(I)该持有人(连同其关联公司)实益拥有的普通股股份总数超过该持有人在行使权利后立即发行的普通股股份总数的4.99%(或在选择持有人时,超过9.99%) ;或(Ii)该持有人(连同其关联公司)实益拥有的我们证券的综合投票权在紧接行使后超过我们所有已发行证券的总投票权的4.99%(或在持有人获选时,超过9.99%) ,因为该百分比所有权是根据预先出资的认股权证的条款而厘定的。因此,您可能无法在您为我们的普通股股份行使预付资金权证的同时, 这样做对您的财务有利。在这种情况下,您可以寻求出售您的预融资权证以实现价值, 但在没有成熟的交易市场和适用的转让限制的情况下,您可能无法这样做。
我们的 未能满足纽约证券交易所美国人的持续上市要求可能会导致我们的普通股退市。
如果 我们未能满足NYSE American的持续上市要求,例如公司治理要求或最低收盘价要求,NYSE American可能会采取措施将我们的普通股退市。这样的退市可能会对我们的普通股价格产生负面的 影响,并会削弱您在您愿意的时候出售或购买我们的普通股的能力。如果发生退市事件,我们不能保证我们为恢复遵守上市要求而采取的任何行动将 允许我们的普通股重新上市,稳定市场价格或提高我们普通股的流动性,防止我们的普通股 跌破NYSE American的最低出价要求,或防止未来不遵守NYSE American的 上市要求。
未来的增资可能会稀释您的所有权和/或对我们的运营产生其他不利影响.
如果 我们通过发行股权证券筹集额外资本,我们现有股东的所有权百分比将会减少,这些 股东可能会经历大幅稀释。如果我们通过发行债务证券筹集更多资金,这些债务证券将 拥有优先于我们普通股的权利,而发行的债务证券的条款可能会对我们的业务施加重大限制,包括对我们资产的留置权。如果我们通过协作和许可安排筹集更多资金,我们可能会被要求 放弃对我们的知识产权或候选产品的某些权利,或按对我们不利的条款授予许可。
| 30 |
有资格未来出售的股票 可能会对我们普通股的市场产生不利影响.
截至本招股说明书日期,本公司已发行及已发行普通股共12,097,643股,所有普通股均符合根据证券法第144条(受第144条的若干限制限制)在公开市场进行普通经纪交易的资格 ,但我们的高级职员及董事持有的约588,745股普通股除外,该等普通股 须受2024年6月到期的IPO禁售期限制。我们已向我们的可转换优先股和可转换本票的前持有人授予需求和搭载登记权,据此,他们可以申请登记转售最多9,542,519股普通股。根据规则144或根据任何转售招股说明书进行的任何重大出售我们的普通股(包括投资者出售与本次发行相关的证券)可能会对我们的普通股的市场价格产生重大不利影响 。
根据《就业法案》,我们 是一家“新兴成长型公司”,我们不能确定适用于新兴成长型公司的披露要求的降低是否会降低我们的普通股对投资者的吸引力.
根据《就业法案》的定义,我们 是“新兴成长型公司”,我们可以利用适用于非“新兴成长型公司”的其他上市公司的各种 报告要求的某些豁免,包括但不限于:
| ● | 未被要求遵守《萨班斯-奥克斯利法案》第404节的审计师认证要求; | |
| ● | 减少了我们定期报告和委托书中有关高管薪酬的披露义务; | |
| ● | 豁免 从对高管薪酬进行不具约束力的咨询投票和股东批准任何金降落伞的要求 付款;以及 | |
| ● | 扩展 为遵守新的或修订的会计准则提供过渡期。 |
我们 已选择利用《就业法案》提供的所有福利,包括上文讨论的豁免。我们无法预测投资者是否会因为我们可能依赖这些豁免而发现我们的普通股吸引力下降。如果一些投资者因此发现我们的普通股吸引力下降,我们的普通股可能会出现不那么活跃的交易市场,我们的股价可能会更加波动。
我们 将在五年内保持“新兴成长型公司”的地位,但如果我们的收入超过 12.35亿美元,如果我们在三年期内发行超过10亿美元的不可转换债券,或者如果非关联公司持有的普通股 市值在未来任何一年的6月30日超过7亿美元,我们将很快失去这一地位。
根据《就业法案》,我们作为“新兴成长型公司”的身份可能会使我们在需要时筹集资金变得更加困难 .
由于我们作为一家“新兴成长型公司”获得了各种报告要求的豁免,因此我们对投资者的吸引力可能会降低 ,因此我们可能很难在需要时筹集更多资本。如果投资者认为我们的报告不如行业中的其他公司透明,他们可能无法将我们的业务与行业内的其他公司进行比较。 如果我们无法在需要时筹集额外资本,我们的财务状况和运营结果可能会受到实质性的 和不利影响。
我们 过去没有为我们的普通股支付股息,目前也没有支付此类股息的计划.
我们 计划将我们所有的收益进行再投资,以弥补运营成本,并以其他方式保持竞争力。 在可预见的将来,我们不打算就我们的普通股支付任何现金股息。我们无法向您保证, 我们将在任何时候产生足够的盈余现金,可用于分配给我们的普通股持有人作为股息。 因此,您不应期望从我们提供的普通股中获得现金股息。
| 31 |
如果股票研究分析师不发表关于我们业务的研究或报告,或者如果他们发表不利评论或下调我们的股票评级,我们的股票价格可能会下跌.
我们股票的交易市场将部分依赖股票研究分析师发布的关于我们和我们业务的研究和报告。 如果有的话。我们对这些分析师没有控制权,他们也没有承诺要写关于我们的研究报告。如果没有发布关于我们或我们业务的研究报告,或者如果一个或多个股票研究分析师 下调了我们的股票评级,或者如果这些分析师发布了其他不利的评论或停止发布关于我们或我们业务的报告,则我们的股票价格可能会下跌。
您 将立即经历您购买的普通股或预融资权证的每股账面价值的稀释。
由于 我们提供的普通股和预先注资认股权证的每股价格远高于我们普通股的每股 账面价值,因此您在本次发行中购买的普通股和/或预先注资 认股权证的有形账面净值将大幅稀释。根据每股$的公开发行价格,如果您在本次发行中购买普通股和/或预配资金认股权证,您将在2023年9月30日的普通股有形账面净值中立即大幅稀释每股$1.36。
我们 可能面临更高的证券集体诉讼风险。
从历史上看, 证券集体诉讼通常是在证券市场价格下跌后针对公司提起的。 这种风险对我们尤其重要,因为生物技术和制药公司近年来经历了重大的股价波动 。如果我们被起诉,可能会导致大量成本,并转移管理层的注意力和资源, 这可能会损害我们的业务。我们为董事和高级管理人员购买了保险,我们认为该保险足以保护我们免受潜在的 索赔;但是,我们有责任满足保单规定的某些免赔额,并且在任何情况下,我们无法向您保证 保险范围将充分保护我们免受索赔。此外,保险成本可能会增加, 承保范围可能会减少。因此,我们可能无法以合理的成本维持目前的保险水平,或根本无法维持。
我们 在如何使用此次发行的收益方面拥有广泛的自由裁量权,可能无法有效地使用这些收益,这可能会影响我们的 运营结果,并导致我们的股价下跌.
我们 可能会以您不同意的方式以及可能不会为您的投资带来回报的方式投资或使用这些收益。我们的 管理层将有相当大的自由裁量权来运用本次发行的净收益,包括用于本招股说明书题为“收益的使用”。然而,随着我们业务和行业的发展,我们的需求可能会发生变化,因此,我们从此次发行中获得的收益可能会以与我们目前的 预期有很大不同的方式使用。我们可以将净收益用于不会为我们的股东带来显著回报或任何回报的目的。 此外,在使用之前,我们可能会以不产生收入或失去 价值的方式投资此次发行的净收益。如果我们的管理层未能有效地使用这些资金,可能会导致财务损失,从而损害我们的业务, 导致我们的普通股价格下跌,并推迟我们候选产品的开发。您将没有机会 作为您的投资决策的一部分来评估净收益是否得到了适当的使用,因此,您将依赖我们管理层的判断。
我们的章程文件和特拉华州法律可能会阻止股东认为有利的收购。
本公司经修订和重述的公司注册证书、经修订和重述的公司章程以及特拉华州法律的适用条款 可能会 延迟或阻碍涉及实际或潜在的控制权变更或管理层变更的交易,包括 股东可能会因其股份获得溢价的交易,或本公司股东可能会认为 符合其最佳利益的交易。我们修订和重述的公司注册证书和修订和重述的章程中的规定:
| ● | 限制可以召开股东大会的人; | |
| ● | 如果没有遵循适当的程序,限制我们的股东向我们的年度股东大会提出事项,或在我们的 年度股东大会上提名董事; | |
| ● | 是否没有规定股东通过书面同意采取行动; | |
| ● | 是否没有规定累积投票权;以及 | |
| ● | 规定所有董事会空缺可由当时在任的大多数董事投赞成票填补,即使不足法定人数。 |
| 32 |
DGCL第 203条可能会限制我们与实益拥有我们已发行 有表决权股票15%或更多的人进行任何业务合并的能力,除非满足某些条件。这一限制在股份收购后持续三年。 这些规定可能会加强我们的管理团队,并可能剥夺您以高于当前价格的溢价将您的股份出售给 潜在收购者的机会。这种可能无法获得控制权溢价的情况可能会降低我们普通股的价格 。
一般风险因素
会计准则的变化以及管理层与复杂会计事项相关的主观假设、估计和判断可能会对我们的财务状况和经营结果的报告产生重大影响。
会计 美国普遍接受的会计原则以及相关的会计声明、实施指南和解释 我们适用于与我们的业务相关的广泛事项,如长期资产减值会计和基于股份的薪酬,这些都是复杂的,涉及我们管理层的主观假设、估计和判断。这些规则或其解释的变化,或我们管理层对基本假设、估计或判断的变化,可能会显著改变我们的报告或预期财务业绩,或使其大幅波动。
如果未能根据《萨班斯-奥克斯利法案》第404条对财务报告进行有效的内部控制,可能会对我们的业务、财务状况和经营结果产生重大不利影响。
我们的管理层负责建立和维护对财务报告的充分内部控制。财务报告内部控制是一个旨在根据美国公认会计原则(GAAP)对财务报告的可靠性和财务报表的编制提供合理保证的过程。根据上市公司会计监督委员会(PCAOB)制定的标准,当控制的设计或操作不允许管理人员或人员在正常履行其指定职能的过程中防止或及时发现错误陈述时,财务报告的内部控制存在缺陷。PCAOB将重大缺陷定义为财务报告内部控制的缺陷或缺陷的组合,因此有合理的可能性年度或中期财务报表的重大错报将不会得到及时防止或发现和纠正。
根据萨班斯-奥克斯利法案第404条,我们 必须为我们向美国证券交易委员会提交的第二份10-K表格年度报告以及此后每年提交一份关于我们财务报告内部控制有效性的报告,其中包括管理层的报告。 我们的审计师还需要在我们是加速申报公司或大型加速申报公司而不再是新兴成长型公司或较小的报告公司时证明我们财务报告内部控制的有效性。如果我们无法 断言我们对财务报告的内部控制是有效的,或者在未来需要时,如果我们的独立注册会计师事务所无法对我们的财务报告内部控制的有效性发表无保留意见, 投资者可能会对我们财务报告的准确性和完整性失去信心,我们普通股的市场价格可能会受到不利影响,我们可能会成为我们普通股上市交易所、美国证券交易委员会或其他监管机构的诉讼或调查对象。这可能需要额外的财务和管理资源,并可能对我们的业务、财务状况和运营结果产生重大不利影响。
| 33 |
我们管理团队有限的上市公司经验可能会对我们遵守美国证券法的报告要求的能力产生不利影响 ,这可能会对我们的业务产生实质性的不利影响。
我们的 官员的上市公司经验有限,这可能会削弱我们遵守法律和监管要求的能力,例如 萨班斯-奥克斯利法案规定的要求。此类责任包括遵守联邦证券法并及时披露所需信息。 任何此类缺陷、弱点或不合规性都可能对我们遵守1934年《证券交易法》或《交易法》的报告要求的能力产生重大不利影响,《交易法》是维持我们的上市公司地位所必需的。如果我们未能履行这些义务,我们继续作为美国上市公司的能力将处于危险之中 ,在这种情况下,您可能会失去对我们公司的全部投资。
我们 发现了我们在财务报告内部控制方面的重大弱点,我们可能会在未来发现其他重大弱点,这些弱点可能会导致我们无法履行报告义务或导致我们的财务报表出现重大错报。 如果我们未能纠正任何重大弱点,或者如果我们未能建立和保持对财务报告的有效控制, 我们准确及时报告财务业绩的能力可能会受到不利影响。
有效的财务报告内部控制对于我们提供可靠的财务报告是必要的,再加上充分的披露 控制和程序旨在防止欺诈。任何未能实施所需的新的或改进的控制措施,或在实施过程中遇到困难,都可能导致我们无法履行我们的报告义务。此外,我们根据《萨班斯-奥克斯利法案》第404条进行的任何测试,或在需要时由我们的独立注册会计师事务所进行的后续测试, 可能会揭示我们在财务报告内部控制方面的缺陷,这些缺陷被认为是重大弱点,或可能需要对我们的财务报表进行 前瞻性或追溯性更改,或确定需要进一步关注或改进的其他领域。劣质的内部控制还可能导致投资者对我们报告的财务信息失去信心,这可能对我们普通股的交易价格产生负面影响 。还有一个风险是,我们和我们的独立注册公共会计师事务所(如果将来适用)都不能在规定的时间范围内得出结论,即财务报告的内部控制 按照第404条的要求有效。因此,投资者可能会对我们的财务和其他公开报告失去信心,这 将损害我们的业务和我们普通股的交易价格。
在编制本招股说明书中包含的财务报表的过程中,我们和我们的独立注册会计师事务所发现了一个重大弱点,因为它与会计职能缺乏充分的分离有关。我们正在实施旨在改善财务报告内部控制并弥补这一重大弱点的措施 。我们打算在我们的会计基础设施内增加人员 ,以促进会计职能的适当分离。
我们 可能在财务报告的内部控制中发现未来的重大弱点,或无法满足上市公司对我们提出的要求,包括萨班斯-奥克斯利法案的要求,我们可能无法准确报告我们的财务 结果,或在法律或证券交易所法规要求的时间范围内报告这些结果。我们不能保证我们现有的材料缺陷将得到补救,或者不会存在或以其他方式发现其他材料缺陷,任何可能对我们的声誉、财务状况和运营结果产生不利影响的情况 。
作为一家向美国证券交易委员会报告的上市公司,我们 已经并将继续大幅增加成本,我们的管理层将被要求投入大量时间来履行合规义务.
作为上市后向美国证券交易委员会报告的上市公司,我们将继续产生重大的法律、会计和其他费用,这是我们作为私人公司没有产生的。我们受《交易所法案》的报告要求、《萨班斯-奥克斯利法案》和《多德-弗兰克华尔街改革与保护法》的报告和治理条款以及美国证券交易委员会随后实施的规则的约束,这些规则对上市公司提出了重大要求,包括要求建立和维持有效的 披露和财务控制,以及改变公司治理做法。这些法律中有重要的公司治理和报告 条款,这将增加我们的法律和财务合规成本,使一些活动更加困难、耗时 或成本高昂,还可能给我们的人员、系统和资源带来不必要的压力。我们的管理层和其他人员将需要投入大量时间来制定这些规定。此外,我们预计这些规章制度将使我们获得董事和高级职员责任保险变得更加困难和更加昂贵,我们可能被要求接受降低的保单限额和承保范围 或产生更高的费用才能获得相同或类似的承保范围。因此,我们可能更难吸引和留住合格的人员加入我们的董事会我们的董事会委员会或担任高管。
| 34 |
不利的 地缘政治和宏观经济发展可能对我们的业务、财务状况或经营业绩产生不利影响。
我们的 业务可能受到美国和全球经济状况、美国和全球金融市场以及 不利的地缘政治和宏观经济发展的不利影响,包括通胀率上升、持续的COVID-19疫情、乌克兰/俄罗斯 和以色列/巴勒斯坦冲突及相关制裁、银行倒闭以及与这些状况相关的经济不确定性。
例如,通货膨胀率(尤其是美国的通货膨胀率)最近已上升至多年未见的水平,通货膨胀的上升 可能导致我们的运营成本(包括劳动力成本)增加、流动性减少,并限制我们获得信贷的能力 或以可接受的条件筹集资本(如果有的话)。为了应对不断上升的通货膨胀,美国联邦储备委员会已经提高了利率, 并可能再次提高利率,再加上政府支出的减少和金融市场的波动,可能会进一步增加经济的不确定性并加剧这些风险。2023年3月Silvergate银行、硅谷银行和Signature 银行以及2023年5月第一共和银行的倒闭,以及对其他银行倒闭的担忧,可能会加剧这些风险。 经济疲软或下滑也可能给我们的供应商和制造商带来压力,可能导致供应中断。上述任何情况都可能损害我们的 业务。
此外,在2022年2月俄罗斯入侵乌克兰和2023年10月以色列/巴勒斯坦冲突爆发后,全球金融市场经历了波动,包括对俄罗斯的经济制裁和出口管制以及俄罗斯采取的反措施。这些制裁和反措施的全面经济和社会影响,加上乌克兰和加沙正在发生的 军事冲突,可以想象,这种冲突可能会扩大,仍然不确定;然而,冲突和相关制裁 已经并可能继续导致欧洲和全球贸易、商业、价格稳定性、信贷可用性和/或供应链 连续性中断,并给全球市场带来了巨大的不确定性。虽然我们目前 不在俄罗斯、乌克兰或中东开展业务,但由于这些冲突的不利影响将继续影响我们的业务, 经营业绩可能会受到不利影响。
| 35 |
有关前瞻性陈述的警示性说明
本招股说明书,包括标题为“招股说明书摘要,” “风险因素,” “使用 的收益,” “管理层对财务状况和经营成果的探讨与分析,“ 和”业务,“包含前瞻性陈述。“相信”、“可能”、“将会”、“可能”、“估计”、“继续”、“预期”、“打算”、“可能”、“将会”、“项目”、“计划”、“预期”以及表达未来事件或结果不确定性的类似表述旨在识别前瞻性表述。这些前瞻性陈述包括但不限于关于以下方面的陈述:
| ● | 我们的 未来的财务和经营业绩; | |
| ● | 我们的 关于我们业务的预期增长、市场渗透和趋势的意图、期望和信念; | |
| ● | 该 我们商业化计划的时机和成功; | |
| ● | 我们的 成功开发和临床测试我们的候选产品的能力; | |
| ● | 我们的 能够获得FDA对我们任何候选产品的批准; | |
| ● | 我们的 能够遵守有关我们候选产品的开发、制造和销售的所有美国和外国法规; | |
| ● | 我们的 依赖第三方生产我们的候选产品; | |
| ● | 本次发行的净收益是否充足; | |
| ● | 市场状况对我们股票价格和经营业绩的影响; | |
| ● | 我们 维护、保护和提高知识产权的能力; | |
| ● | 我们市场竞争加剧的影响和我们有效竞争的能力; | |
| ● | 我们的 计划使用此次发行所得资金; | |
| ● | 与发起和辩护知识产权侵权和其他索赔有关的费用; | |
| ● | 吸引和留住合格的员工和关键人员; | |
| ● | 未来对互补公司或技术的收购或投资;以及 | |
| ● | 我们 遵守不断变化的法律标准和法规的能力,特别是有关上市公司的要求。 |
这些 前瞻性陈述受许多风险、不确定因素和假设的影响,包括“风险因素 “以及在本招股说明书的其他地方。此外,我们的运营环境竞争激烈且瞬息万变, 新的风险不时出现。我们无法预测所有风险,也无法评估所有因素对我们业务的影响,或任何因素或因素组合可能导致实际结果与我们可能做出的任何前瞻性陈述中包含的结果大不相同的程度。鉴于这些风险、不确定性和假设,本招股说明书中讨论的前瞻性事件和 情况可能不会发生,实际结果可能与我们的前瞻性陈述中预期的或暗示的大不相同。
您不应依赖前瞻性陈述作为对未来事件的预测。尽管我们认为前瞻性陈述中反映的预期是合理的,但我们不能保证前瞻性陈述中描述的未来结果、活动水平、业绩或事件 和情况将会实现或发生。此外,我们或任何其他人士均不对前瞻性陈述的准确性和完整性承担责任。除法律要求外,我们没有义务在本招股说明书发布之日后,以任何理由公开更新任何 前瞻性陈述,以使这些陈述符合实际结果或符合我们预期的变化。
您 应阅读本招股说明书以及我们在招股说明书中引用并已向美国证券交易委员会提交的作为注册说明书一部分的文档 ,并了解我们未来的实际业绩、活动水平、业绩以及 事件和情况可能与我们预期的大不相同。
| 36 |
商标、服务标志和商号
我们在美国和/或某些外国司法管辖区拥有或有权使用与我们的业务相关的多个注册商标和普通法商标、服务标记和/或商品名称。
仅为方便起见,本招股说明书中提及的商标、服务标记、徽标和商品名称没有®和™符号,但此类引用并不以任何方式表明,我们不会根据适用的法律在最大程度上主张我们的权利或适用许可人对这些商标、服务标记和商品名称的权利。本招股说明书包含 其他公司的其他商标、服务标志和商号,这些都是其各自所有者的财产。据我们所知,本招股说明书中出现的所有商标、服务标志和商品名称均为其各自所有者的财产。我们不打算 使用或展示其他公司的商标、服务标记、版权或商号来暗示我们与任何其他公司的关系,或由任何其他公司为我们背书或赞助。
| 37 |
使用收益的
我们 估计,在此次发行中,我们发行和出售3,000,000股普通股(和/或预资金权证,以购买最多3,000,000股普通股作为替代)的净收益,按假定的公开发行价 每股2.05美元计算,我们普通股在纽约证券交易所美国交易所于2024年1月18日最后报告的销售价格将为 约5,127,250美元(或5,971,338美元,如果承销商全面行使购买额外股票和/或预资金权证的选择权),扣除预计承销折扣和佣金以及预计应支付的发行费用 。
我们 打算使用本次发行的净收益以及我们现有的现金和现金等价物,如下所示:
| ● | 大约120万美元用于临床试验和产品开发,包括用于ATR-12 Netherton综合征计划的90万美元和用于ATR-04 EGFR抑制剂相关皮疹计划的30万美元; | |
| ● | 约50万美元用于研究和开发,重点是新产品开发; | |
| ● | 约60万美元用于临床制造;以及 | |
| ● | 余额用于其他一般公司用途,包括许可内和合作活动、实验室设施改进、一般和行政费用以及营运资本。 |
根据我们目前的计划和业务状况,我们的 本次发行净收益的预期用途代表了我们目前的意图。 截至本招股说明书日期,我们无法完全肯定地预测本次发行完成后将收到的净收益的所有特定用途 我们将用于上述用途的实际金额。我们相信,可能会不时有机会通过收购或许可补充候选产品来扩展我们当前的业务。虽然 我们目前没有任何特定收购或许可证内的协议或计划,但我们可能会将部分净收益 用于这些目的。
我们实际支出的金额和时间将取决于许多因素,包括我们的临床试验和我们最初候选产品的其他 开发和商业化努力的进展,以及我们运营中使用的现金数量。然而, 我们无法确定地估计将用于上述目的的净收益数额。我们可能会发现将净收益用于其他目的是必要的或 明智的,我们将在净收益的应用方面拥有广泛的自由裁量权。在完成上述用途之前,我们计划将本次发行的净收益投资于短期和中期有息债务、投资级票据、存单或政府的直接或担保债务。
| 38 |
分红政策
我们 从未就我们的普通股宣布或支付任何现金股息,我们预计在可预见的未来不会对我们的普通股 支付任何现金股息。投资者不应期望获得现金股利而购买我们的普通股。本公司未来是否派发普通股股息(如有)由本公司董事会酌情决定,并将视乎本公司的盈利、资本要求及财务状况及其他相关事实而定。我们目前打算保留未来的所有收益(如果有的话),为我们业务的发展和增长提供资金。
| 39 |
大写
下表列出了我们截至2023年9月30日的现金和资本:
| ● | 以实际为基础;以及 | |
| ● | 在扣除承销折扣和佣金以及预计我们应支付的发售费用后,按调整后的基准反映我们在本次发售中以每股2.05美元的假定公开发行价格出售了3,000,000股普通股 ,这是我们在纽约证券交易所美国交易所最后一次报告的普通股销售价格, 没有出售预融资权证。 |
您 应将此表中的信息与我们的财务报表和相关注释一起阅读,并“管理层对财务状况和经营成果的讨论和分析“出现在本招股说明书的其他地方。
| 2023年9月30日 | ||||||||
| (单位:千) | 实际 | 已调整为 | ||||||
| 现金和现金等价物 | $ | 4,400 | $ | 9,527 | ||||
| 普通股,0.0001美元 面值,100,000,000股法定股份,12,097,643股已发行及已发行股份,实际; 15,097,643股已发行股份 和未偿债务, | 1,210 | 1,510 | ||||||
| 额外实收资本 | $ | 51,475 | $ | 56,601 | ||||
| 累计赤字 | $ | (46,144 | ) | $ | (46,144 | ) | ||
| 股东权益总额 | $ | 5,332 | $ | 10,459 | ||||
| 总市值 | $ | 5,332 | $ | 10,459 | ||||
| 40 |
稀释
如果 您在本次发行中投资于我们的普通股,您的权益将被稀释到本次发行中普通股购买者支付的每股金额与本次发行完成后立即调整的每股普通股有形账面净值之间的差额。
截至2023年9月30日,我们的有形账面净值约为530万美元,或每股普通股0.44美元。我们的每股净有形 账面价值是指我们的有形资产总额减去我们的负债总额,再除以 截至2023年9月30日我们已发行普通股的股份总数。
在本次普通股发行中,我们以每股2.05美元的假设公开发行价格(2024年1月18日在纽约证券交易所美国证券交易所最后报告的普通股销售价格,扣除承销 折扣和佣金以及我们应支付的估计发行费用后,并假设没有出售预先融资认股权证,截至2023年9月30日,我们调整后的 净有形账面价值约为1040万美元,或每股 普通股0.69美元。这意味着我们现有 股东的调整后有形账面净值立即增加每股0.25美元,购买本次发行股票的投资者立即稀释每股1.36美元。
下表说明了这种稀释:
| 假定为公共 每股发售价 | $ | 2.05 | ||||||
| 有形账面净值 截至2023年9月30日,在本次发行生效之前, | $ | 0.44 | ||||||
| 增加 每股净有形账面价值归属于新投资者购买本次发行的股票 | $ | 0.25 | ||||||
| 作为 调整后的每股有形账面净值,在本次发行生效后 | $ | 0.69 | ||||||
| 每股摊薄至 购买本次发行股票的新投资者 | $ | 1.36 |
上述表格和计算基于截至2024年1月12日我们已发行的12,097,643股普通股,不包括:
| ● | 1,288,255 行使时可发行的普通股股份 根据我们的2016年计划授予的未行使期权,加权平均行使价为每股1.36美元, 2023年计划; | |
| ● | 约323,736股我们的普通股可在行使已发行认股权证时发行,加权平均行权价为每股4.75美元; | |
| ● | 根据承销商的超额配售选择权,最多可发行450,000股我们的普通股(和/或购买最多450,000股我们的普通股的预筹资金认股权证 ); | |
| ● | 12,000股可在行使认股权证时发行,作为与此次发行相关的补偿的一部分 (如果全部行使超额配售选择权,最多138,000股),行使价为每股2.56美元(本次发行中出售的普通股每股假定公开发行价的125% );以及 | |
| ● | 242,345股我们的普通股为2016年计划下的未来赠款预留,1,960,000股我们的普通股为我们2023年计划下的未来 赠款预留。 |
| 41 |
管理层的讨论和分析
的财务状况和经营结果
您 应阅读以下讨论以及本招股说明书中其他地方包含的财务报表和相关说明。 本讨论包含基于我们当前对业务和运营的预期、估计和预测的前瞻性陈述。 由于许多因素,包括我们在“风险因素”和本招股说明书其他部分讨论的因素,我们的实际结果可能与此类前瞻性陈述中目前预期和表达的结果大不相同。 请参阅标题为“有关前瞻性陈述的告诫说明”一节。
概述
我们 成立于2014年1月,是一家生物制药公司,专注于使用 工程蛋白和活生物素产品开发精密皮肤病的创新疗法。我们已经建立了一个专有平台,其中包括一个微生物库,该微生物库由 约1,500种独特的细菌菌株组成,可以筛选这些菌株的独特治疗特性。该平台通过人工智能和机器学习技术进行了增强 ,该技术可以分析、预测并帮助筛选我们的菌株库中的药物样 分子。该平台还利用了许可的基因工程技术,该技术能够转化以前遗传上难以 处理的菌株。我们是一家早期临床生物制药公司,尚未开始商业运营。
迄今为止,我们主要通过一系列可转换优先股和可转换 承兑票据的私募以及我们于2023年6月21日结束的普通股首次公开募股(IPO)来资本化我们的业务。在我们的首次公开募股中, 我们以每股5美元的公开发行价发行了150万股普通股。在我们IPO结束的同时,我们所有 可转换优先股和可转换承兑票据的流通股转换为总计8,951,526股 普通股。截至2023年11月14日,我们有12,097,643股已发行和流通的普通股。除 另有说明外,本招股说明书中的所有股份及股价均适用于2023年5月17日生效的远期股份拆细,拆细比例为 7.1比1。
运营结果
我们 是一家早期临床生物制药公司,成立于2014年1月,运营历史有限。除了通过与拜耳的JDA获得的有限服务收入外,我们尚未开始 创收业务。根据JDA的条款,我们 负责测试我们的微生物菌株库及其天然产物的关键临床前特性,拜耳将 补偿我们的开发成本。迄今为止,我们的业务包括开发我们的专有微生物库,从我们的微生物库中鉴定、 表征和测试我们认为能够被改造 以提供显著治疗效果的某些细菌物种,以及开发我们的初始候选产品。
| 42 |
截至二零二三年九月三十日止九个月与截至二零二二年九月三十日止九个月比较
| 截至9月30日的9个月, | ||||||||||||||||
| 2023 | 2022 | $ 更改 | % 更改 | |||||||||||||
| 服务 收入相关方 | $ | 596,000 | $ | 253,500 | $ | 342,500 | 135 | % | ||||||||
| 总收入 | 596,000 | 253,500 | 342,500 | 135 | % | |||||||||||
| 运营费用: | ||||||||||||||||
| 一般和行政 | 3,443,559 | 2,583,818 | 859,741 | 33 | % | |||||||||||
| 研发 | 2,188,795 | 4,425,195 | (2,236,400 | ) | (51 | )% | ||||||||||
| 总运营费用 | 5,632,354 | 7,009,013 | (1,376,659 | ) | (20 | )% | ||||||||||
| 运营亏损 | (5,036,354 | ) | (6,755,513 | ) | 1,719,159 | (25 | )% | |||||||||
| 其他收入(支出): | ||||||||||||||||
| 利息收入 | 1,184 | 4,056 | (2,872 | ) | (71 | )% | ||||||||||
| 利息支出 | (166,729 | ) | (66,781 | ) | (99,948 | ) | 150 | % | ||||||||
| 员工留任积分 | - | 229,813 | (229,813 | ) | (100 | )% | ||||||||||
| 宽免应付帐款 | 56,285 | - | 56,285 | 100 | % | |||||||||||
| 可转换票据公允价值变动 | (3,630,100 | ) | - | (3,630,100 | ) | 100 | % | |||||||||
| 其他 费用 | (54,282 | ) | (45,365 | ) | (8,917 | ) | 20 | % | ||||||||
| 其他收入(费用)合计 | (3,793,642 | ) | 121,723 | (3,915,365 | ) | (3,217 | )% | |||||||||
| 净亏损 | (8,829,996 | ) | (6,633,790 | ) | (2,196,206 | ) | 33 | % | ||||||||
| 优先股股息 | (1,355,347 | ) | (2,076,737 | ) | 721,390 | (35 | )% | |||||||||
| 普通股股东应占净亏损 | $ | (10,185,343 | ) | $ | (8,710,527 | ) | $ | (1,474,816 | ) | 17 | % | |||||
服务 收入相关方
在2023财年前9个月,我们在拜耳联合发展协议下产生了596,000美元的服务收入,而在2022财年同期,联合发展协议下的服务收入为253,500美元。服务收入增加342 500美元是由于2023年可报销的开发费用增加。
常规 和管理
2023财年前9个月的一般和行政成本较上一财年增加859,741美元,或33%,达到3,443,559美元 。增加的主要原因是会计、融资、法律和保险成本增加1,167,000美元,但被工资及相关成本和债务发行成本减少381,000美元以及其他间接费用净增加73,741美元所抵销。
研究和开发
研究和开发费用包括所有研究人员的工资和福利、支付给合同研究机构的费用、支付给研究顾问的费用和购买实验室用品的费用。这些支出被政府拨款支付的收入所抵消。 我们通过与各种联邦机构和非营利研究机构签订合同,为我们进行的一般研究创造拨款收入 。这些赠款安排也不符合收入确认的标准,根据这些赠款合同赚取的金额 被记录为负研究和开发费用。
在2023财年的前9个月,研发费用比上一财年减少了2,236,400美元,降幅为51%,降至2,188,795美元。减少的主要原因是,由于我们努力推进Netherton计划,研发相关成本减少了1,547,000美元,工资和相关成本净减少了702,000美元,这是由于裁员 ,以及其他成本净减少12,600美元。在2023财年或2022财年的前九个月,我们没有收到任何政府和非营利性拨款收入。
| 43 |
我们 预计我们的研究和开发费用在未来将大幅增加,这主要是由于我们计划的临床试验活动 和继续开发候选产品。
其他 收入(费用)
我们的 其他收入(费用)包括可退还的研发信用、认股权证估值、债务发行摊销成本、应付账款减免、设备处置损失、外币折算损失、员工留任信用、可转换票据公允价值变动和利息支出。与2022财年同期相比,2023财年前9个月的其他收入(支出) 增加了3,915,365美元,增幅为3217%。这一增长主要是由于可转换票据的公允价值变化导致增加了3,630,100美元,利息支出增加了99,948美元,员工留任信贷增加了229,813美元,应收账款的宽免导致减少了56,285美元,其他收入和支出净增加了11,789美元。
截至2022年12月31日的年度与截至2021年12月31日的年度比较
| 截至12月31日的年度 , | ||||||||||||||||
| 2022 | 2021 | $ 更改 | % 更改 | |||||||||||||
| 与服务收入相关的 方 | $ | 284,000 | $ | 110,000 | $ | 174,000 | 158 | % | ||||||||
| 总收入 | 284,000 | 110,000 | 174,000 | 158 | % | |||||||||||
| 运营费用: | ||||||||||||||||
| 一般和行政 | 3,639,666 | 3,951,352 | (311,686 | ) | (8 | )% | ||||||||||
| 研发 | 6,097,938 | 5,380,102 | 717,836 | 13 | % | |||||||||||
| 总运营费用 | 9,737,604 | 9,331,454 | 406,150 | 5 | % | |||||||||||
| 运营亏损 | (9,453,604 | ) | (9,221,454 | ) | (232,150 | ) | 3 | % | ||||||||
| 其他收入(支出): | ||||||||||||||||
| 利息收入 | 4,818 | 8,759 | (3,941 | ) | (45 | )% | ||||||||||
| 利息支出 | (251,891 | ) | (66,968 | ) | (184,923 | ) | 276 | % | ||||||||
| 其他收入 | 65,849 | 112,141 | (46,292 | ) | (41 | )% | ||||||||||
| 员工留任积分 | 229,813 | – | 229,813 | 100 | % | |||||||||||
| 免除工资单 保障计划贷款 | – | 232,506 | (232,506 | ) | (100 | )% | ||||||||||
| 可转换票据公允价值变动 | (1,250,000 | ) | – | (1,250,000 | ) | 100 | % | |||||||||
| 其他费用 | (25,351 | ) | (4,659 | ) | (20,692 | ) | 444 | % | ||||||||
| 其他收入(费用)合计 | (1,226,762 | ) | 281,779 | (1,508,541 | ) | 734 | % | |||||||||
| 所得税前净亏损 | (10,680,366 | ) | (8,939,675 | ) | (1,740,691 | ) | 19 | % | ||||||||
| 所得税优惠(费用) | – | – | ||||||||||||||
| 净亏损 | $ | (10,680,366 | ) | $ | (8,939,675 | ) | (1,740,691 | ) | 19 | % | ||||||
服务 收入相关方
我们 在2022财年根据拜耳JDA产生了28.4万美元的服务收入,而在 财年根据JDA产生的服务收入为110,000美元。服务收入增加174,000美元是由于2022年可报销的开发成本增加。
| 44 |
常规 和管理
与上一年同期相比,2022财年的一般和行政成本减少了311,686美元,降幅为8%,降至3,639,666美元。减少主要是由于停止支付给前行政总裁及营运总监的离职福利而导致的薪金及相关成本减少961,000美元,以及新行政总裁招聘开支减少,但会计及法律费用增加607,000美元及其他间接费用净增加43,000美元所抵销。
研究和开发
研究和开发费用包括所有研究人员的工资和福利、支付给合同研究机构的费用、支付给研究顾问的费用和购买实验室用品的费用。这些支出被政府拨款支付的收入所抵消。 我们通过与各种联邦机构和非营利研究机构签订合同,为我们进行的一般研究创造拨款收入 。这些赠款安排也不符合收入确认的标准,根据这些赠款合同赚取的金额 被记录为负研究和开发费用。
在2022财年,研发费用比上一财年增加了717,836美元,增幅为13%,达到6,097,938美元。增加的主要原因是研发相关成本增加了808,000美元,这是由于我们努力推进Netherton计划,但由于裁员导致工资和相关成本净减少85,738美元。2022财年和2021财年的研究和开发费用分别由我们收到的4,426美元和202,509美元的政府和非营利性赠款 收入抵消。
我们 预计我们的研究和开发费用在未来将大幅增加,这主要是由于我们计划的临床试验活动 和继续开发候选产品。
其他 收入(费用)
我们的 其他收入(支出)包括可退还的研发信用、员工留任信用、工资保护贷款的免除、认股权证的估值、债务发行成本的摊销、可转换票据的公允价值变化以及2021年1月配售100万美元无担保本票的利息 支出。在2022财年,与2021财年相比,其他收入(支出)增加了1,508,541美元,增幅为734%。这一增长主要是由于可转换票据的公允价值变化增加了1,250,000美元,员工保留信贷增加了229,813美元,利息支出增加了184,923美元,但其他收入和支出净减少156,195美元。
流动性 和财务状况
概述
截至2023年9月30日,我们的总资产为750万美元,营运资本为340万美元。截至2023年9月30日,我们的流动资金包括约440万美元的现金和现金等价物。截至本招股说明书日期,我们预计的营运资金需求 包括用于进一步临床试验和产品开发、研发、临床制造以及其他一般公司用途的资金 ,包括一般和行政费用。见标题为“”的部分收益的使用。”
资金需求
我们 认为,此次发行的净收益,连同我们截至招股说明书日期的手头现金,可能不足以 支付我们至少在此次发行后12个月内的拟议运营计划。我们打算通过各种融资来源寻求更多资金,包括出售我们的股权和债务证券、我们技术的许可费以及与行业合作伙伴的合资企业。此外, 我们将考虑当前业务计划的替代方案,使我们能够以较少的资本实现创收业务和有意义的商业成功。然而,不能保证此类资金将按商业上的合理条款(如果有的话)可用。如果不能以令人满意的条款获得此类融资,我们可能无法继续执行我们的业务计划,也可能无法继续运营。
| 45 |
对于我们通过出售股权或可转换债务证券筹集额外资本的程度,我们普通股股东的所有权权益将被稀释,这些证券的条款可能包括清算或其他优惠,对您作为普通股股东的权利产生不利影响。债务融资和优先股权融资(如果可用)可能涉及的协议包括: 限制或限制我们采取特定行动的能力的契约,例如产生额外债务、进行收购或资本支出或宣布股息。如果我们通过合作、战略联盟或营销、分销或与第三方的许可安排来筹集更多资金,我们可能不得不放弃对我们的技术、未来收入流、研究计划或候选产品的宝贵权利,或者以可能对我们不利的条款授予许可证。如果我们无法在需要时通过股权或债务融资或其他安排筹集更多资金,我们可能需要推迟、限制、减少或终止我们的 研究、产品开发或未来的商业化努力,或者授予我们 本来更愿意自己开发和营销的候选产品的开发和营销权利。
我们的独立注册会计师事务所在截至2023年9月30日的9个月的报告中指出,由于我们累积的运营赤字、经常性现金流和负现金流,我们作为一家持续经营的企业的能力受到极大的怀疑。 我们的财务报表在附注1中包括关于我们是否有能力继续作为一家持续经营的企业的重大怀疑的披露 我们的独立审计师的报告中包括一段关于这一重大怀疑的解释性段落。
合同义务
材料 在正常业务过程中产生的合同义务主要包括经营租赁。有关未来五年内初始或剩余期限超过一年的不可撤销经营租赁的未来最低付款,请参阅我们经审计的财务报表附注15。
现金流
下表显示了我们在所示时期的现金流摘要:
| 截至9月30日的9个月, | ||||||||
| 2023 | 2022 | |||||||
| 用于经营活动的现金净额 | $ | (4,778,962 | ) | $ | (6,176,777 | ) | ||
| 用于投资活动的现金净额 | $ | (258,274 | ) | $ | (239,970 | ) | ||
| 融资活动提供的现金净额 | $ | 5,944,907 | $ | 4,310,807 | ||||
| 现金净增(减) | $ | 907,671 | $ | (2,105,940 | ) | |||
操作 活动。在2023财年的前九个月,运营活动使用了480万美元的现金,这主要是由我们的净亏损880万美元由400万美元的非现金项目抵消的。在2022财年的可比期间,运营活动使用了620万美元的现金,主要是由我们660万美元的净亏损由400,000美元的非现金项目抵消。
投资 活动。在2023财政年度的前9个月,投资活动使用了258,274美元的现金,主要是由23.5万美元的商标和专利费用以及23,000美元的家具和设备采购费用推动的。在2022财年的可比期间,投资活动使用了240,000美元的现金,主要是由221,000美元的商标和专利成本以及19,000美元的家具和设备购买成本推动的。
| 46 |
为 活动提供资金。在2023财年的前九个月,融资活动提供了590万美元的现金,这得益于我们的IPO收益。在2022财年的可比期间,融资活动提供了430万美元的现金,主要由可转换票据的收益 推动。
截至2022年12月31日的年度与截至2021年12月31日的年度比较
| 截至12月31日的年度 , | ||||||||
| 2022 | 2021 | |||||||
| 用于经营活动的现金 | $ | (8,349,469 | ) | $ | (8,067,359 | ) | ||
| 用于投资活动的现金 | $ | (336,761 | ) | $ | (652,275 | ) | ||
| 融资活动提供的现金 | $ | 4,134,624 | $ | 992,862 | ||||
| 现金及现金等价物净减少 | $ | (4,551,606 | ) | $ | (7,726,772 | ) | ||
操作 活动。在截至2022年12月31日的一年中,经营活动使用了830万美元的现金,主要由我们1070万美元的净亏损 被240万美元的非现金项目抵消。在截至2021年12月31日的一年中,经营活动使用了810万美元的现金 ,主要由我们890万美元的净亏损由80万美元的非现金项目抵消。
投资 活动。在截至2022年12月31日的一年中,投资活动使用了33.6万美元的现金,主要是由30.8万美元的商标和专利成本以及0.28亿美元的家具和设备采购费用推动的。在截至2021年12月31日的一年中,投资活动使用了65.2万美元的现金,主要是由20.6万美元的商标和专利成本以及44.6万美元的家具和设备采购成本推动的。
为 活动提供资金。在截至2022年12月31日的年度内,融资活动提供了410万美元的现金,主要是由于发行了440万美元的可转换本票,被30万美元的递延发行成本抵消。在截至2021年12月31日的年度内,融资活动提供了99.3万美元现金,主要由发行100万美元可转换本票推动。
关键会计政策
管理层对我们的财务状况和经营结果的讨论和分析基于我们的财务报表, 这些报表是根据美国公认会计准则编制的。编制这些财务报表需要我们作出估计和判断,以影响我们财务报表中报告的资产、负债和费用金额以及或有资产和负债的披露 。我们持续评估我们的估计和判断,包括与预付/应计研发费用、基于股份的薪酬和可转换本票公允价值有关的估计和判断。我们的估计基于 历史经验、已知趋势和事件以及在当时情况下被认为合理的各种其他因素,这些因素的结果构成了对从其他来源难以看出的资产和负债的账面价值作出判断的基础 。在不同的假设或条件下,实际结果可能与这些估计值不同。
虽然我们的主要会计政策在本招股说明书其他地方的经审核财务报表附注2中有更详细的描述,但我们认为以下会计政策对我们编制财务报表所使用的判断和估计最为关键。
财务报告内部控制
财务报告内部控制是一个旨在为财务报告的可靠性和根据美国公认会计准则编制财务报表提供合理保证的过程。根据上市公司会计监督委员会(PCAOB)建立的标准,当控制的设计或操作 不允许管理层或人员在履行其指定职能的正常过程中及时防止或发现错误陈述 时,财务报告的内部控制存在缺陷。PCAOB将重大缺陷定义为财务报告内部控制的缺陷或缺陷的组合,使得年度或中期财务报表的重大错报有可能无法得到及时防止或发现和纠正。
| 47 |
在编制截至2022年12月31日和2021年12月31日的年度财务报表期间,我们和我们的独立注册会计师事务所 发现了一个重大弱点,因为它与会计职能缺乏足够的分离以及对2021年发行的某些权证缺乏适当的会计处理有关,这些权证是与我们以前发行的但不再未偿还的债务工具相关的。 我们正在实施旨在改善财务报告内部控制和补救这一重大弱点的措施 。我们打算在我们的会计基础设施内增加足够的人员,以促进会计职能的适当分离,并使我们能够适当审查我们内部编制的财务报表。
收入 确认
正如本注册表其他部分所载经审计财务报表附注2所述,根据会计准则 编纂或ASC,606,与客户签订合同的收入,当其客户获得对承诺的 商品或服务的控制权时,实体确认收入,其金额反映该实体预期以该等商品或服务换取的对价。
为了确定确定在ASC606范围内的安排应确认的适当收入金额,我们执行以下五个步骤:(I)确定与客户的合同(S),(Ii)确定合同中承诺的货物或服务,并确定承诺的货物或服务是否为履约义务,(Iii)计量交易价格,(Iv)将交易价格分配给履约义务,以及(V)当(或作为)我们满足每项履约义务时确认收入。我们仅在实体可能收取其有权获得的对价以换取其转让给客户的商品或服务时,才将五步模型应用于合同。
当提供可选商品或服务时,我们评估选项以确定选项是否授予客户物质权利。此 确定包括选项的定价是否为客户在没有签订 合同的情况下不会收到的金额。如果我们得出结论,期权传达了一项实质性权利,它将作为一项单独的履行义务入账。在确定合同中的 履约义务时,我们确定了那些不同的承诺。当客户可以单独或与现成的资源一起从货物或服务中受益,并且货物或服务可与合同中的其他承诺分开识别时,承诺的货物或服务被视为不同的 。如果承诺不明确,则将其与合同中的其他承诺合并,直到合并后的承诺组能够区分。
我们 根据转让合同中承诺的货物或服务预期收到的对价金额来估计交易价格 。对价可以包括固定对价和变动对价。在每个包含可变对价的安排开始时,我们评估潜在付款的金额和收到付款的可能性。 如果很可能不会发生重大收入逆转,则可变对价包括在交易价格中。 对于包括基于许可化合物的基于销售的版税的合同,我们在相关销售发生的日期确认收入。 最后,我们通过分析相对于承诺商品和服务的独立销售价格的承诺对价,以及相对于承诺商品和服务转让的付款时间,来确定合同是否包含重要的融资部分。在每个报告日期,我们重新评估交易价格和履约义务实现的可能性以及对交易价格的相关限制。如有必要,我们会调整交易价格,根据之前受限制的金额的进度记录累计追赶进度。
收入 在(或作为)履行义务控制权转移到客户时确认。当综合履约义务 包含承诺的许可证和相关服务或其他承诺时,需要管理层判断以确定收入确认的适当时间 。为此,我们必须确定合同中的一个或多个主要承诺,以确定收入是在某个时间点确认还是在某个时间确认。如果随着时间的推移,我们必须确定适当的进展衡量标准。如果许可证被认为是履行义务中的主要承诺,我们必须确定许可证的性质,无论是功能性的还是象征性的 知识产权,以得出时间点或长期收入确认最合适的结论。确定功能性 或象征性知识产权需要评估客户是否能够在其当前状态下利用许可证并从中受益,或者许可证的效用是否依赖于我们正在进行的活动或受我们的影响或与我们相关联。
| 48 |
在每个报告日期,我们都会计算一段时间内转移的履约义务的进度。计算一般采用基于迄今发生的费用与估计总费用之比的投入计量,以完成履约义务的转移。
研究和开发费用
研究和开发费用主要包括与我们的候选产品开发相关的成本。我们会按实际发生的费用来支付研发费用。
我们 根据对已完成工作的比例的估计,为我们的供应商执行的临床前研究和临床试验活动计提费用。我们通过审查合同、供应商协议和采购订单,并通过与我们的内部临床人员和外部服务提供商讨论试验或服务的进度或完成阶段以及为此类服务支付的商定费用来确定估计数。然而,临床试验的实际成本和时间是高度不确定的,受到风险的影响,可能会根据包括我们的临床开发计划在内的许多因素而变化。
我们 根据当时已知的事实和情况,在财务报表中对截至每个资产负债表日期的预付/应计费用进行估计。如果服务执行的实际时间或工作水平与估计值不同,我们将相应地调整应计项目。不可退还的商品和服务预付款,包括将在未来研发活动中使用的临床试验费用、工艺开发费用或临床用品的制造和分销费用,将延期 并在相关商品或服务被消费或提供服务期间确认为费用。
基于股份的薪酬
我们 根据授予日基于股票的奖励的估计公允价值来衡量所有基于股票的奖励的薪酬支出。 我们使用Black-Scholes期权定价模型对基于股票的奖励进行估值。我们以直线方式确认所需服务期内的补偿费用 ,这通常是奖励的授权期。我们尚未根据市场或业绩条件颁发奖励,其归属取决于市场或业绩条件。
布莱克-斯科尔斯期权定价模型要求使用包括预期股价波动率和授予日标的普通股公允价值在内的主观假设。有关我们在应用布莱克-斯科尔斯期权定价模型以确定我们授予的奖励的估计公允价值时使用的某些特定假设的信息,请参阅本招股说明书中其他部分包括的我们经审计的财务报表的附注10。
估计普通股的公允价值
在使用布莱克-斯科尔斯期权定价模型进行公允价值计算时,我们 需要估计作为股票奖励基础的普通股的公允价值。由于我们的普通股目前没有公开交易,我们的股票期权相关普通股的公允价值在每个授予日都得到了董事会的批准,管理层也提供了意见。
我们普通股的第三方估值是使用与美国注册会计师协会、审计和会计实务援助系列:作为补偿发布的私人持股公司股权证券估值 一致的方法、方法和假设进行的。此外,我们的董事会考虑了各种客观和主观因素来估计我们普通股的估计公允价值,包括:
| ● | 在公平交易中出售给外部投资者的我们优先股的价格,以及我们优先股相对于我们普通股的权利、优先和特权,包括我们优先股的清算优先; | |
| ● | 每种未偿还证券和预期证券的估计价值; |
| 49 |
| ● | 预期的资本结构,这将直接影响当前已发行证券的价值; | |
| ● | 我们的经营业绩和财务状况; | |
| ● | 我们研究和开发工作的状况; | |
| ● | 我们的管理团队和董事会的组成和变动; | |
| ● | 作为一家私人公司,我们的普通股缺乏流动性; | |
| ● | 我们的发展阶段和业务战略以及与我们的业务和行业相关的重大风险; | |
| ● | 影响生命科学和生物技术行业的外部市场状况; | |
| ● | 美国和全球经济状况; | |
| ● | 该 在当前 市场状况;以及 | |
| ● | 可比公司的市值和波动性。 |
在确定我们普通股的估计公允价值时,我们的董事会考虑了上述主观因素,并结合 由独立第三方编制的我们普通股的最新估值。我们的董事会在确定2017年10月至 2021年12月授予的奖励的普通股的估计公允价值时使用了独立估值专家 。我们的董事会根据这些第三方估值,批准了截至2017年10月的普通股估值为每股3.39美元,截至2019年4月为每股6.58美元,截至2020年9月为每股12.09美元,截至2021年12月为每股11.05美元。
评估权证的公允价值
我们 采用布莱克-斯科尔斯方法在每个报告期对我们的未偿还认股权证进行估值,公允价值的变化在 经营报表中确认。认股权证负债的估计公允价值是使用第3级投入确定的。布莱克-斯科尔斯模型中固有的假设与预期股价波动、预期寿命、无风险利率和股息收益率有关。我们根据市场参与者的假设估计我们普通股的波动率,并与用于评估我们股票期权的波动率相匹配。 无风险利率基于授予日的美国财政部零息收益率曲线,到期日与认股权证的预期剩余期限相似。我们的未清偿认股权证的预期寿命假设与其剩余的合同期限相等。股息率基于历史利率,公司预计历史利率将保持在零。
最近 会计声明
有关适用于我们财务报表的近期会计公告的描述,请参阅本招股章程其他部分的经审核财务报表附注2。
| 50 |
生意场
概述
我们 是一家早期临床生物制药公司,专注于使用工程 蛋白质和局部活性生物治疗产品开发精准皮肤病的创新疗法。我们已经建立了一个专利平台,其中包括一个微生物文库,该文库由大约1,500个独特的细菌菌株组成,可以筛选出独特的治疗特征。该平台得到了 人工智能和机器学习技术的增强,该技术可以分析、预测和帮助筛选我们的菌株库中类似药物的 分子。该平台还利用了一项获得许可的基因工程技术,可以转化以前在基因上难以处理的菌株。我们最初的重点是开发基因工程菌株。表皮葡萄球菌, 或 表皮葡萄球菌,我们认为其是皮肤病学治疗工程的最佳治疗候选物种。 特定种属在皮肤中展示了许多描述良好的特性。截至本招股说明书的日期,我们已经在我们的微生物库中鉴定了 超过60种不同的细菌物种,我们认为这些细菌物种能够被工程化以产生具有显著治疗效果的活生物体 或工程化蛋白质。
我们是基因工程细菌用于皮肤病治疗的先驱。我们的目标是利用我们的平台和内部微生物库细菌菌株来创造新的疗法,这些疗法要么是工程生物,要么是工程蛋白质或多肽,用于治疗皮肤病。我们最初的重点是开发我们目前的候选产品,包括:
| ● | ATR-12, 一个转基因菌株表皮葡萄球菌用于治疗孤儿病,内瑟顿综合征,一种慢性,有时 一种致命的皮肤病,估计每100,000人中约有1 - 9人患病,但其患病率可能被低估 由于与其他皮肤病相似而造成误诊。我们收到了 美国食品和药物管理局,或FDA,在2019年。2022年12月,我们提交了一份研究性新药申请, 或IND,用于在Netherton综合征患者中进行ATR-12的IIb期临床试验,并于2023年1月27日收到通知 FDA表示,关于拟议的1b期临床试验,“研究可能继续进行”。我们已经开始 101 b期临床试验,预计将在2024年第一季度招募第一例患者,并报告初步安全性结果 2024年下半年。 | |
| ● | ATR-04, 一株转基因菌株表皮葡萄球菌用于治疗接受表皮生长因子受体抑制剂或EGFRi靶向治疗的癌症患者出现的丘疹丘疹。我们打算在2024年上半年之前将IND提交给正在接受EGFRi靶向治疗的某些癌症患者进行1b期临床试验。根据FDA对我们IND的批准,我们预计 将于2024年下半年开始我们的1b期临床试验。 | |
| ● | ATR-01, 一种用于治疗寻常型鱼鳞病的工程重组人微丝蛋白,这是一种慢性、干燥性(异常干燥)、鳞状皮肤 疾病,估计发病率和患病率为1/250,这表明美国的总患者人数为130万。我们计划在2024年完成线索优化和IND支持研究,以支持2025年年中的IND申报目标。 | |
| ● | 我们和拜耳消费者护理股份公司(拜耳股份公司的消费品部门)或国际生命科学公司拜耳正在研究和开发两种不同的细菌微生物菌株。我们于2019年12月与拜耳签订了联合开发协议(JDA)。根据JDA的条款,我们负责测试我们的细菌库及其天然 产品的关键临床前特性。在对数百个菌株进行筛选后,我们和拜耳选择了两个特定的菌株 进行进一步开发。拜耳拥有授予这些菌株专利权的独家选择权。 2020年12月,拜耳购买了800万美元的B系列优先股,这些优先股转换为1,449,743股我们的普通股,约占我们普通股流通股的12.0%。 |
| 51 |
我们 还与卡内基梅隆大学和弗雷德·哈钦森癌症中心或弗雷德·哈奇的团队建立了合作伙伴关系,这两个中心是美国两个主要的学术中心。我们与卡内基梅隆大学团队的合作利用了全基因组测序的力量。这一合作伙伴关系正在挖掘我们专有的细菌菌株库,以寻找新的、类似药物的多肽和蛋白质。该团队开发的人工智能/机器学习技术根据微生物的基因序列预测微生物制造的分子。然后,该系统将预测结果与通过串联质谱学和/或核磁共振成像实际做出的产品进行比较,以完善未来的预测。这些预测可以与公开可用的2D和3D蛋白质数据库进行比较,以选择类似药物的结构。
我们 持有Fred Hutch的全球独家许可,允许将其获得专利的SyMPL技术用于基因工程的所有领域,包括发现、开发和商业化皮肤疾病的工程微生物疗法和微生物衍生的多肽和蛋白质 。我们正在利用我们许可的专利权来构建质粒,以便进行以前从未实现过的基因转化。我们与Fred Hutch的合作是由微生物工程专家Christopher Johnston博士领导的,他也是SyMPL技术的创新者。
除了我们的三个主要候选产品和与拜耳的合作之外,我们的目标是开发广泛的候选产品组合, 专注于扩展我们的精确皮肤病平台的应用。我们相信,我们已经在推动精准皮肤病生物制剂的开发方面确立了独特的地位。

我们的 业务战略
我们 打算通过开发从我们的专利微生物库中挑选的约1,500种独特细菌菌株中挑选出来的基因工程 蛋白质,为精密皮肤病创造广泛的候选产品组合。我们的策略如下:
| ● | 打造一家可持续发展的精准皮肤病公司。我们的目标是打造一家领先的精准皮肤病公司,拥有可持续的候选产品流水线。为此,我们专注于快速推进我们目前的生物治疗候选活体管道,同时积极开发更多的候选产品。我们目前的每一款候选产品都是专有产品,都需要申请专利。我们预计,我们开发的大多数(如果不是全部)基因工程产品候选产品将有资格获得专利 保护。 | |
| ● | 推动我们的主要候选产品ATR-12和ATR-04通过临床试验。我们预计将在2024年下半年报告我们的ATR-12在Netherton综合征患者中的1b期临床试验的初步安全性结果,目前 计划在2024年下半年开始我们的ATR-04在接受Ri治疗的某些癌症患者中的1b期试验 。我们已经批准了ATR-12的IND,预计将在2024年上半年提交ATR-04的IND。 |
| 52 |
| ● | 通过有选择地探索战略合作伙伴关系,最大限度地发挥我们精准皮肤病项目的潜力, 拓宽我们的平台。 我们打算保留对我们所有核心技术和候选产品的重要权利。但是,我们将继续评估 战略合作伙伴可以帮助我们加快技术和候选产品开发的合作机会, 提供协同组合的途径,或提供专业知识,使我们能够扩展到不同类型皮肤病的治疗 。我们还可以通过有选择地授权技术或候选产品来扩大我们平台的覆盖范围。此外,我们还将考虑将我们的某些专有技术授权给那些我们自己并不追求的适应症和行业。我们相信,我们的基因工程技术和技术不仅适用于医药领域,包括化妆品,还适用于清洁燃料的产生和生物修复。 | |
| ● | 利用我们的学术合作伙伴关系。我们目前与弗雷德·哈钦森癌症中心、耶鲁大学、杰克逊基因组医学实验室和卡内基梅隆大学的研究人员建立了合作伙伴关系。我们从弗雷德·哈钦森癌症中心获得了DNA技术的独家许可证,这些技术可以对以前在遗传上难以处理的菌株进行基因转化。 我们与卡内基梅隆大学的研究人员合作建立在人工智能和机器学习技术的基础上, 预测由我们图书馆中的微生物制造的类似分子的药物。我们与杰克逊实验室的朱莉娅·吴博士签订了持续的科学顾问委员会合同,并通过赞助小鼠实验的研究协议与杰克逊实验室进行了历史上的合作。我们希望利用这些合作伙伴关系,并有可能扩大它们或形成其他学术合作伙伴关系,以 支持我们的工程平台并扩大我们的研发渠道。 | |
| ● | 经验丰富的管理团队和董事会。我们由我们的首席执行官Francisco D.Salva和我们的联合创始人兼首席运营官Travis Whitill领导,他们在生物技术公司管理和医疗保健投资方面拥有超过35年的经验。萨尔瓦之前是Acerta Pharma的联合创始人,该公司于2016年开始分阶段收购,以约63亿美元的价格出售给阿斯利康。他还致力于Pharmacclics的扭亏为盈,该公司随后在2015年以约210亿美元的价格将 出售给Abbvie。在此之前,萨尔瓦在生命科学风险投资领域工作了近十年。惠特菲尔先生曾担任副研究科学家,目前在耶鲁大学担任助理教授兼职教授,在儿科和急诊医学系任职。作为专注于生物技术的风险投资基金Bios Partners的合伙人,他在风险投资领域工作了近十年。他领导了许多赠款资助的项目,拥有近12项专利,并与人合著了60多份出版物。我们的董事会由生物技术行业的知名高管、科学家和投资者组成。. |
我们的微生物文库和微生物药物传递平台
共生微生物存在于人体表面或粘膜中,不会损害人类健康。它们作用于宿主的免疫系统,以诱导保护性反应,防止感染病原体的侵袭和侵袭,从而在维持人类许多器官系统的健康方面发挥关键作用,特别是在皮肤中。皮肤上分布着各种各样的微生物群落,一平方厘米可以容纳多达十亿个微生物。这些不同的细菌、真菌、螨虫和病毒群落可以提供对疾病的保护,并在皮肤上形成动态而独特的生态位。它们共同构成了皮肤微生物群。
| 53 |
许多由基因驱动的人类疾病在系统上或部分上与特定蛋白质的功能障碍有关,这些蛋白质因突变而缺失或功能惰性。自大约1982年以来,生物制药行业一直在对细菌微生物中的重组蛋白进行基因工程 ,目的是提供模仿或支持人体正常功能的蛋白质和多肽的疗法。几十年来,绝大多数基因工程一直局限于初级大肠杆菌以及少数其他细菌 物种,其中许多可以致病,导致感染。相比之下,我们选择将重点放在表皮葡萄球菌因为它作为一种在皮肤上自然存在的共生微生物具有有益的作用。我们的目标是利用我们的平台和60多种细菌的内部微生物库来设计并通过皮肤角质层将共生皮肤细菌直接输送到目标皮肤。在皮肤的这些更深层次,工程微生物可以产生缺失或惰性的蛋白质,从而解决潜在的疾病原因。
S.和我们的专有微生物文库
表皮葡萄球菌是一种强有力的治疗候选物种,因为皮肤中有许多描述良好的特性。表皮葡萄球菌 是一种革兰氏阳性细菌,普遍存在于人类皮肤和粘膜菌群中。作为最早的皮肤殖民者之一, 表皮葡萄球菌在皮肤免疫和维持微生物群落动态平衡方面起着重要作用。表皮葡萄球菌 已知与宿主有一种有益的皮肤共生关系。该物种对致病菌株 显示出抑制作用,金黄色葡萄球菌,或金黄色葡萄球菌,以及压力痤疮丙酸杆菌,或痤疮假单胞菌. 表皮葡萄球菌 诱导角质形成细胞产生抗菌肽,并通过免疫细胞信号产生CD4+和CD8+T细胞的非炎性T细胞积聚。T细胞反应诱导损伤后皮肤重新上皮化,加速修复和伤口闭合。基于这些原因,我们认为表皮葡萄球菌作为局部递送治疗性蛋白质的载体提供了几个优点。
在他们2019年的研究中,世界领先的皮肤微生物组专家Stacy和Belkaid描述了表皮葡萄球菌作为“皮肤微生物区系的‘海报孩子’,它展示了微生物对皮肤生理和健康所能起到的不同功能。”表皮葡萄球菌具有巨大的菌株多样性,可用于治疗目的。在2020年的ONG研究中,朱莉娅·吴的实验室报告称,1,482株独特的表皮葡萄球菌只出现在五个个体身上。这些菌株不仅具有显著的遗传多样性,而且具有较大的表型多样性。我们相信这种巨大的菌株间差异表皮葡萄球菌可以被利用。为此,我们收集了健康志愿者的样本,以开发和鉴定我们自己的菌株 库表皮葡萄球菌其中包括900多个独特的表皮葡萄球菌具有治疗用途潜力的菌株。我们已经使用这个微生物文库对选定的特性进行了筛选,包括抗菌肽分泌,金黄色葡萄球菌杀伤力、抗生素敏感性和其他与治疗相关的特征。我们还收集了图书馆中的其他物种,其中包括大约60种不同的皮肤共生物种,也可以出于治疗目的进行筛选。
图1.Azitra微生物文库中的代表性物种

| 54 |
我们的微生物文库的预测性分析
生物制药行业在鉴定和分离数千种细菌方面取得了成功。然而,只有相对较少的几个这样的物种,据信不到20个,已经被改造成生产具有治疗潜力的蛋白质或多肽。我们已经与卡内基梅隆大学的研究和开发集团Chia Biosciences,Inc.建立了合作伙伴关系。通过我们与中国生物科学公司的合作,我们能够使用他们专有的基因组和多肽人工智能和机器学习系统NRPMiner, 来开发和确认我们专有的 菌库产生的蛋白质、多肽和小分子的天然产物预测。这些预测通过串联质谱学或核磁共振得到证实。然后将信息反馈给机器学习算法以改进预测。它还可以与现有的2D和3D蛋白质数据库进行比较 ,以查找我们的产品与现有蛋白质和多肽药物的结构同源性。我们相信,我们与卡内基 梅隆大学团队的合作为我们提供了一种可扩展和容忍修改的方法,以加速我们微生物 库中的治疗发现。
我们微生物生产的药物的交付
将基因工程蛋白运送到皮下靶点的过程受到天然屏障和角质层防御的阻碍。这是皮肤最外面的一层,它起到了屏障的作用,防止不需要的物质进入身体。为了应对这一挑战,我们开发了一种专利工艺,能够以一种绕过通常无法穿透的角质层的方式促进蛋白质的输送。该策略利用特定微生物渗透到皮肤更深层的能力。在那里,转基因微生物充当微型工厂,在需要的地方生产治疗性蛋白质或分子。
我们治疗皮肤病的蛋白质输送能力是基于工程技术表皮葡萄球菌和其他微生物分泌蛋白质,将药物输送到皮肤。我们相信,任何数量的蛋白质都可以由我们的细菌进行工程和编码,产生 并输送到皮肤上,以治疗各种皮肤疾病。我们还在其平台中添加了关键的专有功能,以促进蛋白质的交付。该系统的一个关键特征是它绕过了通常无法穿透的皮肤屏障,这是一个局部蛋白质输送的问题。皮肤屏障由角质层组成,由去核的角质形成细胞封闭,并由许多结构、物理和生化特性形成。其他经皮给药挑战是由于蛋白质对酶消化的敏感性,以及疏水表面和组成角质层的相连角质细胞层造成的溶解和扩散障碍。我们通过利用自然归位的表皮葡萄球菌角质层以下的层。 在临床前研究中,我们表明表皮葡萄球菌栖息在角质层下面的几层,将蛋白质输送到更深的表皮。
为了扩展我们的重组蛋白质构建能力,我们获得了专有技术的独家许可,该技术可以伪装我们的基因工程DNA序列,使其能够在以前难以处理的细菌物种中生产蛋白质。弗雷德·哈钦森癌症中心或弗雷德·哈奇的这项技术扩大了可以转基因的细菌物种的范围。它 基于限制修改系统-静默SyMPL工具集。SyMPL技术平台使人造DNA对细菌的防御系统不可见。从理论上讲,这种方法可以应用于任何类型的细菌。我们当前的候选产品未采用SyMPL技术平台,但我们预计未来的部分或全部候选产品将采用此技术平台。
事实上,所有自然产生的细菌菌株都有称为限制修饰系统的防御机制。四种类型的限制修饰系统识别和防御用于编码重组蛋白质的外来DNA的插入。S的功能基因工程。表皮炎(以及金黄色葡萄球菌)以前受到限制,因为在这些细菌物种的几乎所有菌株中都存在I型和IV型限制系统 。这些限制系统识别来自标准克隆扩增系统(例如(E.Coli)并阻碍外来DNA在微生物中的结合。表皮葡萄球菌由于其遗传上的顽固性,曾被认为是一种“不可转化”的菌株。然而,我们已经能够克服S. 表皮‘防御。
目前的基因工程流程添加了特定的修饰来伪装人造DNA,以欺骗细菌认为入侵者 是其自身DNA的一部分。此方法通常需要花费相当多的时间和资源来尝试将正确的伪装与每个特定的识别主题相匹配。相比之下,Fred Hutch的SyMPL技术平台是一种系统化的“工程隐身”方法 ,以克服限制修改防御系统。这些限制修饰防御系统保护微生物免受外来DNA的影响,并阻碍绝大多数基因工程方法。SyMPL技术平台基于构建微环DNA质粒的能力,这些DNA质粒缺乏任何目标识别基序,供微生物的防御系统识别。该技术使用目标细菌基因组序列中的基因组和甲基组来识别限制酶修饰的目标基序。然后将它们从遗传工具的核苷酸序列中消除硅片。生成的序列用于构建限制 修改、SyMPL工具。这些基因被繁殖,然后用于基因转化。“通过工程进行隐形” 方法不仅能够在遗传上难以处理的细菌菌株中进行转化,而且它还被证明能够显著提高转化效率。原则性实验证明,转基因菌落的产量提高了10,000倍以上。
| 55 |
2022年1月,Fred Hutch向我们授予了SyMPL技术平台在所有使用领域的全球独家专利权和非独家全球专利权使用费许可。有关根据弗雷德·哈奇许可协议获得的知识产权的更多信息,请参阅标题为“营业执照和知识产权.”
我们的 候选产品
ATR-12治疗Netherton综合征
ATR-12是我们的专利和正在申请专利的候选药物,它包含一种新的菌株表皮葡萄球菌该基因经过基因修饰,可以表达和分泌全长蛋白质的活性片段,称为淋巴上皮型Kazal相关抑制物,或Lekti。它还被设计成营养缺陷型,这意味着它需要配方中的D-丙氨酸营养才能存活和繁殖。这提供了额外的安全级别,防止潜在的系统性感染。ATR-12是一种局部应用,旨在通过用人重组lekti的活性片段 或rhLEKTI-D6替换缺陷的lekti来解决Netherton综合征的根本原因,以对抗在Netherton综合征患者中观察到的皮肤丝氨酸蛋白酶活性失调。丝氨酸蛋白酶活性失控导致严重的皮肤屏障缺陷,并导致角质形成细胞和免疫细胞释放促炎和促过敏介质。截至本招股说明书发布之日,还没有治愈或有效治疗Netherton综合征的已知疗法。 我们相信ATR-12有可能成为第一种有效治疗这种皮肤病的疗法。根据Barbati和Sun的研究,我们认为ATR-12代表着到2030年年中潜在的2.5亿美元的全球销售机会。
Netherton 综合征概述
Netherton综合征是一种罕见的常染色体隐性遗传病,估计每200,000人中就有一人患病,但由于误诊,其患病率可能被低估了。这是一种慢性皮肤疾病,以严重的炎症、瘙痒、鳞屑、红肿和脱水为特征。出生时患有Netherton综合征的婴儿可能会遭受发育不良的痛苦,据报道,大约十分之一的Netherton综合征婴儿在出生后的第一年死亡。那些幸存下来的人一生都面临着皮肤病的挑战,包括红色、鳞片状皮肤、头发缺陷以及持续高于正常水平的感染和过敏风险。
Netherton综合征是由基因突变引起的Spink5基因,它编码淋巴上皮型Kazal相关抑制物,或lekti。LEKTI的功能是抑制表皮中的酶,如激肽释放酶5、7和14,或KLK5、KLK7和KLK14,它们促进皮肤细胞在一个称为脱皮的过程中脱落。当Lekti缺失或活动减少时,会导致皮肤过度脱皮,皮肤敏感、开放,并出现红色和鳞片。伴随而来的是角质层的脱离,导致严重的屏障功能障碍、脱水和潜在的环境因素,如化学物质。与健康志愿者相比,Netherton综合征患者的皮肤组织病理学和免疫荧光染色显示皮肤中没有Lekti和异常,如角化过度、表皮增厚和嗜碱性角化透明质颗粒减少。
| 56 |

图2:Netherton综合征的病理生理学和LETKI缺乏症
Netherton综合症的严重程度从轻微的皮肤红斑到危及生命不等。疾病的严重程度与皮肤上LEKTI功能丧失的程度直接相关。Netherton综合征在出生后不久出现,在婴儿出生的第一年最为严重。在大多数情况下,第一年以上的存活是常见的,但这种疾病的影响是一个终生的挑战。
截至本招股说明书发布之日,Netherton综合征尚无已知的治愈方法,治疗选择也有限。治疗Netherton综合征严重皮肤症状的皮肤科干预措施 包括保湿霜、外用皮质类固醇和钙调神经磷酸酶抑制剂, 所有这些都是有限的,因为它们不能提供持续的补救措施。鉴于新生儿期疾病的严重性,除了治疗这些患者经常发生的感染外,还需要液体/电解质和饮食支持。虽然针对Netherton综合征相关免疫缺陷的免疫球蛋白治疗显示出有限的成功,但目前尚不能持续修复因lekti调节失调而导致的皮肤屏障缺陷。
我们的解决方案-ATR-12用于治疗Netherton综合征
ATR-12是一种外用软膏,含有表皮葡萄球菌菌株SE351,已经经过基因改造,表达了来自 染色体的lekti。SE351菌株还被设计成对D-丙氨酸具有营养缺陷性,这意味着如果没有配方中提供的外源D-丙氨酸营养,它就不能生存。ATR-12旨在通过将缺乏/功能失调的lekti替换为具有活性的重组人全长蛋白片段rhLEKTI-D6来解决Netherton综合征的根本原因。治疗包括将ATR-12应用于受影响的地区。由SE351生产的rhLEKTI-D6将对抗Netherton综合征患者观察到的皮肤丝氨酸蛋白酶活性失调,恢复皮肤屏障功能,减少炎症。我们认为,这种方法的重要优点之一是,随着时间的推移,有可能将rhLEKTI-D6输送到角质层和表皮的下层,这是Netherton综合征患者调节失调的主要部位。
表皮葡萄球菌SE351是从我们的专利菌株库中挑选出来的将重组人LEKTI-D6运送到皮肤上的菌株。 该菌株的特点是毒力低,是一种不形成生物膜的宿主菌株。为了进一步提高ATR-12的安全性,我们已经对D-丙氨酸的微生物进行了改造,使其具有营养缺陷性。工程营养缺陷症的关键优势是能够控制生长和阻止潜在的感染。全长人类LETKI是一种15个结构域的蛋白质(145 KDa),太大了,无法可靠地在细菌中表达和分泌。有证据表明,全长蛋白片段足以对抗Netherton综合征患者观察到的失调的皮肤丝氨酸蛋白酶活性,我们选择D6在表皮葡萄球菌.
| 57 |
在2020年5月,我们从FDA获得了ATR-12的罕见儿科疾病称号。因此,如果我们能够在儿科方面获得FDA对ATR-12的批准,我们将有资格收到优先审查凭证,我们可以使用该凭证在六个月的加速期内获得FDA对此或其他候选药物的新药申请或生物制品许可证申请的审查 。这些 代金券通常可以转让,有些代金券的售价已超过1亿美元。
ATR-12的临床前 数据
截至本招股说明书发布之日,我们已经进行了几次体内和离体共同支持ATR-12作为Netherton综合征患者疾病修正疗法的潜在疗效的实验。在配方ATR-12药物产品中使用的基因工程表皮葡萄球菌菌株被称为SE351。2021年,我们进行了体外培养研究评估外源应用SE351定植无菌重建人类表皮的能力。SE351成功地在重建的人表皮上定植,而且,没有表皮葡萄球菌在没有D-丙氨酸的情况下发生了定植,证实了必须提供D-丙氨酸才能使SE351在皮肤上生长。这些数据表明,SE351能够在人体皮肤上定植,并且可以通过补充D-丙氨酸来控制定植。
此外, 体外培养使用添加了KLK5的健康志愿者的胶带剥离皮肤来模拟Netherton综合征的研究表明,稀释的SE351培养上清液可剂量依赖性地抑制胰蛋白酶样活性(KLK5活性)。当加入含有≥0.5%的SE351培养上清液时,Netherton综合征代谢物中的胰酶样活性恢复到正常健康水平。

图 3:离体人皮带提取液辅以病级KLK5活性建立Netherton综合征模型
在 此外,来自离体猪皮肤模型显示,单次局部注射3个剂量水平的ATR-12可导致活性rhLEKTI-D6分泌 。最后,来自离体健康人体皮肤模型显示,单次局部剂量的ATR-12最大预期剂量为109Cfu/g可将足够活性的rhLEKTI-D6送入角质层的下层,有效地抑制激肽释放酶5(KLK5),达到Netherton综合征患者的典型水平。
具体地说,来自离体健康的人体皮肤模型显示,单次局部注射ATR-12的最大预期剂量为109每克集落形成单位(CFU/g)可将足够活性的rhLEKTI-D6送入角质层的下层 ,有效抑制KLK5,达到Netherton综合征患者的典型水平。提取层中Lekti 活度的量来自于离体用安慰剂和ATR-12治疗的人皮肤。在皮肤涂抹(T=0小时,白条)或30°C孵化8小时(T=8小时,黑条)后立即进行采集。通过安慰剂(灰条)或ATR-12(黑条)样品的第1至30层添加pmol量,得到总的lekti活性水平。 数据是3个独立样品(N=3)的平均±a标准偏差(SD)。统计分析采用 双因素方差分析,**代表p
| 58 |

图 4:安慰剂和ATR-12处理的皮肤样品在孵育0和8小时后的LETKI活性
此外,单次治疗剂量的ATR-12在24小时的孵育中产生的LEKTI活性是8小时孵育的~2倍。 这表明随着时间的推移,ATR-12持续产生功能性的重组人LEKTI-D6。

图5:24小时孵育后安慰剂和ATR-12处理的皮肤样本中的LETKI活性
在试管中Azitra进行的化学计量学研究表明,KLK5需要在rhLEKTI-D6蛋白上有2个摩尔当量的抑制 (IC测量50)。历史研究表明,Netherton综合征患者的KLK5含量是正常皮肤的~6倍。这相当于每一特定区域60 pmoL的KLK5。以上研究表明,SE351在8小时内释放了350 pmol的重组人LEKTI-D6,在24小时内释放了700 pmol的重组人LEKTI-D6。这比预计的活动所需金额高出5至11倍。
| 59 |

图 6:离体抑制KLK5的LEKTI-D6的化学计量比
在2022年,我们获得了与FDA的IND前通信,目的是讨论我们建议的ATR-12监管途径,并从FDA获得导致提交和接受ATR-12的IND申请的临床前计划指导。2022年12月,我们提交了一份IND申请,对Netherton综合征患者进行ATR-12的首次人体试验。我们IND建议对Netherton综合征患者的ATR-12进行1b期多中心、随机、双盲、单剂量水平的安慰剂对照临床研究。主要终点 是安全性,次要终点将包括疗效和药代动力学信号。探索性终点包括免疫和炎症机制生物标记物。2023年1月27日,我们收到FDA的通知,关于拟议的1b期临床试验的研究可能会继续进行,初步安全结果预计在2024年下半年。
ATR-04用于治疗EGFRi相关性皮疹
ATR-04是我们的专利和正在申请专利的候选药物,它包含一种新的菌株表皮葡萄球菌,SE484,经基因改造为营养缺陷型D-丙氨酸。ATR-04是一种局部应用,旨在解决接受表皮生长因子受体抑制剂(EGFRi)靶向治疗的癌症患者所经历的丘疹/丘疹。我们相信,这款候选产品 代表着2030年前10亿美元的潜在全球销售机会。
EGFRi-关联的 皮疹概述
靶向癌症疗法为诊断为各种肿瘤类型的患者带来了显著的治疗进展,但它们也与独特的皮肤病毒性有关,这些毒性可能会阻碍治疗努力,并给患者造成严重的身体和心理不适 。预防和处理这些毒性可能会使患者更好地耐受治疗,延长治疗时间,从而有可能从药物中获得最大的临床益处。其中一类靶向癌症治疗包括EGFR抑制剂。EGFR是细胞表面的一种蛋白质,有助于细胞生长和分裂。它也是某些恶性肿瘤的关键因素,它的活性促进了肿瘤的生长、侵袭和转移。全身暴露于EGFRi制剂会抑制靶肿瘤部位的EGFR,同时也会抑制全身的EGFR。在皮肤中,EGFR调节多种角质形成细胞的功能,包括增殖、黏附、迁移、存活和分化。因此,抑制皮肤中的EGFR会导致不良皮肤反应,这使得患者很难坚持这些有效的治疗方法。
皮肤病毒性是EGFRi靶向治疗中最常见的副作用之一。丘疹是EGFRi治疗中最早也是最常见的皮肤科不良事件,通常发生在50%-80%的患者中,具体取决于药物、正在治疗的癌症和治疗方案。丘疹皮疹的出现是一种剂量依赖的皮肤药物反应,通常在最初的一到两周内出现,在治疗后三到四周达到高峰。皮疹的强度可能在两周后开始减轻,但可以在EGFRi治疗的整个过程中持续。皮疹的临床特征是细嫩的红斑丘疹,几天后演变为脓疱疹,然后在面部、头皮、胸部和上背部形成结痂。皮疹通常伴有严重的干燥症,有时还会出现严重的皮肤细菌感染,主要是金黄色葡萄球菌。虽然大多数皮疹被认为是轻度到中度,但也有一些是严重的。在许多情况下,皮疹会导致严重的生活质量问题,甚至可能导致EGFRi治疗中断或停止.
| 60 |
目前接受EGFRi治疗的患者的皮疹治疗标准因皮疹的严重程度而异。通常,皮肤保湿剂、局部类固醇和多西环素从EGFRi治疗开始就预防性使用,并在整个治疗期内持续使用。如果皮疹继续发展,就需要口服类固醇和/或抗生素。然而,已知有与这些辅助疗法相关的全身不良反应,我们认为医生和患者试图 限制其使用。此外,研究表明,口服抗生素会导致肠道微生物群的破坏,进而导致靶向治疗的有效性降低,包括EGFRi。鉴于这些患者持续出现皮疹的高发病率,以及与抗生素对这些治疗的潜在影响相关的担忧,我们认为显然存在着对额外安全有效的辅助治疗的医疗需求,以解决丘疹-丘疹皮疹。
基于佐藤和利希滕贝格进行的研究,细胞因子,白介素36伽马,或白介素36γ,以及金黄色葡萄球菌与接受EGFR治疗的患者所经历的皮疹相关,并在其中发挥重要作用。IL-36γ在接受EGFR i治疗的患者皮肤中升高。2020年,Satoh使用基因表达谱确定IL-36γ是EGFRi/MEKi皮肤毒性的候选驱动因素。它由EGFR抑制诱导, 痤疮皮肤杆菌协同诱导皮肤中的IL-36γ,随后诱导IL-8和NF-κB,导致皮肤嗜中性粒细胞。IL-36γ可能是治疗EGFRi诱导的皮疹的关键治疗靶点。2013年,Lichtenberger注意到EGFRi治疗患者(n=107)的细菌感染率较高(70%),并提出了EGFR消融导致 金黄色葡萄球菌-在小鼠中诱导感染。该研究指出,大多数患者的 金黄色葡萄球菌(54%).从机制上讲,作者注意到EGFRi治疗损害宿主防御:抗微生物肽的表达受损,特别是抗 金黄色葡萄球菌以及紧密连接的表达降低。此外,该研究显示EGFR消融导致皮肤屏障缺陷以及受损的皮肤免疫应答和细胞因子表达。
我们的解决方案-ATR-04用于治疗EGFRi相关性皮疹
ATR-04是我们用于治疗EGFRi相关皮疹的配方候选药物产品。它包括一种新的营养缺陷型菌株表皮葡萄球菌从我们的微生物菌种库中选择的菌株,基于所需的IL-36γ还原特性和抑制金黄色葡萄球菌以及它的生物膜。目前的铅菌株被称为SE484。然后,我们将SE484进行基因工程,使其成为营养缺乏型D-丙氨酸,并创造出我们的候选药物产品ATR-04。
从我们的微生物文库中选择SE484是基于关键特性,如对IL-36γ的抑制以及对S 金色。总之,我们预计这些作用机制将显著降低接受EGFRi治疗的患者的皮疹严重程度。
我们 相信ATR-04有可能解决目前治疗EGFRi相关皮疹的局限性:
| ● | 减少了抗生素的使用。从我们对临床医生和主要意见领袖的调查来看,从业者不愿给接受EGFRi治疗的患者开全身抗生素 。这些患者通常可以服用抗生素超过12个月,并遭受与抗生素相关的不良事件。我们相信ATR-04将减少这些患者对抗生素的需求,并由于EGFRi和抗生素的使用而导致较少的不良事件。 | |
| ● | 改善了 EGFRi合规性。高达20%的接受EGFRi治疗的患者因不良事件(主要是皮疹)而停止治疗。 我们相信我们可以降低接受EGFRi治疗的患者的停用率,从而提高依从性。 | |
| ● | 更高的生活质量。许多接受EGFRi治疗的患者报告称,由于不良事件和丘疹皮疹,患者的生活质量较差。 目前的治疗方案无法充分减少这些不良事件。我们相信,接受EGFRi治疗的患者接受ATR-04治疗将降低皮疹严重程度,从而提高生活质量。 |
| 61 |
ATR-04的临床前数据
我们根据安全性(例如,缺乏抗生素耐药性)和生物活性(例如,IL-36γ抑制和活性与金黄色葡萄球菌),并指定SE484为我们的主要候选菌株。在将该菌株设计为D-丙氨酸的营养缺陷型菌株后,我们提名该候选菌株作为ATR-04药物产品配方中的活性微生物。
EGFR相关皮疹是一种以皮肤发红、瘙痒和刺激为特征的疾病,由某些癌症治疗引起。 基因表达谱(Satoh Et Al 2020)显示,与健康捐赠者的皮肤相比,EGFR相关皮疹患者的皮肤活检样本中细胞因子IL-36γ(IL-36γ)和IL-8水平升高。这些是促炎细胞因子,是免疫系统的信号分子,可增加免疫反应的强度,并可能导致组织损伤。 除了细胞因子水平升高外,接受EGFRi治疗的患者还会损害皮肤屏障功能。感染致病菌株 金黄色葡萄球菌加重EGFRi诱导的皮肤病。
我们的工作重点是确定一个表皮葡萄球菌菌株,一种皮肤共生体,可降低IL-36γ水平,从而减少与EGFRi相关的皮疹。我们推测,许多生活在人类皮肤上的细菌物种可能在那里生存下来,因为它们已经进化出减少人类免疫系统对它们存在的反应的方法,我们或许能够识别出一种存活下来的人类皮肤共生细菌,从而特别地降低IL-36γ的活性。
要 确定这样的表皮葡萄球菌菌株,我们开发了一种体外培养检测培养的人皮肤细胞产生IL-36、γ和IL-8的水平。我们使用的细胞系被称为HaCaT,它来自人类角质形成细胞,角质形成细胞是表皮中的一种细胞类型。为了模拟表皮生长因子受体相关疾病皮肤的炎症表型,用免疫刺激剂多肌苷:多胞苷或多聚I:C刺激HaCaT细胞,使其分泌高水平的IL-36γ和IL-8。本试验用来鉴定和评价不同菌株的能力。表皮葡萄球菌可降低IL-36γ和IL-8水平。
我们根据安全性(例如,缺乏抗生素耐药性)和生物活性(IL-36γ抑制和抗病毒活性)筛选了100多个菌株金黄色葡萄球菌),并指定SE484为我们的主要候选菌株。在将该菌株改造成对D-丙氨酸具有营养缺陷型 ,以便只有在提供D-丙氨酸的情况下才能生长之后,我们还消除了一个抗生物质抗性基因。然后,我们提名该候选微生物作为ATR-04药品配方中的活性微生物。
为了在类皮肤模型上测试SE484降低IL-36γ的能力,使用厄洛替尼诱导重建的人表皮分泌IL-36γ。同时应用SE484和厄洛替尼可将IL-36γ降低到与未用厄洛替尼治疗的相似的水平,这表明SE484作用于皮肤模型以减少这种促炎细胞因子。图7显示了两个测试SE484降低IL-36γ的实验结果。在图7A中,将来自SE484培养物的无细胞上清液(CFs)应用于RHE,而在图7B中,将SE484的活细胞(1x108CFU或1x109CFU),检测SE484降低IL-36γ的能力。在这两种情况下,无细胞培养上清液或SE484细胞,厄洛替尼诱导的IL-36γ 水平均降低。
| 62 |

图7.SE484对RHE的抗IL-36G活性将重建的人表皮或RHE单独用1 mM厄洛替尼处理72小时,或用来自SE484培养(A)的无细胞培养上清(CFs)处理,或用约10 mM厄洛替尼处理72小时。8或109SE484(B)的CFU。用酶联免疫吸附试验检测培养上清液中IL-36γ水平。

图8.Poly I:C诱导的IL-8被SE484的CS降低。来自SE484的培养基可阻止聚I:C(红色箭头)对IL-8的刺激和释放。使用Poly I:C的抑制剂作为对照(蓝色箭头)。数据代表两个独立的 实验。CS=培养上清液。
图8显示了SE484培养上清对PolyI:C诱导的IL-8的抑制作用,与IL-36γ相似,当PolyI:C 加入HaCaT细胞时,IL-8也被分泌,比本底高出数倍(如未处理的HaCaT和经SE484处理的HaCaT所见)。然而,在SE484存在的情况下,检测到较低水平的IL-8,从而进一步证明了SE484抑制参与EGFRi相关皮疹的促炎 途径的有效性。
| 63 |
我们的 结果显示表皮葡萄球菌菌株从健康人志愿者中分离得到的SE484可以降低HaCaT细胞产生的IL-36γ和IL-8的水平(分别见图7和图8),从而有助于治疗EGFRi-相关皮疹。除了抗IL-36γ特性外,SE484对不同的甲氧西林耐药株也具有广泛的活性S 金色,或MRSA,菌株类型以及对甲氧西林敏感金黄色葡萄球菌,或MSSA。SE484降低IL-36γ/IL-8水平及其抗肿瘤活性的研究金黄色葡萄球菌经过改造的D-丙氨酸营养缺陷症使我们能够提名菌株SE484作为ATR-04药物产品配方中的活性微生物,以形成治疗的基础并降低EGFRi皮疹的严重程度。
我们 还表明,SE484可帮助体外培养抑制对甲氧西林耐药的已知毒力菌株USA300和对甲氧西林敏感的MSSA。以下数据表明,ATR-04降低了致病能力金黄色葡萄球菌细菌 种,用于生长和引发EGFRi皮疹患者的感染。

图9.表达Epidermin的SE484杀死金黄色葡萄球菌在体外琼脂平板上具有与莫匹罗星相似的活性。
我们 建议对ATR-04配方中的SE484进行初步研究。预计这将是一项1b期多中心、随机、 双盲、单剂量、安慰剂对照试验,适用于正在开始EGFRi治疗的结直肠癌或头颈部癌症患者。 主要终点是安全性,次要终点将包括疗效和生活质量,或QOL我们计划在2024年上半年提交 IND。如果FDA批准了我们的IND,我们预计将在2024年下半年开始我们的1b期临床试验。
ATR-01治疗寻常型鱼鳞病
ATR-01是我们用于治疗寻常型鱼鳞病的候选药物。该项目目前正在研究人类微丝蛋白的专利和正在申请专利的新型工程片段。ATR-01正在开发为一种局部应用,旨在治疗寻常型鱼鳞病,这是一种慢性鳞状皮肤病,估计发病率和患病率为1/250,使美国的患者总数达到130万人。寻常型鱼鳞病是由编码微丝蛋白的基因功能缺失突变引起的。利用蛋白质工程的合成生物学工具,我们在微丝蛋白上附加了一种细胞穿透肽,这有助于更深层次地将微丝蛋白输送到皮肤。这是为了克服皮肤屏障的不可穿透性,否则会限制局部蛋白质的传递。
寻常型鱼鳞病概述
寻常型鱼鳞病,或IV,是一种慢性、干燥性、鳞片状皮肤病,估计发病率和患病率为1/250,这使得美国的患者总数达到130万人。IV的临床特征通常出现在2个月左右,包括全身干燥和腹部、胸部和四肢伸肌表面突出的细小、白色到灰色的鳞片。 虽然罕见,但一些IV患者也会出现汗量减少和热耐受。长期以来,IV的发病机制一直被认为是表皮角质透明质颗粒的减少或数量减少,甚至完全不存在。此外,IV患者患特应性皮炎、哮喘和过敏的风险增加。
| 64 |
寻常型鱼鳞病是一种常染色体半显性遗传病,由编码微丝蛋白的基因功能缺失突变引起。微丝蛋白是一种必需的结构蛋白,来源于蛋白原蛋白,它在角质层分解成单独的微丝蛋白单位。这些 通过与角质形成细胞细胞骨架中的角蛋白和其他中间丝蛋白结合来增强皮肤屏障。许多研究 已经发现了功能丧失突变外挂在IV患者中,这些突变与角蛋白细丝紊乱、皮肤屏障缺陷和角质层微骨折相关,从而导致经皮变应原增敏。此外,丝状蛋白及其分解产物在皮肤中还具有显著的附加功能,包括滋润皮肤(通过吸湿性氨基酸或“天然保湿因子”),影响抗菌分子的产生(特别是针对S 金色)和保持有益的脂类分布和皮肤的PH值。
治疗IV几乎没有有效的疗法。目前IV的治疗选择主要包括局部水分蒸发抑制剂 (例如氯化钠、尿素、乳酸、水杨酸),以及少量的保湿剂(例如甘油、丙二醇)。也可以使用局部维甲酸来减缓人体皮肤细胞的产生。然而,长期使用维甲酸并不理想。特别令人担忧的是所有维甲酸的致畸作用,这限制了它们在有生育潜力的妇女中的使用。长期使用维甲酸治疗的慢性毒性可能会导致骨骼异常。此外,儿童长期使用维甲酸可能会抑制他们的生长。值得注意的是,许多IV患者由于自我意识和社交尴尬而显著降低了生活质量,并对家庭生活、教育/职业生活甚至休闲/体育活动产生了负面影响。
我们治疗寻常型鱼鳞病的解决方案-ATR-01
现已知,IV是由编码微丝蛋白的基因功能丧失突变引起的,导致角蛋白细丝组织紊乱、皮肤屏障缺陷和角质层微骨折,以及细菌和病毒皮肤感染导致经皮变应原增敏。我们正在开发ATR-01作为IV的一种新的治疗方式,直接针对这种疾病的病理生理学。ATR-01由人Flg蛋白的Flg9-10功能单位和一个附着的细胞穿透肽组成。目标 是通过局部涂抹和通过细胞穿透肽更深入地渗透皮肤来补充hFlg的稳定释放。
ATR-01的临床前 数据
人类Flg单位(结构域9-10)在人体皮肤外植体(来自整形手术)上进行了评估离体。外植体的皮肤屏障被反复剥离胶带破坏,导致经皮水分损失或TEWL值较正常皮肤显著增加。如下例所示,每天局部应用含有细胞穿透肽的人微丝蛋白单元5天后,TEWL迅速改善,呈剂量依赖性(未显示),提示皮肤屏障得到改善。因此,局部注射重组hFLG单位和细胞穿透肽可以改善/加速受损的人皮肤屏障的修复。
| 65 |

图 10:剥离的磁带上的局部微丝胶合应用离体使用人类微丝凝聚蛋白后的人体皮肤。
最后, 我们已经证明,外用微丝蛋白可以改善微丝蛋白缺陷小鼠模型的皮肤屏障缺陷。将重组小鼠微丝蛋白,或mFlg,应用于片状尾巴或FT小鼠的尾部(一种在细丝研磨基因),每天一次,持续2周(50微克总蛋白质/尾部或15.2微克总蛋白质/厘米2)。与赋形剂(“基线”组)相比,每日服用mFlg显著改善了FT小鼠在治疗时的经皮水分损失(FT+Flg组)。X轴上的第三个 组是正常、对照、野生型组(WT),它没有细丝研磨吉恩被击倒了。重组mFlg联合细胞穿透肽处理受损小鼠皮肤可改善受损小鼠皮肤屏障(见下图A)。此外,对小鼠尾部切片的表皮的组织学分析显示,使用mFlg处理有改善角质层厚度的趋势(见下图B)。在这张图中,Y轴表示角质层增厚,角质层在超过正常厚度后开始分裂或结垢。用mFlg治疗后,6个样本中有4个样本的厚度有所改善。

| 66 |
其他 个潜在候选产品
除了我们的三个主要候选产品外,我们的目标是开发广泛的候选产品组合,专注于扩大我们的精确皮肤病平台的应用 。我们拥有发现和开发精准皮肤病治疗产品的专有平台。我们的平台围绕由大约1,500个独特的细菌菌株组成的微生物文库构建,以筛选独特的治疗特性,并利用微生物基因技术来分析、预测和设计皮肤微生物产生的蛋白质、多肽和分子。通过SyMPL技术的独家许可,我们对难处理的微生物物种进行基因工程的能力得到了独一无二的利用。
拜耳 联合开发协议
2019年12月,我们与拜耳签订了联合开发协议(JDA),根据该协议,我们同意联合开发从我们的专有微生物文库中挑选出来的某些菌株。我们和拜耳已经同意在身份识别和在试管中和离体用于外用制剂的微生物菌株的特性。拜耳在签署联合开发协议时向我们一次性支付了150,000美元 ,并同意偿还我们的开发费用。2021年10月,拜耳扩大了期权协议 ,并支付了375,000美元用于额外的表征工作。我们已授予拜耳获得JDA项下开发活动的最多六个品种的独家版税许可的选择权,包括任何相关专利权的独家版税许可 。在对数百个菌株进行筛选后,我们和拜耳选择了两个特定的菌株进行进一步研究在试管中和离体我们打算将其开发为潜在的非处方药化妆品。我们在2023年第四季度完成了表征工作,并将数据交付给拜耳,届时拜耳有12个月的时间来行使其许可菌株和相关专利的选择权。在完成特性研究并将数据 交付给拜耳后,JDA将结束,但拜耳可以选择许可菌株和相关专利。截至本招股说明书的日期,我们 尚未与拜耳就商业许可协议进行谈判,我们不会这样做,直到拜耳行使其 选择权获得独家版税许可。
2020年9月,拜耳的风险投资集团Leaps by Bayer购买了我们B系列优先股800万美元。
销售 和市场营销
鉴于我们所处的发展阶段,我们尚未建立商业组织或分销能力。我们计划在美国建立有重点的 能力,将我们的开发计划商业化,重点是用于皮肤病治疗的活生物治疗产品和重组蛋白 ,我们相信,在美国,患者群体和针对我们目标适应症的医学专家足够集中,使我们能够通过有针对性的销售团队有效地推广我们的产品,如果批准进行商业销售的话。在商业化可能对我们来说资本效率较低的其他市场,我们可能会有选择地寻求与第三方的战略合作 ,以最大限度地发挥我们候选产品的商业潜力。
制造业
我们 不拥有或运营用于生产当前候选产品的制造设施。我们目前依赖第三方合同制造商提供我们所需的所有原材料、制造设备和活性药物成分,以及我们的 临床前研究和临床试验。虽然我们能够在我们的康涅狄格州格罗顿工厂为我们的临床试验 生产成品,但我们将依赖第三方生产我们用于商业销售的成品。我们与这些第三方中的任何一方都没有长期的 协议。我们目前也没有关于制造3期临床试验或商业用品的任何合同关系。我们打算与第三方合同制造商和一个或多个备份制造商签订协议,以用于未来的生产。我们正在分析为未来的开发和我们开发的任何产品的商业 量建立制造能力的可行性。此类产品将需要在符合FDA和我们正在寻求批准的其他司法管辖区监管机构的要求的设施和工艺中进行生产。
| 67 |
竞争
生物制药行业的特点是技术快速进步、竞争激烈以及对专利药物的高度重视。虽然我们相信我们的知识、经验和科学资源为我们提供了竞争优势,但我们面临着来自许多不同来源的潜在竞争,包括其他生物制药公司、学术机构和政府机构 以及公共和私人研究机构。我们成功开发和商业化的任何候选药物都将与现有疗法和未来可能出现的新疗法展开竞争。
Netherton综合征
关于Netherton综合征,到目前为止还没有药物被FDA批准,特别是针对Netherton综合征。标准护理包括使用温和/柔软的非洗涤剂液体洁面油清洁皮肤,最好是酸性(5)。由于Netherton综合征患者的皮肤最常见的是干燥、鳞屑和脱皮,因此也经常使用润肤剂和保湿霜。水杨酸、尿素或α-羟基酸等角质溶解药物通常具有刺激性,Netherton综合征患者对其耐受性不佳。Netherton综合征患者的皮肤易受细菌感染。有限的感染用局部抗生素治疗,治疗时间很短,最长可达2周。口服抗生素也可以用来治疗病原体金黄色葡萄球菌和链球菌可以导致更极端感染的菌株。漂白剂也被推荐每周洗两到三次,因为它们有抗菌作用。外用皮质类固醇通常用于治疗与非感染性Netherton综合征皮损相关的炎症和过度增殖,但由于其不良反应,必须加以限制。这些不良事件包括氨基酸尿症、库欣综合征、皮肤萎缩、肾上腺功能不全、生长迟缓、高血压和虚弱。过度使用局部类固醇甚至会导致角质层的丧失,从而加剧皮肤屏障的缺陷。全身性维甲酸对Netherton综合征显示出不同程度的疗效,但也具有骨毒性和致畸作用。局部的钙调神经磷酸酶抑制剂已被用于减少红斑(红肿),但患者 已表现出快速反应,并随着治疗时间的延长而降低疗效。这些免疫调节剂还存在严重不良影响的风险,包括增加感染、肿胀、灼热感和刺痛感的风险。光疗法(窄带UVB(NB-UVB)和补骨脂素-UVA(PUVA))也已被研究用于Netherton综合征患者,但由于其可能导致红斑和皮肤癌风险增加而受到限制。
我们还知道,Sixera Pharma于2021年12月在欧洲启动了SXR-1096的临床试验,SXR-1096是一种局部使用的小分子KLK抑制剂 ,用于治疗Netherton综合征。此外,Quoin制药公司于2022年12月和2023年3月启动了QRX003的两项临床试验,QRX003是一种局部使用的小分子广谱丝氨酸蛋白酶抑制剂。Krystore Biotech、MatriSys和BridgeBio已经报告说,他们正在开发处于临床前阶段的Netherton综合征项目。
如果我们的竞争对手开发和商业化比ATR-12或我们可能开发的任何其他药物更安全、更有效、副作用更少或更少、更方便或更便宜的药物,我们的商业机会可能会减少或消失。 我们的竞争对手也可能比我们更快地获得FDA或其他监管机构对其药物的批准, 这可能会使我们的竞争对手在我们能够进入市场之前建立强大的市场地位。与我们相比,我们正在竞争或未来可能竞争的许多公司在研发、制造、临床前试验、进行临床试验、获得监管批准和营销 药品方面拥有更多的财务资源和专业知识。制药和生物技术行业的合并和收购可能会导致更多的资源集中在我们数量较少的竞争对手中。规模较小或处于早期阶段的公司也可能成为重要的竞争对手,尤其是通过与大公司和成熟公司的合作安排。这些竞争对手还在招聘和留住合格的科学和管理人员、为临床 试验建立临床试验站点和受试者注册以及在获取与我们的计划互补或可能需要的技术方面与我们展开竞争。
| 68 |
EGFRi相关 皮疹
迄今为止,FDA尚未专门批准任何药物用于治疗EGFRi相关皮疹。大多数持续接受抗EGFR治疗的患者(估计高达90%)发生皮肤病不良事件,尤其是丘疹脓疱性皮疹、 瘙痒(瘙痒)、干燥症(干燥)和甲沟炎(指甲感染)。丘疹脓疱或痤疮样皮疹是EGFR在皮肤上最常见的不良 事件。这种皮疹在许多患者中对EGFRi治疗的依从性产生负面影响。严重病例需调整剂量或停止 治疗。由于循证对照试验仍然非常稀少,EGFRi皮肤毒性的治疗主要 依赖于医师经验和专家共识会议的建议。因此,在EGFRi皮疹的临床治疗中存在地理差异 甚至不一致。对于痤疮样皮疹,在欧洲避免使用局部皮质类固醇,但在美国经常使用。此外,局部治疗经常根据个体患者定制 ,并可能根据具体情况进行更改。没有任何局部治疗方案普遍适用于所有患者。
我们 了解到以下第二阶段计划正在开发针对EGFRi相关皮疹的候选研究药物。Lutris Pharma正在美国和以色列开发外用B-Raf抑制剂LUT014。大同药业正在韩国开发DWP708。
知识产权
概述
我们 积极寻求通过各种方式保护我们的专有技术、发明、发明改进和其他对我们的业务发展具有重要商业意义的知识产权,例如寻求、维护和捍卫专利权,无论是内部开发还是从第三方获得许可。我们还可以依靠与我们的专有技术平台相关的商业秘密和技术诀窍,依靠持续的技术创新和未来的许可机会来发展、加强和保持我们在基因治疗领域的地位,这可能对我们的业务发展至关重要。还可以通过数据独占性、市场独占性和专利期延长提供额外的监管保护 。
截至 本招股说明书日期,我们拥有或独家许可三项已颁发的美国专利、12项待审批的美国专利申请、三项待审批的PCT申请和57项对我们业务发展 重要的其他外国专利和专利申请。
我们的 政策是提交专利申请,以保护专有技术、发明和对发明的改进以及可能对我们业务发展具有重要商业意义的其他知识 产权。我们还打算寻求额外的专利保护或 依靠专有技术或商业秘密权利来保护可能用于生产和开发我们的活体生物 产品的其他技术。如下所述,我们是独家许可协议的一方,该协议授予我们在我们的 活体生物产品以及我们产品的制造和开发中使用特定技术的权利。
我们的 专利组合
我们的专利组合广泛涵盖治疗细菌的药物组合物,这些药物组合物含有用于治疗异常皮肤状况的治疗细菌,以及制造和使用这些重组细菌的方法。在我们最广泛的申请中,我们获得了一项美国专利 ,该专利保护了使用一种细菌菌株治疗异常皮肤状况的药物组合物,该细菌菌株表达了具有治疗效果的重组多肽。这项专利将于2035年5月到期。具体地说,本专利涉及含有一种或多种以下细菌菌株的药物组合物:双歧杆菌、短杆菌、丙酸杆菌、乳球菌、链球菌、葡萄球菌、乳杆菌、肠球菌、小球菌属、明串珠菌或葡萄球菌,其中该细菌菌株经过改造可生产用于治疗异常皮肤状况的治疗性多肽。我们相信,这项专利为我们使用重组细菌治疗皮肤病和疾病提供了广泛的保护。到2035年5月到期。
| 69 |
针对我们最先进项目的专利申请摘要如下。
ATR-12
我们的 ATR-12候选产品拥有三项已颁发的美国专利、七项待审批的美国专利申请以及31项待审批的外国 专利和专利申请。这些专利和专利申请代表了十个权利要求族,其涵盖了 的药物组合物, 表皮葡萄球菌重组治疗性多肽的表达--营养缺陷型表皮葡萄球菌,和重组人表皮葡萄球菌表达治疗性LEKTI蛋白的菌株和ATR-12的制剂。 其中一项已颁发的美国专利涵盖了一种含有治疗性多肽的重组细菌菌株,用于治疗异常皮肤状况 ,将于2035年到期。第二个发布的美国专利涵盖了营养缺陷型 表皮葡萄球菌这项规定将于2039年到期。如果从未决的专利申请中授予额外的 项专利,这些专利将在2035至2044年间到期。
ATR-04
我们的 ATR-12候选产品受一项已颁发的美国专利、两项待决的美国专利申请和17项待决的外国申请的约束。 这些专利和专利申请代表了针对营养缺陷型细菌及其治疗疾病用途的两类权利要求。我们有一项已颁发的美国专利,涵盖ATR-04。如果授予更多专利,它们也将在2039年到期 。
专利期限和期限延长
个别专利有不同的期限,具体期限取决于专利申请的提交日期或专利颁发日期以及获得专利的国家/地区的专利的法律期限。通常,为在美国提交的申请颁发的实用新型专利的有效期为自非临时专利申请的最早有效申请之日起20年。此外,在 某些情况下,美国专利的有效期可以延长,以重新获得美国专利商标局或USPTO的一部分,延迟发布专利,以及因FDA监管审查期间而实际失去的一部分期限 。但是,对于FDA的组件,恢复期限不能超过5年,恢复期限不能从FDA批准之日起延长 14年以上。此外,只有一项适用于批准的药物的专利有资格延期, 并且只有那些涉及批准的药物、其使用方法或制造方法的权利要求才能延长。外国专利的有效期根据适用的当地法律规定有所不同,但通常也是自最早生效日期起计的20年。根据美国专利商标局和各个外国司法管辖区的要求,专利的所有税金、年金或维护费都必须及时支付,以便专利在这段时间内保持有效。
专利提供的实际保护可能因国家/地区的不同产品而有所不同,并可能取决于许多因素,包括专利的类型、其覆盖范围、与监管相关的延期的可用性、特定国家/地区的法律 补救措施的可用性以及专利的有效性和可执行性。
我们的专利和专利申请可能会受到其他人的程序或法律挑战。我们可能无法获得、维护和 保护开展业务所需的知识产权,并且我们可能会受到侵犯或以其他方式侵犯他人知识产权的索赔,这可能会对我们的业务造成实质性损害。有关更多信息,请参阅标题为 “风险因素-与我们的知识产权有关的风险.”
交易秘密和诀窍
我们 还可能依靠商业秘密、技术诀窍、持续的技术创新和机密信息来发展和维护我们的 专有地位,并保护我们业务中不受专利 保护或我们认为不适合专利保护的方面,包括我们生产活性生物治疗产品的专有工艺。我们寻求通过与我们的员工、顾问、科学顾问、承包商和其他可能可以访问专有信息的人签订保密协议和发明转让协议来保护我们的专有技术和流程,根据这些协议,他们有义务将他们在受雇期间或服务期限内做出的发明转让给我们。这些协议可能会被违反,我们可能没有足够的 任何违反的补救措施。此外,我们的商业秘密可能会被竞争对手知晓或独立发现。对于我们的承包商、商业合作伙伴、合作者、员工和顾问在为我们工作时使用他人拥有的知识产权的程度,可能会就相关或由此产生的专有技术和发明的权利产生争议。有关更多信息,请参阅 标题为“风险因素-与我们的知识产权有关的风险.”
| 70 |
我们 还试图通过维护我们场所的物理安全以及我们信息技术系统的物理和电子安全来保护我们的数据和商业秘密的完整性和机密性。
与弗雷德·哈奇森癌症中心签订独家许可协议
2022年1月,我们与弗雷德·哈钦森癌症中心或弗雷德·哈奇签订了独家许可协议。根据我们与Fred Hutch的协议,我们在由Fred Hutch开发和拥有的与SyMPL技术相关的某些专利下获得了全球独家许可,可以开发、制造、分销、分销、使用、研究、改进、进口、提供销售、销售和以其他方式商业化此类专利涵盖的产品。此类独家许可受Fred Hutch和美国政府保留的某些权利的约束。弗雷德·哈奇授予我们的专利权包括两个专利申请系列 ,这些专利申请针对的是绕过限制修饰系统的方法,以便更容易地将异种DNA引入工程微生物。 这些专利申请以及这些申请颁发的任何专利将使我们能够生产更多用于疾病治疗的改良微生物。我们当前的候选产品未采用SyMPL技术平台,但我们预计部分或全部未来候选产品将采用SyMPL技术平台。如果发行,这两个家族将分别于2037年和2040年到期。
考虑到根据Fred Hutch许可协议授予我们的许可,我们象征性地向Fred Hutch支付了预付款。此外, 我们需要向Fred Hutch支付某些开发和商业里程碑付款,并按许可产品的净销售额支付个位数版税 。弗雷德·哈奇协议还要求我们向弗雷德·哈奇报销许可专利的起诉和维护费用。
根据弗雷德·哈奇许可协议,我们必须以商业上合理的努力,通过一个积极而勤奋的计划,将许可产品推向市场,以利用许可的专利权。Fred Hutch许可协议的期限将持续 ,直至(I)许可专利到期或(Ii)自许可产品首次销售之日起十年内。如事先书面通知Fred Hutch,我们可随时终止Fred Hutch许可协议。如果我们严重违反协议并且未能在指定的治愈期限内纠正此类违规行为,或者如果 我们破产或资不抵债,则Fred Hutch有权终止该许可协议。有关根据弗雷德·哈奇许可协议获得的知识产权的更多信息,请参阅标题为“营业执照和知识产权.”
我们 还在美国和七个国家/地区拥有我们公司名称和设计的注册商标。
政府法规
制药公司受到外国、联邦、州和当地机构的广泛监管,如美国FDA,以及全球大多数国家和地区的各种类似机构。药品的研究、开发、测试、制造、分销、包装、标签、储存、记录保存、营销和销售在美国和其他国家均受政府监管。此外, 在美国,我们必须遵守FDA制定的规章制度,要求提交数据,表明我们的候选产品 是安全有效的,并根据cGMP规定生产。如果我们不遵守适用的要求, 我们可能会被罚款,政府可能会拒绝批准我们的营销申请,或者允许我们制造或营销我们的候选产品, 我们可能会受到刑事起诉。我们、我们的制造商和临床研究组织也可能受到其他外国、联邦、州和当地法律的监管,包括但不限于美国《职业安全与健康法》、《资源保护和回收法》、《清洁空气法》、进出口和海关法规以及其他 国家的法律法规。美国政府加强了针对国内和国际非法营销行为的执法活动。 因此,制药公司必须确保其遵守《反海外腐败法》和联邦医疗欺诈 以及包括《虚假索赔法》在内的滥用法律。
| 71 |
这些 监管要求会影响我们的运营,并且因国家/地区的不同而有所不同,因此确保一个国家/地区获得适用的监管批准并不意味着另一个国家/地区的批准。审批程序成本高,人力密集, 通常持续多年,需要高技能和专业资源。
FDA 上市审批流程
在美国,我们的候选产品根据联邦食品、药物和化妆品法案(FDCA)、公共卫生服务法案(PHSA)和FDA颁布的法规作为生物制品受到FDA的监管。在产品开发流程(包括临床前测试、临床测试、审批流程或审批后流程)期间的任何时间未能遵守适用要求 可能会使申请人在进行临床试验、监管审查和批准和/或行政或司法制裁方面受到延误。这些制裁可能包括但不限于FDA拒绝允许申请人继续进行临床测试、拒绝批准未决申请、吊销或吊销执照、撤回批准、警告信、不良宣传、客户通知、产品召回、产品扣押、拒绝批准出口或进口批准、完全或部分暂停生产或分销、同意法令、禁令、罚款,以及由FDA或美国司法部或其他政府实体提起的民事或刑事调查和处罚。
新生物在美国上市前通常需要采取的步骤通常包括:
| ● | 根据FDA当前的良好实验室操作规范完成临床前实验室测试和动物研究。 | |
| ● | 向FDA提交IND,该IND必须在临床试验开始之前生效,并且必须每年更新或在发生重大变化时 ; | |
| ● | 试验开始前每个治疗地点的独立机构审查委员会或伦理委员会批准 ; | |
| ● | 执行充分和良好控制的人体临床试验,以确定拟议生物产品的安全性、纯度和效力 候选生物产品建议的使用适应症; | |
| ● | 提交支持安全性和有效性的数据,以及有关产品临床开发和拟议标签的制造和成分的详细信息。 | |
| ● | 在所有关键临床试验完成后,准备并向FDA提交BLA; | |
| ● | 满意 完成FDA咨询委员会审查(如适用); | |
| ● | FDA在收到BLA后60天内决定提交复审申请; | |
| ● | 令人满意的 完成FDA对生产建议产品的一个或多个制造设施的批准前检查,以评估符合cGMP标准,并确保设施、方法和控制足以保持生物产品的持续安全性、纯度和效力,以及选定的临床研究地点,以评估是否符合良好的临床实践或GCP; | |
| ● | 令人满意的 完成FDA对非临床和临床试验地点的任何审计,以确保符合CGP要求和支持BLA的临床数据的完整性; | |
| ● | 支付使用费,并确保FDA批准拟议的使用适应症的BLA; | |
| ● | FDA 审查和批准BLA,以允许该产品在美国使用的特定适应症的商业营销; 和 |
| 72 |
| ● | 合规性 符合任何批准后要求,包括REMS和FDA要求的任何批准后研究。 |
临床前研究和探索性新药应用
临床前试验包括对产品的化学成分、配方和稳定性进行实验室评估,以及对动物进行动物研究以评估其潜在的疗效和毒性。进行临床前试验和用于试验的化合物配方必须符合联邦法规和要求。临床前试验的结果连同生产信息和分析数据一起作为IND申请的一部分提交给FDA。即使在提交IND申请后,某些临床前试验仍可能继续。 IND在FDA收到后30天自动生效,除非在此之前FDA对拟议的临床试验的产品或进行提出担忧或问题,包括担心人类研究志愿者将面临不合理的健康风险 。在这种情况下,IND赞助商和FDA必须在临床试验开始之前解决FDA的任何悬而未决的问题。
因此,提交IND可能导致FDA不允许临床试验开始,或允许临床试验按发起人最初在IND中指定的条款开始。如果FDA在最初的30天期间或在IND过程中的任何时候提出担忧或问题,它可以选择实施部分或全部临床搁置。FDA发布的这一命令将推迟拟议的临床试验或导致正在进行的临床试验的一个阶段的启动延迟,直到所有悬而未决的问题得到充分解决,FDA已通知该公司可能会继续进行调查。这可能会导致在及时完成计划的临床试验方面出现重大延误或困难。
临床试验
临床 试验涉及根据良好临床实践或GCP要求,在合格的首席研究人员的监督下,将研究产品候选给健康志愿者或要接受治疗的疾病患者 。临床 研究是在详细说明研究目标、哪些类型的患者可以参加研究、测试和程序的时间表、药物、剂量和研究时间、以及用于监测安全性的参数和要评估的疗效标准的方案下进行的。作为IND过程的一部分,每项临床研究的方案和任何后续方案修改都必须提交给FDA。
希望在美国境外进行临床试验的赞助商可以(但不需要)获得FDA的授权,根据IND进行临床试验。如果在美国境外的临床试验不是根据IND进行的,只要临床试验的进行符合GCP的精神,并符合国际临床研究道德行为指南《赫尔辛基宣言》和/或进行临床试验的一个或多个国家的法律法规,赞助商可以将临床试验的数据提交给FDA以支持BLA,以为临床试验的参与者提供更大保护的 。
IRB还必须集中或单独审查将进行临床试验的每个机构的每项临床试验。IRB将考虑临床试验设计、患者知情同意、伦理因素、人类受试者的安全、该机构可能的责任,以及在适当情况下保护人类受试者的隐私。IRB必须按照FDA的规定进行操作。FDA、IRB或临床试验赞助商或首席研究人员可因各种原因在任何时间暂停或中止临床试验,包括发现临床试验未按照FDA要求进行,或受试者或患者面临不可接受的健康风险。临床测试还必须满足广泛的GCP规则和知情同意的要求。此外,一些临床研究由临床研究赞助商组织的一个独立的合格专家小组监督,称为数据安全监测委员会或委员会。根据对研究中某些数据的访问,该小组建议是否可以在指定的检查点进行试验。临床研究赞助商 还可以根据不断变化的业务目标和/或竞争环境暂停或终止临床试验。
| 73 |
临床试验通常分三个连续阶段进行,但这些阶段可能会重叠或合并。详细说明临床试验阶段结果的年度进度必须提交给FDA。
| ● | 阶段 1临床试验通常在健康志愿者的小团体中进行,以评估各种剂量方案的安全性和耐受性以及药代动力学。对于一些针对孤儿、严重疾病或危及生命的疾病的产品,特别是如果该产品可能毒性太大而不适合健康人体使用,初始临床试验可能会在患有特定疾病的个人身上进行, 指示使用测试产品。这些针对患者的试验通常被称为1b期试验。如果它们包括确定特定剂量的设计,则通常称为1b/2a期临床试验。然而,额外的2期(有时称为2b期)临床试验通常是必要的,以完善最终选择的剂量,以纳入关键的3期临床试验。 | |
| ● | 阶段 2临床试验通常在有限的患者群体中进行,以确定可能的不良反应和安全风险, 评估特定目标适应症的候选产品的疗效,并确定剂量耐受性和最佳剂量。 赞助商可能会在开始更大、更昂贵的3期临床试验之前进行多个2期临床试验以获取信息。 | |
| ● | 阶段 3如果第二阶段临床试验证明候选产品的剂量范围可能有效并具有可接受的安全性,则继续进行临床试验。进行第三阶段临床试验是为了在更多的 患者中进一步评估剂量,提供大量的临床疗效证据,并在多个地理上分散的临床试验地点对扩大和多样化的患者人群进行进一步的安全性测试。一项控制良好、统计稳健的3期试验可能会被设计成提供数据,监管机构将利用这些数据来决定是否批准,以及如果获得批准,如何 适当地为药物贴标签:这种3期研究被称为“关键”。 |
如果FDA认为临床研究没有按照FDA的要求进行,或者参与者面临不可接受的健康风险,FDA可以在任何时候下令暂时或永久停止临床研究或施加其他制裁。在某些情况下,FDA可能会批准候选产品的BLA,但要求赞助商进行额外的临床试验,以在BLA批准后进一步评估该药物的安全性和有效性。此类批准后试验通常被称为4期临床试验。这些研究用于从预期治疗适应症患者的治疗中获得其他经验数据,并在根据加速审批法规批准的药物或生物制品的情况下记录临床益处。 如果FDA批准了产品,而公司正在进行不需要批准的临床试验,则公司可以 使用这些临床试验的数据来满足任何第四阶段临床试验的全部或部分要求,或请求更改 产品标签。未能对进行4期临床试验进行尽职调查可能会导致撤回对产品的批准 。
符合cGMP要求
当候选产品通过临床测试阶段时,生产流程将进一步定义、细化、控制和验证。 FDA要求的控制和验证级别随着临床研究的进展而提高。FDA通常不会批准BLA申请,除非它确定制造工艺和设施完全符合cGMP要求,并且 能够确保产品在所要求的规格内一致生产。PHSA强调了对属性无法精确定义的生物制品等产品进行生产控制的重要性。
我们 和我们赖以生产我们的候选产品及其各自成分(包括活性药物成分或原料药)的第三方制造商必须遵守药品的制造、包装和标签符合cGMP的要求。为了符合cGMP要求,制造商必须继续花费时间、金钱和精力来满足与人员、设施、设备、生产和工艺、标签和包装、质量控制、记录保存和其他要求有关的要求。
| 74 |
制造商和其他涉及产品制造和分销的企业也必须向FDA和某些州监管机构注册。美国和非美国制造企业在首次参与制造过程时,必须注册并向FDA提供附加信息。由未经注册的工厂制造或进口的任何产品,无论是在美国还是非美国,都被视为在FDCA下有错误的品牌。机构可能会受到政府当局的定期突击检查,以确保遵守cGMP和其他法律。检查必须遵循“基于风险的时间表” ,这可能会导致某些机构更频繁地被检查。制造商可能还必须应要求提供有关其工厂的电子或实物记录。推迟、拒绝、限制或拒绝FDA的检查可能会导致产品被视为掺假。
BLA 提交和审查
假设 根据所有适用的法规要求完成了所有要求的测试,则将以BLA的形式向FDA提交有关候选产品的详细信息,请求批准针对一个或多个适应症销售该产品,并支付 使用费,除非放弃。BLA包括从相关的非临床和临床研究中获得的所有相关数据,包括阴性或不明确的结果以及阳性结果,以及有关化学、制造、对照和建议的 标签等的详细信息。为支持上市审批,提交的数据必须在质量和数量上足以确定候选产品的安全性和有效性,使FDA满意。FDA还在批准BLA之前对制造商和实验室进行预批准 检查。
如果BLA提交的申请被接受,FDA将开始对BLA进行深入审查。根据《处方药使用费法案》(PDUFA),FDA的目标是在提交后十个月内完成初步审查并对申请人做出回应,除非申请 涉及未满足的医疗需求,或涉及严重或危及生命的适应症,在这种情况下,目标可能是在提交BLA后六个月内 。但是,PDUFA目标日期不是法定要求,FDA的回应通常比最初的PDUFA目标日期晚几个月。此外,如果FDA要求或BLA发起人以其他方式提供关于BLA中已经提供的信息的补充信息或澄清,则PDUFA项下的审查过程和目标答复日期可被延长。因此,BLA审查 过程可能非常漫长。在审查BLA期间,FDA可以将申请提交给咨询委员会进行审查、评估和建议,以确定是否应该批准申请。FDA不受咨询委员会的建议的约束,但它通常遵循这样的建议。来自临床研究的数据并不总是决定性的,FDA和/或其任命的任何咨询委员会可能会以不同于申请者的方式解释数据。
在 FDA评估BLA并检查将生产和测试药品和/或其原料药的制造设施后,它 将批准药物产品的商业销售,并提供特定适应症的处方信息,或发布完整的 回复信,表明申请尚未准备好批准,并说明为确保BLA获得批准必须满足的条件。如果完整的回复信需要额外的数据,而申请人随后提交了该数据,FDA仍可能最终判定BLA不符合其批准标准。FDA还可以通过风险评估和缓解策略或REMS计划来批准BLA以降低风险,其中可能包括药物指南、医生沟通计划或确保安全使用的要素,如受限分发方法、患者登记和其他风险最小化工具。 FDA还可能以更改建议的标签、制定适当的控制和规范或承诺进行上市后测试为条件进行批准。此类上市后测试可能包括第四阶段临床试验和监测,以便 在批准后进一步评估和监测产品的安全性和有效性。对严重或危及生命的适应症的产品的监管批准可能需要对临床研究的参与者进行长期跟踪,以确定该药物的总体生存益处 。
如果FDA批准了我们的候选产品之一,我们将被要求遵守批准后的一些监管要求。 我们将被要求向FDA报告某些不良反应和生产问题,提供最新的安全性和有效性信息,并遵守有关我们任何候选产品的广告和促销标签的要求。此外,质量控制和制造程序在批准后必须继续符合cGMP,FDA定期检查 制造设施以评估是否符合cGMP,这规定了广泛的程序性,实质性和记录保存要求。 如果我们寻求对批准的产品进行某些更改,例如某些制造更改,我们可能需要FDA审查和批准 才能实施更改。
| 75 |
虽然 医生可以将产品用于未经FDA批准的适应症,但我们不能将产品用于未经批准的适应症 。确保FDA批准新适应症类似于批准原始适应症的流程 ,除其他事项外,还需要提交充分且受控的研究数据,以证明该产品在新适应症中的安全性和有效性。即使进行了这样的研究,FDA也可能不会及时批准任何变化,或者根本不批准。
FDA还可能要求进行上市后测试或第四阶段测试,以及风险最小化行动计划和监督,以监控可能限制产品分销或使用的批准产品或场所条件或批准的影响。
快速跟踪、突破性治疗和优先审查指定
FDA有权指定某些产品进行快速审查,如果这些产品旨在满足在治疗严重或危及生命的疾病或状况或在紧急情况下未得到满足的医疗需求。这些计划是快速通道指定、突破性治疗指定和优先审查指定。
具体而言,如果一种产品是用于治疗严重或危及生命的疾病或病症,并且有可能满足此类疾病或病症的未得到满足的医疗需求,则FDA可指定该产品进行快速通道审查,无论该产品是单独使用还是与一种或多种其他产品联合使用。对于Fast Track产品,赞助商可能会与FDA有更多的互动,FDA可能会在申请完成之前对Fast Track产品申请的部分进行审查。如果FDA在对赞助商提交的临床数据进行初步评估后确定快速通道产品可能有效,则可以进行滚动审查。 赞助商还必须提供提交剩余信息的时间表,并且赞助商必须 支付适用的用户费用。然而,FDA审查快速通道申请的时间段目标直到申请的最后 部分提交后才开始。此外,如果FDA认为快速通道指定不再得到临床试验过程中出现的数据的支持,则FDA可能会撤回该指定。
此外,2012年,国会颁布了《食品和药物管理局安全与创新法案》,简称FDASIA。这项法律建立了一个新的监管方案,允许加快对被指定为“突破性疗法”的产品的审查。如果一种产品旨在单独或与一个或多个其他产品联合用于治疗严重或危及生命的疾病或状况,并且初步临床证据表明该产品可能在一个或多个临床重要终点显示出比现有 疗法显著改善的效果,例如在临床开发早期观察到显著的治疗效果,则该产品可被指定为 突破性疗法。 FDA可能会针对突破性疗法采取某些行动,包括在整个开发过程中与赞助商举行会议;及时向产品赞助商提供有关开发和批准的建议;让更多的高级人员参与评审流程;为评审团队指派一名跨学科的项目负责人;以及采取其他步骤以高效的方式设计临床试验。
此外,如果一种产品治疗严重疾病,并且如果获得批准,将在安全性或有效性方面有显著改善,则FDA可指定该产品进行优先审查。FDA根据具体情况确定,与其他可用的疗法相比,建议的产品是否有显著改善。显著的改善可能表现为:有证据表明在治疗某种疾病方面提高了 有效性,消除或大幅减少了限制治疗的产物反应,有记录的 患者依从性的提高可能导致严重结果的改善,以及新的 亚群的安全性和有效性的证据。优先指定的目的是将整体注意力和资源引导到对此类申请的评估上,并将FDA对营销申请采取行动的目标从10个月缩短到6个月。
此外,如果美国政府已指定实际或潜在的紧急情况,卫生与公众服务部部长可授权销售未经批准的药品和生物制品。在指定紧急情况后,FDA可以根据FDCA建立的标准,为特定产品的使用颁发紧急使用授权。EUA是特定于产品的,并受特定的 条件和限制。一旦作为EUA基础的紧急情况结束,那么EUA就会终止。
| 76 |
儿科 罕见病指定和优先审查凭证
根据修订后的FDCA,FDA鼓励开发符合“罕见儿科疾病”定义的药物和生物制品。“定义为一种严重的或危及生命的疾病,其严重的危及生命的表现主要影响从出生到18岁的个人,该疾病在美国影响不到200,000人,或者在美国影响到200,000人或更多人,并且没有合理的预期在美国开发和制造治疗此类疾病或疾病的药物或生物制剂的成本将从在美国销售此类药物或生物制剂中获得。罕见儿科疾病候选产品的 赞助商可能有资格获得优惠券,该优惠券可用于在罕见儿科疾病药物产品批准之日后获得后续人类药物或生物应用的优先审查 ,称为优先审查优惠券,或PRV。赞助商可以在提交其保密协议或BLA之前向FDA申请罕见儿科疾病的指定。一种罕见的儿科疾病指定并不保证赞助商在其NDA或BLA获得批准后会收到PRV。此外,选择不提交罕见儿科疾病指定请求的赞助商,如果他们请求原始凭证,则在其营销申请获得批准 后仍可收到PRV。市场推广申请,并满足所有资格条件 。如果收到PRV,它可能会被出售或转让不限次数。国会已将PRV计划延长至2024年9月30日,并有可能批准PRV至2026年。
审批后条例
一旦获得监管机构批准的产品上市或现有产品的新适应症,赞助商将被要求 遵守批准后的监管要求,包括FDA可能作为批准条件 强加的任何批准后要求。赞助商将被要求向FDA报告某些不良反应和生产问题,提供最新的安全性和有效性信息,并遵守有关广告和促销标签要求的要求。制造商及其某些分包商必须向FDA和某些州机构注册其机构,并接受FDA和某些州机构的定期突击检查,以了解是否符合持续的法规要求,包括对药品制造商施加某些程序和文件要求的cGMP法规。因此,赞助商及其第三方制造商必须继续在生产和质量控制方面投入时间、金钱和精力,以保持 遵守cGMP法规和其他法规要求。
产品也可能需要正式批次发布,这意味着制造商需要对 产品的每个批次进行某些测试,然后才能发布分销。如果产品需要正式发布,制造商必须向FDA提交每个批次的样品,以及显示该批次生产历史摘要和制造商对该批次进行的所有测试结果的发布协议。此外,FDA可能还会对一些 产品的批次进行某些验证性测试,然后再放行批次进行分销。最后,FDA将进行与药品的安全性、纯度、效力和有效性有关的实验室研究。
批准后,如果没有遵守监管要求和标准,或者产品上市后出现问题,FDA可能会撤回批准。如果后来发现产品存在以前未知的问题,包括未预料到的严重程度或频率的不良事件,或生产工艺,或未能遵守法规要求,可能会 导致修订批准的标签以添加新的安全信息;实施上市后研究或临床试验以评估新的安全风险;或根据REMS计划实施分销或其他限制。除其他事项外,其他潜在后果包括:
| ● | 限制产品的销售或制造、产品完全退出市场或产品召回; | |
| ● | 罚款, 批准后临床试验的警告信或暂停; |
| 77 |
| ● | FDA拒绝批准待批准的BLAS或已批准的BLAS的补充,或暂停或撤销产品许可证批准; | |
| ● | 产品 扣押或扣留,或拒绝允许产品进出口;或 | |
| ● | 禁令或施加民事或刑事处罚。 |
FDA对投放市场的产品的营销、标签、广告和促销进行严格管理。药品和生物制品 只能针对批准的适应症并根据批准的标签的规定进行推广。FDA和其他机构 积极执行禁止推广非标签用途的法律和法规,被发现以不正当方式推广非标签用途的公司可能会承担重大责任。
孤儿 药品名称
根据《孤儿药品法》,FDA可以授予一种药物孤儿称号,该药物旨在治疗在美国影响少于200,000人的罕见疾病或疾病,或在其他有限的情况下。孤儿药物指定(ODD)向拥有将特定产品推向市场的ODD的公司规定了七年的市场排他性,独立于专利保护。此外,开发孤儿药物的公司有资格享受某些激励措施,包括对合格的临床测试给予税收抵免。此外,已获得孤儿药物指定的产品的BLA 不受处方药使用费的限制,除非申请包括 药物指定用于治疗罕见疾病或病症以外的其他适应症。
为了获得排他性,如果具有孤儿药物指定的产品随后获得了FDA对其具有此类指定的疾病或情况的第一次批准 ,该产品有权获得孤儿药物排他性,这意味着FDA在七年内不得批准任何其他申请在同一适应症内销售相同的活性部分,除非在有限的情况下,例如 另一种药物显示出优于具有孤儿排他性的药物的临床优势。此外,医生可能会开出用于非标签用途的产品 ,从而破坏我们的排他性。如果竞争对手先于我们获得了对相同适应症的相同活性部分的批准,则孤立药物独占可能会在 七年内阻止我们的某个候选产品获得批准,除非我们能够证明我们的产品在临床上是优越的。
赞助商可以为以前未获批准的产品申请孤儿药物指定,或为已上市的产品申请新的孤儿药物指定。 此外,如果赞助商能够提出其 产品可能在临床上优于第一个批准的产品的合理假设,则该产品与已批准的孤儿药物相同的产品可以申请并获得针对相同罕见疾病或疾病的后续产品的孤儿药物指定。多个赞助商可以因相同的罕见疾病或疾病获得同一产品的孤儿药物指定,但每个寻求孤儿药物指定的赞助商必须提交完整的孤儿药物指定申请,并且只有第一个获得该药物的孤儿适应症批准的赞助商才能获得市场排他性, 有效地阻止了FDA批准同一药物和相同适应症的竞争对手正在开发的产品,除非 竞争对手能够证明正在开发的产品在临床上优于批准的产品,或者批准的 产品供应不足。为了允许FDA结束另一家制造商的孤儿排他期,FDA必须确定该制造商已经通过证明后一种药物更安全、更有效,或者 在其他方面对患者护理做出了重大贡献,从而证明了该制造商的临床优势。
专营期从FDA批准上市申请之日开始,仅适用于该产品已被指定的 适应症。FDA可能会批准同一产品用于不同用途的第二次申请,或随后针对同一适应症的不同药物的 申请。指定孤儿药物既不会缩短药物的开发时间或监管审查时间,也不会在监管审查或批准过程中给药物带来任何优势。
我们 可能计划在美国、欧盟和其他特定产品感兴趣的地区为我们的一些候选产品申请孤儿药物指定和独家经营权。我们不能保证我们在任何司法管辖区的任何产品都会获得孤儿药物称号 。即使我们能够获得产品的孤儿药物称号,我们也不能确保该产品将获得 批准,我们是否能够在获得批准后获得孤儿药物独家经营权(如果有的话),或者我们是否能够保持授予的任何独家专利权 。
| 78 |
生物仿制药和排他性
2010年3月23日签署成为法律的《患者保护和平价医疗法案》(ACA)包括一个副标题,名为《2009年价格竞争和创新法案》(BPCIA)。BPCIA建立了一个管理方案,授权FDA批准生物仿制药和可互换的生物仿制药。FDA已经发布了几份指导文件草案,概述了审查和批准生物仿制药的方法。与生物制品更大且往往更复杂的结构相关的复杂性,以及制造此类产品的工艺 ,对实施构成了重大障碍,FDA仍在制定这些障碍。
根据《生物产品检验法》,制造商可以提交一份生物制品的许可申请,该生物制品与先前批准的生物制品或参比产品具有生物相似性或互换性。为了让FDA批准生物相似产品,必须发现参考产品和建议的生物相似产品在安全性、纯度和效力方面没有临床上有意义的差异。为使FDA批准生物相似产品可与参考产品互换,该机构必须发现该生物相似产品可预期产生与参考产品相同的临床结果,并且(对于多次给药的产品)生物制剂和参考生物制剂可在先前给药后 在不增加安全风险或相对于单独使用参考生物制剂而降低疗效的情况下进行切换。
根据BPCIA,生物相似产品的申请必须在参考产品获得批准之日起4年后才能提交给FDA。FDA可能在参考产品获得批准之日起12年后才会批准生物相似产品。 即使一种产品被认为是有资格独家销售的参考产品,如果FDA批准该产品的完整BLA,该产品包含赞助商自己的临床前数据和来自充分的临床试验和良好控制的临床试验的数据,以证明其产品的安全性、纯度和有效性,则另一家公司可以销售该产品的竞争版本 。BPCIA还为被批准为可互换产品的生物仿制药设立了某些排他性期限。
美国以外的法规
为了在美国境外销售任何产品,公司还必须遵守其他国家/地区和司法管辖区关于质量、安全性和有效性的众多且各不相同的监管要求,其中包括临床试验、营销授权、商业销售和药品分销。无论产品是否获得FDA批准,该公司 都需要获得类似非美国监管机构的必要批准,然后才能在这些国家或司法管辖区开始临床试验或产品营销。审批流程最终因国家和司法管辖区而异 ,可能涉及额外的产品测试和额外的行政审查期。在其他国家和司法管辖区获得批准所需的时间可能与获得FDA批准所需的时间不同,甚至可能更长。在一个国家/地区或司法管辖区获得监管批准并不能确保在另一个国家/地区获得监管批准,但在一个国家/地区 或司法管辖区未能或延迟获得监管批准可能会对其他国家/地区的监管流程产生负面影响。
欧盟的法规和销售授权
欧洲药品管理局(简称EMA)是欧盟或欧盟的科学机构,负责协调对药品和生物制品等新的和批准的医药产品进行评估和监测。它负责对欧盟营销授权申请进行科学评估,并制定技术指导并向赞助商提供科学建议。
| 79 |
欧盟的医药产品审批流程与美国的流程大致相同,通常也包括圆满完成以下各项:
| ● | 临床前 实验室测试、动物研究和配方研究均根据适用的欧盟良好实验室规范进行。 | |
| ● | 向欧盟成员国的相关监管机构或国家当局提交每项临床试验的临床试验申请或CTA,该申请必须在人体临床试验开始前获得批准; | |
| ● | 充分和良好控制的临床试验的绩效,以确定产品针对每个建议的适应症的安全性和有效性; | |
| ● | 向相关国家当局提交上市授权申请或MAA,其中包括支持安全性和有效性的数据,以及有关临床开发中产品的制造和成分的详细信息,以及拟议的标签。 | |
| ● | 令人满意的 有关国家当局完成对生产产品的一个或多个制造设施的检查,包括第三方的检查,以评估cGMP的遵守情况; | |
| ● | 可能对产生支持MAA的数据的非临床和临床试验地点进行审计;以及 | |
| ● | 在对产品进行任何商业营销、销售或发货之前,请审查 并获得MAA相关国家当局的批准。 |
临床前研究
临床前试验包括对产品化学成分、配方和稳定性的实验室评估,以及对动物潜在疗效和毒性的评估研究。进行临床前试验和用于试验的化合物配方必须符合欧盟相关法规和要求。临床前试验的结果,连同相关的生产信息和分析数据,在寻求批准开始临床试验时作为CTA的一部分提交,在寻求营销授权时与MAA一起提交。
临床试验批准
在欧盟进行临床试验(包括CGCP)的要求 在当前的临床试验指令2001/20/EC和 GCP指令2005/28/EC中执行。根据修订后的2001/20/EC号指令和2005/28/EC号指令,欧盟已通过成员国的国家立法实施了临床试验审批制度。根据这一制度,必须获得计划进行试验的国家主管部门的批准,如果要在多个成员国进行临床试验,则必须在多个成员国获得批准。为此,必须提交CTA,该文件必须有调查药品档案或IMPD,以及指令2001/20/EC和指令2005/28/EC以及其他适用的指南文件所规定的进一步支持信息。此外,只有在主管伦理委员会对该国的临床试验申请发表了积极的意见后,才能开始临床试验。
2022年1月31日,《临床试验条例》(EU)第536/2014号取代了现行的《临床试验指令2001/20/EC》。为确保临床试验规则在整个欧盟范围内保持一致,通过了《临床试验条例》(EU)第536/2014号,作为一项直接适用于所有欧盟成员国的条例。然而,《临床试验指令2001/20/EC》仍将在《临床试验条例》生效之日起三年内适用于(I)在申请前提交的临床试验申请,以及(Ii)如果发起人选择旧系统,在申请后一年内提交的临床试验申请。
| 80 |
第(Br)(EU)2014号法规旨在简化欧盟临床试验的审批流程。该条例的主要特点包括:
| ● | 通过称为临床试验信息系统的单一入口点简化申请程序; | |
| ● | 为申请编写和提交的一套文件以及简化的报告程序,使发起人不必将大致相同的信息分开提交给不同的国家当局; | |
| ● | 评估临床试验申请的统一程序,分为两部分; | |
| ● | 严格规定临床试验申请评估的截止日期;以及 | |
| ● | 道德委员会根据有关成员国的国家法律但在(欧盟)第536/2014号条例规定的总体时限内参与评估程序。 |
营销 授权
在欧盟成员国销售产品的授权是按照以下四种程序之一进行的:集中程序、相互承认程序、分散程序或国家程序。
集中式 流程
通过 集中程序,申请者可以根据单个 申请获得在所有欧盟成员国都有效的营销授权。某些医药产品,包括通过生物技术方法开发的产品,必须经过集中的上市授权程序,如果根据EMA的意见,如果得到欧盟委员会的批准,则 自动在所有欧盟成员国有效。赞助商可以选择通过其他类别的 产品的集中程序提交MAA。
集中程序对于某些类型的产品是强制性的,例如来自生物技术过程的药物,如基因工程 ,高级治疗药物,如基因疗法或组织工程药物,孤儿药物,以及含有用于治疗艾滋病毒、艾滋病、癌症、糖尿病、神经退行性疾病、自身免疫和其他免疫功能障碍以及病毒疾病的含有新活性物质的医药产品。
如果其他医药产品含有新的活性物质、申请人 证明相关医药产品构成了重大的治疗、科学或技术创新,或者批准的批准符合欧盟的公共利益,则可选择采用 集中授权程序。
管理 程序
根据集中程序,EMA的人类医药产品委员会,或CHMP作为科学委员会,代表EMA就人类使用的医药产品的安全性、有效性和质量提出意见。CHMP由每个成员国的国家药品主管部门提名的专家组成,其中一人被任命为评估协调工作的报告员,可能的话还会有另一名委员会成员担任联合报告员。批准后,报告员(S)继续对产品的整个生命周期进行监测。CHMP有210个有效天数来采纳关于是否应授予营销授权的意见 。在请求额外信息的情况下,该过程通常需要更长的时间,这会触发程序时间表中的时钟停止。这一过程很复杂,需要与成员国的监管当局和一些专家进行广泛的磋商。如果从公共卫生的角度,特别是从治疗创新的角度,就一种具有重大意义的药物提出上市许可申请,则申请人可根据第14(9)条(EC)第726/2004号条例,请求加快评估程序。如果CHMP接受这样的请求,210天的时限将减少到150天,但如果CHMP认为不再适合进行加速评估,也可以恢复到集中程序的标准时限 。一旦程序 完成,就会生成一份欧洲公共评估报告,简称EPAR。如果意见是否定的,则提供关于得出这一结论的理由的信息。CHMP意见通过后,关于MAA的决定必须由欧盟委员会在咨询欧盟成员国后 通过,总共可能需要60多天的时间。药品获得授权并投放市场后,必须对与其质量、安全性和有效性有关的所有方面进行 审查,这是维持上市授权的条件。
| 81 |
有条件的 审批
在特定情况下,欧盟立法(第14(7)条条例(EC)第726/2004号和第(EC)507/2006号条例)允许申请者在获得申请全面营销授权所需的全面临床数据之前获得有条件营销授权。如果 (1)产品的风险-效益平衡为正,(2)申请人很可能能够提供所需的全面临床试验数据,(3)产品满足未得到满足的医疗需求,以及(4)相关药物产品立即上市对公共健康的益处大于仍需要额外数据这一事实所固有的风险,则可对产品(包括被指定为孤儿药品的药品)授予此类有条件批准。有条件的营销授权 可能包含营销授权持有人必须履行的具体义务,包括完成正在进行的或新的研究的义务,以及收集药物警戒数据的义务。有条件营销授权的有效期为一年,如果风险-收益平衡保持为正,并且在评估是否需要额外的 或修改的条件和/或特定义务后,可以每年续签。上述集中程序的时间表也适用于CHMP对有条件营销授权申请的审查。
营销 特殊情况下的授权
根据第(Br)条第(8)款(EC)第726/2004号条例,在特殊情况下,申请人能够证明无法提供(由于立法中预见的特定原因)综合数据(符合经修订的2001/83/EC指令附件I中的要求)的产品可能有资格获得上市许可。此类授权每年都会进行审查 以重新评估风险与收益的平衡。在特殊情况下履行作为营销授权的一部分而施加的任何特定程序/义务旨在提供有关产品安全有效使用的信息,通常不会导致完成完整的档案/批准。
儿科研究
在欧盟获得营销授权之前,申请人必须证明符合EMA批准的涵盖所有儿科人群的儿科调查计划(PIP)中包括的所有措施,除非EMA已批准(1)特定产品的豁免、(2)类别豁免或(3)推迟PIP中包括的一项或多项措施。所有销售授权程序的各自要求在(EC)第1901/2006号条例,即所谓的儿科条例中规定。当公司希望为已获授权的药物添加新的适应症、药物形式或给药途径时,此要求 也适用。EMA的儿科委员会,或PDCO,可能会批准某些药物的延期,允许公司推迟儿童药物的开发,直到有足够的信息证明其对成人的有效性和安全性。当不需要或不适合在儿童中开发药物时,PDCO也可以批准豁免,例如只影响老年人口的疾病。
在提交营销授权申请或修改现有营销授权之前,EMA确定公司 确实遵守了每个相关PIP中列出的商定研究和措施。
| 82 |
授权和续订期限
营销授权原则上有效期为五年,营销授权可在五年后根据EMA或国家当局重新评估风险-收益平衡的基础续签。为此,营销授权书持有人必须在营销授权书失效前至少九个月向EMA或主管当局提供关于质量、安全性和有效性的文件的合并版本,包括自营销授权书颁发以来引入的所有变化。一旦续签,上市授权将在无限期内有效,除非欧盟委员会或 国家当局基于与药物警戒相关的正当理由决定继续进行一次为期五年的续签。 任何授权之后,如果没有在授权后三年内将药品实际投放到欧盟市场(如果是集中式程序)或授权成员国的 市场,则将不再有效,即所谓的“日落条款”。
孤儿 药品名称和排他性
欧盟委员会可以对赞助商可以确定用于诊断、预防或治疗 (1)危及生命或慢性衰弱的疾病,或(2)威胁生命、严重衰弱或严重慢性疾病的产品授予孤儿药品称号,如果没有激励措施,该药物在欧盟的销售不太可能产生足够的回报,以证明必要的投资是合理的。此外,赞助商必须证明欧盟没有批准的其他令人满意的诊断、预防或治疗这种疾病的方法,或者如果存在这样的方法,建议的孤儿药物将对患者有重大好处。
孤儿 药物指定提供许多好处,包括费用减免、监管协助和申请集中的欧盟营销授权(请参阅“-政府法规和产品审批-美国境外的监管-集中的授权程序”),以及在获得营销授权后10年的市场排他性。在此市场独占期内,EMA、欧盟委员会或成员国均不能接受申请或授予销售授权 含有与授权孤儿药品相似的一种或多种活性物质的药品,以及用于相同治疗适应症的药品。如果在第五年结束时确定不再符合孤儿药物指定标准,则授权治疗适应症的市场专营期可缩短至六年,包括证明该产品具有足够的利润而不足以证明维持市场专有性是合理的。此外,在市场独占期结束之前,竞争对手的类似药品可以获得授权,包括如果 被证明比已经批准的孤儿药物更安全、更有效或在临床上更好,或者如果已经批准的孤儿药物的上市授权持有人无法供应足够数量的产品。
如果被指定为孤儿药物的医药产品的MAA包括按照商定的PIP进行的所有研究的结果,并且随后在授予的上市授权中包含相应的声明,则十年的市场专营期将延长至十二年。
监管数据保护
欧盟立法还规定了监管数据和市场排他性制度。在获得营销授权后,基于完整独立数据包获得批准的新化学品 实体将受益于八年的数据独占权和额外的两年市场独占权。数据排他性使欧盟的监管机构无法参考创新者的数据来评估通用或生物相似(缩写)应用。在额外的两年市场独占期内,可以提交仿制药或生物相似药的上市授权,并可以参考创新者的数据,但在市场独家经营权到期之前,不能销售仿制药或生物相似药 。如果在这十年的前八年中,营销授权持有人或MAH获得了一个或多个新的治疗适应症的授权,那么整个十年的期限将延长到最多11年 ,在授权之前的科学评估中,这些适应症被认为与现有疗法相比可以带来显著的临床 益处。即使一种化合物被认为是一种新的化学实体,创新者能够 获得数据独占期,但另一家公司也可以销售该药物的另一版本,前提是该公司基于具有药物试验、临床前试验和临床试验的完整独立数据包的MAA获得 营销授权。但是,被指定为孤儿药品的产品在获得上市许可后,享有10年的孤儿市场专营权(另见“项目4.B--政府法规和产品审批--欧盟的法规和营销--孤儿药品的指定和专营权”)。根据欧盟营销授权流程的时间和持续时间,产品可能有资格获得最多五年的补充保护证书,或 SPC。这种SPC延长了该药物基本专利下的权利。
| 83 |
获得营销授权后的监管要求
如果 我们在欧盟获得医药产品的授权,我们将被要求遵守适用于医药产品的制造、营销、促销和销售的一系列要求:
药物警戒
例如,我们 将必须遵守欧盟严格的药物警戒或安全报告规则,根据这些规则,可以实施授权后研究和额外的监测义务。
其他 要求涉及,例如,按照良好制造规范标准制造产品和原料药。 欧盟监管机构可能会进行检查,以验证我们是否符合适用的要求,我们将不得不继续花费时间、金钱和精力来保持合规性。不遵守欧盟关于安全监测或药物警戒的要求,以及与为儿科人群开发产品相关的要求,也可能导致欧盟的重大经济处罚 。同样,不遵守欧盟关于保护个人数据的要求也可能导致重大处罚和制裁。如果我们不遵守当地适用的要求,个别欧盟成员国也可能实施各种制裁和处罚。
制造业
必须持有单独的制造商许可证的授权药品的生产必须遵守EMA的cGMP要求和其他国家主管部门的类似要求,这些要求规定了药品生产、加工和包装过程中使用的方法、设施和控制措施,以确保其安全性和身份。EMA通过强制登记设施和检查这些设施来执行其cGMP要求。EMA可能对这些检查起到协调作用 ,而执行这些检查的责任则由制造商所属的成员国主管当局负责。不遵守这些要求可能会中断供应并导致延误、意外成本和收入损失, 并可能使申请者面临潜在的法律或监管行动,包括但不限于警告信、暂停生产、扣押产品、禁令行动或可能的民事和刑事处罚。
营销 和促销
欧盟严格监管授权药品的营销和推广,包括行业赞助的继续医学教育和面向药品处方者和/或普通公众的广告。适用法规旨在确保营销授权持有者提供的有关其产品的信息 真实、平衡,并准确反映EMA或授权成员国的国家当局授权的安全性和功效声明。不遵守这些要求 可能会导致负面宣传、警告信、改正广告以及潜在的民事和刑事处罚。
其他美国医保法和合规性要求
对于在美国分销的产品,我们还将接受联邦 政府和我们开展业务的州的额外医疗法规和执法。适用的联邦和州医疗法律法规包括 以下内容:
| ● | 联邦医疗保健反回扣法规除其他事项外,禁止任何人在知情和故意的情况下,直接或间接以现金或实物形式索取、提供、收受或提供报酬,以诱导或奖励个人推荐或购买、订购或推荐任何商品或服务,而这些商品或服务可根据联邦医疗保健计划 ,如Medicare、Medicaid或其他政府计划进行支付。个人或实体不需要实际了解联邦反回扣法规或违反该法规的具体意图即可实施违规;此外,根据《虚假申报法》,因违反联邦反回扣法规而产生的物品或服务可能构成虚假或欺诈性索赔; |
| 84 |
| ● | 《患者转诊道德法》(通常称为《斯塔克法》)及其相应法规禁止医生将根据Medicare或Medicaid计划报销的指定健康服务(包括门诊药物) 转介给医生或其直系亲属与其有财务关系或所有权利益的实体,但受监管例外的限制,并禁止这些实体向Medicare或Medicaid提交支付项目或向转介受益人提供的服务的索赔; | |
| ● | 联邦虚假索赔法案对故意或导致向联邦政府提出虚假或欺诈性或虚假陈述以避免、减少或隐瞒向联邦政府支付款项的义务的个人或实体施加刑事和民事处罚,包括民事举报人或准诉讼; | |
| ● | 1996年的《保险携带和责任法案》规定了实施诈骗任何医疗福利计划的计划的刑事和民事责任,并规定了保护个人可识别健康信息的隐私、安全和传输方面的义务,包括强制性合同条款。该法规还禁止故意伪造、隐瞒或掩盖与交付或支付医疗福利、项目或服务有关的重大事实或作出任何重大虚假陈述; | |
| ● | 联邦虚假陈述法禁止故意伪造、隐瞒或掩盖重大事实,或作出与提供或支付医疗保健福利、项目或服务有关的任何重大虚假陈述; | |
| ● | 根据ACA创建的《医生支付阳光法案》及其实施条例,要求特定的药品、设备、生物制品和医疗用品制造商 在Medicare、Medicaid或儿童健康保险计划下可获得付款的 除特定例外情况外,每年向Medicare&Medicaid服务中心(CMS)报告与向医生支付款项或其他“价值转移”有关的信息。所有此类报告的信息都是公开的;以及 | |
| ● | 类似的州法律法规,如州反回扣和虚假索赔法律,可能适用于涉及由非政府第三方付款人(包括私人保险公司)报销的医疗项目或服务的销售或营销安排和索赔,一些州法律 要求制药公司遵守制药行业的自愿合规指南和联邦政府颁布的相关合规指南。 |
由于这些法律的广度以及法定例外和可用避风港的狭隘,我们 未来的一些商业活动可能会受到一项或多项此类法律的挑战。努力确保我们与第三方的业务安排符合适用的法律和法规,这将涉及大量成本。政府 当局可能会得出结论,我们的业务实践可能不符合当前或未来涉及 适用的欺诈和滥用或其他医疗保健法律和法规的法律、法规或判例法。如果我们的运营被发现违反了这些 法律或任何其他可能适用于我们的政府法规,我们可能会受到重大的民事、刑事和行政 处罚、损害赔偿、罚款、被排除在政府资助的医疗保健计划(如Medicare和Medicaid)之外,以及削减或 重组我们的运营。如果我们预期与之开展业务的任何医生或其他提供者或实体被发现 不符合适用法律,他们可能会受到刑事、民事或行政制裁,包括将 排除在政府资助的医疗保健计划之外。
| 85 |
报销
我们候选产品在美国的销售额 可能在一定程度上取决于第三方付款人支付候选产品成本的程度,如政府医疗计划、商业保险和管理的医疗保健组织。这些第三方付款人对医疗产品和服务的收费提出了越来越多的挑战。此外,控制医疗成本已成为联邦和州政府的优先事项,药品价格一直是这一努力的重点。美国政府、州立法机构和外国政府对实施成本控制计划表现出了极大的兴趣,包括价格控制、限制报销和非专利产品的替代要求。采用 价格控制和成本控制措施,以及在现有控制和措施的司法管辖区采用更严格的政策, 可能会进一步限制我们的净收入和业绩。如果这些第三方付款人不认为我们的候选产品与其他可用的疗法相比具有成本效益 ,他们可能不会在批准后将我们的候选产品作为其计划下的一项福利覆盖,或者,如果他们这样认为,付款水平可能不足以让我们在有利可图的基础上销售我们的候选产品。
为了确保可能被批准销售的任何产品的承保范围和报销,我们可能需要进行昂贵的药物经济学研究,以证明该产品的医疗必要性和成本效益,以及获得FDA、EMA或其他类似监管批准所需的成本。我们的候选产品可能不被视为具有医疗必要性或成本效益。 付款人决定为药品提供保险并不意味着将批准适当的报销率。 第三方报销可能不足以使我们能够将价格保持在足够高的水平,以实现产品开发投资的适当回报。
定价 和报销方案因国家/地区而异。一些国家规定,只有在商定了报销价格之后,才能销售药品。一些国家可能要求完成额外的研究,将特定候选产品的成本效益与目前可用的疗法进行比较。进行此类研究的成本可能很高,并导致我们的商业化工作延迟 。欧盟为其成员国提供了多种选择,以限制其国家医疗保险制度提供报销的药品范围,并控制供人使用的医疗产品的价格。欧盟成员国 可以批准药品的具体价格,或者转而对将药品投放市场的公司的盈利能力采取直接或间接控制制度。其他成员国允许公司自行确定药品价格,但监督和控制公司利润。总体上,医疗成本,特别是处方药的下行压力变得非常大。因此,对新产品的进入设置了越来越高的壁垒。此外,在某些国家/地区,来自低价市场的跨境进口产品会带来竞争压力,可能会降低一国国内的定价水平。不能保证 任何对药品实行价格控制或报销限制的国家/地区都会允许对我们的任何产品进行优惠的报销和定价安排。
如果政府和第三方付款人未能提供足够的保险和报销,我们获得监管部门批准用于商业销售的任何产品的适销性可能会受到影响。此外,美国对管理式医疗的重视程度也有所提高 ,我们预计这将继续增加药品定价的压力。承保政策、第三方报销费率和药品定价规则可能随时更改。 即使我们获得监管部门批准的一个或多个产品获得了有利的承保范围和报销状态,未来也可能会实施不太有利的承保政策和报销费率。
医疗保健 改革
在美国,已经并将继续有许多重要的立法举措来控制医疗成本。ACA于2010年3月在美国颁布,其中包含的条款可能会降低药品的盈利能力,包括 例如,增加受Medicaid药品返点计划约束的药品的返点、将Medicaid返点扩大到Medicaid管理的护理计划、对某些Medicare Part D受益人强制折扣,以及根据制药公司在联邦医疗保健计划的销售中所占份额 计算的年费。
| 86 |
此外,自《ACA》颁布以来,还提出并通过了其他立法修改。这些变化包括从2013年4月1日起将向提供商支付的医疗保险总金额削减 每财年2%,由于随后对法规进行的立法修订,这些削减将持续到2027年,除非国会采取额外行动;然而,根据CARE法案和随后的 立法,由于新冠肺炎疫情,这些削减将从2020年5月1日起暂停至2022年3月31日。2013年1月,《2012年美国纳税人救济法》签署成为法律,其中包括减少了对几家医疗服务提供者的医疗保险支付, 并将政府向提供者追回多付款项的诉讼时效期限从三年延长至五年。这些 新法律可能会导致医疗保险和其他医疗保健资金的进一步减少,如果获得批准,这可能会对我们药品的 客户以及我们的财务运营产生实质性的不利影响。
此外, 最近,政府加强了对制造商为其商业产品定价的方式的审查。 美国国会最近进行了几次调查,提出并颁布了联邦和州立法,旨在提高药品定价的透明度,审查定价与制造商患者计划之间的关系,降低医疗保险下的药品成本,并改革政府计划的药品报销方法。FDA于2020年9月24日发布了最终规则,自2020年11月30日起生效,为各州制定和提交来自加拿大的药品进口计划提供了指导。此外,2020年11月20日,美国卫生与公众服务部(HHS)敲定了一项法规,将药品制造商对D部分下的计划赞助商的降价安全港保护 直接或通过药房福利经理删除,除非法律要求降价。该规则还为反映在销售点的降价创造了新的安全港,并为药房福利经理和制造商之间的某些固定费用安排创造了安全港。 在州一级,立法机构越来越多地通过立法并实施旨在控制药品和生物制品定价的法规,包括价格或患者报销限制、折扣、对某些产品准入的限制 以及营销成本披露和透明度措施,在某些情况下,旨在鼓励从其他国家进口和 批量购买。
最近,2022年8月16日,2022年《降低通货膨胀率法案》或《爱尔兰共和军》签署成为法律。除其他事项外,爱尔兰共和军指示 卫生与公众服务部或HHS协商医疗保险覆盖的某些高支出、单一来源的药物和生物制品的价格 。谈判价格将于2026年首次生效,将以法定最高价格为上限 ,这意味着相对于批发商和直接购买者的平均价格有很大折扣。从2023年开始,该法律还将惩罚那些以高于通货膨胀率的速度提高联邦医疗保险B部分和D部分药品价格的药品制造商。此外,从2025年开始,IRA通过显著降低受益人的最大自付成本并创建新的制造商折扣计划,消除了Medicare Part D计划下的“甜甜圈漏洞”。爱尔兰共和军允许卫生和公众服务部部长在最初几年通过指导而不是监管来实施许多这些规定。HHS已经并将继续在这些计划实施时发布和更新指导,尽管爱尔兰共和军可能会受到法律挑战。目前尚不清楚IRA 将如何实施,但可能会对制药行业产生重大影响此外,为了回应拜登政府2022年10月的行政命令,HHS于2023年2月14日发布了一份报告,概述了医疗保险和医疗补助创新中心 测试的三种新模型,这些模型将根据它们降低药品成本、促进可获得性和提高医疗质量的能力进行评估 。目前还不清楚这些模型是否会在未来的任何医疗改革措施中使用。
尽管其中许多措施以及其他拟议的措施可能需要通过额外的立法授权才能生效,但国会 已表示将继续寻求新的立法措施来控制药品成本。
CMS 发布了一项最终规则,于2019年7月9日生效,该规则要求处方药和生物 产品的直接面向消费者的广告(可通过或根据联邦医疗保险或医疗补助付款)在广告中包括该药物或生物制品的批发采购成本或标价,如果该药物或生物制品每月供应或通常疗程的成本等于或大于35美元。违反这些要求的处方药和生物制品将被列入公开名单。
| 87 |
任何 医疗改革措施如果获得批准,都可能减少对我们产品的最终需求,或给我们的产品定价带来压力。 美国各州也越来越积极地通过立法和实施旨在控制药品定价的法规,包括价格或患者报销限制、折扣、对某些产品的限制 准入和营销成本披露和透明度措施,在某些情况下,旨在鼓励从其他国家/地区进口和批量购买。此外,地区医疗当局和个别医院越来越多地使用招标程序 来确定哪些药品和供应商将被纳入其处方药和其他医疗保健计划。 我们预计未来将采取更多的州和联邦医疗改革措施。
我们 预计未来将采取更多的州和联邦医疗改革措施,以及外国政府的法律改革,其中任何一项都可能限制政府为医疗保健产品和服务支付的金额,这可能导致对我们候选产品的需求减少或额外的定价压力。
员工
截至本招股说明书之日,我们有10名员工和全职顾问,包括我们的高管,提供管理和财务服务,以及一般行政责任。我们相信,我们与我们的员工保持着令人满意的工作关系 ,我们没有遇到任何重大的劳资纠纷或在为我们的运营招聘员工方面遇到任何困难。 我们的员工中没有工会代表。
人力资源 资本资源
我们的人力资本资源目标包括识别、招聘、留住、激励和整合我们现有的 和新员工、顾问和顾问。我们的股权和现金激励计划的主要目的是通过授予基于股票和现金的薪酬奖励来吸引、留住和奖励人员,以通过激励这些人员尽其所能并实现我们的目标来增加股东价值和公司的成功。
法律诉讼
我们 不是任何重大法律程序的一方。在正常业务过程中,我们可能会不时卷入法律诉讼或受到索赔事件的影响。无论结果如何,此类诉讼或索赔可能会因为 辩护和和解成本、资源转移和其他因素而对我们产生不利影响,并且不能保证会获得有利的结果 。
设施
我们的行政办公室位于康涅狄格州06405号布兰福德商业园大道21号约12,030平方英尺的租赁办公和实验室空间内。租约将于2027年到期,取决于我们是否选择将租约再延长两次,为期五年。根据租约,我们目前每月支付14,035美元,到2024年将增加到14,385美元,外加我们按比例分摊的某些物业运营费用 。
我们 还租用了约1,093平方英尺的额外实验室空间,位于康涅狄格州格罗顿申内科塞特路93号 06340。租约将于2024年4月到期,视我们是否选择将租约再延长一年而定。根据租约,我们每月支付7,235美元,外加我们按比例分摊的某些物业运营费用。
我们 还租用了约1,868平方英尺的办公和实验室空间,位于加拿大魁北克省拉瓦尔的卡地亚大道500号。根据租约,我们每月支付6,515美元。租约将于2024年4月到期,取决于我们是否选择将租约再延长 一年。
我们 相信我们的设施足以满足我们目前的需求,并且可以根据需要以商业上合理的条款获得更多空间。
| 88 |
管理
执行官员和董事
下表列出了我们现任高管和董事的姓名、年龄和职位。
| 名字 | 年龄 | 职位 | ||
| 弗朗西斯科·D·萨尔瓦 | 53 | 董事首席执行官总裁 | ||
| 诺曼·斯塔斯基 | 54 | 首席财务官 | ||
| 特拉维斯 惠特菲尔 | 34 | 首席运营官兼董事 | ||
| 安德鲁·麦克拉利,医学博士 | 38 | 独立 董事 | ||
| 芭芭拉 瑞安 | 64 | 独立 董事 | ||
| 约翰·施罗尔 | 58 | 独立 董事 |
有关我们的高管和董事的信息
弗朗西斯科·D·萨尔瓦自2021年4月以来,一直担任我们的总裁兼首席执行官和董事会成员。Salva先生在生物技术和制药行业的高级领导职位上拥有超过15年的经验。2018年5月至2020年8月,萨尔瓦先生担任专注于炎症和纤维化的生物制药公司Complexa,Inc.的总裁和首席执行官。 2011年2月至2016年11月,萨尔瓦先生担任专注于癌症和自身免疫的生物制药公司Acerta Pharma B.V.,Inc.的联合创始人兼副总裁总裁。萨尔瓦先生是文塞克斯制药公司(董事代码:VUC)的一名合伙人。在担任运营职务之前,Salva先生曾在风险投资和投资银行行业担任多个高级职位,专注于医疗保健、生物技术和制药公司。Salva先生拥有布朗大学的学士学位,以及伦敦政治经济学院的经济学和哲学硕士学位。我们相信,Salva先生作为生物科技和制药行业的高级管理人员、风险投资家和投资银行家的经验使他有资格在我们的董事会任职。
诺曼·斯塔斯基自2022年10月以来一直担任我们的首席财务官。自2021年5月15日以来,Staskey先生还担任丹福斯顾问公司的高级董事 ,该公司是一家全国性咨询公司,为生命科学行业提供财务、会计和报告服务。2014年9月至2021年5月,Staskey先生受雇于安永(前身为安永),最近担任安永财务会计和咨询服务业务的董事管理人员 。
特拉维斯 惠特菲尔是Azitra的联合创始人,自成立以来一直在我们的董事会任职。惠特菲尔先生曾在Azitra担任过各种职务, 从2014年1月至2019年9月担任首席科学官,自2019年9月以来担任董事先进技术公司的首席运营官, 自2023年6月以来担任首席运营官。2015年10月至2023年6月,惠特菲尔先生担任专注于生物技术的风险投资公司Bios Equity Partners,LP的合伙人,并于2014年9月至2023年6月担任Bios Research的高级分析师。他还分别于2016年7月至2022年3月和2022年3月以来在耶鲁大学担任副研究科学家和助理教授兼职 ,并在儿科和急诊医学系任职。惠特菲尔先生自2018年3月起担任IN8Bio,Inc.(纳斯达克代码:INAB)董事会成员,2017年9月至2019年7月担任410医疗公司董事会成员,2021年9月至2023年6月担任SIRPant免疫疗法公司董事会成员。惠特菲尔先生领导过许多赠款资助的项目,拥有多项专利,并与人合著了60多份出版物。 惠特菲尔先生拥有达拉斯浸会大学的学士学位、耶鲁大学的公共卫生硕士学位和伦敦大学学院的硕士学位。 我们相信,惠特菲尔先生在创业以及生物技术和医疗保健行业的深厚背景使他 有资格在我们的董事会任职。
| 89 |
安德鲁·麦克拉利,医学博士自2019年3月以来一直担任我们的董事会成员。McClary博士是KDT Ventures LP的创始普通合伙人,KDT Ventures是一家专注于生物技术的风险投资公司,成立于2017年。在KDT,McClary博士投资于利用物理科学和工程(包括计算和生物化学)交叉的公司。除了领导KDT在Azitra的投资外,McClary博士还领导KDT在PathAI、Dyno Treateutics、Solugen、Terray Treateutics、STRM Treeutics、Elegen和Checkerpot的投资。在KDT之前,McClary博士曾在斯坦福大学担任教职员工,并是Include Health(前身为Grand Runds)的早期员工,在那里他是数据科学和分析团队的内科主管。McClary博士在杜兰大学获得医学博士学位,他曾在该大学担任学术职务,是HHMI/NIH研究员,并在布朗大学获得生物化学和分子生物学理学学士学位。我们相信,McClary博士作为一名内科科学家的医疗和科学专长,再加上他在风险投资行业的工作经验,使他有资格在我们的董事会任职。
芭芭拉 瑞安自2023年6月以来一直担任本公司董事会成员。瑞安女士于2012年创立了资本市场和沟通公司Barbara Ryan Advisors,此前她在华尔街担任了30多年的研究分析师,涵盖美国制药行业。 瑞安女士在股权和债务融资、并购、估值、美国证券交易委员会报告、财务分析和企业战略 方面拥有丰富的经验。Ryan女士参与了行业内几笔最大的并购交易,包括Shire对Abbvie的敌意收购企图的辩护,Shire对Baxalta的收购,Allergan对Valeant的辩护以及Perrigo对Mylan的辩护。Ryan女士在2014年1月至2017年12月担任Radius Health的执行团队成员和披露委员会成员。此前,Ryan女士在德意志银行/Alex Brown担任董事执行董事19年,并领导该公司的药物研究团队达19年之久,并于1982年在贝尔斯登开始了她的制药行业研究生涯。 Ryan女士目前是水貂治疗公司(纳斯达克代码:iNKT)董事会的董事成员,担任审计委员会主席, INVO生物科学公司(纳斯达克:INVO),Invidior,PLC(伦敦股票代码:INDV)和红门社区(前吉尔达俱乐部纽约),是一个非营利性组织。Ryan女士是致力于推动女性在生物制药行业发展的非营利性组织--辉立医药女性组织的创始人, 是《制药高管》杂志编辑顾问委员会的成员,GLG研究所的教员,以及Prix Glen执行顾问委员会的成员。我们认为,Ryan女士之所以有资格担任董事会成员,是因为她在公司财务、并购、公司治理以及其他运营、财务和会计事务方面的经验 以及作为其他上市和私营公司前任和现任高管和/或董事获得的知识。
约翰·施罗尔自2023年6月以来一直担任本公司董事会成员。施罗尔自2022年3月以来一直担任Alumis,Inc.的首席财务官,这是一家私人持股的生物技术公司,开发精密免疫疗法。施罗尔先生在2021年2月至2022年2月期间担任阿森纳生物科学公司的首席财务官,该公司是一家私人持股的生物技术公司,开发实体肿瘤的可编程细胞疗法。施罗尔是生物科技公司Translate Bio,Inc.的首席财务长,该公司研发基因疗法和疫苗。赛诺菲于2021年9月斥资32亿美元收购了该公司,时间为2018年5月至2020年12月。此前,施罗尔先生在2014年1月至2018年5月期间担任国际资产管理公司安联全球投资者全球医疗保健部门主管。 施罗尔先生在威斯康星大学麦迪逊分校获得理学士和工商管理硕士学位。我们相信,施罗尔先生在生物技术行业担任领导职务的深厚背景,以及在生命科学领域近30年的投资经验,使他有资格在我们的董事会任职。
家庭关系
我们的任何高管或董事之间没有家族关系。
参与某些法律程序
据我们所知,在过去十年中,我们的高管或董事均未参与S-K法规第401(F)项 所述的任何法律诉讼。
| 90 |
董事会 组成
我们的 董事会可不时通过决议确定授权的董事人数。我们的董事会由五名成员组成,其中三名 根据纽约证券交易所美国人的上市规则符合独立资格。萨尔瓦先生和惠特菲尔先生均不被视为独立 ,因为他们是本公司的执行人员。然而,我们的董事会已经确定,麦克拉里博士、瑞安女士和施罗尔先生之间没有任何关系会干扰董事董事在履行职责时行使独立判断 ,该董事是“独立的”,该词由美国证券交易委员会的适用规则和规定以及纽约证券交易所美国上市公司的上市要求和规则所界定。在作出这一决定时,我们的董事会考虑了McClary博士、Ryan女士和Schroer先生每个人目前和以前与我们公司的关系,以及我们董事会认为与确定他们的独立性相关的所有其他事实和情况,包括他们对我们的股本的实益所有权。
董事会在风险监督中的作用
我们董事会的主要职能之一是对我们的风险管理过程进行知情监督。我们的董事会没有常设风险管理委员会,而是打算通过整个董事会以及我们董事会的各个常设委员会直接管理这一监督职能,这些委员会将处理各自监管领域的固有风险。特别是,我们的董事会将负责监测和评估战略风险敞口,我们的审计委员会将负责 考虑和讨论我们的主要财务风险敞口以及我们的管理层为监测和控制这些敞口而采取的步骤, 包括指导方针和政策,以管理进行风险评估和管理的流程。审计委员会还将监督法律和法规要求的遵守情况。
董事会 委员会
我们的 董事会成立了审计委员会、薪酬委员会以及提名和公司治理委员会,每个委员会都根据委员会章程运作。我们的董事会可能会设立其他委员会,以促进我们业务的管理。各委员会的组成和职能说明如下。
审计委员会
我们的审计委员会由McClary博士、Ryan女士和Schroer先生组成,Schroer先生担任主席。本公司董事会已确定 每位会员均符合《萨班斯-奥克斯利法案》、《交易所法案》下的规则10A-3以及纽约证券交易所美国上市公司适用的上市标准的独立性要求。我们审计委员会的每位成员都可以根据美国证券交易委员会和纽约证券交易所美国审计委员会的要求阅读和理解基本财务报表。在作出这一决定时,董事会审查了每名审计委员会成员的经验范围以及他们以前和/或现在工作的性质。
我们的 董事会认定,施罗尔先生具备美国证券交易委员会规定所指的审计委员会财务专家资格,并符合纽约证券交易所美国上市规则的财务复杂性要求。我们的独立注册会计师事务所和管理层都会定期与我们的审计委员会会面。
除其他事项外,该委员会的职能包括:
| ● | 选择 一家符合条件的会计师事务所作为独立注册会计师事务所审计我们的 财务报表; | |
| ● | 与独立注册会计师事务所讨论审计的范围和结果,与管理层和独立注册会计师事务所审查我们的中期和年终经营业绩; | |
| ● | 审查并批准聘请我们的独立审计师执行审计服务和任何允许的非审计服务; | |
| ● | 制定程序,让员工匿名提交对有问题的会计或审计事项的担忧; | |
| ● | 审查我们关于风险评估和风险管理的政策; | |
| ● | 审查 个关联方交易;以及 | |
| ● | 每年审查和评估审计委员会和审计委员会章程的业绩。 |
| 91 |
我们 相信,我们审计委员会的组成和运作符合萨班斯-奥克斯利法案的所有适用要求,以及所有适用的美国证券交易委员会和纽约证券交易所美国规则和法规。我们打算遵守未来的要求,直到这些要求变为适用于我们为止。
薪酬委员会
我们的薪酬委员会由瑞安女士和施罗尔先生组成,瑞安女士担任主席。每个会员都不是董事的雇员,如《交易法》颁布的第16b-3条规则所界定。我们的董事会已确定每个成员都是纽约证券交易所美国证券交易所适用的上市标准所定义的“独立” ,包括薪酬委员会成员的特定标准 。除其他外,该委员会的职能包括:
| ● | 审查、修改和批准我们的整体薪酬战略和政策(或如果它认为合适,向董事会全体成员提出建议)。 | |
| ● | 审查、修改和批准(或如果它认为适当,向董事会全体成员提出建议)我们执行官员的薪酬和其他雇用条件; | |
| ● | 审查 并批准(或如果它认为合适,向全体董事会提出建议) 我们建议的股权激励计划、薪酬计划和类似计划,以及修改、修改或终止现有计划和计划; | |
| ● | 管理 我们的股权激励计划; | |
| ● | 制定有关股权薪酬安排的政策;以及 | |
| ● | 每年审查和评估薪酬委员会的业绩和薪酬委员会章程。 |
我们 相信,我们薪酬委员会的组成和运作符合萨班斯-奥克斯利法案的所有适用要求,以及所有适用的美国证券交易委员会和纽约证券交易所美国规则和法规。我们打算在未来的要求适用于我们的范围内遵守这些要求。
提名 和公司治理委员会
我们的提名和公司治理委员会由McClary博士和Ryan女士组成,McClary博士担任主席。我们提名和公司治理委员会的组成 符合纽约证券交易所美国上市标准 和美国证券交易委员会规章制度对独立性的要求。除其他外,该委员会的职能包括:
| ● | 确定、评估并向董事会推荐董事会及其各委员会的提名人选。 | |
| ● | 评估本公司董事会和个人董事的业绩; | |
| ● | 审议董事会及其各委员会的组成,并向董事会提出建议; | |
| ● | 审查公司治理实践的发展情况; | |
| ● | 评估我们的公司治理实践和报告的充分性;以及 | |
| ● | 制定 并就公司治理准则和事项向我们的董事会提出建议。 |
我们的每个委员会都根据书面章程运作,满足纽约证券交易所美国证券交易所适用的上市要求和规则。
道德准则
我们 通过了适用于我们所有员工、高管和董事的道德准则。道德准则可在我们的网站www.azitrainc.com上找到。本公司董事会的审计委员会负责监督《道德守则》,并必须批准 员工、高管和董事对《道德守则》的任何豁免。此外,我们已在我们的网站上张贴了适用证券交易所的法律或上市标准要求的所有披露,涉及对道德守则任何条款的任何修订或豁免 。
| 92 |
高管薪酬
官员 薪酬
下表列出了截至2023年12月31日和2022年12月31日的年度,我们的首席执行官和另外两名薪酬最高的高管获得的薪酬。在审阅该表时,请注意:
| ● | 弗朗西斯科·D·萨尔瓦于2021年4月被任命为我们的总裁兼首席执行官; | |
| ● | 诺曼·斯塔斯基于2022年10月被任命为首席财务官;以及 | |
| ● | Travis Whitfill先生于二零二三年六月获委任为我们的首席营运官。 |
| 年 | 薪金(元) | 奖金(美元) | 期权奖励$(1) | 所有其他补偿(2) | 总计 | |||||||||||||||||||
| 弗朗西斯科·D萨尔瓦, | 2023 | $ | 420,000 | $ | — | $ | — | $ | 7,030 | $ | 427,030 | |||||||||||||
| 总裁兼CEO | 2022 | $ | 403,846 | $ | — | $ | — | $ | 202 | $ | 404,048 | |||||||||||||
| 诺曼·斯塔斯基 | 2023 | $ | — | $ | — | $ | 20,700 | $ | 314,025 | $ | 334,725 | |||||||||||||
| 首席财务官 | 2022 | $ | — | $ | — | $ | — | $ | 63,200 | $ | 63,200 | |||||||||||||
| 特拉维斯·惠特菲尔, | 2023 | $ | 158,846 | $ | — | $ | 20,700 | $ | 2,767 | $ | 182,313 | |||||||||||||
| 首席运营官 | 2022 | $ | -- | $ | — | $ | — | $ | 10,050 | $ | 10,050 | |||||||||||||
| (1) | 该 以上期权奖励列中的美元金额反映了截至 截至2023年及2022年12月31日止年度的授出日期,根据 ASC 718, 薪酬--股票薪酬(“ASC 718”),因此, 并不一定反映个人获得的实际利益。 中使用的假设 该等金额的计算载于本公司经审核财务报表附注11。 |
| (2) | 全部 其他补偿包括通勤福利、假期支出、搬迁补偿, 401 K匹配的贡献,人寿保险费,加上为先生支付的咨询费。 Staskey作为首席财务官的服务和支付给Whitfill先生的咨询费 在被任命为首席运营官之前。 |
Narrative 向主管人员薪酬表披露
我们目前任命的所有高管都是随心所欲的员工,下面是他们当前薪酬安排条款的摘要 。
弗朗西斯科·D·萨尔瓦
我们 已于2021年4月22日与Salva先生签订了高管聘用协议,根据该协议,Salva先生将担任我们的总裁 兼首席执行官。根据协议,我们已同意向萨尔瓦先生支付42万美元的年度基本工资。根据我们董事会设定的绩效参数,Salva先生也有资格获得高达其基本工资的35%的奖金。Salva先生的高管雇佣协议使他有权参加医疗保险和其他福利,费用由我们承担,并提供给其他高管 官员。如果Salva先生被我们无故解雇或因正当理由辞职,如高管聘用协议中所定义的此类条款 ,Salva先生将有权在12个月内继续领取其基本工资和医疗保险,并按比例获得终止发生当年的年度奖金,但须满足适用的业绩目标。Salva先生的高管雇佣协议是一项“随意”协议,可由任何一方在任何时间以任何理由终止,但须遵守某些通知要求。该协议包含与知识产权转让、保密和赔偿有关的惯例条款。
| 93 |
在我们执行高管聘用协议时,我们授予Salva先生一项选择权,根据2016年计划,我们可以每股1.56美元的行使价购买最多465,760股我们的普通股。期权的归属和行使如下: 80%的期权或购买372,608股我们普通股的期权受基于时间的归属的约束,其中购买93,152股(25%)的期权在授予一周年的第一周年归属,购买279,456股(75%)的期权在一周年后的36个月内按月等额分期付款;20%的期权或购买13,120股我们普通股的期权 将根据患者剂量授予ATR-12或替代生物治疗产品的首次人体临床试验, 由我们的董事会以合理的酌情权确定。期权在授予之日的十年纪念日到期。
诺曼·斯塔斯基
根据我们与丹福斯顾问有限责任公司于2002年10月12日签订的咨询协议,斯塔斯基先生担任我们的首席财务官。根据咨询协议,丹福斯顾问公司向我们提供某些战略和财务咨询及支持服务,包括Staskey先生作为首席财务官提供的服务,每小时收费在135美元至575美元之间,具体取决于服务水平和服务提供商的资历。咨询协议可由任何一方在30天书面通知后终止 ,并包含与知识产权转让、保密和赔偿有关的惯例条款。
2023年9月8日,我们向Staskey先生授予了一项根据2016年计划以每股2.07美元的行使价购买最多10,000股我们普通股的期权。 这些期权受基于时间的归属的限制,其中购买2,500股(25%)的期权在授予一周年的第一周年归属时授予 ,购买7,500股(75%)的期权在授予一周年后的36个月内按月等额分期付款; 期权在授予日期的十年周年日到期。
特拉维斯 惠特菲尔
我们已于2023年7月5日与惠特菲尔先生签订了高管聘用协议,根据该协议,惠特菲尔先生将担任我们的首席运营官。根据协议,我们已同意向惠特菲尔先生支付350,000美元的年基本工资。惠特菲尔先生也有资格根据我们董事会设定的绩效参数获得高达其基本工资30%的奖金。惠特菲尔先生的高管雇佣协议使他有权参加医疗保险和其他福利,费用由我们承担,提供给其他高管 官员。如果惠特菲尔先生因除原因或他丧失工作能力以外的任何原因被我们终止,惠特菲尔先生将有权继续他的基本工资六个月 个月,如果在终止时没有支付,他将有权获得终止发生的前一年的年度奖金。 惠特菲尔先生的高管雇佣协议是一项“随意”协议,可由任何一方在 任何时间和任何原因终止,受某些通知要求的限制。该协议包含与知识产权转让、保密和赔偿有关的惯例条款。
2023年9月8日,我们授予惠特菲尔先生根据2016年计划以每股2.07美元的行使价购买最多10,000股普通股的选择权。该等购股权须按时间归属,购入2,500股(25%)的购股权于授出日期的第一周年归属,而购入7,500股(75%)的购股权于授出一周年后的36个月内按月等额分期付款 ;该等购股权于授出日期的十年内到期。
非员工 董事薪酬
2023年9月8日,我们授予芭芭拉·瑞安和约翰·施罗尔各自的选择权,根据2016年计划,以每股2.07美元的行使价购买最多10,000股我们的普通股。购股权须按时间归属,购入2,500股(25%)的期权于授出一周年后归属,购入7,500股(75%)的期权于授出一周年后的36个月内按月等额分期付款 ,但须继续在本公司董事会任职;购股权将于授出日期十年届满。
除上述选项外,本公司并无向本公司董事支付任何董事酬金或其他酬金。我们的所有董事都将获得报销 参加董事会会议的自付费用。我们打算开始支付我们的非执行董事,包括支付现金和股权奖励,或两者兼而有之,但截至 日期,我们尚未采取任何此类计划或政策。我们也可能不时聘请某些外部董事会成员代表我们提供服务,我们 将对该等人士提供的服务给予补偿。
股票 激励计划
我们 通过了Azitra,Inc.2016股票激励计划,规定授予非限制性股票期权和激励 股票期权以购买我们普通股的股票,并授予限制性和非限制性股票授予和限制性股票 单位。根据2016年计划,我们目前已预留242,345股普通股。2016年计划的目的是为 符合条件的参与者提供获得我们公司所有权权益的机会。根据2016年计划,我们公司的所有高级管理人员、董事、员工和顾问都有资格参加。2016年计划规定,不得以低于授予日我们普通股公平市场价值的行权价格 授予期权。截至本招股说明书日期,我们拥有根据2016年计划授予的未偿还期权,可按平均行权价每股1.34美元购买1,248,255股普通股。
2023年3月,我们的董事会和股东批准并通过了Azitra,Inc.2023年股票激励计划,即2023年计划,规定授予非限制性股票期权和激励性股票期权以购买我们的普通股,并授予限制性和非限制性股票授予和限制性股票单位。我们目前已根据2023年计划预留了200万股普通股。2023年计划的目的是为符合条件的参与者提供获得我们公司所有权权益的机会。 根据2023年计划,我们公司的所有高管、董事、员工和顾问都有资格参与。2023年计划规定,不得以低于授予日我们普通股公平市场价值的行权价授予期权。 截至本招股说明书日期,我们根据2023年计划授予的未偿还期权可按平均行权价每股2.07美元购买40,000股普通股 。
| 94 |
相关的 方交易
除以下所述的 外,自2020年1月1日以来,本公司从未参与任何交易,交易涉及的金额 超过12万美元或本公司截至2022年和2021年12月31日的总资产平均值的1%,且本公司的任何董事、高管或据我们所知,拥有超过5%的有投票权证券的实益拥有人或任何前述人士的直系亲属已经或将拥有直接或间接重大利益(薪酬安排除外),其中包括股权和其他补偿,终止、控制权变更和其他安排,具体说明如下:高管薪酬“我们采取了一项政策,与董事、高级管理人员、持有我们普通股5%或以上的实益所有者、上述任何直系亲属或前述任何人也是高级管理人员或董事或他们拥有财务利益的实体进行的任何交易,将仅以符合行业标准的条款进行,并得到本公司董事会多数无利害关系董事的批准。
于2022年9月,本公司向五名现有股东发行本金总额为435万美元的无抵押可转换本票,包括本金总额为400万美元的票据予三个共同控制的基金,分别为Bios Fund III、 LP、Bios Fund III QP,LP及Bios Fund III NT,LP。Bios实体实益拥有紧接本次发行前我们已发行普通股的合计4,883,658股,或约43.0%。关于Bios Entities对我们公司的投资,我们授予了Bios Entities某些董事会委任权,据此他们向我们的董事会任命了一名Bios代表,该代表在2016年4月至我们2023年6月IPO日期之前在我们的董事会任职。此外,我们的联合创始人、首席运营官兼董事会成员特拉维斯·惠特菲尔在2023年6月之前一直是Bios Equity Partners,LP的合伙人,Bios Equity Partners LP是上述 Bios实体的普通合伙人。
2019年12月,我们与拜耳签订了联合开发协议(JDA),根据该协议,我们同意联合开发从我们的专有微生物文库中挑选出来的某些菌株。拜耳在执行JDA时向我们支付了一次性较低的六位数付款。根据联合开发协议,拜耳负责偿还我们的开发成本,2023年拜耳向我们支付了六位数的开发成本。我们向拜耳授予了一项选择权,可以为最多六个受JDA开发活动约束的 (6)品系获得独家版税许可,包括任何相关专利权的独家版税许可。
2020年9月,拜耳的风险投资集团Leaps by Bayer购买了我们B系列优先股800万美元。关于该项投资,吾等授予拜耳若干董事会委任权,据此,拜耳委任一名拜耳代表 加入本公司董事会,此人于2020年9月至本招股说明书日期前一天在本公司董事会任职。
赔偿协议
我们 已与我们的每位董事和执行官签订了可能比DGCL中包含的具体 赔偿条款更广泛的赔偿协议。这些赔偿协议要求我们(除其他事项外)对我们的董事 和执行官因其地位或服务而可能产生的责任进行赔偿。这些赔偿协议还 要求我们预付董事和执行官在调查或辩护任何此类诉讼、起诉、 或程序时发生的所有费用。我们认为,这些协议对于吸引和留住合格的个人担任董事和执行 官是必要的。
董事责任限制及董事和高级职员的赔偿
特拉华州一般公司法规定,公司可在其公司注册证书中加入一项条款,免除董事因违反其作为董事的受托责任而承担的金钱责任,但该条款不得免除或限制董事的以下责任:(I)违反董事对公司或其股东的忠诚义务;(Ii)非善意的行为或不作为,或涉及故意不当行为或明知违法;(Iii)非法支付股息或非法股票购买或赎回,或(Iv)董事从中获得不正当个人利益的任何交易。 我们修订并重述的公司注册证书规定,董事在特拉华州法律允许的最大程度上违反其作为董事的受托责任,不对我们或我们的股东承担金钱损害赔偿责任。除上述规定外,我们修订和重述的公司注册证书规定,我们将在法律允许的最大程度上对董事和高级管理人员进行赔偿。
我们修订和重述的公司注册证书中的 上述规定可能会降低针对董事的衍生 诉讼的可能性,并可能会阻止或阻止股东或管理层就董事违反其受托责任 提起诉讼,即使这样的诉讼如果成功,可能会使我们和我们的股东受益。但是, 我们认为,上述规定对于吸引和留住合格人员担任董事是必要的。
鉴于根据上述条款或其他规定,我们的董事、高级管理人员和控制人员可能被允许对1933年证券法下产生的责任进行赔偿,我们已被告知,美国证券交易委员会认为此类赔偿 违反证券法中所表达的公共政策,因此不可强制执行。
| 95 |
主要股东
下表列出了截至本招股说明书发布之日我们普通股的实益所有权的某些信息,具体如下:
| ● | 我们所知的持有我们 已发行和已发行普通股的5%(5%)以上的实益所有人; | |
| ● | 每个 我们的执行官和董事;以及 | |
| ● | 全部 上述董事及行政人员作为一个整体。 |
每个人的受益所有权是根据发行前已发行和流通的12,097,643股普通股计算的。 美国证券交易委员会将“受益所有权”定义为比通常意义上的所有权更广泛的所有权。例如,一个人拥有一个股份的受益 所有权,不仅是因为他拥有该股份,而且还因为他拥有(单独或共同)投票、出售或以其他方式处置该 股份的权力。实益拥有权亦包括任何人士有权于本 招股章程日期起计60日内,根据行使购股权或认股权证或转换票据、债权证或其他债务而收购的股份数目。两个或两个以上 人可被视为同一股份的受益所有人。本次发行后我们普通股的所有权百分比假设我们 在本次发行中出售普通股,并且没有行使承销商的超额配售权。
除非 另有说明,每个报告人的地址为c/o Azitra,Inc.,康涅狄格州布兰福德商业园大道21号,邮编06405。
| 名称 董事兼执行官 | 股份数量: | 百分比 发售前拥有 | 百分比 发售后拥有 | |||||||||
| 弗朗西斯科·D萨尔瓦 (1) | 268,929 | 2.2 | % | 1.8 | % | |||||||
| 诺曼·斯塔斯基 | — | * | * | |||||||||
| 特拉维斯·惠特菲尔(2) | 412,653 | 3.4 | % | 2.7 | % | |||||||
| 安德鲁·麦克拉利(3) | 313,713 | 2.6 | % | 2.1 | % | |||||||
| 芭芭拉·瑞安 | — | * | * | |||||||||
| 约翰·施罗尔 | — | * | * | |||||||||
| 董事和高管 军官,作为一个群体(6人) | 995,295 | 8.0 | % | 6.4 | % | |||||||
| 名称和 5%股东的地址 | 股份数量: | 百分比 发售前拥有 | 百分比 发售后拥有 | |||||||||
| 生物股权实体 (4) | 6,799,021 | 55.5 | % | 44.6 | % | |||||||
| 拜耳保健有限责任公司(5) | 1,307,401 | 10.8 | % | 8.7 | % | |||||||
| Connecticut Innovations,Inc. (6) | 814,031 | 6.7 | % | 5.4 | % | |||||||
| * | 占我们已发行普通股数量的 不到1%。 |
| (1) | 包括 263,929股我们的普通股在行使目前可行使的期权时可发行。 |
| (2) | 包括 93,153股可于行使现时可行使购股权时发行之股份。 |
| (3) | 该 证券由KdT Ventures LP持有,McClary先生是其管理合伙人。包括 21,802股我们的普通股可在认股权证行使时发行。 |
| (4) | Consists of (i) 799,467 shares of common stock held by Bios Fund I, LP, (ii) 436,173 shares of common stock and 39,760 shares of common stock issuable upon the exercise of warrants held by Bios Azitra Co-Invest I, LP, (iii) 313,250 shares of common stock and 22,726 shares of common stock issuable upon the exercise of warrants held by Bios Fund II, LP, (iv) 404,767 shares of common stock held by Bios Fund III, LP, (v) 467,613 shares of common stock held by Bios Fund I QP, LP, (vi) 1,023,442 shares of common stock and 74,236 shares of common stock issuable upon the exercise of warrants held by Bios Fund II QP, LP and 74,236 shares of common stock issuable upon the exercise of warrants, (vii) 2,643,705 shares of common stock held by Bios Fund III QP, LP, (viii) 137,000 shares of common stock and 9,938 shares of common stock issuable upon the exercise of warrants held by Bios Fund II NT, LP, (ix) 426,944 shares of common stock held by Bios Fund III NT, LP. Bios Equity Partners, LP is the general partner of the following entities: Bios Fund I, LP and Bios Fund I QP, LP. Bios Equity Partners II, LP is the general partner of Bios Fund II, LP, QP, LP, Bios Fund II, LP and Bios Fund II NT, LP. Cavu Management, LP, an entity managed and controlled by Mr. Les Kreis, and Bios Capital Management, LP, an entity managed and controlled by Mr. Aaron Fletcher, are the general partners of Bios Equity I, LP and Bios Equity II, LP. Cavu Advisors LLC, an entity that is managed and controlled by Mr. Kreis, is the general partner of Cavu Management LP. Bios Advisors GP, LLC, an entity that is managed and controlled by Mr. Fletcher, is the general partner of Bios Capital Management, LP. The shares owned by Bios Fund I, Bios Fund I QP, Bios Fund II, Bios Fund II QP, Bios Fund II NT and Bios Fund III NT (“Bios Equity Entities”) are aggregated for purposes of reporting share ownership information. Mr. Kreis and Mr. Fletcher share voting and investment control with respect to shares held by the Bios Equity Entities. Travis Whitfill, a chief operator officer and director of the Company, was a partner at Bios Equity Partners, LP until June 2023, but did not have any voting or investment control with respect to the shares held by the Bio Equity Entities. The address for Bios Equity Entities is 1751 River Run, Suite 400, Fort Worth, Texas 76107. |
| (5) | 该 拜耳医疗保健有限责任公司的地址是610 Main Street Cambridge,Massachusetts 02139。 |
| (6) | 包括 行使认股权证时可发行的41,314股普通股。康涅狄格州的地址 创新公司地址:470 James Street,Suite 8 New Haven,CT 06513 |
| 96 |
证券说明
一般信息
下面的描述总结了我们的股本中最重要的条款。由于它只是一个摘要,因此不包含可能对您重要的所有 信息。有关本《证券说明》中所述事项的完整描述, 您应参考我们修订和重述的公司注册证书以及修订和重述的法律和投资者权利协议, 作为本招股说明书一部分的注册说明书的证物,以及特拉华州法律的适用条款 。
我们的法定股本包括100,000,000股普通股,每股面值0.0001美元,以及1,000,000股非指定 优先股,每股面值0.0001美元。
截至本招股说明书日期,已发行普通股有12,097,643股,优先股未发行。
截至本招股说明书发布之日,我们有32名登记在册的股东。
普通股 股票
普通股持有者每持有一股普通股可享有一票投票权。普通股持有人有权在董事会酌情决定的时间和数额获得董事会可能宣布的任何股息 从可用于支付股息的合法资金中 。在本公司发生任何清算、解散或清盘的情况下,普通股持有人有权 按普通股持有人持有的普通股股数按比例收取可供分配给其股东的公司资产。普通股持有者没有优先认购权、转换权、认购权或累计投票权。
优先股 股票
截至本招股说明书日期,共有1,000,000,000股非指定优先股获授权发行,其中无一股已发行。
我们的 董事会被授权在不采取进一步行动的情况下,不时为一个或多个优先股系列提供未发行的优先股 股票,并就每个此类系列确定组成该系列的股份数量和该系列的指定、该系列股票和优先股的权力(包括投票权) 和相对、参与、可选、特别或其他权利(如果有),以及该系列股票的资格、限制或限制(如果有)。发行我们的优先股可能会对我们普通股持有人的投票权 以及这些持有人在清算时获得股息和付款的可能性产生不利影响。此外,发行优先股可能具有推迟、推迟或防止控制权变更或其他公司行动的效果。
预付资金 认股权证
以下提供的预资资权证的某些条款和条款的摘要并不完整,受预资资权证条款的约束,并受预资资权证条款的全部限制,其形式作为注册声明的证物提交,本招股说明书是其中的一部分。潜在投资者应仔细阅读预融资权证表格的条款和条款,以获得预融资权证的条款和条件的完整说明。
持续期 和行权价
在此发售的每一份预付资金认股权证的初始行权价将相当于每股普通股0.001美元。预资权证 将可立即行使,并可随时行使,直至预资权证全部行使为止。在股份分红、股份分拆、重组或类似事件影响我们的普通股股份和行权价格时,行权价格和行权时可发行的普通股股份数量将进行适当的比例调整。
| 97 |
可运动性
预筹资认股权证将可由每名持有人选择全部或部分行使,方式为向吾等递交正式签立行使权证通知,并于(I)两个交易日及(Ii)普通股标准结算期内的交易日内(以较早者为准),就行使权证后有效的普通股标准结算期 全数支付因行使权证而购买的普通股股数(以下讨论的无现金行使除外)。持有人 不得行使预先出资认股权证的任何部分,条件是持有人及其关联公司和任何其他作为集团行事的人 将拥有超过4.99%(或在购买者选择时,9.99%)在行使权证后紧随其后发行的普通股数量 的股份(“受益所有权限制”);如果受益所有权限额为4.99%的持有人在收到通知后61天内发出使用通知,可以提高受益所有权限额,只要该限额在任何情况下都不超过行权后已发行普通股数量的9.99% 。
无现金锻炼
The Pre-Funded Warrants may also be exercised, in whole or in part, at such time by means of “cashless exercise” in which the holder shall be entitled to receive upon such exercise (either in whole or in part) the net number of shares of common stock determined according to a formula set forth in the Pre-Funded Warrants, which generally provides for a number of shares of common stock equal to (A)(1) the last closing trade price for such security on NYSE American on (x) the trading day immediately preceding the date of the applicable notice of exercise, if the notice of exercise is executed and delivered on day that is not a trading day or prior to the opening of “regular trading hours” on a trading day or (y) the trading day of the notice of exercise, if the notice of exercise is executed and delivered after the close of “regular trading hours” on such trading day; (2) at the option of the holder, either (x) the volume weighted average price on the trading day immediately preceding the date of the applicable notice of exercise or (y) the bid price of our common stock on NYSE American as of the time of the holder’s execution of the applicable notice of exercise if such notice of exercise is executed during “regular trading hours” on a trading day and is delivered within two hours thereafter (including until two hours after the close of “regular trading hours” on a trading day); or (3) the last closing trade price for such security on NYSE American on the day of the notice of exercise, if the notice of exercise is executed and delivered after “regular trading hours” on a trading day, less (B) the exercise price, multiplied by (C) the number of shares of common stock the Pre-Funded Warrant was exercisable into, with such product then divided by the number determined under clause (A) in the this sentence.
零碎的 股
在行使预先注资认股权证时,将不会发行 普通股的零碎股份。相反,我们将根据我们的选择, 支付与该最终部分有关的现金调整,金额等于该部分乘以行使价,或 向上舍入到下一个普通股整股。
可转让性
在符合适用法律的情况下,预付资金认股权证可在持有人将预付资金认股权证交还给我们时由持有人选择转让,连同适当的转让文书和足以支付此类转让时应缴任何转让税款的资金。
交易 市场
在任何证券交易所或国家认可的交易系统上,都没有预融资权证的交易市场。我们 不打算在任何证券交易所或国家认可的交易系统上上市预融资权证。在行使预融资认股权证后可发行的普通股股票目前在纽约证券交易所美国证券交易所挂牌上市,代码为“AZTR”。
股东权利
除 预资金权证另有规定或该持有人对普通股相关股份的所有权另有规定外, 预资资权证持有人在行使预资资权证之前,并不享有以普通股股份为代表的本公司普通股持有人的权利或特权,包括任何投票权。
基本交易
如果发生预筹资权证中所述的基本交易,一般包括我们普通股的任何重组、资本重组或重新分类,出售、转让或以其他方式处置我们所有或几乎所有的财产或资产,我们与另一人的合并或合并,收购我们50%以上的普通股流通股或50%或更多的公司普通股投票权,预资金权证的持有人将有权在行使预资金权证时获得持有者在紧接该基本交易前行使预资金权证时应获得的证券、现金或其他财产的种类和数量。
认股权证
我们 已发行以下认股权证,以购买我们普通股的股份:
| ● | 因我们于2018年4月配售无抵押可转换本票而发行的认股权证 以每股行使价相当于0.48美元的价格购买最多47,890股我们的普通股。这些认股权证将于2028年4月到期。 | |
| ● | 与我们2019年2月配售A-1系列可转换优先股相关而发行的认股权证 购买最多215,856股我们的普通股,每股行权价相当于5.28美元。这些认股权证将于2029年2月到期。 | |
| ● | 发行给我们IPO承销商的认股权证,购买60,000股我们的普通股。此认股权证可按每股6.25美元的价格执行。这些认股权证将于2028年6月到期。 |
| 98 |
股票 激励计划
我们 通过了Azitra,Inc.2016股票激励计划,规定授予非限制性股票期权和激励 股票期权以购买我们普通股的股票,并授予限制性和非限制性股票授予和限制性股票 单位。根据2016年计划,我们目前已预留242,345股普通股。2016年计划的目的是为 符合条件的参与者提供获得我们公司所有权权益的机会。根据2016年计划,我们公司的所有高级管理人员、董事、员工和顾问都有资格参加。2016年计划规定,不得以低于授予日我们普通股公平市场价值的行权价格 授予期权。截至本招股说明书日期,我们拥有根据2016年计划授予的未偿还期权,可按平均行权价每股1.34美元购买1,248,255股普通股。
2023年3月,我们的董事会和股东批准并通过了Azitra,Inc.2023年股票激励计划,即2023年计划,规定授予非限制性股票期权和激励性股票期权以购买我们的普通股,并授予限制性和非限制性股票授予和限制性股票单位。我们目前已根据2023年计划预留了200万股普通股。2023年计划的目的是为符合条件的参与者提供获得我们公司所有权权益的机会。 根据2023年计划,我们公司的所有高管、董事、员工和顾问都有资格参与。2023年计划规定,不得以低于授予日我们普通股公平市场价值的行权价授予期权。 截至本招股说明书日期,我们根据2023年计划授予的未偿还期权可按平均行权价每股2.07美元购买40,000股普通股 。
分红
我们 预计在可预见的未来不会为我们的普通股支付现金股息。
注册 权利
我们普通股的某些 持有者或其获准受让人有权享有下文所述的登记权。根据下文所述注册权的行使登记我们普通股的股票,将使持有人能够在适用的注册声明宣布生效时出售这些 股票而不受证券法的限制。除承销折扣和佣金外,我们将支付根据下述登记 登记的股份的登记费用 。以下所述的注册权将于2026年6月20日较早时到期,或当所有投资者(连同其附属公司被视为 )可根据规则144在三个月内出售其所有股份时到期。
可转换 优先股登记权。关于我们的可转换优先股融资,我们签订了一项经修订的投资者权利协议,根据该协议,我们已向可转换优先股的购买者授予若干需求和附带的呼吸权。该等各方实益持有约9,542,519股本公司普通股,包括1,838,775股本公司普通股,可在行使与本公司2018年配售无担保可转换本票及本公司2019年配售A-1系列可转换优先股相关的认股权证时发行。
根据投资者权利协议,吾等须应持有至少50%根据投资者权利协议有权享有登记权的股份的持有人的书面要求,在实际可行的情况下尽快登记该等股份的全部或部分以供 公开转售。吾等须根据S-1表格登记声明进行两次要求登记。 视乎我们是否有资格使用S-3表格登记声明,吾等须根据S-3表格进行不限次数的要求登记 ,条件是登记申请的总发行价(扣除承保折扣及 佣金)等于或大于1,000,000美元。根据投资者权利协议,我们还授予了搭载式登记 权利和需求登记权。当投资者可根据证券法第144条出售其受注册权协议约束的股份时,这些索取权和搭载式注册权即告终止,而不受第144条所规定的销售量限制。
| 99 |
承销商 注册权。关于我们的首次公开募股,我们向承销商代表或其指定人发行了认股权证,称为代表认股权证,以购买最多60,000股我们的普通股。代表的认股权证规定了登记权(包括一次性索要登记权和无限制的搭载权),符合《财务条例》规则5110.05。根据FINRA规则5110(G)(8)(C),注册要求可在代表权证首次行使之日起至本登记声明生效日期五周年之日止的任何时间提出。 除一次性要求登记权外,代表权证还享有不受限制的附带权利,期限为根据FINRA规则5110(G)(8)(D),自代表权证首次行使之日起不超过两年。
反收购 特拉华州法律和我们的宪章文件某些条款的效力
以下是特拉华州法律的某些条款以及我们修订和重述的公司注册证书以及修订和重述的章程的摘要。根据特拉华州的公司法以及我们修订和重述的公司章程以及修订和重述的章程,本摘要并不声称是完整的,其全文是有保留的。
特拉华州 法律
我们 受反收购法《特拉华州公司法》第203条的约束。一般而言,第203条禁止特拉华州 公司在股东成为利益股东之日起三年内与任何有利害关系的股东(定义见下文)进行任何业务合并,除非:
| ● | 在该日期之前,公司董事会批准了导致股东成为利益股东的企业合并或交易; | |
| ● | 在 导致股东成为有利害关系的股东的交易完成后, 有利害关系的股东在交易开始时至少拥有公司已发行有表决权股票的85%。为确定已发行的有表决权股票(但不包括相关股东拥有的有表决权股票)的数量, 不包括董事和高级管理人员所拥有的股票,也不包括员工参与计划的员工股票。无权决定按计划持有的股份是否将以投标或交换要约的形式进行投标;或 | |
| ● | 在该日或之后,企业合并须经公司董事会批准,并经股东年度会议或特别会议批准,而不是经书面同意。通过至少662/3%的已发行有投票权的非相关股东所拥有的股份的赞成票。 |
第 203节将“企业合并”定义为包括以下内容:
| ● | 涉及公司和利益相关股东的任何合并或合并; | |
| ● | 涉及利害关系人的公司资产的10%或以上的出售、转让、质押或其他处置。 | |
| ● | 除某些例外情况外,任何导致公司向有利害关系的股东发行或转让公司股票的交易; | |
| ● | 除有限的例外情况外,涉及公司的任何交易的效果是增加 有利害关系的股东实益拥有的任何类别或系列公司股票的比例份额;或 | |
| ● | 利益相关股东收到公司提供或通过公司提供的任何贷款、垫款、担保、质押或其他财务利益的利益。 |
总体而言,第203条将有利害关系的股东定义为任何实体或个人,他们实益拥有公司15%或以上的已发行有表决权股票,或在紧接确定该人是否为有利害关系的股东之前的三年期间内的任何时间,实益拥有公司已发行有表决权股票的15%或以上,以及与任何这些实体或个人有关联或控制或控制的任何实体或个人。
| 100 |
我们的 宪章文件
我们的 宪章文件包括的条款可能会阻止其他人对我们的股票提出收购要约,并可能 具有阻止敌意收购或推迟我们控制权或管理层变动的效果。这些规定旨在提高我们董事会组成及其政策持续稳定的可能性,并阻止可能涉及实际或威胁收购我们的某些类型的交易 。这些条款还旨在降低我们对主动收购提议的脆弱性,并阻止可能在代理权之争中使用的某些策略。然而,此类条款可能具有以下效果: 阻止、推迟或阻止股东可能认为有利的控制权变更或主动收购提议,包括可能导致为我们的股东持有的股份支付高于市场价的溢价的提议。 以下段落总结了其中某些条款。
授权但未发行的普通股和优先股的影响 。存在授权但未发行的普通股和优先股的影响之一可能是使我们的董事会更难或阻止通过合并、要约收购、委托书竞争或其他方式获得对我们公司的控制权的尝试,从而保护管理层的连续性。如果董事会在适当行使其受托责任时确定收购建议不符合我们的最佳利益,董事会可在一项或多项交易中 在没有股东批准的情况下发行此类股票,这些交易可能会通过稀释拟议收购人或反叛股东集团的投票权或其他权利来阻止或增加完成收购交易的难度或成本, 通过将大量投票权置于可能支持现任董事会地位的机构或其他人手中, 通过进行可能使收购复杂化或排除收购或以其他方式进行的收购。
累计投票 。我们修订和重述的公司注册证书没有规定在董事选举中进行累积投票, 这将允许持有股份少于多数的股东选举一些董事。
空缺。 我们修订和重述的章程规定,所有空缺均可由当时在任的大多数董事投赞成票来填补, 即使不足法定人数。
股东特别会议和股东书面同意的股东行动。股东特别会议只能由我们的董事会 或董事会主席召集。所有股东行动必须在正式召开的股东会议上进行,而不是经书面同意。
提前通知条款 。我们修订和重述的章程为寻求在我们的年度股东大会上开展业务或在我们的年度股东大会上提名董事候选人的股东提供了预先通知程序。我们修订的 和重述的章程还将对股东通知的形式和内容提出某些要求。如果不遵循适当的程序,这些条款 可能会阻止我们的股东向我们的年度股东大会提出事项,或在我们的年度股东大会上提名董事 。我们预计,这些规定还可能阻止或阻止潜在收购者征集代理人以选举收购者自己的董事名单,或以其他方式 试图获得对我们公司的控制权。
论坛选择 。我们修订和重述的公司注册证书以及修订和重述的章程将规定,特拉华州衡平法院将是代表我们提起的任何派生诉讼或诉讼的独家法院;任何声称违反受托责任的诉讼;根据特拉华州公司法、我们修订的 和重述的公司注册证书或我们的章程对我们提出索赔的任何诉讼;或受内部事务原则管辖的针对我们的索赔的任何诉讼。
转接 代理和注册表
我们普通股的转让代理和登记机构是VStock Transfer,LLC。转让代理和登记员的地址是纽约伍德米尔拉斐特广场18号,邮编:11598。
全国证券交易所上市
我们的普通股在纽约证券交易所美国交易所挂牌上市,代码为“AZTR”。
| 101 |
有资格在未来出售的股票
未来 出售大量普通股,包括行使已发行认股权证和期权后发行的股票,在本次发行后在公开市场上出售,或发生这些出售的可能性,可能会对我们普通股的现行市场价格产生不利影响 或削弱我们筹集股权资本的能力。
本次发行完成后,共发行15,097,643股。普通股将流通股。我们在此次发行中出售的所有3,000,000股普通股,加上承销商行使超额配售选择权后出售的任何股票,将 可以在公开市场上自由交易,不受限制,也不会根据证券法进行进一步登记,除非这些股票 由证券法第144条规则中定义的“关联方”持有。此外,在本次发行前已发行的12,097,643股普通股中,约3,984,145股将可以在公开市场自由交易,而不受证券法的限制或进一步注册。
剩余的8,113,498股普通股将被称为“受限证券”,这一术语在《证券法》第144条中有定义。这些受限制的证券只有在根据《证券法》注册或根据《证券法》第144条有资格获得豁免注册的情况下才有资格公开销售,其摘要如下。
在遵守下列锁定协议和证券法第144条规定的前提下,这些受限证券可在公开市场上销售。
规则 144
一般而言,根据现行的第144条规则,在出售前90天内的任何时间不被视为吾等联营公司之一的人士 如已实益拥有拟出售的股份至少六个月(包括除吾等联营公司以外的任何先前所有人的持有期),则有权在不遵守第144条的出售方式、成交量限制或通知规定的情况下出售该等股份,但须遵守 第144条的公开资料要求。如果该人实益拥有拟出售的股份至少一年,包括我们关联公司以外的任何先前所有人的持有期 ,则该人有权在不遵守第144条任何要求的情况下出售该等股份。
一般而言,根据目前有效的第144条规则,我们的关联公司或代表我们关联公司出售股份的人员有权在下列锁定协议到期后,在任何三个月内出售不超过以下较大者的股份数量:
| ● | 当时已发行普通股数量的1% ;或 | |
| ● | 在以表格144提交有关出售通知之前的四个日历周内,普通股的每周平均交易量。 |
我们的联属公司或代表我们的联属公司出售股份的人根据规则144进行的销售 也受某些销售条款和通知要求的约束,并受制于关于我们的当前公开信息的可用性。
锁定协议
除某些例外情况外,我们的每一位董事和高级管理人员已同意,在我们首次公开募股后十二(12)个月内,或在我们首次公开募股后十二(12)个月内,或在2024年6月15日之前,不直接或间接提供、质押、出售、合同出售、授予、借出或以其他方式转让或处置任何交换或其他安排,以全部或部分转让我们股本的任何股份或任何可转换为 或可行使或可交换为普通股的证券的任何经济后果。 未经代表事先书面同意。除某些例外情况外,我们已同意,除某些例外情况外,在本招股说明书发布之日起九十(90)天内,未经代表事先书面同意,我们同意在招股说明书发布之日起九十(90)天内,不得直接或间接提供、质押、出售、出售、授予、借出或以其他方式转让或处置任何 交换或其他安排,以全部或部分转让我们股本的任何股份或可转换为、可行使或可交换为我们普通股的任何证券的所有权的任何经济后果。
股权 计划
我们 已根据证券法向美国证券交易委员会提交了采用S-8表格的登记声明,登记将根据我们的2016年计划和2023年计划发行或保留发行的所有普通股。本注册声明所涵盖的股份在锁定协议到期或解除锁定协议条款后,有资格在公开市场出售,但须受该等股份归属的规限。
| 102 |
材料:美国联邦所得税对非美国持有者的影响
以下讨论是根据本次发行发行的普通股的购买、所有权和处置给非美国持有者(定义如下)带来的重大美国联邦所得税后果的摘要,但并不是对所有潜在税收影响的完整分析 。不讨论其他美国联邦税法的影响,如遗产税和赠与税法律,以及任何适用的州、当地或非美国税法。本讨论基于1986年修订后的《美国国税法》或《国税法》、据此颁布的《财政部条例》、司法裁决以及美国国税局或美国国税局公布的裁决和行政声明,每种情况下均自本协议生效之日起生效。这些机构可能会发生变化,或受到不同解释的影响。任何此类变更或不同的解释可能会追溯适用于可能对非美国持有人产生不利影响的方式。我们没有也不会寻求美国国税局就以下讨论的事项做出任何裁决。不能保证国税局或法院不会就购买、所有权和处置我们普通股的税收后果采取与以下讨论相反的立场。
本讨论仅限于将我们的普通股作为守则第1221条所指的“资本资产”持有的非美国持有者(通常是为投资而持有的财产)。本讨论不涉及与非美国持有人的特定情况相关的所有美国联邦所得税后果,包括联邦医疗保险缴费税对净投资收入的影响 和替代最低税。此外,它不涉及受特殊规则约束的非美国持有人的相关后果, 包括但不限于:
| ● | 在美国的侨民和前公民或长期居民; | |
| ● | 作为对冲、跨境或其他降低风险战略的一部分或作为转换交易或其他综合投资的一部分而持有我们的普通股的人员 ; | |
| ● | 银行、保险公司和其他金融机构; | |
| ● | 经纪商、交易商或证券交易商; | |
| ● | “受控制的外国公司”,“被动的外国投资公司”,以及通过积累收益来逃避美国联邦所得税的公司; | |
| ● | 合伙企业 或为美国联邦所得税目的被视为合伙企业的其他实体或安排 (及其投资者); | |
| ● | 免税组织或政府组织; | |
| ● | 根据《准则》的推定销售条款被视为出售我们普通股的人员; | |
| ● | 根据任何员工股票期权的行使或以其他方式作为补偿而持有或接受我们普通股的人员 ; | |
| ● | 符合税务条件的退休计划;以及 | |
| ● | “准则”第897条(L)(2)所界定的“合格境外养老基金”,以及其全部 权益由合格境外养老基金持有的实体。 |
如果出于美国联邦所得税的目的,被视为合伙企业的实体持有我们的普通股,则 合伙企业中合伙人的纳税待遇将取决于合伙人的状态、合伙企业的活动以及在合伙人 级别做出的某些决定。因此,持有我们普通股的合伙企业和此类合伙企业的合伙人应就美国联邦所得税对其产生的后果咨询其税务顾问。
此 讨论仅供参考,不是税务建议。投资者应就美国联邦所得税法在其特定情况下的适用情况以及根据美国联邦遗产法或赠与税法或根据任何州、地方或非美国征税管辖区的法律或任何适用的所得税条约购买、拥有和处置我们的普通股而产生的任何税收后果咨询他们的税务顾问。
| 103 |
非美国持有人的定义
就本讨论而言,“非美国持有人”是指我们普通股的任何实益持有人,既不是“美国人”,也不是美国联邦所得税中被视为合伙企业的实体。美国人是指就美国联邦所得税而言,被视为或被视为下列任何一项的任何人:
| ● | 是美国公民或居民的个人; | |
| ● | 根据美国、其任何州或哥伦比亚特区的法律创建或组织的公司; | |
| ● | 其收入应缴纳美国联邦所得税的遗产,无论其来源如何; 或 | |
| ● | A 信任(1)受美国法院的主要监督和一名或多名“美国人”的控制(符合《守则》第7701(A)(30)条的含义),或(2)就美国联邦所得税而言,具有被视为美国人的有效选举 。 |
分配
正如 在“分红政策”一节中所述,我们预计在可预见的将来不会宣布或向我们普通股的持有者支付红利。但是,如果我们在普通股上进行现金或财产分配,此类分配 将构成美国联邦所得税用途的股息,根据美国联邦所得税原则确定,从我们当前或累计的收益和利润中支付。对于美国联邦所得税而言,不被视为股息的金额将构成资本返还,并首先适用于非美国持有者的普通股调整后的计税基础,但不能 低于零。任何超出的部分将被视为资本利得,并将按照以下“-出售或其他应纳税处置”项下的描述进行处理。
根据以下关于有效关联收入的讨论,支付给非美国持有人的股息将按股息总额的30%缴纳美国联邦预扣税(或适用所得税条约规定的较低税率,前提是非美国持有人提供有效的IRS表格W-8BEN或W-8BEN-E(或其他适用文件),以证明 较低的条约税率的资格)。非美国持有者如果没有及时提供所需的文件,但有资格享受降低的条约费率,则可以通过及时向美国国税局提出适当的退款申请,获得任何扣留的超额金额的退款。非美国持有者 应咨询他们的税务顾问,了解他们根据任何适用的所得税条约享有的福利。
如果支付给非美国持有者的股息与非美国持有者在美国境内进行贸易或业务的行为有效相关(如果适用的所得税条约要求,非美国持有者在 美国境内设有永久机构),则该非美国持有者将免除上述美国联邦预扣税 。要申请豁免,非美国持有者必须向适用的扣缴代理人提供有效的美国国税局W-8ECI表格,证明股息与非美国持有者在美国境内进行的贸易或业务有效相关。
任何此类有效关联的股息都将按常规税率按净收入缴纳美国联邦所得税。作为公司的非美国持有者也可以按30%的税率(或适用的 所得税条约规定的较低税率)对此类有效关联股息缴纳针对某些项目进行调整的分支机构利得税。非美国持有者应就任何可能规定不同规则的适用税收条约咨询他们的税务顾问。
出售 或其他应税处置
非美国持有者在出售或以其他应税方式处置我们的普通股时获得的任何收益将不需要缴纳美国联邦所得税,除非:
| ● | 收益与非美国持有者在美国境内进行贸易或业务有关(如果适用的所得税条约要求,非美国(Br)持有者在美国有常设机构,该收益可归因于该机构); |
| 104 |
| ● | 非美国持有人是指在资产处置的纳税年度内在美国居住183天或以上且符合某些其他要求的非居民外国人; | |
| ● | 我们的普通股构成美国不动产权益或USRPI,因为我们是美国不动产控股公司或USRPHC,用于美国联邦所得税目的。 |
上述第一个要点中描述的收益 一般将按常规税率按净所得额缴纳美国联邦所得税。 作为公司的非美国持有者也可能对此类有效关联收益按30%的税率(或适用的所得税条约规定的较低税率)缴纳针对某些项目进行调整的分支机构利得税。
以上第二个要点中描述的非美国持有人将按出售或其他应税处置普通股时实现的收益按30%(或适用所得税条约规定的较低税率)缴纳美国联邦所得税, 可由非美国持有人的美国来源资本损失抵消(即使该个人不被视为美国居民)。只要非美国持有人及时提交了有关此类损失的美国联邦所得税申报单。
关于上面的第三个要点,我们认为我们目前不是,也不会成为USRPHC。然而,由于确定我们是否为USRPHC取决于我们的USRPI的公平市场价值相对于我们的USRPI的公平市场价值和我们的其他业务资产,因此不能保证我们目前不是USRPHC或未来不会成为USRPHC。即使我们是或将成为USRPHC,如果我们的普通股按照适用的财政部法规的定义进行定期交易,且非美国持有者实际和建设性地拥有该普通股,则非美国持有者出售或以其他应税方式处置普通股所产生的收益将不会 缴纳美国联邦所得税。在截至出售或其他应税处置日期或非美国持有者持有的五年期间中较短的一段时间内,占我们普通股的5%或更少 。
非美国 持有人应就可能适用的所得税条约咨询其税务顾问,这些条约可能规定不同的规则。
信息 报告和备份扣缴
我们普通股的股息支付 将不会受到备用扣缴的约束,前提是适用的扣缴义务人不知道或没有理由知道持有人是美国人,并且持有人证明其非美国身份,例如通过提供有效的IRS表格W-8BEN、W-8BEN-E或W-8ECI,或以其他方式确定豁免。但是,对于支付给非美国持有人的普通股的任何分配,都需要向美国国税局提交信息申报单,无论此类分配 是否构成股息或是否实际扣缴了任何税款。此外,在美国境内或通过某些与美国相关的经纪人进行的出售或其他应税处置我们的普通股的收益,如果适用的扣缴代理人收到上述证明,但并不实际知道 或没有理由知道该持有人是美国人,或者持有人以其他方式确立了豁免,则通常不会受到备用扣缴 或信息报告的约束。通过非美国经纪商的非美国办事处处置我们普通股的收益 通常不会受到备用扣留或信息 报告的约束。
根据适用条约或协议的规定,向美国国税局提交的信息申报单副本 也可提供给非美国持有人居住或设立的国家/地区的税务机关。
备份 预扣不是附加税。根据备份预扣规则扣缴的任何金额,只要及时向美国国税局提供所需信息,都可以作为非美国持有人的美国联邦所得税义务的退款或抵免 。
| 105 |
向外国账户支付款项的额外 预扣税
根据《守则》第1471至1474节(通常称为《外国账户税收合规法》或FATCA),可对向非美国金融机构和某些其他非美国实体支付的某些类型的款项征收预扣税。具体而言,可对支付给“外国金融机构”或“非金融外国实体”的普通股的股息或毛收入征收30%的预扣税,除非(1)该外国金融机构承担了一定的尽职调查和报告义务。(2)非金融外国实体证明其没有任何“主要美国所有者” (定义见《守则》),或提供有关每个主要美国所有者的身份信息,或(3)外国金融机构或非金融外国实体有资格以其他方式获得豁免,不受本规则的约束。如果收款人是外国金融机构,并遵守上述(1)中的尽职调查和报告要求,则必须与美国财政部签订协议,除其他事项外,要求财政部承诺确定某些“特定美国人”或“美国拥有的外国实体”(各自在守则中定义)持有的账户,每年报告有关此类账户的某些信息。并对向不合规的外国金融机构和某些其他账户持有人支付的某些款项扣缴30%。 位于与美国有管理FATCA的政府间协议的司法管辖区的外国金融机构可能受不同的规则约束。
根据适用的财政部条例和行政指导,FATCA下的扣缴一般适用于我们普通股的股息支付 。虽然FATCA下的预提也适用于在2019年1月1日或之后出售或以其他方式处置股票的毛收入的支付,但拟议的财政部条例完全取消了FATCA对毛收入付款的预提。 纳税人通常可以依赖这些拟议的财政部条例,直到最终的财政部条例发布。
潜在的 投资者应咨询他们的税务顾问,了解他们在投资我们的 普通股时是否可能适用FATCA下的预提。
| 106 |
承销
ThinkEquity LLC是此次发行的承销商代表。我们已与 代表签订了一份承销协议。根据承销协议的条款和条件,吾等已同意向下列各承销商出售股票, 而各承销商已分别同意按公开发行价减去本招股说明书封面上所列的承销折扣,购买其名称旁边列于 下表的普通股和预先出资认股权证的股份数目:
| 承销商 | 第 个 股票 | 预先出资认股权证的数目 | ||||||
| ThinkEquity LLC | ||||||||
| 总计 | ||||||||
承销商承诺购买除以下超额配售选择权所涵盖的 以外的我们提供的所有普通股和预筹资权证的股票(如果购买了任何股票)。承销协议中约定的事项发生时,承销商的义务可以终止。此外,根据承销协议,承销商的责任须受承保协议所载的惯常条件、陈述及保证所规限,例如承销商收到高级人员证书及法律意见。
承销商发行普通股和预融资权证,但须事先出售,发行时、发行时及发行后均获承销商接受,并须经其律师批准法律事宜,以及其他条件。承销商保留 撤回、取消或修改对公众的报价以及拒绝全部或部分订单的权利。
承销商建议按招股说明书封面上的公开发行价格向社会公开发售本公司发行的普通股和预融资权证。普通股和预筹资权证股票对外发行后,承销商可以随时变更发行价等出售条件。
超额配售 选项
我们 已授予承销商超额配售选择权。这项选择权在本招股说明书日期后最多可行使45天, 允许代表向吾等购买最多450,000股额外普通股及/或预资金权证(占本次发售售出的股份及/或预资金权证的15%),以弥补超额配售(如有)。如果代表 行使该期权的全部或部分,它将以本招股说明书封面上显示的每股公开发售 价格减去承销折扣,购买该期权涵盖的股票和/或预筹资权证。如果全面行使这一选择权, 对公众的总发行价将为710万美元,扣除费用前对我们的总净收益将为600万美元。
折扣
承销商最初建议按本招股说明书封面所载的公开发行价向公众发售普通股和/或预筹资权证,并以该价格减去不超过每股普通股$1的优惠向交易商发售。如果我们发行的所有普通股和/或预筹资权证的股份没有按公开发行价出售,承销商可以通过本招股说明书的补充文件来改变发行价和其他出售条款。
下表显示了我们的公开发行价格、承销折扣和扣除费用前的收益。该信息假设承销商不行使或完全行使其超额配售选择权。
| 每股 | 每一份预先出资的认股权证 | 不含合计 超额配售 选择权 | 总计为 超额配售 选择权 | |||||||||||||
| 公开发行价 | $ | $ | ||||||||||||||
| 承保折扣(7.5%) | $ | $ | ||||||||||||||
| 扣除费用前的收益,付给我们 | $ | $ | ||||||||||||||
| 107 |
我们 已同意向承销商支付相当于本次发行中收到的总收益的1%的非实报性费用津贴 (不包括因行使承销商超额配售选择权而收到的收益)。
我们 将向代表 支付35,000美元的费用保证金,用于支付自付可交代费用,只要此类自付可交代费用不是根据FINRA规则5110(G)(4)(A)实际产生的,我们将退还给我们。
此外,吾等同意向代表人报销(I)承销商法律顾问的费用和开支,金额不超过125,000美元;(Ii)与使用Ipreo的询价、招股说明书跟踪和合规软件有关的费用和开支为21,000美元;(Iii)根据代表人合理指定的外国司法管辖区的证券法登记、资格 或豁免该等股份的所有费用、开支和支出;(Iv) 根据蓝天证券法律注册、资格或豁免该等股份的所有费用、开支及支出。 代表合理指定的州及其他司法管辖区的证券法(如适用);及(V)最高10,000元的实际须交代的“路演”开支。
我们 估计,我们应支付的发行总费用约为500,000美元,其中不包括承保折扣和非实报实销费用 津贴。
代表的 授权
吾等 已同意向代表或其指定人发行认股权证,以购买最多120,000股(或138,000股,如果超额配售选择权已全部行使)本公司普通股股份(占本次发售的普通股及/或预筹资权证股份总数的4%),或代表认股权证。代表认股权证将可按每股行使价相当于本次发售所售普通股每股公开发售价格的125%行使。 代表认股权证可于本次发售开始发售证券后180天起计的四年半期间内随时、不时、全部或部分行使。
代表认股权证和代表认股权证相关的普通股股份已被FINRA视为补偿 ,因此,根据FINRA规则5110(E)(1),禁售期为180天。代表或(第5110(E)(2)条规定的允许受让人 )不得出售、转让、转让、质押或质押代表的认股权证或代表认股权证相关的证券 ,也不会从事任何对冲、卖空、衍生工具、认沽或看涨 交易,从而导致代表的认股权证或普通股的相关股份在登记声明生效之日起180天内有效进行经济处置。此外,代表的认股权证在注册声明生效之日起180天内不得出售、转让、转让、质押或质押,但向参与发售的任何承销商和选定的交易商及其真诚的高级职员或合伙人出售、转让、转让、质押或质押除外。如果发生资本重组、合并、股票拆分或其他结构性 交易,或我们未来进行融资,代表权证的数量和价格以及代表权证所涉及的普通股的数量和价格将进行调整。代表的认股权证将根据FINRA规则5110.05规定登记权(包括一次性要求登记权和无限搭载权)。根据FINRA规则5110(G)(8)(C),登记要求可在代表权证首次行使之日起至本登记声明生效之日起五周年 止的任何时间提出。根据FINRA规则第5110(G)(8)(D)条,除一次性要求登记权外,代表认股权证还应享有不受限制的附带权利,自代表认股权证首次行使之日起不超过两年 。代表认股权证还将根据FINRA规则5110规定惯常的反稀释条款(用于股票分红、拆分和资本重组),此外,如有必要,代表认股权证的股份数量应减少,以符合FINRA规则和法规。
| 108 |
可自由支配的 帐户
承销商不打算确认将在此发售的证券出售给他们拥有自由裁量权的任何账户。
锁定协议
除某些例外情况外,我们的每一位董事和高级管理人员已同意,在本招股说明书发布之日起六(6)个月内,在未经代表事先书面同意的情况下,在本招股说明书发布之日起六(6)个月内,不直接或间接地提供、质押、出售、出售、授予、借出、或以其他方式转让或处置任何互换或其他安排,以全部或部分转让任何我们的股本股份或任何可转换为 或可行使或可交换为我们普通股股份的证券。除某些例外情况外,除某些例外情况外,吾等已同意,在本招股说明书发出日期后三(3)个月内,未经代表事先书面同意,不得在本招股说明书公布之日起三(3)个月内,直接或间接地提出、质押、出售、出售、授予、借出或以其他方式转让或处置,或订立任何互换或其他安排,全部或部分将我们股本的任何股份或可转换为或可行使或可交换为我们普通股的任何证券的所有权的任何经济后果转移给另一人。
此外, 我们同意,在本次发行后的六(6)个月内,我们将不会直接或间接地在任何“市场"、 连续股权、股权额度或可变利率交易中,出售出售要约、出售、合同出售,授予任何出售或其他选择权 处置我们的股本股份或任何可转换为或可行使或可交换为我们的股本股份的证券, 未经ThinkEquity事先书面同意。
在适用的锁定期结束后,我们普通股的所有已发行和已发行股票将有资格在未来 出售,但受适用数量、销售方式、持有期和第144条其他限制的限制。
优先购买权
关于我们的首次公开募股,我们同意,在自发行结束后的十五(15)个月内,我们将授予代表 不可撤销的优先购买权,由代表自行决定担任唯一投资银行家、唯一账簿管理人、唯一财务顾问、唯一承销商和/或 唯一配售代理,在此十五(15)个月期间,根据代表的习惯条款,为我们或我们的任何继任者或任何子公司进行的每一次未来的公开和私人股本和债务发行, 包括所有股票相关融资。我们还同意,该代表有权决定任何其他 经纪交易商是否有权参与任何此类发行以及任何此类参与的经济条款。
与本次发行有关,如果获得至少1500万美元的发行收益,承销协议将 规定在首次公开募股期间最初授予代表的优先购买权延长六(6)个月。
赔偿
为了在法律允许的范围内,我们同意赔偿承销商及其关联公司、股东、董事、高级管理人员、员工、成员和控制人的某些责任,包括证券法下的责任,并支付承销商可能被要求为这些责任支付的款项 。
电子股份要约、出售和分配
参与此次发行的一个或多个承销商或销售团队成员(如果有)维护的网站上可能提供电子格式的招股说明书,参与此次发行的一个或多个承销商可以电子方式分发招股说明书 。代表可同意向承销商和销售集团成员分配一定数量的股票,以出售给其在线经纪账户持有人。互联网分销将由承销商和销售集团成员进行分配,这些承销商和销售团队成员将在与其他分配相同的基础上进行互联网分销。除电子格式的招股说明书外,承销商网站上的信息不是本招股说明书或注册说明书的一部分,也不是本招股说明书或注册说明书的一部分,未经我们或任何承销商以承销商身份批准或背书,投资者不应依赖 。
| 109 |
稳定化
对于此次发行,承销商可以从事稳定交易、超额配售交易、银团回补交易、惩罚性出价和买入,以回补因卖空而建立的头寸。
稳定交易允许出价购买证券,只要稳定出价不超过规定的最高出价,并从事 目的是为了在发行过程中防止或延缓证券市场价格的下跌。
超额配售 交易涉及承销商出售超过承销商有义务购买的证券数量的证券。这创造了一个辛迪加空头头寸,可以是回补空头头寸,也可以是裸空头头寸。在有担保的 空头头寸中,承销商超额配售的证券数量不超过他们可以在超额配售期权中购买的证券数量。在裸空头头寸中,涉及的证券数量多于超额配售期权中的证券数量。承销商可以通过行使超额配售选择权和/或在公开市场购买证券来平仓任何空头头寸。
辛迪加 回补交易涉及在分销完成后在公开市场购买证券,以回补 辛迪加空头头寸。在确定平仓的证券来源时,承销商将考虑公开市场上可供购买的证券的价格与他们通过行使超额配售选择权购买证券的价格相比较。如果承销商出售的证券超过了行使超额配售选择权所能覆盖的范围,因此拥有裸空头头寸,则只能通过在公开市场买入证券来平仓。如果承销商担心定价后公开市场上的证券价格可能面临下行压力,从而可能对购买此次发行的投资者造成不利影响,则更有可能建立裸空头头寸。
罚金 出价允许代表在辛迪加 成员最初出售的证券通过稳定或辛迪加回补交易购买以回补辛迪加空头头寸时,从该辛迪加成员那里收回出售特许权。
这些 稳定交易、银团覆盖交易和惩罚性出价可能具有提高或维持我们证券的市场价格或防止或延缓我们证券的市场价格下跌的效果。因此,我们的证券在公开市场上的价格可能会高于没有这些交易的情况下的价格。我们和承销商都不会就上述交易可能对我们证券价格产生的影响作出任何陈述或预测。这些 交易可以在纽约证券交易所美国交易所、场外交易市场或其他市场上进行,如果开始,可以随时终止 。
被动做市
与本次发行相关,承销商和销售集团成员可在 开始发行或销售证券之前的一段时间内,并一直持续到完成分销,根据《交易法》下M条例第103条的规定,在纽约证券交易所美国证券交易所或OTCQB进行我们普通股的被动做市交易。被动做市商 必须以不超过该证券的最高独立出价的价格显示其出价。但是,如果所有独立出价都被降低 到被动做市商的出价以下,那么当超过指定的购买限额时,该出价必须被降低。
| 110 |
其他 关系
某些承销商及其关联公司未来可能会在正常业务过程中向我们提供各种咨询、投资和商业银行及其他服务 ,因此他们可能会收取惯常的费用和佣金。然而,我们还没有, 目前没有与任何承销商就任何进一步的服务达成任何安排。
提供美国以外的限制
除美国以外,我们或承销商尚未采取任何行动,允许本招股说明书提供的证券在需要采取行动的任何司法管辖区进行公开发行。本招股说明书提供的证券不得直接或间接发售或出售,本招股说明书或任何其他与发售和出售任何此类证券有关的发售材料或广告不得在任何司法管辖区分发或发布,除非在符合该司法管辖区适用规则的情况下。建议持有本招股说明书的人告知自己,并遵守与本次发行和分发本招股说明书有关的任何限制。 本招股说明书不构成在 任何司法管辖区出售或邀请购买本招股说明书所提供的任何证券的要约,在任何司法管辖区此类要约或要约均为非法。
澳大利亚
本招股说明书并非《澳大利亚公司法》第6D章规定的披露文件,未向澳大利亚证券和投资委员会提交,也未声称包括《澳大利亚公司法》第6D章规定的披露文件所要求的信息。因此,(I)根据《澳大利亚公司法》第6D章的规定,根据《澳大利亚公司法》第708条规定的一项或多项豁免,本招股说明书下的证券要约仅提供给根据《澳大利亚公司法》第6D章在不披露的情况下合法提供证券的人,(Ii)本招股说明书在澳大利亚仅向上文第(I)款所述的人提供,以及(Iii)必须向受要约人发送通知,通知实质上表明接受要约的人是上文第(I)款所述的人,此外,除非《澳大利亚公司法》允许,否则同意在向招股说明书下的受要约人转让证券后12个月内,不在澳大利亚境内出售或要约出售出售给受要约人的任何证券。
中国
本文件中的信息不构成以出售或认购方式公开发售Republic of China(本段不包括香港特别行政区、澳门特别行政区和台湾)的证券。证券不得在中国境内直接或间接向法人或自然人发售或出售,除非直接向“合格境内机构投资者”发行或出售。
欧洲经济区-比利时、德国、卢森堡和荷兰
本文件中的信息是根据欧洲经济区成员国(每个成员国均为“相关成员国”)实施的指令2003/71/EC(“招股说明书指令”)下的豁免要求制作证券要约的基础上编制的。
相关成员国尚未且不得向公众发出证券要约,除非根据在该相关成员国实施的《招股说明书指令》规定的下列 豁免之一:
| ● | 被授权或受监管在金融市场运营的法人实体,或如果未获授权或受监管,其公司目的仅为投资证券的法人实体; | |
| ● | 拥有以下两项或两项以上的任何法人实体:(1)上一会计年度平均至少250名员工;(2)总资产负债表超过43,000,000欧元(如上一年度未合并或合并财务报表所示);(3)年营业额净额超过5,000万欧元(如上一年度未合并或合并财务报表所示); |
| 111 |
| ● | 向不到100名自然人或法人(不包括《招股章程指令》第2(1)(E)条所指的合格投资者) 出售,但须事先征得本公司或任何承销商的同意;或 | |
| ● | 招股章程指令第3(2)条所指的任何其他情况,但该等证券要约不得 导致本公司须根据招股章程指令第3条刊登招股章程。 |
法国
根据《法国货币和金融法》(Code Monétaire et Financer)第L.411-1条和第 211-1条及以下条款的含义,本文件未在法国公开发行金融证券(Offre Au Public De Titires Finance Ers) 。根据法国S金融家监管总局(“金融监管机构”)的规定。这些证券 尚未发售或出售,也不会直接或间接向法国公众发售或出售。
本文件和与证券有关的任何其他发售材料尚未、也不会在法国提交给AMF审批 ,因此,不得直接或间接向法国公众分发或安排分发。
此类要约、销售和分配已经且仅应在法国向(I)合格投资者(合格投资者S) 按照《法国货币和金融法典》第L.411-2-2条和D.411-1至D.411-3、D.744-1、D.754-1和D.764-1以及任何实施条例和/或(Ii)有限数量的非合格投资者(投资人)自行行事,按照《法国货币和金融法》第L.411-2-II-2和D.411-4、D.744-1、D.754-1和D.764-1条以及任何实施条例的定义和规定。
根据《资产管理基金通则》第211-3条的规定,法国投资者被告知,除非按照《法国货币和金融法典》第L.411-1、L.411-2、L.412-1和L.621-8至L.621-8-3条的规定,否则投资者不能(直接或间接)向公众分销证券。
爱尔兰
根据任何爱尔兰法律或法规,本文档中的信息不构成招股说明书,也未向任何爱尔兰监管机构 备案或批准,因为这些信息不是在爱尔兰公开发行证券的背景下准备的, 《爱尔兰招股说明书2005年(指令2003/71/EC)条例》(《招股说明书条例》)。 这些证券没有被发售或出售,也不会在爱尔兰以公开发售的方式直接或间接地提供、出售或交付,除(I)招股章程第2(L)条所界定的合资格投资者及(Ii)少于100名非合资格投资者的自然人或法人外。
以色列
本招股说明书提供的证券未经以色列证券管理局(ISA)批准或不批准,也未在以色列注册销售。在没有发布招股说明书的情况下,不得直接或间接向以色列公众发售或出售股票。ISA未就此次发行或发布招股说明书 颁发许可证、批准或许可证;也未对本文中包含的细节进行验证、确认其可靠性或完整性,或对所发行证券的质量发表意见。在以色列境内直接或间接向公众转售本招股说明书提供的证券均受转让限制,且只能在符合以色列证券 法律法规的情况下进行。
| 112 |
意大利
根据意大利证券法,在意大利共和国发行证券未经意大利证券交易委员会(Comissione)授权,因此,不得在意大利境内分销与证券有关的发售材料,不得在意大利境内公开发售此类证券,除非符合1998年2月24日第58号法令(“第58号法令”)第1.1(T)条的规定:
| ● | 意大利合格投资者(“合格投资者”),如第58号法令第100条所界定,参照经修订的1999年5月14日《全国委员会条例》11971号第34条之三(“条例第1197l号”);以及 | |
| ● | 依照第58号法令第100条和第1197l号条例规定不受公开募集规则约束的其他情形。 |
根据上述段落,任何与意大利证券有关的要约、出售或交付证券或分发任何要约文件(不包括合格投资者向发行人征求要约的配售)必须:
| ● | 投资公司、银行或金融中介机构根据经修订的1993年9月1日第385号法令、2007年10月29日第58号法令、全国委员会16190号条例以及任何其他适用法律,获准在意大利开展此类活动;以及 | |
| ● | 遵守所有相关的意大利证券、税收和外汇管制以及任何其他适用法律。 |
随后在意大利进行的任何证券分销必须遵守第58号法令和修订后的11971号条例规定的公开要约和招股说明书要求规则,除非这些规则有例外情况。不遵守此类规则可能会导致此类证券的出售被宣布为无效,并导致转让证券的实体对投资者遭受的任何损害承担责任。
日本
根据日本金融工具及交易法(1948年第25号法律)第4条第1款(下称“FIEL”)豁免适用于向合格机构投资者私募证券的注册要求(定义见及根据FIEL第2条第3款及其下颁布的条例),该等证券并未、亦不会根据经修订的《日本金融工具及交易法》(FIEL)第4条第1款注册。因此,这些证券不得直接或间接在日本境内或为合格机构投资者以外的任何日本居民提供或出售。任何购买证券的合格机构投资者不得将其转售给日本境内非合格机构投资者的任何人,任何此类人士购买证券 须以签署相关协议为条件。
葡萄牙
本文件并非按照《葡萄牙证券法》第109条的规定,在葡萄牙公开发行金融证券(oferta pública de valors mobiliários) 。这些证券尚未发售或出售,也不会直接或间接向葡萄牙公众发售或出售。本文件 和任何其他与证券有关的发售材料尚未、也不会提交葡萄牙证券市场委员会(Comissăo do Mercado de Valore Mobiliários)在葡萄牙审批,因此,除非根据葡萄牙证券法, 被视为不符合公开发售资格的情况,否则不得直接或间接将其分发给葡萄牙公众。在葡萄牙,此类证券的发售、销售和分销仅限于“合格投资者”(根据葡萄牙证券法的定义)。只有此类投资者才能收到此 文档,并且不得将其或其中包含的信息分发给任何其他人。
| 113 |
瑞典
本文件 尚未也不会在瑞典金融监管局(FinansinSpektionen)注册或批准。 因此,除根据瑞典金融工具交易法(1991:980)(Sw)被视为不需要招股说明书的情况外,本文件不能在瑞典提供,也不能在瑞典出售证券。滞后(1991:980)(韩德尔医学Fansiella仪器)。在瑞典,任何证券发行仅限于“合格投资者”(如《金融工具交易法》所定义)。只有这样的投资者才能收到本文件,他们不得将本文件或其中包含的信息分发给任何其他人。
瑞士
这些证券可能不会在瑞士公开发售,也不会在瑞士证券交易所(“Six”)或瑞士任何其他证券交易所或受监管的交易机构上市。本文件在编制时未考虑根据ART发行招股说明书的披露标准 。652a或Art.1156《瑞士债法》或上市招股说明书的披露标准 。从27岁起。六个上市规则或瑞士任何其他证券交易所或受监管交易机构的上市规则。 本文件或任何其他与证券有关的发售材料不得在瑞士公开分发或公开 。
本文件或任何其他与证券有关的发售材料尚未或将提交任何瑞士监管机构或获得其批准。特别是,本文件不会向瑞士金融市场监管局(FINMA)备案,也不会对证券的发售进行监管。
此 文件仅为收件人个人信息,不在瑞士广泛传播。
阿拉伯联合酋长国
本文件或证券均未经阿拉伯联合酋长国中央银行或阿拉伯联合酋长国任何其他政府机构以任何方式批准、不批准或传递,本公司也未获得阿拉伯联合酋长国中央银行或阿拉伯联合酋长国任何其他政府机构的授权或许可在阿拉伯联合酋长国境内销售或销售证券。本文档不构成也不得用于要约或邀请的目的。本公司不得在阿联酋境内提供与证券有关的服务,包括接收申请及/或配发或赎回该等股份。
在迪拜国际金融中心,任何认购证券的要约或邀请均无效或不被允许。
联合王国
本文件中的信息或与要约有关的任何其他文件均未提交英国金融服务管理局审批,也未发布或打算发布有关证券的招股说明书(符合经 修订的《2000年金融服务和市场法》第85条的含义)。本文件以保密方式向英国的“合格投资者”(FSMA第86(7)条所指的合格投资者)发布, 不得通过本文件、任何随附信函或任何其他文件在英国发售或出售证券, 除非根据FSMA第86(1)条的规定不需要发布招股说明书。本文档不应 全部或部分分发、发布或复制,收件人也不得将其内容披露给英国的任何其他人。
任何与证券发行或销售相关的 参与投资活动的邀请或诱因(FSMA第21条的含义)仅被传达或导致被传达,并且仅在FSMA第21(1)条不适用于本公司的情况下才在英国传达或导致传达。在英国, 本文档仅分发给(I)在有关投资事宜方面具有专业经验的人士, 属于《2000年金融服务及市场法令2005(金融推广)令》(“金融推广条例”)第19(5)条(投资专业人士),(Ii)属于第49(2)(A)至(D)条所述类别的人士(高净值公司、 非法人团体等)。或(Iii)以其他方式合法传达给谁(统称“相关人士”)。 与本文件有关的投资仅对相关人士可用,任何邀请、要约或购买协议将仅与相关人士进行 。任何非相关人士不应采取行动或依赖本文件或其任何内容。
加拿大
证券只能在加拿大出售给购买或被视为购买本金的购买者,这些购买者是认可投资者, 如国家文书45-106招股说明书豁免或证券法(安大略省)第73.3(1)款所定义,并且允许 客户,如国家文书31-103注册要求、豁免和持续登记义务所定义。证券的任何转售 必须符合适用证券法的招股说明书要求 的豁免或不受其约束的交易。如果本招股说明书(包括其任何修正案)包含失实陈述,加拿大某些省或地区的证券法可为买方提供撤销或损害赔偿 ,前提是买方在买方所在省或地区的证券法规定的时限内行使撤销或损害赔偿。买方应参考买方所在省份或地区证券法规的任何适用条款,以了解这些权利的详情,或咨询法律顾问。根据NI33-105《承销冲突》(NI 33-105)第3A.3节的规定,承销商无需遵守NI33-105关于承销商与本次发行相关的利益冲突的披露要求。
| 114 |
法律事务
位于加利福尼亚州欧文的Greenberg LLP Traurig将传递在此发售的普通股和预筹资权证的有效性。位于纽约的Vable LLP在与此次发行相关的某些法律问题上担任承销商的法律顾问。
专家
本招股说明书中包括的截至和截至2022年和2021年12月31日的财政年度的财务报表 是根据独立注册会计师事务所Grassi&Co.,CPAS,P.C.的报告列入的,该报告是经 所述事务所作为审计和会计专家的授权而提供的。
此处 您可以找到详细信息
我们 已根据证券法以S-1表格向美国证券交易委员会提交了关于本招股说明书提供的普通股股份的登记说明书 。本招股说明书是注册说明书的一部分,并不包含注册说明书中规定的所有信息,其中一些信息在美国证券交易委员会规则和规则允许的情况下包含在注册说明书的证物中。关于我们和我们的普通股的更多信息,我们建议您参考注册声明, 包括作为注册声明的一部分提交的展品。本招股说明书中包含的关于任何合同或任何其他文件的内容的陈述不一定完整。如果已将合同或文件作为登记声明的证物提交,请参阅已提交的合同或文件的副本。每一项声明均为本招股说明书,与作为证物备案的合同或文件有关,在各方面均符合备案证物的要求。美国证券交易委员会维护着一个互联网网站,其中包含 报告、委托书和其他有关发行人的信息,这些发行人和我们一样,以电子方式在美国证券交易委员会备案。该网站网址为www.sec.gov。
此外,我们还向美国证券交易委员会提交年度、季度和当前报告以及委托书和其他信息。我们的美国证券交易委员会备案文件可在美国证券交易委员会网站www.sec.gov上查阅。公众也可以在我们的公司网站www.azitrainc.com上免费获取或通过公司网站访问这些文件。我们的网站以及我们 网站上包含的或可以通过我们的网站访问的信息不被视为通过引用并入本招股说明书,也不被视为本招股说明书的一部分。您不应依赖任何此类信息来决定是否购买我们的普通股。
除本招股说明书中包含的信息外,我们 未授权任何人向您提供任何信息或就本招股说明书中讨论的交易向您作出任何陈述。如果向您提供了本招股说明书中未讨论的有关这些事项的任何信息或陈述,您不得依赖该信息。本招股说明书不是在任何地方或向根据适用法律我们不允许向其提供或出售证券的任何人出售或邀请购买证券的要约。
| 115 |
AZITRA, Inc.
财务报表索引
| 独立注册会计师事务所报告(PCAOB ID 606) | F-1 |
| 截至2022年12月31日和2021年12月31日的资产负债表 | F-2 |
| 声明 截至2022年及2021年12月31日止年度的营运成本 | F-3 |
| 截至2022年12月31日和2021年12月31日的年度股东权益(赤字)变动报表 | F-4 |
| 声明 截至2022年及2021年12月31日止年度的现金流量 | F-5 |
| 财务报表附注 | F-6 |
| 截至2023年9月30日(未经审计)和2022年12月31日的资产负债表 | F-24 |
| 截至2023年9月30日和2022年9月30日的9个月的运营报表 | F-25 |
| 截至2023年9月30日和2022年9月30日的9个月股东权益报表 (未经审计) | F-26 |
| 截至2023年9月30日和2022年9月30日的9个月现金流量表 | F-27 |
| 未审计财务报表附注 | F-28 |
| 116 |
独立注册会计师事务所报告{br
致 公司董事会和股东
Azitra, Inc.
Branford,CT
对财务报表的意见
我们 审计了Azitra,Inc.(“本公司”)截至2022年和2021年12月31日的资产负债表,以及截至该日止年度的相关经营报表、股东权益和现金流量表,以及相关附注(统称为财务报表)。我们认为,财务报表在所有重要方面都公平地反映了本公司截至2022年、2022年和2021年12月31日的财务状况,以及截至该日止年度的经营成果和现金流量,符合美国公认的会计原则。
对公司作为持续经营企业的持续经营能力有很大的怀疑
所附财务报表的编制假设Azitra,Inc.将继续作为一个持续经营的企业。正如财务报表附注 1所述,该公司的重大经营亏损令人对其持续经营的能力产生极大怀疑。附注1还说明了管理层对事件和情况的评估以及管理层对这些事项的计划。财务报表不包括可能因这种不确定性的结果而产生的任何调整。
征求意见的依据
这些 财务报表由公司管理层负责。我们的责任是根据我们的审计对公司的财务报表发表意见。我们是一家在美国上市公司会计监督委员会(PCAOB)注册的公共会计师事务所,根据美国联邦证券 法律以及美国证券交易委员会和PCAOB的适用规则和法规,我们必须与公司保持独立。
我们 按照PCAOB的标准和美国公认的审计标准进行审计。这些标准要求我们计划和执行审计,以获得关于财务报表是否没有重大错报的合理保证,无论是由于错误还是舞弊。本公司不需要对其财务报告的内部控制进行审计,也没有聘请本公司进行审计。作为我们审计的一部分,我们需要了解财务报告的内部控制,但不是为了对公司财务报告的内部控制的有效性发表意见。因此,我们不表达这样的意见。
我们的 审计包括执行程序,以评估财务报表重大错报的风险,无论是由于错误 还是欺诈,以及执行应对这些风险的程序。这些程序包括在测试的基础上审查与财务报表中的金额和披露有关的证据。我们的审计还包括评估管理层使用的会计原则和作出的重大估计,以及评估财务报表的整体列报。我们相信,我们的审计 为我们的观点提供了合理的基础。
/S/ 格拉西会计师事务所,P.C.
我们 自2022年以来一直担任本公司的审计师。
纽约杰里科
2023年2月20日,除附注9、10、11、14和19外,日期为2023年6月13日。
| F-1 |
AZITRA, Inc.
资产负债表 表
| 12月31日, | ||||||||
| 2022 | 2021 | |||||||
| 资产 | ||||||||
| 当前 资产: | ||||||||
| 现金 和现金等价物 | $ | 3,492,656 | $ | 8,044,262 | ||||
| 应收账款 | 182,820 | 160,867 | ||||||
| 应收税额抵免 | 69,666 | 173,311 | ||||||
| 收入 应收税金 | 13,722 | - | ||||||
| 延期的 产品成本 | 216,886 | - | ||||||
| 预付 费用 | 160,133 | 110,289 | ||||||
| 流动资产总额 | 4,135,883 | 8,488,729 | ||||||
| 财产和设备,净额 | 846,958 | 946,681 | ||||||
| 其他资产 | ||||||||
| 其他 资产 | 47,507 | 48,201 | ||||||
| 运营 租赁使用权资产 | 1,116,697 | - | ||||||
| 无形资产,净额 | 219,567 | 97,693 | ||||||
| 延期 专利成本 | 800,831 | 620,029 | ||||||
| 其他资产合计 | 2,184,602 | 765,923 | ||||||
| 总资产 | $ | 7,167,443 | $ | 10,201,333 | ||||
| 负债、可转换优先股和股东亏损 | ||||||||
| 流动负债: | ||||||||
| 应付帐款 | $ | 784,687 | $ | 717,800 | ||||
| 当前 经营租赁负债 | 287,384 | - | ||||||
| 所得 应缴税金 | - | 1,302 | ||||||
| 应计费用 | 993,961 | 475,485 | ||||||
| 合同债务 | 156,000 | 15,000 | ||||||
| 流动负债总额 | 2,222,032 | 1,209,587 | ||||||
| 长期经营租赁负债 | 840,896 | - | ||||||
| 担保 责任 | 70,283 | 71,104 | ||||||
| 可转换 应付票据,净额 | 6,600,000 | 992,019 | ||||||
| 总负债 | 9,733,211 | 2,272,710 | ||||||
| 可转换优先股: | ||||||||
| A系列可转换优先股;面值0.0001美元;2022年和2021年12月31日授权发行的205,385股;2022年和2021年12月31日发行和发行的205,385股;截至2022年和2021年12月31日的清算价值3337,506美元 | 3,272,944 | 3,272,944 | ||||||
| A-1系列可转换优先股;面值0.0001美元;2022年和2021年12月31日授权发行的380,657股;2022年和2021年12月31日发行和发行的380,657股;截至2022年和2021年12月31日的清算价值14,274,638美元 | 14,100,533 | 14,100,533 | ||||||
| B系列可转换优先股;面值0.0001美元;分别于2022年12月31日和2021年12月31日授权发行851,108股和392,000股; 2022年和2021年12月31日发行和发行的391,303股;截至2022年12月31日和2021年12月31日的清算价值17,000,159美元 | 16,321,065 | 16,321,065 | ||||||
| 股东赤字: | ||||||||
| 普通股;面值0.0001美元;分别于2022年和2021年12月31日授权100,000,000股;分别于2022年和2021年12月31日发行并发行1,043,103股 | 104 | 104 | ||||||
| 额外的 实收资本 | 1,054,138 | 868,163 | ||||||
| 累计赤字 | (37,314,552 | ) | (26,634,186 | ) | ||||
| 股东亏损额合计 | (36,260,310 | ) | (25,765,919 | ) | ||||
| 总负债、可转换优先股和股东赤字 | $ | 7,167,443 | $ | 10,201,333 | ||||
请参阅 附注
| F-2 |
AZITRA, Inc.
运营报表
| 截至12月31日的年度 , | ||||||||
| 2022 | 2021 | |||||||
| 服务 收入相关方 | $ | 284,000 | $ | 110,000 | ||||
| 总收入 | 284,000 | 110,000 | ||||||
| 运营费用: | ||||||||
| 常规 和管理 | 3,639,666 | 3,951,352 | ||||||
| 研发 | 6,097,938 | 5,380,102 | ||||||
| 运营费用总额 | 9,737,604 | 9,331,454 | ||||||
| 运营亏损 | (9,453,604 | ) | (9,221,454 | ) | ||||
| 其他收入(支出): | ||||||||
| 利息收入 | 4,818 | 8,759 | ||||||
| 利息 费用 | (251,891 | ) | (66,968 | ) | ||||
| 其他 收入 | 65,849 | 112,141 | ||||||
| 员工 留任积分 | 229,813 | — | ||||||
| 工资保障计划贷款的宽免 | — | 232,506 | ||||||
| 更改可转换票据公允价值 | (1,250,000 | ) | — | |||||
| 其他 费用 | (25,351 | ) | (4,659 | ) | ||||
| 合计 其他收入(费用) | (1,226,762 | ) | 281,779 | |||||
| 所得税前净亏损 | (10,680,366 | ) | (8,939,675 | ) | ||||
| 所得税优惠(费用) | ||||||||
| 净亏损 | $ | (10,680,366 | ) | $ | (8,939,675 | ) | ||
| 分部 优先股 | (2,768,984 | ) | (2,768,984 | ) | ||||
| 净额 普通股股东应占亏损 | $ | (13,449,350 | ) | $ | (11,708,659 | ) | ||
| 每股净亏损,基本 和摊薄 | $ | (12.74 | ) | $ | (11.20 | ) | ||
| 加权平均普通股 突出、基本和稀释 | 1,055,457 | 1,045,766 | ||||||
请参阅 附注
| F-3 |
AZITRA, Inc.
可转换优先股和股东亏损报表
截至2022年12月31日和2021年12月31日的年度
| 系列 A敞篷车 | 系列A-1敞篷车 | B系列敞篷车 | 其他内容 | 总计 | ||||||||||||||||||||||||||||||||||||||||
| 优先股 股票 | 优先股 股票 | 优先股 股票 | 普通股 股票 | 已缴费 | 累计 | 股东的 | ||||||||||||||||||||||||||||||||||||||
| 股票 | 金额 | 股票 | 金额 | 股票 | 金额 | 股票 | 金额 | 资本 | 赤字 | 赤字 | ||||||||||||||||||||||||||||||||||
| 平衡,2020年12月31日 | 205,385 | $ | 3,272,944 | 380,657 | $ | 14,100,533 | 391,303 | $ | 16,321,065 | 1,025,353 | $ | 103 | $ | 553,534 | $ | (17,694,511 | ) | $ | (17,140,774 | ) | ||||||||||||||||||||||||
| 基于股票的薪酬 | — | — | — | — | — | — | — | — | 306,055 | — | 306,055 | |||||||||||||||||||||||||||||||||
| 股票期权的行使 | — | — | — | — | — | — | 17,750 | 1 | 8,574 | — | 8,475 | |||||||||||||||||||||||||||||||||
| 净亏损 | — | — | — | — | — | — | - | — | — | (8,939,675 | ) | (8,939,675 | ) | |||||||||||||||||||||||||||||||
| 平衡,2021年12月31日 | 205,385 | 3,272,944 | 380,657 | 14,100,533 | 391,303 | 16,321,065 | 1,043,103 | 104 | 868,163 | (26,634,186 | ) | (25,765,919 | ) | |||||||||||||||||||||||||||||||
| 基于股票的薪酬 | — | — | — | — | — | — | — | — | 184,465 | — | 184,465 | |||||||||||||||||||||||||||||||||
| 股票期权的行使 | — | — | — | — | — | — | 888 | — | 1,510 | — | 1,510 | |||||||||||||||||||||||||||||||||
| 净亏损 | — | — | — | — | — | — | — | — | — | (10,680,366 | ) | (10,680,366 | ) | |||||||||||||||||||||||||||||||
| 余额, 2022年12月31日 | 205,385 | $ | 3,272,944 | 380,657 | $ | 14,100,533 | 391,303 | $ | 16,321,065 | 1,043,991 | $ | 104 | $ | 1,054,138 | $ | (37,314,552 | ) | $ | (36,260,310 | ) | ||||||||||||||||||||||||
请参阅 附注
| F-4 |
AZITRA, Inc.
现金流量表
| 截至12月31日的年度 , | ||||||||
| 2022 | 2021 | |||||||
| 经营活动的现金流 : | ||||||||
| 净亏损 | $ | (10,680,366 | ) | $ | (8,939,675 | ) | ||
| 调整 将净亏损与经营活动使用的现金和现金等价物净额进行核对: | ||||||||
| 折旧和摊销 | 125,885 | 84,772 | ||||||
| 债务贴现摊销 | 7,981 | 7,632 | ||||||
| 摊销使用权资产 | 280,092 | - | ||||||
| 可转换票据的应计利息 | 164,611 | 59,181 | ||||||
| 基于股票的薪酬 | 184,465 | 306,055 | ||||||
| 权证负债的公允价值变动 | (821 | ) | (989 | ) | ||||
| 更改可转换票据的公允价值 | 1,250,000 | - | ||||||
| 工资保障计划贷款的宽免 | - | (230,685 | ) | |||||
| 财产和设备处置损失 | 7,923 | - | ||||||
| 经营资产和负债的变化 : | ||||||||
| 应收账款 | (21,953 | ) | (37,573 | ) | ||||
| 预付 费用 | (49,844 | ) | 163,952 | |||||
| 其他 资产 | 694 | (919 | ) | |||||
| 应收税额抵免 | 103,645 | 231,745 | ||||||
| 收入 应收税金 | (15,024 | ) | - | |||||
| 应付账款和应计费用 | 420,752 | 282,976 | ||||||
| 运营 租赁负债 | (268,509 | ) | - | |||||
| 所得 应缴税金 | - | (8,831 | ) | |||||
| 合同债务 | 141,000 | 15,000 | ||||||
| 现金及现金等价物净额 业务活动所用 | (8,349,469 | ) | (8,067,359 | ) | ||||
| 投资活动的现金流 : | ||||||||
| 购买财产和设备 | (33,101 | ) | (446,136 | ) | ||||
| 收益 出售财产和设备所得 | 4,250 | - | ||||||
| 资本化 递延专利费用 | (180,802 | ) | (196,267 | ) | ||||
| 许可证的资本化 | (65,510 | ) | - | |||||
| 资本化 专利和商标成本 | (61,598 | ) | (9,872 | ) | ||||
| 现金及现金等价物净额 用于投资活动 | (336,761 | ) | (652,275 | ) | ||||
| 融资活动的现金流 : | ||||||||
| 收益 来自可换股票据,扣除发行成本 | 4,350,000 | 984,387 | ||||||
| 延期发行成本的支付 | (216,886 | ) | - | |||||
| 行使股票期权所得收益 | 1,510 | 8,475 | ||||||
| 净额 融资活动提供的现金和现金等价物 | 4,134,624 | 992,862 | ||||||
| 现金和现金等价物净减少 | (4,551,606 | ) | (7,726,772 | ) | ||||
| 年初现金 和现金等价物 | 8,044,262 | 15,771,034 | ||||||
| 年终现金 和现金等价物 | $ | 3,492,656 | $ | 8,044,262 | ||||
请参阅 附注
| F-5 |
AZITRA,
Inc.
合并财务报表附注
截至2022年和2021年12月31日止年度
1. 业务的组织和性质
Azitra, Inc.成立于2014年1月2日。它是一家合成生物公司,专注于皮肤微生物的筛选和基因工程。其使命是发现和开发新的治疗方法,以创造治疗皮肤病的新范例。该公司的 发现平台经过筛选,寻找具有有益效果的自然产生的细菌细胞。然后对这些微生物进行基因组测序,并对其进行工程设计,以制造细胞疗法、重组治疗性蛋白、多肽和小分子,用于精确治疗皮肤病。
公司在加拿大蒙特利尔设有一个地点,用于某些研究活动。该地点和在那里完成的操作在2021年和2022年期间保持一致。2021年,该公司还在康涅狄格州格罗顿开设了一个制造和实验室空间。
去 关注事项
财务报表是根据持续经营基础编制的,假设公司将在可预见的未来继续经营,并考虑在正常业务过程中变现资产和清算负债。 然而,管理层确认了以下情况和事件,这些情况和事件造成了对公司作为持续经营企业的能力的不确定性。截至2022年12月31日止年度,公司累计亏损3,730万美元,运营亏损950万美元,运营资金为860万美元。这些因素以及其他因素令人对公司作为持续经营企业的持续经营能力产生了极大的怀疑。
管理层 计划继续通过股权和债务融资筹集资金,以满足运营和营运资金需求,然而,公司 将需要大量额外资金来完成其产品开发,并为公司预计在未来几年发生的额外亏损提供资金。该公司处于早期临床阶段,因此尚未获得产品 收入。2022年,该公司发行了可转换票据,净现金收益为440万美元(见附注7)。不能保证 如果需要,公司将成功获得额外融资,以满足其运营需求。
这些 条件和事件给公司持续经营到2024年2月20日(财务报表发布之日后一年)的能力带来了不确定性。财务报表不包括公司无法继续经营时可能需要进行的任何调整 。
2. 重要会计政策摘要
会计基础
本公司的财务报表按照美国公认会计原则编制。
使用预估的
按照美国公认的会计原则编制财务报表需要 管理层作出估计和假设,这些估计和假设会影响资产负债表日期报告的资产和负债额。 虽然管理层认为编制财务报表时使用的估计和假设是适当的,但实际结果可能与这些估计不同。
现金 和现金等价物
就资产负债表及现金流量表而言,本公司将所有手头现金、活期存款及所有原始到期日为三个月或以下的高流动性投资视为现金等价物。
| F-6 |
AZITRA,
INC.
合并财务报表附注
截至2022年和2021年12月31日止年度
应收账款
公司的应收账款按成本减去坏账准备计提。本公司定期评估其应收账款,并根据过去的核销、催收和当前情况计提坏账准备。2022年12月31日或2021年12月31日的坏账不计提。应收账款在被认为无法收回时予以核销。以前核销的应收账款在收到时被记录下来。
延期的 产品成本
公司将递延发售成本资本化,这些成本主要包括与公司首次公开募股相关的直接、递增法律、专业、会计和其他 第三方费用。递延发售成本将于完成发售后抵销首次公开招股所得款项 。如果计划的IPO被证明不成功,这些递延成本以及将产生的额外费用 将计入运营费用。
财产 和设备
财产和设备按成本入账。折旧采用直线法计算估计使用年限,使用年限为3至10年。维护和维修支出不会延长相关资产的经济使用寿命, 在发生时计入运营费用。处置财产和设备的损益反映在处置期间的经营报表 中。
使用资产的权利
2016年2月,财务会计准则委员会(“FASB”)发布了ASU第2016-02号租赁(“主题842”)。ASU 2016-02要求承租人在资产负债表上列报所有租期超过12个月的使用权资产和租赁负债 。见附注2--最近通过的会计公告。
在计算ASU 2016-02年度的影响时,本公司选择了过渡方法,因此不再重复可比期间。公司 选择将非租赁组件作为与其相关的租赁组件的一部分进行核算。租赁会计涉及重大判断,包括作出与租赁期限、租赁付款和贴现率相关的估计。根据指导意见,公司确认了所有租期超过12个月的租赁的ROU资产和租赁负债。
公司拥有建筑物的运营租约。目前,截至2022年1月1日,该公司有3份营运租约,其ROU资产和租赁负债总额为1,418,502美元。租约的基础、条款及条件由个别协议决定。本公司可选择延长某些租约,期限为36-52个月。所有延期选项都已包含在ROU资产和租赁负债的计算中。租约不包含可能对公司产生额外财务义务的剩余价值担保、限制或契诺。不存在转租、回租或关联方交易。
截至2022年12月31日,公司的经营性使用权资产净值为1,116,697美元,流动和长期经营租赁负债分别为287,384美元和840,896美元。
无形资产
无形资产包括商标和专利。与专利和商标申请的提交和起诉直接相关的所有成本都是资本化的。专利在正式批准后在其各自的剩余使用寿命内摊销。商标具有无限的生命期 。
公司按照ASC主题350对其他无限期无形资产进行核算,商誉及其他无形资产 (ASC 350)。ASC 350要求具有无限年限的无形资产必须至少每年进行减值测试 ,或者只要发生事件或情况变化表明账面价值可能无法收回。寿命有限的无形资产将继续在其使用年限内摊销。2022年或2021年未录得与无形资产相关的减值损失 。
| F-7 |
AZITRA,
Inc.
综合财务报表附注
截至二零二二年及二零二一年十二月三十一日止年度
延期的专利成本
递延专利成本是指与提交待批准的专利申请相关的法律和申请费用。 这些递延成本将在专利正式批准后的预计使用寿命内开始摊销。如果专利 未获批准,则与该专利相关的成本将在该专利被拒绝的当年支出。截至2022年12月31日及2021年12月31日止年度,并无与递延专利成本有关的减值亏损。
长期资产减值
根据ASC主题360-10,长期资产减值或处置的会计处理根据美国会计准则(ASC 360-10),本公司的 政策是,每当事件或环境变化显示某项资产的账面金额可能无法收回时,本公司便会审查其长期资产的减值情况。在这次审查中,公司还重新评估了这些 资产的折旧期。当资产的使用和最终处置产生的未贴现预期未来现金流量之和少于其账面金额时,本公司确认减值亏损。如果一项资产被视为减值,则应确认的减值按该资产的账面价值超过该资产的公允价值的金额计量,该金额是根据该资产产生的未来营运现金流量净值的现值确定的。
可转换债务和权证会计
认股权证
根据对权证具体条款的评估和ASC 480中适用的权威指导,公司将权证作为股权分类或负债分类工具进行会计处理。区分负债与股权(“ASC 480”)和ASC 815,衍生工具和套期保值(“ASC 815”)。评估考虑认股权证是否为ASC 480所指的独立财务工具,是否符合ASC 480所指的负债定义,以及认股权证是否符合ASC 815中有关股权分类的所有要求,包括权证是否与本公司本身的普通股挂钩,以及其他股权分类条件。这项评估需要使用专业判断,在权证发行时以及在权证尚未结清的每个季度结束日进行。
对于符合所有股权分类标准的已发行权证,权证必须在发行时记录为额外 实收资本的组成部分。对于不符合所有股权分类标准的已发行权证,权证 必须在发行当日及其之后的每个资产负债表日按其初始公允价值入账。认股权证估计公允价值的变动在其他损益项下的经营报表中确认为非现金损益。
可转换债务
公司发行具有转换功能的债务时,首先评估转换功能是否符合作为股票结算债务入账的要求。如果不符合这些要求,则评估是否应将转换功能分为 并作为衍生负债处理,如下所示:a)一个或多个标的,通常为我们普通股的价格;b)一个或多个名义金额或支付条款,或两者兼而有之,通常为转换后的股份数量;c)无初始净投资,通常 不包括借款金额;d)净结算准备金,在可转换债务的情况下,这通常意味着转换后收到的股票可以随时出售为现金。符合衍生品定义的嵌入式股权挂钩组件如果符合涉及发行人自有股权的某些合同的范围例外,则不必 与宿主工具分离。合同的范围例外适用于以下两种情况:a)以自己的股票为索引;b)在其财务状况报表中归类为股东权益。
| F-8 |
AZITRA,
Inc.
综合财务报表附注
截至二零二二年及二零二一年十二月三十一日止年度
可转换 优先股
由于 可转换优先股股东在发生被视为清盘事件时拥有清算权,而在某些情况下, 并非完全在本公司的控制范围内,需要赎回当时尚未发行的可转换优先股,因此,本公司将可转换优先股归入资产负债表夹层股权。由于目前不太可能发生被视为清盘的事件,可转换优先股的账面价值不会计入其赎回价值。只有在可能发生被视为清算事件的情况下,才会对可转换优先股的账面价值进行后续调整。
收入
公司按照以下五个步骤确认与客户签订的合同收入:ASC 606,与客户签订的合同收入 (“ASC606”),它们是:
| ● | 第 1步:确定与客户的合同(S) | |
| ● | 第 2步:确定合同中的履约义务 | |
| ● | 第 3步:确定成交价 | |
| ● | 第 4步:将交易价格分配给合同中的履约义务 | |
| ● | 第 5步:在履行履约义务时(或作为)确认收入 |
该公司通过与一家研究合作伙伴签订的联合开发协议获得服务收入。随着合同工作的完成,公司使用输入法确认与协议研究和开发方面相关的收入。
公司还产生赠款收入,这是从与各联邦机构和非营利性研究机构签订的合同中收到的款项,用于公司为进一步产品开发而进行的一般研究,因此被视为对公司的贡献 。合同的期限一般为一年或更长时间,任何一方都可以取消。本公司的结论是,由于本公司 是该安排的唯一积极参与者,因此赠款安排不符合被视为FASB ASC主题808项下的合作安排的标准。赠款安排也不符合主题606下的收入确认标准,因为美国政府不符合客户的定义。
在发生符合条件的费用且可实现或已实现支付权并赚取本政策与主题606一致的情况下,根据这些授予合同赚取的金额 被记录为负研发费用,以确保确认反映了向客户转让承诺的商品或服务的金额,其金额反映了 公司期望有权换取这些商品或服务的对价,即使没有主题606中定义的交换。 此外,本公司已确定,将收到的金额确认为已产生的成本和可变现的金额 类似于主题606下的随时间转移服务控制权的概念。
预付补助金的收据 ,如果未按照赠款中的条件使用,则应返还给供资机构,这些赠款涉及在执行 合同工作之前允许的成本或从研究合作伙伴获得的与服务收入安排有关的资金,在随附的资产负债表中归类为合同负债。
研究和开发
本公司按照会计准则编纂(ASC)小标题730-10核算研发费用,研究和开发 。因此,内部研究和开发成本在发生时计入费用。研发成本包括与人力、材料和用品相关的成本。截至2022年和2021年的年度内,研发成本分别为5,920,538美元和5,380,102美元。
| F-9 |
AZITRA,
Inc.
综合财务报表附注
截至二零二二年及二零二一年十二月三十一日止年度
截至2022年12月31日和2021年12月31日,该公司分别拥有32,459美元和71,396美元的州税收抵免,用于 将研发税收抵免返还给康涅狄格州的待决退款。截至2022年12月31日和2021年12月31日,该公司分别有28,925美元和89,855美元用于与加拿大科学研究和实验发展积分相关的待定退款。截至2022年12月31日和2021年12月31日,该公司还分别记录了8,282美元和12,060美元,涉及加拿大商品和服务税(GST)和魁北克销售税(QST)的退款。退款收入记入经营报表上的其他收入。
基于股票的薪酬
公司根据ASC 718对股票薪酬进行核算,薪酬--股票薪酬(ASC 718)。ASC 718要求 员工的股票期权和根据股票参与计划购买股票的权利必须按公允价值入账。ASC 718要求 与以股份为基础的支付交易相关的补偿成本在财务报表中确认为运营费用。 根据该方法,所有授予或修改的奖励的补偿成本均按授予日的估计公允价值计量,并 计入员工提供服务以换取奖励的归属期间的补偿费用。对于绩效条件影响归属的奖励 ,公司在确定可能达到绩效条件时确认补偿费用。
该公司使用布莱克-斯科尔斯期权定价模型来确定其股票期权的公允价值。布莱克-斯科尔斯模型包括各种假设,包括标的普通股的价值、股票期权的预期寿命、预期波动率和预期无风险利率。这些假设反映了公司的最佳估计,但它们涉及基于一般不受公司控制的市场情况的固有不确定性 。因此,如果使用其他假设,基于股票的薪酬成本可能会受到重大影响。此外,如果公司对未来的赠款使用不同的假设,基于股票的薪酬成本可能会在未来期间受到重大影响。
公司按照会计准则更新(ASU)2018-07号更新的ASC 718的规定,对发行给非员工的股权工具进行会计核算。对非员工股份支付会计的改进,这将ASC 718的范围扩大到包括对非员工的基于股票的支付交易。
在对使用Black-Scholes期权定价模型发行的期权进行估值时,使用了以下假设:
预期波动 。公司股票的预期波动率是根据公司的外部估值估计的。
预期的 期限。期权的预期期限采用简化方法估计,该方法基于每个授予的归属期限和合同 期限,或者对于具有分级归属的奖励的每个归属部分。
基础 普通股价值。本公司股票的基本普通股价值由第三方估值专家估计。
无风险利率 。该公司的无风险利率以美国国库券的隐含收益为基础,其条款等于标的授权书的预期期限。
股息 收益率。布莱克-斯科尔斯估值模型要求以单一的预期股息收益率作为输入。本公司过去没有就普通股支付股息 ,近期也不会对普通股支付股息。因此,公司使用的股息 收益率百分比为零。
| F-10 |
AZITRA,
Inc.
综合财务报表附注
截至二零二二年及二零二一年十二月三十一日止年度
所得税 税
公司采用ASC 740中规定的所得税责任会计方法,所得税会计。根据此方法,递延税项资产及负债按资产及负债的账面值与计税基准之间的暂时性差异及经营亏损结转净额之间的暂时性差异而产生的预期未来税务后果确认,均按现行的税率计算(见附注13)。
管理层已评估与不确定所得税头寸相关的ASC指导的效果,并得出结论,公司在2022年12月31日和2021年12月31日的财务报表中没有对不确定所得税头寸的重大敞口。截至2022年12月31日,本公司的所得税申报单 未经税务机关审查。本公司目前未接受任何税务管辖区的审计。
公允价值计量
公司按公允价值经常性地承担某些负债。使用由三个级别组成的公允价值层次结构来确定公允价值评估技术的输入的优先顺序:
| ● | 级别 1-投入基于在活跃市场交易的相同工具的可观察或报价 。 | |
| ● | 第2级-投入基于活跃市场中类似工具的报价, 非活跃市场中相同或类似工具的报价,以及基于模型的估值技术,其所有重要假设均可在市场上观察到,或可由资产或负债的基本完整期限的可观察市场数据来证实。 | |
| ● | 级别 3-投入通常是不可观察的,通常反映了管理层对市场参与者在为资产或负债定价时将使用的假设的估计。因此,公允价值是使用基于模型的技术来确定的,这些技术包括期权定价模型、贴现现金流模型和类似技术。 |
在确定公允价值时,本公司采用估值技术,最大限度地利用可观察到的投入和最大限度地减少使用不可观察到的投入,并在评估公允价值时考虑交易对手信用风险。
最近 采用了会计公告
2016年2月,财务会计准则委员会(“FASB”)发布了2016-02年度最新会计准则(“ASU”)租约(主题842)。本ASU要求承租人在其资产负债表中确认大多数经营租赁项下的使用权资产和租赁负债。ASU在2021年12月15日之后开始的年度和过渡期内有效。本公司于2022年1月1日采用ASU 2016-02。见附注15--经营租赁。
2019年12月,FASB发布了ASU第2019-12号,所得税(话题740):简化所得税会计。该标准 取消了以前规定的各种例外情况,并规定了额外的所得税申报要求,从而简化了所得税的会计核算。ASU自2022年1月1日起对公司生效。本公司自2022年1月1日起采用该准则,并未对财务报表产生实质性影响。
2020年8月,FASB发布了ASU第2020-06号,债务--可转换债务和其他选择(分主题470-20)和衍生工具和对冲--实体自有权益的合同(分主题815-40)简化了某些具有负债和权益特征的金融工具的会计处理,包括可转换工具和实体自有权益的合同 。该标准将于2024年1月1日对公司生效,允许提前采用(但不早于从2020年12月15日开始的 财年)。本公司已于2021年1月1日起采用该准则,该准则对财务报表没有重大影响。
管理层 不认为最近发布但尚未生效的任何其他会计准则会对随附的财务报表产生实质性影响。随着新的会计公告的发布,公司将采用在这种情况下适用的会计公告。
| F-11 |
AZITRA,
Inc.
综合财务报表附注
截至二零二二年及二零二一年十二月三十一日止年度
金融工具
公司的金融工具主要包括应收账款、应付账款、应计负债和长期债务。对于应收账款、应付账款和应计负债,由于该等票据的短期到期日,账面金额接近公允价值。本公司长期债务的估计公允价值接近账面价值。
3. 员工留任积分
《CARE法案》提供员工留任抵免(“CARE Employee Return Credits”),这是一项可退还的税收抵免 符合条件的雇主每位员工最高可缴纳5,000美元的就业税。税收抵免相当于在一个季度内支付给员工的合格工资的50%,截至2020年12月31日,每位员工的合格工资上限为10,000美元。美国政府通过了额外的救济条款 ,将这些信用额度的合格工资上限延长并略微扩大至2021年9月30日。根据这些额外规定,税收抵免现在相当于一个季度支付给员工的合格工资的70%, 每名员工的合格工资上限已提高到每季度10,000美元。2022年4月,公司 确定其符合《CARE法案》规定的税收抵免条件,并记录了229,813美元的应收账款,并在经营报表上将该金额确认为其他 收入。公司在2022年9月收到了这笔款项的全额付款。
4. 财产和设备
截至2022年12月31日和2021年12月31日,财产和设备包括:
| 2022 | 2021 | |||||||
| 实验室设备 | $ | 1,034,579 | $ | 1,016,737 | ||||
| 计算机设备 | 30,825 | 30,825 | ||||||
| 家具和固定装置 | 24,316 | 24,316 | ||||||
| 租赁权改进 | 28,855 | 28,855 | ||||||
| 建筑设备 | 14,932 | 14,932 | ||||||
| 1,133,507 | 1,115,665 | |||||||
| 减去:累计折旧 | (286,549 | ) | (168,984 | ) | ||||
| 净资产和设备 | $ | 846,958 | $ | 946,681 | ||||
截至2022年12月31日和2021年12月31日的年度折旧费用分别为120,651美元和81,866美元。
5. 无形资产
截至12月31日,无形资产 包括:
2022:
| 预计使用寿命 | 毛 金额 | 累计摊销 | 净额 金额 | |||||||||||
| 商标 | 不定 | $ | 53,999 | $ | - | $ | 53,999 | |||||||
| 专利 | 17年 | 108,198 | 8,140 | 100,058 | ||||||||||
| 许可证 协议 | 17年 | 65,510 | - | 65,510 | ||||||||||
| 无形资产 | $ | 227,707 | $ | 8,140 | $ | 219,567 | ||||||||
| F-12 |
AZITRA,
INC.
合并财务报表附注
截至2022年和2021年12月31日止年度
2021:
| 预计使用寿命 | 毛 金额 | 累计摊销 | 净额 金额 | |||||||||||
| 商标 | 不定 | $ | 50,955 | $ | - | $ | 50,955 | |||||||
| 专利 | 17年 | 49,644 | 2,906 | 46,738 | ||||||||||
| 无形资产 | $ | 100,599 | $ | 2,906 | $ | 97,693 | ||||||||
2022年和2021年,与无形资产相关的摊销费用分别为5,234美元和2,906美元。
预计 截至12月31日的年度摊销费用如下:
| 2023 | $ | 2,920 | ||
| 2024 | 2,920 | |||
| 2025 | 2,920 | |||
| 2026 | 2,920 | |||
| 2027 | 2,920 | |||
| 此后 | 85,456 | |||
| 总计 | $ | 100,058 |
6. 应计费用
应计 截至2022年12月31日和2021年12月31日的费用包括:
| 2022 | 2021 | |||||||
| 员工工资 和奖金 | $ | 371,010 | $ | 138,671 | ||||
| 休假 | 27,082 | 43,473 | ||||||
| 研究和开发项目 | 316,389 | 149,711 | ||||||
| 利息 | 223,792 | 59,181 | ||||||
| 专业费用 | 24,502 | 58,892 | ||||||
| 其他 | 31,186 | 25,557 | ||||||
| $ | 993,961 | $ | 475,485 | |||||
公司根据对收到的服务的评估和根据合同安排的条款支出的工作,计提与第三方开展的开发活动有关的费用。根据其中一些合同支付的费用取决于研究和非临床试验里程碑。在某些情况下,向公司供应商支付的款项可能会超过所提供的服务水平,从而导致预付费用。在应计服务费时,公司估计将提供服务的时间段 以及每个时间段需要花费的工作量。如果实际执行服务的时间或努力程度与估计值不同,公司将相应调整应计或预付费用。本公司自成立以来并未 应计成本与实际成本之间出现任何重大差异。
| F-13 |
AZITRA,
Inc.
合并财务报表附注
截至2022年和2021年12月31日止年度
7. 可转换债务
于2022年9月,本公司订立可转换票据购买协议(该协议)以发行最多4,500,000美元可转换本票 。同日,公司与三个投资者签订了可转换本票(2022年可转换票据),总额为4,350,000美元。2022年可转换票据将于2023年1月13日到期或发生违约事件(定义),并按年利率8%计息,但在转换或全额偿还未偿还本金之前不会到期和应付 。2022年可转换票据项下未偿还的本金和利息在a)合格融资结束时自动转换为证券,为公司带来至少2000万美元的毛收入,并以每股30%的折扣价发行与合格融资相关的证券;b)在控制权变更事件结束时转换为公司或B系列优先股的股本;以及c)在上市公司活动结束时,向投资者发行的股本等于当时已发行本金和应计利息金额除以每股公开发行价的两倍(2倍)。2022年可换股票据项下的未偿还本金及利息可由 持有人选择于到期日转换为新类别的公司优先股(C系列优先股),等同于未偿还本金金额加利息除以上限价格,上限价格的定义为每股价格等于估值上限3,000万美元除以公司资本(定义见协议)。
该公司负责ASC 815项下的2022年可转换票据。根据815-15-25,可以在金融工具开始时进行选择 ,以根据ASC 825项下的公允价值选项对该工具进行会计处理。该公司已经为2022年可转换债券做出了这样的选择。使用公允价值期权,可转换本票应在发行之日按初始公允价值入账 ,此后每个资产负债表日均按初始公允价值入账。本公司根据当前市场价值的换算价对变化进行评估。当确认时,票据估计公允价值的变动在 经营报表上确认为其他收入(费用)中的非现金收益或亏损。本公司确认截至2022年12月31日的年度的2022年可转换票据的公允价值变动为1,250,000美元。
自2021年1月5日起,本公司签订票据购买协议,发行最多2,000,000美元可转换本票。同日,公司与一名投资者签订了一张可转换本票(2021年可转换票据),金额为1,000,000美元。2021年发行的可转换票据的利息年利率为6%,将于2023年1月5日到期并全额支付。2021年可转换票据 根据票据协议中定义的合格股权融资自动转换为等于所有本金和应计利息除以转换价格48.00美元的股份数量,该数字可根据票据协议中的定义进行调整。对于某些非限制性融资、控制权的变更或2021年可转换票据的到期日,2021年可转换票据也可以根据票据协议中的定义进行可选转换。本公司与2021年可转换票据有关的发行成本为15,613美元,已记录为债务折扣,并在2021年可转换票据期限内摊销。发行成本已于2022年12月31日全额摊销。
公司评估了与2021年可转换票据相关的票据购买协议的条款和条件,以评估ASC 480-区分负债与股权以及ASC 815-衍生品和对冲项下的会计考虑事项。 公司认定可转换票据不符合根据ASC 480负债进行会计处理的任何标准。公司 还根据ASC 815中的指导对嵌入式功能进行了评估,并确定嵌入式功能不符合任何分支标准 。
截至12月31日,可转换 应付票据包括以下内容:
| 2022 | 2021 | |||||||
| 2021敞篷车 注意 | $ | 1,000,000 | $ | 1,000,000 | ||||
| 2022年可转换票据 | 5,600,000 | — | ||||||
| 6,600,000 | 1,000,000 | |||||||
| 债务 发行成本 | — | (7,981 | ) | |||||
| $ | 6,600,000 | $ | 992,019 | |||||
于截至2022年及2021年12月31日止年度内,分别有7,981美元及7,632美元与债务发行成本相关摊销。截至2022年12月31日和2021年12月31日,可转换票据的累计利息分别为223,792美元和59,181美元。
| F-14 |
AZITRA,
INC.
合并财务报表附注
截至2022年和2021年12月31日止年度
8. 薪资保障计划贷款
2020年4月10日,公司根据薪资保障计划(PPP贷款)获得了230,685美元的贷款。贷款按1%的利率计息,原定到期日为两年,经公司和贷款人双方同意可延长至五年。
根据经2021年PPP灵活性法案和综合拨款法案修订的CARE法案的要求,收益只能 用于公司的合格工资成本(每位员工的年薪上限为100,000美元),或 与租金、抵押贷款利息公用事业、承保运营支出、承保财产损失、承保供应商成本和工人保护支出有关的其他符合条件的成本,每种情况下均在付款后24周内支付。如果(I)收益用于支付符合条件的工资成本或其他符合条件的成本,以及(Ii)全职员工人数和薪资在付款后的24周内保持不变,或在2020年12月31日之前恢复,则PPP 贷款可以完全免除。
公司于2021年1月25日收到PPP贷款全额免除的通知,并已将金额记录在 经营报表上的其他收入中。
9. 股东权益
普通股 股票
分别于2022年及2021年12月31日,根据本公司经修订及重述的公司注册证书,本公司获授权发行100,000,000股面值0.0001美元的普通股。有关与正向股票拆分相关的更多信息,请参阅附注19,后续事件。
截至2022年12月31日和2021年12月31日,公司分别发行和发行普通股1,043,991股和1,043,103股。
每股普通股 股东有权就提交本公司股东表决的所有事项投一票,而普通股持有人有权选举本公司一名董事股东。
公司目前预留了8,504,678股普通股,用于未来发行,用于可能转换已发行的优先股,以及在2022年12月31日行使未偿还的股票期权和认股权证。
优先股 股票
分别于2022年和2021年12月31日,根据公司修订和重述的公司注册证书,公司已批准1,437,150股和978,042股面值0.0001美元的优先股。
A系列、A-1系列和B系列优先股具有以下权利、优先选项和特权:
转换
根据持有者的选择,优先股可根据预先定义的公式转换为普通股。优先股的持有者可以随时将优先股转换为普通股。就转换而言,A系列优先股的初始转换价格为每股2.2887美元(原始发行价),A-1系列优先股的初始转换价格为每股5.2817美元(原始发行价),B系列优先股的初始转换价格为每股6.1190美元(原始发行价),并可根据 注册证书中的描述进行调整。优先股将在(A)总收益超过100,000,000美元的首次公开募股或(B)所需优先股股东投票或书面同意指定的日期和时间或事件发生时自动转换为普通股,所有已发行的A系列、A系列1和B系列优先股应按当时有效的转换率自动 转换为普通股。
| F-15 |
AZITRA,
INC.
合并财务报表附注
截至2022年和2021年12月31日止年度
投票权 权利
A系列、A-1系列和B系列优先股的持有人有权就提交给公司股东以供其在公司任何股东大会上采取行动或审议的任何事项投票(或经股东书面同意以代替会议),则每名优先股流通股持有人有权投与普通股整体股数相等的投票数,该普通股持有人持有的优先股股份可于确定有权就该事项投票的股东的记录日期 之日起转换为普通股。A系列和A-1系列优先股的持有者每人有权选举公司的一名董事成员。B系列股票的持有者有权选举两名董事会成员。 每类优先股可罢免该等董事,并在公司注册证书所述的特定情况下填补因该等董事辞职、死亡或罢免而造成的任何空缺。
分红
A系列优先股的持有者有权按A系列原始发行价的年利率8%获得每股2.2887美元的A系列优先股已发行股票的股息(如果A系列优先股发生任何股息、股票拆分、合并或其他类似的资本重组,则需进行适当调整)。股息自A系列优先股原定发行之日起累计,为累积股息,于董事会宣布或本公司清盘时支付。截至2022年12月31日,A系列优先股的累计股息为1,541,575美元。
A-1系列股票的持有者有权以A-1系列原始发行价每股5.2817美元的年利率获得股息(在A-1系列优先股发生任何股息、股票拆分、合并或其他类似资本重组的情况下,须进行适当调整)。股息是累积的,在董事会宣布或公司清算时支付。截至2022年12月31日,A-1系列优先股的累计股息为4,332,153美元。
B系列股票的持有者有权获得B系列股票每股已发行股票每股6.1190美元的B系列原始发行价的年利率8%的股息(如果发生任何股票股息、股票拆分、合并或与B系列优先股有关的其他类似资本重组,须进行适当调整)。股息是累积的,在董事会宣布或公司清算时支付。截至2022年12月31日,B系列优先股的累计股息为3,135,585美元。
清算
在公司发生任何清算、解散或清盘的情况下,优先股持有人有权在普通股持有人之前和优先于普通股持有人获得相当于A系列、A系列1或B系列优先股原始发行价的金额,外加已宣布和/或应计但未支付的股息。在发生任何此类清算事件时,在支付所有需要支付给优先股股东的优先金额后,公司可供分配给其股东的剩余资产应根据每个优先股和普通股持有人持有的股份数量按比例分配给优先股和普通股持有人,为此将所有此类证券视为已根据紧接该清算事件之前的公司注册证书条款转换为 普通股。
10. 认股权证
该公司于2018年发行了47,889股普通股的认股权证,连同可转换债务融资,该等认股权证有一项赎回条款,规定持有人有权让本公司以相当于董事会或独立评估师厘定的股份公平市价的购买价赎回全部或任何部分认股权证(或其已转换为的股份)。 由于这项赎回条款,认股权证在基于ASC 480的财务报表中被分类为负债-区分负债与股权。这些认股权证的行使价为每股0.48美元,期限为10年。权证 在每个报告期按市价计价。截至2022年12月31日和2021年12月31日,公允价值分别为70,283美元和71,104美元。于2022年12月31日,本公司使用Black-Scholes期权定价模型估计认股权证的公允价值,并假设: 基本普通股价值为1.70美元;预期期限为5年;预期波动率为86.0%;无风险利率为3.01%;以及 股息率为0%。于2021年12月31日,本公司采用Black-Scholes期权定价模型估计认股权证的公允价值,其假设如下:相关普通股价值为1.70美元;预期年期为6年;预期波动率为86.0%; 无风险利率为1.35%;股息率为0%。
| F-16 |
AZITRA,
INC.
合并财务报表附注
截至2022年和2021年12月31日止年度
该公司亦于2016及2019年发行认股权证,但该等认股权证不符合ASC 480分类为负债的标准,而是符合股权分类标准。
下表汇总了有关2022年12月31日未到期认股权证的信息:
| 未偿还认股权证 | 可行使认股权证 | |||||||||||||||||||||||||||
| 授予年份 | 演练 价格 | 2022年12月31日的认股权证数量 | 加权 平均剩余合同期限 | 加权 平均行权价 | 2022年12月31日的认股权证数量 | 加权 平均剩余合同期限 | 加权 平均行权价 | |||||||||||||||||||||
| 2016 | $ | 0.01 | 11,467 | $ | 0.01 | 11,467 | $ | 0.01 | ||||||||||||||||||||
| 2018 | $ | 0.48 | 47,889 | 3.7年 | $ | 0.48 | 47,889 | 3.7年 | $ | 0.48 | ||||||||||||||||||
| 2019 | $ | 5.28 | 215,854 | 5.3年 | $ | 5.28 | 215,854 | 5.3年 | $ | 5.28 | ||||||||||||||||||
| 275,210 | 3.1年 | $ | 4.23 | 275,210 | 3.1年 | $ | 4.23 | |||||||||||||||||||||
11. 股票期权
2016年,公司制定了Azitra,Inc.2016股票激励计划(以下简称计划),规定向公司员工、高级管理人员、董事、顾问和顾问授予股票期权和限制性股票。根据该计划,2022年12月31日和2021年12月31日有1,490,595股可供授予 。期权在不同的时间范围内授予。
于截至2022年及2021年12月31日止年度内,本公司分别授予0及495,580份购股权以收购普通股。这些期权在两年至四年之间的不同时间范围内授予,有效期为十年,行使价格为1.70美元。 在截至2022年12月31日和2021年12月31日的年度内,公司确认了与发行服务型股票期权有关的股票薪酬支出分别为184,465美元和306,055美元。截至2022年12月31日,有427,784美元的未摊销补偿费用 将在剩余的授权期内摊销。截至2022年12月31日,未偿还的绩效期权数量为93,152份,公允价值为109,551美元。在截至2022年12月31日的年度内,公司未确认绩效期权的任何补偿费用。根据SAB 107的规定,本公司确定了符合普通期权条件的期权,并采用简化方法 估计预期期权寿命。
为了确定2021年期间授予的期权的估计公允价值,本公司使用Black-Scholes期权定价模型, 假设:基础普通股价值为1.70美元;预期期限为7年;预期波动率为86.0%;无风险利率为0.66%-1.26%;股息率为0%。
| F-17 |
AZITRA,
INC.
合并财务报表附注
截至2022年和2021年12月31日止年度
下表汇总了截至2022年12月31日未完成和可行使的期权的信息:
| 未偿还认股权证 | 可行使认股权证 | |||||||||||||||||||||||||
| 演练 价格 | 2022年12月31日的选项数量 | 加权 平均剩余合同期限 | 加权 平均行权价 | 2022年12月31日的选项数量 | 加权 平均剩余合同期限 | 加权 平均行权价 | ||||||||||||||||||||
| $ | 0.48 | 246,136 | 3.0年 | $ | 0.48 | 246,136 | 3.0年 | $ | 0.48 | |||||||||||||||||
| $ | 0.93 | 231,680 | 3.0年 | $ | 0.93 | 231,680 | 3.0年 | $ | 0.93 | |||||||||||||||||
| $ | 1.70 | 812,502 | 8.3年 | $ | 1.70 | 411,707 | 8.0年 | $ | 1.70 | |||||||||||||||||
| 1,290,318 | 889,523 | |||||||||||||||||||||||||
截至2022年12月31日和2021年12月31日的年度股票期权活动总额摘要如下:
| 股票 | 加权 平均行权价 | |||||||
| 截至2020年12月31日未偿还 | 959,827 | $ | 1.11 | |||||
| 授与 | 495,580 | 1.70 | ||||||
| 已锻炼 | (17,750 | 0.48 | ||||||
| 被没收 | (55,749 | 1.03 | ||||||
| 截至2021年12月31日的未偿还债务 | 1,381,908 | $ | 1.34 | |||||
| 已锻炼 | (888 | 1.70 | ||||||
| 被没收 | (90,702 | 5.91.41 | ||||||
| 未偿还日期为2022年12月31日 | 1,290,318 | $ | 1.33 | |||||
截至2022年12月31日,根据该计划,可供未来授予的股票数量为157,989股。
12. 公允价值计量
下表汇总了公允价值层次中的公允价值和水平,其中公允价值计量属于按经常性基础计量的资产和负债,截至以下日期:
2022年12月31日 描述 | 级别 1 | 级别 2 | 第 3级 | 总计 | ||||||||||||
| 负债: | ||||||||||||||||
| 普通认股权证 | $ | 70,283 | $ | 70,283 | ||||||||||||
| 2022年可转换票据 | 5,600,000 | 5,600,000 | ||||||||||||||
| 总计 | $ | — | $ | — | $ | 5,670,283 | $ | 5,670,283 | ||||||||
2021年12月31日 描述 | 级别 1 | 级别 2 | 第 3级 | 总计 | ||||||||||||
| 负债: | ||||||||||||||||
| 普通认股权证 | $ | $ | $ | 71,104 | $ | 71,104 | ||||||||||
| 2021年1月1日的余额 | $ | 72,093 | ||
| 认股权证公允价值变动 | (989 | ) | ||
| 2021年12月31日的余额 | 71,104 | |||
| 权证公允价值变动 | (821 | ) | ||
| 发行2022年可转换票据 | 4,350,000 | |||
| 2022年可转换票据公允价值变动 | 1,250,000 | |||
| $ | 5,670,283 |
| F-18 |
AZITRA,
Inc.
合并财务报表附注
截至2022年和2021年12月31日止年度
公司普通股公允价值的波动 是每年普通股认股权证负债估值变化的主要驱动因素 。随着普通股公允价值的增加,票据持有人的价值通常也会增加。
各种投入的波动 ,包括企业价值、达到流动性的时间、波动性和贴现率,是每个报告期2022年可转换票据估值变化的主要驱动因素。随着企业价值的公允价值、预计达到流动性的时间、波动性和贴现率的增加,2022年可转换票据持有人的价值一般会增加。
13. 所得税
递延所得税是根据财务报告用途的资产和负债的账面价值与所得税报告用途的资产和负债的账面价值之间的临时差额计提的。截至2022年和2021年12月31日的递延所得税资产/(负债)如下:
| 2022 | 2021 | |||||||
| 递延税项资产: | ||||||||
| 净营业亏损结转 | $ | 7,870,665 | $ | 6,994,967 | ||||
| 税收抵免 | 1,729,421 | 1,216,246 | ||||||
| 折旧和摊销 | 1,189,975 | |||||||
| 应计费用 | 81,876 | 48,288 | ||||||
| 其他 | 28,057 | 25,240 | ||||||
| 递延税项资产总额 | 10,899,994 | 8,284,741 | ||||||
| 递延税项负债: | ||||||||
| 折旧和摊销 | ||||||||
| 递延税项负债合计 | — | (234,616 | ) | |||||
| 估值免税额 | (234,616 | ) | ||||||
| 净额 递延税金(负债)资产 | (10,899,994 | ) | (8,050,125 | ) | ||||
| $ | — | $ | — | |||||
在截至2022年12月31日和2021年12月31日的纳税年度中,公司结转的联邦净营业亏损分别约为29,192,000美元和25,954,000美元,其中1,285,000美元将在2036至2037纳税年度到期,约27,907,000美元将在 未到期的纳税年度到期。在截至2022年12月31日和2021年12月31日的纳税年度,本公司结转的国家净营业亏损分别约为29,374,000美元和25,947,000美元,这两个纳税年度将于2036至2042纳税年度到期。
公司在截至2022年12月31日和2021年12月31日的纳税年度分别享有约1,235,000美元和859,000美元的联邦研究税收抵免 ,这两个纳税年度将于2039至2042纳税年度到期。在截至2022年12月31日和2021年12月31日的两个纳税年度,公司分别拥有约350,000美元和249,000美元的州研究税收抵免,其中60,000美元将在2036纳税年度到期,100,000美元将在2037纳税年度到期 ,其余部分可以无限期结转。该公司在截至2022年12月31日和2021年12月31日的纳税年度分别享有约21.8万美元和13.8万美元的加拿大研究税收抵免,这两个纳税年度将于2039年至2042年纳税年度到期。
| F-19 |
AZITRA,
INC.
合并财务报表附注
截至2022年和2021年12月31日止年度
美国国税法第382节对所有权超过50%的公司使用其净营业亏损结转来减少纳税义务的能力进行了年度限制。 如果未来本公司的所有权变更超过第382条规定的50%限制门槛,则本公司结转的净营业亏损在特定年度的使用量方面可能受到显著限制。此外,本公司在2018年前产生的全部或部分净营业亏损结转 可能到期而未使用。
递延税项资产的变现取决于公司在临时差额可扣除期间产生未来应纳税所得额的能力。根据公司最近的盈利历史和预计的美国未来收益,管理层认为,在可预见的未来,其联邦和州递延税项资产更有可能无法完全变现 。作为这项评估的结果,管理层认为需要对其联邦和州递延税项净资产进行全额估值扣除。
公司适用ASC 740-10的规定来处理不确定的税务状况。ASC 740-10解决了是否应在财务报表中记录在纳税申报单上申报或预期申报的税收优惠的确定问题。根据美国会计准则第740-10条,公司只有在税务机关根据税务机关的技术价值审查后更有可能不会维持该税务头寸的情况下,才可确认来自不确定税务头寸的税收优惠。本公司已确定其 并无重大不确定税务状况需要根据美国会计准则740-10予以确认和计量。
该公司需缴纳美国联邦所得税、康涅狄格州所得税和加拿大分行税。本公司尚未接受美国国税局、州或外国税务机关与所得税有关的审计。本公司的纳税年度将继续接受所有联邦和州税务事项的审查 ,直到其净营业亏损结转使用且适用的诉讼时效已过期 。
如果适用,公司将确认与未确认的税收优惠相关的利息和罚款,作为所得税费用的组成部分。
14. 每股净亏损
基本 和稀释后每股净亏损计算如下:
每股基本净亏损和摊薄后净亏损的分子如下:
| 截至12月31日的年度, | ||||||||
| 2022 | 2021 | |||||||
| 净亏损 | $ | 10,680,366 | $ | 8,939,675 | ||||
| 分部 优先股 | 2,768,984 | 2,768,984 | ||||||
| 净额 普通股股东应占亏损 | $ | 13,449,350 | $ | 11,708,659 | ||||
分母如下:
| 截至12月31日的年度, | ||||||||
| 2022 | 2021 | |||||||
| 加权平均 已发行普通股、基本普通股和稀释后普通股 | 1,043,990 | 1,034,299 | ||||||
| $0.01认股权证 | 11,467 | 11,467 | ||||||
| 总计 | 1,055,457 | 1,045,766 | ||||||
| F-20 |
AZITRA,
INC.
合并财务报表附注
截至2022年和2021年12月31日止年度
每股净亏损(基本亏损和摊薄亏损)如下:
| 截至12月31日的年度, | ||||||||
| 2022 | 2021 | |||||||
| 每股净亏损, 基本摊薄 | $ | (12.74 | ) | $ | (11.20 | ) | ||
下列潜在普通股等价物是根据每个期末的未偿还金额列示的,不计入所示期间的稀释后每股净亏损计算 ,因为计入这些等价物会产生反摊薄效果:
| 12月31日, | ||||||||
| 2022 | 2021 | |||||||
| 购买 普通股的选择权 | 1,290,318 | 1,381,908 | ||||||
| 未偿还认股权证 | 263,743 | 263,743 | ||||||
| 1,554,061 | 1,645,651 | |||||||
15. 承付款和或有事项
法律
该公司在正常业务过程中受到法律程序或索赔的约束。虽然偶尔会出现不利的决定或和解,但本公司相信该等事宜的最终处置不应对其财务状况、经营业绩或流动资金造成重大不利影响。
许可证 协议
自2022年1月26日起,本公司与无关第三方签订独家许可协议(该协议)。根据该协议,公司获得某些专利的独家许可和某些专有技术的非独家许可。协议有效期为 ,直至最后一个许可专利到期后或第一个许可的治疗性或非治疗性产品首次商业销售后十年。本公司可随时通过向第三方提供至少30天的书面通知来终止本协议。该协议也在违反协议规定的重大义务或破产时终止。协议终止后,任何一方均不得解除终止前发生的义务。
在截至2022年12月31日的年度内,公司将根据本许可协议支付的款项资本化,金额为65,510美元。这些 资本化成本将在获得许可的专利发布后的有效期内摊销。
运营 租约
该公司在康涅狄格州布兰福德、康涅狄格州格罗顿和魁北克省拉瓦尔租用办公和实验室空间。本公司的租约将于 至2027年5月31日的不同日期到期。大多数租约都是固定期限和固定金额的。本公司不参与任何基于任何指数或费率增加租金条款、升级条款、资本改善资金或付款增加的租约。
在 2020年期间,公司就公司位于康涅狄格州布兰福德的主要办公和实验室空间签订了新的租赁协议。Branford租约需要在租约的第一年每月支付13,033美元,在接下来的几年中每年增加约2%。Branford租约还要求该公司按比例支付公共区域维护费用。
| F-21 |
AZITRA,
INC.
合并财务报表附注
截至2022年和2021年12月31日止年度
2021年5月,公司与康涅狄格州格罗顿的办公室和实验室签订了新租约。格罗顿的租赁需要每月支付4,234美元,在租赁额外空间后,这一数字在2021年9月增加到6,824美元。Groton的租期最初为一年 ,最多可续订三年。
未来 在接下来的 五年中,每年初始或剩余期限超过一年的不可取消经营租赁的最低付款如下:
| 2023 | $ | 329,937 | ||
| 2024 | 335,988 | |||
| 2025 | 277,209 | |||
| 2026 | 204,159 | |||
| 2027 | 76,324 | |||
| 未来未贴现的租赁付款总额 | 1,223,617 | |||
| 减息: 利息 | (95,337 | ) | ||
| 租赁负债现值 | $ | 1,128,280 |
截至2022年12月31日的年度,所有经营租赁的租金 费用为338,864美元。所有营运租约的加权平均租期为3.8年。所有经营租赁的加权平均贴现率为4.25%。
16. 退休计划
自2019年1月1日起,公司发起了一项涵盖几乎所有员工的401(K)计划。要有资格参加, 员工必须完成连续两个月的服务,并在服务的第一年内至少工作250小时或1,000小时。员工可以在满足计划资格要求后进行税前延期。从2020年1月1日起,该计划过渡到安全港计划,其中高薪员工没有资格获得匹配缴费 ,非高薪员工在前3%的缴费和随后的2%的缴费上获得100%的匹配和50%的匹配。截至2022年12月31日和2021年12月31日的年度,雇主匹配的缴款总额分别为23,466美元和31,548美元。
17. 信用风险集中
可能使公司面临信用风险的金融工具主要包括现金和应收账款。
在截至2022年12月31日和2021年12月31日的年度内,所有授权收入分别来自一名授予人和三名授予人,所有服务收入 均来自一名客户。
资产负债表中确定的现金余额存放在金融机构的账户中,由联邦存款保险公司(FDIC)承保,最高可达250,000美元。有时,存放在银行的现金可能会超过FDIC的限额。
2020年3月初,新冠肺炎在全球范围内爆发,导致全球经济发生重大变化。虽然本公司 迄今尚未经历任何业务运作中断,但无法确定这些变化,包括潜在的经济下滑,以及任何可能对本公司造成的直接或间接负面影响,但它们可能对本公司的业务、现金流和流动资金产生预期的重大影响。
| F-22 |
AZITRA,
INC.
合并财务报表附注
截至2022年和2021年12月31日止年度
18. 关联方
公司从一家实体获得服务收入,该实体也是公司B系列优先股融资的投资者(见 注9)。于截至2022年及2021年12月31日止年度,关联方总收入分别为284,000美元及110,000美元,而于2022年及2021年12月31日应收关联方应收账款分别为175,000美元及125,000美元。截至2022年12月31日和2021年12月31日,关联方的合同负债分别为156,000美元和15,000美元。
本公司于2022年9月订立总额为4,350,000美元的可转换本票,其中4,000,000美元归属于同时亦为本公司A系列、A-1及B系列优先股融资投资者的一家实体。(见注7)
19. 后续事件
公司对2022年12月31日至2023年6月13日期间发生的事件进行了评估,2023年6月13日是财务报表发布之日 。
于2023年1月,本公司选择将2021年可换股票据(见附注7),包括应计但尚未支付的利息120,058美元,按换算价48.00美元转换为其B系列优先股23,335股,根据附注 购买协议概述的条款。
2023年2月,对2022年可转换票据进行了修订,将到期日延长至2023年3月31日,并将有条件融资或控制权变更事件时的转换价格 改为3,000万美元除以在紧接有条件融资或控制权变更事件结束前按完全稀释基础发行和发行的公司普通股数量 。
2023年3月,公司董事会和股东批准了2023年股票激励计划(“2023年计划”); 然而,在建议的远期股票拆分和普通股授权股份增加的生效日期之前,不应进行授予 预计将于本招股说明书 构成的注册说明书生效之日起生效。2023年计划允许委员会以激励性和非法定股票期权、限制性股票奖励、限制性股票单位和其他基于股票的奖励的形式向员工、董事和非员工授予多达200万股普通股。 截至2023年3月20日,没有根据2023年计划颁发的奖励。
2023年5月17日,董事会批准在注册说明书生效后按7.1:1的比例进行前瞻性股票拆分 招股说明书是其中的一部分。董事会还批准将公司普通股的授权股份增加到100,000,000股,同时将普通股面值改为0.0001美元。所有提及普通股、购买普通股的期权、股份数据、每股数据及合并财务报表及相关的 附注所载的相关资料均已追溯调整,以反映股票拆分的影响、我们的 普通股的面值变动,以及优先股换股比率的调整(如适用)。因此,在综合资产负债表中进行了普通股和额外实收资本之间的调整,以反映股票拆分后的新价值。
| F-23 |
AZITRA, Inc.
资产负债表 表
未经审计
| 2023年9月30日 | 2022年12月31日 | |||||||
| 资产 | (未经审计) | |||||||
| 流动资产: | ||||||||
| 现金和现金等价物 | $ | 4,400,327 | $ | 3,492,656 | ||||
| 应收账款 | - | 182,820 | ||||||
| 应收税额抵免 | 40,525 | 69,666 | ||||||
| 应收所得税 | 13,722 | 13,722 | ||||||
| 递延发售成本 | - | 216,886 | ||||||
| 预付 费用 | 409,170 | 160,133 | ||||||
| 流动资产总额 | 4,863,744 | 4,135,883 | ||||||
| 财产和设备,净额 | 736,423 | 846,958 | ||||||
| 其他资产 | ||||||||
| 其他资产 | 47,546 | 47,507 | ||||||
| 融资租赁使用权 资产 | 43,872 | - | ||||||
| 经营租赁使用权 资产 | 899,619 | 1,116,697 | ||||||
| 无形资产,净额 | 162,240 | 219,567 | ||||||
| 延期 专利成本 | 736,800 | 800,831 | ||||||
| 其他资产总额 | $ | 1,890,077 | $ | 2,184,602 | ||||
| 总资产 | $ | 7,490,244 | $ | 7,167,443 | ||||
| 负债,股票, 和股东权益 | ||||||||
| 流动负债: | ||||||||
| 应付帐款 | 417,928 | 784,687 | ||||||
| 本期融资租赁 责任 | 14,254 | - | ||||||
| 当前经营租赁 责任 | 301,423 | 287,384 | ||||||
| 应计费用 | 720,095 | 993,961 | ||||||
| 合同债务 | - | 156,000 | ||||||
| 流动负债总额 | 1,453,700 | 2,222,032 | ||||||
| 长期融资租赁 责任 | 29,952 | - | ||||||
| 长期经营租赁 责任 | 613,572 | 840,896 | ||||||
| 认股权证法律责任 | 60,933 | 70,283 | ||||||
| 可转换 应付票据,净额 | - | 6,600,000 | ||||||
| 总负债 | 2,158,157 | 9,733,211 | ||||||
| 承付款和意外开支 (Note(十三) | ||||||||
| 优先股: | ||||||||
| A系列敞篷车 优先股;面值0.0001美元; 2023年9月30日和2022年12月31日授权的205,385股;已发行的0和205,385股 分别于2023年9月30日及2022年12月31日尚未偿还;于9月30日的清算价值为0美元及3,337,506美元, 分别为二零二三年及二零二二年十二月三十一日 | 3,272,944 | |||||||
| A-1系列可转换优先股;面值0.0001美元;在2023年9月30日和2022年12月31日授权发行的380,657股;分别于2023年9月30日和2022年12月31日发行和发行的0股和380,657股;截至2023年9月30日和2022年12月31日的清算价值分别为0美元和14,274,638美元 | 14,100,533 | |||||||
| B系列可转换优先股;面值0.0001美元;2023年9月30日和2022年12月31日授权发行的851,108股;分别于2023年9月30日和2022年12月31日发行和发行的0股和391,303股;截至2022年9月30日和2022年12月31日的清算价值分别为0美元和17,000,159美元 | 16,321,065 | |||||||
| 股东权益 (赤字) | ||||||||
| 普通股;面值0.0001美元,分别于2023年9月30日和2022年12月31日授权发行100,000,000股,2023年9月30日和2022年12月31日分别发行和发行1,043,988股 | 1,210 | 104 | ||||||
| 额外实收资本 | 51,475,425 | 1,054,138 | ||||||
| 累计赤字 | (46,144,548 | ) | (37,314,552 | ) | ||||
| 股东权益合计(亏损) | 5,332,087 | (36,260,310 | ) | |||||
| 负债、优先股和股东权益合计(赤字) | $ | 7,490,244 | $ | 7,167,443 | ||||
附注是这些简明财务报表的组成部分。
| F-24 |
AZITRA, Inc.
运营报表
未经审计
| 前九个月 | 九人组
个月 | |||||||
| 2023年9月30日 | 2022年9月30日 | |||||||
| 服务 收入相关方 | $ | 596,000 | $ | 253,500 | ||||
| 总收入 | 596,000 | 253,500 | ||||||
| 运营费用: | ||||||||
| 一般和行政 | 3,443,559 | 2,583,818 | ||||||
| 研发 | 2,188,795 | 4,425,195 | ||||||
| 运营费用总额 | 5,632,354 | 7,009,013 | ||||||
| 运营亏损 | (5,036,354 | ) | (6,755,513 | ) | ||||
| 其他收入(支出): | ||||||||
| 利息收入 | 1,184 | 4,056 | ||||||
| 利息支出 | (166,729 | ) | (66,781 | ) | ||||
| 员工留任积分 | - | 229,813 | ||||||
| 宽免应付帐款 | 56,285 | - | ||||||
| 可转换票据公允价值变动 | (3,630,100 | - | ||||||
| 其他 收入(费用) | (54,282 | ) | (45,365 | ) | ||||
| 合计 其他收入(费用) | (3,793,642 | ) | 121,723 | |||||
| 净亏损 | $ | (8,829,996 | ) | $ | (6,633,790 | ) | ||
| 优先股股息 | (1,355,347 | ) | (2,076,737 | ) | ||||
| 普通股股东应占净亏损 | $ | (10,185,343 | ) | $ | (8,710,527 | ) | ||
| 每股基本和稀释后净亏损 | $ | (1.97 | ) | $ | (8.25 | ) | ||
| 加权平均已发行普通股, 基本和摊薄 | 5,181,107 | 1,055,380 | ||||||
附注是这些简明财务报表的组成部分。
| F-25 |
AZITRA, Inc.
可转换优先股和股东亏损报表
截至二零二三年及二零二二年九月三十日止九个月
未经审计
| 系列 A可转换优先股 | 系列 A-1可转换优先股 | B系列可转换优先股 | 普通股 股票 | 其他内容 实收- | 累计 | 股东合计
股权 | ||||||||||||||||||||||||||||||||||||||
| 股票 | 金额 | 股票 | 金额 | 股票 | 金额 | 股票 | 金额 | 资本 | 赤字 | (赤字) | ||||||||||||||||||||||||||||||||||
余额 -2021年12月31日 | 205,385 | $ | 3,272,944 | 380,657 | $ | 14,100,533 | 391,303 | $ | 16,321,065 | 1,043,100 | $ | 104 | 868,163 | $ | (26,634,186 | ) | $ | (25,765,919 | ) | |||||||||||||||||||||||||
| 基于股票的薪酬 | - | - | - | - | - | - | - | - | 56,983 | - | 56,983 | |||||||||||||||||||||||||||||||||
| 股票期权的行使 | - | - | - | - | - | - | 888 | - | 1,510 | - | 1,510 | |||||||||||||||||||||||||||||||||
| 净亏损 | - | - | - | - | - | - | - | - | - | (2,326,017 | ) | (2,326,017 | ) | |||||||||||||||||||||||||||||||
余额, 2022年3月31日 | 205,385 | 3,272,944 | 380,657 | 14,100,533 | 391,303 | 16,321,065 | 1,043,988 | 104 | 926,656 | (28,960,203 | ) | (28,033,443 | ) | |||||||||||||||||||||||||||||||
| 基于股票的薪酬 | - | - | - | - | - | - | - | - | 53,826 | - | 53,826 | |||||||||||||||||||||||||||||||||
| 净亏损 | - | - | - | - | - | - | - | - | - | (1,890,153 | ) | (1,890,153 | ) | |||||||||||||||||||||||||||||||
余额, 2022年6月30日 | 205,385 | 3,272,944 | 380,657 | 14,100,533 | 391,303 | 16,321,065 | 1,043,988 | 104 | 980,482 | (30,850,356 | ) | (29,869,770 | ) | |||||||||||||||||||||||||||||||
| 基于股票的薪酬 | - | - | - | - | - | - | - | - | 44,329 | - | 44,329 | |||||||||||||||||||||||||||||||||
| 净亏损 | - | - | - | - | - | - | - | - | - | (2,417,620 | ) | (2,417,620 | ) | |||||||||||||||||||||||||||||||
余额 -2022年9月30日 | 205,385 | $ | 3,272,944 | 380,657 | $ | 14,100,533 | 391,303 | $ | 16,321,065 | 1,043,988 | $ | 104 | $ | 1,024,811 | $ | (33,267,976 | ) | $ | (32,243,061 | ) | ||||||||||||||||||||||||
余额 -2022年12月31日 | 205,385 | $ | 3,272,944 | 380,657 | $ | 14,100,533 | 391,303 | $ | 16,321,065 | 1,043,988 | $ | 104 | $ | 1,054,138 | $ | (37,314,552 | ) | $ | (36,260,310 | ) | ||||||||||||||||||||||||
| 发行B系列可转换优先股 | ||||||||||||||||||||||||||||||||||||||||||||
| 库存 | - | - | - | - | 23,432 | 1,124,759 | - | - | - | - | 1,124,759 | |||||||||||||||||||||||||||||||||
| 基于股票的薪酬 | - | - | - | - | - | - | - | - | 38,794 | - | 38,794 | |||||||||||||||||||||||||||||||||
| 净亏损 | - | - | - | - | - | - | - | - | - | (2,457,179 | ) | (2,457,179 | ) | |||||||||||||||||||||||||||||||
余额, 2023年3月31日 | 205,385 | 3,272,944 | 380,657 | 14,100,533 | 414,735 | 17,445,824 | 1,043,988 | 104 | 1,092,932 | (39,771,731 | ) | (38,678,695 | ) | |||||||||||||||||||||||||||||||
| 转换可转换应付票据 | - | - | - | - | - | - | 1,846,020 | 185 | 9,494,887 | - | 9,495,072 | |||||||||||||||||||||||||||||||||
| 系列 A可转换优先股 | 系列 A-1可转换优先股 | B系列可转换优先股 | 普通股 股票 | 额外的 实收- | 累计 | 股东权益合计 | ||||||||||||||||||||||||||||||||||||||
| 股票 | 金额 | 股票 | 金额 | 股票 | 金额 | 股票 | 金额 | 资本 | 赤字 | (赤字) | ||||||||||||||||||||||||||||||||||
| 转换优先股 | (205,385 | ) | (3,272,944 | ) | (380,657 | ) | (14,100,533 | ) | (414,735 | ) | (17,445,824 | ) | 7,707,635 | 771 | 34,818,530 | - | 34,819,301 | |||||||||||||||||||||||||||
| 首次公开募股,扣除1,508,791美元的发行成本 | - | - | - | - | - | - | 1,500,000 | 150 | 5,991,209 | - | 5,991,359 | |||||||||||||||||||||||||||||||||
| 基于股票的薪酬 | - | - | - | - | - | - | - | - | 38,794 | - | 38,794 | |||||||||||||||||||||||||||||||||
| 净亏损 | - | - | - | - | - | - | - | - | - | (4,429,528 | ) | (4,429,528 | ) | |||||||||||||||||||||||||||||||
余额, 2023年6月30日 | - | - | - | - | - | - | 12,097,643 | 1,210 | 51,436,352 | (44,201,259 | ) | 7,236,303 | ||||||||||||||||||||||||||||||||
| 基于股票的薪酬 费用 | - | - | - | - | - | - | - | - | 39,073 | - | 39,073 | |||||||||||||||||||||||||||||||||
| 净亏损 | - | - | - | - | - | - | - | - | - | (1,943,289 | (1,943,289 | ) | ||||||||||||||||||||||||||||||||
余额 -2023年9月30日 | - | $ | - | - | $ | - | - | $ | - | 12,097,643 | $ | 1,210 | $ | 51,475,425 | $ | (46,144,548 | ) | $ | 5,332,087 | |||||||||||||||||||||||||
附注是这些简明财务报表的组成部分。
| F-26 |
AZITRA, Inc.
现金流量表
未经审计
| 截至9月30日的9个月, | ||||||||
| 2023 | 2022 | |||||||
| 经营活动的现金流: | ||||||||
| 净亏损 | $ | (8,829,996 | ) | $ | (6,633,790 | ) | ||
| 调整净亏损与经营活动中使用的现金净额 : | ||||||||
| 折旧及摊销 | 97,390 | 93,515 | ||||||
| 债务贴现摊销 | - | 5,895 | ||||||
| 摊销使用权资产 | 219,658 | 212,470 | ||||||
| 可转换票据的应计利息 | 165,939 | 60,877 | ||||||
| 基于股票的薪酬 | 116,661 | 155,138 | ||||||
| 权证责任的公允价值变动 | (9,350 | ) | (420 | ) | ||||
| 可转换票据公允价值变动 | 3,630,100 | - | ||||||
| 宽免应付帐款 | (56,285 | ) | - | |||||
| 财产和设备处置损失 | 41,417 | 7,923 | ||||||
| 无形资产减值和专利成本 | 351,360 | - | ||||||
| 经营性资产和负债变动情况: | ||||||||
| 应收账款 | 182,820 | 75,172 | ||||||
| 预付费用 | (249,037 | ) | 45,636 | |||||
| 其他资产 | (39 | ) | (39,847 | ) | ||||
| 应收税额抵免 | 29,141 | 48,871 | ||||||
| 应付账款和应计费用 | (143,662 | ) | (1,864 | ) | ||||
| 融资租赁责任 | 44,206 | - | ||||||
| 经营租赁负债 | (213,285 | ) | (202,853 | ) | ||||
| 合同债务 | (156,000 | ) | (3,500 | ) | ||||
| 净额 经营活动中使用的现金 | (4,778,962 | ) | (6,176,777 | ) | ||||
| 投资活动的现金流 : | ||||||||
| 购买财产和设备 | (22,882 | ) | (23,198 | ) | ||||
| 出售财产和设备的收益 | - | 4,250 | ||||||
| 延期专利成本的资本化 | (208,723 | ) | (117,244 | ) | ||||
| 许可证的资本化 | (13,096 | ) | (57,372 | ) | ||||
| 资本化 专利和商标成本 | (13,573 | ) | (46,406 | ) | ||||
| 用于投资活动的现金净额 | (258,274 | ) | (239,970 | ) | ||||
| 为活动融资产生的现金流 | ||||||||
| 可兑换货币收益 票据,扣除发行费用 | - | 4,350,000 | ||||||
| 支付延期发售费用 | - | (40,703 | ) | |||||
| 融资本金支付 租赁 | (46,452 | ) | - | |||||
| 首次公开发行收益 提供,净 | 5,991,359 | - | ||||||
| 行使股票期权所得收益 | - | 1,510 | ||||||
| 净额 融资活动提供的现金 | 5,944,907 | 4,310,807 | ||||||
| 现金和现金等价物净变化 | 907,671 | (2,105,940 | ) | |||||
| 期初现金和现金等价物 | 3,492,656 | 8,044,262 | ||||||
| 期末现金和现金等价物 | $ | 4,400,327 | $ | 5,938,322 | ||||
| 补充披露 非现金投资和融资信息: | ||||||||
| 通过交换获得使用权资产 有关租赁负债 | $ | - | $ | 1,418,502 | ||||
| 通过交换获得使用权资产 融资租赁负债 | $ | 46,452 | $ | - | ||||
| 将票据转换为普通股 | $ | 9,495,152 | $ | - | ||||
| 将票据转换为B系列可转换债券 优先股 | $ | 1,124,759 | $ | - | ||||
附注是这些简明财务报表的组成部分。
| F-27 |
AZITRA,
INC.
未经审计简明综合财务报表附注
截至二零二三年及二零二二年九月三十日止九个月
1.组织机构和业务性质
Azitra, Inc.成立于2014年1月2日。它是一家合成生物公司,专注于皮肤微生物的筛选和基因工程。其使命是发现和开发新的治疗方法,以创造治疗皮肤病的新范例。该公司的 发现平台经过筛选,寻找具有有益效果的自然产生的细菌细胞。然后对这些微生物进行基因组测序,并对其进行工程设计,以制造细胞疗法、重组治疗性蛋白、多肽和小分子,用于精确治疗皮肤病。2023年5月17日,该公司从“Azitra Inc.”更名为“Azitra,Inc.”。
公司在加拿大蒙特利尔设有一个地点,用于某些研究活动。该地点和在那里完成的操作在整个2022年和2023年期间保持一致。该公司还于2021年在康涅狄格州格罗顿开设了制造和实验室。
远期 股票拆分、面值变动和首次公开发行
2023年6月,本公司完成首次公开发行(IPO),以每股5.00美元的价格向公众发行和出售1,500,000股普通股。该股于2023年6月16日在纽约证券交易所美国交易所开始交易,代码为“AZTR”。 扣除承销折扣、佣金和其他发售费用后,该公司从此次发行中获得的净收益为600万美元。
在本公司的注册声明生效前,本公司立即对其已发行和已发行普通股进行了7.1比1的远期股票拆分(远期股票拆分)。2023年5月17日,该公司将其股本的面值从0.10美元改为0.0001美元。因此,随附的未经审核综合财务报表及其附注中列报的所有期间的所有股份及每股金额已追溯调整(如适用),以反映远期股票拆分的影响。有关正向股票拆分的其他详情,请参阅附注8。
去 关注事项
未经审核简明财务报表乃按持续经营基准编制,假设本公司将于可预见的未来继续经营,并考虑在正常业务过程中变现资产及清算负债。然而,管理层已经确定了以下情况和事件,这些情况和事件使公司的持续经营能力 存在不确定性。截至2023年9月30日及截至9月30日的9个月,公司累计亏损4610万美元,运营亏损500万美元,运营资金为480万美元。这些因素以及其他因素使人对公司作为持续经营企业的持续经营能力产生了极大的怀疑。
管理层 计划继续通过股权和债务融资筹集资金,以满足运营和营运资金需求;然而,公司 将需要大量额外资金来完成其产品开发,并为公司预计在未来几年发生的额外亏损提供资金。该公司仍处于临床阶段,因此尚未获得产品 收入。不能保证公司在需要时成功获得额外融资以满足其运营需求 。
这些 条件和事件使本公司在财务报表可供发布之日起12个月内继续经营的能力存在不确定性。财务报表不包括任何必要的调整,如果公司无法继续经营下去的话。
重新分类
某些上期金额和披露已重新分类,以符合本期的财务列报。
| F-28 |
AZITRA,
Inc.
未经审计的简明合并财务报表附注
截至二零二三年及二零二二年九月三十日止九个月
2. 重要会计政策摘要
会计基础
公司的财务报表是根据美国公认会计原则(“美国公认会计原则”)编制的。
未经审计的 中期财务信息
未经审计的中期财务报表及相关附注乃根据美国中期财务信息公认会计准则 在美国证券交易委员会(“美国证券交易委员会”)的规章制度下编制。按照美国公认会计原则编制的年度财务报表中通常包含的某些信息 和披露内容已根据此类规则和规定予以精简或省略 。未经审核中期财务报表乃按与经审核财务报表一致的基准编制,管理层认为该等中期财务报表反映所有调整,包括正常经常性调整、公平列报中期业绩所需的调整及截至中期资产负债表日期的财务状况。中期财务报表附注中披露的与三个月和九个月相关的财务数据和其他信息未经审计。未经审计的中期业绩不一定代表整个财政年度的业绩。这些未经审计的中期财务报表应与本公司截至2022年12月31日的年度财务报表及包含在本公司于2023年6月5日提交给美国证券交易委员会的注册说明书中的附注一并阅读。
使用预估的
按照美国公认的会计原则编制财务报表需要 管理层作出估计和假设,这些估计和假设会影响资产负债表日期报告的资产和负债额。 虽然管理层认为编制财务报表时使用的估计和假设是适当的,但实际结果可能与这些估计不同。
现金 和现金等价物
就资产负债表及现金流量表而言,本公司将所有手头现金、活期存款及所有原始到期日为三个月或以下的高流动性投资视为现金等价物。
财产 和设备
财产和设备按成本入账。折旧采用直线法计算估计使用年限,使用年限为3至10年。维护和维修支出不会延长相关资产的经济使用寿命, 在发生时计入运营费用。处置财产和设备的损益反映在处置期间的经营报表 中。
应收账款
公司以成本减去呆账准备金的应收账款入账。公司定期评估其 应收账款,并根据过去的核销、收款和当前 状况的历史记录为可疑账款计提准备金。于二零二三年九月三十日及二零二二年十二月三十一日,概无呆账拨备。应收账款在被认为无法收回时被注销。收回的先前核销的应收账款在收到时入账。
| F-29 |
AZITRA,
Inc.
未经审计的简明合并财务报表附注
截至二零二三年及二零二二年九月三十日止九个月
延期的 产品成本
公司将递延发行成本资本化,该成本主要包括与公司首次公开发行相关的直接、增量法律、专业、会计和其他 第三方费用。于二零二三年六月,本公司完成其首次公开发售,并于截至二零二三年九月三十日止九个月之股东权益表内将 该等金额计入其首次公开发售所得款项总额。
租契
2016年2月,财务会计准则委员会(“FASB”)发布了ASU第2016-02号,租赁(“主题842”)。 ASU 2016-02要求承租人在资产负债表上为所有期限超过12个月的租赁 列报使用权(“ROU”)资产和租赁负债。见附注2 -最近采用的会计公告。
在计算ASU 2016-02的影响时,公司选择了过渡方法,因此没有重述可比期间。本公司 选择将非租赁组成部分作为其相关租赁组成部分的一部分进行会计处理。租赁会计处理涉及重大 判断,包括对租赁期、租赁付款和贴现率作出估计。根据该指引, 本公司就所有租期超过12个月的租赁确认使用权资产及租赁负债。租赁根据协议的经济实质分类为 经营租赁或融资租赁。
公司拥有建筑物的经营租赁。目前,公司有3个经营租赁,截至2022年1月1日,使用权资产和租赁负债总额为1,418,502美元。租赁之基准、条款及条件由个别协议厘定。本公司 可选择将某些租赁期限延长36 - 52个月。所有延期选择权均已计入使用权资产 和租赁负债的计算中。租赁不包含剩余价值担保、限制或可能对公司产生额外财务 义务的契约。概无转租、售后回租或关联方交易。
于 2023年9月30日,本公司的经营使用权资产净值为899,619美元,流动及长期经营租赁负债分别为301,423美元及613,572美元。
于 2023年,本公司就使用若干设备订立租赁,分类为融资租赁。融资租赁为期 36个月。于2023年9月30日,本公司的融资使用权资产净值为43,872美元,流动及长期经营租赁负债分别为14,254美元及29,952美元。
无形资产
无形资产包括商标和专利。与专利和商标申请的提交和起诉直接相关的所有成本都是资本化的。专利在正式批准后在其各自的剩余使用寿命内摊销。商标具有无限的生命期 。
公司按照ASC主题350对其他无限期无形资产进行核算,商誉及其他无形资产 (ASC 350)。ASC 350要求具有无限年限的无形资产必须至少每年进行减值测试 ,或者只要发生事件或情况变化表明账面价值可能无法收回。寿命有限的无形资产将继续在其使用年限内摊销。在截至2023年9月30日的9个月内,与许可协议有关的减值损失为78,606美元,在截至2022年9月30日的9个月内为0美元。
延期的专利成本
递延专利成本是指与提交待批准的专利申请相关的法律和申请费用。 这些递延成本将在专利正式批准后的预计使用寿命内开始摊销。如果未颁发专利 ,则与该专利相关的成本将在该专利被拒绝的当年支出。在截至2023年9月30日的9个月中,与递延专利成本相关的减值损失为272,754美元,在截至2022年9月30日的9个月中为0美元。
| F-30 |
AZITRA,
Inc.
未经审计的简明合并财务报表附注
截至二零二三年及二零二二年九月三十日止九个月
长期资产减值
根据ASC主题360-10《长期资产减值或处置会计》(ASC 360-10),本公司的政策 是在发生事件或环境变化表明资产的账面价值可能无法收回时,审查其长期资产的减值。为配合本次审核,本公司亦会重新评估该等资产的折旧期。 当资产的使用及最终处置所产生的未贴现预期未来现金流量总和少于其账面金额时,本公司确认减值亏损。如果一项资产被视为减值,应确认的减值按该资产的账面价值超过该资产的公允价值的金额计量,该金额是根据该资产产生的未来营运现金流量净值的现值 确定的。
可转换债务和权证会计
认股权证
根据对权证具体条款的评估和ASC 480中适用的权威指导,公司将权证作为股权分类或负债分类工具进行会计处理。区分负债与股权(“ASC 480”)和ASC 815,衍生工具和套期保值(“ASC 815”)。评估考虑认股权证是否为ASC 480所指的独立财务工具,是否符合ASC 480所指的负债定义,以及认股权证是否符合ASC 815中有关股权分类的所有要求,包括权证是否与本公司本身的普通股挂钩,以及其他股权分类条件。这项评估需要使用专业判断,在权证发行时以及在权证尚未结清的每个季度结束日进行。
对于符合所有股权分类标准的已发行权证,权证必须在发行时记录为额外 实收资本的组成部分。对于不符合所有股权分类标准的已发行权证,权证 必须在发行当日及其之后的每个资产负债表日按其初始公允价值入账。认股权证估计公允价值的变动在其他损益项下的经营报表中确认为非现金损益。
可转换债务
当公司发行具有转换功能的债务时,它首先评估债务是否应按照ASC 480-区分负债和股权-入账。如果债务不符合ASC 480负债的标准,票据的转换 功能需要根据ASC 815衍生工具和对冲进行分流。如果公司确定嵌入式转换 功能需要根据ASC 815进行分支,公司还会考虑是否可以选择公允价值选项。如果选择了公允价值选项,公司将按其初始公允价值记录票据,随后公允价值的任何变化将记录在 收益中。如附注7所示,本公司已为2022年可换股票据选择公允价值选项,并将按其初始公允价值入账 ,其后任何公允价值变动将记入收益。可换股票据于本公司首次公开发售截止日期转换为本公司普通股。
可转换 优先股
由于 可转换优先股股东在发生被视为清盘事件时拥有清算权,而在某些情况下, 并非完全在本公司的控制范围内,需要赎回当时尚未发行的可转换优先股,因此,本公司将可转换优先股归入资产负债表夹层股权。
如附注8所述,于本公司首次公开招股截止日期,可换股优先股转换为本公司的普通股。
| F-31 |
AZITRA,
Inc.
未经审计的简明合并财务报表附注
截至二零二三年及二零二二年九月三十日止九个月
收入
公司遵循五根据ASC 606确认与客户的合同收入的步骤 (“ASC 606”),包括:
| ● | 第 1步:确定与客户的合同(S) | |
| ● | 第 2步:确定合同中的履约义务 | |
| ● | 第 3步:确定成交价格 | |
| ● | 第 4步:将交易价格分摊到合同中的履约义务 | |
| ● | 第 5步:在履行履约义务时(或作为)确认收入 |
该公司通过与一家研究合作伙伴签订的联合开发协议获得服务收入。随着合同工作的完成,公司使用输入法确认与协议研究和开发方面相关的收入。
公司还产生赠款收入,这是从与各联邦机构和非营利性研究机构签订的合同中收到的款项,用于公司为进一步产品开发而进行的一般研究,因此被视为对公司的贡献 。合同的期限一般为一年或更长时间,任何一方都可以取消。本公司的结论是,由于本公司 是该安排的唯一积极参与者,因此赠款安排不符合被视为FASB ASC主题808项下的合作安排的标准。赠款安排也不符合主题606下的收入确认标准,因为美国政府不符合客户的定义。
如果发生了符合条件的费用,并且可实现或已实现并赚取了支付权,则根据这些赠款合同赚取的金额 将作为研发费用的减少额入账。本公司相信这一政策与主题606一致,以确保 确认反映了向客户转让承诺的商品或服务的金额,反映了 公司希望有权获得的对价,以换取这些商品或服务,即使没有主题606中定义的交换。 此外,公司已确定,将收到的金额确认为已产生的成本和可实现的金额 类似于主题606下的随着时间推移转移服务控制权的概念。
预付补助金的收据 如果未按照赠款中与允许成本有关的条件使用,或在执行合同之前从研究合作伙伴收取与服务收入安排有关的资金时,应返还给供资机构,在随附的资产负债表中被归类为合同负债。
研究和开发
本公司按照会计准则编纂(ASC)小标题730-10核算研发费用,研究和开发 。因此,内部研究和开发成本在发生时计入费用。研发成本包括与人力、材料和用品相关的成本。截至2023年9月30日的9个月内,产生的研发成本为2,188,795美元。在截至2022年9月30日的9个月中,发生的研发成本为4,425,195美元。
在2023年9月30日和2022年12月31日,该公司有32,459美元的州税收抵免,用于与 向康涅狄格州出售研发税收抵免相关的待决退款。截至2023年9月30日和2022年12月31日,公司 分别有0美元和28,925美元用于与加拿大科学研究和实验发展(SRED)抵免相关的待决退款。 截至2023年9月30日和2022年12月31日,公司还分别记录了与加拿大商品和服务税(GST)和魁北克销售税(QST)退款相关的8,066美元和8,282美元。退款收入记入经营报表上的其他收入。
| F-32 |
AZITRA,
Inc.
未经审计的简明合并财务报表附注
截至2023年和2022年9月30日的9个月
基于股票的薪酬
公司根据ASC 718对股票薪酬进行核算,薪酬--股票薪酬(ASC 718)。ASC 718要求 员工的股票期权和根据股票参与计划购买股票的权利必须按公允价值入账。ASC 718要求 与以股份为基础的支付交易相关的补偿成本在财务报表中确认为运营费用。 根据该方法,所有授予或修改的奖励的补偿成本均按授予日的估计公允价值计量,并 计入员工提供服务以换取奖励的归属期间的补偿费用。对于绩效条件影响归属的奖励 ,公司在确定可能达到绩效条件时确认补偿费用。当没收发生时,公司确认没收的影响。
该公司使用布莱克-斯科尔斯期权定价模型来确定其股票期权的公允价值。布莱克-斯科尔斯模型包括各种假设,包括标的普通股的价值、股票期权的预期寿命、预期波动率和预期无风险利率。这些假设反映了公司的最佳估计,但它们涉及基于一般不受公司控制的市场情况的固有不确定性 。因此,如果使用其他假设,基于股票的薪酬成本可能会受到重大影响。此外,如果公司对未来的赠款使用不同的假设,基于股票的薪酬成本可能会在未来期间受到重大影响。
公司按照会计准则更新(ASU)2018-07号更新的ASC 718的规定,对发行给非员工的股权工具进行会计核算。对非员工股份支付会计的改进,这将ASC 718的范围扩大到包括对非员工的基于股票的支付交易。
在对使用Black-Scholes期权定价模型发行的期权进行估值时,使用了以下假设:
预期波动 。本公司股票的预期波动率是根据同行公司的平均波动率估计的。
预期的 期限。期权的预期期限采用简化方法估计,该方法基于每个授予的归属期限和合同 期限,或者对于具有分级归属的奖励的每个归属部分。
基础 普通股价值。在公司首次公开募股之前,公司股票的基本普通股价值由第三方估值专家进行估计,当时公司利用其在授予日在纽约证券交易所美国证券交易所的交易价格。
无风险利率 。该公司的无风险利率以美国国库券的隐含收益为基础,其条款等于标的授权书的预期期限。
股息 收益率。布莱克-斯科尔斯估值模型要求以单一的预期股息收益率作为输入。本公司过去没有就普通股支付股息 ,近期也不会对普通股支付股息。因此,公司使用的股息 收益率百分比为零。
所得税 税
公司采用ASC 740《所得税会计》中规定的负债法核算所得税。根据此方法,递延税项资产及负债按账面金额与资产及负债的计税基准及净营业亏损结转之间的暂时性差异而产生的预期未来税项后果确认,均按现行制定的税率计算。
管理层已评估与不确定所得税头寸相关的ASC指导的影响,并得出结论,公司在2023年9月30日和2022年12月31日的财务报表中对不确定所得税头寸没有重大风险敞口。截至2022年12月31日,公司的所得税纳税申报单未经税务机关审查。
| F-33 |
AZITRA,
Inc.
未经审计的简明合并财务报表附注
截至2023年和2022年9月30日的9个月
公允价值计量
公司按公允价值经常性地承担某些负债。使用由三个级别组成的公允价值层次结构来确定公允价值评估技术的输入的优先顺序:
| ● | 级别 1-投入基于在活跃市场交易的相同工具的可观察价格或报价。 | |
| ● | 第2级-投入基于活跃市场中类似工具的报价、非活跃市场中相同或类似工具的报价、以及基于模型的估值技术,其所有重要假设均可在市场上观察到,或可由资产或负债的基本完整期限的可观察市场数据来证实。 | |
| ● | 级别 3-投入通常是不可观察的,通常反映了管理层对市场参与者在为资产或负债定价时将使用的假设的估计。因此,公允价值是使用基于模型的技术来确定的,这些技术包括期权定价模型、贴现现金流模型和类似技术。 |
在确定公允价值时,本公司采用估值技术,最大限度地利用可观察到的投入和最大限度地减少使用不可观察到的投入,并在评估公允价值时考虑交易对手信用风险。
金融工具
公司的金融工具主要包括应收账款、应付账款、应计负债和长期债务。对于应收账款、应付账款和应计负债,由于该等票据的短期到期日,账面金额接近公允价值。本公司长期债务的估计公允价值接近账面价值。
最近 会计声明
2016年2月,财务会计准则委员会(“FASB”)发布了会计准则更新(“ASU”)2016-02, 租赁(主题842)。本ASU要求承租人在其资产负债表中确认大多数经营租赁下的使用权资产和租赁负债。会计准则于二零二一年十二月十五日后开始的年度及中期期间生效。本公司于二零二二年一月一日采纳会计准则第2016-02号。见附注13 -经营租赁。
2019年12月,FASB发布了ASU第2019-12号,所得税(话题740):简化所得税的会计核算. 本标准通过删除以前规定的各种例外情况,以及提供 额外的所得税报告要求,简化了所得税的会计处理。会计准则于二零二二年一月一日对本公司生效。本公司已于2022年1月1日采用 该准则,该准则对财务报表没有重大影响。
2020年8月,FASB发布了ASU第2020-06号,债务-有转换和其他选择权的债务(子专题470-20)和衍生工具和 套期保值-实体自有权益中的合同(子专题815-40)简化了具有负债和权益特征的某些金融工具 的会计处理,包括可转换工具和实体自身权益的合同。本 准则将于2024年1月1日对公司生效,允许提前采用(但不得早于 2020年12月15日之后开始的财政年度)。本公司已于2021年1月1日采纳该准则,该准则对 财务报表没有重大影响。
| F-34 |
AZITRA,
Inc.
未经审计的简明合并财务报表附注
截至2023年和2022年9月30日的9个月
管理层 不认为最近发布但尚未生效的任何其他会计准则会对随附的财务报表产生实质性影响。随着新的会计公告的发布,公司将采用在这种情况下适用的会计公告。
3. 员工留任积分
《CARE法案》提供员工留任抵免(“CARE Employee Return Credits”),这是一项可退还的税收抵免 符合条件的雇主每位员工最高可缴纳5,000美元的就业税。税收抵免相当于在一个季度内支付给员工的合格工资的50%,截至2020年12月31日,每位员工的合格工资上限为10,000美元。美国政府通过了额外的救济条款 ,将这些信用额度的合格工资上限延长并略微扩大至2021年9月30日。根据这些额外规定,税收抵免现在相当于一个季度支付给员工的合格工资的70%, 每名员工的合格工资上限已提高到每季度10,000美元。2022年4月,公司 确定其符合《CARE法案》规定的税收抵免条件,并记录了229,813美元的应收账款,并在经营报表上将该金额确认为其他 收入。公司在2022年9月收到了这笔款项的全额付款。
4. 财产和设备
于二零二三年九月三十日及二零二二年十二月三十一日,物业及设备包括以下各项:
| 2023年9月30日 | 2022年12月31日 | |||||||
| 实验室设备 | $ | 1,008,063 | $ | 1,034,579 | ||||
| 计算机和办公设备 | 30,825 | 30,825 | ||||||
| 家具和固定装置 | 24,316 | 24,316 | ||||||
| 租赁权改进 | 28,855 | 28,855 | ||||||
| 建筑设备 | 14,932 | 14,932 | ||||||
| 总资产和设备 | 1,106,991 | 1,133,507 | ||||||
| 减去累计折旧 和摊销 | (370,568 | ) | (286,549 | ) | ||||
| 物业、厂房和设备合计,净额 | $ | 736,423 | $ | 846,958 | ||||
折旧 截至2023年9月30日的9个月的费用为92,000美元。截至2022年9月30日的9个月的折旧费用为90,165美元。
在截至2023年9月30日的9个月内,在处置所记录的财产和设备方面出现了41,417美元的损失。截至2022年9月30日的9个月内,记录的财产和设备处置亏损7,923美元。
5. 无形资产
截至9月30日,无形资产 包括以下内容:
2023:
预计 有用的寿命 | 毛 金额 | 累计摊销 | 减损 | 净额 金额 | ||||||||||||||
| 商标 | 不定 | $ | 56,409 | $ | - | $ | - | $ | 56,409 | |||||||||
| 专利 | 17年 | 119,361 | 13,530 | - | 105,831 | |||||||||||||
| 许可协议 | 17年 | 78,606 | - | 78,606 | - | |||||||||||||
| 无形资产 | $ | 254,376 | $ | 13,530 | $ | 78,606 | $ | 162,240 | ||||||||||
2022:
| F-35 |
AZITRA,
Inc.
未经审计的简明合并财务报表附注
截至2023年和2022年9月30日的9个月
预计 有用的寿命 | 毛 金额 | 累计摊销 | 减损 | 净额 金额 | ||||||||||||||
| 商标 | 不定 | $ | 53,999 | $ | - | $ | - | $ | 53,999 | |||||||||
| 专利 | 17年 | 108,198 | 8,140 | - | 100,058 | |||||||||||||
| 许可协议 | 17年 | 65,510 | - | - | 65,510 | |||||||||||||
| 无形资产 | $ | 227,707 | $ | 8,140 | $ | - | $ | 219,567 | ||||||||||
在截至2023年9月30日的九个月内,与无形资产相关的摊销费用为5,390美元。在截至2022年9月30日的九个月内,与无形资产相关的摊销费用为3,350美元。
6. 应计费用
截至2023年9月30日、2023年9月和2022年9月30日的应计费用包括:
| 2023年9月30日 | 2022年12月31日 | |||||||
| 应计费用: | ||||||||
| 员工工资单和奖金 | $ | 272,950 | $ | 371,010 | ||||
| 休假 | 57,963 | 27,082 | ||||||
| 研究和开发项目 | 130,233 | 316,389 | ||||||
| 利息 | - | 223,792 | ||||||
| 专业费用 | 255,794 | 24,502 | ||||||
| 其他 | 3,155 | 31,186 | ||||||
| 应计费用总额 | $ | 720,095 | $ | 993,961 | ||||
公司根据对收到的服务的评估和根据合同安排的条款支出的工作,计提与第三方开展的开发活动有关的费用。根据其中一些合同支付的费用取决于研究和非临床试验里程碑。在某些情况下,向公司供应商支付的款项可能会超过所提供的服务水平,从而导致预付费用。在应计服务费时,公司估计将提供服务的时间段 以及每个时间段需要花费的工作量。如果实际执行服务的时间或努力程度与估计值不同,公司将相应调整应计或预付费用。本公司自成立以来并未 应计成本与实际成本之间出现任何重大差异。
7. 可转换债务
于2022年9月,本公司订立可转换票据购买协议(该协议)以发行最多4,500,000美元可转换本票 。同日,公司与三个投资者签订了可转换本票(2022年可转换票据),总额为4,350,000美元。2022年可转换票据将于2023年1月13日到期或发生违约事件(定义),并按年利率8%计息,但在转换或全额偿还未偿还本金之前不会到期和应付 。2022年可转换票据项下未偿还的本金和利息在a)合格融资结束时自动转换为证券,为公司带来至少2000万美元的毛收入,并以每股30%的折扣价发行与合格融资相关的证券;b)在控制权变更事件结束时转换为公司或B系列优先股的股本;以及c)在上市公司活动结束时,向投资者发行的股本等于当时已发行本金和应计利息金额除以每股公开发行价的两倍(2倍)。2022年可换股票据项下的未偿还本金及利息可由 持有人选择于到期日转换为新类别的公司优先股(C系列优先股),等同于未偿还本金金额加利息除以上限价格,上限价格的定义为每股价格等于估值上限3,000万美元除以公司资本(定义见协议)。
| F-36 |
AZITRA,
Inc.
未经审计的简明合并财务报表附注
截至2023年和2022年9月30日的9个月
2023年2月,对2022年可转换票据进行了修订,将到期日延长至2023年3月31日,并将有条件融资或控制权变更事件时的转换价格 改为3,000万美元除以在紧接有条件融资或控制权变更事件结束前按完全稀释基础发行和发行的公司普通股数量 。
于2023年4月至6月期间,2022年可转换票据进一步修订,将到期日延长至2023年9月30日,并允许 出售500,000美元的额外票据,本金总额为4,850,000美元。
从2023年6月21日起,2022年可转换票据被转换为1,846,020股公司普通股,相当于9,494,887美元。 转换后,公司在截至2023年9月30日的9个月中记录了公允价值变化3,630,100美元,在经营报表上确认为其他收入(费用)中的公允价值非现金变化。
该公司负责ASC 815项下的2022年可转换票据。根据815-15-25,可以在金融工具开始时进行选择 ,以根据ASC 825项下的公允价值选项对该工具进行会计处理。该公司已经为2022年可转换债券做出了这样的选择。使用公允价值期权,可转换本票应在发行之日按初始公允价值入账 ,此后每个资产负债表日均按初始公允价值入账。本公司根据当前市场价值的换算价对变化进行评估。当确认时,票据估计公允价值的变动在 经营报表上确认为其他收入(费用)中的非现金收益或亏损。
自2021年1月5日起,本公司签订票据购买协议,发行最多2,000,000美元可转换本票。同日,公司与一名投资者签订了一张可转换本票(2021年可转换票据),金额为1,000,000美元。2021年发行的可转换票据的利息年利率为6%,将于2023年1月5日到期并全额支付。2021年可转换票据 根据票据协议中定义的合格股权融资自动转换为等于所有本金和应计利息除以转换价格48.00美元的股份数量,该数字可根据票据协议中的定义进行调整。对于某些非限制性融资、控制权的变更或2021年可转换票据的到期日,2021年可转换票据也可以根据票据协议中的定义进行可选转换。本公司与2021年可转换票据有关的发行成本为15,613美元,已被记录为债务折扣,并将在2021年可转换票据期限内摊销。
2023年1月,本公司选择根据票据购买协议中概述的条款,将2021年可转换票据(包括应计但尚未支付的利息124,759美元,转换价格为48.00美元)转换为23,432股B系列优先股。
公司评估与2021年可转换票据相关的票据购买协议的条款和条件,以评估ASC 480-区分负债与股权以及ASC 815-衍生工具和对冲项下的会计考虑事项。公司 认定可转换票据不符合根据ASC 480负债入账的任何标准。该公司还根据ASC 815中的指导对嵌入式功能进行了评估,并确定嵌入式功能不符合任何分支标准 。
可转换 应付票据包括以下内容:
| 2023年9月30日 | 2022年12月31日 | |||||||
| 2021敞篷车 注意 | $ | - | $ | 1,000,000 | ||||
| 2022年可转换票据 | - | 5,600,000 | ||||||
| 可转换票据总额 | $ | - | $ | 6,600,000 | ||||
在截至2023年9月30日的九个月内,与债务发行成本相关的摊销费用为0美元。在截至2022年9月30日的九个月内,与债务发行成本相关的摊销费用为5,904美元。截至2023年9月30日和2022年12月31日,可转换票据的应计利息分别为0美元和223,792美元。
| F-37 |
AZITRA,
Inc.
未经审计的简明合并财务报表附注
截至2023年和2022年9月30日的9个月
8. 股东权益
2023年5月17日,本公司对其已发行和已发行的普通股进行了7.1比1的远期股票拆分(“远期股票拆分”),并按比例调整了本公司各系列优先股的现有换股比率。由于远期股票拆分,普通股的面值从0.10美元调整至0.0001美元,与远期股票拆分相关的法定普通股增加至100,000,000股。因远期拆分而产生的零碎股份 已向下一整股股份四舍五入,本公司将向该零碎股份持有人支付现金 金额以代替任何零碎股份。随附的财务报表和财务报表附注追溯 所有列示期间的远期股票拆分。根据管理该等证券的协议条款,以流通股为基础的奖励及其他股本工具的普通股股份按比例增加,而各自的每股价值及行使价(如适用)则按比例减少。
普通股 股票
于2023年9月30日及2022年12月31日,根据本公司经修订及重述的公司注册证书,本公司获授权发行100,000,000股面值0.0001美元的普通股。
截至2023年9月30日和2022年12月31日,公司分别发行和发行普通股12,097,643股和1,043,988股。
每股普通股 股东有权就提交本公司股东表决的所有事项投一票,而普通股持有人有权选举本公司一名董事股东。
公司目前拥有1,611,991股普通股,以备将来发行,以备可能于2023年9月30日行使的认股权和认股权证 。
优先股 股票
于2023年9月30日及2022年12月31日,根据本公司经修订及重述的公司注册证书,本公司已授权1,437,150股面值0.0001美元的优先股。
2023年1月,公司发行了23,432股与2021年可转换票据转换相关的B系列优先股,转换价格为每股48.00美元(见附注7)。
A系列、A-1系列和B系列优先股具有以下权利、优先选项和特权:
转换
根据持有者的选择,优先股可根据预先定义的公式转换为普通股。优先股的持有者可以随时将优先股转换为普通股。就转换而言,A系列优先股的初始转换价格为每股16.25美元(原始发行价),A-1系列优先股的初始转换价格为每股37.50美元(原始发行价),B系列优先股的初始转换价格为每股43.45美元(原始发行价),并可根据公司注册证书中的描述进行调整。 优先股将在以下两者中较早的一个时自动转换为普通股:a)总收益超过100,000,000美元的首次公开募股 或(B)日期和时间,或事件发生,经所需 优先股股东投票或书面同意,所有已发行的A系列、A-1系列和B系列优先股应按当时的有效转换率自动转换为普通股 股。
| F-38 |
AZITRA,
Inc.
未经审计的简明合并财务报表附注
截至2023年和2022年9月30日的9个月
于本公司于2023年6月首次公开招股时,所有已发行优先股均转换为普通股,发行普通股分别为1,458,233股、2,964,849股及3,284,553股,以换取A系列、A-1系列及B系列已发行优先股。在转换时没有任何收益或损失。
投票权 权利
A系列、A-1系列和B系列优先股的持有人有权就提交给公司股东以供其在公司任何股东大会上采取行动或审议的任何事项投票(或经股东书面同意以代替会议),则每名优先股流通股持有人有权投与普通股整体股数相等的投票数,该普通股持有人持有的优先股股份可于确定有权就该事项投票的股东的记录日期 之日起转换为普通股。A系列和A-1系列优先股的持有者每人有权选举公司的一名董事成员。B系列股票的持有者有权选举两名董事会成员。 每类优先股可罢免该等董事,并在公司注册证书所述的特定情况下填补因该等董事辞职、死亡或罢免而造成的任何空缺。
分红
A系列优先股的 持有者有权按A系列原始发行价的8%的年利率获得每股16.25美元的A系列优先股已发行股票的股息(如果A系列优先股发生股息、股票拆分、合并或其他类似的资本重组,则需要进行适当的调整)。股息自A系列优先股原定发行之日起累计,为累积股息,于董事会宣布或本公司清盘时支付。于2023年9月30日,A系列优先股不再派发累计股息,因为不再有任何A系列优先股发行。
A-1系列股票的持有者有权按A-1系列原始发行价每股37.50美元的年利率获得A-1系列股票的股息(在A-1系列优先股发生任何股息、股票拆分、合并或其他类似资本重组的情况下,须进行适当调整)。股息是累积的,在董事会宣布或公司清算时支付。截至2023年9月30日,由于不再有任何A-1系列优先股发行,因此A-1系列优先股没有累计股息。
B系列股票的持有者有权以B系列原始发行价每股43.45美元的年利率获得B系列股票的股息(如果发生任何股票股息、股票拆分、合并或与B系列优先股有关的其他类似资本重组,则须进行适当调整)。股息是累积的,在董事会宣布或公司清算时支付。截至2023年9月30日,B系列优先股没有累计股息 ,因为不再有B系列优先股发行。
清算
在公司发生任何清算、解散或清盘的情况下,优先股持有人有权在普通股持有人之前和优先于普通股持有人获得相当于A系列、A系列1或B系列优先股原始发行价的金额,外加已宣布和/或应计但未支付的股息。在发生任何此类清算事件时,在支付所有需要支付给优先股股东的优先金额后,公司可供分配给其股东的剩余资产应根据每个优先股和普通股持有人持有的股份数量按比例分配给优先股和普通股持有人,为此将所有此类证券视为已根据紧接该清算事件之前的公司注册证书条款转换为 普通股。
| F-39 |
AZITRA,
Inc.
未经审计的简明合并财务报表附注
截至2023年和2022年9月30日的9个月
9. 认股权证
公司于2018年发行认股权证以购买6,745股普通股及可转换债务融资,并附有赎回条款 规定持有人有权让本公司以相当于董事会或独立评估师厘定的股份公平市值的购买价格赎回全部或任何部分认股权证(或已转换为普通股的股份) 。 由于此项赎回条款,认股权证在基于ASC 480的财务报表中被分类为负债-区分负债与股权。这些认股权证的行使价为每股0.48美元,期限为10年。权证 在每个报告期按市价计价。截至2023年9月30日和2022年12月31日的公允价值分别为60,933美元和70,283美元。
该公司亦于2016及2019年发行认股权证,但该等认股权证不符合ASC 480分类为负债的标准,而是符合股权分类标准。2016年发行的11,466份权证于2023年6月首次公开发行时到期。
下表汇总了有关2023年9月30日未到期认股权证的信息:
| 未偿还认股权证 | 可行使认股权证 | |||||||||||||||||||||||||||
| 授予年份 | 演练 价格 | 2023年9月30日的认股权证数量 | 重量 平均剩余合同寿命 | 权重 平均行权价格 | 2023年9月30日的认股权证数量 | 加权 平均剩余合同期限 | 加权 平均行权价 | |||||||||||||||||||||
| 2018 | $ | 0.48 | 47,890 | 四年半 | $ | 0.48 | 47,890 | 四年半 | $ | 0.48 | ||||||||||||||||||
| 2019 | $ | 5.28 | 215,846 | 2.4年 | $ | 5.28 | 215,846 | 2.4年 | $ | 5.28 | ||||||||||||||||||
| 2023 | $ | 6.25 | 60,000 | 4.7年 | $ | 6.25 | 60,000 | 4.7年 | $ | 6.25 | ||||||||||||||||||
| 323,736 | $ | 4.75 | 323,736 | $ | 4.75 | |||||||||||||||||||||||
10. 股票期权
2023年3月,公司董事会和股东批准了2023年股票激励计划(“2023年计划”)。 2023年计划允许委员会以激励和非法定股票期权的形式授予多达200万股普通股, 限制性股票奖励、限制性股票单位和其他基于股票的奖励给员工、董事和非员工。截至2023年9月30日,根据2023年计划,已授予购买40,000股普通股的期权并已发行,根据该计划,可授予1,960,000股普通股。
2016年,公司制定了Azitra Inc.2016股票激励计划(以下简称计划),规定向公司员工、高级管理人员、董事、顾问和顾问授予股票期权和限制性股票。截至2023年9月30日,购买1,248,255股普通股的期权 已根据2016年计划授予并已发行,242,345股普通股 可根据该计划授予。
于截至2023年9月30日止九个月内,本公司授予购买40,000股普通股之购股权,而于截至2022年9月30日止九个月内,本公司并无根据本计划授予任何购股权。在截至2023年9月30日的九个月内,公司确认与发行服务型股票期权有关的股票薪酬支出116,661美元。在截至2022年9月30日的9个月内,公司确认了与发行基于服务的股票期权有关的股票薪酬支出155,138美元。截至2023年9月30日,有361,288美元的未摊销补偿费用将在剩余的授权期内摊销。截至2023年9月30日和2022年9月,共有13,120份绩效期权未平仓,公允价值为109,551美元。在截至2023年9月30日和2022年9月30日的9个月内,公司未确认绩效期权的任何补偿费用。根据SAB 107的规定,本公司确定了符合普通期权条件的期权,并采用简化方法 估计预期期权寿命。
| F-40 |
AZITRA,
Inc.
未经审计的简明合并财务报表附注
截至2023年和2022年9月30日的9个月
下表汇总了截至2023年9月30日未完成和可行使的期权的信息:
| 选项 未完成 | 可行使的期权 | |||||||||||||||||||||||||
| 演练 价格 | 2023年9月30日的选项数量 | 重量 平均剩余合同寿命 | 权重 平均行权价格 | 2023年9月30日的选项数量 | 加权 平均剩余合同期限 | 加权 平均行权价 | ||||||||||||||||||||
| $ | 0.48 | 246,137 | 2.3年 | $ | 0.48 | 246,137 | 2.3年 | $ | 0.48 | |||||||||||||||||
| $ | 0.93 | 202,040 | 2.3年 | $ | 0.93 | 201,593 | 2.3年 | $ | 0.93 | |||||||||||||||||
| $ | 1.70 | 800,078 | 7.5年 | $ | 1.70 | 547,151 | 7.3年 | $ | 1.70 | |||||||||||||||||
| $ | 2.07 | 40,000 | 9.9年 | $ | 2.07 | 1,667 | 9.9年 | $ | 2.07 | |||||||||||||||||
| 1,288,255 | 996,548 | |||||||||||||||||||||||||
截至2023年9月30日的9个月的股票期权活动总额摘要如下:
| 股票 | 加权 平均行权价 | |||||||
| 在2022年12月31日未偿还 | 1,290,325 | $ | 1.27 | |||||
| 授与 | 40,000 | 2.07 | ||||||
| 已锻炼 | - | - | ||||||
| 被没收 | (42,070 | ) | 0.87 | |||||
| 截至2023年9月30日的未偿还债务 | 1,288,255 | $ | 1.31 | |||||
截至2023年9月30日,2016年计划下可供未来授予的股票数量为242,345股,2023年计划下可供授予的股票数量为1,96万股。
11. 公允价值计量
下表汇总了公允价值层次中的公允价值和水平,其中公允价值计量属于按经常性基础计量的资产和负债,截至以下日期:
2023年9月30日
| 描述 | 级别 1 | 级别 2 | 第 3级 | 总计 | ||||||||||||
| 负债 | ||||||||||||||||
| 普通认股权证 | $ | - | $ | - | $ | 60,933 | $ | 60,933 | ||||||||
| 总计 | $ | - | $ | - | $ | 60,933 | $ | 60,933 | ||||||||
2022年12月31日
| 描述 | 级别 1 | 级别 2 | 第 3级 | 总计 | ||||||||||||
| 负债 | ||||||||||||||||
| 普通股 认股权证 | $ | - | $ | - | $ | 70,283 | $ | 70,283 | ||||||||
| 2022年可转换票据 | $ | - | $ | - | $ | 5,600,000 | $ | 5,600,000 | ||||||||
| 总计 | $ | - | $ | - | $ | 5,670,283 | $ | 5,670,283 | ||||||||
| F-41 |
AZITRA,
Inc.
未经审计的简明合并财务报表附注
截至2023年和2022年9月30日的9个月
下表呈列截至二零二三年九月三十日止期间按经常性基准计量的第三级工具的变动:
| 2022年12月31日的余额 | $ | 5,670,283 | ||
| 公允价值变动 权证 | (5,621 | ) | ||
| 变更 2022年可换股票据的公允价值 | 800,000 | |||
| 2023年3月31日的余额 | $ | 6,464,662 | ||
| 公允价值变动 权证 | 94,036 | |||
| 公允价值变动 2022年可换股票据 | 2,830,100 | |||
| 转换 2022年可换股票据 | (9,230,100 | ) | ||
| 2023年6月30日的余额 | $ | 158,698 | ||
| 变更 认股权证公平值 | (97,765 | ) | ||
| 2023年9月30日的余额 | $ | 60,933 |
于 2023年9月30日及2022年12月31日,本公司使用柏力克-舒尔斯期权定价 模型估计认股权证的公平值,假设如下:
| 2023年9月30日 | 2022年12月31日 | |||||||
| 基础普通股价值 | $ | 1.50 | $ | 12.09 | ||||
| 预期期限(年) | 4.54 | 5 | ||||||
| 预期波动率 | 93 | % | 86 | % | ||||
| 无风险利率 | 3 | % | 3 | % | ||||
| 股息率 | - | % | - | % | ||||
公司普通股公允价值的波动 是每年普通股认股权证负债估值变化的主要驱动因素 。随着普通股公允价值的增加,票据持有人的价值通常也会增加。
赎回前,各种输入数据的波动(包括企业价值、变现时间、波动性及贴现率 )为二零二二年可换股票据各报告期间估值变动的主要驱动因素。随着 企业价值的公允价值、估计变现时间、波动性及贴现率增加,二零二二年可换股 票据持有人的价值普遍增加。
12. 每股净亏损
基本 和稀释后每股净亏损计算如下:
截至2023年9月30日和2022年9月30日的9个月,每股基本净亏损和稀释后净亏损的分子如下:
| 截至9个月 个月 | ||||||||
| 2023 | 2022 | |||||||
| 净亏损 | $ | (8,829,996 | ) | $ | (6,633,790 | ) | ||
| 优先股股息 | (1,355,347 | ) | (2,076,737 | ) | ||||
| 普通股股东应占净亏损 | $ | (10,185,343 | ) | $ | (8,710,527 | ) | ||
| F-42 |
AZITRA,
Inc.
未经审计的简明合并财务报表附注
截至二零二三年及二零二二年九月三十日止九个月
截至2023年9月30日和2022年9月30日的9个月的分母如下:
| 截至9个月 个月 | ||||||||
| 2023 | 2022 | |||||||
| 加权平均已发行普通股, 基本和摊薄 | 5,173,925 | 1,043,913 | ||||||
| $0.01认股权证 | 7,182 | 11,467 | ||||||
| 总计 | 5,181,107 | 1,055,380 | ||||||
截至2023年9月30日和2022年9月30日的9个月,每股基本亏损和稀释后每股净亏损如下:
| 截至9个月 个月 | ||||||||
| 2023 | 2022 | |||||||
| 每股基本和稀释后净亏损 | $ | (1.97 | ) | $ | (8.25 | ) | ||
下列潜在普通股等价物是根据每个期末的未偿还金额列示的,不计入所示期间的稀释后每股净亏损计算 ,因为计入这些等价物会产生反摊薄效果:
| 9月30日 | ||||||||
| 2023 | 2022 | |||||||
| 购买普通股的期权 | 1,288,255 | 1,290,318 | ||||||
| 未清偿认股权证 | 323,736 | 11,467 | ||||||
| 总计 | 1,611,991 | 1,301,785 | ||||||
13. 承诺和或有事项
法律
该公司在正常业务过程中受到法律程序或索赔的约束。虽然偶尔会出现不利的决定或和解,但本公司相信该等事宜的最终处置不应对其财务状况、经营业绩或流动资金造成重大不利影响。
许可证 协议
自2022年1月26日起,本公司与无关第三方订立独家许可协议(许可协议)。根据许可协议,本公司被授予某些专利的独家许可和某些专有技术的非独家许可。 许可协议持续到最后一个许可专利到期或第一个许可治疗或非治疗产品商业销售 后十年。公司可通过向第三方提供至少30天的书面通知,随时终止许可协议。如果违反协议规定的重大义务或破产,许可协议也将终止。许可协议终止后,任何一方均不得解除终止前产生的义务 。
在截至2023年9月30日和2022年9月30日的九个月内,公司将根据本许可协议支付的款项分别资本化为0美元和15,263美元。在截至2023年9月30日的9个月内,本公司支出了资本化余额的剩余部分。
| F-43 |
AZITRA,
Inc.
未经审计的简明合并财务报表附注
截至2023年和2022年9月30日的9个月
运营 租约
该公司在康涅狄格州布兰福德、康涅狄格州格罗顿和魁北克省拉瓦尔租用办公和实验室空间。本公司的租约将于 至2027年5月31日的不同日期到期。大多数租约都是固定期限和固定金额的。本公司不参与任何基于任何指数或费率增加租金条款、升级条款、资本改善资金或付款增加的租约。
在 2020年期间,公司就公司位于康涅狄格州布兰福德的主要办公和实验室空间签订了新的租赁协议。Branford租约需要在租约的第一年每月支付13,033美元,在接下来的几年中每年增加约2%。Branford租约还要求该公司按比例支付公共区域维护费用。
2021年5月,公司与康涅狄格州格罗顿的办公室和实验室签订了新租约。格罗顿的租赁需要每月支付4,234美元,在租赁额外空间后,这一数字在2021年9月增加到6,824美元。Groton的租期最初为一年 ,最多可续订三年。
未来 在接下来的 五年中,每年初始或剩余期限超过一年的不可取消经营租赁的最低付款如下:
| 2023 | $ | 81,354 | ||
| 2024 | 337,708 | |||
| 2025 | 278,928 | |||
| 2026 | 205,877 | |||
| 2027 | 73,725 | |||
| 此后 | - | |||
| 未来未贴现的租赁付款总额 | 977,592 | |||
| 更少的兴趣 | (62,597 | ) | ||
| 最低租赁付款现值 | $ | 914,995 |
截至2023年9月30日的9个月,所有运营租赁的租金 费用为254,142美元。所有营运租约的加权平均租期为3.2年。所有经营租赁的加权平均贴现率为4.25%。
融资 租赁
在 2023年间,公司与惠普公司签订了设备租赁协议。租赁需要每月支付1,478美元,包括 税。租期为3年,租期结束时可选择购买或延期。剩余租期为2.8年,折扣率为9.60%。
下面的时间表显示了融资租赁项下未来的最低租赁付款年数以及截至2023年9月30日的最低付款金额的现值。截至2023年9月30日的最低还款额。
| 2023 | $ | 4,435 | ||
| 2024 | 17,740 | |||
| 2025 | 17,740 | |||
| 2026 | 10,349 | |||
| 此后 | - | |||
| 未来未贴现的租赁付款总额 | 50,264 | |||
| 更少的兴趣 | (6,058 | ) | ||
| 最低租赁付款现值 | $ | 44,206 |
截至2023年9月30日的九个月,融资租赁的租赁费用为2,580美元。截至2023年9月30日的9个月,融资租赁的利息支出为710美元。
| F-44 |
AZITRA,
Inc.
未经审计的简明合并财务报表附注
截至二零二三年及二零二二年九月三十日止九个月
14. 退休计划
自2019年1月1日起,公司发起了一项涵盖几乎所有员工的401(K)计划。要有资格参加, 员工必须完成连续两个月的服务,并在服务的第一年内至少工作250小时或1,000小时。员工可以在满足计划资格要求后进行税前延期。从2020年1月1日起,该计划过渡到安全港计划,其中高薪员工没有资格获得匹配缴费 ,非高薪员工在前3%的缴费和随后的2%的缴费上获得100%的匹配和50%的匹配。截至2023年9月30日的9个月,雇主匹配的总供款为7634美元。截至2022年9月30日的9个月,雇主配对供款总额为18,945美元。
15. 信用风险集中
可能使公司面临信用风险的金融工具主要包括现金和应收账款。
在截至2023年9月30日和2022年9月30日的9个月中,所有服务收入均来自一个客户。截至2023年9月30日的9个月,没有赠款收入,而截至2022年9月30日的9个月,所有赠款收入来自一个授权人。
资产负债表中确定的现金余额存放在金融机构的账户中,由联邦存款保险公司(FDIC)承保,最高可达250,000美元。有时,存放在银行的现金可能会超过FDIC的限额。
16. 关联方
截至2023年9月30日的9个月,关联方总收入为596,000美元。截至2022年9月30日的9个月,关联方总收入为253,500美元。于2023年9月30日及2022年12月31日,应收关联方应收账款分别为0美元及175,000美元。截至2023年9月30日和2022年12月31日,关联方的合同负债分别为0美元和156,000美元 。
本公司于2022年9月订立总额为4,350,000美元的可转换本票,其中4,000,000美元归属于同时亦为本公司A系列、A-1及B系列优先股融资投资者的 实体(见附注7)。该实体在转换本票本金和利息4,243,726美元时收到了1,697,490股普通股。
17. 后续事件
公司评估了资产负债表日期之后至2023年11月14日的事件,也就是这些简明财务报表的发布日期 。
| F-45 |
最多 300万股普通股
最多 300,000,000份预筹资金认股权证,购买最多3,000,000股普通股

初步招股说明书
ThinkEquity
, 2024
| II-1 |
第(Br)II部分-招股章程中不需要的信息
第 项13.发行和发行的其他费用。
下表列出了与本公司在此登记的普通股的销售和分销相关的各种费用,所有费用将由我们承担(任何承销折扣和佣金以及经纪费用、会计、税务或法律服务或出售股份所产生的任何其他费用除外)。除美国证券交易委员会注册费和FINRA备案费外,所有金额均为估计值。
| 描述 | 金额 | |||
| 美国证券交易委员会 注册费 | $ | 1,097 | ||
| FINRA申请费 | 2,750 | |||
| 不向承保人交代费用 | 150,000 | |||
| 打印费 | 25,000 | |||
| 费用和支出会计 | 50,000 | |||
| 法律费用 及开支 | 250,000 | |||
| 转移代理人和注册官的费用和开支 | 5,000 | |||
| 杂费 | 16,153 | |||
| 总计 | $ | 500,000 | ||
*由修正案提供。
第 项14.对董事和高级职员的赔偿
以下摘要通过参考下文提及的任何法规的完整文本和特拉华州公司Azitra,Inc.的第二次修订的 和重新签署的公司注册证书或公司注册证书,对全文进行了限定。
特拉华州一般公司法(“DGCL”)第145节允许特拉华州公司赔偿任何 个人是或是任何受威胁、待决或已完成的诉讼、诉讼或法律程序的一方, 无论是民事、刑事、行政还是调查(由公司提起或根据公司权利提起的诉讼除外),原因是 该人是或曾经是该公司的董事、高级职员、雇员或代理人,或正应该公司的请求作为董事高级职员、高级职员、另一家公司、合伙企业、合资企业、信托公司或其他企业的雇员或代理人,如果该人本着善意行事,并以合理地 相信符合或不反对公司最大利益的方式行事,且就任何刑事诉讼或法律程序而言, 没有合理理由相信该人的行为是非法的,则该人就该诉讼、诉讼或法律程序实际和合理地支付的费用(包括律师费)、判决、罚款和为达成和解而支付的金额。
在由公司提起诉讼或根据公司的权利提起诉讼的情况下,《特拉华州公司条例》第145条允许特拉华州公司赔偿因 该人是或曾经是该公司的董事、高级职员、雇员或代理人,或应该公司的请求而作为另一公司、合伙企业、合资企业、信托或其他企业的董事、高级职员、雇员或代理人而成为任何受威胁、待决或已完成的诉讼或诉讼的一方或被威胁成为其中一方的任何人, 如果该人本着善意行事,并以合理地相信符合或不反对公司最大利益的方式行事,则该人在与该诉讼、诉讼或法律程序有关的实际和合理地招致的费用(包括律师费)中不得获得赔偿,但不得就该人被判决对该公司负有法律责任的任何索赔、问题或事项作出赔偿,除非且仅限于衡平法院或提起该诉讼或诉讼的法院应应申请作出裁定的范围:尽管判决了责任,但考虑到案件的所有情况,该人公平和合理地有权获得赔偿,以支付衡平法院或其他法院 认为适当的费用。
| II-2 |
《特拉华州公司条例》第145节还允许特拉华州公司代表任何人购买和维护保险,该人是或曾经是公司的董事人员、雇员或代理人,或应公司的请求,作为另一公司、合伙企业、合资企业、信托公司或其他企业的董事人员、职员、雇员或代理人,为针对该人而声称的、由该人以任何上述身份招致的或因该人的身份而产生的任何责任购买和维护保险。公司 是否有权根据DGCL第145条对该人的此类责任进行赔偿。
我们的公司注册证书规定,在DGCL允许的最大范围内,我们的董事不对我们或我们的股东因违反董事受托责任而造成的金钱损害承担个人责任。如果DGCL在本修订日期后 授权公司采取行动,进一步免除或限制董事的个人责任,则我们董事的责任将被取消或限制到DGCL允许的最大限度内。
我们的公司注册证书要求我们在适用法律允许的最大范围内为我们的董事和高级管理人员提供赔偿(和垫付费用),并授权我们在适用法律允许的最大限度内通过章程条款、与该等董事、高级管理人员、员工、代理或其他人员的协议、股东投票或无利害关系的董事或其他方式向其他员工和代理人(以及DGCL允许我们向其提供赔偿的任何其他人) 提供赔偿(和垫付费用) 。仅限于DGCL就违反对我们公司、我们的股东和其他人的责任的行为制定的限制。
我们的公司注册证书规定,我们将在DGCL允许的最大范围内,以DGCL允许的方式,赔偿我们的每位董事、高级管理人员和根据DGCL第145条我们有权赔偿的所有其他人,包括与任何诉讼有关的实际和合理产生的费用(包括律师费)、判决、罚款、和解和其他金额, 此人是或曾经是本公司的董事会员。我们可以自费维持保险,以保护公司和我们的任何董事、高级管理人员、员工或代理人免受任何此类费用、责任或损失,无论我们是否 有权赔偿此等人士。
我们 已与我们的每位董事和执行官签订了可能比DGCL中包含的具体 赔偿条款更广泛的赔偿协议。这些赔偿协议要求我们(除其他事项外)对我们的董事 和执行官因其地位或服务而可能产生的责任进行赔偿。这些赔偿协议还 要求我们预付董事和执行官在调查或辩护任何此类诉讼、起诉、 或程序时发生的所有费用。我们认为,这些协议对于吸引和留住合格的个人担任董事和执行 官是必要的。
在本次发行结束前,我们计划签订一份承销协议,规定承销商在某些情况下有义务赔偿我们的董事、高级管理人员和控制人的特定责任。
第 项15.近期出售的未登记证券。
发行股本
以下列表列出了我们在招股说明书日期 之前三年内出售的所有未注册证券的信息,招股说明书是本注册声明的一部分。
2022年1月,我们向一位投资者出售了本金为1,000,000美元的无担保可转换本票。2023年1月,票据的本金连同所有应计利息被转换为我们B系列可转换优先股的23,432股 。随后,这些股票在IPO完成后转换为普通股。
2022年9月,我们向五名投资者配售了本金总额为435万美元的无担保可转换本票。票据本金连同所有应计及未付利息于首次公开招股完成后转换为1,846,020股本公司普通股。
| II-3 |
上述证券发行并无任何承销商参与。我们认为,根据证券法第4(A)(2)节和规则506,我们对上述证券的要约、销售和发行 作为不涉及公开募股的交易而免于根据证券法注册。所有投资者都是《证券法》规则501中定义的合格投资者。每项交易中证券的接受方均表示其收购证券的意向仅用于投资,而不是为了出售或与其任何分销相关的目的,并在这些交易中发行的股票、票据和认股权证上添加了适当的图例。所有收件人都可以通过他们与我们的关系 获得有关我们公司的信息。这些证券的出售是在没有任何一般招揽或广告的情况下进行的。
项目 16.证物和财务报表附表。
| (a) | 展品。 |
| 附件 编号: | 文档说明 | 备案方式 | ||
| 1.1 | 承销协议书表格 。 | 通过修改提交。 | ||
| 3.1 | 第二份注册人注册证书的修改和重新注册。 | 通过引用附件3.1将其并入本公司于2023年6月21日提交的当前8-K表格报告(文件编号001-41705)中。 | ||
| 3.2 | 第二次 修订和重新制定注册人章程。 | 通过引用附件3.2将其并入本公司于2023年6月21日提交的当前8-K表格报告(文件编号001-41705)中。 | ||
| 4.1 | 样本 代表普通股的证书。 | 在此引用本公司于2023年6月13日提交的S-1表格(文件编号333-269876)的附件4.1。 | ||
| 4.2 | 发给私募投资者的认股权证表格 。 | 通过引用本公司于2023年6月13日提交的S-1表格(文件编号333-269876)的附件4.2将其并入本文。 | ||
| 4.3 | 2023年6月20日签发给ThinkEquity LLC的代表认股权证表格 。 | 在此引用本公司于2023年6月13日提交的S-1表格(文件编号333-269876)的附件4.3。 | ||
| 4.4 | 预筹普通股认购权证的形式 | 在此以电子方式提交。 | ||
| 5.1 | Greenberg Traurig,LLP对普通股的意见。 | 通过修改提交。 | ||
| 5.2 | Greenberg Traurig,LLP对预筹资权证的意见。 | 须以修订方式提交。 | ||
| 10.1+ | Azitra, Inc.2016股票激励计划。 | 在此引用附件10.2将其并入本公司于2023年6月13日提交的S-1表格(档案号333-269876)。 | ||
| 10.2+ | 阿齐特拉, Inc.2023年股票激励计划。 | 在此引用本公司于2023年6月13日提交的S-1表格(文件编号333-269876)的附件10.5。 | ||
| 10.3+ | 注册人与Francisco D.Salva之间于2021年4月22日签订的执行雇佣协议。 | 于此引用附件10.4于本公司于2023年6月13日提交的S-1表格(档案号:333-269876)。 |
| II-4 |
| 10.4+ | 注册人和特拉维斯·惠特菲尔于2023年7月5日达成的高管雇佣协议。 | 在此以电子方式提交。 | ||
| 10.5+ | 注册人与其每一位董事和高级管理人员之间的赔偿协议表格。 | 在此引用附件10.1并入本公司于2023年6月13日提交的S-1表格(档案号333-269876)。 | ||
| 10.6 | 第二份 于2020年9月10日修订并重新签署的注册人与其中所列每名投资者之间的投资者权利协议 。 | 于此引用附件10.3于本公司于2023年6月13日提交的S-1表格(档案号:333-269876)。 | ||
| 21.1 | 注册人子公司列表 。 | 通过引用本公司于2023年6月13日提交的S-1表格(文件编号333-269876)的附件21.1将其并入本文。 | ||
| 23.1 | Greenberg Traurig,LLP同意(见附件5.1和5.2)。 | 通过修改提交。 | ||
| 23.2 | 独立注册会计师事务所Grassi&Co.,CPAS,P.C.的同意。 | 在此以电子方式提交。 | ||
| 24.1 | 授权书。 | 在注册声明的签名页上包含 。 | ||
| 107 | 备案费表。 | 在此以电子方式提交。 |
+ 表示管理层补偿计划、合同或安排。
(B)财务报表附表。
已省略所有 计划,因为它们不是必需的或不适用。
第 项17.承诺
以下签署的登记人承诺在承销协议规定的截止日期向承销商提供按承销商要求的面额和名称登记的证书 ,以允许迅速交付给每一购买者。
由于根据《1933年证券法》产生的责任的赔偿可能根据前述条款允许注册人的董事、高级职员和控制人 进行,因此注册人已被告知,证券和交易委员会认为这种赔偿违反证券法中明示的公共政策,因此不能强制执行。 如果针对此类责任提出的赔偿要求(注册人为成功抗辩任何诉讼而招致的或由登记人的董事、高级职员或控制人支付的费用除外),如果该董事、高级职员或控制人就正在登记的证券提出索赔(br},除非注册人的律师认为此事已通过控制先例解决,否则注册人将向具有适当管辖权的法院提交 该赔偿是否违反《证券法》所表达的公共政策,并将受该发行的最终裁决所管辖。
以下签署的注册人承诺:
(1) 为了确定证券法项下的任何责任,在根据规则430A作为本注册说明书的一部分提交的招股说明书中遗漏的信息,以及注册人根据证券法根据规则 424(B)(1)或(4)或497(H)提交的招股说明书中包含的信息,应被视为本注册说明书的一部分,自其宣布生效之时起 。
(2) 为了确定《证券法》规定的任何责任,每次生效后包含招股说明书形式的修正案应被视为与其中所提供的证券有关的新的登记声明,而届时发售此类证券应被视为其首次善意发售。
| II-5 |
签名
根据《1933年证券法》的要求,注册人已于2024年1月19日在康涅狄格州布兰福德市正式授权以下签署人代表注册人签署本注册声明。
| AZITRA, Inc. | |
/S/ 弗朗西斯科·D·萨尔瓦 | |
| 弗朗西斯科·D·萨尔瓦 | |
| 首席执行官兼董事 |
授权书
以下签名的每个人构成并任命其真实合法的事实代理和代理人Francisco D.Salva,具有完全的替代和再替代权力,以任何和所有身份,以他的名义、地点和替代身份,签署对本注册声明、任何后续注册声明的任何和所有修订(包括生效后的修订),并将其连同所有证物和其他相关文件提交给美国证券交易委员会。授予上述实际受权人和代理人完全的权力和权限,以进行和执行 在建筑物内和周围进行的每一项必要和必要的行为和事情,尽他本人可能或可以亲自进行的所有意图和目的,在此批准和确认上述事实受权人和代理人,或其替代者, 可凭借本条例合法地进行或导致进行的所有行为和事情。本委托书可以副本执行。
根据《1933年证券法》的要求,本注册声明已由下列人员在指定日期以 身份签署。
签名 |
标题 |
日期 | ||
/S/Francisco D. Salva |
总裁, | |||
|
弗朗西斯科·D·萨尔瓦 |
首席执行官兼董事 (首席执行官 ) |
2024年1月19日 | ||
/S/ 诺曼·斯塔斯基 |
首席财务官, | |||
|
诺曼·斯塔斯基 |
财务主管和秘书 (首席财务会计官 ) |
2024年1月19日 | ||
/S/ 特拉维斯·惠特菲尔 |
||||
|
特拉维斯 惠特菲尔 |
首席运营官兼董事 | 2024年1月19日 | ||
/S/ 安德鲁·麦克拉利 |
||||
|
安德鲁·麦克拉利 |
董事 | 2024年1月19日 | ||
/S/ 芭芭拉·瑞安 |
||||
|
芭芭拉 瑞安 |
董事 | 2024年1月19日 | ||
S/ 约翰·施罗尔 |
||||
|
约翰·施罗尔 |
董事 | 2024年1月19日 |