

打造一家专注于 ADC 的领先公司纳斯达克:PYXS 2024 年 3 月附录 99.2

前瞻性陈述本演示文稿包含前瞻性陈述,涉及1995年《私人证券诉讼改革法》和其他联邦证券法中的安全港条款。这些陈述通常使用诸如 “预期”、“相信”、“可以”、“继续”、“可以”、“估计”、“期望”、“打算”、“可能”、“可能”、“目标”、“持续”、“计划”、“潜在”、“预测”、“项目”、“应该”、“将来”、“将”、“将”、“将来”、“将来”、“将”、“将”、“将来”、“将来”、“将来”、“将来”、“将来”、“将来”、“将来”、“将来”、“将来”、“将”、“将”、“将”、“将”、“将”、“将”、“将”,” 或这些词的否定或复数,或类似的表达方式或变体,尽管并非所有前瞻性陈述都包含这些词语。我们无法向您保证,前瞻性陈述中反映的事件和情况将会实现或发生,实际结果可能与这些前瞻性陈述所表达或暗示的结果存在重大差异。可能导致或促成此类差异的因素包括但不限于此处确定的因素,以及公司于2024年3月21日向美国证券交易委员会提交的10-K表年度报告第二部分第1A项中标题为 “风险因素” 的部分中讨论的因素,以及我们的其他文件,每份文件均已向美国证券交易委员会存档。这些风险并非穷尽无遗。新的风险因素不时出现,我们的管理层无法预测所有风险因素,也无法评估所有因素对我们业务的影响,也无法评估任何因素或因素组合在多大程度上可能导致实际业绩与任何前瞻性陈述中包含的结果存在重大差异。此外,“我们相信” 的陈述和类似的陈述反映了我们对相关主题的信念和观点。这些声明基于截至本文发布之日我们获得的信息,尽管我们认为此类信息构成了此类陈述的合理依据,但此类信息可能有限或不完整,不应将我们的陈述理解为表明我们已对所有可能可用的相关信息进行了详尽的调查或审查。这些陈述本质上是不确定的,提醒投资者不要过分依赖这些陈述。除非法律要求,否则我们没有义务更新任何前瞻性陈述以反映此类陈述发布之日之后的事件或情况。我们在竞争激烈且瞬息万变的环境中运营。新的风险不时出现,我们的管理层无法预测所有风险,也无法评估所有因素对我们业务的影响,也无法评估任何因素或因素组合在多大程度上可能导致实际业绩与我们可能做出的任何前瞻性陈述中包含的结果存在重大差异。鉴于这些风险、不确定性和假设,本演示文稿中描述的前瞻性事件和情况可能不会发生,实际结果可能与本演示文稿中包含的前瞻性陈述中的预期或暗示的结果存在重大和不利的差异。市场和行业数据本演示文稿包含有关我们的行业、业务和候选产品市场的估计、预测和其他信息。这些信息基于估计、预测、预测、市场研究或类似方法,本质上受不确定性、假设和局限性的影响,实际事件或情况可能与本信息中假设的事件和情况存在重大差异。除非另有明确说明,否则我们从自己的内部估计和研究,以及市场研究公司和其他第三方、行业、医学和一般出版物、政府数据和类似来源编制的报告、研究调查、研究和类似数据中获得的行业、业务、市场和其他数据。尽管我们没有发现本演示文稿中对任何第三方信息有任何错误陈述,但他们的估计,特别是与预测相关的估计,涉及许多假设和局限性,受风险和不确定性的影响,并可能发生变化。我们尚未独立验证任何第三方信息。提醒你不要过分重视任何此类信息、预测和估计。商标本演示文稿包含对属于其他实体的商标和服务标志的引用。仅为方便起见,本演示文稿中提及的商标和商品名称可能不带有® 或符号,但此类提及的目的不在于以任何方式表明适用的许可方不会在适用法律的最大范围内主张其对这些商标和商品名称的权利。我们无意使用或展示其他公司的商品名称、商标或服务标志,以暗示与任何其他公司的关系,或对我们的认可或赞助。
PYXS:打造下一家专注于ADC的领先公司,在I/O上投注机会主义,经验丰富的团队,在制药和生物技术临床阶段的投资组合中均有良好的往绩,2024年数据催化剂强劲的资产负债表和1.73亿美元的现金为进入2026年下半年提供了机会

Lara Sullivan,医学博士首席执行官杨晓东,医学博士,杰出研究员 Jan Pinkas,博士首席科学官 Pam Connealy,工商管理硕士首席财务官兼首席运营官 Balu Balasubramanian,博士首席技术官执行领导团队 PYXS 团队成员共同为超过 60 项肿瘤药物批准做出了贡献 Ken Kobayashi,医学博士,FACP 首席营销官
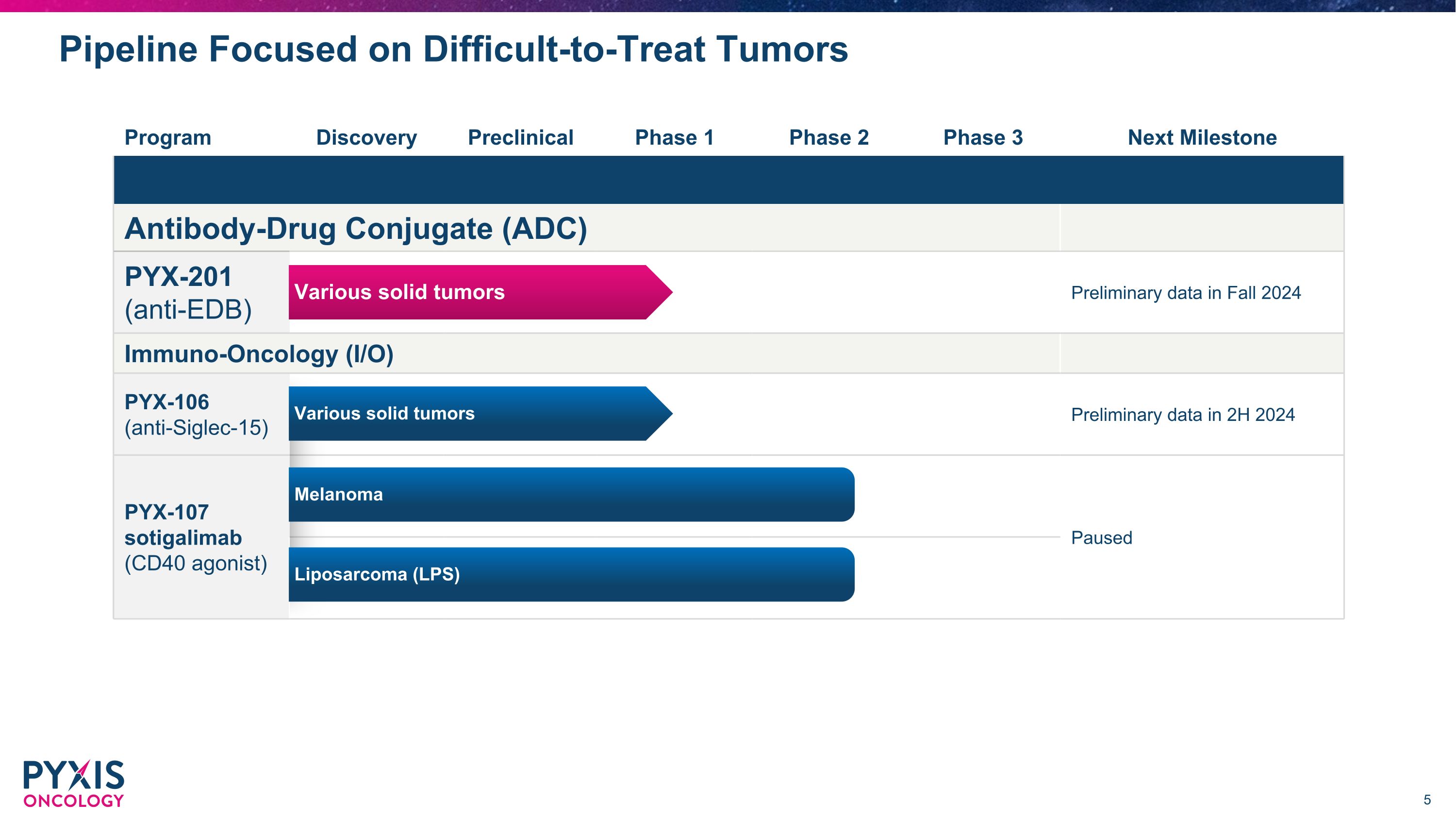
研发管道专注于难以治疗的肿瘤项目发现临床前 1 期 2 期 3 期下一个里程碑抗体药物偶联物 (ADC) PYX-201(抗 EDB)2024 年秋季的初步数据免疫肿瘤学(I/O)PYX-106(抗 SIGLEC-15)2024 年下半年的初步数据 PYX-107 索替利单抗(CD40 激动剂)暂停脂肪肉瘤(LPS)各种实体瘤黑色素瘤各种实体瘤
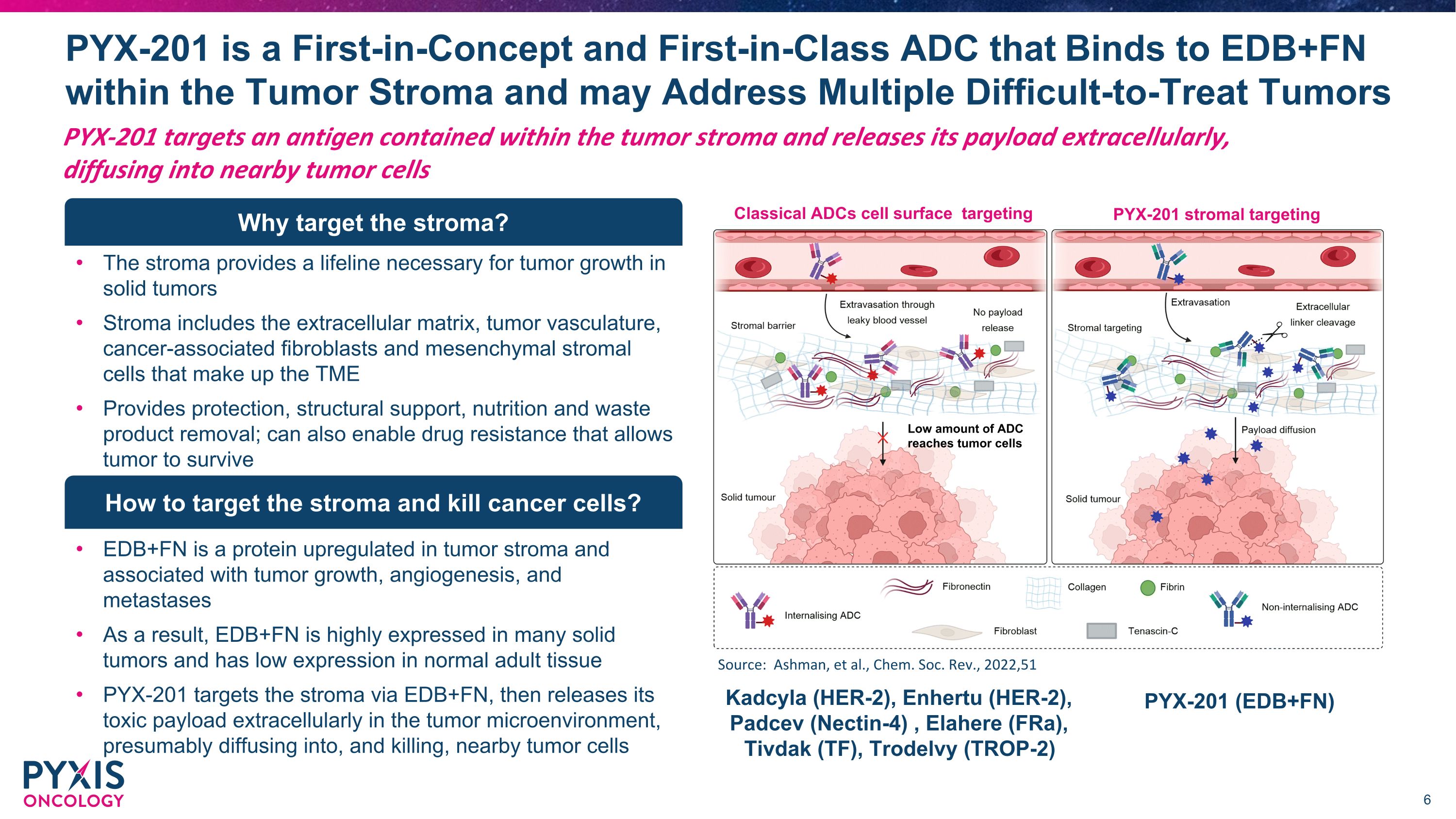
PYX-201 靶向肿瘤基质中含有的抗原并通过细胞外释放其有效载荷,扩散到附近的肿瘤细胞中 PYX-201 是概念上首创的同类首创的 ADC,可与肿瘤基质内的 EDB+FN 结合,可以解决多种难以治疗的肿瘤。该基质为实体瘤的肿瘤生长提供了必要的生命线 Stroma 包括细胞外基质、肿瘤血管、癌症相关成纤维细胞和构成 TME 的间充质基质细胞提供保护、结构支持、营养和废弃物去除;还可以启用耐药性,使肿瘤得以存活为什么要靶向基质?EDB+FN 是一种在肿瘤基质中上调的蛋白质,与肿瘤生长、血管生成和转移有关。因此,EDB+FN 在许多实体瘤中高度表达,在正常成体组织中的表达较低 PYX-201 通过 EDB+FN 靶向基质,然后在肿瘤微环境中细胞外释放其毒性载荷,可能扩散到附近的肿瘤细胞中并杀死该肿瘤细胞。如何靶向基质然后杀死癌细胞?靶向 PYX-201 基质靶向的经典 ADC 细胞表面少量的 ADC 到达肿瘤细胞来源:Ashman 等人,Chem。Soc。Rev.,2022,51 Kadcyla (HER-2)、Enhertu (HER-2)、Padcev (Nectin-4)、Elahere (fRA)、Tivdak (TF)、Trodelvy (TROP-2) PYX-201 (EDB+FN)

肿瘤基质为ADC模式提供了一个令人兴奋的机会许多细胞内发现的蛋白酶也存在于细胞外,并参与包括癌症在内的疾病病理学* 肿瘤微环境(TME)呈酸性(即,pH值介于6.4至7.0之间),正常生理pH值为7.4**,在酸性TME中可以减弱免疫反应酸性。TME 已被用来开发具有肿瘤选择性 pH 依赖性抗原结合的治疗性抗体*** *Yadati,Cells (9) 2020:1679-1705;** Boedtkjer,annrevPhys(82) 2020:103-126;*** Chang,PNAS (118) 2021:1-10 肿瘤中的酸性环境和细胞外蛋白酶导致 TME 中的 PYX-201 释放 AUR-0101(奥瑞他汀微管抑制剂)有效载荷
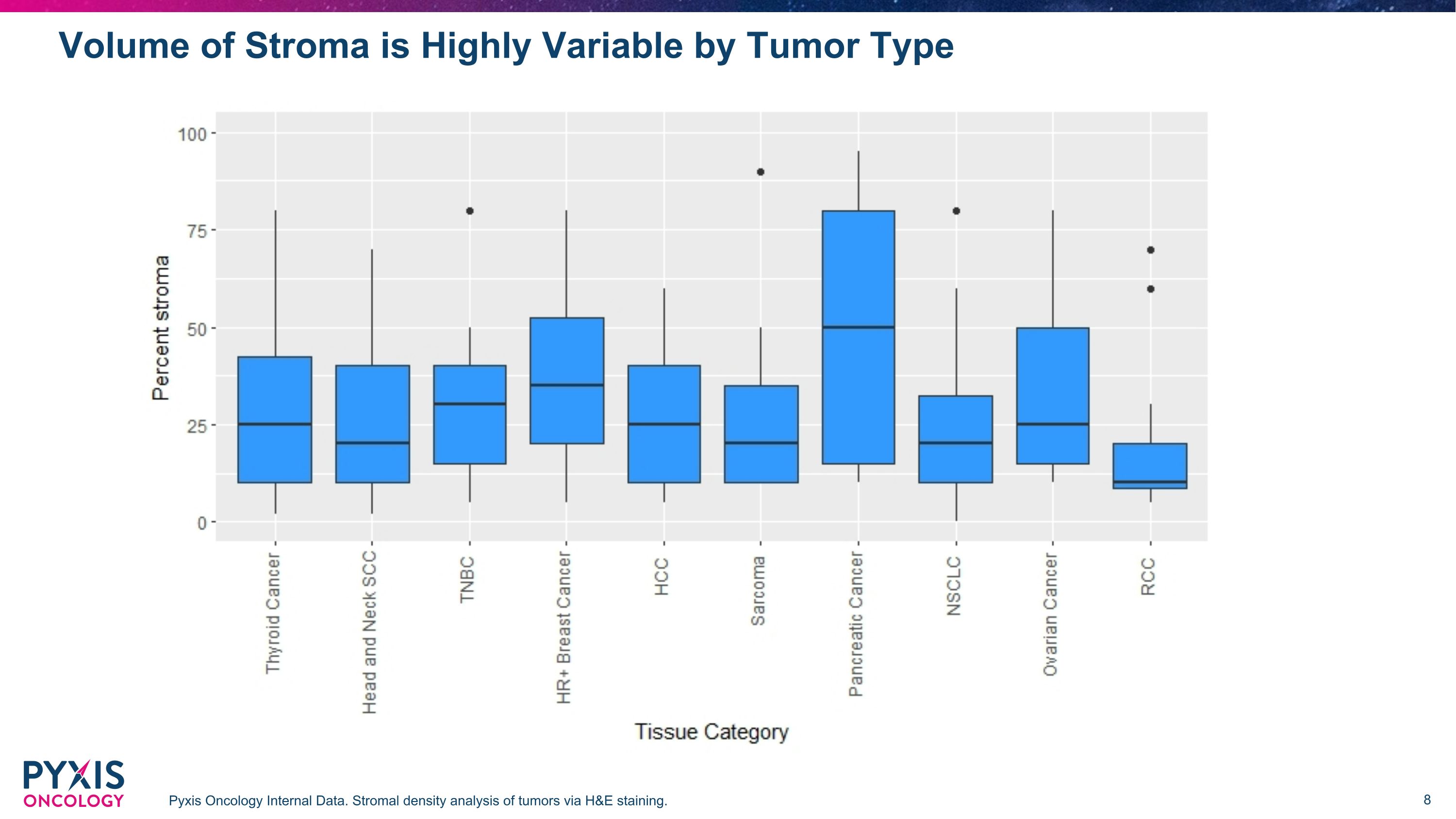
根据肿瘤类型 Pyxis 肿瘤学内部数据,间质体积变化很大。通过 H&E 染色对肿瘤进行基质密度分析。
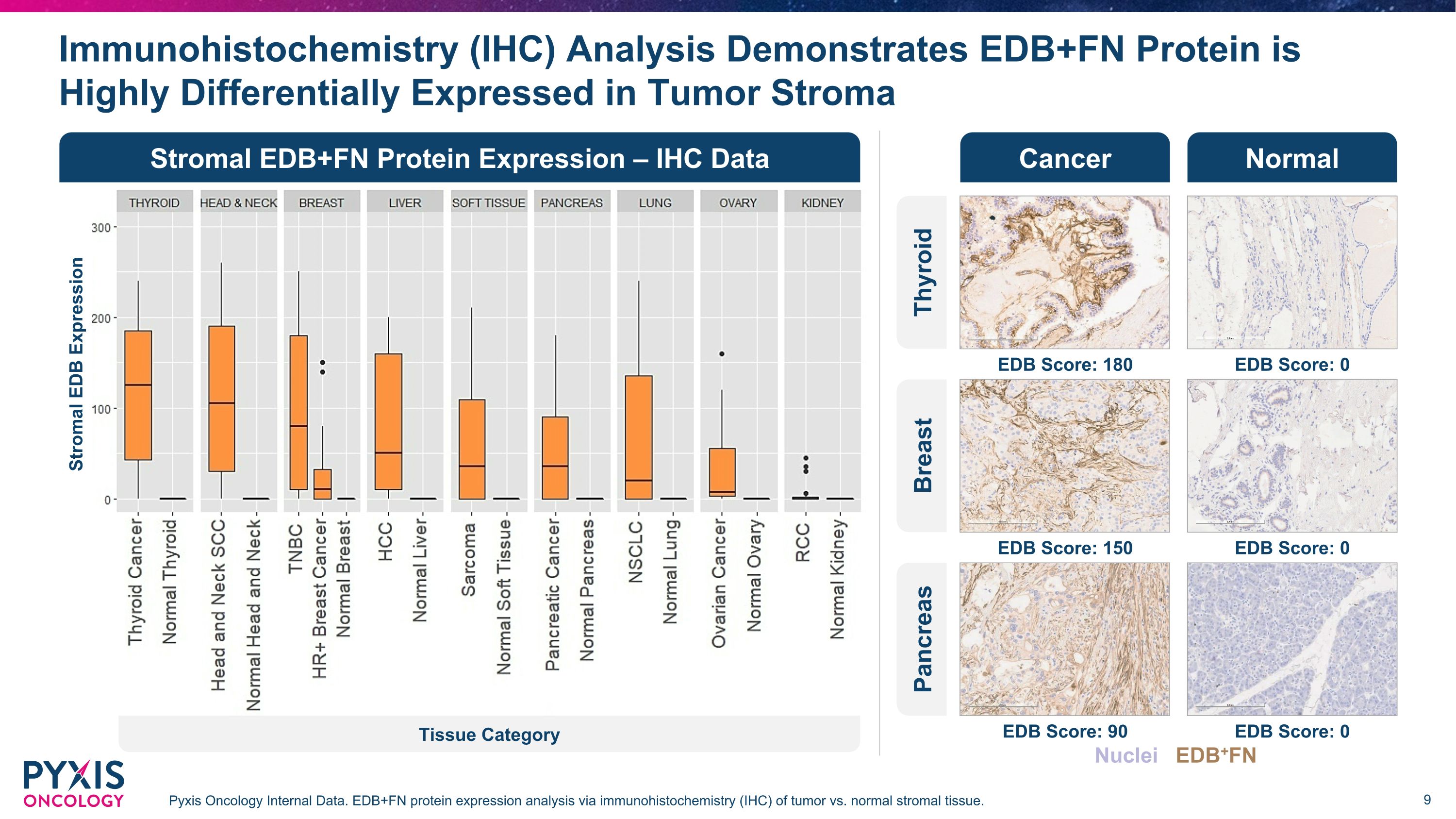
免疫组织化学(IHC)分析表明,EDB+FN蛋白在肿瘤基质Pyxis肿瘤学内部数据中具有高度差异的表达。通过免疫组织化学(IHC)对肿瘤与正常基质组织进行EDB+FN蛋白表达分析。基质 EDB+FN 蛋白表达 — IHC 数据正常癌症甲状腺 EDB 分数:180 EDB 分数:0 乳房 EDB 分数:150 EDB 分数:0 胰腺 EDB 分数:90 EDB 分数:0 间质 EDB 表达组织类别核 EDB+FN
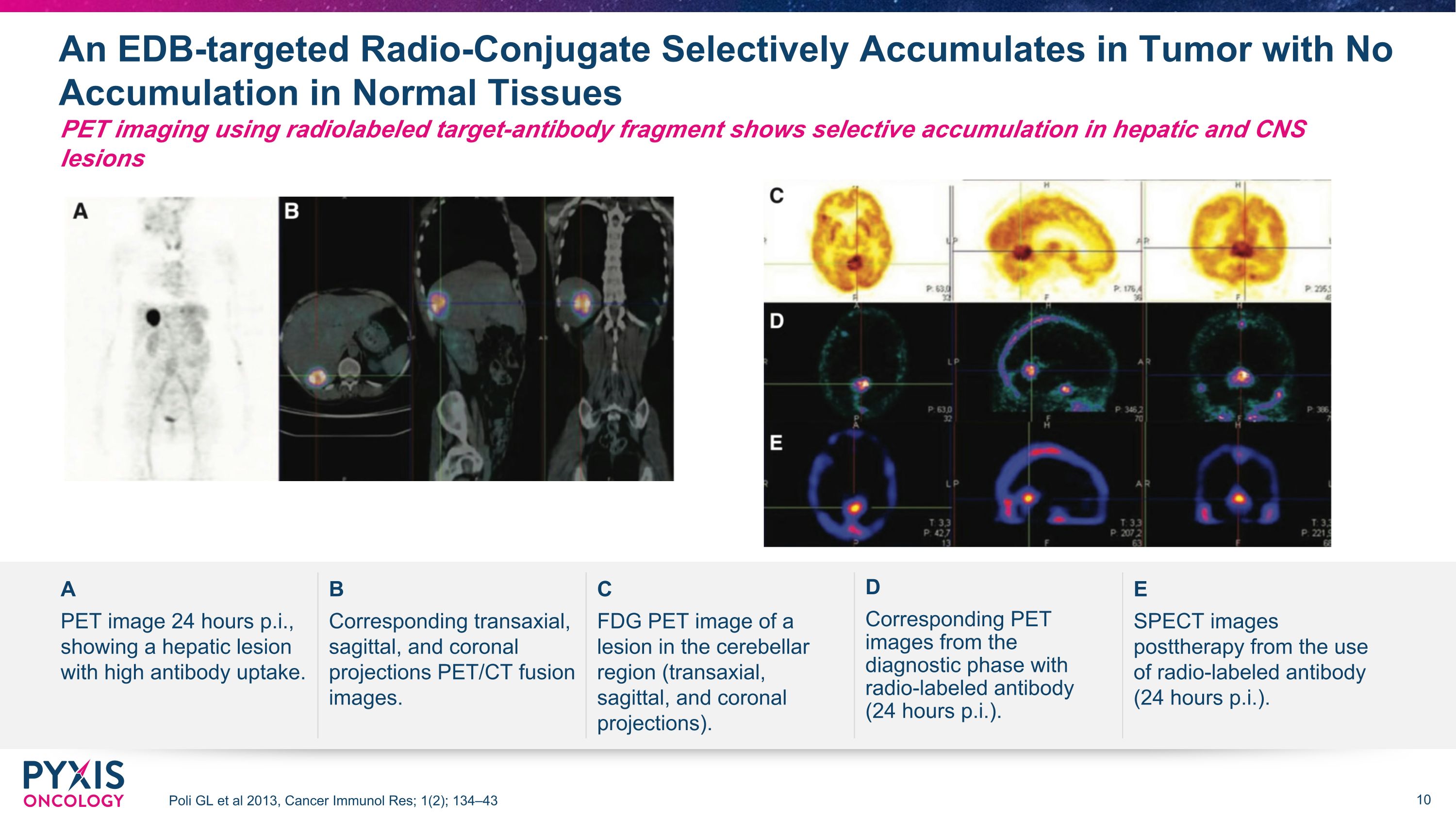
EDB 靶向放射性偶联物选择性地在肿瘤中累积,不会在正常组织中积累 Poli GL 等人 2013,《癌症免疫研究》;1(2);使用放射标记靶抗体片段的 134—43 PET 成像显示肝脏和中枢神经系统病变 A B C D E PET 图像的选择性积累,抗体吸收率高。相应的经轴、矢状和日冕投影 PET/CT 融合图像。小脑区域病变(经轴、矢状和冠状突起)的 FDG PET 图像。使用放射标记抗体的诊断阶段对应的PET图像(每隔24小时)。SPECT 在治疗后使用放射标记的抗体拍摄图像(每周 24 小时)。
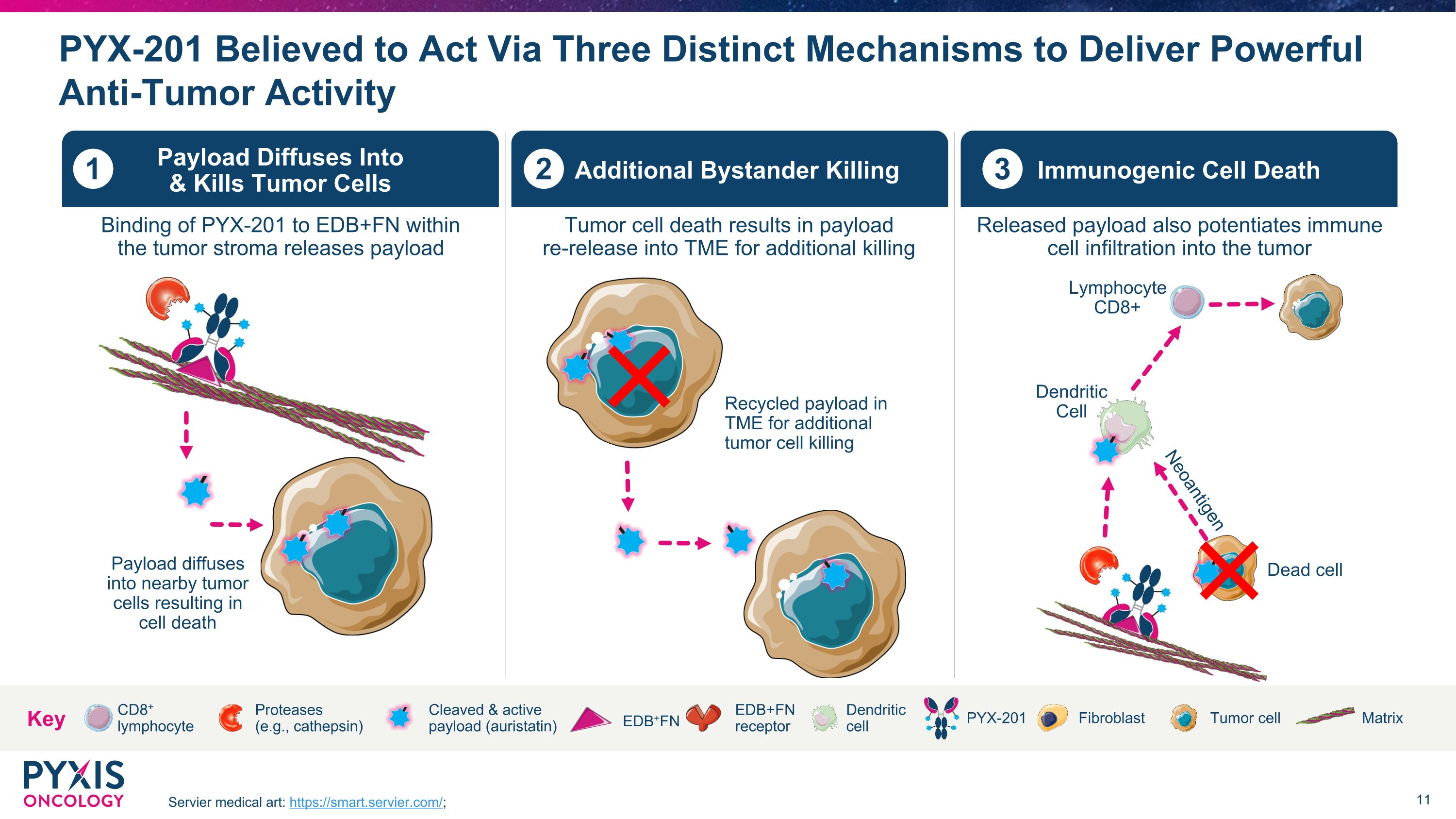
据信 PYX-201 将通过三种不同的机制发挥作用,提供强大的抗肿瘤活性 Servier 医学艺术:https://smart.servier.com/;CD8+ 淋巴细胞树突状细胞 PYX-201 裂解和活性有效载荷(奥里斯他汀)肿瘤细胞成纤维细胞 EDB+FN 矩阵 EDB+FN 受体蛋白酶(例如组织蛋白酶)关键附加旁观者杀死 2 肿瘤细胞死亡会导致有效载荷重新释放到 TME,从而进一步杀死有效载荷扩散到 & 杀死肿瘤细胞 1 在肿瘤基质内将 PYX-201 与 EDB+FN 结合释放有效载荷免疫原性细胞死亡 3 已释放有效载荷还能增强免疫细胞对肿瘤的浸润有效载荷扩散到附近的肿瘤细胞导致细胞死亡 TME 中的回收载荷可进一步杀灭肿瘤细胞树突状细胞淋巴细胞 CD8+ 死细胞新抗原

PYX-201 与其他 ADC 偶联反应的 ADC 技术改进:经过设计的半胱氨酸残基可在不破坏将抗体结合在一起的链间半胱氨酸键的情况下将目标 DAR 设为 4 Linker:与 Adcetris、Padcev 等中使用的 val-cit 连接剂相比,经过优化的 val-cit 连接剂在循环中更稳定(即减少羧酸酯酶裂解)。有效载荷:优化的奥瑞他汀(AUR-0101) 之所以被选中,是因为与 MMAE 相比具有增强的细胞通透性和旁观者细胞杀伤活性。与 MMAE 相比,AUR-0101 的代谢和排泄特性也有所改善。与传统 Val-cit-MMAE ADC 相比,PYX-201 的这三个技术改进领域表现出更高的耐受性和稳定性,非临床毒理学研究中流通中的游离奥瑞他汀有效载荷水平较低

PYX-201 专为耐受性和活性而设计 PYXS 优化的 ADC 技术的关键改进:专为肿瘤基质中纤维连接蛋白 (EDB+FN) 的外域 B 而设计的单克隆抗体旨在减少脱靶效应和提高耐受性携带四个 Auristatin 0101、微管解聚抑制有效载荷最大化肿瘤杀伤和效力 4 个位点的可预测统一药物抗体比 (DAR) 特异性、可组织蛋白分解的缬氨酸瓜氨酸连接剂经过优化,可提高循环稳定性并减少自由载荷 EDB+FN (HuigG1) 靶向 mAb auristatin 0101 有效载荷 (x4) 缬氨酸瓜氨酸连接剂 PYX-201 药物设计 MC VC PBAC aur0101 PYX-201 结构人源化 L19 抗 EDB-fn 单抗 (kk183c + K290C) vc0101 MC-VC-PABC 连接剂结构使用马来酰亚胺己酰基 (MC) 间隔,一种对蛋白酶(组织蛋白酶)敏感的间隔二肽、缬氨酸 (VC)、自焚间隔、对氨基苯甲氧基羰基 (PABC) 和经过优化的奥瑞他汀 — Aur0101
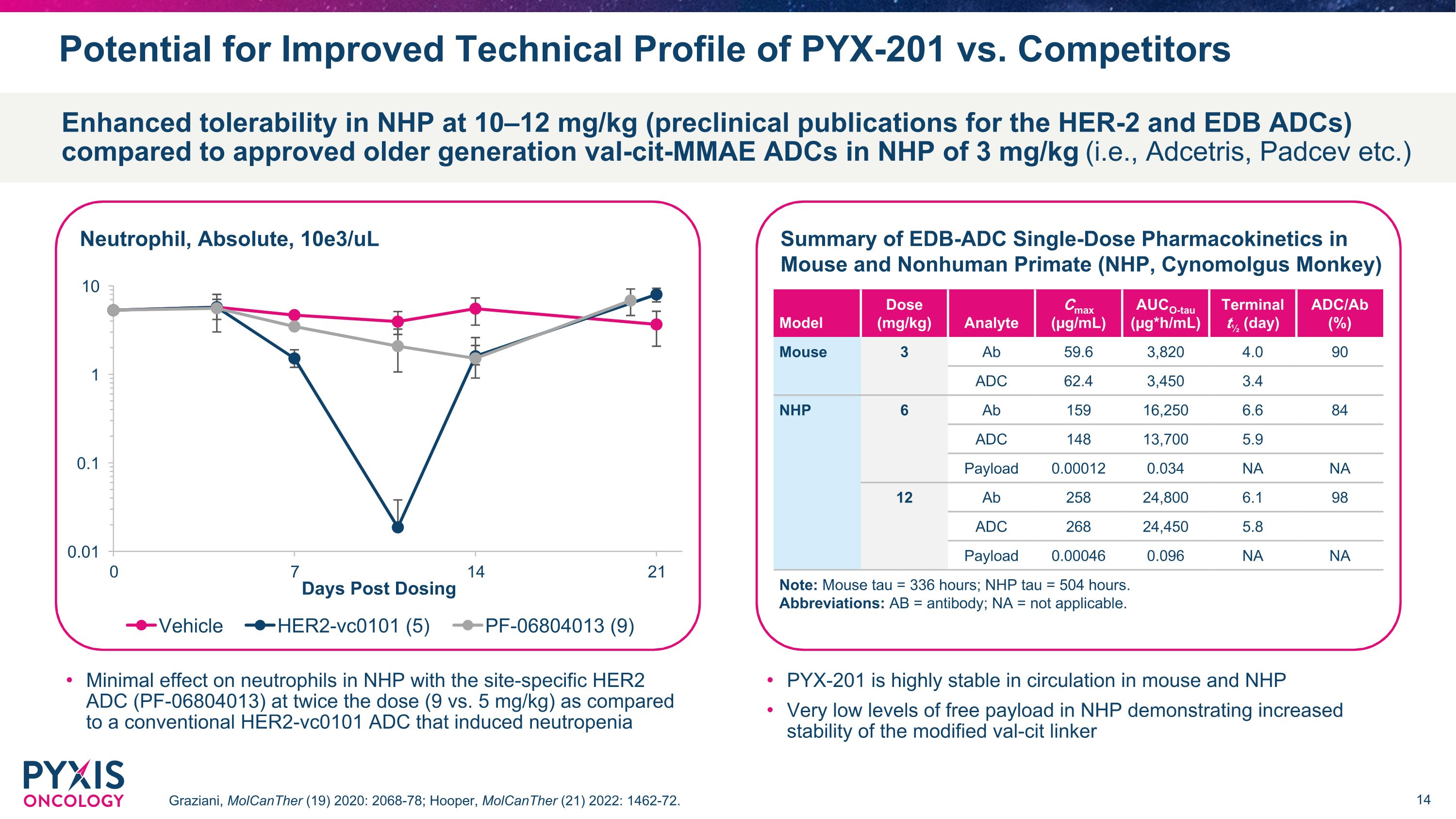
PYX-201 对比竞争对手的技术概况有可能改善 Graziani,MolcAnther(19)2020:2068-78;Hooper,MolcAnther(21)2022年:1462-72。与经批准的 3 mg/kg(即 Adcetris、Padcev 等)的老一代 Val-cit-MMAE ADC 相比,NHP 在 10—12 mg/kg(HER-2 和 EDB ADC 的临床前出版物)下的耐受性增强与诱发中性粒细胞减少的传统 HER2-vc0101 ADC 相比,使用位点特异性 HER2 ADC (PF-06804013) 的剂量(9 与 5 mg/kg)对新生儿中性粒细胞的影响微乎其微 PYX-201 在小鼠和 NHP 的循环中高度稳定 NHP 中的游离载荷水平非常低,表明改性的 val-cit 连接剂的稳定性更高 EDB-ADC 单剂量药代动力学摘要非人灵长类动物(NHP、Cynomolgus Monkey)模型剂量(mg/kg)分析物 Cmax(µg/mL)Auco-TAU(µg*H/mL)终端½(天)ADC/Ab(%)小鼠 3 Ab 59.6 3,820 4.0 90 ADC62.4 3,450 3.4 NHP 6 Ab 159 16,250 6.6 84 ADC 148 13,700 5.9 有效载荷 0.00012 0.034 NA NA 12 Ab 258 24,800 6.1 98 ADC 268 24,450 5.8 有效载荷 0.00046 0.096 NA NA 注意:鼠标 tau = 336 小时;NHP tau = 504 小时。缩写:AB = 抗体;NA = 不适用。中性粒细胞,绝对值,10e3/uL
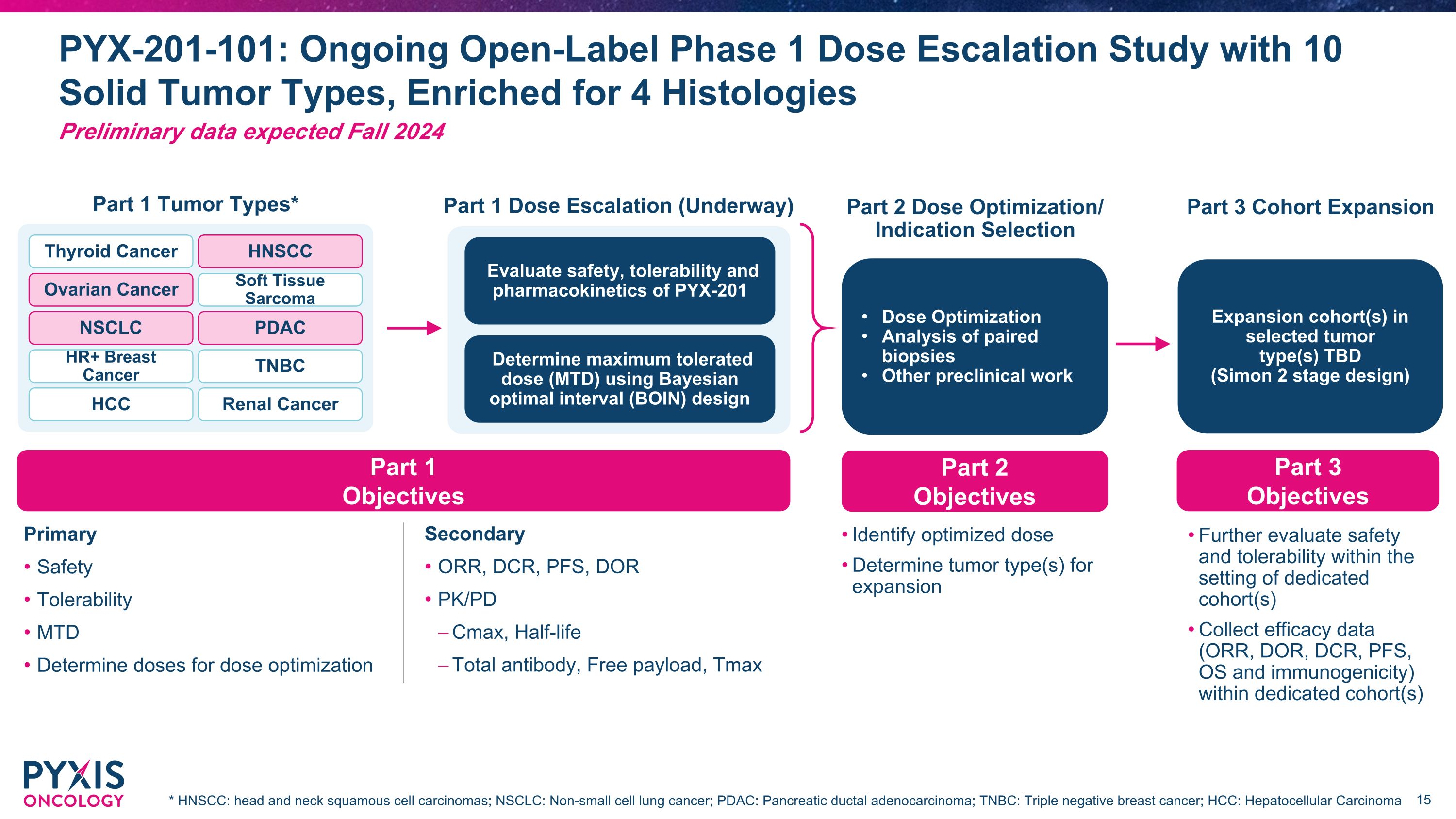
2022 年 2023 年第一季度 PYX-201-101:正在进行的开放标签 1 期剂量递增研究,涉及 10 种实体瘤类型,丰富 4 种组织学 2024 年秋季初步数据第 1 部分肿瘤类型* 第 1 部分剂量递增(进行中)第 2 部分选定肿瘤类型的剂量优化/适应症选择扩展队列待定(西蒙 2 阶段设计)配对活检的剂量优化分析其他临床前研究使用 Bays 确定最大耐受剂量 (MTD) 最佳间隔 (BOIN) 设计评估 PYX-201 卵巢的安全性、耐受性和药代动力学癌症 NSCLC HR+ 乳腺癌 HCC 软组织肉瘤 PDAC TNBC 甲状腺癌 HNSCC 肾癌第 3 部分队列扩展 * HNSCC:头颈部鳞状细胞癌;NSCC:非小细胞肺癌;PDAC:胰腺导管腺癌;TNBC:三阴性乳腺癌;HCC:肝细胞癌第 2 部分目标第 3 部分确定优化目标剂量确定要扩大的肿瘤类型进一步评估专用队列中的安全性和耐受性收集其中的疗效数据(ORR、DOR、DCR、PFS、OS 和免疫原性)专用队列第 1 部分目标主要安全耐受性 MTD 确定剂量优化剂量次要 ORR、DCR、PFS、DOR PK/PD Cmax、半衰期总抗体、空闲有效载荷、Tmax
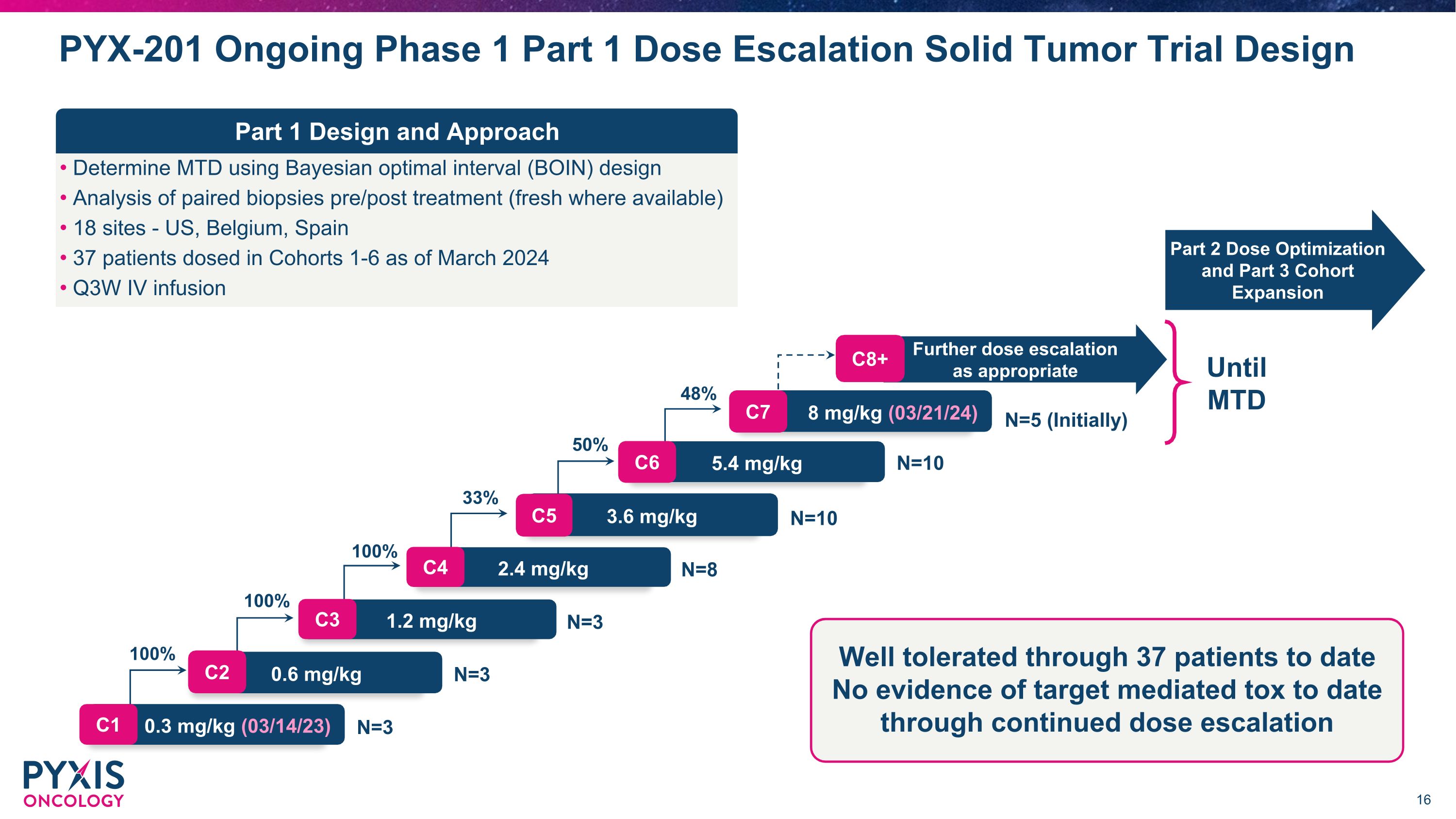
使用贝叶斯最佳间隔 (BOIN) 设计对配对活检进行分析治疗前/后(如果有最新活检)18 个部位——美国、比利时、西班牙 37 名患者截至 2024 年 3 月 Q3W IV 输液 PYX-201 正在进行第 1 阶段第 1 部分剂量递增实体瘤试验设计酌情进一步增加剂量 0.3 mg/kg(03/14/23)N=3 0.6 mg/kg N=3 1.2 mg/kg N=3 1.2 mg/kg N=3 1.2 mg/kg N=3 1.2 mg/kg N=3 1.2 mg/kg N=3 1.2 mg/kg N=3 1.2 mg/kg N=3 3 2.4 mg/kg N=8 3.6 mg/kg N=10 5.4 mg/kg N=10 8 mg/kg (03/21/24) N=5(初始)100% 100% 100% 33% 50% 48% 48% C1 C2 C3 C4 C5 C6 C7 C8+ 第 2 部分剂量优化和第 3 部分队列扩张直到 MTD 迄今为止 37 名患者耐受性良好,迄今为止,没有证据表明持续增加剂量会产生靶向介导的毒素(第 1 部分)设计与方法

Anti-Siglec-15(PYX-106):潜在的非小细胞肺癌和实体瘤中同类最佳、高度分化的全人源抗体更高的结合亲和力可增强较高剂量水平下的T细胞反应,使免疫系统能够杀死和抵御癌细胞。可能与抗PD-(L)1或其他免疫疗法联合使用可能获得更好的暴露且没有抗药抗体证据的临床前研究耐受性良好,半衰期为7天减少给药频率表现出对人类 Siglec-15 的亲和力比基准值高 10 倍发育体外 SIGLEC-15 介导的 T 细胞抑制效果强大、剂量依赖性逆转
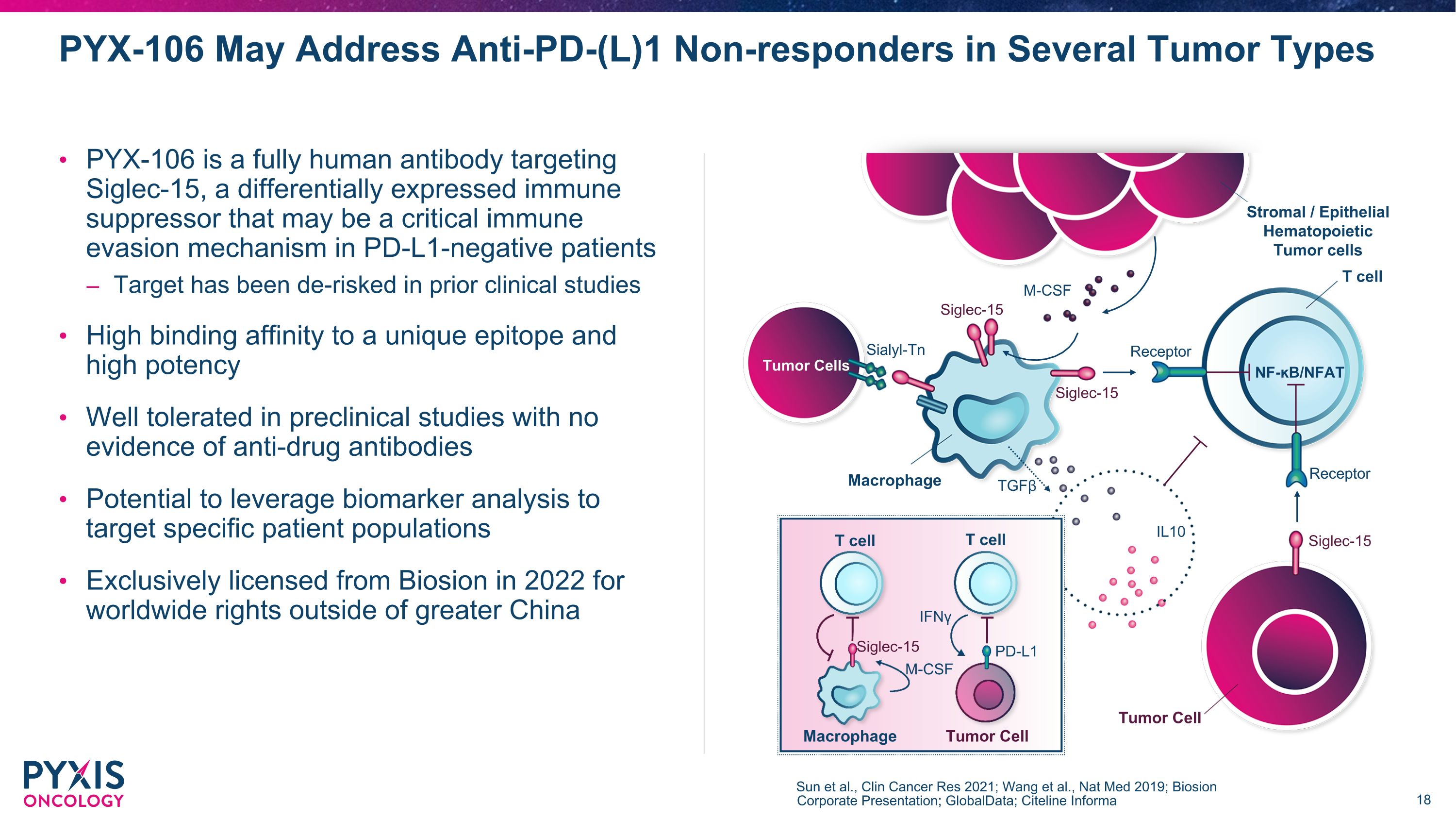
PYX-106 可能会解决几种肿瘤类型中抗PD-(L) 1 无反应者 Sun 等人,《2021 年临床癌症研究报告》;Wang 等人,2019 年 Nat Med;Biosion 企业演讲;GlobalData;Citeline Informa 基质/上皮造血肿瘤细胞 T 细胞 NF-B/nFAT 肿瘤细胞巨噬细胞受体 TGFβ Sialyl-Tn M-CSF Siglector -15 Siglec-15 Siglec-15 IL10 Siglec-15 M-CSF PD-L1 IFNγT 细胞 T 细胞巨噬细胞肿瘤细胞 PYX-106 是一种靶向 Siglec-15 的完全人源抗体,这是一种差异表达的免疫抑制剂,可能是一种关键的免疫逃避PD-L1 阴性患者的机制在先前的临床研究中,靶点已被去除风险,与独特表位的结合亲和力高,在没有抗药抗体证据的临床前研究中耐受性良好。有可能利用生物标记物分析靶向特定患者群体 2022 年获得博奥信独家许可,可获得大中华区以外的全球版权
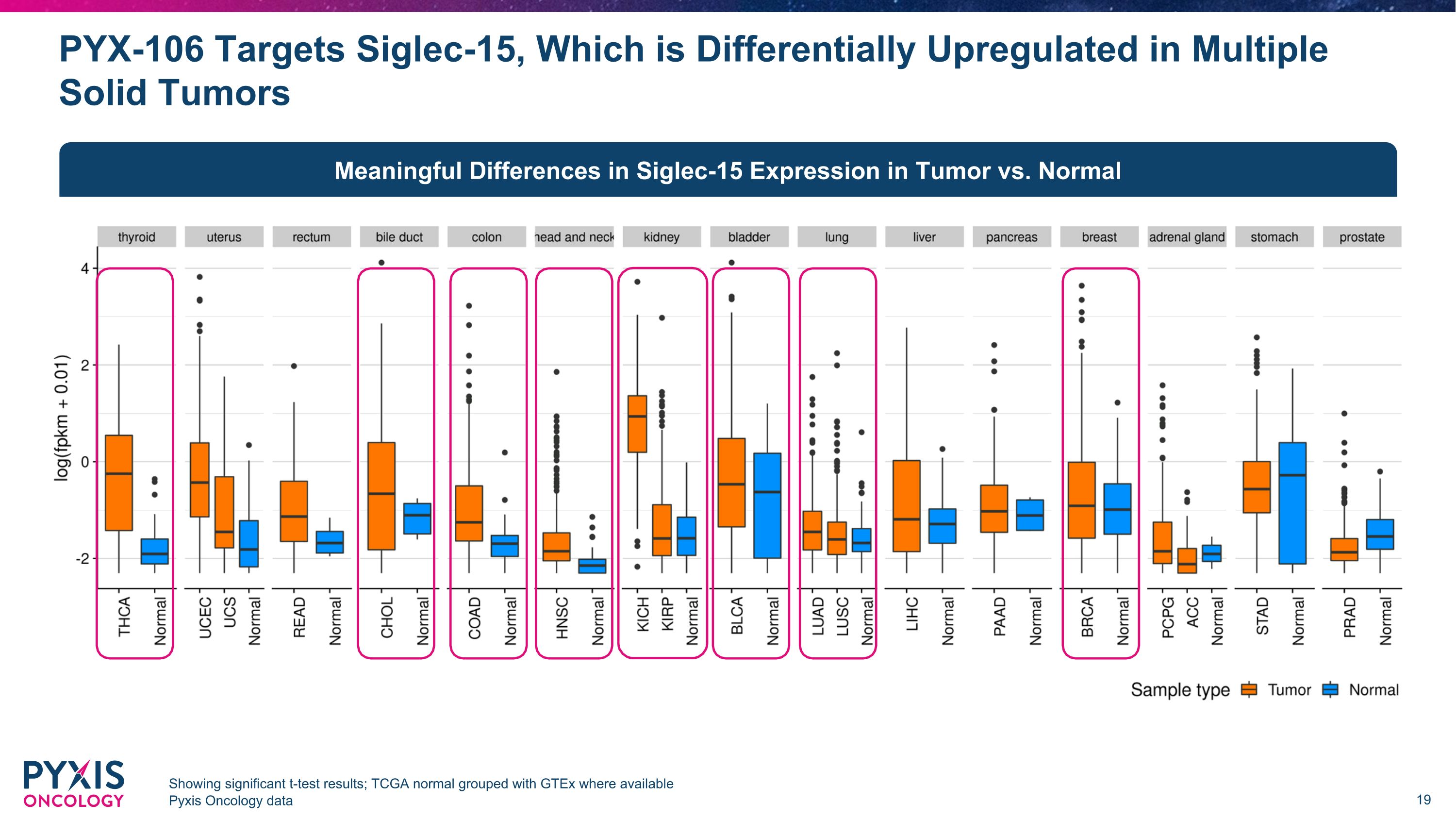
PYX-106 靶向 Siglec-15,在多个实体瘤中差异上调,显示出显著的 t 检验结果;TCGA 正常与 gTeX 分组,其中 Pyxis Oncology 数据有 Pyxis Oncology 数据,肿瘤与正常肿瘤中 Siglec-15 的表达存在显著差异
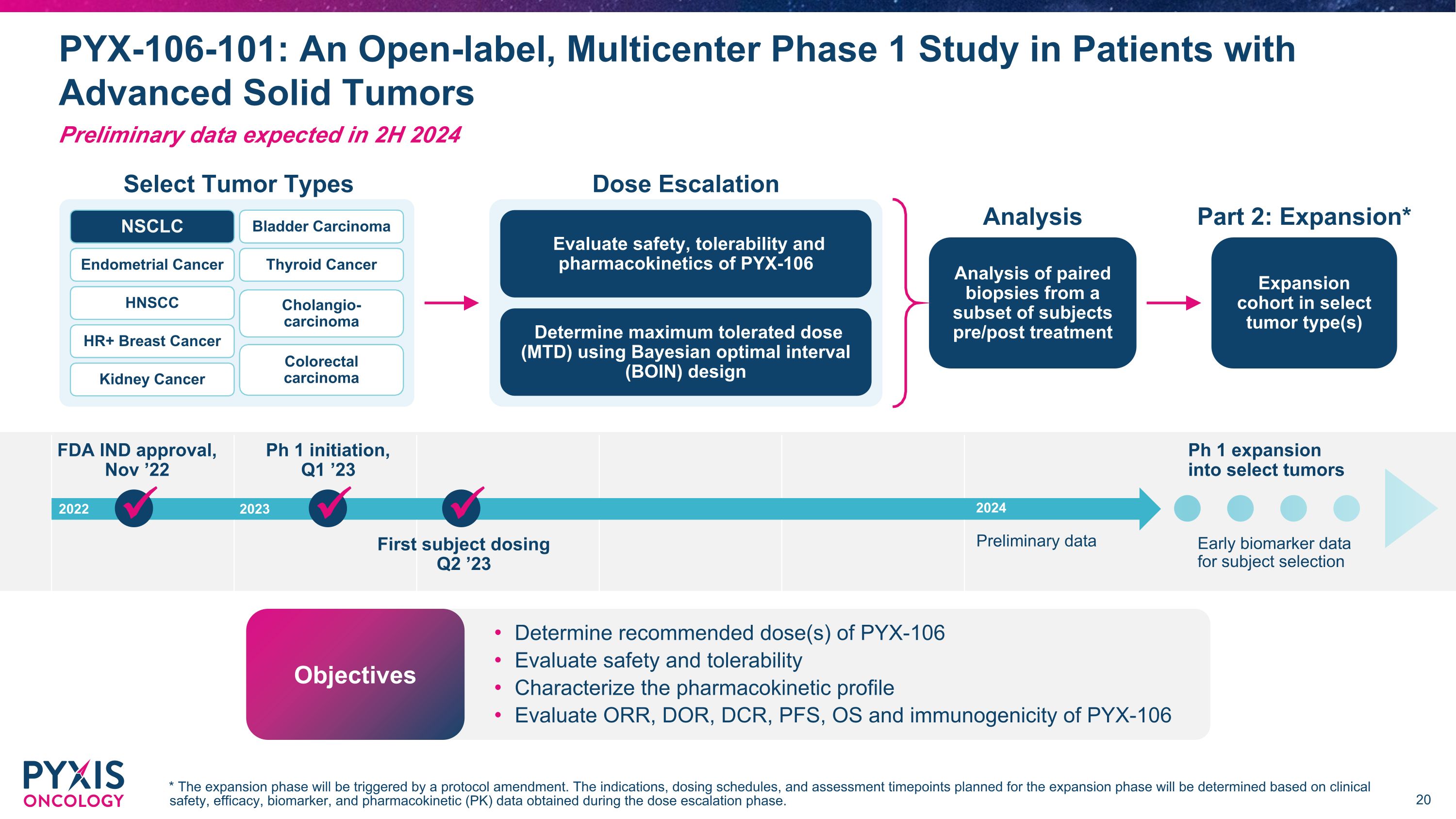
FDA IND 批准,22 年 11 月 Ph 1 启动,2023 年第一季度 Ph 1 扩展到特定肿瘤受试者选择的早期生物标志物数据第一受试者给药 2023 年 2023 年第二季度初步数据选择肿瘤类型剂量递增分析特定肿瘤类型的扩展队列治疗前/后对部分受试者的配对活检进行分析使用贝叶斯最佳间隔 (BOIN) 设计确定最大耐受剂量 (MTD) 评估安全性,PYX-106 子宫内膜癌的耐受性和药代动力学 HNSCC HR+ 乳腺癌肾癌甲状腺癌胆管癌结直肠癌 NSCLC 膀胱癌第 2 部分:扩张* 确定 PYX-106 的推荐剂量评估安全性和耐受性表征药代动力学特征评估 PYX-106 的 ORR、DOR、DCR、PFS、OS 和免疫原性目标 PYX-106-101:一项针对晚期实体瘤患者的开放标签、多中心 1 期研究 * 扩展阶段将由协议修正案触发。扩张阶段计划的适应症、给药时间表和评估时间点将根据剂量递增阶段获得的临床安全性、疗效、生物标志物和药代动力学(PK)数据确定。初步数据预计将在2024年下半年公布
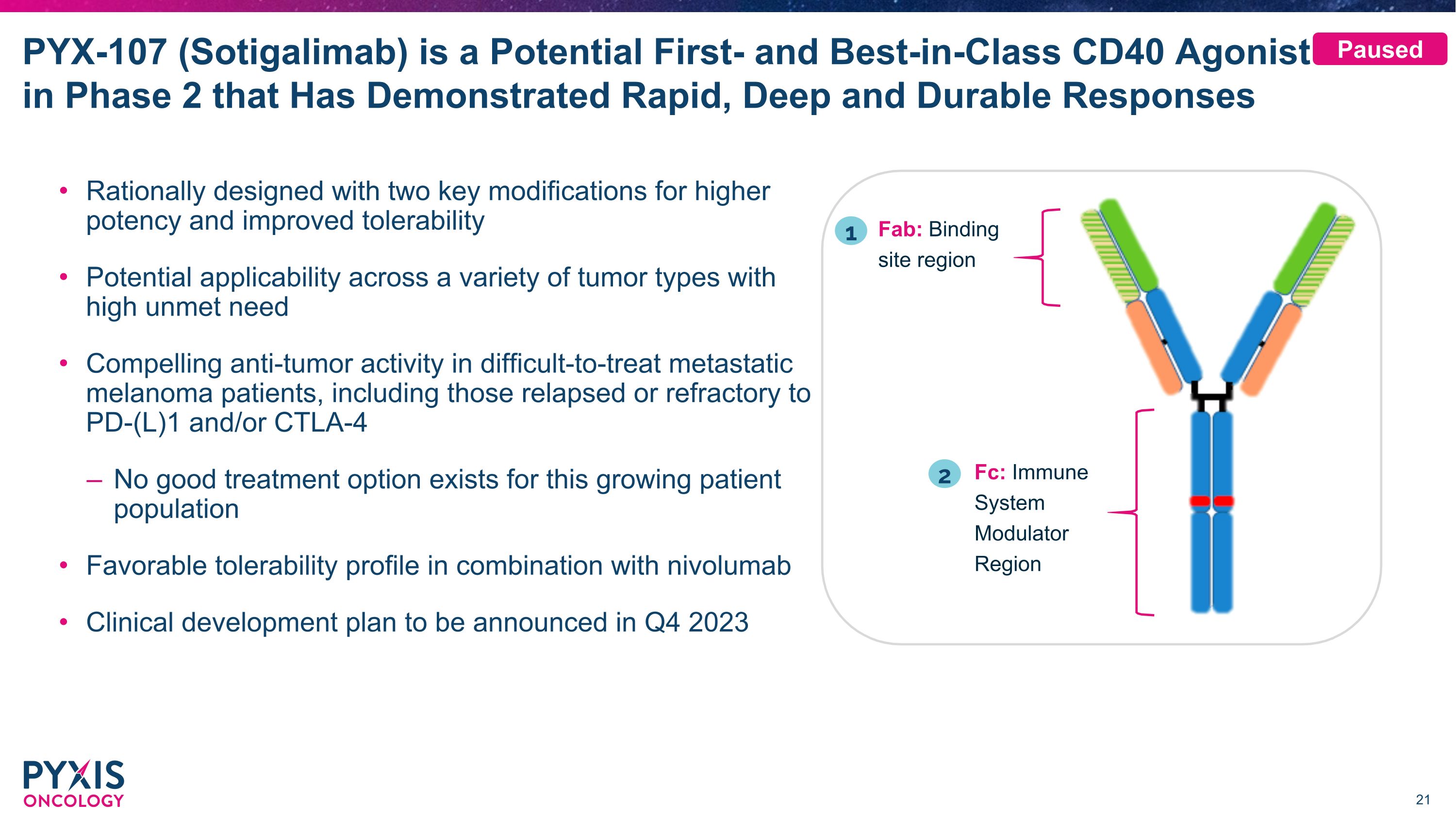
PYX-107(Sotigalimab)是处于第二阶段的潜在首创和同类最佳CD40激动剂,已显示出快速、深层和持久的反应合理设计,具有更高的效力和更高的耐受性。潜在的适用性适用于需求量大的各种肿瘤类型,对难以治疗的转移性黑色素瘤患者,包括PD-(L)1和/或 CTLA-4 复发或难治的患者,具有吸引力的抗肿瘤活性对于这种不断增长的患者群体,没有好的治疗选择良好的耐受性状况与 nivolumab 联合临床开发计划将于 2023 年第四季度公布 Fab:结合位点区域 Fc:免疫系统调节剂区域 1 2 已暂停
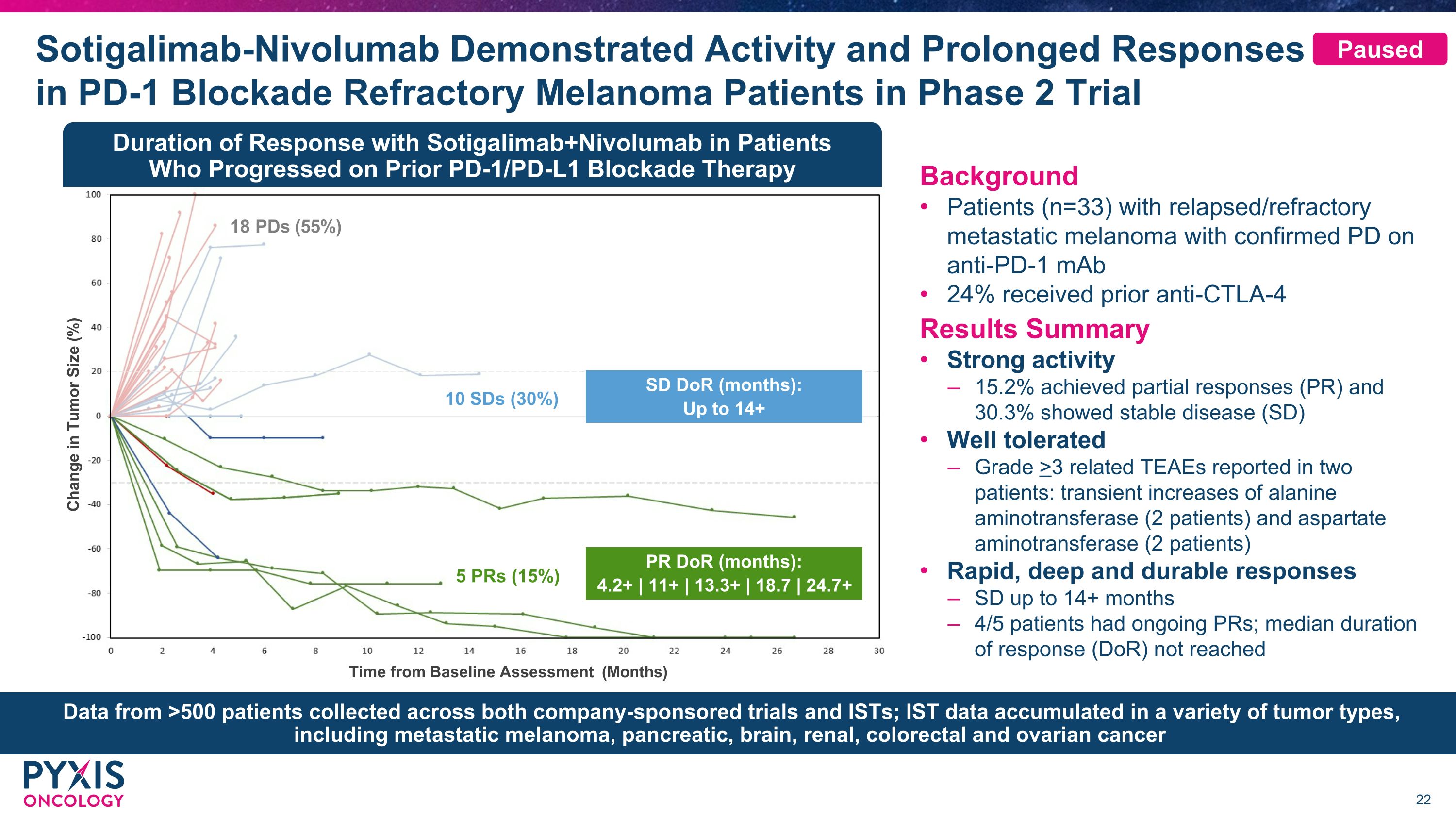
Sotigalimab-Nivolumab 在 PD-1 阻断难治性黑色素瘤患者的 2 期试验中表现出活性和长期反应肿瘤大小变化(%)距基线评估时间(月)5 个 PR(15%)PR(月):4.2+ | 11+ | 13.3+ | 18.7 | 24.7+ SD dOR(月):最多 14+ 10 个 SD (30%) 18 个 PD (55%) 背景复发/难治性转移性黑色素瘤的患者(n=33)在使用抗PD-1单克隆抗体时确诊患者 24% 先前接受过抗CTLA-4结果摘要强活性 15.2% 实现部分反应(PR),30.3% 表现出稳定的疾病(SD)耐受性良好在两名患者中报告的丙氨酸转氨酶(2名患者)和天冬氨酸氨基转移酶(2名患者)和天冬氨酸转氨酶(2名患者)反应快速、深层和持久的SD长达14个月以上 4/5名患者有持续的PR;在先前接受PD-1/PD-L1阻断疗法进展的患者中,Sotigalimab+Nivolumab的中位反应持续时间(DoR)未达到中位缓解持续时间(DoR)在公司赞助的试验和IST中收集了来自超过500名患者的数据;IST数据积累在各种肿瘤类型中,包括转移性黑色素瘤、胰腺瘤、脑癌、肾癌、结直肠癌和卵巢癌已暂停

即将举行的会议 2024 年 5 月 14 日至 15 日在纽约举行的 RBCCM 全球医疗保健会议 BTIG 虚拟生物技术会议 2024 年 8 月 5 日至 6 日在波士顿举行的富国银行医疗保健会议 4 份 AACR 摘要:PYX-201(抗 EDB)、PYX-106(抗 SIGLEC-15)、PYX-102(抗 KLRG1),2024 年 4 月 5 日至 10 日在圣地亚哥举行 Stifel 虚拟靶向肿瘤日 2024 年 4 月 16 日至 17 日 2024 年 6 月 5 日至 6 日在纽约举行的系列医疗保健会议

附录 PYX-201 和 ADC 工具包 PYX-106 apxiMab 平台和 Sotigalimab
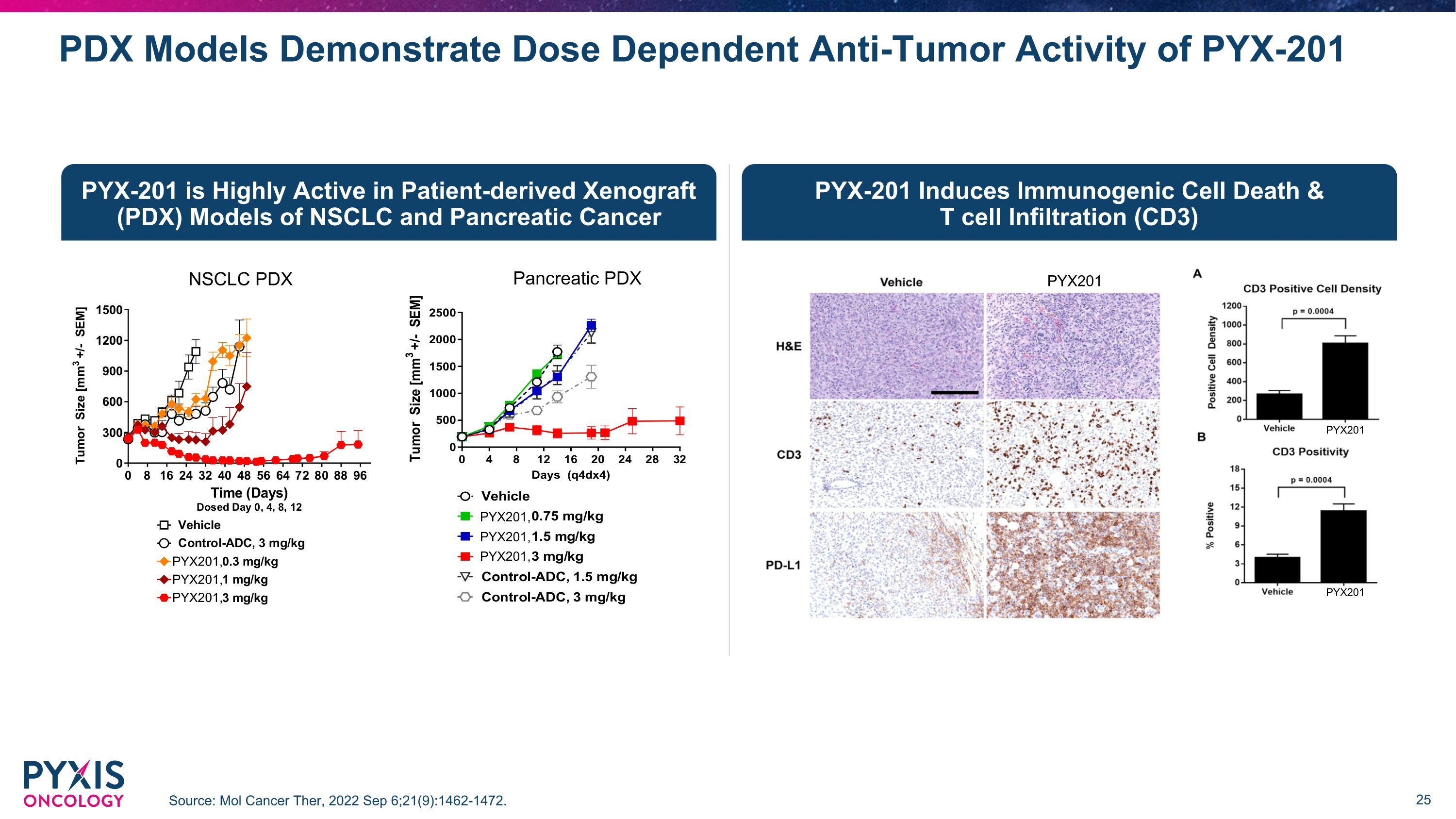
PYX-201 在 NSCLC 和胰腺癌的患者源性异种移植 (PDX) 模型中非常活跃 PYX-201 诱导免疫原性细胞死亡和 T 细胞浸润 (CD3) PDX 模型显示 PYX-201 的剂量依赖性抗肿瘤活性来源:Mol Cancer Ther,2022 年 9 月 6 日;21 (9): 1462-1472。PYX201 PYX201 PYX201 PYX201、PYX201、PYX201、胰腺 PDX PYX201、PYX201、PYX201、NSCLC PDX
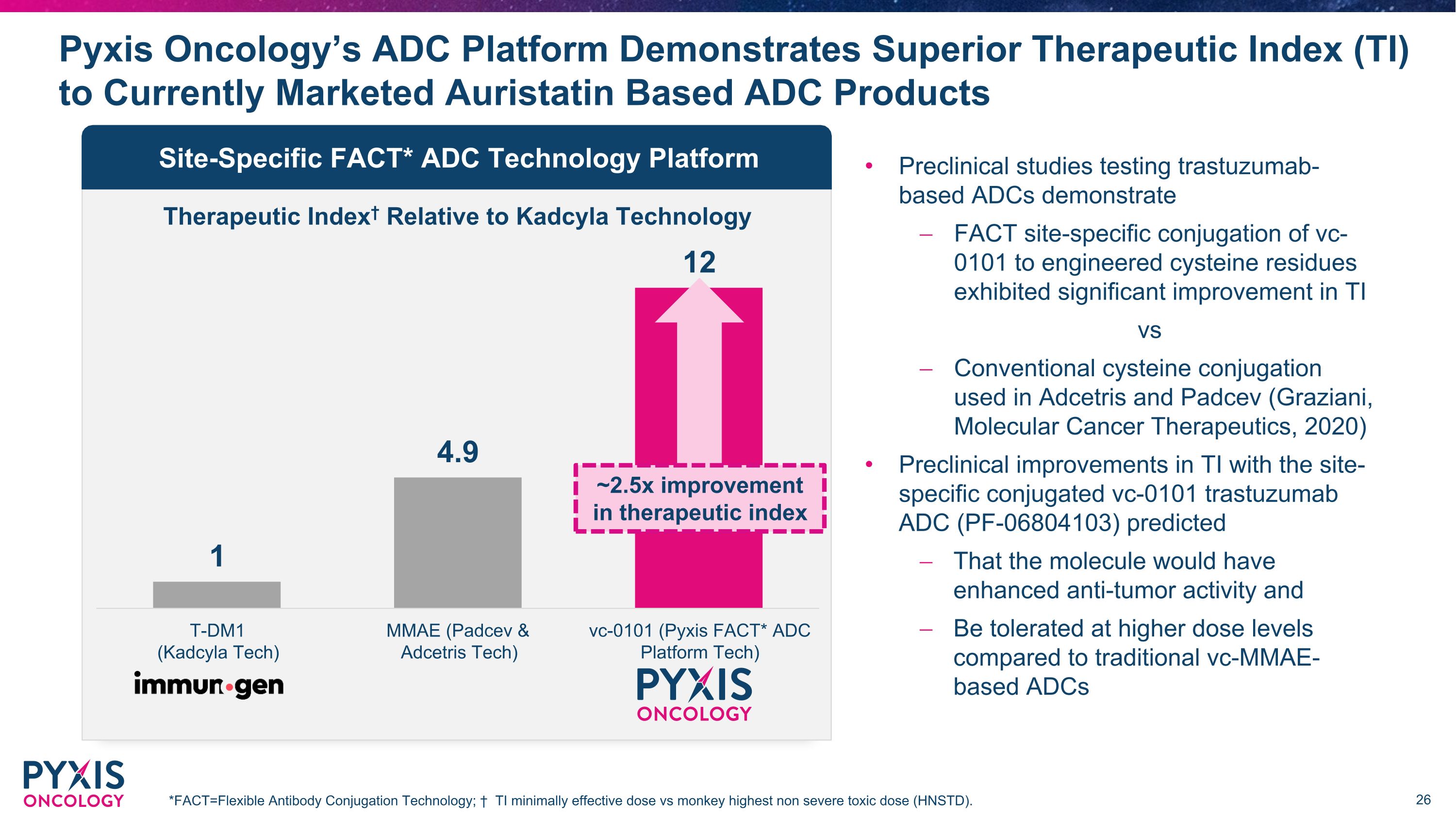
相对于Kadcyla Technology的治疗指数,Pyxis Oncology的ADC平台显示出优于目前上市的基于奥瑞他汀的ADC产品的治疗指数(TI)*fact=灵活的抗体偶联技术;与猴子最高非重度毒性剂量(HNSTD)相比,TI 的有效剂量最低。位点特异性 FACT* ADC 技术平台治疗指数提高了约 2.5 倍测试曲妥珠单抗药物的临床前研究表明,与Adcetris和Padcev(Graziani,《分子癌疗法》,2020年)使用位点特异性偶联vc-0对TI进行临床前改进,与Adcetris和Padcev(Graziani,《分子癌疗法》,2020年)与位点特异性偶联vc-0相比,TI 的临床前改进 101 曲妥珠单抗ADC(PF-06804103)预测该分子具有增强的抗肿瘤活性,并且在更高的条件下耐受性与传统的基于 VC-MMAE 的 ADC 相比的剂量水平
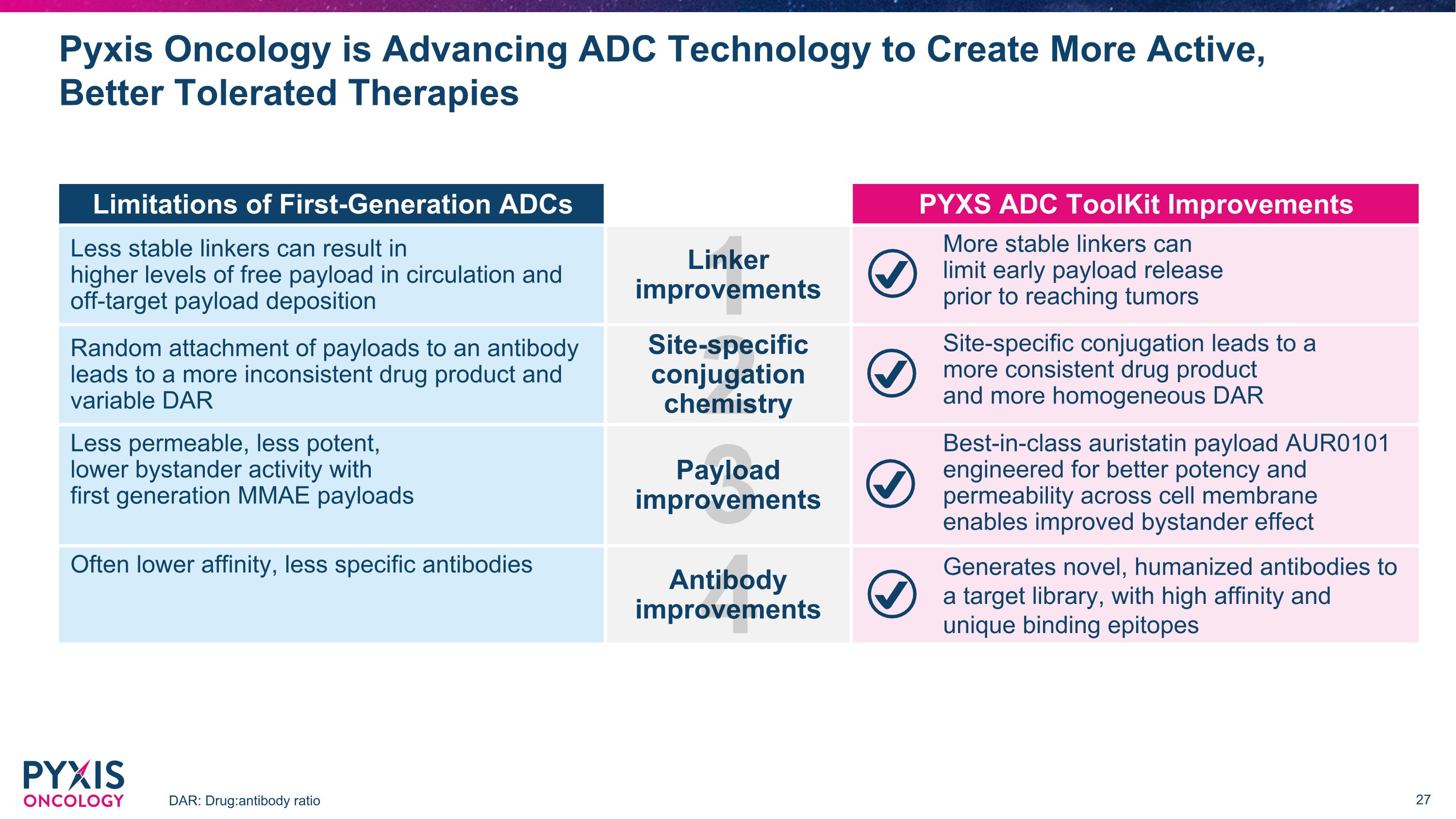
Pyxis Oncology正在推进ADC技术以开发更活跃、更耐受的疗法 DAR:药物:抗体比率第一代 ADC 的局限性 PYXS ADC 工具包的改进不太稳定的连接剂会导致更高的循环中自由载荷水平和脱靶载荷沉积连接器的改进更稳定的连接剂可以在到达肿瘤之前限制有效载荷的早期释放。随机附着在抗体上会导致药物产物更加不一致和 DAR 位点特异性偶联化学变化不定特定位点的偶联导致更稳定的药物产品和更均匀的 DAR 采用第一代 MMAE 有效载荷的渗透性更低、效力更低、旁观者活性更低有效载荷改进一流的奥瑞他汀有效载荷 AUR0101 专为提高细胞膜的效力和渗透性而设计可改善旁观者效应通常较低亲和力、特异性抗体改进向靶库生成具有高亲和力和独特结合表位的新型人源化抗体 1 2 3 4
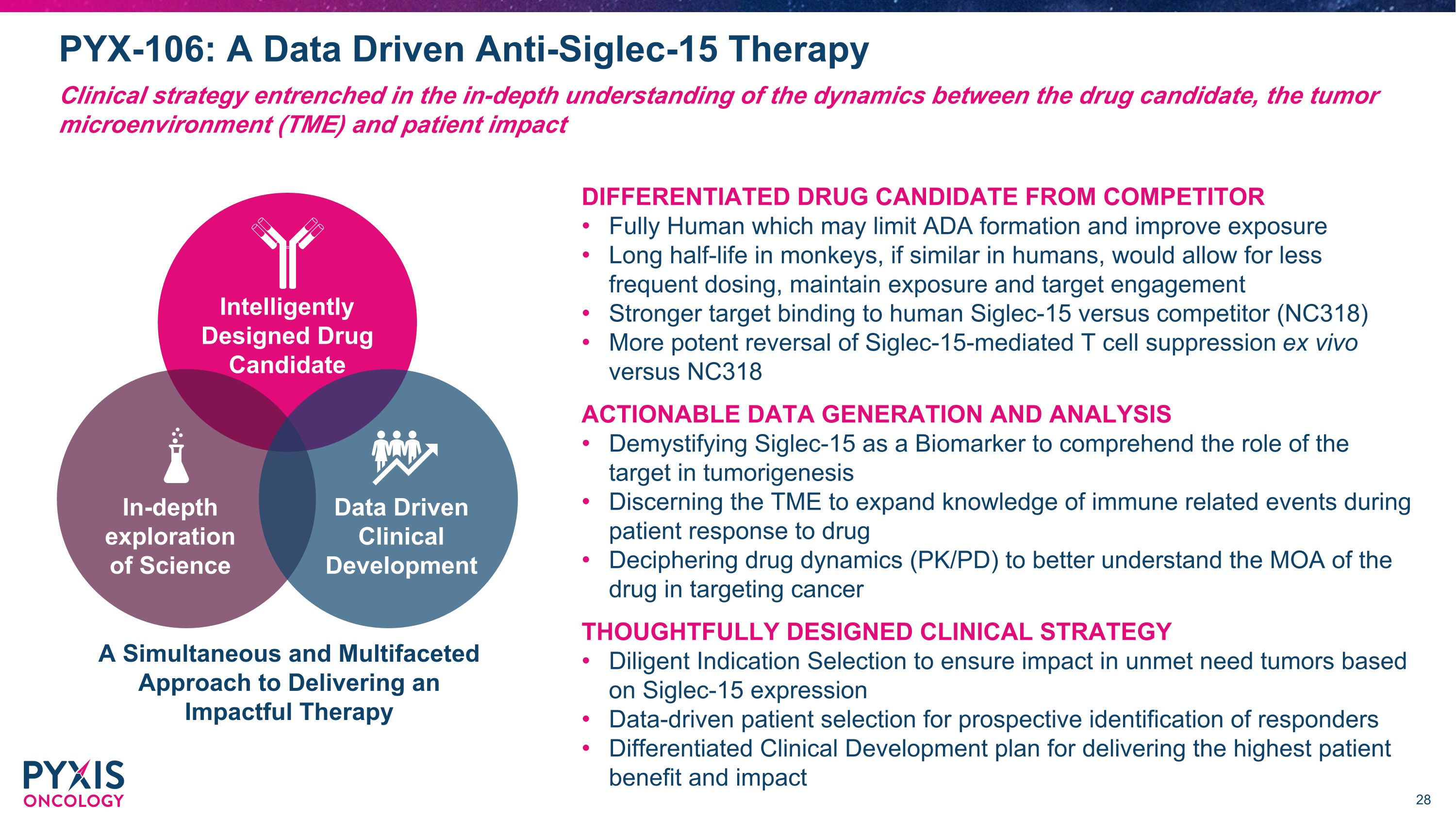
PYX-106:数据驱动的抗Siglec-15疗法临床策略根深蒂固于对候选药物、肿瘤微环境(TME)和患者影响之间动态的深入理解,与竞争对手的全人类区分开来,这可能会限制ADA的形成并改善暴露猴子的半衰期,如果人类相似,则可以减少给药频率,保持暴露和靶向参与度与人Siglec-15的结合力强于竞争对手(NC318)更有效的逆转 siglec-15 介导的 T 细胞抑制 ex体内与 NC318 的可操作数据生成和分析揭开 Siglec-15 作为生物标志物的神秘面纱,以理解靶标在肿瘤发生中的作用辨别 TME 以扩大患者对药物反应期间的免疫相关事件的了解解密药物动力学 (PK/PD) 以更好地了解该药物在靶向癌症方面的MOA 精心设计的临床策略勤奋的适应症选择,确保根据未满足的肿瘤产生影响 Siglec-15 表达数据驱动的患者选择用于前瞻性识别应答者差异化为患者提供最高收益和影响力的临床开发计划提供有影响力的疗法的同步和多方面的方法深入探索科学数据驱动的临床开发智能设计的候选药物
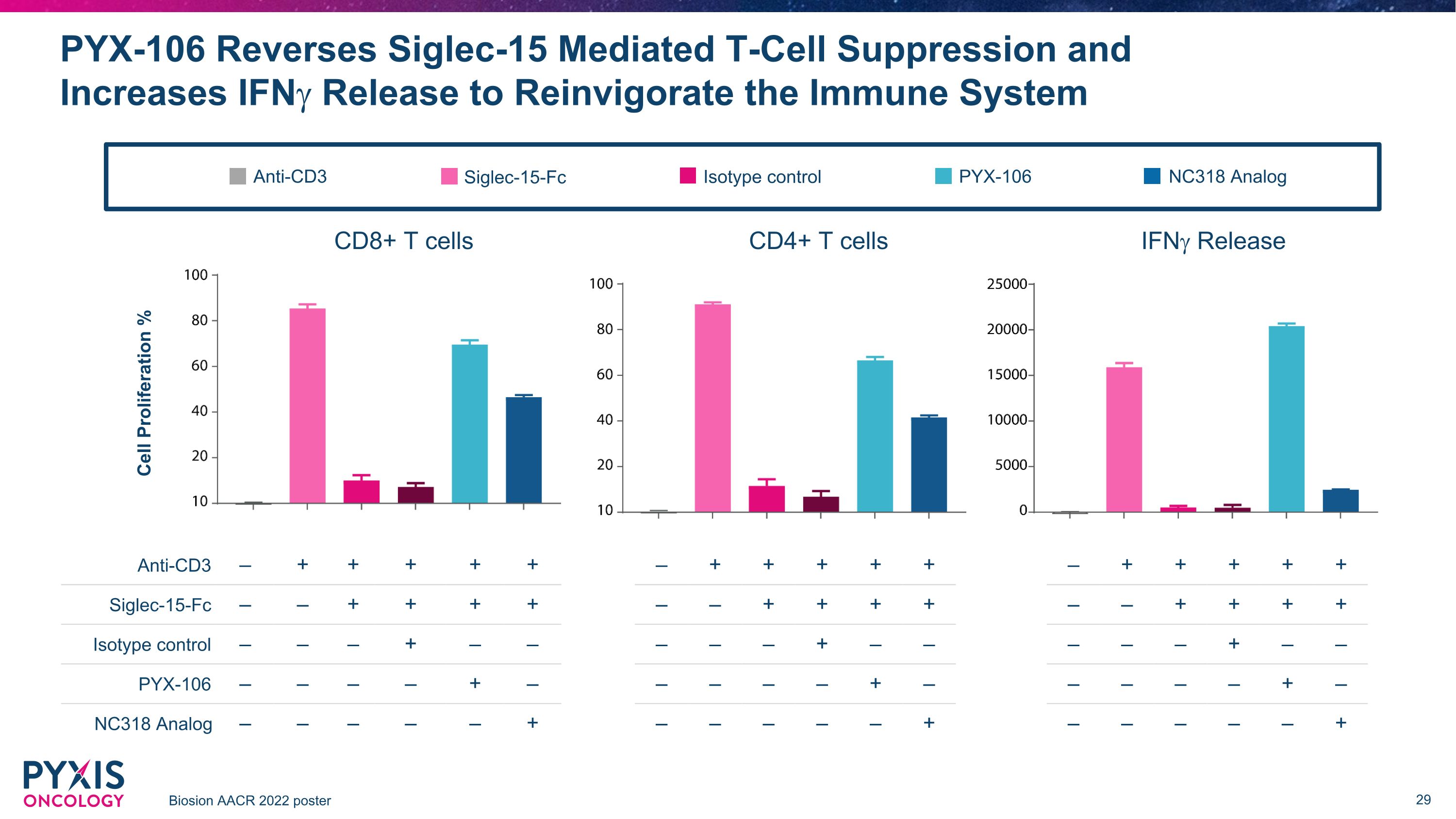
PYX-106 逆转 Siglec-15 介导的 T 细胞抑制并增加 IfNG 释放以重振免疫系统 Biosion AACR 2022 海报 CD8+ T 细胞 CD4+ T 细胞 iFnG 释放抗 CD3 — + + + + Siglec-15-Fc — — — + + 同型控制 — — — — — — + NC318 模拟 — — — — — + 细胞增殖% — — — + + + + — — + + + + — — — — — — — — — — — — — — — — — — — — — — — — — + — + + + + — — + + + — — — — — — — — — — — — — — — — — — — — — + 抗CD3 Siglec-15-Fc同型控制 PYX-106 NC318 模拟 PYX-106
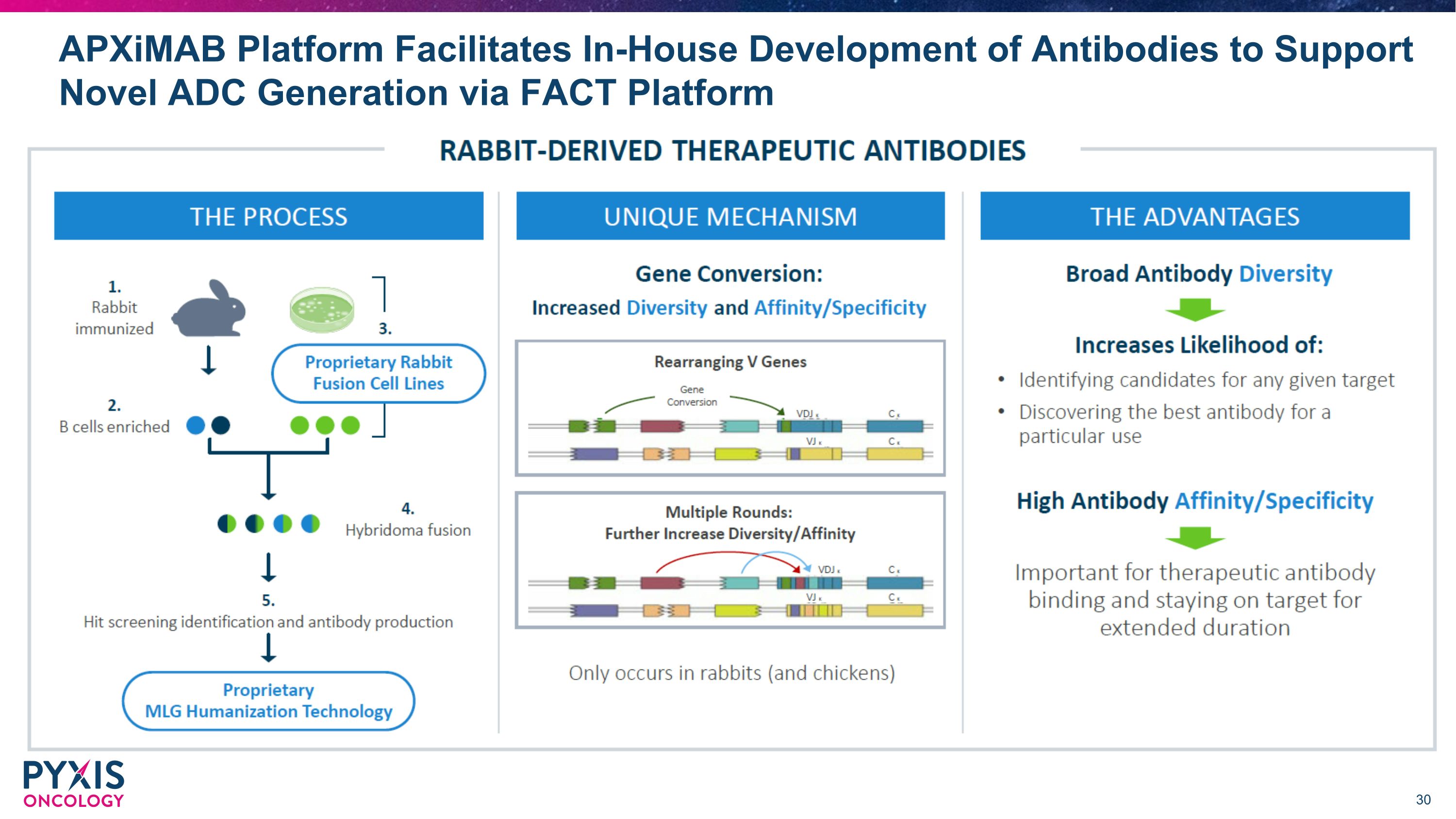
Apximab 平台促进抗体的内部开发,支持通过 FACT 平台生成新型 ADC
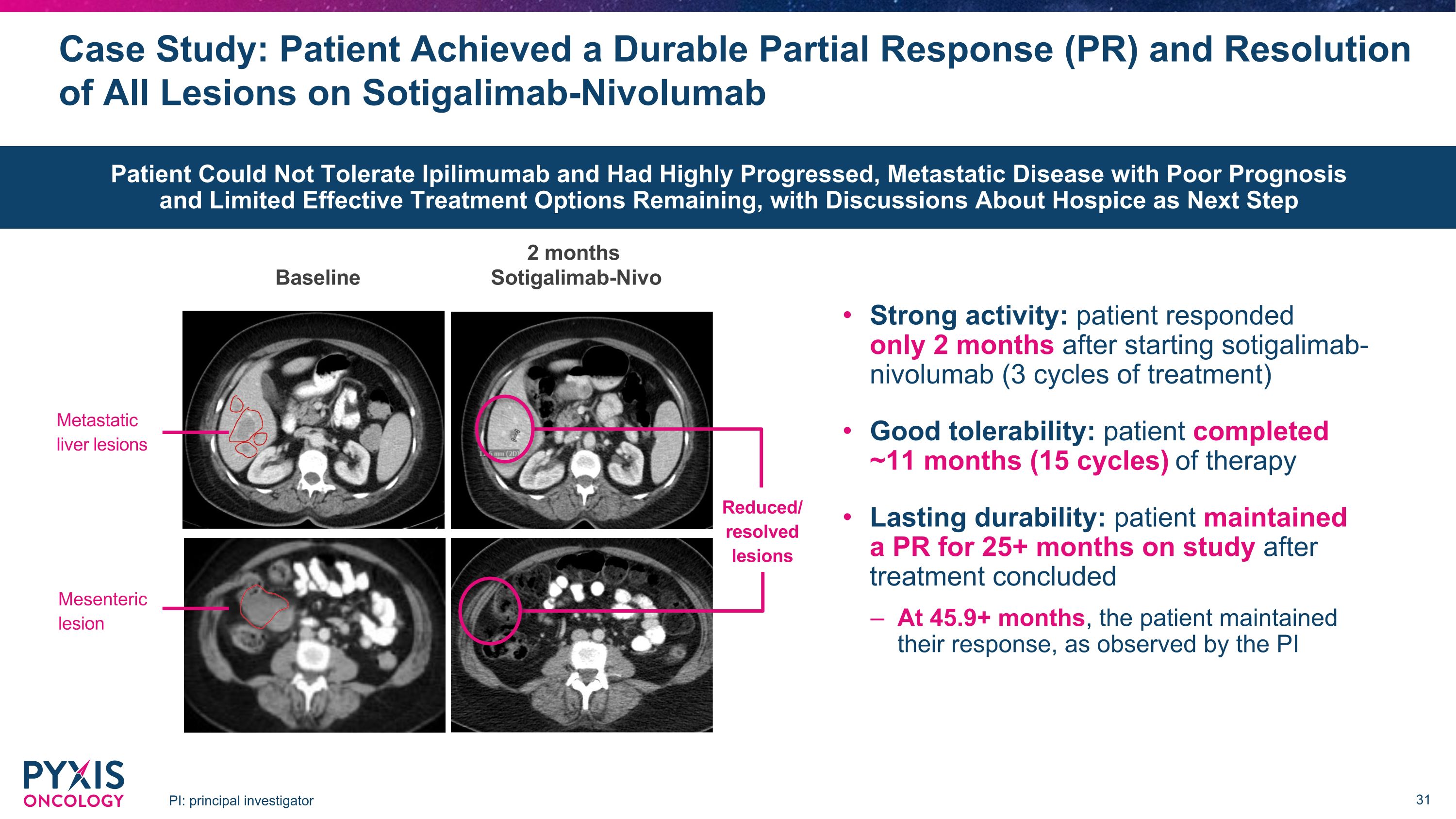
案例研究:患者在使用Sotigalimab-Nivolumab PI时实现了持久的部分反应(PR)和所有病变的缓解:首席研究员 2 个月基线 Sotigalimab-Nivo 活性强:患者在开始索替加利单抗仅两个月后才出现反应(3 个周期)耐受性良好:患者完成了大约 11 个月(15 个周期)的治疗持续时间:患者维持了 PR 25+ 治疗结束后数月的研究表明,在45.9个月以上的时候,患者维持了反应,如PI减少/消退的病变转移所观察肝脏病变肠系膜病变患者无法耐受Ipilimumab且进展良好,转移性疾病预后不佳,有效治疗选择有限,下一步将讨论临终关怀问题
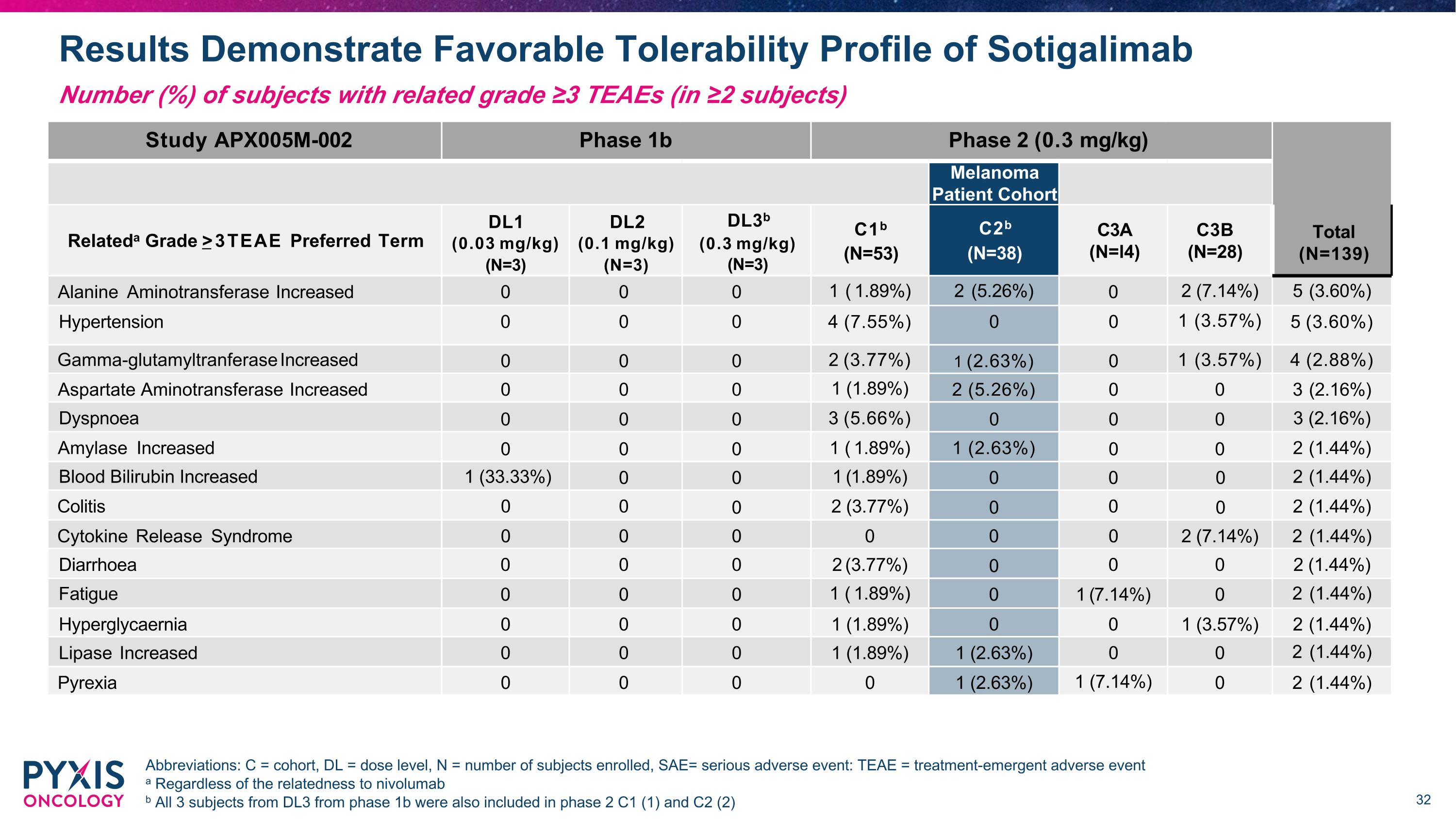
结果显示Sotigalimab具有良好的耐受性简称:C = 队列,DL = 剂量水平,N = 入组受试者数量,SAE= 严重不良事件:TEAE = 治疗紧急不良事件 a 无论与 nivolumab 的相关性如何,1b 期 DL3 的所有 3 名受试者也被纳入第 2 期 C1 (1) 和 C2 (2) 受试者人数 (%) 相关等级 ≥3 TEAE(在 ≥ 2 名受试者中)研究 APX005M-002 1b 期 2 期(0.3 mg/kg)总计(N = 139)黑色素瘤患者队列相关等级 > 3 TEAE 首选术语 DL1(0.03 mg/kg)(N = 3)DL2(0.1 mg)/kg) (N=3) DL3b (0.3 mg/kg) (N=3) C1b (N=53) C2b (N=38) C3A (n=L4) C3B (N=28) 丙氨酸氨基转移酶升高 0 0 0 1 (1.89%) 2 (7.26%) 0 2 (7.14%) 5 (3.60%) 高血压 0 0 0 4 (7.60%) 55%) 0 0 1 (3.57%) 5 (3.60%) gamma-谷氨酰转移酶增加 0 0 0 2 (3.77%) 1 (2.63%) 0 1 (3.57%) 4 (2.88%) 天冬氨酸氨基转移酶增加 0 0 0 1 (1.89%) 2 (5.26%) 0 3 (2.16%) 呼吸困难 0 0 0 0 3 (5.66%) 6%) 0 0 0 3 (2.16%) 淀粉酶增加 0 0 0 1 (1.89%) 1 (2.63%) 0 0 2 (1.44%) 血液胆红素增加 1 (33.33%) 0 0 1 (1.89%) 0 0 2 (1.44%) 0 0 2 (1.44%) 结肠炎 0 0 0 2 (3.77%) 0 0 00 2 (1.44%) 细胞因子释放综合征 0 0 0 0 0 2 (7.14%) 2 (1.44%) 腹泻 0 0 0 2 (3.77%) 0 0 2 (1.44%) 疲劳 0 0 0 1 (1.89%) 0 1 (1.89%) 0 1 (7.14%) 0 2 (1.44%) 高甘油 0 0 0 1 (1.89%) 0 0 1 (3.559%) 0 1 (3.559%) 0 1 (3.559%) 0 1 (3.559%) 0 1 (3.554%) 7%) 2 (1.44%) 脂肪酶增加 0 0 0 1 (1.89%) 1 (2.63%) 0 0 2 (1.44%) Pyrexia 0 0 0 0 1 (2.63%) 1 (7.14%) 0 2 (1.44%) 1 (7.14%) 0 2 (1.44%)
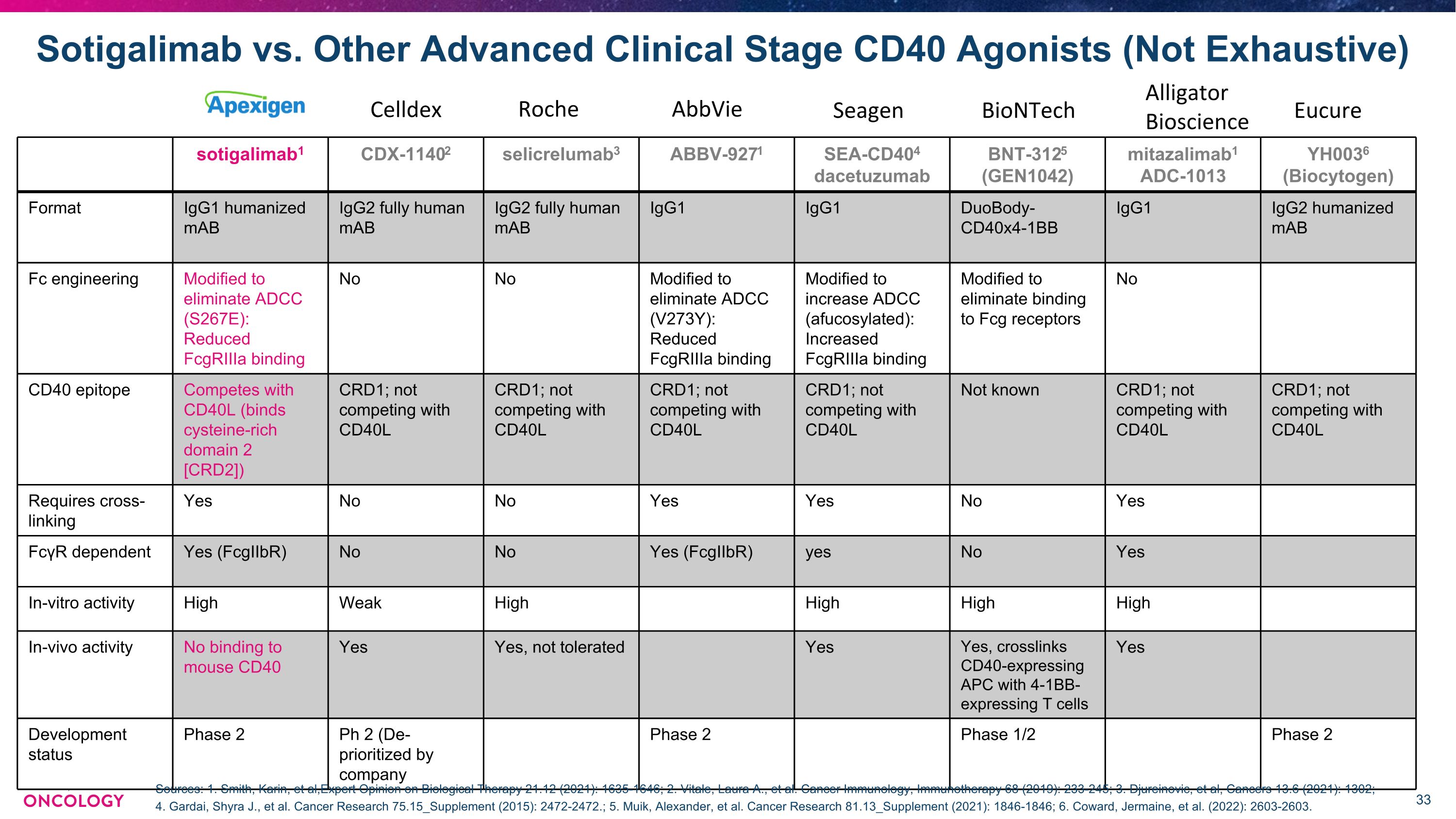
Sotigalimab 对比其他高级临床阶段 CD40 激动剂(未穷尽)sotigalimab1 CDX-11402 selicrelumab3 ABBV-9271 SEA-CD404 dacetuzumab BNT-3125 (GEN1042) mitazalimab1 ADC-1013 YH0036(Biocytogen)格式 igG1 人源化单抗 IgG2 完全人源化 IgG2 完全人源化 IgG1 iGG1 duoBody-40x4-fully 1bb IgG1 IgG2 人源化单抗 Fc 工程经过改良以消除 ADCC (S267E):降低 fcgriIIA 结合无修饰以消除 ADCC (V273Y):降低 fcgriiia 结合以提高 ADCC(afucosylated):增加 fcgriIIA 结合改性以消除结合到 Fcg 受体没有 CD40 表位与 CD40L 竞争(结合富含半胱氨酸的结构域 2) [CRD2]) CRD1;不与 CD40L CRD1 竞争;不与 CD40L CRD1 竞争;不与 CD40L CRD1 竞争;不与 CD40L 竞争未知 CRD1;不与 CD40L CRD1 竞争;不与 CD40L 竞争需要交联是否是否是的依赖于 FcγR 是 (fcGIIBR) 不是 (fcGIIBR) 是的体外活性高弱高高内高 Vivo 活性不与小鼠 CD40 结合是的,不可耐受是的,表达 CD40 的 APC 与表达 4-1bb 的 T 细胞交联是的发育状态 2 期 Ph 2(由公司取消优先级 2 阶段 1/2 期)第 2 阶段 Celldex Roche AbbVie Seagen BioNTech Alligator Bioscience Eucure 来源:1.Smith、Karin等人,《生物疗法专家意见》21.12(2021):1635-1646;2.Vitale、Laura A. 等癌症免疫学,免疫疗法 68(2019):233-245;3.久雷诺维奇等人,《癌症》13.6(2021):1302;4。Gardai、Shyra J. 等癌症研究 75.15_补编(2015):2472-2472。;5.Muik、Alexander 等。癌症研究 81.13_增刊(2021):1846-1846;6.科沃德、杰梅因等人(2022年):2603-2603。