

附录 99.2 2023 年 11 月公司演讲

法律披露本演示文稿包含前瞻性陈述, 所有这些陈述均受本警示性陈述的全面限制。此处包含的许多前瞻性陈述可以通过使用前瞻性词语来识别,例如可能、预期、相信、可能、预期、应该、 计划、打算、估计、将来、潜在和持续等,尽管并非所有前瞻性陈述都包含这些识别词。这些前瞻性陈述包括有关我们的研发项目以及我们当前和未来的临床前研究和临床试验的启动、时间、进展、结果、 和成本的陈述,包括关于启动和完成研究或试验的时间以及相关准备工作的陈述、试验结果公布的 期以及我们的研发计划;我们成功制造临床前药物和候选产品的能力,对于临床试验和更大规模的 商业用途(如果获得批准);我们的第三方战略合作者继续与我们的候选开发和产品相关的研发活动的能力和意愿;我们为完成候选产品的进一步开发和商业化所必需的运营获得 资金的能力;我们获得和维持候选产品的监管批准的能力; 候选产品的市场规模和增长潜力,还有我们的为这些市场服务的能力;我们的财务业绩;以及我们的商业模式的实施,以及针对我们的业务和候选产品的战略计划。除非另有说明,否则这些前瞻性 陈述仅代表截至本演讲之日,我们没有义务更新或修改任何此类陈述以反映本演示之后发生的事件或情况。由于前瞻性陈述 本质上受风险和不确定性的影响,其中一些是无法预测或量化的,有些是我们无法控制的,因此您不应依赖这些前瞻性陈述作为对未来事件的预测。有关 这些风险和不确定性以及其他重要因素的讨论,其中任何一个都可能导致我们的实际业绩与前瞻性陈述中包含的有所不同,请参阅我们最近向美国证券交易委员会提交的10-K表年度报告和10-Q表季度报告中标题为 “风险因素” 的章节,以及我们随后向美国证券交易委员会提交的其他文件中对潜在风险、不确定性和其他重要因素的讨论 交易所委员会。我们的前瞻性陈述中反映的事件和情况可能无法实现或发生,实际结果可能与前瞻性陈述中的预测存在重大差异。我们提醒您不要过分依赖本演示文稿中包含的前瞻性陈述。本演示文稿讨论了正在进行临床前或临床评估且尚未获得美国食品和 药物管理局或任何其他监管机构批准上市的候选产品。在临床研究报告最终确定之前,此处提供的临床试验数据仍有待根据临床现场审计和其他审查流程进行调整。 未就这些候选产品的安全性或有效性作出任何陈述,以供研究此类候选产品的用途。根据任何此类州或其他司法管辖区的证券法,在注册或获得资格认证之前,在任何州或其他司法管辖区的要约、招标或出售为非法的州或其他司法管辖区,本演示不构成卖出要约或征求买入要约,也不得出售 任何此类证券。2
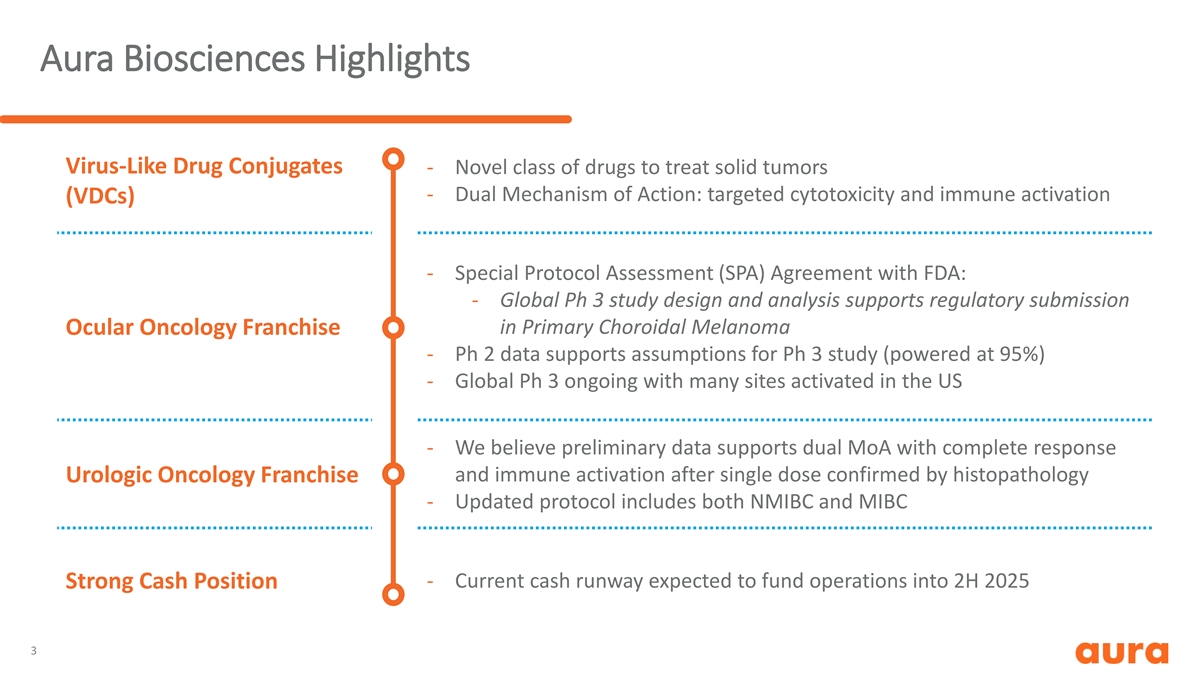
Aura Biosciences重点介绍病毒样药物偶联物-用于治疗实体瘤的新型 药物——双重作用机制:靶向细胞毒性和免疫激活(VDC)——与美国食品药品管理局达成的特别协议评估(SPA)协议:-全球Ph 3研究设计和分析支持初级 脉络膜黑色素瘤眼部肿瘤系列的监管申报——Ph 2数据支持Ph 3研究的假设(功率为95%)-全球Ph 3 正在进行中,美国有许多站点已启用-我们认为初步数据支持双重谅解备忘录,并且经组织病理学泌尿外科肿瘤学特许经营权证实单剂后免疫 激活——更新后的协议包括NMIBC和MIBC——目前的现金流预计将为2025年下半年的运营提供资金强劲的现金状况 3
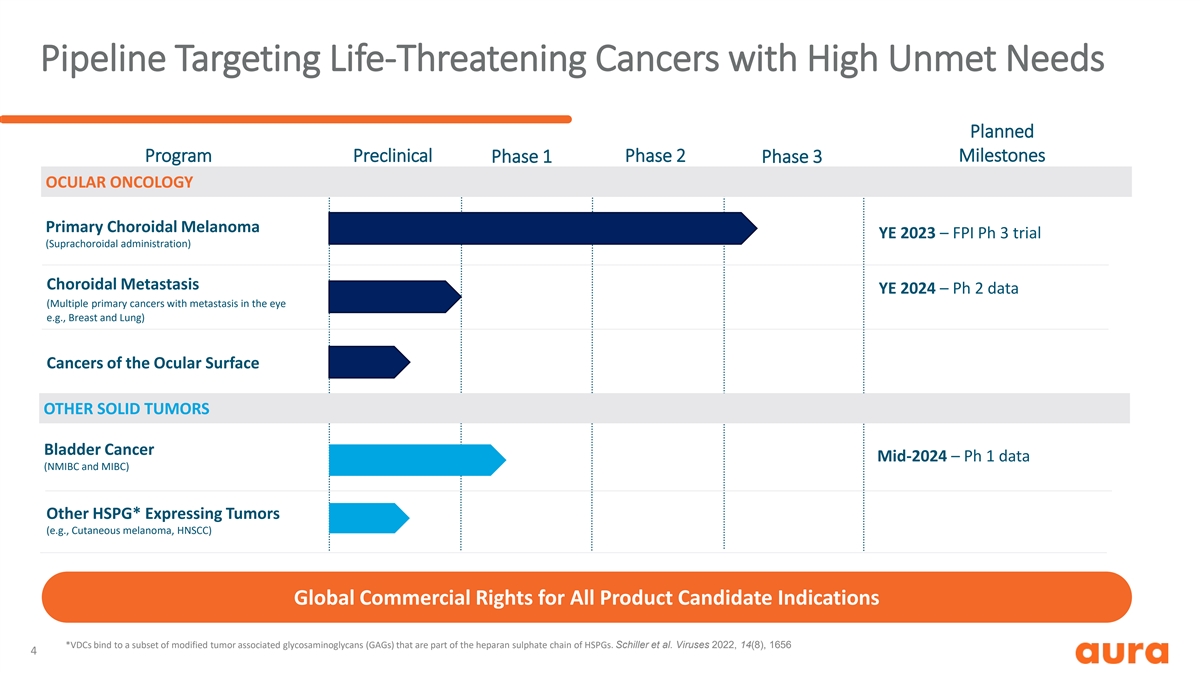
针对需求量高的危及生命的癌症的管线 计划中的里程碑计划临床前 1 期 2 期 3 期眼部肿瘤原发性脉络膜黑色素瘤 YE 2023 — FPI Ph 3 试验(脉络膜上给药)脉络膜转移 YE 2024 — Ph 2 数据(眼部有 转移的多种原发性癌症,例如乳腺和肺部)眼表癌其他实体性膀胱肿瘤癌症 2024 年中期 — Ph 1 数据(NMIBC 和 MIBC)其他 HSPG* 表达肿瘤(例如皮肤黑色素瘤、HNSCC)所有 产品的全球商业权候选适应症 *VDC 与一部分改性肿瘤相关糖胺聚糖 (GAG) 结合,这些糖胺聚糖是 HSPG 硫酸肝素链的一部分。席勒等病毒 2022, 14 (8), 1656 4

靶向肿瘤学平台:病毒样药物偶联物(VDC)潜在的 治疗病毒样颗粒与肿瘤相关 HSPG* 选择性结合到细胞毒性载荷多实体瘤 Cx 病毒样药物病毒样颗粒细胞毒性药物偶联物(VDC)(VLP)潜在的关键区别:效力、 多价结合和选择性 Kines 等人;《国际癌症杂志》,138; 901—911,2016 年 2 月;Kines 等人;分子癌症疗法,2018 年 2 月 17 (2) 日;Kines 等人;癌症免疫学研究,2021 年 5 月 5 *VDC 与 改性肿瘤相关糖胺聚糖 (GAG) 的子集,它们是 HSPG 硫酸肝素链的一部分。席勒等病毒 2022, 14 (8), 1656
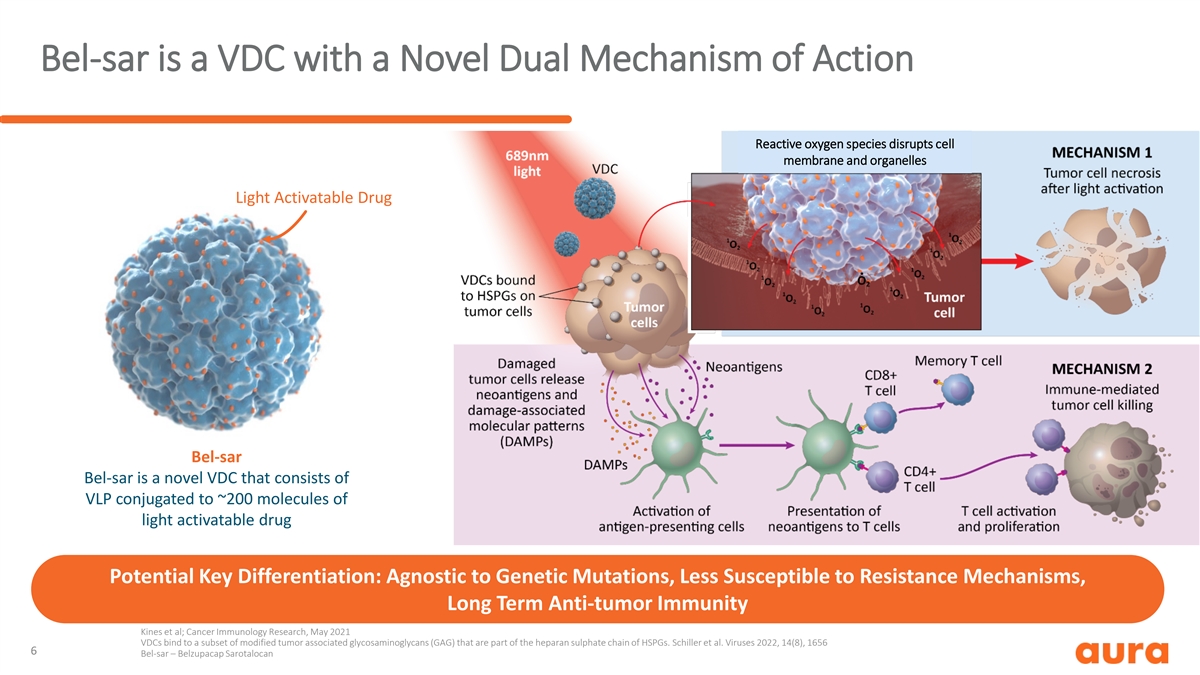
Bel-SAR 是一种具有新型双重作用机制的 VDC 活性氧 物种破坏细胞膜和细胞器光活化药物 Bel-SAR Bel-SAR 是一种新型 VDC,由与约 200 个光活化药物分子偶联的 VLP 组成,潜在的关键区别:不受基因突变影响,不易受耐药机制影响,长期抗肿瘤免疫 Kines 等;癌症免疫学研究,2021 年 5 月 VDC 与一部分改性肿瘤相关糖胺聚糖 (GAG) 结合,这些糖胺聚糖是 HSPG 硫酸肝素链的一部分。 席勒等人。病毒 2022, 14 (8), 1656 6 Bel-sar — Belzupacap Sarotalocan

眼部肿瘤学 Bel-SAR 特许经营店:belzupacap sarotalocan 靶标 适应症:• 早期脉络膜黑色素瘤 • 脉络膜转移 • 其他眼癌 7
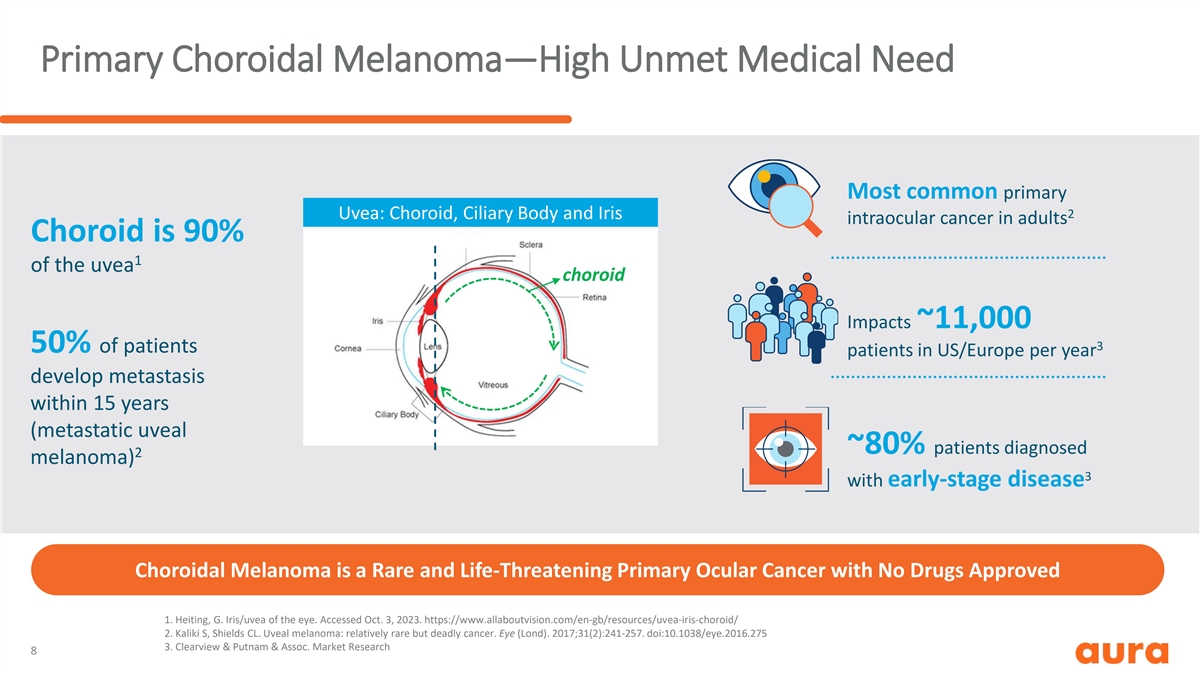
原发性脉络膜黑色素瘤——高未得到满足的医疗需求最常见的 原发性葡萄膜:成人的脉络膜、睫状体和虹膜 2 眼内癌脉络膜是 90% 1 的葡萄膜脉络膜影响约为 11,000 3 50% 的患者在 15 年内出现转移(转移性葡萄膜 ~ 80% 患者 被诊断为 2 黑色素瘤)3 伴有耳朵慢性病脉络膜黑色素瘤是一种罕见且危及生命的原发性眼癌,未获批准任何药物 1.Heiting,G. Iris/UVEA of the eye。已于 2023 年 10 月 3 日访问。 https://www.allaboutvision.com/en-gb/resources/uvea-iris-choroid/ 2.Kaliki S,Shields CL。葡萄膜黑色素瘤:相对罕见但致命的癌症。眼睛(伦敦大学)。2017;31 (2): 241-257. doi: 10.1038/eye.2016.275 3.Clearview & Putnam & Assoc。市场 研究 8

放射治疗是早期疾病的护理标准。脉络膜黑色素瘤的近距离放射治疗需要进行具有不可逆转并发症的侵入性手术 2 (A) 示意图显示了协作性眼部黑色素瘤研究 (COMS) 式斑块使用缝合在巩膜上的钌106斑块近距离疗法 1 对大型 脉络膜黑色素瘤进行手术治疗上面覆盖葡萄膜黑色素瘤(B)术中照片,显示COMS斑块到位。斑块在原位停留 3 1 到 7 天黄斑病变、 白内障、青光眼、玻璃体脱落和玻璃体出血 3 是近距离放射治疗中常见的威胁视力的并发症 1。最新。葡萄膜黑色素瘤的斑块近距离放疗。已于 2023 年 9 月 20 日访问。 https://ykhoa.org/d/image.htm?imageKey=ONC/116591 2.Kim M,Lee SM,Lee。大型脉络膜黑色素瘤的手术治疗。美国验光学会2022年视频节目。2023 年 3 月 1 日。已于 2023 年 9 月 20 日访问。 https://www.aao.org/education/annual-meeting-video/surgical-treatment-of-large-choroidal-melanoma 9 3.Peddada KV、Sangani R、Menon H、Verma V. 眼部黑色素瘤斑块近距离放射治疗的并发症和不良事件。J Contemp 近距离放射疗法。 2019; 11 (4): 392-397. doi: 10.5114/jcb.2019.87407

接受放射治疗后,高达 87% 的患者会失明 对比度在近距离放射治疗后的第一年合法失明(BCVA)的患者比例范围内显著降低,并且继续保持近距离放射治疗后合法盲人 1、d 2 (BCVA ≤20/200) 的患者比例 随时间推移在短距离治疗后的 1、2 ≤20/200) 100% 80% 40% 20% 基准年 0% 第 2 年第 3 年正常视力下降的长期视力对比度灵敏度视力、色觉和对比度灵敏度在正常视力范围内显著下降 治疗后的第一年,并随着时间的推移继续减少 1.Jarczak J、Karska-Basta I、Romanowska-Dixon B. 葡萄膜黑色素瘤的近距离放射治疗和质子治疗后的视力下降以及对抗这种 并发症的方法,根据最近的出版物。医学(考纳斯). 2023; 59 (6): 1131. 2.Tsui I、Beardsley RM、McCannel TA、Oliver SC 等对脉络膜和 纤体黑色素瘤进行碘125近距离放射三年后的视力、对比敏感度和色觉。Open Ophathalmol J. 2015;9:131-5. 10

放射治疗的益处/风险驱动 早期疾病早期晚期转移性疾病 2 不确定病变和小型 PCM 中型/大型 PCM (~2,000) 1 1 (~8,000) (~2,300) 观察并等待/近距离放射治疗系统化疗近距离放疗:视力丧失/失明 (KIMMTRAK) 不可避免地是可解决的问题由于与治疗相关的视力丧失和严重合并症的风险,人群未接受治疗 1.Clearview & Putnam & Assoc。市场研究 11 2.Kaliki S,Shields CL。葡萄膜黑色素瘤:相对 罕见但致命的癌症。眼部(伦敦大学)。2017;31 (2): 241-257。doi: 10.1038/eye.2016.275 当前患病率:治疗患者美国/欧盟
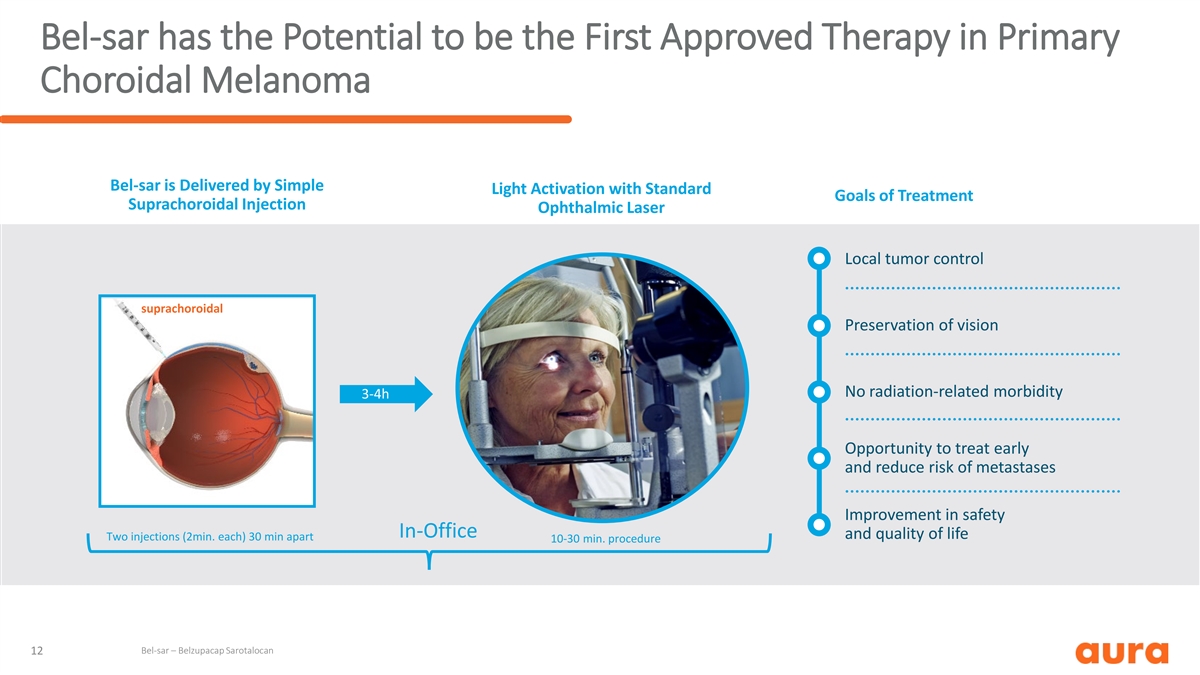
Bel-sar 有可能成为首款获批准的原发性 脉络膜黑色素瘤疗法 bel-SAR 通过简单的光激活提供,具有治疗的标准目标眼科激光局部肿瘤控制脉络膜上腔保持视力无辐射相关发病率 3-4h 机会 早期治疗并降低转移风险改善办公室安全性和生活质量两次注射(2 分钟)每) 间隔 30 分钟 10-30 分钟手术 Bel-sar — Belzupacap Sarotalocan 12

眼部肿瘤特许经营权代表着数十亿美元的潜在市场机会 每年约 66,000 名患者/年 11,000 名患者/年眼部肿瘤特许经营权总潜在市场(美国/欧盟)每年诊断的脉络膜黑色素瘤患者(美国/欧盟)3 1 ~35,000 名患者/年 11,000 名患者当前的放射治疗 ~ 80% 患者的眼表癌脉络膜黑色素瘤的治疗是确诊后,约 87% 的患者在早期阶段会出现数十亿美元的严重不可逆视力丧失(不确定病变(IL)和小肿瘤)市场 机会
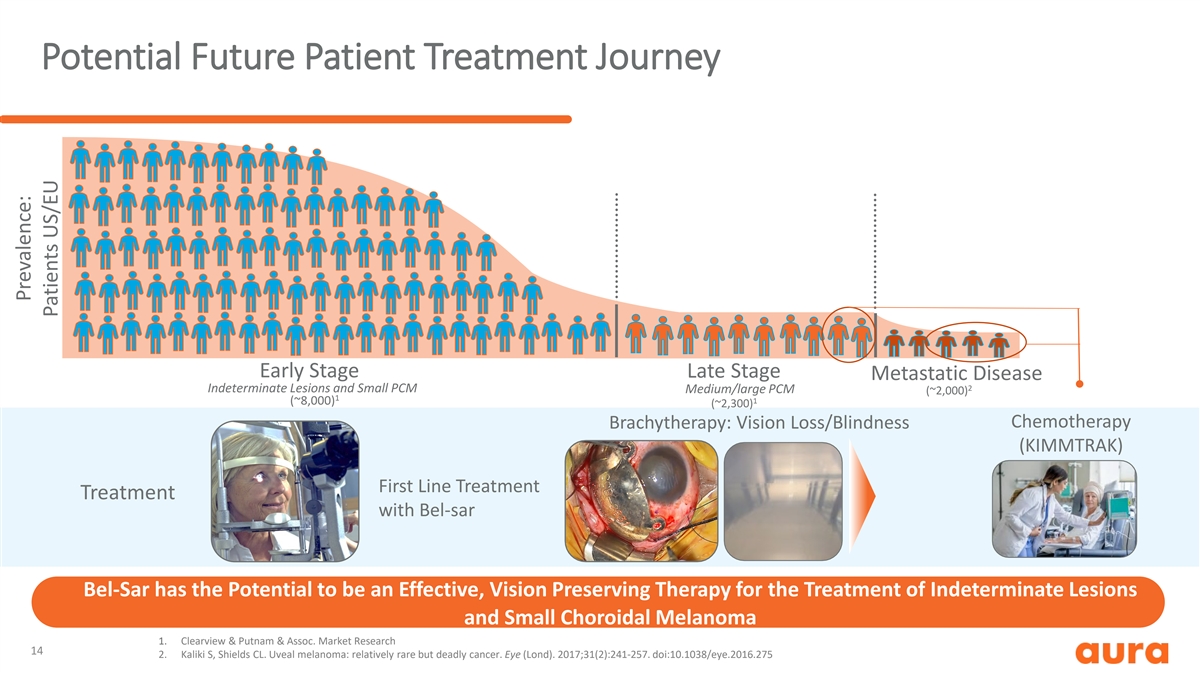
潜在的未来患者治疗历程早期晚期 转移性疾病 2 不确定病变和小中型/大型 PCM (~2,000) 1 1 (~8,000) (~2,300) 化疗近距离放疗:Bel-SAR Bel-Sar 的一线治疗有可能成为治疗不确定病变的 有效视力保持疗法和小脉络膜黑色素瘤 1.Clearview & Putnam & Assoc市场研究 14 2.Kaliki S,Shields CL。葡萄膜黑色素瘤:相对罕见但致命的癌症。Eye (伦敦)。2017;31 (2): 241-257。doi: 10.1038/eye.2016.275 患病率:患者美国/欧盟

Bel-sar 在治疗 早期疾病方面表现出良好的形象 Darovasertib + Crizotinib 1 KIMMTRAK Bel-Sar 2 组合不良事件或不良反应任何等级任何级别*细胞因子释放综合征 89% 未披露 0% 皮疹 83% 未披露 0% 瘙痒 69% 未披露 0% 疲劳 64% 40% 恶心 0% 79% 0% 呕吐未披露 52% 0% 寒战 48% 未披露 0% 减退/色素沉着 47% 未披露 0% 腹痛 45% 未披露 0% 水肿 45% 57% 0% 痤疮样皮炎不 已披露 44% 0% 低血压未披露 34% 0% 低白蛋白血症未披露 32% 0% 头晕未披露 28% 0% 1。Immunocore 公司介绍。2023 年 8 月。幻灯片 12。 https://ir.immunocore.com/static-files/415c5cbb-caae-4ffa-9beb-cb40cfcfc132 2.IDEAYA 临床最新简报。2023 年 4 月 24 日。幻灯片 10。注意:本演示文稿中的某些数据基于跨试验比较,并非基于任何 头对头临床试验。交叉试验比较本质上是有限的,可能暗示误导性的相似或差异。正面比较的结果可能与此处列出的结果有显著差异。15 *幻灯片 22 中显示了 正在进行的使用 bel-sar 进行的 Ph2 研究的安全结果

脉络膜黑色素瘤 Ph 2 数据 16
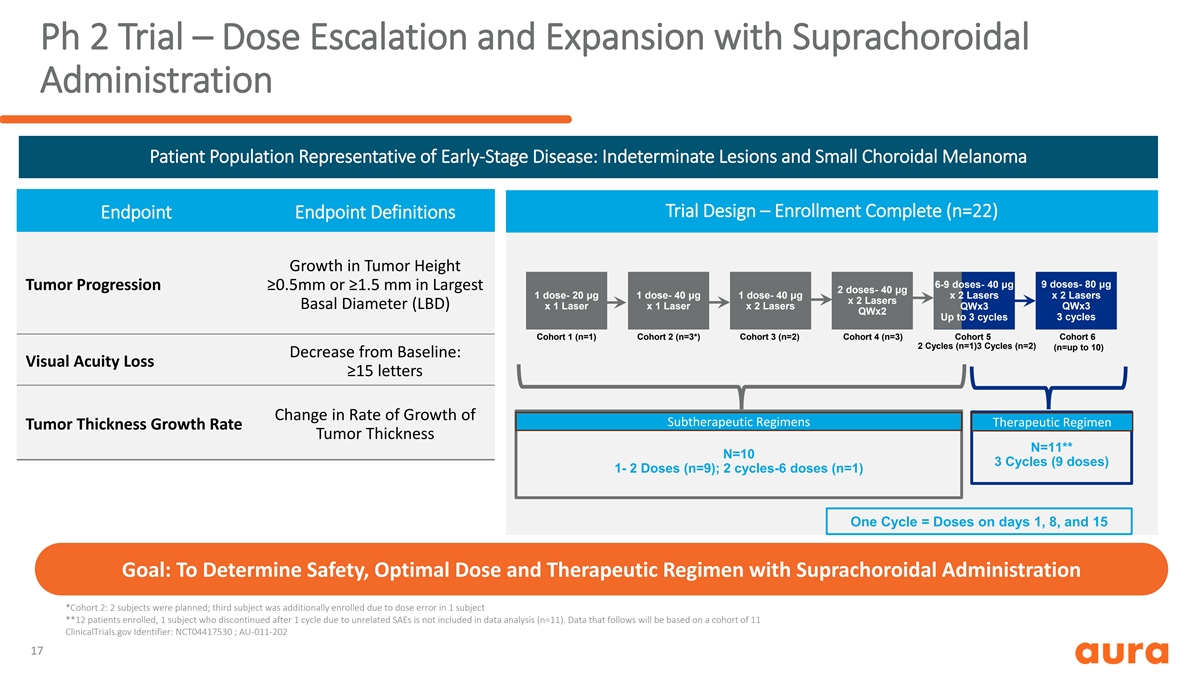
Ph 2 试验 — 剂量递增和扩大,使用上腔体 给药患者群体代表性早期疾病:不确定病变和小脉络膜黑色素瘤试验设计 — 注册完成 (n=22) 终点定义肿瘤高度增长 9 剂量-80 μg 6-9 剂量-40 μg 肿瘤进展 ≥0.5mm 或 ≥1.5 mm,最大剂量 2 剂-40 μg 1 剂量-20 μg 1 剂量-20 μg 40 μg 1 剂量-40 μg x 2 激光器 x 2 个激光器基础直径 (LBD) x 1 激光 x 1 个激光 x 2 个激光器 qwx3 qwx2 最多 3 个周期 3 个周期 3 个周期队列 1 (n=1) 队列 2 (n=3*) 队列 3 (n=2) 队列 4 (n=3) 队列 6 2 个周期 (n=1) 3 个周期 (n=2)(n = 最多 10)较基线下降:视力丧失 ≥ 15 个字母 亚治疗方案生长速度的变化治疗方案肿瘤厚度增长率肿瘤厚度 N=11** N=10 3 个周期(9 剂量)1-2 剂量(n=9);2 个周期-6 剂量(n=1)一个周期 = 第 1、8 和 15 天的剂量目标:确定安全性、最佳剂量和 使用上络膜给药的治疗方案 *队列 2:计划了 2 名受试者;第三名受试者由于剂量而额外入组1 名受试者的错误 **12 名入组患者,1 名因无关的 SAE 而在 1 个周期后停止治疗的受试者 不包括在数据分析中(n=11)。以下数据将基于 11 个 ClinicalTrials.gov 组成的队列标识符:NCT04417530;AU-011-202 17

观察到较高的肿瘤控制率 — 在 12 个月内可持续 向上剂量反应:> 90% 已完成 12 个月亚治疗与治疗方案患者总数肿瘤控制剂量/方案 (n) 率 100% 亚治疗方案 80% 80% 单剂量最多 2 个周期 10 20% (2/10) 60% 治疗方案 3 个周期 (n=11) 11 73% (8/11) 40% 3 个周期和 Ph 3 合格 (n=10) * 10 80% (8/10) 20% 20% * 不包括 1 名患有环乳头状肿瘤但不符合 Ph 3 标准的受试者 0% 最多 2 个周期方案 (n=10) 3 个周期方案 (n=10) 肿瘤进展: 变化2023 年 8 月 3 日,存档数据 Aura Biosciences 对于 Ph 3 符合条件且具有活性 生长活跃的患者的治疗方案具有较高的肿瘤控制率和治疗方案;在 2023 年 8 月 3 日的至少一次重复评估中证实了 LBD ≥1.5mm

在使用 治疗方案亚治疗方案(n=10)活性生长和三周期方案(n=10)治疗的 Ph 3 人群中观察到的肿瘤控制率较高的肿瘤控制率在 12 个月内肿瘤厚度与基线相比变化 12 个月内肿瘤厚度与基线的变化 2.00 1.75 1.50 1.25 0.00 0.25 -0.50 0 90 180 270 360 450 治疗随访时间框架时间框架有入院时生长记录的患者 (n=6) 入院时有生长记录的患者 (n=10) 没有 记录的患者入学时生长(n=4)进展定义基于肿瘤厚度(增大 ≥0.5mm)进展定义基于肿瘤厚度(增大 ≥0.5mm)2023 年 8 月 3 日,存档数据 Aura Biosciences Ph 2 临时数据 显示肿瘤控制率为 80%,随访 12 个月时 90% 的患者肿瘤厚度(mm)与基线相比肿瘤厚度(mm)变化 19
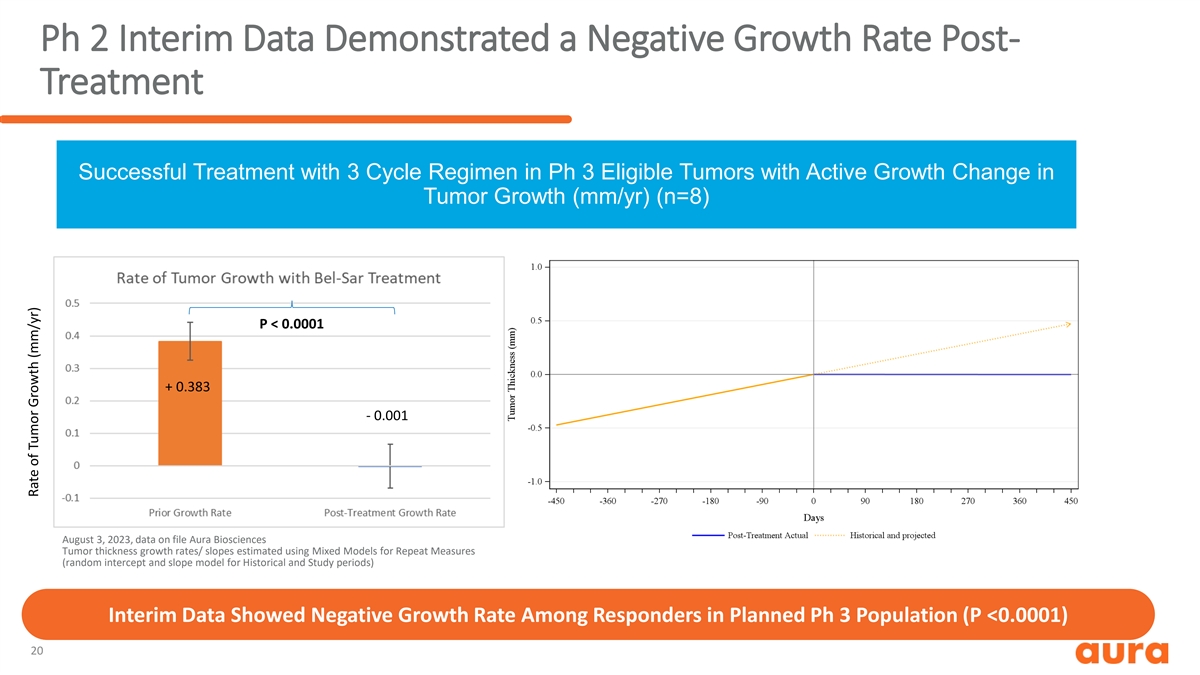
第 2 期中期数据显示,治疗后生长率为负 对符合 Ph 3 条件且肿瘤生长发生活跃变化 (mm/yr) (n=8) P 的肿瘤进行了成功的三周期治疗

尽管 80% 的患者处于 视力丧失的高风险,但仍保持 90% 的视力 > 90% 的患者完成了 12 个月。视力总患者失败率保持 Ph3 合格人群中 BCVA 的中位数变化 (n) (n) 对接受治疗方案的患者 (n=10) 所有剂量队列 3 1 所有 接受治疗的患者 22 1 96% -1 亚治疗 -3 -5 最多 2 个周期的单剂量 10 0 100% -7 治疗方案 -9 -11 3 个周期 (n=11) 11 1 91% -13 3 个周期且符合 Ph 3 个周期 (n=11) =10) * -15 10 1 90% 0 3 6 9 12 *不包括一名患有环乳头状肿瘤 但不符合 Ph 3 标准的受试者月视力下降定义基于 ETDRS 视力丧失(15 个字母)BCVA 信函分数(距基线 ≥ 15 个字母)2023 年 8 月 3 日,存档数据 Aura Biosciences 90% 视力 保存数据支持成为早期疾病前线治疗的潜力 21 与基线的变化

Ph 2 安全数据支持有可能成为 早期疾病 + 不良事件放射治疗的一线治疗* Bel-Sar 持续 Ph 2 安全结果 SC 给药 + 继发于 AE 的手术(例如白内障)40% + 0% 所有接受治疗的受试者(n=22)放射性视网膜病变 40% + 0% 三级药物/激光 相关不良事件 I 级 > 5% 受试者* 新生血管青光眼 10% 0% 前房干眼症 20% 0% 18% 18% 炎症斜视 2% + 0% 前房细胞 9% 0 9% 视网膜脱离 1-2% 0% 眼痛 9% 9% 眼痛 9% 0% 视力丧失(≥15 个字母)~ 70% ~ 5% + 严重不良事件放射治疗* Bel-Sar 表按严重程度和总体情况显示了与 bel-sar 或激光相关的不良反应的受试者的百分比;AE 大于 1 的受试者被计入最高 严重程度组 *1 名患者中与 bel-sar 或激光相关的治疗紧急不良事件或

随机对照全球 Ph 3 试验 23
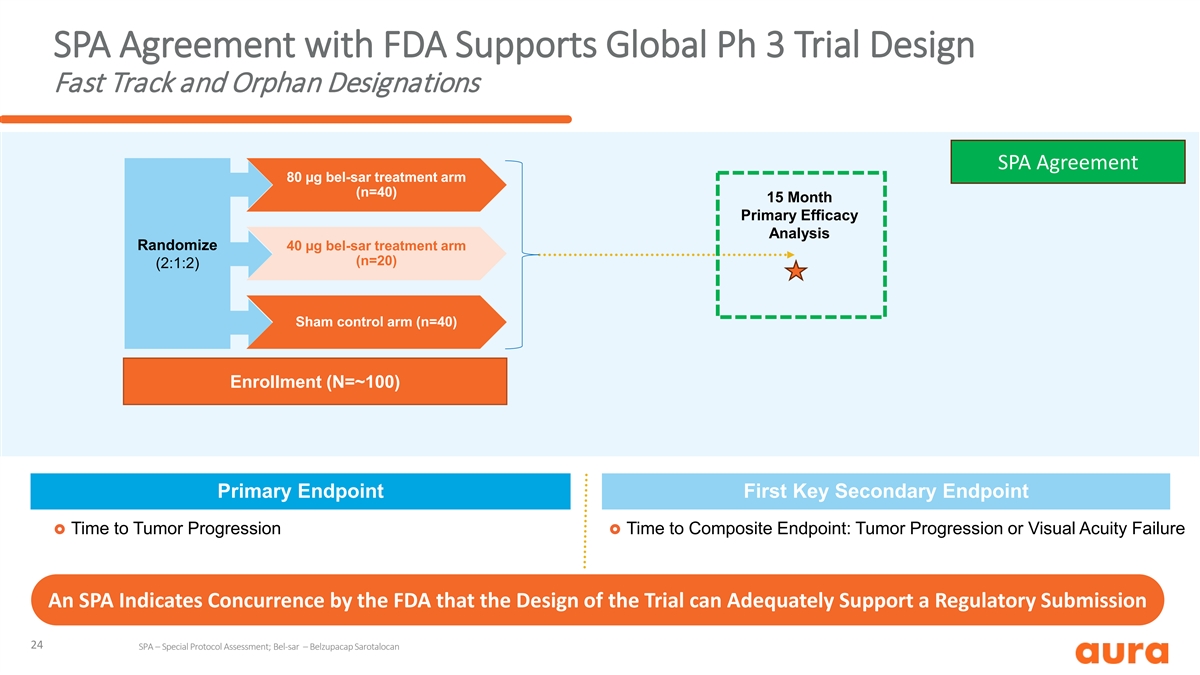
SPA 与 FDA 的协议支持全球 Ph 3 试验设计快速通道和 孤儿名称 SPA 协议 80 µg bel-sar 治疗组 (n=40) 15 个月主要疗效分析随机化 40 µg bel-sar 治疗组 (n=20) (2:1:2) Sham 对照组 (n=40) 入组 (N=~100) 主要终点第一关键次要 终点 £ 肿瘤进展时间到复合终点时间:肿瘤进展或视力衰竭 SPA 表示美国食品和药物管理局同意该试验的设计足以支持监管机构提交的文件 24 SPA — 特殊协议评估;Bel-SAR — Belzupacap Sarotalocan
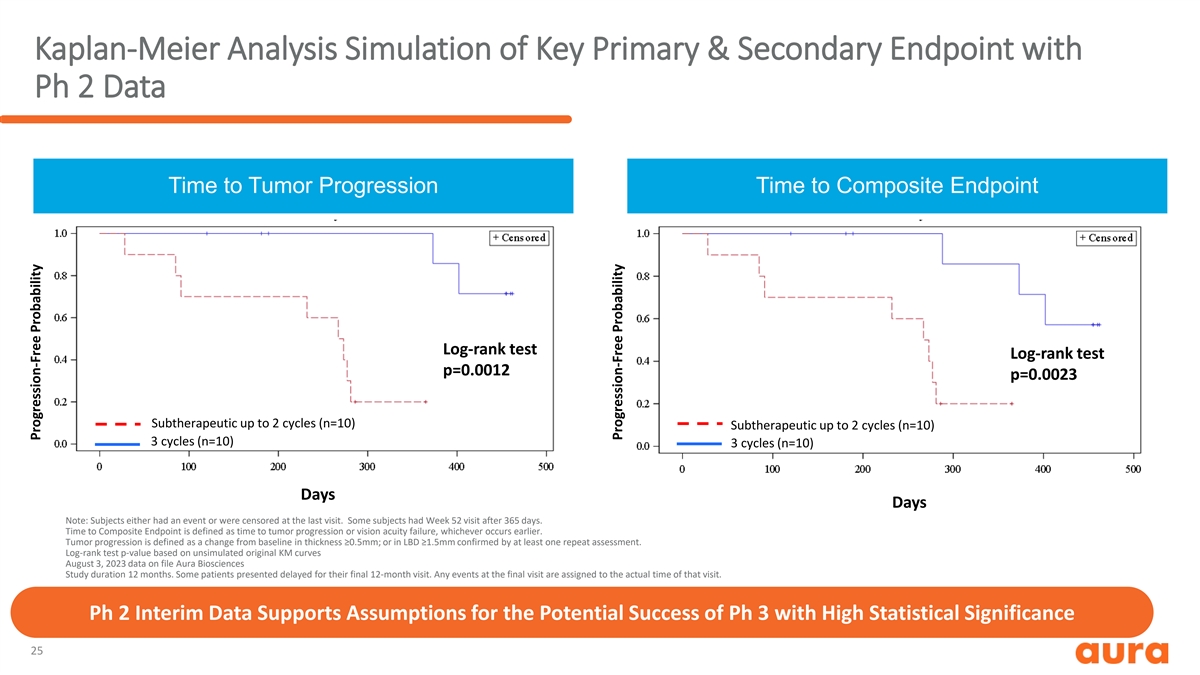
Kaplan-Meier 分析模拟具有 Ph 2 数据的主要和次要 终点肿瘤进展时间到复合终点的时间 log-rank 测试 log-rank 测试 p=0.0012 p=0.0023 亚治疗最多 2 个周期 (n=10) 3 个周期 (n=10) 3 个周期 (n=10) 天注意: 受试者要么有事件要么接受了审查在上次访问时。有些受试者在 365 天后接受了第 52 周的就诊。到达复合终点的时间定义为肿瘤进展或视力衰竭的时间,以较早发生者为准。肿瘤进展 定义为厚度与基线相比的变化 ≥0.5mm;或经至少一次重复评估确认的 LBD ≥1.5 毫米的变化。对数排名测试 p 值基于未模拟的原始 KM 曲线 2023 年 8 月 3 日存档数据 Aura Biosciences Study 持续时间 12 个月。一些患者出现了最后12个月的就诊延迟。最后一次访问中的任何活动都将以该次访问的实际时间为准。Ph 2 中期数据支持假设 Ph 3 的潜在成功率具有高 统计显著性 25 无进展概率无进展概率

支持潜在批准与 监管机构一致的临床终点假设终点定义 Bel-SAR:35% 肿瘤进展肿瘤高度≥0.5mm 或肿瘤进展假设:80% 肿瘤进展大于1.5 mm bel-SAR:15% VA 损失 较基线下降:2% VA 损失 ≥15 个字母肿瘤进展视力损失假设 80% 13% 45% 15% 2% Sham Bel-SAR Sham Bel-SAR 保守假设为 监管的潜力提供了支持提交(第三阶段试验的支持率为 95%)注:肿瘤高度是肿瘤厚度的代名词;VA — 视力;Bel-sar — Belzupacap Sarotalocan 26 复合终点

脉络膜转移 27

脉络膜转移是未得到满足的高度医疗需求标准是 每日放射治疗源自多个持续4周的原发癌乳腺皮肤(例如乳房和肺癌)40-53% 2% 20,000/年眼睛在美国肾脏确诊的肺部 20-29% 2% 88% 伴有脉络膜位置 GI 前列腺 72% 单侧和孤立性 4% 视力 丧失和辐射相关的 2% 并发症脉络膜转移导致视力下降以及抗击转移癌症患者的生活质量下降Mathis等人脉络膜转移的新概念,视网膜和眼科研究进展 (2019),Cohen,《眼部转移》,《眼部转移》(2014),Shields等人。对 520 只有 28 个葡萄膜转移的眼睛进行了调查。眼科(1997),纳马德等人。来自非小肺癌的双侧脉络膜转移,肿瘤医学病例报告(2014)。

脉络膜转移 — Ph 2 试验设计研究设计 (n=12*) 队列 1a 队列 2a 队列 3a 队列 3a 队列 3b N=3 患者 N=3 患者 N=3 患者 N=3 患者 80µg x 2L 140µg x 2L 200µg x 2L 1 周期 1 个周期 1 个周期 2 个周期研究目标研究人群 • 安全/DLT • 单侧单灶脉络膜转移的患者 • 疗效 • 乳房或肺部原发性 • 脉络膜肿瘤进展 • 并发全身性无变化 • 计划使用脉络膜肿瘤生长速率药物 • 视力改善亮点:一个月后的主要终点-治疗;肿瘤萎缩的可能性;美国食品药品管理局肿瘤学部 29 *3+3 设计。每个队列将至少有3名患者,最多6名患者。
泌尿外科肿瘤学 Bel-sar INN:belzupacap sarotalocan 靶标 适应症:膀胱癌 30

膀胱癌是未得到满足的高度医疗需求 61,000 20,000 ~500,000 1 1 2 美国每年新增病例/年全球新增病例/年肌肉浸润性膀胱癌未满足的需求复发、多次 TURBT 手术、疾病进展、 膀胱/膀胱切除术流失、疾病进展、转移损失和膀胱/囊肿存活率 Tomy 31 1.Putnam & Assoc。流行病学分析 2.Campbell-Walsh-Wein 泌尿外科,2021 年,第 12 版;第 137 章,第 3112 页

Bel-Sar 有可能成为与 TURBT 辅助泌尿科医生治疗联合使用的最前线 Bel-SAR 尿液内复发免疫疗法 (Keytruda) 辅助性尿液内复发免疫疗法 (Keytruda) 辅助 泌尿科医生治疗 bel-SAR 膀胱内注射疗法 + 诊断和基因疗法膀胱切除术卡介苗 >6 tx 卡介苗难治性 (Adstiladrin) 尿中血液治疗计划 TURBT 全身免疫疗法静脉注射 (Keytruda) 化疗添加 bel-SAR 罐 有可能:• 预防 TURBT 后复发 • 避免需要辅助化疗 • 避免需要六个周期的卡介苗 • 提高检查点抑制剂 BCG — Bacillus Calmette Guerin 的疗效;• 预防 膀胱切除术 32 TURBT-膀胱肿瘤经尿道切除术说明当前膀胱癌膀胱癌患者旅程的示意性未来膀胱癌患者旅程
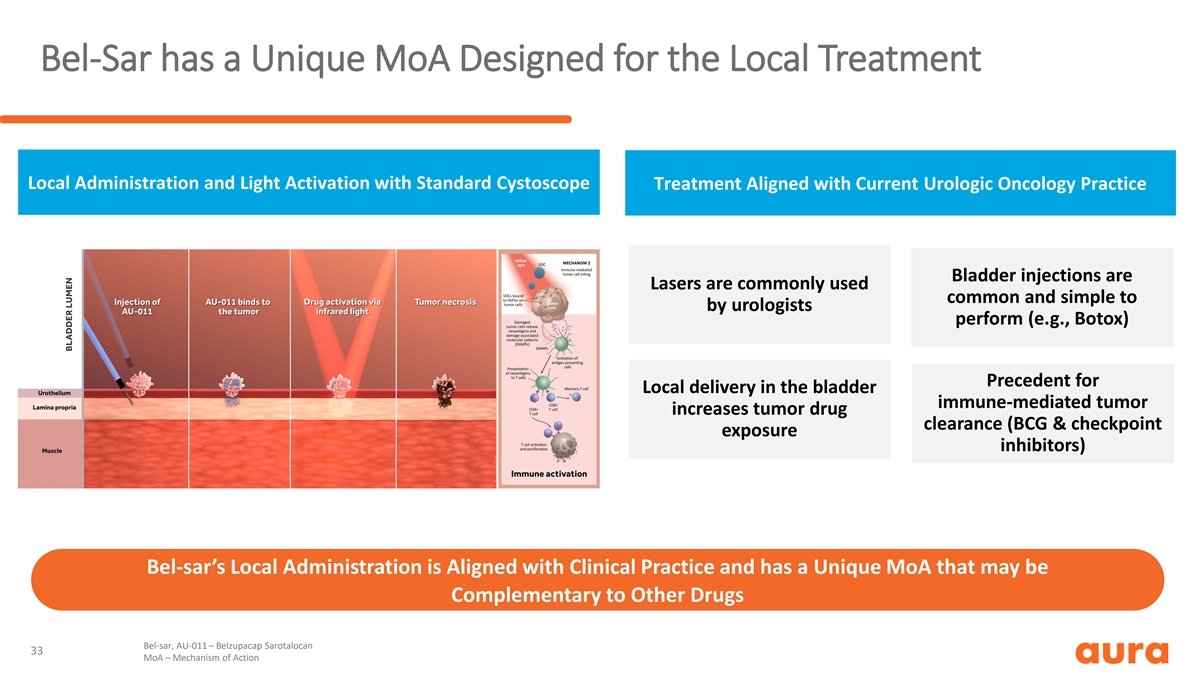
Bel-Sar 拥有独一无二的 MoA,专为局部治疗局部 给药和光激活而设计,符合当前泌尿外科肿瘤学实践膀胱注射通常是泌尿科医生常用的(例如肉毒杆菌毒素)膀胱免疫介导的肿瘤局部 递送可提高肿瘤药物清除率(卡介苗和检查点暴露抑制剂)Bel-SAR 的地方管理部门赞同临床实践且具有独特的 MoA,可能与其他 药物互补 bel-sar,AU-011 — Belzupacap Sarotalocan 33 MoA — 作用机制

旨在评估安全性、可行性和 MoA 研究的 Ph 1 试验 目标研究设计和目标 (n=19) • 安全性/DLT • 技术可行性已完成第 1 部分 (n=5) • bel-sar 的焦点分布 Bel-sar 仅有治疗相关的 Bel-SAR • 局灶坏死不良事件、严重不良事件、严重不良事件 事件或剂量-• 在 5 名患者研究群体中发现了免疫激活限制毒性的标志物 TURL • BT 和膀胱切除术患者第 2 部分 (n=14) 正在进行中 • NMIBC 和 MIBC 患者 bel-SAR + 聚焦光激活 Ph 1 数据有望为未来提供支持开发用于治疗 NMIBC 和 MIBC Bel-SAR 的 Bel-SAR — Belzupacap Sarotalocan MoA — 作用机制 34 TURBT-经尿道膀胱肿瘤切除术
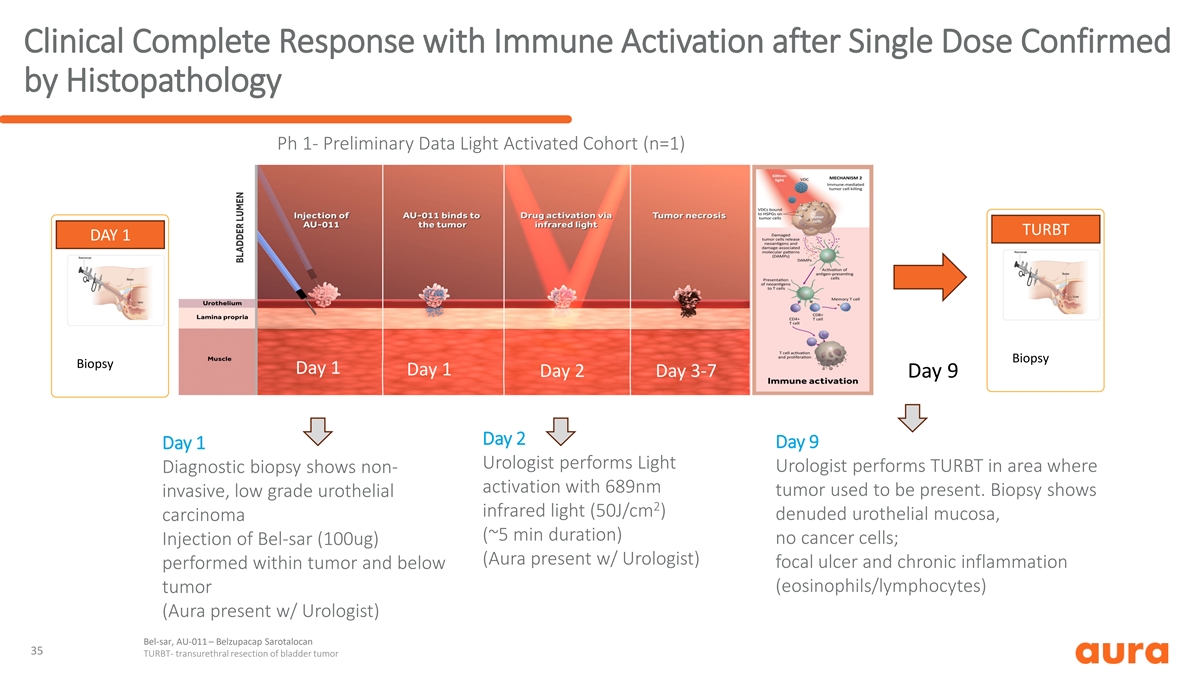
经组织病理学 Ph 1 确认单剂量 后免疫激活的临床完全反应-初步数据光激活队列 (n=1) TURBT 第 1 天活检第 1 天 2 天 3-7 天 9 天第 2 天第 9 天第 1 天第 1 天泌尿科医生在诊断活检显示有 689nm 肿瘤存在非 活化的区域进行轻度泌尿外科医生 TURBT。活检显示侵入性、低等级尿路上皮 2 红外光 (50J/cm) 裸露的尿路上皮粘膜、癌(持续约 5 分钟)无癌细胞;注射 Bel-SAR(100ug)(Aura 与泌尿科医生一起出现) 局灶性溃疡和慢性炎症发生在肿瘤内及以下(嗜酸性粒细胞/淋巴细胞)肿瘤(Aura 在泌尿科医生的陪同下)) Bel-sar,AU-011 — Belzupacap Sarotalocan 35 TURBT-经尿道膀胱肿瘤切除术

治疗前活检(第 1 天)显示乳头状尿路上皮癌 H&E Stain 乳头状尿路上皮癌乳头状癌(Ta)注射前膀胱活检显示低度乳头状尿路上皮癌;非侵入性。36

单剂量 bel-SAR 治疗和免疫激活后所有癌细胞消失后,组织病理学证实临床完全反应免疫浸润坏死治疗后 TURBT 显示坏死、炎症浸润,无残留癌。圆圈区域显示 坏死区域;箭头表示炎性浸润边缘。首例患者单剂量治疗后肿瘤细胞缺失可完全缓解的证据 37
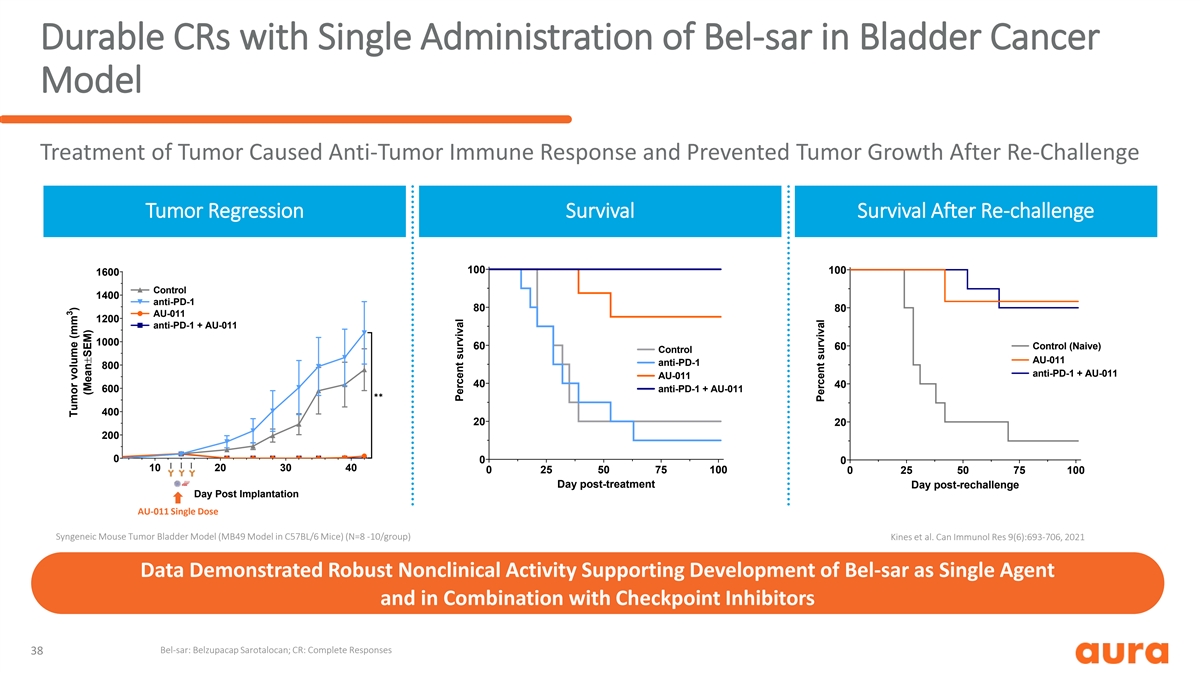
膀胱癌单次给药 Bel-SAR 的耐用 CR 肿瘤的模型治疗可引起抗肿瘤免疫反应并阻止肿瘤生长再挑战肿瘤回归后的存活率 100 100 1600 对照 1400 抗 PD-1 80 80 AU-011 1200 抗 PD-1 + AU-011 1000 60 60 对照 AU-011 800 抗 PD-1 + AU-011 40 40 600 抗 PD-1 + AU-011 ✱✱ 400 20 200 0 0 0 0 0 10 20 20 0 0 10 20 20 0 0 20 20 0 0 0 20 20 0 0 20 20 0 0 0 20 20 0 0 20 20 0 0 0 20 20 0 0 20 20 0 0 0 20 20 0 0 20 0 0 20 20 0 0 20 0 0 20 20 0 0 20 0 0 20 20 0 0 20 0 0 20 20 0 0 20 0 0 20 20 0 0 30 40 0 25 50 75 100 0 25 50 75 100 治疗后一天再挑战后一天植入后一天 AU-011 单剂量同基因 AU-011小鼠肿瘤膀胱模型(C57BL/6 小鼠中的 MB49 模型)(N=8 -10/组)Kines 等人Can Immunol Res 9 (6): 693-706,2021 年的数据显示出强大的非临床活性支持 Bel-SAR 作为单一药物的开发以及 与检查点抑制剂联合使用 Bel-SAR:Belzupacap Sarotalocan;CR:完全反应 38 3 肿瘤体积 (mm) (平均值±SEM) 存活百分比存活率

战略和关键里程碑 39
Aura Biosciences投资亮点 • 原发性脉络膜 黑色素瘤 • 与美国食品药品管理局的SPA协议支持监管机构申报 • Ph 2数据支持Ph 3研究的假设(支持率为95%)关键亮点 • 膀胱癌 (NMIBC/MIBC)• 我们认为初步数据支持双重谅解备忘录,临床完全反应和免疫激活已得到组织病理学原发脉络膜的证实黑色素瘤:• YE 2023:全球 Ph 3 试验的首位患者剂量预计 临床里程碑脉络膜转移:6-12 个月内 • 2024 年:Ph 2 数据膀胱癌 (NMIBC/MIBC):• 2024 年中期:1 期数据 40


Bel-Sar 在第 3 期符合条件的患者基准特征基准特征中显示出长期持久反应且视力保持不变 符合条件的受试者记录的肿瘤生长是基线时的肿瘤大小 AU-011 治疗周期肿瘤高度 1.03 mm 最大基底直径 (LBD) 6.12 mm 危险因素视网膜下积液 (F) 是的橙色色素 (O) 是的由肿瘤引起的视力下降是的基线 Wk 4 Wk 6 Wk 12 Wk 16 Wk k 30 Wk 39 Wk 52 到 Fovea 的位置距离 0 mm 0 mm BCVA 79 87 84 85 85 80 85 85 80 85 85 85 85 85 85 到视神经的距离(4 个时钟 小时).) 42