| Momentum—pemviduTide 2 期肥胖试验 第 48 周成绩 纳斯达克:ALT 2023 年 11 月 30 日 |
| 前瞻性陈述 安全港声明 本演示文稿由Altimmune, Inc.(“我们”、“我们的”、“Altimmune” 或 “公司”)编写,包括1995年《私人证券诉讼改革法》所指的某些 “前瞻性陈述”,包括但不限于 与未来财务或业务业绩、状况、计划相关的声明前景、趋势或战略以及其他财务 和业务事项,包括但不限于我们的临床资产实现关键里程碑的时机,pemvidutide 2期肥胖症临床试验的结果,我们的候选药物在正在进行和未来的临床试验中的表现,以及 监管机构批准、商业化或销售任何产品或候选药物的前景。此外,当或如果在本新闻稿中使用 词语 “可能”、“可以”、“应该”、“预测”、“相信”、“估计”、“期望”、“打算”、“计划”、“预测” 及与公司相关的类似表述以及 它们的变体可能会识别前瞻性陈述。公司警告说,这些前瞻性陈述受许多假设、风险和不确定性的影响,这些假设、风险和不确定性会随着时间的推移而变化。 可能导致实际结果与前瞻性陈述或历史经验 中讨论的结果存在重大差异的重要因素包括风险和不确定性,包括监管审查延迟、制造和供应链中断、 进入临床场所、入组、对医疗系统的不利影响和全球经济混乱等风险;影响对象 基线特征,包括体重,对未来试验成功的影响以及的可靠性;与之相关的研究结果人类 的安全性以及管理公司候选产品可能产生的不良影响;公司 按预期时间表生产临床试验材料的能力;以及未来产品进步的成功,包括 未来临床试验的成功。有关可能影响公司业务、财务 状况和经营业绩的因素和风险的更多信息载于公司向美国证券交易委员会提交的文件, 包括公司最新的10-K表年度报告以及我们向美国证券交易委员会提交的其他文件 标题下的 “风险因素” 标题下,这些文件可在www.sec.gov上查阅。 2 |
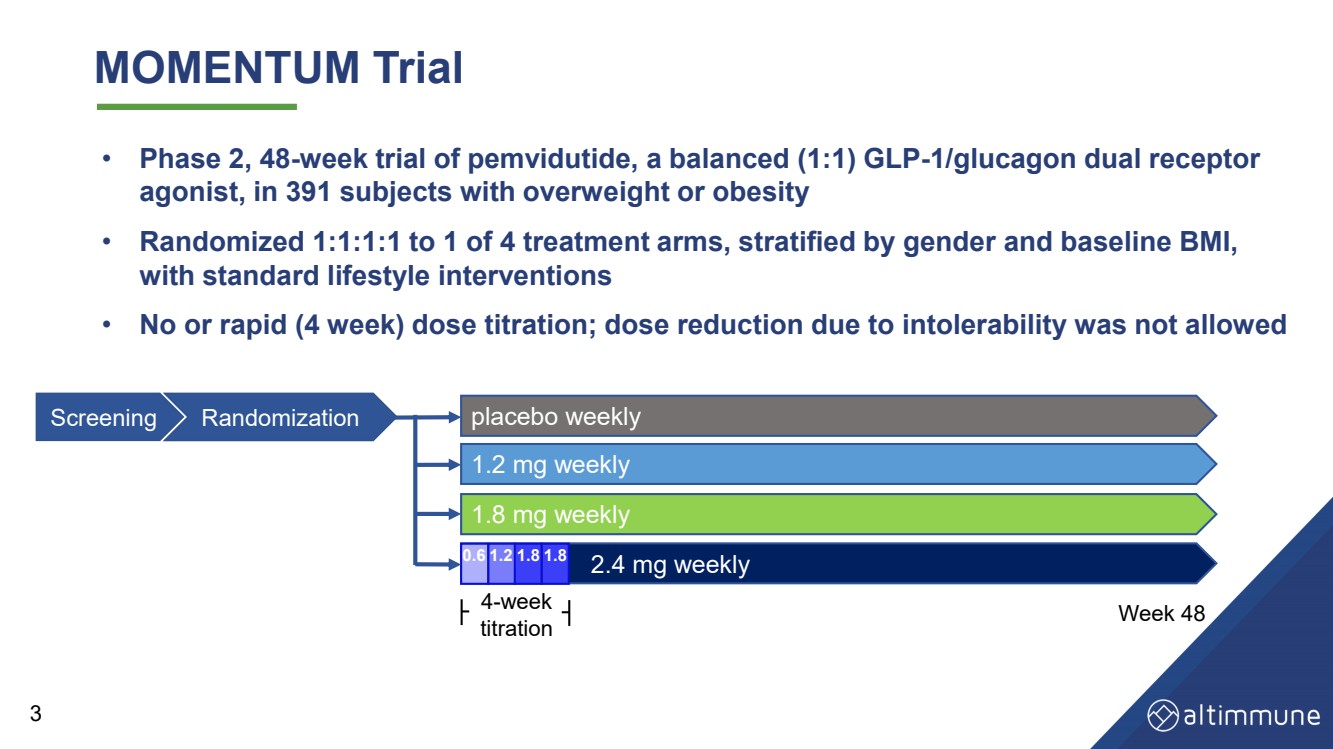
| MOMENTUM 试验 • 针对 391 名超重或肥胖受试者 pemvidutide(一种平衡(1:1)的 GLP-1/Glucagon 双受体 激动剂,为期 48 周的第 2 期试验 • 按性别和基线体重指数分层, 采用标准生活方式干预措施 • 无剂量或快速(4 周)剂量滴定;不允许因不耐受而减少剂量 0。 6 每周 1.8 安慰剂 每周 1.8 mg 2.4 mg 每周 1.2 mg 4 周 滴定第 48 周筛查随机化 0.6 1.2 1.8 1.8 3 |
| 研究人群—关键资格标准 • 18-75 岁的男性和女性 • BMI ≥ 30 kg/m2 或 BMI ≥ 27 kg/m2 且至少有一种肥胖相关合并症 -心血管疾病史 -高血压 -糖尿病前期 -阻塞性睡眠呼吸暂停 • 非糖尿病:Hba1c ≤ 6.0 5%,空腹血糖 ≤ 125 mg/dL • 至少有一次减肥尝试失败 • 至少有大约 25% 的受试者是男性 4 |
| 研究终点 功效 • 主要终点 • 与基线相比体重的相对变化 (%) • 关键次要终点 • 体重减轻 ≥ 5%、≥ 10%、≥ 15% 和 ≥ 20% 的受试者比例 (%) • 血清脂质和血压与基线相比的变化 安全 • 不良事件 (Ae) • 严重不良事件 • 严重不良事件 • 严重不良事件 • 严重不良事件 • 严重不良事件 • 严重不良事件 • 严重不良事件 • 严重不良事件 • br} • 特别关注的不良事件 (AESI) • 心脏不良事件和重大心脏不良事件 (MACE) • 心率 • 葡萄糖动态平衡 耐受性 • 导致停药的不良事件 • 胃肠道 (GI)AeS 5 |
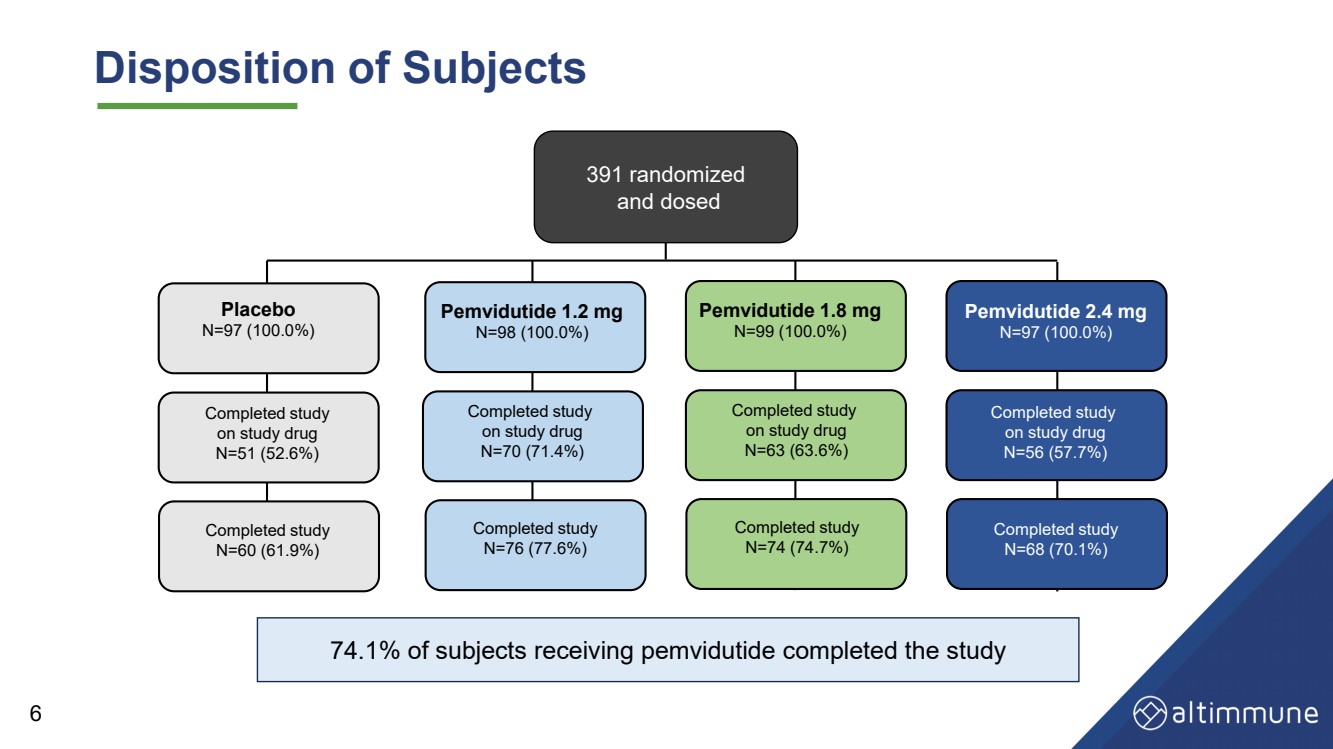
| 受试者 391 随机分配 和剂量 安慰剂 N=97 (100.0%) Pemvidutide 1.2 mg N=98 (100.0%) Pemvidutide 1.8 mg N=97 (100.0%) N=97 (100.0%) 已完成的关于研究药物的研究 N=51 (52.6%) 已完成的关于研究药物 N=70 (71.4%) 已完成的研究 关于研究药物 N=56 (57.7%) 已完成的研究 N=63 (63.6%) 已完成研究 N=63 (63.6%) 已完成研究 N=63 (63.6%) 已完成研究 N=63 (63.6%) 已完成的研究 60 (61.9%) 已完成研究 N=76 (77.6%) 已完成研究 N=68 (70.1%) 已完成研究 N=74 (74.7%) 6 74.1% 的受试者接受 pempiditide 完成了研究 |
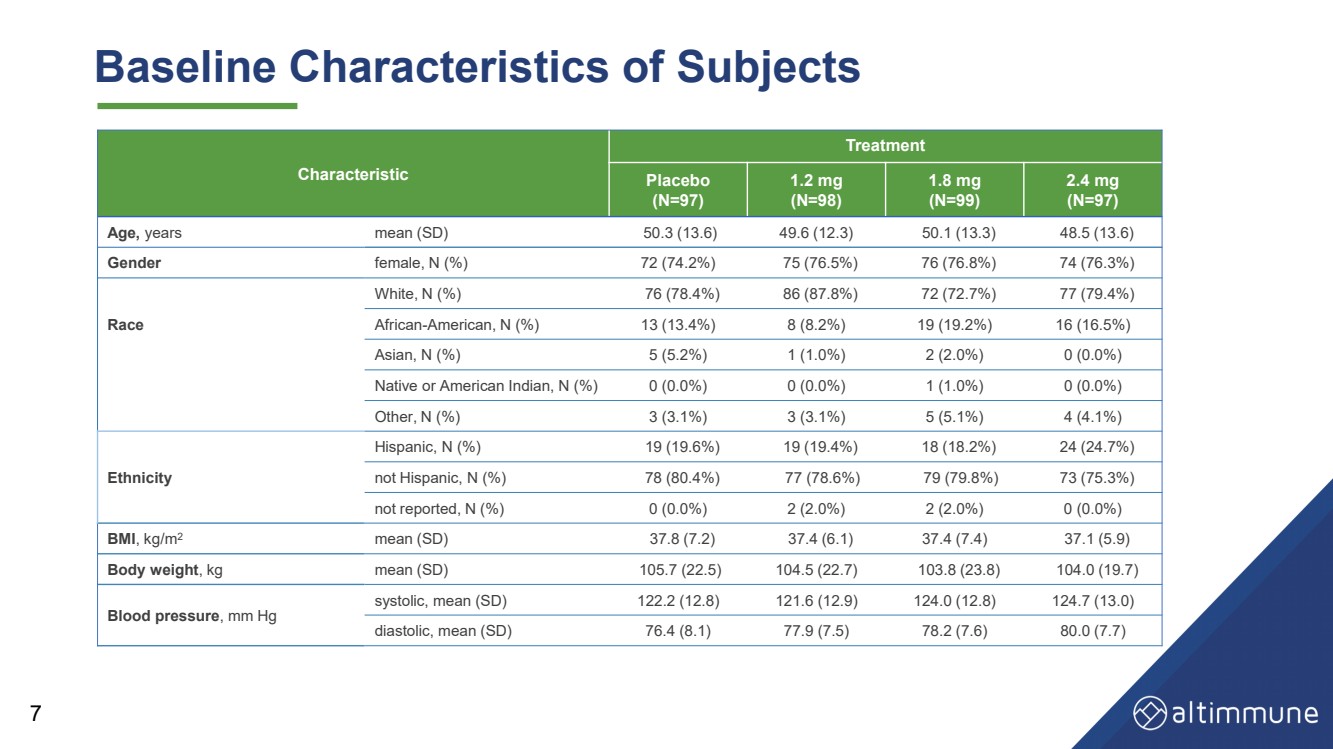
| 受试者的基线特征 7 特征 治疗 安慰剂 (N=97) 1.2 mg (N=98) 1.8 mg (N=99) 2.4 mg (N=97) 平均年龄 (SD) 50.3 (13.6) 49.6 (12.3) 50.1 (13.3) 40.1 (13.3) 40.1 (13.3) 40.1 (13.3) 40.1 (13.3) 40.1 (13.3) 40.1 (13.3) 40.1 (13.3) 40.1 (13.3) 40.8.5 (13.6) 性别女性,N (%) 72 (74.2%) 75 (76.5%) 76 (76.8%) 74 (76.3%) 种族 白人,N (%) 76 (78.4%) 86 (87.8%) 72 (72.7%) 77 (79.4%) 非裔美国人,N (%) 13 (13.4%) 8 (8.2%)) 19 (19.2%) 16 (16.5%) 亚洲人,N (%) 5 (5.2%) 1 (1.0%) 2 (2.0%) 0 (0.0%) 原住民或美洲印第安人,N (%) 0 (0.0%) 0 (0.0%) 1 (1.0%) 0 (0.0%) 其他,N (%) 3(3.1%) 3 (3.1%) 5 (5.1%) 4 (4.1%) 种族 西班牙裔,N (%) 19 (19.6%) 19 (19.4%) 18 (18.2%) 24 (24.7%) 非西班牙裔,N (%) 78 (80.4%) 77 (79.8%) 73 (75.3%) 未报告,N (%)) 0 (0.0%) 2 (2.0%) 2 (2.0%) 0 (0.0%) 体重指数,kg/m2 平均值 (SD) 37.8 (7.2) 37.4 (6.1) 37.4 (7.4) 37.1 (5.9) 体重,kg 平均值 (SD) 105.7 (22.7) 103.8 (23.8) 104.0 (19.7) 血压,mm Hg 收缩压,平均值(SD)122.2(12.8)121.6(12.9)124.0(12.8)124.0(12.8)124.7(13.0) 舒张压,平均值(SD)76.4(8.1)77.9(7.5)78.2(7.6)80.0(7.7) |
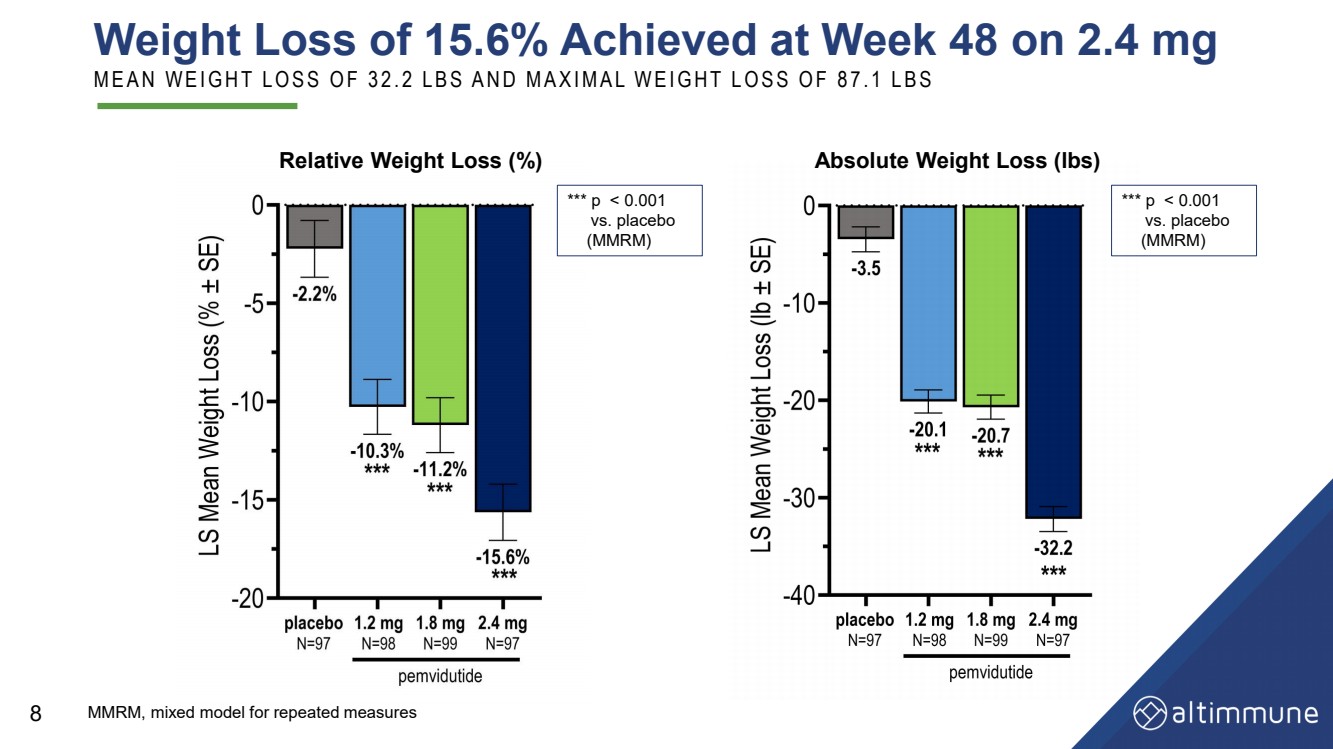
| MMRM,重复测量的混合模型 在第 48 周减重 2.4 mg M E A N W E I G H T L O S S O F 3 2. 2 L B S A N D M A X I M A L W E I G H L W E I G H T L O S S O F 8 7. 1 L B S 8 相对减重 (%) *** p |
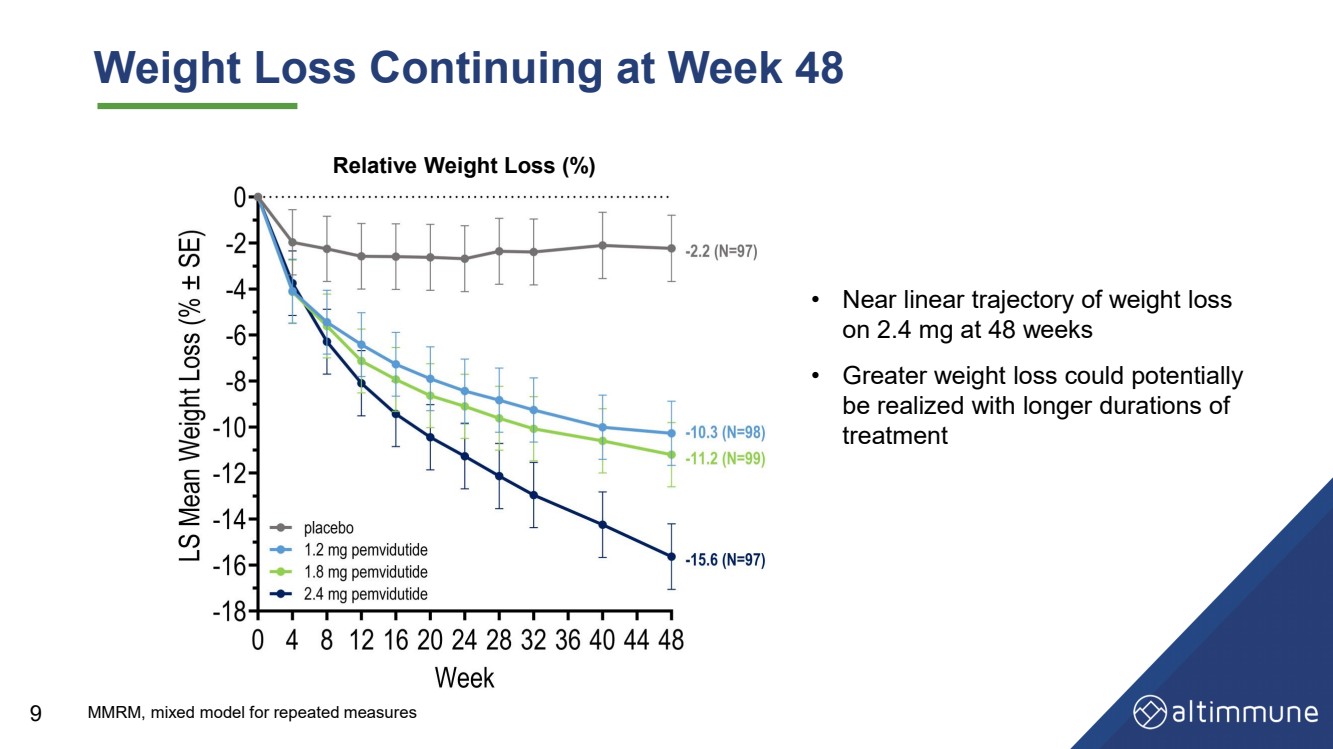
| 体重减轻持续至第 48 周 9 • 48 周减重 2.4 mg 的近线性轨迹 • 更长的 治疗持续时间 有可能实现更大的减肥 相对体重减轻 (%) MMRM,重复测量的混合模型 |
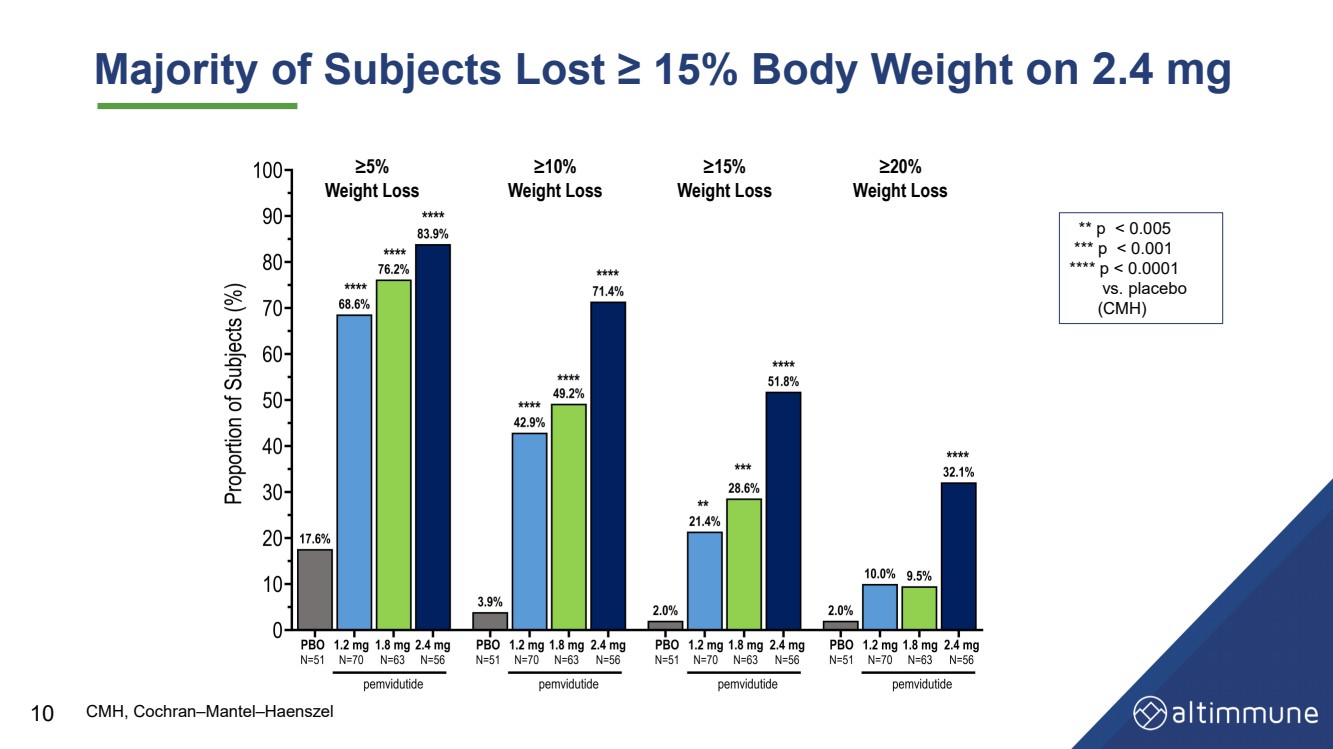
| 大多数受试者服用 2.4 mg 的体重减轻了 ≥ 15% ** p |
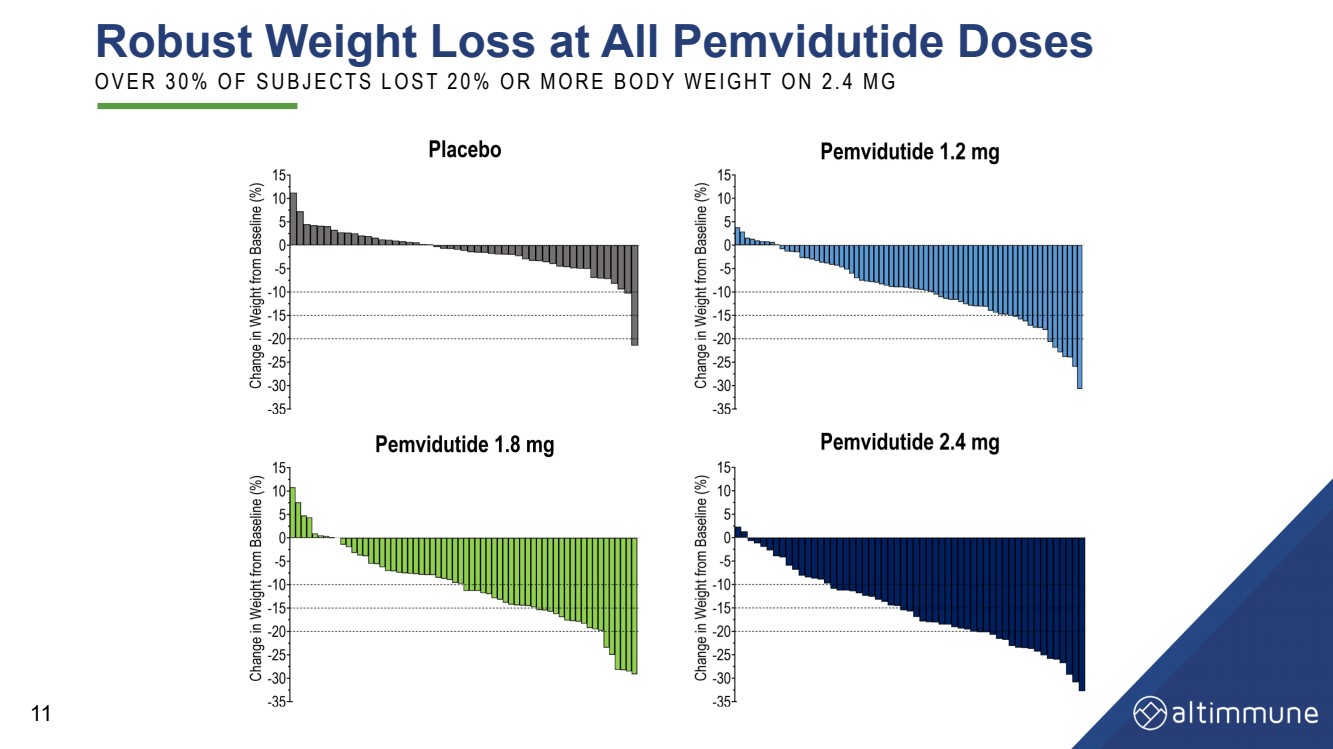
| 所有 PemviduTide 剂量均可有效减肥 O V E R 3 0% O F S U B J E C T S L O S T 2 0% O R M O R E B O D Y W E I G H T O D Y W E I G H T O N 2. 4 M G 11 |
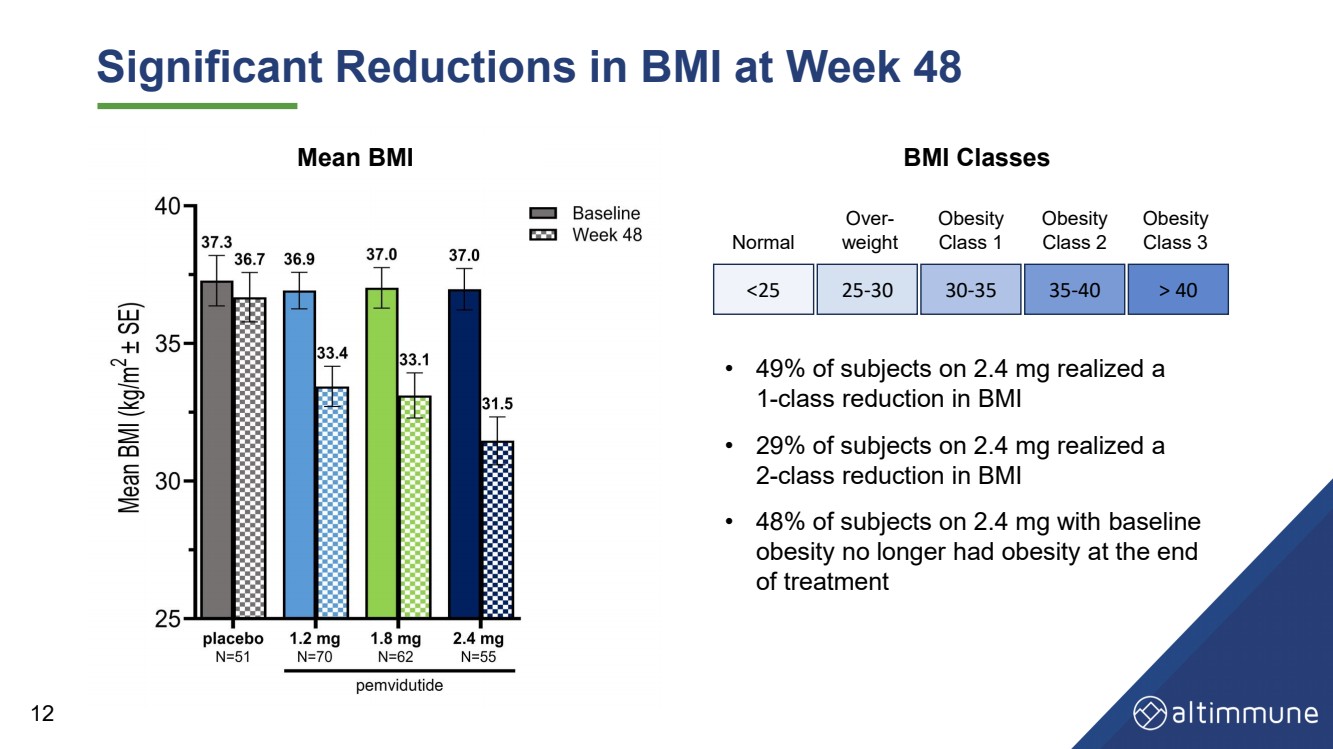
| 第 48 周 BMI 显著降低 12 • 服用 2.4 mg 的受试者中有 49% 实现了 1 类体重指数降低 • 29% 的受试者体重指数降低 2 类 。在基线 肥胖的受试者中,有 48% 在 治疗结束时不再肥胖 体重指数类别 正常 超重 br} 肥胖 1 类肥胖 2 类肥胖 3 类平均体重指数 40 |
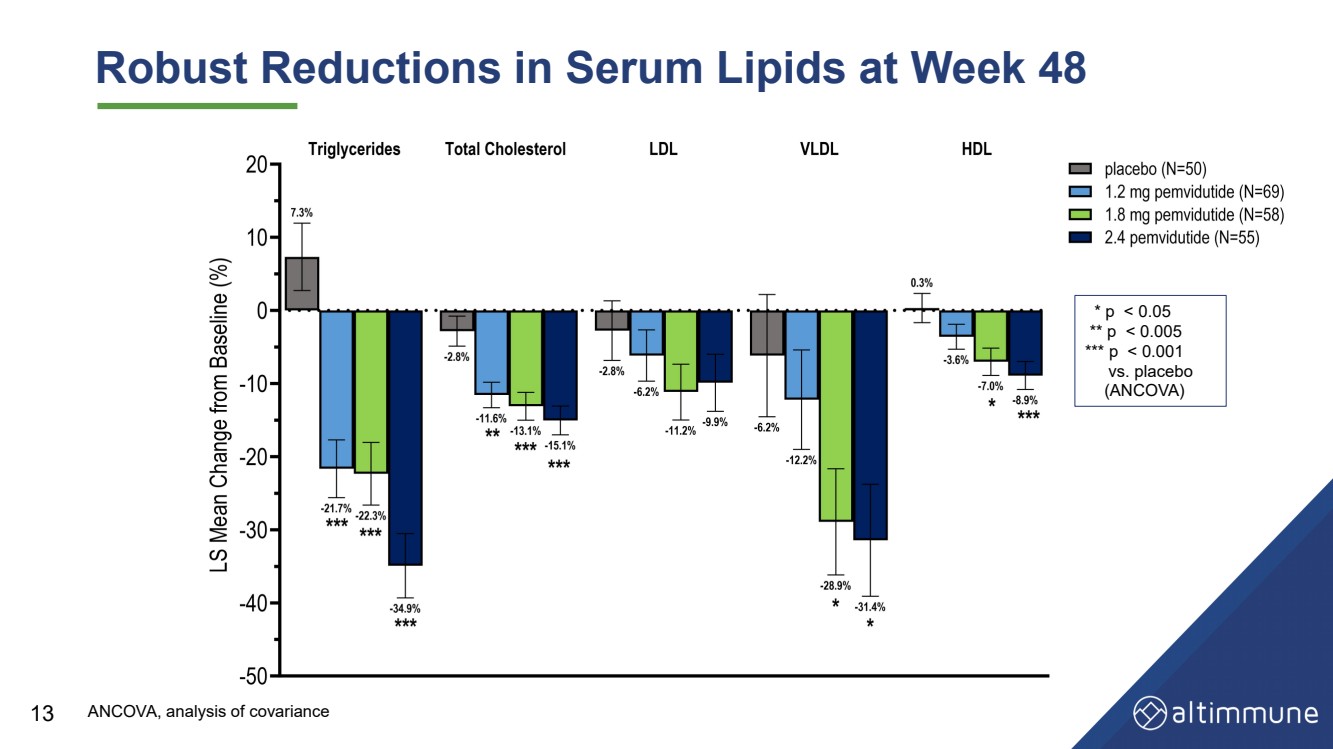
| 第 48 周血清脂质大幅降低 13 * p |
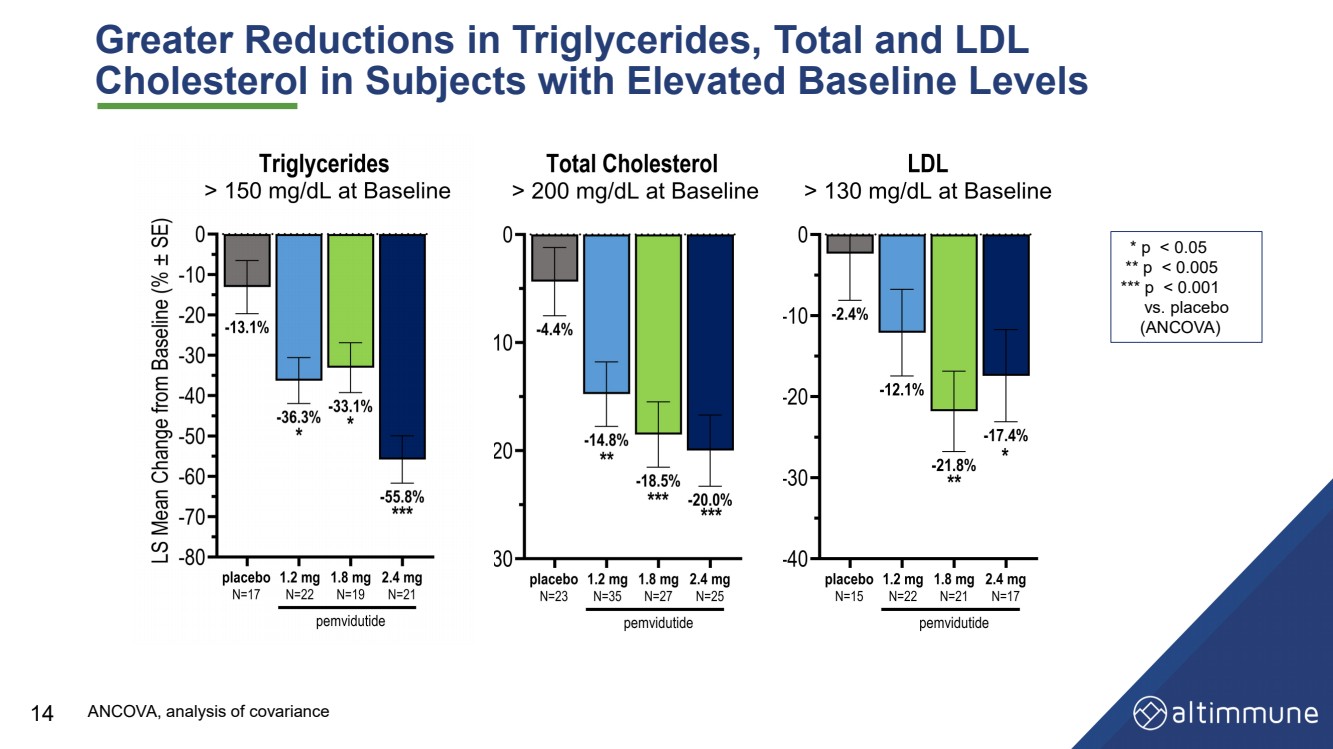
| 基线水平升高的受试者的甘油三酯、总胆固醇和低密度脂蛋白 胆固醇的降幅更大 14 * p |
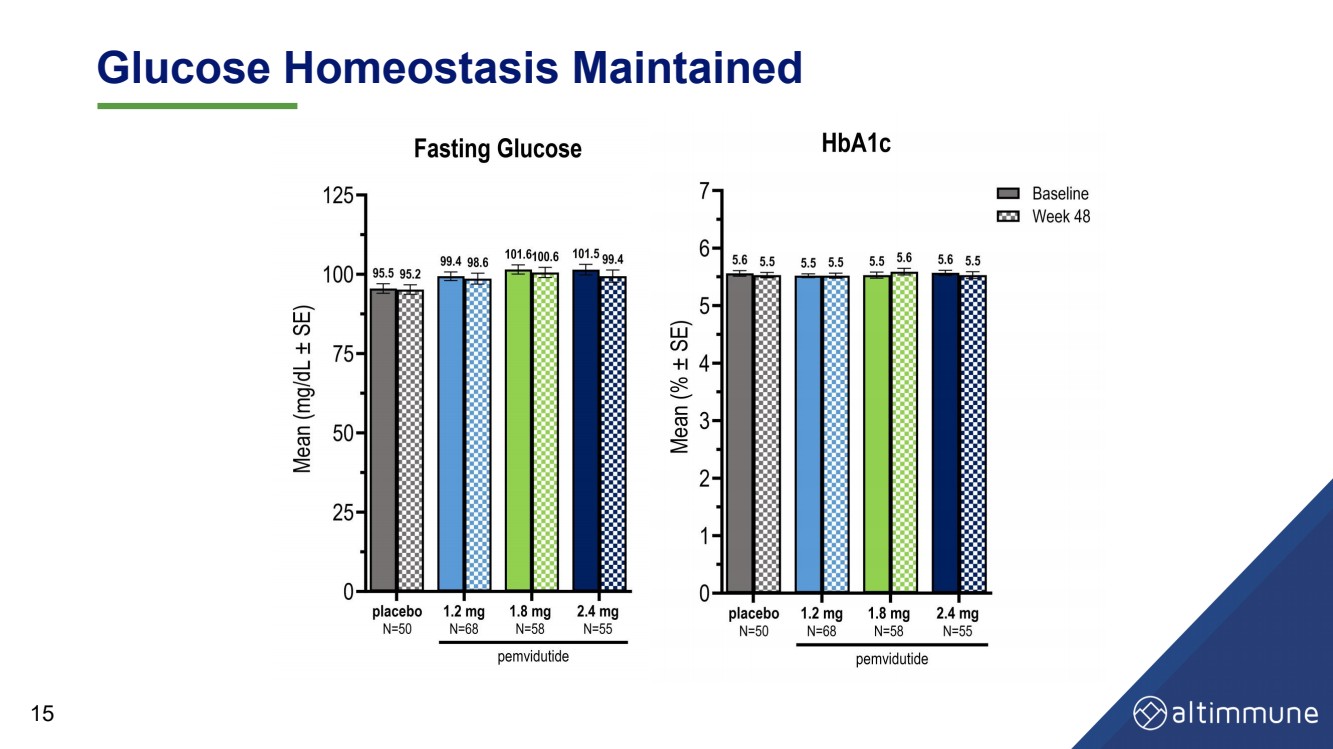
| 维持血糖动态平衡 15 |
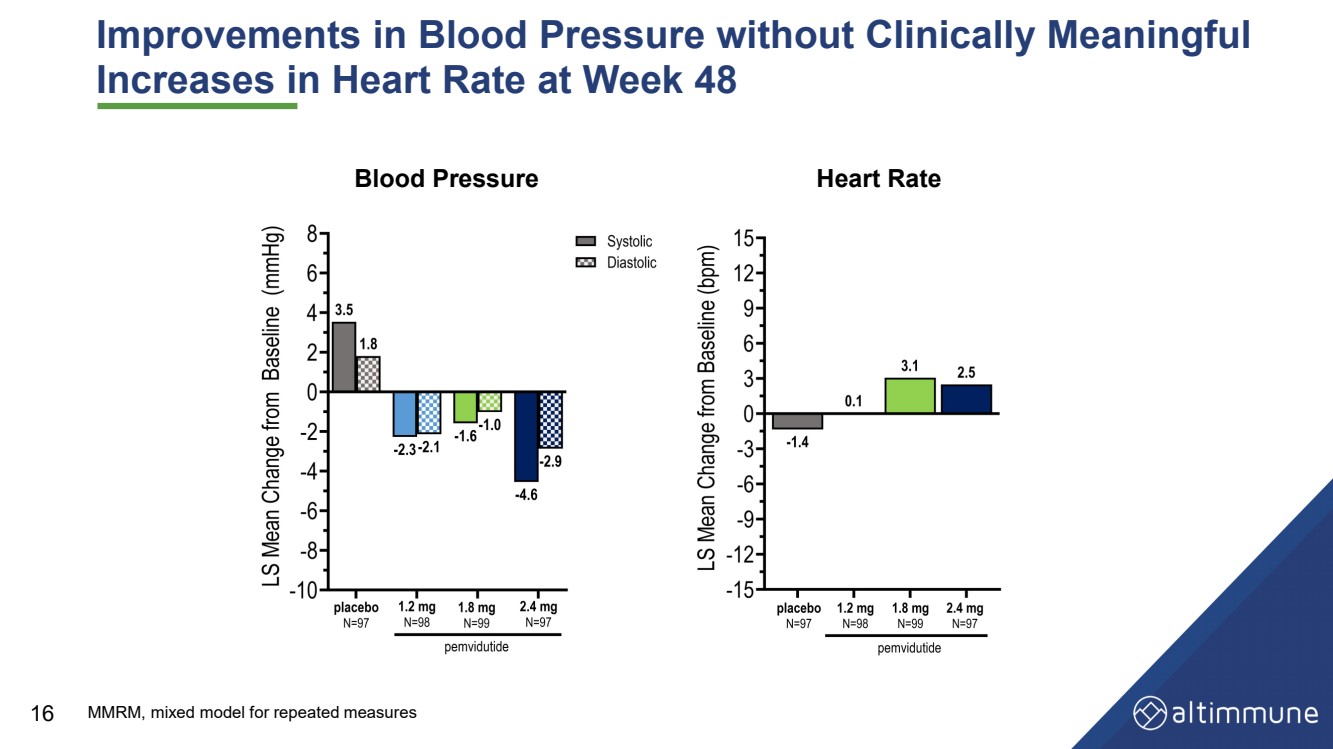
| 血压改善但没有临床意义 第 48 周心率升高血压 16 血压心率心率 MMRM,重复测量的混合模型 |
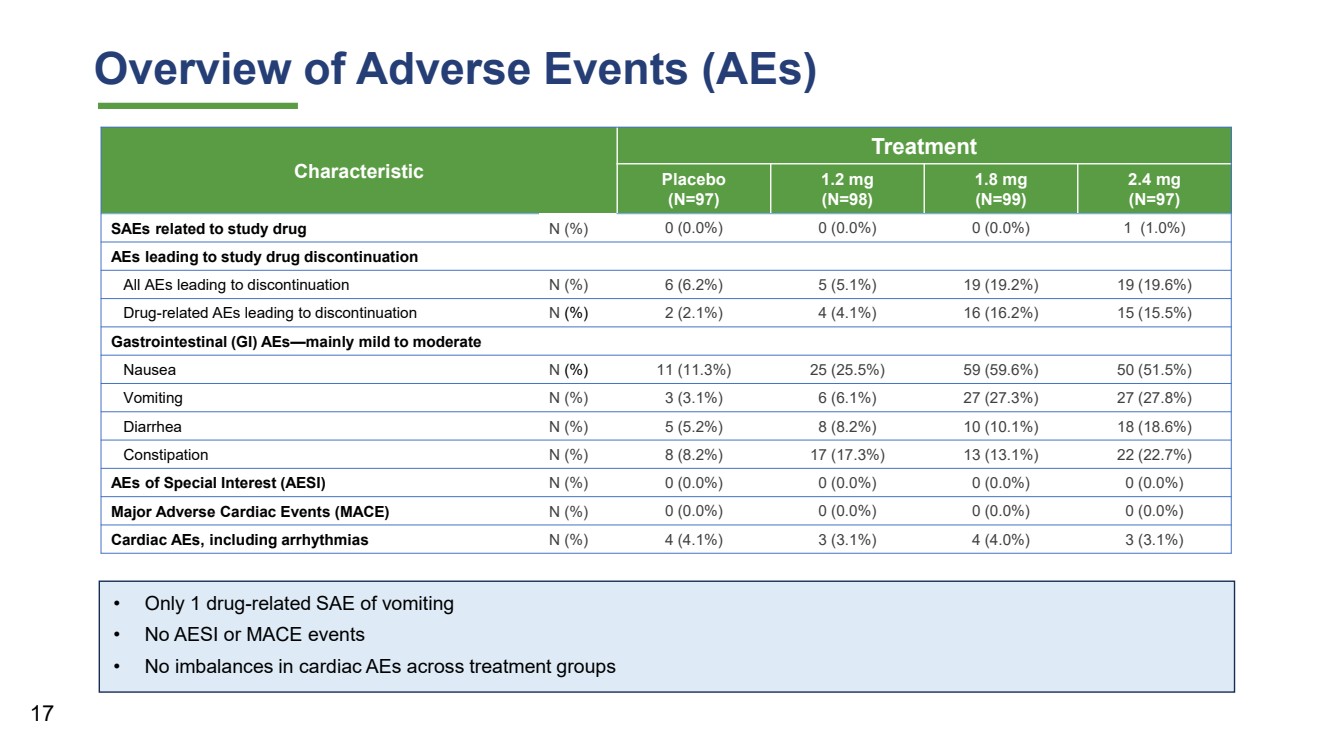
| • 只有 1 次药物相关的 SAE 呕吐 • 无 AESI 或 MACE 事件 • 不同治疗组的心脏不良反应概述 特征 治疗 安慰剂 (N=97) 1.2 mg (N=98) 1.8 mg (N=99) 2.4 mg br} (N=97) 与研究药物 N (%) 0 (0.0%) 0 (0.0%) 0 (0.0%) 1 (1.0%) 导致研究药物停药的 AE 导致停药的所有不良反应 N (%) 6 (6.2%) 5 (5.1%) 19 (19.6%) 导致停药的药物相关不良事件 N (%) 6 (6.2%) 19 (19.6%) 导致停药的药物相关不良事件 N (%) 6 (6.2%) 19 (19.6%) 与药物相关的不良反应 N (%) 6 (6.2%)%) 2 (2.1%) 4 (4.1%) 16 (16.2%) 15 (15.5%) 胃肠道 (GI) AES — 主要是轻度至中度 恶心 N (%) 11 (11.3%) 25 (25.5%) 59 (59.6%) 50 (51.5%) 呕吐 N (%) 3 (3.1%) 6 (6.1%) 27 (27.3%) 27 (27.8%) 腹泻 N (%) 5 (5.2%) 8 (8.2%) 10 (10.1%) 18 (18.1%) 6%) 便秘 N (%) 8 (8.2%) 17 (17.3%) 13 (13.1%) 22 (22.7%) 特别关注者 (AESI) N (%) 0 (0.0%) 0 (0.0%) 0 (0.0%) 0 (0.0%) 0 (0.0%) 重大心脏不良事件 (MACE) N (%) 0 (0.0%) 0 (0.0%) 0 (0.0%) 0 (0.0%) 0 (0.0%) 0 (0.0%) 0 (0.0%) 0 (0.0%) (0.0%) 0 (0.0%) (0.0%) 0 (0.0%) (0.0%) 0 (0.0%) (0.0%)) 0 (0.0%) 心脏AE,包括心律失常 N (%) 4 (4.1%) 3 (3.1%) 4 (4.0%) 3 (4.0%) 3 (3.1%) 17 |
| MOMENTUM Trial—Week 48 Summary Efficacy • Robust mean weight loss of 15.6% on pemvidutide 2.4 mg at Week 48 • Mean and maximal weight losses of 32.2 lbs and 87.1 lbs, respectively, on 2.4 mg at Week 48 • Over 30% of subjects lost 20% or more body weight on 2.4 mg at Week 48 • Continued weight loss on 2.4 mg at Week 48—greater weight loss could potentially be achieved with longer duration of treatment • Substantial and clinically meaningful reductions in total cholesterol, LDL, triglycerides and blood pressure Safety and Tolerability • Gastrointestinal AEs, common to incretin-based agents, mainly mild to moderate in severity • No imbalance of cardiac AEs, including arrhythmias • No clinically meaningful increases in heart rate • Glucose homeostasis maintained 18 |
| NASDAQ: ALT Questions pertaining to this presentation: Rich Eisenstadt, CFO reisenstadt@altimmune.com 19 |