美国 美国
证券交易委员会
华盛顿特区,20549
表格
(标记 一)
对于
截止的财政年度
或
对于 ,从_到_的过渡期
佣金
文件编号:
(注册人的确切名称与其章程中规定的名称相同)
(州或其他司法管辖区 公司(br}或组织) |
(I.R.S.雇主 标识 编号) | |
| (主要执行办公室地址 ) | (Zip 代码) |
注册人的电话号码,包括区号:
根据该法第12(B)条登记的证券:
| 每个班级的标题 | 交易 个符号 | 注册的每个交易所的名称 | ||
| 这个 |
根据该法第12(G)条登记的证券:无
如果注册人是证券法规则405中定义的知名经验丰富的发行人,请用复选标记表示
。是的☐
如果注册人不需要根据该法第13或15(D)条提交报告,请用复选标记表示。是的☐
用复选标记表示注册人是否:(1)在过去12个月内(或注册人被要求提交此类报告的较短期限内)提交了1934年《证券交易法》第13或15(D)节要求提交的所有报告,以及(2)
在过去90天内是否符合此类提交要求。
在过去12个月内(或在注册人
被要求提交和张贴此类文件的较短时间内),请勾选
注册人是否以电子方式提交了根据法规S—T(本章第232.405节)第405条规定提交的每个交互式数据文件。
用复选标记表示注册人是大型加速申报公司、加速申报公司、非加速申报公司、较小的申报公司或新兴成长型公司。请参阅《交易法》第12b-2条规则中“大型加速申报公司”、“加速申报公司”、“较小报告公司”和“新兴成长型公司”的定义。
| 大型 加速文件服务器 | ☐ | 加速的 文件管理器 | ☐ |
| ☒ | 较小的报告公司 | ||
| 新兴的 成长型公司 |
如果 是一家新兴成长型公司,请用复选标记表示注册人是否已选择不使用延长的过渡期来遵守根据《交易法》第13(A)节提供的任何新的或修订的财务会计准则。☐
用复选标记表示注册人是否提交了一份报告,并证明其管理层根据《萨班斯-奥克斯利法案》(《美国法典》第15编第7262(B)节)第404(B)条对其财务报告内部控制的有效性进行了评估
编制或发布其审计报告的注册会计师事务所。
如果证券是根据该法第12(B)条登记的,请用复选标记表示备案文件中包括的注册人的财务报表是否反映了对以前发布的财务报表的错误更正。
勾选任何错误更正是否是重述,要求对注册人的任何执行官在相关恢复期内根据§ 240.10D-1(b)收到的激励性薪酬 进行恢复分析。☐
用复选标记表示注册人是否是空壳公司(如《交易法》第12b-2条所定义)。是,☐不是
截至2023年6月30日,也就是注册人最近完成的第二财季的最后一个营业日,注册人的非关联公司持有的普通股总市值约为$
截至2024年3月6日,注册人普通股的流通股数量,每股面值0.0001美元,为.
通过引用并入的文档
Motus GI控股公司
表格10-K年度报告
截至2023年12月31日的年度
| 页面 | ||
| 第一部分 | ||
| 项目 1 | 业务 | 2 |
| 项目 1a | 风险因素 | 25 |
| 项目 1B | 未解决的员工意见 | 55 |
| 项目1C | 网络安全 | 55 |
| 第 项2 | 属性 | 55 |
| 第 项3 | 法律诉讼 | 55 |
| 第 项4 | 煤矿安全信息披露 | 55 |
| 第II部 | ||
| 第 项5 | 注册人普通股市场、相关股东事项与发行人购买股权证券 | 56 |
| 第 项6 | 已保留 | 56 |
| 第 项7 | 管理层对财务状况和经营成果的探讨与分析 | 56 |
| 项目 7A | 关于市场风险的定量和定性披露 | 65 |
| 第 项8 | 财务报表和补充数据 | 65 |
| 第 项9 | 会计与财务信息披露的变更与分歧 | 65 |
| 项目 9A | 控制和程序 | 65 |
| 项目 9B | 其他信息 | 65 |
| 第 9C项 | 关于妨碍检查的外国司法管辖区的披露 | 65 |
| 第三部分 | ||
| 第 10项 | 董事、高管与公司治理 | 66 |
| 第 项11 | 高管薪酬 | 69 |
| 第 12项 | 某些实益拥有人的担保所有权以及管理层和相关股东的事项 | 73 |
| 第 项13 | 某些关系和相关交易,以及董事的独立性 | 76 |
| 第 项14 | 首席会计费及服务 | 77 |
| 第四部分 | ||
| 第 项15 | 展示、财务报表明细表 | 78 |
| 第 项16 | 表格10-K摘要 | 84 |
| 附件 索引 | ||
| 签名 | 85 | |
| i |
第 部分I
有关前瞻性陈述的特别说明
本10-K表格报告包含根据1995年《私人证券诉讼改革法》(修订后的《证券法》第27A节)和《1934年证券交易法》(经修订的《证券交易法》)第21E节的安全港条款作出的前瞻性陈述。前瞻性表述包括有关我们的信念、计划、目标、目标、预期、预期、假设、估计、意图和未来表现的表述,涉及已知和未知的风险、不确定性和其他因素,这些因素可能超出我们的控制范围,并可能导致我们的实际结果、业绩或成就与此类前瞻性表述明示或暗示的未来结果、业绩或成就大不相同。除历史事实以外的所有陈述均为前瞻性陈述。您可以通过使用“可能”、“可以”、“预期”、“假设”、“应该”、“ ”表示“将”、“相信”、“考虑”、“预期”、“寻求”、 “估计”、“继续”、“计划”、“指向”、“项目”、“预测”、“ ”等词语来识别这些前瞻性陈述。“意向”、“目标”、“潜在”和其他类似的词语和表达的未来。
有许多重要因素可能会导致实际结果与我们发表的任何前瞻性声明中所表达的结果大相径庭。这些因素包括但不限于:
| ● | 我们有限的经营历史和对额外资本的需求; | |
| ● | 我们有能力执行旨在保本、减少现金支出和裁员的战略重组计划; | |
| ● | 我们有能力进入和完善战略选择,包括任何收购、合并、反向合并、其他业务合并、出售资产、许可和其他战略交易; | |
| ● | 我们自成立以来每年的运营亏损历史,以及在可预见的未来我们将继续遭受运营亏损的预期; | |
| ● | 我们目前和未来的资本需求,以支持我们对Pure-Vu系统的开发和商业化努力,以及我们满足资本需求的能力; | |
| ● | 有能力保持符合纳斯达克资本市场对继续上市的要求; | |
| ● | 我们对Pure-Vu系统的依赖,这是我们唯一的产品; | |
| ● | 我们将Pure-Vu系统商业化的能力; | |
| ● | 我们的Pure-Vu系统和准备结肠镜检查的结肠清洁程序目前不能通过私人或政府第三方付款人单独报销; | |
| ● | 我们有能力从不同司法管辖区的监管机构或其他主管实体获得Pure-Vu系统的批准或认证; | |
| ● | 我们依赖第三方生产Pure—Vu系统; | |
| ● | 我们维护或保护我们的专利和其他知识产权的有效性的能力; | |
| ● | 我们有能力留住关键高管以及医疗和科学人员; | |
| ● | 我们在内部开发新发明和知识产权的能力; | |
| ● | 对现行法律的解释和未来法律的段落; | |
| ● | 投资者接受我们的商业模式; | |
| ● | 我们对费用和资本需求估计的准确性; |
| ● | 我们充分支持增长的能力; | |
| ● | 我们预测通货膨胀对劳动力、运费和材料等成本的财务影响的能力; | |
| ● | 我们在 中投射的能力 考虑到全球流行病和医院系统的财务压力,短期内医院医疗器械环境; 和 | |
| ● | 中东发生的事件和以色列发生的冲突的影响 |
| 1 |
上述内容并不代表本文所载前瞻性陈述可能涵盖的事项的详尽清单,或 我们面临的可能导致我们的实际结果与我们前瞻性陈述中预期的结果不同的风险因素。 有关可能对我们的业务和财务业绩造成不利影响的其他风险,请参见“第一部分—第1A项—风险因素”。
所有 前瞻性陈述均由本警示通知明确限定。谨提醒阁下不要过分依赖任何前瞻性陈述,这些陈述仅限于本报告日期或 引用纳入本报告的文件日期。我们没有义务,并明确否认任何义务,更新,修改或更正任何前瞻性 声明,无论是由于新信息,未来事件或其他原因。我们已经真诚地表达了我们的期望、信念和预测 ,我们相信它们有合理的基础。然而,我们不能向你们保证我们的期望、信念或预测 将产生或实现或完成。
| 第 项1. | 生意场 |
概述
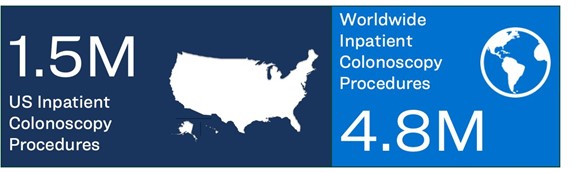
We have developed the Pure-Vu System, a medical device that has been cleared by the U.S. Food and Drug Administration (the “FDA”) to help facilitate the cleansing of a poorly prepared gastrointestinal tract during colonoscopy and to help facilitate upper gastrointestinal (“GI”) endoscopy procedures and colonoscopies. A redesigned version of the system received FDA 510(k) clearance in Q4 of 2023 which improves the overall ease of use of the system and lowers the overall cost of goods by close to 50%. An earlier version of the Pure-Vu System is also “Conformité Européenne” (“CE”) marked in the European Economic Area (EEA) for use in colonoscopy. The Pure-Vu System is also CE marked in the European Economic Area (EEA) for use in colonoscopy. The Pure-Vu System integrates with standard and slim colonoscopes, as well as gastroscopes, to improve visualization during colonoscopy and upper GI procedures while preserving established procedural workflow and techniques. Through irrigation and evacuation of debris, the Pure-Vu System is designed to provide better-quality exams. Challenges exist for inpatient colonoscopy and endoscopy, particularly for patients who are elderly, with comorbidities, or active bleeds, where the ability to visualize, diagnose and treat is often compromised due to debris, including fecal matter, blood, or blood clots. We believe this is especially true in high acuity patients, like GI bleeding where the existence of blood and blood clots can impair a physician’s view and removing them can be critical in allowing a physician the ability to identify and treat the source of bleeding on a timely basis. We believe use of the Pure-Vu System may lead to positive outcomes and lower costs for hospitals by safely and quickly improving visualization of the colon and upper GI tract, potentially enabling effective diagnosis and treatment without delay. In multiple clinical studies to date, involving the treatment of challenging inpatient and outpatient cases, the Pure-Vu System has consistently helped achieve adequate bowel cleanliness rates greater than 95% following a reduced prep regimen. We also believe that the technology may be useful in the future as a tool to help reduce user dependency on conventional pre-procedural bowel prep regimens. Based on our review and analysis of 2019 market data and 2021 projections for the U.S. and Europe, as obtained from iData Research Inc., we believe that during 2023 approximately 1.5 million inpatient colonoscopy procedures were performed in the U.S. and approximately 4.8 million worldwide. Upper GI bleeds occurred in the U.S. at a rate of approximately 400,000 cases per year in 2019, according to iData Research Inc. The Pure-Vu System has been assigned an ICD-10 code in the US. The system does not currently have unique codes with any private or governmental third-party payors in any other country or for any other use; however, we may pursue reimbursement activities in the future, particularly in the outpatient colonoscopy market. Since we received 510(k) clearance in Q4 2023 from the FDA for the new Pure-Vu EVS System for use in the Upper GI tract and Colon we commenced limited market introduction of this product at the end of 2023. Both devices leverage the same Workstation and feature key enhancements such as a larger and more powerful suction channel, more efficient irrigation jets, a smaller profile distal tip that offers enhanced flexibility during insertion, enhanced navigation and a much easier bed side set up.

| 2 |
战略 审查和重组
我们 已经启动了一个进程,探索一系列战略和融资替代方案,重点是最大化股东价值和加速 Pure—Vu系统的商业化。我们可能考虑的潜在战略替代方案预计包括收购、 合并、反向合并、其他业务合并、出售资产、许可和其他战略交易。
在截至2023年12月31日的上半年,我们致力于重组计划,旨在减少我们的开支,并使我们能够探索一系列战略和融资替代方案,专注于最大化股东价值和加快Pure-Vu系统的商业化。
我们 打算继续评估和确定我们业务的其他领域,以提高效率和改进流程,目标是 进一步降低我们的运营费用和资本需求。无法保证此战略审查流程将导致我们当前业务计划的 更改或导致任何特定行动或交易。我们不打算在此战略审查过程中讨论或披露进一步的 发展,除非董事会批准了一项具体行动或我们以其他方式确定 进一步披露是适当的。如果我们未能完成战略交易,我们可能需要寻求破产、解散 或清算。
市场 概述
在医院环境中进行上下内镜检查,以诊断和治疗突发GI疾病患者。根据我们对美国和欧洲2019年市场数据和2021年预测的回顾和分析,这些数据来自 iData Research Inc.我们相信,在2023年期间,大约有150万例住院结肠镜检查在美国进行。 全球约有480万人。根据iData Research Inc.的数据,2019年,美国每年发生上消化道出血病例约为40万例。这些程序通常用于帮助诊断 和治疗消化道出血、未知腹痛、肠易激综合征(IBS)、炎性肠病(IBD)、贫血或 感染。
| 3 |
尽管内窥镜检查的普及性和有效性,但它可能导致 失败、延误和质量差的手术,尤其是在住院环境中。重新安排手术会导致 提供者工作流程的效率低下,并增加住院时间,每一项都会导致医疗保健成本增加。在消化道出血中, 诊断出血源治疗对患者预后至关重要,尤其是上消化道出血,其死亡率为10%。对于住院患者的结肠镜检查,准备方案通常要求患者24小时的流食,饮用多达4升的泻药,在检查前花费长达12小时的时间周期性地去洗手间排便,这对于医院中的体弱患者来说是很困难的。根据克利夫兰诊所发表的一项研究,大约51%的住院病人没有充分的准备,导致至少多住院一晚。
上消化道内窥镜市场
在 2023年第4季度,我们宣布我们获得FDA的510(k)批准,该版本与 上消化道(GI)内窥镜手术期间使用的胃镜兼容,用于清除血液、血凝块和碎屑,以便为内镜医生提供清晰的视野。该器械旨在与治疗胃镜集成,以在手术过程中实现安全快速的 清洁,同时保留既定的手术工作流程和技术。
根据iData Research Inc.的数据,2019年美国上消化道出血的发生率约为每年40万例。大约 这些患者中有50%的血液和血凝块会在手术过程中损害医生的视野,因此难以 快速识别出血源。我们认为,从视野中清除粘连的血凝块对于 医生能够识别和治疗出血源是一个非常重要的需要。这种疾病的死亡率可高达约13%, 如Thad Wilkins,MD等人所述,美国家庭医生(2012)
公司已在美国市场启动了新型上消化道器械的受控上市,不仅在上消化道出血 手术中获得了积极反馈,而且在治疗手术中清除胃内容物(否则这些手术将被取消)方面也获得了积极反馈。Pure Vu EVS 系统安装到位后,无需通过胃镜工作通道利用现有冲洗和抽吸,医生 可以将工具与Pure—Vu EVS配合使用。例如,使用圈套器将大块凝块分解,然后使用大型Pure—Vu EVS智能感应抽吸通道立即抽吸 较小的凝块。此外,在出现严重出血的情况下,Pure—Vu EVS允许医生清洁感兴趣区域并立即应用治疗以实现止血,因为医生可以将 治疗器械预先放置在胃镜的工作通道中,并在清洁后血流覆盖感兴趣区域 之前输送。

住院患者 机会:改善结局、医院资源利用率并缩短内窥镜手术成功的时间
Inpatient colonoscopy is usually performed to diagnose the source of various gastrointestinal conditions such as lower GI bleeding or bowel pain. For an inpatient hospital stay, the Centers for Medicare & Medicaid Services, or CMS, uses a prospective payment system, or PPS, based upon the MS-DRG payment groupings, to pay for hospital services with the goal of encouraging efforts to minimize their costs. The DRG assignment is influenced by a combination of factors such as a patient’s sex, diagnosis at the time of discharge and procedures performed. Based on patient specific information, all hospital expenses for their care during an inpatient stay are packaged and assigned to one of over 700 MS-DRGs (“Medicare Severity – Diagnostics Related Groups”). According to Decision Driver Analytics, a reimbursement consulting agency, when a colonoscopy is performed as the primary procedure (no other procedures or complicating diagnosis), MSDRGs 395, 394 or 393 would apply which pay between $3,861 (without complications or major comorbidities) and $9,421 (with major complications and comorbidities), which are average figures subject to adjustment. The National Inpatient Sample (“NIS”) and other literature sources note that the cost for a standard hospital bed averages $2,298 and the cost for an intensive care unit (“ICU”) bed averages $6,546 per day in the U.S, so reducing the length of stay can save the hospital significant expense.
| 4 |
An inpatient colonoscopy is generally more problematic than an outpatient procedure due primarily to the acuity of the patient who often struggles to complete a satisfactory pre-procedural bowel prep, which can lead to lower rates of successful completion of the procedure and a higher frequency of repeat procedures. Inpatients are difficult to prep as shown by inadequate bowel prep rates. Published studies have found that the inpatient population experiences rates of insufficiently prepped colons at the time of colonoscopy as high as 55%. This has been shown to lead directly to significantly longer hospital stays and other additional costs due to the need for repeated preps, repeated colonoscopies, and additional diagnostic procedures. This is exemplified in a recently published study by the Cleveland Clinic that showed an inadequate preparation rate of 51% in the study population of 8,819 inpatients. The study noted that the 51% of the study population that were inadequately prepped stayed one day extra in the hospital compared to patients with adequate preparation. Another study, from Northwestern University Hospital System, showed an average hospital stay extension of two days and cost increase of as much as $8,000 per patient as a result of challenges associated with bowel preparation. We believe the Pure-Vu System may improve outcomes and lower costs for hospitals by potentially reducing the time to a successful colonoscopy, minimizing delayed and incomplete procedures, and improving the quality of an exam.

我们的 Pure—Vu解决方案
Our system consists of a workstation controller and a single-use, disposable Flex-Channel that attaches to most gastroscopes and colonoscopes (endoscopes). Together with the endoscopes, the Pure-Vu System performs rapid, effective, and efficient intra-procedural cleaning without compromising procedural workflow and techniques. The Flex-Channel has an umbilical section that connects the disposable to the workstation. The workstation, through a series of peristaltic pumps activated by foot pedals, delivers an irrigation medium of air and water that creates a pulsed vortex inside the GI tract to break up debris while simultaneously evacuating the content into waste receptacles already used in a standard colonoscopy procedure. The proprietary smart sense suction (evacuation) system in the device has sensors built in that can detect the formation of a blockage and automatically clear it allowing the physician to remove significant debris from the patient. The Pure-Vu System has been clinically demonstrated to be capable of cleaning poorly prepared colons in minutes. We have built and continue to extend our intellectual property portfolio designed to protect key aspects of the system, including the pulsed vortex irrigation and auto-purge functions.

| 5 |
2019年6月,FDA审查并批准了第二代Pure—Vu系统("Gen 2")的510(k)上市前通知 。我们收到了首份CE符合性证书,允许我们在2020年3月将CE标志贴在Gen 2 Pure—Vu系统上。我们于二零二一年一月收到首份CE符合性证书的补充。

2023年10月,我们宣布FDA获得510(k)批准,基于Pure Vu EVS Gastro设计的升级版Pure—Vu EVS系统,简化了器械,取消了覆盖范围的 套管,并大大简化了设置。Pure—Vu EVS提供了可用性方面的改进,包括增强的医生 导航和控制、按需床旁装载、扩大清洁能力以及更小的工作站占地面积。
临床前 和临床数据与安全性
Pure-Vu系统已经在多项临床研究中进行了研究,研究对象接受了减少的准备方案,以及一项专注于住院人群的研究。Pure-Vu系统在欧盟和以色列的两项多中心临床研究中使用,在美国也在单中心研究中使用。第一项研究涉及49名受试者,于2016年第二季度完成。第二项研究于2017年6月完成,涉及46名受试者。这些研究中的受试者限制饮食18-24小时,并接受20毫克的非处方药Dulcolax®(比索可待因)的分割剂量。他们没有服用任何传统上用于肠道准备的液体泻剂。 在使用BBPS的这些研究中,显示Pure-Vu系统性能的临床数据如下所示。 2016年的临床研究结果在2016年10月的联合欧洲胃肠病学周(UEGW)上发表,第二项研究 发表在同行评议期刊上内镜2018年。2017年的临床研究结果于2017年10月在UEGW 上公布,显示了类似的结果,如下所示。这项研究已发表在内窥镜检查,欧盟最受同行评审的期刊之一。
The third clinical study in the outpatient setting was presented at the American College of Gastroenterology (“ACG”) Annual Meeting in October 2018. This study was performed in the United States and showed that the Pure-Vu System demonstrated safe and effective colonic cleaning in the per protocol analysis of 46 subjects receiving a reduced prep regimen. The study was initially designed to compare two different minimal bowel preparation regimens. Initially subjects were randomized to receive one of two minimal bowel preparations: three doses of 17 gr. MiraLAX each mixed in 8.5 oz. of clear liquids or two doses of 7.5 oz. magnesium citrate (MgC) each taken with 19.5 oz. of clear liquid. A study amendment early on replaced the MiraLAX arm, due to obvious inferior Boston Bowel Preparation Scale (“BBPS”), a validated assessment instrument, scoring from the outset. The replacement arm consisted of two doses of 5 oz. MgC taken with 16 oz. of clear liquid. All subjects were allowed to eat a low residue diet on the day prior and were asked to avoid seeds and nuts for five days prior to their procedure. Study objectives evaluated for each study arm included: (1) improvement of colon cleansing from presentation baseline to completion of the procedure (as assessed by the BBPS) through the use of the Pure-Vu System, (2) time required to reach the cecum, (3) total procedure time, and (4) safety. No significant differences were found between the three groups with regard to demographics or indication for colonoscopy. No serious adverse events related to the device were reported. The use of the Pure-Vu System enabled successful intraprocedural cleansing of the colon and ensured successful completion of all colonoscopies performed (100% success rate). Although there were only 46 subjects in the study, there was a highly significant difference in the study population (p value
| 6 |
减少 研究
Reduce研究("Reliable Endoscopic Diagnosis Using Cleansing Enhancement"),首次在2019年5月的消化疾病周(DDW)会议上发表,并发表了一份完整的手稿,标题为"一项多中心、前瞻性、住院可行性研究, 评估使用结肠镜检查清洁设备优化住院受试者结肠准备:REDUCE研究”, 发表在同行评审期刊上 BMC胃肠病学2021年Q2。REDUCE研究是一项多中心住院前瞻性 试验,旨在评价Pure—Vu系统持续可靠地改善肠道准备的能力,以促进适应症诊断性结肠镜检查的患者及时成功进行结肠镜检查。本研究按计划入组了95名住院受试者 ,无论其术前肠道准备水平如何。本研究的主要终点是根据波士顿肠道准备量表("BBPS")评估的肠道准备从基线到术后的改善情况,该量表以0—3分的量表评估了结肠三个节段中每一节段的清洁度,并要求每个节段的最低评分为2分或更高 才被视为充分准备。
对于 接受Pure—Vu系统的住院患者,在评价节段中,充分的肠道准备从基线的38%改善到96%。 REDUCE研究的分析显示,使用Pure—Vu系统后,结肠的每个节段均有统计学显著改善。 每节段BBPS分别从平均基线的1.74、1.74和1.5改善至2.89、2.91和2.86,结肠所有三节段的 具有统计学意义的p值为0.001。入组研究患者的主要适应症(68%)是GI出血。急性胃肠道出血可导致血流动力学不稳定,是紧急治疗的关键人群。医生 能够在研究中97%的受试者中实现成功的临床结局。
下图以并行方式显示了Pure—Vu系统使用前后使用BBPS的主要终点结果。 从数据中可以看出,在各种研究中,Pure—Vu系统实现的高清洁水平是一致的:

当前 其他临床研究
2022年第2季度,我们完成了一项针对有肠道准备不良病史的受试者的欧盟研究,计划在两个研究中心(包括Radboud University Medical Center(荷兰)和GastroZentrum Lippe(德国))接受筛查、 诊断或监测结肠镜检查。受试者接受了低容量肠道准备,仅使用2x150 ml picoprep。受试者还被允许在结肠镜检查前两天 吃低纤维饮食,而不是结肠镜检查前一天典型的清汤饮食。 然后,受试者接受了Pure—Vu系统的术中肠道清洁。本研究的主要终点是通过波士顿肠道准备量表(BBPS)评估的肠道准备从基线到术后的改善 ,该量表以0到3的量表评估了结肠三个节段中每一节段的清洁度,并要求每个节段的最低评分为2分或更高 才被视为充分准备。该研究的结果在2022年5月的消化系统疾病周会议上公布, 使用Pure—Vu后,质量差的受试者从基线水平的31.8%提高到97.7%,具有统计学意义,p值为
| 7 |
成本 效益分析和独立研究
2021年,我们宣布在《成本效益和资源分配杂志》上发表赞助的Pure—Vu System ®成本效益分析,标题为"结肠镜检查在准备不良的结肠。比较标准护理与新清洁技术的成本效益分析。“这项研究表明,假设美国结肠镜检查的全国平均依从率为60%,正如美国癌症协会2017年报告的那样,使用Pure Vu有可能为每个患者提供美国医疗保健系统的终身节省833—922美元,具体取决于保险公司,与护理标准相比。我们提供了分析 和手稿开发的赞助。
2021年,我们还在2021年美国胃肠病学会 (ACG)年度科学会议上的海报演示中宣布了一项独立单中心研究的结果,该研究将Pure—Vu系统作为肠道准备不足(IBP)受试者的结肠清洁的辅助手段。
在 独立研究中,40例有IBP的受试者(14例住院手术(35%)和26例门诊手术(65%))使用Pure—Vu系统完成结肠镜检查。结肠镜检查的适应症是诊断性或结直肠癌(CRC)筛查/监测。 Pure—Vu用作IBP的辅助治疗,以允许37例受试者完成手术。在IBP受试者中,术中清洁后平均BBPS评分从3.1分(范围:0—6分)改善至8.5分(范围:5—9分)。3名受试者发生活动性下消化道出血 (LGIB),在未进行肠道准备的情况下使用Pure—Vu系统以及时检测病因并进行可能的治疗。当在未进行肠道准备的情况下进行紧急结肠镜检查时,所有3名受试者均可完成手术,分别检测和治疗憩室和息肉切除术后出血 ,并诊断出另一名受试者严重右侧缺血性结肠炎。研究作者得出结论, 未经事先肠道准备的Pure—Vu系统在LGIB中的应用需要进一步研究。Pure—Vu系统的使用不会干扰内窥镜干预的性能 ,包括活检、冷/热圈套器息肉切除术或EMR。除2例患者轻微粘膜损伤外,Pure—Vu系统未观察到严重并发症。
此外, 在2022年10月的ACG会议上,在VA系统中一家独立的单中心报告了在6个月内在45名受试者中使用Pure—Vu EVS 的结果,这些受试者可以作为内窥镜检查可见准备不足的受试者的补救方法,或者 最初用于高度怀疑准备不良的受试者。研究显示, BBPS的平均值从基线时的4.8改善至使用Pure—Vu EVS后的8.7(低于6被认为不充分,9是范围的上限)。研究者得出的结论 指出,"使用该术中清洁装置提高了检查质量,延长了监测时间 间隔,提高了资源利用率"。
知识产权
我们的 IP职位包括一个产品组合,涵盖高度创新的技术,这些技术植根于使用 或不使用内窥镜清洁体腔的系统和方法。目前,我们在美国拥有18项授权或允许的专利,在亚洲(日本、中国和香港)有19项专利,在欧盟有10项专利,专利保护期至少到2040年。此外,我们在世界不同地区有十一项待审专利 申请,重点是美国,欧盟和日本。我们在美国注册了Motus GI和 Pure—Vu系统的商标,欧盟和其他国际司法管辖区。在美国,我们还有一个正在审理的商标申请 MICRO—PREP。
我们的 专利和专利申请集中在以安全有效的方式清洁体腔,内窥镜装置在体腔内以预定方向插入、移动和 操纵;内窥镜与 抽吸装置的协调定位以及具有自动自净化功能的清洁系统。覆盖范围包括我们系统的关键方面,我们认为, 是有效和高效清洁结肠或其他体腔的关键。这些方面包括清洗喷射方法、 检测和控制抽空以避免堵塞、易于连接到内窥镜的设计以及水下清洗部分。
我们 的商业成功部分取决于我们获得和维护Pure—Vu专利和其他专有保护的能力,以及在不侵犯他人所有权的情况下运行 ,以及防止他人侵犯我们的所有权。我们努力通过专利和商标的组合以及合同中的保密条款来保护 我们的知识产权。 关于Pure—Vu系统,我们努力在美国和国际范围内就系统的 已确定和潜在可申请专利的方面获得和维护专利保护。我们不能确定专利将被授予与我们将来可能拥有或许可的任何专利申请相关的专利,我们也不能确定我们现有的专利或我们将来可能拥有或许可的任何专利将有助于保护我们的技术。
| 8 |
In addition to patents, we rely on trade secrets and know-how to develop and maintain our competitive position. For example, significant aspects of our proprietary technology platform are based on unpatented trade secrets and know-how. Trade secrets and know-how can be difficult to protect. We seek to protect our proprietary technology and processes, in part, by confidentiality agreements and invention assignment agreements with our employees, consultants, scientific advisors, contractors and commercial partners. These agreements are designed to protect our proprietary information and, in the case of the invention assignment agreements, to grant us ownership of technologies that are developed through a relationship with a third-party. We also seek to preserve the integrity and confidentiality of our data and trade secrets by maintaining physical security of our premises and physical and electronic security of our information technology systems. While we have confidence in these individuals, organizations and systems, agreements or security measures may be breached, and we may not have adequate remedies for any breach. In addition, our trade secrets may otherwise become known or be independently discovered by competitors. To the extent that our contractors use intellectual property owned by others in their work for us, disputes may arise as to the rights in related or resulting know-how and inventions.
我们 还计划继续在美国和美国境外寻求商标保护(如适用)。 我们打算将这些注册商标用于我们的研究和开发以及我们的候选产品。
竞争
We do not believe that there are currently any direct competitors in the market, nor any known competing medical device under development, using similar technology to our technology. Currently the major colonoscope manufacturers (i.e., Olympus Corp, Pentax Medical, Fujifilm Medical) as well as some smaller equipment manufacturers (i.e., Medivators, Erbe) sell a lesser powered irrigation pump that can pump fluid through the auxiliary water jet or working channel of a colonoscope. Potentially competitive is an intra-procedural device under development by Medjet Ltd. MedJet’s device goes through the working channel of a scope, is used mostly for spot cleaning a small amount of debris and does not have the capability to fully clean the colon of large amounts of fecal matter. The MedJet product also requires the physician to remove it from the working channel during the procedure if they need to remove significant debris, polyps or take a biopsy, impacting the workflow of the procedure. There is also a device under development by a company named OTTek Ltd. The device is called the FIOT (Flow in Over Tube). The tube is noted as being able to create a channel between the endoscope and the inside of the over tube to facilitate the removal of debris. The competitive products mentioned are not currently separately reimbursed by private or government payors. There are over ten different preparation regimens used prior to colonoscopy today. Some are prescription medications and others are over-the-counter. Typically, the over-the-counter regimens are not indicated for colonoscopy prep but for issues of motility, such as constipation, but are still widely prescribed by physicians for colonoscopy prep. Depending on the insurance a patient has, the prescription prep may be covered in part but many of them require the patient to pay out-of-pocket.
The medical device and pharmaceutical industries are intensely competitive and subject to rapid and significant technological change. We have indirect competitors in a number of sectors, many of which have substantially greater name recognition, commercial infrastructures and financial, technical and personnel resources than Motus GI. Currently, the colonoscopy market is dominated by Olympus Corp, who controls a majority of the market, with Pentax Medical and FujiFilm Medical taking most of the rest of the U.S. colonoscope market. Boston Scientific, Medtronic GI Solutions, Conmed Corporation, Steris, Ambu A/S, and other smaller players sell ancillary devices and accessories into the marketplace as well. These established competitors may invest heavily to quickly discover and develop novel devices that could make our Pure-Vu System obsolete or uneconomical. These include but are not limited to capsule endoscopy, virtual colonoscopy using CT scans, etc. These technologies may require the same level of prep as conventional colonoscopies and if a polyp or abnormality is detected, the patient may still need to undergo a colonoscopy. Other screening tests for colon cancer specifically include fecal occult blood tests and DNA stool tests such as the Cologuard test from Exact Sciences. However, Cologuard is not a replacement for diagnostic colonoscopies or surveillance colonoscopies in high-risk individuals and has a lower specificity than standard colonoscopies. While none of these testing alternatives may ever fully replace the colonoscopy, over time, they may take market share away from conventional colonoscopies for specific purposes and may lower the potential market opportunity for us.
| 9 |
任何与获批产品竞争的 新产品可能需要在有效性、成本、便利性、耐受性 和安全性方面证明令人信服的优势才能在商业上取得成功。其他竞争因素,包括新的竞争进入者,可能会迫使我们降低价格 或导致销售额下降。此外,其他公司开发的新产品可能成为Pure—Vu系统的竞争对手。如果 我们无法与当前和未来的竞争对手有效竞争,我们的业务将无法增长,我们的财务状况 和运营将受到影响。
研究和开发
我们 在电气和机械工程方面拥有研发能力,在以色列的工厂设有实验室,用于开发 和原型设计,以及电子设计和测试。我们还使用顾问和第三方设计公司来补充我们的内部 能力。
我们 已经收到并且将来可能收到以色列国政府通过以色列国家技术创新管理局的赠款 ("IIA")(以前称为经济和工业部首席科学家办公室("OCS")),根据以色列鼓励研究法,为我们的一部分研究和开发开支提供资金,工业发展和技术创新5744—1984(“研究法”), 和先前根据该法律颁布的条例,以及适用于接受 IIA资助的公司的IIA规则和利益轨道(统称,包括研究法,“IIA条例”)。
截至 2023年12月31日,我们从IIA收到总计130万美元的赠款,并对 IIA负有总计约140万美元的或有债务(假设没有增加,根据IIA条例,如下所述)。 截至2023年12月31日,我们向IIA支付了最低金额。我们可能会在未来申请额外的IIA资助。然而,由于以色列国年度预算中用于IIA赠款的资金 须经IIA的事先批准,且过去已经减少 ,将来可能会进一步减少,因此我们无法预测我们是否有权获得或批准— 任何未来赠款,或任何此类赠款的金额(如果获得批准)。
作为 这些赠款的交换,我们需要向IIA支付4%的特许权使用费(在某些情况下可能会增加)来自我们产生的收入(以任何方式)利用国际投资协定赠款开发的专门知识(以及此类IIA资助的专有技术的任何衍生产品), 合计最多100%(在某些情况下可能会增加)补助金与美元挂钩的价值,加利息 (通常按日历年年初公布的12个月美元LIBOR利率计算,其中特定 已获IIA批准)。
IIA条例还要求IIA批准开发的产品在以色列制造的速度(范围)不得低于提交给IIA的相关赠款申请中规定的以色列制造和附加值的比率。此外,IIA条例还要求,根据IIA批准的计划进行研究和开发所产生的专有技术,不是在该批准计划的框架内开发的产品,由此产生的任何权利不得转让到以色列以外(包括以某些许可证的方式)。除非事先得到国际投资总署的批准。我们获得了将袖子的制造转移到以色列以外的批准。将与IIA资助的专有技术有关的制造转移到以色列以外,将导致更高的特许权使用费偿还率,并可能进一步导致特许权使用费增加(最高可达IIA赠款总额及其利息的三倍)。此外,将国际投资机构资助的专有技术转移到以色列境外可能会引发向国际投资机构支付额外的款项(最高可达国际投资机构赠款总额及其利息的六倍)。即使在全额偿还国际保险业协会的任何补助金之后,我们仍然必须继续遵守国际保险业协会条例的要求。上述限制和付款要求可能会削弱我们将我们的技术资产转移或出售到以色列境外,或外包或转移有关IIA资助的任何以色列境外专有技术的开发或制造活动的能力。
此外,接受国际保险业协会资助的公司通常被要求确保其保留国际保险业协会支持的产品的所有权利。这意味着,一般而言,根据国际投资协定核准的计划进行的研究和开发所产生的所有专有技术,以及由此产生的每一项权利,自产生这些专有技术之日起,必须归接受国际投资机构资助的人所有。接受国际保险业协会资助的公司还须遵守报告要求和其他技术要求,这些要求旨在使国际保险业协会 能够确保国际保险业协会的规定得到遵守。
| 10 |
如果 我们未能遵守IIA规定的任何条件和限制,或我们 获得赠款的特定条款,我们可能被要求退还之前收到的任何赠款以及利息和罚款,在某些 情况下,可能会受到刑事指控。
关于更多信息,见“第一部分--项目1A--风险因素--与我们在以色列的业务有关的风险”。
制造和供应
我们 已与研究机构、合同制造组织或CMO以及我们的合作者建立了关系,以生产和供应我们的产品,用于我们针对早期采用者医院的首次美国市场发布,以及我们更广泛的商业化。目前,我们Pure-Vu系统的工作站组件是由Sanmina Corporation在以色列的工厂生产的。 我们可能会与Sanmina Corporation就我们Pure-Vu系统的工作站组件和加载夹具的制造签订正式的供应协议 随着我们继续建立更高的批量能力和我们的商业化努力的增长。Pure-Vu电动汽车的一次性部分由Sterling Industries在美国密歇根州的工厂生产。我们于2021年第二季度与Sterling Industries签订了供应协议 。Sterling Industries使用深圳的Medacys、中国作为Pure Vu一次性产品中注塑成型部件的主要分供应商。这些制造供应商在医疗器械以及与监管机构和其他主管实体打交道方面拥有丰富的经验。这些供应商拥有国际标准化组织13485认证的质量体系。我们与美国的第三方物流供应商签订了协议,该供应商已通过国际标准化组织13485认证,专门生产医疗器械和设备。他们提供仓储、运输和后台支持,以满足我们的商业需求。
有关更多信息,见上文“第一部分--第1项--业务--研究和发展”和“第一部分-第1项--风险因素--与我们在以色列业务有关的风险”。
美国 市场进入战略
我们在美国 最新批准的器械版本的最初市场引入策略集中在住院医院市场。我们专注于在关键胃肠病学家中培养 临床冠军,这可能是关键的参考帐户,以阐明 上消化道和结肠的益处和易用性。此外,我们还阐述了Pure—Vu系统技术对医院管理部门的关键成员的临床和经济价值。在预定义的产品评估期后,我们寻求在价值分析 委员会批准流程内开展工作,该流程目前在大多数美国医院和综合交付网络(IDN)中使用。 在IDN内的旗舰位置成功实施后,我们将寻求在其他网络医院位置进一步扩展Pure—Vu系统 。2022年9月29日,该公司宣布已被退伍军人健康管理局(VHA)正式认可为 唯一来源供应商和小型企业。VHA是美国最大的综合医疗保健 系统,为超过900万退伍军人提供医疗服务。该特殊指定将使公司可以直接 访问VHA的采购部门,从而简化采购和合同流程。
除了与专门从事医疗器械的第三方物流 供应商合作,提供前台和后台支持,以成功完成客户订单外,我们的商业 组织还实施了一个强大的客户关系管理工具,以跟踪客户进度并帮助为运营提供准确的预测 。我们预计销售周期约为六个月。医院资本预算可用性的时间 可能会影响该预期周期。我们的主要重点是在急症护理医院市场获得系统的安置,推动 我们的Pure—Vu一次性系统在关键参考客户中的利用率,以促进直接或通过 合作伙伴关系扩大商业努力。
市场 扩展机会
虽然我们的时间、精力和注意力主要集中在推动美国医院市场的采用 ,但我们已经确定了几个后续市场扩张机会,目前正在评估这些机会,包括 欧洲和其他美国境外目标市场以及目标门诊市场,如下所述。
| 11 |
高 医疗需求门诊市场
我们 的目标门诊市场集中于那些面临准备不足风险的患者,为Pure—Vu系统提供了巨大的潜在商业市场机会 。根据我们对2019年美国和欧洲市场数据和2021年预测的回顾和分析, 从iData Research Inc.获得,根据2015年5月的HRA Healthcare Research & Analytics Market Research的估计,我们认为美国每年约有 470万例针对性门诊结肠镜检查,全球约有1170万例。这些结肠镜检查患者往往 准备不足,这可能导致比医学指南建议的更早重复手术。我们认为,如果 门诊结肠镜检查市场中存在准备不足风险的患者使用 Pure—Vu系统有可能减少此类重复手术的需要。我们可能会通过探索与 私人和公共支付者共同关注新技术平台的计划,寻求获得该市场的报销覆盖。

此外,如果我们选择探索任何一个市场, 我们可能能够利用通过我们的临床和未来商业努力建立的现有医院和医生关系。
2021年,医疗保险和医疗补助服务中心("CMS")授予Pure—Vu系统永久ICD—10代码供住院患者使用 。该编码工作是更广泛战略的一部分,可为某些住院和门诊手术获得补偿 ,其中Pure—Vu系统可帮助提高高医疗需求患者结肠准备不足的可视化效果。
员工
截至2023年12月31日,我们有15名全职员工。我们的所有员工都从事行政、财务、研发、工程、监管或销售和市场营销职能。我们相信我们与员工的关系良好。此外, 我们利用并将继续利用顾问、临床研究组织和第三方来执行我们的临床前研究、 临床研究、生产和监管职能。
根据 以色列法律,我们和我们在以色列的员工须遵守以色列保护劳工条款,这些条款涉及某些事项,例如 工作日长度、员工最低工资、年假、病假工资、解雇费的确定和提前通知终止雇佣 ,以及雇用和解雇员工的程序以及平等机会和反歧视法。虽然 我们在以色列的员工都没有加入任何集体谈判协议,但以色列 经济和工业部发布的扩张令可能会使某些行业范围的集体谈判协议适用于我们。这些协议会影响 工作日和工作周的长度、疗养费、差旅费和养老金权利等事项。我们从未经历过与劳动相关的 停工,我们相信我们与员工良好而积极的关系是我们运营的重要组成部分。
以色列 法律一般要求雇主在雇员退休、死亡或解雇时支付遣散费。我们通过每月向员工各自的保险单支付款项,为 正在进行的以色列遣散费义务提供资金。我们在以色列的所有现有 员工都同意,作为其雇佣协议的一部分,在终止雇佣关系时,他们将有权 仅获得保险单中关于遣散费的累计金额。
此外, 以色列雇员和雇主必须向国家保险协会(National Insurance Institute)支付预定金额,这与美国类似。 社会保障管理局。这些数额还包括国民健康保险的付款。
监管事项
政府 法规
我们的 业务受到广泛的联邦、州、地方和外国法律法规的约束,包括与 环境保护、健康和安全相关的法律法规。有些相关法律尚未得到监管机构或 法院的明确解释,其条款可供各种主观解释。此外,这些法律及其解释 可能会发生变化,或者可能会颁布新的法律。
| 12 |
联邦和州政府机构继续使医疗保健行业受到严格的监管审查,包括加强 民事和刑事执法力度。我们认为,我们已经构建了业务运营和与客户的关系 ,以符合所有适用的法律要求。然而,政府实体或其他第三方可能会对这些法律进行不同的解释,并提出相反的主张。我们在下文讨论与我们业务最相关的法规和法规。
美国 食品药品管理局医疗器械法规。
FDCA和FDA法规建立了一个全面的管理人类使用医疗器械的体系。我们的产品 包括受这些以及其他联邦、州、地方和外国法律法规约束的医疗器械。FDA 负责在美国执行管理医疗器械的法律和法规。
FDA将医疗器械分为三类(I类、II类或III类),具体取决于其风险水平和确保器械安全性和有效性所需的控制类型 。类别分配是决定在美国上市前需要的 上市前提交或申请类型的一个因素。
| ● | 类别 I器械风险较低,不能维持生命或维持生命。大多数I类设备仅受 "一般控制"(例如,禁止掺假和贴错标签、注册和上市、良好制造 实践、标签和不良事件报告。一般控制是适用于所有医疗类别的基线要求 设备。) | |
| ● | 类别 II型器械存在中等风险,且仅凭一般控制不足以提供合理保证的器械 安全性和有效性。II类器械受一般控制和"特殊控制"(例如,特殊 标签、符合性能标准和上市后监督。除非豁免,II类器械通常需要 FDA在上市前批准,通过上市前通知(510(k))程序。 | |
| ● | 类别 III型器械风险最高。这些器械通常用于维持生命、维持生命或用于实质性用途 在预防损害人类健康或带来潜在的不合理疾病或伤害风险方面的重要性。III类器械 这些设备的一般控制本身是不够的,并且没有足够的信息来确定 采用特别管制措施可为安全和有效提供合理保证。III类器械为主题 一般控制措施,通常需要FDA批准上市前批准(“PMA”)申请。 |
除非 豁免上市前审查要求,否则医疗器械在美国上市、分销或销售之前必须获得FDA的上市许可。获得上市许可的最常见途径是510(k)批准 和PMA。
510(k) 途径
510(k)审查过程将新器械与合法上市器械进行比较。通过510(k)程序,FDA确定新的 医疗器械是否与合法上市的器械"实质等同"(即,同品种器械)不受 PMA要求的约束。"实质等同"是指申报器械与同品种器械具有相同的预期用途, 和相同或相似的技术特征,或者如果技术特征存在差异,则与同品种器械相比,差异 不会引起不同的安全性和有效性问题,510(k) 中提交的信息证明申报器械与同品种器械一样安全有效。
| 13 |
为获得510(k)许可,公司必须提交一份包含充分信息和数据的510(k)申请,以证明其申报器械与合法上市的同品种器械实质等同。这些数据通常包括非临床性能 测试(例如,软件验证、动物测试、电气安全测试),但也可能包括临床数据。通常情况下,FDA需要 三到十二个月的时间才能完成对510(k)申请的审查;然而,这可能需要更长的时间,并且 永远无法保证获得批准。在510(k)审查期间,FDA可能会要求提供额外信息,包括临床数据,这可能会显著延长审查过程。在完成对510(k)的审查后,FDA可以以信函的形式发布命令,认定 器械(i)实质等同,并声明器械可在美国上市,或(ii)实质等同,并声明器械不能在美国上市。根据不实质等同结果的原因 ,器械可能需要在商业化前通过PMA途径(下文讨论)获得批准。
After a device receives 510(k) clearance, any modification that could significantly affect the safety or effectiveness of the device, or that would constitute a major change in its intended use, including significant modifications to any of our products or procedures, requires submission and clearance of a new 510(k) or approval of a PMA. The FDA relies on each manufacturer to make and document this determination initially, but the FDA can review any such decision and can disagree with a manufacturer’s determination. Modifications meeting certain conditions may be candidates for a streamlined FDA review known as Special 510(k) review, which the FDA intends to process within 30 days of receipt. If a device modification requires the submission of a 510(k), but the modification does not affect the intended use of the device or alter the fundamental technology of the device, then summary information that results from the design control process associated with the cleared device can serve as the basis for clearing the application. A Special 510(k) allows a manufacturer to declare conformance to design controls without providing new data. When a modification involves a change in material, the nature of the “new” material will determine whether a traditional or Special 510(k) is necessary. An Abbreviated 510(k) is another type of 510(k) that is intended to streamline the review of data through the reliance on one or more FDA-recognized consensus standards, special controls established by regulation, or FDA guidance documents. In most cases, an Abbreviated 510(k) includes one or more declarations of conformity to an FDA-recognized consensus standard. We may also make minor product enhancements that we believe do not require new 510(k) clearances. If the FDA disagrees with our determination regarding whether a new 510(k) clearance was required for these modifications, we may need to cease marketing and/or recall the modified device. The FDA may also subject us to other enforcement actions, including, but not limited to, issuing a warning letter or untitled letter to us, seizing our products, imposing civil penalties, or initiating criminal prosecution.
上市前 批准途径
与 510(k)途径的比较标准不同,PMA批准流程需要对器械的安全性和有效性进行独立证明 。PMA是FDA要求的最严格的器械上市申请类型。PMA批准是基于FDA的决定 ,即PMA包含足够有效的科学证据,以确保器械在其预期用途 时安全有效。PMA申请通常包括有关器械的广泛信息,包括对器械进行的临床试验结果 和制造工艺的详细描述。
PMA申请被接受审查后,FDA开始对提交的信息进行深入审查。FDA法规规定180天的时间来审查PMA并做出决定;然而,实际上,审查时间通常更长(例如,1-3年)。在此 审查期间,FDA可能要求提供更多信息或澄清已经提供的信息。此外,在审查期间, 可召集来自FDA以外的专家咨询小组审查和评估支持申请的数据,并就数据是否提供了合理保证,证明器械可用于预期用途 的安全有效性向FDA提供建议。此外,FDA通常会对生产设施进行批准前检查,以确保符合QSR, QSR对医疗器械的设计和 制造提出了全面的开发、测试、控制、文档和其他质量保证要求。
根据其审查,FDA可以(i)发布批准PMA的命令,(ii)发布信函,声明PMA是"可批准的"(例如, 需要次要的附加信息),(iii)发出信函,说明PMA“不可批准”,或(iv)发出命令 拒绝PMA。在FDA发布批准PMA的命令之前,公司不得销售接受PMA审查的器械。作为PMA 批准的一部分,FDA可能会施加旨在确保器械持续安全性和有效性的批准后条件,其中包括 对标签、促销、销售和分销的限制,以及要求收集其他临床数据。 不遵守批准条件可能导致重大不利的执法行动,包括撤销批准。
| 14 |
对PMA批准器械的大多数 修改,包括设计、标签或制造过程的变更,在 实施之前都需要事先批准。通过提交PMA补充文件获得事先批准。支持PMA补充文件所需的信息类型和FDA审查PMA补充文件的时间因修改的性质而异。
临床试验
在美国,医疗器械的临床试验(包括评估已上市医疗器械的新用途或改良用途的临床研究)受FDA的试验器械豁免("IDE")法规的管辖。本法规赋予临床研究的申办者重大 责任,包括但不限于选择合格的研究者、监测试验、 提交所需报告、保存所需记录,并确保研究者获得知情同意、遵守研究方案 控制试验用器械的处置、提交所需报告等。
重大风险器械的临床 试验(例如,植入物、用于支持或维持人类生命的器械、在诊断、治愈、缓解或治疗疾病或以其他方式预防人类健康损害方面具有重大意义的器械)在开始试验前需要FDA和机构审查委员会("IRB")批准。FDA批准通过提交IDE申请获得。 非重大风险临床试验("NSR")、器械(即,不符合重大风险器械( )的监管定义的器械)在开始前仅需要IRB批准。临床试验申办方负责初步确定 临床研究是否具有重大风险或NSR;但是,审查IRB和/或FDA可能会审查该决定,并不同意 该决定。
IDE申请必须得到适当数据的支持,如性能数据、动物和实验室试验结果,证明 在人体中评价器械是安全的,并且临床研究方案是科学合理的。无法保证 提交IDE将导致开始临床试验的能力。此外,在试验开始后,如果(除其他原因外)FDA得出结论认为临床受试者暴露于不可接受的健康风险,则会暂停试验或终止试验。
如上所述,FDA可能要求公司收集上市后器械的临床数据。
收集此类数据可能是PMA批准的一个条件。FDA还有权在某些器械获得许可或批准后的任何时候通过信函命令对其进行上市后 监督研究。
类似的 要求可能适用于其他国家和司法管辖区,包括欧洲经济区或EEA(其中包括 27个欧盟成员国以及冰岛、列支敦士登和挪威)和英国。
普遍的 和持续的FDA法规
器械投放市场后,无论其分类或上市前途径如何,通常都会适用许多额外的FDA要求 。这些包括但不限于:
| ● | 机构 注册和器械上市要求; | |
| ● | 质量 系统法规(“QSR”),管理设计、制造中使用的方法、设施和控制, 成品器械的包装、贴标签、储存、安装和维修; | |
| ● | 标签 要求,要求在器械标签和标签中包含某些内容,通常要求标签和包装 包括唯一器械标识符("UDI")的医疗器械,并且还禁止为 未经批准或未经批准,即,"标签外"使用; | |
| ● | 医疗 器械报告("MDR")法规,要求制造商和进口商向FDA报告器械 可能导致或促成死亡或重伤,或可能导致或促成 死亡或严重伤害,如果它再次发生;和 | |
| ● | 报告 纠正和召回条例,要求制造商和进口商向FDA报告召回(即,更正 或移除),如果采取措施以降低器械对健康造成的风险,或补救可能导致的FDCA违反行为 对健康的风险;制造商和进口商必须保留他们认为不应报告的召回记录。 |
| 15 |
2024年1月31日,FDA发布了一项最终规则,修订了21 CFR 第820部分下的QSR现行药品生产质量管理规范(CGMP)要求,以更接近 全球许多其他监管机构使用的医疗器械质量管理体系的国际共识标准。本规则通过引用纳入国际标准化组织(ISO)ISO 13485:2016针对医疗器械质量管理体系制定的国际标准的质量管理体系要求,修订了21 CFR第820部分。这项新规定在《联邦公报》上公布两年后生效。在 之前,制造商必须遵守QS法规。FDA将于2026年2月2日生效 起开始执行QMSR要求。
FDA通过检查和市场监督来执行这些要求。不遵守适用的监管要求可能导致FDA采取执法行动,其中可能包括但不限于以下制裁:
| ● | 无标题 信件或警告信; | |
| ● | 罚款 禁令和民事处罚; | |
| ● | 召回 或扣押我们的产品; | |
| ● | 操作 限制、部分停止或全部停止生产; | |
| ● | 拒绝 我们要求新产品获得510(k)许可或上市前批准; | |
| ● | 退出 510(k)已经获得的许可或上市前批准;以及 | |
| ● | 刑事 起诉 |
我们 将接受FDA以及其他监管机构宣布或未宣布的器械检查,以监督适用州公共卫生法规的实施和遵守情况。这些检查可能包括我们供应商的设施。
国际
医疗器械的国际销售 受外国政府法规的约束,各国的法规差异很大。为了在其他国家 销售我们的产品,我们必须获得监管部门的批准或认证,并遵守这些国家的广泛安全和质量 法规。获得批准或认证以在国外销售我们的产品所需的时间 可能比FDA批准或批准所需的时间更长或更短,并且要求可能有所不同。有意在欧洲经济区(“EEA”)销售医疗器械的医疗器械制造商 需要在其医疗器械上贴上CE标志,通常需要在公告机构的干预下并颁发CE符合性证书后才行。许多其他国家,如澳大利亚、印度、新西兰、巴基斯坦和斯里兰卡,接受CE符合性证书或FDA批准或批准,但 其他国家,如巴西、加拿大和日本要求单独提交监管文件。
欧盟医疗器械法规(2017年4月5日欧洲议会和理事会关于医疗器械的法规2017/745), 或"欧盟MDR",规定了目前适用于EEA医疗器械的基本监管框架。欧盟MDR于2021年5月26日开始适用,废除了之前的理事会指令93/42/EEC或"欧盟MDD",该指令在过去20多年里一直在规范EEA的医疗器械。这代表了 欧洲经济区医疗器械监管格局的重大变化。欧盟MDR列出了某些过渡性条款,允许已废除的欧盟MDD涵盖的医疗器械(称为"遗留 器械")在一段时间内仍在EEA上市。
| 16 |
在 EEA中,医疗器械目前需要符合EU MDR附录I中的一般安全性和性能要求(或"GSPR") (对于遗留器械,这对应于EU MDD附录I的基本要求)。符合 GSPR是我们能够在医疗器械上贴上CE标志的先决条件,没有CE标志,医疗器械无法在 EEA商业化。为了证明符合GSPR并获得贴上CE标志的权利,我们必须接受符合性评估程序, 该程序根据医疗器械的类型及其分类而有所不同。在EEA中,医疗器械分为四个不同的 风险类别:I类(进一步分为(i)无菌条件下上市的器械,(ii)具有测量 功能,(iii)可重复使用的手术器械,以及(iv)所有其他)、IIa、IIb和III类。
低风险医疗器械除外(I类,如果它们没有测量功能、非无菌且不是可重复使用的手术器械), 如果制造商可以根据器械符合GSPR的自我评估发布欧盟符合性声明,则符合性评估程序需要公告机构的干预,该组织是经欧洲经济区成员国主管机构 认可的进行符合性评估的组织。在 颁发CE符合性证书之前,公告机构通常会审核和检查产品的 技术文件和质量管理体系,以用于医疗器械的制造、设计和最终检验。在成功完成符合性评估后收到公告机构颁发的CE符合性证书 ,我们可以起草欧盟符合性声明,以便我们在产品上贴上CE标志。
根据 欧盟MDR,在器械预期用途的正常条件下,确认符合相关GSPR,评价 不良副作用和受益风险比的可接受性,应基于提供充分 临床证据的临床数据,包括适用的上市后数据。要求制造商详细说明并证明证明符合相关GSPR所需的临床证据水平。考虑到器械的特性及其预期用途,此级别的临床证据必须适当。
除了 参与初始符合性评估程序外,公告机构还需要进行年度审核(监督 审核),并且还需要至少每五年一次随机进行未经通知的审核。制造商的质量管理体系和 技术文件将需要定期重新认证,因为 认证机构颁发的CE符合性证书仅在其中指定的期限内有效,在任何情况下都不超过五年。
在EEA进行临床研究受详细监管义务的约束。这些要求包括要求获得研究所在国主管当局的事先授权, 以及要求获得 相关主管伦理委员会的肯定意见。临床研究(根据欧盟MDR称为"临床研究") 现在对于植入式器械和III类医疗器械(有某些豁免)是强制性的。
欧盟MDR还提供了与上市后监督和警戒相关的各种要求,包括制造商 实施上市后监督系统的义务,其方式应与风险等级成比例,并适用于器械类型。 一旦器械进入欧洲经济区市场,制造商必须遵守某些警戒要求,例如向相关主管部门报告严重事件 和现场安全纠正措施(即使是发生在欧洲经济区以外的事件)。
此外, 我们的产品在EEA的广告和促销受欧盟MDR、各个EEA成员国的国家法律、 关于误导性和比较性广告的指令2006/114/EC、关于不公平商业行为的指令2005/29/EC以及 以及其他EEA成员国关于医疗器械广告和促销的法律和行业规范的约束。这些法律可能会限制 或限制向公众宣传我们的产品,并可能会限制我们与医疗保健专业人员的促销活动 。
与欧盟MDD相比, 欧盟MDR要求我们在进入并留在欧洲经济区市场方面承担更多的合规义务。根据欧盟MDR第120条,我们的 当前CE符合性证书的有效期至2024年5月27日。这意味着,如果我们 希望在EEA不间断地继续销售我们的产品,我们需要在该有效期之前根据EU MDR获得新的CE符合性证书 。目前,有数量相对较少的公告机构已根据欧盟MDR进行符合性 评估。这可能会大大延迟我们未来的合格评定程序。
| 17 |
2023年3月15日,欧洲议会和欧盟理事会通过了一项修订欧盟MDR的条例,现行的欧盟MDR第120条过渡性条款允许延长某些CE符合性证书的有效期。这些过渡性条款允许根据欧盟MDD颁发的CE符合性证书在以下主要条件下对IIb类植入式设备(和其他设备)和IIa类设备(和其他设备)有效到2027年12月31日: (1)设备不会对健康和安全构成任何不可接受的风险,(2)设备的设计或预期用途未发生重大变化,以及(3)制造商应采取必要步骤以启动MDR下的认证过程,例如 调整其质量管理体系以适应MDR,并向通知机构提交MDR认证申请。 此次对欧盟MDR的修订可能会对我们当前的CE符合性证书产生影响,将其有效期延长至2024年5月27日之后。
英国退欧
英国于2020年1月31日退出欧盟(这一退出通常被称为英国退欧)。英国脱欧给英国和欧盟之间的未来关系带来了巨大的不确定性。2020年12月24日,欧盟和英国就未来关系的框架--《欧盟-英国贸易与合作协定》--达成原则性协议。该协定主要侧重于确保欧盟和英国之间在商品方面的自由贸易,但没有具体涉及医疗器械。英国退出欧盟后,英国(英格兰、苏格兰和威尔士)被欧盟视为第三国。北爱尔兰在欧盟法规方面继续遵守欧盟监管规则。鉴于CE标志程序是在欧盟法律中规定的,而欧盟法律已不再适用于英国,英国设计了一条进入市场的新途径,最终以英国符合性评估(UKCA)标志取代CE标志。进入市场的路线和UKCA的标志要求是基于欧盟MDD的要求。 北爱尔兰继续受CE标志管理条例的保护。作为协议的一部分,欧盟和英国已同意 继续承认基于对方领土自我评估的符合性声明。
自2021年1月1日起,《2020年医疗器械(欧盟出口)条例》对医疗器械在英国市场上的投放方式进行了一系列变化。CE标志将在2024年7月之前继续在英国得到认可,而由欧洲经济区指定的通知机构颁发的证书将在2024年7月之前继续在英国市场有效。从2024年7月起,当未来的英国医疗器械法规预计将适用时,制造商必须获得英国KCA标志才能将医疗器械 投放到英国市场。现有CE和UKCA标记的设备有一定的过渡期。
其他监管事项
产品审批后的制造、销售、促销和其他活动也受到FDA监管机构的监管,包括在美国的医疗保险和医疗补助服务中心(“CMS”)、卫生与公众服务部的其他部门、司法部、消费品安全委员会、联邦贸易委员会、职业安全与健康管理局、环境保护局以及州和地方政府。 如果产品是向综合服务管理局联邦供应时间表的授权用户提供的,适用其他 法律和要求。制造、销售、促销和其他活动也可能受到联邦和州消费者保护和不正当竞争法律的约束。
医疗器械产品的分销受到其他要求和法规的约束,包括旨在防止未经授权销售医疗器械产品的广泛记录保存、许可、 存储和安全要求。
| 18 |
第三方 付款人承保和报销
Our Pure-Vu System and the procedure to cleanse the colon in preparation for colonoscopy are not currently separately reimbursable through private or governmental third-party payors in any country. Significant uncertainty exists as to whether coverage and separate reimbursement of the Pure-Vu System will develop; but we sought new technology payments from Medicare under the hospital Inpatient and Outpatient Prospective Payment Systems and were denied in 2021. We intend to seek separate reimbursement for future versions of the system through private or governmental third-party payors in the future. In both the United States and foreign markets, our ability to commercialize the Pure-Vu System successfully, and to attract commercialization partners for the Pure-Vu System, depends in part on the availability of adequate coverage and reimbursement from third-party payors, including, in the United States, governmental payors such as the Medicare and Medicaid programs, managed care organizations, and private health insurers. Medicare is a federally funded program managed by CMS through local contractors that administer coverage and reimbursement for certain healthcare items and services furnished to the elderly and disabled. Medicaid is an insurance program for certain categories of patients whose income and assets fall below state defined levels and who are otherwise uninsured, and it is both federally and state funded and managed by each state. The federal government sets general guidelines for Medicaid and each state creates specific regulations or other guidelines that govern its individual program. Each payor, whether governmental or private, has its own process and standards for determining whether it will cover and reimburse a procedure or particular product. Private payors often rely on the lead of the governmental payors in rendering coverage and reimbursement determinations. Therefore, achieving favorable Medicare coverage and reimbursement is usually a significant gating issue for successful introduction of a new product. The competitive position of the Pure-Vu System will depend, in part, upon the extent of coverage and adequate reimbursement for such product and for the procedures in which such product is used. Prices at which we or our customers seek reimbursement for the Pure-Vu System can be subject to challenge, reduction or denial by the government and other payors.
如果 我们确实获得了第三方或政府对我们产品进行补偿的批准,如果政府和商业第三方支付方未能提供足够的保险范围和支付金额,则此类产品的适销性可能会受到影响。在美国,对成本控制措施的重视程度有所提高,我们预计这种情况将继续下去。承保政策和第三方报销率 可能随时更改。即使我们获得监管部门 批准的一个或多个产品获得了有利的承保范围和报销状态,将来可能会实施不太有利的承保范围和报销率。
未来可能会采取州 和联邦医疗改革措施,其中任何措施都可能导致Medicare和 其他医疗保健资金的进一步减少,并以其他方式影响我们可能获得监管部门 批准的任何候选产品的价格,或任何此类候选产品的处方或使用频率。
此外,在某些国外,医疗器械的拟议定价必须获得批准,方可合法上市。 管理医疗器械定价的要求因国家而异。例如,欧洲经济区为其成员国 提供了选项,以限制其国家健康保险系统提供报销的医疗器械范围,并控制 医疗器械价格。在某些国家,我们可能需要进行临床研究或其他研究,将我们的任何医疗器械与其他疗法的成本效益进行比较,以获得或保持报销或定价批准。其他欧洲经济区国家 允许公司自行确定医疗器械价格,但监督和控制公司利润。医疗费用的下行压力已经变得非常大。因此,对新设备的进入设置了越来越高的障碍。此外, 在某些国家,来自低价市场的跨境进口会对一个国家的定价造成商业压力。
近年来,许多欧洲经济区国家引入了所谓的卫生技术评估(HTA)。HTA衡量 一种新的医疗技术(在我们的例子中是医疗设备)与现有技术相比的附加值。HTA的评估包括 患者的成本影响及其对治疗管理中医疗保健系统组织的影响。欧盟关于HTA的法规于2022年1月生效,并将在三年后(2025年1月)实施。它为欧洲经济区国家的HTA 机构对新型高风险医疗器械进行联合临床评估提供了可能性。
| 19 |
从历史上看, 在欧盟推出的产品并不遵循美国的价格结构,通常价格往往会大幅降低 。第三方付款人或当局公布折扣可能会导致价格或报销水平在发布国和其他国家/地区受到进一步压力。如果定价设置在不令人满意的水平,或者如果无法报销医疗器械 ,或者报销范围或金额有限,我们或战略合作伙伴的销售收入以及我们在这些国家/地区的任何医疗器械的潜在盈利能力 都会受到负面影响。
其他 医疗保健法律和合规要求
医疗保健服务提供者、医生和第三方付款人在推荐和使用我们当前产品和未来任何 产品时发挥着主要作用,我们可能获得上市许可,根据任何联邦医疗保健计划支付费用。 与第三方付款人、医疗保健提供者和医生的安排将使我们面临广泛适用的欺诈和滥用以及其他 医疗保健法律法规,这些法律法规可能会限制我们营销、 销售和分销产品的业务或财务安排和关系。在美国,适用的联邦和州医疗保健法律和法规规定的限制包括, 但不限于:
| ● | The federal Anti-Kickback Statute (“AKS”) makes it illegal for any person, including a device manufacturer (or a party acting on its behalf), to knowingly and willfully solicit, receive, offer or pay any remuneration, directly or indirectly, in cash or in kind, that is intended to induce or reward, or in return for, the purchase, lease, recommendation, order, or arranging for the purchase, lease, or order, of any health care product or service for which payment may be made under a federal healthcare program, such as Medicare or Medicaid. The term “remuneration” has been broadly interpreted to include anything of value, including cash, improper discounts, and free or reduced-price items and services. Violations of this law are punishable by up to ten years in prison, criminal fines, administrative civil money penalties and exclusion from participation in federal healthcare programs. In addition, a person or entity does not need to have actual knowledge of the statute or specific intent to violate it. There are a number of statutory exceptions and regulatory safe harbors protecting from prosecution some common activities like discounts, or engaging health care professionals to provide services to the company; however, those exceptions and safe harbors are drawn narrowly, and there is no exception or safe harbor for many common business activities like educational grants or reimbursement support programs. Failure to meet all of the requirements of a particular statutory exception or regulatory safe harbor does not make the conduct per se illegal under the Anti-Kickback Statute, but the legality of the arrangement will be evaluated on a case by case basis based on the totality of the facts and circumstances. | |
| ● | The federal civil False Claims Act imposes liability, including through civil whistleblower or qui tam actions, against individuals or entities (including manufacturers) for, among other things, knowingly presenting, or causing to be presented, false or fraudulent claims for payment of government funds, knowingly making, using, or causing to be made or used a false statement or record material to an obligation to pay money to the government, or knowingly concealing or knowingly and improperly avoiding, decreasing or concealing an obligation to pay money to the federal government. Penalties for a False Claims Act violation include three times the actual damages sustained by the government, plus significant mandatory penalties per false claim or statement for violations for each separate false claim, and the potential for exclusion from participation in federal healthcare programs. Conduct that violates the False Claims Act also may implicate various federal criminal statutes. The government may deem manufacturers to have “caused” the submission of false or fraudulent claims by, for example, providing inaccurate billing or coding- information to customers or promoting a product off-label. Claims which include items or services resulting from a violation of the federal Anti-Kickback Statute also are deemed false or fraudulent claims for purposes of the False Claims Act. Our marketing and activities relating to the reporting of wholesaler or estimated retail prices for our products and other information affecting federal, state and third-party reimbursement for our products, and the sale and marketing of our product and any future product candidates, are subject to scrutiny under this law. |
| 20 |
| ● | 1996年《健康保险流通和责任法案》及其实施条例(统称为"HIPAA") 对故意实施或企图实施欺诈医疗福利的计划,规定刑事责任 计划,包括私人第三方付款人;故意挪用或窃取医疗福利计划; 故意妨碍对医疗保健犯罪的刑事调查;以及故意伪造、隐瞒或掩盖 隐瞒重要事实,或就交付或付款作出任何重大虚假、虚构或欺诈性声明 医疗福利、物品或服务。HIPAA还规定了某些义务,包括合同条款和技术保障措施, 保障个人可识别健康资料的隐私、安全和传输。 | |
| ● | 联邦医师支付阳光法案及其实施条例,该法案要求某些设备制造商和 根据Medicare、Medicaid或儿童健康保险计划(某些 例外)报告与直接或间接进行或分配的某些付款或其他价值转移有关的信息, 医生、医生助理、执业护士、临床专科护士、注册护士麻醉师,以及注册 护士助产士和教学医院,以及医生及其直系亲属持有的所有权和投资权益 成员 |
| ● | 类似 国家和外国欺诈和滥用法律法规,如反回扣和虚假索赔法,这些法律可能适用于销售和 涉及由任何第三方付款人报销的医疗保健项目或服务的营销安排和索赔,包括商业 保险公司,以及要求制造商报告与付款和其他价值转移相关的信息的州和地方法律 卫生保健提供者以及州和地方法律,要求制造商实施合规计划或营销守则。 在某些情况下管理健康信息隐私和安全的州法律,其中许多法律彼此不同 在很大程度上,而且往往没有被联邦法律抢先,从而使合规努力复杂化。此类法律通常很宽泛 并由各种国家机构和私人行动执行。 |
医疗器械制造商和医生之间的互动 也受严格的法律、法规、行业自律行为准则 和医生职业行为准则的约束,这些准则在欧洲经济区层面和欧洲经济区成员国制定。欧洲经济区通常禁止向医生提供利益或好处,以诱导或鼓励推荐、认可、购买、供应、订购或 使用医疗器械。违反这些法律可能导致巨额罚款和监禁。 支付给某些欧洲经济区成员国的医生的款项也必须公开披露。此外,与医生的协议通常必须 事先通知并得到医生雇主、其主管专业组织和/或个别欧洲经济区成员国主管当局的批准。不遵守这些要求可能导致声誉风险、公开谴责、行政处罚、罚款或监禁。
此外,我们可能会遵守联邦政府和我们开展业务的州 的数据隐私和安全法规。HIPAA对个人可识别健康 信息的隐私、安全和传输实施了某些要求,这些要求适用于"业务伙伴"——创建、接收、维护 或传输与提供特定服务或代表受保护 实体执行某项功能有关的受保护健康信息的某些个人或实体。
Further, the legislative and regulatory landscape for privacy and data security continues to evolve, and there has been an increasing amount of focus on privacy and data security issues with the potential to affect our business. Congress and state legislatures also have been considering and enacting new legislation relating to privacy and data protection. For example, in California, the California Consumer Privacy Act (“CCPA”) created new transparency requirements and granted California residents several new rights with regard their personal information. In addition, in November 2020, California voters approved the California Privacy Rights Act (“CPRA”) ballot initiative which introduced significant amendments to the CCPA and established and funded a dedicated California privacy regulator, the California Privacy Protection Agency (“CPPA”). The amendments introduced by the CPRA go into effect on January 1, 2023, and new implementing regulations are expected to be introduced by the CPPA. Failure to comply with the CCPA may result in, among other things, significant civil penalties and injunctive relief, or potential statutory or actual damages. In addition, California residents have the right to bring a private right of action in connection with certain types of incidents. These claims may result in significant liability and potential damages. We implemented processes to manage compliance with the CCPA and continue to assess the impact of the CPRA, and other state legislation, on our business as additional information and guidance becomes available.
| 21 |
The Federal Trade Commission (“FTC”) also sets expectations for failing to take appropriate steps to keep consumers’ personal information secure, or failing to provide a level of security commensurate to promises made to individual about the security of their personal information (such as in a privacy notice) may constitute unfair or deceptive acts or practices in violation of Section 5(a) of the Federal Trade Commission Act (“FTC Act”). The FTC expects a company’s data security measures to be reasonable and appropriate in light of the sensitivity and volume of consumer information it holds, the size and complexity of its business, and the cost of available tools to improve security and reduce vulnerabilities. Individually identifiable health information is considered sensitive data that merits stronger safeguards. With respect to privacy, the FTC also sets expectations that companies honor the privacy promises made to individuals about how the company handles consumers’ personal information; any failure to honor promises, such as the statements made in a privacy policy or on a website, may also constitute unfair or deceptive acts or practices in violation of the FTC Act. While we do not intend to engage in unfair or deceptive acts or practices, the FTC has the power to enforce promises as it interprets them, and events that we cannot fully control, such as data breaches, may be result in FTC enforcement. Enforcement by the FTC under the FTC Act can result in civil penalties or enforcement actions.
欧洲经济区 成员国和我们运营所在的其他司法管辖区已采纳了数据保护法律和法规,这些法律和法规规定了重要的合规性 义务。例如,《通用数据保护条例》(或“GDPR”)对收集、分析和传输个人数据的能力施加了严格的义务和限制 ,特别是在敏感个人数据(例如来自临床研究的健康数据 )和安全报告的情况下。GDPR还对个人数据从欧洲经济区(包括向美国)的传输实施了严格的规定,以及对未能遵守GDPR和欧洲经济区国家相关国家数据保护法要求的罚款和处罚,最高可达2,000万欧元或 上一财年全球年营业额总额的4%,以较高者为准。因此,GDPR项下的义务可能繁重,并对我们的业务、 财务状况、经营业绩和前景造成不利影响。
瑞士 也采取了类似的限制措施。这些义务和限制特别涉及 个人数据所涉及的个人的同意、向个人提供的信息、将个人数据转移到欧洲经济区或瑞士、安全 违规通知、个人数据的安全性和保密性,以及违反数据保护义务 的潜在罚款。
来自不同欧盟成员国的数据保护机构可能会对GDPR和适用的相关国家法律进行不同的解释,并且 在GDPR中规定的要求之外施加额外的要求。此外,实施和合规实践指南可能会 更新或以其他方式修订,这增加了欧盟处理个人数据的复杂性。在欧盟处理受试者 的个人数据时,我们必须遵守适用的数据保护法律。特别是,当我们依赖第三方服务提供商处理 欧盟受试者的个人数据时,我们必须与这些提供商签订适当的协议,并获得充分保证, 提供商满足适用的数据保护法律的要求,特别是规定了具体和相关的 义务的GDPR。
虽然 有法律机制允许将个人数据从欧洲经济区转移到美国,但欧洲法院的裁决 增加了遵守欧盟隐私法要求的不确定性。由于Schrems案(案件 C—362/14 Maximillian Schrems诉数据保护专员)的判决,不再可能依赖安全港认证作为将个人数据从欧盟转移到美国实体的法律依据。一些可用的合法转让机制正在受到 的审查和不断变化,例如欧盟委员会的标准合同条款(SCC)。虽然SCC仍然是最常见的 授权的将个人数据转移出欧盟的程序,但2023年7月10日,欧盟委员会通过了关于欧盟—美国数据隐私框架的充分性决定 ,这意味着个人数据现在可以自由地从欧洲经济区流向参与 数据隐私框架的美国公司。
| 22 |
此外, 在英国退出欧盟后,英国在个人数据传输方面成为欧洲经济区的第三国。欧盟委员会通过了 关于个人数据保护水平的无资格决定。然而,从欧洲经济区到英国的个人数据传输 仍然可能面临比以前更大的风险,因为一项资格决定可能会被暂停。
在 Schrems II决定之后,瑞士联邦数据保护和信息专员(FDPIC)也宣布,瑞士—美国 隐私保护并未为从瑞士到美国的个人数据传输提供足够的保障。虽然 FDPIC无权使瑞士—美国隐私保护制度失效,但FDPIC的公告令人怀疑瑞士—美国隐私保护制度是否能作为瑞士—美国数据传输的未来合规机制。
遵守数据传输义务涉及对数据进口商所在国家/地区的数据访问和保护法律的详细分析,这可能成本高昂且耗时。数据进口商还必须花费资源来分析其遵守转移义务的能力,包括实施新的保障和控制措施以进一步保护个人数据。如果我们或我们的供应商 未能遵守适用的数据隐私法,或者如果我们或我们的供应商所依赖的法律机制允许将个人数据从欧洲经济区、英国或瑞士转移到欧盟委员会认为不足以提供足够水平的数据保护的其他国家/地区,我们可能会受到政府的执法行动和严厉的惩罚 ,如果我们将个人数据转移到欧洲经济区、英国或瑞士之外的能力受到限制,我们的业务可能会受到不利影响,这可能会对我们的经营业绩产生不利影响。
规范个人数据的法律环境正在不断发展,遵守这些法律需要灵活的隐私框架 和大量资源,而在未来,合规工作可能会带来越来越大的成本。
当前 和未来立法
在 美国和外国司法管辖区, 医疗保健系统方面发生了多项立法和监管变更以及拟议变更,这些变更可能会阻止或延迟我们候选产品的上市批准,限制或监管批准后活动 ,并影响我们以盈利方式销售我们获得上市批准的任何候选产品的能力。我们预计,现行法律 以及未来可能采用的其他医疗改革措施,可能会导致更严格的覆盖标准,并对我们或任何合作者可能收到的任何获批产品的价格造成额外的 下行压力。
在 欧洲经济区,如上所述,欧盟MDR要求我们进入并留在欧洲经济区市场的合规义务增加。 它对适用于欧洲经济区医疗器械制造商和公告机构的义务进行了实质性修改。因此, 可根据欧盟MDR进行符合性评估的公告机构减少,这显著增加了 公司进入EEA市场所需的时间。此外,由于欧盟MDR从2021年5月开始适用,因此许多指南 文件仍无法用于指导制造商和公告机构。2022年1月生效并将在三年后(2025年1月)实施的欧盟卫生技术评估法规(HTA) 也可能在未来影响我们产品的定价 和报销。
关于国际业务的其他 法律和法规
如果 我们进一步将业务扩展到美国以外,我们必须投入额外的资源,以遵守我们计划开展业务的每个司法管辖区的众多法律和 法规。《反海外腐败法》(FCPA)禁止任何美国个人 或企业直接或间接向任何外国官员、 政党或候选人或国际公共组织的任何雇员支付、提供、授权支付或提供任何有价值的东西,目的是影响外国实体的任何行为或决定 ,以协助个人或企业获得或保留业务。《反腐败法》还规定,证券在美国上市的公司 有义务遵守某些会计规定,这些规定要求公司保存准确、公平地反映公司(包括国际子公司)所有交易的账簿和记录,并设计 和维护适当的内部会计控制系统。
| 23 |
遵守《反海外腐败法》 成本高昂且资源密集,特别是在腐败是公认问题的国家。此外, 《反海外腐败法》在医疗器械和制药行业带来了特殊的挑战,因为在许多国家,医院 由政府运营,医生和其他医院员工被视为外国官员。与临床试验和其他工作有关的某些向医院支付的款项 被认为是向政府官员支付的不当款项,并导致了FCPA 的执行行动。近年来,在美国和世界各地,政府对在我们行业经营的公司进行的调查和诉讼呈上升趋势。我们可能会卷入在我们日常业务过程中出现的政府调查 。
各种 法律、法规和行政命令还限制在美国境外使用和传播,或与某些 非美国国民共享出于国家安全目的而分类的信息,以及某些产品和与这些产品相关的技术数据。如果我们将业务扩展到美国以外,将需要我们投入额外资源来遵守 这些法律,而这些法律可能会阻止我们在 美国境外开发、制造或销售某些产品和候选产品,这可能会限制我们的增长潜力并增加我们的开发成本。
不遵守国际商业惯例的法律可能导致重大民事和刑事处罚以及暂停 或禁止政府订约。美国证券交易委员会(SEC)也可以暂停或禁止发行人在美国交易所交易 证券,因为其违反了《反海外腐败法》的会计规定。
我们在美国以外的 业务活动还受反贿赂或反腐败法律、法规、行业自律 行为准则和医生职业行为准则或我们业务所在的其他国家(包括英国)的规则的约束。2010年《反贿赂法》。
上市后 法规
在 新产品获得批准或批准后,公司和产品将受到FDA和其他外国、 联邦和州监管机构的持续监管,其中包括监测和记录保存活动,向适用的 监管机构报告产品的不良经历,向监管机构提供最新的安全性和有效性 信息,产品抽样和分销要求,以及遵守促销和广告要求,其中包括 直接面向消费者的广告标准,对产品批准标签中未描述的用途或患者人群中的促销限制 (称为"标签外使用"),对行业赞助的科学和教育活动的限制,以及对涉及互联网的促销活动的要求。虽然医生可以处方合法可用的产品 用于标签外用途,但制造商不得销售或推广此类标签外用途。产品或标签的修改或增强 或生产地点的变更通常需要FDA和其他监管机构的批准,或需要欧盟公告 机构的审查,这些通知可能会收到,也可能不会收到,或可能会导致漫长的审查过程。
公司 和可用信息
我们 是一家特拉华州公司,成立于2016年9月,名称为Eight—Ten Merger Corp.。2016年11月,我们更名为Motus GI Holdings,Inc.。我们是Motus GI Medical Technologies Ltd.的母公司,一家以色列公司和Motus GI,LLC(前 Motus GI,Inc.),特拉华州的一家有限责任公司Motus GI,Inc.自2021年1月1日起由公司转变为有限责任公司。
我们的 主要执行办公室位于1301 East Broward Boulevard,3楼,Ft. 33301.我们的电话号码是(954) 541—8000,我们的网址是www.motusgi.com。我们的网站和包含在我们的网站上或可通过我们的网站访问的信息 将不被视为通过引用纳入本10—K表格的年度报告或我们向 提交或提供给SEC的任何其他报告。
| 24 |
我们 通过网站www.example.com上的投资者关系链接或免费提供新闻稿和 投资者介绍,以及我们以电子方式向SEC提交的所有材料,包括我们的年度10—K表报告、 季度报告、当前8—K表报告以及这些报告的修订,www.motusgi.com或将其提供给证监会。在本表格10—K涵盖的期间内,我们在向SEC提交此类材料后,在合理可行的情况下 尽快通过我们的网站提供所有此类材料。SEC维护一个互联网网站www.example.com,其中包含报告、代理 和信息声明以及我们以电子方式提交给SEC的其他信息。
此处出现的"Motus GI"、"Pure—Vu"以及我们其他注册或普通法商标、服务商标或商品名称均为Motus GI Holdings,Inc.的财产。本报告中提到的某些商标没有使用®和™符号, 但此类引用不应被解释为任何指示,表明其各自的所有者不会在 适用法律的最大程度上主张其对商标的权利。我们无意使用或展示其他公司的商标和商品名称以暗示 与任何其他公司的关系,或由任何其他公司对我们的认可或赞助。
| 第 1a项。 | 风险因素 |
投资我们的普通股涉及高度风险。您应仔细考虑以下所述的风险和不确定性, 以及本10—K表格年度报告和我们提交给美国证券交易委员会的其他报告中的所有其他信息。 以下所列风险并非我们面临的唯一风险。可能存在其他风险和不确定性,可能对我们的 业务、运营和财务状况造成不利影响。如果以下任何一个或多个风险实际发生,我们的业务、财务状况、声誉、运营和/或未来前景将受到影响。在这种情况下,我们普通股的价值可能会下降,您 可能会损失您为我们普通股支付的全部或大部分资金。
摘要
以下总结了可能对我们产生重大不利影响的主要风险和不确定性。您应结合 下面对每个风险因素的更详细描述阅读本摘要。
与我们的战略替代流程相关的风险 ,包括与以下各项相关的风险:
| ● | 无法识别和实施任何战略性业务合并或其他交易。 | |
| ● | 我们可能完成的任何战略性交易的负面后果。 | |
| ● | 与战略交易谈判和完成有关的运营和财务风险。 | |
| ● | 如果 我们未能完成一项战略性交易,我们可能需要寻求破产,解散或清算。 |
与我们的财务状况和资本需求有关的风险,包括与以下方面有关的风险:
| ● | 我们的业务的可持续性以及持续经营的能力。 | |
| ● | 自成立以来的经营经常性亏损,以及可能永远无法盈利。 | |
| ● | 我们的 贷款协议项下对Kreos Capital VI(Expert Fund)LP的债务及相关限制。 | |
| ● | 需要大量额外资金来资助我们的运营,如果我们无法获得此类融资,我们可能无法完成 我们任何候选产品的开发和商业化。 | |
| ● | 发行额外股本证券与必要集资有关的潜在摊薄影响。 | |
| ● | 我们的 使用净经营亏损结转和其他税务属性的能力可能受到限制。 |
与政府监管和第三方报销有关的风险 ,包括与以下方面有关的风险:
| ● | 当前和未来监管成本高昂和复杂的影响。 | |
| ● | 我们的 能够成功获得或保持必要的政府批准或第三方认证,以销售我们的Pure—Vu 在国内和整个欧洲经济区的系统。 | |
| ● | 需要获得新的510(k)许可或新的CE符合性证书,以防需要我们进行新的修改 停止销售或启动召回等待批准。 | |
| ● | 可能导致死亡或重伤的产品故障,使我们受到执法行动. |
| 25 |
| ● | 我们的Pure—Vu系统可能召回或发现产品存在严重安全问题。 | |
| ● | 我们的 Pure—Vu系统目前无法通过私人或政府第三方支付者单独偿还。 | |
| ● | 由于最近和未来的立法,我们的产品上市审批和商业化的困难和成本增加。 | |
| ● | 如果我们未能遵守欺诈和滥用法律,我们将承担潜在的责任。 | |
| ● | 如果我们不适当地推广我们的Pure—Vu系统,则可能承担的责任和商业化后果。 | |
| ● | 可能因可能不遵守反腐败法而受到民事和/或刑事制裁。 | |
| ● | 管理国际业务运营的法律法规以及对我们业务的潜在不利影响。 |
与我们的业务运营相关的风险 ,包括与以下各项相关的风险:
| ● | 有 只有一种产品,而且缺乏保证,我们将开发任何额外的产品。 | |
| ● | 一家经营历史有限的医疗技术公司 | |
| ● | 潜力 医生和患者不接受Pure—Vu系统。 | |
| ● | 我们的 我们的Pure—Vu系统成功商业化。 | |
| ● | 我们的 有限的销售和营销组织以及相关的困难,使我们的Pure—Vu系统商业化。 | |
| ● | 我们的Pure—Vu系统引起的任何潜在不良副作用。 | |
| ● | 任何安全漏洞、计算机恶意软件、计算机黑客攻击和其他安全事件的影响。 | |
| ● | 数据隐私法律法规的广度。 | |
| ● | 实现商业化的困难。 | |
| ● | 培训医疗专业人员安全和适当使用我们的产品方面的困难。 | |
| ● | 竞争 在市场上。 | |
| ● | 技术过时的可能性。 | |
| ● | 如果发现我们的产品存在缺陷,可能会导致声誉受损和不可预见的费用。 | |
| ● | 我们打入国际市场的能力。 | |
| ● | 我们依赖第三方制造商生产我们的Pure-Vu系统。 | |
| ● | 以色列法规对我们Pure-Vu系统的外包和开发的影响。 |
与我们的知识产权相关的风险 ,包括与以下内容相关的风险:
| ● | 我们 妥善保护我们知识产权的能力。 | |
| ● | 潜在知识产权纠纷的影响。 | |
| ● | 就业和保密纠纷的影响。 |
一般风险,包括与以下各项相关的风险:
| ● | 这些困难与预测和管理增长有关。 | |
| ● | 我们 吸引和留住关键人员的能力。 | |
| ● | 产品责任诉讼的影响。 | |
| ● | 不确定因素与汇率波动有关。 | |
| ● | 与收购和投资活动有关的 成本。 | |
| ● | 包括新冠肺炎在内的传染病暴发,可能对我们的业务、财务状况和经营业绩造成实质性影响 。 |
与我们的股本相关的风险 ,包括与以下方面相关的风险:
| ● | 我们的季度经营业绩出现重大波动。 | |
| ● | 交易市场的不可预测性。 | |
| ● | 与大规模抛售有关的股票价格下跌。 | |
| ● | 我们 有能力继续遵守纳斯达克资本市场的要求,包括重新符合250万美元的最低股东权益要求。 | |
| ● | 如果我们实施反向股票拆分,对我们普通股流动性的潜在不利影响。 |
| 26 |
| ● | 股票分析师报告的频率、性质和内容。 | |
| ● | 我们股价的波动。 | |
| ● | 版税 根据特许权支付权利证书的条款到期的付款。 | |
| ● | 我们的 管理内部控制以防止欺诈或错误的能力。 | |
| ● | 我们的 未能对财务报告进行内部控制。 | |
| ● | 我们的 预期我们不会在可预见的将来支付股息。 | |
| ● | 股东解散后,可能失去部分或全部投资。 | |
| ● | 额外发行优先股的稀释效应。 | |
| ● | 我们的 选择特拉华州的法院可能会阻止股东对我们提起诉讼。 |
与我们在以色列的业务有关的风险,包括与以下方面有关的风险:
| ● | 以色列政治、经济和军事不稳定的影响,包括以色列和 加沙地带的恐怖组织,我们的研究和开发设施和供应商在该地区。 | |
| ● | 版税 以及某些研究和开发赠款条款要求向以色列政府支付的其他款项。 | |
| ● | 与执行外国法院判决和在外国司法管辖区送达有关的困难。 | |
| ● | 潜在专利诉讼的影响。 |
与我们的战略替代流程相关的风险
我们 可能无法成功识别和实施任何战略性业务合并或其他交易。
We continue to evaluate various potential strategic options for us, including a merger, reverse merger, sale or other strategic transaction. However, there can be no assurance that we will be able to identify a counterparty willing to move forward with us or, if we do, successfully consummate any particular strategic transaction. The biotech industry is a competitive industry and thus there are numerous competitors of ours for strategic transactions with a limited number of parties seeking a transaction on terms that would be beneficial to our shareholders. The process of evaluating these strategic options may be very costly, time-consuming and complex and we have incurred, and may in the future incur, significant costs related to this continued evaluation, such as legal and accounting fees and expenses and other related charges. We may also incur additional unanticipated expenses in connection with this process. A considerable portion of these costs will be incurred regardless of whether any such course of action is implemented or transaction is completed. Any such expenses will decrease the remaining cash available for use in our business and may diminish or delay any future distributions to our stockholders. Any delays in identifying a potential counterparty will cause our cash balance to continue to deplete, which could make us less attractive as a strategic counterparty. Our existing outstanding indebtedness with Kreos may also impact the interest of potential third parties and may negatively impact our ability to consummate a strategic transaction. The continued review of our strategic options may also create continued uncertainty for our employees and this uncertainty may adversely affect our ability to retain key employees necessary to maintain our ongoing operations or to execute any potential strategic options, which could have a material adverse effect on our business. Further, the market capitalization of our company is below the value of our cash and cash equivalents. Potential counterparties in a strategic transaction involving our company may place minimal or no value on our remaining assets. As a result, we may not be able to execute on a strategic transaction before our cash position gets reduced, as a result of running a public company, to the point that we will need to pursue the winding down and dissolution of the company.
我们将来可能完成的任何 战略性交易都可能产生负面影响。
任何 我们将来可能完成的战略性业务合并或其他交易都可能产生各种负面后果 ,我们可能会实施一项行动方案或完成一项交易,从而产生意外结果,从而对我们的业务产生不利影响 并降低我们公司的价值。无法保证任何特定的行动方针、业务安排或交易 或一系列交易将被追求、成功完成、导致股东价值增加或实现 所期望的结果。任何此类潜在交易未能实现预期结果都可能严重损害股东 从任何未来战略交易中获得任何利益的能力。
| 27 |
如果 我们成功完成任何战略交易,我们可能面临其他运营和财务风险。
任何战略交易的谈判和完成也可能需要比我们预期的更多时间或更多现金资源, 使我们面临其他运营和财务风险,包括:
* 近期和长期支出增加;
● 我们偿还未偿债务的能力;
● 未知负债风险;
● 高于预期的收购或整合成本;
● 发生大量额外债务或发行稀释性股本证券以资助未来运营;
● 资产或商誉的减记或发生非经常性、减值或其他费用;
● 摊销费用增加;
● 将任何被收购业务的运营和人员与我们的运营和人员合并的困难和成本;
● 由于管理层和所有权的变更,与任何所收购业务的主要供应商或客户的关系发生减值;
● 无法留住本公司或任何被收购业务的关键员工;以及
● 未来诉讼的可能性。
上述任何风险都可能对我们的业务、财务状况和前景造成重大不利影响。
如果 一项战略性交易没有完成,我们的董事会可能决定申请破产保护或寻求解散和清算我们的剩余资产 。在这种情况下,由于我们的未偿债务, 可供分配给我们股东的现金数额(如果有)将在很大程度上取决于此类破产或清算的时间以及 需要为我们当前债务(包括偿还贷款协议项下的金额)保留的现金数额(定义见下文)、承诺 和或有负债,并且可能没有任何现金或其他资产可分配给我们的股东。
There can be no assurance that a strategic transaction will be completed. If a strategic transaction is not completed, our Board may decide to file for bankruptcy protection or pursue a dissolution of the company and liquidation of all of our remaining assets. In such an event, the amount of cash available for distribution to our stockholders, if any, will depend heavily on the timing of such decision, as with the passage of time the amount of cash available for distribution will be reduced as we continue to fund our operations and service our outstanding indebtedness. The process of bankruptcy or liquidation may be lengthy and we cannot make any assurances regarding the timing of completing such a process. If our Board were to approve and recommend, and our stockholders were to approve, a dissolution and liquidation, we would be required under Delaware corporate law to pay our outstanding obligations, as well as to make reasonable provision for contingent and unknown obligations, including repayment of the indebtedness under our Loan Agreement, which debt is secured by our assets, prior to making any distributions in liquidation to our stockholders. There can be no assurance as to the amount of available cash that will be available to distribute to stockholders, if any, after paying our debts and other obligations and setting aside funds for reserves, nor as to the timing of any such distribution. Our financial commitments and contingent liabilities would include: (i) repayment of our outstanding indebtedness under our Loan Agreement; (ii) personnel costs, including severance; (iii) contractual obligations to vendors and clinical study sites; (iv) non-cancelable lease obligations; and (v) potential litigation against us.
| 28 |
由于 要求为或有事项准备金,我们的一部分资产可能需要在解决此类 债务之前保留,而且任何此类解决方案的时间尚不确定。此外,我们可能会受到与破产或解散和清算有关的诉讼或其他索赔 。如果寻求解散和清算,我们的董事会需要与我们的顾问协商, 将评估这些事项,并确定合理的储备金额。因此,如果发生破产、清算、解散或清盘,我们普通股的持有人可能会损失全部或相当大一部分投资。
我们 可能会卷入证券集体诉讼,这可能会转移管理层的注意力并损害公司 业务,而且保险范围可能不足以支付所有费用和损失。
过去,证券集体诉讼通常是在某些重大商业交易之后进行的,例如出售公司 或宣布任何其他战略交易,或宣布负面事件,例如中止临床项目。 这些事件还可能导致SEC进行调查。即使没有发生不当行为 ,我们也可能面临此类诉讼或调查。诉讼和调查通常费用高昂,分散了管理层的注意力和资源,这可能对 我们的业务和现金资源以及我们完成潜在战略交易的能力或我们的股东 在任何此类交易中获得的最终价值产生不利影响。
与我们的财务状况和资金需求相关的风险
对我们作为一家持续经营企业的能力存在重大疑问,这将影响我们获得未来融资的能力,并可能 要求我们缩减运营。
我们截至2023年12月31日的财务报表是在假设我们将继续作为一家持续经营的企业的基础上编制的。审计我们2023年财务报表的独立注册会计师事务所在其报告中包括一段说明,提到我们自成立以来的经常性亏损,并表达了管理层的评估和结论,即我们作为一家持续经营的企业继续经营的能力存在很大疑问。我们的财务报表不包括这种不确定性的结果 可能导致的任何调整。我们能否继续经营下去,取决于我们能否获得额外的股权或债务融资, 进一步提高运营效率,减少支出,并最终创造收入。但是,我们不能向您保证 我们将能够实现上述任何一项。有关详情,请参阅我们的综合财务报表附注2。
自成立以来,我们 每年都出现巨额运营亏损,预计在可预见的未来还将继续出现巨额亏损。我们可能永远不会盈利,或者,如果实现了,我们将能够持续盈利。
我们 预计,除非我们扩大商业化努力,否则将在没有相应收入的情况下产生大量费用。到目前为止,作为我们最初针对早期采用医院的美国市场推出的一部分,我们从Pure-Vu系统产生的收入有限,但我们预计在我们扩大Pure-Vu系统的商业化努力之前,不会从产品销售中获得可观的收入。Pure-Vu系统存在很大的不确定性。我们预计将在美国、欧洲和其他地方产生巨额营销费用,而且不能保证我们会产生可观的收入或实现盈利。在截至2023年12月31日和2022年12月31日的 年度,我们的净亏损分别约为1,290万美元和1,860万美元。截至2023年12月31日,我们的累计赤字约为1.542亿美元。
我们欠Kreos Capital VI(Expert Fund)LP的债务可能会限制我们经营业务的灵活性,并对我们的财务状况和竞争地位产生不利影响。我们对Kreos Capital VI(Expert Fund)LP的债务基本上是以我们的所有资产为抵押的。 如果我们违约,Kreos Capital VI(Expert Fund)LP可能会取消我们的资产的抵押品赎回权,这可能会对我们的业务产生重大不利的 影响。
于2021年7月,吾等与Kreos Capital VI(Expert Fund)LP订立提供贷款安排的协议(“贷款 协议”)。贷款协议项下的所有债务均以我们几乎所有个人财产资产(包括我们在子公司中的重大知识产权和股权)的优先担保权益作为担保。因此,如果我们拖欠贷款协议下的任何义务,Kreos Capital VI(Expert Fund)LP可以取消其担保权益的抵押品赎回权 并清算部分或全部抵押品,这将损害我们的业务、财务状况和运营结果,并可能要求 我们减少或停止运营。
| 29 |
为了偿还这笔债务和我们未来可能产生的任何额外债务,我们需要从我们的 经营活动中产生现金。我们产生现金的能力在一定程度上取决于我们成功执行业务战略的能力,以及我们无法控制的一般经济、财务、竞争、监管和其他因素。如果我们无法产生足够的现金来偿还到期和应付的债务,无论是在债务到期时,还是在违约的情况下,我们可能无法 以优惠的条款获得额外的债务或股权融资,这可能会对我们的业务运营和财务状况产生负面影响,我们可能需要申请破产保护。
贷款协议限制了我们的能力,除其他事项外,在每个情况下,除某些例外情况外,我们可以:
| ● | 出售、转让或以其他方式处置我们的任何业务资产或财产; | |
| ● | 将 输入交易,导致我们股票的投票控制权发生重大变化; | |
| ● | 合并 或与其他主体合并或收购其他主体; | |
| ● | 产生额外的债务或对我们的资产造成负担; | |
| ● | 支付股息,或进行分配,在某些情况下,回购我们的股本; | |
| ● | 在与我们附属公司的某些交易中输入 ; | |
| ● | 偿还次级债务;或 | |
| ● | 进行 某些投资。 |
此外,根据贷款协议,我们必须遵守各项承诺。贷款协议中的承诺、限制和义务,以及我们未来可能达成的任何融资协议,可能会限制我们为我们的业务提供资金的能力, 从事业务活动或扩大或全面推行我们的业务战略。我们遵守这些承诺的能力可能会受到我们无法控制的事件的影响,我们可能无法履行这些承诺。
如果 我们违反贷款协议下的任何承诺或违约我们在贷款协议下的任何义务,贷款协议下的所有未偿债务可能立即到期并支付,和/或Kreos Capital VI(Expert Fund)LP可能取消其担保 利息并清算部分或全部抵押品,这将损害我们的业务、财务状况和运营结果,并且 可能要求我们减少或停止运营。
如果 我们根据贷款协议加速偿还债务,则无法保证我们的资产将足以偿还 全部债务。此外,在根据任何清算、破产、解散、重组 或类似程序进行资产分配时,Kreos Capital VI(Expert Fund)LP将有权在其他债务持有人或我们普通股持有人收到与此相关的任何分配 之前,从担保我们债务的担保品所得中获得全额付款。
我们的 现金和现金等价物只会在有限的时间内为我们的运营提供资金,我们需要筹集额外的资金,以支持 我们的开发和商业化努力。
我们 目前处于亏损状态,预计我们的运营成本将大幅增加,因为我们产生了与我们的Pure—Vu系统相关的商业化活动相关的成本。审计我们2023年财务报表的独立注册会计师事务所 在其报告中包含了一个解释性段落,提及我们自成立以来的经常性亏损,并表达了管理层 的评估和结论,即我们的持续经营能力存在重大疑问。2023年12月31日,我们拥有现金和现金等价物约500万美元。
我们 将需要筹集额外资金或产生大量收入,以支持我们的开发和商业化努力。
如果 我们的可用现金余额不足以满足我们的流动性要求,包括由于本文所述的风险,我们可能寻求 通过股票发行、债务融资、合作或许可安排筹集额外资本。我们将需要筹集 额外的资本,我们还可能考虑在未来筹集额外的资本,以扩大我们的业务,寻求战略投资, 利用融资机会,或出于其他原因,包括:
| ● | 基金 未来产品的开发和努力; | |
| ● | 获取, 技术许可或投资; | |
| ● | 收购或投资于互补业务或资产;以及 | |
| ● | 金融 资本开支及一般及行政开支。 |
| 30 |
我们目前和未来的资金需求将取决于许多因素,包括:
| ● | 我们的 收入增长率和经营活动产生现金流量的能力; | |
| ● | 我们的 销售和市场营销以及研发活动; | |
| ● | 成本 产品开发的潜在延迟; | |
| ● | 更改 适用于我们产品的监管;以及 | |
| ● | 与国际扩张相关的成本 。 |
Except for our Loan Agreement with Kreos Capital VI (Expert Fund) LP and our Equity Distribution Agreement (as defined below) with Oppenheimer & Co. Inc. (“Oppenheimer”), we have no arrangements or credit facilities in place as a source of funds, and there can be no assurance that we will be able to raise sufficient additional capital on acceptable terms, or at all, and if we are not successful in raising additional capital, we may not be able to continue as a going concern. We may seek additional capital through a combination of private and public equity offerings (which, in limited circumstances, may require the prior written consent of Oppenheimer pursuant to our Equity Distribution Agreement), debt financings (which, except for limited circumstances, would require the prior written consent of Kreos Capital VI (Expert Fund) LP pursuant to our Loan Agreement), and strategic collaborations. Debt financing, if obtained, may involve agreements that include covenants limiting or restricting our ability to take specific actions, such as incurring additional debt, that could increase our expenses and require that our assets secure such debt. Equity financing, if obtained, could result in dilution to our then existing stockholders and/or require such stockholders to waive certain rights and preferences. If such financing is not available on satisfactory terms, or is not available at all, we may be required to delay, scale back or eliminate the development of business opportunities and our operations and financial condition may be materially adversely affected. We can provide no assurances that any additional sources of financing will be available to us on favorable terms, if at all. In addition, if we are unable to secure sufficient capital to fund our operations, we might have to enter into strategic collaborations that could require us to share commercial rights to the Pure-Vu System with third parties in ways that we currently do not intend or on terms that may not be favorable to us. If we choose to pursue additional indications and/or geographies for the Pure-Vu System or otherwise expand more rapidly than we presently anticipate, we may also need to raise additional capital sooner than expected.
未来的 资本筹集可能会稀释我们现有股东的所有权和/或对我们的运营产生其他不利影响。
如果 我们通过发行股本证券筹集额外资本,我们现有股东的持股比例将减少,这些 股东可能会经历大量稀释。如果我们通过发行债务证券筹集额外资金,这些债务证券 将拥有优先于我们普通股的权利,而发行债务证券的条款可能会对 我们的运营造成重大限制,包括对我们资产的留置权。如果我们通过合作和许可协议筹集额外资金,我们可能 被要求放弃对我们技术或产品的某些权利,或以不利于我们的条款授予许可。
我们使用净营业亏损结转和某些其他税务属性的能力可能会受到限制。
Effective on December 1, 2016, Motus GI Medical Technologies LTD, and the holders of all issued and outstanding shares of capital stock of Motus GI Medical Technologies LTD (the “LTD Stockholders”), entered into a share exchange agreement (the “Share Exchange Agreement”) with us. Pursuant to the terms of the Share Exchange Agreement, as a condition of and contemporaneously with the initial closing (the “Initial Closing”) of the 2017 Private Placement, the LTD Stockholders sold to us, and we acquired, all of the issued and outstanding shares of capital stock of Motus GI Medical Technologies LTD (the “Share Exchange Transaction”) and Motus GI Medical Technologies LTD became our direct wholly-owned subsidiary. As a result of the Share Exchange Transaction, our ability to utilize our federal net operating loss carryforwards and federal tax credits may be limited under Sections 382 of the Internal Revenue Code of 1986, as amended (the “Code”). The limitations apply if an “ownership change,” as defined by Code Section 382, occurs. Generally, an ownership change occurs if the percentage of the value of the stock that is owned by one or more direct or indirect “five percent shareholders” increases by more than 50 percentage points over their lowest ownership percentage at any time during the applicable testing period (typically three years). In addition, future changes in our stock ownership, which may be outside of our control, may trigger an “ownership change” and, consequently, Code Section 382 limitations. As a result, if we earn net taxable income, our ability to use our pre-change net operating loss carryforwards and other tax attributes to offset United States federal taxable income may be subject to limitations, which could potentially result in increased future tax liability to us.
| 31 |
与政府监管和第三方报销相关的风险
我们 受到复杂而昂贵的监管。
Our product, and any products we may develop in the future, are subject to regulation by the FDA and other national, supranational, federal and state governmental authorities (both domestic and foreign). It can be costly and time-consuming to obtain regulatory clearance, approval, or certification to market a new or modified medical device or other product. Clearance and/or approval might not be granted on a timely basis, if at all. Regulations are subject to change as a result of legislative, administrative or judicial action, which may further increase our costs or reduce sales. Unless an exception applies, the FDA requires that the manufacturer of a new medical device or a new indication for use of, or other significant change in, an existing medical device obtain either FDA 510(k) pre-market clearance or pre-market approval before that product can be marketed or sold in the United States. Modifications or enhancements to a product that could significantly affect its safety or effectiveness, or that would constitute a major change in the intended use of the device, technology, materials, labeling, packaging, or manufacturing process may also require a new 510(k) clearance or possibly premarket approval. The FDA has indicated that it intends to continue to enhance its pre-market requirements for medical devices. Although we cannot predict with certainty the future impact of these initiatives, it appears that the time and cost to get medical devices to market could increase significantly.
此外,我们还必须遵守管理质量管理和质量体系制造实践、产品标签和广告以及不良事件报告的法规,这些法规在我们获得销售产品的许可或批准后适用,我们还必须 考虑与医疗设备相关的新出现的风险,如网络安全漏洞。我们未能保持Pure-Vu系统的许可,未能获得新产品或修改产品的许可或批准,或未能遵守制造、标签、广告或不良事件报告方面的规定,可能会对我们的运营结果和财务状况产生不利影响。此外,如果我们确定我们制造或销售的产品不符合我们的规格、发布的标准或法规要求,我们可能会寻求更正该产品或将其从市场上撤回,这可能会对我们的业务产生不利影响。我们的许多设施和程序以及我们供应商的设施和程序都受到持续监督,包括政府当局的定期检查。遵守生产、安全、质量控制和质量保证法规可能既昂贵又耗时。
医疗器械的销售和营销受到FDA和其他执法机构以及外国司法管辖区主管当局(如欧洲经济区成员国)的更严格审查。如果我们的销售和营销活动不符合FDA或外国法规或指南,或其他适用法律,我们可能会受到FDA或其他执法机构和外国主管当局的监管询问、警告信或执法行动。
我们 可能无法获得或保持政府批准或认证,无法在美国和欧洲经济区国家/地区之外销售我们的Pure-Vu系统。
要 能够在其他国家/地区营销和销售我们的Pure-Vu系统,我们必须获得监管部门的批准或认证,并遵守这些国家/地区的法规。这些法规,包括审批或认证的要求以及监管审查所需的时间,因国家/地区而异。许多非欧洲市场,包括南美和亚太地区的主要市场, 允许根据现有的CE符合性证书加快监管审查和批准。我们的第一代Pure-Vu系统和第二代Pure-Vu系统已获得CE符合性证书,允许我们贴上CE标志并在欧洲经济区进行销售。我们打算以具有与欧洲经济区类似要求的监管审批程序的国家为目标。然而,获得和维护外国监管批准或认证是复杂且昂贵的,而且可能会受到延误,而且管理层不能确定 我们将在计划销售我们的Pure-Vu系统的任何外国国家或在我们预期的时间范围内获得并有能力保持监管批准或认证。
| 32 |
对我们产品的修改 可能需要新的510(K)许可,或者可能需要我们停止营销或召回修改后的产品,直到获得批准 。
在设备获得510(K)许可后,任何可能严重影响其安全性或有效性的修改,或会对其预期用途造成重大改变的任何修改,都将需要新的许可或可能的上市前批准。未达到此重要性级别的更改,包括某些制造更改,可在制造商确定更改重要性的 文件中记录后,无需FDA批准即可进行。FDA要求每个制造商最初做出这一决定,但FDA可以审查任何这样的决定,并可以不同意制造商的决定。如果FDA不同意我们未来可能做出的任何决定,并要求我们寻求新的510(K)许可来修改我们认为不需要新批准的任何先前批准的 或批准的产品,我们可能会被要求停止营销或分销我们的产品 或召回修改后的产品,直到我们获得批准,我们可能会受到巨额的监管罚款或 处罚。在未来,我们可能会寻求扩大Pure-Vu系统被批准或批准的适应症,以允许我们积极向患者推广该产品和较少准备的方案。这将需要我们执行一项或多项临床试验,以促进此类扩展标签的批准,但是,如果此类试验不成功或FDA拒绝我们的扩展标签,我们的收入可能会 受到不利影响。
在欧洲药品管理局中,我们将被要求通知对我们在欧洲药品管理局销售或销售的医疗器械进行符合性评估的通知机构对我们的质量管理体系或我们设备的任何计划变更,这些变更可能会影响遵守欧盟MDR中规定的GSPR、设备的安全和性能或其规定的使用条件。通知机构将对变更进行评估,如果评估结果良好,将签发CE符合性证书的补充文件。通知机构还可以确定计划中的变更需要进行新的合格评估。对于根据欧盟MDD颁发的CE符合性证书(“传统设备”)所涵盖的设备,在欧盟MDR应用日期(2021年5月25日)之后,不允许对设计或预期用途进行重大更改。对我们产品的任何拟议更改都可能迫使我们执行未来的临床和技术程序 ,并提供支持初始合格评估的信息以外的信息。
如果我们的产品发生故障或导致或导致死亡或严重伤害,我们将遵守医疗器械报告法规,这可能导致自愿纠正措施或机构执法行动。
根据FDA医疗器械报告条例,医疗器械制造商必须向FDA报告设备 已经或可能导致或导致死亡或重伤的信息,或者如果设备或我们的类似设备再次发生故障,可能会导致或导致 死亡或重伤的故障。如果我们未能在规定的时间范围内或根本不向FDA报告这些事件,FDA可能会对我们采取执法行动。涉及我们产品的任何此类不良事件也可能导致未来的自愿纠正行动,如召回或客户通知,或机构行动,如检查或执法行动。任何纠正措施,无论是自愿的还是非自愿的,以及在诉讼中为自己辩护, 都需要我们投入时间和资金,分散管理层对业务运营的注意力,并可能损害我们的声誉和 财务业绩。有关安全报告和上市后监督义务的类似严格监管要求适用于欧洲经济区 。
| 33 |
我们的Pure-Vu系统未来可能会被产品召回。无论是自愿还是在FDA或其他政府机构(包括第三国机构)的指示下召回我们的产品,或者发现我们的产品存在严重的安全问题, 都可能对我们产生重大不利影响。
FDA和类似的外国政府机构有权要求在设计或制造方面存在重大缺陷或缺陷的情况下召回商业化产品。在FDA的情况下,要求召回的授权必须基于FDA发现该设备有合理的可能性会导致严重伤害或死亡。此外,外国政府机构有权要求在设计或制造中存在重大缺陷或缺陷的情况下召回我们的产品。 如果在设备中发现任何实质性缺陷,制造商可以主动召回产品。FDA要求在召回开始后十个工作日内将某些类别的召回报告给FDA。由于不可接受的健康风险、组件故障、故障、制造错误、设计或标签缺陷或其他缺陷和问题,我们或经销商可能会进行政府强制召回或自愿召回。召回我们的产品将转移管理和财务资源,并对我们的声誉、运营结果和财务状况产生不利影响,这可能会削弱我们以经济高效和及时的方式生产产品以满足客户需求的能力。我们还可能受到责任索赔的影响,需要承担其他成本,或采取其他可能对我们未来的销售和我们的 盈利能力产生负面影响的行动。公司被要求保留某些召回记录,即使这些召回不需要向FDA或其他第三国主管当局报告。我们可以发起我们认为不需要通知FDA或其他第三国主管当局的自愿召回。如果FDA不同意我们的决定,他们可能会要求我们将这些 行为报告为召回。未来的召回声明可能会损害我们在客户中的声誉,并对我们的销售产生负面影响。此外,FDA可能会对未报告召回事件采取执法行动。
对于所有公司发起的医疗器械更正和拆卸,我们 还需要遵循详细的记录保存要求。此外, 2014年10月,FDA发布了指导意见,旨在帮助FDA和行业区分医疗设备召回与产品改进 。根据该指南,如果设备的任何更改或一组更改涉及违反联邦食品、药物和化妆品法案(FDCA),该更改通常将构成医疗设备召回,并要求向FDA提交召回报告 。有关医疗器械召回和相关报告义务的类似严格监管要求也适用于欧洲经济区。
我们的Pure-Vu系统目前不能通过私人或政府第三方付款人单独报销,这可能会限制市场 的接受度。
Our Pure-Vu System and the procedure to cleanse the colon in preparation for colonoscopy are not currently separately reimbursable through private or governmental third-party payors in any country. We sought new technology payments from Medicare under the hospital Inpatient and Outpatient Prospective Payment Systems and were denied in 2021. We intend to seek separate reimbursement through private or governmental third-party payors for future versions of the system, however coverage and reimbursement may not be available for any product that we commercialize and, even if available, the level of reimbursement may not be satisfactory. The commercialization of our Pure-Vu System depends on third-party payor coverage policies and reimbursement rates, prospective patients’ ability to cover the costs of the procedure, and/or physician/hospital willingness to subsidize all or some of the costs of the procedure. We believe that a substantial portion of individuals who are candidates for the use of the Pure-Vu System worldwide do not have the financial means to cover its cost out-of-pocket. Moreover, healthcare providers may be reluctant to make the initial investment in the system. A general regional or worldwide economic downturn could negatively impact demand for our Pure-Vu System. In the event that medically eligible patients deem the costs of our procedure to be prohibitively high or consider alternative treatment options to be more affordable, or healthcare providers deem the cost of the system to be too high, our business, results of operations and financial condition would be negatively impacted.
| 34 |
最近 颁布的和未来的立法可能会增加我们获得候选产品的市场批准和商业化的难度和成本,并影响我们可能获得的价格。
已经发生了许多关于医疗保健系统的立法和法规变更以及拟议变更,这些变更可能会阻止或延迟 我们候选产品的上市批准,限制或规范批准后活动,并影响我们以盈利方式销售 我们获得上市批准的任何候选产品的能力。我们预计,现行法律以及未来可能采用的其他医疗改革措施 可能会导致更严格的覆盖标准,并对 我们或任何合作者可能会收到的任何获批产品的价格造成额外的下行压力。
For example, in March 2010, the Affordable Care Act was enacted. The Affordable Care Act has substantially changed the way healthcare is financed by both governmental and private insurers and has significantly affected the health care industry. Certain provisions of the Affordable Care Act have been subject to judicial challenges as well as efforts to modify or invalidate them or to alter their interpretation and implementation. For example, the Tax Cuts and Jobs Act (TCJA) enacted on December 22, 2017, included a provision that eliminated the tax-based shared responsibility payment for individuals who fail to maintain minimum essential coverage under Section 5000A of the Internal Revenue Code of 1986, commonly referred to as the “individual mandate,” effective January 1, 2019. Additional legislative changes, regulatory changes, and judicial challenges related to the Affordable Care Act remain possible, but the nature and extent of such potential changes or challenges are uncertain at this time. The implications of the Affordable Care Act, and efforts to modify or invalidate the Affordable Care Act or its implementing regulations, or portions thereof, and the uncertainty surrounding any other modification related to the Affordable Care Act or any other health care reform measure for our business and financial condition, if any, are not yet clear. It is possible that the Affordable Care Act as well as its possible modification or invalidation, in whole or in part or another health care reform measure could negatively impact our business.
如果 我们或我们的销售人员或分销商不遵守欺诈和滥用法律,包括针对在美国批准的任何产品的反回扣法律 ,或与我们销售产品的类似外国法律,我们可能面临重大责任。
There are numerous federal and state laws pertaining to healthcare fraud and abuse, including anti-kickback laws, false claims, and physician transparency laws. Our relationships with physicians and surgeons, hospitals and our independent distributors are subject to scrutiny under these laws. If our operations are found to be in violation of any of these laws or any other governmental regulations that apply to us, we may be subject to penalties, including civil and criminal penalties, exclusion from participation in government healthcare programs, damages, fines and the curtailment or restructuring of our operations. Any penalties, damages, fines, curtailment or restructuring of our operations could adversely affect our ability to operate our business and our financial results. The risk of our being found in violation of these laws is increased by the fact that their provisions are open to a variety of evolving interpretations and enforcement discretion. Any action against us for violation of these laws, even if we successfully defend against it, could cause us to incur significant legal expenses and divert our management’s attention from the operation of our business. For a fuller discussion of the applicable anti-kickback, fraud and abuse, transparency and other healthcare laws and regulations applicable to our business, see Item 1 “Description of Business - Other Healthcare Laws and Compliance Requirements.”
许多 外国国家已经颁布了类似的法律来解决医疗保健部门的欺诈和滥用问题。不断变化的商业合规环境 以及构建和维护稳健且可扩展的系统以符合多个司法管辖区的不同合规要求的需求 增加了医疗保健公司违反一项或多项要求的可能性。
| 35 |
如果我们对Pure—Vu 系统进行了不适当的推广,我们 可能会对重大损害承担责任,或被限制销售我们的产品。
Our promotional materials and training methods for our Pure-Vu System must comply with FDA and other foreign applicable laws and regulations, including the prohibition of the promotion of the “off-label” use of our Pure-Vu System, including by using our Pure-Vu System in a way not approved by the FDA or not consistent with the intended purpose for which Pure-Vu System is CE marked in the EEA. The Pure-Vu System is currently indicated to connect to standard colonoscopes to facilitate intra-procedural cleaning of a poorly prepared colon by irrigating or cleaning the colon and evacuating the irrigated fluid, feces and other bodily fluids and matter. We do not currently promote a particular prep regimen as this is left up to the discretion of the physician since our current indication does not reference any preparation protocol. Healthcare providers may use our products off-label, as the FDA or the competent authorities in the EEA Member States do not restrict or regulate a physician’s choice of treatment within the practice of medicine. However, if the FDA or a competent authority in an EEA Member State determines that our promotional materials, training or marketing efforts constitute promotion of an off-label use, it could request that we modify our training or promotional materials or marketing efforts or subject us to regulatory or enforcement actions, including the issuance of an untitled letter, a warning letter, injunction, seizure, civil fine and criminal penalties. It is also possible that other federal, state or foreign enforcement authorities might take action if they consider our promotional or training materials to constitute promotion of an unapproved use, which could result in significant fines or penalties. Although we do not intend to engage in any activities that may be considered off-label promotion of our products, the FDA or another regulatory agency could disagree and conclude that we have engaged, directly or indirectly, in off-label promotion. In addition, the off-label use of our products may increase the risk of product liability claims. Product liability claims are expensive to defend and could result in substantial damage awards against us and harm our reputation.
不遵守反腐败法律可能会对我们的业务造成重大不利影响,并导致民事和/或刑事制裁。
美国《反海外腐败法》(FCPA)和其他司法管辖区的类似反腐败法一般禁止公司及其 中间人为获得或保留业务而向政府官员支付不当款项。由于 在世界各地的许多司法管辖区中,政府管理的医疗保健系统占主导地位,我们在美国以外的许多客户关系 都与政府实体建立联系,因此可能受到此类法律的约束。
近年来,全球 反腐败法的执行有所增加,包括调查和执行程序,导致 对公司和个人的巨额罚款和处罚进行评估。我们的国际运营会造成未经授权的付款 或我们的员工、顾问、销售代理或分销商提供付款的风险。我们维护政策和计划,以实施 保护措施,教育我们的员工和代理了解这些法律要求,并防止和禁止不当做法。但是, 现有的保障措施和任何未来的改进措施可能并不总是有效的,我们的员工、顾问、销售代理或分销商 可能会从事我们可能负责的行为。此外,监管机构可以要求我们对我们投资或收购的公司的行为承担 责任。任何指控或实际违反这些法规的行为都可能使我们受到政府 审查、刑事或民事制裁以及其他责任,包括政府合同的排除,并可能扰乱我们的业务, 对我们的声誉造成不利影响,并对我们的业务、经营业绩、财务状况和 现金流造成重大不利影响。
| 36 |
管理国际业务运营的法律 和法规可能会对我们的业务产生不利影响。
The U.S. Department of the Treasury’s Office of Foreign Assets Control (OFAC), and the Bureau of Industry and Security at the U.S. Department of Commerce (BIS), administer certain laws and regulations that restrict U.S. persons and, in some instances, non-U.S. persons, in conducting activities, transacting business with or making investments in certain countries, governments, entities and individuals subject to U.S. economic sanctions. Our international operations subject us to these laws and regulations, which are complex, restrict our business dealings with certain countries, governments, entities, and individuals, and are constantly changing. Further restrictions may be enacted, amended, enforced or interpreted in a manner that materially impacts our operations. Violations of these regulations are punishable by civil penalties, including fines, denial of export privileges, injunctions, asset seizures, debarment from government contracts and revocations or restrictions of licenses, as well as criminal fines and imprisonment. We have established policies and procedures designed to assist with our compliance with such laws and regulations. However, there can be no assurance that our policies and procedures will prevent us from violating these regulations in every transaction in which we may engage, and such a violation could adversely affect our reputation, business, financial condition, results of operations and cash flows.
与我们的业务运营相关的风险
我们的 Pure—Vu系统目前是我们的唯一产品,我们完全依赖于该产品的成功营销和销售。 无法保证我们能够开发任何其他产品。
我们的 Pure—Vu系统目前是我们的唯一产品,我们完全依赖于该产品的成功。我们可能无法成功 将我们的产品商业化。像我们这样的医疗器械成功商业化是一个复杂而不确定的过程,取决于 管理层、分销商、外部顾问、医生和总体经济条件等因素的努力。对Pure—Vu系统商业化产生不利影响的任何因素 ,包括但不限于市场上的竞争或接受程度, 将对我们的业务、运营业绩和财务状况产生负面影响。我们无法向您保证,我们将成功 开发或商业化我们Pure—Vu系统或任何其他产品的任何潜在增强功能。我们无法成功 将Pure—Vu系统商业化和/或成功开发和商业化其他产品或我们可能开发的Pure—Vu 系统的任何增强功能,将对我们的业务、经营业绩和财务状况产生重大不利影响。
我们 是一家经营历史有限的医疗技术公司。
我们 是一家经营历史有限的医疗技术公司。我们获得了FDA的批准,并获得了符合性证书 ,允许我们在欧洲经济区为我们的第一代和第二代Pure—Vu系统贴上CE标志,并于2019年第四季度开始商业化 ,我们的第二代Pure—Vu系统的首次商业化投放作为我们针对早期采用者医院的首次美国市场的一部分。我们预计,在可预见的将来,Pure—Vu系统的销售将占我们全部收入 。但是,我们在销售产品方面的经验有限,我们可能无法成功将 Pure—Vu系统商业化,原因包括:
| ● | 市场 医生和患者对我们的Pure—Vu系统的接受程度在很大程度上取决于我们证明其相对安全性的能力, 功效、成本效益和易用性; | |
| ● | 我们的 缺乏营销、销售和分销我们产品的经验; | |
| ● | 我们 可能没有足够的财政或其他资源来成功地将我们的Pure—Vu系统商业化; | |
| ● | 我们 可能无法以商业数量或可接受的成本生产我们的Pure—Vu系统; | |
| ● | 与建立和鉴定生产设施有关的不确定性; | |
| ● | 患者 通常不会从第三方付款人处获得使用我们的Pure—Vu系统进行结肠清洗的单独补偿, 这可能会减少我们Pure—Vu系统的广泛使用; |
| 37 |
| ● | 竞争产品和技术的引进和市场接受; | |
| ● | 快速 技术变革可能会使我们的Pure—Vu系统过时; | |
| ● | 我们的 考虑到全球流行病和医院压力,无法在短期内预测医院医疗器械环境 系统;以及 | |
| ● | 我们的 无法预测通货膨胀对劳动力、运费和材料等成本的财务影响 |
潜在的 投资者应仔细考虑经营历史有限的公司将面临的风险和不确定性。特别是, 潜在投资者应考虑到,我们无法向您保证,我们将能够:
| ● | 成功 执行我们当前的商业计划,以商业化我们的Pure—Vu系统,或我们的商业计划是合理的; | |
| ● | 成功 合同并建立我们产品的商业供应; | |
| ● | 实现 我们的Pure—Vu系统的市场接受度;以及 | |
| ● | 吸引 并保留经验丰富的管理和顾问团队。 |
如果 我们无法成功执行上述任何一项,我们的业务可能不会成功,您的投资将受到不利影响。
医生和患者可能不接受 Pure—Vu系统。
我们的 Pure—Vu系统用于结肠镜检查筛查过程中,通过冲洗和排空肠内容物来清洁结肠,这是一项新的 技术,可能被认为比当前的结肠镜检查筛查程序更具侵入性,患者可能不愿意接受 该程序。此外,患者可能不愿意偏离目前的护理标准。此外,由于使用新产品可能会产生责任风险,医生往往 改变其医疗实践的速度较慢。医生在有长期临床证据说服他们改变现有治疗方法之前, 医生可能不会推荐或开具我们的Pure—Vu系统的处方。知名医生建议我们的Pure—Vu系统安全有效,并且可以单独报销 或保险。我们无法预测医生和患者何时会采用我们的Pure—Vu系统。 如果我们的Pure—Vu系统没有获得患者、医生和医疗保健支付者的充分认可,我们可能无法产生 可观的产品收入,我们可能无法盈利。
如果 我们无法成功地将Pure—Vu系统商业化,我们从其销售中产生的收入(如果有的话)可能会受到限制。
我们的Pure—Vu系统的商业成功将取决于医疗界的接受,包括医生、患者和 医疗保健支付者。我们的Pure—Vu系统的市场接受程度将取决于多个因素,包括:
| ● | 演示 临床安全性和有效性; | |
| ● | 相对 方便、负担和易于管理; | |
| ● | 任何不良影响的流行率和严重程度; | |
| ● | 医生是否愿意开具Pure—Vu系统处方,以及目标患者人群是否愿意尝试新手术; | |
| ● | 功效 我们的Pure—Vu系统与竞争程序的比较; |
| 38 |
| ● | 任何新产品和程序的引入,可能在将来成为可用于结肠镜检查准备的准备可能获得批准; | |
| ● | 定价 和成本效益; | |
| ● | 在适用的治疗指南中包含或省略我们的Pure—Vu系统; | |
| ● | 我们或任何未来合作伙伴的销售和营销策略的有效性; | |
| ● | 限制 或FDA或公告机构批准的标签中包含的警告; | |
| ● | 我们的 有能力获得并保持足够的第三方保险或政府医疗保健计划(包括Medicare)的报销 医疗补助、私人医疗保险公司和其他第三方支付者;以及 | |
| ● | 在没有第三方承保或单独报销的情况下,患者愿意自付费用。 |
如果 我们的Pure—Vu系统没有获得医生、医疗保健支付者和患者的充分接受程度,我们可能无法产生 足够的收入,我们可能无法实现或维持盈利能力。我们努力教育医疗界和第三方 支付方了解我们的Pure—Vu系统的好处,可能需要大量资源,而且可能永远不会成功。
我们 目前有一个有限的销售和市场营销组织。如果我们无法获得销售和营销合作伙伴和/或建立 令人满意的销售和营销能力,我们可能无法成功地将Pure—Vu系统商业化。
目前,我们的销售或营销人员有限。为了使获准商业销售的设备商业化,我们必须 与拥有此类商业基础设施的第三方合作,和/或继续开发我们自己的销售和营销基础设施 。如果我们未能成功达成适当的合作安排、招聘销售和市场营销人员 或建立销售和市场营销基础设施,我们将难以成功地将Pure—Vu系统商业化,这将对我们的业务、经营业绩和财务状况造成不利影响。
我们 可能无法按照我们可接受的条款或根本无法达成合作协议。此外,即使我们建立了此类关系, 我们可能对这些第三方的销售、营销和分销活动具有有限的控制权或没有控制权。我们未来的收入可能 在很大程度上取决于这些第三方努力的成功。如果我们选择建立销售和市场营销基础设施, 可能无法实现这项投资的正回报。此外,我们将不得不与成熟且资金充足的医疗器械公司竞争,以招聘、雇用、培训和留住销售和营销人员。可能会阻碍我们在没有战略合作伙伴或许可证的情况下将 Pure—Vu系统商业化的因素包括:
| ● | 我们无法招聘和留住足够数量的有效销售和营销人员; | |
| ● | 销售人员无法接触或说服足够数量的医生使用我们的Pure—Vu系统; | |
| ● | 销售人员缺乏配套产品,这可能使我们相对于产品线更广的公司 处于竞争劣势;以及 | |
| ● | 与创建独立的销售和营销组织相关的不可预见的成本和费用。 |
| 39 |
我们的 Pure—Vu系统可能会导致不良副作用,从而阻止其广泛采用,或可能导致其退出市场。
我们的 Pure—Vu系统目前被认为具有与标准结肠镜检查相同的副作用,例如诱导结肠粘膜损伤,或在极少数情况下导致结肠穿孔。随着更广泛的使用,Pure—Vu系统可能会导致额外的不良 和非预期副作用,或显示比标准结肠镜检查更高的副作用发生率,这可能会妨碍或限制其商业 采用和使用。即使获得FDA的批准、EEA的公告机构的CE符合性证书以及其他监管机构的批准 ,我们的产品在以后可能会表现出不良副作用,从而阻止广泛使用或需要退出市场 。这种副作用的表现可能会导致我们的业务受到影响。
我们 依赖于我们的信息技术系统的正常功能、可用性和安全性来运营我们的业务,网络攻击 或对这些系统的其他破坏或破坏可能对我们的业务和运营结果造成重大不利影响。
我们在日常运营中依赖信息技术系统来处理、传输和存储电子信息。随着我们业务需求的变化,此类系统的形式和功能可能会随着时间的推移而变化。我们的业务性质涉及接收和存储有关客户的个人和财务信息。我们使用我们的信息技术系统来管理或支持各种业务流程和活动,包括销售、运输、账单、客户服务、采购和供应链、制造 和应付帐款。此外,我们使用企业信息技术系统记录、处理和汇总交易及其他财务信息和运营结果,以供内部报告之用,并遵守监管财务报告、法律和税务要求。我们的信息技术系统可能会因计算机病毒、计算机黑客攻击、升级或更换软件、数据库或其组件过程中的故障、停电、硬件故障、电信故障、用户错误或灾难性事件而损坏、中断或关闭。如果我们未能维护或保护我们的信息技术系统和数据完整性,包括防止网络攻击、入侵、中断或关闭,可能会导致 未经授权访问客户数据、知识产权被盗或其他资产挪用或关键数据和信息丢失,或以其他方式危及我们的机密或专有信息并扰乱我们的运营。如果我们的信息技术 系统被破坏或遭受严重损坏、中断或停机,而我们无法及时有效地解决这些问题,我们的业务和运营结果可能会受到实质性和不利的影响。随着威胁形势的不断变化,虽然我们已经实施了安全措施来保护我们的信息技术系统和基础设施,但不能保证 这些措施将防止可能对我们的业务造成不利影响的服务中断或安全漏洞。
如果我们维护客户、员工、供应商或公司信息的隐私和安全的努力不成功,我们可能会 产生大量额外成本,并成为诉讼、执法行动和声誉损害的对象。
与大多数医疗器械公司一样,我们的业务涉及接收、存储和传输客户信息以及付款和报销信息、我们的员工、供应商和我们的公司。我们的信息系统容易受到不断演变的网络安全风险的日益增长的威胁。未经授权的各方可能试图通过欺诈或其他方式欺骗我们的员工、业务收购或第三方服务提供商来访问我们的系统或信息。我们开发或从第三方获得的硬件、软件或应用程序 可能包含设计或制造方面的缺陷,或可能意外危及信息和设备安全的其他问题。通过我们的业务收购开发的硬件或软件应用程序可能面临与其系统中的缺陷和漏洞相关的风险,或者在将收购整合到我们的信息系统中时遇到困难。 用于获得未经授权的访问、禁用或降级服务或破坏系统的方法也在不断变化和发展, 可能很难在很长一段时间内预测或检测到。不断变化的威胁意味着我们必须不断评估和调整我们的系统和流程,而我们的努力可能不足以防范所有数据安全漏洞、数据滥用或我们的系统遭到破坏。未来对我们数据安全的任何重大损害或破坏,无论是外部还是内部,或滥用客户、员工、供应商或公司数据,都可能导致额外的重大成本、销售损失、罚款、诉讼和损害我们的声誉 。此外,随着与信息安全、数据收集和使用以及隐私相关的监管环境变得越来越严格,以及适用于我们业务的新的和不断变化的要求,遵守这些要求可能 也会导致额外的成本。
| 40 |
如果我们不能让胃肠病专家相信,我们的产品是当前市场上销售的医疗设备的有吸引力的替代品,并且适合用于肠道准备或清洁,我们将不会在商业上取得成功。
如果 我们不能成功地说服胃肠病专家相信我们产品的优点或教育他们使用我们的产品,他们 可能不会使用我们的产品,我们将无法将我们的产品完全商业化或实现盈利。胃肠病专家可能会因以下原因而犹豫是否改变他们的医疗实践:
| ● | 缺少 使用我们产品的经验和对潜在副作用的担忧; | |
| ● | 缺少 目前可用于支持我们产品的安全性和有效性的临床数据; | |
| ● | 缺少 或认为缺乏支持额外患者受益的证据; | |
| ● | 感知 通常与使用新产品和程序有关的责任风险;以及 | |
| ● | 培训可能需要的时间承诺。 |
此外,我们认为,有影响力的胃肠病学家对我们产品的推荐和支持对于市场接受度和采用非常重要。如果我们没有得到此类胃肠病学家的支持,或长期数据未显示使用我们产品的益处, 胃肠病学家可能不会使用我们的产品。在这种情况下,我们可能无法增加收入或实现盈利.
如果 我们无法对胃肠病科医生及其临床人员进行安全和适当使用我们产品的培训,我们可能无法 实现收入增长或盈利。
我们销售流程的一个重要部分包括培训胃肠病学家及其临床人员如何安全和适当地使用我们的产品 的能力。我们在培训和留住合格的独立胃肠病学家以使用Pure—Vu系统执行 结肠清洗程序方面的经验非常有限。如果我们无法吸引胃肠科医生参加我们的培训项目, 可能导致更高的伤害率、负面宣传和产品责任风险增加,这将对我们的增长 或盈利能力产生不利影响。
胃肠病学家及其临床人员需要学习过程,使其能够熟练使用我们的产品。 培训足够数量的胃肠病学家并为他们提供 使用我们的Pure—Vu系统的充分指导,对于我们商业化努力的成功至关重要。此培训过程可能需要比预期的时间更长,因此可能会影响我们 增加销售额的能力。培训完成后,我们希望依靠受过培训的胃肠病学家在更广阔的市场上宣传我们产品的益处 。说服胃肠病学家投入必要的时间和精力进行充分的培训 是一项挑战,我们无法向您保证我们将在这些努力中取得成功。如果胃肠科医生及其临床工作人员 没有经过适当的培训,他们可能会误用或无效地使用我们的产品。此类使用可能导致患者治疗结果不理想、患者 受伤、负面宣传或针对我们的诉讼,其中任何一种情况都会对我们的业务、运营结果 和财务状况产生重大不利影响。
我们 未来可能面临来自其他医疗器械公司的竞争,如果我们不能有效竞争,我们的经营业绩将受到影响。
The medical device industries are intensely competitive and subject to rapidly evolving technology and intense research and development efforts. We have competitors in a number of jurisdictions that have substantially greater name recognition, commercial infrastructures and financial, technical and personnel resources than we have. Established competitors may invest heavily to quickly discover and develop novel devices or procedures that could make our Pure-Vu System obsolete or uneconomical. Any new product that competes with a cleared medical device may need to demonstrate compelling advantages in efficacy, cost, convenience, tolerability and safety to be commercially successful. Other competitive factors could force us to lower prices or could result in reduced sales, including increased use of alternatives to colonoscopies such as capsule endoscopy systems, virtual colonoscopies using a CT scan, and other similar screening tests for colon cancer. While none of these testing alternatives may ever fully replace the colonoscopy, over time, they may take market share away from conventional colonoscopies for specific purposes and may lower the potential market opportunity for us. In addition, new devices developed by others could emerge as competitors to our Pure-Vu System. If we are not able to compete effectively against our current and future competitors, our business will not grow and our financial condition and operations will suffer.
| 41 |
我们的 产品面临技术过时的风险,如果实现,可能会对我们的业务产生重大不利影响。
医疗器械行业的特点是快速而显著的技术变革。无法保证第三方 不会成功地开发或销售比我们更有效的技术和产品,或者会使我们的技术 和产品过时或失去竞争力。此外,可以开发新的、侵入性较小的外科手术和药物,取代或降低使用或可能使用我们产品的当前手术的重要性。因此,我们的成功将部分取决于我们通过开发新产品快速响应医疗和技术变化的能力。产品开发 涉及高度风险,我们无法向您保证,我们的新产品开发工作将导致任何商业成功 产品。
如果 在我们的产品中发现缺陷,我们可能会产生额外的不可预见的成本,医院可能不会购买我们的产品,我们的声誉 可能会受到影响。
我们的 产品包含机械部件,其中任何部件都可能包含错误或故障,尤其是在首次推出时。此外,新的 产品或增强功能可能包含未检测到的错误或性能问题,尽管进行了测试,但只有在商业运输 后才发现这些问题。由于我们的产品设计用于执行医疗程序,因此我们希望客户对此类缺陷的 敏感度会更高。我们不能保证我们的产品将来不会出现组件老化、错误或性能问题 。如果我们遇到缺陷或性能问题,可能会发生以下任何情况:
| ● | 延迟 产品发货; | |
| ● | 收入损失 ; | |
| ● | 延迟 市场接受度; | |
| ● | 转移 我们的资源; | |
| ● | 损坏 我们的声誉; | |
| ● | 产品 召回; | |
| ● | 法规 行动; | |
| ● | 增加 服务或保修费用;或 | |
| ● | 产品 责任索赔。 |
我们未来的增长在一定程度上取决于我们打入海外市场的能力,在那里我们将受到额外的监管负担和其他风险和不确定性的影响。
我们 未来的盈利能力将部分取决于我们在国外市场商业化Pure—Vu系统的能力,我们打算 依靠与第三方的合作。如果我们将Pure—Vu系统在国外市场商业化,我们将面临额外的 风险和不确定性,包括:
| ● | 我们的 客户在国外市场获得我们的Pure—Vu系统报销的能力; | |
| ● | 我们无法直接控制商业活动,因为我们依赖第三方; | |
| ● | 遵守复杂多变的外国监管、税务、会计和法律要求的负担; | |
| ● | 外国不同的医疗实践和风俗习惯影响市场接受度; |
| 42 |
| ● | 进口或出口许可要求; | |
| ● | 应收账款收款时间较长 ; | |
| ● | 发货的交货期更长; | |
| ● | 语言障碍 技术培训; | |
| ● | 减少国外一些国家对知识产权的保护; | |
| ● | 外国货币汇率波动;以及 | |
| ● | 在发生合同纠纷时,受外国法律管辖的合同条款的解释。 |
我们的Pure—Vu系统的海外销售也可能受到政府控制、政治和经济不稳定、贸易限制和关税变化的不利影响,其中任何一个都可能对我们的经营业绩产生不利影响。
我们 现在并将完全依赖第三方来生产Pure—Vu系统,如果这些第三方未能获得或维持FDA 或类似的外国监管机构的生产批准,我们Pure—Vu系统 的商业化可能会停止、延迟或降低利润,未能向我们提供足够数量的Pure—Vu系统设备组件,或 未能以可接受的质量水平或价格提供。
We do not currently have, nor do we plan to acquire, the capability or infrastructure to manufacture our Pure-Vu System, as well as the other related device components for high volume commercial purposes. We do have capability to produce limited units for use in our clinical studies, if required. As a result, we are obligated to rely on contract manufacturers for the commercial supply of our product. We currently rely on several manufacturing partners to manufacture and produce the components of our Pure-Vu System, and the loss of the services of these manufacturers or an adverse change in the manufacturer’s business or our relationship could have a material adverse effect on our business. Our primary reliance on these manufacturers for all or substantially all of our manufacturing needs involves several risks, including the potential inability to obtain an adequate supply of components and limited control over pricing, quality and timely delivery of the components. In addition, replacing these manufacturers may be difficult and could result in an inability or delay in obtaining the components for our Pure-Vu System. As a result, if such a disruption were to occur we may be unable to fulfill customer orders or orders for trials, and our operating results may fluctuate from period to period, particularly if a disruption occurs near the end of a fiscal period. However, we anticipate engaging additional manufacturers for the production of the components of our Pure-Vu System as we expand our commercialization efforts.
我们的合同制造商用于生产Pure—Vu系统的 设施必须符合FDA质量体系法规 的要求,并在FDA注册。我们不控制生产过程,并完全依赖我们的合同 生产合作伙伴,以符合《质量体系法规》(21 CFR第820部分)中发布的医疗器械生产的现行药品生产质量管理规范("cGMP")。这些cGMP法规涵盖了与Pure—Vu系统相关的生产、检测、 质量控制和记录保存的所有方面。如果我们的合同制造商无法成功生产出符合我们的规范和FDA或其他部门严格监管要求的产品,他们将无法获得和/或 对其生产设施的监管批准。如果FDA或类似的外国监管机构不批准 这些设施用于生产我们的产品,或者如果FDA在未来撤回任何此类批准,我们可能需要寻找替代 生产设施,这将严重影响我们维持监管部门批准或销售Pure—Vu系统的能力。
| 43 |
我们的 合同制造商将接受FDA和相应州和外国机构的持续定期突击检查 ,以确保其符合cGMP和类似监管要求。我们无法控制合同制造商遵守这些法规和标准的情况 。如果我们的任何合同制造商未能遵守适用的法规, 可能会对我们实施制裁,包括罚款、禁令、民事处罚、未能销售Pure—Vu系统、延迟、暂停 或撤回批准、运营限制和刑事起诉,其中任何一种行为都可能对 的业务造成重大不利影响。此外,我们将无法控制我们的合同制造商保持充分质量控制、 质量保证和合格人员的能力。如果我们的合同制造商未能遵守或维护任何这些标准, 可能会对我们维持监管部门批准或营销Pure—Vu系统的能力产生不利影响。
如果 出于任何原因,这些第三方无法或不愿履行,我们可能无法终止与他们的协议, 我们可能无法找到替代制造商或与他们达成有利协议,我们无法确定任何 此类第三方将具有满足未来要求的生产能力。如果这些制造商或任何替代制造商 在各自的产品制造过程中遇到任何重大困难,或应停止与我们的业务往来,我们可能会遇到供应严重中断,或可能无法创建或维持商业供应。如果我们 遇到制造问题,我们生产足够商业供应的能力可能会受到负面影响。我们无法协调 第三方制造合作伙伴的努力,或第三方制造合作伙伴的可用能力不足,可能 损害我们按要求水平供应Pure—Vu系统的能力。如果我们与我们的制造合作伙伴面临这些或其他困难 ,如果我们决定将生产转移给一个或多个 替代制造商以应对这些困难,我们的产品供应可能会出现严重中断。
任何 制造问题或失去合同制造商都可能扰乱我们的运营,并导致销售损失。对供应商的任何依赖都可能涉及若干风险,包括可能无法获得关键组件,以及降低对生产成本、交货计划、可靠性和质量的控制。由于供应商的问题 对未来合同制造商造成的任何意外中断都可能导致我们Pure—Vu系统的发货延迟,增加我们的销售成本并导致销售损失。
我们的Pure—Vu系统的 制造及其所开发的技术受某些以色列政府法规的约束,这些法规 可能会损害我们将任何产品或技术的开发或制造活动外包或转移到以色列境外的能力。
我们 已经收到并且将来可能收到以色列国政府通过IIA提供的赠款,用于根据IIA条例为 我们的部分研发支出提供资金。
The IIA Regulations also require that products developed with IIA grants be manufactured in Israel at a rate (scope) which will not be less than the rate of manufacturing and added value in Israel that were set forth in the relevant grant applications submitted to the IIA. Furthermore, the IIA Regulations require that the know how resulting from research and development according to an IIA-approved plan, not being the product developed within the framework of such approved plan, and any right deriving therefrom may not be transferred outside of Israel (including by way of certain licenses), unless prior approval is received from the IIA. We received approval for the transfer of manufacturing of the sleeves outside of Israel. The transfer outside of Israel of manufacturing which is connected with the IIA-funded knowhow will result in a higher royalty repayment rate and may further result in increased royalties (up to three times the aggregate amount of the IIA grants plus interest thereon). In addition, the transfer outside of Israel of IIA-funded knowhow may trigger additional payments to the IIA (up to six times the aggregate amount of the IIA grants plus interest thereon). Even following the full repayment of any IIA grants, we must nevertheless continue to comply with the requirements of the IIA Regulations. The foregoing restrictions and requirements for payment may impair our ability to transfer or sell our technology assets outside of Israel or to outsource or transfer development or manufacturing activities with respect to any IIA-funded know how outside of Israel.
此外, 接受IIA资助的公司通常需要确保它们保留IIA支持的产品中的所有权利。 这意味着,一般而言,根据IIA批准的计划进行的研究和开发所产生的所有专有技术, 以及由此产生的每一项权利,必须自专有技术产生之日起由IIA资助的接受方所有。接受IIA资助的公司 还需遵守报告要求和其他技术要求,这些要求旨在允许IIA确保IIA遵守IIA条例。
| 44 |
如果 我们未能遵守IIA规定的任何条件和限制,或我们 获得赠款的特定条款,我们可能被要求退还之前收到的任何赠款以及利息和罚款,在某些 情况下,可能会受到刑事指控。
关于更多信息,见“第一部分--项目1A--风险因素--与我们在以色列的业务有关的风险”。
与我们知识产权有关的风险
我们 可能无法保护我们的知识产权或可能侵犯他人的知识产权。
我们 依靠专利、商标、版权、商业秘密和保密协议的组合来保护我们的专有知识 财产。我们努力保护我们的知识产权和所有权可能还不够。我们不能确定我们的未决专利申请将导致我们获得专利,我们过去或将来颁发或授权的专利不会受到竞争对手的挑战或规避,或者这些专利将保持有效或足够广泛以阻止我们的竞争对手 引入与我们的专利和专利申请所涵盖的技术类似的技术。此外,我们执行和 保护知识产权的能力在美国以外的某些国家可能受到限制,这可能使 竞争对手更容易通过利用与我们开发或授权的技术类似的技术在这些国家占领市场地位。
竞争对手 还可能通过设计反映我们产品或技术功能的产品而不侵犯我们的知识产权 ,损害我们的销售。如果我们的知识产权得不到足够的保护,或者我们无法有效地执行 我们的知识产权,我们的竞争力可能会受到损害,这将限制我们的增长和未来的收入。
我们 将来可能会成为专利诉讼和行政诉讼的一方,这些诉讼和行政诉讼的费用可能很高,并且可能会干扰我们 销售Pure—Vu系统的能力。
与侵权和其他知识产权索赔有关的诉讼 ,无论是否有价值,都是不可预测的,可能会花费昂贵和耗时的 ,并且可能会分散管理层对我们核心业务的注意力。如果我们在此类诉讼中败诉,法院可能要求我们支付 重大损害赔偿,并禁止我们使用Pure—Vu系统所必需的技术,其中任何技术都会对我们的业务、运营结果和财务状况产生重大不利影响 。如果相关专利被认定为有效和可执行的,并且我们 被发现侵权,则我们可能会被阻止出售我们的Pure—Vu系统,除非我们能够获得使用这些专利所涵盖的技术或想法的许可, 或者能够重新设计我们的Pure—Vu系统以避免侵权。我们不知道我们是否会以令人满意的条款获得任何必要的许可证 (如果有的话),或者我们是否可以重新设计Pure—Vu系统或流程以避免侵权。
竞争产品 也可能出现在其他国家,在这些国家,我们的专利覆盖范围可能不存在或不那么强大。如果我们输掉了一场外国专利诉讼 ,我们可能无法在一个或多个外国国家销售我们的Pure—Vu系统。
我们 可能会受到以下指控:我们错误地从竞争对手那里雇佣了一名员工,或者我们或我们的员工错误地使用了 ,或者泄露了他们前雇主的所谓机密信息或商业秘密。
由于 在我们的行业中很常见,我们雇用并计划雇用以前在其他医疗设备公司工作过的人员,包括我们的竞争对手或潜在竞争对手。虽然目前没有针对我们的索赔待决,但我们未来可能会受到索赔,即我们的员工或潜在员工对其前雇主负有持续义务(例如竞业禁止义务或非征集义务),或者我们的员工或我们无意中或以其他方式使用或泄露了其前雇主的商业秘密或 其他专有信息。可能有必要提起诉讼来抗辩这些指控。即使我们成功地对这些索赔进行了辩护,诉讼也可能导致巨额成本,并分散管理层的注意力。
| 45 |
一般 公司相关风险
我们 将需要扩大我们组织的规模,我们在管理这种增长时可能会遇到困难。
截至2023年12月31日,我们有15名全职员工。随着我们的营销和商业化计划和战略的发展,我们将需要 扩大管理、运营、销售、营销、财务和其他资源方面的员工和顾问基础的规模。 未来的增长将给管理层成员带来巨大的额外责任,包括需要确定、招聘、维护、 激励和整合更多员工。此外,我们的管理层可能不得不将不成比例的注意力从我们的日常活动中转移出来,并投入大量时间管理这些增长活动。我们未来的财务业绩和我们将Pure-Vu系统和任何其他未来候选产品商业化的能力以及我们有效竞争的能力 将在一定程度上取决于我们有效管理未来增长的能力。
我们的成功将在一定程度上取决于我们在通过临床研究推进产品的同时管理我们的运营的能力,以及扩展我们的开发、监管和商业能力或与第三方签订合同为我们提供这些能力的能力。如果未能实现上述任何目标,都可能对我们的业务、财务状况或运营结果产生重大不利影响。
如果我们不能成功地吸引和留住高素质的人才,我们就可能无法成功地实施我们的业务 战略。此外,失去某些关键员工的服务将对我们的业务前景产生不利影响。
我们 依赖我们管理团队的关键成员。失去首席执行官Mark Pmeranz、Ravit Ram、首席财务官Elad Amor、首席会计官或我们高级管理团队的任何成员的服务,可能会损害我们执行Pure-Vu系统的商业战略和公司战略目标的能力。我们分别与我们的首席执行官、首席财务官和首席会计官签订了雇佣协议,但 这些协议可由员工在短时间内或在没有通知的情况下随时终止,而不会受到或受到有限的惩罚。此外,我们 不为我们管理 团队的任何成员维护,目前也无意为其购买“关键人物”人寿保险。
招聘和留住合格的科学和商业人员,包括销售和营销主管以及现场人员,对我们的成功也至关重要。鉴于众多医疗设备和制药公司之间对类似人员的竞争,以及基于我们的公司概况,我们可能无法以可接受的条件吸引和留住这些人员。我们还面临着从大学和研究机构招聘科学人员的竞争。如果我们未能招聘并留住这些人员,我们可能无法 有效地执行我们针对Pure-Vu系统的商业战略。
如果对我们提起产品责任诉讼,我们可能会承担大量责任,并可能被要求限制Pure-Vu系统的商业化 。
我们 现在是,将来也可能会受到产品责任索赔和诉讼,包括可能的集体诉讼,声称我们的 产品已经或可能导致不安全条件或伤害。对我们提出的任何产品责任索赔,无论是否具有 价值,都可能是昂贵的辩护费用,并可能导致不在保险覆盖范围内或超出保险范围的和解付款和调整。此外,我们可能无法按照我们可以接受的条款获得保险,或者根本无法获得保险,因为保险的成本各不相同,可能很难获得 。我们未能成功防御产品责任索赔或保持足够的保险覆盖范围,可能会对我们的运营结果和财务状况产生不利影响。
| 46 |
汇率 美元与以色列新谢克尔(“NIS”)之间的汇率波动和通货膨胀可能会对我们的收益产生负面影响,我们可能无法成功对冲货币兑换风险。
美元是我们的职能货币和报告货币。然而,我们的部分运营费用,包括人员和设施相关费用,都是在NIS发生的。因此,我们面临着新谢克尔兑美元可能升值的风险,或者,如果新谢克尔相对美元贬值,以色列的通货膨胀率可能会超过新谢克尔的贬值速度,或者这种贬值的时机可能会落后于以色列的通胀。在任何这种情况下,我们在以色列业务的美元成本都将增加,我们以美元计价的业务结果将受到不利影响。鉴于我们普遍缺乏货币 套期保值安排来保护我们免受NIS和其他外币相对于美元的汇率波动(和/或此类外币的通胀)的影响,我们可能会受到此类变动的实质性不利影响。我们 无法预测以色列通货膨胀率或新谢克尔对美元的贬值速度(如果有的话)的任何未来趋势。
我们 可能会收购其他业务或组建合资企业,或对其他公司或技术进行投资,这可能会对我们的经营业绩产生负面影响、稀释我们的股东所有权、增加我们的债务或导致我们产生巨额费用。
We may pursue acquisitions of businesses and assets. We also may pursue strategic alliances and joint ventures that leverage our intellectual property and industry experience to expand our offerings or distribution. We have no history of acquiring other companies or with forming strategic partnerships. We may not be able to find suitable partners or acquisition candidates, and we may not be able to complete such transactions on favorable terms, if at all. If we make any acquisitions, we may not be able to integrate these acquisitions successfully into our existing business, and we could assume unknown or contingent liabilities. Any future acquisitions also could result in the issuance of equity securities, incurrence of debt, contingent liabilities or future write-offs of intangible assets or goodwill, any of which could have a material adverse effect on our financial condition, results of operations, and cash flows. Integration of an acquired company also may disrupt ongoing operations and require management resources that we would otherwise focus on developing our existing business. We may experience losses related to investments in other companies, which could have a material negative effect on our results of operations and financial condition. We may not realize the anticipated benefits of any acquisition, technology license, strategic alliance, or joint venture.
为 为任何收购或合资企业提供资金,我们可以选择发行普通股作为对价,这将稀释 我们股东的所有权。额外资金可能无法以对我们有利的条款提供,或根本无法获得。如果我们的 普通股价格较低或波动较大,我们可能无法收购其他公司或以我们的股票为代价为合资项目提供资金。
全球 或区域性流行病,包括传染病爆发,可能会对我们的业务、财务状况、 收入和经营业绩造成重大不利影响。
我们 可能面临与健康流行病或传染病爆发有关的风险。例如,最近全球爆发 高传播性和致病性冠状病毒COVID—19。这类传染病的爆发可能导致广泛的卫生危机,对一般商业活动以及许多国家的经济和金融市场产生不利影响。
COVID—19疫情导致的 持续影响,我们和我们的业务合作伙伴开展业务,或认为此类 疫情可能发生的看法,以及我们的业务合作伙伴采取的措施,包括对业务或医院程序的限制 ,对我们与业务合作伙伴接触的限制,和/或受影响国家或地区的监管机构或 政府施加的限制,可能对我们的业务、财务状况、收入和经营业绩造成不利影响。
例如,COVID—19疫情或其他类似疫情可能对我们员工的整体生产力产生不利影响 ,我们可能需要采取非常措施,以确保员工和业务伙伴的安全。这些 措施可能要求我们的员工长时间避免前往正常工作场所,由于COVID—19爆发,我们 在某些地点已经经历过这种情况,这反过来又可能导致我们的商业 活动减少,或导致更高的成本或其他效率低下。
| 47 |
因此类疫情导致的供应商或客户的任何 严重中断都可能削弱我们满足和/或产生对 产品需求的能力,这可能对我们的收入、财务状况和商业运营造成负面影响。此类疫情还可能导致 我们的业务合作伙伴的制造作业延迟或暂停。
此外, 我们的业务可能会受到损害,如果我们的客户寻求限制或阻止我们的销售和临床支持团队访问其设施(由于COVID—19疫情,我们在某些地点已经经历过这种情况),或者 我们的客户推迟了择期手术,而他们的资源被转移到应对此类疫情,或者如果医院的资本支出 因此类疫情而削减或延迟,我们已经因为COVID—19疫情而经历过这种情况。疫情还可能导致国内和国际旅行受到限制,这可能会对我们 的客户互动工作产生负面影响,包括取消或推迟第三方会议、贸易展和类似活动, 我们已经因COVID—19疫情而经历过这些活动。
除上述风险外,在我们和业务合作伙伴的业务最初显示出从此类疫情中出现改善迹象的地点,我们可能面临疫情死灰复燃的风险,包括正在进行的COVID—19疫情死灰复燃。此类重新出现可能导致上述风险和限制的再次出现,以及我们的业务合作伙伴施加的新的或不可预见的 风险或限制,包括与我们的业务合作伙伴的运营或程序和/或 我们与这些业务合作伙伴的接触有关的,或由受影响国家或地区的监管机构和/或政府施加的,所有 可能对我们的业务、财务状况、收入和经营业绩造成不利影响。
此外, 在我们作为上市公司的运营中,长期的政府干扰、全球流行病和其他自然灾害或地缘政治 行动可能会影响我们进入公共市场和获得必要资本的能力,以便适当地利用和继续 我们的运营。
与我们的资本存量相关的风险
我们的 季度经营业绩可能会有很大的波动。
迄今为止,作为我们首次在美国市场推出的一部分,我们从Pure—Vu系统中产生的收入有限,但在扩大Pure—Vu系统的商业化努力之前,我们预计不会从产品销售中产生 可观的收入,这受到重大 不确定性的影响,因此,我们未来季度经营业绩可能会出现重大波动。 Pure—Vu系统的市场接受率可能导致季度变化。我们有限的运营历史使我们 预测季度收入的能力变得复杂,未来销售Pure—Vu系统产生的收入可能会不时波动。 此外,我们的费用水平部分基于对未来收入水平的预期。因此,预期收入的不足(如果有的话)可能导致我们的净收入不成比例地减少。因此,我们的季度经营业绩可能会 出现重大波动。
我们普通股的 活跃交易市场可能无法维持。
在2018年2月16日我们的IPO结束之前,我们的普通股没有公开市场。虽然我们的普通股在纳斯达克资本市场上市 ,但我们股票的市场表现出不同水平的交易活动。此外,当前 交易水平在未来可能无法维持。我们的普通股缺乏活跃的市场可能会损害投资者 在他们希望出售的时候或在他们认为合理的价格出售他们的股票的能力,可能会降低其股票的公允市值 ,并可能损害我们通过出售股票筹集资金以继续运营的能力,并可能损害我们的能力 以我们的股份为代价收购额外的知识产权资产。
在公开市场上出售大量普通股股票可能会导致普通股的市价大幅下跌 ,即使我们的业务表现良好。
我们的 股票价格可能会下跌,原因是大量出售我们的普通股股票,或认为这些出售可能发生 。这些出售,或这些出售可能发生的可能性,也可能使我们更难在未来以我们认为合适的时间和价格出售股本证券 。
| 48 |
此外,将来我们可能会发行额外的普通股股份或其他可转换为普通股的股权或债务证券 ,以供融资、收购、诉讼和解、员工安排或其他方面使用。任何此类发行都可能导致 对我们现有股东的实质性稀释,并可能导致我们的股价下跌。
如果 我们未能重新遵守继续在纳斯达克上市的要求,我们的普通股可能会被摘牌交易, 这将对我们普通股的流动性和我们筹集额外资本的能力产生不利影响。
纳斯达克资本市场针对上市公司的规则要求我们持续满足某些财务、公众持股量、投标价和流动性 标准,以便继续我们的普通股上市。为了维持我们在纳斯达克的上市,我们必须 满足纳斯达克在纳斯达克资本市场的持续上市要求,其中包括最低 股东权益为250万美元,以及我们普通股的最低出价为每股1美元。
正如 之前在2023年1月4日提交的8—K表格当前报告中披露的,我们收到纳斯达克的一封信,表明我们 不符合纳斯达克上市规则 5550(b)(1)(“股权规则”)下继续在纳斯达克上市的最低股东权益要求。此外,正如先前在2023年10月2日提交的8—K表格当前报告中披露的,我们于2023年9月27日收到通知,纳斯达克听证会小组(以下简称“听证会小组”)批准公司 延期,以重新遵守《股权规则》至2024年1月。
2024年1月18日,公司正式收到通知,听证小组确定公司已证明遵守了 《股权规则》规定的继续在纳斯达克资本市场上市的最低股东权益要求。 根据纳斯达克上市规则第5815(d)(4)(B)条,本公司将于2025年1月18日之前接受强制性小组监察。
此外,如之前在2023年4月5日提交的8—K表格当前报告中披露的,我们收到纳斯达克的一封信,表明 公司普通股的出价在过去30个交易日未能以最低1美元的价格收盘,违反了上市规则5550(a)(2)(“出价规则”)。公司被提供180个日历日,或直到2023年9月27日,以恢复遵守投标价格规则。于2023年11月21日,我们收到纳斯达克的函件,确认该公司已重新遵守上市规则5550(a)(2)中的最低买入价要求。
我们的普通股从纳斯达克退市将对我们进入资本市场产生重大不利影响,而 市场流动性的任何限制或因退市而导致的普通股价格下跌,都将对我们按照我们可接受的条件筹集 资本的能力产生不利影响。
如果 股票研究分析师不发表关于我们业务的研究或报告,或者他们发表不利评论或下调我们的 普通股的价格,我们普通股的价格可能会下跌。
我们普通股的 交易市场部分依赖于股票研究分析师发布的关于我们和我们 业务的研究和报告。我们不控制这些分析师。如果一个或多个股票分析师下调我们的 普通股的评级,或者如果分析师发表其他不利评论或停止发布关于我们或我们业务的报告,我们的普通股的价格可能会下跌。
我们的 股价可能会波动,这可能会使我们面临证券集体诉讼,我们的股东可能会遭受大量 损失。
我们普通股的市场价格可能会波动,并可能因以下因素而出现大幅波动:
| ● | 本公司季度或年度经营业绩的实际或预期波动; | |
| ● | 我们相对于竞争对手的增长率的实际变化或预期变化; | |
| ● | 未能达到或超过投资界或我们向公众提供的财务估计和预测; |
| 49 |
| ● | 发布证券分析师新的或最新的研究报告或报告; | |
| ● | 共享 由于我们股票的交易量水平不一致导致的价格和成交量波动;主要管理层的增加或离职 或其他人员; | |
| ● | 纠纷 或与专有权相关的其他发展,包括专利、诉讼事项以及我们为我们的技术获得专利保护的能力 ; | |
| ● | 宣布 或预期进行额外的债务或股权融资努力; | |
| ● | 销售 我们、我们的内部人士或其他股东持有我们的普通股;以及 | |
| ● | 一般 美国或其他地方的经济、市场或政治状况。 |
特别是 ,像我们这样的早期商业化阶段公司的市场价格由于因素而高度波动,包括但 不限于:
| ● | 任何 延迟或未能对我们的产品进行临床试验或获得FDA和其他监管机构的批准; | |
| ● | 产品知识产权方面的事态发展或纠纷; | |
| ● | 我们 或我们竞争对手的技术创新; | |
| ● | 投资者认为与我们相当的公司估值波动 ; | |
| ● | 公告 我们或我们的竞争对手签订的重大合同、收购、战略合作伙伴关系、合资企业、资本承诺、新 技术或专利; | |
| ● | 未能完成重大交易或与供应商合作生产我们的产品;以及 | |
| ● | 建议立法限制医疗治疗的价格。 |
这些 以及其他市场和行业因素可能会导致市场价格和对我们普通股的需求大幅波动,无论 我们的实际经营业绩如何,这可能会限制或阻止投资者轻易出售他们的普通股股票,否则可能 对我们普通股的流动性产生负面影响。此外,股票市场,特别是纳斯达克资本市场公司,经历了极端的价格和成交量波动,这些波动往往与这些公司的经营业绩无关或不成比例。过去,当股票的市场价格波动时,该股票的持有人会对发行股票的公司提起 证券集体诉讼。如果我们的任何股东对我们提起诉讼, 我们可能会为此付出大量的费用。这样的诉讼也会分散我们管理层的时间和注意力。
我们的内部控制的有效性可能会受到限制,如果我们的控制系统未能防止错误或欺诈, 可能会对我们的公司造成重大损害。
适当的 财务会计内部控制系统和披露控制和程序对于上市公司的运营至关重要。我们不期望披露控制或财务报告内部控制将防止 所有错误和所有欺诈。无论控制系统的设计和操作如何良好,都只能提供合理而非绝对的保证 控制系统的目标将得到满足。此外,控制系统的设计必须反映出存在资源限制的事实,并且必须相对于控制成本考虑控制的好处。由于 所有控制系统都存在固有的局限性,任何控制措施的评估都不能提供检测到所有控制问题和欺诈实例(如果有的话)的绝对保证。我们的控制系统未能防止错误或欺诈,可能会对我们造成重大不利影响。
| 50 |
如果 我们未能对财务报告保持适当和有效的内部控制,我们编制准确和及时的财务报表的能力可能受到损害,投资者可能对我们的财务报告失去信心,我们普通股的交易价格可能 下跌。此外,由于我们作为非加速申报人的身份,我们的独立注册公共会计师在可预见的将来无需 就我们对财务报告的内部控制提供证明报告。
根据《萨班斯—奥克斯利法案》第404条,我们 需要向管理层提交报告,其中包括我们对财务报告的内部控制的有效性 。此评估包括披露我们管理层在财务报告内部控制中发现的任何重大弱点 。我们还将被要求每季度披露内部控制和程序的变更 。
重大弱点定义为财务报告内部控制中存在缺陷或缺陷组合,致使 年度或中期财务报表中存在重大错报 的合理可能性无法防止或发现和及时纠正。
我们 可能无法及时完成评估、测试和任何所需的补救措施。在评估和测试 过程中,如果我们发现我们对财务报告的内部控制存在一个或多个重大弱点,我们将无法断言 我们的内部控制是有效的。
本 年度报告不包括我们独立注册会计师事务所的证明报告,因为我们是一家"非加速 申报人",并且可能会利用适用于加速申报人的上市公司的各种报告要求的某些豁免, 这些要求包括但不限于,无需遵守《萨班斯—奥克斯利法案》第404(b)条的审计师认证要求。
过去,我们发现了控制措施中存在的重大缺陷,随后予以纠正。我们无法向投资者保证,我们 未来在财务报告内部控制方面不会有其他重大缺陷。
如果 我们在未来发现财务报告内部控制存在重大缺陷,或者如果我们无法成功纠正 已发现的重大缺陷,或者,如果我们无法及时遵守第404条的要求,或者 我们对财务报告的内部控制是有效的,或者,如果适用,我们的独立注册会计师事务所无法 对我们内部控制的有效性发表意见,我们可能失去投资者对我们财务报告的准确性和完整性的信心 ,这将导致我们普通股的价格下跌,我们可能会受到SEC或其他监管机构的调查或制裁 ,这可能需要额外的财务和管理资源。
我们 目前不打算在可预见的将来支付普通股股息,因此,投资普通股的收益 很可能取决于普通股价格的升值。
我们 从未就普通股宣布或支付现金股息,且预期在可预见的将来不会向普通股 持有人支付现金股息。因此,投资者必须依赖于价格上涨后出售其普通股,这可能 永远不会发生,这是实现其投资未来收益的唯一途径。无法保证我们的普通股 的股票会升值,甚至维持我们的股东购买其股票的价格。
本公司解散后,本公司股东不得收回全部或部分投资。
如果 本公司发生清算、解散或清盘(无论是自愿还是非自愿), 本公司在该交易生效后剩余的所得款项和/或资产,以及支付所有债务和负债以及 需要向任何未发行优先股持有人进行的分配,将按比例分配给本公司普通股股东。我们无法保证,我们将有可用资产支付给我们的普通股持有人,或任何金额, 在我们的公司进行此类清算、解散或清盘。
| 51 |
我们的 注册证书(经修订)允许我们的董事会在未经 股东进一步批准的情况下创建新系列的优先股,这可能会对我们普通股持有人的权利造成不利影响。
我们的 董事会有权确定和确定优先股的相对权利和优先权。我们的董事会 有权发行最多1000万股我们的优先股,而无需股东进一步批准。因此,我们的董事会 可以授权发行一系列优先股,这些优先股将在清算时授予持有人对我们资产的优先权 ,以及在股息分配给普通股持有人之前接受股息付款的权利。此外, 我们的董事会可以授权发行一系列优先股,这些优先股的投票权大于我们的普通股 ,或者可以转换为我们的普通股,这可能会降低我们普通股的相对投票权,或者导致 对我们现有股东的稀释。
我们的 注册证书(经修订)指定特拉华州法院为 股东可能发起的某些类型的诉讼和诉讼的唯一和专属论坛,这可能会阻止对我们、我们的 董事和高级管理人员提起诉讼。
经修订的公司注册证书规定,除非我们书面同意选择替代法院,否则特拉华州衡平法院将是(I)代表我们提起的任何派生诉讼或诉讼;(Ii)任何声称违反受托责任的诉讼;(Iii)根据《特拉华州公司法》、经修订的公司注册证书或本公司章程的任何条款的解释或适用而针对我们或我们的任何高级职员或董事提出的任何索赔的任何诉讼; 或(Iv)任何声称受内部事务原则管辖的索赔的诉讼。但是,如果特拉华州衡平法院因缺乏标的物管辖权而驳回任何此类诉讼,诉讼可在特拉华州的另一家州法院开庭审理。
与我们在以色列的业务有关的风险
我们的研发设施和一些供应商位于以色列,因此,我们的业务、财务状况和运营结果可能会受到以色列政治、经济和军事不稳定的不利影响。
我们的研发设施位于以色列北部。此外,我们的大多数员工都是以色列居民。因此,以色列的政治、经济和军事状况可能会直接影响我们的业务。自1948年以色列国建立以来,以色列国及其经济经历了显著的增长和扩张,同时生活水平也有所提高,并发展了世界上最先进的高科技产业之一。然而,它继续面临许多地缘政治和其他挑战,这些挑战可能会影响到位于以色列的公司,如我们的公司。例如,以色列与其阿拉伯邻国之间发生了多起武装冲突。尽管以色列与埃及和约旦签署了和平协议,与巴勒斯坦权力机构达成了全面协议,与阿拉伯邻国达成了其他关于公开关系正常化的协议,但以色列境内继续存在不同程度的动乱和恐怖活动,以色列与巴勒斯坦权力机构以及约旦河西岸和加沙地带的其他组织之间持续的敌对行动和武装冲突 最近的动乱是由于美国将其大使馆从特拉维夫迁至耶路撒冷。这些敌对行动和暴力对以色列经济和我们的行动的影响尚不清楚,我们无法预测这些敌对行动的进一步增加或该地区未来的任何武装冲突、政治不稳定或暴力对我们的影响。我们可能会受到涉及以色列的任何重大敌对行动、以色列与其贸易伙伴之间的贸易中断或削减、抵制或以色列经济或财政状况的显著下滑的伤害。 以色列与其阿拉伯邻国的关系,尤其是对我们在该地区的行动的影响仍不确定。建立新的原教旨主义伊斯兰政权或对以色列更具敌意的政府可能会对该地区的稳定产生严重后果 ,对以色列施加额外的政治、经济和军事限制,对我们的行动产生实质性的不利影响,并限制我们向该地区国家销售产品的能力。
| 52 |
特别是,2023年10月7日,在加沙地带某些武装团体对以色列发动突然袭击后,以色列和加沙地带的恐怖组织之间爆发了战争。到目前为止,我们在以色列的行动没有受到持续战争的重大影响。
此外,主要在中东的几个国家仍然限制与以色列和以色列公司做生意,如果以色列境内的敌对行动或该地区的政治不稳定持续或加剧,还有更多的国家和组织已经或可能对与以色列和以色列公司做生意施加限制。这些限制可能会限制我们向这些国家/地区的公司销售产品的能力。此外,抵制、撤资和制裁运动是一场全球运动,试图增加对以色列的经济和政治压力,要求以色列遵守该运动所述的目标,这可能会获得更大的吸引力,并导致对以色列产品和服务的抵制。任何涉及以色列的敌对行动或以色列与其目前贸易伙伴之间的贸易中断或削减,或以色列经济或财政状况的显著下滑,都可能对我们的业务、业务结果和财务状况产生不利影响。
我们的商业保险单不包括与武装冲突和恐怖袭击有关的损失。尽管以色列政府 过去承保了因恐怖袭击或战争行为造成的某些损害的恢复价值,但我们无法向您保证,该政府承保范围将保持不变,或者如果保持,将足以全额赔偿我们造成的损害。 我们造成的任何损失或损害都可能对我们的业务产生实质性的不利影响。
我们 的运营也可能因我们的一些员工履行兵役义务而中断。 以色列的一些员工可能需要在每三年期间内工作54天(对于军官, 每三年最多为84天)军事预备役,直到他们年满40岁(在某些情况下,取决于其特定的军事 和军衔,最高可达45岁甚至49岁),并且在某些紧急情况下,可以立即和无限制的现役。为了应对恐怖活动的增加,有几个时期对军事预备役人员进行了大量的征召, 今后可能会有类似的大规模军事预备役人员征召。我们的运营可能会因大量与兵役相关的员工缺席而中断 ,这可能会对我们的业务 和运营结果造成重大不利影响。
根据 我们收到的以色列政府研发支出补助金的条款,我们有义务向以色列政府支付某些 特许权使用费。补助金的条款要求我们满足特定条件,并在某些事件时除偿还补助金外,还支付额外的 款项。
我们 已经收到并且将来可能收到来自IIA的赠款,用于根据IIA条例为我们的一部分研发支出提供资金 。
截至 2023年12月31日,我们从IIA收到总额为130万美元的赠款, 对IIA负有总额约为140万美元的或有债务(假设没有增加,根据IIA条例,如下所述)。 截至2023年12月31日,我们向IIA支付了最低金额。我们可能会在未来申请额外的IIA资助。然而,由于以色列国年度预算中用于IIA赠款的资金 须经IIA的事先批准,且过去已经减少 ,将来可能会进一步减少,因此我们无法预测我们是否有权获得或批准— 任何未来赠款,或任何此类赠款的金额(如果获得批准)。
作为 这些赠款的交换,我们需要向IIA支付4%的特许权使用费(在某些情况下可能会增加)来自我们产生的收入(以任何方式)从使用IIA赠款开发的专有技术中获得,最多100%(在某些情况下可能会增加)补助金的美元挂钩价值,加上利息(通常按12个月的美国, 国际投资协会批准特定补助金的日历年年初公布的美元LIBOR利率)。
| 53 |
The IIA Regulations also require that products developed with IIA grants be manufactured in Israel at a rate (scope) which will not be less than the rate of manufacturing and added value in Israel that were included in the relevant grant applications submitted to the IIA. Furthermore, the IIA Regulations require that the know-how resulting from research and development according to an IIA-approved plan, not being the product developed within the framework of such approved plan, and any right deriving therefrom may not be transferred outside of Israel (including by way of certain licenses), unless prior approval is received from the IIA. We received approval for the transfer of manufacturing of the sleeves outside of Israel. The transfer outside of Israel of manufacturing which is connected with the IIA-funded knowhow will result in a higher royalty repayment rate and may further result in increased royalties (up to three times the aggregate amount of the IIA grants plus interest thereon). Even following the full repayment of any IIA grants, we must nevertheless continue to comply with the requirements of the IIA Regulations. The foregoing restrictions and requirements for payment may impair our ability to transfer or sell our technology assets outside of Israel or to outsource or transfer development or manufacturing activities with respect to any IIA-funded know-how outside of Israel.
此外,接受国际保险业协会资助的公司通常被要求确保其保留国际保险业协会支持的产品的所有权利。这意味着,一般而言,根据国际投资协定核准的计划进行的研究和开发所产生的所有专有技术,以及由此产生的每一项权利,自产生这些专有技术之日起,必须归接受国际投资机构资助的人所有。接受国际保险业协会资助的公司还须遵守报告要求和其他技术要求,这些要求旨在使国际保险业协会 能够确保国际保险业协会的规定得到遵守。
如果 我们未能遵守IIA规定的任何条件和限制,或我们 获得赠款的特定条款,我们可能被要求退还之前收到的任何赠款以及利息和罚款,在某些 情况下,可能会受到刑事指控。
可能难以执行美国法院在以色列针对我们的判决,或在以色列维护美国证券法索赔 或向这些专家提供诉讼程序。
Motus GI Medical Technologies Ltd., our wholly owned subsidiary, is incorporated in Israel. Our Israeli experts reside in Israel, and substantially all of our technology and intellectual property assets are located in Israel. Therefore, a judgment obtained against us, or any of such persons, may not be collectible in the United States and may not be enforced by an Israeli court. It also may be difficult for you to affect service of process on such persons in the United States or to assert U.S. securities law claims in original actions instituted in Israel. Israeli courts may refuse to hear a claim based on an alleged violation of U.S. securities laws on the grounds that Israel is not the most appropriate forum in which to bring such a claim. In addition, even if an Israeli court agrees to hear a claim, it may determine that Israeli law and not U.S. law is applicable to the claim. If U.S. law is found to be applicable, the content of applicable U.S. law must be proven as a fact by expert witnesses, which can be a time consuming and costly process. Certain matters of procedure would also be governed by Israeli law. There is little binding case law in Israel that addresses the matters described above. As a result of the difficulty associated with enforcing a judgment against us in Israel, you may not be able to collect any damages awarded by either a U.S. or foreign court.
我们 可能会因我们的现任或前任员工就指定的服务发明支付赔偿金而受到索赔,这可能 导致诉讼并对我们的业务造成不利影响。
根据 以色列专利法,5727—1967或专利法,雇员在其工作范围内构思的发明被视为"服务发明",由雇主拥有,雇员和 雇主之间没有给予雇员服务发明权的具体协议。《专利法》还规定,如果雇主和 雇员之间没有此类协议,该协议规定雇员是否有权获得其 或她的职务发明的报酬,以及在何种程度上以及在何种条件下获得报酬,则此类事项可根据雇员的申请由政府任命的根据《专利法》设立的报酬和特许权使用费委员会决定。我们的知识产权很大一部分是由我们在以色列的 员工在任职期间开发的。这些员工同意放弃并转让给我们的所有知识产权 的所有权利,我们的大多数现任员工,包括所有参与我们知识产权开发的员工,都同意放弃他们可能拥有的与职务发明有关的经济权利。
然而, 尽管有这些合同义务,我们不能向您保证,现任或前任员工不会向我们提出索赔 要求报酬,以换取转让的指称的职务发明或任何其他知识产权。如果提出任何此类 索赔,我们可能会被要求就此类分配服务 发明或任何其他知识产权向现任或前任员工支付报酬,或被迫提起此类索赔诉讼,这可能会对我们的业务造成负面影响。
| 54 |
| 项目 1B。 | 未解决的 员工意见 |
没有。
| 项目 1C. | 网络安全 |
网络安全 风险管理
我们 和我们行业中的其他公司一样,面临着与我们业务有关的许多网络安全风险。迄今为止,我们的业务策略、运营结果 和财务状况尚未受到网络安全威胁风险的影响。在报告期内, 我们没有经历任何重大网络事件,也没有经历一系列需要披露的非重大事件。
在 日常业务过程中,我们使用、存储和处理数据,包括员工、合作伙伴、协作者和供应商的数据。 我们实施了一项网络安全风险管理计划,旨在识别、评估和缓解网络安全 威胁对这些数据和我们的系统造成的风险。我们的网络安全风险管理计划包含多个组成部分,包括信息 安全计划评估、使用自动化工具持续监控网络风险和威胁、本地和云备份、 定期威胁测试以及员工培训。在执行管理层的指导下,我们的网络风险管理计划 由获得Microsoft网络安全架构专家认证的第三方IT顾问领导。我们将端点检测软件和 设备管理与其他信誉良好的网络安全软件结合使用。我们需要跨所有系统进行多因素身份验证 ,并利用访问控制策略进一步限制对系统内数据的访问。
我们 定期与第三方进行风险评估,包括渗透测试和其他漏洞分析。我们的财务 部门在外部技术顾问的协助下,定期对不同系统进行内部评估,以评估 我们风险管理流程的有效性。通过这些评估和测试,我们评估了已知风险,并加强了 本地环境和基于云的环境。此外,我们的计划还包括针对所有员工的网络安全培训和测试—在 入职期间和此后的季度。该培训侧重于网络威胁意识、网络钓鱼和其他攻击方法,并辅之以测试计划(包括半年一次的网络钓鱼测试)。
治理
在 首席执行官和执行管理团队的最终指导下,在 董事会审计委员会(以下简称"审计委员会")的监督下,我们维持一个安全治理结构,以评估和应对网络风险。我们的 执行管理团队定期咨询我们在网络安全方面具有专业知识的第三方IT顾问,以制定策略 来评估、解决网络安全工作并使其符合我们的业务目标和运营要求。
我们的 董事会负责监督网络安全风险管理。我们的董事会已授权审计委员会对 网络安全风险管理计划进行定期监督,其中包括对信息安全和网络安全威胁 以及相关合规性和披露要求的监督。每季度,我们的执行管理团队向审计 委员会提供有关我们网络安全风险管理计划的最新信息,包括任何关键网络安全风险、正在进行的网络安全计划 和战略以及适用的监管要求和行业标准。执行管理团队还将任何网络安全事件(疑似或实际事件)通知审计 委员会,并酌情提供有关事件的最新信息以及网络安全风险缓解 活动。
| 第 项2. | 特性 |
我们 目前租用7,836平方英尺的空间在Tirat Carmel,以色列。此设施用于办公空间以及 产品开发的实验室。我们与该设施签订了一份新的租赁合同,合同期限为十二个月,自2024年1月1日至2024年12月31日。12个月的租金约为20万美元。
On April 13, 2017, we entered into a lease for a facility in Fort Lauderdale, Florida, which we began occupying in October 2017. On December 20, 2017, we entered into a lease amendment upon remeasurement of the lease space. The facility currently consists of 4,554 square feet, which increased to 6,496 square feet by the second year of the lease. The term runs for seven years and two months from September 2017. Annual base rent was amended to $159 thousand per year, subject to annual increases of 2.75%. This facility is used for office space as well as laboratories for both quality assurance and product development. In January 2020, the Company entered into a license agreement (the “Shared Space Agreement”) with Orchestra BioMed, Inc. (OBIO), formerly a greater than 5% holder of the Company’s common stock. Pursuant to the Shared Space Agreement, the Company granted a license to OBIO for the use of portions of the office space not being used by the Company in the Company’s leased facility in Fort Lauderdale, Florida (the “Premises”), and a proportionate share of common areas of such Premises, which previously covered approximately 35% of the Premises and was to expand incrementally to approximately 60 to 70% of the Premises by September 2024. In May 2022, the Company entered into an amendment to the Shared Space Agreement. Pursuant to the amendment, the area covered by the Shared Space Agreement was expanded to 95% of the premises and the aggregate license fees will generally range from approximately $212 thousand to approximately $270 thousand in any given calendar year during the term of the Shared Space Agreement until the termination of the lease in November 2024.
我们 相信我们的设施足以满足我们可预见的需求。
| 第 项3. | 法律程序 |
我们 目前不受任何重大法律诉讼的影响;然而,我们可能不时成为在日常业务过程中产生的各种法律诉讼的一方 。尽管诉讼及索偿的结果无法确定地预测,但截至本报告日期 ,吾等认为吾等并无任何索偿或诉讼的当事方,而该等索偿或诉讼的结果(倘其结果对吾等不利)将合理预期个别或整体对吾等业务造成重大不利影响。无论 结果如何,诉讼都可能对我们产生不利影响,原因是辩护和和解成本、管理资源的转移和其他 因素。
| 第 项。 | 矿山 安全信息披露 |
不适用 。
| 55 |
第 第二部分
| 第 项5. | 注册人普通股、相关股东事项和发行人购买股权证券的市场 |
市场信息
我们的 普通股在纳斯达克资本市场交易,代码为MOTS。我们的普通股于2018年2月14日开始交易,与我们的首次公开募股相关。在此之前,我们的普通股还没有成熟的公开交易市场。
记录持有者
截至2024年2月6日,我们约有289名普通股持有者。这一数字不包括其 股票以街道名义持有的受益所有者。我们普通股的实际持有者人数超过这一记录持有者的数量,包括 作为实益所有者的股东,但其股票由经纪人以街头名义持有或由其他被指定人持有。
| 第 项6. | 已保留 |
不适用 。
| 第 项7. | 管理层对财务状况和经营结果的讨论和分析。 |
以下对我们财务状况和经营结果的讨论和分析应与我们的财务报表一起阅读 以及本报告中其他部分包含的相关说明和其他财务信息。本讨论包含涉及风险和不确定性的前瞻性 陈述。由于各种因素的影响,我们的实际结果可能与这些前瞻性陈述中预期的结果大不相同,包括下文和本报告其他部分讨论的因素,特别是“风险因素”下的因素。
概述
我们 开发了Pure-Vu系统,这是一种已获得美国食品和药物管理局(FDA)批准的医疗设备 ,可帮助在结肠镜检查过程中清理准备不足的胃肠道,并帮助促进上消化道 (“GI”)内窥镜检查。Pure-Vu系统还在欧洲经济区(EEA)获得CE认证,用于结肠镜检查。Pure-Vu系统与标准和细长结肠镜以及胃镜相集成,以改进结肠镜检查和上消化道检查过程中的可视化,同时保留已建立的程序流程和技术。通过灌溉和清理废墟,Pure-Vu系统旨在提供更高质量的考试。住院患者的结肠镜检查和内窥镜检查存在挑战,尤其是对于患有并存或活动性出血的老年患者,由于粪便、血液或血栓等碎片,其可视化、诊断和治疗的能力经常受到影响。我们认为,在高视力患者中尤其如此,如胃肠道出血 ,血液和血栓的存在可能会损害医生的视野,清除它们对于医生 能够及时识别和治疗出血来源至关重要。我们相信,使用Pure-Vu系统可以安全、快速地改善结肠和上消化道的可视化,从而为医院带来积极的结果和更低的成本,有可能使 立即进行有效的诊断和治疗。到目前为止,在涉及治疗具有挑战性的住院患者和门诊病例的多项临床研究中,Pure-Vu系统在减少PREP方案后一直帮助实现了高于95%的足够的肠道清洁率。我们还相信,这项技术在未来可能会有用,作为一种工具,有助于减少用户对传统的术前肠道准备方案的依赖。根据我们对从iData Research Inc.获得的美国和欧洲最新市场数据的回顾和分析,我们认为,2022年期间,美国约有150万例住院患者进行了结肠镜检查,全球约有480万例。根据iData Research Inc.的数据,2019年美国上消化道出血的发生率约为每年40万例。Pure-Vu系统在美国已被分配了ICD-10代码。该系统目前与任何其他国家/地区的任何私人或政府第三方付款人没有唯一的 代码;但是,我们可能会在未来开展报销 活动,特别是在门诊结肠镜检查市场。我们在2023年10月获得了FDA的510(K)批准,用于上消化道的Pure-Vu EVS系统以及用于结肠的增强版本。我们已于2024年第四季度末开始将这些产品推向市场。在我们进一步扩大商业化努力之前,我们预计不会从产品销售中获得可观的收入,而商业化努力受到重大不确定性的影响。
| 56 |
财务 运营概述
到目前为止,我们从产品销售中获得的收入有限。自成立以来,我们从未实现盈利,每年都出现重大净亏损,包括截至2023年12月31日的年度净亏损1,290万美元,我们预计在可预见的未来, 将继续出现净运营亏损。截至2023年12月31日,我们拥有500万美元的现金和现金等价物,累计赤字为1.542亿美元。根据我们的贷款协议,我们还有230万美元的未偿债务。在 2月,我们完成了一项交易,即立即行使由一名机构投资者持有的B系列未偿还普通股认购权证,购买总计2,933,334股普通股,给我们带来约270万美元的总收益。
2023年1月和4月,我们承诺实施重组计划,旨在让我们探索一系列战略和融资替代方案,专注于最大化股东价值和加快Pure-Vu系统的商业化。如果战略交易没有完成,或者如果没有额外的融资,我们可能无法偿还我们的未偿债务和应付款项,可能不得不申请破产保护或 解散和清算我们所有剩余的资产。在这种情况下,可用于分配给我们的 股东的现金数量(如果有的话)将在很大程度上取决于做出这一决定的时机,因为随着时间的推移,可用于分配的现金数量 将减少,因为我们将继续为我们的运营提供资金并偿还未偿债务。我们不能保证在偿还我们的债务和其他 义务并拨备储备资金后,可供分配给股东的现金金额(如果有的话),也不能保证任何此类分配的时间(如果有的话)。这样的情况让人对我们作为一家持续经营的企业继续下去的能力产生了严重的怀疑。
我们 继续寻求通过公开或私募股权或债务融资或其他来源为我们的运营提供资金,这可能包括与第三方合作和评估其他战略替代交易,包括但不限于收购、合并、反向合并、其他业务合并、资产出售、许可和其他交易。出售股权和可转换债务证券可能会导致我们的股东的股权被稀释,其中某些证券的权利可能优先于我们普通股的权利。如果我们 通过发行优先股、可转换债务证券或其他债务融资来筹集额外资金,这些证券或其他债务可能包含限制我们运营的契诺。任何其他第三方融资安排都可能要求我们 放弃宝贵的权利。未来融资的来源、时间和可获得性将主要取决于市场状况,更具体地说,取决于我们产品和临床开发计划的进展以及商业活动。我们可能无法以可接受的条款获得足够的额外 融资,或者根本无法获得融资。我们未能在需要时筹集资金或执行战略交易 将对我们的财务状况和我们执行业务战略的能力产生负面影响。我们将需要 产生可观的收入来实现盈利,但我们可能永远不会这样做。此外,通货膨胀对劳动力、运费和材料等成本的影响以及金融市场的持续波动可能会对企业的财务业绩和流动性产生负面影响。
关键会计政策和重大判断和估计
我们的合并财务报表是根据美国公认的会计原则编制的。在编制我们的合并财务报表和相关披露时,我们需要做出影响 资产、负债、收入、成本和支出的报告金额以及在我们财务报表中披露或有资产和负债的估计和判断。我们的估计基于历史经验、已知趋势和事件以及我们认为 在当时情况下是合理的各种其他因素,这些因素的结果构成了对资产和负债的账面价值作出判断的基础,而这些资产和负债的账面价值从其他来源看起来并不明显。我们在持续的基础上评估我们的估计和假设。在不同的假设或条件下,我们的实际结果可能与这些估计值不同。
虽然我们的主要会计政策在我们的综合财务报表附注3中有更详细的描述,但我们认为以下会计政策对我们编制综合财务报表时使用的判断和估计是最关键的。
收入 确认
我们 通过销售或租赁我们的Pure-Vu系统工作站(“工作站”)以及销售我们的一次性套筒(“一次性用品”)和相关服务获得收入,这些服务主要是我们工作站上的支持和维护服务。 有关收入确认的进一步讨论,请参阅附注3。
| 57 |
我们的工作站和一次性用品的销售 按照ASC主题606—客户合同收入进行核算,以描述 控制权转移给我们的客户,金额反映了我们预期有权获得的对价。 工作站销售收入在客户承诺购买工作站并交付工作站后确认, 是所有权转移时。一次性物品被识别为单独的履约义务,因此, 一次性物品销售收入在一次性物品交付给客户且所有权转移时确认。
对于 ASC 606范围以外的合同,我们根据 ASC 842确定带有嵌入式租赁的拟议供应安排的收入,并根据ASC 606确定拟议供应安排内的某些销售组成部分。对于(i) 包含最低采购承诺的安排,以及(ii)不包含最低采购承诺的安排, 但为超过指定级别的采购提供批量折扣的安排,我们使用总估计采购量方法,将交易 价格分配至拟议供应安排内的履约义务。
库存
存货 使用加权平均成本法按成本和可变现净值两者中的较低者入账。确定库存 成本是否可变现需要管理层进行估计。我们在每个报告期间执行库存的可变现性评估 。潜在过时或过剩库存的减记是根据管理层对库存水平、历史过时、未来销售预测和商业业务的任何变化的分析进行的。我们将任何多余和过时的 存货减记至其首次识别减值期间的估计可变现价值。根据未来销售预测,自资产负债表日起未来12个月内超过 预计实现的存货分类为长期资产。
基于股份的薪酬
我们的 基于股份的薪酬计划授予的奖励包括股票期权、认股权证和限制性股票单位。向员工和非员工(包括董事)颁发补助金 。
我们 根据ASC主题718 "补偿—股票补偿"或ASC 718对基于股份的补偿进行核算。 ASC 718要求向雇员和非雇员董事支付的所有股票支付,包括授予雇员股票期权和受限制的 股票单位以及对现有股票期权的修改,均应根据其公允价值在综合全面损失表中确认 。
我们 在发生时对没收进行会计处理,而不是在授予时估计没收,如果实际没收与我们的估计不同,则在后续 期间修订这些估计。在财务报表中确认的基于股份的薪酬开支是 基于预期满足绩效或服务条件的奖励。
我们的 基于股份的奖励受服务或基于绩效的归属条件的约束。与授予雇员、 董事和非雇员的奖励有关的补偿费用,按奖励的相关服务期(通常为归属期)内的授予日期公允 价值以直线法确认。
我们 在奖励的相关服务期间,根据奖励的公允价值以直线法计算奖励给员工的限制性股票单位奖励 。
| 58 |
We estimate the fair value of our option awards to employees, directors and non-employees using the Black-Scholes option pricing model, which requires the input of subjective assumptions, including (i) the expected stock price volatility, (ii) the calculation of expected term of the award, (iii) the risk-free interest rate and (iv) expected dividends. Due to the lack of complete company-specific historical and implied volatility data for the full expected term of the stock-based awards, we base our estimate of expected volatility on a representative group of publicly traded companies in addition to our own volatility data. For these analyses, we selected companies with comparable characteristics to our own, including enterprise value, risk profiles, position within the industry and with historical share price information sufficient to meet the expected life of the stock-based awards. We compute historical volatility data using the daily closing prices for the selected companies’ shares during the equivalent period of the calculated expected term of the stock-based awards. We will continue to apply this process until a sufficient amount of historical information regarding the volatility of our own stock price becomes available. We have estimated the expected term of our employee stock options using the “simplified” method, whereby, the expected term equals the arithmetic average of the vesting term and the original contractual term of the option due to its lack of sufficient historical data. The risk-free interest rates for periods within the expected term of the option are based on the U.S. Treasury securities with a maturity date commensurate with the expected term of the associated award. We have never paid, and do not expect to pay, dividends in the foreseeable future.
复杂金融工具
本公司审阅债务工具、 股本工具和其他融资安排的条款,以确定是否存在嵌入式衍生工具特征,包括嵌入式转换 期权,其需要分开并作为衍生金融工具单独入账。此外, 与发行融资工具有关,公司可能会发行独立期权和认股权证,包括向 非员工发行期权或认股权证,以换取咨询或其他服务。本公司根据 会计准则编纂("ASC")815,衍生品和套期保值("ASC 815")对其普通股权证进行会计处理。根据ASC 815的条款 ,如果普通股权证要求净现金结算或给予持有人 以净现金结算的选择权,或其不符合权益分类标准,则本公司将普通股权证入账为负债。
如果合同要求实物结算或实物净额 结算,或者如果本公司可以选择实物结算或实物净额结算,且认股权证符合 分类为权益的要求,本公司将普通股认股权证入账为权益。分类为负债的普通股认股权证最初按授出日期的公允价值入账,并在每个结算日按公允价值重新计量 ,抵销调整记录在综合 经营报表内的认股权证负债公允价值变动中。分类为权益的普通股认股权证最初按授出日期的公允价值计量,其后不会 重新计量。
最近 会计声明
有关最近会计声明的讨论,请参阅 合并财务报表随附附注中的附注3 "重要会计政策和呈列基准" 。
运营结果
截至2023年12月31日和2022年12月31日的年度比较
收入
截至2023年12月31日,我们从产品销售中产生了有限的收入。在进一步扩大Pure—Vu EVS系统的商业化努力之前,我们预计不会从产品销售中产生大量 收入,这是一个很大的 不确定性。
截至2023年12月31日止年度的收入 总计为319. 0万美元,而截至2022年12月31日止年度为592. 0万美元。减少 27.3亿美元,主要是由于EVS产品线的销售额减少,原因是2023年重组 导致销售人员减少。
收入成本
截至2023年12月31日止年度的收入成本 总计为56.9万美元,而截至2022年12月31日止年度的收入成本为79.6万美元。减少22.7万美元的主要原因是一次性评估和 出售的商用设备以及出售的工作站设备减少了11.7万美元,以及与过剩库存有关的库存减值减少了11.0万美元。截至2023年12月31日止年度的产品销售收入成本 总计为81,000美元,而截至2023年及2022年12月31日止年度的产品销售毛利 分别为75%及67%。
研究和开发
研究和开发费用包括与我们的Pure—Vu系统开发和临床项目进展有关的费用。 我们在电气和机械工程方面拥有研发能力,在以色列的工厂设有实验室,用于 开发和原型设计以及电子设计和测试。我们还使用顾问和第三方设计公司来补充 我们的内部能力。
截至2023年12月31日止年度的研发费用共计350万美元,而截至2022年12月31日止年度为560万美元。减少210万美元主要是由于截至2023年12月31日止年度上半年的重组导致工资及相关成本减少90万美元,临床试验成本减少60万美元, 基于股份的薪酬减少20万美元,专业和咨询费用30万美元,差旅费和其他研发费用10万美元。
| 59 |
销售 和市场营销
销售 和市场营销费用包括主要与我们的销售和市场营销人员以及支持Pure—Vu系统商业化的基础设施有关的费用。
截至2023年12月31日止年度的销售 和营销费用共计160万美元,而截至2022年12月31日止年度为440万美元。减少280万美元的主要原因是由于截至2023年12月31日止年度上半年的重组导致工资及相关成本减少190万美元,演示产品减少20万美元, 促销及贸易展览减少20万美元,20万美元的股份薪酬和30万美元的差旅费和其他销售和 营销费用。
常规 和管理
一般 和管理费用主要包括与我们的整体运营和作为上市公司相关的费用。这些成本 包括人事、法律和金融专业服务、保险、投资者关系以及合规相关费用。
截至2023年12月31日止年度的一般 及行政费用总计为660万美元,而截至2022年12月31日止年度为760万美元。减少100万美元的主要原因是,基于股份的薪酬减少了90万美元,投资者和公共关系成本减少了20万美元,保险成本减少了10万美元,其他一般 和行政费用减少了30万美元,但工资和相关费用增加了50万美元,部分抵消了减少额。
其他 收入和支出
截至2023年12月31日止年度的其他 支出净额共计100万美元,而截至2022年12月31日止年度为70万美元。其他支出净额增加30万美元主要是由于财务支出减少50万美元,但被或有特许权使用费责任估计公允价值变动收益减少40万美元和债务清偿损失增加30万美元所抵消。
流动性 与资本资源
To date, we have generated minimal revenues, experienced negative operating cash flows and have incurred substantial operating losses from our activities. We expect operating costs will increase significantly as we incur costs associated with commercialization activities related to the Pure-Vu System. As described above under “Overview” and “Financial Operations Overview,” we adopted a restructuring program in January and April 2023 intended to reduce our operating costs and other expenses and have commenced a process of evaluating strategic alternatives. If a strategic transaction is not completed, or if additional financing is not available, we may not be able to service our outstanding indebtedness and our payables and may have to file for bankruptcy protection or pursue a dissolution of the company and liquidation of all of our remaining assets. In such an event, the amount of cash available for distribution to our shareholders, if any, would depend heavily on the timing of such decision, as with the passage of time the amount of cash available for distribution may be reduced as we continue to fund our operations and service our outstanding indebtedness. Further, we cannot provide assurance as to the amount of cash that would be available to distribute to shareholders, if any, after paying our debts and other obligations and setting aside funds for reserves, nor as to the timing of any such distribution, if any. We expect to continue to fund our operations primarily through utilization of our current financial resources, future product sales, the issuance of debt or equity, as well as through potential strategic alternative transactions. We believe our cash on hand at December 31, 2023 and the proceeds received in our February 2024 transaction will fund our projected operations through Q2 2024.
| 60 |
于2023年11月28日(“修订生效日期”),吾等与Kreos签订了2021年贷款协议的第一修正案(“第一修正案”) ,其中规定:
| ● | 于修订生效日期,吾等向Kreos支付750,000美元现金,以抵销长期债务项下的未偿还债务 。 | |
| ● | 于 完成第一修正案集资(定义见下文)及紧随可转换票据证券交易所 (定义如下)(其中第一修正案集资于2023年12月进行)后,吾等向Kreos支付150万美元现金,该现金将用于抵销 长期债务项下的未偿还责任。 | |
| ● | 在完成第一修正案资本筹集后,我们将对期限为6个月的长期债务进行仅利息支付,并对剩余12个月的本金和利息进行支付,直到长期债务得到全额偿还。 | |
| ● | 主题 完成根据经修订的1933年证券法(“证券法”)登记的股权融资,以及 不迟于2023年12月29日完成,总收益至少为500万美元("第一修正案资本 募集"),Kreos交出了相当于未偿还资产400万美元(“转换金额”)的证券 我们交付给Kreos的可换股票据本金总额,以换取可换股贷款 证券,指下文所述之证券(“可换股票据证券交易所”)。 |
我们 决定,第一修正案应作为一项修订入账,因为现金流量的变动未被确定为重大变动。此外,我们 评估了增加可换股票据证券交换功能作为股份结算赎回条款,并确定 其不需要作为单独衍生负债进行拆分。因此,我们在未来的基础上对第一修正案进行了核算,并将支付给Kreos的与第一修正案有关的费用资本化了30万美元。此外,我们确认了 债务清偿损失2.2万美元,反映了根据第一修正案要求的 部分偿还 部分债务时按比例减记未摊销债务发行成本。
| 61 |
2023年12月18日,我们签订了证券购买协议( “购买协议”),根据该协议,我们同意以公开发售的方式发行和出售(i)520,000股股份(“股份”)我们的普通股,每股面值0.0001美元,("普通股"),(ii)2,813,334份预供资认股权证(“预配资认股权证”)可行使合共2,813,334股普通股, (iii)3,333,334股A系列普通认股权证(「A系列普通认股权证」)可行使合共3,333,334股普通股股票 ,及(iv)3,333,334股B系列普通认股权证(“B系列普通认股权证”,连同A系列普通认股权证,统称“普通认股权证”)可行使合共3,333,334股普通股。股份(或 已出售的预出资认股权证代替其出售)及随附普通认股权证的合并购买价为每 股份1.50美元(或每份预出资认股权证1.4999美元),以及随附的系列A普通认股权证购买一股普通股,以及系列B 普通认股权证购买一股普通股。发售于2023年12月21日结束。股份及认股权证乃根据日期为2023年12月18日的招股章程提呈 及出售。该交易被视为第一修正案的资本筹集。
On December 21, 2023, immediately following the closing of the Offering, and pursuant to the terms of the First Amendment, the $4 million outstanding principal amount of the Convertible Note was automatically exchanged into (i) 54,461 shares of Common Stock (the “Private Shares”), (ii) pre-funded warrants (the “Private Pre-Funded Warrants”) exercisable for an aggregate of up to 2,612,205 shares of Common Stock, (iii) Series A common warrants (the “Series A Private Warrants”) exercisable for an aggregate of up to 2,666,666 shares of Common Stock and (iv) Series B common warrants (the “Series B Private Warrants,” together with the Series A Private Warrants and Private Pre-Funded Warrants, the “Private Warrants”) exercisable for an aggregate of up to 2,666,666 shares of Common Stock (the shares issuable upon exercise of the Private Warrants, the “Private Warrant Shares”). The Series A Private Warrants and the Series B Private Warrants are each exercisable for one share of Common Stock at an exercise price of $1.50 per share and will expire on the fifth year anniversary and the eighteen months anniversary from the date of issuance, respectively. The Series B Private Warrants will not be exercisable until shareholder approval is obtained. In addition, upon a fundamental transaction, the holder of the Series A Private Warrants and Series B Private Warrants shall have the right to receive payment in cash, or under certain circumstances in other consideration, from the Company at the Black Scholes value, as described in such warrants. The Private Pre-Funded Warrants are each exercisable for one share of Common Stock at an exercise price of $0.0001 per share and will expire when exercised in full.
2024年2月26日,我们完成了一项最终协议 ,立即行使由一名机构投资者持有的尚未行使的B系列普通股购买权证,以购买总计 2,933,334股普通股,所得款项总额约为270万美元。
作为本次交易的一部分,投资者同意 行使现有的B系列普通股购买权证,该权证最初于2023年12月发行,行使价为 每股1.50美元,修订后的行使价为每股0.925美元。作为立即行使现有认股权证 以换取现金,我们同意向投资者发行两份新的未注册认股权证,每份认股权证分别以每股0.74美元的行使价购买2,200,000股和2,200,001股普通股(或总计4,400,001股)。新认股权证可在发行后立即行使 。这些认股权证是相同的,但首2,200,000份认股权证的有效期为自发行日期起计五年 ,第二2,200,001份认股权证的有效期为自发行日期起计十八个月。
关于此次发行,吾等亦同意修订同一机构投资者于2023年12月发行的2,933,334份A系列普通股认购权证的条款 ,以将其现有的行权价降至每股0.74美元,并将该机构投资者于2023年5月发行的276,134份认股权证的行权价降至0.74美元,自本次发行完成时起生效。这两份认股权证的到期日都将延长至2029年2月。此类 认股权证的所有其他条款保持不变。
于2023年5月17日,吾等与一名认可投资者订立证券购买协议,据此吾等同意发行及以私募方式出售合共(I)35,000股普通股、(Ii)认股权证购买最多241,134股普通股(“预筹资权证”)及(Iii)认股权证购买最多276,134股普通股(“普通股 认股权证”)。收购价格为每股普通股12.675美元,每股预付资金认股权证12.674美元,净收益约300万美元,包括发行成本50万美元,不包括认股权证发行成本20万美元。
| 62 |
2021年7月16日,我们与Kreos签订了 贷款协议。根据贷款协议,Kreos同意向吾等提供本金总额达1,200万美元的定期贷款,分三批发放:(A)于生效日期,本金总额为4,000,000美元的贷款(“可换股票据”,或“A批”),(B)于生效日,本金总额为5,000,000美元的贷款(“B批”),及(C)截至2021年12月31日的贷款,本金总额为3,000,000美元(“C批”)。贷款协议项下的未偿还借款以吾等几乎所有个人财产资产的优先抵押权益作抵押 ,包括吾等于其附属公司的重大知识产权及股权权益。 可换股票据及B部分于生效日期获得资金。截至2021年12月31日,我们提取了全部300万美元的C部分本金。
可转换票据需要 从2021年7月16日开始以7.75%的年利率支付48个月的利息,然后在2025年7月1日全额支付当时的未偿还本金余额。贷款协议包含允许Kreos在任何时候转换全部或任何部分可转换票据的未偿还本金余额的功能,据此,可转换票据的转换部分 将转换为我们普通股的该数量的股票,将以每股价格等于转换价格 的每股420美元的价格向Kreos发行。在转换可转换票据任何部分的未偿还本金余额后,未偿还的可转换票据的本金余额将继续按7.75%的年利率计息。
B部分贷款从2021年7月16日开始至2022年9月30日只需按月支付利息,此后每月支付33笔本金和利息,直至2025年6月1日。C部分贷款从提款之日起至2022年9月30日,每月只需支付利息,此后,应按月支付32笔本金和利息,直至2025年6月1日。截至2023年12月31日,B期贷款和C期贷款的未偿还本金余额合计为230万美元。
于完成可转换票据证券交易所后,贷款协议项下的未偿还本金余额为2.3美元。
于2021年3月,吾等与Oppenheimer& Co.Inc.(“Oppenheimer”)订立股权分配协议(“股权分配协议”),根据该协议,吾等可不时发售总价高达2,500万美元的普通股。在截至2023年12月31日的一年中,我们根据该协议出售了7942股普通股,扣除发行成本19,000美元后,净现金收益为102,000美元。
通胀上升、利率上升和金融市场波动可能会对我们订立、修改和谈判有关股权和债务融资计划的有利条款和条件的能力产生不利影响。 不确定的金融市场、供应链中的潜在中断以及不断变化的优先事项也可能影响我们达成关键协议的能力。这些中断可能会对我们未来的销售、运营结果、财务状况和流动性产生负面影响。
Our ability to continue as a going concern for the next twelve months from the issuance of our Annual Report on Form 10-K, depends on our ability to execute our business plan, increase revenue and reduce expenditures. As of December 31, 2023, we had cash and cash equivalents of $5.0 million and an accumulated deficit of $154.2 million. We also had $2.3 million of debt outstanding under or Loan Agreement. In February 2024, as described in more detail below, we completed a transaction for the immediate exercise of an outstanding Series B common stock purchase warrant held by an institutional investor to purchase an aggregate of 2,933,334 shares of common stock for gross proceeds to us of approximately $2.7 million Based on our current business plan, we believe our cash and cash equivalents as of December 31, 2023 and the proceeds received in the February 2024 transaction will be sufficient to meet our anticipated cash requirements into Q2 2024. We will need to raise significant additional capital to continue to fund operations. We may seek to sell common or preferred equity, convertible debt securities or seek other debt financing. In addition, we may seek to raise cash through collaborative agreements or from government grants, as well as evaluate other strategic alternative transactions. The sale of equity and convertible debt securities may result in dilution to our shareholders and certain of those securities may have rights senior to those of our common shares. If we raise additional funds through the issuance of preferred stock, convertible debt securities or other debt financing, these securities or other debt could contain covenants that would restrict our operations. Any other third-party funding arrangement could require us to relinquish valuable rights. The source, timing and availability of any future financing will depend principally upon market conditions, and, more specifically, on the progress of our product and clinical development programs as well as commercial activities. Funding may not be available when needed, at all, or on terms acceptable to us. Lack of necessary funds may require us, among other things, to delay, scale back or eliminate expenses including those associated with our planned product development, clinical trial and commercial efforts.
| 63 |
这些 因素对我们能否继续作为一家持续经营企业产生了巨大的怀疑。财务报表不包括可能因此不确定性结果而导致 的任何调整。有关更多信息,请参阅本年报其他部分的合并 财务报表附注2。
现金流
下表提供了有关我们在以下每个期间的现金流量的信息:
| 截至十二月三十一日止的年度, | ||||||||
| 2023 | 2022 | |||||||
| (单位:千) | ||||||||
| 用于经营活动的现金净额 | $ | (11,197 | ) | $ | (17,467 | ) | ||
| 用于投资活动的现金净额 | (104 | ) | (224 | ) | ||||
| 融资活动提供的现金净额 | 2,217 | 9,170 | ||||||
| 现金和现金等价物净减少 | $ | (9,084 | ) | $ | (8,521 | ) | ||
操作 活动
在 截至2023年12月31日的年度,经营活动使用了1120万美元的现金,原因是我们的净亏损1290万美元,被非现金 支出主要与基于股份的补偿费用50万美元、折旧和摊销50万美元、债务发行成本摊销 30万美元,债务清偿损失30万美元,存货减值50万美元,经营租赁使用权资产摊销20万美元,并被或然特许权使用费债务估计公允价值变动收益10万美元所抵消,净营运资本项目的变动主要与预付费用和其他流动 资产增加30万美元、经营租赁负债增加20万美元以及应付账款和应计 费用增加50万美元有关。
投资 活动
截至2023年12月31日止年度,投资活动使用的现金净额为10万美元,与购买固定资产有关。
为 活动提供资金
截至2023年12月31日止年度,融资活动提供的现金净额为220万美元,涉及根据市场发行登记发行发行普通股所得款项10万美元,公开发行普通股所得款项 500万美元,以及私募发行所得款项350万美元,被定期贷款还款500万元,债务发行成本20万元,股本融资费用130万元,抵销。
货架注册声明
2021年3月16日,我们提交了一份货架登记声明(档案编号:333—254343)与美国证券交易委员会( "2021年货架登记声明"),于2021年3月26日宣布生效,允许我们在2024年5月26日之前提供、发行和 销售,我们的普通股、 优先股、认股权证、债务证券、认购权和/或单位的任何组合的最高总发行价为1亿美元,同时或单独地在一个或 多个发行中。截至2023年12月31日,我们尚未根据2021年货架登记声明出售任何证券, 根据下文所述与奥本海默的市场发售计划除外。
2021年货架登记声明包括根据与奥本海默的股权分配协议 登记上市发售计划的招股说明书,根据该协议,我们可以不时发售和出售总发行价最高 2500万美元的普通股。截至2023年12月31日止年度,我们根据上述 股权分配协议出售约7,942股普通股,扣除发行成本19,000美元后,产生现金所得净额102,000美元。
我们的 发行证券的能力受市场条件和其他因素的影响,包括(就我们的债务证券而言)我们的信用 评级。根据货架登记声明进行的每次发行都需要提交招股说明书补充文件,以确定拟发行证券的金额 和条款。
| 64 |
合同义务和承诺
对于 经营租赁和其他承诺
有关 更多信息,请参阅本年度报告表格10—K第F—15页至 F—17页中包含的合并财务报表附注的附注7和附注9。
| 第 7A项。 | 关于市场风险的定量和定性披露 |
作为 一家规模较小的报告公司,我们不需要提供本项目所需的信息。
| 第 项8. | 财务 报表和补充数据 |
根据本项目8要求提交的合并财务报表见F-1至F-25页。
| 第 项9. | 会计人员在会计和财务披露方面的变化和分歧 |
没有。
| 第 9A项。 | 控制 和程序 |
对披露控制和程序进行评估
管理层在首席执行官、首席财务官和首席会计官的参与下,对截至2023年12月31日的披露控制和程序的有效性进行了评估。交易法下规则13a-15(E)和15d-15(E)中定义的术语“披露控制和程序”是指公司的控制和其他程序,旨在确保 公司根据交易法提交或提交的报告中要求披露的信息在美国证券交易委员会规则和表格指定的时间段内得到记录、处理、汇总和报告。披露控制和程序包括, 但不限于,旨在确保公司根据《交易法》提交或提交的报告中要求披露的信息被累积并传达给我们的管理层,包括我们的主要高管和主要财务官,以便及时做出关于要求披露的决定。管理层认识到, 任何控制和程序,无论设计和操作多么良好,都只能提供实现其目标的合理保证 ,管理人员必须在评估可能的控制和程序的成本-收益关系时应用其判断。我们的首席执行官、首席财务官和首席会计官得出结论,截至2023年12月31日,我们的披露控制程序 在合理的保证水平下有效。
管理层财务报告内部控制年度报告
管理层负责根据《交易法》第13a-15(F)和 15d-15(F)条的规定,建立和维护对财务报告的充分内部控制。在包括首席执行官、首席财务官和首席会计官在内的管理层的监督和参与下,我们根据特雷德韦委员会赞助组织委员会发布的《内部控制-综合框架(2013)框架》中确立的标准,对我们对财务报告的内部控制的有效性进行了评估。根据此次评估的结果,管理层得出结论,截至2023年12月31日,我们对财务报告的内部控制在合理的保证水平下是有效的。
由于其固有的局限性,财务报告的内部控制可能无法防止或发现错误陈述。此外,对未来期间进行任何有效性评估的预测可能会受到以下风险的影响:由于 条件的变化,控制可能会变得不充分,或者政策或程序的遵守程度可能会恶化。
本 年度报告不包括我们独立注册会计师事务所的证明报告,因为我们是一家"非加速 申报人",并且可能会利用适用于加速申报人的上市公司的各种报告要求的某些豁免, 这些要求包括但不限于,无需遵守《萨班斯—奥克斯利法案》第404(b)条的审计师认证要求。
财务报告内部控制变更
在截至2023年12月31日的财政季度内,我们对财务报告的内部控制(根据《交易法》第13a-15(F)和15d-15(F)规则的定义)没有 发生变化,这对我们对财务报告的内部控制 产生了重大影响,也有可能对其产生重大影响。
| 第 9B项。 | 其他 信息 |
董事和高级职员交易安排
我们的董事或高级职员
认股权证
在截至2023年12月31日的季度和 2024年2月,我们向一家投资银行发行认股权证,分别以1.875美元的行使价购买150,417股普通股和(ii)以每股1.1563美元的行使价购买146,667股普通股,可于发行时立即行使 ,自发行日期起为期五年。这些证券尚未根据 证券法进行注册,而是根据《证券法》第4(a)(2)节和 据此颁布的规则506(b)中规定的注册豁免进行发行。
| 第 9C项。 | 披露 关于禁止检查的外国司法管辖区。 |
不适用 。
| 65 |
第 第三部分
| 第 项10. | 董事、高管和公司治理 |
以下列出了有关我们的高级管理人员和董事的某些信息。
| 名字 | 年龄 | 职位 | ||
| 标记 彭慕兰 | 62 | 首席执行官兼董事 | ||
| 拉维特 RAM | 49 | 首席财务官 | ||
| Elad amor | 40 | 主管 会计官 | ||
| 蒂莫西 皮·莫伦 | 52 | 董事 | ||
| 斯科特 德宾 | 55 | 董事 | ||
| Gary J. Pruden | 62 | 董事 | ||
| 索尼娅 纳尔逊 | 50 | 董事 |
管理
Mark Pomeranz,首席执行官兼董事
Mr. Pomeranz has served as Chief Executive Officer since April 13, 2023 and a member of our board since 2014. Prior to his tenure as Chief Executive Officer, Mr. Pomeranz served as the Company’s Chief Operating Officer from September 2018 through April 2023. Mr. Pomeranz has also previously served as our Chief Executive Officer from December 2016 through September 2018, and as the Chief Executive Officer of Motus GI Medical Technologies Ltd., our wholly owned subsidiary, from 2014 through September 2018. Prior to joining Motus GI Medical Technologies Ltd., from 2008 to 2014, Mr. Pomeranz was the founding CEO of Svelte Medical Systems, a start-up company that is currently commercializing a unique drug eluting stent platform. From 2007 to 2008 Mr. Pomeranz was the Vice President of Research and Development at Prescient Medical, Inc. From 1998 to 2007, Mr. Pomeranz served as Vice President at Cordis, a Johnson& Johnson Company, where his responsibilities included developing new technologies, exploring new market opportunities and leading major restructuring efforts to create cross-functional global commercialization teams. Prior to that, Mr. Pomeranz held a number of senior leadership roles, including positions at Cardiac Pathways Corporations from 1991 to 1998, and Cardiovascular Imaging Systems from 1989 to 1991, both of which were acquired by Boston Scientific Corporation. Mr. Pomeranz earned a M.Sc. in biomedical engineering from the University of Miami. Mr. Pomeranz was selected as a director due to his history as a director of Motus GI Medical Technologies Ltd. And his business and leadership experience in the medical technology sector; his broad scientific background is also seen as an asset to us.
Ravit Ram,首席财务官
夫人 Ram自2023年6月起担任首席财务官。在担任我们的首席财务官之前,Ram女士于2018年4月至2023年5月担任我们的 总经理兼全球运营副总裁。在2018年4月加入Motus GI之前,Ram女士曾担任EndoChoice的财务总监、供应链总监和现场经理,管理EndoChoice以色列现场财务、供应链和IT部门。此前,她曾担任Given Imaging的全球运营总监,负责 公司全球运营和研发活动的所有财务方面。拉姆太太获得了文学学士学位在"巴宜兰"大学获得金融和社会学硕士学位。在海法大学精算师。
Elad Amor,首席会计官
先生 Amor自2023年6月起担任首席会计官。在担任首席会计官之前,Amor先生自2019年以来一直担任 公司的企业财务和会计全球总监,负责监督公司 全球会计职能的所有方面,以及内部和外部财务报告的编制。在2019年加入本公司之前,Amor先生曾担任Kaleido Biosciences会计和SEC报告副总监。2016年至2019年,他 在CRISPR Therapeutics AG担任SEC报告和技术会计经理,负责准备 并监督所有公开文件的准备工作。Amor先生是一名注册会计师,并获得东北大学会计学硕士学位和工商管理硕士学位,以及威斯康星医学院医学流行病学硕士学位和威斯康星大学遗传学学士学位。
| 66 |
董事
Mark Pomeranz,总裁、首席执行官兼董事
请参见 管理下的说明。
Timothy P. Moran,董事会主席
Mr. Moran served as Chief Executive Officer from October 1, 2018 to April 13, 2023. Prior to joining us, from 2015 to September 2018, Mr. Moran served as President of the Americas, ConvaTec Group Plc (LON: CTEC) (“ConvaTec”), an international medical products and technologies company, offering products and services in the areas of wound and skin care, ostomy care, continence and critical care and infusion devices. Prior to his employment at ConvaTec, Mr. Moran held roles in sales, marketing and general management over the course of eighteen years at Covidien plc (“Covidien”), an Irish-headquartered global health care products company and manufacturer of medical devices and supplies. While at Covidien, until 2015, Mr. Moran served simultaneously as VP and General Manager of both the SharpSafety and Monitoring & Operating Room divisions. Following the 2015 acquisition of Covidien by Medtronic (NYSE:MDT), Mr. Moran was named the Global Vice President and General Manager of the Patient Care and Safety Division. Mr. Moran also served on the CEO Advisory Council for Advanced Medical Technology Association (AdvaMed), a medical device trade association. Mr. Moran earned a B.A. in Organizational Communication at The State University of New York at Geneseo. Mr. Moran was selected as a director because of his broad commercial experience and leadership in the medical technology sector.
Scott Durbin,总监
Mr. Durbin has served on our board of directors since September 2023. Currently, Mr. Durbin is CEO and Director of illumiSonics Inc., developer of the PARS platform, a revolutionary, non-contact, high-resolution, label-free, non-destructive optical imaging system based on new physics. Prior to illumiSonics, Mr. Durbin held executive roles at Viveve from May 2012 to March 2023, including as the Chief Executive Officer and Chief Financial Officer, as well as serving on the Board of Directors. Prior to his time at Viveve, he was Chief Financial Officer at Vericel, formerly Aastrom Biosciences (ASTM). Prior to joining Vericel, Mr. Durbin was Chief Financial Officer, Chief Operating Officer and Secretary of Board at Prescient Medical. Prior to Prescient Medical, Mr. Durbin was with the Investment Banking team, Healthcare and Merger & Acquisition, at Lehman Brothers. Mr. Durbin began his career as a Director of Neurophysiology at Biotronic. He holds a Master’s degree in Health Management w/ honors from Yale University. He received his Bachelor’s of Science / Pre-med from the University of Michigan. Mr. Durbin was selected as a director because he has decades of experience as an executive at start-ups and multi-national life sciences companies. During this time, he established strong industry knowledge across the life sciences industry, including substantial therapeutic clinical development and global commercialization experience.
Gary J. Pruden,导演
Mr. Pruden has served on our board of directors since December 2017. Prior to joining us, from 1985 until 2017, Mr. Pruden held a number of senior commercial leadership positions across both the medical devices and pharmaceutical sectors of Johnson & Johnson (NYSE: JNJ). In April 2004, he became President of the Johnson & Johnson subsidiary, Janssen-Ortho Inc. in Canada. In January 2006, Mr. Pruden was appointed Worldwide President of Ethicon, Inc., a Johnson & Johnson subsidiary, and in 2009 became the Company Group Chairman of Ethicon, Inc. In 2012, he was named Worldwide Chairman of Johnson & Johnson’s Global Surgery Group and in 2015 he became Worldwide Chairman in the Medical Devices division. In April 2016, Mr. Pruden became a member of the Executive Committee at Johnson & Johnson where his official title was Executive Vice President, Worldwide Chairman, Medical Devices. Mr. Pruden also served in several capacities with the Advanced Medical Technology Association (AdvaMed), a medical device trade association, where he participated in negotiations with the FDA. While at AdvaMed Mr. Pruden served as a member of the Board of Directors, as Chair of the AdvaMed Regulatory Committee, and as a member of the AdvaMed Executive Committee. Mr Pruden serves as an independent board member for Olympus Corporation, (OTCMKTS: OCPNY) (and serves as a member of its compensation committee), Lantheus Holdings, Inc. (NASDAQ: LNTH) (and serves as a member of its audit committee and the chair of its compensation committee), OSSIO Inc, and Avisi Technologies Inc. Mr. Pruden received his B.S. degree in finance at Rider University, where he later served on the Board of Trustees from 2011 until 2015. Mr. Pruden was selected as a director due to his global management and regulatory experience with medical device and pharmaceutical products and his financial experience in leading a large business.
| 67 |
Sonja Nelson,主管
Ms. Nelson has served on our board of directors since June 2021. In June 2021, Ms. Nelson began serving as the Chief Financial Officer of Ambrx Biopharma, Inc, (NASDAQ: AMAM ) and from October 2022 through April 2023, as the company’s Chief Financial and Operating Officer. Prior to that, Ms. Nelson, served as the Senior Vice President, Finance, of ImmunityBio, Inc. (NASDAQ: IBRX), from March 2021 to June 2021. Ms. Nelson served as the Chief Financial Officer of NantKwest, Inc. from June 2018 to March 2021, at which time NantKwest, Inc. merged with ImmunityBio, Inc. (NASDAQ: IBRX). Ms. Nelson previously served as the Chief Accounting Officer of NantKwest, Inc. from May 2016 to June 2018 and as the VP/Corporate Controller of NantKwest, Inc. from November 2015 to May 2016. Ms. Nelson also served as a director of Inex Bio (a subsidiary of NantKwest, Inc., now merged with ImmunityBio, Inc. (NASDAQ: IBRX)) from October 2017 to June 2021. Prior to joining NantKwest, Inc., Ms. Nelson was Vice President and Corporate Controller at AltheaDx, Inc. from July 2014 through October 2015. Previously, Ms. Nelson was Senior Director and Controller at Cadence Pharmaceuticals, Inc. (acquired by Mallinckrodt plc) from May 2012 through June 2014. Prior to that, Ms. Nelson was Director, General Accounting at Cricket Communications, Inc. (acquired by AT&T, Inc.) from September 2008 through May 2012. Ms. Nelson began her career with KPMG LLP, holds a Bachelor’s degree in business administration with specialization in taxation and auditing from the University of Applied Sciences in Pforzheim, Germany, and is a Certified Public Accountant. Ms. Nelson was selected as a director due to her management experience with pharmaceutical and consumer health products, and her financial and accounting experience.
家庭关系
我们的董事会成员或执行官之间没有家庭关系。
商业行为和道德准则
我们 已采纳了适用于员工、管理人员和董事的书面商业行为和道德准则。我们的 代码的最新副本张贴在我们网站的公司治理部分,该部分位于www.motusgi.com。我们打算在上述网站或提交给SEC的文件中披露未来对我们商业行为和道德准则某些条款的 修订,或对适用于任何主要 执行官、主要财务官、主要会计官或控制人或履行类似职能的人员 和我们的董事的此类条款的豁免。
董事会委员会
我们的 董事会已经成立了审计委员会、薪酬委员会以及提名和公司治理委员会。 我们的董事会可能会设立其他委员会,以促进我们的业务管理。 每个委员会的组成和职能如下所述。成员在这些委员会任职,直至辞职或董事会 另行决定。每个委员会都根据我们的董事会批准的章程运作,该章程可在我们的网站上获得 。
审计 委员会我们的审计委员会由Nelson女士、Pruden先生和Durbin先生组成,Nelson女士担任审计委员会主席。我们的董事会已确定,目前在我们审计委员会任职的三名董事是独立的 ,这符合纳斯达克市场规则和交易法第10A—3条的定义。此外,我们的董事会已确定 Nelson女士符合SEC法规和纳斯达克市场规则所指的审计委员会财务专家的资格。
审核委员会监督和监控我们的财务报告流程和内部控制系统,审阅和评估我们的注册独立公共会计师执行的审计 ,并向董事会报告审计过程中发现的任何实质性问题。 审计委员会直接负责我们注册独立会计师的任命、薪酬和监督工作。审核委员会审阅及批准所有与关联方的交易。
薪酬 委员会。我们的薪酬委员会由Nelson女士、Pruden先生和Durbin先生组成,Durbin先生担任薪酬委员会主席 。我们的董事会已经确定,目前在我们薪酬委员会任职的三名董事 根据上市标准是独立的,是 交易法颁布的规则16b—3中定义的"非雇员董事",以及根据1986年《国内税收法》(经修订)第162(m)节定义的"外部董事"。
| 68 |
薪酬委员会就员工薪酬、福利 计划和董事薪酬等方面向董事会提供咨询意见和建议。薪酬委员会还审查和批准与 总裁、首席执行官和其他管理人员薪酬相关的公司目标和目标,并就此向整个董事会 提出建议。
提名 和公司治理委员会。我们的提名及企业管治委员会由Nelson女士、Pruden先生及Druden先生组成。 Durbin,Pruden先生担任提名和公司治理委员会主席。提名和公司治理 委员会提名由股东选举进入董事会的个人。提名和公司治理 委员会将根据 公司章程中规定的程序及时提交股东的建议,并将对所有被考虑的人员适用相同的标准。提名和公司治理委员会 的所有成员均为纳斯达克上市标准定义的独立董事。
第16节报告
《交易法》第16(a)条要求 我们的董事、执行官和实益拥有我们10%以上股本的人员,以表 3、4和5向SEC提交关于他们对我们股本的所有权和交易的报告。
据我们所知,仅根据我们对提供给我们的此类报告副本的审查 以及报告人的陈述,所有这些报告均于截至2023年12月31日止年度及时提交。
| 第 项11. | 高管薪酬 |
汇总表 薪酬表
下表显示了截至2023年12月31日止财政年度,我们的首席执行官判给或赚取的薪酬,以及截至2023年12月31日担任执行官的另外两名薪酬最高的执行官,以及 最多两个额外的个人,如果不是因为该个人没有担任 ,截至2023年12月31日的执行官。下表所列人员在此称为"指定执行官员"。
| 名称和主要职位 | 年 | 薪金(元) | 奖金 ($) | 库存 奖项 ($) (2) | 选择权 奖项 ($) (1) | 所有其他 补偿 ($) | 总计 ($) | ||||||||||||||||||||
| 马克·波梅兰茨 | 2023 | 428,333 | 256,500 | - | 79,254 | 192,266 | (4) | 956,353 | |||||||||||||||||||
| 首席执行官 | 2022 | 385,000 | - | (7) | 43,102 | 43,092 | 44,311 | (3) | 515,505 | ||||||||||||||||||
| 拉维特·拉姆 | 2023 | 197,425 | 66,916 | - | 47,551 | 107,244 | (5) | 419,136 | |||||||||||||||||||
| 首席财务官 | 2022 | 214,710 | - | (7) | - | 45,985 | 74,908 | (3) | 335,603 | ||||||||||||||||||
| 埃拉德·阿莫尔 | 2023 | 200,000 | 47,500 | - | 28,529 | 102,369 | (6) | 378,398 | |||||||||||||||||||
| 首席会计官 | 2022 | 197,500 | - | (7) | - | 17,629 | 45,144 | (3) | 260,273 | ||||||||||||||||||
| (1) | 金额 反映了2023年和2022年根据会计准则编码主题718授予的期权奖励的授予日期公允价值。有关股权奖励估值所依据的假设的信息,请参阅我们的综合财务报表附注11和本报告中“第二部分--第7项--管理层对财务状况和经营成果的讨论和分析”下的讨论。如果行使股票期权,这些金额与被任命的高管可能收到的实际价值不符。 |
| (2) | 金额 反映根据会计准则汇编主题718计算的2023年和2022年授予股票奖励的授予日期公允价值。有关股权奖励估值所依据的假设的信息,请参阅我们的综合财务报表的附注11。 |
| (3) | 金额 涉及公司福利和健康福利以及退休福利。 |
| (4) | 这一数额反映了100,000美元的一次性留存、51,825美元的应计假期支出以及40,441美元的健康福利和退休福利。 |
| (5) | 这一数额反映了一次性保留40,387美元,应计假期支出7,636美元,以及健康福利和退休福利 40,59,221美元。 |
| (6) | 包括一次性留存30,000美元、累计假期支出21,537美元以及健康福利和退休福利50,832美元。 |
| (7) | 2022年的奖金支付被取消。 |
| 69 |
Narrative 薪酬汇总表披露
与我们指定的高管签订雇佣协议
2018年9月24日,我们与Mark Pmeranz签订了修订并重述的雇佣协议,它规定在自愿的基础上雇用,并包含保密和发明转让条款。根据修订和重述的雇佣协议条款,波美兰兹先生担任总裁兼首席运营官,并于2023年4月13日被任命为首席执行官。他每年的基本工资为385,000美元(“波美兰兹基本工资”)。此外,波美兰兹先生有资格获得(I)截至2018年12月31日的日历年度的奖金,金额为其当时基本工资的31.25%(31.25%)(2018年奖金目标),如果董事会确定他达到了传达给他的目标,2018年奖金的支付范围为2018年奖金目标的50%(50%)至200%(200%)。以及(Ii)自2019年1月1日起生效,此后,如果我们的董事会确定他实现了传达给他的目标,我们将向他支付高达波美兰兹基本工资的50%(50%)的年度奖金(“波美兰兹绩效奖金”)。波美兰兹绩效奖金的支付参数将由我们的董事会根据我们的董事会和首席执行官使用市场数据和第三方专家薪酬公司的分析输入为整个高管奖金计划设置的参数来确定。2017年5月,根据他最初的雇佣协议,波美兰兹先生收到了根据我们的股权激励计划以每股100.00美元的行使价购买最多25,555股普通股的期权,其中53%(53%)在发行时完全归属,40%(40%)在我们董事会的薪酬委员会确定的三(3) 年内完成连续十二(12)个连续相等的季度分期付款后,在三(3) 年内计算,而七个 %(7%)要到2019年12月22日才能完全归属。该期权于2017年9月重新定价为每股90.00美元。 根据修订和重述的雇佣协议条款,波美兰兹先生还有资格根据我们现有的股权激励计划或我们未来可能采用的任何其他股权激励计划不时获得股权奖励,并且此类奖励的条款和条件(如果有)将由我们的董事会或薪酬委员会自行决定。 波美兰兹先生还有资格参与我们采用的任何高管福利计划或计划。
如果波美兰兹先生因任何原因被解雇,或如果波美兰兹先生自愿离职,波美兰兹先生有权:(I)通过 支付其未支付的工资(包括解雇之日);(Ii)任何既得金额或福利;以及(Iii)报销业务费用。如果波美兰兹先生死亡、因残而被解雇、无故被解雇,或如果波美兰兹先生因正当理由而被解雇,波美兰兹先生将有权:(I)截至解雇之日(包括解雇之日)的未付工资;(Ii)任何既得金额或福利;(Iii)业务费用的报销;(Iv)作为遣散费支付12个月的基本工资;(V)支付公司支付的12个月眼镜蛇保险费用部分;(Vi)任何已赚取但未获支付的2018年红利或波美兰兹绩效红利,而该红利与终止发生的历年前一个历年 年有关;及(Vii)除控制权变更后十二个月内终止外,任何未授期权的25%将于终止时归属,或如波美兰兹先生于控制权变更后十二个月 内终止,则所有未行使购股权将加速归属。2023年5月,波梅兰兹的基本工资增至每年45万美元,绩效奖金增至基本工资的60%,即27万美元。
根据拉姆女士的雇佣协议(“拉姆雇佣协议”),拉姆女士有权获得以下补偿:(1)每月16,500美元的基本工资,其中包括根据以色列法律分配的加班费;(2)有资格获得相当于拉姆女士49,200美元基本工资的25%的绩效奖金;(3)只要拉姆女士继续受雇于公司,公司和拉姆女士就应为拉姆女士的利益维持一项进修基金。本公司将出资相当于Ram女士年薪的7.5%,而Ram女士将出资相当于其工资的2.5%,(Iv)购买最多2,500股本公司普通股的期权,(V)移动电话和(Vi)一辆公司汽车。2023年8月,拉姆的绩效奖金增至基本工资的35%,为69,300美元。
根据Amor先生的雇佣协议(“Amor雇佣协议”),Amor先生有权获得以下补偿:(I)200,000美元的年度基本工资,(Ii)有资格获得相当于Amor先生基本工资的15%或30,000美元的绩效奖金,以及(Iii)购买最多2,500股公司普通股的选择权。2023年8月,阿莫尔的绩效奖金增至基本工资的25%,即5万美元。
与我们的全资子公司Motus GI Medical Technologies Ltd.的以色列员工签订的 雇佣协议包含了我们行业中一家公司关于竞业禁止、信息保密和发明转让的标准条款。不在以色列进行竞争的契约的可执行性受到限制。例如,以色列法院要求试图强制执行一名前雇员的竞业禁止承诺的雇主必须证明,该前雇员的竞争性活动将损害该雇主已得到法院承认的有限数量的物质利益之一,如保密一家公司的机密商业信息或其知识产权。
| 70 |
未偿还的 2023财年年终表格中的股权奖励
下表汇总了每位被任命的高管截至2023年12月31日持有的普通股标的已发行股票期权的股份数量。
| 期权大奖 | 股票大奖 | |||||||||||||||||||
| 未行使期权标的证券数量 | 期权行权 | 期权到期 | 没有任何股份或股票单位的数量 | 不具备的股份或单位的市值 | ||||||||||||||||
| 名字 | 可操练 | 不能行使 | 价格(美元) | 日期 | 既得 | 既得利益(美元) | ||||||||||||||
| Ravit Ram(CFO) | 166 | - | $ | 1,308 | (1) | 2028年5月10日 | ||||||||||||||
| 142 | - | $ | 1,296 | (2) | 2029年2月13日 | |||||||||||||||
| 172 | - | $ | 648 | (3) | 2030年2月6日 | |||||||||||||||
| 166 | - | $ | 351 | (4) | 2030年6月11日 | |||||||||||||||
| 150 | - | $ | 222 | (5) | 2030年11月11日 | |||||||||||||||
| 212 | 21 | $ | 534 | (8) | 2031年2月17日 | |||||||||||||||
| 252 | 181 | 138 | (10) | 2032年2月10日 | ||||||||||||||||
| 569 | 6,263 | $ | 9 | (11) | 2033年8月5日 | |||||||||||||||
| Mark Pomeranz(CEO) | 223 | - | $ | 714 | (6) | 2024年4月2日 | 150(9) | $ | 191.25 | |||||||||||
| 1,703 | - | $ | 1,350 | (7) | 2027年5月3日 | |||||||||||||||
| 428 | - | $ | 1,296 | (2) | 2029年2月13日 | |||||||||||||||
| 134 | - | $ | 648 | (3) | 2030年2月6日 | |||||||||||||||
| 266 | - | $ | 351 | (4) | 2030年6月11日 | |||||||||||||||
| 250 | - | $ | 222 | (5) | 2030年11月11日 | |||||||||||||||
| 198 | 18 | $ | 534 | (8) | 2031年2月17日 | |||||||||||||||
| 184 | 132 | $ | 138 | (10) | 2032年2月10日 | |||||||||||||||
| 948 | 10,349 | $ | 9 | (11) | 2033年8月5日 | |||||||||||||||
| Elad Amor(CAO) | 166 | - | $ | 648 | (3) | 2030年2月6日 | - | |||||||||||||
| 66 | - | $ | 351 | (4) | 2030年6月11日 | |||||||||||||||
| 66 | - | $ | 222 | (5) | 2030年11月11日 | |||||||||||||||
| 103 | 10 | $ | 534 | (8) | 2031年2月17日 | |||||||||||||||
| 96 | 70 | $ | 138 | (10) | 2032年2月10日 | |||||||||||||||
| 341 | 3,758 | 9 | (11) | 2033年8月5日 | ||||||||||||||||
| 71 |
| (1) | 代表 2018年5月10日授予的购买我们普通股股份的期权,行使价为每股1,308.00美元。股票 自2018年4月1日开始,并继续以连续十二(12)个季度分期付款的方式归属期权。 第三个月的第一天。 |
| (2) | 代表 2019年2月13日授予的购买我们普通股股份的期权,行使价为每股1,296.00美元。股票 自2019年5月1日开始,并持续至12个连续的季度分期付款,以连续12个(12)个季度分期付款方式归属。 第三个月的第一天。 |
| (3) | 代表 2020年2月6日授予的购买我们普通股股份的期权,行使价为每股648美元。股票 自2020年5月1日开始,并持续至12个连续的季度分期付款,以连续12个(12)个季度分期付款方式归属。 第三个月的第一天。 |
| (4) | 代表 2020年6月11日授予的购买我们普通股股份的期权,行使价为每股351美元。相关股份 购股权于授出日期起计一周年归属。 |
| (5) | 代表 2020年11月11日授予的购买我们普通股股份的期权,行使价为每股222美元。股票 购股权的相关权益于授出日期起计一周年归属。 |
| (6) | 代表 2014年4月2日根据Motus GI Medical Technologies LTD员工股份授予的购买我们普通股股份的期权 2016年股权激励计划( “2016年计划”),并根据其条款继续有效,并按调整基准反映联交所 交易日61%的购股权已于2017年12月31日归属,其余39%的购股权将于11月全部归属 2018. |
| (7) | 代表 2017年5月4日授予的购买我们普通股股份的期权,行使价为每股1500.00美元。五十三 百分之五十(53%)的期权在授予后立即归属,百分之四十(40%)的期权在连续12(12)个 从2017年5月4日开始的季度分期付款,此后每三个月的第一天继续,其余 7%(7%)的期权于2019年12月22日到期。该购股权于二零一七年九月重新定价至每股1,350. 00元。 |
| (8) | 代表 2021年2月17日授予的购买我们普通股股份的期权,行使价为每股534美元。股票 自2021年2月1日起,期权以连续十二(12)个季度分期付款的方式归属, 在其后每三个月的第一天继续。 |
| (9) | 代表 于二零一九年二月十三日、二零二零年二月六日及二零二一年二月十七日授出的受限制股份单位。2月13日授予的受限制股份单位的相关股份, 自2019年5月1日开始,2019年5月1日开始,第一个 第三个月的一天。于2020年2月6日授出的受限制股份单位相关的股份以连续十二(12)次归属 从2020年5月1日开始,并在其后每三个月的第一天继续。股票 于2021年2月17日授出的受限制股份单位的相关归属,自 2021年5月1日,并于其后每三个月的第一天继续。 |
| (10) | 代表 2022年2月10日授予的购买我们普通股股份的期权,行使价为每股138美元。股票 自2022年5月1日开始,并继续以连续十二(12)个季度分期付款的方式归属期权。 第三个月的第一天。 |
| (11) | 代表 2023年8月5日授予的购买我们普通股股份的期权,行使价为每股9美元。相关股份 该期权从2023年11月1日开始,分12个连续的季度分期付款方式归属,并持续 第三个月的第一天。 |
董事 薪酬
下表载列了有关2023年支付予我们若干非雇员董事的补偿的资料。
| 名字 | 赚取的费用或 以现金支付 ($) | 期权大奖 ($) (1) | 总计 ($) | |||||||||
| (1)(2) | 17,417 | 963 | 18,380 | |||||||||
| 加里·普鲁登 | 52,250 | - | 52,250 | |||||||||
| 索尼娅·纳尔逊 | 53,900 | - | 53,900 | |||||||||
| 蒂莫西·P·莫兰 | 40,800 | - | 40,800 | |||||||||
| 72 |
| (1) | 金额 反映2023年授出的每份股票期权的授出日公允价值的合计(根据会计准则法典) 718.有关股权奖励估值所依据的假设的信息,请参见我们的合并财务报表附注11 "第二部分—项目7—管理层对财务状况的讨论和分析"下的说明和讨论 《行动的结果》包括在本报告中。这些金额与可能收到的实际价值不符 如购股权获行使,则董事会应作出决定。 |
| (2) | T他 截至2023年12月31日,Durbin先生持有的普通股相关股票期权总数为166股。 |
非员工 董事薪酬
我们的 董事会批准了董事薪酬政策,于2022年1月1日生效。本政策规定 以下现金补偿:
| ● | 每位董事都有权 每季度收取7,150元的费用; | |
| ● | 我们的董事会主席 每季度可获发6,450元酬金; | |
| ● | 审计委员会主席 委员会将收到季度费用2 750美元; | |
| ● | 任何其他椅子 董事会委员会每季度可收取1,650元的费用, | |
| ● | 每个非员工董事 担任超过两个董事局委员会成员的人士,可获额外收取825元的季度酬金; | |
| ● | 审计委员会、薪酬委员会和提名和公司治理 委员会的每位非主席成员将分别获得2,062美元、1,375美元和1,375美元的年费。 |
每名 非雇员董事也有资格获得年度期权授予,金额将由我们的薪酬委员会每年与独立薪酬顾问协商确定,以购买我们现有的股权激励计划 或我们未来可能采用的任何其他股权激励计划下的普通股股份,该计划将分两个相等的年度分期归属,自 授出日期的第一周年开始,至授出日期的第二周年结束。
收回错误补偿的措施 补偿
在上一个完成的财政年度期间或之后,我们没有编制 要求根据公司的补偿金追回政策追回错误判给的补偿金的会计报表,而且截至上一个完成的财政年度末,也没有从将政策应用到先前的重述中追回错误判给的补偿金的未偿余额。
| 第12项。 | 某些受益所有者和管理层的担保所有权及相关股东事项 |
根据股权补偿计划授权发行的证券
2016股权激励计划
一般信息
2016年12月14日,我们的董事会采纳了Motus GI Holdings,Inc.。Motus GI Holdings,Inc.的2016年股权激励计划和2016年以色列子计划2016年股权激励计划(“2016年计划”),须经股东批准, 于2016年12月20日收到。
| 73 |
2016年计划的总体目的是提供一种方式,使符合条件的员工、高级管理人员、非员工董事和其他个人 服务提供商能够培养所有权意识和个人参与我们的发展和财务成功,并鼓励 他们尽最大努力为我们的业务,从而促进我们和股东的利益。通过 2016年计划,我们寻求保留此类合格人员的服务,并为此类人员提供激励,以尽最大努力 为我们和我们子公司的成功。
下表提供了截至2023年12月31日授权股权补偿的有关我们的补偿计划的信息:
证券数量 和权利 |
加权—未行使期权的平均行使价 和权利 |
数量 根据股权补偿计划可供今后发行的证券(不包括a栏所列证券) | ||||||||||
| 计划类别 | (a) | (b) | (c)(4) | |||||||||
| 已批准股权薪酬计划 证券持有人(1) | 60,602 | (2) | $ | 171.23 | (3) | 6,082 | ||||||
| 股权补偿计划 未经证券持有人批准 | - | $ | - | - | ||||||||
| 总计 | 60,602 | $ | 171.23 | 6,082 | ||||||||
| (1) | 本行所示金额包括2016年计划下的证券。 |
| (2) | 包括 行使未行使期权时可发行的60,170股普通股和根据未行使期权可发行的432股普通股 限制性股票单位 |
| (3) | 加权平均行使价不考虑根据未发行限制性股票单位可发行的股份, 没有行使价格。 |
| (4) | 在 根据我们2016年计划中的"常青"条款,自动提供额外92,823股股票 于2024年第一天发行,占2023年12月31日已发行股份数量的6%;这些股份 被排除在这个计算之外。 |
安全 某些受益所有者和管理层的所有权
下表列出了截至本报告日期我们普通股实益所有权的信息:
| ● | 我们的每个股东 我们所知道的受益人拥有我们5%或以上的普通股; | |
| ● | 我们任命的每一位主管人员; | |
| ● | 我们每一位董事; 和 | |
| ● | 我们所有的董事和 现任官员作为一个小组。 |
| 74 |
受益的 所有权是根据美国证券交易委员会的规章制度确定的。如果个人 有权投票和/或处置股份,则该人拥有股份的实益所有权。这种权力可以是单独的或共享的,也可以是直接的或间接的。在计算一个人实益拥有的股份数量和该人的所有权百分比时,受该人持有的可在2024年2月14日或之后60天内行使的期权或认股权证约束的普通股股票被算作已发行股票。然而,在计算任何其他人(S)的持股百分比时,这些股份不被算作已发行股份。除表内附注另有注明外,吾等相信表内列名的每名人士或实体对该人士或实体实益拥有的所有本公司普通股股份(或与其配偶分享该等权力)拥有独家投票权及投资权。除非下面说明,否则下面列出的每个人的地址是C/o Motus GI Holdings,Inc.,1301 East Broward Boulevard,Ft.佛罗里达州劳德代尔,邮编33301。
下表所列每个个人或实体实益拥有的普通股百分比是根据截至2024年2月6日已发行及已发行的普通股4,078,042股,加上该个人或实体于2024年2月6日或之后60天内可行使的认股权或认股权证而发行的任何股份。
受益的 低于1%的所有权用星号(*)表示。
| 受益人姓名 | 金额和 性质 实益所有权 |
百分比 班级 |
||||||
| 高级职员和董事 | ||||||||
| 马克·波美兰兹(1) | 6,085 | * | % | |||||
| Ravit Ram(2) | 2,455 | * | ||||||
| 埃拉德·阿莫尔(3) | 1,204 | * | ||||||
| 蒂莫西·P·莫兰(4) | 5,892 | * | ||||||
| 斯科特·德宾(5) | - | * | ||||||
| 索尼娅·纳尔逊(6) | 666 | * | ||||||
| 加里·普鲁登(7) | 1,432 | * | ||||||
| 全体董事和高级职员(7人) | 24,063 | 1.6 | % | |||||
| 5%的股东 | ||||||||
| 停战资本 | 226,000 | 5.54 | % | |||||
| 1. | 包括 在2月6日起六十天内行使的股票期权行使时,可发行5,326股普通股, 2024.不包括在行使不可在 内行使的股票期权时可发行的9,597股普通股 2024年2月6日的60天。包括根据已授予的限制性股票单位奖励获得的702股普通股 2024年2月6日,或将在2024年2月6日起60天内归属。不包括我们的106股股票 于2024年2月6日起计六十日内不会归属的受限制股票单位归属时可发行的股票。 |
| 2. | 包括 2,455股普通股股票在2月6日起60天内行使的股票期权行使后可发行, 2024.不包括5,839股普通股股票,在行使不可在 内行使的股票期权时发行 2024年2月6日的60天。 |
| 3. | 包括 1,204股普通股股票在2月6日起60天内行使的股票期权行使后可发行, 2024.不包括在行使不可在 内行使的股票期权时可发行的3,472股普通股 2024年2月6日的60天。 |
| 4. | 包括 在2月6日起六十天内行使的股票期权行使后,可发行3,896股普通股, 2024.不包括544股普通股股票,在行使不可在 内行使的股票期权时可发行 2024年2月6日的60天。包括根据已授予的限制性股票单位奖励获得的1,785股普通股 2024年2月6日,或将在2024年2月6日起60天内归属。不包括我们的195股股票 于2024年2月6日起计六十日内不会归属的受限制股票单位归属时可发行的股票。 |
| 5. | 是否 不包括166股普通股股票,在行使不可在60天内行使的股票期权时可发行 2024年2月6日 |
| 75 |
| 6. | 包括 在2月6日起六十天内可行使的股票期权行使后,可发行332股普通股, 2024. |
| 7. | 包括 697股普通股股票可在2月6日起60天内行使的股票期权行使后发行, 2024. |
| 第13项。 | 某些关系 和相关交易,以及董事独立性 |
除 我们指定的执行人员和董事的薪酬安排外,我们在下文中描述了自2021年1月1日以来我们是或将是其中一方的每项交易或一系列类似 交易,其中:
| ● | 涉及的金额超过 或将超过(i)120,000美元或(ii)公司年末平均总资产的1%(以较低者为准) 财政年度;及 | |
| ● | 我们的任何董事、执行人员 管理人员、发起人或持有我们5%以上股本的人,或上述人员的任何直系亲属, 有或将有直接或间接的物质利益。 |
我们指定的行政人员和董事的薪酬安排见第三部分—第11项—行政人员薪酬。
赔偿协议
我们 已与所有董事和指定执行官签订了赔偿协议。这些协议要求我们在特拉华州法律允许的最大范围内赔偿 这些个人因向 我们提供服务而可能产生的责任,并提前支付因对他们提起的任何诉讼而产生的费用,因为他们可能被起诉。我们还打算 与我们未来的董事和执行官签订赔偿协议。
关联方交易的政策和程序
Our board of directors has adopted a policy that our executive officers, directors, nominees for election as a director, beneficial owners of more than 5% of any class of our Common Stock, any members of the immediate family of any of the foregoing persons and any firms, corporations or other entities in which any of the foregoing persons is employed or is a partner or principal or in a similar position or in which such person has a 5% or greater beneficial ownership interest (collectively “related parties”), are not permitted to enter into a transaction with us without the prior consent of our board of directors acting through the Audit Committee or, in certain circumstances, the chairman of the Audit Committee. Any request for us to enter into a transaction with a related party, in which the amount involved exceeds $100,000 and such related party would have a direct or indirect interest must first be presented to our Audit Committee, or in certain circumstances the chairman of our Audit Committee, for review, consideration and approval. In approving or rejecting any such proposal, our Audit Committee, or the chairman of our Audit Committee, is to consider the material facts of the transaction, including, but not limited to, whether the transaction is on terms no less favorable than terms generally available to an unaffiliated third-party under the same or similar circumstances, the extent of the benefits to us, the availability of other sources of comparable products or services and the extent of the related party’s interest in the transaction.
董事 独立
我们的 董事会对其组成、委员会的组成和每位董事的独立性进行了审查。根据 每位董事要求并提供的有关其背景、就业和隶属关系(包括 家庭关系)的信息,我们的董事会已决定莫兰先生、德宾先生,Pruden先生和Nelson女士不存在 在履行董事职责时会干扰独立判断的关系,而且这两个关系 董事是“独立的”,这一术语定义在纳斯达克市场和SEC规则。
| 76 |
| 第14项。 | 主要会计费用和服务 |
委托人 会计师费用和服务
下表汇总了过去两个会计年度每年为我们的独立注册公共会计师事务所—
| 费用类别 | 2023 | 2022 | ||||||
| 审计费 | $ | 377,265 | $ | 272,369 | ||||
| 审计相关费用 | $ | - | $ | - | ||||
| 税费 | $ | 32,875 | $ | 27,800 | ||||
| 所有其他费用 | $ | - | $ | - | ||||
| 总费用 | $ | 410,140 | $ | 300,169 | ||||
审计费用
"审计 费用"包括2023年和2022年分别约275,000美元和207,000美元的专业服务费用,以及2023年和2022年的约102,000美元和65,000美元,分别为与我们的普通股产品有关的同意和安慰信的费用 。
税 手续费
"税费"包括2023年和2022年与税务准备和 申报相关的服务约为29,000美元和28,000美元,以及2023年和2022年分别为4,000美元和0美元,用于其他税务咨询和准备服务。
费用审批程序
审核委员会负责任命、设定薪酬并监督独立审计师的工作。审计委员会 已经制定了一项关于独立审计师向我们提供的所有审计服务及其条款和非审计服务(《交易法》第10A(g)条或SEC或上市公司会计监督 委员会适用规则禁止的非审计服务除外)的预先批准的政策。但是,如果符合《交易法》第10A(i)(1)(B)条的"最低限度"规定,则 可以免除为我们提供非审计服务的事先批准要求。
审计委员会已考虑了上述审计相关费用、税务费用和所有其他费用的提供是否与保持Amper LLP的独立性兼容 ,并已确定2023财年的此类服务是兼容的。所有 此类服务均由审计委员会根据《交易法》第S—X条第2—01条的规定批准, 规则适用。
审计委员会负责与管理层审查和讨论经审计的财务报表,与独立 注册会计师讨论AS 1301中要求的事项,根据上市公司会计监督委员会关于独立注册公共会计师的适用要求,接受独立注册公共会计师 的书面披露。与审计委员会就独立性进行沟通,并与独立注册会计师讨论其独立性,并向董事会建议将经审计财务报表纳入表格10—K的年度报告。
| 77 |
第四部分
| 第15项。 | 展品和财务报表表 |
(A) 作为本报告一部分提交的文件清单
(1) 合并财务报表
财务报表和相关附注,连同EisnerAmper LLP的报告,见F-1至F-26页,按照本表格10-K“第二部分--第8项--财务报表和补充数据”的要求,列于附件 清单之后。
(2)财务报表明细表。
计划 被省略,因为它们要么不是必需的、不适用的,要么是以其他方式包括的信息。
(3) 展品
根据规则12b-32,公司已向本报告提交了本报告,或通过引用将某些证据并入本报告中。
| 展品 | 通过引用并入 | 已归档 | ||||||||||
| 数 | 附件 说明 | 表格 | 文件 第 | 展品 | 提交日期 | 特此声明 | ||||||
| 2.1 + | 换股协议,日期为2016年12月1日 | S-1 | 333-222441 | 2.1 | 1/5/2018 | |||||||
| 3.1 | 公司注册证书 | S-1 | 333-222441 | 3.1 | 1/5/2018 | |||||||
| 3.2 | 公司注册证书修订证书 | S-1 | 333-222441 | 3.2 | 1/5/2018 | |||||||
| 3.3 | 公司注册证书修订证书,日期为2020年8月13日 | 8-K | 001-38389 | 3.1 | 8/14/2020 | |||||||
| 3.4 | Motus GI Holdings,Inc.注册证书修订证书2022年7月25日 | 8-K | 001-38389 | 3.1 | 7/26/2022 | |||||||
| 3.5 | 经修订的附例 | 10-Q | 001-38389 | 3.1 | 11/14/2022 | |||||||
| 3.6 | A系列可转换优先股指定证书 | S-1 | 333-222441 | 3.4 | 1/5/2018 | |||||||
| 3.7 | A系列可转换优先股指定证书修订证书 | 10-Q | 001-38389 | 3.1 | 5/14/2018 | |||||||
| 3.8 | 公司注册证书修订证书,经修订,日期为2023年11月1日 | 8-K | 001-38389 | 3.1 | 11/2/2023 | |||||||
| 4.1 | 普通股股票的格式 | S-1 | 333-222441 | 4.1 | 1/5/2018 | |||||||
| 4.2 | A系列可转换优先股证书的格式 | S-1 | 333-222441 | 4.2 | 1/5/2018 | |||||||
| 4.3 | 兑换权证的格式 | S-1 | 333-222441 | 4.3 | 1/5/2018 | |||||||
| 78 |
| 展品 | 通过引用并入 | 已归档 | ||||||||||
| 数 | 附件 说明 | 表格 | 文件 第 | 展品 | 提交日期 | 特此声明 | ||||||
| 4.4 | 配售代理人授权书表格 | S-1 | 333-222441 | 4.4 | 1/5/2018 | |||||||
| 4.5 | 注册权协议的格式 | S-1 | 333-222441 | 4.5 | 1/5/2018 | |||||||
| 4.6 | 2017年5月顾问权证的形式 | S-1 | 333-222441 | 4.6 | 1/5/2018 | |||||||
| 4.7 | 配售代理版税支付权证书格式 | S-1 | 333-222441 | 4.7 | 1/5/2018 | |||||||
| 4.8 | 注册权协议修订表 | S-1 | 333-222441 | 4.8 | 1/5/2018 | |||||||
| 4.9 | 10%认股权证 | S-1 | 333-222441 | 4.9 | 1/5/2018 | |||||||
| 4.10 | 版税支付权证书格式 | S-1/A | 333-222441 | 4.10 | 1/31/2018 | |||||||
| 4.11 | 2018年6月顾问权证格式 | 10-Q | 001-38389 | 4.1 | 8/13/2018 | |||||||
| 4.12 | 2017年5月的附加顾问授权书 | 10-Q | 001-38389 | 4.2 | 8/13/2018 | |||||||
| 4.13 | 2018年7月顾问权证表格 | 10-Q | 001-38389 | 4.3 | 8/13/2018 | |||||||
| 4.14 | 2018年11月顾问权证表格 | 10-Q | 001-38389 | 4.4 | 11/14/2018 | |||||||
| 4.15 | 注册人证券说明 | 10-K | 001-38389 | 4.15 | 3/16/2021 | |||||||
| 4.16 | 预先出资认股权证的格式 | 8-K | 001-38389 | 4.1 | 8/28/2020 | |||||||
| 4.17 | 共同授权书的格式 | 8-K | 001-38389 | 4.2 | 8/28/2020 | |||||||
| 4.18 | 新认股权证的形式 | 8-K | 001-38389 | 4.1 | 1/27/2021 | |||||||
| 4.19 | 普通股认购权证的形式 | 8-K | 001-38389 | 4.1 | 5/22/2023 | |||||||
| 4.20 | 预筹普通股认购权证的形式 | 8-K | 001-38389 | 4.2 | 5/22/2023 | |||||||
| 4.21 | 配售代理人授权书表格 | 8-K | 001-38389 | 4.3 | 5/22/2023 | |||||||
| 79 |
| 展品 | 通过引用并入 | 已归档 | ||||||||||
| 数 | 附件 说明 | 表格 | 文件 第 | 展品 | 提交日期 | 特此声明 | ||||||
| 4.22 | 修订协议格式,日期为2023年9月12日 | 8-K | 001-38389 | 4.1 | 9/14/2023 | |||||||
| 4.23 | 预先出资认股权证的格式 | S-1 | 333-275121 | 4.19 | 12/11/2023 | |||||||
| 4.24 | A系列普通认股权证的形式 | S-1 | 333-275121 | 4.20 | 12/11/2023 | |||||||
| 4.25 | B系列普通权证的格式 | S-1 | 333-275121 | 4.21 | 12/11/2023 | |||||||
| 4.26 | 预先出资认股权证的格式 | 8-K | 001-38389 | 4.1 | 12/22/2023 | |||||||
| 4.27 | A系列普通认股权证的形式 | 8-K | 001-38389 | 4.2 | 12/22/2023 | |||||||
| 4.28 | B系列普通权证的格式 | 8-K | 001-38389 | 4.3 | 12/22/2023 | |||||||
| 4.29 | 私人预筹资金认股权证格式 | 8-K | 001-38389 | 4.4 | 12/22/2023 | |||||||
| 4.30 | A系列私募认股权证的形式 | 8-K | 001-38389 | 4.5 | 12/22/2023 | |||||||
| 4.31 | B系列私募认股权证的格式 | 8-K | 001-38389 | 4.6 | 12/22/2023 | |||||||
| 10.1 | 2016年12月1日,公司与配售代理签订的配售代理协议 | S-1 | 333-222441 | 10.1 | 1/5/2018 | |||||||
| 10.2 | 认购协议的格式 | S-1 | 333-222441 | 10.2 | 1/5/2018 | |||||||
| 10.3 | 本公司与股东于2016年12月1日签署的投票协议格式 | S-1 | 333-222441 | 10.3 | 1/5/2018 | |||||||
| 10.4 † | 2016年股权激励计划和2016年以色列子计划 | S-1 | 333-222441 | 10.4 | 1/5/2018 | |||||||
| 80 |
| 展品 | 通过引用并入 | 已归档 | ||||||||||
| 数 | 附件 说明 | 表格 | 文件 第 | 展品 | 提交日期 | 特此声明 | ||||||
| 10.5 | Motus GI Holdings,Inc. 2016年股权激励计划,日期:2020年2月6日 | 8-K | 001-38389 | 10.1 | 8/14/2020 | |||||||
| 10.6 † | 激励股票期权协议的格式 | S-1 | 333-222441 | 10.5 | 1/5/2018 | |||||||
| 10.7 † | 非限制性股票期权协议的格式 | S-1 | 333-222441 | 10.6 | 1/5/2018 | |||||||
| 10.8 † | 限制性股票协议的格式 | S-1 | 333-222441 | 10.7 | 1/5/2018 | |||||||
| 10.9 † | 以色列雇员和董事的假定选择协议形式 | S-1 | 333-222441 | 10.8 | 1/5/2018 | |||||||
| 10.10 | 以色列非雇员和控股股东协议的假设期权形式 | S-1 | 333-222441 | 10.9 | 1/5/2018 | |||||||
| 10.11 † | 向以色列雇员和董事授予以色列期权协议的形式 | S-1 | 333-222441 | 10.10 | 1/5/2018 | |||||||
| 10.12 | 向以色列非雇员和控股股东授予以色列期权协议的形式 | S-1 | 333-222441 | 10.11 | 1/5/2018 | |||||||
| 10.13 † | 2016年12月22日,公司与Mark Pomeranz之间的雇佣协议 | S-1 | 333-222441 | 10.12 | 1/5/2018 | |||||||
| 10.14 | 租赁日期为2017年4月13日,公司与Fantana Building,LLC | S-1 | 333-222441 | 10.13 | 1/5/2018 | |||||||
| 10.15 | 可换股票据发售认购协议格式 | S-1 | 333-222441 | 10.14 | 1/5/2018 | |||||||
| 10.16 | 本公司与Aegis Capital Corporation之间日期为2016年10月14日的《发现者协议》 | S-1 | 333-222441 | 10.15 | 1/5/2018 | |||||||
| 10.17 | 本公司与Aegis Capital Corporation之间日期为2016年12月22日的《发现者协议》 | S-1 | 333-222441 | 10.16 | 1/5/2018 | |||||||
| 10.18 † | 弥偿协议的格式 | S-1 | 333-222441 | 10.17 | 1/5/2018 | |||||||
| 81 |
| 展品 | 通过引用并入 | 已归档 | ||||||||||
| 数 | 附件 说明 | 表格 | 文件 第 | 展品 | 提交日期 | 特此声明 | ||||||
| 10.19 # | Motus GI Technologies Ltd.和Polyzen,Inc.之间的供货协议,日期为2017年9月1日。 | 10-K | 001-38389 | 10.20 | 3/29/2022 | |||||||
| 10.20 † | 经修订和重申的雇佣协议,2018年9月24日生效,公司和Mark Pomeranz | 8-K | 001-38389 | 10.2 | 9/25/2018 | |||||||
| 10.21 † | 雇佣协议,2018年10月1日生效,公司与Timothy P. Moran | 8-K | 001-38389 | 10.1 | 9/25/2018 | |||||||
| 10.22 | 限制性股票奖励协议格式 | 10-K | 001-38389 | 10.22 | 3/26/2019 | |||||||
| 10.23 † | 公司与安德鲁·泰勒(Andrew Taylor)于2021年3月15日修订并重述的雇佣协议的第一次修订 | 10-K | 001-38389 | 10.25 | 3/16/2021 | |||||||
| 10.24 | 2019年12月13日,硅谷银行与Motus GI Holdings,Inc.签署的贷款和担保协议。 | 8-K | 001-38389 | 10.1 | 12/18/2019 | |||||||
| 10.25 | 2020年2月7日,硅谷银行与Motus GI Holdings,Inc.签署的贷款和担保协议的第一修正案。 | 10-K | 001-38389 | 10.25 | 3/30/2020 | |||||||
| 10.26 | 2020年2月25日,硅谷银行与Motus GI Holdings,Inc.签署的贷款和担保协议第二次修订案。 | 10-K | 001-38389 | 10.26 | 3/30/2020 | |||||||
| 10.27 | 2021年1月4日,硅谷银行与Motus GI Holdings,Inc.签署的贷款和担保协议第三修正案。 | 10-K | 001-38389 | 10.29 | 3/16/2021 | |||||||
| 10.28 | 延迟协议,日期为2020年4月10日,自2020年4月2日起生效,由硅谷银行、Motus GI Holdings,Inc. Motus GI,Inc. | 8-K | 001- 38389 | 10.1 | 4/13/2020 | |||||||
| 82 |
| 展品 | 通过引用并入 | 已归档 | ||||||||||
| 数 | 附件 说明 | 表格 | 文件 第 | 展品 | 提交日期 | 特此声明 | ||||||
| 10.29 | 就业机构协议,日期为2020年8月28日,由A.G.P./ Alliance Global Partners和Motus GI Holdings,Inc. | 8-K | 001-38389 | 10.1 | 8/28/2020 | |||||||
| 10.30 | 日期为2020年8月28日的证券购买协议格式,由Motus GI Holdings,Inc.以及每个购买者 | 8-K | 001-38389 | 10.2 | 8/28/2020 | |||||||
| 10.31 | 日期为2021年1月27日,Motus GI Holdings,Inc.和保持器 | 8-K | 001-38389 | 10.1 | 1/27/2021 | |||||||
| 10.32 | 协议书,日期为2021年1月27日,由A.G.P./ Alliance Global Partners和公司 | 8-K | 001-38389 | 10.2 | 1/27/2021 | |||||||
| 10.33 | 贷款协议,日期为2021年7月16日,由Kreos Capital,Motus GI Holdings,Inc.,Motus GI,LLC和Motus GI Medical Technologies,LTD. | 8-K | 001-38389 | 10.1 | 7/21/2021 | |||||||
| 10.34 | Kreos Capital与Motus GI Holdings,Inc.于2021年7月16日签订的担保协议。 | 8-K | 001-38389 | 10.2 | 7/21/2021 | |||||||
| 10.35 | Kreos Capital和Motus GI,LLC于2021年7月16日签署的担保协议。 | 8-K | 001-38389 | 10.3 | 7/21/2021 | |||||||
| 10.36 | 2021年7月16日,Kreos Capital与Motus GI Medical Technologies,LTD.之间的债务—固定费用。 | 8-K | 001-38389 | 10.4 | 7/21/2021 | |||||||
| 10.37 | 债务—浮动押记日期为2021年7月16日,Kreos Capital与Motus GI,LLC。 | 8-K | 001-38389 | 10.5 | 7/21/2021 | |||||||
| 10.38 | 美国知识产权安全协议,日期为2021年7月16日,Kreos Capital与Motus GI Medical Technologies,LTD. | 8-K | 001-38389 | 10.6 | 7/21/2021 | |||||||
| 10.39 # | J. Sterling Industries LLC与Motus GI Holdings,Inc.于2021年4月1日签署的主供应协议。 | 10-K | 001-38389 | 10.41 | 3/29/2022 | |||||||
| 10.40 | 证券购买协议格式 | 8-K | 001-38389 | 10.1 | 5/22/2023 | |||||||
| 10.41 | 注册权协议的格式 | 8-K | 001-38389 | 10.2 | 5/22/2023 | |||||||
| 10.42 | 认股权证修订的形式 | 8-K | 001-38389 | 10.3 | 5/22/2023 | |||||||
| 10.43 | 2018年4月1日,公司与Ravit Ram签订的雇佣协议 | 8-K | 001-38389 | 10.1 | 6/5/2023 | |||||||
| 10.44 | 2019年12月23日,公司与Elad Amor签订的雇佣协议 | 8-K | 001-38389 | 10.2 | 6/5/2023 | |||||||
| 10.45 | 提供贷款融资协议的第一次修订,日期为2023年11月28日,Motus GI,LLC和Motus GI Medical Technologies,LTD. | 8-K | 001-38389 | 10.1 | 11/28/2023 | |||||||
| 10.46 | 证券购买协议格式 | S-1 | 333-275121 | 10.48 | 12/11/2023 | |||||||
| 10.47 | 公司与A.G.P.签订的配售代理协议格式。 | S-1 | 333-275121 | 10.47 | 12/11/2023 | |||||||
| 10.48† | 公司与Ravit Ram之间的雇佣协议修订表 | 8-K | 001-38389 | 10.1 | 03/11/2024 | |||||||
| 21.1 | 本公司附属公司名单 | 10-K | 001-38389 | 21.1 | 3/16/2021 | |||||||
| 83 |
| 展品 | 通过引用并入 | 已归档 | ||||||||||
| 数 | 附件 说明 | 表格 | 文件 第 | 展品 | 提交日期 | 特此声明 | ||||||
| 23.1 | EisnerAmper LLP的同意 | X | ||||||||||
| 31.1 | 根据第13a—14(a)条或第15d—14(a)条认证首席执行官 | X | ||||||||||
| 31.2 | 根据细则13a—14(a)或细则15d—14(a)对首席财务官的核证 | X | ||||||||||
| 31.3 | 根据细则13a—14(a)或细则15d—14(a)对首席会计官的证明 | X | ||||||||||
| 32.1 ** | 首席执行官、首席财务官和首席会计官根据18 U.S.C.部1350 | X | ||||||||||
| 97.1† | 赔偿追讨政策 | X | ||||||||||
| 101.INS | 内联 XBRL实例文档(实例文档不会出现在交互式数据文件中,因为其XBRL标记嵌入在 中 Inline XBRL文档)。 | X | ||||||||||
| 101.SCH | 内联 XBRL分类扩展架构文档。 | X | ||||||||||
| 101.CAL | 内联 XBRL分类扩展计算链接库文档。 | X | ||||||||||
| 101.DEF | 内联 XBRL分类扩展定义Linkbase文档。 | X | ||||||||||
| 101.LAB | 内联 XBRL分类扩展标签Linkbase文档。 | X | ||||||||||
| 101.PRE | 内联 XBRL分类扩展演示文稿Linkbase文档。 | X | ||||||||||
| 104 | 封面 页面交互数据文件(格式为内联XBRL,包含在附件101中) | |||||||||||
| + | 由于S-K法规第601(B)(2)项允许,本协议的某些附表未在此提交。公司将应要求补充提供任何遗漏的美国证券交易委员会时间表的副本。 |
| † | 表示 管理合同或补偿计划。 |
| # | 本展品的某些 部分(由“[***]“)已被省略,因为我们已确定(1)它不是实质性的,(2) 是本公司视为私人或机密的类型。 |
| ** | 本协议附件32.1中提供的证书被视为本年度报告的10-K表格,不会被视为根据修订后的1934年《证券交易法》第18条的规定而提交,除非注册人通过引用明确地将其纳入其中。 |
| 第16项。 | 表格10-K摘要 |
没有。
| 84 |
签名
根据1934年《证券交易法》第13或15(D)节的要求,注册人已正式促使本报告由经正式授权的签署人代表其签署。
| Motus GI控股公司 | ||
| 日期:2024年3月18日 | 发信人: | /s/Mark Pomeranz |
| 姓名: | 马克·波梅兰茨 | |
| 标题: | 首席执行官 | |
| (首席行政主任) | ||
| 日期:2024年3月18日 | 发信人: | /s/Ravit Ram |
| 姓名: | 拉维特·拉姆 | |
| 标题: | 首席财务官 | |
| (首席财务官) | ||
| 日期:2024年3月18日 | 发信人: | Elad Amor |
| 姓名: | 埃拉德·阿莫尔 | |
| 标题: | 首席会计官 | |
| (首席会计主任) | ||
根据1934年《证券交易法》的要求,本报告已由以下人员以注册人的身份在指定日期签署。
| 签名 | 标题 | 日期 | ||
| /s/Mark Pomeranz | 首席 执行官兼总监 (首席行政主任) |
三月 2024年18月18日 | ||
| 马克·波梅兰茨 | ||||
| /s/Ravit Ram | 首席财务官(首席财务官) | 2024年3月18日 | ||
| 拉维特·拉姆 | ||||
| Elad Amor | 首席会计官(首席会计官) | 2024年3月18日 | ||
| 埃拉德·阿莫尔 | ||||
| /S/蒂莫西·P·莫兰 | 董事 | 2024年3月18日 | ||
| 蒂姆·P·莫兰 | ||||
| /发稿S/斯科特·德宾 | 董事 | 2024年3月18日 | ||
| 斯科特·德宾 | ||||
| 撰稿S/索尼娅·纳尔逊 | 董事 | 2024年3月18日 | ||
| 索尼娅·纳尔逊 | ||||
| /S/加里·普鲁登 | 董事 | 2024年3月18日 | ||
| 加里·普鲁登 |
| 85 |
索引 至
合并财务报表
目录
| 页面 | ||
| 合并 财务报表—2023年和2022年12月31日: | ||
| 独立注册会计师事务所报告(PCAOB ID号 |
F-2 | |
| 截至2023年12月31日和2022年12月31日的合并资产负债表 | F-4 | |
| 截至2023年及2022年12月31日止年度的综合全面亏损报表 | F-5 | |
| 截至2023年及2022年12月31日止年度的合并股东权益变动表 | F-6 | |
| 截至2023年12月31日和2022年12月31日的合并现金流量表 | F-7 | |
| 合并财务报表附注 | F—8 - F—23 |
| F-1 |
独立注册会计师事务所报告{br
致 公司董事会和股东
Motus GI控股公司
对财务报表的意见
我们已审计随附的Motus GI Holdings,Inc.的合并资产负债表。本公司于2023年12月31日及2022年12月31日止的综合损益表、股东权益变动表、现金流量表及相关附注(统称为“财务报表”)。我们认为,财务报表在所有重大方面公允列报了 公司截至2023年和2022年12月31日的合并财务状况,以及截至该日止各年度的合并经营成果 和现金流量,符合美利坚合众国公认的会计原则 。
正在进行 关注
随附财务报表的编制假设 公司将持续经营。如财务报表附注2所述,该公司产生的收入极少, 经营活动产生负现金流,并产生了重大经营亏损,这对 其持续经营能力产生了重大怀疑。管理层有关该等事项的计划亦载于附注2。财务报表 不包括可能由这种不确定性的结果导致的任何调整。
征求意见的依据
这些财务报表由公司管理层负责。我们的责任是根据我们的审计对公司的财务报表发表意见。我们是一家在美国上市公司会计监督委员会(“PCAOB”)(“PCAOB”)注册的公共会计师事务所,根据美国联邦证券法以及美国证券交易委员会和PCAOB适用的规则和法规,我们必须对公司保持独立。
我们按照PCAOB的标准进行审核。这些标准要求我们计划和执行审计,以获得关于财务报表是否没有重大错报的合理保证,无论是由于错误还是舞弊。本公司不需要,也不需要我们对其财务报告的内部控制进行审计。作为我们审计的一部分,我们需要了解财务报告的内部控制,但不是为了对公司财务报告内部控制的有效性发表意见。因此,我们不表达这样的意见。
我们的审计包括执行程序以评估财务报表重大错误陈述的风险,无论是由于错误还是舞弊,以及执行应对这些风险的程序。这种程序 包括在测试的基础上审查关于财务报表中的数额和披露的证据。我们的审计还包括 评估管理层使用的会计原则和作出的重大估计,以及评估财务报表的整体列报。我们相信,我们的审计为我们的观点提供了合理的基础。
重大审计事项
以下传达的关键审计事项是 已传达或要求传达给审计委员会的财务报表本期审计所产生的事项,并且: (1)与对财务报表具有重要意义的账目或披露有关,以及(2)涉及我们特别具有挑战性、主观性、 或复杂的判断。重要审计事项的沟通不会以任何方式改变我们对整个财务报表的意见, 我们不会通过以下沟通关键审计事项,就关键审计事项或与之相关的账目或披露提供单独的意见。
| F-2 |
债务和股权交易会计
如财务报表附注8和11所述,公司 签订了两份独立的证券购买协议和一份债务修正案和随后的结算,公司同意 发行总额为(i)609,461股公司普通股,(ii)5,666,673份可行使普通股股份的预融资认股权证 ,以及(iii)12,276,134普通股可行使的普通认股权证。根据协议中的具体条款 和适用的权威指引,本公司确定预存权证和普通权证应分类为 永久股权。本公司亦须应用复杂的会计指引,以确定 修订及结算可换股票据的适当会计处理方法,包括厘定用以结算可换股票据的股本工具的公平值的复杂性。
由于评估工具特征的复杂性,我们将预存资金权证和普通权证的适当会计和 资产负债表分类的评估确定为关键审计事项 ,这要求管理层解释和应用协议中的复杂条款,以适当应用会计 权威指导。因此,审计师的判断和主观性很高,在执行评估管理层结论的程序时,需要 大量的审计工作。
解决关键审计事项涉及执行程序 和评估审计证据,以形成我们对财务报表的总体意见。这些程序除其他外包括: (i)了解并评价与财务报告会计有关的控制设计,包括 复杂交易;(ii)取得协议并评价协议的条款和条件,并评估管理层解释和应用适当的会计权威指导的合理性 ;以及(iii)利用具有专门技能和知识的人员 协助评估管理层达成的结论的适当性,方法是(a)评估 协议的基本条款,(b)评估管理层应用权威会计指导的适当性,以及(c)评估用于估计为结算 可换股票据而交换的工具的公允价值的方法和假设。
/S/ 艾斯纳安培有限责任公司
我们 自2018年起担任本公司的审计师。
2024年3月18日
| F-3 |
Motus GI Holdings,Inc和子公司
合并资产负债表
(单位 千,不包括每股和每股金额)
| 十二月三十一日, | ||||||||
| 2023 | 2022 | |||||||
| 资产 | ||||||||
| 流动资产: | ||||||||
| 现金和现金等价物 | $ | $ | ||||||
| 应收账款 | ||||||||
| 库存,当前 | ||||||||
| 预付费用和其他流动资产 | ||||||||
| 流动资产总额 | ||||||||
| 固定资产,净额 | ||||||||
| 库存,非流动 | ||||||||
| 使用权资产 | ||||||||
| 其他非流动资产 | ||||||||
| 总资产 | $ | $ | ||||||
| 负债与股东权益 | ||||||||
| 流动负债: | ||||||||
| 应付账款和应计费用 | $ | $ | ||||||
| 经营租赁负债--流动负债 | ||||||||
| 其他流动负债 | ||||||||
| 长期债务的流动部分,扣除未摊销债务贴现后,美元 | ||||||||
| 流动负债总额 | ||||||||
| 或有特许权使用费债务 | ||||||||
| 经营租赁负债--非流动负债 | ||||||||
| 可转换票据,扣除未摊销债务贴现 | ||||||||
| 长期债务,扣除未摊销债务贴现#美元 | ||||||||
| 总负债 | ||||||||
| 承担和或有负债(附注9) | ||||||||
| 股东权益 | ||||||||
| 优先股$票面价值;授权股份;已发行及已发行股份 | ||||||||
| 普通股$票面价值;授权股份;和截至2023年12月31日和2022年12月31日的已发行和已发行股票 | ||||||||
| 额外实收资本 | ||||||||
| 累计赤字 | ( | ) | ( | ) | ||||
| 股东权益总额 | ||||||||
| 总负债和股东权益 | $ | $ | ||||||
附注是这些合并财务报表的组成部分。
| F-4 |
Motus GI Holdings,Inc和子公司
合并 全面损失表
(以 千计,不包括股份和每股金额)
| 截至十二月三十一日止的年度, | ||||||||
| 2023 | 2022 | |||||||
| 收入 | $ | $ | ||||||
| 运营费用: | ||||||||
| 收入成本—销售 | ||||||||
| 收入成本—存货减值 | ||||||||
| 研发 | ||||||||
| 销售和市场营销 | ||||||||
| 一般和行政 | ||||||||
| 总成本和费用 | ||||||||
| 运营亏损 | ( | ) | ( | ) | ||||
| 或有特许权使用费责任估计公允价值变动收益 | ||||||||
| 债务清偿损失 | ( | ) | ||||||
| 财务费用,净额 | ( | ) | ( | ) | ||||
| 外币损失 | ( | ) | ( | ) | ||||
| 净亏损 | $ | ( | ) | $ | ( | ) | ||
| 普通股基本和稀释后每股亏损: | $ | ) | $ | ) | ||||
| 已发行普通股、基本普通股和稀释普通股的加权平均数 | ||||||||
附注是这些合并财务报表的组成部分。
| F-5 |
Motus GI Holdings,Inc和子公司
合并股东权益变动表
(单位 千,不包括每股和每股金额)
| 普通股 股票 | 其他内容 已缴费 |
累计 | 总计 股东的 |
|||||||||||||||||
| 股票 | 金额 | 资本 | 赤字 | 股权 | ||||||||||||||||
| 2021年12月31日的余额 | $ | $ | $ | ( |
) | $ | ||||||||||||||
| 发行普通股
根据市场登记发行,扣除发行成本, |
||||||||||||||||||||
| 发行普通股 受限制股票单位归属后 | ||||||||||||||||||||
| 已结算的零碎股份 按照反向股票分割,以现金支付 | ( |
) | ( |
) | ( |
) | ||||||||||||||
| 发行普通股 董事会的补偿 | ||||||||||||||||||||
| 基于股份的薪酬 | - | |||||||||||||||||||
| 净亏损 | - | ( |
) | ( |
) | |||||||||||||||
| 2022年12月31日的余额 | ( |
) | ||||||||||||||||||
| 发行普通股
根据市场登记发行,扣除发行成本, |
||||||||||||||||||||
| 发行普通股 受限制股票单位归属后 | ||||||||||||||||||||
| 私募发行,
扣除融资费用 |
||||||||||||||||||||
| 发行普通股
公开发售时,扣除融资费用 |
||||||||||||||||||||
| 发行普通股 在行使认股权证时, | ||||||||||||||||||||
| 发行普通股
或有特许权使用费债务到期后,扣除发行费 |
||||||||||||||||||||
| 发行普通股 可换股票据结算时 | ||||||||||||||||||||
| 已结算的零碎股份 按照反向股票分割,以现金支付 | ( |
) | ( |
) | ( |
) | ||||||||||||||
| 基于股份的薪酬 | - | |||||||||||||||||||
| 净亏损 | - | ( |
) | ( |
) | |||||||||||||||
| 2023年12月31日的余额 | $ | $ | $ | ( |
) | $ | ||||||||||||||
附注是这些合并财务报表的组成部分。
| F-6 |
Motus GI Holdings,Inc和子公司
合并的现金流量表
(以 千计,不包括股份和每股金额)
| 截至十二月三十一日止的年度, | ||||||||
| 2023 | 2022 | |||||||
| 经营活动的现金流: | ||||||||
| 净亏损 | $ | ( | ) | $ | ( | ) | ||
| 对净亏损与经营活动中使用的现金净额进行的调整: | ||||||||
| 折旧及摊销 | ||||||||
| 债务发行成本摊销 | ||||||||
| 或有特许权使用费责任估计公允价值变动收益 | ( | ) | ( | ) | ||||
| 基于股份的薪酬 | ||||||||
| 发行普通股作为董事会报酬 | ||||||||
| 债务清偿损失 | ||||||||
| 存货减值 | ||||||||
| 固定资产减值准备 | ||||||||
| 经营租赁使用权资产摊销 | ||||||||
| 租赁终止损失 | ||||||||
| 经营性资产和负债变动情况: | ||||||||
| 应收账款 | ( | ) | ||||||
| 库存 | ( | ) | ||||||
| 预付费用和其他流动资产 | ||||||||
| 应付账款和应计费用 | ( | ) | ( | ) | ||||
| 经营租赁负债 | ( | ) | ( | ) | ||||
| 其他流动负债 | ||||||||
| 用于经营活动的现金净额 | ( | ) | ( | ) | ||||
| 投资活动产生的现金流: | ||||||||
| 固定资产购置 | ( | ) | ( | ) | ||||
| 用于投资活动的现金净额 | ( | ) | ( | ) | ||||
| 融资活动的现金流: | ||||||||
| 根据市场登记发行发行普通股所得款项 | ||||||||
| 私募发行收益 | ||||||||
| 公开发行普通股所得款项 | ||||||||
| 根据反向股票分割以现金支付的部分股份 | ( | ) | ( | ) | ||||
| 偿还长期债务 | ( | ) | ( | ) | ||||
| 支付债务发行成本 | ( | ) | ||||||
| 股权融资费 | ( | ) | ( | ) | ||||
| 融资活动提供的现金净额 | ||||||||
| 现金和现金等价物净减少 | ( | ) | ( | ) | ||||
| 期初现金及现金等价物 | ||||||||
| 期末现金及现金等价物 | $ | $ | ||||||
| 补充现金流信息: | ||||||||
| 支付的现金: | ||||||||
| 利息 | $ | $ | ||||||
| 补充披露非现金融资和投资活动: | ||||||||
| 将存货重新分类为固定资产 | $ | $ | ||||||
| 将预付费用重新分类为固定资产 | $ | $ | ||||||
| 应付账款和应计费用中固定资产的购置 | $ | $ | ||||||
| 定向增发的非现金发行成本 | $ | $ | ||||||
| 公开发行的非现金发行成本 | $ | $ | ||||||
| 期末已发生但未支付的融资费 | $ | $ | ||||||
| 期末已发生但未支付的债务发行成本 | $ | $ | ||||||
| 或有专营权使用费义务的终绝 | $ | |||||||
| 因取得使用权资产而产生的经营租赁负债 | $ | $ | ||||||
| 可转换票据转股权的结算 | $ | $ | ||||||
附注是这些合并财务报表的组成部分。
| F-7 |
Motus GI Holdings,Inc和子公司
合并财务报表附注
(以 千计,不包括股份和每股金额)
注 1-业务说明
Motus GI Holdings,Inc (the于二零一六年九月在美国特拉华州注册成立。本公司及其子公司Motus GI Technologies,Ltd.和Motus GI,LLC统称为“Motus GI”或“公司”。
The Company has developed the Pure-Vu System, a medical device that has been cleared by the U.S. Food and Drug Administration (the “FDA”) to help facilitate the cleansing of a poorly prepared gastrointestinal tract during colonoscopy and to help facilitate upper gastrointestinal (“GI”) endoscopy procedures. The Pure-Vu System has received a CE Mark in the EU for use in colonoscopy. The Pure-Vu System integrates with standard and slim colonoscopes, as well as gastroscopes, to improve visualization during colonoscopy and upper GI procedures while preserving established procedural workflow and techniques. Through irrigation and evacuation of debris, the Pure-Vu System is designed to provide better-quality exams. The Company received 510(k) clearance in October 2023 from the FDA for the Pure-Vu EVS System for use in the upper GI tract and Gen 4 Colon and will commence market introduction of these products in the coming months. Both devices leverage the same workstation and feature key enhancements such as a larger and more powerful suction channel, more efficient irrigation jets, a smaller profile distal tip that offers enhanced flexibility during insertion, enhanced navigation and a much easier bed side set up. The Company does not expect to generate significant revenue from product sales until it further expands its commercialization efforts, which is subject to significant uncertainty.
注: 2-持续经营的不确定性
迄今为止,该公司的收入最低,经营现金流为负,并从其活动中产生了巨大的经营损失 。管理层预计,公司将继续产生巨大的经营亏损,并继续主要通过利用其当前的财务资源、未来的产品销售、通过发行债务或 股权以及通过其他战略性替代交易为其运营提供资金。通货膨胀上升、利率上升和金融市场波动可能会对 公司订立、修改和谈判有关股权和债务融资计划的有利条款和条件的能力产生不利影响 。不确定的金融市场、供应链的潜在中断以及不断变化的优先事项也可能影响公司签署关键协议的能力。这些中断可能会对公司的销售额、经营业绩、财务状况和流动性产生负面影响,直至2024年。
迄今为止,我们
从产品销售中产生的收入有限。我们从未盈利过,自成立以来每年都发生了巨大的净亏损
,其中包括亏损美元
此外,我们正在探索一系列战略和融资替代方案,重点是最大化股东价值和加速 Pure—Vu系统的商业化。如果一项战略性交易没有完成,或者如果无法获得额外融资,我们 可能无法偿还我们的未偿债务和应付款项,可能不得不申请破产保护或寻求解散公司 并清算我们所有剩余资产。在这种情况下,可供分配给 股东的现金数额(如果有的话)将在很大程度上取决于该决定的时间,因为随着时间的推移, 可供分配的现金数额将随着我们继续为我们的运营提供资金并偿还我们的未偿债务而减少。我们无法保证 在支付我们的债务和其他义务以及 预留资金用于准备金后,将可分配给股东(如有)的现金数额,也无法保证任何此类分配的时间(如有)。
| F-8 |
此类 情况令人对公司能否继续作为一家持续经营企业产生重大疑问。该等综合财务报表 不包括因其不确定性而可能导致的任何调整。
注: 3-重要会计政策和列报依据
编制随附综合财务报表时应用的主要会计政策摘要如下:
列报基准 和估计数的使用
随附的合并财务报表是根据 美国公认会计原则("公认会计原则")编制的,包括公司及其全资子公司Motus Ltd.的账目,一家以色列公司, 在以色列的Tirat Carmel和Motus Inc.有业务,特拉华州的一家公司,在美国有业务。所有公司间 账户和交易都已在合并中消除。本说明中对适用指南的任何引用均指 财务会计准则委员会("FASB")的会计准则编纂(或ASC)和会计准则更新(或ASU)中的权威公认会计原则。
按照公认会计原则编制合并财务报表要求管理层作出估计和假设, 影响截至财务报表日期的资产和负债报告金额,以及报告期内收入和支出报告金额。实际结果可能与该等估计不同。
反向 股票拆分
因此, 所有人都分享、与股份有关的信息及随附综合财务报表及其附注中呈列的所有期间的每股金额 已追溯调整(如适用),以反映反向股票分割。
本位币和外币折算
公司(包括外国子公司)的 功能货币为美元(以下简称"美元"),因为美元是公司已在其中运营并预计在可预见的未来 将继续运营的主要经济环境的 货币。以美元计值的交易及结余按原金额呈列。 以外币计价的交易和余额已根据ASC 830—10 "外币换算"的规定重新计量为美元。 重新计量以非美元货币计值的货币资产负债表项目的所有交易收益及亏损均于综合全面亏损表中反映 为外币(亏损)收益(如适用)。
现金 和现金等价物
公司将原到期日为三个月或以下的所有高流动性投资证券视为现金等价物。由于 该等投资的期限较短,账面值为公允价值的合理估计。现金及现金等价物 包括手头现金和高评级美国政府支持的货币市场基金投资。
| F-9 |
信贷风险和资产负债表外风险的集中
可能使公司承受信贷风险集中的金融工具主要是现金和现金等价物。 本公司在这些账户中没有出现任何信贷损失,并且不认为其在这些资金上面临任何 重大信贷风险。本公司并无资产负债表外亏损风险之金融工具。
收入 确认
为Pure—Vu EVS系统执行的销售 合同按照ASC主题606— 与客户的合同收入("ASC 606")进行核算,以描述控制权转移给公司客户的情况,其金额反映了公司预期有权获得的 对价。Pure—Vu EVS系统由工作站( "工作站")和一次性使用套管("一次性")组成。
ASC 606适用于与客户签订的所有合同,但属于其他标准范围的合同除外,例如租赁和协作 安排。为确定公司确定在ASC 606范围内的安排的收入确认,公司 执行以下五个步骤:(1)识别与客户的合同,(2)识别合同中的履约义务, (3)确定交易价格,(4)将交易价格分配到合同中的履约义务,(5)在履约义务履行时确认收入。
EVS系统的商业 安装包括工作站、一次性用品的销售和服务计划。工作站在没有 任何重大定制和修改的情况下运行,一次性用品是专门的消耗品,可随时从公司购买 。因此,工作站销售收入在客户承诺购买工作站 并交付工作站后确认,即所有权转移之时。一次性物品被识别为单独的履约义务, 因此,当一次性物品交付给客户且所有权转移时,销售一次性物品的收入确认。
购买任何工作站均包含 免费一年服务计划。在免费一年服务计划期结束后,提供 工作站不同支持和维护的扩展服务计划。在 免费一年服务计划的情况下,工作站销售价格的一部分将根据相对独立价值在一年服务计划 期间内按比例进行递延和确认。工作站的独立销售价格在合同开始时根据工作站独立销售的可观察价格设定 ,但是,有时,公司会向某些客户提供该价格的折扣 。一年服务计划的独立销售价格是基于更换部件的预期成本和 执行服务的直接成本加上公司设定的标准利润。假定的标准利润与为扩展服务计划定价时的 预期利润一致。扩展服务计划的收入在 服务计划合同期内按比例确认。
有时,公司可能会向潜在客户提供为期最长6个月的有限时间免费试用,以评估工作站 ,在某些情况下,将试用期延长至总计11个月。公司认为6—11个月的使用期为 不连续的有限试用期,因为免费试用的总时长仍不足一年。在公司 继续向客户提供工作站的使用期超过一年的情况下,该安排超出了ASC 606的 范围,如下所述。管理层在开始免费试用期前不会收取任何预付款项或按金。 在免费试用期间,工作站不确认收入,但是,评估人员 购买的任何一次性用品在交付时确认,如上所述。
对于 ASC 606范围以外的合同,公司根据1)ASC 842— 租赁("ASC 842")确定拟议供应安排的收入,因为它涉及拟议供应安排内工作站的嵌入式租赁,以及2) ASC 606确定拟议供应安排内套筒销售的收入。对于(i)包含最低采购承诺的安排 和(ii)不包含最低采购承诺但 为超过指定级别的采购提供批量折扣的安排,公司使用总估计采购量法将交易价格分配至拟议供应安排内的 履约义务。
| F-10 |
截至2023年12月31日止年度,公司确认收入为美元
截至2023年12月31日止年度,公司确认收入的时间点为美元
合同成本
在某些符合条件的销售时,向销售代表支付超过基本佣金水平的增量
佣金(如适用),该佣金在销售协议执行时支付
。ASC 606中的指南提供了一种可行的权宜方法,如果实体以其他方式确认的资产的摊销期为一年或更短。公司选择应用可用的可行的权宜方法,因为
对合格销售订单支付的佣金与销售订单的履行期有关。截至2023年12月31日和2022年12月31日止年度,对符合条件的销售订单支付的增量佣金为美元
应收账款和坏账准备
应收账款
按原始发票金额减去任何潜在无法收回金额的备抵进行记录和入账。
公司根据其对各种因素的评估,包括历史
经验、应收账款余额的账龄、我们客户的信贷质量、当前经济状况以及可能影响客户支付能力的其他
因素,对呆账备抵作出估计。截至2023年12月31日和2022年12月31日,可疑账款准备金为美元
库存
存货 采用加权平均成本法按成本和可变现净值中较低者列报,并至少每年评估一次减值。 本公司记录了与过期、过期、过剩和过时项目相关的损失的存货准备金。库存的储备和减记 基于管理层目前对库存水平、计划产量和现有材料的扩展能力的了解。与预测数量相比,对公司产品的需求时间或水平发生重大变化 可能会导致未来记录额外的过剩和过时库存费用。公司将超额和过期存货的费用计入收入成本。根据未来销售预测,从资产负债表 日期起超过未来12个月预计变现的库存被归类为长期资产。
租契
公司根据ASC 842、租赁或ASC 842对其租赁进行会计处理。在安排开始时,本公司根据安排中存在的独特事实和情况确定该安排是否为租约或包含租约。租期超过一年的租赁在资产负债表上确认为使用权资产以及短期和长期租赁负债, 视情况而定。该公司没有融资租赁。
经营性 租赁负债及其相应的使用权资产最初根据预期剩余租赁期内租赁付款的现值入账。对于收到的奖励等项目,可能需要对使用权资产进行某些调整。 租赁合同中隐含的利率通常不容易确定。因此,本公司利用其递增的借款利率 对租赁付款进行贴现,这反映了在类似的经济环境下,本公司可以在抵押的基础上借款的固定利率 相同货币、类似期限的租赁付款金额。预期,公司 将调整直线租金支出或收到的任何奖励的使用权资产,并使用自租赁开始或过渡日期有效的相同增量借款利率,按 净现值重新计量租赁负债。
| F-11 |
公司已选择不在资产负债表上确认原始期限为一年或一年以下的租赁。该公司通常只在评估租赁安排时包括初始租赁期。除非存在合理的续订确定性,否则续订租约的选项不包括在公司的评估中。
固定资产 净资产
固定资产按成本减去累计折旧列报。折旧按直线法计算,折旧率 反映相关资产的估计使用寿命,具体如下:
| 办公设备 | ||
| 计算机和软件 | ||
| 机械设备 | ||
| 实验室和医疗设备 | ||
| 租赁权改进 |
员工 和非员工股份薪酬
公司适用ASC 718-10“股份支付”,要求计量和确认发放给员工和董事的所有股份支付奖励的薪酬支出 ,包括公司股票计划下的员工股票期权和基于估计公允价值发放给非员工的股权奖励。
发放给非员工的奖励的会计核算类似于员工奖励的会计核算,不同之处在于:
| ● | 公司可以在逐个授予的基础上选择使用合同条款作为期权定价模型中的预期期限假设,以及 | |
| ● | 赠款的费用 在同一时期确认(S),并以相同的方式确认,就像设保人支付了现金一样。 |
ASC 718-10要求公司在授予之日使用期权定价模型估计基于股权的期权奖励的公允价值。 奖励的公允价值在公司的 综合全面损失表中以直线方式确认为必要服务期内的费用。该公司在发生基于股票的奖励没收时予以确认。
公司使用Black-Scholes期权定价模型估计授予的期权股权奖励的公允价值。期权定价模型 需要许多假设,其中最重要的是股价、预期波动率和预期期权期限(从授予之日到期权行使或到期的时间)。预期波动率是根据技术行业类似 公司的波动率进行估计的。该公司历来不派发股息,也没有可预见的发行股息的计划。 无风险利率是基于同等期限的政府零息债券的收益率。对于授予员工和董事的期权,使用“简化”方法计算预期期权期限 。发放给非雇员的补助金是根据合同条款发放的。每一项投入的确定的变化可能会影响授予的期权的公允价值和本公司的经营业绩。
受限的 个库存单位
公司根据2016年股权激励计划发行限制性股票单位。限制性股票单位的公允价值以授出日的收盘价为基础,并在单位归属期间作为营业费用支出。每个受限股票单位使受让人有权获得一股普通股,在授予日后最多四年内在归属时收到。在授予奖励之前,受限股票单位的接受者 没有投票权。
| F-12 |
基本 每股净亏损通过将普通股股东应占净亏损除以适用期间已发行普通股的加权平均数计算得出。每股摊薄净亏损的计算方法是将普通股股东应占净亏损除以适用期间已发行普通股的加权平均数量,包括任何潜在的摊薄证券,如股票期权、未授予的限制性股票、权证和其他可转换工具,除非纳入的结果 将是反摊薄的。受归属和其他以股份为基础的支付奖励的限制性股票单位的摊薄效应是使用“库藏股方法”计算的,该方法假定行使这些工具的“收益” 用于按该期间的平均市场价格购买普通股。可转换证券的稀释效应 是用“如果转换法”计算的。在IF-转换方法下,证券假设在期初转换,由此产生的普通股计入整个列报期间的摊薄计算的分母 。公司的净亏损是指列报的所有期间普通股股东应占净亏损 。
鉴于 本公司发行预筹资权证的名义行使价,该等预资资权证计入每股基本及摊薄净亏损的计算 ,因为与相关普通股的公允价值相比,每份认股权证的行权价被视为非实质性。这个截至2023年12月31日未行使的预融资权证计入了公司计算的每股基本亏损和摊薄亏损。
| 截至十二月三十一日止的年度: | ||||||||
| 2023 | 2022 | |||||||
| 未平仓期权 | ||||||||
| 未归属的限制性股票单位 | ||||||||
| 认股权证 | ||||||||
研发费用
研究和开发费用在发生时计入综合全面损益表。
专利成本
与获得专利权和保护专有技术有关的成本 在发生时计入费用。
债务 发行成本
债务 发行成本指与发行债务工具相关的成本,并在相关债务工具的有效期内使用实际利息法 摊销。本公司将债务发行成本记录为债务贴现,并减少债务负债的账面金额。
| F-13 |
因终止雇佣协议而产生的负债
根据以色列就业法,Motus有限公司的雇员根据1963年《劳资补偿法》第14条(“第14条”)支付一部分工资。根据第14条,这些雇员有权获得Motus Ltd.代表他们在保险公司缴纳的每月存款。
根据第14条支付的款项 使Motus Ltd.免于支付未来与这些员工有关的任何遣散费(根据1963年以色列遣散费补偿法) 。上述存款并未在本公司的资产负债表中作为资产入账,亦无任何负债入账,因为本公司未来并无义务支付任何额外款项。
所得税 税
公司采用资产负债法计提所得税。递延税项资产及负债乃根据资产及负债的财务报表及课税基准之间的差额,以及预期该等差额可拨回时的实际税率而入账。如果根据现有证据的权重,部分或全部递延税项资产更有可能无法变现,则递延税项资产减值准备。截至2023年12月31日和2022年12月31日,公司 拥有递延税项资产的全额估值津贴。
公司须遵守ASC 740-10-25所得税(ASC 740)的规定。ASC 740为不确定税务状况的财务报表确认规定了一个更有可能的门槛。ASC 740通过规定财务报表确认和计量的最低确认阈值和计量属性来澄清所得税的会计处理,以确认和计量纳税申报单中已采取或预期采取的纳税状况。本公司每季度进行一次评估,以确定所得税应计项目是否符合《美国会计准则》740关于不确定税务状况的指引。目前没有公开的联邦或州审计。截至2023年12月31日或2022年12月31日,本公司未记录任何 不确定税务状况的责任。如果出现此类问题,本公司将在所得税支出中确认与所得税事项相关的利息和罚款。
截至2023年12月31日及2022年12月31日止年度,本公司录得
金融工具的公允价值
公司根据ASC 820“公允价值计量和披露”(“ASC 820”)对金融工具进行会计处理。ASC 820建立了一个公允价值等级,该等级对用于计量公允价值的估值技术的输入进行了优先排序。 该等级对相同资产或负债的活跃市场的未调整报价给予最高优先级(第1级计量) ,对不可观察到的投入(第3级计量)给予最低优先权。ASC 820下的公允价值层次结构的三个级别说明如下:
级别 1-活跃市场的未调整报价,在计量日期可获得相同、不受限制的资产或负债;
第2级--非活跃市场或活跃市场对类似资产或负债的报价、报价以外的可观察投入、不可直接观察但得到可观察市场数据证实的投入;
第 3级-需要对公允价值计量具有重大意义且无法观察到的投入的价格或估值。
截至2023年12月31日及2022年12月31日止年度内,公允价值层级水平并无变动。
复杂金融工具
本公司审阅债务工具、 股本工具和其他融资安排的条款,以确定是否存在嵌入式衍生工具特征,包括嵌入式转换 期权,其需要分开并作为衍生金融工具单独入账。此外, 与发行融资工具有关,公司可能会发行独立期权和认股权证,包括向 非员工发行期权或认股权证,以换取咨询或其他服务。本公司根据 会计准则编纂("ASC")815,衍生品和套期保值("ASC 815")对其普通股权证进行会计处理。根据ASC 815的条款 ,如果普通股权证要求净现金结算或给予持有人 以净现金结算的选择权,或其不符合权益分类标准,则本公司将普通股权证入账为负债。
如果合同需要实物结算或实物净结算,或者如果公司可以选择实物结算或实物净结算,且认股权证符合归类为股权的要求,则本公司将普通股权证计入 权益。归类为负债的普通股股权证于授出日按公允价值入账,并于每个资产负债表日按公允价值重新计量,抵销调整计入综合经营报表内认股权证负债的公允价值变动。归类为权益的普通股认股权证于授出日按公允价值初步计量,其后不会重新计量。
| F-14 |
新的 会计声明-最近采用
2016年9月,财务会计准则委员会发布了ASU 2016-13《金融工具-信贷损失》,以改进有关金融资产信贷损失和租赁净投资的信息,这些资产和净投资未通过净收入按公允价值入账。ASU 2016-13用反映预期信贷损失的方法取代了当前的已发生损失减值方法。2019年4月和2019年5月,财务会计准则委员会发布了ASU第2019-04号《对第326号专题《金融工具-信贷损失》、第815号专题《衍生工具与对冲》和第825号专题《金融工具》和《ASU第2019-05号》《金融工具--信用损失(专题326): 定向过渡救济》,为之前发布的ASU提供了额外的实施指导。2019年11月,FASB发布了ASU 2019-10《金融工具-信用损失(主题326)、衍生品和对冲(主题815)和租赁(主题842)》,将被证券和交易委员会定义为较小报告公司的公共申报人的生效日期推迟到2022年12月15日之后的财年,包括这些财年内的过渡期。公司 于2023年1月1日采用此ASU。采用这一ASU并未对合并财务报表和披露造成实质性影响。
2020年8月,财务会计准则委员会发布了ASU第2020-06号,债务-债务,包括转换和其他期权(分主题470-20)和衍生工具和对冲-实体自有股权合同(分主题 815-40):实体自有股权中可转换工具和合同的会计。本指南简化了可转换工具的会计 ,主要是取消了470-20分主题中现有的现金转换和受益转换模式 ,这将导致较少的嵌入转换选项独立于债务主机进行会计处理。该指引还修订并简化了与可转换工具相关的每股收益的计算。本指引适用于2021年12月15日之后开始的年度期间,包括该报告期内的过渡期,不包括较小的报告公司。对于所有其他 实体,修订在2023年12月15日之后的财年生效,包括该财年 年度内的过渡期。允许提前采用,但不得早于2020年12月15日之后开始的财政年度,包括报告期内的过渡期,使用完全或修改后的追溯方法。公司于2023年第四季度采用了此ASU。采用这一ASU并未对合并财务报表和披露造成实质性影响。
会计 公告--尚未采用
2020年3月,FASB发布ASU No. 2020—04, 参考汇率改革(主题848):促进参考汇率改革对财务报告的影响它为合同、套期保值关系、 和其他受参考汇率改革影响的交易的会计处理提供了可选的权宜之计和例外,前提是满足某些标准。ASU 2020-04中的指导是可选的,随着参考汇率改革活动的进行,可能会随着时间的推移而选择。2021年1月,FASB发布了ASU 2021-01,澄清了受贴现过渡影响的衍生品的某些可选权宜之计的范围。2022年12月,FASB发布了ASU 2022-06,将主题848的日落日期从2022年12月31日推迟到2024年12月31日,之后实体将不再被允许应用主题848中的救济。截至2023年12月31日,该公司目前正在评估该指导对其合并财务报表的影响。
注: 4-公允价值计量
按公允价值经常性计量和记录的负债包括2023年12月31日和2022年12月31日的以下负债:
| 2023年12月31日 | ||||||||||||||||
| 级别 1 | 级别 2 | 第 3级 | 公允价值 | |||||||||||||
| 负债 | ||||||||||||||||
| 或有特许权使用费债务 | $ | $ | $ | $ | ||||||||||||
| 2022年12月31日 | ||||||||||||||||
| 级别 1 | 级别 2 | 第 3级 | 公允价值 | |||||||||||||
| 负债 | ||||||||||||||||
| 或有特许权使用费债务 | $ | $ | $ | $ | ||||||||||||
账面值与公允价值接近的金融工具 包括现金及现金等价物、应收账款、预付费用和 其他流动资产、应付账款和应计费用,以及若干其他流动负债,由于其短期性质。债务 工具按公司合并资产负债表上的摊余成本计量。如果在财务报表中按公允价值计量 ,这些工具将被分类为公允价值等级中的第2级。
| F-15 |
在
估计本公司或有特许权使用费责任的公允价值时,本公司使用了
2023年9月12日和2022年12月31日的贴现现金流量法。根据公允价值等级,本公司将或然特许权使用费责任分类为
第3级,因为估值输入是基于贴现至现值的预计收入。
或有特许权使用费责任在每个结算日和2023年9月12日使用若干假设重新计量,其中包括
:1)估计销售增长,2)产品周期长度,3)专利寿命,4)贴现率(
如 附注9所述,根据修订协议,本公司终止其特许权使用费义务以换取股权。 公司将已发行普通股股份的公允价值与特许权使用费责任的账面价值(按最终公允价值计算) 之间的差额作为收益进行计量。由于大部分特许权使用费支付权证书的持有人被视为关联方, 如附注10所述,本公司将特许权使用费责任的终止记录为基于已发行股份总值以及 权益内结算收益,作为资本交易的额外支付资本。
注: 5-库存
2023年和2022年12月31日的库存 包括以下内容:
| 十二月三十一日, | ||||||||
| 2023 | 2022 | |||||||
| 原料 | $ | $ | ||||||
| 在制品 | ||||||||
| 成品 | ||||||||
| 库存储备 | ( | ) | ( | ) | ||||
| 库存,净额 | $ | $ | ||||||
| 库存,当前 | $ | $ | ||||||
| 库存,非流动 | $ | $ | ||||||
截至2023年和2022年12月31日止年度,存货减值为美元
注: 6-固定资产,净额
固定 资产净额由以下各项组成:
| 十二月三十一日, | ||||||||
| 2023 | 2022 | |||||||
| 办公设备 | $ | $ | ||||||
| 计算机和软件 | ||||||||
| 机械设备 | ||||||||
| 实验室和医疗设备 | ||||||||
| 租赁权改进 | ||||||||
| 总计 | ||||||||
| 减去累计折旧和摊销 | ( | ) | ( | ) | ||||
| 固定资产,净额 | $ | $ | ||||||
截至2023年12月31日和2022年12月31日止年度的折旧和摊销费用为$
| F-16 |
注: 7-租契
公司根据经营租约在佛罗里达州劳德代尔堡租赁了一个办公室。
公司根据经营租约在以色列租赁了一个办事处。
公司根据经营租赁车辆,这些租赁将于2026年之前的不同日期到期。
其中许多租赁
规定公司(作为承租人)支付税款、保险费、维护费用和其他费用
,这些费用在发生时计入费用。
本公司租赁组合的租赁成本和补充资产负债表信息的 组成部分如下:
| 截至十二月三十一日止的年度: | ||||||||
| 2023 | 2022 | |||||||
| 租赁费 | ||||||||
| 经营租赁(收入)成本,扣除关联方许可费 | $ | ( | ) | $ | ||||
| 可变租赁成本 | ||||||||
短期租赁成本 | ||||||||
| 总租赁成本 | $ | $ | ||||||
| 截至12月31日, | ||||||||
| 2023 | 2022 | |||||||
| 资产 | ||||||||
| 经营性租赁、使用权资产 | $ | $ | ||||||
| 负债 | ||||||||
| 当前 | ||||||||
| 经营租赁负债 | $ | $ | ||||||
| 非当前 | ||||||||
| 经营租赁负债,扣除当期部分 | ||||||||
| 租赁总负债 | $ | $ | ||||||
| 其他信息: | ||||||||
| 加权平均剩余租赁期限--经营租赁 | ||||||||
| 加权平均贴现率-经营租赁 | % | % | ||||||
公司使用直线法将经营租赁付款记录为租赁费用。公司租赁费用为美元
| F-17 |
截至2023年12月31日,根据不可撤销经营租赁的未来 最低租赁付款如下:
| 截至十二月三十一日止的年度: | 金额 | |||
| 2024 | $ | |||
| 2025 | ||||
| 2026 | ||||
| 未来最低租赁付款总额 | ||||
| 推定利息 | ( | ) | ||
| 总负债 | $ | |||
下表概述了截至2023年及2022年12月31日止年度的租赁负债计量所包括金额支付的现金:
| 截至十二月三十一日止的年度, | ||||||||
| 2023 | 2022 | |||||||
| 为计量租赁负债所包括的金额支付的现金: | $ | ( | ) | $ | ( | ) | ||
注: 8-可转换票据和长期债务
于
2021年7月16日(“生效日期”),本公司与
Kreos Capital VI(Expert Fund)LP(“Kreos贷款协议”)订立贷款融资(“Kreos贷款协议”)。根据Kreos贷款协议,贷款人将为公司提供
获得本金总额最高为美元的定期贷款。
可转换票据需要48个月仅支付利息,
| F-18 |
关于Kreos贷款协议,本公司亦于2021年7月16日向贷款人发出认股权证(“认股权证”),以购买最多
于2023年11月28日(“修订生效日期”),本公司与Kreos订立2021年贷款协议第一修正案(“第一修正案”) ,根据该协议,本公司:
| ● | 修订生效日期,第
页ID克里奥斯$ | |
| ● | 在完成第一修正案资本募集(定义如下)并紧随可转换票据证券交易所(定义如下)之后,公司付讫克里奥斯$ | |
| ● | 在完成《第一修正案》融资后,本公司将对期限为6个月的长期债务仅支付利息,并对剩余12个月支付本金和利息,直至长期债务全部偿还为止。 | |
| ● | 在根据经修订的1933年证券法(“证券法”)登记的股权融资完成后,
必须立即满足(或Kreos放弃)某些交易条件(如修正案中定义的),并且
必须不迟于2023年12月29日完成,毛收入至少为$ |
由于根据《2021年贷款协议》,《2021年贷款协议》的预期现金流变化不到10%(不是很大),因此公司认为第一修正案应被视为一项修订。此外,本公司评估新增可转换票据
证券交换功能作为股份结算赎回条款,并确定在执行第一修正案时,不需要将分流作为独立的
衍生负债。因此,公司按预期
基础计入第一修正案,并资本化$
| F-19 |
2023年12月21日,紧随本公司公开募股结束后(见附注11),根据《第一修正案》的条款,美元
公司应用清偿模型确认了第一修正案募资时可转换票据交换普通股和私募认股权证的交易
。该公司确认了债务清偿损失#美元。
该公司在第四季度记录了利息费用的调整
(包括在财务费用中,合并全面亏损表中的净额),共计美元,
截至二零二三年及二零二二年十二月三十一日止年度,贷款的利息开支如下:
| 截至十二月三十一日止的年度: | ||||||||
| 2023 | 2022 | |||||||
| 合同利息支出 | $ | $ | ||||||
| 债务发行成本摊销 | ||||||||
| 利息支出总额 | $ | $ | ||||||
截至2023年12月31日,长期债务项下的未来 本金支付如下:
| 截至12月31日止的年度, | 金额 | |||
| 2024 | $ | |||
| 2025 | ||||
| 未来本金支付总额 | ||||
| 贷款支付结束 | ||||
| 减长期债务流动部分未摊销债务发行费用 | ( | ) | ||
| 减非流动部分长期债务未摊销债务发行费用 | ( | ) | ||
| 总余额 | $ | |||
注: 9-承付款和或有事项
向IIA支付的版税
公司已通过以色列国家技术创新管理局
(简称"IIA")获得以色列国政府的赠款,用于资助其部分研发支出。截至2011年12月31日至2016年期间收到和记录的总额为美元
补助金的偿还 取决于公司正在进行的商业化和销售额,这将受到重大 风险和不确定性的影响。倘并无产生重大销售,本公司并无责任偿还该等补助。本公司已于截至2023年及2022年12月31日止年度录得 不重大开支,并于2023年及2022年12月31日录得不重大负债。
版税 版税支付权证书上的支付权
公司向 公司A系列可转换优先股(面值为美元)的原持有人发行了若干(i)特许权支付权证书(经修订)(“特许权支付权证书”)。每股(“A系列可转换优先股”和此类持有人,“证书持有人”),有权为实现某些商业化里程碑(“特许权金额”)收取某些单位数特许权使用费,以及(ii)2016年12月22日发给Aegis Capital Corp.的配售代理权使用费支付权证书(“配售代理权支付权证书”),纽约公司(“配售代理”)或其指定人,有权收取相当于支付给证书持有人的特许权使用费总额的百分比的款项(“证书付款”)。
2023年9月12日(以下简称"生效日期"),公司与大多数特许权使用费支付权证书持有人签订了一份修订协议(以下简称"修订协议") ,以取消所有证书持有人接收 特许权使用费金额的权利,以换取总计 公司普通股股份(“证书持有人证券”)。因此,配售代理付款权证书持有人接收证书 付款的权利也被取消,以换取 股份(该等股份,连同证书持有人证券, 称为“交易所证券”)。因此,自二零二三年九月十二日起,本公司同意发行合共 公司普通股的股份,以结清所有未偿还的版税支付义务。
公司将已发行普通股股份的公允价值与特许权使用费责任的账面价值(按最终公允价值计算) 之间的差额作为收益进行计量。由于大部分特许权使用费支付权证书的持有人被视为关联方, 如附注10所述,本公司根据已发行股份的总公允价值 以及权益内结算收益,将特许权使用费责任的清偿记录为资本交易的额外支付。
灭火 关于 版税 义务 | ||||
| 2022年12月31日的余额 | $ | |||
| 特许权使用费义务的估计公允价值变动 | ( | ) | ||
| 2023年9月12日余额 | ||||
| 减换取特许权使用费义务的普通股的公允价值 | ||||
| 变现收益—计入额外实缴资本 | $ | |||
注: 10-关联方交易
共享 空间协议
2020年1月,本公司与管弦乐团BioMed,Inc.签订许可协议(“共享空间协议”)。(OBIO),
以前是一个大于 公司普通股的%持有人。根据共享空间协议,公司授予OBIO许可证,允许其使用公司在佛罗里达州劳德代尔堡租赁设施中未使用的部分办公空间("房地"),以及按比例分享这些房地的公用区域,该项目之前覆盖了
约35%的房地,并将在2024年9月之前逐步扩大到约60%至70%的房地。2022年5月
,本公司签署了《共享空间协议》的修订。根据该修正案,共享空间协议涵盖的面积扩大到95%的场地,总许可费一般从大约$
版税义务的消灭
如 附注9所述,根据修订协议,本公司终止其特许权使用费义务以换取股权。OBIO 持有大部分版税支付权证书,因此批准了修订协议和结算交易所。 收到OBIO 股份作为所有未清偿特许权使用费支付义务的一部分。
| Year ended December 31, | ||||||||
| 2023 | 2022 | |||||||
| 研发 | $ | $ | ||||||
| 销售和市场营销 | ||||||||
| 一般和行政 | ||||||||
| 总计 | $ | $ | ||||||
截至2023年12月31日 ,股票期权的未摊销股份报酬为美元,加权平均识别期为 好几年了。
股票 期权和权证活动
2016年12月,本公司通过了Motus GI Holdings,Inc.2016年股权激励计划(“2016计划”)。根据《2016年计划》,公司董事会可向员工、高级管理人员、董事、顾问和顾问授予购买公司普通股、股票增值权、限制性股票、股票单位、绩效股票、绩效单位、激励奖金、其他现金奖励和其他股票奖励的期权。根据2016年计划中年度常青树条款的条款,2016年计划下可供发行的普通股数量应以每年6%的速度增长(%);但条件是,董事会可在任何日历年的第一天之前采取行动,规定该日历年不得增加,或增加的普通股数量应少于其他情况下出现的数量。2023年1月1日,根据一项年度常青条款,为未来授予保留的普通股数量增加了 个共享。根据自2024年1月1日起生效的2016年计划,公司普通股授权发行的最高股份数量为。截至2023年12月31日,有根据2016年计划可供未来授予的普通股。
| F-20 |
公司的股票期权和认股权证活动摘要如下:
| 选项 | 认股权证 | |||||||||||||||||||||||||||||||
股票 潜在的 选项 |
加权 平均值 演练 价格 |
加权 平均剩余合同寿命(年) | 平均 内在价值 | 股票 潜在的 认股权证 |
加权 平均值 演练 价格 |
加权 平均剩余合同寿命(年) | 平均 内在价值 | |||||||||||||||||||||||||
| 截至2021年12月31日的未偿还债务 | $ | $ | $ | $ | ||||||||||||||||||||||||||||
| 授与 | $ | $ | ||||||||||||||||||||||||||||||
| 过期 | ( |
) | $ | ( |
) | $ | ||||||||||||||||||||||||||
| 取消 | $ | ( |
) | $ | ||||||||||||||||||||||||||||
| 被没收 | ( |
) | $ | $ | ||||||||||||||||||||||||||||
| 截至2022年12月31日的未偿债务 | $ | $ | $ | $ | ||||||||||||||||||||||||||||
| 授与 | $ | $ | ||||||||||||||||||||||||||||||
| 已锻炼 | $ | ( |
$ | |||||||||||||||||||||||||||||
| 过期 | ( |
) | $ | ( |
) | $ | ||||||||||||||||||||||||||
| 取消 | $ | $ | ||||||||||||||||||||||||||||||
| 被没收 | ( |
) | $ | $ | ||||||||||||||||||||||||||||
| 截至2023年12月31日的未偿债务 | $ | $ | $ | $ | ||||||||||||||||||||||||||||
| 可在2023年12月31日行使 | $ | $ | ||||||||||||||||||||||||||||||
| 截至12月31日止年度, | ||||||||
| 2023 | 2022 | |||||||
| 预期期限(以年为单位) | ||||||||
| 预期波动率 | % | % | ||||||
| 无风险利率 | % | % | ||||||
| 股息率 | ||||||||
截至2023年和2022年12月31日止年度发行的股票期权的 授出日期公允价值为美元及$,分别为。
于截至二零二三年及二零二二年十二月三十一日止年度授出之认股权证乃采用柏力克—舒尔斯期权定价模式及以下加权平均假设估值:
| 截至12月31日止年度, | ||||||||
| 2023 | 2022 | |||||||
| 预期期限(以年为单位) | ||||||||
| 预期波动率 | % | % | ||||||
| 无风险利率 | % | % | ||||||
| 股息率 | ||||||||
限制性股票单位
截至2023年12月31日,有 加权平均授出日期公允价值为美元的未偿还限制性股票单位奖励. 截至2023年12月31日止年度, 受限制股票单位被释放, 取消。截至2022年12月31日, 未归属限制性股票单位奖励于授出日期的加权平均公平值为美元.
截至2023年12月31日 ,限制性股票单位的未摊销股票补偿为美元,加权平均识别期为 好几年了。
发行认股权证以购买普通股
于
2020年2月,本公司订立了一份服务协议,据此,本公司同意发行认股权证,
私人 配售产品
于
2023年5月17日,本公司与一名认可投资者订立证券购买协议,据此,本公司同意
以私募形式发行和出售总计(i) 普通股股票
,(ii)购买权证,
预出资认股权证及普通认股权证之公平值计量乃采用柏力克—舒尔斯模式厘定。分配给发行中发行的普通股的相对
公允价值为美元
此外,根据发行条款,本公司向配售代理H.C. Wainwright & Co.,有限责任公司,
购买最多13,806股公司普通股的认股权证(“配售代理认股权证”)。配售代理认股权证
可于发行日期起计五年半内行使,行使价为$
此外,关于私募,
公司于2023年5月17日与持有人签署了认股权证修订案(“认股权证修订案”),根据该修订案,公司同意修订某些现有认股权证,以购买最多总计
私募带来的净收益约为
$
2023年12月公开发行和可转换票据交换
于2023年12月18日,本公司与若干买方订立证券购买协议,据此,本公司同意以公开发售(“公开发售”)方式发行及出售合共(I)普通股,(Ii)预筹资金
认股权证,最多可购买
公募预筹资权证可予行使,直至全部行使为止,行使价为$。
公开发售认股权证之公平值计量乃采用柏力克—斯科尔斯模型厘定。分配给公开发售中发行的普通股股份的相对公允价值
为美元
作为公开发行的一部分,本公司与Alliance Global Partners(简称"A.G.P.")签订了配售代理协议,
据此,A.G.P.同意作为独家配售代理,发行及销售公开发售证券。
作为这些服务的交换,该公司向A.G.P.支付了总额为美元的现金费用
在完成公开发售时,本公司亦有义务发行H. C. Wainwright & Co.,LLC.保证
购买总额,
| F-21 |
如
附注8中所述,本公司发行了
私人认股权证之公平值之计量
乃采用柏力克—斯科尔斯模型厘定。分配给已发行普通股股份的相对公允价值低于美元,
2024年2月26日,本公司达成最终协议,立即行使由一名机构投资者持有的未行使的B系列普通认股权证, 上述发行 以购买总计 公司的普通股。详情见附注13。
于二零二一年三月,我们与Oppenheimer &
Co. Inc.订立股权分派协议(“股权分派协议”)。(“奥本海默”),据此,我们可以不时发售和出售总发行价
最高为美元的普通股
注: 12-所得税
递延 所得税反映了财务报告中资产和负债账面值 与所得税中使用的金额之间的临时差异的净影响。本公司的递延税项资产主要与其净经营亏损结转和其他资产负债表基础差异有关。根据ASC 740,“所得税”,公司记录了 估值拨备以完全抵消递延所得税资产总额,因为公司在2023年和2022年12月31日实现 与这些递延所得税资产相关的未来利益的可能性不大。
截至2023年12月31日及2022年12月31日,本公司的递延税项资产约为美元。
| 十二月三十一日, | ||||||||
| 2023 | 2022 | |||||||
| 递延税项资产: | ||||||||
| 净经营亏损结转—联邦和州 | $ | $ | ||||||
| 结转净营业损失—以色列 | ||||||||
| 基于股份的薪酬 | ||||||||
| 资本化研究与开发 | ||||||||
| 应计负债和准备金 | ||||||||
| 递延税项资产总额 | ||||||||
| 递延税项负债: | ||||||||
| 使用权资产 | ( | ) | ( | ) | ||||
| 其他 | ( | ) | ( | ) | ||||
| 递延税项负债总额 | ( | ) | ( | ) | ||||
| 减值前递延税项资产净值 | ||||||||
| 估值免税额 | ( | ) | ( | ) | ||||
| 减值准备后的递延税项资产净值 | $ | $ | ||||||
| F-22 |
截至2023年及2022年12月31日止年度的联邦法定税率与实际税率的对账如下:
| 截至12月31日止年度, | ||||||||
| 2023 | 2022 | |||||||
| 美国联邦法定税率 | % | % | ||||||
| 扣除联邦福利后的州所得税 | ||||||||
| 美国与外国的税率差异 | ||||||||
| 不可扣除的费用 | ( | ) | ( | ) | ||||
| 税收抵免 | ||||||||
| 递延税项资产调整 | ( | ) | ( | ) | ||||
| 更改估值免税额 | ( | ) | ( | ) | ||||
| 实际税率 | % | % | ||||||
公司大约有$
2017年减税和就业法案(TCJA)修改了IRC 174与2021年12月31日之后开始的纳税年度的研发相关费用。根据TCJA,公司现在必须将与研究和开发活动相关的支出资本化,并使用年中惯例在五年内摊销美国活动,在15年内摊销非美国活动。由于这是公司自2019年以来的政策,根据IRC 174,本年度研究和开发成本的净资本为$
在截至2021年12月31日的年度内,公司根据《国内收入法》第382条进行了所有权变更,导致每年的净资产使用量限制约为$
本公司截至2023年12月31日和2022年12月31日年度的NOL对账如下:
| 十二月三十一日, | ||||||||
| 2023 | 2022 | |||||||
| 美国联邦NOL | $ | $ | ||||||
| 美国NOL | ||||||||
| 以色列NOL's | ||||||||
| NOL共计 | $ | $ | ||||||
公司的联邦和州NOL为美元
公司遵循所得税不确定性会计准则,其中规定了税务状况 在财务报表中确认之前必须达到的最低门槛值。截至2023年及2022年12月31日,本公司并无任何负债以计入潜在所得税风险。公司有义务在美国联邦司法管辖区、 美国几个州和以色列提交所得税申报表。由于本公司过去有亏损,所以产生净经营亏损结转的所有以往年度都是开放的,并接受与这些年度产生的净经营亏损有关的审计检查。
注: 13-后续事件
2024年2月26日,本公司达成最终
协议,立即行使一家机构投资者持有的尚未行使的B系列普通认股权证,以购买
总计 公司的普通股股份的总收益约为$
作为本次交易的一部分,投资者同意
行使现有的B系列普通股申购权证,该权证最初于2023年12月发行,行使价
为美元。每股,修订行使价
为美元每股考虑到
立即行使现有的现金权证,公司同意向投资者发行两份新的未注册权证,每份权证都用于购买
与交易有关,公司
还同意修改,自交易完成后生效,
| F-23 |