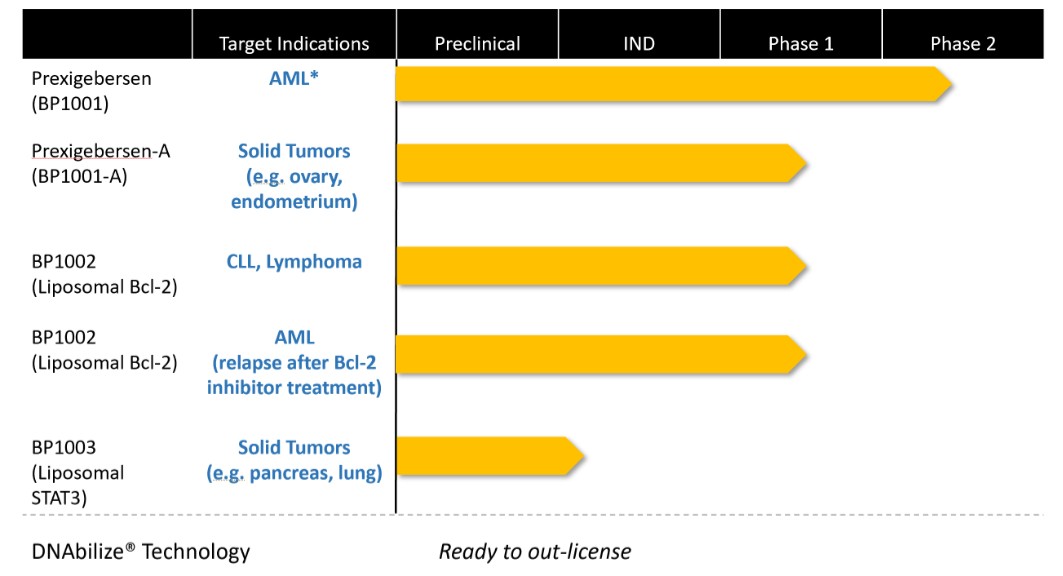
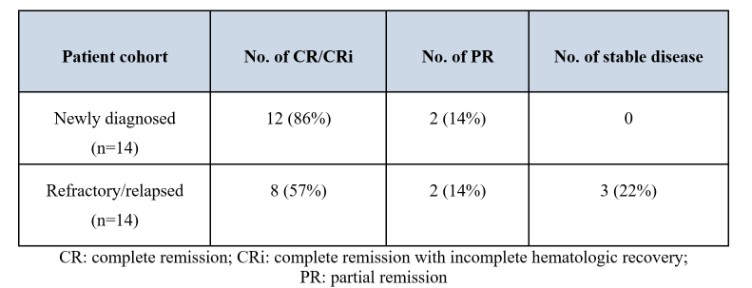
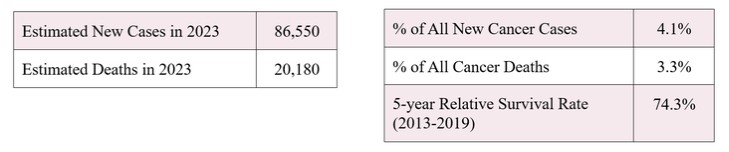
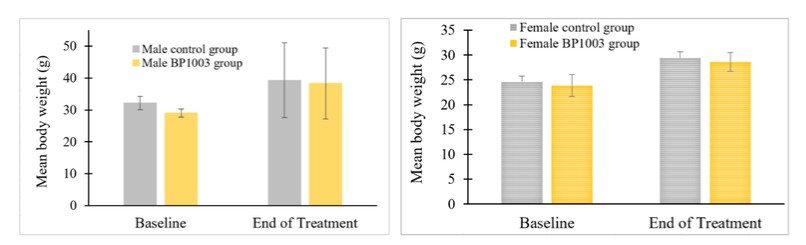
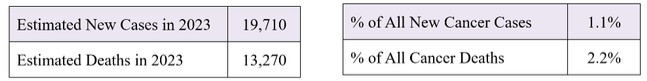
美国
美国证券交易委员会
华盛顿特区,20549
表格:10-K
(标记一)
☒根据1934年《证券交易法》第13或15(D)款提交的年度报告
截至本财年的2023年12月31日
或
☐根据1934年《证券交易法》第13或15(D)款提交的过渡报告
的过渡期 从现在开始
佣金文件编号001-36333
Bio-Path控股公司。
(注册人的确切姓名载于其章程)
| | |
特拉华州 | | 87-0652870 |
(注册成立的国家或其他司法管辖权 | | (国际税务局雇主身分证号码) |
或组织) | | |
贝莱尔大道4710号,210号套房, 贝莱尔, 德克萨斯州 | | 77401 |
(主要执行办公室地址) | | (邮政编码) |
注册人的电话号码,包括区号:(832) 742-1357
根据该法第12(B)款登记的证券:
| | | | |
每个班级的标题 | | 交易符号 | | 注册的每个交易所的名称 |
普通股,每股票面价值0.001美元 | | BPTH | | 这个纳斯达克资本市场 |
根据该法第12(G)款登记的证券:无
用复选标记表示注册人是否为证券法规则第405条所定义的知名经验丰富的发行人。是◻ 不是 ⌧
如果注册人不需要根据该法第13节或第15(D)节提交报告,请用复选标记表示。是◻ 不是 ⌧
用复选标记表示注册人(1)是否在过去12个月内(或注册人被要求提交此类报告的较短期限内)提交了1934年《证券交易法》第13节或15(D)节要求提交的所有报告,以及(2)在过去90天内是否符合此类提交要求。是 ⌧不是◻
用复选标记表示注册人是否已在过去12个月内(或在注册人被要求提交此类文件的较短时间内)以电子方式提交了根据S-T规则第405条(本章232.405节)要求提交的每个交互数据文件。是 ⌧不是◻
用复选标记表示注册人是大型加速申报公司、加速申报公司、非加速申报公司、较小的报告公司或新兴成长型公司。请参阅《交易法》第12b-2条规则中的“大型加速申报公司”、“加速申报公司”、“较小报告公司”和“新兴成长型公司”的定义。
大型加速文件服务器◻ | 加速文件管理器◻ |
非加速文件服务器⌧ | 规模较小的报告公司☒ |
| 新兴成长型公司☐ |
如果是一家新兴的成长型公司,用复选标记表示注册人是否已选择不使用延长的过渡期来遵守根据交易所法案第13(A)节提供的任何新的或修订的财务会计准则。◻
用复选标记表示注册人是否提交了一份报告,证明其管理层根据《萨班斯-奥克斯利法案》(《美国联邦法典》第15编,第7262(B)节)第404(B)条对其财务报告的内部控制的有效性进行了评估,该评估是由编制或发布其审计报告的注册会计师事务所进行的。☐
如果证券是根据该法第12(B)条登记的,应用复选标记表示登记人的财务报表是否反映了对以前发布的财务报表的错误更正。☐
用复选标记表示这些错误更正中是否有任何重述需要对注册人的任何执行人员在相关恢复期间根据第240.10D-1(B)条收到的基于激励的补偿进行恢复分析。☐
用复选标记表示注册人是否是空壳公司(如该法第12b-2条所界定)。是☐不是⌧
截至2024年3月6日,有678,795已发行和已发行的注册人普通股的股份。注册人的非关联公司持有的有表决权股票的总市值约为#美元。13,509,998.86截至2023年6月30日,也就是注册人最近完成的第二财季的最后一个工作日,基于注册人普通股在该日期在纳斯达克资本市场上报告的最后销售价格。仅就上一句而言,持有注册人普通股10%或以上的所有董事、高管和实益所有者均被视为关联公司。
通过引用并入的文件:无