

附录 99.2 VTX002 2 期溃疡性结肠炎结果 2023 年 10 月 9 日 1

前瞻性陈述 Ventyx Biosciences, Inc. (“Ventyx” 或 “公司”)提醒您,本演示文稿中有关非历史事实事项的陈述均为前瞻性陈述。这些陈述基于公司当前 的信念和期望。此类前瞻性陈述包括但不限于以下方面的陈述:Ventyx 候选产品的潜力和这些 候选产品的开发渠道的预期持续进展;以及 VTX002 在溃疡性结肠炎中的治疗和商业潜力。Ventyx不应将纳入前瞻性陈述视为其任何计划都将实现的陈述。由于 Ventyx 业务固有的风险和不确定性,实际结果 可能与本演示文稿中列出的结果有所不同,包括但不限于:临床试验的开始、注册和完成可能出现延迟; Ventyx 在产品制造、研究、临床前和临床测试方面对第三方的依赖;供应链中断,包括制造所需原材料和研究中使用的动物; 延迟临床试验的场地激活和注册;结果的临床前研究;早期临床试验不一定能预测未来的结果;中期结果不一定能预测最终结果;随着试验的继续、更多的患者数据的可用以及更全面的审计和验证程序, 一个或多个结果可能会发生实质性变化;美国和国外 国家的监管发展;Ventyx候选产品的意外不良副作用或疗效不足,可能会限制其开发、监管批准和/或商业化,或可能导致召回或产品责任索赔; Ventyx获得和维持其候选产品的知识产权保护的能力;Ventyx比预期更快地使用资本资源;乌克兰持续的军事冲突导致Ventyx的运营中断,包括临床试验的延迟;以及Ventyx先前的新闻稿和Ventyx向美国证券交易委员会提交的文件中描述的其他风险 (SEC),包括在 Ventyx 的 季度报告的第二部分第 1A 项(风险因素)中截至2023年6月30日的季度期限的10-Q表格,于2023年8月10日提交,以及随后向美国证券交易委员会提交的任何文件。提醒您不要过分依赖这些前瞻性陈述,这些陈述仅代表截至本文发布之日,Ventyx没有义务更新此类陈述以反映在本声明发布之日之后发生的事件或存在的情况。所有前瞻性陈述均受这份警告 声明的全部限制,该声明是根据1995年《私人证券诉讼改革法》的安全港条款作出的。本演示文稿包括我们从行业出版物和研究、第三方进行的 调查和研究中获得的统计数据和其他行业和市场数据,以及我们自己对潜在市场机会的估计。行业出版物和第三方研究、调查和研究通常表明,他们的信息是从被认为可靠的 来源获得的,尽管它们不能保证此类信息的准确性或完整性。我们对产品潜在市场机会的估计包括基于我们的行业知识、 行业出版物、第三方研究和其他调查的几个关键假设,这些假设可能基于少量样本,可能无法准确反映市场机会。虽然我们认为我们的内部假设是可靠的,但此类假设并未得到任何第三方的验证。由于各种重要因素,我们经营的行业面临高度的不确定性和风险,这些因素可能导致结果与 第三方和我们的估计结果存在重大差异。本演示文稿中的商标是其各自所有者的财产,仅用于信息和教育目的。2

简介 Raju Mohan,博士,创始人兼首席执行官 3

VTX002 第二阶段溃疡性结肠炎结果演讲者和参与者 Ventyx 管理团队特邀发言人兼关键人物 Martin Auster,医学博士 Chris Krueger,JD Raju Mohan,博士 William Sandborn,医学博士首席执行官、总裁兼首席医学官 胃肠病学创始人兼董事西奈山卫生系统首席执行官桑兹博士是该试验的主要研究员和带薪顾问适用于拥有公司股票和股票期权的 Ventyx Biosciences, Inc.

VTX002 第 2 期溃疡性结肠炎结果 William Sandborn,医学博士 总裁兼首席营销官 5

内容提要-溃疡性结肠炎数据的 2 期试验确立 VTX002 作为潜在的病中最佳口服药物 Ø 潜在的病中最佳口服疗效和安全性:§ 在严格和客观的结果指标上具有高度差异化的疗效 § 前所未有的完全内窥镜缓解率 § 实现内窥镜缓解/正常化是重中之重 § 卓越的安全性:§ 无房室传导阻滞或心动过速 § 无严重或 机会性感染 § 否黄斑水肿 Ø 第 2 期数据支持 VTX002 在溃疡性结肠炎中的进一步发展 6

VTX002 II 期 UC 试验设计概述关键资格标准: 终点:• 中度至重度活性 UC 患者,定义为 • 主要终点:第 13 周临床缓解,定义为修改后的 Mayo 评分的改性(3 组分)梅奥分数 • 反应不足、反应丧失和/或不耐受 • 关键次要终点:内窥镜改善;传统或晚期疗法症状缓解;组织学缓解;内窥镜改善组织学缓解主要终点基准第 52 周第 13 周 R VTX00260 mg VTX002 60 mg 患者随机分配中度至 VTX002 30 mg VTX002 30 mg 1:1:1 重度 UC(N=213)安慰剂无反应的患者 NR *开放标签延期 — VTX002 60 mg 至约 2 年注意: NCT05156125。彩信:修改后的梅奥分数;R:回复者;NR:无回复者。7

受试者倾向:试验完成率高 (N=213) * 安慰剂 (N=70) VTX002 30 mg (N=73) VTX002 60 mg (N=70) 停药停止治疗停止治疗 (N=3,4.3%) (N=3,4.1%) (N=4;5.7%) 主要原因:主要原因:疾病恶化 (n=1) 疾病 恶化 (n=1) 疾病恶化 (n=1) 不良事件 (n=2) 撤回同意 (n=1) 不合规 (n=1) 不良事件 (n=1) 调查人员决定 (n=1) 不合规 (n=1) 不合规 (n=1) 已完成 (N=66,94.3%) 已完成 (N=67,94.9%)95.7%) *协议最初允许基线 MMS 为 4 到 9 的参与者。随后对纳入标准进行了修订,允许基准MMS为5至9。对四名基线 MMS 为 4 的参与者进行了随机分组和治疗。 将这些参与者排除在主要疗效分析集合中,但包含在安全性分析集合中。彩信:修改了 8 梅奥分数。ES:梅奥内窥镜分数。RB:梅奥直肠出血分数。
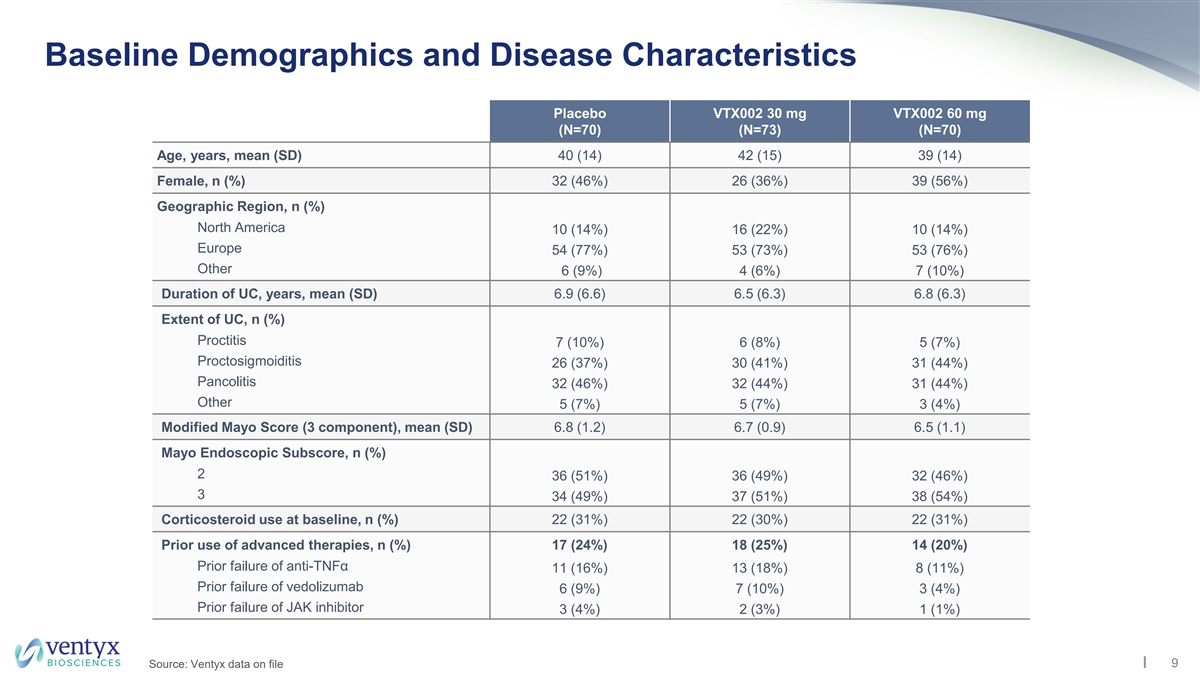
基线人口统计学和疾病特征安慰剂 VTX002 30 mg VTX002 60 mg (N=70) (N=70) (N=70) 年龄、年龄、平均值 (SD) 40 (14) 42 (15) 39 (14) 女,n (%) 32 (46%) 26 (36%) 39 (56%) 地理区域,n (%) 北美 10 (14%) 16 (22%) 10 (14%) 10 (14%) 10 (14%)) 欧洲 54 (77%) 53 (73%) 53 (76%) 其他 6 (9%) 4 (6%) 7 (10%) UC 持续时间,年份,平均值 (SD) 6.9 (6.6) 6.5 (6.3) UC 的程度,n (%) 直肠炎 7 (10%) 6 (8%) 5 (7%) 26 (37%) 30 (41%)) 31 (44%) Pancolitis 32 (46%) 32 (44%) 31 (44%) 其他 5 (7%) 5 (7%) 5 (7%) 3 (4%) 修改后的梅奥分数(3 个成分),平均值(SD)6.8(1.2)6.7(0.9)6.5(1.1)梅奥内窥镜分数,n(%)2 36(51%)36(49%)32(46%)3 34(49%)37(51%)38(54%)基线使用皮质类固醇,n(%)22(30%)22(30%)22(31%)先前使用过高级皮质类固醇疗法,n (%) 17 (24%) 18 (25%) 14 (20%) 先前抗肿瘤坏死因子α失败 11 (16%) 13 (18%) 8 (11%) vedolizumab 6 (9%) 7 (10%) 3 (4%) 3 (4%) 3 (4%) 先前失败 JAK 抑制剂 3 (4%) 2 (3%) 1 (1%) 9 来源:存档的 Ventyx 数据
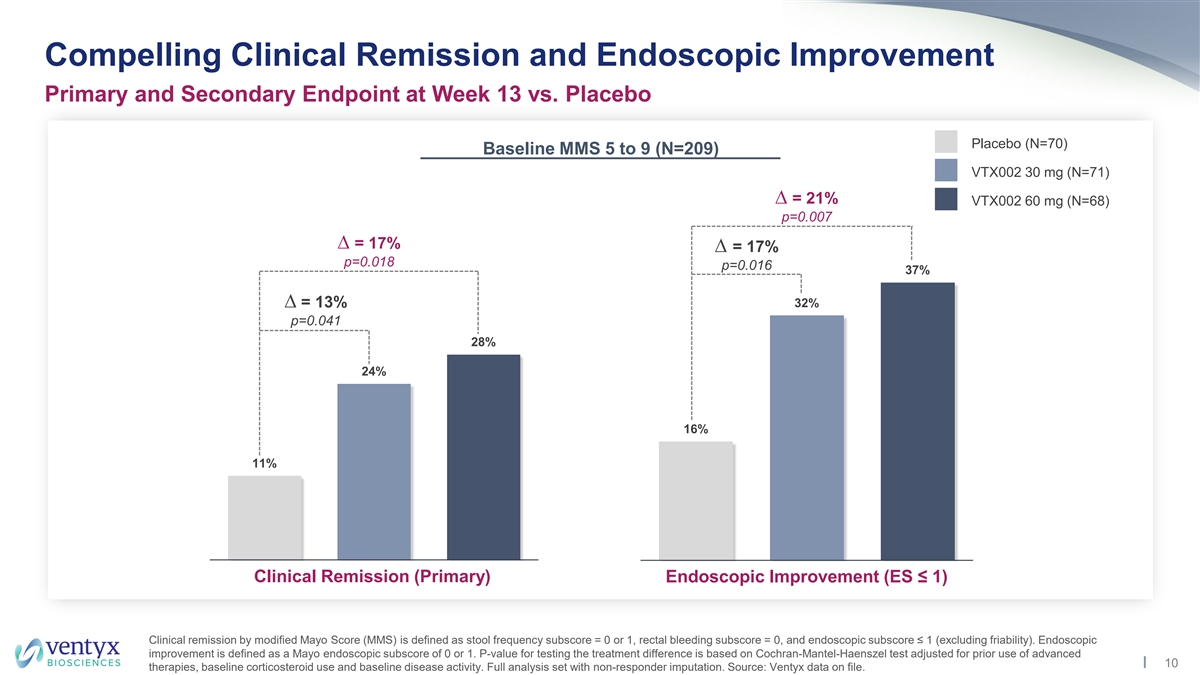
与安慰剂安慰剂(N=70)基线 MMS 5 至 9(N = 209)第 13 周的临床缓解和内窥镜改善主要和 次要终点相比,MMS 5 至 9(N = 209)VTX002 30 mg(N=71)= 21% VTX002 60 mg(N=68)p=0.007 = 17% p=0.018 p=0.016 37% = 13% 32% p=0.041 28% 24% 16% 11% 安慰剂 VTX002 VTX002 安慰剂 VTX002 VTX002 临床缓解(主要)内窥镜改善(ES ≤ 1)30mg 60mg 30mg 60mg 60mg 根据修改后的梅奥评分(MMS)进行临床缓解定义为粪便频率分数 = 0 或 1,直肠出血分数 = 0, 和内窥镜亚分数 ≤ 1(不包括脆弱性)。内窥镜改善的定义是 Mayo 内窥镜分数为 0 或 1。测试治疗差异的P值基于Cochran-Mantel-Haenszel测试,该测试根据先前使用的 高级10种疗法、基线皮质类固醇使用情况和基线疾病活动进行了调整。包含非响应者归因的完整分析集。来源:存档的 Ventyx 数据。

与安慰剂安慰剂(N=70)基线 MMS 5 至 9(N = 209)相比,第 13 周完全内窥镜缓解次要终点 的比率 前所未有的 VTX002 30 mg(N = 71)VTX002 60 mg(N=68)= 22% = 16% p=0.001 p=0.007 = 14% 29% = 10% p=0.014 p=0.046 22% 21% 16% 7% VTX002 VTX002 安慰剂 VTX002 VTX002 内窥镜缓解(ES=0)内窥镜和临床缓解 30mg 60mg 30mg 60mg 60mg 根据修改后的梅奥评分(MMS)进行的临床缓解定义为粪便频率分数 = 0 或 1,直肠出血分数 = 0,内窥镜亚分数 ≤ 1(不包括易碎性)。内窥镜缓解的定义为梅奥内窥镜分数为 0。测试治疗差异的P值基于Cochran-Mantel-Haenszel测试,该测试根据先前使用过的先进疗法、11个基线 皮质类固醇的使用情况和基线疾病活动进行了调整。包含非响应者归因的完整分析集。来源:存档的 Ventyx 数据。
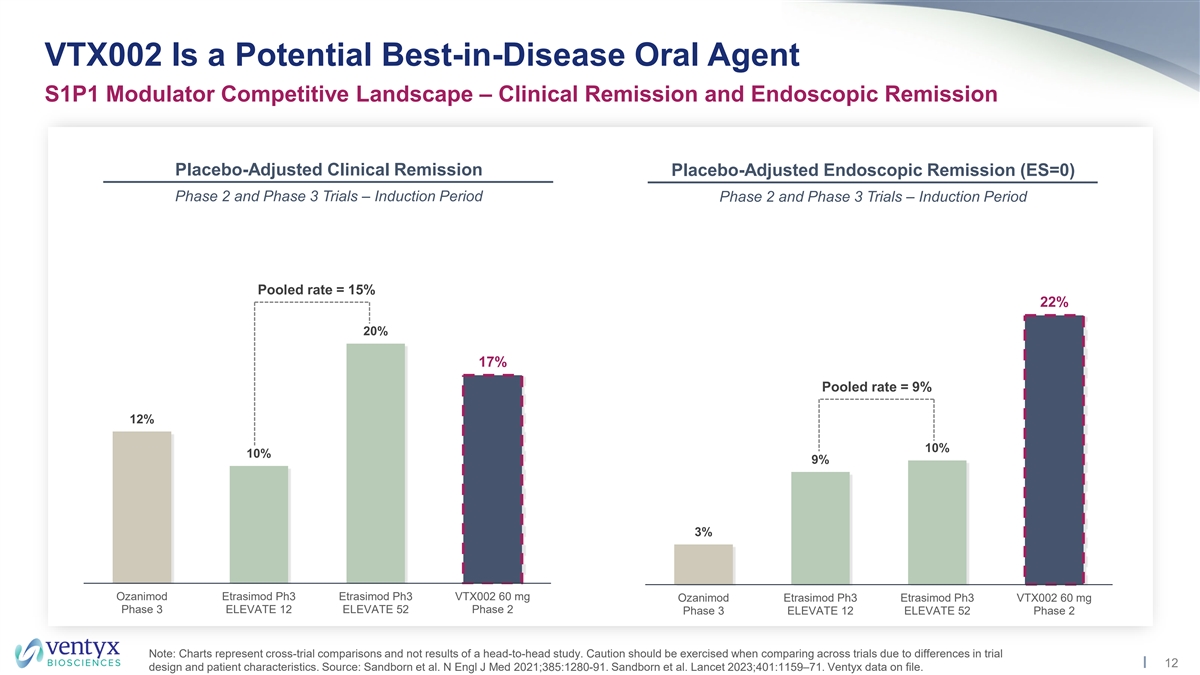
VTX002 是潜在的病中最佳口服药物 S1P1 调节剂 竞争格局 — 临床缓解和内窥镜缓解安慰剂调整后的临床缓解安慰剂调整内窥镜缓解期 (ES=0) 2 期和 3 期试验 — 诱导期 2 期和 3 期试验 — 诱导期合并率 = 15% 22% 20% 17% 合并率 = 9% 12% 10% 9% 3% Ozanimod Etramod Etramod Etramod Etramod Etramod Etramod Etramod Etramod Etramod Etramod Etramod Etrasimod ph3 ELEVATE Ph3 VTX002 60 mg Ozanimod Etrasimod ph3 Etrasimod ph3 VTX002 60 mg 第 3 期 ELEVATE 12 ELEVATE 52 第 2 阶段 3 ELEVATE 12 ELEVATE 52 第 2 阶段注意:图表代表跨试验比较,而不是正面交锋研究的结果。由于试验 12 的设计和患者特征的差异,在比较各项试验时应谨慎行事。资料来源:桑德伯恩等人。N Engl J Med 2021; 385:1280-91。桑德伯恩等人《柳叶刀》2023; 401:1159 —71。Ventyx 数据已存档。

竞争激烈的临床缓解率竞争格局 — 绝对和安慰剂调整后的临床缓解临床缓解(三组分梅奥评分)* 2 期和第 3 期试验 — 诱导期 33% 28% 27% 26% 25% 23% 10% 18% 18% 17% 29% 17% 17% 17% 15% 15% 12% 12% 11% 8% 7% 5% 4% 2% 2% O Tremfya PRA023 Xeljanz Xeljanz Rinvoq Rinvoq Ozanimod Etrasimod ph3 Etrasimod ph3 VTX002 60 mg 第 3 阶段 3 期 UC-1 第 3 阶段 UC-2 第 3 阶段 UC-1 第 3 阶段 UC-2 第 3 阶段 ELEVATE 12 ELEVATE 52 第 2 阶段 α4β7 IL-23 p19TL1A S1P1 jAki *Entyvio 临床缓解以 4 组分梅奥评分为基础;所有其他分量使用 3 组分梅奥分数。注意:图表代表跨试验比较,而不是正面交锋研究的结果。由于试验设计和患者特征的差异,在比较不同试验时应谨慎 。资料来源:丹尼斯等人。《柳叶刀》2022年;399:2113 —28。Feagan 等人N Engl J Med 2013;369:699-710。桑德伯恩等人N Engl J Med 2017;376:1723-36。桑德伯恩等人N Engl J Med 2021;385:1280-91。13 Sandborn 等人。《柳叶刀》2023; 401:1159 —71。PRA023:Danese 等人(ECCO 2023)。Tremfya:JNJ Ph3 头条新闻稿。Ventyx 数据已存档。
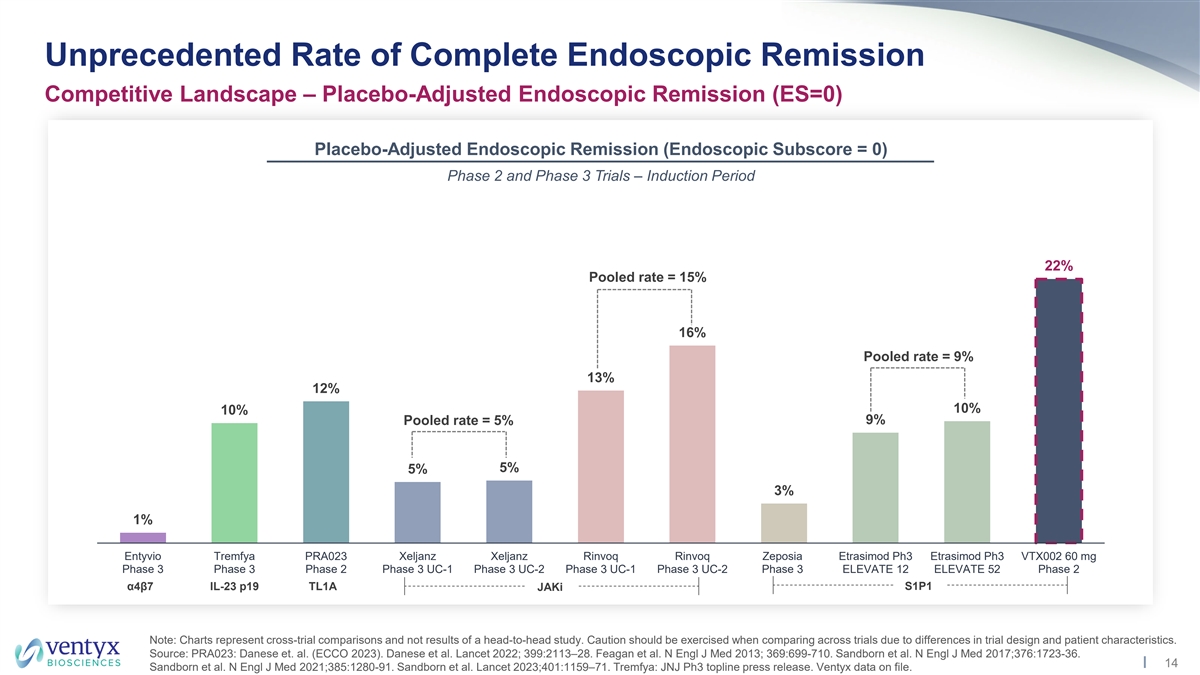
前所未有的完全内窥镜缓解率竞争力 格局 — 安慰剂调整后的内窥镜缓解率(ES=0)安慰剂调整后的内窥镜缓解率(内窥镜分数 = 0)2 期和第 3 期试验 — 引导期 22% 合并率 = 15% 16% 合并率 = 9% z 13% 12% 10% 10% 合并 率 = 5% 9% 5% 3% 1% Entyvio Tremfya PRA023 JANZ Xeljanz Rinvoq Rinvoq Zeposia Etrasimod ph3 Etrasimod ph3 VTX002 60 mg 第 3 阶段 3 期 UC-1 第 3 阶段 UC-2 第 3 阶段 UC-1 第 3 阶段 UC-2 第 3 阶段 UC-2 第 3 阶段 ELEVATE 12 ELEVATE 52 第 2 阶段 α4β7 IL-23 p19 TL1A S1P1jAki 注意:图表代表跨试验比较,而不是正面交锋研究的结果。由于试验设计和患者特征的差异,在比较试验时应谨慎行事。 来源:PRA023:Danese 等人(ECCO 2023)。丹尼斯等人《柳叶刀》2022年;399:2113 —28。Feagan 等人N Engl J Med 2013;369:699-710。桑德伯恩等人N Engl J Med 2017;376:1723-36。14 Sandborn 等人N Engl J Med 2021; 385:1280-91。桑德伯恩等人 《柳叶刀》2023;401:1159 —71。Tremfya:JNJ Ph3 头条新闻稿。Ventyx 数据已存档。
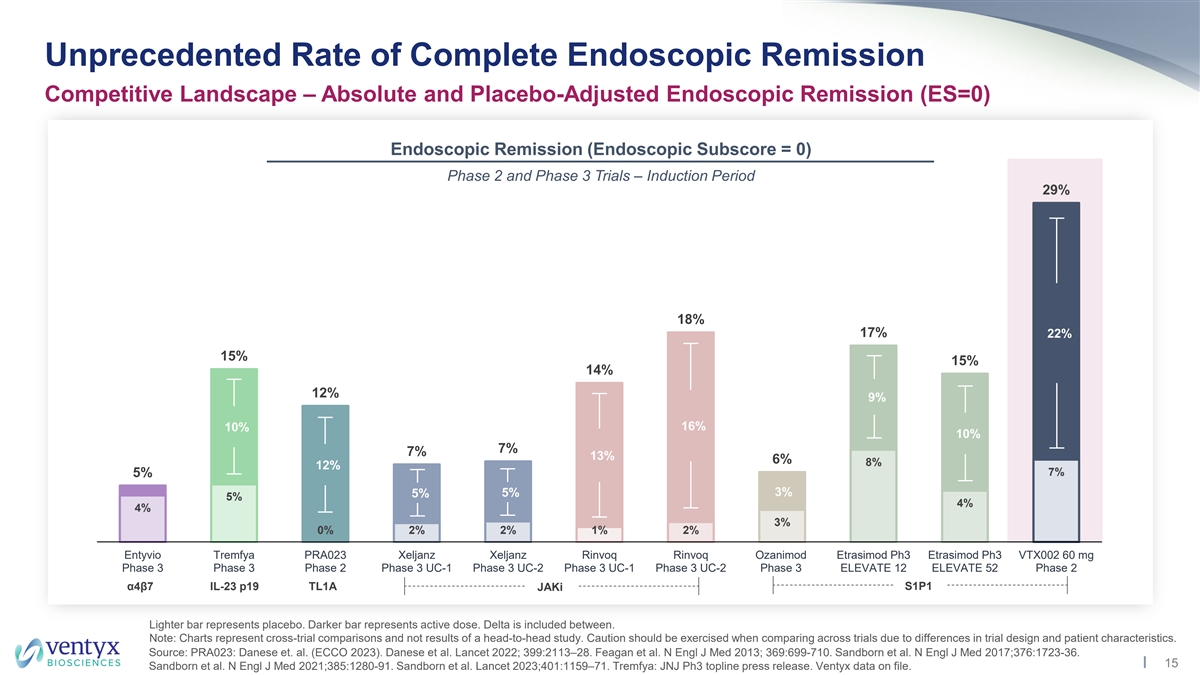
前所未有的完全内窥镜缓解率 格局——绝对和安慰剂调整后的内窥镜缓解率(ES=0)内窥镜缓解率(内窥镜分数= 0)2期和3期试验 — 引导期 29% 18% 17% 22% 27% 15% 15% 15% z 14% 22% 22% 12% 12% 9% 10% 7% 7% 13% 12% 7% 7% 7% 8% 5% 5% 4% 3% 0% 2% 2% 1% 2% Entyvio Tremfya PRA023 Xeljanz Xeljanz Rinvoq Rinvoq Rinvoq Ozanimod Etrasimod ph3 VTX002 60 mg 第 3 阶段 3 期 UC-1 第 3 阶段 UC-2 第 3 阶段 ELEVATE 12 ELEVATE 52第 2 阶段 α4β7 IL-23 p19 TL1A S1P1 jAki Lighter 棒代表安慰剂。较暗的条表示活性剂量。介于两者之间包括三角洲。注意:图表代表跨试验比较,而不是正面交锋研究的结果。由于试验设计和患者特征的差异,在比较不同试验时应谨慎 。资料来源:PRA023:Danese 等人。(ECCO 2023)。丹尼斯等人《柳叶刀》2022年;399:2113 —28。Feagan 等人N Engl J Med 2013;369:699-710。 桑德伯恩等人N Engl J Med 2017;376:1723-36。15 Sandborn 等人N Engl J Med 2021; 385:1280-91。桑德伯恩等人《柳叶刀》2023; 401:1159 —71。Tremfya:JNJ Ph3 头条新闻稿。Ventyx 数据已存档。

药效学效应与剂量反应相一致绝对 淋巴细胞数 (ALC) 与基线相比变化百分比 VTX002 30mg VTX002 60mg (N=71) (N=68) 0% • 观察到绝对淋巴细胞数 (ALC) 快速、稳健且剂量依赖性 -10% 的绝对淋巴细胞计数 (ALC) 减少了 -20% -30% • VTX002 60 mg 与前代相比实现了 差异化药效应 -40% UC 中的 50% -55% -56% S1P1 受体调节剂 -64% -60% • 对严格的 -70% -67% -67% -67% -68% 临床结果有明确的剂量反应支持 ALC -80% 以上的增量降低 -68% 的益处依曲西莫德和奥扎尼莫德达到的约 50% 水平 -90% -100% 基准第 1 周第 4 周第 8 周第 13 周第 16 周来源:存档的 Ventyx 数据。依曲莫德和奥扎尼莫德淋巴细胞数据分别来自加州大学的2期和3期试验。 绝对淋巴细胞数 (ALC) 与基线相比的百分比变化,平均值

VTX002 安全且耐受性良好 第 13 周安慰剂 VTX002 30 mg VTX002 60 mg 治疗紧急不良事件 (N=70) (N=70) (N=70) (N=70) 受试者有任何不良事件,n (%) 24 (34%) 34 (47%) 33 (47%) 与研究药物相关的不良事件,n (%) 3 (4%) 7 (10%) 11 (16%) 不良事件事件 导致研究药物停药,n (%) * 0 1 (1%) 2 (4%) † 任何严重不良事件 (SAE),n (%) 0 2 (3%) 3 (4%) SAE 与研究药物有关,n (%) 0 0 0 死亡 0 0 0 *AE 导致停药的受试者:食欲下降和 疲劳 (2 级,30 mg,与研究药物无关);头痛(2 级,60 mg);UC 恶化(3 级,60 mg,无关)。† SAE 受试者:直肠出血(3 级,30 mg,无关)、胆囊炎(3 级,30 mg,无关)、 肺水肿(3 级,60 mg,无关——高血压和糖尿病患者、肺部疾病利尿疗法可缓解水肿);溃疡性结肠炎(3 级,60 mg,无关紧要);贫血(3 级,60 mg,无关联)17 来源: 文件上的 Ventyx 数据
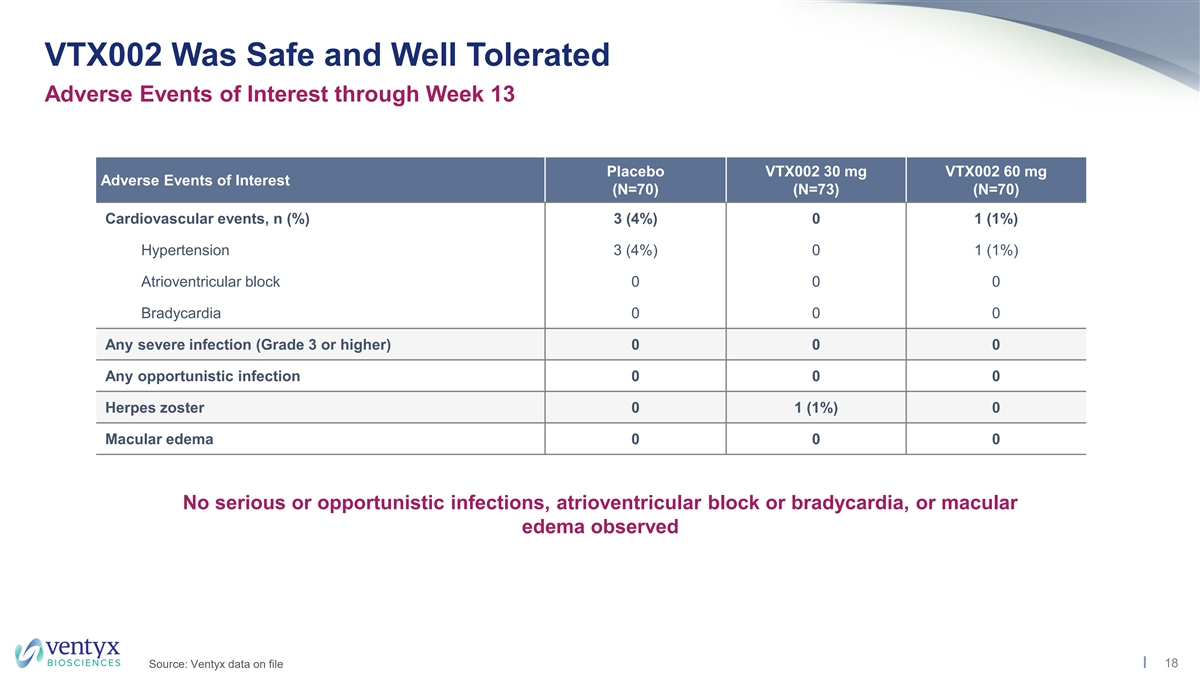
VTX002 通过 第 13 周安慰剂 VTX002 30 mg VTX002 60 mg 关注的不良事件 (N=70) (N=70) (N=70) (N=70) (N=70) 心血管事件,n (%) 3 (4%) 0 1 (1%) 高血压 3 (4%) 0 1 (1%) 房室传导阻滞 0 0 0 0 任何严重感染(3 级或 更高) 0 0 0 任何机会性感染 0 0 0 带状疱疹 0 1 (1%) 0 黄斑水肿 0 0 0 未观察到严重或机会性感染、房室传导阻滞或心动过缓或黄斑水肿 18 来源:存档的 Ventyx 数据

溃疡性结肠炎 2 期临床试验的结论 2 期数据 将 VTX002 确立为潜在的病中最佳口服药物 Ø 潜在的病中最佳口服疗效和安全性:§ 在严格和客观的结果指标上具有高度差异化的疗效 § 令人信服的临床缓解率 § 前所未有的完全内窥镜缓解率 § 实现内窥镜缓解/正常化是重中之重 § 卓越的安全性:§ 无房室传导阻滞或心动过缓 § 没有 严重或机会性感染 §无黄斑水肿 Ø 第 2 期数据支持 VTX002 在溃疡性结肠炎中的进一步发展 19

问答环节 Ventyx 管理团队和客座关键人物布鲁斯·桑兹,医学博士 西奈山卫生系统胃肠病学负责人