美国
证券交易委员会
华盛顿特区20549
附表14A
根据第14(A)节的委托书
1934年证券交易法
(修订编号:_)
选中相应的框:
|
初步委托书 |
| ☐ |
保密,仅供委员会使用(规则14a-6(E)(2)允许) |
| ☐ |
最终委托书 |
| ☐ |
权威的附加材料 |
| ☐ |
根据第240.14a-12条征求材料 |
ONCONETIX,Inc.
(其章程中规定的注册人姓名)
(提交委托书的人的姓名,如果不是注册人,则为
)
支付申请费(勾选适当的方框):
|
不需要任何费用。 |
| ☐ |
以前与初步材料一起支付的费用。 |
| ☐ |
根据交易法规则14a-6(I)(1)和0-11所要求的第25(B)项所要求的证物中的表格计算费用。 |
初稿
Onconetix,Inc.
201 E.第五街,1900套房
俄亥俄州辛辛那提,邮编45202
致Onconetix,Inc.股东:
诚挚邀请您参加Onconetix,Inc.的特别
会议(“特别会议”)。(“Onconetix”或“公司”)将通过网络直播在 [●],2024,从[●]上午,东部时间。
| |
1. |
批准并采纳Onconetix修订和重述的公司注册证书的修订案(“章程”),格式随附于随附的代理声明附件A(“反向股票分割修正案”),以实现公司普通股的所有流通股的反向股票分割,每股面值0.00001美元(“普通股”),比例范围为1比30至1比60,该比例由Onconetix董事会(“董事会”)确定(“反向股票分割提案”); |
| |
2. |
根据纳斯达克上市规则第5635条,批准在转换公司A系列优先股(每股面值0.00001美元)(“A系列优先股”)后,发行最多5,709,935股普通股(可调整)(“A系列转换提案”); |
| 3. | 根据纳斯达克上市规则第5635条,批准
发行:(i)269,672,900股普通股将在公司B系列优先股转换时发行,每股面值0.00001美元(“B系列优先股”)和(ii)该数量的普通股将由公司发行的500万美元的私募融资单位(“PMX融资”),最初应包括20,000,000股普通股
和最多6,000,000股普通股相关认股权证(可调整),加上在满足某些价格保护条件后可发行的额外普通股
数量,如本文进一步描述
(“PMX发行提案”); |
| 4. | 批准董事会任命CornerAmper LLP(“CornerAmper”)为公司
截至2024年12月31日的财年的独立注册会计师事务所(“审计师批准提案”);
以及 |
| 5. | 如有必要或适当,批准特别会议延期,如果在特别会议召开时没有足够的票数批准反向股票
拆分提案、A系列转换提案、PMX发行提案或审计师批准提案(“延期
提案”),则征求额外的
代理人。 |
董事会已将营业时间定为[●],
2024年作为特别会议的记录日期(“记录日期”),只有截至记录日期
持有Onconetix普通股的股东才有权在特别会议及其任何休会和延期会议上投票。
Onconetix董事会一致认定并决定,反向股票分割提案、A系列转换提案、PMX发行提案、审计师
批准提案和延期提案对Onconetix及其股东来说是明智和公平的,并符合其最佳利益,
并已批准反向股票分割修正案,但须经股东批准。因此,Onconetix
董事会一致建议Onconetix股东对上述每项提案投“赞成”票。
你的投票很重要。关于Onconetix和特别会议的更多信息
包含在随附的代理声明中。我们鼓励您完整阅读随附的
委托书。
| |
非常真诚地属于你, |
| |
|
| |
/S/拉尔夫·希斯博士 |
| |
Ralph Schiess博士 |
| |
临时行政总裁 |
随附的委托书注明日期[●],2024,这是第一个邮寄给Onconentix股东的邮件,大约在[●], 2024.
Onconetix,Inc.
201 E.第五街,1900套房
俄亥俄州辛辛那提,邮编:45202
特别会议的通知
个股东
待扣留[●], 2024
致Onconentix,
Inc.的股东:
特此通知,位于特拉华州的公司Onconentix,Inc.(以下简称“Onconentix”或“公司”)的股东特别会议(简称“特别会议”)将于网上直播。[●],2024,从[●]东部时间上午。诚挚邀请您参加本次特别会议,会议的目的如下:
| |
1. |
批准并通过一项修订后的公司注册证书(“约章”),以附件A所附的委托书形式(“反向股票拆分修订”)对本公司所有已发行普通股进行反向股票拆分,每股面值0.00001美元的普通股(“普通股”)按30股1股至60股1股的比例进行反向股票拆分,比例由董事会决定(“反向股票拆分方案”); |
| |
2. |
根据纳斯达克上市规则第5635条,批准在转换公司A系列优先股(每股面值0.00001美元)(“A系列优先股”)后,发行最多5,709,935股普通股(可调整)(“A系列转换提案”); |
| 3. | 根据纳斯达克上市规则第5635条,批准
发行:(i)269,672,900股普通股将在公司B系列优先股转换时发行,每股面值0.00001美元(“B系列优先股”)和(ii)该数量的普通股将由公司发行的500万美元的私募融资单位(“PMX融资”),最初应包括20,000,000股普通股
和最多6,000,000股普通股相关认股权证(可调整),加上在满足某些价格保护条件后可发行的额外普通股
数量,如本文进一步描述
(“PMX发行提案”); |
| 4. | 批准董事会任命CornerAmper LLP(“CornerAmper”)为公司
截至2024年12月31日的财年的独立注册会计师事务所(“审计师批准提案”);
以及 |
| 5. | 如有必要或适当,批准特别会议延期,如果在特别会议召开时没有足够的票数批准反向股票
拆分提案、A系列转换提案、PMX发行提案或审计师批准提案(“延期
提案”),则征求额外的
代理人。 |
提案在随附的
委托书中进行了说明,我们鼓励您在投票前阅读全文。只有在收盘时持有普通股记录的持有者[●]2024的成员有权获得特别会议的通知,并有权在特别会议以及特别会议的任何休会或延期上投票和点票。在股东特别大会召开前十天内,可在股东大会上投票的完整股东名单将于股东大会前于Onconentix的主要执行办事处
备妥,供股东于正常营业时间内查阅,以供股东查阅,以供股东于任何与特别会议有关的目的查阅。
Onconentix董事会一致建议Onconentix股东投票支持上述每一项提议。
董事的一名或多名董事的任何财务和个人利益的存在可能会导致董事(S)在决定建议股东投票支持提案时,
他/她或他们认为对安康泰克斯及其股东最有利的
与他/她或他们认为对他/她或他们最有利的
之间的利益冲突。见标题为“”的部分Onconentix董事和高管在提案中的利益“在随附的委托书中,进一步讨论这一问题。
假设出席特别会议的股东人数达到法定人数,
(I)批准股份反向分拆建议须获得有权就该建议投票的Onconentix普通股过半数流通股持有人的
赞成票,及(Ii)其他建议需要有权在特别会议上就此事投赞成票的出席股东或其代表所投的多数赞成票。无论您是否计划虚拟出席特别会议,请使用随附的代理卡中包含的说明,通过互联网或电话通过代理投票,或立即填写您的代理卡并将其放入已付邮资的信封中交回,以便授权您代理卡上指定的个人在特别会议上投票您持有的Onconentix普通股
。如果您通过经纪、银行或其他代名人以“街道名称”(而不是以登记持有人的身份)持有您的股票,请按照您的银行、经纪或代名人提供的投票指示表格上的说明投票您的股票。有权在特别大会上投票的Onconentix股东名单将于正常营业时间内于Onconentix总部
供任何与特别会议有关的股东查阅,查阅时间至少为特别大会召开前十天。股东名单也将在特别会议期间通过特别会议网站查阅。
无论您是否计划参加特别会议,请尽快通过特别会议网站进行投票。如果您以后出于任何原因想要撤销或更改您的委托书,您可以按照随附的委托书中所述的方式进行。有关正在表决的提案、换股协议、PMX交易、委托书的使用和其他相关事项的更多信息,请阅读随附的委托书声明。
| |
根据董事会的命令, |
| |
|
| |
/S/拉尔夫·希斯博士 |
| |
Ralph Schiess博士 |
| |
临时行政总裁 |
| |
Onconetix,Inc. |
如果您退回您的代理卡,但没有说明您希望如何投票,您的股票将投票赞成每一项提案。
此委托书的日期为[●],2024和
首先邮寄给Onconentix的股东大约[●], 2024.
目录
| |
|
页面 |
| 对其他信息的引用 |
|
II |
| 关于前瞻性陈述的警告性声明 |
|
三、 |
| 常见问题 |
|
四. |
| 摘要 |
|
1 |
| PMX交易和相关融资的说明 |
|
4 |
| 交易的当事人 |
|
10 |
| 关于合并后公司业务的信息 |
|
11 |
| PROTEOMEDIX业务说明
|
|
18 |
| Onconentix管理层对财务状况和经营结果的讨论与分析 |
|
28 |
| PROTEOMEDIX管理层对财务状况和经营成果的讨论与分析 |
|
34 |
| PMX交易的背景 |
|
44 |
| 风险因素 |
|
62 |
| 未经审计的备考综合财务信息 |
|
76 |
| 未审计备考合并财务信息附注
|
|
81 |
| 特别会议 |
|
84 |
| 方案1:反向股票拆分方案 |
|
89 |
| 建议2:A系列转换建议 |
|
97 |
| 提案3:PMX发行提案 |
|
98 |
| 提案4:审计员批准提案 |
|
100 |
| 提案5:休会提案 |
|
102 |
| 董事及行政人员在建议书中的利益 |
|
103 |
| 合并后公司的管理 |
|
104 |
| 合并后公司的证券说明 |
|
109 |
| 证券的实益所有权 |
|
111 |
| 股东提案 |
|
112 |
| 代理材料的入库 |
|
112 |
| 在那里您可以找到更多信息 |
|
113 |
| 附件A |
|
A-1 |
| 附件B |
|
B-1 |
| 附件C |
|
C-1 |
对其他信息的引用
随附的委托书包含有关安康泰的重要商业和财务信息,这些信息来自安康泰提交给美国证券交易委员会(“美国证券交易委员会”)的其他文件,这些文件没有包含在附带的委托书中,而是通过引用并入附带的委托书。有关在随附的委托书中通过引用并入的文件列表,请参阅您可以在哪里找到更多信息
“您可以通过美国证券交易委员会的网站www.sec.gov免费查看这些信息。
您可以免费通过书面请求向以下联系人索要随附的委托书、通过引用并入随附的委托书中的任何文件或安康提交给美国证券交易委员会的其他信息的副本
:
Onconentix,Inc.
注意:首席财务官布鲁斯·哈蒙
电子邮件:bharmon@onconentix.com
第五街201 E号,1900号套房
俄亥俄州辛辛那提,邮编:45202
为了使您能在Onconetix股东特别会议召开之前
及时收到文件, [●],2024年,称为
“特别会议”,您必须在 [●], 2024.
如果您对特别
会议有任何疑问或需要获得代理卡或其他信息,请联系Onconetix的代理律师,电话:
[●]
SEC、Onconetix、
Proteomektop或任何其他实体网站的内容不包含在随附的委托书中。有关如何获得
这些网站上随附的代理声明中引用的某些文件的信息仅为您提供方便。
关于前瞻性陈述的警示声明
This proxy statement, and the documents incorporated
by reference into this proxy statement, includes certain “forward-looking statements” within the meaning of, and subject to
the safe harbor created by, Section 27A of the Securities Act, Section 21E of the Exchange Act and the Private Securities
Litigation Reform Act of 1995, which are referred to as the “safe harbor provisions.” Statements contained or incorporated
by reference in this proxy statement that are not historical facts are forward-looking statements, including statements regarding Onconetix’s
or Proteomedix’s business and future financial and operating results, and other aspects of Onconetix’s or Proteomedix’s
operations or operating results. Words such as “may,” “should,” “will,” “believe,” “expect,”
“anticipate,” “target,” “project,” and similar phrases that denote future expectations or intent regarding
Onconetix’s or Proteomedix’s financial results, operations, and other matters are intended to identify forward-looking statements
that are intended to be covered by the safe harbor provisions. Investors are cautioned not to rely upon forward-looking statements as
predictions of future events. The outcome of the events described in these forward-looking statements is subject to known and unknown
risks, uncertainties, and other factors that may cause future events to differ materially from the forward-looking statements in this
proxy statement, including:
| ● | 与Onconetix普通股市场价值波动相关的风险,包括由于Onconetix普通股长期价值的不确定性或由于更广泛的股票市场波动造成的风险; |
| ● | 因转换任何
系列A或系列B优先股而获得Onconetix普通股的Onconetix股东将拥有与其当前优先
股东权利不同的Onconetix普通股股东权利; |
| ● | 我们将ENTADFI和Procarlix商业化并将收购的资产和商业运营
整合到Onconetix业务中的能力; |
| |
● |
Onconetix或Proteomerase的业务中断,可能对其各自的业务和财务业绩产生不利影响;以及 |
| ● | 本委托书中的未经审计的形式简明
合并财务信息仅用于说明目的,可能无法反映Onconetix和Proteomerase合并的经营
结果和财务状况。 |
本委托书中包含的前瞻性陈述
还受到其他风险、不确定性和因素的影响,包括本委托书中包含的Onconetix财务报表
以及Onconetix最新的10-K表年度报告和10-Q表季度报告
以及他们中任何一方不时向SEC提交的其他文件中描述的风险、不确定性和因素。参见标题为“在那里您可以找到更多信息
.”
本
报告中包含的前瞻性陈述仅在本报告发布之日做出。Onconetix不承诺更新、更改或修订本报告中
的任何前瞻性陈述,以反映本报告日期后的事件或情况,或反映新信息或意外
事件的发生,除非法律要求。
常见问题
以下问题和回答
简要回答了您作为Onconetix股东可能对特别会议上考虑的事项提出的一些问题。
请您仔细阅读本委托书及本委托书中提及的其他文件,因为
本节可能无法提供有关这些事项的所有重要信息。有关特别会议的重要信息摘要
,请参阅“摘要”。其他重要信息包含在本委托书的附件和通过引用并入本委托书的文件中。您可以按照标题为“您可以在哪里找到更多信息”的部分中的说明免费获得本委托书中引用的信息。
为什么我会收到这份委托书?
我们向您发送此委托声明,因为我们的董事会正在征求您的
代理人在Onconetix举行的特别会议上投票,以寻求股东对本文
中进一步详细描述的某些事项的批准。本委托书概述了您在特别会议上投票所需的信息。您不需要参加特别
会议就可以投票。
投票表决的是什么?
我们要求您对五项提案进行
投票:
|
1. |
批准并通过反向股票分割修正案,以实现我们普通股所有流通股的反向股票分割,比例范围为1比30至1比60,该比例由董事会确定; |
| |
2. |
根据纳斯达克上市规则第5635条,批准在转换公司A系列优先股后发行至多5,709,935股普通股(可调整),每股面值0.00001美元; |
| 3. | 根据纳斯达克上市规则第5635条,批准
发行:(i)在转换B系列优先股时发行的269,672,900股普通股,以及(ii)公司在PMX融资中发行的普通股数量,最初应包括20,000,000股普通股和
最多6股,单位中包含的000,000股普通股相关认股权证(可调整),加上在满足某些价格保护条件后可发行的
股普通股的额外数量,如本文进一步所述; |
| 4. | 批准董事会任命CornerAmper为公司截至2024年12月31日财年的独立注册公共会计师事务所;以及 |
| 5. | 如有必要或适当,批准特别会议休会,如果在特别会议时没有足够的票数批准反向股票
拆分提案、A系列转换提案、PMX发行提案或审计师批准提案,则征求额外的
代理人。 |
这份委托书和随附的
材料计划何时发送给股东?
在或在附近[●],2024年,我们将开始邮寄
我们的代理材料,包括特别会议通知、本代理声明和随附的代理卡,或者,对于以街道名称持有的股票
(即,由经纪或其他代名人代阁下持有的股份)、投票指示表格。
特别会议将在何时何地举行
?
特别会议将通过
仅限音频的网络直播以虚拟方式举行, [●],2024,从[●]上午,东部时间。不会有物理会议地点。
Onconetix股东将能够通过访问 www.w.[●].com,
称为“特别会议网站”。为了虚拟出席特别会议并在会上投票,您需要
代理卡上的16位控制号码。如果您以“街道名称”持有您的普通股股份,则只有在您从经纪公司、银行、交易商或
其他类似组织、受托人或指定人处获得特定控制编号并赋予您投票权的情况下,您才可以
虚拟出席特别会议并在特别会议上投票。
特别会议的记录日期是什么时候?
确定有权在特别会议上投票的股东的记录日期为[●],2024年,我们称之为“创纪录之日”。
谁有权在特别会议上投票?
所有在交易日收盘时持有Onconentix普通股的股票的记录持有人[●]2024年,也就是记录日期,有权收到特别会议的通知并在会议上投票。不需要通过特别会议网站虚拟出席特别会议即可投票。见下文和
标题为“特别会议--表决方法“有关如何在没有
实际出席特别会议的情况下投票的说明。
我的投票有意义吗?
是的,无论您持有多少股份,您的投票都非常重要。
Onconentix董事会如何建议我在特别会议上投票?
Onconentix董事会一致建议Onconentix股东投票支持每一项提议。
我为什么要投票支持反向股票拆分方案
?
2023年9月18日,我们收到了纳斯达克工作人员的通知,通知指出,根据普通股连续30个工作日的收盘价计算,我们
没有遵守纳斯达克上市规则第5550(A)(2)条(“投标价格规则”)中规定的继续在纳斯达克上市必须保持每股1.00美元的最低投标价格的要求。从2023年9月18日或到20年3月16日,我们有180天的时间
重新遵守投标价格规则。
为了重新遵守投标价格规则并获得在纳斯达克资本市场继续上市的资格,我们普通股的每股收盘价必须在2024年3月16日或之前的至少连续10个工作日至少为1.00美元。纳斯达克员工保留延长这10个工作日的自由裁量权,以确定公司已证明有能力保持长期合规。
如果我们未能在2024年3月16日之前重新遵守投标价格规则,但符合纳斯达克初始上市的所有其他适用标准(投标价格规则除外),则我们可能有资格再获得180个日历日,或直到2024年9月12日,以重新遵守投标价格规则。
如果我们在合规期(或第二个合规期
期限,如果适用)结束前未能重新遵守投标价格规则,则我们的普通股将被退市。如果吾等收到本公司普通股将被摘牌的通知,《纳斯达克上市规则》允许吾等就纳斯达克的摘牌决定向聆讯小组提出上诉,但不能
保证小组会批准本公司继续上市的请求。
董事会认为,股东
未能批准反向股票拆分修正案可能会阻止本公司遵守投标价格规则,并可能(其中包括)抑制我们进行融资活动的能力。如果纳斯达克股票市场将普通股退市,那么普通股很可能会在场外交易市场交易,例如场外交易市场集团公司,它没有像纳斯达克股票市场那样的实质性
公司治理或继续上市的量化要求。在这种情况下,对普通股的兴趣可能会下降,某些机构可能没有能力进行普通股交易,所有这些都可能对普通股的流动性或交易量产生重大不利的
影响。如果普通股因从纳斯达克股票市场退市而导致流动性大幅下降,公司股东可能没有能力在需要的时候变现他们在普通股的投资
,公司认为其维持和获得分析师报道、吸引投资者兴趣以及获得资金的能力可能会因此大大降低。
我为什么要投票支持A系列转换方案
?
我们受纳斯达克规则的约束,因为我们的普通股目前在纳斯达克资本市场上市。
根据纳斯达克第5635(A)条,公司就收购另一公司的股票或资产而发行普通股(或可转换为普通股或可行使普通股的证券)之前,如果由于现有或潜在发行普通股,包括根据赚取拨备或类似类型的拨备发行的
股票,或可转换为或可行使普通股的证券,则必须获得股东批准。除公开发行现金外:(A)普通股在发行时具有或将具有相当于或超过发行前已发行投票权的20%的投票权;或可转换为普通股或可行使普通股的证券;或(B)
将发行的普通股数量等于或将等于或超过股票或证券发行前已发行普通股数量的20%。
结合在PMX交易中发行的股份和在PMX融资中可发行的股份,A系列优先股转换后可发行的股份将导致
A系列优先股发行时超过20%的投票权和已发行普通股数量
。由于上述原因,根据纳斯达克第5635(A)条,A系列指定证书规定,A系列优先股不得转换为普通股,直到我们获得股东批准移除它们
,如中所述。建议2:A系列转换建议.”
如果股东不批准A系列转换建议,公司将不能兑现Veru Inc.(“Veru”)持有的A系列优先股的任何转换(见“有关合并后公司业务的信息
-近期收购-ENTADFI”).
为什么我要投票支持PMX的发行方案?
如上所述,根据纳斯达克第5635(A)条,在本公司发行与收购另一公司的股票或资产有关的普通股(或可转换为普通股或可行使普通股的证券)之前,
必须获得股东批准,如果由于目前或潜在发行普通股,包括根据获利条款或类似类型的条款发行的股票,或可转换为普通股或可行使普通股的证券,除公开发行现金外:(A)普通股在发行时具有或将具有投票权,等于或超过发行前已发行的可转换为普通股或可行使普通股的证券的投票权的20%。或(B)拟发行的普通股数量等于或将等于或超过股票或证券发行前已发行普通股数量的20%。
结合A系列优先股转换后可发行的股份和在PMX交易中发行的普通股,在转换B系列优先股时可发行并在PMX融资中发行的股份将导致发行超过20%的投票权和截至发行时的已发行普通股数量
(I)PMX融资中的股票和B系列优先股。
如果股东不在2025年1月1日之前批准PMX发行提议,本公司有义务将B系列优先股的股份赎回为现金,如“提案3:PMX发行提案.”
如果股东不批准PMX发行方案,本公司将无法完成PMX融资。
我为什么要投票支持审计师批准提案
?
自2023年7月以来,EisnerAmper一直是该公司的独立注册会计师事务所。我们的审计委员会和董事会认为,在我们推进业务计划的过程中,公司审计师的稳定性和连续性非常重要。
我为何要投票赞成休会建议呢?
如果休会建议未获批准,如果在特别会议举行时没有足够的票数批准反向股票拆分建议、A系列转换建议、PMX发行建议或审计师批准建议,则在必要或适当的情况下,Onconentix董事会可能无法将特别会议推迟到另一个时间和地点,以允许
征集额外的代表。
如果股东不批准PMX发行提议,他们是否有能力解除PMX交易?
不,PMX交易于2023年12月15日完成,股东批准PMX发行方案不是完成PMX交易的条件。如果股东
在2025年1月1日之前没有批准将B系列优先股转换为普通股,则在
股东提出该持有人对B系列优先股的若干股票进行现金结算的请求时,公司应向持股人支付现金,金额等于(I)请求中所列B系列优先股的公允价值(定义见下文)乘以(Ii)在向Onconentix提交请求的交易日有效的换股比率(在B系列优先股指定证书中定义)。
股票的“公允价值”应参考普通股主要交易市场上最后报告的收盘价确定。
相关PMX融资的完成
取决于收到股东对PMX发行建议的批准。
什么是代理?
委托书是股东的法定名称
,由另一人代表股东投票表决该股东持有的股份。如果您是记录股东,您可以按照随附的代理卡中提供的说明通过互联网或邮寄方式进行投票,或者,如果您是Onconentix记录股东,则可以通过电话进行投票。如果您通过经纪商、银行或其他代理人以“街名”实益持有股票,您应
遵循您的经纪商、银行或其他代理人提供的投票指示。
我在特别会议上有多少票?
每名Onconentix股东有权在记录日期营业结束时就每股登记在册的普通股股份的每一项提案投一票。在记录日期的营业结束时,有[●]已发行普通股。
什么构成特别会议的法定人数?
法定人数是召开有效会议所需
代表的最低股份数,无论是通过虚拟出席还是通过代理代表。
持有三分之一的已发行和流通
普通股并有权在特别会议上投票的股东必须亲自出席或由代理人代表出席,以构成特别会议事务处理的法定人数。虚拟出席特别会议将构成亲自出席,以确定出席特别会议处理事务的法定人数。弃权将
计为出席并有权投票的票数,以确定出席
特别会议处理事务的法定人数。
由于审计师批准提案
被视为常规事项,因此,如果经纪人、银行或其他被提名人没有收到投票指示,则通过经纪人、银行或其他被提名人以“街道名称”持有的股票将被视为
出席,以确定是否存在法定人数 在这样的提议下。
如何在特别
会议上投票?
以您作为Onconetix
记录股东的名义直接持有的股份可通过特别会议网站在特别会议上投票,网址为 www.w.[●].com。您将需要代理卡上包含的
16位控制编号,才能访问特别会议网站并进行投票,如
标题为“特别会议-虚拟出席特别会议。”
如果您通过股票经纪人、
代理人、受托人或其他托管人持有股票,您也可以通过Broadridge Financial Solutions(“Broadridge”)
提供的计划进行投票,该计划提供互联网投票选项。如果您的股票是在参与Broadridge
计划的经纪公司或银行的账户中持有的,您将有机会选择通过互联网投票。通过Broadridge计划
通过互联网提交的投票必须在美国东部时间2016年12月29日晚上11:59之前收到。 [●],2024年。参见标题为“特别会议-虚拟
出席特别会议.”
即使您计划通过特别会议网站虚拟出席特别
会议,Onconetix也建议您按照下文所述提前通过代理投票,以便在您后来决定不参加或无法虚拟出席特别会议时,您的投票将被计算在内。
有关虚拟出席
特别会议的其他信息,请参阅标题为“特别会议.”
我如何在实际上不参加特别会议的情况下投票?
无论您是作为Onconetix记录的股东
直接持有您的股份,还是以“街道名称”受益,您都可以通过代理人直接投票,而无需实际参加
特别会议。
如果您是记录在案的股东,您可以通过代理投票:
| ● | 一周七天,每天24小时上网,直到晚上11点59分。东部时间开始[●],
2024(访问网站时手持代理卡); |
| ● | 按照您的代理卡上的说明打电话,直到晚上11:59。东部时间
On[●],2024(打电话时手持代理卡);或 |
如果您以“Street
的名义”实益持有股票,您应该遵循您的银行、经纪人或其他被提名人提供的投票指示。如果您通过股票经纪人、代理人、受托人或其他托管人持有您的股票,您还可以通过Broadbridge提供的提供
互联网投票选项的程序进行投票。如果您的股票在参与Broadbridge计划的经纪公司或银行的账户中持有,您
将有机会通过互联网选择投票。通过Broadbridge计划通过互联网提交的投票必须在晚上11:59之前
收到。东部时间开始[●], 2024.
有关投票程序的其他信息,
请参阅标题为“特别会议.”
在特别会议上批准每一项提案需要多少股东投票?
反向股票拆分建议的批准需要普通股持有者投赞成票,普通股持有者至少占有权投票的普通股流通股的大多数。
A系列转换方案、PMX发行方案、审计师批准方案和休会方案需要有权在特别会议上就此事进行表决的股东在实际出席或委派代表出席的股东所投的多数票中投赞成票。
什么是“经纪人无投票权”?
根据纳斯达克规则,银行、经纪商和其他被提名人
可以使用其自由裁量权,就被视为“例行”事项但不涉及“非例行”事项的“无指示”股份(即银行、经纪商或其他被提名人持有的股份,但此类股份的实益所有人未就如何就特定提案投票提供指示的股份)
投票。除审计员批准提案外的所有提案
都是“非常规”事项。
如果(I)经纪人、银行或其他被提名人有权对一个或多个将在股东会议上表决的提案进行表决,但在没有股票实益所有人指示的情况下不得就其他提案进行投票,以及(Ii)受益所有人未向经纪、银行或其他被提名人提供此类指示,则发生“经纪人无投票权”
。审计师的批准提案是Onconentix预计将有经纪人无投票权的唯一事项。
如果我在特别会议上没有对每个提案进行投票或投弃权票,会发生什么情况?
弃权代表股东
拒绝对提案进行投票的肯定选择。如果股东在其委托书上表明其希望放弃投票,或持有其客户股票的经纪人、银行或其他被提名人导致其股票被记录为弃权,则这些股票将被视为出席并有权在年会上投票。因此,弃权将被计入
以确定是否有法定人数,如果提案的批准需要获得已发行股份或亲自出席或由受委代表投票的多数股份的赞成票,并有权
在年会上投票,则弃权也将被算作反对提案的投票。
作为登记在册的股东持股和作为“街头名下”持股的实益所有人持股有何不同?
如果您的普通股直接以您的名义在Onconentix的转让代理登记,则您被视为这些股票的登记股东。
作为登记的股东,您有权在特别会议上直接投票。您也可以直接委托Onconentix
或第三方在特别会议上投票表决您的股票。
如果您的普通股由经纪公司、银行、交易商或其他类似组织、受托人或被指定人持有,则您被视为以“Street
名义”持有的股票的实益所有人。您的经纪公司、银行、交易商或其他类似组织、受托人或被指定人将作为受益所有人向您发送一个包裹,说明投票您的股票的程序。您应遵循您的经纪公司、银行、交易商或其他类似组织、受托人或被指定人提供的说明来投票您的股票。
为了通过特别会议网站虚拟出席特别会议并在会议上投票,您应遵循您的银行、经纪人或其他被提名人提供的投票说明。如果您
通过股票经纪人、代名人、受托人或其他托管人持有您的普通股,您还可以通过Broadbridge提供的提供互联网投票选项的程序进行投票。如果您的普通股股票存放在参加Broadbridge计划的经纪公司或银行的账户中,您可以通过互联网选择投票。通过Broadbridge计划通过互联网提交的投票必须在晚上11:59之前收到。东部时间开始[●], 2024.
如果我的普通股被我的经纪公司、银行、交易商或其他类似组织、受托人或被指定人以“街道名称”持有,我的经纪公司、银行、交易商或其他类似组织、受托人或被指定人是否会自动投票支持我?
不是的。如果您指示您的银行、经纪人或其他被指定人,您的银行、经纪人或其他被指定人将仅被允许在特别会议上投票表决您的普通股。您应
遵循您的银行、经纪人或其他指定人提供的有关您的股票投票的程序。银行、经纪商和其他被提名人
在未收到受益所有人的指示时,有权为其客户持有普通股股票
,对“常规”提案进行投票。但是,禁止银行、经纪商和其他被提名者对非例行事项行使投票决定权,包括除审计师批准提案外的所有提案。因此,在该等股份的实益拥有人没有特别指示的情况下,银行、经纪商及其他代名人无权就该等建议投票表决该等股份。
如果我收到一套以上的特别会议投票材料,我该怎么办?
如果您以“Street
名义”持有普通股,也直接以您作为股东或其他身份持有普通股,或者如果您在一个以上的经纪账户中持有普通股,您可能会收到一套以上与特别会议有关的投票材料。
纪录保持者。对于直接持有的股票,
请使用随附的代理卡中的说明,通过互联网或电话通过代理投票,或立即填写您的代理卡并将其装在随附的邮资已付信封中返回,以确保您的所有普通股都获得投票。
持有的股份“街名。“
对于通过银行、经纪人或其他代理人以”街道名称“持有的股票,您应遵循银行、经纪人或其他代理人提供的程序提交委托书或投票您的股票。
如果股东委托代理,普通股的
股票如何投票?
无论您选择哪种投票方式,随附的代理卡上指定的
个人都将按照您指定的方式投票您的普通股。对于
特别会议之前的每个项目,您可以指定您的普通股是应该投票赞成还是反对,或者
放弃投票。
如果您正确签署、注明日期并返回代理卡,但未指明您的普通股应如何投票,有关您的股票将如何投票的更多信息,请参见下面的
“-如果我返回空白委托书,我的股票将如何投票?”
如果我返回空白委托书,我的股票将如何投票?
如果您签署、注明日期并返回您的委托书,并且没有说明您希望您的普通股如何投票,则您的普通股将根据Onconentix董事会的建议进行投票。
我是否可以在
提交代理后更改我的投票?
任何提供委托书的Onconentix股东都有权在特别会议表决委托书之前撤销委托书并更改其投票,方法是执行下列操作之一:
| ● | 随后提交新的特别会议委托书,并在随附的委托书上指定的截止日期前收到
; |
| ● | 向Onconentix的公司秘书发出关于您被撤销的书面通知;或 |
| ● | 通过特别会议网站虚拟出席特别会议并进行表决。请注意,如果您出席特别会议但不在特别会议上投票,委托书
不会被撤销。 |
委托书的签署或撤销不会以任何方式影响您通过特别会议网站虚拟出席特别会议并在特别会议上投票的权利。请参阅标题为
“特别会议--代理人的可撤销性。”
如果我以“街道名称”持有我的股票,
在我向我的银行、经纪人或其他被提名者提交投票指示后,我是否可以更改我的投票指示?
如果您的股票是以银行、经纪人或其他代名人的名义持有的,并且您之前向您的银行、经纪人或其他代名人提供了投票指示,则您应按照您的银行、经纪人或其他代名人提供的指示
撤销或更改您的投票指示。
我在哪里可以找到特别会议的投票结果?
特别会议的初步投票结果预计将在特别会议上公布。此外,在最终投票结果获得认证后的四个工作日内,Onconentix将向美国证券交易委员会提交特别会议的最终投票结果(如果最终投票结果尚未得到认证,则提交初步结果),并以8-K表格的形式提交当前报告。
Onconentix股东是否拥有持不同政见者的权利或评估权?
根据特拉华州法律,Onconentix的股东无权
获得与特别会议上的提案相关的评估权。
如果我在记录日期之后但在特别会议之前出售我的普通股
股票会发生什么情况?
录制日期早于
特别会议日期。如果您在记录日期之后但在特别会议之前出售或以其他方式转让您的普通股股份,您
将保留您在特别会议上的表决权。
谁将征集并支付征集代理的费用
?
Onconentix已经订婚[●],它被称为“[●],“协助征集特别会议的委托书。Onconentix估计,它将支付[●]
费用约为$[●],外加某些自付费用和开支的报销。Onconentix已同意赔偿[●]
针对与其征集委托书有关或因其征集委托书而产生的各种责任和费用(除某些例外情况外)。
Onconentix还可以报销银行、经纪人和其他托管人、被指定人和受托人或他们各自的代理人将代理材料转发给普通股受益所有人的费用。Onconentix董事、高级管理人员和员工也可以通过电话、电子方式或亲自征集代理人。
他们不会因招募代理人而获得任何额外费用。
我现在该怎么办?
您应仔细阅读本委托书
及其全文,包括附件。然后,您可以使用随附的代理卡附带的说明,通过互联网或电话进行代理投票,或者立即填写您的代理卡并将其装在随附的邮资已付信封中寄回,以便您的
股票将根据您的说明进行投票。
如何找到有关
Onconentix的更多信息?
您可以从不同来源找到有关Onconentix
的更多信息,如标题为“在那里您可以找到更多信息.”
如果我有关于特别会议的问题,我应该打电话给谁?
如果您对特别会议有疑问,
或希望获得本委托书的其他副本或其他委托书,您可以联系Onconentix的委托书律师:
[●]
摘要
为方便起见,以下是本委托书中包含的某些信息的简要摘要。本摘要重点介绍了本委托书中的部分信息
,并不包含作为Onconentix股东可能对您很重要的所有信息。要全面了解PMX交易
并更完整地描述PMX交易的条款,您应仔细阅读整个委托书及其附件和您所参考的其他文件。您可以按照“在哪里可以找到更多信息”下的说明免费获取本代理
声明中引用的信息。
PMX交易
于2023年12月15日,Onconentix收购Proteomedex的全部已发行及已发行权益(“已购买股份”),以交换Onconentix普通股的新发行股份
及B系列优先股的新发行股份,详情如下(“股份交换”及股份交换协议预期的其他交易,即“PMX交易”)。
PMX交易的条款及条件
载于股份交换协议,其副本载于本协议附件B。Onconentix和Proteomedex鼓励您仔细阅读股份交换协议的全文,因为它是管理PMX交易的法律文件。
此外,2023年12月15日,Onconentix向特拉华州国务卿提交了修订和重新注册证书的修正案证书。
修正案将Onconentix的名称从“Blue Water Biotech,Inc.”改为“Blue Water Biotech,Inc.”。改为“Onconentix,Inc.”,立即生效
(“更名”)。
PMX交易的各方
Onconetix,Inc.
Onconentix是一家商业阶段的生物技术公司,专注于肿瘤学创新解决方案的研究、开发和商业化。它拥有ENTADFI,一种FDA批准的每日一次的药片,
结合非那雄胺和他达拉非治疗良性前列腺增生症(BPH),
和Proclarix,一种根据体外诊断法规(IVDR)在欧盟批准销售的前列腺癌体外诊断测试,以及一种实验室开发的测试,最初由Proteomedex开发。
Onconentix股票在纳斯达克资本市场挂牌交易,代码为“ONCO”。欲了解更多公司和产品信息,请访问Onconentix的网站
Http://www.onconetix.com. Onconetix的主要行政办公室位于201 E。Fifth Street,Suite 1900,Cincinnati,
Ohio 45202,其电话号码是(513)620-4101。
蛋白质组学AG(蛋白质组学)
成立于2010年,Proteomeetry开发,营销
和销售非侵入性诊断测试以及决策支持系统,以检测和评估癌症的预后。蛋白质组学的
主导产品,Procarlix®是前列腺癌的体外诊断测试。蛋白质组学正致力于通过开发更准确检测和更有效治疗癌症的工具来解决癌症管理的所有阶段,包括(i)早期检测和确定癌症阶段的诊断
测试;(ii)用于识别侵袭性疾病患者的预后工具;
和(iii)分层生物标志物,以将患者与更可能安全有效的治疗相匹配。
Proclarix解决了前列腺
癌过度诊断导致大量前列腺活检阴性的未解决问题,这些问题增加了医疗保健系统的成本和
患者的不确定性。根据IVDR,Procarix已获准在欧盟销售。临床研究已证实,Procarix通过临床决策支持系统得出的风险评分,
可准确识别具有临床意义的前列腺癌,并可帮助
避免许多不必要的活检。作为临床支持系统,Procarix旨在汇总多模态信息,以努力开发
以患者为中心的诊断方法。蛋白质组学打算在未来将更多信息添加到风险评分中,例如其他生物标志物或磁共振成像数据,以提供更强大的工具来指导患者的诊断旅程。使用的标记
和生物信息学算法受专利保护。
欧洲泌尿外科协会(“EAU”)
和美国泌尿外科协会/泌尿肿瘤学会(“AUA/SUO”)的指南均建议使用基于血液的
生物标志物检测,如Procarix,以帮助早期检测和评估前列腺癌。可以在任何
实验室使用标准设备进行Proclarix。在欧洲,Proteomerase已开始向选定市场的试点实验室销售Procarix,这些市场
对自费开放,以显示初步采用。在美国,Procarlix的开发和商业化由Laboratory Corporation of America Holdings(通常称为Labcorp)根据
Proteomerase与Labcorp于2023年签订的独家许可协议进行。
Onconetix进行PMX交易的原因
和Onconetix董事会的建议
有关Onconetix董事会在
决定批准股份交换协议及其预期交易(包括PMX交易)时考虑的因素的说明,以及有关Onconetix董事会建议的其他
信息,请参见标题为“PMX交易的背景.”
特别会议
特别会议将以虚拟
会议形式举行,通过仅限音频的现场网络广播, [●],2024,从[●]上午,东部时间。Onconetix股东将
能够通过访问特别会议网站, www.w.[●].com.
特别会议的目的如下:
| |
1. |
批准并通过反向股票分割修正案,以实现我们普通股所有流通股的反向股票分割,比例范围为1比30至1比60,该比例由董事会确定; |
| |
2. |
根据纳斯达克上市规则第5635条,批准在转换公司A系列优先股后发行至多5,709,935股普通股(可调整),每股面值0.00001美元; |
| 3. | 根据纳斯达克上市规则第5635条,批准
发行:(i)在转换B系列优先股时发行的269,672,900股普通股,以及(ii)公司在PMX融资中发行的普通股数量,最初应包括20,000,000股普通股和
最多6股,单位中包含的000,000股普通股相关认股权证(可调整),加上在满足某些价格保护条件后可发行的
股普通股的额外数量,如本文进一步所述; |
| 4. | 批准董事会任命CornerAmper为公司截至2024年12月31日财年的独立注册公共会计师事务所;以及 |
| 5. | 如有必要或适当,批准特别会议休会,如果在特别会议时没有足够的票数批准反向股票
拆分提案、A系列转换提案、PMX发行提案或审计师批准提案,则征求额外的
代理人。 |
在特别会议上开展业务需要达到Onconentix股东的法定人数。有权在特别会议上投票的三分之一已发行和已发行普通股的持有人亲自或委派代表出席将构成法定人数。就确定出席特别会议的事务的法定人数而言,虚拟出席特别会议将
构成亲自出席。就确定特别会议的事务处理的法定人数而言,弃权将被视为出席并有权投票。由于审计师批准提案被视为例行公事
,如果经纪商、银行或其他被提名人没有接到就该提案进行投票的指示,则通过经纪商、银行或其他被提名人以“街头名义”持有的股票将被视为存在,以确定是否存在法定人数。
反向股票拆分建议的批准需要普通股持有者投赞成票,普通股持有者至少占有权投票的普通股流通股的大多数。A系列转换方案、PMX发行方案、审计师批准方案和休会方案需要出席或由代表出席并有权在特别会议上就此事投票的股东投赞成票。
弃权代表股东
拒绝对提案进行投票的肯定选择。如果股东在其委托书上表明其希望放弃投票,或持有其客户股票的经纪人、银行或其他被提名人导致其股票被记录为弃权,则这些股票将被视为出席并有权在年会上投票。因此,弃权将被计入
以确定是否有法定人数,如果提案的批准需要获得已发行股份或亲自出席或由受委代表投票的多数股份的赞成票,并有权
在年会上投票,则弃权也将被算作反对提案的投票。
Oncontix董事和高管在PMX交易中的利益
截至本委托书发表之日,Onconentix董事和高管在不同于或不同于其他Onconentix股东一般利益的提案中不拥有任何利益,但以下情况除外:
| |
● |
拉尔夫·希斯博士,我们的临时首席执行官兼首席科学官,持有269,749股普通股和195,664股B系列优先股。 |
| |
● |
我们的首席战略官克里斯蒂安·布鲁曼持有236,029股普通股和171,204股B系列优先股。 |
Onconentix普通股的某些实益所有者
股票
在……营业结束时[●],2024,即本委托书发表日期之前的最后实际可行日期,作为一个团体,Onconentix董事和高管及其附属公司拥有并有权投票[●]持有Onconentix普通股股份的百分比。
PMX交易和相关融资的说明
换股协议概述
于二零二三年十二月十五日,Onconentix与(I)Onconentix、
(Ii)瑞士公司Proteomedex AG(“Proteomedex”)、(Iii)名列于该协议内的已发行股本或Proteomedex可换股证券(统称“卖方”除外)的每名持有人(统称为“卖方”)及(Iv)Thomas
Meier(根据股份交换协议的条款及条件以卖方代表的身份)订立股份交换协议(“股份交换协议”)。
根据股份交换协议,在该协议所载条款及条件的规限下,卖方同意向Onconentix出售所有已购股份,而Onconentix则同意购买,以换取新发行的普通股及新发行的B系列优先股,详情如下。
股份交易所的完成(“成交”)须受惯常成交条件及签署于PMX交易完成前与Proteomedex股东Altos Ventures订立的认购协议(定义见下文)
(“PMX投资者”)限制。联交所于2023年12月15日(“收市日期”)收市。
考虑事项
于已购股份之缴足股款中,Onconentix发行股份(“交换股份”)包括:(I)3,675,414股普通股,相当于全部已发行及已发行普通股约19.9%;及(Ii)2,696,729股B系列优先股,可转换为269,672,900股普通股。这个订约方
同意,收市时交易所股份的总值约等于7500万美元(75,000,000美元)(“交易所代价”)减去Proteomedex股份的价值,而Proteomedex的股票期权(定义见下文)可于紧接收市前行使,但须按下文所述
作出赔偿调整。收盘后,发行和发行了22,061,746股普通股。
钨顾问公司担任Proteomedex的财务顾问。作为对钨顾问所提供服务的部分补偿,已向钨顾问的若干联营公司(“咨询方”)发行了7,500,000美元的交易所股票,交易对价总额由Onconentix发行。
作为PMX交易的结果,Proteomedex成为Onconentix的直接全资子公司。预期于根据认购协议(定义见下文)转换(定义见下文)及完成投资后,卖方将拥有Onconentix约87.2%的未偿还股本权益,PMX投资者将拥有Onconentix约7.5%的未偿还股本权益,而紧接于
完成交易前的Onconentix股东将拥有Onconentix未偿还股本权益约5.3%。
购买Proteomedex股份的每个
购股权(每个为“Proteomedex购股权”),不论是否已归属,均在紧接交易结束前仍未行使,除非按照其条款终止。于
转换时,每项尚未行使的Proteomedex购股权,不论是否归属,均须由Onconentix承担及转换为权利
,以收取(A)收购普通股股份的选择权(各为“假设购股权”)或(B)Onconentix与Proteomedex可能同意的其他衍生证券
,但在任何一种情况下,均须遵守在紧接收市前适用于该等
Proteomedex股票购股权的大致相同的条款及条件。每项认购权应:(I)代表收购数目为
普通股的权利,等于(A)于紧接成交前受相应Proteomedex期权规限的Proteomedex普通股数目乘以(B)交换比率(定义见股份交换协议“);及
(Ii)行使价(四舍五入至最接近的整数分)等于(A)相应
Proteomedex期权的行使价除以(B)交换比率的商数。
B系列优先股
根据与美国外国投资委员会(“CFIUS”)有关的任何要求,经股东在特别会议上所需的表决通过(“股东批准”),B系列优先股的每股股份应根据指定证书的条款自动转换为100股普通股(“转换”)。如果股东在2025年1月1日之前仍未获得批准,Onconentix将有义务兑现B系列优先股,如下所述。
陈述
和保证
Onconentix、
Proteomedex和卖方已在换股协议中作出惯常陈述及保证。Onconentix和Proteomedex的陈述和保证将一直有效,直到改装,而卖方的陈述和保证
将持续到交易结束的一周年。
赔偿
直至
(I)股东批准或(Ii)2024年6月30日(“申索截止日期”)(以较早者为准),Onconentix可就以下事项向Proteomedex及卖方提出索偿:(I)股份交换协议所载Proteomedex作出的任何陈述或保证的任何失实或违反,或(Ii)Proteomedex根据股份交换协议须履行的任何契诺、协议或责任的任何违反或不履行。在索偿截止日期前,代表卖方行事的卖方代表可就卖方就(I)股份交换协议所载有关Onconentix的任何陈述或保证的任何失实或违反,或(Ii)Onconentix根据股份交换协议须履行的任何契诺、协议或责任的任何违反或
未能履行而招致的任何损失向Onconentix提出申索。
转换后发行的普通股数量应增加或减少一个数字,通过将净调整除以成交日前第三个
天前十(10)天期间普通股的成交量加权平均价格(VWAP)确定,并向下舍入到最接近的整数股;但条件是:(1)如果净调整金额少于1,000,000美元,则转换后发行的普通股数量不得调整;(2)转换后发行的普通股数量不得增加或减少超过
在没有调整时可发行的普通股数量的10%。在此使用的“净调整”是指由Onconentix和卖方代表
商定或由双方都能接受的争议解决公司确定的、对每一方都有利的损失总和调整之间的差额的绝对值。
自
、成交后及成交一周年为止,卖方须个别及非联名地就(I)股份交换协议所载卖方的任何陈述或保证的任何失实或违反,及(Ii)违反或不履行根据股份交换协议须由卖方履行的任何契诺、协议或责任
向Onconentix
及其联属公司及其各自的代表(统称“Onconentix受偿人”)作出弥偿。任何卖方就任何Onconentix受偿人的赔偿要求应支付的任何款项应仅通过求助于交换股份和转换后可发行的普通股来支付,普通股的每股估值与普通股的每股价格相同,用于确定交换比例。
各方的契诺
股份交换协议各订约方同意利用其商业上合理的努力完成PMX交易。安康泰同意尽其商业上合理的努力,在切实可行的范围内尽快从持有安康泰克斯5%(5%)以上有表决权股票的每位股东以及每位董事和安康泰克斯高管那里获得一份正式签署的股东支持协议(定义见
下文)。
《股份交换协议》包含双方在成交和转换之间必须遵守的某些契约,包括以下契约:(1)提供获取财产、账簿和人员的途径;(2)交付Onconentix的财务报表;(3)诉讼支持;(4)Onconentix的公开文件;(5)没有内幕交易;(6)进一步保证;(7)公告;(8)保密;(9)对董事和高级管理人员的赔偿和尾部保险;(10)股票交易所的拟纳税处理;(11)第16条事项;(12)转让税。
各方同意采取一切必要行动,在股东批准后立即安排Onconentix董事会(股东批准后董事会)由五名董事组成,其中包括:(I)两名由Onconentix指定且
合理地被Proteomedex接受的人士;及(Ii)由Proteomedex
指定并合理地被Onconentix接受的三名人士。
发行转换股份,修订Onconentix的公司注册证书以授权足够的额外普通股
股份以允许转换(在完成PMX交易所需的范围内),以及任命股东批准后的Oncontix董事会需要获得Onconentix股东的批准。安康同意准备并向美国证券交易委员会提交一份委托书(“委托书”),以便就将在安康的股东特别会议上采取行动的事项向安康的股东征集委托书。Onconentix亦同意以表格S-1或表格S-4就将于股份交易所协议下发行的Onconentix证券的发行根据经修订的1933年证券法(“证券法”)注册事宜拟备一份登记声明,并就将于股东特别大会上处理的事项向Onconentix股东征集代表委任声明。
卖方、Onconentix和Proteomedex同意
在Onconentix的选举(其已决定不行使该选举)或CFIUS的要求下,在切实可行的范围内尽快向CFIUS提交关于PMX交易的联合声明或通知,但在任何情况下不得迟于股份交换协议日期后
天。双方相互合作,同意在各自的权力范围内采取合理的最大努力采取所有此类行动,以获得CFIUS的批准(“CFIUS批准”),并在不限制上述规定的情况下,在经过合理的谈判努力后,双方同意CFIUS可能要求或要求的、或作为CFIUS批准条件的任何国家安全问题的缓解要求或条件,包括
签订缓解协议、保证书或国家安全协议。但前提是:(1)双方没有义务(A)通过同意法令、持有单独的订单、协议或其他方式,提议、谈判、承诺或以其他方式出售、转让、许可、剥离或以其他方式处置Onconentix或其任何关联公司或卖方的任何业务、产品线或资产,(B)终止或创建Onconentix或其关联公司的现有关系、合同权利或义务,
(C)实现Onconentix或其关联公司的任何其他变更或重组,或(D)以其他方式采取或承诺采取任何合理的行动,
预期将对卖方的业务运营产生重大不利影响,或干扰Onconentix控制Proteomedex或Onconentix在任何重大方面指导Proteomedex业务的管理和政策的能力
;以及(2)Proteomedex和卖方同意,未经Onconentix事先书面同意,不采取或同意采取任何前述行动。
双方同意
尽商业上合理的最大努力:(I)确保将纳斯达克控制权变更申请(“纳斯达克控制权变更申请”)提交给纳斯达克证券市场有限责任公司(“纳斯达克”);及(Ii)在收到此类问题后,立即回复纳斯达克就纳斯达克控制权变更申请提出的任何问题,但在任何情况下不得迟于收到此类问题后十(10)个工作日。
在关闭和转换之间的时间内,Onconentix还同意并同意促使其子公司在正常业务过程中开展各自的业务
,并同意与各自业务的运营有关的契诺,包括与以下内容有关的契诺:(I)修订Onconentix的组织文件;(Ii)对Onconentix的股权进行资本重组;(Iii)发行额外的证券;(Iv)产生额外的债务;(V)税收选择的重大变化;(Vi)重大合同的修订或终止。(Vii)记录和账簿;(Viii)设立任何子公司或进入新的业务范围;(Ix)保单的维护;(X)重大资产的重估或会计方法、原则或政策的重大变更,但符合美国公认会计原则的范围除外;(Xi)放弃或解决任何索赔、诉讼或法律程序,但豁免不超过500,000美元;(Xii)在正常业务过程之外收购股权或资产或任何其他形式的业务组合;(Xiii)超过500,000美元的单独资本支出或总计超过1,000,000美元的资本支出;(Xiv)采用清算、解散、合并、合并、重组、资本重组或其他重组计划;(Xv)自愿
产生任何超过单独超过500,000美元或总计超过1,000,000美元的负债或义务,但根据股份交换协议日期存在的合同或在正常业务过程中订立的
条款除外;(Xvi)出售、租赁、许可或以其他方式处置Onconentix
财产、资产或权利的任何主要部分;(Xvii)就普通股的投票订立任何协议、谅解或安排,但与准许融资有关的除外;(Xviii)采取任何合理预期会导致
重大延迟或损害取得任何政府当局就股份交换协议将取得的任何意见书的行动;
或(Xix)授权或同意进行上述任何行动。
“允许融资”
指在交易完成和转换期间由Onconentix完成并向其提供资金的一项或多项债务或股权融资交易,总收益总额不超过2,500万美元。
治国理政法
股份交换协议受特拉华州法律管辖。
B系列优先股条款
指定证书中所述的B系列优先股的
条款如下:
投票。B系列优先股的
股份没有投票权,但以下情况除外:(I)对于选举董事(如下所述)和(Ii)作为单一类别的B系列优先股已发行股份的多数持有人(“多数股东”),
必须投赞成票,以(A)反向改变或改变赋予B系列优先股的权力、优先或权利,(B)更改或修订指定证书,或修订或废除以下任何规定,或在Onconentix的公司注册证书或章程中增加任何条款,如果此类行动将不利地改变或改变为B系列优先股的利益而规定的偏好、权利、特权或权力,(C)增发B系列优先股或增加或减少(除转换外)B系列优先股的授权股份数量,或(D)授权或创建任何类别或系列的股票,或发行具有
权力的任何类别或系列股票,优先于B系列优先股的优先权或权利。
蛋白质组分
董事。独立投票的多数股东有权选出一(1)名董事股东。
任何按前一句规定当选的董事股东均可经B系列优先股持有者
投赞成票后方可罢免。如果B系列优先股持有人未能选出董事的董事职位,则任何未如此填补的董事职位将一直空缺,直到B系列优先股持有人选出一人填补该董事职位为止;除B系列优先股持有人外,该等董事职位不得由Onconentix的股东填补。在为选举董事的目的而举行的任何会议上,B系列优先股的多数流通股持有人亲自或委派代表出席构成投票该董事的法定人数。
救赎。
B系列优先股的股票不能由Onconentix赎回。
清算
优先。在Onconentix清盘、解散或清盘时,无论是自愿还是非自愿(“清算”),B系列优先股持有人有权从Onconentix的资产中获得相同的
普通股持有人将获得的金额,如果该持有人的B系列优先股按转换比率(定义见下文)全部转换为普通股
,外加相当于已宣布但未支付给该等股份的任何股息的额外金额,这些
金额应与所有普通股持有人按同等比例支付。
分红.
B系列优先股的持有者有权获得B系列优先股的股息(按假设转换为普通股的基础),其形式和方式与实际支付普通股的股息(普通股股息除外)相同,当此类股息(普通股形式的股息除外)以普通股支付时。
转换.
经股东批准后,B系列优先股每股应转换为普通股(“转换股
股”),转换比例为B系列优先股每股100股转换股(“转换比例”)。B系列优先股的所有
股份将自动转换为转换股份,而无需采取任何进一步行动,转换比例应为(I)Onconentix已获股东批准发行所有转换后可发行普通股的最后日期
,超过截止日期已发行及已发行普通股的20%,及(Ii)Onconentix已增加其注册证书下授权的普通股股份数目,
至完成PMX交易所需的程度。
现金结算
。如果在股东批准之日或2025年1月1日(最早的日期为现金结算日)之后的任何时间,Onconentix(X)已获得股东批准,但未能或未能将
提交给持股人证书或代表转换股份的证书,或在股东批准日期后第五个营业日或之前提交(或使其
转让代理以电子方式交付此类证据)转换股份账簿记录文件,或(Y)未能获得股东批准,应持有人提出现金结算B系列优先股的请求,向该持有人支付现金,金额等于(I)该请求中陈述的B系列优先股的公允价值(定义见下文)乘以(Ii)向Onconentix交付请求的交易日的有效转换比率,并在持有人提出请求之日起两(2)个工作日内支付此类款项,因此,在Onconentix全额支付后,Onconentix
交付此类股份的义务将被解除。股票的“公允价值”应固定为
参考在上市普通股的主要交易市场上最后一次报告的收盘价
截至向Onconentix提交请求的交易日的最后一次报告的收盘价。
某些调整.
如果Onconentix,在B系列优先股发行期间的任何时间:(A)支付股票股息或以其他方式进行普通股应支付的一次或多次分配;(B)将普通股的已发行股票细分为更多的
股;或(C)将已发行的普通股合并(包括以反向股票拆分的方式)为较少的股份,则转换比率应乘以一个分数,分子为紧接该事件发生后的已发行普通股数量
,分母为紧接该事件发生前的已发行普通股数量(不包括本公司的任何库藏股)。如果在B系列优先股发行期间的任何时间,(A)Onconentix与另一人合并或合并,或向另一人出售股票,或与另一人或与另一人合并的其他业务(交易中,Onconentix是尚存或持续的实体,并在交易生效后持有至少大部分普通股,且其普通股没有交换或转换为其他证券、现金或财产),(B)Oncontix实现任何出售、租赁、在一次交易或一系列相关交易中转让或独家许可其全部或基本上所有资产,(C)完成任何要约收购或交换要约(无论是由Onconentix或其他人持有),据此,超过50%的普通股被交换或转换为其他证券、现金或财产,或(D)Oncontix对普通股或任何强制性股票交换进行任何重新分类,据此普通股有效地转换为或交换其他证券、现金或财产(在任何该等情况下,如果(A)至
(D)中的任何此类交易涉及B系列优先股持有人,则B系列优先股持有人在此类交易中获得的证券、现金或财产的种类和金额将与B系列优先股持有人在B系列优先股完全转换为普通股时将获得的证券、现金或财产的种类和金额相同,外加
相当于已宣布但未支付给该等股份的任何股息的额外金额,这些金额将在基本PMX交易中与所有普通股持有人按比例支付(“替代对价”)。如果普通股持有者
在(A)至(D)的交易中被给予将收到的证券、现金或财产的任何选择,则B系列优先股的持有者
应获得与其在该交易中获得的替代对价相同的选择。
禁售协议
随着股份交换协议的签署,卖方及顾问方(作为Proteomedex的股东)同时签订禁售协议(各一份“禁售协议”)。根据每份《禁售协议》,在截止日期起至股东批准之日起6个月止的期间内,各签署方不得同意:(I)出借、要约、质押、抵押、抵押、转让、出售任何期权或合同、购买、购买任何期权或合同、购买
任何出售、授予任何期权、权利或权证、或以其他方式直接或间接转让或处置交易所股份或转换股份的任何期权或合同,(Ii)订立将交易所股份或兑换股份所有权的任何经济后果全部或
转移至另一人的任何掉期或其他安排,或(Iii)公开披露进行上述任何交易的意向,不论上文第(I)、(Ii)或(Iii)条所述的任何交易将以现金或其他方式(除若干例外情况外)以交付交易所股份或兑换股份或其他证券的方式结算。
竞业禁止和竞业禁止协议
同时
随着股份交换协议的签署,Proteomedex的若干高管(每位均为“管理股东”)分别与Onconentix订立竞业禁止及竞业禁止协议(统称为“竞业禁止及竞业禁止协议”)
。根据竞业禁止及竞业禁止协议,各管理层股东同意在关闭后的三年期间内,不与Proteomedex、
及在关闭后的三年内,Onconentix及其各自的联属公司进行竞争,并在该三年限制期内,不招揽该等实体的雇员或客户。每个竞业禁止和竞业禁止协议
还包含惯常的保密和非贬损条款。
股东支持协议
同时
随着股份交换协议的签订,Onconentix、Proteomedex及Onconentix的股东中的若干董事订立股东支持协议(“股东支持协议”),据此,Onconentix的各有关股东已同意(A)支持采纳股份交换协议及批准PMX交易,但须受若干惯常条件规限,及(B)不会转让彼等的任何标的股份(或就此订立任何安排
),惟须受若干惯常条件规限。
股东认购
协议和债券
关于PMX交易,于2023年12月15日,Onconentix与PMX投资者订立认购协议(“认购协议”)
,以私募5,000,000美元的单位(“该等单位”),每个单位包括(I)一股普通股
及(Ii)一股预先出资的认股权证(统称为“认股权证”),以每股0.001美元的行使价购买0.3股普通股,每单位的总购买价为0.25美元(“购买价”)。额外股份
可向PMX投资者发行,前提是PMX投资者继续持有该等单位所包括的普通股,且如在成交后270天内的VWAP低于认购协议所载的收购价。
股东批准是结束PMX融资的条件,预计在股东批准发行转换股票
后,发行将完成。在交易完成后30天内,安康将向美国证券交易委员会提交转售登记声明,登记根据认购协议和认股权证转售可发行普通股。
于二零二四年一月二十三日,本公司向PMX投资者发行本金为5,000,000美元的不可转换债券(“债券”),支付款项将抵销根据认购协议单位的总购买价。
债券的年利率为4.0%,本金和应计利息将于(I)根据认购协议完成及(Ii)2024年6月30日两者中较早者悉数偿还。此外,认购协议下的500万美元认购金额将增加
债券项下应支付的利息金额。截至2024年2月12日,债券项下的未偿还本金总额为500万美元。
交易各方
Onconetix,Inc.
Onconentix是一家商业阶段的生物技术公司,专注于肿瘤学创新解决方案的研究、开发和商业化。它拥有ENTADFI,一种FDA批准的每日一次的药片,结合非那雄胺和他达拉非治疗前列腺疾病BPH,以及Proclarix,一种前列腺癌的体外诊断测试,根据欧盟批准在欧盟销售体外诊断性调节(“IVDR”)
和一个实验室开发的测试,目前在美国,最初由Proteomedex开发。
Onconentix股票在纳斯达克资本市场挂牌交易,代码为“ONCO”。欲了解更多公司和产品信息,请访问Onconentix的网站
Http://www.onconetix.com. Onconetix的主要行政办公室位于201 E。Fifth Street,Suite 1900,Cincinnati,
Ohio 45202,其电话号码是(513)620-4101。
Proteomedex AG
成立于2010年,Proteomeetry开发,营销
和销售非侵入性诊断测试以及决策支持系统,以检测和评估癌症的预后。蛋白质组学的
主导产品,Procarlix®是前列腺癌的体外诊断测试。蛋白质组学正致力于通过开发更准确检测和更有效治疗癌症的工具来解决癌症管理的所有阶段,包括(i)早期检测和确定癌症阶段的诊断
测试;(ii)用于识别侵袭性疾病患者的预后工具;
和(iii)分层生物标志物,以将患者与更可能安全有效的治疗相匹配。
Proclarix解决了前列腺癌过度诊断导致大量阴性前列腺活检的悬而未决的问题,从而增加了医疗保健系统的成本和患者的不确定性
。根据IVDR,Proclarix被批准在欧盟销售。临床研究证实,Proclarix通过从临床决策支持系统得出的风险评分,准确地识别出具有临床意义的前列腺癌,并可帮助
避免许多不必要的活检。Proclarix作为一种临床支持系统,旨在聚合多模式信息,以努力开发以患者为中心的诊断方法。Proteomedex打算在未来向评分中添加更多信息,如其他生物标志物或磁共振成像数据,以提供更强大的工具来指导患者的诊断过程。
所使用的标志物和生物信息学算法受专利保护。
欧洲泌尿外科协会(“EAU”)和美国泌尿外科协会/泌尿外科肿瘤学会(“AUA/SUO”)的指南都建议使用基于血液的生物标记物检测,如Proclarix,以帮助前列腺癌的早期发现和评估。Proclarix
可在任何实验室使用标准设备进行。在欧洲,Proteomedex已开始向选定市场的试点实验室
推广Proclarix,这些市场开放自费以展示其初步采用情况。在美国,根据Proteomedex和Labcorp于2023年签订的独家许可协议,Proclarix的开发和商业化由美国实验室控股公司(通常称为Labcorp)进行。
合并后公司的业务信息
我公司
我们是一家商业阶段的生物技术公司,专注于肿瘤学创新解决方案的研究、开发和商业化。我们拥有ENTADFI,FDA批准的每日一次的药片,结合非那雄胺和他达拉非治疗BPH,一种前列腺疾病,以及Proclarix,一种前列腺癌的体外诊断测试,根据欧盟批准在欧盟销售体外诊断性调节(“IVDR”)
和一个实验室开发的测试,目前在美国,最初由Proteomedex开发。
ENTADFI使男性能够接受治疗,治疗他们的BPH症状,而不会出现通常只服用非那雄胺的患者的负性副作用。随着最近业务战略转向肿瘤学领域和取消临床前疫苗计划,我们正在为肿瘤学的治疗、诊断和临床医生服务
建立更多资产。一旦推出,ENTADFI将成为该公司不断扩大的肿瘤治疗产品组合中的首个治疗药物。
Proclarix是一种易于使用的基于蛋白质的新一代血液测试,可以使用与患者常规前列腺特异性抗原(PSA)测试相同的样本进行测试。PSA检测是一种久负盛名的前列腺特异性标志物,可以测量血液样本中PSA分子的浓度。高水平的PSA可能是前列腺癌的征兆。然而,PSA水平也可能因为许多其他原因而升高,包括感染、前列腺刺激、剧烈运动甚至某些药物。PSA结果可能会让许多患者甚至医生感到困惑。据
估计,超过50%的PSA升高的活检呈阴性或临床意义不大,从而导致过度诊断和过度治疗
,从而影响医生的日常工作、我们的医疗体系和患者的生活质量。Proclarix通过使用我们专有的Proclarix风险评分来帮助PSA检测结果不明确的医生和患者,该评分可为进一步的治疗决策提供明确和即时的诊断支持。不需要额外的干预,结果很快就出来了。当地诊断实验室
可以轻松地将这种负担得起的多参数测试添加到他们现有的基础设施中。
在收购ENTADFI之前,我们管理着一个不同的业务部门,即研发。从2023年第二季度开始,由于收购了ENTADFI,我们正在努力实现商业推出,我们在两个业务领域开展业务:研发和商业。
在2023年第三季度,我们剥夺了疫苗发现和开发计划的权利,因此,我们现在在一个领域开展业务:商业。我们最近在2023年第四季度收购了Proteomedex及其相关诊断产品Proclarix
,确定属于我们的商业细分市场。研发部门是我们的历史业务,致力于研究和开发各种预防传染病的疫苗。商业部门在2023年第二季度是新的
,致力于我们批准销售的产品的商业化,即美国的ENTADFI和欧洲的Proclarix。
最近影响我们业务的主要事态发展
包括:
| |
● |
宣布将业务战略转变为专注于肿瘤学领域:2023年10月30日,前总裁兼首席执行官尼尔·坎贝尔博士在致股东的一封信中宣布,公司打算将重点转向在肿瘤学领域建立治疗、诊断和服务产品的基础。该公司之前从WraSer和Xspire Pharma收购资产的活动,包括旨在营销和销售这些资产的某些商业关系,已重新评估,并决定这些关系不能满足公司创造更大股东价值的要求。
此外,该公司对其临床前疫苗计划进行了战略和战术评估,考虑到实施这些计划所需的大量时间和资源以及不断变化的市场动态,这些计划已被取消。该公司相信,业务战略向肿瘤学领域的战略转变,以及寻求在2024年推出ENTADFI,将提高股东价值,使公司能够为临床医生、患者和护理人员提供尖端疗法、诊断和服务。 |
| |
● |
收购了一家商业阶段肿瘤学公司:2023年12月15日,该公司完成了对Proteomedex的收购,并引入Onconentix,Inc.作为合并后公司的新名称。以所有股票对价完成对Proteomedex的收购后,Proteomedex股东将获得Onconentix 16.4%的初始所有权股份,B系列优先股可转换为269,672,900股Onconentix普通股,但须得到Onconentix股东的批准。 |
| |
● |
签署各种协议以支持ENTADFI的商业推出:在整个2023年第三季度,该公司签署了几项协议并建立了关键关系,以支持ENTADFI的商业推出。这些协议包括以下内容: |
| |
● |
营销和广告支持:2023年7月,该公司与BFW广告公司(“BFW”)签署了一项主服务协议,为Onconentix的商业阶段药物组合制作营销和广告材料。BFW将致力于通过面向患者的材料、网站更新、社交美国存托股份、目标提供商参与以及支持Onconentix销售团队的材料等服务来提高对Onconentix商业产品的认识。 |
| |
● |
医疗保健支付方覆盖支持:2023年7月,Onconentix与Advantage Point Solutions,LLC(“APS”)签署了一项协议,以支持Onconentix的商业药物组合的市场准入战略。APS将支持ENTADFI的市场准入,包括协助与商业和政府部门的关键医疗保健支付者和药房福利经理进行处方谈判。凭借其强大的关系网络,APS帮助商业阶段的制药公司与支付者建立长期关系,目标是最大限度地获得批准的药品并获得报销。APS还拥有数十年的经验,为公司在广泛的治疗领域推出产品提供建议。 |
| |
● |
远程医疗频道:2023年7月,Onconentix与UpScriptHealth签署了一项协议,以生成一个强大的在线远程医疗平台来分发ENTADFI。通过这个平台,UpScriptHealth将在整个处方和覆盖过程中帮助支持良性前列腺增生症患者,并为符合条件的患者提供ENTADFI直接寄到他们家里。 |
| |
● |
签订分销协议:2023年9月21日,该公司签订了一项独家经销协议,聘请Cardinal Health 105,LLC作为其独家第三方物流分销代理,销售公司的所有商业资产。 |
| |
● |
在俄亥俄州和田纳西州获得药品批发商许可证:俄亥俄州药房委员会和田纳西州药房委员会分别于2023年7月和2023年9月授予Onconentix作为药品批发商的经营许可证。这些许可证允许Onconentix在俄亥俄州和田纳西州开展业务。 |
自我们于2018年10月成立至2023年4月收购ENTADFI为止,我们将几乎所有的资源投入到研发、开展临床前研究和支持制造活动以支持我们的产品开发工作、招聘人员、收购和开发我们的技术以及现在剥夺候选疫苗、组织我们的公司并为其配备人员、执行业务规划、建立我们的知识产权组合以及筹集资金以支持和扩展此类活动。
我们目前正集中精力(I)建立我们的商业能力,以便在市场上推出ENTADFI,以及(Ii)将Proclarix商业化。
鉴于ENTADFI目前在美国获得FDA批准销售,Proclarix获得CE认证在欧盟销售,我们预计近期将从ENTADFI和Proclarix的销售中获得收入。虽然我们预计这些销售将抵消与商业扩展和开发相关的一些费用,但我们预计与我们正在进行的活动相关的费用将大幅增加,因为我们:
| |
● |
商业化和/或推出ENTADFI和Proclarix以及其他商业阶段的产品
; |
我们依赖并将继续依赖第三方生产ENTADFI和Proclarix。我们没有内部制造能力,我们将继续依赖第三方
,其中主要供应商是单一来源的供应商,用于商业产品。
由于我们有一款产品正处于商业阶段,我们正在寻求建立一支强大而高效的商业团队来适应这一发展。这包括执行我们商业化战略所需的适当
人员和第三方关系以及合同。我们还预计会产生与这些产品的营销、制造和分销相关的巨额商业化费用。
我们没有任何获准销售的产品,
除了ENTADFI和Proclarix之外,我们没有从产品销售中获得任何收入,而Proclarix自收购以来只产生了
最低限度的收入。到目前为止,我们的运营资金主要来自向种子投资者出售优先证券的收益、首次公开募股、2022年私募、2023年8月认股权证行使的收益以及2024年1月发行债券的收益。我们将继续需要大量额外资本将ENTADFI和Proclarix商业化,并在可预见的未来为运营提供资金。因此,在我们能够产生可观的
收入之前,我们预计将通过公共或私募股权或债务融资、第三方(包括政府)资金,以及依靠第三方资源进行营销和分销安排,以及其他合作、战略联盟和许可安排,或这些方法的任何组合来支持我们的运营,以满足我们的现金需求。
我们自成立以来一直出现净亏损,预计在可预见的未来还将继续出现净亏损。我们的净亏损可能在季度间和年度间波动很大,这在很大程度上取决于我们的临床前研究、临床试验和制造活动的时间安排,以及我们在其他研发活动和商业化活动上的支出
。截至2023年9月30日,公司营运资金赤字约为810万美元,累计赤字约为3440万美元。我们需要在未来12个月内筹集额外资金
以维持运营。此外,如果在2025年1月1日之前仍未获得股东批准,公司
可能有义务现金结算B系列优先股。
在我们产生足以支持
自给自足现金流的收入(如果有的话)之前,我们将需要筹集更多资金来支持我们的持续运营,包括与我们当前和未来产品相关的产品开发和商业化活动。不能保证我们将以可接受的条款获得额外资本,或者根本不能保证我们将产生足够的收入来提供自给自足的现金流
。这些情况使人对我们作为一家持续经营的企业继续下去的能力产生了极大的怀疑。本委托书中包含的未经审计的Onconentix简明财务报表不包括在公司无法继续经营的情况下可能需要进行的任何调整。
由于与我们的业务相关的许多风险和不确定性
,我们无法预测增加费用的时间或金额,也无法预测我们何时或是否能够实现
或保持盈利。此外,即使我们能够从ENTADFI或Proclarix获得收入,我们也可能无法盈利。
如果我们无法盈利或无法持续盈利,则我们可能无法按计划水平继续运营
并可能被迫减少运营。
管理层和董事会的变动
自2023年8月16日起,约瑟夫·埃尔南德斯
辞去公司董事长、首席执行官和董事会成员职务。
自2023年8月16日起,董事会委任本公司前首席财务官乔恩·加菲尔德为本公司临时首席执行官。
自2023年10月4日起,乔恩·加菲尔德辞去本公司首席财务官兼临时首席执行官一职。
本公司与加菲尔德先生签订了离职协议,约定两个月的遣散费。
自2023年9月2日起,Vuk Jeremy
辞去了公司董事会成员的职务,辞去了薪酬委员会成员的职务,并提名了董事会的公司治理委员会成员。杰里米奇先生的离职并非由于与管理层或董事会就有关本公司经营、政策或惯例的任何事宜有任何分歧所致。
2023年10月4日,本公司任命现年63岁的尼尔·坎贝尔博士为本公司首席执行官兼总裁以及董事会成员。
关于Campbell博士的任命,本公司与Campbell博士签订了雇佣协议(“Campbell雇用协议”),据此,Campbell博士将担任本公司的总裁兼首席执行官,并获得75,000美元的签约奖金和475,000美元的年基本工资。根据坎贝尔雇佣协议,坎贝尔博士以购买532,326股公司普通股的期权的形式获得了长期股权奖励。此类奖励将在三年内按季度递增授予,条件是坎贝尔博士在适用的归属日期继续受雇于公司。坎贝尔博士授予的期权的行权价相当于每股0.4305美元,这是该公司普通股在授予日在纳斯达克上的收盘价。
2023年10月4日,公司还任命65岁的布鲁斯·哈蒙为公司首席财务官,立即生效。
关于Harmon先生的任命,公司和Harmon先生签订了雇佣协议(“Harmon雇用协议”),根据该协议,Harmon先生将
担任公司的首席财务官,并将获得325,000美元的年度基本工资。此外,Harmon先生
有权获得年度目标酌情红利,金额最多为其年度基本工资的30%,由董事会薪酬委员会酌情决定,但须受本公司于适用的花红派发日期聘用。根据Harmon雇佣协议,Harmon先生还有资格获得本公司可能不时向其员工提供的医疗福利,并每年获得带薪假期。根据Harmon雇佣协议,Harmon先生获得了一项长期股权激励,其形式为购买177,442股本公司普通股。此类
奖励在三年内按季度递增授予,条件是Harmon先生在适用的归属日期继续受雇于公司
。哈蒙先生授予的期权的行权价相当于每股0.4305美元,这是公司普通股在授予日在纳斯达克上的收盘价。
在收购Proteomedex的过程中,克里斯蒂安·布鲁尔曼被任命为首席战略官,拉尔夫·希斯博士被任命为首席科学官。Brühlmann先生是Proteomedex的联合创始人,并于2010年3月至2018年11月担任其首席财务和运营官。从2018年12月开始,Brühlmann先生担任Proteomedex的首席商务官。希斯博士于2010年3月与他人共同创立了Proteomedex,并从公司成立至2019年12月担任首席执行官。希斯博士随后在2020年1月至2023年5月期间担任Proteomedex的首席科学官。希斯博士于2023年6月重新担任首席执行官。
自2023年12月21日起,艾琳·亨德森辞去首席商务官一职,以寻求其他机会。于2024年1月17日,本公司与亨德森女士订立《分居协议及全面解除协议》,据此,本公司同意聘请由亨德森女士创立及管理的管理咨询公司Aetos Group(“Aetos”)为本公司提供若干咨询服务。
于2024年1月17日,本公司与Aetos订立咨询协议,根据该协议,Aetos将向本公司提供咨询服务至2024年4月25日,并收取月费约27,083美元。
自2024年1月10日起,尼尔·坎贝尔博士辞去总裁和董事首席执行官一职。公司与Campbell博士签订了一项索赔协议,根据该协议,Campbell博士将获得158,333美元的一次性遣散费。2024年1月12日,董事会任命公司首席科学官拉尔夫·希斯博士为公司临时首席执行官。作为临时首席执行官,希斯博士将对公司的业务和事务进行全面监督和指导。
最近的收购
蛋白质组分
见标题为“”的部分PMX交易和相关融资说明
“和”Proteomedex的业务描述.”
企业ADFI
2023年4月19日,本公司与Veru(“Veru APA”)签订了资产购买协议。根据Veru APA的条款及条件,本公司购买了与Veru的ENTADFI业务相关的几乎所有资产,并承担了Veru的某些负债
。这笔交易于2023年4月19日完成。
该公司购买了Veru与ENTADFI相关的几乎所有资产、权利和财产,可能的总对价为100,000,000美元(如下所述)。收购ENTADFI充分利用了FDA批准的药物ENTADFI在治疗良性前列腺增生症方面取得的明显成功,并
抵消了男性在替代BPH疗法中出现的负面性副作用。
根据Veru APA的条款,本公司同意向Veru提供合共2,000万美元的初步代价,包括(I)于交易完成时支付6,000,000美元,(Ii)额外4,000,000美元的无息票据,于2023年9月30日到期,及(Iii)额外1,000万美元,分别于2024年4月19日及2024年9月30日到期的两笔相等的无息票据(即各5,000,000美元)。本公司于2023年9月29日订立Veru APA修订案(“修订案”)。
根据Veru修订案,原于2023年9月30日到期的4,000,000美元应付票据于(1)于2023年9月29日向Veru支付1,000美元即时可用资金及(2)于2023年10月3日向Veru发行3,000股本公司A系列优先股后,视为已支付及悉数偿付。
A系列优先股的条款在2023年9月29日提交给特拉华州的指定证书中阐述。根据指定证书
,A系列优先股的每股股份将在A系列优先股发行之日起一年内转换为该数量的公司普通股,其确定方法为每股1,000美元的规定价值除以每股0.5254美元的转换价格(定义见指定证书),但须受指定证书规定的调整,但受某些股东批准限制的限制。A系列优先股
有权按比例分享本公司普通股支付的任何股息(按假设转换为普通股的基础),
没有投票权,但对指定证书中指定的某些重大事项除外,并具有相当于每股1,000美元的声明价值加上任何应计但未支付的股息的清算优先权
。A系列优先股可随时由公司选择全部或部分赎回。指定证书授权发行最多10,000股A系列优先股。
向卖方发行的A系列优先股最初总计可转换为约5,709,935股本公司普通股,但须受指定证书规定的调整和某些股东批准限制的限制。根据《Veru修正案》,本公司同意在2023年12月31日之前以商业上合理的努力获得股东的批准。该公司还同意将A系列优先股转换后可发行的普通股纳入下一份提交给美国证券交易委员会的转售登记声明中。
此外,Veru APA的条款要求公司根据公司ENTADFI业务在完成交易后的净销售额,向Veru额外支付至多800万美元。里程碑付款如下:(I)如果公司来自ENTADFI业务的年度净销售额等于或超过1亿美元,则应支付1,000万美元;(Ii)如果公司来自ENTADFI业务的年度净销售额等于或超过2亿美元,则应支付2,000万美元;以及(3)如果ENTADFI业务的年度净销售额等于或超过5.0亿美元,则应支付5,000万美元。每个净销售额里程碑的实现不应超过一次里程碑付款。
不能保证将达到任何里程碑付款的净销售额里程碑。
此外,在这笔交易中,公司根据Veru和Camargo Pharmtics Services,LLC于2017年12月11日签订的他达拉非-非那雄胺组合物的资产购买协议,承担了特许权使用费和里程碑义务。公司承担的Camargo债务包括对他达拉非-非那雄胺的所有销售收取6%的特许权使用费,以及不超过2250万美元的销售里程碑付款,具体如下:(I)在公司首次实现ENTADFI在一个日历年度的净销售额1.0亿美元时应支付500万美元,(Ii)在公司在一个日历年度首次实现ENTADFI的净销售额2.0亿美元时应支付750万美元。以及(3)当公司首次实现ENTADFI在一个日历年度的净销售额为3.0亿美元时,应支付1,000万美元
。
WraSer
于2023年6月13日(“签立日期”),
本公司与密西西比州有限责任公司WraSer,LLC,Xspire Pharma,密西西比州有限责任公司(统称为“WraSer卖方”)及Legacy-Xspire Holdings,LLC(特拉华州一家有限责任公司及WraSer卖方的母公司(“母公司”)(“WraSer APA”)订立资产购买协议。
根据WraSer APA,并受其条款及条件的规限,在WraSer的结算日(定义如下),公司将
购买FDA批准的六项药物资产,涉及多个适应症,包括心脏病、耳科感染和疼痛治疗
(“WraSer资产”)。
根据WraSer APA的条款,公司
将在签署WraSer APA时以350万美元的现金购买WraSer资产(“签署现金”);(Ii)在WraSer APA签署后90天或(Y)WraSer APA项下的所有成交条件满足或以其他方式放弃的日期(“WraSer成交日期”)以较晚的日期(X)以450万美元的现金购买WraSer资产;(Iii)可于WraSer结算日发行的100万股公司普通股
股票(“结算股”),及(Iv)WraSer结算日起一年内可发行的现金500,000美元。交易的完成须遵守若干惯常的成交条件,以及WraSer卖方及母公司于截至2022年及2021年12月31日止财政年度向本公司提交经本公司合理接纳的合格核数师审核的财务报表
。
在WraSer成交日起90天内,本公司将尽其最大努力(自费)向美国证券交易委员会提交一份登记声明,以S-3表格的形式根据证券法进行登记,并将尽其最大努力在可行范围内尽快宣布该登记声明
在提交后生效。
与WraSer APA一起,公司
与WraSer卖方于签立日期签订了管理服务协议(“MSA”)。根据MSA的条款,本公司将在执行日期至WraSer成交日期之间的期间内担任WraSer卖方业务的管理人。在此期间,如果需要维持运营,公司将向WraSer预付款。当WraSer根据美国破产法第11章向破产法院(见下文)申请救济时,公司作为WraSer卖家业务经理的参与终止。如果在WraSer成交日,WraSer卖家的现金余额超过了MSA中规定的110万美元的目标
金额(“现金目标”),公司将把超出的金额用于成交时到期的450万美元的现金付款。相反,如果出现差额,公司将被要求随着时间的推移将差额汇给
WraSer卖家。具体地说,由于公司收取了WraSer结束日期后产生的应收账款,公司
将被要求将50%的收款汇给WraSer卖方,直到差额全额支付为止。MSA在WraSer结束日期终止
。
WraSer APA可在关闭前按如下方式终止
:(I)经各方同意;(Ii)任何一方违反合同时,在通知后20天内未治愈。如果WraSer APA在与各方达成协议或WraSer卖方违反合同的情况下终止,WraSer卖方将保留最初的350万美元
付款。如果确定WraSer卖方存在未治愈的违约行为,并且终止了WraSer APA,则公司将向WraSer提出无担保债权,要求支付公司在签定WraSer APA时支付的350万美元。交易的完成取决于各种成交条件,包括提交FDA
转让文件以将收购产品的所有权转让给公司监管部门的批准。
2023年9月26日,WraSer及其附属公司
根据美国破产法第11章向破产法院申请救济。
2023年10月4日,双方同意修改WraSer《行政程序法》。在申请破产后不久,WraSer提交了一项动议,寻求批准修订后的WraSer APA。这项修订取消了2024年6月13日到期的500,000美元的成交后付款,并错开了公司在成交时必须支付的450万美元现金付款:(I)成交时支付220万美元,(Ii)230万美元,自2024年1月起按月分期付款150,000美元(“成交后付款”)和(Iii)789股A系列优先股将在成交时支付
。修正案还通过排除止痛药减少了我们获得的产品数量,仅包括(I)美国FDA NDA编号208251批准的商标OTOVEL及其授权仿制药OTOVEL的环丙沙星
0.3%和氟喹诺酮0.025%Otic溶液,(Ii)商标Cetraxal的0.2%环丙沙星Otic溶液,以及(Iii)根据美国FDA NDA N204886批准的商标Zontivity
的硫酸伏拉帕片。
2023年10月,WraSer提醒我们,其为Zontivity生产有效药物成分(“原料药”)的唯一
制造商将
不再生产Zontivity的原料药,Zontivity是收购WraSer的关键驱动因素。我们认为,根据《行政程序法》,这一事态发展构成了实质性的不利影响,使我们能够终止《行政程序法》和《行政程序法》。2023年10月20日,我们向破产法院提交了一项自动中止豁免的动议,以
行使经修订的WraSer APA下的我们的终止权。2023年12月18日,破产法院发布了一项协议命令,取消了自动中止,使我们能够行使我们终止《行政程序法》和《行政程序法》的权利,而不损害双方根据《程序法》和《行政程序法》各自享有的权利、补救办法、索赔和抗辩。2023年12月21日,我们向破产法院提交了终止APA和MSA的通知。WraSer通知我们,它不认为发生了重大不利事件。
由于WraSer申请破产以及我们作为WraSer的无担保债权人的身份,我们也不太可能收回350万美元的签约现金或与公司根据WraSer MSA提供的服务相关的任何成本和资源。
与红衣主教健康公司达成协议
于2023年9月21日,本公司与红衣主教健康105有限公司(“红衣主教健康”)订立独家经销协议(“独家经销协议”),自2023年9月20日(“生效日期”)起生效。根据及受制于独家经销协议的条款及条件,本公司聘请红衣主教健康作为其独家第三方物流分销代理,以
出售本公司所有商业资产。分销协议的有效期为自生效日期起计三年,除非根据独家分销协议的条款终止,否则会自动续期一年。
根据独家分销协议的条款,公司必须向红衣主教健康支付15,500美元的一次性启动费,以及在ENTADFI推出后每月7,000美元的账户管理费,以及各种服务的其他费用,包括启动后计划的实施、信息系统、仓库运营和金融服务。
公司名称变更及附例修订
2023年4月21日,该公司向特拉华州州务卿提交了公司章程修正案,将公司名称从“Blue Water Vaccines,
Inc.”改为“Blue Water Vaccines,
Inc.”。给“蓝水生物科技公司”。更名自2023年4月21日起生效。与更名相关,公司修改了公司章程,以反映公司名称Blue Water Biotech,Inc.,也于2023年4月21日生效。
2023年12月15日,该公司向特拉华州国务卿提交了公司注册证书修正案,将公司名称从“Blue Water Biotech,
Inc.”更改为“Blue Water Biotech,
Inc.”。致“Onconentix,Inc.”
与更名相关,公司
还修订了公司章程,以反映新的公司名称。
董事会于2023年5月31日修订本公司附例,将本公司股东大会的法定人数要求由有权投票的本公司已发行股份的多数投票权减至本公司有权投票的已发行股份的三分之一,即时生效。附例没有做出其他修改。
权证诱因
于2023年7月31日,本公司
与某一现有优先投资期权持有人(“持有人”)订立普通股优先投资期权行使诱因要约书(“诱因函件”),以购买本公司于2022年8月11日发出的普通股
普通股股份,原行使价为每股2.546美元(“现有优先投资期权”)。根据邀请函,持有人同意以现金方式行使其现有的PIO,以每股1.09美元的折合行权价购买2,486,214股公司普通股,以换取公司同意发行
新的优先投资期权(“激励PIO”),以购买最多4,972,428股公司普通股。
该激励PIO的条款与现有的PIO基本相同,但诱因PIO的行使价为每股1.09美元,期限为自发行之日起五(5)年。2023年8月2日,交易(“权证诱因”)
结束。在扣除配售代理费及本公司应付的其他发售费用后,本公司从认股权证激励中获得合共约230万美元的净收益。
本公司聘请H.C.Wainwright&
Co.LLC(“Wainwright”)作为其配售代理,并向Wainwright支付相当于行使现有PIO所得总收益的7.5%的现金费用,以及相当于行使现有PIO所得毛收入的
1.0%的管理费。本公司还同意偿还Wainwright与行使现有PIO和发行诱因PIO相关的费用,50,000美元的律师费用和其他自付费用,并同意向Wainwright支付35,000美元的非实报实销费用和15,950美元的清算费用。此外,现有PIO的现金行使触发了向Wainwright或其
指定人发行认股权证,以购买149,173股普通股,这些普通股的条款与诱因PIO相同,只是行使价格相当于每股1.3625美元。本公司还同意向Wainwright支付现金费用,金额为本公司可能从行使诱因PIO的现金中获得的任何毛收入的7.5%,并在任何
行使诱因PIO的现金时向Wainwright或其指定人发行认股权证,该普通股数量相当于已行使任何诱因PIO的普通股总数的6.0%,行使价也为1.3625美元。根据这一条款应支付的现金最高为406,496美元,根据这一条款可发行的权证最高数量为298,346份。
纳斯达克合规性
2023年9月18日,我们接到纳斯达克工作人员的通知,指出根据普通股连续30个工作日的收盘价计算,我们
没有遵守《投标价格规则》中关于继续在纳斯达克上市必须将最低投标价格维持在每股1.00美元的要求。从2023年9月18日或到2024年3月16日,我们有180天的时间重新遵守投标价格规则。
2023年8月22日,我们收到了来自纳斯达克的通知,称我们没有遵守纳斯达克上市规则第5250(C)(1)条的规定,该规则要求上市公司及时向美国证券交易委员会提交所有必需的
定期财务报告,因为我们未能及时提交截至2023年6月30日的10-Q表季报。2023年10月20日,我们提交了截至2023年6月30日的10-Q表格,2023年11月1日,我们宣布
我们重新遵守纳斯达克上市规则第5250(C)(1)条。
PROTEOMEDIX业务说明
概述
成立于2010年,Proteomeetry开发,营销
和销售非侵入性诊断测试以及决策支持系统,以检测和评估癌症的预后。蛋白质组学的
主导产品,Procarlix®是前列腺癌的体外诊断测试。蛋白质组学正致力于通过开发更准确检测和更有效治疗癌症的工具来解决癌症管理的所有阶段,包括(i)早期检测和确定癌症阶段的诊断
测试;(ii)用于识别侵袭性疾病患者的预后工具;
和(iii)分层生物标志物,以将患者与更可能安全有效的治疗相匹配。
目前,前列腺癌是影响男性的最常见和第二致命的癌症类型。前列腺特异性抗原(“PSA”)筛查的广泛应用自20世纪80年代开始广泛应用以来,帮助将转移性前列腺癌的发生减少了一半以上,但也导致过度诊断的显著增加,有时会导致过度治疗、严重并发症和潜在的心理
困扰。在全球范围内,每年约有1亿次前列腺癌诊断PSA检测,其中约10%的PSA读数出现在所谓的诊断“灰色地带”,即PSA检测结果不确定的区域。因此,每年都有相当多的男性因为PSA水平升高而被告知患前列腺癌的风险增加,除了侵入性针吸活检外,管理他们的癌症风险的选择有限。
Proclarix解决了前列腺癌过度诊断导致前列腺活检阴性的悬而未决的问题,从而增加了医疗系统的成本和患者的不确定性。Proclarix根据欧盟批准在欧盟销售体外诊断性调节(“IVDR”)。
临床研究证实,Proclarix通过从临床决策支持系统得出的风险评分,准确地识别出具有临床意义的前列腺癌,并可帮助避免许多不必要的活检。Proclarix作为一种临床支持系统,旨在收集多模式信息,努力开发以患者为中心的诊断方法。我们打算在未来的风险评分中添加更多信息,例如其他生物标志物或磁共振成像(MRI)数据,以提供一个更强大的工具来指导患者的诊断过程。使用的标记和生物信息学算法受专利保护。
欧洲泌尿外科协会(“EAU”)和美国泌尿外科协会/泌尿外科肿瘤学会(“AUA/SUO”)的指南都建议使用基于血液的生物标记物检测,如Proclarix,以帮助前列腺癌的早期发现和评估。Proclarix
可在任何实验室使用标准设备进行。在欧洲,Proteomedex已开始向选定市场的试点实验室
推广Proclarix,这些市场开放自费以展示其初步采用情况。在美国,根据Proteomedex和Labcorp于2023年签订的独家许可协议,Proclarix的开发和商业化由美国实验室控股公司(通常称为Labcorp)进行。
技术与知识产权
Proteomedex的生物标记物是通过遗传学引导的发现方法发现的,重点放在PI3K/PTEN癌症途径上,该途径在前列腺癌的发展中起着主导作用。
将蛋白质组学技术应用于与疾病相关的小鼠模型,可以识别与前列腺癌分子相关的蛋白质
。Proclarix中使用的生物标记物和生物信息学算法受欧洲、美国和其他国家/地区已颁发和正在申请的专利保护。
组队
Proteomedex是由一个多学科的科学家和临床医生小组创立的,其中包括名誉教授梅德博士。瑞士癌症研究基金会的总裁教授、蛋白质组学技术开发的先驱Ruedi Aebersell教授以及癌症研究的领军人物已故Wilhelm Krek教授。公司管理层由开发生物标记技术的首席执行官拉尔夫·希斯博士和在财务、业务发展和产品管理方面拥有丰富经验的克里斯蒂安·布鲁尔曼组成。
市场潜力和竞争优势
PSA检测代表了前列腺癌诊断中目前的护理标准。它准确地识别出没有疾病迹象的个人。大约10%的男性PSA水平升高,通常被称为诊断性“灰色地带”,其中只有20%-40%的人临床上患有癌症。
Proclarix用于诊断这些患者,在这些患者中,很难确定是否需要活检来验证潜在的临床显著癌症诊断。这一细分领域对改进患者分层或诊断分诊的高度未得到满足的需求
仅通过几项测试就能解决。与这些检测相比,Proclarix具有重要的竞争优势:(I)它显示出卓越的临床性能,(Ii)它是基于血液的,因此具有最小的侵入性,以及(Iii)与基于尿液的检测相比,它具有高度的重复性。Proclarix的使用不需要事先进行前列腺按摩。样品是稳定的,可以在常温下运输。Proclarix
具有很高的准确性和阴性预测值(NPV),易于在现成的设备上实现自动化,并可适应当前的实验室实践和临床常规。
商业化战略
Proteomedex已开始向欧洲选定市场的试点实验室推销Proclarix,这些实验室开放自费以展示最初的采用情况,同时向欧洲关键市场的公共和私人付款人寻求报销,以确保长期广泛采用。Proclarix的市场推介
遵循了两个阶段的方法:首先是市场准备阶段,在此阶段我们联系选定欧洲国家的主要意见领袖以寻求他们对Proclix的支持,然后是市场开发阶段,我们将通过面向泌尿科医生和全科医生的重点营销和销售活动开始在这些市场商业化Proclarix
。我们打算通过具有参考诊断实验室的合作伙伴关系
确保对检测的访问。我们已开始接触经常为研究地点和学术合作伙伴提供服务的商业实验室和医院实验室,并在瑞士、德国、意大利和英国的实验室建立了试点。
在美国,Proteomedex于2023年与Labcorp建立了独家合作伙伴关系,据此Labcorp拥有独家权利,使用许可证所涵盖的Proteomedex知识产权在美国开发和商业化Proclarix、
和Labcorp开发的其他产品,用于前列腺癌的识别、筛查、分期、易感、诊断、预后、监测、预防或治疗选择。作为授予Labcorp独家许可的代价,Proteomedex收到了预付许可费,并有权根据许可产品在美国的销售情况获得版税和里程碑付款。LabCorp完全负责许可产品在美国的研究、开发和商业化的费用,但有权将这些费用的一部分与未来因Proteomedex支付的版税和里程碑付款相抵销。
市场机遇
2022年,体外诊断(IVD)产品的全球市场价值为1178亿美元。根据Markets和Markets的数据,欧洲和北美是最大的市场,其次是亚洲,主要是日本和中国。
Proclarix是Proteomedex的第一款诊断产品,
正在解决与前列腺癌相关的未得到满足的医疗需求,前列腺癌是男性第二常见的癌症,根据世界癌症研究基金会国际数据,2020年全球估计有140万新病例和超过395,000人死亡。在全球范围内,每年约有1.5亿次PSA检测,其中约三分之二用于前列腺癌诊断,筛查主要由全科医生安排。约有850万患者处于诊断灰色地带。Proclarix的目标应用
是在此诊断灰色区域重新测量样本。
根据美国癌症协会的数据,大约三分之二的前列腺癌诊断发生在人类发展指数排名非常靠前的国家,而世界上只有18%的男性人口居住在这些国家。这突显了市场对改进的诊断工具的巨大需求,特别是在拥有强大的医疗基础设施的地区,早期发现和治疗至关重要。我们的创新测试旨在通过提供更高的准确性、可及性和效率来满足这一需求,将其定位为抗击前列腺癌的宝贵资产,同时也为利益相关者提供了
有利可图的商业机会。图1列出了不同地区的市场潜力。
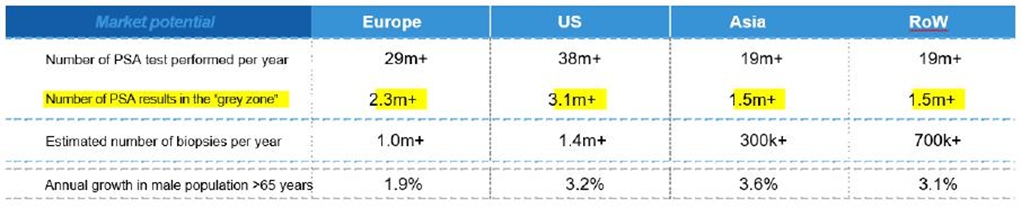
图1:全球市场潜力概览。
目前,标准的前列腺癌筛查将直肠指检(“DRE”)与PSA测量相结合。PSA不是高度癌症特异性标记物,这意味着它会发现血液中PSA水平升高的许多良性疾病--例如临床上不明显的前列腺增大或
炎症。其后果是前列腺癌过度诊断,导致不必要的前列腺活检。据目前估计,接受活检的男性中,超过60%的人没有临床上明显的前列腺癌,但由于活检,
可能会出现感染、出血和大小便失禁等副作用。
核磁共振用于前列腺癌的诊断在过去十年中迅速被采用。有临床证据表明,与其他方法相比,磁共振成像可以让临床医生验证诊断,并改进具有临床意义的前列腺癌的定位、风险分层和分期。MRI引导的活检比超声引导的活检具有更高的准确性。然而,基于MRI的前列腺癌诊断受到相对较高的费用(415-900美元)和可获得性有限的阻碍。尽管如此,高达三分之一的核磁共振检查是不确定的。因此,对于具有临床意义的前列腺癌,显然需要一种改进的、具有更高特异性的非侵入性诊断测试,以帮助选择接受MRI、MRI引导下的活检和活检的患者。
对临床上有意义的癌症和不明显的类型或非癌症疾病(如良性前列腺增生)进行正确的分类,对于防止过度治疗及其相关的副作用和成本非常重要。Proteomedex正在开发疾病预后和监测的诊断工具,这些工具对于可靠、患者友好和具有成本效益的疾病管理至关重要。Proteomedex的生物标记物已经显示出区分前列腺癌患者的潜力,这些患者更有可能对某些基于药物的干预措施产生反应。有了这些信息,可以做出更好的药物治疗选择,以最大限度地提高有效治疗的可能性。Proteomedex的生物标志物也可以帮助临床药物开发。
我们的产品战略
商业模式
Proteomedex在高度监管的领域开发新型诊断测试
。该公司的核心能力包括开发高质量的免疫分析和管理监管事务。该公司在免疫分析开发方面的专业知识是高度专业化的员工队伍的结果,他们与外部软件开发公司一起开发了集成在该公司领先的IVD
产品Proclarix中的专有软件。公司人员在实施和维护符合法规要求的最先进质量管理体系方面也拥有丰富的经验,包括进行临床研究和管理关键意见领袖(“KOL”)。
公司在这些领域的经验和专业知识是通过聘用有经验的人员以及通过关键顾问获得的。
Proteomedex最初将专注于营销(特别是面向医生的医疗营销)和对选定国家/地区的实验室的直接销售。一旦将地理范围扩展到更多国家/地区,销售将通过专业分销商进行,但Proteomedex仍将为为医生提供检测服务的
实验室提供医疗营销和技术客户支持。生产能力最初不会在内部建立,因为这需要在生产设备上进行大量投资。相反,制造外包给德国的合同制造组织
(“CMO”)。该公司的IVD试剂盒中使用的所有关键试剂(即抗原和抗体)都是专有的,由Proteomedex独家拥有。这些试剂由德国的一家独立供应商生产,然后运往CMO制造IVD试剂盒。
产品和管道
Proteomedex正在寻求开发诊断、预后和预测工具,以实现在疾病进展的所有阶段进行更有效的癌症管理。Proteomedex的测试
使用专有的蛋白质生物标记物来解决当前癌症检测、预后和治疗预测方面的局限性。此外,决策支持系统通过将不同的输入整合到风险评分中来支持临床决策(参见图2)。

图2:产品管道
普乐可复
减少前列腺癌过度诊断的临床决策支持
Proclarix用于通过从临床决策支持系统(图3)得出的风险评分来指示具有临床意义的前列腺癌的风险。在试剂方面,它由两种定量的酶联免疫吸附分析(“ELISA”)组成,用于测量人血清中凝血酶反应蛋白1(“THBS1”)和组织蛋白酶D(“CTSD”)的浓度。临床决策支持系统是运行专有算法的基于Web的软件,该算法集成了THBS1和CTSD的值、患者的年龄以及来自第三方提供商(例如,罗氏诊断公司、西门子医疗保健公司)的总PSA水平和免费PSA水平,以计算风险评分。
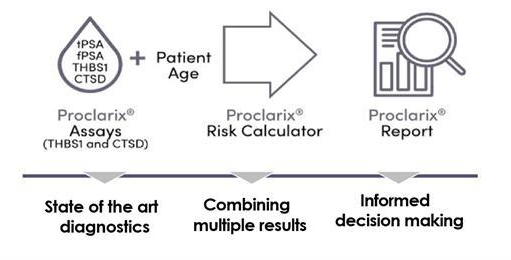
图3:Proclarix:风险分数计算的分析和软件算法。
Proclarix被用作前列腺癌的辅助诊断
作为PSA和DRE检测之后的二线检测。它使每个患者能够根据客观风险参数(4个血清糖蛋白+年龄)为每个患者做出个性化决策,以便在活检或监测方法之间进行分类。Proclarix已被验证和批准
用于总PSA2.0至10.0 ng/mL升高、正常DRE对癌症不可疑以及前列腺体积增大(≥35毫升)的男性(图4)。Proclarix决策支持工具返回可用于帮助区分临床显著(2级或更高级别)的风险分数[GG2+])和微不足道的前列腺癌或良性前列腺疾病。Proclarix的风险评分
为医生和患者提供了可操作的信息,以便在考虑前列腺癌诊断所需的前列腺活检的必要性时自信地做出决定。
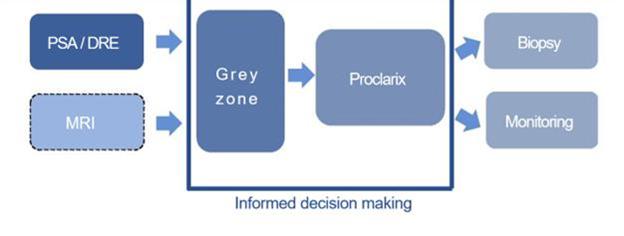
图4:Proclarix:发现临床上有意义的前列腺癌
处于诊断“灰色地带”。
临床研究
Proteomedex的生物标记物已经在临床研究中进行了测试,包括来自多个临床地点的总共2000多个患者样本,结果已发表在同行评议的期刊上。我们相信这些结果表明,Proclarix是一种识别具有临床意义的前列腺癌的有价值的测试,因此有助于考虑进行前列腺活检的患者做出明智的决定。
验证性研究。导致欧洲监管机构批准的这项研究包括在两个临床地点、奥地利因斯布鲁克的一个筛查中心和德国汉堡的一个转诊中心收集的955个样本。这项研究的结果表明,通过使用Proclarix测试,不需要的活检的负担可以降低约43%-与临床比较者游离PSA百分比
(“%fPSA”)或PSA密度相比,降低了约两倍。对于具有临床意义的前列腺癌,90%的敏感度和95%的阴性预测值表明极少数癌症的诊断会被推迟。
提出研究建议。这项拟议的研究评估了Proclarix在前列腺活检决策中的准确性。德国、丹麦和奥地利的10个临床站点前瞻性地招募了457名男性进行前列腺活检。Proclarix检测到具有临床意义的癌症,敏感度高于90%,并可靠地排除了阴性预测值大于90%的无癌或惰性癌患者。在MRI引导下进行活检时,敏感性(97%)和阴性预测值(96%)都更高。重要的是,Proclarix在排除不必要的活检(22%对14%)方面明显优于当前的临床标准%fPSA,并且达到了主要研究终点(p值
那不勒斯研究。一项双中心研究评估了Beckman Coulter公司的Proclarix和前列腺健康指数(Phi)测试在总共344名男性中预测临床显著前列腺癌的作用。
Proclarix和Phi测试都准确地预测了临床显著的癌症。当使用制造商推荐的预定义分界值时,Proclarix(分界值10)在特异性和阳性预测值方面优于Phi(分界值27)(p
普罗克拉克斯的临床评价。联合使用Proclarix和MRI进行前列腺癌诊断的多项临床评估结果表明,Proclarix可以在不需要限制前列腺体积的情况下用于广泛的患者
。其中一项评估的目的是评估Proclarix
结合MRI的诊断性能。分析了721名在两个临床中心接受核磁共振检查和活组织检查的男性的血液样本。联合使用Proclarix-MRI评分的特异性(68%)显著(p
临床指南
指南帮助临床医生在考虑现有科学数据的情况下,做出明智的治疗决定。为了减少PSA水平在3-10 ng/mL之间且DRE正常的无症状男性的阴性活检次数,EAU指南建议使用根据人群患病率进行正确校准的在线风险计算器、前列腺MRI或附加的生物标记物测试,如Proclarix。EAU指南明确指出,Proclarix与重大前列腺癌的检测相关,特别是在MRI结果不明确的情况下。
Proclarix也包括在2023年AUA/SOO
临床实践指南中。AUA/SUO指南涵盖了前列腺癌早期检测的建议,并提供了一个框架,以促进前列腺癌筛查、活检和随访的临床决策。AUA/SUO指南
得出结论,前列腺癌风险的评估应侧重于临床上有意义的前列腺癌(GG2+)的检测。
AUA/SUO指南建议,当前列腺癌筛查后认为有必要进行前列腺活检时,使用实验室生物标记物,如Proclarix、前列腺MRI和活检技术可能会提高检测率和安全性。
将Proclarix纳入欧洲和美国的指南是对Proclarix临床价值的重要认可。这是对Proclarix用于前列腺癌检测的临床效用和重要性的验证,我们相信它将导致Proclarix被更广泛的接受,并加快付款人的采用。
研发与管道产品
普罗斯加德
Prosgard作为临床支持系统
旨在收集多模式信息,以努力开发以患者为中心的诊断方法。Prosgard的愿景是在未来将更多信息添加到现有的Proclarix风险评分中,例如其他生物标记物、临床信息或核磁共振成像数据,以提供更强大的工具来指导患者的诊断过程。
预后(Px)
Proteomedex的蛋白质生物标志物的一个子集也与前列腺癌的预后相关。根治性前列腺癌根治术为临床局限性前列腺癌提供了良好的癌症控制。然而,大约30%的接受手术治疗的男性将在手术后10年内经历癌症复发。
几个临床参数及其组合(例如前列腺癌风险评估(CAPRA)评分)
已被证明是治疗失败的可靠预测因素。尽管如此,迫切需要确定与生物学侵袭性前列腺癌存在明确联系的新标记物,以改善对PSA水平中度升高的人群的预后预测。
一种可改善确诊前列腺癌患者疾病预后的新血清生物标记物五元组
建立了包括纤维连接蛋白1、Galectin-3结合蛋白、Lumcan、基质金属蛋白酶9、凝血酶敏感蛋白-1和PSA的多变量模型,并结合临床分级(GG)和临床分期(CT)进行了临床评估。在557名确诊为局限性前列腺癌的男性患者的血清样本中,评估了所建议的标记物组合的预后效用。分析表明,与“CAPRA”评分相比,建议的模型对疾病进展和前列腺癌侵袭性的预测更好。这一新的生物标志物测试具有通过指示谁需要积极治疗来改善前列腺癌患者管理的潜力。与竞争对手现有的生物标记物检测都需要组织样本不同,该检测是非侵入性的,可以直接在患者的血液样本中进行测量。
预测(Rx)
Proteomedex的蛋白质生物标记物
进一步有可能预测接受抑制PI3K信号通路的药物治疗的患者的反应。
Proteomedex分析了参与II期试验(SAKK 08/08)的患者的血液。患者接受诺华制药的埃博利莫斯治疗,这是一种通过阻断mTOR来抑制PI3K信号通路的药物。8个血清生物标志物的子集可以单独预测达到主要终点(12周无进展存活率),准确率至少为75%。与制药合作伙伴就此类标记物在个性化医学研究中的潜在用途的早期讨论正在进行中。
决策支持系统
最近的举措包括
以及解释来自各种来源的临床信息(例如,生物标记物信息和其他患者数据),使医生
能够对每个患者的疾病有更全面的生化洞察,以便为患者确定最佳治疗计划。整理临床工作流程中的多个数据源可以实现精准医疗,从而实现经济高效的诊断和治疗。Proclarix已经由一个决策支持系统组成,该系统将不同的值整合到一个风险分数中。将来,可以将其他临床信息(如MRI扫描结果)整合到报告中,以提供患者诊断情况的完整图像,从而实现有效的患者管理。
产品质量和安全
Proteomedex的质量管理体系
已通过国际标准化组织13485:2016年认证,可用于“前列腺癌管理的体外诊断试剂和独立软件的设计和开发、生产和销售”。Proteomedex由总部设在德国的国际公认的通知机构S德国产品服务有限公司每年进行审核。ISO认证是获得CE标志的先决条件
CE标志是市场准入的监管许可要求,在IVDR中得到欧洲委员会(“EC”)的认可。根据IVDR,诊断产品被归类为从A类(低风险)到D类(最高风险)的四种分类之一的新系统。Proclarix作为C级设备,已通过TÜV S德意志集团的符合性评估,获得了IVDR认证。
根据新的IVDR认证,Proclarix符合目前用于癌症筛查、诊断或分期的最高质量标准
。Proteomedex正在将Proclarix作为首批符合IVDR标准的癌症测试之一进行营销
,以展示对最高分析和临床性能的承诺。
知识产权
技术
癌症源于不同的基因突变,这些突变可以与特定的信号通路相关联,这些信号通路通常被称为癌症通路。根据患者受影响的途径,会导致不同的癌症亚型,或多或少具有侵袭性,并进一步确定患者是否对某种药物治疗有反应。
Proteomedex的生物标记物是由苏黎世理工大学的一组研究人员使用遗传学指导的发现方法发现的,该方法专注于PI3K/PTEN癌症途径,该途径在前列腺癌的发展中起着主导作用。使用小鼠模型和基于质谱学的蛋白质组学技术,包括糖蛋白浓缩技术,可以识别出与癌症的分子原因直接相关的蛋白质,从而将其与前列腺癌的疾病状态相关联。不同的血清糖蛋白结合形成了预测组织PI3K/PTEN状态以及前列腺癌的诊断和预后的多重生物标志物签名(图5)。基因引导的蛋白质组学方法使
能够快速发现和验证几个生物标记物,这些生物标记物以不同的组合对应于诊断、预后和潜在的治疗反应。
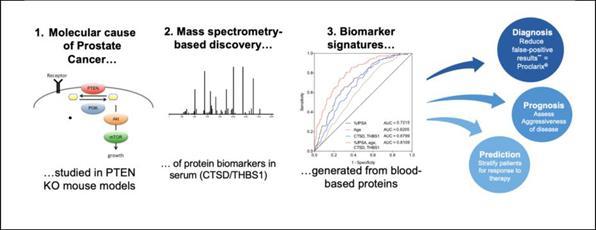
图5:改善前列腺癌疾病管理的蛋白质组学方法。
生物标志物分析从基于质谱学的平台转移到以免疫分析为基础的平台。与其他分析方法相比,基于免疫分析的测量具有多项优势。通常,免疫分析提供快速、灵敏、可重复性、成本效益高且易于管理的分析。
所用试剂稳定,该方法在常规诊断实验室建立,确保Proteomeix在已建立的自动化临床平台上的测试广泛兼容,从而快速采用率和诊断测试的平台灵活性。Proteomedex在选择新的生物标记物、检测开发和临床开发方面的深厚知识使其能够建立几个研发合作伙伴关系。
2021年,Proteomedex与开曼群岛大开曼群岛的New Horizon Health Limited建立了研发合作伙伴关系。这一合作建立在免费平台和生物标记物开发的基础上,在癌症患者管理方面具有实用价值。
2022年,免疫公司(瑞典)与Proteomedex合作,利用Proteomedex的研发能力,推进他们的研发工作。通过这一合作伙伴关系,免疫获得了一个更灵活的研发组织,提高了研发生产率,并将内部资源重新集中在商业建设上,从而进一步加快了其专有IMMray的推出TMPANCAN-d测试。
这一合作利用了两家基于蛋白质组学的诊断领域领先创新者的综合专业知识,这两家公司都推出了创新的肿瘤学测试,免疫与IMMrayTMPANCAN-d在美国,Proteomedex与Proclarix®在欧洲。
专利
Proteomedex已在全球范围内独家授权苏黎世工业大学和圣加伦州立医院的一个专利家族的权利,该家族描述和保护用于诊断和监测前列腺癌的专有生物标记物的使用。母公司国际专利申请WO 2009138392 A1于2008年5月14日(优先权日期)提交,并在中国(CN201027373B)、欧洲(EP2281201B1)、日本(JP6025607B)和美国(US10151755B2/US9377463B2)获得授权。
Proteomedex还从苏黎世获得了与糖蛋白特定浓缩有关的某些专利的非独家许可,包括苏黎世从西雅图系统生物学研究所(ISB)获得许可的EP1514107。该许可证使Proteomedex能够使用糖蛋白技术开发新的诊断产品。
此外,Proteomedex于2016年7月15日提交了一项涵盖最新开发和临床结果的新专利
。该专利涵盖了Proteomeix的第一个产品(Proclarix)中包含的用于改进前列腺癌诊断的特定测试格式和算法。国际
申请(WO2018011212A1)已在欧洲(EP3270163B1)、日本(JP6979712B2)、韩国(KR102408276B1)、
澳大利亚(AU2017294979B2)、美国(US11320435B2)和中国(CN109477836B)获得授权,该申请在加拿大(CA3028874A1)仍在等待中。
Proteomedex于2021年6月29日提交了一项专利申请,描述了一种将Proclarix和磁共振成像相结合来诊断前列腺癌的方法。该专利最初在瑞士提交,随后作为PCT申请(WO2023274742A1),并在美国和中国作为国家申请。
Proteomedex于2021年6月29日提交了一项专利申请,该申请描述了一种测量前列腺癌患者血液中具有预后效用的蛋白质组合的方法。该专利最初是在瑞士提交的,随后是一项国际申请(WO2018011212A1)。国家申请
在欧洲、美国和中国提交。
商标
Proteomedex品牌于2010年6月4日提交申请,并于2010年6月22日在瑞士注册,注册号为602190。该申请是国际商标申请的基础。产品名称Proclarix于2019年7月1日注册,并于2019年7月22日在瑞士注册,注册号为733974。该申请是国际商标申请的基础。产品名称“Prosgard”于2019年7月1日备案,并于2019年7月22日在瑞士注册,注册号为733975。
竞争
分子诊断领域竞争激烈
,其特点是快速的技术变革、频繁的新产品推出、不断变化的客户偏好、新出现的竞争、
不断演变的行业标准、报销不确定性和价格竞争。此外,该行业最近的整合允许较大的临床实验室服务提供商
提高成本效益和服务水平,导致竞争更加激烈。
Proclarix竞争分析
评估前列腺癌高危男性的市场很大,有许多竞争对手,其中一些拥有更多的财务、销售、后勤和实验室资源,
在与第三方付款人打交道方面有更多经验,更大的市场渗透率、购买力和营销预算,以及更多提供诊断服务的经验
。一些公司和机构正在开发基于液体活组织检查(血液和尿液)的测试和诊断性测试,其基础是检测与前列腺癌相关的蛋白质、mRNA、核酸或突变基因片段的存在。这些竞争对手可能比我们在技术、财务、声誉和市场准入方面都有优势。
市场上已经有许多检测方法,或者正在进行的临床测试或商业开发中,它们也旨在对PSA水平中度升高的男性进行分类诊断。
在这些检测中,大多数也仅将PSA作为生物标志物。PSA的某些异构体是不同的,或者除了蛋白质水平外,还需要确定转录水平(MRNA)
。在这些检测中,建立得最好的是%fPSA,它也可以从PSA检测的所有供应商那里获得
,包括市场领先者雅培、罗氏诊断公司、西门子医疗保健公司和Beckman Coulter,Inc.然而,敏感性和特异性的改善非常有限。
OPKO Health,Inc.(纳斯达克代码:OPK)的4KScore和Beckman Coulter,Inc.的PHI评分测量其他形式的PSA和相关蛋白质,但它们也不包括其他生物标记物
。4KScore测试是一种基于血液的4-plex测试,它将血液测试结果与临床信息结合在一个算法
中,该算法在首次或重复活检(以前没有前列腺癌诊断
)之前计算患者患侵袭性前列腺癌的百分比风险。4KScore测试于2021年12月获得FDA的上市批准。Phi评分结合三项血液测试的结果,提供有关PSA水平升高可能意味着什么以及活检发现前列腺癌的可能性的信息。
克利夫兰诊断公司的IsoPSA测试分析PSA的结构变化,以检测潜在的癌症生物学。
在过去的十年里,针对更多生物标志物的尿液基因检测成为可能。Gen-Probe Inc.(现在是霍洛奇公司的一部分)的PCA3测试是第一个推向市场的基因检测。MDxHealth SA的SelectMDx测试测量了两个基因的组合,并将它们与PSA值、前列腺体积、患者年龄和直肠指检相结合,得出风险分数。该检测针对的是患者尿液中的mRNA转录本。通常情况下,mRNA不能充分进入尿液进行直接分析。
因此,这种检测方法需要在采集样本之前进行前列腺按摩,尿样将在
专业实践中采集。来自生物技术公司子公司Exosome Diagnostics,Inc.的ExoDx IntelliScore测量从尿液中收获的Exosome中的PCA3和其他基因转录本。该方法不需要前列腺按摩,但不同的生物标志物会产生大量(30%)不确定样本。此外,由于mRNA相对不稳定,样品
在运输过程中需要冷藏,测试周期相对较快。
斯托克霍尔米测试是由瑞典卡罗林斯卡研究所领导并由欧洲创新与技术健康研究所资助的学术倡议OncoWatch的一部分。斯托克霍尔米测试是一种基于血液的测试,它通过分析五种蛋白质标记物、100多个遗传标记物和临床数据,在活检时预测侵袭性前列腺癌的风险。
除PCA3、前列腺健康指数和4KScore外,上述所有检测仅通过专业参考实验室提供检测服务,不作为商业产品提供
。检测是由一个诊断实验室作为实验室开发的测试(“LDT”)集中进行的。在美国,LDT的应用有限,而在欧洲,泌尿科医生大多不了解LDT。到目前为止,欧洲唯一一个接受LDTS的国家是西班牙。2019年总共进行了大约100,000次LDT测试。平均价格
/报销(如果包含)为600美元。
近年来,基于MRI的诊断和靶向活检正在成为专业中心的标准选择。由于MRI仪器成本高昂,而且其可用性仍然有限,因此需要诊断来支持Proclarix可以满足的执行MRI的决定。MRI不被视为与Proclarix的定位竞争,而是互补。
Proclarix的竞争优势
尽管
上市一段时间了,但竞争对手的测试都没有进入护理标准,渗透率非常有限。Proclarix
具有重要的竞争优势:
| |
● |
血基检测 |
- |
侵入性最小,重复性高,不需要前列腺按摩,适合运输,是临床实验室最常见的样本类型,因此适合当前的实验室工作流程 |
| |
● |
以免疫分析为基础 |
- |
与当地实验室现有的实验室仪器兼容 |
| |
● |
易于实现自动化
|
- |
适应临床常规,见效快 |
| |
● |
目标
结果生成 |
- |
类似的
独立于运算符的结果 |
| |
● |
遗传学引导的发现 |
- |
与癌症相关的高度可信的生物标志物 |
Proclarix
可应用于任何诊断实验室,使用现成的免疫分析技术平台。此外,Proclarix非常适合当前的实验室工作流程,这对于受效率和成本驱动的实验室非常重要。
利益相关者以各种方式受益于Proclarix:
患者:
通过快速得出结果的微创程序获得是否真的需要活组织检查的更多确定性。这减少了人们对前列腺癌诊断的焦虑,减少了活检带来的并发症和副作用。
医生:
将重点放在具有临床意义的相关癌症患者身上,并通过显著减少不必要的前列腺活检及其伴随的并发症来提高患者满意度。不需要额外的培训或新的后勤流程:可以使用标准的采血设备,并将血样送到当前的实验室。
实验室:
无需额外投资购买新设备即可增加收入,因为Proclarix可方便地应用于任何实验室。
付款人
(保险公司):通过节省避免活检(伴随并发症、不适的风险)和由此导致的过度治疗的成本来增加利润。
销售、分销、营销和广告
在临床诊断中,像PSA这样的高通量分析参数通常是在使用专有试剂的封闭、完全集成的系统上执行的。集成系统由几家大中型诊断公司提供(例如罗氏诊断公司、雅培、西门子医疗保健公司、DiaSorin S.p.A.)拥有遍布全球的分销网络。试剂以封闭系统方式提供,访问仅通过协作协议进行。与多家诊断公司的业务发展谈判已经开始。
较低的
卷参数在较小的开放系统上运行,这些系统在实验室中用于吞吐量较低的测试,以补充测试
菜单。在市场推出期间,进入这些开放系统为在选定的市场直接商业化提供了一种选择。首先,
目标是建立商业概念验证并推动最初的市场采用。
市场
KOL和临床泌尿外科中心推动了一种新检测方法的采用。发表临床研究证明该测试的医疗益处,以及KOL在科学会议上倡导该测试,将引发其他医生的使用。此外,需求是通过覆盖大片地理区域的前列腺癌专业泌尿外科中心创造的。他们对该地区其他泌尿科医生和全科医生的影响将导致乘数效应。临床泌尿科中心的诊断检测由医院内部实验室或商业实验室提供,Proclarix将在该实验室实施。
全科医生招募患者进行筛查,并决定是否将患者转介给专家。他们扮演着重要的看门人角色,而Proclarix是此分类的有用工具。商业实验室网络的营销拓展(例如,瑞士Unilabs;澳大利亚Sonic Healthcare;美国Labcorp)提供了通过其专业销售团队直接面向私人执业的大量全科医生和泌尿科医生的机会。
Onconentix管理层对财务状况和财务状况的讨论与分析
运营结果
运营结果的组成部分
研究和开发费用
基本上
我们所有的研发费用都包括与我们的候选产品开发相关的费用。
这些费用包括支付给第三方代表我们进行某些研究和开发活动的费用、咨询成本、实验室用品成本、产品采购和许可成本、某些工资和人员相关费用(包括工资和奖金)、员工福利成本和我们研究和产品开发员工的股票薪酬支出,并分配了
管理费用,包括信息技术成本和公用事业。我们在发生内部和外部研发费用时对其进行支出
。
我们
不按候选产品分配我们的内部成本,因为相当大的研发费用包括
成本,如工资和其他人员费用、实验室用品和分配的管理费用,以及外部成本,如支付给第三方
代表我们进行研发活动的费用,这些成本不按候选产品跟踪。
预测完成我们的临床计划或验证我们的商业制造和供应流程的时间或成本是很困难的
,可能会因为许多因素而发生延误,包括我们无法控制的因素。例如,如果FDA或其他监管机构
要求我们进行超出目前预期的临床试验,我们可能需要花费大量额外的财政资源和时间来完成临床开发。此外,我们无法预测我们的产品
候选产品何时或是否肯定会获得监管部门的批准。
销售、一般和管理费用
销售方面,一般及行政开支主要包括工资及人事开支,包括薪金及奖金、福利及
股票薪酬开支、法律、咨询、会计及税务服务的专业费用,以及ENTADFI的商业化,
包括资讯科技成本及其他不属于研发开支的一般营运开支。
我们
预计我们的销售、一般和行政费用将继续增加,原因是人员成本增加、基础设施扩大以及与遵守适用的证券交易所和美国证券交易委员会要求相关的咨询、法律和会计服务成本增加、投资者关系成本、董事和与上市公司相关的高级管理人员保险费
以及产品商业化成本。
运营结果
2022年和2021年12月31日终了年度比较
下表汇总了我们在所示期间的运营报表和全面亏损:
| | |
截至12月31日的年度
,
2022 | | |
年
结束
十二月三十一日,
2021 | | |
$
更改 | | |
%
更改 | |
| 运营费用
| |
| | |
| | |
| | |
| |
| 常规
和管理 | |
$ | 9,351,552 | | |
$ | 2,092,304 | | |
| 7,259,248 | | |
| 346.9 | % |
| 研发
| |
| 4,129,688 | | |
| 1,325,030 | | |
| 2,804,658 | | |
| 211.7 | % |
| 运营费用总额
| |
| 13,481,240 | | |
| 3,417,334 | | |
| 10,063,906 | | |
| 294.5 | % |
| 运营亏损
| |
| (13,481,240 | ) | |
| (3,417,334 | ) | |
| (10,063,906 | ) | |
| 294.5 | % |
| | |
| | | |
| | | |
| | | |
| | |
| 其他
收入 | |
| | | |
| | | |
| | | |
| | |
| 或有权证负债的公允价值变动
| |
| (61,410 | ) | |
| — | | |
| (61,410 | ) | |
| * | |
| 其他收入合计
| |
| (61,410 | ) | |
| — | | |
| (61,410 | ) | |
| * | |
| 净亏损
| |
$ | (13,419,830 | ) | |
$ | (3,417,334 | ) | |
| (10,002,496 | ) | |
| 292.7 | % |
一般费用
和管理费用
在截至2022年12月31日的一年中,与2021年相比,一般和行政费用增加了约730万美元。增长的主要原因是员工和董事的薪酬和福利增加了约240万美元,包括年度奖金薪酬和股票薪酬
增加了约240万美元,以审计、会计、
和法律服务为主的专业服务增加了约120万美元,与公司增长和发展相关的各种业务活动增加了
,如签订新租约、专利相关费用、特许经营税、差旅和商业咨询服务等总计约
90万美元。与现在成为一家上市公司相关的其他业务活动增加了约110万美元。此外,在截至2022年12月31日的年度内,本公司与Boustead的和解协议产生了约130万美元的相关费用,以及因提前与该承销商终止协议而向本公司前承销商支付的非经常性解约费约30万美元。
研究和开发费用
在截至2022年12月31日的一年中,研发费用比2021年增加了约280万美元。增加的主要原因是员工薪酬和福利(包括年度奖金薪酬和基于股票的薪酬)增加了约110万美元,主要与BWV-201相关的临床前开发活动增加了约150万美元,外部研发人员成本增加了约40万美元,但被许可费减少了约30万美元所抵消,这主要与根据2021年6月1日与儿童医院医疗中心签订的许可协议而产生的一次性许可费有关。D/b/a辛辛那提儿童医院医疗中心截至2021年12月31日的
年度。
其他
收入
截至2022年12月31日止年度的其他
收入与或有认股权证负债的公允价值变动有关,该等负债是于2022年4月及8月私募发行结束时产生的。截至2021年12月31日止年度并无其他收入或支出。
截至2023年9月30日和2022年9月30日的9个月的比较
下表汇总了我们在指定时间段的运营报表:
| | |
九个月已结束
9月30日,
2023 | | |
九个月
已结束
9月30日,
2022 | | |
$
更改 | | |
%
更改 | |
| 运营成本和支出
| |
| | |
| | |
| | |
| |
| 销售,
一般和管理 | |
$ | 8,337,615 | | |
$ | 7,311,243 | | |
$ | 1,026,372 | | |
| 14.0 | % |
| 研发
| |
| 2,148,327 | | |
| 2,924,037 | | |
| (775,710 | ) | |
| (26.5 | )% |
| 资产购买协议保证金减值
| |
| 3,500,000 | | |
| - | | |
| 3,500,000 | | |
| 100.0 | % |
| 运营费用总额
| |
| 13,985,942 | | |
| 10,235,280 | | |
| 3,750,662 | | |
| 36.6 | % |
| 运营亏损
| |
| (13,985,942 | ) | |
| (10,235,280 | ) | |
| (3,750,662 | ) | |
| (36.6 | )% |
| 合计
其他收入(费用) | |
| (1,072,880 | ) | |
| 33,375 | | |
| (1,106,255 | ) | |
| (3,314.6 | )% |
| 净亏损
| |
$ | (15,058,822 | ) | |
$ | (10,201,905 | ) | |
$ | (4,856,917 | ) | |
| (47.6 | )% |
销售、一般和管理费用
在截至2023年9月30日的9个月中,销售、一般和管理费用与2022年同期相比增加了约100万美元
。这一增长主要是由于ENTADFI的商业化活动增加了220万美元,专业费用增加了110万美元,长期资产减值亏损30万美元,以及关联方应收账款亏损产生了20万美元。这些增长被员工薪酬减少100万美元所抵消,
主要是由于基于股票的薪酬支出减少以及高管奖金减少以及各种业务活动的减少,
如商业咨询服务、与差旅相关的费用和租金费用,总计20万美元。此外,由于一家前承销商提前终止了与该承销商的协议,与或有损失相关的损失减少了130万美元,非经常性终止罚款减少了30万美元,这两项费用都是在截至2022年9月30日的九个月内发生的
,本期没有类似的费用。
研究和开发费用
在截至2023年9月30日的9个月中,研发费用与2022年同期相比减少了约80万美元。减少的主要原因是该公司决定在截至2023年9月30日的三个月内取消疫苗计划。
资产购买协议保证金减值
在截至2023年9月30日的九个月内,WraSer资产购买协议的保证金记录了350万美元的减值损失。
其他
收入(费用)
在截至2023年9月30日的9个月内发生的其他支出,主要涉及2023年4月发行的与收购ENTADFI有关的新应付票据
的利息支出,与Veru有关的50万美元应付票据被取消时的损失或有认股权证负债的公允价值变动。截至2022年9月30日的9个月内录得的其他收入与或有认股权证负债的公允价值变动有关。
流动性
与资本资源
自2018年10月成立至2023年4月收购ENTADFI以来,我们将几乎所有的努力都投入到研究和开发上,
开展临床前研究并支持制造活动以支持我们的产品开发工作,招聘人员,
获取和开发我们的技术,现在剥夺候选疫苗,组织我们的公司并为其配备人员,执行业务规划,建立我们的知识产权组合,并筹集资金支持和扩大此类活动。自我们于2023年4月收购ENTADFI以来,我们一直致力于增强我们的商业能力,以在市场上推出ENTADFI,并于2023年12月完成对Proteomedex及其相关诊断产品的收购。除ENTADFI和Proclarix外,我们还没有
任何获准销售的产品,也没有从产品销售中获得可观的收入。
自成立以来,我们
每年都出现净亏损,预计在可预见的未来还将继续出现净亏损。截至2023年9月30日的三个月和九个月,我们的净亏损分别为530万美元和1510万美元。截至2023年9月30日,我们
的累计赤字为3440万美元。在截至2023年9月30日的9个月中,我们还产生了930万美元的负运营现金流
。
这些
因素以及公司预测的未来现金流表明,公司将无法在2023年9月30日简明财务报表发布后一年内履行其在正常业务过程中到期的合同承诺和义务。
2024年1月23日,该公司发行了债券,换取了460万美元的现金净收益。债券将于(I)根据认购协议完成及(Ii)2024年6月30日两者中较早者悉数偿还
。
我们
将在短期内需要大量额外资本,以继续为我们的持续运营提供资金,满足现有的
和未来的义务和债务,包括根据Veru APA到期的剩余付款、到期的债券和为支持公司商业化计划而签订的其他
合同,此外还需要资金支持我们的营运
资本需求和业务活动,包括ENTADFI和Proclarix的商业化,以及我们当前候选产品和未来候选产品的开发和商业化
。管理层为公司运营提供资金的计划
包括从ENTADFI的销售中产生产品收入,这一过程尚未成功商业化,这一过程将需要
大量额外资本才能完成。此外,某些商业化活动不在公司的控制范围内,包括但不限于与批发商和第三方付款人签订合同、与第三方物流提供商签订合同、在不同司法管辖区获得所需许可,以及试图通过股权或债务融资获得额外所需资金
。然而,我们可能无法以对我们有利的条款获得额外融资,
如果有的话,这给我们能否成功推出ENTADFI并扩大Proclarix的商业化带来了极大的不确定性。如果我们无法在需要时以令我们满意的条款获得足够的融资或融资,或者如果我们将资本花费在不成功的项目上,我们继续支持业务增长和应对业务挑战的能力可能会受到极大限制
,甚至可能不得不停止运营。如果我们通过进一步发行股权或可转换债务证券来筹集更多资金,我们的现有股东可能会遭受严重稀释,我们
发行的任何新股权证券可能拥有高于普通股持有人的权利、优先和特权。
未来
资金需求
到目前为止,我们现金的主要用途是为我们的运营提供资金,这主要包括与我们的计划相关的
研发支出,与收购和潜在收购相关的成本,以及销售、一般和管理支出。我们预计,在可预见的未来,随着我们继续
将ENTADFI和Proclarix商业化,并扩展我们的公司基础设施,包括与上市公司相关的成本,我们将继续产生巨额费用。我们面临与新药候选开发相关的所有风险,可能会遇到不可预见的费用、
困难、并发症、延误和其他未知因素,这些因素可能会对我们的业务产生不利影响。我们预计,我们将需要大量额外资金用于持续运营和执行我们的长期业务计划。
我们
将在短期内需要大量额外资本,以继续为我们的持续运营提供资金,履行现有和未来的义务和债务,
包括根据Veru APA和为支持公司商业化计划而签订的其他合同应支付的剩余款项,以及支持我们的营运资金需求和业务活动所需的资金。包括ENTADFI的商业化
以及我们当前候选产品和未来候选产品的开发和商业化。在我们能够通过销售ENTADFI或Proclarix产生足够的收入之前,我们预计将通过公共或私人股权或债务融资、第三方(包括政府)资金以及营销和分销安排,以及其他合作,为我们未来的现金需求提供资金。战略联盟和许可安排,
或这些方法的任意组合。未来出售股权或可转换债务证券可能会对我们的股东造成稀释,如果是优先股权证券或可转换债务,这些证券可能会提供优先于我们普通股的权利、优惠或特权
。债务融资可能会使我们受到契约限制或我们采取特定行动的能力的限制,例如招致额外债务、进行资本支出或宣布股息。不能保证我们将
成功地以足以为我们的运营提供资金的水平或以对我们有利或可接受的条款获得额外资金。如果我们无法在需要时或按对我们有利或可接受的条款获得足够的资金,我们可能会被迫推迟、缩小业务活动范围。
我们未来的资本需求将取决于许多因素,包括:
| |
● |
该
建立销售队伍的成本,以预期任何产品的商业化; |
| |
|
|
| |
● |
我们已经获得或将获得上市许可的ENTADFI、Proclarix和其他产品未来商业化活动的成本,包括产品制造、营销、销售、特许权使用费和分销; |
| |
|
|
| |
● |
研发、测试、筛查、制造、临床前和非临床研究及临床试验的时间、范围、进度、结果和成本; |
| |
|
|
| |
● |
从FDA和类似的外国监管机构寻求和获得监管批准的结果、时间和成本,包括这些机构要求我们进行现场疗效研究的可能性,需要进行比
我们目前预期的更多的研究,或者改变他们对支持营销应用所需数据的要求; |
| |
|
|
| |
● |
我们
保持和建立新的战略合作、许可或其他安排的能力以及任何此类协议的财务条款,包括任何此类协议规定的任何未来里程碑、特许权使用费或其他付款的时间和金额; |
| |
|
|
| |
● |
任何
产品责任或与我们的产品有关的其他诉讼; |
| |
|
|
| |
● |
吸引、聘用和留住技术人员所需的费用; |
| |
|
|
| |
● |
我们可能已获得或将获得上市批准的ENTADFI、Proclarix或其他产品的商业销售或向外国政府销售所获得的收入(如果有); |
| |
|
|
| |
● |
建立、维护、扩大、强制执行和捍卫我们的知识产权组合范围的成本,包括我们可能被要求支付的任何款项的金额和时间,或者我们可能收到的与许可、准备、提交、起诉、捍卫和执行我们的专利或其他知识产权有关的费用;以及 |
| |
|
|
| |
● |
作为一家上市公司的运营成本。 |
任何这些或其他变量的结果发生变化,都可能显著改变与我们业务活动相关的成本和时间安排。
此外,我们的运营计划未来可能会发生变化,我们可能需要额外的资金来满足运营需求和与此变化相关的资本要求。
现金流
下表汇总了我们在所示时期的现金流:
| | |
截至9个月
个月
9月30日,
2023 | | |
九个
个月
告一段落
9月30日,
2022 | |
| 净额
经营活动中使用的现金 | |
$ | (9,269,131 | ) | |
$ | (5,875,492 | ) |
| 用于投资活动的现金净额
| |
| (9,864,613 | ) | |
| (31,488 | ) |
| 净额
融资活动提供的现金 | |
| 1,035,060 | | |
| 33,115,222 | |
| 净增(减)现金
| |
$ | (18,098,684 | ) | |
$ | 27,208,242 | |
| | |
年
结束
十二月三十一日,
2022 | | |
年
结束
十二月三十一日,
2021 | |
| 净额
经营活动中使用的现金 | |
$ | (8,698,860 | ) | |
$ | (2,044,235 | ) |
| 用于投资活动的现金净额
| |
| (9,339 | ) | |
| (1,924 | ) |
| 净额
由融资活动提供(用于)的现金 | |
| 32,532,384 | | |
| (334,188 | ) |
| 净增(减)现金
| |
$ | 23,824,185 | | |
$ | (2,380,347 | ) |
经营活动的现金流
截至2023年9月30日的9个月,经营活动中使用的现金净额约为930万美元,这主要是由于净亏损1510万美元。
这被我们运营资产和负债净变化10万美元所抵消。
与WraSer APA存款有关的减值损失350万美元,应付票据清偿造成的约50万美元损失,基于非现金股票的补偿约60万美元,非现金利息支出约50万美元,长期资产减值亏损30万美元,关联方应收账款亏损约30万美元。
截至2022年9月30日的9个月,用于经营活动的现金净额约为590万美元,主要原因是净亏损约1,020万美元,这部分被约180万美元的非现金股票薪酬以及约260万美元的运营资产和负债净变化所抵消。
截至2022年12月31日的年度,经营活动中使用的现金净额为870万美元,这主要是由于净亏损1340万美元,但被基于非现金股票的薪酬约200万美元、已发行的受限普通股公允价值约30万美元以及我们运营资产和负债的净变化250万美元部分抵消。
截至2021年12月31日止年度,经营活动所用的净
现金为200万美元,主要来自
340万美元的净亏损,该净亏损被120万美元的经营资产和负债净变动以及10万美元的股票报酬
部分抵消。
投资活动的现金流
截至2023年9月30日的九个月,投资活动所用现金净额约为990万美元,其中约610万美元用于收购ENTADFI,350万美元用于与潜在的WraSer APA有关的存款,
该存款将于2023年9月30日关闭,30万美元是应收关联方款项的净变动。
截至2022年9月30日止九个月,投资活动所用现金净额约为31,000美元,这是由于
购买物业和设备以及应收关联方款项的净变动。
截至2022年及2021年12月31日止年度,投资活动所用现金净额分别为9,000元及2,000元,乃购买物业及设备所致。
融资活动的现金流
截至2023年9月30日止九个月,融资活动提供的净
现金约为100万美元,来自
与认股权证诱导交易有关的优先投资期权的行使所得款项净额230万美元
,被应付票据本金支付100万美元、购买库存股59,000美元、以及205,000美元的延期发行费用。
截至2022年9月30日止九个月,融资活动提供的现金净额约为3310万美元,主要来自我们的IPO以及4月和8月的私人配售。
净额
截至2022年12月31日止年度,融资活动提供的现金约为
3250万美元,主要来自我们的首次公开募股和私人配售的结束,
净收益约为3 310万美元, 亿股回购。本年度融资活动使用的现金净额
截至2021年12月31日,与递延发行成本支付有关的30万美元。
法律上的或有事项
我们可能会不时卷入日常业务过程中产生的法律诉讼。当未来可能发生损失且此类损失可以合理估计时,我们将此类
事项记录为负债。
表外安排
表内安排
在本报告所述期间,我们没有,目前也没有美国证券交易委员会规则和法规所定义的任何表外安排
。
PROTEOMEDIX
管理层对财务状况的讨论与分析
运营结果
您
应结合本代理
声明中其他地方包含的我们的财务报表和相关注释阅读以下讨论。本讨论包含涉及风险和不确定性的前瞻性陈述。我们的实际结果和所选事件的时间
可能会因各种因素而与这些前瞻性陈述中的预期存在重大差异,
这些因素包括但不限于“风险因素”和本代理声明中其他地方所述的因素。
关键会计政策和估算
演示基础
ProteomeTM的
财务报表是根据美国公认会计原则(“美国GAAP”)编制的,该原则要求
确认和披露因换算以美元以外货币计价的财务报表而产生的外币换算调整。
ProteomeTools的
功能货币是瑞士法郎。以外币计值的交易按交易日期的现行汇率换算为功能货币。由此产生的换算调整记录为累计其他全面收益(亏损)的独立
部分。
现金
和现金等价物
为了报告现金流,Proteomedex将现金和现金等价物定义为可供当前使用且初始到期日为三个月或更短的所有银行现金和高流动性投资
。截至2022年或2021年12月31日,Proteomedex没有现金等价物
。
Proteomedex
在瑞士金融市场监督管理局(FINMA)承保的金融机构维护其现金余额。
Proteomedex的现金余额有时可能超过FINMA提供的保险。Proteomedex于该等账户并无出现任何亏损,管理层并不认为Proteomedex面临任何与超额存款有关的重大风险。
合作协议
Proteomedex
定期与交易对手签订战略联盟协议,以生产产品和/或向客户提供服务。
由此类协议创建的联盟不是法人实体,没有员工,没有资产,也没有真正的运营。这些安排
通过在全面损失表中报告发生的成本和从研发费用内的交易中收到的报销,为这些联盟创建了合同权利和Proteomedex帐户,作为一种合作安排。
基于股份的薪酬
Proteomedex
说明根据财务会计准则委员会(FASB)会计标准编纂(ASC)718,“薪酬--股票薪酬”,为换取非员工提供的货物或服务而发行的股权工具。成本按所收代价的估计公允价值或已发行权益工具的估计公允价值(以较可靠的计量为准)计量。除员工服务外,为对价而发行的股权工具的价值是根据FASB ASC 718“补偿-股票补偿”定义的货物或服务提供者的业绩承诺或完成业绩中最早的一项确定的。
收入
确认
自2021年1月1日起,Proteomedex采用了ASC主题606“与客户签订合同的收入”(“ASC 606”)。根据ASC 606,收入在所执行服务的控制权转移给客户时确认,金额反映了我们预期有权获得这些服务的对价
。ASC 606提供了包括以下内容的五步模型:
产品销售
Proteomedex
通过直接向最终用户和分销商销售其产品来获得收入。Proteomedex将其产品销售给包括实验室、医院、医疗中心、医生和分销商在内的客户。Proteomedex将客户采购订单视为与客户签订的合同,在某些情况下,客户采购订单受主销售协议或标准条款和条件管辖。对于每个合同,Proteomedex将转让产品的承诺视为已确定的履约义务,每个产品都是不同的。在确定交易价格时,Proteomedex评估价格是否需要退款或调整,以确定其预期有权获得的净对价
。一旦产品转让给客户,Proteomedex即履行其适用于产品销售的履约义务。
开发
服务
Proteomedex
为生命科学客户提供一系列称为“开发服务”的服务,包括生物标记物
发现、分析设计和开发的测试。这些开发服务根据单独的工作说明书(“SOW”)
根据客户定义的特定交付内容安排执行。开发服务通常按时间和材料执行
。在根据SOW向客户履行和完成服务期间,我们有权按商定价格向客户开具
账单,并确认预计完成SOW期间的开发服务收入。我们通常将每个SOW确定为单一的履约义务。
服务的完成和SOW规定的履约义务的履行通常通过访问向客户提供的数据或测试或SOW中定义的任何其他形式或适用的交付方式来证明。但是,对于根据客户高度定制的规范执行工作的某些SOW,我们有权强制执行客户完成的工作
,而不是在SOW完成后。对于这些母猪,我们根据花费的努力(投入)确认在工作完成期间
的收入。由于SOW规定的履约义务已履行,因此作为收入
并向客户开具账单的任何金额都将计入应收账款。截至财务报表日期
,任何已赚取但尚未向客户开具帐单的收入将被记录为合同资产,并在财务报表日期计入预付和其他流动资产。当客户
根据合同中的开票时间表开具发票时,合同资产中记录的金额将在我们的财务报表中重新分类为应收账款。
在
SOW包括可变对价部分的情况下,Proteomedex使用期望值方法或最可能金额方法估计交易价格中应包括的可变对价金额,具体取决于哪种方法有望更好地预测Proteomedex有权获得的对价金额。如果且在一定程度上,当与可变对价相关的不确定性随后得到解决时,确认的累计收入很可能不会发生重大逆转,则可变对价
的价值计入交易价格。这些估计会在每个报告期内按需要重新评估,而任何所需的调整均以累积追赶的方式记录,这会影响调整期间的收入及净收入。
许可收入
许可证
收入是根据评估许可证是否有别于可能包含在基础许可安排中的任何其他履约义务确定的。如果客户能够从许可证中受益,而无需提供Proteomedex提供的任何其他性能义务,
则Proteomedex会确定客户是否已获得使用许可证的权利或访问许可证的权利。对于Proteomedex不需要
进一步实质性开发或其他持续活动的功能许可证,客户被视为获得了在转让时以及在何时转让许可证的使用权,并且收入通常记录在某个时间点。对于仅与Proteomedex提供的其他履行义务一起提供可观
价值的象征性许可,收入通常使用基于该许可的合同剩余时间的投入在许可协议的
期限内记录。Proteomedex
提供的此类其他义务通常包括在许可期内与
签订合同提供的制成品、其他开发服务或其他交付内容。
与许可安排相关的特许权使用费
在记录与商业许可方的供应协议下的销售时进行估计和确认,没有任何合同限制或可收入性不确定性。版税取决于是否达到某些销售里程碑
当很可能达到里程碑时才会记录。
已定义的
福利养老金计划
Proteomedex
发起了一项涵盖合格员工的固定收益养老金计划(“计划”)。该计划根据员工的服务年限和薪酬水平提供退休福利。Proteomedex在其资产负债表中确认该计划的资产处于资金过剩状态或负债资金不足状态。此外,Proteomedex衡量其计划的资产和债务,以确定其截至年底的资金状况,并确认发生变化的当年资金状况的变化
。这些变动在“累计其他综合损失”中报告。Proteomedex使用精算估值来确定其养老金和退休后福利成本和信用。计算的金额取决于各种关键假设,包括贴现率和计划资产的预期回报率。在选择这些假设时,考虑了当前的市场条件。
Proteomedex的养老金计划一般使用每股资产净值(NAV)进行估值,作为公允价值的实际权宜之计,前提是满足某些
标准。资产净值是根据基金相关投资的公允价值确定的。在
不符合标准的情况下,公允是根据交易基金的基础市场确定的,该市场通常被认为是活跃的市场。
运营结果的组成部分
营销
和业务发展
此费用分类包括与Proclarix的营销和早期商业化相关的所有努力,以及与Proclarix和其他业务领域(例如开发服务、管道产品)相关的一般业务开发费用。此类成本
在发生期间计入费用。
我们
预计未来我们的营销和业务开发费用将增加,我们将继续扩大我们的商业化和Proclarix以及其他业务领域。
研发
此
费用分类包括与开发Proclarix和管道产品相关的所有成本,以及与合作伙伴协作相关的开发活动
(例如,管道产品或开发服务的研发协作)。
这些费用包括为代表我们进行某些研发活动而支付给第三方的费用。
咨询成本、临床研究中使用的临床样本成本、实验室用品成本、某些工资和与人员相关的费用,包括
工资。我们为内部和外部研发费用支付费用,因为它们
已发生。
我们
不按候选产品分配我们的内部成本,因为相当大的研发费用包括
成本,如工资和其他人员费用、实验室用品和分配的管理费用,以及外部成本,如支付给第三方
代表我们进行研发活动的费用,这些成本不按候选产品跟踪。
我们
预计研发费用将会增加。如果任何监管机构要求我们进行临床试验,
我们可能需要花费大量额外的财政资源和时间来完成临床开发。此外,
我们无法准确预测我们的流水线产品何时或是否需要获得监管部门的批准,以及将这些产品投入商用所需的任何额外开发成本的规模。
常规
和管理
一般费用和行政费用主要包括工资和人事费用,包括工资和奖金、福利和基于股票的薪酬费用、法律、咨询、会计和税务服务的专业费用以及其他非
归类为研发费用的一般运营费用。
我们
预计,由于人员成本增加、基础设施扩展
以及与Proteomedex持续增长相关的咨询、法律和会计服务成本上升,我们的一般和行政费用将继续增加。
折旧
折旧
与我们的某些长期资产在其估计使用寿命内的摊销有关。这些成本在发生的期间
内支出,该期间通常是资产使用至Proteomedex处置资产为止的期间。
利息
费用
本公司应付未偿还可转换票据的利息
计入已发生的费用。利息支出还包括将其他货币
转换为我们的本币瑞士法郎的成本。我们认为这是我们资本融资活动的组成部分,因此将这笔
金额的利息支出计入随附的全面收益(亏损)表中。
外币
货币换算调整
此
余额是将我们的财务报表从我们的本位币瑞士法郎转换为我们的
报告货币美元的结果。资产和负债按报告期末的汇率换算,截至2022年12月31日、2021年12月31日和2023年9月30日分别为1.098、1.082和1.093。权益使用与交易相关的历史汇率进行折算。收入和支出按报告期内的平均汇率换算。导致这些余额变化的重要因素与瑞士法郎和美元之间的差异以及我们在此期间资产和负债构成的变化有关。
养老金福利义务的变化
根据瑞士法律的要求,我们为所有员工提供固定福利养老金计划。这些余额的变化与基本养恤金资产和负债的收益和损失、精算损益以及因支付福利而进行的结算有关。
运营结果
2022年和2021年12月31日终了年度比较
| | |
年限
结束 | | |
$ | | |
% | |
| | |
2022 | | |
2021 | | |
变化 | | |
变化 | |
| | |
| | |
| | |
| | |
| |
| 收入 | |
$ | 392,460 | | |
$ | 140,600 | | |
$ | 251,860 | | |
| 179 | % |
| | |
| | | |
| | | |
| | | |
| | |
| 售出商品的成本
| |
| 48,429 | | |
| 31,977 | | |
| 16,452 | | |
| 51 | % |
| | |
| | | |
| | | |
| | | |
| | |
| 毛利
| |
| 344,031 | | |
| 108,623 | | |
| 235,408 | | |
| 217 | % |
| | |
| | | |
| | | |
| | | |
| | |
| 运营费用
| |
| | | |
| | | |
| | | |
| | |
| 营销
和业务发展 | |
| 240,298 | | |
| 200,096 | | |
| 40,202 | | |
| 20 | % |
| 研发
| |
| 393,274 | | |
| 312,586 | | |
| 80,688 | | |
| 26 | % |
| 常规
和管理 | |
| 1,671,960 | | |
| 1,766,843 | | |
| (94,883 | ) | |
| (5 | )% |
| 折旧 | |
| 17,492 | | |
| 36,866 | | |
| (19,374 | ) | |
| (53 | )% |
| 运营费用总额
| |
| 2,323,024 | | |
| 2,316,391 | | |
| 6,633 | | |
| 0 | % |
| | |
| | | |
| | | |
| | | |
| | |
| 运营亏损
| |
| (1,978,993 | ) | |
| (2,207,768 | ) | |
| 228,775 | | |
| (10 | )% |
| | |
| | | |
| | | |
| | | |
| | |
| 其他
费用 | |
| | | |
| | | |
| | | |
| | |
| 利息
费用 | |
| (63,580 | ) | |
| (41,536 | ) | |
| (22,044 | ) | |
| 53 | % |
| 合计
其他费用 | |
| (63,580 | ) | |
| (41,536 | ) | |
| (22,044 | ) | |
| 53 | % |
| | |
| | | |
| | | |
| | | |
| | |
| 扣除所得税准备前的净亏损
| |
| (2,042,573 | ) | |
| (2,249,304 | ) | |
| 206,731 | | |
| (9 | )% |
| | |
| | | |
| | | |
| | | |
| | |
| 所得税拨备
| |
| - | | |
| - | | |
| - | | |
| 0 | % |
| | |
| | | |
| | | |
| | | |
| | |
| 净亏损
| |
| (2,042,573 | ) | |
| (2,249,304 | ) | |
| 206,731 | | |
| (9 | )% |
| | |
| | | |
| | | |
| | | |
| | |
| 其他
综合(亏损)收入 | |
| | | |
| | | |
| | | |
| | |
| 福利
养老金义务更改 | |
| 179,892 | | |
| 397,709 | | |
| (217,817 | ) | |
| (55 | )% |
| | |
| | | |
| | | |
| | | |
| | |
| 外汇
平移调整 | |
| (4,986 | ) | |
| 32,837 | | |
| (37,823 | ) | |
| (115 | )% |
| 其他综合(亏损)收入合计
| |
| 174,906 | | |
| 430,546 | | |
| (255,640 | ) | |
| (59 | )% |
| 全面损失
| |
$ | (1,867,667 | ) | |
$ | (1,818,758 | ) | |
$ | (48,909 | ) | |
| 3 | % |
收入
与截至2021年12月31日的财年相比,截至2022年12月31日的财年收入增加了252,000美元,增幅为179%。增长
是由于Proteomedex在2022年下半年与客户签订了一份重要的开发服务合同。
运营亏损
在截至2022年和2021年12月31日的年度内,我们的综合亏损分别为190万美元和180万美元。减少
是由于向第三方提供开发服务带来的收入增加。
营销
和业务发展
与截至2021年12月31日的年度相比,截至2022年12月31日的年度的市场营销和业务发展支出增加了40,000美元,增幅为20%。这一增长是由于欧洲加大了医疗营销力度。
研发
与截至2021年12月31日的年度相比,截至2022年12月31日的年度的研究和开发费用增加了8.1万美元,增幅为26%。增加的原因是与第三方的合作安排,根据该安排,我们确认了人员、设施和材料的某些成本。
常规
和管理
与截至2021年12月31日的年度相比,截至2022年12月31日的年度的一般和行政费用减少了95,000美元,或5%。减少的原因是我们减少了对非核心服务顾问的使用。
折旧
与截至2021年12月31日的年度相比,截至2022年12月31日的年度折旧
减少了19,000美元,或53%。减少
是由于现有固定资产达到各自估计使用年限的末期。
利息
费用
与截至2021年12月31日的年度相比,截至2022年12月31日的年度的利息支出增加了2.2万美元,增幅为53%。这一增长是由于我们从客户那里收到的货币兑换成我们的本位币瑞士法郎造成的损失。
福利
养老金义务更改
福利
与截至2021年12月31日的年度相比,截至2022年12月31日的年度养老金义务变化减少了218,000美元,或55%。
减少的原因是,2021年养恤金信托基金以信托形式非经常性地支付了福利。
外币
货币换算调整
与截至2021年12月31日的年度相比,截至2022年12月31日的年度外币折算调整减少3.8万美元,或115%。减少的原因是瑞士法郎和美元之间的汇率变化以及2021年期间的额外借款。
截至2023年9月30日和2022年9月30日的9个月的比较
| | |
截至9个月
个月 | | |
| | |
| |
| | |
2023年9月30日
| | |
9月30日,
2022 | | |
$
更改 | | |
%
更改 | |
| | |
| | |
| | |
| | |
| |
| 收入 | |
$ | 2,092,761 | | |
$ | 128,773 | | |
$ | 1,963,988 | | |
| 1525 | % |
| | |
| | | |
| | | |
| | | |
| | |
| 售出商品的成本
| |
| 22,548 | | |
| 28,176 | | |
| (5,628 | ) | |
| -20 | % |
| | |
| | | |
| | | |
| | | |
| | |
| 毛利
| |
| 2,070,213 | | |
| 100,597 | | |
| 1,969,616 | | |
| 1545 | % |
| | |
| | | |
| | | |
| | | |
| | |
| 运营费用
| |
| | | |
| | | |
| | | |
| | |
| 营销
和业务发展 | |
| 151,478 | | |
| 172,478 | | |
| (21,000 | ) | |
| -12 | % |
| 研发
| |
| 275,020 | | |
| 262,818 | | |
| 12,202 | | |
| 5 | % |
| 常规
和管理 | |
| 1,240,875 | | |
| 1,633,860 | | |
| (392,985 | ) | |
| -24 | % |
| 折旧 | |
| 9,293 | | |
| 12,966 | | |
| (3,673 | ) | |
| -28 | % |
| 运营费用总额
| |
| 1,676,666 | | |
| 2,082,122 | | |
| (405,456 | ) | |
| -60 | % |
| | |
| | | |
| | | |
| | | |
| | |
| 营业收入
(亏损) | |
| 393,547 | | |
| (1,981,525 | ) | |
| 2,375,072 | | |
| 1605 | % |
| | |
| | | |
| | | |
| | | |
| | |
| 其他
费用 | |
| | | |
| | | |
| | | |
| | |
| 利息
费用 | |
| (74,359 | ) | |
| (48,257 | ) | |
| (26,102 | ) | |
| 54 | % |
| 合计
其他费用 | |
| (74,359 | ) | |
| (48,257 | ) | |
| (26,102 | ) | |
| 54 | % |
| | |
| | | |
| | | |
| | | |
| | |
| 净额
拨备所得税前收益(亏损) | |
| 319,188 | | |
| (2,029,782 | ) | |
| 2,348,970 | | |
| 1659 | % |
| | |
| | | |
| | | |
| | | |
| | |
| 所得税拨备
| |
| - | | |
| - | | |
| - | | |
| 0 | % |
| | |
| | | |
| | | |
| | | |
| | |
| 净收益(亏损)
| |
| 319,188 | | |
| (2,029,782 | ) | |
| 2,348,970 | | |
| 1659 | % |
| | |
| | | |
| | | |
| | | |
| | |
| 外汇
平移调整 | |
| 172,351 | | |
| 344,957 | | |
| (172,606 | ) | |
| -50 | % |
| | |
| | | |
| | | |
| | | |
| | |
| 变更
在养恤金福利义务中 | |
| (168,307 | ) | |
| 369,287 | | |
| (537,594 | ) | |
| -146 | % |
| | |
| | | |
| | | |
| | | |
| | |
| 综合收入
| |
$ | 323,232 | | |
$ | (1,315,538 | ) | |
$ | 1,638,770 | | |
| 1464 | % |
收入
与截至2022年9月30日止九个月相比,截至2023年9月30日止九个月的收入
增加了200万美元,即1,525%。
其中约150万美元的增加是由于与
单一客户的开发服务合同的扩展和持续进展,约50万美元的增加是由于与单一客户的一次性许可合同,在截至2023年9月30日的九个月内。
运营亏损
在截至2023年9月30日的9个月中,我们的综合收益为323,000美元,在截至2022年9月30日的9个月中,我们的综合亏损为130万美元。这一变化是由于与提供开发服务和许可费相关的收入增加。
营销
和业务发展
与截至2022年9月30日的9个月相比,截至2023年9月30日的9个月的营销和业务开发费用减少了21,000美元,降幅为12%。减少的原因是我们缩小了在欧洲、中东和非洲地区的营销努力,并将重点放在已经在使用我们的Proclarix产品的现有实验室合作伙伴
。
研发
与截至2022年9月30日的9个月相比,截至2023年9月30日的9个月的研发费用增加了12,000美元,增幅为5%。增加的原因是与第三方的合作安排,根据该安排,我们确认了人员、设施和材料的某些成本。
常规
和管理
与截至2022年9月30日的9个月相比,截至2023年9月30日的9个月的一般和管理费用减少了39.3万美元,降幅为24%。减少的原因是我们减少了对非核心服务顾问的使用以及人员成本
。
折旧
与截至2022年9月30日的9个月相比,截至2023年9月30日的9个月的折旧
减少了4,000美元,降幅为28%。
减少的原因是现有固定资产的预计使用年限即将结束。
利息
费用
与截至2022年9月30日的九个月相比,截至2023年9月30日的九个月的利息支出增加了26,000美元,或54%。这一增长是由于我们从客户那里收到的货币兑换成瑞士法郎造成的损失。
福利
养老金义务更改
福利
与截至2022年9月30日的9个月相比,截至2023年9月30日的9个月的养老金义务变化减少了538,000美元,降幅为146%。减少的原因是精算收益被雇员在2023年作出的缴款所抵消,而2022年没有发生。
外币
货币换算调整
与截至2022年9月30日的9个月相比,截至2023年9月30日的9个月的外汇换算调整减少了17.2万美元,降幅为50%。这一减少是由于瑞士法郎与美元之间的汇率变化所致。
趋势
信息
除本委托书所披露的情况外,本公司并不知悉有任何趋势、不确定性、需求、承诺或事件可能会对本公司的收入、净收入、盈利能力、流动资金或资本资源产生重大影响,或会导致所报告的财务信息不一定能反映未来的经营业绩或财务状况。
流动性
与资本资源
| | |
在这九个月中
告一段落
9月30日,
2023 | | |
对于
九个月
告一段落
9月30日,
2022 | | |
年份
结束
十二月三十一日,
2022 | | |
年份
结束
十二月三十一日,
2021 | |
| 净额
现金(用于)由提供 | |
| | |
| | |
| | |
| |
| 操作
活动 | |
$ | 346,029 | | |
$ | (1,477,904 | ) | |
$ | (1,933,570 | ) | |
$ | (2,239,556 | ) |
| 投资
活动 | |
$ | - | | |
$ | - | | |
$ | - | | |
$ | - | |
| 为
活动提供资金 | |
$ | - | | |
$ | (50,000 | ) | |
$ | (50,000 | ) | |
$ | 3,277,170 | |
操作
活动
截至2023年9月30日的9个月,经营活动提供的现金净额为34万6千美元,而截至2022年9月30日的9个月的现金使用量为150万美元,减少了180万美元。减少的原因是开发服务收入增加和2023年期间收到的一次性许可费。
截至2022年12月31日的年度,经营活动中使用的现金净额为190万美元,而截至2021年12月31日的年度为230万美元,减少了36.6万美元。这一下降是由于期内收入增加,导致运营中使用的现金减少。
投资
活动
在上述任何期间内,我们
并无现金用于投资活动或由投资活动提供现金。
为
活动提供资金
截至2023年9月30日的9个月,融资活动中使用的现金净额为0美元,而截至2022年9月30日的9个月为50,000美元,减少了50,000美元。减少的原因是一次性偿还2022年期间应付的一笔票据。
截至2022年12月31日的年度,融资活动使用的现金净额为50,000美元,而截至2021年12月31日的年度,融资活动提供的现金净额为340万美元。减少的原因是一次性偿还了2022年的应付票据。
流动性
前景
自公司成立以来,我们出现了严重的运营亏损和负现金流,并主要通过向股东和董事发行股票和可转换票据来为我们的运营提供资金。我们对流动资金和资本的主要短期需求是为一般营运资本和资本支出提供资金。我们的主要长期营运资本用途包括开发辅助诊断标记和相关支持服务,以扩大我们现有的知识产权组合。
随着我们继续实施我们的业务战略,我们
预计将产生与我们持续活动相关的巨额费用。我们
需要与这些活动相关的额外资金。我们未来的短期和长期资金需求将取决于许多因素,包括:
| ● | 与我们预期在欧洲扩大Proclarix分销和在美国推出分销相关的成本
; |
| ● | 未来商业化活动的成本,包括Proclarix的产品制造、营销、销售; |
| ● | 寻求和获得监管机构的监管批准的结果、时间和成本,包括监管机构要求我们进行现场药效研究的可能性,
需要进行比我们目前预期更多的研究,或者更改他们对支持营销应用程序所需数据的要求。 |
| ● | 我们
有能力维持和建立新的战略合作、许可或其他
安排和任何此类协议的财务条款,包括根据任何此类协议应支付的任何未来里程碑、特许权使用费或其他付款的时间和金额。 |
| ● |
准备、提交和起诉专利申请、维护和执行我们的知识产权以及为任何与知识产权相关的索赔辩护的成本和时间。 |
任何这些或其他变量的结果发生变化,都可能显著改变与我们业务活动相关的成本和时间安排。
此外,我们的运营计划未来可能会发生变化,我们可能需要额外的资金来满足运营需求和与此变化相关的资本要求。
在可预见的未来,我们预计将继续通过Onconentix的出资或贷款为我们的运营提供资金。我们目前没有任何承诺的外部资金来源。如果我们或Onconentix无法筹集更多资金,我们可能会被要求
推迟、减少、暂停或停止我们的产品开发计划或任何未来的商业化努力,这将对我们的业务、前景、经营业绩和财务状况产生负面影响
。
截至2023年9月30日,我们的累计赤字为2700万美元。截至2022年12月31日和2021年12月31日,我们的累计赤字分别为2720万美元和2520万美元。截至2023年9月30日,我们拥有100万美元的现金。截至2022年12月31日和2021年12月31日,我们分别拥有47万美元和250万美元的现金。这些事项及其他事项令人对Proteomedex是否有能力在随附的合并财务报表发布后的12个月内继续经营下去产生重大怀疑。
管理层
认为,目前为进一步实施业务计划和创造收入而采取的行动为Proteomedex提供了继续经营下去的机会
。虽然Proteomedex相信其创造收入的战略的可行性,以及其Onconentix提供额外资金的能力,但无法保证这一点。Proteomedex能否持续经营取决于Proteomedex是否有能力进一步执行其业务计划,并根据需要从Onconentix获得额外资金。
表外安排
表内安排
我们
在过去三个财年没有,目前也没有美国证券交易委员会规则
和条例中定义的任何表外安排。只要我们有任何或有资产或负债,这些资产或负债都已在随附的合并财务报表中计入和审计。
PMX交易的背景
Onconentix和Proteomedex之间的谈判说明
2023年10月5日,钨顾问(“钨”)代表Proteomedex向Onconentix提交了意向书草稿(“LOI”)。Proteomedex建议的意向书条款包括(I)向Proteomedex
股权持有人建议的交易对价,该交易对价由Onconentix新发行的普通股组成,总价值为7,500万美元,(Ii)持续至最终协议签署为止的相互排他性
期限,及(Iii)在任何未来公司交易的情况下,每名Onconentix股东获得额外对价的或有价值权(“CVR”)。意向书草案还规定,在Onconentix完成至少500万美元的私募,以与Onconentix和Proteomedex之间的拟议交易同时完成,将是拟议交易的结束条件。
2023年10月18日,钨代表Onconentix通过电子邮件向Proteomedex发送了拟议的意向书的加价。与意向书初稿相比,Onconentix提出的意向书修订草案(I)将排他性期限修改为60天,(Ii)为Proteomedex股权持有人增加了六个月的关闭后禁售期,(Iii)规定Onconentix将向Proteomedex股东发行相当于Onconentix当时已发行和流通股的19.9%的股份
普通股,其余对价将作为Onconentix可转换优先股发行,经Onconentix股东批准后可兑换,(Iv)删除向Onconentix股东发行CVR的概念,及(V)增加成交条件
,如Onconentix董事会(“Onconentix董事会”)认为必要或适当,则Onconentix董事会收到一家信誉良好的公司发出的公平意见,认为建议的交易对Onconentix股东公平。
2023年10月20日,钨公司代表Proteomedex通过电子邮件将意向书的修订草案发送给Onconentix,在钨、Proteomex和Proteomedex之间进行了进一步沟通后,Proteomedex和Onconentix最终敲定了意向书。2023年10月22日,Proteomedex董事会批准了意向书。2023年10月24日,Onconentix董事会批准了意向书,随后各方签署了意向书。
在签署意向书之后,于2023年10月30日举行了视频会议,参加会议的有:(I)Onconentix的代表,(Ii)Onconentix的美国法律顾问Ellenoff Grossman&Schole LLP(以下简称EGS)的代表,(Iii)钨的代表,(Iv)Proteomedex的瑞士法律顾问的代表Vischer AG(“Vischer”)和(V)Proteomedex的美国法律顾问Brown Rudnick LLP的代表,讨论意向书中概述的拟议交易的预期条款,以及在较高层面上完成拟议交易的预期流程和时间表。在那次会议之后,2023年10月10日,钨为Onconentix、EGS和Onconentix的瑞士法律顾问Wenger Plattner提供了访问虚拟数据库的权限,其中包含Proteomedex的某些财务和法律信息。2023年11月30日,Onconentix提供Proteomedex,Nelson
MullinsRiley&Scarborough LLP(“NM”),Proteomedex
取代Brown Rudnick的美国法律顾问,以及Vischer访问包含Onconentix的某些财务和法律信息的虚拟数据室。
各方及其法律顾问就换股协议的条款进行了讨论和谈判,该协议的初稿已于2023年11月14日由EGS发送给NM。在2023年11月14日至2023年12月15日期间,Onconentix、EGS、Wenger Plattner、Proteomedex、NM和Vischer交换了多份股份交换协议草案。在此期间,EGS、Wenger Plattner、NM和Vischer之间举行了多次电话会议和虚拟会议,以讨论换股协议的条款,包括2023年12月5日、2023年12月7日、2023年12月10日、2023年12月13日、2023年12月14日和2023年12月15日的会议。Onconentix和Proteomedex的代表参加了许多这样的电话会议和会议。在该等电话会议及虚拟会议期间讨论的议题包括但不限于:(I)股份交换机制,包括有关未偿还Proteomedex购股权的事宜;(Ii)Proteomedex股东、Proteomedex及Onconentix股东的陈述、保证及契诺;(Iii)Onconentix及Proteomedex于成交及转换(“转换”)股份之间的运作契诺
及(Iv)赔偿。
在股份交换协议的谈判过程中,双方还交换了禁售协议、竞业禁止协议、支持协议和B系列指定证书(统称为“附属协议”)的草案,并就其条款进行了谈判。
在签署意向书和签署换股协议之间的
期间,Onconentix的法律顾问Wenger Plattner和EGS根据Proteomedex在虚拟数据室提供的文件和其他信息进行了法律尽职调查。
尽职调查工作重点放在Proteomedex的资本、知识产权和材料合同等方面。为了促进法律尽职调查工作,EGS于2023年11月2日向Brown Rudnick和钨公司发送了一份惯常的法律尽职调查请求清单,Proteomedex及其律师以书面形式回应了这些请求。在会议期间口头发言,并通过ProteomeDIX定期
将响应文件和其他信息上传到虚拟数据室。在接下来的几周里,在签署换股协议之前,Proteomedex、Onconentix及其各自的律师继续举行补充尽职调查会议,并与
进行相关沟通。
在签署意向书和签署换股协议之间的
期间,Proteomedex的法律顾问NM和Vischer根据Onconentix在虚拟数据室提供的文件和其他信息进行了法律尽职调查。尽职调查
除其他领域外,工作重点是Onconentix的资本化、知识产权和材料合同。为了促进法律尽职调查工作,Nelson Mullins于2023年11月20日向EGS发送了一份惯常的法律尽职调查请求列表,Onconentix及其律师在会议期间以书面、口头和Onconentix定期将响应的
文件和其他信息上传到虚拟数据室,对此请求做出了书面回应。
股份交换协议及附属协议的签署版本包含多项重大条款,反映双方于2023年11月14日后进行的谈判,其中包括(I)各方同意:(Br)在股份交换中作为代价发行的Onconentix普通股及B系列可转换优先股的股份(“交换股份”)的总价值约为7500万美元
(75,000,000美元),减去可行使已发行Proteomedex期权的Proteomedex股份的价值,但须作出赔偿调整
,(Ii)Proteomedex期权将保持未偿还状态,直至转换完成为止,届时未偿还的Proteomedex
期权将由Onconentix承担,并转换为获得获得Onconentix普通股股份或
Oncontix和Proteomedex同意的其他衍生证券的期权的权利,(Iii)Proteomedex将通过调整转换后发行的Oncontix普通股的
数量,就股份交换协议中包含的Proteomedex的陈述、担保或契诺的任何违反向Onconomex赔偿,(Iv)Oncontix将赔偿Proteomedex透过调整转换后发行的Onconentix普通股股份数目及(V)Proteomedex股东将因任何
违反股份交换协议所载Proteomedex股东的陈述、保证及契诺而向交易所股份及转换时可发行的Onconentix普通股股份作出追索,以弥偿Onconentix于股份交换协议内所载的保证或契诺。
于2023年12月13日,Onconentix董事会召开虚拟会议,审议Proteomedex与Onconentix之间的拟议交易。
EGS就股份交换协议的条款及拟进行的交易向Onconentix董事会作了简要介绍。由Campbell先生领导的Onconentix管理层还根据会议前与Onconentix董事会分享的信息和材料,向Onconentix董事会介绍了Onconentix管理层对Proteomedex的分析,以及Onconentix管理层认为可能通过与Proteomedex的交易所代表的商机。经审核和讨论,包括Onconentix董事会成员向EGS和Onconentix管理层提出的问题,Onconentix董事会宣布2023年12月13日的会议休会,并同意就换股协议采取行动,该协议的表格已于2023年12月14日分发给Onconentix董事会成员。于2023年12月15日,Onconentix董事会成员一致书面同意批准股份交换协议的建议最终版本及拟进行的交易,并建议Onconentix的股东全面采纳及批准股份交换协议及拟进行的交易。
董事会批准企业合并的理由
Onconentix董事会在评估PMX交易时,已征询Onconentix管理层及其财务和法律顾问的意见。
在达成一致决议案,认为换股协议及拟进行的交易(包括PMX交易及发行相关普通股)是可取的,并符合Onconentix的最佳利益时,Onconentix董事会考虑了一系列因素,包括但不限于以下讨论的因素。鉴于在评估PMX交易时考虑的因素众多且种类繁多,Onconentix董事会认为,
并不可行,也没有尝试对其在作出决定和支持其决定时所考虑的特定因素进行量化或以其他方式赋予其相对权重。Onconentix董事会认为其决定是基于所有可获得的信息和提交给它并由其考虑的因素。此外,个别董事可能会对不同因素给予不同的权重。本部分对Onconentix进行PMX交易的原因以及本节中提供的所有其他信息的解释具有前瞻性
,因此,阅读时应参考“关于前瞻性陈述的告诫说明”中讨论的因素。
Onconentix董事会认为与PMX交易有关的若干因素总体上支持其决定订立换股协议及拟进行的交易,包括但不限于以下重大因素:
| ● | 即时收入流
。Proteomedex是一项商业阶段的业务,从Proclarix中获得收入。 |
| | | |
| ● | 战略调整
。Onconentix的ENTADFI和Proteomedex的Proclarix的营销和销售活动都集中在泌尿科医生身上。 |
| | | |
| ● | 规模大、成长性强的产业:根据Global Industry Analyses的数据,前列腺癌诊断市场预计将从2023年的约85亿美元增长到2030年的约137亿美元。由于非侵入性和更精确的测试,该行业正在经历一场变革。凭借其融合了10多年的行业专业知识和创新的现有技术,Proteomedex尤其能够从这一不断增长的市场中受益。Proteomedex预计增长强劲。 |
| | | |
| ● | 到期
勤奋.蛋白质组学的尽职调查检查以及与蛋白质组学的讨论
管理团队和Onconetix的法律顾问就Onconetix的尽职调查
蛋白质组学检查。 |
| | | |
| ● | 财务
条件.董事会还考虑了ProteomeTM的历史财务
业绩、展望、财务计划和债务结构以及并购活动
为生命科学诊断行业的公司提供服务。考虑到这些因素,
Onconetix董事会回顾了Proteomeores的历史增长及其当前前景
如果Proteomerase实现其业务计划以及各种历史和当前平衡,则可实现增长
蛋白质组学的表项。 |
| | | |
| ● | 经验丰富
管理团队. Proteomeopathy拥有强大的管理团队, 体验.蛋白质组学的高级管理层打算在
管理人员和/或董事的能力,为推进蛋白质组学提供有益的连续性
战略和增长目标。 |
| | | |
| ● | 公正性
意见. Wainwright向Onconetix董事会提供了意见,即,根据
所遵循的程序、所做的假设、所进行的审查的资格和限制
以及Wainwright在准备其意见时考虑的其他事项,交换对价
从财务角度来看,对Onconetix来说是公平的。 |
| | | |
| ● | 锁定.
Proteomerase的股东已同意对其
公司证券,但有某些惯例例外。 |
| | | |
| ● | 管道
投资.第三方投资者对PIPE投资的兴趣是一种验证
与Proteomeetry的交易所代表的估值和机会。 |
| | | |
| ● | 其他
替代方案.董事会认为,在全面审查其他战略机会后
Onconetix合理可用,PMX交易代表了最佳潜力
Onconetix的机会。 |
| | | |
| ● | 协商的
交易.股份交换协议的财务和其他条款以及
这些条款和条件是合理的,是公平交易的产物
Onconetix和Proteomeopathy之间的谈判。 |
Onconetix董事会还考虑了与PMX交易有关的各种不确定性和风险以及其他潜在负面因素,包括但不限于以下内容:
| |
● |
业务计划和预测可能无法实现. Proteomerase可能无法执行业务计划的风险,并实现财务预测中规定的财务业绩,在每种情况下,提交给Onconetix的管理团队和董事会。 |
| |
● |
诉讼。诉讼挑战PMX交易的可能性,或者给予永久禁令救济的不利判决可能无限期地禁止完成PMX交易。 |
| |
● |
好处可能得不到。PMX交易的潜在利益可能无法完全实现或可能无法在预期时间框架内实现的风险。 |
| |
● |
获得Proteomedex少数股权的公司股东。Onconentix股东持有Proteomedex少数股权的风险。 |
| |
● |
费用及开支。与完成PMX交易相关的费用和开支。 |
| |
● |
其他风险因素。与Proteomedex业务相关的各种其他风险因素,如本委托书其他部分题为“风险因素”一节所述。 |
Onconentix董事会考虑的主要因素
的上述讨论并不打算详尽无遗,但确实阐述了Onconentix董事会考虑的主要因素。
管理预测
Onconentix和Proteomedex的管理层就其潜在的未来业务制定了某些有限的财务预测。这些分析已与Wainwright分享,并被Wainwright利用,
未经独立核实,与其公平意见的准备有关。这些财务预测和其中包含的重大
假设如下。
由Onconentix和Proteomedex管理层编制并由Wainwright使用的财务预测并不是由Onconentix和Proteomedex管理层在正常过程中维护的详细财务预测,也不是为了公开披露而编制的。此外,这些预测完全依赖于对可能或可能不会发生的各种事件和情况的假设,并受制于实际结果以及已知和未知的风险和意外情况,在许多情况下,这些事件和情况不受Onconentix和Proteomedex的控制,无法提前预测。前瞻性信息,包括有关未来业务计划的信息,固有地受到重大不确定性和意外情况的影响。前瞻性
陈述也容易受到多种解释的影响,本质上反映了有关一般商业、经济、监管、市场和金融状况以及其他未来事件的假设,所有这些都很难预测,其中许多超出了Onconentix和Proteomedex的控制范围。鼓励投资者仔细阅读本委托书中包含的信息,
包括财务信息以及与本文所述的Onconentix和Proteomedex业务有关的各种风险和不确定性的描述,包括标题下“风险因素,” “Onconentix管理层对财务状况和经营业绩的讨论和分析,” “Proteomedex管理层讨论及财务状况和经营结果分析”以及“关于前瞻性陈述的警告性声明.”
由Onconentix和Proteomedex管理层编制并与Wainwright分享的财务预测包括对Onconentix管理层和Proteomedex的预期未来现金流的概率加权预测,如下表所示。如下文进一步描述的那样,Wainwright在未经独立核实的情况下,将这些预测用于
其公平意见的准备。
Onconentix管理层根据管理层的观察、专业知识和行业知识认为这些预测是合理的,并考虑到预测中反映的Onconentix所有计划的业务活动都是推测性的,而Onconentix
产生的成本和支出可能与假设中包含的估计值大不相同。此外,Onconentix的
计划可能也可以预期在预测期的时间线上发生变化,这可能是实质性的,因为Onconentix特有的和更一般的基本事实和情况
发生了变化。
Proteomedex管理层根据管理层的观察、专业知识和行业知识认为该等预测是合理的,并考虑到预测中反映的Proteomedex的所有计划业务活动均属推测,而Proteomedex产生的成本和开支可能与假设中包含的估计存在较大差异。此外,Proteomedex的
计划可能也可以预期在预测期的时间线上发生变化,这可能是实质性的,因为Proteomedex特有的和更一般的基本事实和情况
发生了变化。
对Onconentix财务顾问的看法
董事会于二零二三年十一月六日聘请Wainwright就Onconentix根据股份交换协议须支付的交换代价的公平性从财务角度提出意见
。
2023年12月13日,Wainwright向Onconentix董事会提交了其
口头意见(随后以书面形式确认了Wainwright于同日发表的书面意见),大意是,基于并受制于本文所述书面意见中提出的假设、因素、资格和限制,截至2023年12月13日,从财务角度来看,交易所对价对Onconentix是公平的。
Wainwright的意见是为Onconentix董事会的资料而准备的,仅从财务角度阐述了Onconentix根据股份交换协议支付的交换代价对Onconentix
的公平性。Wainwright未被要求就联交所或联交所的任何替代方案的相对优点、Onconentix继续或实施联交所的基本决定或联交所的任何其他方面
发表意见,而Wainwright的公允意见亦不涉及此点。Wainwright的意见不涉及股票交易所对任何类别证券的持有者、债权人或Onconentix的其他选民的公平性。Wainwright并未就应支付或将支付给Onconentix的任何高级职员、董事或雇员的金额
的公平性或任何补偿的性质发表意见,无论
是否相对于联交所。温赖特没有对私募投资的公平性发表意见。
Wainwright在本委托书中的意见摘要
参考其书面意见全文进行保留,该书面意见全文作为本委托书的附件C,阐述了Wainwright在准备其意见时所遵循的程序、所做的假设、所进行的审查的资格和限制以及Wainwright在准备其意见时考虑的其他事项。Wainwright的意见是为提供给Onconentix董事会的信息而准备的,以供其在考虑联交所时使用。
Wainwright的书面意见及其意见摘要和本委托书中所载的相关分析都不打算也不构成对Onconentix的任何股东就该股东应如何就与联交所有关的任何事项或任何其他事项进行投票的建议。
联交所的条款、将于联交所支付的代价及相关交易乃经Onconentix与Proteomedex进行公平谈判而厘定,并获Onconentix董事会一致批准。Wainwright没有确定Onconentix
就股份交易所支付的对价。
关于提出上述公平意见并进行相关的财务分析,Wainwright除其他事项外,还审查了:
| ● | 2023年12月13日的《换股协议》草案所述的换股财务条款; |
| ● | 与Onconentix和Proteomedex的业务、收益、现金流、资产、负债和前景有关的某些信息,包括财务预测,这些信息分别由Onconentix和Proteomedex的管理层提供给Wainwright; |
| ● | 对Onconentix将收购的资产和负债进行相关的市场规模预测; |
| |
● |
管理Onconentix对股票交易所的战略理由和潜在利益的评估; |
| |
● |
Onconentix普通股的报告价格和交易活动; |
| |
● |
某些可公开获得的信息,包括但不限于,Onconentix最近提交给美国证券交易委员会的文件和其中列出的财务报表; |
| ● | Wainwright认为相关的某些收购和融资交易的财务条款(在公开范围内);以及 |
| ● | Wainwright
认为适合表达其意见的其他分析和其他因素。 |
出于其意见的目的,Wainwright在获得Onconentix董事会批准的情况下,未经独立核实,假定:
| |
● |
债权人和已购买股份的前持有人将在紧接交易结束和私募投资和转换生效后拥有Onconentix流通股的87.1%; |
| |
● |
私募投资者将拥有Onconentix 7.6%的流通股,紧随交易结束并在私募投资和转换生效后; |
| |
● |
紧接换股前持有Onconentix已发行股本的人士,将在紧接交易完成及私募投资及换股生效后,拥有Onconentix已发行股本的5.3%;及 |
| |
● |
Onconentix普通股在紧随交易完成及私募投资生效后将发行的普通股总数(于转换生效后)是根据已发行股份7,500万美元及假设的10天等同收益每股0.249美元计算。 |
在得出其意见时,Wainwright假定
并依赖所有公开提供给Wainwright、提供给Wainwright或以其他方式提供给Wainwright、与Wainwright讨论或为Wainwright审查以准备其意见的信息的准确性和完整性,并进一步假设提供给Wainwright的财务信息是由Onconentix和Proteomedex各自的管理层根据行业惯例在合理的基础上编制的,Oncontix和Proteomedex的管理层不知道任何会使向Wainwright提供的任何信息不完整或具有误导性的信息或事实。
关于Wainwright审阅的财务预测、
估计及其他前瞻性资料,Wainwright假设该等资料已由Onconentix及Proteomedex的管理层根据分别反映彼等目前可得的最佳
估计及对Onconentix及Proteomedex的预期未来营运业绩及财务状况的判断而合理地
编制。Wainwright未受聘评估任何此类财务预测、估计或前瞻性
信息或其所基于的假设的可实现性,Wainwright对该等信息或假设也不发表意见。
此外,Wainwright不承担任何责任,也不对Oncontix或Proteomedex的任何特定资产或负债(固定、或有或有或其他)进行任何评估或估值,Wainwright也未向其提供或提供任何此类评估或估值。在不限制前述一般性的原则下,Wainwright并未参与亦未
承担对Onconentix、Proteomedex或其各自联营公司为当事一方或可能受其约束的任何未决或受威胁的诉讼、监管行动、可能未断言的索赔或其他
或其他负债的任何独立分析,而Wainwright在
董事会的指示下并经其同意,Wainwright的公平意见并无就任何该等事宜可能提出的索赔、结果或损害作出任何假设
,亦未考虑任何此等事宜可能引致的索赔、结果或损害。
Wainwright依赖并假设,在未经独立
核实的情况下,股份交换协议及其中提及的所有相关文件及文书所载各订约方的陈述及保证均属真实及正确,股份交换协议订约方将全面及及时
履行其须履行的所有契诺及协议,股份交换将根据股份交换协议的条款完成而不会作出修订,而完成股份交换的所有条件将获满足而任何一方均不会放弃其项下的任何条件或责任。Wainwright进一步假设,换股协议在所有重要方面与提供给Wainwright的换股协议草案完全相同。最后,Wainwright
还假设,联交所所需的所有必要的监管批准和同意,包括Onconentix股东的批准,将以不会对Proteomedex产生不利影响的方式获得。
就其意见而言,Wainwright假定
并依赖其提供、与其讨论或审查的所有财务、法律、监管、税务、会计和其他信息的准确性和完整性,而无需独立核实。Wainwright的意见不涉及任何法律、税务、会计、
或监管事项。Wainwright的公平意见在提交给Onconentix董事会之前,得到了公平意见委员会的批准。
Wainwright的意见必须基于Wainwright可获得的信息以及存在的事实和情况,并在2023年12月13日(也就是Wainwright发表意见的日期)进行评估。尽管在Wainwright发表意见之日之后发生的事件可能会对准备意见时使用的假设产生重大影响,但Wainwright没有任何义务更新、修改或重申其意见
,Wainwright明确表示不承担任何责任。Wainwright未就将在联交所发行的Onconentix普通股的价值或Onconentix普通股在联交所公布后或未来任何时间的交易价格发表任何意见。
联交所的条款、将于联交所支付的代价
及相关交易乃经Onconentix
与Proteomedex之间的公平磋商而厘定,并获Onconentix董事会一致批准。Wainwright没有确定Onconentix就股份交易所支付的对价
。Wainwright的意见及其向Onconentix董事会提交的意见是Onconentix董事会在决定批准、采纳和授权换股协议时考虑的众多因素之一。因此,本文所述的分析不应被视为决定Onconentix董事会对Onconentix将在股份交易所支付的对价的意见,或Onconentix董事会是否愿意同意不同的对价。
以下是Wainwright就其公平意见的准备所进行的重大财务分析的摘要,该意见已于2023年12月13日口头提交给Onconentix董事会(并随后以书面形式确认了Wainwright于同日提交的书面意见)。分析和公允意见的准备是一个复杂的分析过程,涉及对最合适和相关的财务分析方法以及这些方法在特定情况下的应用的各种确定
,因此,此类意见不容易进行摘要描述,本摘要并不旨在完整描述Wainwright执行的分析或将Wainwright的意见提交给Oncontix董事会的情况。本摘要
包括以表格形式提供的信息。为了充分理解Wainwright提出的财务分析,表
必须与每个分析摘要的正文一起阅读,并作为一个整体来考虑。这些表格本身并不构成财务分析的完整摘要。考虑此类分析的任何部分和所考虑的因素,而不考虑所有分析和因素,可能会对支撑Wainwright观点的过程产生误导性或不完整的看法。
在提供其意见时,Wainwright没有
试图将本文所述的分析合并为一个综合估值范围,也没有为任何分析或考虑的其他因素分配任何定量权重。此外,在得出其意见时,Wainwright没有将任何特定的
权重归因于它所考虑的任何分析或因素,而是根据彼此的情况对每个
分析和因素的重要性和相关性做出定性判断。因此,Wainwright表示,它认为其分析必须作为一个整体来考虑,考虑其分析的任何部分,而不考虑所有分析,可能会对其意见或由此得出的结论所依据的过程产生误导性或不完整的
观点。
Wainwright从财务角度对Onconentix根据股份交换协议须支付的交换代价的公平性进行分析时,评估了Onconentix和Proteomedex的独立估值。Wainwright随后评估了合并后公司的潜在估值,并根据股份交换协议的条款,将其与紧接股份交换前Onconentix股东对合并后公司的形式所有权进行了比较。
Wainwright应用与其公平意见有关的每一种估值方法的结果摘要如下。
须在股份交易所支付的代价
如股份交换协议所述,订约方将企业价值7,500万美元归属于Proteomedex,将企业价值9,900万美元归属于Onconentix,相当于股权价值4,600,000美元,外加净债务530万美元。如上所述,就其意见而言,温赖特在未经独立核实的情况下,经Onconentix董事会批准,作出了以下假设:
| |
● |
债权人和已购买股份的前持有人将在紧接交易结束和私募投资和转换生效后拥有Onconentix流通股的87.1%; |
| |
● |
私募投资者将拥有Onconentix 7.6%的流通股,紧随交易结束并在私募投资和转换生效后; |
| |
● |
紧接换股前持有Onconentix已发行股本的人士,将于紧接交易完成及私募投资及转换生效后,拥有Onconentix已发行股本的5.3%。 |
在从财务角度分析根据股份交换协议安康将支付的交换代价对安康的公平性时,Wainwright独立评估了Proteomedex的隐含估值
,并将其与股份交换协议中Proteomedex应占的7,500万美元企业价值和安康的隐含估值进行了比较,并将其与股份交换协议中安康的990万美元企业价值进行了比较。
Proteomedex隐含估值
Wainwright使用以下估值指标确定了Proteomedex的一系列隐含估值
,每一项都将在下文中进一步描述。
贴现现金流分析
贴现现金流分析是一种“前瞻性”方法,基于Proteomedex将产生的预计未来现金流,然后将这些现金流折现回现在。这种方法有三个主要组成部分:(1)确定期间的预计无杠杆现金流的现值;(2)现金流的最终价值(代表预测时间范围之外的公司价值)的现值或基于最终自由现金流的永久增长计算;以及(3)用于将此类未来现金流和最终价值或永久价值折现到现在的加权平均资本成本(WACC)。未来现金流加上此类现金流的终端价值或永久价值,再用公司经风险调整的资本成本WACC进行贴现,得出现值。
Proteomedex管理层向Wainwright
提供了Proteomedex预期未来现金流的概率加权预测,如下表所示。
百万美元
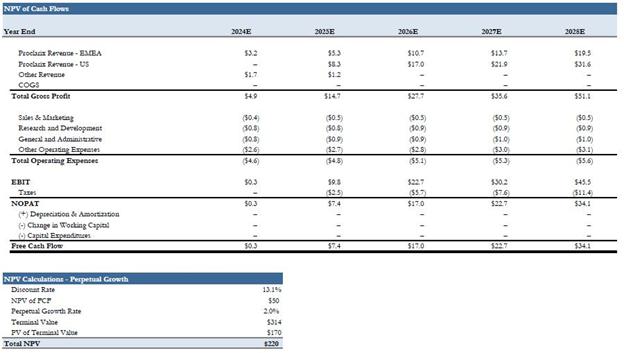
资料来源:公司管理层
Wainwright估计永久增长率在0%到4.0%之间。Wainwright还假设加权平均资本成本(WACC或贴现率)范围为11.1%至15.1%。根据这些投入,Wainwright确定的企业价值区间在1.59亿美元至3.56亿美元之间。下面提供的表格
显示了这些计算和Wainwright计算的WACC。
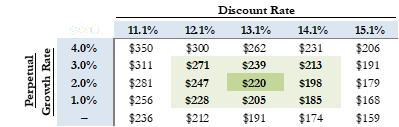
蛋白质组分的WACC分析

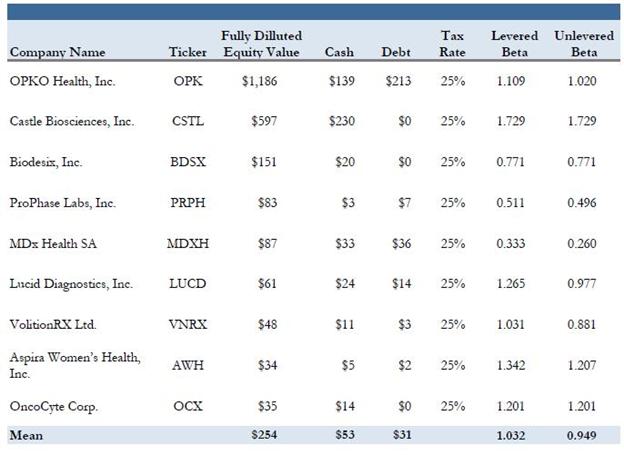
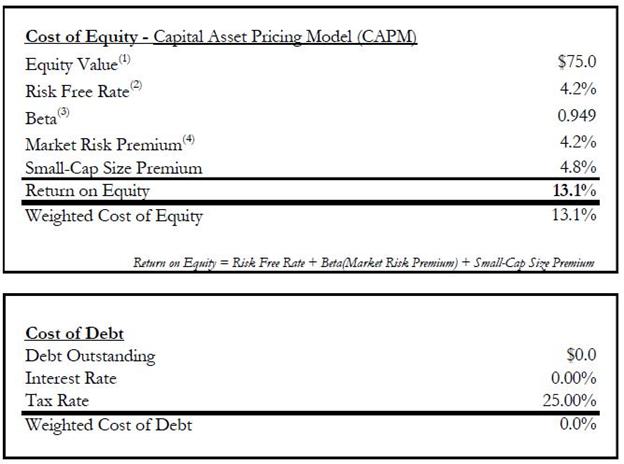
来源:Bloomberg&FactSet;截至2023年12月11日的市场数据
| (2) | 基于FactSet于2023年12月11日发布的5年期国债收益率 |
| (3) | 贝塔系数由选定公开市场可比公司的平均2年无杠杆调整贝塔系数确定。 |
| (4) | Aswath
Damodaran发布的截至2023年7月的长期美国ERP |
基于这些投入,Wainwright使用永久增长法计算出的企业价值范围在1.85亿美元至2.71亿美元之间,相比之下,Proteomedex在换股协议中的企业价值为7,500万美元。
可比上市公司分析
Wainwright还使用可比较的公司分析评估了Proteomedex的隐含企业估值。可比公司分析使用基于上市公司当前企业价值的数据
Wainwright认为这些上市公司与Proteomedex可比,以制定Proteomedex的现值衡量标准。Wainwright
回顾了选定的上市商业阶段医疗诊断公司的总企业价值,Wainwright认为这些公司在类似于Proteomedex的商业市场运营。下表所示的选定可比上市公司的企业估值范围在4,300万美元(25这是百分位数)和2.55亿美元(75这是百分位数)。Wainwright
没有排除任何符合上述标准的公司。
百万美元

资料来源:截至2023年12月11日的FactSet
根据上述分析,Wainwright
估计Proteomeetry的企业价值在4300万美元至2.55亿美元之间,而在股份交换协议中,Proteomeetry的企业价值为7500万美元。
并购交易先例
先前的并购分析使用基于
收购方先前在合并或收购中对可比公司的价值的数据,以衡量ProteomeTM的当前价值
。Wainwright研究了从2018年6月25日到2022年8月2日的先例交易,涉及Wainwright认为在类似商业市场运营的上市商业阶段医疗诊断公司。Wainwright仅使用这些交易中支付的
预付对价,未考虑任何或有价值权利或其他或有对价。下表中显示的
交易的前期对价值介于30.0百万美元(25这是百分位数)和
4.32亿美元(75这是百分位)。Wainwright没有排除任何符合上述标准的公司。
百万美元
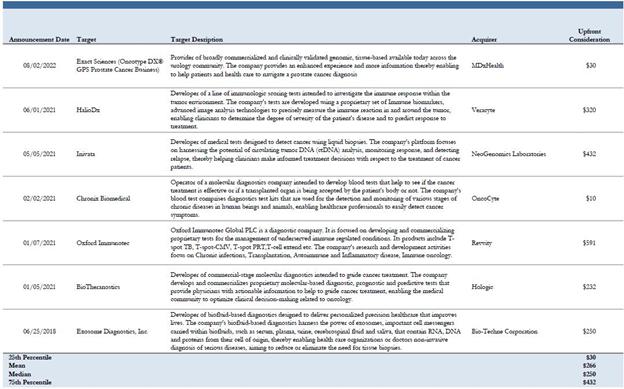
资料来源:截至2023年11月12日的公司SEC文件、新闻稿、Pitchbook
| (1) | 根据NeoGenomics
在彻底收购之前已经拥有的约10%的Alvata股份进行调整 |
Onconetix隐含估值
Wainwright使用
以下估值指标确定了Onconetix的一系列隐含估值,以下将进一步描述每个指标。Wainwright表示,其认为应
对Onconetix的贴现现金流分析应用重要权重,因为Onconetix的公开可比公司和先例交易
分析没有考虑到(i)Onconetix为未来运营提供资金所需的重大稀释,(ii)Onconetix的
高资本成本以及(iii)Onconetix无法进入资本市场。
贴现现金流分析
贴现现金流分析是一种“前瞻性”方法,基于Onconetix产生的预计未来现金流,然后将其贴现回
现在。该方法有三个主要组成部分:(1)确定期间的预计无杠杆现金流的现值;
(2)现金流终值的现值(代表预测时间范围以外的公司价值)或基于终端自由现金流的永久
增长计算;以及(3)用于将此类未来
现金流和终值或永续价值折现回现值的加权平均资本成本(WACC)。未来现金流加上此类现金流的终值或永久价值
,通过公司的风险调整资本成本(WACC)进行贴现,以获得现值。
Onconetix管理层向Wainwright提供了Onconetix预期未来现金流的概率加权
预测,如下表所示。
百万美元

资料来源:公司管理层
Wainwright估计永久性增长率
在(2.0)%和2.0%之间。温赖特还假设加权平均资本成本(WACC或贴现率)范围为14.8%至18.8%。
根据这些输入,Wainwright确定了企业价值范围在500万美元到700万美元之间。下表
显示了这些计算结果和Wainwright计算的WACC。
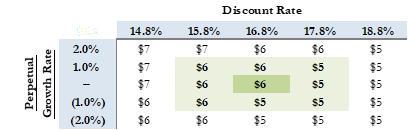
Onconetix WACC分析

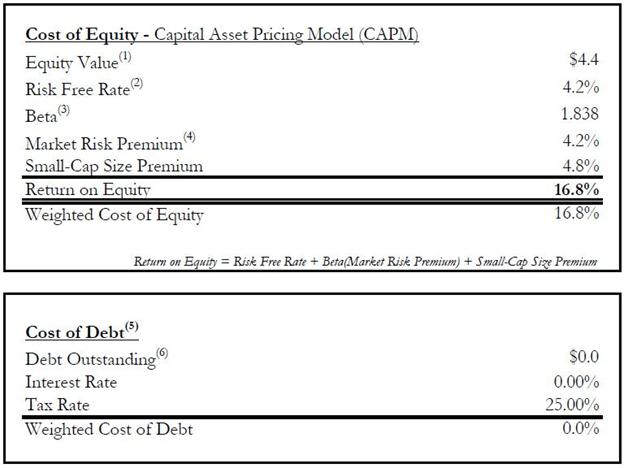
来源:Bloomberg&FactSet;截至2023年12月11日的市场数据
| (2) | 基于FactSet于2023年12月11日发布的5年期国债收益率 |
| (3) | 截至2023年12月11日,彭博社BWV的两年历史调整贝塔系数 |
| (4) | Aswath Damodaran发布的截至2023年7月的长期美国ERP |
| (5) | 从公司10-Q获取的所有数字在2023年10月20日提交,代表2-23季度 |
| (6) | 不包括欠Veru Inc.的对价,因为它不产生任何利息 |
基于这些投入,Wainwright使用永久增长方法计算了企业价值范围
在500万美元至600万美元之间,而股份交换协议中Onconentix的企业价值为990万美元。
可比上市公司分析
Wainwright还使用可比较的公司分析评估了Onconentix
的隐含企业估值。可比公司分析使用基于上市公司当前企业价值的数据
Wainwright认为这些上市公司与Onconentix具有可比性,以制定Onconentix的当前价值衡量标准。Wainwright回顾了选定的上市专业制药公司的企业总价值,Wainwright认为这些公司在与Onconentix类似的商业市场运营。下表所示的选定可比上市公司的企业估值范围在500万美元
(25这是百分数)和4,300万美元(75这是百分位数)。Wainwright没有排除任何符合上述标准的公司。
百万美元
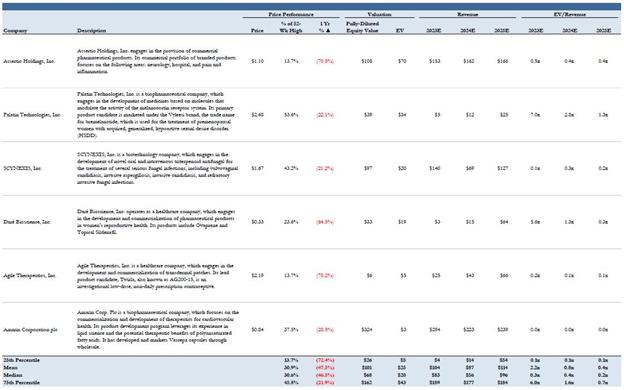
资料来源:截至2023年12月11日的FactSet
基于上述分析,Wainwright估计Onconentix的企业价值介乎500万美元至4,300万美元之间,而股份交换协议中Onconentix的企业价值为990万美元。
并购交易先例
先例并购分析使用基于收购者之前在合并或收购中对可比公司施加的价值的数据,以制定Onconentix的现值衡量标准。Wainwright
审查了2019年9月6日至2023年8月31日的先例交易,涉及Wainwright
认为在与Onconentix类似的商业市场运营的专业制药公司。Wainwright只使用了在这些交易中支付的预付对价
,没有考虑任何或有价值权利或其他或有对价。下表中显示的交易的预付对价为1,500万美元(25这是百分位数)和7900万美元(75这是百分位数)。
百万美元
资料来源:截至2023年11月12日的公司SEC文件、新闻稿、Pitchbook
| (1) | 收购剩余约40%的流通股的调整对价
以反映公司完全摊薄的企业价值 |
一般信息
Wainwright是一家全国公认的投资银行公司,
提供金融咨询服务,并持续从事与合并和收购、谈判承销、上市和非上市证券的二级分销、私募以及用于房地产、公司和其他目的的估值相关的企业及其证券的估值。Onconentix董事会聘请Wainwright根据前述资格、经验及专业知识,就Onconentix根据股份交换协议支付的代价从财务角度向Onconentix支付的公平性提出意见。
Onconentix向Wainwright支付了25万美元的费用,因为Wainwright提供了与股票交易所相关的公平意见。意见费并非全部或部分取决于联交所的成功与否、或Wainwright的评估及分析结果或Wainwright的意见所得出的结论。此外,Onconentix同意偿还Wainwright的合理自付费用,包括合理的律师费用和支出。Onconentix还同意赔偿Wainwright因其与Wainwright的接触而可能产生的某些责任和其他事项。
Onconentix董事会在其进行的调查或提出意见时遵循的程序中没有以任何方式限制Wainwright。
除以下所述外,Wainwright在Wainwright提出意见的日期前两年内,并未与Onconentix、Proteomedex或任何其他联交所各方
有实质关系,亦未以其他方式收取费用:
| |
● |
2023年7月,Wainwright
担任Onconentix的独家配售代理,参与“关于业务与权证合并诱因的信息”中所述的权证诱因交易。Onconentix向Wainwright支付了约23万美元的现金费用。本公司还同意向Wainwright偿还与行使现有PIO和发行诱因PIO有关的费用,50,000美元的法律顾问费用和支出以及其他自付费用,并同意向Wainwright支付35,000美元的非实报实销费用和15,950美元的结算费用。此外,现有首次公开招股的现金行使触发了向Wainwright或其指定人发行认股权证,以购买149,173股普通股,这些普通股的条款与诱因首次公开募股基本相同,只是行使价相当于每股1.3625美元。本公司还同意向Wainwright
支付本公司可能因行使诱因PIO现金而获得的任何毛收入的7.5%的现金费用,并在任何诱因PIO现金行使时向Wainwright或其指定人发行认股权证,该普通股数量相当于已行使任何诱因PIO的普通股总数的6.0%
,行权价格为1.3625美元。根据这项规定,应付现金的最高限额为406,496美元,根据这项规定可发行的认股权证的最高数目为298,346。 |
| |
|
|
| |
● |
于2023年3月,Onconentix与Wainwright订立市场发售协议(“自动柜员机协议”),内容包括出售最多390万美元的Onconentix普通股,根据该协议,Onconentix同意向Wainwright支付出售股份所得总收益的3.0%的佣金,并偿还Wainwright的若干开支。根据自动柜员机协议,没有发生任何销售。 |
| |
|
|
| |
● |
2022年8月,Wainwright
担任Onconentix与私募证券有关的独家配售代理。Onconentix向Wainwright
支付了约850,000美元的现金费用和85,000美元的非实报性费用。此外,公司还向Wainwright或其指定人发行认股权证,购买最多220,997股普通股(“八月Wainwright认股权证”)。8月份的Wainwright认股权证的条款与私募发行的优先投资期权基本相同,只是行使价格为3.3938美元。此外,在行使任何优先投资期权时,公司同意向Wainwright支付7.5%的现金费用,并向Wainwright(或其指定人)发行额外的认股权证,以购买相当于已行使的优先投资期权相关普通股总数的6.0%的普通股,同时行使价为3.3938美元(“8月或有认股权证”)。8月份Wainwright认股权证现金行使时应付的最高现金费用约为949,485美元,根据本条款可向Wainwright发行的8月份或有认股权证涵盖的Onconentix普通股最高股票数量为298,346股。 |
| |
|
|
| |
● |
2022年4月,Wainwright
担任Onconetix在证券私募方面的独家配售代理。Onconetix支付给Wainwright
约680,000美元的现金费用,以及总计50,000美元的非实付费用报销
费用35000元。此外,该公司向Wainwright或其指定人发出认股权证,以购买多达70,849 四月Wainwright认股权证(April Wainwright Warrants)Wainwright认股权证的形式与
私募发行的优先投资选择权,但行使价为8.46875美元。此外,在任何
行使现金的任何优先投资选择权,该公司同意支付温赖特7.5%的现金费用,并发行给温赖特
(or其指定人)额外认股权证,以购买普通股的数量等于
总数的6.0% 已行使的优先投资期权相关普通股,行使价也为8.46875美元 (the“四月或有认股权证”)。四月Wainwright认股权证现金行使时应付的最高现金费用
约为588,930美元,4月或有认股权证所涵盖的Onconetix普通股的最大股数
根据这项规定,可向Wainwright发行的债券为70,849,并与2022年8月的私人
安置 |
将来,Wainwright可能会向Onconetix、Proteomesterion或其各自的关联公司提供财务咨询
和投资银行服务,Wainwright预计会因此获得
报酬。
根据适用的法律和法规要求,Wainwright
已采用政策和程序来建立和保持其研究部门和人员的独立性。因此,
Wainwright的研究分析师可能会持有与其投资银行人员不同的观点,发表与Onconetix、Proteomerase和/或股票交易所有关的声明或投资建议和/或发表与
研究报告。
风险因素
Onconetix相关风险
对于我们继续作为“持续经营”的能力
存在重大疑问。
本公司自成立以来已产生
重大经营亏损,并预计在可预见的未来将继续产生重大经营亏损。
截至2023年9月30日,公司拥有约770万美元的现金,约810万美元的营运资金赤字
和约3440万美元的累计赤字。
2024年1月23日,公司发行了债务,以换取460万美元的净现金收益。债务须于(i)认购协议项下结算及(ii)二零二四年六月三十日(以较早者为准)悉数偿还。
The Company will require significant additional capital to fund its
continuing operations, satisfy existing and future obligations and liabilities, and otherwise support the Company’s working capital
needs and business activities, including making the remaining payments to Veru, the commercialization of ENTADFI and Proclarix, and the
development and commercialization of its current product candidates and future product candidates. In addition, if Stockholder Approval
is not obtained by January 1, 2025, the Company may be obligated to cash settle the Series B Preferred Stock. Management’s
plans include generating product revenue from sales of ENTADFI, which is subject to further successful commercialization activities, and
Proclarix, which may still be subject to further successful commercialization activities within certain jurisdictions. Certain of the
commercialization activities are outside of the Company’s control, including but not limited to, securing contracts with wholesalers
and third-party payers, securing contracts with third-party logistics providers, obtaining required licensure in various jurisdictions,
as well as attempting to secure additional required funding through equity or debt financings if available. However, there are currently
no commitments in place for further financing nor is there any assurance that such financing will be available to the Company on favorable
terms, if at all. If the Company is unable to secure additional capital, it may be required to delay or curtail any future clinical trials,
development and/or commercialization of products and product candidates, and it may take additional measures to reduce expenses in order
to conserve its cash in amounts sufficient to sustain operations and meet its obligations. These conditions raise substantial doubt about
the Company’s ability to continue as a going concern for a period of time within one year after the date of the issuance of the
condensed financial statements included in this proxy statement. If Stockholder Approval is not obtained, the Series B Preferred Stock becomes redeemable by the holders
of the Series B Preferred Stock for cash. The Company does not currently have sufficient cash to redeem the shares of Series
B Preferred Stock.
我们与WraSer签订了资产购买协议
和管理服务协议,由于我们认为WraSer资产发生了重大不利事件
,这些协议已被终止。但是,终止受WraSer质疑终止并向我们提出
索赔的权利的约束。
于2023年6月13日,我们与WraSer
就购买WraSer资产订立WraSer APA及MSA。根据WraSer APA,我们在签约时向WraSer支付了350万美元现金。
2023年10月,WraSer提醒我们,其Zontivity API的唯一制造商(WraSer收购的关键驱动因素)将不再
生产Zontivity API。我们认为,这一发展构成了APA项下的重大不利影响,使我们能够
终止APA和MSA。2023年10月20日,我们向破产法院提出了一项动议,要求免除自动中止,以行使经修订的WraSer APA下的终止权。于2023年12月18日,破产法院订立一项协议命令,解除
自动中止,使我们能够行使我们的权利终止APA及MSA,而不损害双方各自在APA及MSA项下的
权利、补救、申索及抗辩。2023年12月21日,我们向破产法院提交了终止APA和MSA的通知。WraSer告知我们,它不认为发生了重大不良事件。
由于WraSer的破产申请以及我们作为WraSer的无担保债权人的地位,我们也不太可能收回350万美元的签约现金或与公司根据WraSer MSA提供的服务有关的任何成本和资源。
公司股东可能无法从ENTADFI或Proteomeopathy收购中获得
与他们将在与交易相关的
中经历的所有权稀释相称的利益。
如果本公司无法实现从最近的ENTADFI和Proteomeopathy收购中获得的全部战略和财务
利益,我们的股东可能会在没有获得任何相应利益的情况下稀释他们在本公司的
所有权权益,或仅获得部分与
在某种程度上,公司只能实现目前预计从交易中获得的部分战略和财务利益。
证券的发行或转换将
导致现有股东的股权被大幅稀释,并对证券市场产生不利影响。
发行或转换普通股或其他可转换
为普通股的证券将导致现有股东的股权被严重稀释,并对普通股的市场
价格产生不利影响。我们已向Veru发行了3,000股A系列优先股,这些优先股在发行后一年内可转换为5,709,935股公司普通股,但须根据指定证书中规定的调整和某些股东批准限制进行调整。我们已向Proteomerase的前股东发行了2,696,729股B系列优先股
,这些优先股最初可转换为269,672,900股公司普通股
,但须根据
指定证书中规定的调整和某些股东批准限制。这些和其他未来的证券发行或转换可能会导致现有股东的重大稀释,
这可能会对您的投资产生不利影响。
我们可能违反了《
交易法》第13(k)条(实施2002年《萨班斯-奥克斯利法案》第402条),因此可能受到制裁。
《证券交易法》第13(k)节规定,拥有根据《证券交易法》第12节注册的某类证券的公司,直接或间接(包括通过任何子公司)以个人贷款的形式向其任何董事或执行官提供或维持信贷是非法的。在截至2022年12月31日的财政年度和截至2023年9月30日的九个月,我们支付了我们的前首席执行官和董事会主席的某些费用,这些费用可能被视为我们向我们的前首席执行官和董事会主席提供的个人贷款,根据交易法第13(k)条,这是不允许的。被发现
违反《交易法》第13(k)条的发行人可能会受到民事制裁,包括禁令救济和罚款,
以及刑事制裁。对我们实施任何此类制裁都可能对我们的业务、财务
状况、经营业绩或现金流产生重大不利影响。
我们的现任和
前任员工以及第三方服务提供商的不当行为和错误可能会对我们的业务和声誉造成重大不利影响。
我们的员工和第三方
服务提供商是我们业务运营的组成部分,包括机密信息。如果任何此类信息因人为错误、盗窃、恶意破坏或欺诈性操纵而泄露给
非预期接收者,我们可能会对此类信息的损失
承担责任。此外,如果我们的任何员工或第三方服务提供商为了与我们竞争而携带我们的专有数据或专有技术潜逃,我们的竞争地位可能会受到重大不利影响。
如果我们的任何员工或第三方服务提供商违反我们的协议和政策,
不当行为或使用资金,可能会导致涉及我们的监管
和纪律程序。我们可能会被视为促成或参与了此类行为,我们可能会
承担责任、损失、处罚和名誉损害。不可能完全识别和消除所有不当行为
或人为错误的风险,我们的预防措施可能无法有效地发现和防止此类风险的发生。
上述任何
风险的发生都可能对我们的业务和运营结果造成重大不利影响,因为我们面临对借款人和投资者的潜在责任
、声誉损害、监管干预和财务损害。我们吸引新的和留住现有
借款人和投资者的能力以及作为一个持续关注的企业运营的能力可能会受到损害。
我们可能会考虑战略替代方案,以
最大化股东价值,包括融资、战略联盟、许可安排、收购或可能出售
我们的业务。我们可能无法识别或完善任何合适的战略替代方案,并且任何完善的战略替代方案
可能不会成功。
我们可能会考虑所有可供我们使用的战略
替代方案,以实现股东价值最大化,包括融资、战略联盟、许可安排、
收购或可能的业务出售。我们对各种战略替代方案的探索可能不会导致任何具体行动
或交易。在此约定导致交易的范围内,我们的业务目标可能会根据交易的性质
而变化。概不保证我们将因委聘而订立任何交易。此外,如果我们
决定进行战略交易,我们无法预测此类战略交易可能对我们的运营
或股票价格产生的影响。我们也无法预测如果我们未能达成交易对我们股价的影响。
此外,我们在寻求合适的战略合作伙伴方面面临着巨大的
竞争,谈判过程既耗时又复杂。此外,我们可能无法
成功地建立战略合作伙伴关系或其他业务活动的替代安排,因为
它们可能被视为处于合作努力的早期发展阶段。任何延迟签订新战略合作伙伴协议
的行为都将损害我们的业务前景、财务状况和经营业绩。
如果我们许可产品或
业务,如果我们无法成功地将其与我们现有的
运营和公司文化相结合,我们可能无法实现此类交易的利益。我们无法确定,在战略交易或许可证之后,我们将实现证明此类交易合理的结果、
收入或特定净收入。
由于我们未能及时提交
截至2023年6月30日的10-Q表季度报告,我们目前没有资格提交S-3表的新简短注册
声明,这可能会损害我们及时或根本无法以有利于我们的条款筹集资金的能力。
表格S-3允许符合条件的
发行人使用简短的注册声明进行注册发行,该声明允许发行人通过引用纳入其根据1934年证券交易法(经修订)或交易法编制的
过去和未来申报和报告。此外,
表格S-3使合格的发行人能够根据《1933年证券法》(修订版)或《证券法》第415条的规定进行“现货”首次发行。搁置注册流程与转发合并信息的能力相结合,
使发行人能够避免发行流程中的延迟和中断,并以比根据表格S-1上的注册声明在标准注册发行中筹集资本更迅速和更有效的方式
进入资本市场。
As a result of our failure to timely file our
Quarterly Report on Form 10-Q for quarter ended June 30, 2023, we are currently ineligible to file new short form registration
statements on Form S-3 and we will be unable to conduct “off the shelf” offerings under Rule 415 of the Securities
Act using our currently effective Registration Statement on Form S-3 (File No. 333-270383) after we file our annual report for the
fiscal year ended December 31, 2023. As a result, we may be unable to conduct an “at the market” offering pursuant to our
At The Market Offering Agreement with Wainwright after such date. In addition, if we seek to access the capital markets
through a registered offering during the period of time that we are unable to use Form S-3, we may be required to publicly disclose the
proposed offering and the material terms thereof before the offering commences, we may experience delays in the offering process due to
SEC review of a Form S-1 registration statement and we may incur increased offering and transaction costs and other considerations. Disclosing
a public offering prior to the formal commencement of an offering may result in downward pressure on our stock price. In addition, our
inability to conduct an offering “off the shelf” may require us to offer terms that may not be advantageous (or may be less
advantageous) to us or may generally reduce our ability to raise capital in a registered offering. If we are unable to raise capital through
a registered offering, we would be required to conduct our financing transactions on a private placement basis, which may be subject to
pricing, size and other limitations imposed under Nasdaq rules.
如果我们未能保持适当和有效的
内部控制,我们及时编制准确财务报表的能力可能会受到损害。我们已发现内部控制中的弱点
,但我们无法保证这些弱点将得到有效补救,或未来不会发生其他重大
弱点。
We are subject to the reporting
requirements of the Exchange Act, the Sarbanes-Oxley Act and Nasdaq rules and regulations. The Sarbanes-Oxley Act requires, among other
things, that we maintain effective disclosure controls and procedures and internal control over financial reporting. Effective internal
control over financial reporting is necessary for us to provide reliable financial reports and, together with adequate disclosure controls
and procedures, is designed to prevent fraud. We must perform system and process evaluation and testing of our internal controls over
financial reporting to allow management to report on the effectiveness of our internal controls over financial reporting in our Annual
Report on Form 10-K for each year, as required by Section 404 of the Sarbanes-Oxley Act (“Section 404”). This requires significant
management efforts and requires us to incur substantial professional fees and internal costs to expand our accounting and finance functions.
Any failure to implement required new or improved controls, or difficulties encountered in their implementation, could cause us to fail
to meet our reporting obligations. In addition, any testing by us, as and when required, conducted in connection with Section 404, or
any subsequent testing by our independent registered public accounting firm, as and when required, may reveal deficiencies in our internal
controls over financial reporting that are deemed to be significant deficiencies or material weaknesses or that may require prospective
or retroactive changes to our financial statements, or may identify other areas for further attention or improvement. Furthermore, we
cannot be certain that our efforts will be sufficient to remediate or prevent future material weaknesses or significant deficiencies from
occurring.
我们还没有有效的
披露控制和程序,或对我们财务报告的所有方面的内部控制。具体而言,我们已识别
以下控制缺陷,我们认为这些缺陷属于重大缺陷。
| |
● |
我们没有维持有效的控制环境,因为在某些现金支付方面没有适当的职责分工。信用卡交易和某些银行电汇付款的处理和批准由前首席执行官和一名会计雇员负责,会计雇员负责核对信用卡对账单和银行对账单。这使得这些人能够向未经授权的第三方提交未经授权的付款。 |
| |
|
|
| |
● |
我们没有一个有效的风险评估流程来识别围绕授权、识别、批准和报告从公司公司信用卡收取的个人费用的欺诈风险。 |
| |
● |
我们并无设计及维持有效监察是否遵守既定会计政策及程序。 |
| |
|
|
| |
● |
我们对公司信用卡和某些银行电汇支付的费用的批准和报告的控制不是为了实现公司的目标而设计和维护的。 |
| |
|
|
| |
● |
我们未能雇用足够数量的工作人员来维持最佳的职责分工,围绕信息技术程序维持适当的内部控制,例如缺乏书面的信息安全政策,对日记账条目的批准和发布维持适当的控制,并提供最佳的监督水平,以便及时处理财务信息,分析和说明复杂的,非常规交易,并编制财务报表。 |
| |
|
|
| |
● |
我们尚未建立足够的内部控制以及时识别、批准或报告关联方交易。 |
我们无法保证这些缺陷将得到有效的
补救,或者将来不会出现其他重大缺陷。
由于我们对上述财务报告的内部控制存在重大
缺陷,以及SEC提出或将来可能提出的其他事项,我们可能面临诉讼或其他争议,其中可能包括援引联邦
和州证券法的索赔,合同索赔或因我们对财务
报告和财务报表编制的内部控制存在重大缺陷而产生的其他索赔,其中任何索赔都可能对我们的业务产生不利影响。截至
本报告日期,我们不知道任何此类诉讼或争议。
CFIUS可能会延迟、阻止转换或对其施加条件
。
出于国家安全考虑,CFIUS有权审查外国对美国企业的某些直接或间接投资。除其他事项外,CFIUS有权要求对在美国的某些外国投资进行
强制性备案,并在此类投资的各方选择不自愿备案的情况下,自行启动对某些外国在美国企业的直接和间接投资的国家安全审查。对于美国外国投资委员会认定存在未解决的国家安全担忧的交易,外国投资委员会有权暂停交易,实施
缓解措施,或建议美国总裁在国家安全担忧无法缓解的情况下阻止未决交易或下令剥离已完成的
交易。CFIUS是否拥有审查收购或投资交易的管辖权
除其他因素外,还取决于交易的性质和结构、目标公司是否为美国企业、
外国人获得的实益所有权和投票权的级别以及交易向外国人提供的任何信息、控制权、访问权限或治理权的性质。例如,任何可能导致外国“控制”美国企业的交易
(根据CFIUS法规中的定义)都在CFIUS的管辖范围内。此外,CFIUS对某些投资拥有管辖权,这些投资不会导致外国人士控制美国企业,但向外国人士提供对“TID美国企业”的某些访问、参与或治理权利,即:(1)生产、设计、测试、制造、制造或开发一项或多项“关键技术”;(2)拥有、运营、制造、供应或服务
某些“关键基础设施;或(3)直接或间接维护或收集美国公民的“敏感个人数据”
。
与
关联或以其他方式参与交易的某些实体或个人由非美国人控制或与非美国人有密切联系。具体而言,Schiess博士和Bruühlmann博士都是“外国人”(这一术语在“联邦判例汇编”第31编800.224节中有定义)。
CFIUS拥有广泛的自由裁量权来解释其法规,我们无法预测CFIUS是否会寻求审查转换。如果美国外国投资委员会对转换进行了审查,并发现未解决的国家安全问题作为审查的一部分,美国外国投资委员会可以建议美国的总裁命令一名或多名外国人
剥离他们在未事先获得外国投资委员会批准的情况下获得的全部或部分普通股。此外,如果CFIUS确定转换的任何一方需要向CFIUS提交申请,但未能做到这一点,CFIUS可以对其确定受强制性
提交要求的各方处以不超过25万美元或相关交易价值的民事罚款。
应CFIUS的要求,Onconentix和Proteomedex将向CFIUS提交关于PMX交易的联合声明或通知,但Onconentix已决定
不行使其主动选择提交此类联合声明或通知的权利。
不能保证我们将
能够遵守纳斯达克持续的上市标准。
我们是否继续有资格在纳斯达克上市取决于我们是否有能力遵守纳斯达克的持续上市要求。
2023年9月18日,我们收到了纳斯达克工作人员的通知,指出根据普通股连续30个工作日的收盘价计算,我们
没有遵守纳斯达克上市规则第5550(A)(2)条中规定的继续在纳斯达克上市必须保持每股最低买入价1.00美元的要求。从2023年9月18日或到20年3月16日,我们有180天的时间重新遵守
投标价格规则。
如果纳斯达克因未能达到投标价格规则或任何其他上市标准而使我们的普通股在其交易所退市,我们和我们的股东可能面临重大的
不利后果,包括:
| |
● |
我们证券的市场报价有限; |
| |
|
|
| |
● |
确定我们的普通股是“细价股”,这将要求交易我们普通股的经纪商遵守更严格的规则,这可能会导致我们普通股在二级交易市场的交易活动减少; |
| |
|
|
| |
● |
有限数量的分析师报道;以及 |
| |
|
|
| |
● |
未来发行更多证券或获得更多融资的能力下降。 |
与我们产品商业化相关的风险
我们完全依赖于有限数量的产品和/或候选产品的成功,其中一些处于临床前开发阶段,尚未进入临床试验。如果我们的一个或多个产品和/或候选产品未能获得监管部门的
批准并成功商业化,或者我们在此过程中遇到重大延误
,这些候选产品可能无利可图。
我们有几个产品没有获得监管部门的批准,可能永远无法获得批准并将这些产品推向市场。我们预计,在未来几年中,我们的大部分工作和费用将用于开发我们的产品和/或候选产品。因此,我们的业务
目前在很大程度上依赖于这些产品和/或候选产品的成功开发、监管批准以及(如果获得批准)商业化。我们无法确定我们的产品和/或候选产品是否会获得监管部门的批准,或者是否会成功
商业化,即使它们获得了监管部门的批准。我们产品和/或候选产品的研究、测试、制造、安全性、有效性、标签、批准、销售、营销和分销都将受到FDA和类似外国监管机构的全面监管。在获得任何候选产品商业销售的监管批准之前,
我们可能需要通过临床前研究和临床试验或研究证明该候选产品用于每个目标适应症是安全有效的
。药物、治疗和诊断产品的开发是一个漫长、昂贵且不确定的过程,在我们的临床试验或研究的任何阶段都可能出现延迟或失败。如果我们的产品和/或候选产品在美国未能获得监管部门的批准,我们将无法将我们的产品和/或候选产品
商业化和营销。我们产品和/或候选产品的成功将取决于其他几个因素,包括:
| |
● |
完成证明其有效性和安全性的临床试验和/或研究; |
| |
● |
我们的产品和/或候选产品的不良事件的流行率和严重程度; |
| |
● |
患者、医学界和第三方付款人对我们的产品和/或候选产品的接受度
; |
| |
● |
为我们的产品和/或候选产品获得并维持医疗保险和
足够的报销; |
| |
● |
有效地与其他疗法竞争,包括在我们产品和/或候选产品的销售和营销方面(如果获得批准);以及 |
| |
● |
有资格获得、维护、执行和捍卫我们的知识产权和主张。 |
其中许多因素是我们无法控制的,包括充分完成临床测试所需的时间、监管提交流程、对我们知识产权的潜在威胁
以及竞争格局的变化。即使我们花费大量时间和资源寻求监管批准,我们的任何产品和/或产品
候选产品也可能永远不会获得监管部门的批准。如果我们不能及时或根本实现这些因素中的一个或多个,我们可能会遇到重大延误或无法成功
完成临床试验、获得监管批准或(如果获得批准)将我们的产品和/或候选产品商业化,这将对我们的业务、财务状况和运营结果造成重大损害。
FDA的上市审批流程冗长、耗时
且本质上不可预测,如果我们最终无法为我们打算开发的当前候选产品和未来候选产品获得上市审批,我们的业务将受到严重损害。
我们的一些产品和/或候选产品处于非常早期的开发阶段。我们打算开发的候选产品尚未在美国获得市场批准,我们不能保证我们会有适销对路的产品。我们的业务在很大程度上取决于我们能否及时完成我们当前和未来候选产品的开发、获得市场批准并成功将其商业化
。我们不能在美国将我们的候选产品商业化,除非首先获得FDA的批准以营销每个候选产品
。我们的候选产品可能会因为许多原因而无法获得上市批准,其中包括:
| |
● |
如果我们要通过分别向美国食品和药物管理局(FDA)和欧洲药品管理局(EMA)提交新的生物许可证申请(BLA)和/或新药申请(NDA)以及上市授权申请(MAA)来寻求和获得监管营销申请,我们对候选产品(S)的临床试验必须成功。即使之前的试验成功了,高级临床试验通常也不会成功,即使我们能够进行高级临床试验,而那些试验是成功的,我们也可能无法为我们的候选产品(S)获得必要的监管批准,或者即使我们获得了必要的监管批准,我们也可能无法成功地将我们的产品商业化 |
此外,寻求监管部门
批准将我们打算开发的候选产品推向市场的过程既昂贵又耗时,而且尽管花费了大量精力和费用,但永远不能保证获得批准。如果我们不能及时获得FDA对我们的候选产品的批准,
我们可能永远无法产生可观的收入,并可能被迫停止运营。新的BLA或NDA流程昂贵、耗时
且不确定。我们提交的任何BLA或NDA申请都必须有大量数据支持,包括但不限于技术、临床前、临床、制造和标签数据,以向FDA证明
产品用于其预期用途的安全性和有效性。
为了在美国开始临床试验,我们将被要求为我们的每个候选产品寻求FDA接受IND。我们不能确保我们向FDA提交的任何IND或我们在其他国家/地区提交的任何类似临床试验申请都会被接受。如果监管机构要求我们在提交IND或类似申请之前进行额外的临床前测试,以对我们的任何
候选产品进行临床评估,这可能会导致我们候选产品的开发延迟。任何此类临床前试验的结果可能不是阳性的,并且可能不支持在额外的临床试验中研究我们的任何候选产品的申请。
FDA或EMA可能出于任何一个或多个原因(包括试验设计或执行的要素、安全性问题或其他试验结果),不会认为我们正在进行或计划中的试验为未来的临床试验或上市审批申请提供了足够的支持。如果我们
无法在更大的患者组中确认或复制我们的试验结果,或者如果获得阴性结果,我们可能会
进一步推迟或阻止我们的任何候选产品进一步临床开发。
此外,FDA或EMA可能不同意我们建议的对第三方学术赞助试验生成的临床前、生产或临床数据的充分依赖,或我们对正在进行的试验中的临床前、生产或临床数据的解释。如果是,FDA或EMA可能会要求我们获取并提交额外的临床前、生产或临床数据。
从FDA和其他国家的监管机构获得批准是一个昂贵且耗时的过程,而且结果还不确定。FDA和其他机构
可以要求我们补充提交的材料、收集非临床数据、进行额外的临床试验或采取其他耗时的
行动,或者干脆拒绝我们的申请。此外,即使我们在其他国家/地区获得了BLA批准或上市前批准,
如果上市后数据显示存在安全问题或缺乏有效性,则可能会撤销批准或施加其他限制。我们
无法确切预测FDA将如何或何时采取行动。如果我们无法获得必要的监管批准,我们的财务状况和现金流可能会受到不利影响,我们在国内和国际上的增长能力可能会受到限制。此外,
即使获得批准或批准,我们的产品也可能不会被批准用于成功实现商业化或盈利最必要或最理想的特定适应症
。
我们可能会在完成临床
研究方面遇到重大延误,这将需要额外的成本,或者我们可能无法证明足够的安全性和有效性,使
适用的监管机构满意。
无法预测我们当前或未来的候选产品是否或何时会在人体上证明是安全或有效的,或者是否会获得监管部门的批准。在获得监管部门批准销售我们的候选产品之前,我们必须
进行广泛的临床研究,以证明候选产品在人体上的安全性和有效性。临床测试费用昂贵,耗时长,结果不确定。我们不能保证任何临床研究将按计划进行或如期完成(如果有的话)。一项或多项临床研究的失败可能发生在测试的任何阶段。可能妨碍成功或及时完成临床开发的事件
包括:
| |
● |
延迟或未能与足够数量的预期合同研究组织或CRO和临床研究地点就可接受的条款达成协议,这些组织和临床研究地点的条款可以进行广泛的谈判,不同的CRO和试验地点可能会有很大差异; |
| |
● |
延迟招募足够数量的合适患者参与我们的临床研究; |
| |
● |
在检查了我们的临床研究操作或研究地点后,由监管机构强制实施临床搁置; |
| |
● |
我们的CRO、其他第三方或我们未能遵守临床研究、法规或法律要求; |
| |
● |
未能按照FDA的良好临床实践或GCP或其他国家适用的监管指南进行操作; |
| |
● |
在测试、验证、制造和向临床现场交付足够数量的我们的候选产品时出现延误; |
| |
● |
延迟或未能解决试验过程中出现的任何患者安全性问题; |
| |
● |
我们的候选产品的临床试验的意外成本或成本增加; |
| |
● |
与候选产品相关的严重不良事件的发生,被认为超过了其潜在的好处;或 |
| |
● |
需要修改或提交新的临床方案的法规要求和指南的变化。 |
如果临床试验被我们、机构审查委员会(IRB)或进行此类试验的机构的道德委员会、独立的安全审查委员会(SRB)、FDA或其他监管机构暂停或终止,我们也可能遇到延迟。
此类机构可能会因多种因素而暂停或终止临床试验,包括未能根据法规要求或我们的临床方案进行临床试验。FDA或其他监管机构对临床试验操作或试验地点的检查导致实施临床暂停、不可预见的安全问题或不良反应、
未能证明使用药物的益处、政府法规或行政措施的变化或缺乏足够的
资金来继续临床试验。
任何无法成功完成临床前
和临床开发的情况都可能导致我们的额外成本,或者削弱我们从产品销售、监管
以及商业化里程碑和版税中获得收入的能力。此外,如果我们对我们的候选产品进行制造或配方更改,
我们可能需要进行额外的研究,以将我们修改后的候选产品与更早的版本连接起来。
临床研究延迟还可能缩短我们可能拥有独家权利将我们的产品和/或候选产品商业化的任何期限
,或者允许我们的竞争对手在我们之前将产品推向市场,这可能会削弱我们成功将我们的产品和/或候选产品商业化的能力。
此外,完成临床试验的任何延迟都将增加我们的成本,减缓我们的产品和/或候选产品的开发和审批流程,并危及我们开始产品销售和创造收入的能力。任何此类事件都可能严重损害我们的业务、财务状况和前景。此外,许多导致或导致临床试验开始或完成延迟的因素也可能最终导致我们的产品和/或候选产品无法获得监管部门的批准。
临床前研究和早期临床试验的结果可能不能预测后续临床试验的成功,临床试验的中期结果也不一定能预测最终结果。此外,临床前和临床数据往往容易受到各种解释和分析的影响,许多公司认为他们的产品和/或候选产品在临床前研究和临床试验中表现令人满意
但仍未能获得上市批准。如果我们的临床研究结果不确定,或者如果存在与我们的产品和/或候选产品相关的安全问题或不良事件,我们可以:
| |
● |
延迟获得我们的产品和/或候选产品的上市批准(如果获得批准); |
| |
● |
获得批准的适应症或患者群体并不像预期或期望的那样广泛; |
| |
● |
获得包括重大使用或分销限制或安全警告在内的标签的批准; |
| |
● |
被要求进行额外的临床研究以支持批准或接受额外的上市后测试要求; |
| |
● |
让监管当局撤回对一种产品的批准或以修改后的风险评估和缓解战略的形式对其分销施加限制; |
此外,我们的产品和/或候选产品
可能会导致其他尚未预测的不良事件。将患病患者纳入我们的临床研究可能会因此类患者可能使用的其他疗法或药物而导致死亡或其他不良医疗事件。如上所述,
任何此类事件都可能阻止我们实现或保持市场对我们的产品和/或候选产品的接受程度,并削弱我们将产品商业化的能力。
在一个司法管辖区获得并保持对我们的产品或候选产品的监管批准,并不意味着我们将在其他司法管辖区成功获得监管批准。
在一个司法管辖区获得并保持对我们的产品或候选产品的监管批准
并不能保证我们将能够在任何其他司法管辖区获得或保持监管批准
,而在一个司法管辖区未能或延迟获得监管批准可能会对其他司法管辖区的监管审批流程产生负面影响。例如,即使FDA批准药品上市,外国司法管辖区的类似监管机构也必须批准该产品在这些国家/地区的制造、营销和推广。
审批程序因司法管辖区而异,可能涉及不同于美国的要求和行政审查期限,包括额外的临床前研究或临床试验,因为在一个司法管辖区进行的临床研究可能不会被其他司法管辖区的监管机构接受。在美国以外的许多司法管辖区,产品必须获得报销批准,然后才能在该司法管辖区获得销售批准。在某些情况下,我们打算为我们的产品收取的价格
也需要审批。
我们还可能在其他
国家/地区提交营销申请。美国以外司法管辖区的监管机构对药品或诊断产品的审批有要求,我们在这些司法管辖区上市前必须遵守这些要求。获得外国监管批准并遵守
外国监管要求可能会给我们带来重大延误、困难和成本,并可能推迟或阻止我们的产品在某些国家/地区的推出
。如果我们不遵守国际市场的监管要求和/或获得适用的上市批准,我们的目标市场将会减少,我们实现候选疫苗完全市场潜力的能力将受到损害
。
对我们产品的修改可能需要新的BLA批准。
一旦特定产品获得FDA批准,
我们产品的扩展用途或在新适应症中的用途可能需要额外的人体临床试验和新的监管批准,包括
额外的IND、BLA和/或NDA,以及上市前批准,然后我们才能开始临床开发,和/或在营销和销售之前。
如果FDA要求对特定用途或适应症进行新的批准,我们可能需要进行额外的临床研究,这
将需要额外的支出并损害我们的运营结果。如果产品已经被用于这些新的适应症,
我们还可能受到重大执法行动的影响。进行临床试验和获得批准可能是一个耗时的
过程,延迟获得所需的未来批准可能会对我们及时推出新产品或增强产品的能力产生不利影响,这反过来又会损害我们未来的增长。
临床试验期间对方案的修改可能会导致完成临床研究的额外延迟
,如果这些修改是给定试验中发生的情况所保证和/或要求的
.
临床试验期间对方案的每次修改都必须提交给FDA。这可能会导致在评估修改期间延迟或暂停临床试验。
此外,根据所做更改的数量和性质,FDA可能会采取这样的立场:
临床试验生成的数据不可汇集,因为在整个试验过程中没有使用相同的方案。这可能需要登记额外的
名受试者,这可能会导致临床试验的延长和FDA推迟对产品的批准。任何此类延迟都可能对我们的业务和运营结果产生重大不利影响。
不能保证我们使用修改后的方案进行的临床试验所产生的数据是否会被FDA或其他监管机构接受。
不能保证使用修改后的方案生成的数据
是否会被FDA或其他监管机构接受,也不能保证如果在试验期间需要进一步修改,FDA或其他监管机构是否会接受任何此类修改。如果FDA或其他监管机构认为特定的修改需要事先批准,他们可以推迟或停止临床试验,同时
评估有关更改的其他信息。
在当前或未来的临床试验中,由于我们的候选产品失败而导致的严重伤害或死亡
还可能导致FDA或其他监管机构推迟我们的临床试验,或者拒绝或推迟对产品的批准。
即使不良事件可能不是我们候选产品失败的结果,FDA或其他监管机构也可以在审查不良事件期间无限期推迟或暂停临床试验
,如果发生多个此类事件,也可能会这样做。
由于上述风险而导致的当前或未来临床试验的任何延迟或终止,包括在获得或保持FDA或其他监管机构所需的批准方面的延迟、患者登记的延迟、患者未能继续参与临床试验、
以及由于试验过程中的方案修改或不良事件而导致的临床试验的延迟或终止,都可能导致成本增加和向FDA或其他监管机构提交任何产品的延迟,延迟我们产品的批准和商业化
或导致临床试验失败。这可能会对我们的业务、经营业绩和前景产生不利影响。
对于我们的候选产品,我们将取决于我们的
临床试验中患者的登记和保留情况。如果我们在临床试验中招募或留住患者时遇到延误或困难,
我们的研发工作以及业务、财务状况和运营结果可能会受到重大不利影响。
成功并及时完成临床试验将要求我们招收并保留足够数量的患者候选人。我们进行的任何临床试验都可能因各种原因而延迟
,包括患者登记时间比预期更长、患者退出或不良事件。
这些类型的发展可能会导致我们推迟试验或停止进一步的开发。
我们的临床试验将与与我们的候选产品在相同治疗领域的其他临床试验
竞争,而这一竞争减少了我们可用的患者数量和类型,因为一些可能选择参加我们的试验的患者可能会转而选择参加由我们的竞争对手之一进行的试验。此外,将患者纳入有经批准的护理标准的疾病的临床试验是具有挑战性的,因为患者将首先接受适用的护理标准。许多对护理标准反应积极的患者没有参加临床试验。这可能会限制能够登记参加我们的临床试验的符合条件的患者数量,这些患者有可能从我们的候选产品中受益,并可能延长开发时间表或增加这些计划的成本。未能对护理治疗标准做出积极反应的患者将有资格进行未经批准的候选药物的临床试验。然而,这些之前的治疗方案可能会使我们的疗法在临床试验中效果不佳。
由于合格的临床研究人员和临床试验地点的数量有限,我们预计我们的一些临床试验将在我们的一些竞争对手使用的相同临床试验地点进行,这将减少可供我们在这些临床试验地点进行临床试验的患者数量。
患者入选取决于许多因素,包括:
| |
● |
招聘具有适当能力和经验的临床试验研究人员的能力; |
|
● |
参加临床试验的患者在我们的产品候选药物或试验完成前退出试验的风险; |
| |
● |
根据临床试验正在调查的适应症批准的新药的供应情况;以及 |
| |
● |
临床医生和患者对正在研究的药物相对于其他现有疗法的潜在优势的看法。 |
这些因素可能会使我们很难招募足够多的患者来及时且经济高效地完成我们的临床试验。延迟完成我们候选产品的任何临床试验将增加我们的成本,减慢我们候选产品的开发和审批流程,并且延迟或
可能危及我们开始产品销售和创造收入的能力。此外,一些导致或导致临床试验延迟开始或完成的因素也可能最终导致我们的
候选产品被拒绝监管批准。
进行成功的临床研究可能需要登记大量的患者,而合适的患者可能很难识别和招募。
患者参加临床试验以及完成患者参与和随访取决于许多因素,包括患者群体的规模;试验方案的性质;受试者接受治疗的吸引力或与之相关的不适和风险;是否有合适的临床试验研究人员;支持人员;以及患者与临床地点的接近程度和遵守参与临床试验的资格和排除标准以及患者遵从性的能力。例如,如果试验方案要求患者接受广泛的治疗后程序或后续
以评估我们产品的安全性和有效性,或者如果他们确定根据试验方案接受的治疗
不具吸引力或涉及不可接受的风险或不适,则可能不鼓励患者参加我们的临床试验。如果患者选择
参与竞争产品的同期临床试验,也可能不参与我们的临床试验。
我们未来的临床试验结果可能不支持我们
候选产品的说法,或者可能导致发现意想不到的不良副作用。
即使我们的临床试验按计划完成,
我们也不能确定他们的结果是否支持我们的候选产品声明,或者FDA或外国当局是否会同意我们关于它们的结论。临床前研究和早期临床试验的成功并不能确保以后的临床试验也会成功,我们也不能确定以后的试验是否会复制以前的试验和临床前研究的结果。临床
试验过程可能无法证明我们的候选产品对于建议的指定用途是安全有效的。如果FDA得出结论,我们可能寻求批准的任何产品的临床试验未能证明其安全性和有效性,我们将
不会获得FDA批准,以在美国销售该产品以获得所寻求的适应症。
此外,这种结果可能会导致我们
放弃某个候选产品,并可能延迟其他候选产品的开发。我们临床试验的任何延迟或终止都将推迟向FDA提交任何产品的申请,并最终推迟我们将候选产品商业化并创造收入的能力。也有可能登记参加临床试验的患者会遇到目前不在我们产品候选资料中的不良副作用。
涉及我们产品的不良事件可能会导致FDA或其他监管机构推迟或拒绝批准我们的产品,或导致产品召回,从而损害我们的声誉、业务
和财务业绩。
此外,如果我们的任何产品和/或产品
获得上市批准,FDA可以要求我们采用风险评估和缓解策略,或REMS,而其他非美国监管机构可以施加其他特定义务作为批准条件,以确保收益大于其风险,其中可能包括概述产品分发给患者的风险的药物指南,
向医疗从业者发布的沟通计划,以及对如何或在哪里分发、分配或使用产品的限制。
此外,如果我们或其他人后来发现我们的任何产品和/或候选产品引起的不良副作用,可能会导致几个潜在的重大负面后果,包括:
| |
● |
监管部门可以暂停或撤回对此类产品候选产品的审批; |
| |
● |
监管部门可能会要求在产品标签上附加使用警告或限制; |
| |
● |
我们可能被要求改变候选产品的分配、分配或给药方式,或者进行额外的临床试验; |
| |
● |
我们可能会被起诉,并对给患者造成的伤害承担责任;以及 |
这些事件中的任何一种都可能阻止我们实现或保持市场对我们的产品和/或候选产品的接受度,并可能严重损害我们的业务、前景、财务状况和运营结果。
一旦产品获得FDA批准,该机构
有权要求在设计或制造中出现不良副作用、材料缺陷或缺陷的情况下召回商业化产品。要求召回的权力必须基于FDA发现该产品有合理的可能性会导致严重伤害或死亡。如果在产品中发现任何实质性缺陷,制造商可以主动召回产品。由于不良副作用、杂质或其他产品污染、制造错误、设计或标签缺陷或其他缺陷和问题,我们或我们的某个分销商可能会发生政府强制或自愿召回。
召回我们的任何产品都会转移管理和财务资源,并对我们的财务状况和
运营结果产生不利影响。FDA要求某些类别的召回在召回开始后十个工作日内向FDA报告
。公司被要求保留某些召回记录,即使这些召回不需要向FDA报告。我们可能会在未来启动涉及我们产品的
自愿召回。未来的召回声明可能会损害我们在客户中的声誉,并对我们的销售产生负面影响。此外,FDA和/或其他监管机构可以采取执法行动,因为召回在进行时没有报告
。
即使我们的产品获得监管部门的批准,这些产品
也可能无法获得监管机构、顾问委员会、医生、患者、第三方付款人和医学界其他人的认可。
即使我们的任何产品获得市场
批准,它们也可能无法收到监管机构的使用建议,也无法获得医生、患者、第三方付款人和医学界其他人的市场认可。如果此类产品没有达到足够的接受度,我们可能不会产生显著的产品收入,也可能无法盈利。任何产品如果被批准用于商业销售,其市场接受度将取决于许多因素,包括但不限于:
| |
● |
接受理事/咨询机构的使用建议,以及类似的外国监管和咨询机构的建议; |
| |
● |
我们的产品被批准的疾病指标的流行率和严重程度; |
| |
● |
医生、医院、第三方付款人和患者认为我们的产品安全有效; |
| |
● |
我们的产品相对于现有产品的潜在和公认的优势,包括在疾病治疗方面; |
| |
● |
FDA或类似的外国监管和咨询机构的产品标签或产品插入要求; |
|
● |
FDA或类似的外国监管和咨询机构批准的标签中包含的限制或警告; |
| |
● |
包括政府当局在内的第三方付款人提供保险以及适当的补偿和定价; |
|
● |
在包括政府当局在内的第三方付款人没有承保和适当补偿的情况下,患者愿意自付费用; |
| |
● |
相对方便和易于管理,包括与竞争产品和替代疗法相比;以及 |
如果我们的候选产品获得批准,但未能
收到美国或其他国家/地区的管理或咨询机构的建议,或在医生、医疗保健提供者、患者、第三方付款人或医疗界其他人中获得市场认可
,我们将无法产生显著的收入。即使我们的产品获得市场认可,但如果推出了比我们的产品更受欢迎、更具成本效益或使我们的
产品过时的新产品或技术,随着时间的推移,我们可能无法保持市场接受度。
即使我们能够将我们的产品和/或候选产品
商业化,此类产品也可能会受到不利的定价法规、第三方报销做法或医疗改革
举措的影响,这将损害我们的业务。
管理新药上市审批、定价、覆盖范围和报销的法规因国家/地区而异。在美国,新的和未来的立法
可能会显著更改审批要求,这可能会涉及额外的成本并导致审批延迟。
某些国家/地区要求在药品上市前批准其销售价格。在许多国家/地区,定价审查期在获得营销或产品许可批准后开始。在一些国外市场,处方药定价仍然受到政府的持续控制,即使在初步批准上市后也是如此。因此,我们可能会在特定国家/地区获得产品的营销批准,但随后会受到价格法规的约束,这些法规会推迟其商业发布时间,可能会延迟较长时间
,并对我们在该国家/地区销售该产品所能产生的收入产生负面影响。不利的定价限制
可能会阻碍我们将产品和/或候选产品商业化并从中获得收入的能力,即使我们的产品和/或候选产品获得了市场批准。
我们能否成功地将我们当前和任何
未来的产品和/或候选产品商业化,还将在一定程度上取决于政府健康计划、私人健康保险公司、综合交付网络和其他第三方付款人为这些产品和相关治疗提供的保险范围和足够的报销
。第三方付款人决定他们将为哪些产品付款并建立报销水平。
美国医疗保健行业和其他地方的一个重要趋势是成本控制。政府当局和第三方付款人
试图通过限制特定产品的覆盖范围和付款金额来控制成本。越来越多的第三方付款人
要求制药公司在标价的基础上提供预先确定的折扣,并对医疗产品的定价提出质疑。我们商业化的任何产品可能都不提供保险和报销,如果可以报销,则报销水平可能不足以取得商业成功。承保范围和报销可能会影响我们获得市场批准的任何候选产品的需求或价格。如果无法获得保险和报销,或仅限量提供
,我们可能无法成功将我们获得营销批准的任何候选产品商业化。
对于新批准的产品,在获得保险和充分报销方面可能会有重大延误
,而且保险范围可能比FDA或美国以外类似监管机构批准该产品的目的更有限。此外,有资格获得保险和报销并不意味着在所有情况下都会为任何产品付款,或以覆盖我们成本的费率付款,包括研发、制造、销售和分销。如果适用,新药的临时报销水平也可能不足以支付我们的成本,并且可能不会成为永久性的。承保范围和报销费率可能会因药物的使用和所用药物的医疗情况而异,可能基于已为低成本产品或程序设定的报销水平,也可能纳入其他服务的现有
付款中。通过政府医疗保健计划或私人付款人要求的强制性折扣或回扣,以及未来任何放宽目前限制从药品以低于美国价格销售的国家/地区进口药品的法律,可以降低药品的净价。
商业第三方付款人在设置自己的报销政策时通常依赖于联邦医疗保险覆盖政策和支付限制
。我们无法迅速从政府资助的计划和私人付款人为我们开发的任何经批准的产品获得承保范围和有利可图的付款率,这可能会对我们的经营业绩、我们
筹集将我们的经批准的产品商业化所需的资金的能力以及我们的整体财务状况产生实质性的不利影响。
我们获得市场批准的任何候选产品都可能受到市场限制或退出市场,如果我们未能遵守监管要求或产品遇到意想不到的问题,可能会受到处罚。
我们获得市场批准的任何产品候选产品,以及该产品的制造流程和设施、批准后的临床数据、标签、广告和促销活动,都将受到FDA和其他监管机构的持续要求和审查。这些要求包括提交宣传材料和安全及其他上市后信息和报告,
注册和上市要求,产品设施的现行良好制造规范(“cGMP”)要求,
记录和文件的质量保证和相应维护,以及关于向医生分发样本和相关记录的要求
。即使批准了候选产品的上市,批准也可能受到
该产品可能上市的指定用途的限制,或受批准条件或包含昂贵的上市后测试和监控要求的限制
以监控该药物的安全性或有效性。FDA对药品的审批后营销和促销进行严格监管,以确保药品仅针对批准的适应症销售,并符合批准的标签的规定。然而,公司可能会分享与FDA批准的产品标签一致的真实且不具误导性的信息。FDA对制造商关于非标签使用的沟通施加了严格的限制,如果我们
不遵守这些限制,我们可能会受到执法行动的影响。
此外,如果后来发现我们的产品、制造商或制造工艺和设施存在以前未知的问题,或未能遵守监管要求,
可能会导致:
| |
● |
要求进行批准后的临床试验、其他研究或其他批准后的承诺; |
| |
● |
拒绝批准我们提交的待决申请或已批准申请的补充申请; |
未能在外国司法管辖区获得监管批准
将使我们无法在国际上销售我们的产品。
我们打算将未来的产品推向国际市场。为了在欧洲经济区(EEA)、亚太地区(APAC)和许多其他外国司法管辖区销售我们未来的产品,我们必须获得单独的监管批准。
例如,在EEA中,医药产品只有在获得营销授权(MA)后才能
商业化。在授予MA之前,欧洲药品管理局或欧洲药品管理局成员国的主管当局根据有关产品质量、安全性和有效性的科学标准对产品的风险-效益平衡进行评估。在日本,保健、劳动和福利部(MHLW)的药品和医疗器械厅(PMDA)必须根据《药学事务法》批准申请,然后新药才能在日本上市。
我们与外国
监管机构的互动有限。批准程序因国家而异,可能涉及额外的临床试验,获得批准所需的时间可能与获得FDA批准所需的时间不同。此外,在一个国家进行的临床研究可能不被其他国家的监管机构
接受。FDA的批准并不能确保获得其他
国家监管机构的批准,一个或多个外国监管机构的批准并不能确保获得其他外国
国家监管机构或FDA的批准。但是,在一个国家/地区未能或延迟获得监管批准可能会对其他国家/地区的
监管流程产生负面影响。外国监管批准过程可能包括与获得FDA批准相关的所有风险。
我们可能无法及时获得外国监管机构的批准(如果有的话)。我们可能无法申请监管部门的批准,
即使我们提交了申请,我们也可能无法获得在任何市场上将我们的产品商业化所需的批准。
立法机构(如《通货膨胀降低法案》
)可能会影响我们营销和商业化当前或未来批准产品的能力,并降低我们从此类资产中获得的盈利能力。
立法机构,无论是在美国还是在外国,都可能影响我们营销和商业化当前批准的产品或未来批准的任何产品的能力
,并可能降低我们从此类资产中的盈利能力。例如,《降低通货膨胀法案》(IRA)于2022年在美国签署成为法律,旨在降低与药品相关的自付成本。爱尔兰共和军的主要影响包括:
| ● | 联邦医疗保险现在可以直接与制药商谈判降低处方药价格; |
| ● | 医疗保险受益人的胰岛素费用
现在上限为35美元; |
| ● |
如果药品公司的产品涨价速度快于通货膨胀率,则需要支付回扣。 |
如果
我们决定在批准后提高药品价格,并将其提高到高于通货膨胀率的水平,我们可能会
面临欠联邦医疗保险的退款。这可能会影响我们产品的盈利能力,并减少与之相关的收入。
我们预计ENTADFI和Proclarix将依赖第三方制造商
。
在可预见的
未来,我们预计并确实依赖第三方制造商和其他第三方来生产、包装和储存足够数量的ENTADFI和Proclarix以满足需求。ENTADFI和Proclarix的制造复杂且昂贵。如果我们的
第三方制造商未能以足够的质量及时交付ENTADFI或Proclarix用于商业销售,并且
未能以商业合理的价格交付ENTADFI或Proclarix,我们可能会被要求推迟或暂停ENTADFI和
Proclix的商业销售和/或生产。虽然我们可能能够确定替代第三方制造商或为ENTADFI和Proclarix开发我们自己的制造能力,但这一过程可能会导致ENTADFI和/或Proclarix的供应延迟,并增加
成本。此外,第三方制造商生产ENTADFI和Proclarix的工厂可能数量有限,如果这些工厂因设备故障或故障或自然灾害损坏等事件而中断运营,可能会导致发货取消、制造过程中的产品损失或
ENTADFI和Proclarix短缺。
此外,监管要求可能会对ENTADFI和Proclarix的生产构成
障碍。第三方制造商必须遵守FDA针对ENTADFI的cGMP。因此,任何ENTADFI制造商使用的设施必须保持FDA可接受的合规状态。NDA或其他形式的FDA批准或许可的持有者,或以自己的名义分销受监管产品的持有者,应负责
制造,即使制造是由第三方合同制造组织(CMO)进行的。
我们的第三方制造商将被要求根据FDA的cGMP生产ENTADFI,以达到可接受的标准。我们的第三方
制造商可能无法履行其与我们达成的协议规定的义务,或者可能在我们要求的时间
将候选药物商业化之前停止业务。此外,我们的制造商将接受FDA和相应的州和外国机构持续的定期突击检查,以确保符合cGMP和类似的法规要求。如果我们的任何制造商未能遵守适用的cGMP,可能会导致对我们施加制裁,包括罚款、禁令、民事处罚、延迟、暂停或撤回审批、运营限制、供应中断、召回、撤回、发布安全警报和刑事起诉,其中任何一项都可能对我们的业务、财务状况、运营结果和前景产生重大不利影响。最后,如果我们的CMO比ENTADFI或Proclarix更重视
其他产品的供应,或者没有根据与我们达成的协议条款令人满意,我们也可能遇到制造延迟。
如果ENTADFI
或Proclarix的任何供应商在其制造过程中遇到任何重大困难,不遵守我们之间的协议条款,或者没有投入足够的时间、精力和精力来满足我们的制造需求,我们可能会遇到ENTADFI和/或Proclarix的供应严重中断
,这可能会削弱我们以商业化所需的水平供应ENTADFI和/或Proclarix的能力,并阻止或推迟其成功的开发和商业化。
中断或显著增加与ENTADFI和/或Proclarix的运输和其他分销渠道相关的成本
可能会对我们的利润率和
盈利能力造成不利影响。
我们预计将依靠第三方物流公司不间断且高效的运营来运输和交付ENTADFI和Proclarix。这些第三方物流公司可能会
遇到用于分销我们产品的运输渠道中断,包括机场和航运港口拥堵
增加、运输能力不足、燃料费用增加以及人力或资金短缺或其他业务中断造成的中断。我们的第三方物流公司遇到的运输渠道中断可能会导致成本增加,包括额外使用空运来满足需求。中断此业务模式或我们与第三方的关系
,例如,如果业绩达不到我们的预期,可能会损害我们的业务。
我们可能会失败或选择不将我们的产品商业化。
我们可能无法成功地将我们的产品商业化。在我们产品的任何潜在商业营销努力中,我们或我们的协作合作伙伴可能无法成功
实现患者或医生对本产品的广泛认知或接受。此外,我们可能会受到竞争性产品的定价压力,或者来自政府或商业付款人或监管机构的定价压力,这可能会使我们的产品难以或不可能商业化
。如果我们的产品不能商业化,可能会对我们未来的收入和业务产生实质性的不利影响。
如果我们不能将我们的产品商业化,我们的业务、财务状况、运营结果和前景可能会受到实质性的不利影响,我们在行业和投资界的声誉可能会受到损害。
我们的产品可能无法获得并保持市场认可度。
医生可能不会给我们的产品开处方,这会阻止我们的产品产生收入。医生、患者和付款人对我们产品的市场接受度将取决于许多因素,其中许多因素是我们无法控制的,包括以下因素:
| |
● |
我们的产品获得批准的临床适应症(如果有的话); |
| |
|
|
| |
● |
医生和付款人接受我们的产品作为安全有效的治疗或测试; |
| |
|
|
| |
● |
与替代治疗或检测有关的费用; |
| |
|
|
| |
● |
我们产品在预期条件下的相对便利性和易管理性; |
| |
|
|
| |
● |
竞争性药物或试验的可获得性和有效性; |
| |
|
|
| |
● |
我们的销售和营销努力的有效性; |
| |
|
|
| |
● |
我们的产品在多大程度上被批准纳入医院和管理型护理机构的处方中; |
| |
|
|
| |
● |
第三方,如保险公司和其他医疗保健付款人,或政府医疗保健计划,包括联邦医疗保险和医疗补助,提供保险和足够的补偿; |
| |
|
|
| |
● |
产品的FDA或其他适用监管机构批准的标签中包含的限制或警告;以及 |
| |
|
|
| |
● |
不良反应的发生率和严重程度。 |
即使医学界
接受我们的产品对于其批准的适应症是安全有效的,医生也可能不会立即接受使用
,或者可能会很慢地采用此类产品作为针对其预期条件的接受治疗或测试。如果没有面对面的比较数据,我们也将无法宣传我们的产品优于竞争产品。如果我们的产品没有达到医生和付款人接受的足够水平,我们可能不会从该产品中产生足够的收入或任何收入。此外,我们教育医疗界和第三方付款人了解我们产品的好处的努力可能需要大量资源,
可能永远不会成功。
此外,即使我们的
产品获得市场认可,在以下情况下,我们也可能无法随着时间的推移保持市场认可:
| |
● |
引入比我们的产品更受欢迎、更具成本效益或使我们的产品过时的新产品或技术; |
| |
|
|
| |
● |
使用我们的产品或产品时会出现不可预见的并发症 |
| |
|
|
| |
● |
没有足够的第三方保险覆盖范围或补偿。 |
ENTADFI面临着来自其他BPH药物和拥有比我们多得多的资源的更大、更成熟的公司的竞争。
我们在竞争激烈的行业(包括制药业)从事产品营销。制药行业也以广泛的研究和快速的技术进步为特征。ENTADFI在北美、欧洲和其他地区的潜在竞争对手包括大型制药公司、专业制药公司和生物技术公司、大学和其他研究机构
以及政府机构。我们的许多竞争对手比我们拥有更多的研发和监管能力和
经验,以及更多的管理、制造、分销、营销和财务资源。我们可能无法与当前和未来的竞争对手成功竞争,竞争压力可能会对我们的
净收入和利润率产生负面影响。
其他各方已经开发并销售了治疗BPH的药物,这些药物已被医生、患者和付款人社区接受。其中许多其他产品也达到了现在是仿制药的地步,这意味着它们以非常低的价格出售,而ENTADFI可能
无法满足这个价格,这可能会限制ENTADFI进入医生、患者和付款人社区,包括政府付款人。
我们可能无法成功实施我们的战略,即增加ENTADFI在美国市场的销售和Proclarix在欧洲市场的销售,如果获得授权,也可以在任何外国市场销售。
我们可能无法通过与远程医疗或其他合作伙伴或商业诊断提供商合作或通过我们自己的商业化努力来扩大ENTADFI或Proclarix的销售
。我们可能无法向私人和政府付款人索要ENTADFI或Proclarix的价格,这将证明我们投入大量资源试图增加ENTADFI或Proclarix的销售额是合理的。我们可能无法在一个高度仿制药的成熟BPH市场或竞争激烈的前列腺癌诊断市场中高效或有效地竞争。如果ENTADFI或Proclarix的销售额未能增长,将对我们的收入和未来计划产生负面影响。
未经审计的备考合并财务信息
交易摘要
2023年12月15日,位于特拉华州的Blue Water Biotech,Inc.(“Onconentix”)公司签订了一份股份交换协议(“股份交换协议”),该协议由(I)Onconentix,(Ii)Proteomedex AG,一家瑞士公司(“Proteomedex”),
(Iii)Proteomedex的已发行股本或可转换证券的每个持有人(Proteomedex股票期权除外)
(统称为“卖方”)和(Iv)Thomas Meier签订。根据股份交换协议的条款及条件,作为卖方代表(“卖方代表”)。
根据《股份交换协议》,在该协议所载条款及条件的规限下,卖方同意将Proteomedex的所有已发行及已发行权益(“已购买股份”)出售予Onconentix,而Onconentix则同意购买。以面值每股0.00001美元的新发行普通股(“普通股”)及新发行的Onconentix优先股(“B系列优先股”)为交换对象。如下文所述
(“股份交换”及股份交换协议预期的其他交易,“交易”)。
联交所的完成(“成交”)须受惯常成交条件及与投资者(“PMX投资者”)订立的认购
协议(定义见下文)的签署所规限。联交所于2023年12月15日(“收市日期”)收市。
于已购股份的缴足股款中,Onconentix发行股份(“交换股份”)包括:(I)3,675,414股普通股
,相当于交易结束前已发行及已发行普通股总数的19.99%;及(Ii)2,696,729股B系列优先股,可转换为269,672,900股普通股。
购买Proteomedex股份的每一份购股权(每一份,即“Proteomedex股票期权”)在紧接成交前尚未行使,不论是否归属,
除非根据其条款另行终止,否则在转换前仍未行使。于转换时,每项尚未行使的
Proteomedex购股权,不论是否归属,均须由Onconentix承担,并转换为有权收取(A)收购普通股股份的认购权(各为“假设认购权”)或(B)Onconentix与Proteomedex
可能同意的其他衍生证券,但在任何一种情况下,均须受紧接收市前适用于该Proteomedex购股权的实质相同的条款及条件所规限。每项已认购购股权应:(I)代表取得若干普通股的权利,相等于(A)在紧接收市前受相应Proteomedex购股权规限的Proteomedex普通股数目乘以(B)交换比率的乘积
;及(Ii)行使价(向下舍入至最接近的整数仙)等于(A)相应公司购股权的行使价除以(B)交换比率的商
。
关于该等交易,于2023年12月15日,Onconentix与PMX Investor订立认购协议(“认购协议”),以私募5,000,000美元的单位(“该等单位”),每个单位包括(I)一股普通股及(Ii)一股预先出资的认股权证(统称为“认股权证”),以每股0.001美元的行使价购买0.3股普通股,每单位的总购买价为0.25美元(“收购价”)。额外股份可向PMX投资者发行,前提是PMX投资者继续持有该等单位所包括的普通股,且如在成交后270天内的VWAP低于认购协议所载的收购价。安踏尚未就(S)所需的调整(如有)订立协议,以在其综合财务报表中反映认购协议。因此,随附的备考信息不包括可能需要进行的与认购协议相关的任何调整。
在股东批准发行转换股份后,此次发行预计将完成
。在交易完成后30天内,安康将根据认购协议和认股权证向美国证券交易委员会提交转售登记声明,登记可发行普通股的转售。
形式信息
以下未经审核的备考综合财务报表以本公司经审核及未经审核的中期历史综合财务报表及Proteomedex的经审核及未经审核的中期财务报表为基础,并经调整以落实本公司对Proteomedex的收购。截至2023年9月30日的未经审计备考综合资产负债表使这些交易生效,就像它们发生在2023年9月30日一样。截至2022年12月31日的12个月和截至2023年9月30日的9个月的未经审计的备考综合经营报表将这些交易视为发生在2022年1月1日。
未经审计的备考综合财务报表应与公司的已审计历史财务报表一并阅读,这些财务报表包括公司于2023年3月9日提交给美国证券交易委员会的最新10-K表格年度报告和于2023年11月17日提交给美国证券交易委员会的最新10-Q表格季度报告,以及Proteomedex截至2022年和2021年12月31日及截至2021年12月31日的已审计历史财务报表和截至2023年9月30日期间的未经审计简明财务报表。
未经审计的备考综合财务信息仅供参考,并不代表或表明如果Proteomedex交易在指定日期完成,本公司将报告的综合经营业绩或财务状况,不应被视为代表我们未来的综合经营业绩或财务状况。
与协议有关的备考调整
在未经审计的备考综合财务信息附注中说明,主要包括以下内容:
| - | 预计调整,以消除合并完成时转换的Proteomedex负债 |
| - | 备考调整以记录本公司与Proteomedex的合并 |
随附的未经审核备考综合财务报表所反映的公允价值调整及其他估计,可能与合并后综合公司综合财务报表所反映的调整大不相同。此外,未经审计的备考合并财务报表并不旨在预测合并公司未来的财务状况或经营业绩。
这些未经审核的备考合并财务报表不会产生任何预期的协同效应、运营效率或可能与协议相关的成本节约
。这些财务报表也不包括作为公司业务合并的一部分,公司可能因交易而产生的任何整合成本。
ONCONETIX,Inc.
形式上的合并资产负债表
截至2023年9月30日
| | |
Onconetix,Inc. | | |
Proteomedex AG | | |
事务处理调整 | | |
备注 | | |
形式上
已整合 | |
| 资产 | |
| | |
| | |
| | |
| | |
| |
| 流动资产 | |
| | |
| | |
| | |
| | |
| |
| 现金 | |
$ | 7,653,975 | | |
$ | 1,037,425 | | |
$ | - | | |
| | | |
$ | 8,691,400 | |
| 应收账款 | |
| - | | |
| 116,374 | | |
| - | | |
| | | |
| 116,374 | |
| 盘存 | |
| 1,419,272 | | |
| 83,183 | | |
| - | | |
| | | |
| 1,502,455 | |
| 预付费用和其他流动资产 | |
| 467,738 | | |
| 7,304 | | |
| - | | |
| | | |
| 475,042 | |
| 流动资产总额 | |
| 9,540,985 | | |
| 1,244,286 | | |
| - | | |
| | | |
| 10,785,271 | |
| | |
| | | |
| | | |
| | | |
| | | |
| | |
| 预付费用,长期 | |
| 55,499 | | |
| - | | |
| - | | |
| | | |
| 55,499 | |
| 使用权资产 | |
| - | | |
| 140,588 | | |
| - | | |
| | | |
| 140,588 | |
| 财产和设备,净额 | |
| 12,503 | | |
| 39,163 | | |
| - | | |
| | | |
| 51,666 | |
| 递延发售成本 | |
| 366,113 | | |
| - | | |
| - | | |
| | | |
| 366,113 | |
| 商誉 | |
| - | | |
| - | | |
| 12,096,903 | | |
| 4b、4d | | |
| 12,096,903 | |
| 无形资产 | |
| 17,906,771 | | |
| - | | |
| 55,125,000 | | |
| 4b | | |
| 73,031,771 | |
| 总资产 | |
$ | 27,881,871 | | |
$ | 1,424,037 | | |
$ | 67,221,903 | | |
| | | |
$ | 96,527,811 | |
| | |
| | | |
| | | |
| | | |
| | | |
| | |
| 负债和股东权益 | |
| | | |
| | | |
| | | |
| | | |
| | |
| 流动负债 | |
| | | |
| | | |
| | | |
| | | |
| | |
| 应付帐款 | |
$ | 3,176,332 | | |
$ | - | | |
$ | - | | |
| | | |
$ | 3,176,332 | |
| 应计费用和递延收入 | |
| 1,538,544 | | |
| 230,329 | | |
| 582,764 | | |
| 4C、4E | | |
| 2,351,637 | |
| 可转换应付票据 | |
| - | | |
| 5,704,371 | | |
| (5,704,371 | ) | |
| 4c | | |
| - | |
| 应付票据 | |
| 12,920,093 | | |
| - | | |
| - | | |
| | | |
| 12,920,093 | |
| 租赁负债,流动 | |
| - | | |
| 62,464 | | |
| - | | |
| | | |
| 62,464 | |
| 或有认股权证负债 | |
| 10,461 | | |
| - | | |
| - | | |
| | | |
| 10,461 | |
| 流动负债总额 | |
| 17,645,430 | | |
| 5,997,164 | | |
| (5,121,607 | ) | |
| | | |
| 18,520,987 | |
| | |
| | | |
| | | |
| | | |
| | | |
| | |
| 应付票据 | |
| - | | |
| 109,251 | | |
| - | | |
| | | |
| 109,251.00 | |
| 养老金福利义务 | |
| | | |
| 546,259 | | |
| - | | |
| | | |
| 546,259.00 | |
| 经营租赁负债 | |
| - | | |
| 78,124 | | |
| - | | |
| | | |
| 78,124 | |
| 总负债 | |
$ | 17,645,430 | | |
$ | 6,730,798 | | |
$ | (5,121,607 | ) | |
| | | |
$ | 19,254,621 | |
| | |
| | | |
| | | |
| | | |
| | | |
| | |
| 临时股东权益 | |
| | | |
| | | |
| | | |
| | | |
| | |
| | |
| | | |
| | | |
| | | |
| | | |
| | |
| B系列可赎回优先股 | |
| - | | |
| - | | |
| 61,356,274 | | |
| 4a | | |
| 61,356,274 | |
| | |
| | | |
| | | |
| | | |
| | | |
| | |
| 股东权益 | |
| | | |
| | | |
| | | |
| | | |
| | |
| 优先股 | |
| - | | |
| - | | |
| - | | |
| | | |
| - | |
| 普通股 | |
| 183 | | |
| 466,555 | | |
| (466,518 | ) | |
| 4a、4c、4d | | |
| 220 | |
| 追加实收资本 | |
| 45,297,371 | | |
| 20,539,478 | | |
| (19,430,696 | ) | |
| 4a、4c、4d | | |
| 46,406,153 | |
| 库存股,按成本计算 | |
| (625,791 | ) | |
| - | | |
| - | | |
| | | |
| (625,791 | ) |
| 累计综合收益(亏损) | |
| - | | |
| 610,627 | | |
| (610,627 | ) | |
| 4d | | |
| - | |
| 累计赤字 | |
| (34,435,322 | ) | |
| (26,923,421 | ) | |
| 26,142,119 | | |
| 4D、4E | | |
| (35,216,624 | ) |
| Onconentix,Inc.的总股东权益。 | |
| 10,236,441 | | |
| (5,306,761 | ) | |
| 5,634,278 | | |
| | | |
| 10,563,958 | |
| | |
| | | |
| | | |
| | | |
| | | |
| | |
| 附属公司的非控股权益 | |
| - | | |
| - | | |
| 5,352,958 | | |
| | | |
| 5,352,958 | |
| | |
| | | |
| | | |
| | | |
| | | |
| | |
| 股东权益总额 | |
| 10,236,441 | | |
| (5,306,761 | ) | |
| 10,987,236 | | |
| | | |
| 15,916,916 | |
| | |
| | | |
| | | |
| | | |
| | | |
| | |
| 总负债、临时股东权益和股东权益 | |
$ | 27,881,871 | | |
$ | 1,424,037 | | |
$ | 67,221,903 | | |
| | | |
$ | 96,527,811 | |
ONCONETIX,Inc.
备考综合全面损失表
截至2023年9月30日的9个月
| | |
Onconetix,Inc. | | |
Proteomedex AG | | |
事务处理
调整 | | |
备注 | | |
形式上
合并 | |
| | |
| | |
| | |
| | |
| | |
| |
| 收入 | |
$ | - | | |
$ | 2,092,761 | | |
$ | - | | |
| | | |
$ | 2,092,761 | |
| | |
| | | |
| | | |
| | | |
| | | |
| | |
| 销货成本 | |
| - | | |
| 22,548 | | |
| - | | |
| | | |
| 22,548 | |
| | |
| | | |
| | | |
| | | |
| | | |
| | |
| 毛利 | |
| - | | |
| 2,070,213 | | |
| - | | |
| | | |
| 2,070,213 | |
| | |
| | | |
| | | |
| | | |
| | | |
| | |
| 运营费用 | |
| | | |
| | | |
| | | |
| | | |
| | |
| 销售、一般和行政 | |
| 8,337,615 | | |
| 1,392,353 | | |
| - | | |
| | | |
| 9,729,968 | |
| 研发 | |
| 2,148,327 | | |
| 275,020 | | |
| - | | |
| | | |
| 2,423,347 | |
| 折旧及摊销 | |
| - | | |
| 9,293 | | |
| 2,800,081 | | |
| 4b | | |
| 2,809,374 | |
| 资产购买协议保证金减值 | |
| 3,500,000 | | |
| - | | |
| - | | |
| | | |
| 3,500,000 | |
| 总运营费用 | |
| 13,985,942 | | |
| 1,676,666 | | |
| 2,800,081 | | |
| | | |
| 18,462,689 | |
| 营业收入(亏损) | |
| (13,985,942 | ) | |
| 393,547 | | |
| (2,800,081 | ) | |
| | | |
| (16,392,476 | ) |
| | |
| | | |
| | | |
| | | |
| | | |
| | |
| 其他收入(费用) | |
| | | |
| | | |
| | | |
| | | |
| | |
| 应付票据灭失损失 | |
| (490,000 | ) | |
| - | | |
| - | | |
| | | |
| (490,000 | ) |
| 利息支出 | |
| (483,093 | ) | |
| (74,359 | ) | |
| 74,359 | | |
| 4c | | |
| (483,093 | ) |
| 或有认股权证负债的公允价值变动 | |
| (99,787 | ) | |
| - | | |
| - | | |
| | | |
| (99,787 | ) |
| 其他收入(费用)合计 | |
| (1,072,880 | ) | |
| (74,359 | ) | |
| 74,359 | | |
| | | |
| (1,072,880 | ) |
| | |
| | | |
| | | |
| | | |
| | | |
| | |
| 净亏损 | |
| (15,058,822 | ) | |
| 319,188 | | |
| (2,725,722 | ) | |
| | | |
| (17,465,356 | ) |
| | |
| | | |
| | | |
| | | |
| | | |
| | |
| 累计优先股股息 | |
| - | | |
| - | | |
| - | | |
| | | |
| - | |
| | |
| | | |
| | | |
| | | |
| | | |
| | |
| 适用于普通股股东的净亏损 | |
| (15,058,822 | ) | |
| 319,188 | | |
| (2,725,722 | ) | |
| | | |
| (17,465,356 | ) |
| | |
| | | |
| | | |
| | | |
| | | |
| | |
| 外币折算调整 | |
| - | | |
| 172,351 | | |
| - | | |
| | | |
| 172,351 | |
| | |
| | | |
| | | |
| | | |
| | | |
| | |
| 养恤金福利义务的变化 | |
| - | | |
| (168,307 | ) | |
| - | | |
| | | |
| (168,307 | ) |
| | |
| | | |
| | | |
| | | |
| | | |
| | |
| 其他综合(亏损)收入合计 | |
| - | | |
| 4,044 | | |
| - | | |
| | | |
| 4,044 | |
| | |
| | | |
| | | |
| | | |
| | | |
| | |
| 适用于普通股股东的全面收益(亏损) | |
$ | (15,058,822 | ) | |
$ | 323,232 | | |
$ | (2,725,722 | ) | |
| | | |
$ | (17,461,312 | ) |
| | |
| | | |
| | | |
| | | |
| | | |
| | |
| 普通股股东应占每股基本亏损和稀释后每股净亏损 | |
$ | (0.92 | ) | |
$ | - | | |
| | | |
| | | |
$ | (0.87 | ) |
| 已发行普通股、基本普通股和稀释普通股的加权平均数 | |
| 16,452,136 | | |
| - | | |
| 3,675,414 | | |
| 4a | | |
| 20,127,550 | |
ONCONETIX,Inc.
备考综合全面损失表
截至2022年12月31日止的年度
| | |
Onconetix,Inc. | | |
Proteomedex AG | | |
事务处理调整 | | |
备注 | | |
形式上
已整合 | |
| | |
| | |
| | |
| | |
| | |
| |
| 收入 | |
$ | - | | |
$ | 392,460 | | |
$ | - | | |
| | | |
$ | 392,460 | |
| | |
| | | |
| | | |
| | | |
| | | |
| | |
| 销货成本 | |
| - | | |
| 48,429 | | |
| - | | |
| | | |
| 48,429 | |
| | |
| | | |
| | | |
| | | |
| | | |
| | |
| 毛利 | |
| - | | |
| 344,031 | | |
| - | | |
| | | |
| 344,031 | |
| | |
| | | |
| | | |
| | | |
| | | |
| | |
| 运营费用 | |
| | | |
| | | |
| | | |
| | | |
| | |
| 销售、一般和行政 | |
| 9,351,552 | | |
| 1,912,258 | | |
| 781,302 | | |
| 4e | | |
| 12,045,112 | |
| 研发 | |
| 4,129,688 | | |
| 393,274 | | |
| - | | |
| | | |
| 4,522,962 | |
| 折旧及摊销 | |
| - | | |
| 17,492 | | |
| 3,728,341 | | |
| 4b | | |
| 3,745,833 | |
| 总运营费用 | |
| 13,481,240 | | |
| 2,323,024 | | |
| 4,509,643 | | |
| | | |
| 20,313,907 | |
| 运营亏损 | |
| (13,481,240 | ) | |
| (1,978,993 | ) | |
| (4,509,643 | ) | |
| | | |
| (19,969,876 | ) |
| | |
| | | |
| | | |
| | | |
| | | |
| | |
| 其他收入(费用) | |
| | | |
| | | |
| | | |
| | | |
| | |
| 利息支出 | |
| - | | |
| (63,580 | ) | |
| 63,580 | | |
| 4c | | |
| - | |
| 或有认股权证负债的公允价值变动 | |
| 61,410 | | |
| - | | |
| - | | |
| | | |
| 61,410 | |
| 其他收入(费用)合计 | |
| 61,410 | | |
| (63,580 | ) | |
| 63,580 | | |
| | | |
| 61,410 | |
| | |
| | | |
| | | |
| - | | |
| | | |
| - | |
| 净亏损 | |
| (13,419,830 | ) | |
| (2,042,573 | ) | |
| (4,446,063 | ) | |
| | | |
| (19,908,466 | ) |
| | |
| | | |
| | | |
| | | |
| | | |
| | |
| 累计优先股股息 | |
| 96,359 | | |
| - | | |
| - | | |
| | | |
| 96,359 | |
| | |
| | | |
| | | |
| | | |
| | | |
| | |
| 适用于普通股股东的净亏损 | |
| (13,516,189 | ) | |
| (2,042,573 | ) | |
| (4,446,063 | ) | |
| | | |
| (20,004,825 | ) |
| | |
| | | |
| | | |
| | | |
| | | |
| | |
| 福利养老金义务变化 | |
| - | | |
| 179,892 | | |
| - | | |
| | | |
| 179,892 | |
| | |
| | | |
| | | |
| | | |
| | | |
| | |
| 外币折算调整 | |
| - | | |
| (4,986 | ) | |
| - | | |
| | | |
| (4,986 | ) |
| | |
| - | | |
| 174,906 | | |
| - | | |
| | | |
| 174,906 | |
| | |
| | | |
| | | |
| | | |
| | | |
| | |
| 适用于普通股股东的全面收益(亏损) | |
$ | (13,516,189 | ) | |
$ | (1,867,667 | ) | |
$ | (4,446,063 | ) | |
| | | |
$ | (19,829,919 | ) |
| | |
| | | |
| | | |
| | | |
| | | |
| | |
| 普通股股东应占每股基本亏损和稀释后每股净亏损 | |
$ | (1.10 | ) | |
$ | - | | |
| | | |
| | | |
$ | (1.25 | ) |
| 已发行普通股、基本普通股和稀释普通股的加权平均数 | |
| 12,271,449 | | |
| - | | |
| 3,675,414 | | |
| 4a | | |
| 15,946,863 | |
未经审计的备考合并备注
财务信息
注1-演示的基础
已审核及未经审核的中期历史综合财务报表已根据美国证券交易委员会S-X号法规第11条在预计合并财务报表中进行调整,以实施(1)可直接归因于业务合并、(2)可事实支持和(3)预期将对业务合并后的综合业绩产生持续影响的预计综合业绩的预计预计会产生持续影响的预计合并前事项。
业务组合
按照ASC主题805的会计收购法核算,企业合并。
为会计目的,本公司已估计Proteomedex收购的资产及负债的公允价值
所承担的Proteomedex的会计政策并符合其本身的会计政策。
未经审核备考综合财务报表以本公司经审核及未经审核的中期历史综合财务报表及Proteomedex的经审核及未经审核的中期历史财务报表为基础,并经调整以落实本公司对Proteomedex的收购。截至2023年9月30日的未经审计预计综合资产负债表将这些交易视为发生在2023年9月30日。截至2023年9月30日止九个月及截至2022年12月31日止十二个月的未经审核备考综合全面损益表将该等交易视为发生于2022年1月1日。
未经审计的备考综合财务报表中使用的采购价格的分配是基于管理层的初步估值
。资产和负债的公允价值的最终估计将在第三方评估公司的协助下确定。公司的初步估计和假设可能会在完成内部研究和第三方对资产(包括财产和设备、无形资产以及某些负债)的估值后发生重大变化。
未经审计的预计综合财务报表仅供参考,并不一定表明如果交易在编制预计财务报表的日期
完成,合并后的公司的财务状况和经营结果将会是什么。随附的未经审核备考综合财务报表所反映的公允价值调整及其他估计,可能与交易后合并公司的综合财务报表所反映的调整大不相同。此外,未经审计的备考综合财务报表
并不旨在预测合并公司未来的财务状况或经营结果。如果需要更改公司的财务列报以使Proteomedex会计政策符合公司的会计政策,则可能需要重新分类和调整
。
这些未经审核的备考合并财务报表不会产生任何预期的协同效应、运营效率或可能与交易相关的成本节约。这些财务报表也不包括作为公司业务合并的一部分,公司可能产生的与交易相关的任何整合成本。
注2-重要会计政策摘要
未经审核备考综合财务报表的编制方式与本公司采纳的会计政策一致。对于Proteomedex,基于预计基础进行财务报告所遵循的会计政策与2022年报中披露的10-K表格和
所遵循的会计政策相同;对于Proteomedex,基于预计基础进行财务报告所遵循的会计政策与本委托书所包含的经审计财务报表中披露的会计政策相同。未经审核的备考综合财务报表并未假设本公司与Proteomedex之间的会计政策存在任何差异。本公司现正检讨Proteomedex的会计政策,以确保该等会计政策与本公司的会计政策一致,而作为检讨的结果,本公司可能会在两家公司的会计政策中找出差异,而这些差异如获确认,可能会对综合财务报表产生重大影响。
然而,本公司目前并不知悉有任何差异会对未经审核的备考综合财务报表产生重大影响。
附注3--采购价格分配
于2023年12月15日,
本公司与瑞士公司Proteomedex及其股东订立换股协议,收购Proteomedex所有已发行的
投票权。作为转让Proteomedex有投票权权益的代价
公司发行了3,675,414股普通股和2,696,729股B系列可转换优先股。
下表汇总了基于收购资产的估计公允价值和截至2023年9月30日承担的负债对收购价格的初步分配情况:
| 收购价 | |
$ | 62,465,093 | |
| | |
| | |
| 现金 | |
$ | 1,037,425 | |
| 应收账款 | |
| 116,374 | |
| 盘存 | |
| 83,183 | |
| 预付费用和其他流动资产 | |
| 7,304 | |
| 使用权资产 | |
| 140,588 | |
| 财产和设备,净额 | |
| 39,163 | |
| 商号 | |
| 2,399,000 | |
| 客户关系 | |
| 1,672,000 | |
| 知识产权 | |
| 51,054,000 | |
| 应计费用 | |
| (31,791 | ) |
| 经营租赁负债 | |
| (140,588 | ) |
| 养老金福利义务 | |
| (546,259 | ) |
| 应付票据 | |
| (109,251 | ) |
| 非控制性权益 | |
| (5,352,958 | ) |
| 商誉 | |
| 12,096,903 | |
| | |
$ | 62,465,093 | |
这一初步购进价格分配已用于在预计合并资产负债表和全面损失表中编制预计调整。最终收购价格分配将在公司完成详细估值和
必要计算后确定。最终分配可能与预计调整中使用的初步分配有很大不同。
最终分配可能包括(1)财产和设备公允价值的变化,(2)对商号和技术等无形资产以及商誉的分配变化,以及(3)资产和负债的其他变化。
如上文所述,根据《协议》,收购价格包括:(A)61,356,274美元B系列优先股和(B)1,108,819美元普通股。为编制这些备考合并财务报表,本公司印发了2,696,729份公司B系列优先股和3,675,414股公司普通股。
附注4-预计
形式交易会计调整
预计交易
会计调整基于我们的初步估计和假设,可能会发生变化。以下交易会计调整已反映在未经审计的备考简明合并财务信息中:
| a. | 本次调整记录了(1)向Proteomedex的卖方和某些债权人发行了2,696,729股B系列
优先股,价值61,356,274美元;(2)向Proteomedex的卖方和某些债权人发行了3,675,414股普通股,按每股0.30美元的价格计算,价值1,108,819美元。 |
| b. |
作为初步估值分析的一部分,该公司单独确认了某些估计公允价值为5,510万美元的无形资产。公允价值主要采用“收益法”确定,这需要对预期的未来现金流量进行预测。由于截至本文件提交之日,尚无法获得对Proteomedex无形资产进行详细估值分析所需的所有信息,因此,就这些未经审计的预计合并财务报表而言,该公司使用了基于公开可获得的行业交易数据的某些假设。该公司估计已确认无形资产的使用年限在5年至15年之间,导致在截至2023年9月30日的9个月和截至2022年12月31日的12个月的综合全面亏损表中分别调整了280万美元和370万美元的摊销费用。在计算采购价格的最终分配时,这些数字可能会发生重大变化。 |
下表描述了购得的非商誉无形资产的估计公允价值、使用年限和摊销情况:
| 描述 | |
使用寿命 | |
摊销法 | |
公允价值 | |
| 商号 | |
不定 | |
无 | |
$ | 2,399,000 | |
| 客户关系 | |
5年 | |
直线 | |
| 1,672,000 | |
| 自主研发的技术 | |
15年 | |
直线 | |
| 51,054,000 | |
| 总计 | |
| |
| |
$ | 55,125,000 | |
此外,12 096 903美元的商誉是在确认的资产和负债入账后确认的。
| c. | 本次调整记录了Proteomedex可转换票据按合同条款转换为Proteomedex普通股83,114股
。此次调整还剔除了与这些
可转换票据相关的应计利息和利息支出。 |
| d. | 这一调整消除了Proteomedex截至2022年9月30日未经审计的简明财务报表中报告的股东总股本。 |
| e. | 这一调整反映了公司估计的法律和其他专业费用和支出的总交易成本,估计约为781,000美元。 |
特别会议
本委托书是就Onconentix董事会征集委托书以供特别会议及其任何休会或延期
使用而向Onconentix股东提供的。我们鼓励Onconentix股东仔细阅读本文件全文,包括其附件和通过引用并入本文的文件,以获取有关换股协议和拟进行的交易的更详细信息。
特别会议的日期、时间和地点
特别会议计划在网上通过纯音频网络直播进行。[●],2024,从[●]东部时间上午。
特别会议将通过网络直播远程
交流的方式举行。不会有一个实际的地点。Onconentix股东将能够
通过访问以下地址虚拟出席特别会议并进行投票www.w.[●].com,被称为“特别会议
网站”。Onconentix股东需要在他们的代理卡上找到16位控制号码才能访问特别会议网站。
特别会议将审议的事项
特别
会议的目的是审议和表决以下每一项提议,本委托书中对每一项提议作了进一步说明:
| |
1. |
批准并通过反向股票分割修正案,以实现我们普通股所有流通股的反向股票分割,比例范围为1比30至1比60,该比例由董事会确定; |
| |
2. |
根据纳斯达克上市规则第5635条,批准在转换公司A系列优先股后发行至多5,709,935股普通股(可调整),每股面值0.00001美元; |
| 3. | 根据纳斯达克上市规则第5635条,批准
发行:(i)在转换B系列优先股时发行的269,672,900股普通股,以及(ii)公司在PMX融资中发行的普通股数量,最初应包括20,000,000股普通股和
最多6股,单位中包含的000,000股普通股相关认股权证(可调整),加上在满足某些价格保护条件后可发行的
股普通股的额外数量,如本文进一步所述; |
| 4. | 批准EisnerAmper董事会任命为公司截至2024年12月31日的财政年度的独立注册公共会计师事务所;以及 |
| 5. | 批准特别会议的休会(如有必要或适当),以便在特别会议举行时票数不足以批准反向股票拆分建议、A系列转换建议、PMX发行建议或审计师批准建议的情况下征集额外的委托书。 |
只有在特别会议通知所述目的范围内的事务才可在特别会议上进行。
Onconentix董事会的推荐
经过仔细考虑,Onconentix董事会一致建议Onconentix的股东投票支持每一项提议。
特别会议和投票权的记录日期
确定哪些股东有权收到特别会议或其任何延期或延期的通知并在其上投票的记录日期为[●],2024。
在记录日期的营业结束时,有[●]已发行及已发行并有权在特别会议上投票的普通股
。
每名Onconentix股东有权在记录日期营业结束时就每股登记在册的普通股股份的每一项提案投一票。只有在记录日期收盘时登记在册的Onconentix股东
才有权收到特别会议的通知并在会上投票,以及任何和所有的休会或延期。
有权在特别会议上投票的Onconentix股东的完整名单将在特别会议之前不少于10天的正常营业时间内在Onconentix总部供查阅,地址为俄亥俄州辛辛那提45202号第五街201 E号Suite 1900。有权在特别会议上投票的Onconentix股东名单
也将在特别会议期间通过特别会议网站供查阅
。
法定人数;弃权和经纪人不投票
在特别会议上开展业务需要达到Onconentix股东的法定人数。有权在特别会议上投票的三分之一已发行和已发行普通股的持有人亲自或委派代表出席将构成法定人数。通过特别会议网站虚拟出席特别会议或由代表代表出席特别会议并有权投票的普通股股份,包括Oncontix股东指示“弃权”投票的股份,将被计算以确定法定人数。由于核数师批准提案被认为是例行公事,因此,如果经纪人、银行或其他被提名人没有就该提案进行投票的指示,则通过经纪商、银行或其他被提名人持有的“街道名称”
的股票将被视为存在,以确定是否存在法定人数。
如果出席人数不足法定人数,特别会议将延期或推迟至达到法定人数所需的普通股数量的持有人出席。
根据纳斯达克规则,银行、经纪商或其他被提名人在未收到受益所有人的投票指示时,有权代表此类股份的实益所有人以“街道名义”持有此类股份。
但根据纳斯达克规则,银行、经纪商或其他被提名人不能就“非例行”事项行使其投票裁量权。这可能导致“经纪人不投票”,即在下列情况下发生的提案:(I)一家银行、
经纪人或其他被提名人有自由裁量权对一个或多个“例行”提案进行投票,该提案将在股东会议
上表决,但在没有股票受益所有人指示的情况下,不被允许对其他“非例行”提案进行表决,以及(Ii)受益所有人未能就“非例行”事项向银行、经纪人或其他被提名人提供投票指示。除审计师批准提案外的所有建议均被视为“非常规”事项
,银行、经纪商或其他被提名人将无权在特别会议前就此类事项投票。
因此,Onconentix只希望经纪人不会就审计师批准提案投票。
如果您以“街头名义”持有普通股,您的股票将不会就审计师审批提案以外的任何事项投票,除非您肯定地指示您的银行、经纪商或其他被提名人如何根据您的银行、经纪商或其他被提名人提供的投票指示投票您的股票。因此,您应通过指示您的银行、经纪人或其他被提名人如何投票来进行投票,这一点至关重要。经纪人将不能在特别会议之前对任何非常规提案进行投票,除非他们已收到受益所有人的投票指示。
所需票数
假设出席特别会议的人数达到法定人数,
批准反向股票拆分建议需要持有普通股的持有者投赞成票
普通股至少占有权投票的已发行普通股的多数。如果您是Onconentix的股东
并且没有投票,未能指示您的银行、经纪人或其他被提名人就反向股票拆分提案进行投票,或者放弃投票,则它将与投票反对反向股票拆分提案具有相同的效果。
假设出席特别会议的股东人数达到法定人数,则A系列转换方案、PMX发行方案、审计师批准方案和休会方案需要有权在特别会议上就
事项进行表决的出席股东或委托代表投赞成票。Onconentix股东未能委派代表或亲自在特别会议上投票,
不会对该等建议产生影响,但前提是出席的人数达到法定人数。出席的任何股份或由代表代表的任何股份弃权或以其他方式未能就该等建议进行表决,均不会对该等建议产生影响。
Onconentix董事和执行干事的投票
自.起[●],2024年,记录日期,Onconentix董事和高管及其关联公司实益拥有并有权投票的总投票权[●]普通股股份,
代表[●]在记录日期发行和发行的普通股的百分比。Onconentix目前预计,所有Onconentix董事和高管都将投票支持每一项提议。见标题为“”的部分Oncontix董事和高级管理人员的利益“在这份委托书中。
投票的方法
登记在册的股东
如果您是Onconentix登记在册的股东,
您可以通过代表通过互联网、电话或邮件在特别会议上投票,或通过特别会议网站虚拟出席并投票,如下所述。
| ● | 通过互联网:要通过互联网投票,请转到Www.proxyvote.com
完成一张电子代理卡。系统将要求您提供收到的代理卡中的16位控制号码。您的投票必须在晚上11:59之前收到。东部时间开始[●],2024人,有待统计。如果您通过互联网投票,则不需要
通过邮寄方式退回代理卡。 |
| ● | 电话投票:要通过电话投票,请拨[●]
(通话在美国和加拿大是免费的;来自其他国家/地区的通话需要收费),并遵循录制的
说明。系统将要求您提供代理卡中的16位控制号码。您的投票必须在东部时间晚上11:59之前收到。[●],2024人,有待统计。如果你通过电话投票,你不需要邮寄代理卡。 |
| ● | 邮寄:要使用代理卡邮寄投票(如果您要求将代理材料的纸质副本邮寄给您),您需要填写代理卡,注明日期并签名,并在提供的信封中迅速邮寄
,以便不晚于[●],2024年。代理卡
中指定的人员将根据您在邮寄的代理卡上的说明对您拥有的股票进行投票。 |
| ● | 实际上是通过特别会议网站:要在特别会议上投票,请访问www.w.[●].com,在那里你可以虚拟地出席特别会议并在会议上投票。您将被要求
提供您收到的代理卡中的16位控制号码才能访问特别会议网站。 |
除非被撤销,否则代表有权在特别大会上投票的普通股股份的所有正式签立的委托书将在特别会议上投票,如委托卡上已指定选择
,将根据该说明书投票。如果您提交了一份已执行的委托书,但没有为任何提案提供说明
,您的股份将被投票支持每个提案。
受益者(街名)股东
如果您通过银行、经纪人或其他代名人以“街道名称”而不是登记持有人的身份持有您的普通股股票,您必须遵循您的银行、经纪人或其他代名人提供的投票指示
来投票您的股票。您的银行、经纪人或其他代理人必须在您的银行、经纪人或其他代理人提供的有关如何提交投票指示的信息中规定的截止日期之前收到您的投票指示。
如果您没有向您的银行、经纪人或其他代理人提供提案的投票指示,则您的普通股将不会
就审计师批准提案以外的任何提案进行投票,因为您的银行、经纪人或其他
代理人没有对此类提案进行投票的自由裁量权。见标题为“”的部分特别会议--法定人数;弃权和中间人无投票权.”
如果您通过
银行、经纪人或其他代名人(而不是登记持有人)持有您的普通股股票,您必须从您的银行、经纪人或其他代名人那里获得特定的控制编号
,才能通过特别会议网站虚拟出席特别会议并在会议上投票。
请参阅标题为“特别会议--实际出席特别会议.”
虚拟出席特别会议
如果您希望通过特别会议网站虚拟出席特别会议
,您必须(I)在交易结束时成为Onconentix的股东[●],2024年,
记录日期,(Ii)在记录日期以经纪商、银行或其他代名人的名义实益持有您的普通股
或(Iii)持有有效的特别会议代表。
要进入特别会议网站并实际
出席特别会议,您需要代理卡上的16位控制号码。如果您通过经纪商、银行或其他被提名人以街头名义持有您的普通股
,并且您希望通过特别会议网站虚拟出席特别会议,您将需要从您的银行、经纪人或其他被提名人那里获得您的特定控制号码和进一步指示。
还需要16位控制号码才能访问有权在会议期间
在特别会议上投票的Oncontix股东名单。
如果您计划通过特别会议网站在
特别会议上虚拟出席并投票,Onconentix仍然鼓励您通过互联网、电话或(如果您
收到代理材料的纸质副本)通过邮件提前投票,这样即使您稍后决定不通过特别会议网站虚拟出席特别会议,您的投票也将被计算在内。通过互联网、电话或邮件投票您的代表不会限制您通过特别会议网站实际出席特别会议并在特别会议上投票的权利,如果您稍后决定这样做的话。
委托书的可撤销
任何提供委托书的Onconentix股东都有权在特别会议表决委托书之前的任何时间撤销委托书。如果您是Onconentix的记录股东,您可以通过以下任一操作
撤销您的委托书:
| ● | 通过向Onconentix的公司秘书发送已签署的书面撤销通知,条件是在不晚于[●], 2024; |
| ● | 在东部时间晚上11:59投票设施关闭之前,按照您的代理卡上的指示通过互联网或电话再次投票。[●], 2024; |
| ● | 通过提交一张经过适当签名和注明日期的代理卡,并在不迟于以下日期收到的日期:[●],2024年;或 |
| ● | 通过特别会议网站虚拟出席特别会议并要求撤销您的委托书,或如上所述通过特别会议网站进行虚拟投票。 |
只有您最后提交的委托书才会被考虑。
委托书的签署或撤销不会以任何方式影响Onconentix股东通过特别会议网站实际出席特别会议并在特别会议上投票的权利。
书面撤销通知和与撤销代理有关的其他通信
应发送至:
Onconentix,Inc.
注意:首席财务官布鲁斯·哈蒙
第五街201 E号,1900号套房
俄亥俄州辛辛那提,邮编:45202
如果您的普通股以“Street
名称”持有,并且您之前向您的经纪人、银行或其他代名人提供了投票指示,则您应按照您的经纪人、银行或其他代名人提供的指示
撤销或更改您的投票指示。您也可以通过以下方式更改您的投票:从您的银行、经纪人或其他被指定人那里获得您的特定控制号码和指示,并通过特别会议网站在特别会议上投票。
委托书征集成本
Onconentix代表Onconentix董事会征集委托书。Onconentix
将承担向Onconentix股东征集代理人的全部费用。委托书可由安康公司的董事、管理人员和其他员工亲自或通过邮件、电话、传真、信使、互联网或其他通讯手段(包括电子通讯)征集。Onconentix董事、高级管理人员和员工将不会因他们在这方面的服务或募集而获得任何额外的报酬。
如有必要,Onconentix将要求银行、经纪商和其他被提名者记录持有人向Onconentix普通股的受益者发送委托书和委托书,并确保他们的投票指示。Onconentix可能会被要求向这些银行、经纪人和其他被提名人报销采取这些行动所需的合理费用。
Onconentix也保留了[●]协助
征集代理,并与Onconentix股东沟通,并估计它将支付[●]费用约为
$[●],外加某些自付费用和开支的报销。Onconentix也同意赔偿[●]针对与其征集委托书有关或因其征集委托书而产生的各种责任和费用(除某些例外情况外)。
家居
美国证券交易委员会规则允许公司和中介机构(如经纪人)通过向两个或多个股东发送一份委托书或一份发给这些股东的通知,来满足有关两个或多个股东共享同一地址的委托书和通知的交付要求。这一过程通常被称为“家务管理”,为公司节省了成本。Onconentix之前曾对Onconentix
登记在册的股东采取房屋保有制。因此,具有相同地址和姓氏的Onconentix股东只能收到此代理声明的一份副本
。Onconentix的登记股东(直接以其名义持有普通股的股东,通过Onconentix的转让代理
)可以选择退出家庭控股,并通过向以下地址发送书面请求来获得单独的委托书或其他代理材料。
一些经纪人使用代理材料,向共享同一地址的多个Onconentix股东发送单个代理声明或通知,除非收到受影响股东的相反指示
。一旦您收到经纪人的通知,表示它们将是您地址的房屋托管材料,
房屋托管将继续进行,直到您收到其他通知或直到您撤销您的同意。如果您在任何时候不再希望参与房屋管理而希望收到单独的委托书或通知,或者如果您收到这些文件的多份副本
并且您希望未来的交付仅限于一份副本,请通知您的经纪人。
任何因持家原因而只收到一份这些材料的股东,如因持有这些材料而只收到一份副本,安康公司将立即将该委托书的副本发送至:安康公司,收信人:首席财务官布鲁斯·哈蒙,地址:俄亥俄州辛辛那提45202,辛辛那提第五街201 E号,邮编:1900。
休会
如果出席特别会议的法定人数
但在特别会议时没有足够的票数批准反向股票拆分建议、A系列转换建议、PMX发行建议或审计师批准建议,则可要求Onconentix股东
就休会建议进行表决。如出席人数不足法定人数,则主持会议的高级职员可不时将特别大会续会,而无须于大会上公布会议延期的时间、日期及地点(如有),以及远距离通讯方式(如有),以使Onconentix股东及受委代表可被视为亲身出席及于该续会上投票。主持会议的官员也可将会议延期至另一小时、日期或地点,即使出席人数达到法定人数
。
在随后召开的任何有法定人数的特别会议上
,任何可能在原会议上处理的事务均可被处理,所有代表
的表决方式将与其在最初召开特别会议时的表决方式相同,但在重新召开的会议上表决该代表之前已被有效撤销或撤回的任何代表
除外。
援助
如果您需要帮助投票或填写您的
代理卡,或者如果您对特别会议有任何疑问,请联系[●],Onconentix的代理律师,
特别会议,地址:
[●]
ONCONETIX股东应仔细阅读本委托书全文,了解有关换股协议和PMX交易的更多详细信息。具体而言,ONCONETIX的股东请参阅本协议附件B所附的换股协议。
方案1:反向
股票拆分方案
反向股票拆分提议的理由
董事会现建议本公司股东批准一项修订,该修订授权(但不责成董事会)修订本公司的注册证书,以按30股1股至60股1股的比例将普通股的已发行股份及库存股进行反向股份分拆,而该比率
将于股东批准后由董事会酌情决定(“反向分股”)。本公司相信,一系列反向拆分比率的提供将为本公司提供实施反向股票拆分的灵活性
,其实施方式旨在为本公司及其股东带来最大的预期利益。下文提出的反向拆分修正案的一般说明仅为摘要,其全部内容受作为附件A所附的拟议修正案形式的全文的限制。
董事会要求
授权实施反向拆分的主要目标是提高我们普通股的每股交易价格。如果本公司董事会在股东特别大会上批准反向股票拆分之日起一周年前未实施反向股票拆分,本建议中授予的实施反向股票拆分的授权将终止,并将放弃
反向股票拆分修正案。
2023年9月18日,我们接到纳斯达克工作人员的通知,指出根据普通股连续30个工作日的收盘价计算,我们
没有遵守《投标价格规则》中关于继续在纳斯达克上市必须将最低投标价格维持在每股1.00美元的要求。从2023年9月18日或到2024年3月16日,我们有180天的时间重新遵守投标价格规则。
为了重新遵守投标价格规则并获得在纳斯达克资本市场继续上市的资格,我们普通股的每股收盘价必须在2024年3月16日或之前的至少连续10个工作日至少为1.00美元。纳斯达克员工保留延长这10个工作日的自由裁量权,以确定公司已证明有能力保持长期合规。
如果我们未能在2024年3月16日之前重新遵守投标价格规则,但符合纳斯达克初始上市的所有其他适用标准(投标价格规则除外),则我们可能有资格再获得180个日历日,或直到2024年9月12日,以重新遵守投标价格规则。
如果我们在合规期(或第二个合规期
期限,如果适用)结束前未能重新遵守投标价格规则,则我们的普通股将被退市。如果吾等收到本公司普通股将被摘牌的通知,《纳斯达克上市规则》允许吾等就纳斯达克的摘牌决定向聆讯小组提出上诉,但不能
保证小组会批准本公司继续上市的请求。
董事会认为,股东
未能批准反向股票拆分修正案可能会阻止本公司遵守投标价格规则,并可能(其中包括)抑制我们进行融资活动的能力。如果纳斯达克股票市场将普通股退市,那么普通股很可能会在场外交易市场交易,例如场外交易市场集团公司,它没有像纳斯达克股票市场那样的实质性
公司治理或继续上市的量化要求。在这种情况下,对普通股的兴趣可能会下降,某些机构可能没有能力进行普通股交易,所有这些都可能对普通股的流动性或交易量产生重大不利的
影响。如果普通股因从纳斯达克股票市场退市而导致流动性大幅下降,公司股东可能没有能力在需要的时候变现他们在普通股的投资
,公司认为其维持和获得分析师报道、吸引投资者兴趣以及获得资金的能力可能会因此大大降低。
修正案的潜在影响
如果董事会决定实施反向
股票分割修正案,公司将向公众传达有关反向股票分割修正案的其他细节(包括
由董事会确定的最终反向分割比率)。通过投票赞成反向股票分割修正案,您也明确
授权董事会自行决定是否继续进行反向股票分割修正案,并推迟反向股票分割修正案的时间或放弃反向股票分割修正案。在确定是否在收到股东
对反向股票分割修正案的批准后实施反向股票分割修正案,以及实施何种反向分割比率(如有)时,董事会可考虑(除其他事项外)各种因素,例如:
| ● |
普通股当时的交易价格和交易量,以及反向股票分割对普通股交易市场的短期和长期预期影响; |
| ● | 哪种反向拆分比率将最大程度地降低公司的整体行政成本;以及 |
反向股票分割的主要原因
如果我们的董事会选择实施反向股票分割修正案,
实施反向股票分割修正案的主要目标将是提高我们普通股的每股价格,无论是否可能重新遵守
投标价格规则。我们的董事会认为,如果出现适当的情况,实施反向股票
分割修正案,可以帮助我们吸引更广泛的投资者,提高投资者对
公司的兴趣,改善我们的普通股作为投资证券的认知,并通过使
我们的普通股对更广泛的投资者更具吸引力来帮助我们的资本筹集工作。
A reverse stock split could allow a broader range
of institutions to invest in the Common Stock (namely, funds that are prohibited from buying stocks whose price is below certain thresholds),
potentially increasing trading volume and liquidity of the Common Stock and potentially decreasing the volatility of the Common Stock
if institutions become long-term holders of the Common Stock. A reverse stock split could help increase analyst and broker interest in
the Common Stock as their policies can discourage them from following or recommending companies with low stock prices. Because of the
trading volatility often associated with low-priced stocks, many brokerage houses and institutional investors have internal policies and
practices that either prohibit them from investing in low-priced stocks or tend to discourage individual brokers from recommending low-priced
stocks to their customers. Some of those policies and practices may make the processing of trades in low-priced stocks economically unattractive
to brokers. Additionally, because brokers’ commissions on low-priced stocks generally represent a higher percentage of the stock
price than commissions on higher-priced stocks, a low average price per share of Common Stock can result in individual stockholders paying
transaction costs representing a higher percentage of their total share value than would be the case if the share price were higher. Some
investors, however, may view a reverse stock split negatively since it reduces the number of shares of Common Stock available in the public
market. If the Reverse Stock Split Amendment is approved and the Board believes that effecting the Reverse Stock Split is in the best
interests of the Company and its stockholders, the Board may effect the Reverse Stock Split, regardless of whether the Company’s
stock is at risk of delisting from Nasdaq, trades on the OTC Market, or otherwise for purposes of increasing the per share trading price,
enhancing the liquidity of the Common Stock, and to facilitate capital raising.
与反向库存
拆分相关的某些风险
通过反向股票分割修正案减少
普通股的流通股数量,在没有其他因素的情况下,旨在提高
普通股的每股市场价格。然而,其他因素,如公司的财务业绩,市场状况,市场对公司业务的看法和其他风险,包括下文和公司提交给美国证券交易委员会的文件和报告中所述的因素,包括截至2022年12月31日的10-K表格年度报告,经修订,可能会对普通股的市场价格产生不利影响。因此,
无法保证反向股票分割(如果完成)将产生上述预期收益,无法保证反向股票分割后普通股的市场价格
将上涨,也无法保证普通股的市场价格
将来不会下降。
反向股票分割可能不会导致普通股价格持续上涨.反向股票分割对普通股市场价格的影响
无法确定地预测,并且公司无法向您保证反向股票分割将导致普通股价格在任何有意义的时间段内持续上涨
,或根本不上涨。董事会认为,反向股票分割有
提高普通股市场价格的潜力,因此可能有助于满足买入价规则(如适用)。但是,
反向股票分割对普通股市场价格的长期和短期影响无法确定地预测。
反向股权分置可能降低普通股的流动性
.董事会认为,反向股票分割可能会导致普通股的市场价格上涨,
这可能会导致普通股的兴趣增加,并可能促进公司股东的流动性。
但是,反向股票分割也将减少普通股的流通股总数,这可能会导致交易减少
以及普通股的做市商数量减少。也不能保证反向股票分割将提高公司从事资本筹集活动的能力。
反向股票分割可能会导致一些
股东拥有更难出售或需要更高的每股交易成本的“奇数股”。
如果实施反向股票拆分,将增加持有100股以下普通股的“零头”股东数量。买入或卖出少于100股普通股(“零头”交易)可能会导致通过某些经纪商,特别是“全方位服务”经纪商的交易成本递增。因此,那些在反向股票拆分后持有不到100股普通股的股东如果
出售其普通股,可能需要支付更高的交易成本。
反向股票拆分可能导致公司总市值下降
。反向股票拆分可能会被市场视为负面,因此,
可能会导致公司的整体市值减少。如果普通股的每股市场价格没有
与反向拆分比率成比例增加,则以公司市值衡量的公司价值将减少
。
实施反向股票拆分的影响
反向股票拆分将统一影响所有普通股持有人
,不会影响任何股东的百分比所有权利益或比例投票权。反向股票拆分修正案的其他主要影响将是:
| |
● |
普通股(和库存股,如有)的已发行和流通股数量将根据董事会确定的最终反向拆分比率按比例减少; |
| |
|
|
| |
● |
根据最终的反向拆分比率,所有未行使期权和认股权证的每股行使价将按比例增加,所有未行使期权和认股权证行使后可发行的普通股数量将按比例减少;以及 |
| |
|
|
| |
● |
根据任何尚未行使之股权奖励而预留发行之股份数目及可能授出股权奖励之任何最高股份数目将根据最终反向分割比率按比例减少。 |
董事会不打算
将反向股票分割作为
《交易法》第13 e-3条所指的“私有化交易”的第一步。反向股份分割方案生效后的实际发行股份数将取决于董事会最终选定的
反向分割比率。下表说明了某些(但不是全部)可能的反向
股票分割比率,以及
实施反向股票分割所导致的普通股的已发行和流通股数量, [●]发行在外的普通股, [●],2024年。反向
股票分割不会影响我们公司注册证书下的授权股票总数。
示例
比率授权范围内的比率 | |
编号
的法定股份 普通股
股票 | | |
隐含
近似值
已发行
和
流通股
普通股
反向股票分割后 * | |
| 30投1中 | |
| [●] | | |
| [●] | |
| 40投1中 | |
| [●] | | |
| [●] | |
| 50投1中 | |
| [●] | | |
| [●] | |
| 60投1中 | |
| [●] | | |
| [●] | |
我们目前被授权发行最多
250,000,000股普通股。截至记录日期, [●]我们的普通股发行和流通股。虽然
我们的普通股的授权股数不会因反向股票分割而改变,但我们的
普通股的已发行和流通股数将根据董事会选择的比例减少。因此,反向股票分割将
有效地增加我们可用于未来发行的普通股的授权和未发行股份数量,其数量相当于反向股票分割所产生的
减少量。
反向股票分割后,
董事会将有权根据适用的证券法,
在董事会认为适当的条款和条件下,发行所有授权和未发行的股票,无需股东进一步批准。尽管我们不时考虑融资机会,但除了
与A系列优先股或B系列优先股转换相关的可发行股票或
因PMX融资而可发行的股票外,我们目前没有任何计划、建议或谅解来发行额外的股票,
如果反向股票分割获得批准和生效,但部分增发股份为认股权证标的,可在反向拆股修正案受影响后行使或
转换。
管理层预计公司的
财务状况、管理层对普通股的所有权百分比、公司股东的数量或公司业务的任何方面
不会因反向股票分割修正案而发生重大变化。由于反向股票分割
修正案将适用于普通股的所有已发行和流通股以及购买普通股或将
其他证券转换为普通股的未行使权利,因此拟议的反向股票分割修正案将不会改变现有
股东的相对权利和偏好,除非反向股票分割将导致零碎股份,如下文更详细地讨论。
普通股目前根据《交易法》第12(b)节进行登记,公司须遵守《交易法》的定期报告和其他要求。《
反向股票分割修正案》将不会影响普通股根据《交易法》的注册,也不会影响普通股在纳斯达克的上市,只要普通股仍在纳斯达克上市交易(除非它可能有助于遵守纳斯达克
持续上市标准,如果适用)。反向股票分割后,普通股预计将继续在纳斯达克或场外交易公告板上市,但将被视为具有统一证券识别程序委员会(CUSIP)新编号的新上市。
普通股
持有人的权利将不受反向股票分割修正案的影响,但以下所述的零碎股份处理除外。
例如,在
反向股票分割修正案生效之前持有普通股流通股2%投票权的持有人,通常在反向股票分割之后
将继续持有普通股流通股2%的投票权。记录在案的股东数量将不受反向股票分割修正案
的影响(除非由于持有零碎股份而被兑现)。如果获得批准和实施,反向股票分割
修正案可能会导致一些股东拥有少于100股普通股的“零星股”。奇数手股票可能
更难出售,奇数手交易的经纪佣金和其他成本通常高于100股偶数倍的“整数手”交易的成本。然而,董事会认为,反向股票分割修正案的好处
超过了这些潜在影响。
反向股权分置的有效性
The Reverse Stock Split Amendment, if approved by the Company’s
stockholders, would become effective upon the filing and effectiveness (the “Effective Time”) of the Reverse Stock Split Amendment
with the Secretary of State of the State of Delaware, which would take place at the Board’s discretion. The exact timing of the
filing of the Reverse Stock Split Amendment, if filed, would be determined by the Board based on its evaluation as to when such action
will be the most advantageous to the Company and the Company’s stockholders. In addition, the Board reserves the right, notwithstanding
stockholder approval and without further action by the stockholders, to elect not to proceed with the Reverse Stock Split if, at any time
(i) prior to filing the Reverse Stock Split Amendment with the Secretary of State of the State of Delaware and (ii) before the one-year
anniversary of the date on which the Reverse Stock Split is approved by the Company’s stockholders at the Special Meeting, the Board,
in its sole discretion, determines that it is no longer in the Company’s best interests or the best interests of its stockholders
to proceed with the Reverse Stock Split. If our Board does not implement the Reverse Stock Split prior to the one-year anniversary of
the date on which the Reverse Stock Split is approved by the Company’s stockholders at the Special Meeting, the authority granted
in this proposal to implement the Reverse Stock Split will terminate and the Reverse Stock Split Amendment to effect the Reverse Stock
Split will be abandoned.
对面值的影响;减少国有资本
拟议的反向股票拆分修正案不会影响公司股票的面值,普通股每股面值将保持在0.00001美元。因此,本公司资产负债表上列述的应占普通股的资本,即普通股每股面值乘以已发行和已发行普通股的股份总数,将按董事会选定的反向股票
分割比率按比例递减。相应地,本公司的额外实收资本账户将计入所述资本减少的金额,该额外实收资本账户由其法定资本与发行所有当前已发行普通股时支付给本公司的总金额
之间的差额组成。公司的股东权益总额将保持不变。
记账式股份
如果进行反向股票拆分,股东(无论是直接或实益所有人)将通过本公司的转让代理(对于实益所有人,由其经纪人或为其利益以“街头名义”持有的银行,视情况而定)对其持股进行电子调整,以使反向股票拆分生效
。银行、经纪商、托管人或其他被提名人将被指示对其
实益持有人以街道名义持有普通股实施反向股票拆分。然而,这些银行、经纪商、托管人或其他被指定人可能与注册股东在处理反向股票拆分和支付零碎股份方面有不同的程序。如果股东
在银行、经纪人、托管人或其他代理人处持有普通股,并对此有任何疑问,请
股东与其银行、经纪人、托管人或其他代理人联系。本公司不向股东发放实物凭证。
没有评价权
根据特拉华州公司法,公司股东无权享有与反向股票拆分提案中所述的反向股票拆分相关的异议权利或评价权,公司不会独立向其股东提供任何此类权利。
零碎股份
本公司不打算发行与反向股票拆分相关的零碎
股。本公司目前预计,将促使其交易所代理将反向股票拆分后的所有零碎股份权益合计在一起,向市场出售合并后的零碎股份权益,并
将出售所得净收益(减去任何惯常的经纪费用、佣金和其他费用)
分配和分配给因反向股票拆分而原本会持有零碎股份权益的股东。
股东将无权在有效时间至收到其
零碎股份权益的付款日期之间的一段时间内收取利息。股票反向分拆完成后,股东将不再拥有本公司的零碎股份权益
,而以其他方式享有零碎股份的人士将不会有任何投票权、股息
或与此相关的其他权利,但收取上述现金付款除外。尽管本公司将支付任何经纪费用、佣金和其他与交易所代理在公开市场上出售股票有关的费用,但如上所述,这些费用将减少支付给股东的现金金额,而不是收到零碎
股票。股东应意识到,根据不同司法管辖区的欺诈法律,在有效时间之后未及时申领的零碎权益的到期金额可能需要向每个此类司法管辖区的指定代理人支付。其他有权获得此类资金的股东
如果尚未收到资金,则必须寻求直接从收款所在的司法管辖区获得此类资金。
与反向股票拆分相关的重大美国联邦所得税考虑因素
以下是反向股票拆分对美国持有者(定义如下)的美国联邦所得税考虑事项的综合摘要。本讨论基于1986年《国税法》(下称《国税法》)的现行条款、根据国税法颁布的现行和拟议的《国库条例》(以下简称《国库条例》)、司法权力和行政解释,所有这些都可能发生变化,可能具有追溯效力,并受到不同解释的影响。
这些权力机构的变化可能会导致税收后果与下文所述的后果大相径庭。本公司没有也不会就以下讨论的任何税务考虑事项
寻求法律顾问的意见或美国国税局(“IRS”)的任何裁决。因此,不能保证国税局不会断言或法院不会维持与以下任何结论相反的立场。
本讨论仅限于将普通股作为《守则》第1221条所指的“资本资产”持有的美国持有者(通常是为投资而持有的财产)。
本讨论不涉及投资净收入税或替代最低税产生的任何税收后果,也不涉及任何州、当地或非美国司法管辖区的法律、美国联邦遗产或赠与税法或任何税收条约引起的任何税收后果。此外,本讨论不涉及美国联邦所得税的所有方面,这些方面可能适用于美国持有者的特定情况,或可能适用于受美国联邦所得税法特别规定约束的美国持有者,包括但不限于:
| |
● |
银行、保险公司或其他金融机构; |
| |
|
|
| |
● |
免税组织或政府组织; |
| |
|
|
| |
● |
房地产投资信托基金; |
| |
|
|
| |
● |
S公司或其他传递实体(或S公司等传递实体的出资人); |
| |
|
|
| |
● |
受监管的投资公司或共同基金; |
| |
|
|
| |
● |
股票、证券或货币的交易商或经纪人; |
| |
● |
选择按市值计价的证券交易商; |
| |
|
|
| |
● |
根据退休计划或其他方式,通过行使员工期权或其他方式获得普通股作为补偿的普通股持有人; |
| |
|
|
| |
● |
作为跨境、增值财务状况、合成证券、套期保值、转换交易或其他综合投资或降低风险交易的一部分持有普通股的人; |
| |
|
|
| |
● |
积累收益以逃避美国联邦所得税的公司; |
| |
|
|
| |
● |
其职能货币不是美元的人; |
| |
|
|
| |
● |
通过非美国经纪人或其他非美国中间人持有普通股的美国持有者; |
| |
|
|
| |
● |
受《守则》第451(B)条约束的人;或 |
| |
|
|
| |
● |
根据法典第877或877A条规定的在美国的前公民或长期居民。 |
如果合伙企业或因美国联邦所得税而被视为合伙企业的任何实体(或安排)
持有普通股,则此类合伙企业中的合伙人的纳税待遇通常将取决于合伙人的状况和合伙企业的活动,以及在合伙人
级别做出的某些决定。持有普通股的合伙企业的合伙人应咨询其自己的税务顾问有关反向股票拆分的美国联邦所得税后果
。
出于本讨论的目的,“美国
持有人”是指为美国联邦所得税目的而持有的普通股的实益拥有人:
| |
● |
美国公民个人或美国居民; |
| |
|
|
| |
● |
在美国、其任何州或哥伦比亚特区的法律中或根据该法律设立或组织的公司(或为美国联邦所得税目的作为公司征税的任何其他实体); |
| |
|
|
| |
● |
其收入应缴纳美国联邦所得税的遗产,无论其来源如何;或 |
| |
|
|
| |
● |
信托(I)其管理受美国法院的主要监督,并且有一名或多名美国人有权控制该信托的所有实质性决定,或(Ii)已根据适用的财政部法规作出有效选择,被视为美国人。 |
反向股票拆分的税收后果
通常
股票反向拆分应构成美国联邦所得税的“资本重组”
。因此,普通股的美国持有者通常不应确认反向股票拆分的损益,除非是收到的现金,而不是普通股的一小部分,如下所述。美国持有人根据反向股票拆分收到的普通股股份的合计计税基准应等于交出的普通股股份的合计税基(不包括分配给普通股任何零头股份的该基准的任何部分),并且该美国持有人在收到的普通股股份中的持有期应包括交出的普通股股份的持有期。《国库条例》规定了将普通股退还给根据反向股票拆分进行资本重组时收到的普通股的税基和持有期的详细规则。持有在不同日期、不同价格获得的普通股的美国持有者应咨询其税务顾问有关此类股票的计税依据和持有期的分配
。
零碎股份现金入股
根据反向股票拆分获得现金
以代替普通股零碎股份的美国普通股持有人一般应确认资本收益或亏损,其金额应等于收到的现金金额与美国持有者交出的普通股股份中分配给该零碎普通股的税基之间的差额。此类资本收益或损失应为长期资本收益或损失,如果美国持有者在反向股票拆分生效时对已交出普通股的持有期超过一年
。资本损失的扣除是有限制的。
信息报告和备份扣缴
美国普通股持有人根据反向股票拆分收到的现金付款可能需要进行信息报告,并可能受到美国备用扣缴(目前为24%)的约束,除非该持有人提供适用豁免的证明或正确的纳税人识别码,并在其他方面遵守备用扣缴规则的适用要求。根据美国备用预扣规则扣缴的任何金额不是额外税款,只要及时向美国国税局提供所需信息,通常将被允许作为美国持有人美国联邦所得税责任的退款或抵免
。
所需票数
假设出席特别会议的人数达到法定人数,
批准反向股票拆分建议需要普通股持有人投赞成票,普通股持有人至少占有权就此投票的普通股已发行股份的多数。如果Onconentix股东未能投票,未能指示其银行、经纪商或其他被指定人就反向股票拆分提案进行投票,或放弃投票,其效果将与投票反对反向股票拆分提案具有相同的效果。
ONCONETIX董事会一致
建议ONCONETIX股东投票支持反向股票拆分提案。
建议2:A系列转换建议
概述
于2023年9月29日,本公司与Veru,Inc.订立了资产购买协议(“购买协议”)的修订(“Veru修订”),修订日期为2023年4月19日,内容涉及出售产品ENTADFI。根据购买协议,公司必须在2023年9月30日之前支付400万美元的分期付款。根据Veru修正案,400万美元的分期付款将在(1)于2023年9月29日向Veru支付100万美元的即时可用资金
,以及(2)于2023年10月3日之前向Veru发行3,000股公司A系列可转换优先股时视为已支付和全部清偿。该公司于2023年9月29日支付了100万美元。
向Veru发行的A系列优先股最初总计可转换为约5,709,935股公司普通股,但须经调整
并假设本建议第3号获得批准。
首轮改装建议的目的
我们受纳斯达克规则的约束,因为我们的普通股目前在纳斯达克资本市场上市。
根据纳斯达克第5635(A)条,公司就收购另一公司的股票或资产而发行普通股(或可转换为普通股或可行使普通股的证券)之前,如果由于现有或潜在发行普通股,包括根据赚取拨备或类似类型的拨备发行的
股票,或可转换为或可行使普通股的证券,则必须获得股东批准。除公开发行现金外:(A)普通股在发行时具有或将具有相当于或超过发行前已发行投票权的20%的投票权;或可转换为普通股或可行使普通股的证券;或(B)
将发行的普通股数量等于或将等于或超过股票或证券发行前已发行普通股数量的20%。
结合在PMX交易中发行的股份和在PMX融资中可发行的股份,A系列优先股转换后可发行的股份将导致
A系列优先股发行时超过20%的投票权和已发行普通股数量
。由于上述原因,根据纳斯达克第5635(A)条,A系列指定证书规定,A系列优先股不得转换为普通股,直到我们获得股东批准移除它们
,如中所述。建议2:A系列转换建议.”
如果股东不批准A系列转换建议,公司将不能兑现Veru持有的A系列优先股的任何转换。
A系列优先股说明
A系列可转换优先股的条款载于公司于2023年9月29日提交给特拉华州的A系列可转换优先股权利和优先权指定证书(“指定证书”)中。根据指定证书
,自A系列优先股发行之日起计一年
起计,VERU可随时及不时将A系列优先股的每股股份转换为该数目的本公司普通股,其数目由
每股1,000美元的声明价值除以每股0.5254美元的换股价格(定义见指定证书)决定,但须受指定证书所规定的调整,但须受若干
股东批准的限制所规限。A系列优先股有权按比例分享就本公司
普通股支付的任何股息(按假设转换为普通股的基础),没有投票权,但对指定证书中规定的某些重大事项除外,并具有相当于每股1,000美元的规定价值的清算优先权加上任何应计但未支付的股息。A系列优先股可在任何时候根据公司的选择全部或部分赎回。
该公司还同意将A系列优先股转换后可发行的普通股
纳入提交给证券和交易委员会的下一份转售登记声明中。
所需票数
假设出席特别会议的股东人数达到法定人数,则A系列换股建议的批准需要实际出席或由受委代表出席并有权在特别会议上就此事投票的股东所投的多数赞成票。假设法定人数存在,如果Onconentix股东
未能投票、未能指示其银行、经纪商或其他被提名人就A系列转换方案投票,或
弃权,则不会对A系列转换方案产生任何影响。
ONCONETIX董事会一致
建议ONCONETIX股东投票支持A系列转换方案。
提案3:PMX发行提案
概述
如上所述,公司在PMX交易中发行了2,696,729股B系列优先股。在上述B系列优先股转换后,可发行269,672,900股普通股,前提是本提案获得批准。
关于PMX交易,于2023年12月15日,Onconentix与PMX投资者订立认购协议,以私募5,000,000美元的单位,每个单位包括(I)一股普通股及(Ii)一股预筹资金认股权证,以每股0.001美元的行使价购买0.3股普通股,每单位的总购买价为0.25美元。可向PMX投资者发行额外股份,但前提是PMX投资者继续持有该等单位所包括的普通股,且于成交后270天内的VWAP低于认购协议所载的收购价。如果PMX融资的结束发生在[●],2024,
个单位,包含(I)[●]普通股股份和(Ii)认购权证
[●]如果第4号提案获得批准,普通股可按每股0.001美元的行使价发行。
2024年1月23日,本公司向PMX投资者发行了本金为500万美元的债券
,根据认购协议,支付的款项将抵消单位的总购买价。债券的年利率为4.0%,本金及应计利息须于(I)根据认购协议完成及(Ii)2024年6月30日两者中较早者悉数偿还。此外,认购协议下的500万美元认购金额将增加债券项下应支付的利息金额。
PMX发行提案的目的
根据纳斯达克第5635(A)条,公司就收购另一公司的股票或资产而发行普通股(或可转换为普通股或可行使普通股的证券)之前,如果由于现有或潜在发行普通股,包括根据赚取拨备或类似类型的拨备发行的
股票,或可转换为或可行使普通股的证券,则必须获得股东批准。除公开发行现金外:(A)普通股在发行时具有或将具有相当于或超过发行前已发行投票权的20%的投票权;或可转换为普通股或可行使普通股的证券;或(B)
将发行的普通股数量等于或将等于或超过股票或证券发行前已发行普通股数量的20%。结合在PMX交易中已发行的普通股股份和A系列优先股转换后可发行的普通股,B系列优先股转换后可发行的股份和可在PMX融资中发行的股份将导致于B系列优先股发行和PMX融资认购协议的日期发行超过20%的投票权和
已发行普通股数量。
如果股东在2025年1月1日之前仍未批准PMX发行方案,应持有人提出的现金结算B系列优先股的请求,公司应向该持有人支付的现金金额等于:(I)该请求中所述的B系列优先股的公允价值(定义见下文)乘以(Ii)在向Oncontix递交请求的交易日生效的转换比率(如B系列优先股指定证书中所定义)。股票的“公允价值”应参照普通股在主板交易市场上最后一次报告的收盘价确定。
股东批准是完成PMX融资的一个条件,预计在股东批准发行转换股票后,发行将完成。如果股东不批准PMX发行方案,公司将无法完成PMX融资。
B系列优先股说明
投票。B系列优先股的
股票没有投票权,但以下情况除外:(I)对于选举董事(如下所述),以及(Ii)必须获得作为单一类别的多数股东的赞成票,以(A)对赋予B系列优先股的权力、优先或权利进行不利更改,(B)更改或修订指定证书,或修改或废除Onconestx的公司注册证书或章程的任何规定,或增加任何规定,如果此类行动将不利地改变或改变B系列优先股的优先权、权利、特权或权力,或(Br)为B系列优先股的利益规定的限制,(C)增发B系列优先股或增加或减少(除转换外)B系列优先股的授权股份数量,或(D)授权或创建任何类别或系列股票,或发行任何类别或系列股票,其权力、优先或权利高于B系列优先股。
蛋白质组分
董事。独立投票的多数股东有权选出一(1)名董事股东。
任何按前一句规定当选的董事股东均可经B系列优先股持有者
投赞成票后方可罢免。如果B系列优先股持有人未能选出董事的董事职位,则任何未如此填补的董事职位将一直空缺,直到B系列优先股持有人选出一人填补该董事职位为止;除B系列优先股持有人外,该等董事职位不得由Onconentix的股东填补。在为选举董事的目的而举行的任何会议上,B系列优先股的多数流通股持有人亲自或委派代表出席构成投票该董事的法定人数。
救赎。
B系列优先股的股票不能由Onconentix赎回。
清算
优先。在清算后,B系列优先股的持有人有权从Onconentix的资产中获得相同的金额,无论是资本还是盈余,如果该持有人的B系列优先股按转换比率(定义如下)全部转换为普通股,则B系列优先股持有人将获得相同的金额,外加相当于
宣布但未支付给此类股票的任何股息的额外金额,这笔金额应与所有普通股持有人按同等比例支付。
分红.
B系列优先股的持有者有权获得B系列优先股的股息(按假设转换为普通股的基础),其形式和方式与实际支付普通股的股息(普通股股息除外)相同,当此类股息(普通股形式的股息除外)以普通股支付时。
转换。
股东批准后,B系列优先股的每股股份应按转换比例
转换为转换股份。B系列优先股的所有股份将按以下最后日期的换股比率自动转换为转换
股份:(I)Onconentix已获得股东批准发行所有转换后可发行的普通股,超过截止日期已发行普通股和已发行普通股的20%
及(Ii)Onconentix已根据其公司注册证书授权的普通股数量增加,
达到完成PMX交易所需的程度。
现金结算
。如果在现金结算日之后的任何时间,Onconentix(X)已获得股东批准,但未能
或未能向持有人交付代表转换股份的一张或多张证书,或未能在股东批准日期后的第五个业务
日或之前交付转换股份登记表格(或使其转让代理以电子方式交付此类证据)的账簿文件
,或(Y)未能获得股东批准,则在
情况下,应持有人提出现金结算若干B系列优先股的请求,
向该持有人支付的现金金额等于(I)该请求中提出的B系列优先股的公允价值(定义见下文)乘以(Ii)向Onconentix交付请求的交易日的有效换股比率,
此类付款将在持有人提出请求之日起两(2)个工作日内支付,因此,在Oncontix全额支付后,Onconentix交付该等股份的义务将被解除。股票的“公允价值”
应参照在向Onconentix提交请求的交易日上市的普通股的主要交易市场上最后报告的收盘价确定。
某些调整.
如果Onconentix,在B系列优先股发行期间的任何时间:(A)支付股票股息或以其他方式进行普通股应支付的一次或多次分配;(B)将普通股的已发行股票细分为更多的
股;或(C)将已发行的普通股合并(包括以反向股票拆分的方式)为较少的股份,则转换比率应乘以一个分数,分子为紧接该事件发生后的已发行普通股数量
,分母为紧接该事件发生前的已发行普通股数量(不包括本公司的任何库藏股)。如果在B系列优先股发行期间的任何时间,(A)Onconentix与另一人合并或合并,或向另一人出售股票,或与另一人或与另一人合并的其他业务(交易中,Onconentix是尚存或持续的实体,并在交易生效后持有至少大部分普通股,且其普通股没有交换或转换为其他证券、现金或财产),(B)Oncontix实现任何出售、租赁、在一次交易或一系列相关交易中转让或独家许可其全部或基本上所有资产,(C)任何要约或交换要约(无论是由Onconentix
或其他人)完成,根据该要约或交换要约,超过50%的普通股被交换或转换为其他证券、现金或财产,或(D)Oncontix对普通股或任何强制性股票交换进行任何重新分类,据此普通股有效地转换为或交换其他证券、现金或财产,则,就(A)至(D)中的任何此类交易而言,B系列优先股的持有人在该交易中将获得与普通股持有人在其B系列优先股完全转换为普通股时将获得的相同种类和金额的证券、现金或财产,外加相当于已宣布但未支付给此类股票的任何股息的额外金额,这些金额将在基本PMX交易中与所有普通股持有人按同等比例支付(
“替代对价”)。如果普通股持有者在(A)至(D)中的交易中被给予关于将获得的证券、现金或财产的任何选择,则B系列优先股的持有者应获得与其在该交易中获得的
替代对价相同的选择。
所需票数
假设出席特别会议的股东人数达到法定人数,则批准PMX发行建议需要实际出席或由受委代表出席并有权在特别会议上就此事投票的股东投下多数赞成票。假设法定人数存在,如果Onconentix股东
未能投票、未能指示其银行、经纪人或其他被指定人就PMX发行提案投票,或
弃权,则不会对PMX发行提案产生影响。
ONCONETIX董事会一致
建议ONCONETIX股东投票支持PMX发行提案。
提案
4:审计员批准提案
引言
在……上面[●],董事会建议
股东批准任命EisnerAmper事务所为本公司截至2024年12月31日的财政年度的独立注册会计师事务所
。在这次会议上,我们的股东将被要求批准EisnerAmper
作为我们的独立注册会计师事务所的任命。董事会透过审计委员会直接负责委任本公司的独立注册会计师事务所。董事会不受本次投票结果的约束,但在选择本公司2024财年的独立注册会计师事务所时,将考虑这些投票结果。预计EisnerAmper的代表
不会出席会议。
2023年6月29日,本公司的独立注册会计师事务所Mayer Hoffman McCann P.C.(“MHM”)通知本公司已辞职,自2023年6月29日起生效。
MHM审计了公司截至2022年12月31日和2021年12月31日及截至2021年12月31日的财务报表。MHM对截至2022年12月31日和截至2021年12月31日的财政年度(日期为2023年3月8日)的财务报表的审计报告不包含任何不利意见
或免责声明,也没有对不确定性、审计范围或会计原则进行限制或修改。
在本公司截至2022年及2021年12月31日的财政年度及其后截至2023年7月6日的中期内,本公司与MHM在会计原则或实务、财务报表披露或审计范围或程序等事项上并无分歧,
若不能令MHM满意地解决这些分歧,本会导致MHM参考与该等期间的本公司财务报表审计报告有关的
分歧事项。
在本公司截至2022年和2021年12月31日的财政年度以及随后的截至2023年7月6日的过渡期内,除先前在本公司截至2022年12月31日的财政年度的10-K表格中披露的情况外,并无发生如S法规第304(A)(1)(V)项所界定的“应报告事项”,MHM发现内部控制存在重大缺陷,与缺乏人员有关:(A)为及时处理财务信息而维持最佳的职责分工和提供最佳的监督水平;分析和核算复杂的、非常规的交易,编制财务报表,(B)及时识别、批准或报告相关的交易。该公司正在采取措施补救这些重大弱点。
2023年7月6日,审计委员会任命EisnerAmper为本公司截至2023年12月31日的财政年度及相关过渡期的独立注册会计师事务所。聘请EisnerAmper的决定得到了审计委员会的批准。在本公司最近两个会计年度及其后截至2023年7月6日的过渡期内,本公司并未就S法规第304(A)(2)项所列任何事项或事件征询艾斯纳安珀的意见。
费用
下表显示了截至2023年12月31日的年度内,EisnerAmper提供的专业服务的总费用。
| | |
| |
| 审计费 | |
$ | 778,568 | |
| 审计相关费用 | |
| - | |
| 税费 | |
| - | |
| 所有其他费用 | |
| - | |
| 总费用 | |
$ | 778,568 | |
在上表中,“审计费用”是指为提供与年度合并财务报表审计、中期合并财务报表季度审查相关的服务,以及EisnerAmper通常在该会计期间提供的与监管申报或业务有关的服务而收取的费用。
我们的审计委员会认定,EisnerAmper提供的服务符合保持EisnerAmper作为我们独立注册会计师事务所的独立性。
下表显示了MHM在截至2023年12月31日和2022年12月31日的年度内提供的专业服务的总费用。
| | |
2023 | | |
2022 | |
| 审计费 | |
$ | 208,426 | | |
$ | 633,629 | |
| 审计相关费用 | |
| - | | |
| - | |
| 税费 | |
$ | 11,889 | | |
| 9,975 | |
| 所有其他费用 | |
| - | | |
| - | |
| 总费用 | |
$ | 220,315 | | |
$ | 643,604 | |
在上表中,“审计费”是指提供与审计我们的年度财务报表、季度审查我们的中期财务报表相关的服务的费用,以及通常由MHM提供的与这些会计期间的监管申报或业务有关的服务的费用。“Tax
Fees”由MHM的关联实体为与准备我们的联邦和州纳税申报单相关的服务开出的金额组成。
我们的审计委员会认定,MHM提供的服务
符合保持MHM作为独立注册会计师事务所的独立性。
审批前的政策和程序
我们审计委员会的正式书面章程
要求审计委员会预先批准我们提供的所有审计服务,无论是由我们的主要审计师还是其他事务所提供的服务,以及我们独立注册的会计师事务所向我们提供的所有其他服务(审查、证明和非审计),根据适用的美国证券交易委员会规则批准的最低限度非审计服务除外。
审计委员会已通过了一项预先审批政策,规定了建议由我们的独立注册会计师事务所进行的审计和非审计服务可根据哪些程序和条件进行预先审批。本预先审批政策一般规定,审计委员会不会聘请独立注册会计师事务所提供任何审计、审计相关、税务或许可的非审计服务
,除非该服务是(I)经审计委员会明确批准或(Ii)根据预先审批政策所述的预先审批政策和程序订立的。除非我们的独立注册会计师事务所提供的一种服务已根据预先批准政策获得后者的一般预先批准,否则
它需要审计委员会的具体预先批准。
审计委员会每年审查并通常预先批准本公司的独立注册会计师事务所可能提供的服务(以及相关费用水平或预算金额),而无需事先获得审计委员会的具体预先批准。
审计委员会可根据随后的决定不时修订一般预先批准的服务清单。审计委员会授权其作出预批决定的任何
审计委员会成员必须在审计委员会的下一次预定会议上报告任何此类预批决定。如果出现需要聘请独立注册会计师事务所提供未列入原始预批类别或超出预批金额的额外服务的情况,
审计委员会要求对该等额外服务或该等额外金额进行预先批准。
我们的审计委员会是在首次公开募股完成后成立的
。因此,审计委员会并没有预先批准上述所有服务,尽管在我们的审计委员会成立之前提供的任何服务都得到了我们董事会的批准。自我们的审计委员会成立以来,在未来的基础上,审计委员会已经并将预先批准我们的审计师为我们提供的所有审计服务和允许的非审计服务,包括其费用和条款(受制于在完成审计之前经审计委员会批准的交易所法案中所述的非审计服务的最低限度例外)。
所需票数
假设出席特别会议的股东人数达到法定人数,则核数师批准建议须获得出席的股东所投的多数赞成票,并有权在特别会议上就此事投票。假设法定人数存在,如果Onconentix
股东未能投票,未能指示其银行、经纪人或其他被提名人就审计师批准提案进行投票,
或弃权,则不会对审计师批准提案产生影响。由于这是例行公事,经纪人可以在特别会议上就该提案进行表决,前提是他们没有收到实益所有人的指示。
ONCONETIX董事会一致
建议ONCONETIX股东投票支持审计师批准提案。
提案5:休会提案
如有需要或适当,特别会议可延期至另一个
时间及地点,以便在特别会议时间
没有足够票数批准反向股票分拆建议、A系列转换建议、PMX发行建议或核数师批准建议时,征集额外代表。
本公司要求股东授权
董事会要求的任何委托书的持有人在必要或适当的情况下投票赞成特别会议的任何休会,
如果没有足够的票数批准反向股票拆分方案、A系列转换方案、PMX发行方案或审计师批准方案,则可征集额外的委托书
所需票数
假设出席特别会议的股东人数达到法定人数,
批准休会建议需要实际出席或由受委代表出席并有权在特别会议上就此事投票的股东所投的多数赞成票。假设有法定人数,如果Onconentix股东
未能投票,未能指示其银行、经纪人或其他被提名人就休会提案投票,或放弃投票,则不会对休会提案产生任何影响。
ONCONETIX董事会一致
建议ONCONETIX股东投票支持休会提案。
董事和高管在提案中的利益
截至本委托书发表之日,Onconentix
董事和高管在与其他
其他股东的利益不同或除此之外的提案中没有任何权益,但以下情况除外:
| |
● |
拉尔夫·希斯博士,我们的临时首席执行官兼首席科学官,持有269,749股普通股和195,664股B系列优先股。 |
| |
● |
我们的首席战略官克里斯蒂安·布鲁曼持有236,029股普通股和171,204股B系列优先股。 |
合并后公司的管理
董事及行政人员
下表提供了截至2024年2月14日有关我们的高管和董事的信息:
| 名字 |
|
年龄 |
|
职位 |
| 行政人员及董事 |
|
|
|
|
| Ralph Schiess博士 |
|
45 |
|
临时首席执行官兼首席科学官 |
| 布鲁斯·哈蒙 |
|
65 |
|
首席财务官 |
| 克里斯蒂安·布鲁尔曼 |
|
47 |
|
首席战略官 |
| 非雇员董事 |
|
|
|
|
| 詹姆斯·萨皮尔斯坦 |
|
62 |
|
董事会非执行主席 |
| 西蒙·塔什 |
|
62 |
|
董事 |
| 蒂莫西·拉姆丁 |
|
32 |
|
董事 |
| Thomas Meier,博士 |
|
61 |
|
董事 |
| 阿吉特·辛格 |
|
60 |
|
董事 |
拉尔夫·希斯博士自2023年12月以来一直担任首席科学官,自2024年1月以来一直担任临时首席执行官。Schiess博士在美国和欧洲的世界级学术机构工作了10年,并在诊断行业获得了10多年的经验,成功地开发了从科学原型到商业产品的产品。希斯博士于2010年与人共同创立了Proteomedex,并担任首席执行官至2019年12月,然后在2020年1月至2023年5月担任首席科学官。希斯博士于2023年6月重新担任首席执行官。在他的指导下,Proteomedex确定了在前列腺癌诊断、预后和治疗管理方面具有实用价值的新生物标记物签名。Proteomedex于2023年12月被公司收购后,希斯博士被任命为安康泰克斯的首席科学官,2024年1月,希斯博士被任命为安康泰克斯的临时首席执行官。希斯博士在苏黎世大学获得硕士学位,之后在西雅图系统生物学研究所实习。此后,他获得了瑞士联邦理工学院的博士学位。
布鲁斯·哈蒙在生命科学公司和其他各种行业的财务职位上拥有40多年的经验。哈蒙先生曾担任过各种职务,包括首席财务官、财务总监、首席执行官和审计委员会主席。自2008年以来,他一直通过其公司Lakeport Business Services,Inc.担任独立顾问,并在多家上市公司担任外包CFO
。在此期间,哈蒙先生于2020年至2021年担任Marizyme,Inc.(场外交易代码:MRZM)的首席财务官,2022年担任生物亲和技术公司(纳斯达克:BIAF)的首席财务官,自2017年以来担任戴尔生物科技有限公司的董事首席财务官,自2023年以来担任Patriax Industries
的首席财务官。哈蒙于2023年10月加入Onconentix担任首席财务长。他在筹资、公开发行、并购和扭亏为盈方面拥有丰富的经验。在他职业生涯的早期,他是一个团队的成员,该团队应环境方案的邀请,向联合国代表展示了一种绿色建筑产品。他获得了密苏里州立大学会计学学士学位。
克里斯蒂安·布鲁尔曼自2023年12月以来一直担任首席战略官。他是Proteomedex的首席运营官和联合创始人,Proteomedex于2023年12月被公司收购。Bruühlmann先生共同创立了Proteomedex,并在2010年3月至2018年11月期间担任其首席财务和运营官
。从2018年12月开始,布吕曼先生担任Proteomedex的首席业务官。Bruühlmann先生在生命科学、信息和通信(ICT)和金融行业的公共和私营公司获得了20年的经验。他负责产品管理、业务开发、运营和财务,在Proteomedex从创立到Proclarix推向市场的过程中发挥了重要作用。此前,他曾在瑞士电信市场领先者瑞士电信公司工作,在数字化领域担任多个战略和领导职位。Bruühlmann先生在瑞士苏黎世大学获得工商管理学士和硕士学位,并在美国巴布森学院和瑞士圣加伦大学完成了高管专业培训。
詹姆斯·萨皮尔斯坦自2022年2月以来一直是我们的董事之一,他拥有超过35年的领导、创立、发展和销售医疗保健公司的经验,
特别是在制药领域。萨皮尔斯坦先生现任第一波生物制药公司(纳斯达克:
FWBI)首席执行官兼董事长总裁,自2019年10月以来一直在该公司任职。他的职业生涯始于礼来公司的销售,1996年7月至2000年6月在百时美施贵宝公司晋升为国际营销部门董事
,后来在吉利德科学公司(纳斯达克代码:
GILD)领导威瑞德公司(Tenofovir)的推出,并于2020年6月至2002年6月担任全球营销主管。2006年11月至2011年1月,他担任托比拉治疗公司(纳斯达克代码:TBRA)的创始首席执行官,当时是一家私人公司,后来被艾尔建公司(纽约证券交易所代码:AGN)收购。此后,他于2012年9月至2014年2月担任纳斯达克(Aliqua Biomedical:ALQA)首席执行官,并于2014年3月至2018年10月担任康泰制药(纳斯达克:CTRV)首席执行官
。他参与了近20多个药物产品的推出,具体来说,他要么领导了几个艾滋病毒产品推出的关键成员,要么一直是当时不同新疗法类别的关键成员。此外,萨皮尔斯坦先生自2023年1月以来一直担任ZyVersa治疗公司(纳斯达克代码:ZVSA)的董事会职务,自2018年4月以来一直担任以诺基亚生物科学公司(纳斯达克代码:ENOB)的董事会成员。
他曾于2018年12月至2021年6月担任Marizyme,Inc.(场外交易代码:MRZM)的董事(执行主席),从2016年至2021年领导生物科学
,于2017年2月至2019年2月领导新泽西州的生物制药行业协会,从2014年4月至2020年1月担任RespireRX(纽约证券交易所股票代码:RSPI)
,NanoViricdes Inc.(纽约证券交易所代码:NVC)
。和BWAC从2020年12月开始,直到2021年9月与Clarus的业务合并。他也是BIO的董事会董事成员,该组织是推动医疗保健领域公共政策和网络的领先机构,同时也是卫生科和新兴公司科的董事会成员。Sapirstein先生拥有罗格斯大学的药学学士学位和Fairleigh Dickinson大学的MBA学位。
由于他在医疗保健行业拥有数十年的广泛人脉关系,他完全有资格在我们的董事会任职。Sapirstein先生为我们的董事会带来了在制药和生物技术行业的丰富经验,随着我们继续开发生物技术资产,这些经验对公司来说将是无价的。
Simon Tarsh自2022年8月以来担任我们的董事之一,拥有40多年的财务经验,在英国和美国都有工作。他最近从德勤咨询有限责任公司退休
,在那里他是董事财务和企业绩效实践的高级董事总经理,
自2007年起在那里为全球客户服务。他领导着专注于运营转型的不断增长的全球实践,包括支持美国和印度、中国、东欧和拉丁美洲等国际地点的创业交易、合资企业和混合结构。他在高增长公司全球化的过程中为其金融业务提供支持,并能够为它们的扩张提供建议,同时平衡增长和适当的控制。在2007年移居美国之前,Tarsh先生的咨询职业生涯始于1988年在伦敦的PA Consulting Group,1997年他在那里被选为合伙人,并于2001至2006年间在欧洲建立了ISG的业务流程外包咨询业务。塔什早期的职业生涯是在金融行业,曾在马拉松石油公司和陶氏化学公司工作,在此期间,他取得了特许会计师资格。塔什先生于1981年获得英国曼彻斯特索尔福德大学工商管理学士学位,并于1988年获得英国伦敦城市大学商学院工商管理硕士学位。他是英国特许管理会计师协会(1984)的会员,该协会被视为相当于注册会计师。
塔什先生在德勤咨询有限责任公司15年的丰富财务经验为我们的董事会提供了宝贵的见解,尤其是
考虑到影响上市公司的改进的会计规则和法规。
Timothy Ramdeen自2023年1月以来一直担任我们的董事,他在私募股权和对冲基金投资、资本市场和公司组建方面拥有近十年的经验。自2022年6月以来,Ramdeen先生一直是Dharma Capital Advisors的创始人和管理合伙人,Dharma Capital Advisors是一家专注于早期私人和上市公司的投资和咨询公司。2021年3月至2022年3月,拉姆丁先生是Sixth Borough Capital Management的联合创始人、首席投资官和投资组合经理,该基金是一家专注于私募和公开股票的多阶段、事件驱动型对冲基金。自2022年以来,Ramdeen先生一直是Amplexd Treeutics的联合创始人,Amplexd Treeutics是一家女性健康/生物技术公司,致力于为全球早期宫颈癌和HPV相关癌症提供低成本、有效、安全和可获得的治疗。
Ramdeen先生还担任多家早期公司和投资基金的企业顾问/董事会成员。此前,Ramdeen先生是专注于医疗保健的投资公司Altium Capital Management(“Altium”)的第五位员工,从2019年7月至2021年3月,他担任私人资本市场/特殊情况部门(私下谈判融资、直接投资、事件驱动型多头/空头以及对微型和小盘股公司的私募到公募投资)的唯一投资分析师。在Altium任职期间,Ramdeen先生帮助共同创建了该公司的SPAC和反向并购投资努力,并与生物技术、治疗、医疗保健服务、医疗器械和医疗技术领域的卖方、买方同行以及数百家私营和上市公司建立了广泛的
关系。2017年至2018年,拉姆丁在Brio Capital Management工作,这是一家专注于小型股和微型股的事件驱动型对冲基金。Ramdeen先生在坦普尔大学获得生物学学士学位,在那里他从事神经学、肿瘤学和发育生物学的科学研究。此外,Ramdeen先生还在纽约大学斯特恩商学院获得了金融MBA学位。Ramdeen先生为我们的董事会带来了在资本咨询和公司发展方面的丰富经验,尤其是在生命科学行业和上市公司方面。
Thomas Meier自2024年2月1日以来一直是我们的董事之一,作为生命科学和生物技术企业家、执行经理和董事会成员,他拥有近25年的经验。自2022年6月以来,Meier博士一直担任Santhera PharmPharmticals Holding AG(Six:Sann)的审计和薪酬委员会主席和成员,该公司是一家上市的瑞士专业制药公司,专注于治疗罕见神经肌肉和肺部疾病的创新药物的开发和
商业化。Meier博士自2017年以来一直在Santhera
董事会任职,在担任执行经理15年(过去8年担任CEO)后,于2019年11月辞去公司CEO一职。2020年,Meier博士成为Viopas Venture Consulting GmbH的管理合伙人,这是一家为医疗保健行业提供咨询和咨询的瑞士公司。自2020年以来,Meier博士一直担任Novaremed AG的董事会成员,该公司是一家私人持股的瑞士公司,开发用于管理慢性疼痛和阿片类药物替代品的创新治疗方案。Meier博士自2021年10月以来一直在Novaremed审计委员会任职,并于2024年1月成为该公司的执行主席。自2022年1月起,Meier博士还在Visgenx Inc.(美国)董事会任职。2021年9月,他与他人共同创立了SEAL Treateutics AG,这是一家私有的瑞士基因治疗公司,他也担任该公司的董事长。2020年7月至2021年11月,他担任私人持股的Pharmabiome AG(瑞士)的董事长。
Meier博士拥有生物学博士学位,并在瑞士巴塞尔大学Biozentum担任神经科学讲师。Meier博士
为我们的董事会带来了作为国际公认的科学家的经验,在孤儿疾病的临床研究方面有着良好的记录。
阿吉特·辛格自2024年2月7日起担任我们的董事之一,是硅谷Artiman Ventures的合伙人,专注于早期技术和生命科学投资
管理着超过10亿美元的资产。除了在Artiman投资组合公司的董事会任职外,他还担任过以下公司的董事会成员:专注于肿瘤学和神经学的PET放射性制药公司Sofie Biosciences,自2013年以来专注于放射肿瘤学的Leo癌症护理公司,拥有癌症纳米机械生物标记物的肿瘤学诊断公司ARTIDIS,
以及自2023年以来在护理点诊断领域的Chronus Health。他还在美国癌症研究协会(AACR)基金会董事会任职,该基金会是全球历史最悠久、规模最大的癌症研究组织。辛格博士是斯坦福大学医学院的兼职教授,教授临床诊断学和企业家精神。在过去,辛格博士曾在MAX Healthcare董事会担任董事首席顾问,并担任塔塔信托癌症项目的高级顾问,该项目开发了一个由塔塔集团资助的
“集中计划,本地交付”的癌症护理平台,并通过定制的综合性癌症中心提供该平台。直到2023年,他还在卡迪拉制药公司的董事会任职。在加入Artiman之前,辛格博士是总部位于加利福尼亚州的BioImagene公司的总裁兼首席执行官,该公司专门从事基于人工智能的癌症诊断。BioImagene
于2010年9月被罗氏制药收购。在加入BioImagene之前,辛格博士在西门子任职近20年,先后在美国和德国担任各种职务,最近担任的职务包括西门子肿瘤学公司和西门子数字成像系统公司的全球首席执行官。在过渡到这些高管职责之前,辛格博士在普林斯顿的西门子研究院从事了几年的研发工作,负责人工智能和机器人领域的研究。在此期间,他兼任普林斯顿大学的兼职教员。辛格博士拥有哥伦比亚大学的计算机科学博士学位,锡拉丘兹大学的计算机工程硕士学位,印度瓦拉纳西的印度理工学院(IIT)的电气工程学士学位。
他出版了两本书和大量的参考文章,并拥有五项专利。他的十大书评在每年12月被各种博客和阅读杂志转载。辛格先生为我们的董事会带来了生物技术行业和诊断领域的重要经验,特别是在商业执行能力方面。
董事会与公司治理
一般信息
我们的业务和事务是在董事会的领导下组织的,董事会目前由五名成员组成。我们的董事会分为三类,第一类、第二类和第三类,每一类成员交错任职三年。我们的董事分为三类
如下:
| |
● |
第一类董事是西蒙·塔什和托马斯·迈尔,他们的任期将在我们2025年的年度股东大会上届满; |
| |
● |
第二类董事是詹姆斯·萨皮尔斯坦,他的任期将在我们2026年的年度股东大会上届满;以及 |
| |
● |
第三类董事是蒂莫西·拉姆丁和阿吉特·辛格,他们的任期将在我们2024年年度股东大会上届满。 |
本公司经修订及重订的公司注册证书及经修订及重订的附例规定,经修订及重订的董事人数只可由董事会决议
更改。我们的董事任期至去世、辞职、免职或丧失资格中的较早者,或其继任者当选并获得资格为止。我们的董事会没有关于首席执行官和董事会主席的角色是否应该分开的正式政策。董事会的主要职责是向管理层提供监督、战略指导、咨询和指导。
我们没有关于董事会多样性的正式政策。在选择董事会成员时,我们的首要任务是确定将通过其专业成就、为董事会成员之间的协作文化做出积极贡献的能力、对我们业务的了解和对竞争格局的了解来促进我们股东利益的成员
。
董事及行政人员的资格
我们相信,我们董事的集体技能、经验和资质为我们的董事会提供了促进股东利益所需的专业知识和经验
。在遴选董事时,董事会会考虑具备提升董事会组成的资格和专业知识的候选人。董事的被提名者将根据领导经验、知识、
技能、专业知识、正直、多样性、进行独立分析调查的能力、对公司业务环境的了解以及是否愿意投入足够的时间和精力履行董事会的职责来挑选。提名和公司治理委员会
可能需要某些技能或特质,如财务或会计经验,以满足董事会不时出现的特定需求,并将考虑其成员的整体经验和构成,以获得广泛和多样化的董事会成员组合。我们
认为,我们的董事应该具有最高的职业和个人道德和价值观,与我们长期的价值观和标准保持一致
。他们应该在商业决策层面拥有丰富的经验,致力于提高股东价值,并有足够的时间履行自己的职责,并根据过去的经验提供洞察力和实践智慧。
管理局辖下的委员会
我们的董事会设立了三个常设委员会-审计、薪酬和提名以及公司治理-每个委员会都根据我们董事会通过的章程运作。每个委员会章程的副本都张贴在我们网站的“投资者关系”部分,网址是:Https://onconetix.com/corporate-governance/governance-overview。每个委员会的组成和职责说明如下。我们的董事会可能会不时成立其他委员会。
审计委员会
我们的审计委员会(“审计委员会”)由委员会主席西蒙·塔什、蒂莫西·拉姆丁和詹姆斯·萨皮尔斯坦组成。我们的董事会已经确定我们的审计委员会的每一名成员都符合纳斯达克商城规则和美国证券交易委员会的独立性要求。除其他事项外,该委员会的职能包括:
| ● | 评估我们独立审计师的业绩、独立性和资格,并决定是保留我们现有的独立审计师还是聘用新的独立审计师; |
| ● | 审查和批准聘用我们的独立审计师执行审计服务和任何允许的非审计服务; |
| ● | 审查我们的年度和季度财务报表和报告,包括“管理层对财务状况和经营结果的讨论和分析”标题下的披露,并与我们的独立审计师和管理层讨论报表和报告; |
| ● | 与我们的独立审计师和管理层一起审查与会计原则和财务报表列报有关的重大问题,以及与我们财务控制的范围、充分性和有效性有关的事项。 |
| ● | 根据公司政策,审查和批准适用规则和法规所界定的任何关联方交易 |
| ● | 审查我们的主要财务风险敞口,包括管理实施风险评估和风险管理的流程的指导方针和政策;
和 |
| ● | 每年审查和评估审计委员会的业绩,包括审计委员会遵守其章程的情况。 |
董事会认定,
西蒙·塔什符合适用美国证券交易委员会法规所指的“审计委员会财务专家”资格,并符合“纳斯达克商城规则”对财务精细化的要求。在作出这一决定时,董事会考虑了塔什先生丰富的财务经验和商业背景。我们的独立注册会计师事务所和管理层都会定期与我们的审计委员会私下会面。
薪酬委员会
我们的薪酬委员会
(“薪酬委员会”)由委员会主席詹姆斯·萨皮尔斯坦、西蒙·塔什和蒂莫西·拉姆丁组成。
我们的董事会已经确定,我们薪酬委员会的每位成员都是董事的外部成员,这是根据修订后的1986年美国国税法或该准则
至第162(M)节的定义,并符合纳斯达克商城规则的独立性
要求。除其他外,该委员会的职能包括:
| ● | 审查、修改和批准我们的整体薪酬战略和政策(或如果它认为合适,向董事会全体成员提出建议); |
| ● | 审查和批准薪酬、与薪酬相关的绩效目标和目的,以及其他高管的聘用条件; |
| ● | 审查和批准(或
如果合适,向全体董事会建议)我们建议的股权激励计划、薪酬计划和类似计划,以及修改、修改或终止现有的计划和计划; |
| ● | 审查和批准任何雇佣协议、遣散费安排、控制权保护变更和任何其他高管补偿安排的条款; |
| ● | 与管理层一起审查并批准我们在提交给美国证券交易委员会的定期报告或委托书中“薪酬讨论和分析”项下的披露
;以及 |
| ● | 准备美国证券交易委员会在我们的年度委托书中要求的报告。 |
提名和公司治理委员会
我们的提名和公司治理委员会(“提名委员会”)由委员会主席Timothy Ramdeen、James Sapirstein和Simon Tarsh组成。我们的董事会已经确定,该委员会的每一名成员都满足纳斯达克商城规则独立性
的要求。除其他外,该委员会的职能包括:
| ● | 根据董事会批准的标准确定、审查和评估进入董事会的候选人; |
| ● | 评估董事在董事会和适用委员会的业绩,并确定是否适合继续在我们的董事会任职; |
董事会领导结构
我们的董事会可以
自由选择董事会主席和首席执行官,并在选择时以符合公司最佳利益的方式
选择。目前,拉尔夫·希斯博士担任我们的临时首席执行官。我们董事会的五名成员都被董事会认为是“独立的”。
我们的董事会,作为一个整体和委员会层面,在监督我们风险的全面管理方面发挥着积极的作用。我们的审计委员会与我们的管理层和我们的独立注册会计师事务所一起审查与财务和运营项目相关的风险。我们的董事会与我们的首席执行官保持定期联系,首席执行官直接向董事会报告,并监督
日常风险管理。
董事会在风险监督过程中的作用
我们面临许多风险,包括在本委托书中其他地方包含的标题
“风险因素”下描述的风险。我们的董事会认为,风险管理是制定、更新和执行我们的业务战略的重要组成部分。我们的董事会对可能影响公司战略、业务目标、合规、运营以及财务状况和业绩的风险负有监督责任
。我们的董事会将监督重点放在我们面临的最重大风险以及我们的流程上,以识别、确定、评估、管理和缓解这些风险。我们的董事会定期收到高级管理层成员关于我们面临的重大风险领域的报告,包括战略、运营、财务、法律和监管风险。虽然我们的董事会
有监督作用,但管理层主要负责管理和评估风险,并实施
流程和控制,以减轻其对我们的影响。
我们的董事会通常负责在与我们的活动相关的审查和审议中监督公司风险。我们的主要风险来源分为两类:金融和产品商业化。我们的审计委员会监督财务风险的管理;我们的董事会定期
审查关于我们的现金状况、流动性和运营的信息,以及与每个相关的风险。董事会定期
审查与我们的产品供应、增长和战略相关的计划、结果和潜在风险。我们的薪酬委员会监督
风险管理,因为它与我们针对包括高管和董事在内的所有员工的薪酬计划、政策和做法有关,
尤其是我们的薪酬计划是否会激励我们的员工承担过高或不适当的风险,
可能会对我们的公司产生实质性的不利影响。
科学顾问委员会
2020年1月,我们正式成立了科学顾问委员会,就我们的临床和法规开发计划以及其他惯例事项向我们的管理层提供建议。我们的科学顾问是各个医学领域的专家,包括理论流行病学、疫苗研发和生物技术。
商业行为和道德准则
我们已经通过了适用于我们的董事、高级管理人员和员工的书面商业行为和道德准则,包括我们的首席执行官、首席财务官、首席会计官或财务总监,或执行类似职能的人员。商业行为和道德准则在我们的网站上发布,网址为Www.onconetix.com。我们希望法律或纳斯达克商城规则
要求对代码的任何修改或豁免都将在我们的网站上公布。
内幕交易政策
2023年12月1日,我们通过了针对董事、高级管理人员和员工购买、出售和/或其他证券处置的内幕交易政策和程序,旨在促进遵守内幕交易法律、规则和法规以及适用的纳斯达克上市标准。
合并后公司的证券说明
根据我们修订后的公司注册证书,我们的法定股本包括250,000,000股普通股和10,000,000股优先股,每股面值0.00001美元。
普通股
我们的普通股在纳斯达克资本市场上市,代码为“ONCO”。
根据我们修订和重新注册的公司证书的条款,我们普通股的持有者有权就提交给股东投票的所有事项(包括董事选举)每持有一股普通股投一票,而不具有累积投票权。普通股流通股持有者有权
从合法可用于支付股息的资产或资金中获得股息,股息的支付时间和金额由我们的董事会
不时决定。我们的普通股不享有优先购买权,也不受转换或赎回的影响。在本公司清算、解散或清盘时,可合法分配给股东的资产
在支付清算优先权(如果有的话)后按比例在本公司普通股持有人之间分配,以支付任何未偿还的债权人其他债权付款
。普通股持有人的权利、优先和特权受我们未来可能指定和发行的任何系列优先股的股东权利的制约,并可能受到不利影响
。
优先股
根据我们修订和重新发布的公司注册证书的条款,我们的董事会被授权在不需要股东采取进一步行动的情况下,建立一个或多个类别或系列,并确定公司未指定股本的相对权利和偏好。
A系列优先股和B系列优先股的条款摘要载于标题为“建议2:A系列转换建议“
和”提案3:PMX发行提案,分别是。
特拉华州法的反收购效力与我国《公司注册证书》和《公司章程》的修订和修订
特拉华州法律的某些条款、我们修订和重新发布的公司注册证书以及我们修订和重新发布的章程可能禁止或推迟合并或其他收购或更改控制权的尝试,因此可能会阻止收购我们的尝试,即使此类交易可能为我们的股东提供以高于当前市场价格的价格出售其股票的机会。
以下概述的这些规定旨在
阻止强制收购行为和不充分的收购报价。这些规定还旨在鼓励寻求获得我们控制权的人首先与我们的董事会谈判。我们相信,加强保护我们与收购或重组我们的不友好或主动提议的提倡者进行谈判的潜在能力的好处超过了阻止这些提议的缺点
因为谈判这些提议可能会导致其条款的改善。
特拉华州反收购法规
我们受特拉华州公司法第203条的约束,该条款禁止被视为“有利害关系的股东”的人在这些人成为有利害关系的股东之日起三年内与特拉华州的一家上市公司进行“业务合并”,除非该业务合并或此人成为有利害关系的股东的交易已按规定的
方式批准或适用其他规定的例外情况。一般而言,“有利害关系的股东”是指在确定有利害关系的股东身份之前,或在确定有利害关系的股东身份之前的三年内,与关联公司及联营公司一起拥有公司15%或更多有表决权股票的人。一般而言,“企业合并”包括合并、出售资产或股票或其他交易,从而为利益相关的股东带来经济利益。这一规定的存在可能对未经董事会事先批准的交易具有反收购效力。
论坛的选择
我们修订和重申的公司注册证书规定,除非我们在法律允许的最大范围内以书面形式同意替代法院,否则以我们的名义提起的衍生诉讼、针对董事、高级管理人员和员工的违反受托责任的诉讼和某些其他诉讼只能在特拉华州衡平法院提起。但下列诉讼除外:(A)特拉华州衡平法院裁定
存在不受衡平法院管辖的不可缺少的一方(且不可缺少的一方在作出该裁决后十天内不同意由衡平法院对其进行属人管辖),(B)属于衡平法院以外的法院或法院的专属管辖权,或(C)衡平法院没有管辖权的标的
。如果诉讼在特拉华州以外提起,提起诉讼的股东将被视为同意向该股东的律师送达诉讼程序。尽管我们认为这一条款对我们有利,因为它在适用的诉讼类型中提供了更多的法律适用一致性,但法院可能会裁定这一条款不可执行,并且在可执行的范围内,该条款可能会阻止针对我们的董事和高级管理人员的诉讼。
我们修订和重申的公司注册证书
规定,除某些例外情况外,排他性论坛条款将在适用法律允许的最大范围内适用。
《交易法》第27条规定,为执行《交易法》或其下的规则和法规所产生的任何义务或责任而提起的所有诉讼,均享有联邦专属管辖权。因此,专属法院条款不适用于为执行《交易法》规定的任何义务或责任或联邦法院拥有专属管辖权的任何其他索赔而提起的诉讼。
此外,我们修订和重新修订的公司注册证书规定,除非我们书面同意选择替代法院,否则在法律允许的最大范围内,美国联邦地区法院应在法律允许的最大范围内成为解决根据《证券法》或其颁布的规则和法规提出诉因的任何投诉的独家
法院。然而,我们注意到,对于法院是否会执行这一条款存在不确定性,投资者不能放弃遵守联邦证券法及其下的规则和法规。证券法第22条规定,州法院和联邦法院对为执行证券法或证券法下的规则和条例所产生的任何义务或责任而提起的所有诉讼享有同时的管辖权。
转会代理和注册处
我们普通股的转让代理和登记机构为大陆股票转让信托公司。转移代理的地址是道富大街1号,30号这是纽约,邮编:10004。
上市
我们的普通股在纳斯达克资本市场上交易,交易代码为“ONCO”。
受益的证券所有权
下表列出了有关我们普通股所有权的某些信息,涉及:(I)我们所知的每一个人或一组关联人,
我们普通股超过5%的实益拥有人;(Ii)我们的每一位董事;(Iii)我们每一位被点名的高管;以及(Iv)我们所有现任董事和高管作为一个群体。
适用百分比所有权
基于截至2024年2月5日的22,061,746股已发行普通股。我们已根据
美国证券交易委员会规则确定实益所有权。这些规则一般将证券的实益所有权归于对此类证券拥有单独或共同投票权或投资权的人。此外,根据此类规则,我们认为普通股流通股
受制于该人持有的期权、限制性股票或认股权证,目前可在2024年2月5日起60天内行使或行使。然而,为了计算任何其他
人的所有权百分比,我们并未将该等股份视为已发行股份。除以下脚注所示外,我们认为,根据向我们提供的信息,下表中名为
的实益所有人对他们实益拥有的我们普通股的所有股份拥有唯一投票权和投资权,但受适用的社区财产法的约束。
| | |
所持普通股股份 | |
| 实益拥有人姓名或名称及地址(1) | |
股份数量 | | |
百分比 | |
| 行政人员及董事 | |
| | |
| |
| Ralph Schiess博士 | |
| 269,749 | (2) | |
| 1.2 | % |
| 布鲁斯·哈蒙 | |
| 14,787 | (3) | |
| * | |
| 克里斯蒂安·布鲁尔曼 | |
| 236,029 | (4) | |
| 1.1 | % |
| 西蒙·塔什 | |
| 4,073 | (5) | |
| * | |
| 蒂莫西·拉姆丁 | |
| 2,386 | (6) | |
| * | |
| 詹姆斯·萨皮尔斯坦 | |
| 28,555 | (7) | |
| * | |
| 托马斯·迈尔 | |
| - | | |
| - | |
| 阿吉特·辛格 | |
| - | | |
| - | |
| | |
| | | |
| | |
| 所有董事和指定的执行干事为一组(7人) | |
| 555,579 | | |
| 2.5 | % |
| 5%的股东 | |
| | | |
| | |
| 约瑟夫·埃尔南德斯 | |
| 2,650,351 | (8) | |
| 12.0 | % |
| Altos Venture AG | |
| 1,103,403 | (9) | |
| 5.0 | % |
| 美国金融集团。 | |
| 1,440,927 | (10) | |
| 6.5 | % |
| (1) |
除非另有说明,否则下列实体或个人的营业地址为:C/o Onconentix,Inc.,201 E.Five Street,Suite1900,Cincinnati,Ohio 45202。 |
| (2) |
由269,749股普通股组成。 |
| (3) |
由14,787股普通股标的期权组成,目前可在2024年2月5日起60天内行使。 |
| (4) |
由236,029股普通股组成。 |
| (5) |
由4,073股普通股基础期权组成,目前可在2024年2月5日起60天内行使。 |
| (6) |
由2,386股普通股标的期权组成,目前可在2024年2月5日起60天内行使。 |
| (7) |
由28,555股普通股标的期权组成,目前可在2024年2月5日起60天内行使。 |
| (8) |
根据2023年2月14日提交给美国证券交易委员会的13G时间表。的主要营业地址埃尔南德斯先生是俄亥俄州辛辛那提45202号辛辛那提第五街东201号Suite 1900的C/o Onconentix,Inc. |
| (9) |
根据2023年12月28日提交给美国证券交易委员会的附表13D。的主要营业地址Altos Venture AG的地址是Obertorweg 64,CH-4123 Allschwil/Swiss。 |
| (10) |
根据2024年1月26日提交给美国证券交易委员会的13G/A时间表。AFG的主要业务地址是俄亥俄州辛辛那提东四街301号,邮编:45202。 |
股东提案
任何打算在Onconentix 2024年年会上提交并考虑纳入Onconentix代理材料的股东提案必须在Onconentix
收到或之前收到[●],2024年。请注意:俄亥俄州辛辛那提45202号辛辛那提第五街201 E号首席财务官布鲁斯·哈蒙此类提议还必须符合《交易法》中有关股东提议的规则14a-8所规定的其他要求和程序。
代理材料的入库
美国证券交易委员会规则允许公司和中介机构(如经纪人)通过向两个或多个股东发送一份委托书或一份发给这些股东的通知,来满足有关两个或多个股东共享同一地址的委托书和通知的交付要求。这一过程通常被称为“家务管理”,为公司节省了成本。
Onconentix之前曾对登记在册的股东采用家庭持股
。因此,拥有相同地址和姓氏的股东只能从Onconentix收到本委托书的一份副本。注册股东(以其名义直接向Onconentix的转让代理持有股份的股东)
可以选择退出家庭控股,并通过向以下地址的Onconentix发送书面请求来获得单独的委托书或其他代理材料。
有些经纪人还提供家庭代理材料,向共享同一地址的多个股东发送一份委托声明或通知,除非
受影响的股东有相反的指示。一旦您从您的经纪人那里收到通知,它们将是您地址的房屋托管材料,房屋托管
将继续,直到您收到其他通知或直到您撤销您的同意。如果您在任何时候不再希望参与房屋托管,而希望收到单独的委托书或通知,或者如果您的家庭收到这些
文件的多份副本,并且您希望要求未来的递送仅限于一份副本,请通知您的经纪人。
欲索取本委托书的其他副本,请发送至:俄亥俄州辛辛那提市第五街201 E号,Suite1900,俄亥俄州辛辛那提,邮编:45202,收件人:首席财务官布鲁斯·哈蒙。
在那里您可以找到更多信息
我们通过引用将我们向美国证券交易委员会提交的某些文件合并到此委托书中,这意味着我们可以通过向您推荐
这些文件来向您披露重要信息。通过引用并入的文件中的信息被视为本委托书的一部分。我们
已向美国证券交易委员会提交了以下文件,这些文件自各自的提交日期起通过引用并入本文。
| |
(i) |
我们于2023年3月9日向美国证券交易委员会提交的截至2022年12月31日的财政年度Form 10-K年度报告; |
| |
|
|
| |
(Ii) |
我们向美国证券交易委员会提交的截至2023年3月31日的季度报告;截至2023年6月30日的季度报告;截至2023年10月20日提交给美国证券交易委员会的季度报告;以及截至2023年9月30日提交给美国证券交易委员会的季度报告; |
| |
|
|
| |
(Iii) |
2023年1月17日、2023年3月29日、2023年4月20日、2023年4月24日、2023年6月6日、2023年6月14日、2023年7月6日(三份当前报告)、2023年7月11日、2023年7月21日、2023年7月25日、2023年7月31日(两份当前报告)、2023年8月1日、2023年8月3日、2023年8月10日、2023年8月22日、2023年8月28日、2023年8月22日、2023年9月8日、2023年9月22日、2023年10月3日、2023年10月10日、2023年10月18日、2023年11月2日、2023年12月2023年12月21日、2023年12月27日、2023年12月28日、2024年1月12日、2024年1月19日、2024年1月29日、2024年2月12日和2024年2月13日。 |
| |
|
|
| |
(Iv) |
根据交易法第12节登记的我们证券的描述,作为截至2021年12月31日的10-K表格年度报告中的附件4.2,于2022年3月31日提交给美国证券交易委员会。 |
本委托书中包含或被视为通过引用方式并入的文件中包含的任何陈述应被视为修改、取代或替换本委托书
中包含的陈述,只要本委托书或随后提交的也被视为通过引用并入本委托书中的任何文件中的陈述修改、取代或替换了该陈述。任何如此修改、取代或替换的陈述不应被视为本委托书的一部分,除非被如此修改、取代或替换。除相关文件另有明文规定外,吾等在当前任何8-K表格报告第2.02或7.01项下披露的、或在第
9.01项下提供或作为证据包括在其中的任何相应信息(吾等可能不时向美国证券交易委员会提供的任何信息)均不会以引用方式并入或以其他方式包括在本委托书中。除前述规定外,本委托书中出现的所有信息
全部由通过引用并入的文件中出现的信息限定。
您可以口头或
书面要求提供这些文件的副本,这些文件将免费提供给您(除展品外,除非此类展品被特别纳入作为参考),方法是联系Onconentix,Inc.的Bruce Harmon,C/O,地址:俄亥俄州辛辛那提,辛辛那提,第五街201 E,Suite 1900,邮编:45202。
我们的电话号码是(513)6204101。有关我们的信息也可在我们的网站上获得,网址为http://www.onconetix.com.然而,我们网站上的
信息不是本委托书的一部分,不作为参考并入。
附件A
反向股票拆分修正案
修改证书
注册证书的
ONCONETIX,Inc.的
Onconentix,Inc.是一家根据特拉华州法律组织和存在的公司(以下简称公司),特此证明如下:
1.本公司的名称为Onconentix,Inc.
2.对公司注册证书
进行修改,在第四条D节末尾增加以下新款:
6.备案生效后
(“有效时间“)根据《特拉华州公司法》修订的公司注册证书的本修正案,每个[*1] ([*])在紧接生效时间之前发行的普通股股份(“旧普通股应重新分类并合并为一股有效发行、缴足股款的公司普通股和不可评估的普通股,每股面值0.001美元(新普通股)、
而无需持有者采取任何行动(反向拆分股票“)。不得因反向股票拆分而发行新普通股的零碎股份
,取而代之的是,在账簿入账位置
生效时间之后退回时,任何本来有权因反向股票拆分而获得新普通股零碎股份的人
,在生效时间
之后,应有权获得现金支付,相当于该持有人本来有权获得的新普通股份额
乘以纳斯达克股票市场有限责任公司新普通股在生效时间前一天收盘时的收盘价
。此前代表旧普通股的每个账簿记账位置此后应
代表新普通股的股份数量,该账簿记账位置
所代表的旧普通股股份将被重新分类和合并为新普通股;前提是,每个持有表示旧普通股股份
的账簿记账位置的人将获得一个新的账簿记账位置,证明并代表该人根据上述重新分类和合并有权获得的新普通股股份数量。
3.本修订证书已由公司董事会和股东根据特拉华州《公司法总则》第242条正式通过。
4.本《修改证书》自东部时间上午9时起生效。[__], 202[__].
兹证明,本修订证书已于以下日期起以其公司名义正式签立[__]年第9日[__], 202[__].
附件B
换股协议
执行
版本
保密
(&C)
股票
交换协议
由
和其中
蓝水生物技术有限公司,
PROTEOMEDIX
AG,
THOMAS
MEIER作为卖方代表,
和
Proteomedix AG的
股东在此命名,
日期
截至2023年12月15日
目录表
| |
页面 |
| 第一条
股份交换 |
2 |
| 1.1. |
交换公司股份。 |
2 |
| 1.2. |
交换对价 |
2 |
| 1.3. |
交回公司证券及支付
交换对价 |
2 |
| 1.4. |
公司可转换证券的处理 |
3 |
| 1.5. |
卖方同意 |
3 |
| 1.6. |
某些协议的终止 |
3 |
| |
|
|
| 第二条.
结束 |
3 |
| 2.1. |
结业 |
3 |
| 2.2. |
买方义务的条件 |
4 |
| 2.3. |
公司的义务的条件 |
5 |
| |
|
|
| 第三条买方的陈述和保证 |
5 |
| 3.1. |
组织和地位 |
5 |
| 3.2. |
授权;有约束力的协议 |
6 |
| 3.3. |
政府审批 |
6 |
| 3.4. |
不违反规定 |
6 |
| 3.5. |
大写 |
7 |
| 3.6. |
附属公司 |
7 |
| 3.7. |
美国证券交易委员会备案文件和买方财务报告 |
8 |
| 3.8. |
未作某些更改 |
9 |
| 3.9. |
遵守法律 |
9 |
| 3.10. |
许可证 |
9 |
| 3.11. |
诉讼 |
9 |
| 3.12. |
材料合同 |
10 |
| 3.13. |
知识产权 |
11 |
| 3.14. |
税项及报税表 |
13 |
| 3.15. |
不动产 |
15 |
| 3.16. |
个人财产 |
15 |
| 3.17. |
资产的所有权和充分性 |
16 |
| 3.18. |
员工事务 |
16 |
| 3.19. |
福利计划 |
17 |
| 3.20. |
环境问题。 |
18 |
| 3.21. |
与关联人的交易 |
19 |
| 3.22. |
《投资公司法》 |
19 |
| 3.23. |
发现者和经纪人 |
19 |
| 3.24. |
某些商业惯例 |
20 |
| 3.25. |
商业保险 |
20 |
| 3.26. |
顶级供应商 |
20 |
| 3.27. |
独立调查 |
21 |
| |
|
|
| 第四条。公司的陈述和保证 |
21 |
| 4.1. |
组织和地位 |
21 |
| 4.2. |
授权;有约束力的协议 |
22 |
| 4.3. |
大写 |
22 |
| 4.4. |
附属公司 |
23 |
| 4.5. |
政府审批 |
23 |
| 4.6. |
不违反规定 |
24 |
| 4.7. |
财务报表 |
24 |
| 4.8. |
未作某些更改 |
25 |
| 4.9. |
遵守法律 |
25 |
| 4.10. |
许可证 |
25 |
| 4.11. |
诉讼 |
26 |
| 4.12. |
材料合同 |
26 |
| 4.13. |
知识产权 |
28 |
| 4.14. |
税项及报税表 |
29 |
| 4.15. |
不动产 |
32 |
| 4.16. |
个人财产 |
32 |
| 4.17. |
资产的所有权和充分性 |
32 |
| 4.18. |
员工事务 |
33 |
| 4.19. |
福利计划 |
34 |
| 4.20. |
环境问题 |
35 |
| 4.21. |
与关联人的交易 |
35 |
| 4.22. |
商业保险 |
36 |
| 4.23. |
顶级客户和供应商 |
36 |
| 4.24 |
某些商业惯例。 |
37 |
| 4.25 |
《投资公司法》。 |
37 |
| 4.26. |
发现者和经纪人。 |
37 |
| 4.27. |
没有子公司。 |
37 |
| 4.28. |
提供的信息。 |
38 |
| 4.29. |
独立调查 |
38 |
| |
|
|
| 第v条卖方的陈述和保证 |
38 |
| 5.1. |
组织和地位 |
38 |
| 5.2. |
授权;有约束力的协议 |
38 |
| 5.3. |
所有权 |
39 |
| 5.4. |
政府审批 |
39 |
| 5.5. |
不违反规定 |
39 |
| 5.6. |
不打官司 |
39 |
| 5.7. |
投资申述 |
40 |
| 5.8. |
发现者和经纪人 |
40 |
| 5.9. |
提供的信息 |
40 |
| 5.10. |
独立调查 |
41 |
| |
|
|
| 第六条当事人的其他协议 |
41 |
| 6.1. |
访问和信息 |
41 |
| 6.2. |
诉讼支持 |
41 |
| 6.3. |
禁止交易 |
42 |
| 6.4. |
努力 |
42 |
| 6.5. |
进一步保证 |
42 |
| 6.6. |
转换前的业务行为 |
42 |
| 6.7. |
买方公开文件 |
45 |
| 6.8. |
注册声明 |
45 |
| 6.9. |
纳斯达克控制权变更应用 |
47 |
| 6.10. |
公告 |
47 |
| 6.11. |
机密信息 |
48 |
| 6.12. |
关闭后的董事会和执行干事 |
48 |
| 6.13. |
董事及高级职员的弥偿;尾部保险 |
49 |
| 6.14. |
转让税 |
49 |
| 6.15. |
税务事宜 |
49 |
| 6.16. |
第16条有关事宜 |
49 |
| 6.17. |
交付经审计的公司财务
报表 |
50 |
| 6.18. |
公司股票期权的交换 |
50 |
| 6.19. |
CFIUS |
51 |
| |
|
|
| 第七条.
生存 |
52 |
| 7.1 |
生死存亡 |
52 |
| 7.2. |
转换调整 |
52 |
| 7.3. |
卖方赔偿 |
53 |
| 7.4. |
独家补救措施 |
55 |
| 7.5. |
共享托管 |
55 |
| |
|
|
| 第八条。放弃和免除 |
56 |
| 8.1. |
释放和不起诉的约定 |
56 |
| |
|
|
| 第九条:杂项 |
56 |
| 9.1 |
通告 |
56 |
| 9.2. |
约束效果;赋值 |
57 |
| 9.3. |
第三方 |
57 |
| 9.4. |
管辖法律;管辖权 |
58 |
| 9.5. |
放弃陪审团审讯 |
58 |
| 9.6. |
特技表演 |
58 |
| 9.7. |
可分割性 |
58 |
| 9.8. |
修正案 |
59 |
| 9.9. |
豁免 |
59 |
| 9.10. |
完整协议 |
59 |
| 9.11. |
释义 |
60 |
| 9.12. |
同行 |
60 |
| 9.13. |
卖方代表 |
60 |
| |
|
|
| 第十条。
定义 |
61 |
| 10.1. |
某些定义 |
61 |
| 10.2. |
章节参考文献 |
70 |
展品索引
| 展品 |
描述 |
| |
|
| 附件A |
锁定协议的格式 |
| 附件B |
竞业禁止及竞业禁止协议的格式 |
| 附件C |
支持协议的格式 |
| 附件D |
乙类指定证书的格式 |
| |
|
| 附件一 |
卖主 |
股票
交换协议
本
换股协议(此“协议于2023年12月15日由(I)Proteomedex AG,一家瑞士公司(The公司“),(Ii)Blue Water Biotech,Inc.,特拉华州的一家公司(”买者),(Iii)本合同附件一所列已发行股本或公司可转换证券(公司股票期权除外)的每一位持有人(统称为卖主)和(Iv)Thomas Meier,根据本协议的条款和条件以卖方代表的身份卖家代表
与卖方和本公司一起,卖方当事人“)。本公司、买方、卖方代表和卖方有时在本文中被单独称为聚会
,作为整体,各方“。”此处使用的大写术语和未作其他定义的术语应具有本合同第十条中赋予该术语的相应含义。
独奏会:
鉴于,
卖方合计拥有公司已发行和未偿还的100%股权;
鉴于,在本协议规定的条款和条件的约束下,买方希望从卖方购买,卖方希望向买方出售所有已发行和已发行的公司股票,以换取买方新发行的普通股和新发行的
优先股,符合本协议规定的条款和条件(“股票交易所
及本协议预期的其他交易,交易记录”);
鉴于,
双方希望在交易后:(I)卖方将拥有买方已发行和流通股的大部分
普通股(定义见下文),按紧接交易结束(定义见下文)前买方已发行和已发行普通股的数量计算,以及(Ii)买方将拥有公司已发行和已发行股本的100%;
鉴于,
在签署和交付本协议的同时,(A)卖方正在与买方
和公司签订锁定协议,其形式为本协议附件A(“禁售协议),这些锁定协议将自成交时起生效,并规定卖方不得从成交之日起转让普通股(定义如下)
和优先股(定义如下),直至(6)股东批准之日起6个月,以及(B)拉尔夫·希斯博士和克里斯蒂安·布鲁尔曼(合计,管理层股东)签订了以买方和公司为受益人的竞业禁止和竞业禁止协议,其格式为附件B(
)竞业禁止协议和竞业禁止协议“),哪些竞业禁止协议和竞业禁止协议应自终止之日起生效;
鉴于,
买方董事会(“买方董事会“)已确定(A)订立本协议并完成交易是公平、可取的,符合买方及其股东的最大利益,(B)批准买方签署、交付和履行本协议并完成交易,所有这些都符合本协议中规定的条款和条件,(C)决定在为此目的而召开和举行的买方股东特别会议上,建议买方股东投票赞成批准事项;以及
鉴于,
本公司董事会已(A)确定订立本协议及完成该等交易对本公司及其股东是公平、明智及最有利的,并(B)批准本公司签署、交付及履行本协议及完成该等交易,一切均按本协议所载的条款及条件进行
。
现在,
因此,考虑到上述前提和本协议中所包含的陈述、保证、契诺和协议,并出于其他良好和有价值的代价,在此确认这些代价的收据和充分性,并打算在此受到法律约束,本协议双方同意如下:
文章
i
股票交易所
1.1公司股份的交换。在成交时,根据本协议的条款并在符合本协议的条件下,卖方应
向买方出售、转让和交付,买方应从卖方购买、收购并接受本公司所有已发行和未偿还的股权(统称为购入股份“),免除所有
留置权(适用证券法规定的留置权和买方产生的留置权除外)。
1.2交换对价。
(A)
在成交时,买方应根据本协议的条款并在符合本协议条件的情况下,全额支付所购买的股份,
买方应发行并登记:(I)以本协议附件一所列公司债权人的名义(“公司
债权人“)买方普通股和买方优先股的股份数列于每个公司债权人的名称(”债权股份),及(Ii)以卖方名义持有买方普通股的股份数目
(普通股“)和买方优先股的股份数量(”优先股
连同普通股和债权股,交易所股票“)列于本合同附件一与卖方名称相对的位置。截至收盘时,交易所股票的总价值应相当于7500万美元(7500万美元)(“交换对价“)减去在紧接收市前可行使公司购股权的公司股份价值及减去债权股份的价值。根据本协议的条款,每股公司
将有权获得一定数量的交换股份。
换股后,每名卖方将不再拥有本公司的任何其他权利。
(B)
优先股应享有指定证书中所列的权利、优惠和特权,该证书的格式为附件D(“B组指定证书),并应按照指定证书中规定的
自动转换为买方普通股。
1.3交出公司证券及支付交易所代价。
(A)
成交时,买方应根据卖方的交易所对价份额,安排向卖方发行交易所股票,以换取卖方的公司股份。
(B)
成交时,每名卖方将通过空白背书方式将其公司股份转让给买方,转让方式为代表公司股份的任何证书(“公司证书“)或者,如果没有公司证书,(Ii)买方可以接受的合理转让声明。
(C)
尽管本协议或交易有任何相反规定,买方将不会因本协议或交易而发行买方普通股的一小部分,而原本有权获得买方普通股的一小部分的每个人(在将该人本来会收到的买方普通股的所有零碎股份合计后)将拥有
向该人发行的买方普通股的股数,总数四舍五入为买方普通股的最接近的整体份额。
1.4公司可转换证券的处理。
(A)
在股份交换前,除公司购股权外的公司可转换证券持有人应将根据该等公司可转换证券收取公司股份的所有权利按公司可转换证券(“公司可转换证券”)所载的适用转换比率转换为公司股票。公司可转换证券“)。
在公司可转换证券转换后,除公司股票期权外,所有公司可转换证券将被豁免、注销或终止(视情况而定),不再未偿还,不再存在,不再支付或分销
,公司可转换证券的每位持有人此后将不再拥有与该等证券有关的任何权利。
(B)
截至收盘时,根据本公司任何股权激励计划未偿还的每一项公司股票期权(统称为“公司股权计划“)在紧接成交之前,无论归属或非归属,在根据第6.17(B)节进行交换之前,都应保持未清偿状态。
1.5卖方同意。每名卖方作为本公司的股东或其他证券持有人,特此批准、授权并同意本公司签署和交付本协议及其作为或必须作为一方或以其他方式约束的附属文件、本公司履行本协议项下和本协议项下的义务,以及本公司完成本协议和本协议所预期的交易。每名卖方均确认
并同意本协议所载的意向,并根据公司的组织文件、任何卖方参与或受约束的与公司有关的任何其他协议以及所有适用法律,构成卖方可能需要的同意(如果适用,应作为公司的书面股东决议)。
1.6终止某些协议。在不限制第8.1条规定的情况下,公司和卖方同意:(A)公司与任何卖方之间或卖方之间关于公司股本的任何股东协议、表决协议或类似协议,以及(Br)公司与其股东之间的任何登记权协议,在第(A)和(B)款中的每一种情况下,应自动、
且无需任何一方采取任何进一步行动,
在结束时生效。此外,每一卖方和本公司特此免除双方根据公司组织文件或
上文(A)款所述的任何协议就交易和附属文件所承担的任何义务,以及各方未能遵守与交易相关的条款的任何义务。
第
条二
关闭
2.1收盘。交易的完成(“结业“)将在Ellenoff
Grossman&Schole LLP(”EGS“),地址为纽约纽约美洲大道1345号,邮编:10105,在
满足或放弃本协议规定的截止时间为上午10:00后,立即(但在任何情况下不得晚于两(2)个工作日)通过电子签名交换方式进行远程签名。当地时间,或买方和公司书面商定的其他日期、时间或地点(实际进行交易的日期和时间为截止日期”).
结案签名可以通过电子邮件发送的PDF文件或传真传输。
2.2买方义务的条件。买方完成本协议所设想的交易的义务应
在成交时或成交前履行或免除下列各项条件:
(A)
秘书证书。公司应已向买方交付其秘书或其他高管的证书,证明(A)截至截止日期(紧接截止日期之前)有效的组织文件、(B)董事会授权和批准签署、交付和履行本协议及其所属的每个附属文件的有效性和有效性,并附上这些文件的副本,以及交易的完成情况。
和(C)其受权签署本协定或任何附属文件的官员的在任情况,而本协定或任何附属文件是或必须作为缔约方或以其他方式约束的。
(B)信誉良好。本公司应在不早于截止日期前三十(30)天向买方交付瑞士苏黎世卡顿市商业登记簿的摘录。
(C)
禁售协议.每一卖方应向买方交付由卖方正式签署的《锁定协议》,该协议的格式为本合同附件A。
(D)
竞业禁止和竞业禁止协议.公司应以附件B的形式向买方交付管理层股东正式签署的竞业禁止协议和竞业禁止协议。
(E)
同意。公司应已向买方交付附表2.2(E)所列的所需协议。
(F)
转让宣言。本公司应以买方满意的形式,向买方交付以湿墨水签署的关于所购买股份的转让声明的正本。
(G)
董事会批准和股东登记。本公司应已向买方提交董事会决议,批准将所购买的股份转让给买方,并将买方登记为股东,对所购买的股份在本公司的股份登记册上享有投票权。
(H)
受益所有权登记簿。本公司应已向买方交付一份本公司股份及实益拥有人登记册的副本,显示买方作为股东对本公司股份登记册上所购股份的投票权
,以及买方通知本公司的实益拥有人(如有)为所购股份的实益拥有人。
2.3公司义务的条件。公司完成本协议所设想的交易的义务
应以公司在交易结束时或之前履行或放弃下列各项条件为条件:
(A)
秘书证书。买方应向公司提交一份由其秘书或其他高管出具的证书,证明并附上:(A)截至成交日期(紧接成交前)有效的买方组织文件副本;(B)买方董事会授权和批准签署、交付和履行本协议的决议,以及买方作为当事一方或受其约束的每一份附属文件,以及拟进行的交易的完成。以及(C)受权执行本协议或买方作为或要求作为一方或以其他方式约束的任何附属文件的官员的在任情况。
(B)信誉良好。买方应在不早于成交日前三十(30)天的日期向公司提交买方的良好信誉证书(或适用于此类司法管辖区的类似文件),证明日期不早于成交日期前三十(30)天,由买方所在组织的适当政府管辖机构和买方有资格作为外国实体开展业务的其他司法管辖区在成交时
有资格开展业务的其他司法管辖区提供的良好信誉证书或类似文件在每种情况下均可在此类司法管辖区普遍获得
。
(C)
上市买方应已提交根据本协议于成交时发行的买方普通股在纳斯达克上市的申请,应已被通知该申请已成功提交,且纳斯达克未就与该申请有关的任何合规问题与
联系。
(D)
私募。买方应以公司可接受的形式和实质向公司交付认购协议(“认购协议“),由买方和私募投资者签立,用于私募投资,总金额等于或大于500万美元(5,000,000美元)。
(E)
公平意见。买方董事会应已收到信誉良好的独立投资银行或其他独立金融顾问公司就本公司经营的业务类型定期提出公平意见的书面意见(或有待书面确认的口头意见)
,大意是,自该意见发表之日起,根据和
符合本协议规定的各种条件和假设,买方根据本协议支付的对价从财务角度而言对买方股东是公平的。
第三条
买方的陈述和保证
除(I)买方于本协议日期向本公司及卖方提交的披露时间表(“买方
披露时间表“),其章节编号与其所指的本协议的章节编号相对应,或(Ii)美国证券交易委员会网站上通过EDGAR提供的美国证券交易委员会报告(定义如下),买方代表
并向卖方提供如下授权书:
3.1组织和地位。买方是根据特拉华州法律正式成立、有效存在且信誉良好的公司。买方拥有所有必要的法人权力和授权,以拥有、租赁和经营其物业,并继续开展目前正在进行的业务。买方具备正式资格或获得许可,可在其拥有、租赁或经营的物业的性质或其经营的业务的性质需要此类资格或许可的每个司法管辖区开展业务。附表3.1列出了买方公司开展业务的所有司法管辖区。到目前为止,买方已向公司提供了准确、完整的组织文件副本,每份副本均为当前有效。买方
未违反其组织文件的任何规定。
3.2授权;有约束力的协议。在取得股东批准(包括转换批准)的前提下,买方拥有所有必要的公司权力及授权,以签署及交付本协议及作为其一方的每份附属文件,以履行其在本协议及本协议项下的义务及完成拟进行的交易。签署及交付本协议及其参与的每份附属文件及完成拟于此进行的交易
及因此(A)已获买方董事会正式及有效授权,及(B)除股东批准外,买方并无必要进行任何其他公司程序以授权签署及交付本协议及其参与的每份附属文件,或完成拟于本协议及因此进行的交易。本协议是,
买方为当事一方的每份附属文件在交付时应由买方正式有效地签署和交付,并且,
假定本协议和此类附属文件得到本协议和本协议其他各方的适当授权、签署和交付,则构成买方的法律、有效和具有约束力的义务,或在交付时构成买方的法律、有效和具有约束力的义务,可根据其条款对买方强制执行,但其强制执行可能受到适用的破产、无力偿债、重组
和暂停法及其他普遍适用的法律影响债权人权利的执行,或通过任何适用的诉讼时效或任何有效的抵销或反请求抗辩,以及衡平法救济或救济(包括具体履行的救济)受可寻求此种救济的法院(统称为可执行性
例外”).
3.3政府批准。除附表3.3另有说明外,买方在签署、交付或履行本协议及其所属的每份附属文件,或完成本协议及因此预期的交易时,不需征得或征得任何政府当局的同意
,但根据旨在禁止、限制或管制具有垄断或限制贸易目的或效果的行为的任何法律(“反垄断法“),(B)本协议明确规定的备案文件,
(C)纳斯达克或美国证券交易委员会要求就交易提交的任何备案文件,(D)证券法、交易法和/或任何州的”蓝天“证券法及其下的规则和法规的适用要求(如果有),以及(E)如果
未能获得或做出此类同意或做出此类备案或通知,不会合理地预期对买方产生重大不利影响的情况。
3.4不违反规定。除附表3.4中另有描述外,买方签署和交付本协议及其所属的每份附属文件,完成本协议及由此拟进行的交易,并遵守本协议及本协议的任何规定,不得(A)与买方组织文件的任何规定相冲突或违反,(B)在获得本协议第3.3节所述政府机构的同意后,且其中所指的等待期已满,且已满足此类同意或豁免的任何先决条件。违反或违反适用于买方或其任何财产或资产的任何法律、命令或同意,或(C)(I)违反、
冲突或导致违约,(Ii)构成违约(或因通知或时间流逝或两者兼而有之,将构成违约的事件),(Iii)导致终止、撤回、暂停、取消或修改,(Iv)加速买方根据以下条款要求的履行
,(V)产生终止或加速的权利,(Vi)产生根据以下条款支付款项或提供赔偿的任何义务,(Vii)导致在买方的任何财产或资产项下产生任何留置权,(Viii)产生获得任何第三方同意的任何义务,或根据或(Ix)给予任何人权利,
宣布违约,行使任何补救措施,要求退款、退款、罚款或更改交货时间表,加速到期日或履行,取消、终止或修改任何条款下的任何权利、福利、义务或其他条款,任何买方材料合同的条件或条款
,但与前述(C)条款的任何偏离不能合理地预期会对以下方面产生重大不利影响买家。
3.5大写。
(A)
买方被授权发行250,000,000股普通股,每股面值0.00001美元,10,000,000股为优先股
,每股面值0.00001美元。截至本协议日期的已发行和未偿还买方证券载于附表
3.5(A)。买方普通股的所有已发行和已发行股票均经正式授权、有效发行、足额支付和不可评估
,不受或违反任何购买选择权、优先购买权、优先购买权、认购权或适用法律任何条款、买方组织文件或买方作为当事方的任何合同下的任何类似权利的约束或发行。
未发行的买方证券均未违反任何适用的证券法。
(B)
除附表3.5(B)所列外,不存在(I)未偿还的期权、认股权证、认沽、催缴、可转换证券、优先购买权或类似权利,(Ii)具有一般投票权的债券、债权证、票据或其他债务,或可转换或可兑换为具有该等权利的证券,或(Iii)认购或其他任何性质的权利、协议、安排、合约或承诺
,(A)与买方已发行或未发行的证券有关
或(B)买方有义务发行、转让、交付或出售或安排发行、转让、交付、出售或回购可转换为或可交换该等证券的任何期权或股份或证券,或(C)买方有义务授予、延长或订立
该等股本股份的任何该等期权、认股权证、催缴、认购或其他权利、协议、安排或承诺。买方不存在回购、赎回或以其他方式收购买方任何股份或提供资金对任何人进行任何投资(以贷款、出资或其他形式)的未偿还义务。除附表3.5(B)所述外,就买方任何股份的投票权而言,并无买方为一方的股东协议、有表决权信托或其他协议或谅解。
(C)
截至本协议日期,买方的所有债务均在附表3.5(C)中披露。除附表3.5(C)所述外,买方的债务不包含任何限制:(I)任何此类债务的提前偿付,(Ii)买方产生的债务,(Iii)买方对其财产或资产授予任何留置权的能力,或(Iv)交易的完成。
3.6家子公司。附表3.6列明买方的每一附属公司的名称,以及就每一附属公司而言,(A)其组织的管辖权,(B)其授权股份或其他股权(如适用),及(C)已发行及已发行的股份或其他股权的数目及记录持有人和实益拥有人。买方每一家子公司的所有未偿还股本证券均经正式授权和有效发行、全额支付和不可评估(如果适用),并按照所有适用的证券法提供、出售和交付,并由一家或多家买方公司拥有,且没有任何留置权
(该子公司的组织文件规定的留置权除外)。除买方子公司的组织文件外,买方或其任何关联公司没有任何合同是买方或其任何关联公司参与投票(包括表决权信托或代理)的合同,也没有关于买方任何子公司的股权投票(包括投票信托或代理)的合同。买方的任何附属公司并无任何未偿还或已授权的期权、认股权证、权利、协议、认购事项、可转换证券或承诺,或买方的任何附属公司就发行或赎回买方的任何附属公司的任何股权而作出的约束
。买方的任何附属公司并无
未清偿股权增值、影子股权、利润分享或类似权利。买方的子公司
对其向其股权持有人进行任何分配或分红或偿还欠另一买方公司的任何债务的能力不受合同、订单或适用法律的任何限制。除附表所列子公司的股权外
3.6买方不拥有或有任何权利直接或间接获得任何人的任何股权,或以其他方式控制任何人。除附表3.6所述外,买方公司
不得参与任何合资企业、合伙企业或类似安排。买方公司不存在向任何其他人提供资金或对其进行任何投资(以贷款、出资或其他形式)的未履行合同义务。
3.7.美国证券交易委员会备案和买方财务。
(a)
Except as set forth on Schedule 3.7, Buyer, since January 1, 2021, has filed all forms, reports, schedules, statements,
registration statements, prospectuses and other documents required to be filed or furnished by Buyer with the SEC under the Securities
Act and/or the Exchange Act, together with any amendments, restatements or supplements thereto, and will file all such forms, reports,
schedules, statements and other documents required to be filed subsequent to the date of this Agreement. Except to the extent available
on the SEC’s web site through EDGAR, Buyer has delivered to the Company copies in the form filed with the SEC of all of the following:
(i) Buyer’s annual reports on Form 10-K for each fiscal year of Buyer beginning with the first year Buyer was required to file
such a form, (ii) Buyer’s quarterly reports on Form 10-Q for each fiscal quarter that Buyer filed such reports to disclose its
quarterly financial results in each of the fiscal years of Buyer referred to in clause (i) above, (iii) all other forms, reports, registration
statements, prospectuses and other documents (other than preliminary materials) filed by Buyer with the SEC since the beginning of the
first fiscal year referred to in clause (i) above (the forms, reports, registration statements, prospectuses and other documents referred
to in clauses (i), (ii) and (iii) above, whether or not available through EDGAR, are referred to herein collectively as the “SEC
报告“),及(iv)(A)《交易法》第13 a-14条或第15 d-14条规定的所有证明和声明,以及(B)《美国法典》第18章规定的所有证明和声明。§1350(SOX第906节),关于上述第(i)款所述的任何报告(统称为“公共认证
“)。美国证券交易委员会报告(X)在所有重要方面都是根据证券法和交易法(视情况而定)及其下的规则和条例的要求编制的,而(Y)没有,自其各自的
生效日期(如果是根据证券法的要求提交的登记声明的美国证券交易委员会报告)
以及在提交给美国证券交易委员会时(就美国证券交易委员会的所有其他报告而言)包含任何关于重大事实的不真实陈述或
遗漏陈述其中所需陈述的或为了作出其中所述陈述所必需的重大事实,根据其作出陈述的情况而不具有误导性。公共认证自其各自的备案日期起均有效。如本第3.7节所用,术语“档案”应广义解释为包括“美国证券交易委员会”规则和条例所允许的向“美国证券交易委员会”提供、提供或以其他方式提供文件或信息的任何方式。截至本协议日期
,(A)买方普通股在纳斯达克上市,(B)金融行业监督管理局没有就买方暂停、禁止
或终止在纳斯达克上报价买方证券的任何意图对买方提起诉讼,或据买方所知,对买方进行
威胁,以及(C)买方证券符合纳斯达克所有适用的公司治理规则。
(B)
美国证券交易委员会报告所载或以引用方式并入的买方财务报表和附注(“买家
财务“)在财务报表所指的各个日期和期间,买方的财务状况和经营结果、股东权益的变化和现金流量在所有实质性方面都是公允的,
所有这些都是按照(I)在所涉期间一致基础上应用的公认会计原则方法和(Ii)S-X法规或S-K法规,适用(除附注中可能指出的以及在S-X法规或S-K法规允许的范围内未经审计的季度财务报表的情况下,
略去附注和审计调整外,视情况而定)。
(C)
买方已根据《交易法》第13a-15和15d-15规则的要求,建立并维护财务报告的披露控制和程序以及内部控制(因此,术语分别在规则13a-15和规则15d-15的(E)和(E)段中定义)。买方的披露控制和程序旨在确保
买方根据交易法提交或提供的报告中要求披露的所有信息(包括财务和非财务信息)在美国证券交易委员会规则和表格中指定的时间段内被记录、处理、汇总和报告,
并且所有此类信息都经过积累并酌情传达给买方管理层,以便及时决定是否需要披露,并根据SOX第302条和第906条进行必要的认证。买方管理层已完成
买方信息披露控制程序和程序的有效性评估,并在适用法律要求的范围内,在任何适用的美国证券交易委员会报告(采用Form 10-K或Form 10-Q格式的定期报告或对其进行的任何修订)中提交其关于截至该报告或基于此类评估的修订所涵盖的期限结束时披露控制程序和程序的有效性的结论
。
3.8未作某些更改。自2023年1月1日以来,除附表3.8另有规定外,各买方公司仅在正常业务过程中按照以往惯例开展业务,不受重大不利影响。
3.9遵守法律。除附表3.9所述外,买方公司没有或已经发生重大冲突或重大
不遵守、重大违约或违反,也没有任何买方公司自2021年1月1日以来收到任何书面或(据买方所知)口头通知,关于任何重大冲突或不遵守、或重大违约或违反任何适用的
法律,使其或其任何财产、资产、员工、业务或运营受其约束或影响。
3.10个许可证。每家买方公司(及其雇员在法律上必须获得政府当局的许可,才能履行其受雇于任何买方公司的职责)持有合法开展其目前开展的业务和目前预期进行的业务所需的所有许可证,并拥有、租赁和运营其资产和财产
(统称为买家许可证“)除非未取得任何此类买方许可,
且合理地预计不会单独或总体产生实质性的不利影响。买方已向公司提供所有买方许可材料的真实、正确和完整的副本,买方许可的所有材料均列在附表3.10中。所有买方许可证都是完全有效的,没有暂停或取消买方许可证的任何
待决或,据买方所知,威胁。没有买方公司在任何实质性方面违反了任何买方许可证的条款,也没有买方公司收到任何关于撤销或修改买方许可证的任何行动的书面或口头通知
。
3.11诉讼。除附表3.11所述外,目前尚无(A)任何性质的行动悬而未决或据买方所知受到威胁,也没有任何合理依据可供采取任何行动(且自2021年1月1日以来未采取此类行动或据买方所知受到威胁);或(B)目前悬而未决的或悬而未决的或自2021年1月1日以来由政府当局作出的(A)或(B)由或针对买方公司、其现任或前任董事或高级管理人员的命令(条件是,涉及买方公司董事或高级管理人员的任何诉讼必须与买方公司的业务、股权、证券或资产有关)。如果最终确定附表3.11中所列的项目对买方公司不利,则无论是单独还是合计,都不会对买方公司产生实质性的不利影响。自2021年1月1日以来,任何买方公司的现任或前任高级管理人员、高级管理人员或董事均未因任何重罪或任何涉及欺诈的罪行而被起诉、逮捕或定罪。
3.12份材料合同。
(A)
附表3.12(A)列出了买方已向公司提供的真实、正确和完整的清单(包括口头合同的书面摘要、买方公司为当事一方或任何买方公司或其任何财产或资产受到约束或影响的每份合同的真实、正确和完整的副本)(每个合同要求在附表3.12(A)、
a买方材料合同“)该条:
(I)
包含限制任何买方公司(A)在任何行业或与任何人或在任何地理区域竞争,或销售、提供任何服务或产品或招揽任何人的能力的契诺,包括任何竞业禁止契诺、
员工和客户非征求契诺、排他性限制、优先购买权或最惠价条款,或(B)
购买或获得任何其他人的权益;
(Ii)
涉及任何合资企业、利润分享、合伙、有限责任公司或与任何合伙企业或合资企业的成立、创建、经营、管理或控制有关的其他类似协议或安排。
(Iii)
涉及以任何种类或性质的任何商品、证券、工具、资产、利率或指数为基础的任何交易所买卖、场外交易或其他掉期、上限、下限、挂钩、期货合约、远期合约、期权或其他衍生金融工具或合约
,不论有形或无形,包括货币、利率、外币及指数;
(4)
证明未偿还本金金额超过1,000,000美元的任何买方公司的债务(无论是产生的、假定的、担保的或由任何资产担保的)。
(V)
涉及直接或间接(通过合并或其他方式)收购或处置总价值超过100,000美元的资产(按以往惯例在正常业务过程中除外)或任何买方公司或其他个人的股份或其他股权
;
(Vi)
涉及与任何其他人的任何合并、合并或其他业务合并,或收购或处置任何其他
实体或其业务或重大资产,或出售任何买方公司、其业务或重大资产;
(Vii)
根据其条款,单独或与所有相关合同一起,要求买方公司根据此类合同或合同支付或收取的总金额至少为每年250,000美元或总计500,000美元(不包括每份雇用、管理、服务或咨询协议);
(Viii)
与任何买家顶级供应商;
(Ix)
买方公司有义务在本合同生效之日起为第三方提供超过100,000美元的持续赔偿或义务担保。
(X)
是买方公司与买方公司的任何董事、高级管理人员或雇员之间的关系(但与以往惯例一致的随意雇佣安排和与员工在正常业务过程中签订的限制性契诺协议除外),包括
所有竞业禁止、遣散费和赔偿协议,或任何相关人员;
(Xi)
买方公司有义务作出超过250,000美元的资本承诺或支出(包括根据任何合资企业);
(Xii)
涉及任何买方公司都有未履行义务(习惯保密义务除外)的重大和解;
或
(Xiii)
向另一人(除其他买方公司或任何经理、董事或任何买方公司的管理人员以外)提供授权书
。
(B)
除附表3.12(B)中披露的情况外,对于每一份买方材料合同:(I)此类买方材料合同在各方面对买方公司、据买方所知的每一方都是有效的、具有约束力和可强制执行的,并且完全有效和有效(除非在每种情况下,这种执行都可能受到可执行性例外的限制);
(Ii)交易的完成不会影响任何买方材料合同的有效性或可执行性;(Iii)买方公司没有在任何实质性方面违约或违约,也没有发生随着时间的推移或通知的发出而构成买方公司在该买方材料合同项下的实质性违约或违约,或允许买方另一方终止或加速的事件。(Iv)据买方所知,该买方材料合同的其他任何一方没有在任何实质性方面违约或违约,也没有发生随着时间的推移或通知的发出或两者同时发生而构成该另一方根据该买方材料合同的此类实质性违约或违约,或允许任何买方公司终止或加速的事件;(V)买方公司并无收到任何该等买方材料合同的任何一方发出的书面或据买方所知的口头通知,表示有意终止该买方材料合同或修订其条款,但在正常业务过程中作出的不会在任何实质性方面对买方公司造成不利影响的修改除外;及(Vi)买方公司
并无放弃任何该等买方材料合同项下的任何权利。
3.13知识产权。
(A)
附表3.13(A)(I)列明:(I)买方公司拥有或许可或以其他方式使用或持有以供买方公司使用或持有以供使用的所有专利和专利申请、商标和服务标志注册以及
买方公司拥有或许可的申请、版权注册和申请以及注册的互联网资产。买方注册的IP“),
具体说明每件物品的性质,包括标题,(B)物品的所有人,(C)物品的发行或登记或已在其中提出发行或登记申请的司法管辖区,以及(D)发行、登记或申请编号和日期;以及(Ii)买方公司拥有或声称拥有的所有重大未登记知识产权。附表3.13(A)(Ii)列出了所有知识产权许可、再许可和其他协议或许可
(“买方知识产权许可)(除“压缩包装”、“点击包装”和“现成”以外
软件协议和其他以合理条款向公众提供的商业软件协议(统称为,
)现成软件“),不需要列出,尽管此类许可是”买方知识产权许可“(这里使用的术语),买方公司是被许可人或被授权使用或实践任何知识产权。每个买方公司均拥有所有留置权(允许的留置权除外),拥有有效且可强制执行的
权利,并拥有不受限制的权利使用、出售、许可、转让或转让目前由买方公司使用或持有以供买方公司使用且以前由买方公司使用的所有重大知识产权,但作为买方知识产权许可主体的知识产权除外。但如附表所列者除外3.13(A)(Iii),
所有买方注册的知识产权由适用的买方公司独家拥有,没有义务支付版税、许可费或其他
费用,或以其他方式向任何第三方说明该买方注册的知识产权。
(B)
每家买方公司都拥有有效且可强制执行的许可,可以使用买方知识产权许可证中适用于该买方公司的所有知识产权。每个买方公司均已履行买方知识产权许可证中规定的所有重大义务,已支付到目前为止所需的所有款项,且据买方所知,该买方公司不存在、也不存在任何其他买方违反或违反协议项下的重大事项的情况,据买方所知,也未发生因通知或时间推移而构成违约的事件。买方公司继续使用作为买方知识产权许可标的的知识产权,其使用方式与当前使用的方式相同,不受任何买方公司任何适用许可的限制。由任何买方公司拥有或独家授权给任何买方公司的所有
版权、专利、商标和互联网资产注册都是有效和有效的,所有版权、专利和商标注册申请都在等待中,并且状态良好,所有
都没有任何挑战。
(C)
买方公司目前拥有、许可、使用或持有以供使用的任何知识产权的有效性、可执行性、所有权或使用、出售、许可或再许可的权利,没有悬而未决的或据买方所知对买方公司构成威胁的诉讼。买方公司没有收到任何书面通知或索赔,声称或暗示由于买方公司的业务活动,任何侵犯、挪用、
侵犯、稀释或未经授权使用任何其他人的知识产权的行为正在或可能正在发生或已经发生
(包括第三方提出的任何许可任何知识产权的要求或要约),买方也不知道其是否有合理的依据。没有任何买方公司
是当事一方的命令或其以其他方式约束的权利,即(I)限制买方公司使用、转让、许可或强制执行买方公司拥有的任何知识产权的权利,(Ii)限制买方公司的业务行为以容纳第三人的知识产权,或(Iii)授予任何第三人关于买方公司拥有的任何知识产权的任何权利。
据买方所知,目前没有买方公司侵犯或过去曾被侵犯,在与买方公司拥有或声称拥有的任何知识产权的所有权、使用或许可有关的任何重大方面,或据买方所知,在与买方公司各自业务的行为有关的其他方面,挪用或侵犯任何其他人的任何知识产权。据买方所知,没有第三方侵犯、挪用或以其他方式侵犯任何买方公司拥有、许可、许可或以其他方式使用或持有的任何知识产权
(买方IP“)在任何物质方面。买方公司未收到任何律师意见,即在其业务的运营中提供或分销的任何产品或服务,或在当前或过去从事此类业务的行为,
侵犯了另一人的任何知识产权,或律师对与此类业务相关的任何产品或服务的执业权利的任何意见。
(D)
买方公司的所有员工和独立承包商已将该等员工和独立承包商在为买方公司履行服务时开发的所有知识产权转让给买方公司,但根据法律的实施,此类知识产权的所有权不在适用的买方公司范围内。买方公司的现任或前任
管理人员、员工或独立承包商均未声称对买方公司拥有的任何知识产权拥有任何所有权权益。据买方所知,没有违反买方公司关于保护买方知识产权的政策或做法,或与买方公司拥有的知识产权有关的任何保密或保密合同。
据买方所知,任何买方公司的任何员工都没有义务根据任何合同或受任何命令的约束,
将对该员工尽最大努力促进买方公司利益的使用造成重大干扰,或者
将与任何买方目前进行或预期进行的业务发生重大冲突。各买方公司已
采取合理的安全措施,以保护材料买方知识产权的保密性、保密性和价值。
买方知识产权从其保密性和/或保密性中获得价值。
(E)据买方所知,没有人在未经授权的情况下访问买方公司拥有的第三方机密信息和数据,也没有对此类信息或数据的安全性、保密性或完整性造成任何其他重大损害。据买方所知,每家买方公司均遵守与隐私、个人数据保护以及个人信息的收集、处理和使用有关的所有适用法律以及自己的隐私政策和指南。据买方所知,买方公司的业务经营没有也没有违反任何第三方的隐私权或公开权,也没有构成适用法律下的不正当竞争或贸易行为。
(F)
任何交易的完成不会因为(I)提供买方公司拥有的知识产权的许可或其他用途的任何合同,或(Ii)买方知识产权许可的任何合同而导致实质性违约、实质性修改、取消、
终止、暂停或加速任何与源代码有关的付款或源代码发布。交易完成后,买方将被允许通过其子公司直接或间接行使买方公司在此类合同或买方知识产权许可项下的所有权利,行使范围与买方公司在没有发生交易的情况下所能行使的权利相同,而无需支付除持续费用、使用费或付款外的任何额外金额或对价,如果没有此类交易,买方公司将被要求支付其他费用、使用费或付款。
3.14税项和报税表。除附表3.14所列者外:
(A)
每家买方公司已及时提交或促使其及时提交其要求提交的所有重要纳税申报单(考虑到所有可用的延期)。所有这些报税表在所有重要方面都是真实、准确、正确和完整的。除买方财务已建立充足准备金的税款外,所有需要缴纳、征收或扣缴的税款均已及时缴纳、征收或扣缴。每家买方公司在所有实质性方面都遵守了与税收有关的所有适用法律。
(B)
在买方公司未提交纳税申报单的司法管辖区内,目前没有买方公司正在或可能被该司法管辖区征税的政府当局对买方公司采取的待决或威胁行动
。
(C)
没有任何税务机关对买方公司进行审计,或买方已收到任何税务机关的书面通知,或据买方所知,任何税务机关已口头通知拟进行或即将进行任何此类审计。据买方所知,没有针对买方公司的任何税务索赔、评估、审计、审查、调查或其他行动悬而未决,也没有以书面形式通知买方公司任何拟议的税务索赔或评估(在每一种情况下,除了在买方财务中已建立充足准备金的索赔或评估
外)。
(D)
除允许留置权外,对任何买方公司资产的任何税收均无留置权。
(E)
买方公司没有任何未完成的豁免或延长任何适用的诉讼时效,以评估任何实质性的税额
。买方公司并无要求延长提交任何报税表的时间,或在
报税表显示应缴税款的时间内缴纳任何税款(但因收到自动延长提交适用报税表的时间而不需要任何政府当局批准而导致的延期除外)。
(F)
买方公司未对会计方法作出任何变更(法律变更要求除外),也未收到任何税务机关的裁决,或与任何税务机关签订了协议,而该等税务机关理应预期在交易完成后会对买方公司的税项产生重大影响。
(G)
没有买方公司从事任何(I)《国库条例》1.6011-4(B)节所定义的“可报告交易”、
(Ii)“上市交易”,或(Iii)其“重大”目的是逃避或逃避美国联邦所得税的交易,其含义符合守则第6662、6662a、6011、6012、6111或6707a条或其颁布的国库条例的含义。
(H)
每家买方公司均已遵守并目前遵守所有转让定价规则和法规(在适用范围内,包括守则第482节和适用法律的任何类似或类似规定)。在法律要求的范围内,买方公司已按照《守则》第482和6662节以及适用法律的任何类似或类似规定,适当和及时地记录其转让定价方法。买方公司不是任何预定价协议或任何类似合同或协议的一方。买方公司不受守则第367条下的任何收益确认协议的约束。
(I)
在过去五(5)年内,没有买方公司是根据《守则》第368条报告的或打算符合重组资格的交易的一方。
(J)
买方公司不对另一人(买方公司除外)(I)根据任何适用的税法,(Ii)作为受让人或继承人,或(Iii)通过合同、赔偿或其他方式(不包括在正常业务过程中签订的主要目的不是分享税款的商业协议)的任何税收承担任何责任。买方公司不属于
任何税务赔偿协议、税务分摊协议或税务分配协议或类似的协议、安排或惯例(不包括在正常业务过程中签订的主要目的不是分摊税款的商业协议),也不受
税务(包括预定价协议、结算协议或与任何政府当局的税务相关的其他协议)
的约束,
在截止日期后的任何时间内对买方公司具有约束力。
(K)
买方公司未就任何税收向任何政府当局提出任何私人信函裁决、技术建议备忘录、结束协议或类似裁决、备忘录或协议,也未提出任何此类请求,也不是此类请求的对象或受其约束。
(L)
没有买方公司:(I)在证券分销中(向不是买方为共同母公司的合并集团成员的任何个人或实体)构成有资格或打算有资格参加的证券分销中的“分销公司”或“受控公司”
(《守则》第355(A)(1)(A)条所指),《守则》第355条规定的免税待遇:(A)在截至本条例之日止的两年期间内,或(B)在分销中,否则可能构成与该等交易相关的《计划》或《一系列相关交易》(《守则》第355(E)条所指的)的一部分;或(Ii)是或曾经是(A)守则第897(C)(2)节所指的美国房地产控股公司,或(B)出于任何
税务目的而成为任何合并、合并、单一或附属公司集团的成员,但买方是或曾经是该集团的共同母公司除外。
(M)据买方所知,买方股东并不受具约束力的承诺约束,或已同意出售、交换、转让或以其他方式处置买方根据本协议收取的任何买方股份,或采取任何其他可能会阻止股份交换符合守则第351节所述交易资格的其他行动。
(N)
买方公司或任何该等人士各自的联属公司并无采取或同意采取任何行动,或
知悉任何事实或情况,以致有合理可能阻止联交所符合守则第351节所述的交易所资格
。
3.15不动产。
(A)
附表3.15(A)载有一份完整和准确的清单,列明买方公司目前为经营买方公司的业务而出租、转租或以其他方式使用或占用的所有场所,以及所有现有租约、租赁担保、协议和相关文件,包括对其的所有修订、终止、修改或豁免(统称为
买方不动产租赁“),以及每个买方不动产租赁项下的当前年租金和期限。
买方已向公司提供了每份买方不动产租赁的真实完整副本,如果是口头买方不动产租赁,则提供该买方不动产租赁实质性条款的书面摘要。买方不动产租赁是有效的,
具有约束力,并可根据其条款强制执行,并且完全有效。未发生任何事件(无论是在没有通知的情况下、时间流逝或两者兼有,或任何其他事件的发生或发生)会对买方公司或(据买方所知)买方不动产租赁项下的任何其他一方构成违约,也未有买方公司收到任何此类条件的通知。
(B)附表3.15(B)载有买方公司拥有的所有财产的完整而准确的清单(“买主拥有不动产
“),包括每个买主拥有不动产的记录拥有人的姓名。买方公司不是任何租赁、转租、同意、许可或其他文书下的出租人、转租人或设保人,授予他人对所拥有的不动产的占有、使用、占用或享有的任何权利。
(C)
所有占用证书、许可证、许可证、专营权、批准和授权(统称为不动产
物业许可证“)在所有政府当局、消防承保人委员会、协会或对所拥有的不动产具有管辖权的任何其他人中,使用或占用所拥有的不动产或经营目前在其上进行的买方业务所需或适当的,已经发布,并且完全有效。买方未收到来自任何政府当局的任何未纠正的违反任何联邦、州、县或市政法律、条例、
命令、法规或要求的任何书面通知,影响买方公司、租赁不动产或自有不动产或卖方和买方公司完成交易的能力。买方公司未收到任何书面通知,表明买方公司或其代表持有的与买方自有不动产或买方不动产租赁相关或影响买方不动产或买方不动产租赁的任何保险
保单并非完全有效,且本公司未收到任何尚未治愈的违约书面通知或终止或威胁终止任何此类保险单的通知。
3.16个人财产。买方公司目前拥有、使用或租赁的、账面价值或公平市场价值超过50,000美元(50,000美元)的每一项个人财产,或在其他方面对其业务具有实质性影响的每一项个人财产,均列于附表
3.16,并在适用的范围内,连同与之相关的租赁协议、租赁担保、担保协议和其他协议的清单,包括对其的所有修订、终止、修改或豁免(“买方个人财产租赁
“)。除附表所列者外3.16、
所有此类个人财产均处于良好的运行状况和维修状态(除与此类物品的使用年限一致外的合理损耗),并适合其在买方公司的业务中预期使用。每个买方公司目前的业务运营不依赖于使用买方公司以外个人的个人财产的权利,但买方公司拥有、租赁或许可或以其他方式与买方公司签订合同的个人财产除外。买方已向
公司提供每份买方个人财产租赁的真实、完整的副本,如果是任何口头买方个人财产租赁,则提供此类买方个人财产租赁的实质性条款的书面摘要。买方个人财产租赁是有效的,具有约束力
,并可根据其条款强制执行,并且完全有效。据买方所知,未发生任何事件(无论有无通知、时间流逝或两者兼有,或任何其他事件的发生或发生)会构成买方公司或任何其他方在任何买方个人财产租赁项下的违约
,也未有买方公司收到任何此类条件的通知。
3.17资产的所有权和充分性。每家买方公司对其所有资产拥有良好的、可出售的所有权或有效的租赁权益或使用权,除(A)允许留置权、(B)出租人在租赁权益项下的权利、(C)买方临时资产负债表中明确确定的留置权和(D)附表3.17所列留置权以外的所有留置权均不受任何留置权的影响。买方公司的资产(包括知识产权和合同权利)构成了买方公司目前在业务运营中使用的所有资产、权利和财产,或买方公司在买方公司业务运营中使用或持有的所有资产、权利和财产,这些资产、权利和财产加在一起,足以满足买方公司当前业务运营的需要。
3.18员工事务。
(A)
除附表3.18(A)所述外,买方公司不是涵盖任何买方公司任何员工群体、劳工组织或任何员工的其他代表的任何集体谈判协议或其他合同的一方,买方对任何工会或其他方组织或代表该等员工的任何活动或程序均不知情。买方未对任何此类买方公司员工进行任何罢工、减速、纠察、停工或其他类似劳动活动,据买方所知,未发生或受到任何威胁
。在任何买方公司与受雇于
或作为独立承包商向买方公司提供服务的人员之间,没有悬而未决的或据买方所知受到威胁的劳工诉讼(包括未解决的申诉和年龄或其他
歧视索赔)。买方公司的任何现任管理人员或员工均未向买方公司提供书面或(据买方所知)口头通知,说明其终止与买方公司的雇佣关系的计划。
(B)
除附表3.18(A)所列外,在过去三(3)年中,每家买方公司(I)在所有实质性方面都遵守有关雇佣和雇佣惯例、雇佣条款和条件、健康和安全以及工资和工时的所有适用法律,以及与歧视、残疾、劳动关系、工作时数、工资和加班工资支付、薪酬公平、移民、工人补偿、工作条件、员工日程安排、职业安全、健康、家庭和医疗假、以及员工解雇有关的其他法律。且未收到书面或(据买方所知)口头通知,即存在针对买方公司的任何涉及不公平劳动行为的未决诉讼,(Ii)不对任何重大逾期付款承担责任
拖欠工资或因未能遵守上述任何规定而受到任何物质处罚,以及(Iii)不承担向任何政府当局支付
雇员、独立承包商或顾问的失业救济金、社会保障或其他福利或义务的任何重大付款
的责任(在正常业务过程中支付的常规付款除外,并与过去的做法一致)。据买方所知,不存在由任何求职申请人、任何现任或前任雇员、任何声称是现任或前任雇员的人或任何
政府当局针对买方公司提起的诉讼,涉及任何此类法律或法规,或指控违反任何明示或默示的雇佣合同,
非法终止雇佣,或指控与雇佣关系相关的任何其他歧视性、不法或侵权行为。买方公司未收到任何与基于性别的歧视、性骚扰、
性行为不端、工作场所骚扰或违反买方公司与上述有关的任何政策的任何行为或指控的任何报告,在每个涉及
任何员工、前雇员或独立承包商或顾问的案件中,也没有就任何此类问题达成任何和解或类似的庭外或诉讼前安排,也没有提出任何此类行动、和解或其他安排,据买方所知,也没有受到威胁。
(C)
除附表3.18(C)所列外,(A)没有任何员工是与买方公司签订书面雇佣合同的一方
并且每个人都是“随意”受雇的,以及(B)买方公司已向其所有员工全额支付其应支付给其员工的所有工资、薪金、佣金、奖金和其他补偿,包括加班费,并且买方公司没有任何义务或责任(无论是否或有)根据任何书面或
买方所知、口头协议或承诺或任何适用的法律、惯例、贸易或惯例。除附表
3.18(C)所述外,买方公司的每一名员工均与买方公司签订了买方标准格式的员工保密、发明和限制性契约协议(无论是根据单独的协议还是作为该员工整体雇佣协议的一部分),买方已向公司提供了该协议的副本。
(D)
除附表3.18(D)所述外,每个该等独立承包人在其与买方公司的协议中就发明和版权的保密、竞业禁止和转让订立了惯例契约,买方已向该公司提供了该协议的副本。就适用法律而言,包括本守则在内,目前或过去六(6)年内受雇于买方公司的所有独立承包人
均为真正的独立承包人,而非买方公司的雇员。除附表3.18(D)所述外,每个独立承包人在不到
三十(30)天的通知时间内即可终止,买方公司没有任何义务支付遣散费或解约费。
3.19福利计划。
(A)附表3.19(A)所列的
是买方或任何买方公司为任何现任或前任雇员、高级职员、董事或顾问的利益而维持、出资、要求
出资或赞助的每项福利计划的真实而完整的清单,或买方或任何买方公司有任何责任(各自、任何买方福利计划”).
(B)
对于每个买方福利计划,买方已向公司提供以下各项的准确和完整的副本(如果适用):(I)当前计划文件和当前有效的相关信托协议或年金合同(包括任何修订、修改或补充),以及任何非书面形式的买方福利计划的实质性条款的书面描述;(Ii)最新精算估值;(Iii)最新概要计划说明和重大修改摘要;(Iv)
一份最近提交的三(3)份Form 5500年度报告和随附的时间表,(V)最近收到的美国国税局裁定、意见或咨询信函的副本;(Vi)三(3)份最新的非歧视测试报告、安全港通知、
和自动登记通知(视情况而定),以及(Vii)过去三(3)年内与任何政府当局就任何悬而未决或买方公司有任何未偿责任或义务的任何事项进行的所有重大非常规沟通。
(C)
对于每个买方福利计划:(I)此类买方福利计划已根据其条款和所有适用法律的要求在所有实质性方面得到管理和执行,并在必要时与适用的监管当局和政府当局保持良好的信誉;(Ii)据买方所知,没有违反受托责任;
(Iii)没有悬而未决的诉讼,也没有受到威胁(在正常管理过程中产生的利益的例行索赔除外);以及(Iv)就买方利益要求支付的所有供款、保费和其他付款(包括任何特别供款、利息或罚款)
在所有实质性方面都已及时支付。
(D)
除ERISA或守则或其他适用法律要求的修改、变更或终止外,买方公司不承诺修改、更改或终止任何买方福利计划。
(E)
买方公司不是任何协议、合同、安排或买方福利计划的一方,而该协议、合同、安排或买方福利计划已经或可能导致(I)支付(I)守则第280G节(或州、当地或非美国法律的任何相应或类似规定)所指的任何“超额降落伞付款”,或(Ii)因守则第162(M)条(或州、当地或非美国法律的任何相应或类似规定)而不能完全扣除的任何金额。
(F)
买方福利计划没有或在任何时候都不是,也没有任何买方公司或任何ERISA关联公司(定义如下
)在(I)多雇主计划(ERISA第3(37)条
或4001(A)(3)条所指的)、(Ii)单一雇主养老金计划(ERISA第4001(A)(15)条的含义)下有任何责任或义务,但受《守则》第412节或ERISA第四章的约束,(Iii)受《守则》第413(C)节约束的多雇主计划,(Iv)《雇员退休保障条例》下的多雇主福利安排,或(V)《守则》第501(C)(9)节所界定的自愿雇员受益人协会。ERISA附属公司“指与任何买方公司一道,根据《雇员补偿和再投资法案》第4001(B)(1)节或《守则》第414(B)、(C)、(M)或(O)节的规定,
成为”单一雇主“的任何实体。
3.20环境问题。除附表3.20所列者外:
(A)
每家买方公司在所有实质性方面都遵守所有适用的环境法,包括获得、保持良好的信誉,并在所有实质性方面遵守环境法
规定的其业务和运营所需的所有许可证(“环境许可证“),没有悬而未决的行动,或者据买方所知,威胁要撤销、修改或终止任何此类环境许可证,并且据买方所知,目前不存在可能对继续遵守环境法和环境许可证产生不利影响的事实、情况或条件,或需要资本支出
来实现或维持此类持续遵守环境法和环境许可证。
(B)
买方公司不是与任何政府当局或其他人员就任何(I)环境法、(Ii)补救行动或(Iii)释放或威胁释放有害物质而签订的任何悬而未决的订单或合同的标的。买方公司
未通过合同或法律的实施承担任何环境法项下的任何责任或义务。
(C)
没有针对任何买方公司或买方公司的任何资产采取任何行动,或正在等待采取行动,或据买方所知,对买方公司的任何资产提出威胁,指控买方公司可能严重违反任何环境法或环境许可证
或可能根据任何环境法承担任何重大责任。
(D)
买方公司未制造、处理、储存、处置、安排或允许处置、产生、处理或释放任何有害物质,或拥有或经营任何财产或设施,其方式已产生或将合理地产生适用环境法规定的任何重大责任或义务。买方公司或买方公司目前或以前拥有、运营或租赁的任何财产,或买方公司安排处置或处理危险材料的任何财产,均不存在可合理预期导致买方公司承担任何重大环境责任的事实、情况或条件。
(E)
未对买方公司的业务、经营或目前拥有、经营或租赁的财产进行调查,或据买方所知,买方公司以前拥有、经营或租赁的财产悬而未决,或据买方所知,受到可能导致根据任何环境法或重大环境责任征收任何留置权的威胁。
(F)据买方所知,买方公司的任何物业都没有(I)地下储罐、(Ii)含石棉材料或(Iii)含有多氯联苯的设备。
(G)
买方已向公司提供所有与环境有关的现场评估、审计、研究、报告、分析和调查结果
任何买方公司目前或以前拥有、租赁或经营的物业。
3.21与关联人的交易。除附表3.21所述外,买方公司或其任何关联公司,或买方公司或其任何关联公司的任何高管、董事、经理、员工、受托人或受益人,或前述任何人(无论是直接或间接通过该人的关联公司)的任何直系亲属
(以上每一项,a相关
人员“)目前或在过去三(3)年中,一直是与买方公司的任何交易的一方,包括
任何合同或其他安排(A)规定由买方公司(作为买方公司的高级管理人员、董事或雇员以外)提供服务,(B)规定租赁不动产或个人财产,或(C)以其他方式要求支付(作为董事的服务或费用除外),买方公司在正常业务过程中的高级管理人员或员工)任何相关人士或任何相关人士拥有所有者、高级管理人员、经理、董事、受托人或合伙人的权益,或任何相关人士拥有任何直接或间接利益(不超过上市公司尚未行使投票权或经济利益的2%(br})的证券所有权)。除附表3.21所述的
外,买方公司与任何关联方没有任何未履行的合同或其他安排或承诺,并且
关联方不拥有任何用于买方公司业务的不动产或个人财产或权利、有形或无形(包括知识产权)。除附表3.21所述外,买方公司的资产不包括相关人士的任何应收债务或其他债务,买方公司的负债不包括对任何相关人士的任何应付或其他债务或承诺。附表3.21明确列出了该附表3.21所列的所有合同、安排或承诺,买方公司不能在没有费用或罚款的情况下,在六十(60)天通知后终止这些合同、安排或承诺。
3.22《投资公司法》。买方不是“投资公司”或直接或间接受“投资公司”控制或代表“投资公司”行事的人,均符合“投资公司法”的定义。
3.23寻找人和经纪人。除附表3.23所述外,任何经纪、发现者或投资银行均无权根据买方或其代表作出的安排,从买方、买方公司或其任何关联公司获得与交易有关的任何经纪、发现人或其他费用或佣金。
3.24某些商业惯例。
(A)
买方公司及其任何代表均未(I)将任何资金用于与政治活动有关的非法捐款、礼品、招待或其他非法开支,(Ii)非法向外国或国内政府官员或雇员、向外国或国内政党或竞选活动支付任何款项,或违反美国1977年《反海外腐败法》或任何其他当地或外国反腐败或贿赂法律的任何规定,(Iii)自2021年1月1日以来支付任何其他非法款项或
(Iv),直接或间接地向任何客户、供应商、政府雇员或其他能够或可能在任何实际或拟议的交易中帮助或阻碍任何买方公司或
协助和买方公司的人提供或同意给予任何重大金额的任何非法礼物或类似利益。
(B)
每个买方公司的业务在任何时候都遵守
所有适用司法管辖区的洗钱法规、其下的规则和条例以及由任何政府当局发布、管理或执行的任何相关或类似的规则、法规或指导方针,并且买方公司就上述任何事项
没有任何涉及买方公司的行动悬而未决,据买方所知,没有受到威胁。
(C)
买方公司或其各自的任何董事或高级管理人员,或据买方所知,代表买方公司行事的任何其他代表目前未被列入特别指定的国民或其他被封锁人员的名单或因其他原因
目前受到美国财政部外国资产控制办公室实施的任何美国制裁(“OFAC“),
买方公司在过去五(5)个财政年度中,没有直接或间接地使用任何资金,或贷款、出资或以其他方式向任何
子公司、合资伙伴或其他个人提供此类资金,用于在古巴、伊朗、叙利亚、苏丹、缅甸或
任何其他国家/地区的任何销售或业务,或用于资助目前受到OFAC任何制裁的任何个人的活动,或以其他方式违反OFAC实施的任何美国制裁。
3.25商业保险。
(A)
附表3.25(A)列出买方公司持有的与买方公司或其业务、财产、资产、董事、高级管理人员和员工有关的所有保险单(按保单编号、保险人、承保期、承保金额、年度保费和保单类型),其副本已提供给公司。所有此类保单项下到期和应付的所有保费已
及时支付,买方公司在其他方面实质上遵守了此类保单的条款。每份此类保险单(I)是合法、有效、具有约束力、可强制执行的,并且具有全部效力和作用,以及(Ii)在关闭后将继续具有法律效力、有效、具有约束力、可强制执行性、
并以相同的条款具有完全效力和效力。买方公司没有任何自我保险或共同保险计划。
自2021年1月1日以来,买方公司没有收到任何保险公司或其代表发出的任何通知,这些通知涉及或涉及
保险条款中的任何不利变化或非正常业务过程中的任何变化、任何拒绝开具保险单或不续签保险单。
(B)附表3.25(B)列出买方公司自2021年1月1日以来提出的每项超过50,000美元的个人保险索赔。各买方公司已向其保险公司报告了合理预期会导致索赔的所有索赔和未决情况,但不报告此类索赔对买方公司来说不太可能是重大问题的情况除外。据买方所知,没有发生任何事件,也不存在任何条件或情况,这是合理的预期(在没有通知或没有时间流逝的情况下)会引起或作为拒绝任何此类保险索赔的依据。没有买方公司对保险公司拒绝承保的保险单提出任何索赔。
3.26顶级供应商。附表3.26列出了(A)截至2022年12月31日的十二(12)个月和(B)2023年1月1日至2023年9月30日期间,向买方公司提供货物或服务的十(10)家最大的供应商。买家排名靠前的供应商
每个买方公司与此类供应商之间的关系是良好的商业工作关系,并且(I)在过去十二(12)个月内没有买方顶级供应商取消或以其他方式终止,或据买方所知打算取消或以其他方式终止,
此人与买方公司的任何实质性关系,(Ii)买方顶级供应商在过去十二(12)个月内没有实质性减少,或(据买方所知,没有威胁要停止、减少或限制)或打算大幅修改其与买方公司的重大关系,或打算实质性停止、减少或限制其向任何买方公司提供的产品或服务,或
其使用或购买任何买方公司的产品或服务,(Iii)据买方所知,没有任何买方顶级供应商
有意拒绝向任何买方公司支付任何应付款项或寻求对任何买方公司进行任何补救,(Iv)除按计划规定的情况外3.26在过去两年内,买方公司没有(2)与任何买方顶级供应商发生任何实质性纠纷,(V)据买方所知,交易和附属文件的完成不会对任何买方公司与任何买方顶级供应商的关系产生不利影响。
3.27独立调查。买方已自行对目标公司的业务、运营结果、(财务或其他)状况或资产进行了独立的调查、审查和分析,并承认已为此目的为其提供了对目标公司的人员、财产、资产、场所、账簿和记录以及其他文件和数据的充分
访问权限。买方确认并同意:(A)在作出订立本协议和完成交易的决定时,
它完全依赖于自己的调查以及本协议(包括公司披露时间表(定义如下)的相关部分)和根据本协议交付买方的任何证书中所载的公司和卖方的明示陈述和保证,以及公司或卖方或其代表为登记声明提供的信息;
及(B)除本协议(包括公司披露时间表的相关部分)
或根据本协议交付买方的任何证书明确规定外,本公司、卖方或其各自代表均未对目标公司或卖方作出任何陈述或保证。
第四条
公司的陈述和保证
除本公司于本合同日期向买方提交的披露明细表中所列的
(“公司信息披露时间表“),
其章节编号与其所指的本协议章节编号相对应,公司在此向买方作出如下声明和保证:
4.1组织和地位。本公司是一间根据瑞士法律正式注册成立、有效存在及信誉良好的公司,并拥有所有必要的公司权力及授权,以拥有、租赁及经营其物业及经营现正进行的业务
。各其他目标公司均为正式成立、有效存续及符合其组织司法管辖权的公司或其他实体,并拥有所有必需的公司权力及授权,以拥有、租赁及经营其财产及经营其现正进行的业务。每一家目标公司在其注册或注册所在的司法管辖区以及在其开展业务或经营的其他司法管辖区内均具备正式资格或获得许可且信誉良好,但因其拥有、租赁或经营的物业的性质或其经营的业务的性质而需要此类资格或许可
。附表4.1列出了任何目标公司有资格开展业务的所有司法管辖区,以及任何目标公司开展业务的法定名称以外的所有名称。公司已向买方提供准确、完整的每个目标公司的组织文件副本,每份文件均已修改至最新且当前有效。没有目标公司
违反其组织文件的任何规定。
4.2授权;有约束力的协议。本公司拥有签署和交付本协议及本协议所属的每份附属文件、履行本协议项下和本协议项下的本公司义务以及完成本协议和由此预期的交易的所有必要的公司权力和授权。本协议的签署和交付以及本公司为其中一方的每一附属文件的签署和交付,以及本协议拟进行的交易的完成,(A)已由公司董事会和股东根据公司的组织文件、公司成立或组建管辖权的法律,得到公司董事会和股东的正式和有效授权。本公司或其任何股东
作为一方或受其约束的任何其他适用法律和任何合同,以及(B)本公司无需进行任何其他公司诉讼程序以授权签署和交付本协议及其所属的每一附属文件,或完成本协议和由此拟进行的交易。
本协议和公司所属的每一附属文件在公司方交付、正式和有效签署后,应在获得适当授权的情况下交付。本协议及本协议的其他各方签署和交付本协议及任何此类附属文件,构成本公司的法律、有效和具有约束力的义务,并在交付时构成本公司的法律、有效和具有约束力的义务,可根据本协议的条款对本公司强制执行,但可执行性例外情况除外。
4.3大写。
(A)
本公司股本中的已发行股份由412,572股本公司股份组成,除本公司可转换证券外,并无本公司其他已发行股本权益或收购本公司股权的权利。在交易生效前,卖方是本公司所有已发行及未偿还股权的法定(登记)及实益拥有人,每位卖方均拥有附表4.3(A)所述的本公司股份或可转换证券,除根据本公司组织文件及适用证券法律规定的留置权外,所有股份均由卖方拥有,且无任何留置权。于股份交换生效后,买方将拥有所有已发行及已发行的公司股份,且除根据公司组织文件及适用证券法规定的留置权外,不受任何留置权影响。所有已发行的
公司股票均已获得正式授权、已缴足股款且无需评估(即各持有人无需再支付任何款项)
且不违反任何购买选择权、优先购买权、优先购买权、认购权或其司法管辖区法律、任何其他适用法律、本公司组织文件或本公司或其证券所属或受其约束的任何合同的任何类似权利。本公司并不直接或间接以库房形式持有其任何股份或其他股权。
(B)
附表4.3(B)载列于换股前所有已发行公司可转换证券(如有)的实益拥有人及登记拥有人,除附表4.3(B)所载者外,并无任何公司可转换证券或优先购买权或优先认购权,亦无任何合约、承诺、安排或限制令本公司或据本公司所知其任何股东与本公司的任何股本证券(不论是否未偿还)有关连。本公司并无未清偿或授权的股权增值、影子股权或类似权利。除附表4.3(B)所载外,并无表决权信托、委托书、股东协议或任何其他有关本公司股本表决的协议或谅解。除本公司的
组织文件所载外,本公司并无未履行任何回购、赎回或以其他方式收购其任何股份或证券的合约责任,亦未向任何人士授予任何有关其股份的登记权。本公司所有已发行及已发行证券的授予、发售、出售及发行均符合所有适用的证券法。除附表4.3(B)所述外,交易完成后,本公司股本中任何股份不得发行,与本公司任何权益、认股权证、权利、期权或其他证券有关的权利亦不会加速或触发(不论是否归属、可行使、可兑换或其他)
。
(C)
本公司截至本协议日期的所有债务在目标公司截至2022年12月31日的经审计财务报表中披露,或在附表4.3(C)中披露。本公司的债务并不限制:(I)任何该等债务的预付,(Ii)本公司产生的债务,(Iii)本公司对其物业或资产授予任何留置权的能力,或(Iv)交易的完成。
(D)
自2023年1月1日以来,本公司并无宣布或派发任何有关其股份的分派或股息,亦未
回购、赎回或以其他方式收购本公司股本中的任何股份,本公司董事会亦未
授权任何前述事项。
4.4个子公司。附表4.4载列本公司每间附属公司的名称,以及有关每间附属公司(A)其组织管辖权、(B)其法定股份或其他股权(如适用)及(C)已发行及已发行股份或其他股权的数目及记录持有人及实益拥有人。本公司各附属公司的所有未偿还股本证券
均获正式授权及有效发行、已缴足及不可评估(如适用),并根据所有适用的证券法提供、出售及交付,并由一间或多间目标公司自由及明确地拥有所有留置权(该附属公司的组织文件所规定的留置权除外)。除任何该等附属公司的组织文件外,本公司或其任何联属公司并无就本公司任何附属公司的股权投票(包括有表决权信托或委托书)
订立任何合约或受其约束。本公司并无任何附属公司为订约方或对本公司任何附属公司有约束力的未偿还或
授权期权、认股权证、权利、协议、认购事项、可换股证券或承诺,就发行或赎回本公司任何附属公司的任何股权作出规定。本公司任何附属公司并无授予任何未偿还股本增值、影子股本、分享利润或类似权利
。除附表4.4所载者外,本公司任何附属公司对其向股权持有人作出任何分派或派息或偿还欠另一目标公司的任何债务的能力
均无任何限制(不论根据合同、命令或适用法律)。除附表4.4所列附属公司的股权外,本公司并无直接或间接拥有或拥有任何人士的任何股权,或以其他方式控制任何人士。目标公司
不是任何合资企业、合伙企业或类似安排的参与者。目标公司并无未履行向任何其他人士提供资金或向任何其他人士作出任何投资(以贷款、出资或其他形式)的合同义务。
4.5政府批准。就本公司签署、交付或履行本协议或任何附属文件,或本公司完成拟进行的交易,除(A)本协议明确预期的提交文件,(B)根据反垄断法及(C)未能取得或作出该等提交文件或通知外,不需获得或与任何目标公司的任何政府当局
同意或作出任何同意。
4.6 Non-Contravention. Except as otherwise described in Schedule 4.6, the execution and delivery by the Company (or any other
Target Company, as applicable) of this Agreement and each Ancillary Document to which any Target Company is a party, the consummation
by any Target Company of the transactions contemplated hereby and thereby, and compliance by any Target Company with any of the provisions
hereof and thereof, shall not (a) conflict with or violate any provision of any Target Company’s Organizational Documents, (b)
subject to obtaining the Consents from Governmental Authorities referred to in Section 4.6 hereof, and the waiting periods referred
to therein having expired, and any condition precedent to such Consent or waiver having been satisfied, conflict with or violate any
Law, Order or Consent applicable to any Target Company or any of its properties or assets, or (c) (i) violate, conflict with or result
in a breach of, (ii) constitute a default (or an event which, with notice or lapse of time or both, would constitute a default) under,
(iii) result in the termination, withdrawal, suspension, cancellation or modification of, (iv) accelerate the performance required by
any Target Company under, (v) result in a right of termination or acceleration under, (vi) give rise to any obligation to make payments
or provide compensation under, (vii) result in the creation of any Lien upon any of the properties or assets of any Target Company under,
(viii) give rise to any obligation to obtain any third party Consent or provide any notice to any Person under or (ix) give any Person
the right to declare a default, exercise any remedy, claim a rebate, chargeback, penalty or change in delivery schedule, accelerate the
maturity or performance, cancel, terminate or modify any right, benefit, obligation or other term under, any of the terms, conditions
or provisions of any Company Material Contract, except for any deviations from the foregoing clause (c) that would not reasonably be
expected to have a Material Adverse Effect on the Company.
4.7财务报表。
(a)
如本文所用,术语“公司财务指(i)目标公司经审计的合并财务报表
(包括任何相关附注),包括目标公司截至2022年12月31日的合并资产负债表(公司资产负债表;这样的日期,即公司资产负债表日期
),截至2021年12月31日和2020年12月31日,以及相关的合并审计损益表,
截至该日止年度的股东权益变动和现金流量表(经审计的公司财务报表“)。
审计公司财务报表(X)是根据目标公司截至时间和其中提及的期间的账簿和记录编制的,(Y)是根据瑞士公认会计原则编制的,在所涉期间内和期间内一致适用
(但未经审计的报表不包括瑞士公认会计准则所要求的脚注披露和其他列报项目,也不包括金额不大的年终调整),及(Z)在所有重要方面均完整、正确及公平地列载
目标公司于其各自日期的综合财务状况及目标公司于指定期间的综合经营业绩及现金流量。目标公司从未遵守过交易所法案第13(A)和15(D)节的报告要求
。
(B)
每个目标公司都保存准确的账簿和记录,反映其资产和负债,并保持适当和充分的内部会计控制,以提供合理的保证:(I)该目标公司不保持任何账外账户
,且该目标公司的资产仅根据该目标公司的管理指令使用,(Ii)经管理层授权执行交易,(Iii)根据需要记录交易,以允许编制该目标公司的财务报表,并对该目标公司的资产进行问责。(Iv)仅在获得管理层授权的情况下方可查阅目标公司的资产,(V)定期将目标公司的资产与现有资产进行比较并核实实际金额,及(Vi)准确记录帐目、票据及其他应收账款及存货,并实施适当及充分的程序,以便按现行及及时的原则收取帐目、票据及其他应收账款。目标公司的所有财务账簿和记录
在所有重要方面都是完整和准确的,并在正常过程中按照过去的做法和适用法律进行保存。没有任何目标公司受到或卷入任何涉及管理层或在任何目标公司财务报告内部控制中具有重要角色的其他员工的重大欺诈行为。自2021年1月1日以来,没有任何目标公司或其代表收到任何关于任何目标公司的会计或审计惯例、程序、方法或方法或其内部会计控制的书面投诉、指控、主张或索赔,包括任何关于任何目标公司从事有问题的会计或审计做法的重大书面投诉、指称、主张或索赔
。
(C)
除附表4.7(C)所列的债务外,目标公司并无任何其他债务,其金额为附表4.7(C)所列的
数额(包括本金及任何与该等债务有关的应计但未付的利息或其他债务)。除附表4.7(C)所披露者外,任何目标公司的债务并无对(I)任何该等债务的预付、(Ii)任何目标公司产生的债务或(Iii)目标公司就其各自财产或资产授予任何留置权的能力
构成任何限制。
(D)
目标公司不承担任何负债或义务(无论是否需要反映在根据瑞士公认会计原则编制的资产负债表上),包括任何表外债务或任何“可变利益实体”(在
意为会计准则汇编810的范围内),除(I)于本公司及其附属公司于本公司财务报表日期的综合资产负债表内已充分反映或拨备或计提的
,或(Ii)在本公司资产负债表日之后在正常业务过程中发生且与过去惯例一致的事项(违反任何合约或违反任何法律的责任除外)外。
(E)
本公司或其代表向买方或其代表提交的有关目标公司的所有财务预测均真诚地采用本公司认为合理的假设编制。
4.8未作某些更改。自2023年1月1日以来,除附表4.8所述或本协议明确预期采取的行动外,各目标公司(A)仅在符合过去惯例的正常业务过程中开展业务,且(B)未受重大不利影响。
4.9遵守法律。自2021年1月1日以来,没有任何目标公司处于或一直处于重大冲突或重大不遵守、重大违约或违反,也没有任何目标公司自2021年1月1日以来收到任何书面或据本公司所知的口头通知
任何重大冲突或不遵守、或重大违约或违反任何适用法律,以约束或影响其或其任何资产、员工、业务或运营。
4.10许可证。每一家目标公司(及其员工,在法律上必须获得政府当局的许可才能履行其受雇于任何目标公司的职责),持有合法开展其目前开展的业务和目前预期进行的业务所需的所有许可证,并拥有、租赁和运营其资产和财产
(统称为公司许可证“)除非未能取得任何该等公司许可,
没有,亦不会合理地预期会有个别或整体的重大不利影响。公司已向买方提供了与公司业务有关的所有公司许可证材料的真实、正确和完整的副本,所有这些材料都按计划列出。4.10.本公司的所有许可证均已完全生效,本公司的任何许可证均未被暂停或取消,据本公司所知,本公司的任何许可证均未受到威胁。没有任何目标公司在任何实质性方面违反任何公司许可证的条款,也没有任何目标公司
收到任何书面或(据本公司所知)口头通知,涉及撤销或修改任何公司许可证的任何行动。
4.11诉讼。除附表4.11所述外,(A)目前并无任何性质的行动待决或据本公司所知受到威胁,亦无任何合理依据可采取任何行动(且自2021年1月1日以来,本公司并无采取或据本公司所知受到威胁的行动);或(B)目前悬而未决或悬而未决的或自2021年1月1日以来由政府当局作出的(A)或(B)由任何目标公司、其现任或前任董事或高级管理人员提出或针对目标公司的命令(条件是,涉及目标公司董事或高级管理人员的任何诉讼必须与目标公司的业务、股权、证券或资产有关)、业务、股权证券或资产。附表4.11所列项目如最终确定对目标公司不利
,将不会对目标公司整体产生重大不利影响,无论是单独还是合计。自2021年1月1日以来,任何Target Company的现任或前任高级管理人员、高级管理人员或董事均未因任何重罪或任何涉及欺诈的罪行而被起诉、起诉、逮捕或定罪。
4.12份材料合同。
(A)
附表4.12(A)列出真实、正确和完整的清单,公司已向买方提供任何目标公司为当事一方或任何目标公司或其任何财产或资产受到约束或影响的每份合同的真实、正确和完整的副本(要求在附表4.12(A)、a中列出的每份合同)、真实、正确和完整的副本。公司材料合同“)该条:
(I)
包含限制任何目标公司(A)在任何业务线或与任何
人或在任何地理区域竞争,或销售、提供任何服务或产品或招揽任何人的能力的契诺,包括任何竞业禁止契诺、
员工和客户非征求契诺、排他性限制、优先购买权或最惠价条款,或(B)
购买或获得任何其他人的权益;
(Ii)
涉及任何合资企业、利润分享、合伙、有限责任公司或与任何合伙企业或合资企业的成立、创建、经营、管理或控制有关的其他类似协议或安排。
(Iii)
涉及以任何种类或性质的任何商品、证券、工具、资产、利率或指数为基础的任何交易所买卖、场外交易或其他掉期、上限、下限、挂钩、期货合约、远期合约、期权或其他衍生金融工具或合约
,不论有形或无形,包括货币、利率、外币及指数;
(4)
任何未偿还本金金额超过100,000美元的目标公司的债务(无论是发生的、假设的、担保的或以任何资产作担保的)的证据;
(V)
涉及直接或间接(通过合并或其他方式)收购或处置总价值超过100,000美元的资产(按以往惯例在正常业务过程中除外)或任何目标公司或其他个人的股份或其他股权
;
(Vi)
涉及与任何其他人的任何合并、合并或其他业务合并,或收购或处置任何其他
实体或其业务或重大资产,或出售任何目标公司、其业务或重大资产;
(Vii)
根据其条款,单独或与所有相关合同一起,要求目标公司每年至少支付10万美元或总计500,000美元(不包括每份雇用、管理、服务或咨询协议)根据此类
合同支付或收取的总金额;
(Viii)
与任何公司顶级客户或公司顶级供应商合作;
(Ix)
目标公司有义务在本合同生效之日起为第三方提供超过100,000美元的持续赔偿或义务担保。
(X)
是任何目标公司与目标公司的任何董事、高级管理人员或雇员之间的关系(但与目标公司的任何董事、高级管理人员或雇员之间的自由雇佣安排和在正常业务过程中与员工签订的符合过去惯例的限制性契约协议,以及在正常业务过程中向员工提供的金额不超过25,000美元的贷款),包括所有竞业禁止、遣散费和赔偿协议,或任何相关人员;
(Xi)
要求目标公司作出超过100,000美元的资本承诺或支出(包括根据任何合资企业);
(Xii)
涉及在本协议日期前三(3)年内达成的重大和解协议,或任何目标公司
根据该协议有未履行的义务(习惯保密义务除外);或
(Xiii)
向其他人(除其他目标公司或任何目标公司的经理、董事或高级管理人员以外)提供授权书
。
(B)
对于每一份公司材料合同:(I)该公司材料合同在所有方面都是有效的、具有约束力和可强制执行的,对目标公司一方以及据公司所知的每一方都是有效的,并且是完全有效的(除非在每种情况下,强制执行都可能受到可执行性例外的限制);(Ii)交易的完成不会影响任何公司材料合同的有效性或可执行性;(Iii)没有目标公司在任何实质性方面违约或违约,也没有发生随着时间的推移或通知的发出或两者兼而有之而构成目标公司根据该公司
材料合同的实质性违约或违约,或允许目标公司另一方终止或加速的事件。(Iv)没有目标公司在任何实质性方面违约或违约,也没有发生据本公司所知
该公司材料合同的其他任何一方没有在任何实质性方面违约或违约的事件,也没有事件发生
随着时间的推移或发出通知或两者兼而有之会构成该另一方在该公司材料合同项下的重大违约或违约,或
允许任何目标公司终止或加速该公司的材料合同;(V)除在正常业务过程中不会对任何目标公司造成任何重大不利影响的修订外,目标公司并无接获任何该等公司材料合同任何订约方拟终止该等公司材料合同或修订其条款的书面通知或据本公司所知的口头通知;及(Vi)并无任何目标公司放弃任何该等公司材料合同项下的任何权利。
4.13知识产权。
(A)
附表4.13(A)(I)列出:(I)目标公司拥有或许可或以其他方式使用或持有以供目标公司使用或持有以供目标公司使用的所有专利和专利申请、商标和服务标志注册以及
目标公司拥有或许可的申请、版权注册和申请以及注册的互联网资产(“公司注册
IP“),视情况具体说明:(A)物品的性质,包括标题;(B)物品的所有者;(C)物品在哪些司法管辖区发布或注册,或已在哪些司法管辖区提出发布或注册申请;(D)发布、注册或申请的编号和日期;以及(Ii)目标公司拥有或声称拥有的所有重大未注册商标和软件;附表4.13(A)(Ii)列出了所有知识产权许可、再许可和其他协议或许可(“公司知识产权许可证“)(现成软件除外),这些许可证
不需要列出,尽管此类许可证在本文中使用时为“公司IP许可证”),目标
公司在这些许可证下是被许可人或以其他方式被授权使用或实践任何知识产权。各目标公司拥有所有留置权(许可留置权除外)的自由和明确
权,对该目标公司目前使用或持有以供使用的以及
该目标公司以前使用的所有重大知识产权拥有有效和可执行的权利,并拥有不受限制的使用、出售、许可、
转让或转让的权利,但作为公司知识产权许可标的的知识产权除外。除附表
4.13(a)(iii)中规定的情况外,所有公司注册知识产权均由相关目标公司独家拥有,且无义务就该等公司注册知识产权向任何第三方支付特许权使用费、
许可费或其他费用,或以其他方式向任何第三方说明。
(b)
与知识产权有关的所有注册费和维护费均已按时支付。各目标公司均拥有
有效且可强制执行的许可证,可使用适用于该目标公司的公司知识产权许可证所述的所有知识产权。各目标公司均已履行公司知识产权许可证对其规定的所有重大义务,
已支付迄今为止要求的所有款项,且该目标公司或据公司所知,目标公司的任何其他方均未严重违反或严重
违约,发生任何事件,而该等事件在发出通知或时间届满或两者的情况下将构成
本协议项下的违约。目标公司继续以与当前使用相同的方式使用作为公司知识产权许可
标的的知识产权,不受任何目标公司的任何适用许可的限制。任何目标公司所拥有或独家许可的版权、专利、商标和互联网资产的所有注册
均有效且
生效,所有注册任何版权、专利和商标的申请均处于待定状态且信誉良好,均无任何形式的质疑
。
(c)
No Action is pending or, to the Company’s Knowledge, threatened against a Target Company that challenges the validity, enforceability,
ownership, or right to use, sell, license or sublicense any Intellectual Property currently owned, licensed, used or held for use by
the Target Companies. No Target Company has received any written notice or claim asserting or suggesting that any infringement, misappropriation,
violation, dilution or unauthorized use of the Intellectual Property of any other Person is or may be occurring or has or may have occurred
(including any demands or offers to license any Intellectual Property rights from a third party), as a consequence of the business activities
of any Target Company, nor to the Knowledge of the Company is there a reasonable basis therefor. There are no Orders to which any Target
Company is a party or its otherwise bound that (i) restrict the rights of a Target Company to use, transfer, license or enforce any Intellectual
Property owned by a Target Company, (ii) restrict the conduct of the business of a Target Company in order to accommodate a third Person’s
Intellectual Property, or (iii) grant any third Person any right with respect to any Intellectual Property owned by a Target Company.
No Target Company is currently infringing, or has, in the past, infringed, misappropriated or violated any Intellectual Property of any
other Person in any material respect in connection with the ownership, use or license of any Intellectual Property owned or purported
to be owned by a Target Company or, to the Knowledge of the Company, otherwise in connection with the conduct of the respective businesses
of the Target Companies. To the Company’s Knowledge, no third party is infringing upon, has misappropriated or is otherwise violating
any Intellectual Property owned, licensed by, licensed to, or otherwise used or held for use by any Target Company (“公司
IP“)在任何物质方面。目标公司尚未收到律师的任何意见,认为
在其业务运营中提供或分销的任何产品或服务,或此类业务的开展,
目前或过去侵犯了他人的任何知识产权,也未收到律师的任何意见,其他意见涉及与此类业务相关的任何产品或服务的实践权。
(D)
目标公司的所有员工和独立承包商已将该等员工和独立承包商在为目标公司提供服务时开发的所有知识产权
(包括但不限于发明,在每种情况下包括不受限制的使用权)转让给目标公司(无需进一步付款或特许权使用费),但根据法律的实施,此类知识产权的所有权应归属于适用的目标公司。没有任何目标公司的现任或前任管理人员、员工或独立承包商声称对目标公司拥有的任何知识产权拥有任何所有权权益。据本公司所知,没有违反目标公司关于保护公司知识产权的政策或做法,也没有违反与目标公司拥有的知识产权有关的任何保密或保密合同。据本公司所知,任何目标公司的任何雇员均不会根据任何合约或受任何命令约束而承担任何责任,而该等合约或命令会对该等雇员竭尽所能地促进目标公司的利益造成重大干扰,或会与任何目标公司目前进行或预期进行的业务有重大冲突。各目标公司已采取合理的安全措施,以保护材料公司知识产权的保密性、保密性和价值
,条件是该公司知识产权从其保密性和/或保密性中获得价值。
(E)据本公司所知,没有人在未经授权的情况下访问目标公司拥有的第三方机密信息和数据,也没有对此类信息或数据的安全性、保密性或完整性造成任何其他重大损害。据本公司所知,每家目标公司均遵守与隐私、个人数据保护以及收集、处理和使用个人信息有关的所有适用法律以及其自身的隐私政策和准则。
据本公司所知,目标公司的业务运营没有、也没有违反任何第三方的隐私权或公开权,也没有构成适用法律下的不公平竞争或贸易行为。本公司已采取充分的
预防措施,以保护、记录和维护与本公司业务有关的所有商业秘密、技术诀窍、机密信息、客户名单、软件、技术信息、数据和处理技术。
(F)
任何交易的完成不会因为以下原因而导致重大违约、重大修改、取消、
终止、暂停或加速任何与源代码有关的付款或源代码的发布:(I)任何为目标公司拥有的知识产权提供许可或其他用途的合同,或(Ii)任何公司知识产权许可。交易完成后,公司将被允许通过其子公司直接或间接行使目标公司在该等合同或公司知识产权许可下的所有权利,行使范围与目标公司在没有发生交易的情况下所能行使的权利相同
,而无需支付目标公司在没有此类交易的情况下需要支付的任何额外金额或代价(持续费用、使用费或付款除外)。
4.14税项和报税表。除附表4.14所列者外:
(A)
每家目标公司都及时提交或安排提交其要求提交的所有重要纳税申报单(考虑到所有可用的延期)。所有这些报税表在所有重要方面都是真实、准确、正确和完整的。除已在公司财务中建立充足准备金的税款外,所有需要缴纳、征收或扣缴的税款
均已及时缴纳、征收或扣缴。每一家目标公司在所有实质性方面都遵守了所有适用的税收法律。
(B)
在目标公司没有提交纳税申报单的司法管辖区内,目前没有悬而未决的或据本公司所知,政府当局对目标公司采取的威胁行动。
(C)
没有目标公司正在接受任何税务机关的审计,也没有收到任何税务机关的书面通知,或据本公司所知,任何税务机关已口头通知
任何此类审计正在考虑或即将进行。据本公司所知,并无就任何税项向目标公司提出任何申索、评估、审计、审查、调查或其他待决行动,亦无
目标公司接获任何建议向其提出的税务申索或评估的书面通知(但在每宗个案中,除已在本公司财务中为其设立足够准备金的申索或评估外)。
(D)
除允许留置权外,对任何目标公司资产的任何税收均无留置权。
(E)
没有任何目标公司有任何未完成的豁免或延长任何适用的诉讼时效,以评估任何重大金额的税款
。目标公司并无要求延长提交任何报税表的期限或在
内就任何报税表所显示的应缴税款作出任何延展(但因收到自动延长提交适用报税表的时间而无需任何政府当局批准而导致的延展除外)。
(f)
没有目标公司对会计方法做出任何变更(法律变更要求的除外),或收到任何税务机关的裁决
,或与任何税务机关签署协议,合理预期这些变更将在
交割后对其税收产生重大影响。
(g)
没有目标公司从事任何(i)《财政条例》第1.6011-4(b)节中定义的“应报告交易”,
(ii)“上市交易”,或(iii)交易,其“重大”目的是避免或逃避
美国联邦所得税,符合第6662、6662 A、6011、6012节的含义,6111或6707 A或据此颁布的《财政条例》。
(h)
各目标公司已遵守且目前遵守所有转让定价规则及法规(包括
(如适用)《守则》第482条及适用法律的任何可比或类似条文)。在法律要求的范围内,
目标公司已按照《守则》第482条和第6662条以及适用法律的任何可比或类似规定,适当、及时地记录其转让定价方法。没有目标公司是任何预先定价协议
或任何类似合同或协议的一方。根据守则第367条,目标公司概不受任何收益确认协议所规限。
(i)
在过去五(5)年内,目标公司均未参与根据《守则》第368条报告或拟符合重组条件的交易。
(J)
任何目标公司对另一人(目标公司除外)(I)根据任何适用的税法,(Ii)作为受让人或继承人,或(Iii)通过合同、赔偿或其他方式(不包括在正常业务过程中签订的主要目的不是分享税款的商业协议)承担任何税务责任。任何目标公司都不是
任何税收赔偿协议、税收分享协议或税收分配协议或类似的协议、安排或惯例(不包括在正常业务过程中签订的主要目的不是分享税收的商业协议)的一方,也不受
与
税收(包括与任何政府当局签订的预定价协议、结算协议或其他与税收有关的协议)
的任何税收赔偿协议、税收分享协议或税收分配协议或类似协议、安排或惯例的约束,
在截止日期后的任何时间内对该目标公司具有约束力。
(K)
没有任何目标公司就任何税收向任何政府当局提出任何私人信函裁决、技术建议备忘录、结束协议或类似裁决、备忘录或协议,也没有任何此类请求
未解决,也不是此类裁决、技术建议备忘录的主题或受其约束。
(L)
没有目标公司:(I)在证券分销中(向不是本公司为共同母公司的合并集团成员的任何个人或实体)构成有资格或打算有资格参加的证券分销中的“分销公司”或“受控公司”
(《守则》第355(A)(1)(A)条所指),《守则》第355节规定的免税
待遇:(A)在截至本守则之日止的两年期间内,或(B)以其他方式构成与该等交易有关的“计划”或“一系列相关交易”(《守则》第355(E)节所指的)的一部分的分销;或(Ii)是或曾经是(A)守则第897(C)(2)节所指的美国房地产控股公司,或(B)任何合并、合并、单一或关联的公司集团的成员
,以任何税务目的,而不是本公司现在或曾经是其共同母公司的集团。
(M)
就美国联邦所得税而言,任何目标公司都不被视为国内公司(该术语在《准则》第7701节中定义)。
纳税。目标公司从未从事过美国贸易或业务(在本守则的含义内)。
(N)
作为股票交换的结果,买方将满足《国库条例》第1.367(A)-3(C)(3)节所定义的“活跃的贸易或商业测试”,包括但不限于以下要求:(I)买方直接或间接通过合格附属公司或合格合伙企业,在紧接交易前的整个三十六(36)个月期间从事活跃的贸易或业务,(Ii)买方在交易时无意处置或终止此类贸易或业务,
和(Iii)实体测试(如《财务条例》第1.367(A)-3(C)(3)(Iii)节所定义)将得到满足。
(O)据本公司所知,卖方并不受具约束力的承诺约束,或已同意以其他方式出售、交换、转让或以其他方式处置买方的任何股份,或采取任何其他可能会阻止股份交换符合守则第351节所述交易资格的其他行动。
(P)
目标公司或任何该等人士各自的联属公司并无采取或同意采取任何行动,或
知悉任何事实或情况,以致有合理可能阻止联交所符合守则第351节所述的交易所资格。
(Q)
本公司并无就(I)涉及本公司的任何收购或任何合并、分拆或类似交易,或(Ii)本公司与任何卖方或其任何联营公司之间的任何股东贷款或其他交易,并无实际或或有税务责任。
(R)
本公司没有常设机构(Betriebsstätte im Steuerrechtlichen Sinn)在瑞士或任何其他国家/地区。
(S)
本公司任何时候均未向股东或关联方进行任何隐性利润分配。本公司在任何时候均未获得任何隐性资本
。
4.15不动产。附表4.15载有一份完整和准确的清单,列明目标公司目前为经营目标公司的业务而出租或转租或以其他方式使用或占用的所有场所,以及所有与之相关的现有租约、租赁担保、协议和文件,包括对其的所有修订、终止、修改或豁免(统称为公司不动产租赁“),以及各公司不动产
租赁的当前年租金和期限。公司已向买方提供了公司不动产租赁合同的真实完整副本,如果是任何口头的公司不动产租赁合同,则提供了该公司不动产租赁合同重要条款的书面摘要。公司不动产
租赁合同根据其条款有效、具有约束力和可强制执行,并具有完全效力。据本公司所知,
并无发生任何事件(不论是否发出通知、时间届满或两者兼有或任何其他事件的发生或发生)
构成目标公司或任何其他方在本公司任何不动产租赁项下的违约,且目标
公司亦无收到任何该等情况的通知。公司未对公司不动产租赁进行任何变更,这些变更将要求公司在租赁终止时支付
重大款项,以将租赁场所恢复到原始状态。没有目标公司
拥有任何不动产或不动产的任何权益(公司不动产租赁中的租赁权益除外)。
4.16个人财产。目标公司目前拥有、使用或租赁的账面价值或公平市场价值超过五万美元($50,000)的每项个人财产,在附表4.16中列出,并在适用范围内列出租赁协议、租赁担保、担保协议和其他相关协议,包括所有修订,
终止和修改或放弃(“公司个人物业租约“).除附表4.16中所述外,所有该等个人财产项目均处于良好的运行状态和维修状态(与该等项目的使用年限一致的合理磨损除外),并适合于目标公司业务中的预期用途。各目标公司业务的运营
不依赖于目标公司以外的人员
的个人财产的使用权,但目标公司拥有、租赁或许可或以其他方式与目标公司签订合同的个人财产除外。公司已向买方提供了每一份公司个人财产租赁合同的真实完整副本,如果是任何口头的公司个人财产租赁合同,则提供了该公司个人财产租赁合同的重要条款的书面摘要。
公司个人财产租赁根据其条款有效、具有约束力和可强制执行,并具有完全效力。
据本公司所知,并未发生任何事件(无论是否有通知、时间流逝或两者兼而有之,或任何其他事件的发生或发生),该事件将构成目标公司或任何其他方在本公司任何个人财产租赁项下的违约,且目标公司并未收到任何此类情况的通知。
4.17资产的所有权和充足性。各目标公司对其所有资产均拥有良好且可销售的所有权或有效的租赁权益或
使用权,不存在任何留置权,但(a)许可留置权、(b)租赁权益下出租人的权利以及(c)公司资产负债表中明确规定的留置权除外。资产(包括知识产权和
合同权利)构成目标公司
业务运营中使用的所有资产、权利和财产,如目前所进行的,或目标公司使用或持有的用于目标公司
业务运营的所有资产、权利和财产,并且,就目标
公司目前开展的业务而言,是充足的。
4.18员工事务。
(A)
任何目标公司都不是涵盖任何员工群体、劳工组织或任何目标公司任何员工的其他代表的任何集体谈判协议或其他合同的一方,并且公司不了解任何工会或其他方组织或代表该等员工的任何活动或程序
。对于任何目标公司员工,没有发生任何罢工、减速、纠察、停工或其他类似劳动活动,或据公司所知,
受到威胁。
没有悬而未决的劳工行动(包括未解决的申诉和年龄或其他歧视索赔),或据公司所知,任何目标公司与目标公司雇用的或作为独立承包商向目标公司提供服务的人员之间没有悬而未决的劳工行动。目标公司的现任高级管理人员或雇员均未向目标公司提供任何书面或据公司所知的口头通知,说明其终止受雇于任何目标公司的计划。
(B)
除附表4.18(B)所列外,在过去三(Br)(3)年中,每家目标公司(I)在所有实质性方面都遵守有关雇佣和雇佣惯例、雇佣条款和条件、健康和安全以及工资和工时的所有适用法律,以及与歧视、残疾、劳资关系、工作时数、工资和加班工资支付、薪酬公平、移民、工人补偿、工作条件、员工日程安排、职业安全、健康、家庭和医疗假、以及员工解雇有关的其他法律。且未收到书面或(据本公司所知)口头
通知,即存在针对目标公司的任何涉及不公平劳工行为的未决诉讼,(Ii)不对任何重大拖欠工资或未能遵守前述任何规定的任何实质性罚款负责,及(Iii)不对就失业救济金、社会保障或其他福利或员工、独立承包商或顾问的义务向任何政府当局支付
任何实质性款项
承担责任(常规付款除外,在正常业务过程中支付,并与过去的做法一致)。据本公司所知,任何求职申请人、任何现任或前任雇员、任何声称是现任或前任雇员的人、任何政府当局,或任何政府当局,均不会就任何此类法律或法规,或指控违反任何明示或默示的
雇佣合同,非法终止雇佣,或指控与雇佣关系有关的任何其他歧视性、不法或侵权行为,对目标
公司提起或威胁提起任何诉讼。在涉及任何雇员、前雇员或独立承包商或顾问的每个案件中,没有收到任何关于基于性别的歧视的任何行为或指控、
性骚扰、性行为不当、工作场所骚扰或违反任何目标公司的任何政策的报告,也没有就任何此类事项达成任何和解或类似的
庭外或诉讼前安排,也没有提出或威胁任何此类行动、和解或其他安排。
(C)本合同附表4.18(C)列出了截至本合同日期的目标公司所有员工的完整、准确的名单
显示每个目标公司截至该日期的员工的姓名、职务或描述、雇主和所在地。除附表
4.18(C)所述外,(A)所有员工均为与目标公司签订的书面雇佣合同的当事人,以及(B)目标公司已向所有员工全额支付应支付给其员工的所有工资、薪金、佣金、奖金和其他补偿,包括加班费
补偿,目标公司没有义务或责任(无论是否或有)根据任何书面或(据公司所知)、口头协议或承诺或任何适用的法律、惯例、交易或实践。除附表4.18(C)所述外,每名目标公司员工均已与目标公司订立公司的标准雇佣协议(不论是根据另一协议或作为该雇员的整体雇佣协议的一部分而纳入),而该协议的副本已由公司提供予买方。
(D)
附表4.18(D)包含任何目标公司目前聘用的所有独立承包商(包括顾问)的名单。除附表4.18(C)所述外,所有此类独立承包商均为与目标公司签订的书面合同的一方。除附表4.18(D)所述外,每个独立承包人在不到三十(30)天的通知时间内即可终止合同,任何目标公司均无支付遣散费或解约费的义务。
4.19福利计划..
(A)附表4.19(A)所列的是一家目标公司的每项国外计划的真实和完整的清单(每个、a公司
福利计划“)。目标公司或任何ERISA关联公司从未建立、维护、贡献、具有或具有
任何与任何福利计划有关的责任(或有义务向其贡献),无论是否受ERISA约束,而该计划不是
外国计划。
(B)
对于每个公司福利计划,公司已向买方提供以下各项的准确和完整的副本(如果适用):(I)当前计划文件和当前有效的相关信托协议或年金合同(包括任何修订、修改或补充),以及任何非书面形式的公司福利计划的实质性条款的书面描述;(Ii)最新的精算估值;以及(Iv)在过去三(Br)(3)年内与任何政府当局就任何悬而未决的事项或目标公司有任何未清偿责任或义务的任何事项进行的所有实质性非例行沟通。
(C)
对于每个公司福利计划:(I)该公司福利计划(1)已根据其条款和所有适用法律的要求在所有实质性方面得到管理和执行,以及(2)在必要时与适用的监管当局和政府当局保持良好的
状态(Iii)没有悬而未决的行动,或据公司所知,
没有受到威胁(在正常管理过程中产生的福利例行索赔除外);及(Iv)与公司利益有关而须支付的所有供款、保费及其他付款(包括任何特别供款、利息或罚款)均已在所有重大方面及时支付。除惯常的行政费用外,目标公司并无或将不会因交易而招致任何与终止或退出任何公司福利计划有关的重大责任。
(D)
在适用范围内,每项公司福利计划下的应计福利负债(不论是否归属)的现值,根据合理的精算假设于本公司最近终止的财政年度结束时厘定,
不超过该等公司福利计划可分配予该等福利负债的资产现值,或在本公司财务的所有重大方面应计
。
(E)
根据任何公司福利计划或其他规定,本公司没有、也不会因任何交易而向任何人士支付离职、遣散费、解雇或类似福利,任何交易亦不会加快任何人士的任何福利或其他补偿的支付时间或归属时间,或增加应付任何人士的任何福利或其他补偿的金额。该等交易不得直接或间接导致目标公司已支付或应付的任何款项根据守则第280G条被分类为“超额降落伞付款”,亦不存在任何安排,根据该等安排,本公司或任何目标公司将因根据第499条向任何人士支付款项而被征收任何消费税而被要求“支付毛利”或以其他方式补偿任何人士。
4.20环境问题。除附表4.20所列者外:
(A)
每家目标公司在所有实质性方面都遵守所有适用的环境法律,包括获得、保持良好的信誉,并在所有实质性方面遵守其业务和运营所需的所有环境许可证,
没有悬而未决的行动,或者据公司所知,威胁要撤销、修改或终止任何此类环境许可证,
据公司所知,没有任何事实、情况、或当前存在可能对持续遵守环境法和环境许可证造成不利影响的情况,或者需要资本支出才能实现或保持持续遵守环境法和环境许可证
。
(B)
任何目标公司都不是与任何政府当局或其他人就任何(I)环境法、(Ii)补救行动或(Iii)释放或威胁释放有害物质而签订的任何悬而未决的命令或合同的标的。没有任何目标公司
通过合同或法律的实施承担任何环境法下的任何责任或义务。
(C)
据本公司所知,并无对任何目标公司或目标公司的任何资产
采取或待采取或威胁采取行动,指称目标公司可能严重违反任何环境法或环境许可证,或可能根据任何环境法承担任何重大责任。
(D)
没有任何目标公司制造、处理、储存、处置、安排或允许处置、产生、处理或释放任何有害物质,或拥有或经营任何财产或设施,其方式已产生或将合理地产生适用环境法规定的任何重大责任或义务。对于任何目标公司或任何目标公司目前或以前拥有、运营或租赁的任何财产,或目标公司安排处置或处理危险材料的任何
财产,不存在可合理预期导致目标公司承担任何重大环境责任的事实、情况或条件。
(E)
并无对目标公司的业务、营运或目前拥有、营运或租赁的物业进行调查,或据本公司所知,目标公司先前拥有、营运或租赁的物业尚未完成或据本公司
所知受到威胁,可能导致根据任何环境法或重大环境责任征收任何留置权。
(F)据本公司所知,目标公司的任何物业并无任何(I)地下储罐、(Ii)含石棉材料或(Iii)含有多氯联苯的设备。
(G)
本公司已向买方提供所有与环境有关的现场评估、审计、研究、报告、分析和调查结果
任何目标公司目前或以前拥有、租赁或经营的物业。
4.21与关联人的交易。目标公司或其任何相关人士目前或过去三(3)年内均未参与与目标公司的任何交易,包括任何合同或其他安排(A)规定(作为目标公司的高级管理人员、董事或雇员以外)提供服务,(B)规定租赁不动产或个人财产,或(C)以其他方式要求向(作为董事的服务或费用除外)付款,任何关连人士或任何关连人士以拥有人、高级管理人员、经理、董事、受托人或合伙人的身份拥有权益,或任何关连人士拥有任何直接或间接权益(证券所有权不超过上市公司尚未行使投票权或经济权益的百分之二(br}))。目标公司并无与任何相关人士有任何未履行的合约或其他安排或承诺
,亦无任何相关人士拥有任何用于任何目标公司业务的不动产或个人财产或权利、有形或无形(包括知识产权)。目标公司的资产不包括任何应收款项或来自关连人士的其他债务,而目标公司的负债不包括任何应付或其他债务或对任何关连人士的承诺(按公平条款订立的雇佣协议除外)。进度表4.21明确列出该附表所列的所有合同、安排或承诺,目标公司不能在发出六十(60)天通知后终止这些合同、安排或承诺,除非支付费用或罚款,但按公平条款签订的雇佣协议除外。
4.22商业保险。
(A)
附表4.22(A)列出目标公司持有的与目标公司或其业务、财产、资产、董事、高级管理人员和员工有关的所有保单(按保单编号、保险人、承保期、承保金额、年保费和保单类型),其副本已提供给买方。所有此类保单项下到期和应付的所有保费已及时支付
,目标公司在其他方面实质上遵守了该等保单的条款。每份此类保险单
(I)是合法、有效、具有约束力、可强制执行的,并且具有全部效力和作用,以及(Ii)在交易结束后将继续具有法律效力、有效、有约束力、可强制执行、
和完全有效的条款。没有任何目标公司有任何自我保险或共同保险计划。
自2021年1月1日以来,没有任何目标公司从任何保险公司或代表任何保险公司收到任何关于或涉及
保险条款、拒绝开具保险单或不续保以外的不利变化或任何变化的通知。
(B)附表4.22(B)列出了目标公司自2021年1月1日以来提出的每项超过50,000美元的个人保险索赔。各目标公司已向其保险公司报告了合理预期会导致索赔的所有索赔和未决情况,但不报告此类索赔对目标公司不太可能产生重大影响的情况除外。据本公司所知,没有发生任何事件,也不存在任何条件或情况,这些事件或情况可以合理地预期(在没有通知或时间流逝的情况下)会引起或作为拒绝任何此类保险索赔的依据。没有目标公司
针对保险公司拒绝承保的保险单提出任何索赔。
4.23顶级客户和供应商。附表4.23列出(A)截至2022年12月31日的十二(12)个月及(B)自2023年1月1日至本公司资产负债表日期的十(Br)(10)个目标公司(“公司最大客户“)和向目标公司提供商品或服务的十大供应商(”公司排名靠前的供应商“),以及这些美元的数量。各目标公司与此类供应商和客户之间的关系是良好的商业工作关系,且(I)
在过去十二(12)个月内,没有任何公司顶级供应商或公司顶级客户取消或以其他方式终止,或据本公司所知,打算取消或以其他方式终止其与目标公司的任何实质性关系,(Ii)在过去十二(12)个月内,没有公司
顶级供应商或公司顶级客户威胁要停止、减少或限制,或打算大幅修改其与目标公司的实质性关系,或
打算大幅停止、减少或限制其对任何目标公司的产品或服务,或其使用或购买任何目标公司的产品或服务,(Iii)据本公司所知,没有任何公司最大供应商或公司最大客户打算拒绝
向任何目标公司支付任何款项或寻求对任何目标公司进行任何补救,(Iv)在过去两(2)年内,没有任何目标公司与任何公司最大供应商或公司最大客户发生任何重大纠纷,及(V)据本公司所知,交易及附属文件的完成不会对任何目标
公司与任何公司大供应商或公司大客户的关系造成不利影响。
4.24某些业务惯例。
(A)
任何目标公司或其各自代表均未(I)将任何资金用于非法捐款、礼品、娱乐或其他与政治活动有关的非法开支,(Ii)非法向外国或国内政府官员或雇员、向外国或国内政党或竞选活动支付任何款项,或违反美国1977年《反海外腐败法》或任何其他当地或外国反腐败或贿赂法律的任何规定,(Iii)自2021年1月1日以来进行任何其他非法支付或
(Iv),直接或间接向任何客户、供应商、政府雇员或其他能够或可能在任何实际或拟议交易中帮助或阻碍任何目标公司或协助任何目标公司的人提供或同意给予任何重大金额的任何非法礼物或类似利益
。
(B)
每家目标公司的业务在任何时候都遵守
所有适用司法管辖区的洗钱法规、其下的规则和条例以及由任何政府当局发布、管理或执行的任何相关或类似的规则、法规或指导方针,并且没有任何涉及目标公司的行动
正在进行或据本公司所知受到威胁。
(C)
目标公司或其各自的任何董事或高级管理人员,或据公司所知,代表目标公司行事的任何其他代表
目前未被列入特别指定的国民或其他受OFAC管理的美国制裁的
名单,也没有目标公司直接或间接地使用任何资金或以贷款方式向任何子公司、合资伙伴或其他个人提供此类资金,用于在古巴、伊朗、叙利亚、苏丹、缅甸或OFAC制裁的任何其他国家/地区,或在过去五(5)财年
为目前受OFAC实施或以其他方式违反美国制裁的任何个人的活动提供资金的目的。
4.25《投资公司法》。任何目标公司都不是“投资公司”或由“投资公司”或代表“投资公司”行事的直接或间接“控制”的个人,在每一种情况下都符合“投资公司法”的含义。
4.26寻找人和经纪人。除附表4.26所载者外,任何经纪、发现者或投资银行均无权获得本公司、目标公司或其各自联属公司就根据任何目标公司或其代表作出的安排而拟进行的交易而收取的任何经纪佣金、寻获人佣金或其他费用或佣金。
4.27无补贴。没有任何目标公司从任何政府机构或组织获得任何补贴、援助或减免(包括但不限于税收减免),这些补贴、援助或救济将会或可能必须因执行或完成本协议所预期的交易或其他原因而得到偿还。
4.28所提供的资料。本公司未明确提供或将提供任何信息以供纳入或纳入
以供参考:(A)在任何现行的8-K表格报告及其任何证物中,或在向任何政府主管部门(包括美国证券交易委员会)提交的关于交易或任何附属文件的任何其他报告、表格、登记或其他备案文件中;(B)在注册声明中;或(C)在向买方股东和/或潜在投资者发送的关于交易完成的邮件或其他分发中,或在对(A)至(C)中确定的任何文件的任何修订中,在提交、提供、邮寄或分发(视情况而定)时,
将包含对重大事实的任何不真实陈述,或遗漏陈述为作出陈述所需的或必要的任何重大事实,考虑到这些陈述是在何种情况下作出的,而不是
误导性的。本公司明确提供或将提供的任何信息均不包括在任何截止新闻稿和截止申请文件中,以供参考或纳入
任何截止新闻稿和截止申请文件,在提交或分发(如适用)时,将包含任何关于重大事实的不真实陈述
,或遗漏陈述其中所需陈述或作出陈述所必需的任何重大事实,
根据其作出陈述的情况而不误导。尽管有上述规定,本公司对买方或其关联公司或其代表提供的任何信息不作任何陈述、
担保或契约。
4.29
独立调查。公司已自行对业务、经营结果、状况(财务或其他)或买方资产进行独立调查、审查和分析,并确认已为此目的向买方提供了充分的人员、物业、资产、场所、账簿和记录以及其他文件和数据。本公司确认并同意:(A)在作出订立本协议和完成交易的决定时,本公司完全依赖自己的调查以及本协议(包括买方披露时间表的相关部分)和任何依据本协议交付给公司的证书中买方的明示陈述和保证,以及买方或其代表为登记声明提供的信息;以及(B)除本协议(包括买方披露时间表的相关部分)或根据本协议交付给公司的任何证书明确规定外,买方或其代表均未就买方作出任何陈述或保证。
文章
V
陈述和保证卖家中的
除卖方披露明细表中规定的第
节号与其所指的本
协议的节号相对应外,各卖方单独且非联名向公司和买方作出如下声明和保证:
5.1组织和地位。该卖方(如果不是个人)是根据其成立所在司法管辖区的法律正式组织、有效存在和信誉良好的实体,并拥有所有必要的权力和授权来拥有、租赁和经营其财产
并经营其目前所从事的业务。
5.2授权;有约束力的协议。卖方拥有所有必要的权力、权威和法律权利,如果是个人,则有能力签署和交付本协议及其所属的每一份附属文件,履行卖方在本协议和本协议项下的义务,并据此完成预期的交易。本协议已由卖方交付、正式有效地签署和交付,并且假定本协议和任何此类附属文件得到本协议和本协议其他各方的适当授权、签署和交付,则构成或在交付时构成卖方的法律、有效和具有约束力的义务,并可根据其条款对卖方强制执行,但受可执行性例外情况的限制。除本协议其他规定外,该卖方或本公司不需要进行任何其他公司程序,以授权该卖方签署和交付本协议以及该卖方作为一方的每份附属文件,或完成预期的交易
。
5.3所有权。该卖方对附件I中与卖方姓名相对的已购买股份拥有良好、有效和可出售的所有权,不受任何和所有留置权(适用证券法或公司组织文件规定的除外)。在投票或转让除本协议以外的任何此类
卖方购买的股份方面,不存在任何委托书、投票权、股东协议或其他协议或
卖方作为一方或受其约束的谅解。根据本协议,在截止日期
将卖方购买的股份交付给买方后,该等购买股份的全部合法和实益权益以及良好、有效和可销售的所有权将转移给买方,且不受所有留置权的影响(适用证券法规定的或买方产生的留置权除外)。
5.4政府批准。对于卖方签署、交付或履行本协议或任何附属文件,或完成拟进行的交易,除(A)本协议明确预期的备案,(B)根据反垄断法,(C)要求纳斯达克或美国证券交易委员会就交易提交任何备案文件,
(D)证券法、交易法、和/或任何州的“蓝天”证券法、
及其下的规则和条例,以及(E)如未能取得或作出该等意见书或作出该等备案或通知,则不会合理地预期该卖方完成交易的能力会受到重大损害或延迟。
5.5不违反规定。卖方签署和交付本协议及其作为缔约方或以其他方式具有约束力的每份附属文件,完成预期的交易,并遵守本协议及其任何规定,不会:(A)如果卖方是一个实体,则与卖方组织文件的任何规定相冲突或违反;(B)与适用于卖方或其任何财产或资产的任何法律、命令或同意相冲突或违反,或(C)(I)违反,与下列条款相冲突或导致违约,(Ii)构成违约(或因通知或时间流逝而构成违约的事件),(Iii)导致终止、撤回、暂停、取消或
修改,(Iv)加速卖方根据以下条款所要求的履行,(V)导致第(Br)项下的终止或加速权利,(Vi)产生支付或提供赔偿的任何义务,(Vii)导致根据
卖方的任何财产或资产产生任何留置权,(Viii)产生获得任何第三方同意或向任何人提供
任何通知的任何义务,或(Ix)给予任何人权利,以宣布违约、行使任何补救措施、要求退款、退款、罚款或更改交付时间表,加速到期或履行,取消、终止或修改任何条款、条件或规定下的任何权利、利益、义务或
其他条款,卖方为当事一方的任何合同,或卖方或其财产
或资产受其他约束,除非与前述(C)条款的任何偏离,没有也不会合理地预期
会对卖方完成交易的能力造成实质性损害或延迟。
5.6无诉讼。在任何政府当局面前或由任何政府当局对
或涉及该卖方(无论在法律上或衡平法上),不存在任何悬而未决的行动,或据该卖方所知,威胁也不存在任何悬而未决的命令,也不存在任何悬而未决的命令,合理地预期这将对该卖方完成本协议及该卖方是或被要求参与的本协议及附属文件项下的交易和履行其义务的能力产生重大不利影响。
5.7投资申述。此类卖方(A)既不是证券法下的S规则第902条中定义的“美国人”,也不是证券法下的第(Br)D条规则501(A)中定义的“认可投资者”;(B)仅出于投资目的而收购其在交易所的股份,而不是出于转售或分销此类交易所股票的目的;(C)已被告知并了解交易所股票(I)
是根据证券法和任何适用的州证券法的登记要求的一项或多项豁免而发行的,(Ii)尚未根据证券法或任何适用的州证券法进行登记,因此,
必须无限期持有,并且不能转售,除非此类交易所股票已根据证券法和所有适用的州证券法登记,除非有登记豁免,以及(Iii)根据该卖方的禁售协议,须受转让的额外限制;以及(D)意识到对买方的投资是投机性投资,并面临完全亏损的风险。该卖方并无与任何人士订立任何合约,就交易所股份向该
人士或任何第三人出售、转让或授予参与。卖方有能力评估买方投资的风险和优点,并保护买方与这项投资有关的利益。卖方已仔细阅读并理解买方或其代表提供给卖方或卖方代表的与买方投资有关的所有材料,并已就拟进行的投资及其对卖方的适宜性与卖方的律师、会计师或投资顾问进行磋商。该卖方承认,交易所股票
因不受该卖方控制的事件而受到稀释。卖方已完成其独立调查,并完全依赖其法律顾问、会计师、财务和其他代表的意见,以确定本协议和本协议拟进行的交易的法律、税务、财务和其他后果,以及本协议和本协议拟进行的交易是否适合该卖方及其特殊情况,并且,除此处所述外,不依赖买方或其代表的任何陈述或建议。卖方确认并同意,除第三条(包括买方披露时间表的相关部分)外,买方或其任何代表未作出任何陈述或担保,且卖方未由任何人担保或代表,(I)任何具体金额或任何现金分配事件
,买方的财产或其他权益或(Ii)交易所股票的盈利能力或价值。
此类卖方:(A)由独立律师代表(或曾有机会咨询独立律师,但
拒绝这样做);(B)有充分的权利和机会咨询卖方的律师和其他顾问,并已利用这一权利和机会;(C)已仔细阅读并充分理解本协议的全部内容,并已由该律师向其充分解释;(D)充分了解本协议的内容及其含义、意图和法律效力;
和(E)有能力执行本协议,并在没有胁迫、胁迫或不当影响的情况下执行本协议。
5.8发现者和经纪人。任何经纪、发现者或投资银行家均无权从该卖方或其任何关联公司获得任何经纪佣金、发现者佣金或其他费用或佣金
该卖方或其任何关联公司根据该卖方或代表该卖方作出的安排而进行的交易。
5.9所提供的资料。上述卖方所提供或将提供的任何资料,均未明示列入或纳入
以供参考:(A)任何现行的8-K表格报告及其任何证物,或就交易或任何附属文件而向任何政府主管当局(包括美国证券交易委员会)提交的任何其他报告、表格、登记或其他备案文件;(B)在《登记声明》中;或(C)在向买方股东和/或潜在投资者发送的关于交易完成的邮件或其他分发中,或在对(A)至(C)中确定的任何文件的任何修订中,在提交、提供、邮寄或分发(视情况而定)时,
将包含对重大事实的任何不真实陈述,或遗漏陈述为作出陈述所需的或必要的任何重大事实,考虑到这些陈述是在何种情况下作出的,而不是
误导性的。卖方明确提供或将提供的任何信息都不会包含在任何结案文件和结案新闻稿中,以供参考或纳入
任何结案文件和结案新闻稿(视情况而定),在提交或分发时,不会包含对重大事实的任何不真实陈述,或遗漏陈述其中所需陈述或陈述陈述所必需的任何重大事实,
根据作出陈述的情况,
不得误导。尽管有上述规定,该卖方不对买方或其关联公司或其代表提供的任何信息作出任何
陈述、担保或约定。
5.10
独立调查。卖方已对买方的业务、经营结果、财务状况(财务或其他方面)或资产进行了独立的调查、审查和分析,并确认已为此目的向其提供了充分接触买方的人员、财产、资产、场所、账簿和记录以及其他文件和数据的权限。卖方
确认并同意:(A)在作出订立本协议和完成本协议所设想的交易的决定时,卖方完全依赖自己的调查以及本协议(包括买方披露明细表的相关部分)和根据本协议交付给卖方的任何证书中买方的明示陈述和保证,以及买方或其代表为登记声明提供的信息;和(B)买方及其代表均未就买方作出任何陈述或保证,除非本协议(包括买方披露时间表的相关部分)或依据本协议交付给卖方的任何证书明确规定。
第六条
当事人的其他约定
6.1访问和信息。在从关闭到转换的期间(“过渡期“),买方应按卖方代表可能就买方、其子公司及其各自业务提出的合理要求,在正常营业时间内的合理时间和在合理的时间间隔和通知内,向卖方代表提供所有办公室和其他设施以及所有员工的合理使用权限、财产、合同、协议、承诺、账簿和记录、财务和经营数据以及其他信息(包括纳税申报表、内部工作底稿、客户档案、客户合同和董事服务协议),并应促使卖方代表给予卖方代表合理的访问权限。资产、负债、财务状况、前景、运营、管理、员工和其他方面(包括未经审计的季度财务报表,包括合并的季度资产负债表和损益表、根据适用证券法的要求向政府当局提交或收到的每份重要报告、时间表和其他文件的副本,以及独立的公共会计师工作底稿(须经该等会计师的同意或任何其他条件,如有),并促使
每名买方代表合理地配合卖方代表的调查;但前提是,
卖方代表不得以不合理地干扰买方或其任何子公司的业务或运营的方式开展任何此类活动。
6.2诉讼支持。结案后,如果且只要任何一方在结案日或之前针对与任何事实、情况、情况、状况、状况、活动、实践、计划、发生、事件、事件、行动、不作为或交易有关的任何诉讼积极抗辩或抗辩,其他各方应(I)在抗辩或答辩中与抗辩或辩护方及其律师进行合理合作。(Ii)在正常营业时间内的合理时间内并在合理通知下提供其工作人员,并(Iii)提供(A)与竞赛或辩护有关的合理要求的证词和(B)
访问其非特权账簿和记录,费用和费用由争议或辩护方承担(除非该争议或辩护方有权为此获得赔偿
第七条在这种情况下,费用和费用将由缔约方按照第七条规定承担)。
6.3禁止交易。本公司及卖方各自承认并同意,其知悉及彼等各自联属公司
知悉(彼等各自之代表知悉或于收到买方任何重大非公开资料时,将获告知)美国联邦证券法及据此或以其他方式颁布的美国证券交易委员会及纳斯达克之规则及法规所施加的限制(“联邦证券法“)和其他适用于拥有上市公司重要非公开信息的人的外国和国内法律。公司、买方、卖方和卖方代表均在此同意,在掌握此类重大非公开信息期间,不得买卖买方的任何证券,不得将此类信息传达给任何第三方,不得违反此类法律对买方采取任何其他行动,或
导致或鼓励任何第三方进行上述任何行为。
6.4努力。
(A)
在遵守本协议的条款和条件下,各方应尽其在商业上合理的努力,并应与其他各方充分合作,采取或促使采取一切行动,并采取或促使采取一切合理必要的措施,
根据适用的法律和法规适当或适宜地完成交易(包括收到政府当局的所有适用意见书),并在可行的情况下尽快遵守政府当局适用于交易的所有要求。在不限制前述规定的情况下,每一方应尽其商业上合理的努力,并应与其他各方充分合作,以便在可行的情况下,尽快从每一位持有5%(5%)以上买方有表决权股票的持有人以及每一位董事和买方高管那里获得一份正式签署的母公司股东支持协议,其格式如附件
C所示。
6.5进一步保证。本协议双方应进一步相互合作,并利用各自在商业上合理的
努力采取或促使采取一切行动,并根据本协议和适用法律采取或促使采取一切必要、适当或适宜的措施,以在合理可行的情况下尽快完成交易,包括在切实可行的情况下尽快准备和提交所有文件,以实施所有必要的通知、报告和其他文件。
6.6转换前的业务行为。
(A)
除非卖方代表以其他方式书面同意(此类同意不得被无理拒绝、附加条件或延迟),否则在过渡期内,除本协议或附属文件明确规定或附表6.5所列的情况外,买方应并应促使其子公司:(I)按照以往惯例,在正常业务过程中,在所有重要方面开展各自的业务,(Ii)遵守适用于买方及其子公司及其各自的业务、资产和员工的所有法律。以及(Iii)采取一切必要或适当的商业合理措施,在所有实质性方面保持其各自业务组织的完好无损,保持其各自经理、董事、高级管理人员、员工和顾问的服务,并保持其各自物质资产的占有、控制和状况,所有这些都与过去的做法一致。
(B)
在不限制第6.6(A)款的一般性的情况下,除非本协议或附属文件的条款预期、允许或要求,或适用法律要求或附表6.5所述,在过渡期间,未经卖方代表事先书面同意(此类同意不得被无理拒绝、附加条件或延迟),买方不得,且应促使其子公司不得:
(I)
除适用法律要求外,在任何方面修改、放弃或以其他方式更改其组织文件,但与允许的融资有关的除外;
(Ii)
(A)授权发行、发行、授予、出售、质押、处置或建议发行、授予、出售、质押或处置其任何股权证券,或任何期权、认股权证、承诺、认购或任何种类的权利,以收购或出售其任何股权证券、
或其他证券,包括可转换为或可交换其任何股权证券或任何类别的其他担保权益的任何证券,以及任何其他基于股权的奖励。除优先股转换后可发行的买方普通股或(B)与第三人就此类证券进行任何套期保值交易外,(A)和
(B)的每一种情况下,根据公司福利计划或与允许的融资有关的交易除外;
(Iii)
拆分、合并、资本重组或重新分类其任何股份或其他股权,或就该等股份或其他股权发行任何其他证券,或就其股份或其他股权支付或拨备任何股息或其他分派(不论以现金、股权或财产或其任何组合),或直接或间接赎回、购买或以其他方式收购或要约收购其任何证券;
(Iv)
产生、产生、承担、预付或以其他方式承担任何债务(直接、或有或有或以其他方式)超过500,000美元,或总计超过1,000,000美元,向任何第三方提供贷款或垫款或对其进行投资,或担保或背书任何人的任何债务、债务或义务,但与获准融资有关的除外;
(V)
作出或撤销与税务有关的任何重大选择,解决任何与税务有关的索赔、诉讼、仲裁、调查、审计或争议,提交任何经修订的报税表或退税要求,或对其会计或税务政策或程序作出任何重大更改,在每种情况下,除非适用法律要求或符合美国公认会计原则,否则;
(Vi)
除在正常业务过程中外,终止、放弃或转让任何买方材料合同或公司材料合同项下的任何材料权利;
(Vii)
在正常业务过程中未能在所有重要方面保持账簿、账目和记录的一致性;
(8)
设立任何附属公司或从事任何新的业务;
(Ix)
未能使用商业上合理的努力,使保险单或替换或修订的保险单对其资产、业务和活动提供保险
,其承保金额和范围与目前有效的保险金额和范围基本相似;
(X)
重估其任何重大资产或对会计方法、原则或惯例作出任何重大改变,但符合美国公认会计准则并咨询买方外部审计师的范围除外;
(Xi)
放弃、免除、转让、和解或妥协任何索赔、诉讼或程序(包括与本协议或本协议拟进行的交易有关的任何诉讼、诉讼、索赔、程序或调查),但放弃、免除、转让、和解或妥协除外
仅涉及支付不超过500,000美元(单独或总计)的金钱损害赔偿(且不对买方或其子公司实施衡平救济或承认错误),或以其他方式支付、解除或满足任何诉讼、责任或义务的
。除非买方财务中已预留该金额;
(Xii)
通过合并、合并、收购股权或资产或任何其他形式的商业合并,收购任何
公司、合伙企业、有限责任公司、其他业务组织或其任何分支机构,或在正常业务过程之外的任何重大资产
;
(十三)
任何项目(或一组相关项目)的资本支出单独超过500,000美元,或总计超过1,000,000美元;
(Xiv)
通过全部或部分清算、解散、合并、合并、重组、资本重组或其他重组的计划;
(Xv)
自愿承担的任何责任或义务(无论是绝对的、应计的、或有的或其他)超过500,000美元
或总计1,000,000美元,但根据本协议日期存在的合同条款或在过渡期内按照本第6.6节的条款订立的除外,但与允许的融资有关的除外;
(Xvi)
出售、租赁、许可、转让、交换或互换、抵押或以其他方式质押或抵押(包括证券化),或以其他方式处置其财产、资产或权利的任何重要部分;
(Xvii)
订立关于买方普通股投票的任何协议、谅解或安排,但与允许的交易或允许的融资有关的除外;
(Xviii)
采取任何可以合理预期的行动,使获得与本协议有关的任何政府授权的工作受到严重拖延或损害;或
(Xix)
授权或同意执行上述任何行动。
买方应将根据上述但书采取的任何此类行动以书面形式通知公司,并应采取商业上合理的
努力减轻此类行动对买方及其子公司的任何负面影响。
6.7买方公开备案。在过渡期内,买方应及时及时向美国证券交易委员会提交所有公开备案文件,并在其他重要方面遵守适用的证券法,并应在转换前作出商业上合理的努力,以维持买方普通股在纳斯达克上的上市。
6.8注册声明。
(A)
买方应在本公司的协助下,在切实可行范围内尽快准备并向美国证券交易委员会提交采用S-1表格、S-4表格或类似表格(经不时修订或补充的)的登记声明
注册
语句)关于根据证券法将在成交前根据本协议发行的买方证券的登记和转售,以及买方优先股所涉及的买方普通股,
还将准备买方的委托书(经修订)委托书“)目的是就将在股东特别大会上采取行动的事项向买方股东征集
委托书。
(B)
委托书应包括委托书材料,目的是征求买方股东的委托书,以便在为此目的而召集和举行的买方股东特别会议(“特别股东大会“),
赞成通过决议批准(A)买方普通股持有人根据买方组织文件以及美国证券交易委员会和纳斯达克的规章制度,发行与转换有关的买方普通股,
(B)修改买方公司注册证书,授权增发足够的普通股,以允许转换,
(C)任命邮政成员-股东批准买方委员会,在每种情况下,根据第6.12节,以及(D)公司和买方此后应共同确定的其他必要或适当事项,以实现交易(上述第(A)至(D)条所述的批准,统称为“股东
审批事项“),以及(E)特别股东大会休会,如果买方合理
认为必要或适宜。
(c)
If, on the date one day immediately preceding the date for which the Special Stockholder Meeting is scheduled, Buyer reasonably believes
that it will not receive proxies representing a sufficient number of shares to obtain the Stockholder Approval, whether or not a quorum
is present, or, Buyer will not have sufficient shares of Buyer common stock to constitute a quorum, Buyer may in its sole discretion
make one or more successive postponements or adjournments of the Special Stockholder Meeting as long as such Special Stockholder Meeting
is not postponed more than five days for each postponement or adjournment or an aggregate of ten days for all such postponements or adjournments.
In connection with the Registration Statement and the Proxy Statement, Buyer shall file with the SEC financial and other information
about the Transactions in accordance with applicable Law and applicable proxy solicitation and registration statement rules set forth
in Buyer’s Organizational Documents and the rules and regulations of the SEC and Nasdaq. Buyer shall cooperate and provide the
Company (and its counsel) with a reasonable opportunity to review and comment on the Registration Statement and the Proxy Statement and
any amendment or supplement thereto prior to filing the same with the SEC. The Company shall provide Buyer with such information concerning
the Target Companies and their equity holders, officers, directors, employees, assets, Liabilities, condition (financial or otherwise),
business and operations that may be required or appropriate for inclusion in the Registration Statement or Proxy Statement, or in any
amendments or supplements thereto, which information provided by the Company shall be true and correct and not contain any untrue statement
of a material fact or omit to state a material fact necessary in order to make the statements made, in light of the circumstances under
which they were made, not materially misleading.
(d)
Buyer shall use commercially reasonable best efforts to have the Proxy Statement filed with the SEC as promptly as reasonably practicable.
Buyer shall take any and all reasonable and necessary actions required to satisfy the requirements of the Securities Act, the Exchange
Act and other applicable Laws in connection with the Proxy Statement and the Special Stockholder Meeting, respectively. Each of Buyer
and the Company shall, and shall cause each of its Subsidiaries to, make their respective directors, officers and employees, upon reasonable
advance notice, available to the Company, Buyer and their respective Representatives in connection with the drafting of the public filings
with respect to the Transactions, including the Registration Statement and the Proxy Statement, and responding in a timely manner to
comments from the SEC. Each Party shall promptly correct any information provided by it for use in the Registration Statement and the
Proxy Statement (and other related materials) if and to the extent that such information is determined to have become false or misleading
in any material respect or as otherwise required by applicable Laws. Buyer shall amend or supplement the Proxy Statement and cause the
Proxy Statement, as so amended or supplemented, to be filed with the SEC and to be disseminated to Buyer’s stockholders to the
extent required by applicable Laws and subject to the terms and conditions of this Agreement and Buyer’s Organizational Documents;
provided, however, Buyer may not amend the Proxy Statement without Buyer’s written consent.
(e)
买方应在其他方的协助下,及时回应SEC对注册声明和代理声明的任何评论,
并应在其他方面尽其商业上合理的努力,使注册声明和代理声明“清除”SEC的评论,
并生效(如适用)。买方应向公司提供任何书面意见的副本,并应
通知公司买方或其各自代表从SEC或其工作人员收到的关于注册声明和代理声明的任何材料口头意见,在收到此类意见后立即召开特别股东大会
并应在此情况下给予公司合理的机会,以审查和评论对此类评论的任何拟议书面或实质性
口头回应。买方应尽其商业上合理的努力维持注册
声明的有效性,直至根据本第6.8条的规定,删除了与在注册
声明下注册的买方证券有关的所有限制性图例。
(F)
在美国证券交易委员会发出委托书“结算”意见后,买方应在切实可行范围内尽快将委托书
分发给买方股东,并据此召开股东特别大会。买方同意:(I)买方董事会应建议买方普通股持有人投票批准股东批准事项,并应在商业上
在本条款第6.8节规定的时间范围内作出合理努力争取此类批准,(Ii)委托书应包括一项陈述,大意是买方董事会建议买方股东投票批准股东批准事项。
(G)
买方应遵守所有适用的法律、纳斯达克的任何适用规则和条例、买方的组织文件和本协议,以编制、归档和分发委托书、征求委托书项下的任何委托书、召集
和召开特别股东大会。
6.9纳斯达克控制权变更申请。双方应尽商业上合理的最大努力,确保向纳斯达克(“The”)提交买方变更控制权的申请。纳斯达克控制权变更应用”)。
双方应尽商业上合理的最大努力,在收到纳斯达克关于纳斯达克控制权变更申请的任何问题后立即作出答复,但在任何情况下不得晚于收到此类问题后的十(10)个工作日。
6.10公告。
(A)
双方同意,未经买方和公司事先书面同意(不得无理扣留、附加条件或延迟),任何一方或其任何关联公司不得发布关于本协议或附属文件或拟在此或由此进行的交易的公开发布、备案或公告,除非适用法律或任何证券交易所的规则或法规可能要求此类发布或公告,在这种情况下,适用方应采取商业上合理的努力,允许其他各方有合理时间就以下事项发表评论,并安排任何所需的备案:在此类发行之前发布或公告。
(B)
双方应相互商定,并在交易结束后在切实可行的情况下尽快(但无论如何应在交易结束后二十四(24)小时内)发布新闻稿,宣布交易完成(“闭幕新闻稿)。
在本协议签署后四(4)个工作日内,买方应立即提交表格8-K的最新报告。结案备案“)连同成交新闻稿和联邦证券法要求的成交说明,买方应在备案前对其进行审查、评论和批准(批准不得被无理扣留、附加条件或拖延)。在准备闭幕文件、闭幕新闻稿、或一方或其代表向任何政府当局或其他第三方提交的与本协议拟进行的交易有关的任何其他报告、声明、备案通知或申请时,每一方应应任何其他方的请求,向各方提供关于其本人、各自的董事、高级管理人员和股权持有人的所有信息,以及与本协议拟进行的交易有关的合理需要或建议的其他事项,或任何其他报告、声明、备案、由一方或其代表向任何第三方和/或任何政府当局发出的与本协议所述交易相关的通知或申请
。
6.11机密信息。
(A)
公司和卖方同意,并应安排各自的代表:(I)严格对待和保密任何买方保密信息,并且不会出于任何目的(除非与完成交易或附属文件、履行其在本合同或合同项下的义务或执行其在本合同或合同项下的权利有关),
不得在未经买方事先书面同意的情况下直接或间接地披露、分发、发布、传播或以其他方式向任何第三方提供买方的任何保密信息。以及(Ii)如果公司、任何卖方或他们各自的任何代表在法律上被迫披露任何买方保密信息,(A)在法律允许的范围内向买方提供关于该要求的及时书面通知,以便买方或其关联公司可以寻求
保护令或其他补救措施,或放弃遵守本第6.11(A)条,以及(B)如果未能获得该保护令或其他补救措施,或买方放弃遵守本第6.11(A)条,仅提供此类买方的保密信息
法律要求按照外部律师的建议提供的那部分保密信息,并履行其商业上合理的
努力,以获得此类买方将获得保密待遇的保证。如果本
协议终止,本协议预期的交易未完成,公司、买方和卖方应并应
安排各自的代表迅速向买方交付或销毁(在买方选择的情况下)买方保密信息的任何和所有副本(以任何形式或媒介),并销毁与其相关或基于其的所有笔记、备忘录、摘要、分析、汇编和其他文字
。
(B)
买方特此同意,并应促使其代表:(I)严格保密任何公司机密信息,且不会将其用于任何目的(除非与完成交易或附属文件、履行其在本协议或协议项下的义务或执行其在本协议或协议项下的权利有关),也不会在未经公司事先书面同意的情况下直接或间接披露、分发、发布、传播或以其他方式向任何第三方提供任何公司机密信息;以及(Ii)在买方或其任何代表在法律上被迫披露任何公司机密信息的情况下,(A)在法律允许的范围内向公司提供关于该要求的迅速书面通知
,以便公司可以寻求保护令或其他补救措施,费用由公司承担,或放弃遵守本条款
6.11(B)和(B)如果无法获得保护令或其他
补救措施,或公司放弃遵守本条款6.11(B),则公司仅提供法律上要求由外部律师提供的保密信息,并尽其商业合理的
努力获得公司保密信息将得到此类待遇的保证。如果本协议终止,且预期的交易未完成,买方应迅速向公司交付或销毁(在公司选择的情况下)公司机密信息的任何和所有副本(无论以何种形式或媒介),并销毁与此相关或基于此的所有笔记、备忘录、摘要、分析、汇编和其他文字,并应安排其代表
迅速向公司交付或销毁(在公司选择时)公司机密信息的任何和所有副本。尽管有上述规定,买方及其代表应被允许在联邦证券法要求的范围内披露公司的任何和所有机密信息。
6.12审批后董事会。双方应采取一切必要行动,包括促使买方董事辞职,
以便在股东批准后,买方董事会(“股东批准后的买方董事会“)
将由五(5)个人组成。股东批准后,双方应立即采取一切必要行动指定并任命
担任该职位-股东批准买方委员会(I)买方在收盘前指定的两(2)人,他们将被公司合理地接受(“买家董事“);及(Ii)在交易结束前由本公司指定的三(3)名买方可合理接受的个人(”公司董事”).
6.13董事及高级职员的赔偿;尾部保险。
(A)
双方同意,买方现任或前任
董事和高级管理人员以及作为另一家公司、合伙企业、合资企业、信托、养老金或其他雇员福利计划或企业应买方请求担任董事成员、高级管理人员、成员、受托人或受托人的每一人,均有权获得免除、赔偿和垫付费用。D&O
受赔人“)根据买方的组织文件或任何D&O受保障人与买方之间的任何赔偿、雇用或
其他类似协议的规定,在本协议生效之日起,在买方获得股东批准之日起,应在适用法律允许的范围内,根据各自的
条款继续完全有效。在买方获得股东批准之日起的六(6)年内,买方应使买方的组织文件在适用法律允许的范围内,使买方的组织文件中包含的有关免除责任、赔偿和垫付D&O受赔人费用的条款不低于买方组织文件中所述的条款。本条款第6.13节的规定在结案后仍然有效,其目的是为了每一名D&O受保障人及其各自的继承人和代表的利益,并可由其执行。
(B)
为了买方董事和高级管理人员的利益,买方应被允许在买方获得股东批准之日
之前获得并全额支付“尾部”保险单的保费,该保单为买方获得股东批准之日(
)之前发生的事件提供长达六年的保险
。D&O尾部保险“)实质上等同于且在任何情况下都不低于买方现有保险单,或者,如果没有实质等值的保险范围,则等于或在任何情况下不低于可获得的最佳保险范围。如果获得,买方应维持D&O尾部保险的全部效力,并继续履行其义务,
买方应及时支付或促使支付D&O尾部保险的所有保费。
6.14转让税。与本协议有关的所有转让、单据、销售、使用、印花、注册、间接和其他实质上类似的税(包括任何间接资本利得税)和费用(统称为,转让税“)
应由该转让税的责任方承担。负责此类转让税的一方应自费提交与所有转让税有关的所有必要的纳税申报单和其他文件,卖方同意促使公司
合作提交此类纳税申报单和其他文件,包括迅速提供其拥有的、完成此类纳税申报单和其他文件所合理需要的任何信息。
6.15税务事宜。各订约方(连同其各自的联属公司)应尽其合理的最大努力,使联交所符合守则第351节所述的交易所资格,且不得采取或未能采取任何可合理预期妨碍或阻止联交所符合守则第351节所述交易所资格的行动
。
6.16第16条的事项。在以下句子的规限下,在成交前,买方及本公司将采取一切可能需要
采取的步骤(在适用法律允许的范围内以及美国证券交易委员会发出的不采取行动函的范围内),促使每一位正在或将受交易法第16(A)条关于买方的报告要求的个人(包括任何董事
)收购买方普通股(包括与买方普通股股份有关的衍生证券),
根据交易法第16b-3条获得豁免。
6.17经审计的公司财务报表的交付。
(A)
在本协议签订之日起,卖方应在合理可行的范围内尽快(无论如何不迟于2024年2月5日)
尽商业上合理的最大努力,促使本公司完成对目标公司截至2022年12月31日和2021年12月31日的财务报表的审计,并在随后结束的财政年度内(I)应根据公认会计准则编制,
应在指明的期间内一致适用(但任何经审计的财务报表,在其附注和主题中明确指出的除外)。在任何未经审计的财务报表的情况下,对于正常的年终审计调整(无论是单独的还是总体的,预计都不会是实质性的),并且没有附注,(Ii)应在所有重要方面公平地列报
目标公司的财务状况、经营业绩、股东赤字和现金流量,
如适用,在其日期和其中所示的期间内(如果是任何未经审计的财务报表,则受
正常的年终审计调整的制约)(预计这些都不是,(3)任何经审计的财务报表,应(A)在提交初始注册报表时由PCAOB的合格审计师根据GAAP和PCAOB的标准进行审计,(B)应包含目标公司的
核数师的无保留意见报告,且(C)应在所有重大方面与提供给买方的同期未经审计财务报表基本相同,以及(Iv)应在所有重大方面遵守适用的会计要求,以及于各自交割日期有效的美国证券交易委员会、交易法和证券法的规则和规定
(包括S-X条例或S-K条例(视情况适用))。此外,各卖方应与买方和公司进行合理合作,
促使公司尽其最大努力向买方交付目标公司的任何财务报表或类似报告,
要求包括在登记声明中的任何财务报表或类似报告,或与本协议或任何其他交易文件拟进行的交易相关的任何其他美国证券交易委员会备案文件。
(B)
卖方应与买方合理合作,促使目标公司(I)在接到书面通知后,在正常的
营业时间内,以不无理干扰目标公司正常运营的方式,协助目标公司及时编制要求包括在登记声明中的任何其他财务信息或报表(包括惯常的备考财务报表),以及(Ii)征得目标公司审计师的同意(如果适用)。对于适用法律可能要求或美国证券交易委员会提出的要求。
6.18公司股票期权交换。在转换时,任何公司股权计划下尚未发行的每一项公司股票期权,无论是否归属,都应由买方承担,并转换为获得以下权利:(A)获得买方普通股股份的选择权(每股,一股)。假定的选项“)或(B)买方及本公司同意的其他衍生证券,但在上述任何一种情况下,均须受紧接收市前适用于该公司的条款及条件(包括但不限于其中的归属及加速条款)所规限,但其中对本公司或本公司普通股的任何提及将分别指买方及买方普通股。每项认购股权应:(I)代表取得若干买方普通股股份的权利(向上舍入至最接近的整数
数字),等于(A)在紧接收市前受相应公司购股权约束的公司普通股数目乘以(B)交换比率;及(Ii)行使价(向下舍入至最接近的整数仙)
等于(A)相应公司购股权的行使价除以(B)交换比率的商数。
6.19 CFIUS。
(a)
根据本第6.19节并根据《商标法》,在买方的选择下,除非买方另行通知本公司,或应CFIUS的要求,卖方、本公司和买方应向CFIUS提交或促使向CFIUS提交一份联合声明或通知(“CFIUS备案“)对于交易,应尽可能迅速,但在任何情况下不得迟于本协议日期后六十(60)天。卖方、公司和/或买方应准备并提交一份CFIUS备案草案,然后努力迅速敲定并提交一份CFIUS最终备案文件,解决从CFIUS收到的关于CFIUS备案草案的任何意见或问题。双方应在三(3)个工作日内(在CFIUS通知的情况下)和两(2)个工作日(在CFIUS声明的情况下)
内或CFIUS询问的截止日期之前,协助并提供准备CFIUS备案所需的任何信息和文件,并向CFIUS提供CFIUS在评估、(如果适用)审查、(如果适用)审查(以及,如果适用,还包括调查)
过程中要求的任何附加或补充信息。在就交易向CFIUS提交通知的情况下,向CFIUS支付的申请费应由买方承担。
(B)
当事各方应并应促使各自的关联公司真诚合作:(I)在收到当事各方从当事各方收到或向CFIUS提供的关于任何此类备案、提交、诉讼或交易的任何实质性通知后,立即通知当事另一方或其律师;(Ii)允许每一其他缔约方或其律师事先合理地审查和讨论,并真诚地考虑每一其他缔约方或其律师对它将向CFIUS提供的任何拟议的实质性沟通的意见,(Iii)就任何面对面会议以及由该缔约方发起或事先与CFIUS或该私人当事人安排的任何电话会议,向每一其他缔约方或其律师发出合理的事先通知,并且在未给予每一另一方或其律师合理的出席和参与的机会或如果该另一方或其律师没有出席或参与,应事先合理地与该另一方或其律师协商,并真诚地考虑该另一方或其律师与此有关的意见。
(C)
各方应相互合作,在各自权力范围内尽最大努力采取一切此类行动,以获得CFIUS的批准,在不限制上述规定的情况下,各方应在不限制前述规定的情况下,同意CFIUS可能要求或要求的、或作为CFIUS批准条件的要求或条件,包括签订缓解协议、保函或国家安全协议,以缓解任何国家安全顾虑。但条件是:(1)双方没有义务(A)通过同意法令,提出、谈判、承诺或实施单独的订单、协议或其他方式,出售、转让、许可、剥离或以其他方式处置买方或其任何关联公司或卖方的任何业务、产品线或资产,(B)终止买方或其关联公司的现有关系或建立新的关系、合同权利或义务,(C)实现买方或其关联公司的任何其他变化或重组,或(D)以其他方式
采取或承诺采取任何合理预期会对卖方业务的运营产生重大不利影响的行动,或干扰买方控制本公司的能力或干扰买方在任何重大方面指导本公司的管理和政策的能力的任何行动。和(2)未经买方事先书面同意,公司和卖方不得采取或同意采取上述任何行动。
第七条
生死存亡
7.1生存。
(A)
在符合本协议的限制和其他规定的情况下,本协议第三条和第四条中包含的陈述和保证在关闭后仍然有效,并在转换之前保持十足效力,而本协议第五条中包含的陈述和保证
在关闭后继续有效,并在关闭一周年之前保持完全效力。尽管如上所述,在适用的存活期
到期之前,非违约方向违约方发出书面通知,以合理的具体程度(在当时已知的范围内)真诚地提出的任何索赔,此后不得因相关陈述或保修到期而被禁止,此类索赔应一直有效,直到
最终解决为止。
(B)
本协定所载的契诺在关闭后仍然有效,并保持完全效力,直至转换为止。
7.2换算调整
(A)
买方索赔。直至(I)股东批准或(Ii)2024年6月30日(“索赔截止日期),买方可以就任何和所有损失、责任、损坏、索赔、罚款、罚款、没收、诉讼、费用、成本和开支(统称为)向公司和卖方提出索赔。损失“)买方因以下原因而招致或维持或强加于买方的:(I)本协议或本公司根据本协议交付的任何证书或文书中所载的任何陈述或保证中的任何不准确之处或违反该等陈述或保证的情况,截至作出该等陈述或保证的日期,或犹如该陈述或保证是在截止日期或截止日期作出的一样(明确与指定日期有关的陈述和保证除外)。将参照该指定日期确定其中的不准确或违反情况);或(Ii)违反或不履行根据本协议须由公司履行的任何契诺、协议或义务。
(B)卖方的索赔。在索赔截止日期之前,卖方代表可代表卖方就卖方招致或遭受或强加给卖方的任何损失向买方提出索赔,索赔的依据是:(I)本协议或根据本协议由买方或其代表提交的任何证书或文书中所包含的买方陈述或保证的任何错误或违反;自作出该陈述或保证之日起,或视为该陈述或保证是在截止日期当日作出的(明确与指定日期有关的陈述和保证除外,其不准确或违反将参照该指定日期确定);(Br)或(Ii)违反或不履行根据本协议买方应履行的任何契约、协议或义务。
(C)
调整。在符合本协议规定的限制的前提下,转换后发行的普通股数量应
增加或减少一个数字,该数字通过将净调整(如本文定义)除以截止日期前第三天前十(10)天期间买方普通股的十日VWAP确定,并向下舍入到最接近的整数股;但条件是:(I)如果净调整金额少于1,000,000美元,则转换后发行的普通股数量不得调整;(Ii)转换后发行的普通股数量不得增加或减少超过在没有调整的情况下可发行普通股数量的10%。
(D)
程序。买方和卖方代表可根据第7.2节第(A)或(B)款分别提出索赔,方法是在索赔截止日期或之前向其他各方发出书面通知,详细说明索赔依据和每项索赔造成的损失估计。在索赔截止日期后的两(2)个工作日内,买方和卖方代表应会面,并以合理的诚意努力解决与根据本第7.2条提出的任何索赔有关的任何分歧。如果在索赔截止日期后五(5)个工作日内未能获得最终解决方案,买方和卖方代表应共同保留玛泽美国有限责任公司或其附属公司或另一家双方均可接受的争议解决公司(坚定买方和卖方代表应指示公司尽快作出决定,公司应在保留后三十(30)天内采取商业上合理的努力作出决定,买方、卖方代表及其各自的代理人应在公司聘用期间与公司合作。公司可以只考虑买方和卖方代表无法解决的索赔通知中的那些项目和金额。在解决任何有争议的物品时,公司
不得为任何物品分配大于任何一方所要求的最大价值或小于任何一方所要求的最小价值的任何物品的价值。公司的决定应完全基于买方和卖方代表或其各自代理人的书面陈述或口头陈述,符合本协议中规定的条款和程序(即,不是基于独立审查)以及本协议中包括的定义。未经卖方代表(如果是买方)或买方(如果是卖方代表)事先同意,任何一方(或其各自的代表)
不得与公司进行任何单方面对话或会议,不得进行任何听证或口头审查、证词、证词、证据开示或其他类似程序。如果公司要求,买方和卖方代表均应签署符合本协议条款的合理且惯常的订约函。在没有明显错误或欺诈的情况下,公司的裁决应是最终的、决定性的,对买方和卖方代表具有约束力,并可作为仲裁裁决在任何有管辖权的法院强制执行,根据《联邦仲裁法》或其州法律等价物的条款。
公司的费用和费用应由买方和卖方代表平均承担。前提是,,公司有权根据卖方代表和买方的实际索赔金额中未判给双方的争议金额部分,在卖方代表和买方之间分配费用。如本文所使用的,“净调整额“指经买方和卖方代表商定或由公司确定的对双方当事人有利的合计损失调整额之间的差额的绝对值。
(E)
仅为计算因违反本协议中的任何陈述或保证而引起或造成的任何损失的金额,任何此类陈述或保证中提及的“材料”或“重大不利影响”
或类似的限制应不予考虑。
7.3卖方的赔偿
(A)
由各卖方赔偿。每一卖方应单独而非共同地赔偿和保护每一买方及其关联公司及其各自的代表(统称为买方赔付对象“)反对,并应使他们中的每一人不受损害,并应向他们中的每一人支付和补偿买方受赔人因下列原因而招致或遭受的任何和所有损失:(I)本协议或根据本协议由卖方或其代表交付的任何证书或文书中的任何不准确或违反卖方的陈述或保证,截至作出该陈述或保证之日,或视为该陈述或保证是在截止日期作出的(明确与指定日期有关的陈述和保证除外,其不准确或违反将参照该指定日期确定);(Ii)违反或不履行根据本协议卖方应履行的任何契约、协议或义务。
(B)
限制。尽管本协议有任何相反规定,双方明确承认并同意,任何卖方因任何买方受赔人提出的赔偿要求而应支付的任何款项,应仅通过求助于可在转换时发行的交易所股票和买方普通股来支付,买方普通股的每股价值为用于确定交换比例的买方普通股的每股价格。
(C)
赔偿程序.
(I)
直接索赔。买方受赔人因损失(A)而采取的任何行动直接索赔“)根据本第7.3条的规定进行赔偿时,买方受赔方应向卖方发出合理及时的书面通知,但无论如何不得迟于买方受赔方知道此类直接索赔后三十(30)日。然而,未能及时发出书面通知不应解除卖方的赔偿义务,除非且仅在卖方因此而丧失权利或抗辩的范围内。买方受赔方发出的此类通知应合理详细地描述直接索赔,应包括其所有材料的副本,并应在合理可行的情况下说明买方受赔方已经或可能遭受的损失的估计金额。卖方应在收到此类通知后三十(30)天内对此类直接索赔作出书面答复。买方受赔人应允许卖方及其专业顾问调查所称的引起直接索赔的事项或情况,以及是否以及在多大程度上应就直接索赔支付任何款项,买方受赔人应提供卖方或其任何专业顾问
可能合理要求的信息和协助(包括进入公司的办公场所和人员,以及检查和复制任何账目、文件或记录的权利),以协助卖方的调查。如果卖方在该三十(30)天期限内没有作出回应,则卖方应被视为驳回了此类索赔,在这种情况下,买方受赔方有权根据本协议的条款,自由地寻求买方受赔方可采取的补救措施。
(Ii)
第三方索赔。
(A)
如果任何买方受赔人收到本协议一方以外的任何人或本协议一方的关联方或前述(A)的代表提出或提起的任何诉讼的主张或开始的通知
第三方索赔“)对于卖方根据第7.3条有义务提供赔偿的买方受赔人,买方受偿人应合理地及时向卖方发出书面通知,但在任何情况下不得迟于收到此类第三方索赔通知后三十(30)天。然而,未能及时发出书面通知不应解除卖方的赔偿义务,但仅限于卖方因此而丧失权利或抗辩的情况除外。买方受赔方发出的此类通知应合理详细地描述第三方索赔,应包括所有书面材料的副本,并应在合理可行的情况下说明买方受赔方已经遭受或可能遭受的损失的估计金额。卖方有权
参与或以书面通知买方受赔方,由卖方承担费用并由卖方自己的律师承担任何第三方索赔的抗辩,买方受偿方应真诚配合此类抗辩;但卖方无权就(X)直接由作为公司供应商或客户的人或其代表提出的任何此类第三方索赔提出抗辩,或(Y)寻求针对受赔方的禁令或其他衡平法救济。如果卖方在符合第7.3(C)条的规定下为任何第三方索赔辩护,则卖方有权
采取其认为必要的行动,以买方受赔方的名义和代表买方避免、争议、抗辩、上诉或提出与此类第三方索赔有关的反索赔。买方受赔方有权参与任何第三方索赔的辩护
,并由买方选定律师,但卖方有权承担其辩护责任。此类律师的费用和支出应由买方受赔方承担,但前提是,如果买方受赔方的律师
合理地认为,买方受赔方是指定的被告,并且(A)买方受赔方有与卖方不同的法律抗辩,或有其他法律抗辩;或(B)卖方与买方受偿方之间存在不可放弃的利益冲突。如果卖方选择不为该第三方索赔辩护,或未能努力为该第三方索赔辩护,则买方受赔方可以支付、妥协和/或辩护该第三方索赔,并要求赔偿基于该第三方索赔、由该第三方索赔引起的或与该第三方索赔有关的任何和所有损失。卖方和买方应在所有与第三方索赔辩护相关的合理方面相互合作,包括提供(在符合第6.8节的规定的前提下)与该第三方索赔有关的记录,并向防御方提供为准备该第三方索赔辩护而可能合理需要的非防御方的管理人员,但不收取任何费用(实际自付费用除外)。
(B)
尽管本协议有任何其他规定,但除第7.3条另有规定外,未经买方受赔方事先书面同意,卖方不得就任何第三方索赔达成和解。如果提出实盘以了结第三方索赔,而不导致买方承担责任或产生财务或其他义务,并以惯例形式规定无条件免除每名买方与该第三方索赔有关的所有责任和义务,而卖方希望接受并同意该要约,则卖方应就此向买方受赔方发出书面通知。如果买方被保险人在收到通知后十(10)天内未能同意该实盘,买方被保险人可以继续对该第三方索赔提出异议或提出抗辩,在这种情况下,卖方对该第三方索赔的最高责任不得超过该和解要约的金额。如果买方被赔付人未能同意该实盘,也未承担该第三方索赔的抗辩责任,卖方可根据该实盘中规定的条款解决该第三方索赔。如果买方根据卖方条款承担了抗辩责任(卖方同意不得被无理拒绝、附加条件或拖延)。
7.4独家补救措施。根据第9.6条的规定,双方承认并同意,对于违反本协议所述或与本协议标的有关的任何陈述、保证、契诺、协议或义务的任何索赔(本协议一方因欺诈、犯罪活动或故意不当行为而提出的索赔除外),双方应根据本第七条中规定的规定
采取唯一和排他性的补救措施。为促进上述规定,各方特此在法律允许的最大范围内放弃。因违反本协议所载或与本协议标的有关的任何陈述、保证、契约、协议或义务而产生或基于任何法律而产生或基于任何法律的任何权利、索赔和诉讼理由。本节7.4中的任何规定均不限制任何人寻求和获得任何公平救济的权利,任何人有权因任何一方的欺诈行为而获得任何公平救济,或因任何一方的欺诈行为而寻求任何补救。
犯罪或故意不当行为。
7.5共享托管。如果在转换时,买方或其关联公司已及时提出的索赔
仍未根据本第七条的规定得到解决,则受本协议的限制和其他条款的约束,买方应发行价值超过买方或其关联公司所有未解决索赔总额的所有买方普通股,并应将未解决索赔金额中的剩余股份存入第三方托管帐户,由买方和卖方代表商定。如果在转换时卖方代表及时提出的索赔仍未根据第七条的规定得到解决,买方还应将未解决的索赔金额的额外买方普通股股份存入第三方托管代理的托管账户,由买方和卖方代表商定。
第八条
豁免和放行
8.1释放和约定不起诉。自成交之日起生效,在适用法律允许的最大范围内,每一位卖方,
代表自己及其关联公司,在该卖方中拥有任何股份或其他股权(“释放
人“),特此免除和免除目标公司和买方在法律和衡平法上的任何和所有已知或未知的行动、义务、协议、债务和责任,这些行为、义务、协议、债务和责任,无论是已知的还是未知的,在法律上和衡平法上都是如此。
在截止日期当日或之前发生的任何事项,或者由于目标公司在截止日期或之前发生的任何事项,包括从目标公司获得赔偿或补偿的任何权利,
无论是根据目标公司的组织文件、合同或其他规定,
曾经或此后可能对目标公司具有或可能具有。以及是否与在截止日期待决或在截止日期之后提出的索赔有关。自交易结束起及结束后,各豁免人在此不可撤销地承诺,不会直接或
间接地对目标公司或其各自的关联公司采取任何行动,或开始或导致开始任何针对目标公司或其各自关联公司的任何行动,其依据是本协议所声称的任何豁免事项。尽管本协议有任何相反规定,但本协议规定的免责条款和限制不适用于免责人根据本协议或任何附属文件的条款和条件或附表8.1中规定的任何其他事项对任何一方提出的任何索赔。
第九条
其他
9.1通知。本协议项下的所有通知、同意、豁免和其他通信应以书面形式进行,并且在(I)当面送达时,(Ii)如果在晚上11:59之前通过电子邮件发送,应被视为已
正式发出。(收件人时间),在发送时;
(Iii)如果是在工作日以外的日子通过电子邮件发送,或者如果是在晚上11:59之后通过电子邮件发送。(收件人时间),在发送之日之后的营业日;(Iv)如果通过信誉良好的全国公认的隔夜快递服务发送,则在发送后一个工作日;或(V)如果通过挂号信或挂号信发送,则在邮寄后三(3)个工作日要求预付并要求退回收据
,在每种情况下,请按下列地址(或类似通知指定的当事人的其他地址)将收据发送给适用方:
如果在成交前或成交后
给买方,则:
Blue
Water Biotech,Inc.东五街201号,1900号套房
俄亥俄州辛辛那提,邮编:45202
联系人:首席执行官尼尔·坎贝尔博士
电话:(301)792-4345
电子邮件:ncampbell@bwBioinc.com
|
请
将副本(不构成通知)发送至:
Ellenoff
Grossman&Schole LLP
美洲大道1251号
纽约,纽约10020
联系人:巴里·I·格罗斯曼,Esq.
David,兰道,Esq.
电话号码:(212)370-1300
电子邮件:bigrossman@egsllp.com和
邮箱:dlandau@egsllp.com
|
如果在转换前向公司支付了
,则为:
Proteomedex
AG
Wagstrasse 23
8952纹影
瑞士
联系人:CEO拉尔夫·希斯
电话:+41 44 733 40 90
电子邮件:schess@proomedix.com
|
请
将副本(不构成通知)发送至:
Nelson
Mullins Riley&Scarborough LLP
一号金融中心
马萨诸塞州波士顿,邮编:02111
收信人:本杰明·M·赫伦
电话:(617)217-4607
电子邮件:ben.hron@nelsonmullins.com |
如果将
发送给任何卖家,则:
卖方在本合同签字页上签字后所列的卖方地址
|
请
将副本(不构成通知)发送至:
Vischer
AG
埃舍恩沃施塔特4
邮政信箱,CH-4010巴塞尔
注意:马蒂亚斯·斯塔赫林博士
电话号码:+41 58 211 33 53
电子邮件:mstaehelin@vischer.com
|
如果
致卖方代表:
托马斯·梅尔
C/o Viopas Venture Consulting GmbH
瑞士巴塞尔17号;CH-4053
电话:+41 78 756 34 05
电子邮件:Thomas@viopasventure.ch
|
请
将副本(不构成通知)发送至:
Vischer
AG
埃舍恩沃施塔特4
邮政信箱,CH-4010巴塞尔
注意:马蒂亚斯·斯塔赫林博士
电话号码:+41 58 211 33 53
电子邮件:mstaehelin@vischer.com
|
如果在转换后将
转至公司,则转至:
蓝色
水生物科技公司
东五街201号,1900套房
俄亥俄州辛辛那提,邮编:45202
联系人:首席执行官尼尔·坎贝尔博士
电话:(301)792-4345
电子邮件:ncampbell@bwBioinc.com |
请
将副本(不构成通知)发送至:
Vischer
AG
埃舍恩沃施塔特4
邮政信箱,CH-4010巴塞尔
注意:马蒂亚斯·斯塔赫林博士
电话号码:+41 58 211 33 53
电子邮件:mstaehelin@vischer.com
|
9.2有约束力;转让。本协议和本协议的所有条款对本协议双方及其各自的继承人和允许的受让人具有约束力,并符合其利益。未经买方和公司(以及成交后卖方代表)的事先书面同意,不得通过法律实施或其他方式转让本协议,未经卖方代表同意的任何转让均无效;但此类转让不得解除转让方在本协议项下的义务。
9.3第三方。除第6.13节规定的D&O受赔人的权利外,双方承认并同意这些权利是本协议的明示第三方受益人,本协议或任何一方就本协议拟进行的交易而签署的任何文书或文件
中所包含的任何内容,均不得产生任何权利,也不应被视为为并非本协议或其继承方或允许受让方的任何人的利益而签立的任何权利。
9.4适用法律;管辖权。除转让购买的股份外,本协议应受特拉华州法律管辖、解释和执行,而不考虑其法律冲突原则。包括所有权,
根据第2.2(F)至(I)节规定的任何相关权利和与之相关的物品,应受瑞士实体法管辖并根据瑞士实体法解释,但不包括国际私法原则。所有因本协议引起或与本协议有关的诉讼应由位于特拉华州的任何州或联邦法院(或其任何上诉法院)进行审理和裁决。指明的法院“)。本协议每一方特此(A)就本协议引起或与本协议有关的任何诉讼向
提交任何指定法院的专属管辖权,(Br)不可撤销地放弃,并同意不以动议、抗辩或其他方式在任何此类诉讼中主张
其本人不受上述法院管辖、其财产豁免或免于
扣押或执行、诉讼在不方便的法院提起、诉讼地点不当、或本协议或本协议拟进行的交易不得在任何指定法院或由任何指定法院强制执行。各方同意,任何诉讼中的最终判决应为终局性判决,可在其他司法管辖区通过诉讼或法律规定的任何其他方式强制执行。每一方均不可撤销地同意在与交易有关的任何其他诉讼中,代表其本人或其财产,通过亲自将该程序的副本交付至第9.1节规定的适用地址,向该方送达传票和申诉以及任何其他程序。第9.4节中的任何规定均不影响任何一方以法律允许的任何其他方式履行法律程序的权利。
9.5 放弃陪审团审判。本协议的每一方在适用法律允许的最大限度内,放弃就因本协议或本协议拟进行的交易而直接或间接引起的、根据本协议或与本协议有关的任何诉讼而享有的由陪审团进行审判的权利。本协议的每一方(A)证明,没有任何其他方的代表明确或以其他方式表示,在发生任何行动时,该另一方不会寻求强制执行前述放弃,并且(B)承认IT和本协议的其他各方是受本协议的引诱而签订本协议的,其中包括本节中的相互放弃和证明。9.5.
9.6具体表现。每一方都承认每一方完成本协议所设想的交易的权利是独一无二的
,承认并确认在任何一方违反本协议的情况下,金钱赔偿可能是不够的,并且非违约方可能在法律上没有足够的补救办法,并同意如果适用一方没有按照其特定条款履行本协议的任何条款或以其他方式违反
,将会发生不可弥补的损害。因此,每一方均有权寻求禁止令或限制令以防止违反本协议
并具体执行本协议的条款和规定,而无需提交任何保证书或其他担保或证明金钱损害将是不够的,这是该各方根据本协议在法律或衡平法上有权享有的任何其他权利或补救之外的权利或补救措施。
9.7可分割性。如果本协议中的任何条款在一个司法管辖区被认定为无效、非法或不可执行,则仅在使其有效、合法和可执行所必需的范围内,才应就所涉司法管辖区修改或删除该条款。本协议其余条款的有效性、合法性和可执行性不应因此而受到任何影响或损害,也不会因此而影响该条款在任何其他司法管辖区的有效性、合法性或可执行性。
在确定任何条款或其他条款无效、非法或无法执行后,双方将用
替代任何无效的条款或其他条款。非法或不可执行的规定在可能有效的情况下,执行此类无效、非法或不可执行的规定的意图和目的的适当和公平的规定。
9.8修正案。本协议只能通过签署由买方、本公司和卖方代表签署的书面文件来修改、补充或修改;但未经卖方事先书面同意,任何修改、补充或修改不得以与其他卖方不相称的方式对卖方造成重大影响,
前提是,在买方股东批准交易(视情况而定)后,未经进一步批准,不得进行根据法律需要该等股东进一步批准的修改。
9.9豁免。买方和本公司代表其本身及其关联公司以及代表其代表的每一卖方均可自行决定
(I)延长任何其他非关联方履行义务或其他行为的时间,(Ii)放弃该其他非关联方或根据本协议交付的任何文件中的任何不准确的陈述和担保,以及(Iii)放弃该其他非关联方遵守本文所载的任何约定或条件。任何此类延期或豁免只有在一方或受其约束的一方(包括在本协议规定的范围内由卖方代表代替该方)签署的书面文书中规定的情况下才有效。尽管有上述规定,一方未能或延迟行使本协议项下的任何权利,不应视为放弃该权利,也不能因此而阻止其他或进一步行使本协议项下的任何其他权利。尽管有上述规定,但在交易结束后放弃本协议的任何条款也应事先征得卖方代表的书面同意。
9.10整个协议。本协议和本协议所指的文件或文书,包括本协议所附的任何证物、附件和附表
,这些证物、附件和附表以引用方式并入本协议,连同附属文件,体现了本协议双方关于本协议所含标的事项的完整协议和谅解。除此处明确规定或提及的或此处提及的文件或文书外,不存在任何限制、
承诺、陈述、保证、契诺或承诺,这些限制、承诺、陈述、保证、契诺或承诺将共同取代所有先前的协议以及各方之间关于本协议所含标的的谅解。
9.11 Interpretation. The table of contents and the Article and Section headings contained in this Agreement are solely for the purpose
of reference, are not part of the agreement of the Parties and shall not in any way affect the meaning or interpretation of this Agreement.
In this Agreement, unless the context otherwise requires: (a) any pronoun used in this Agreement shall include the corresponding masculine,
feminine or neuter forms, and words in the singular, including any defined terms, include the plural and vice versa; (b) reference to
any Person includes such Person’s successors and assigns but, if applicable, only if such successors and assigns are permitted
by this Agreement, and reference to a Person in a particular capacity excludes such Person in any other capacity; (c) any accounting
term used and not otherwise defined in this Agreement or any Ancillary Document has the meaning assigned to such term in accordance with
GAAP, as applicable, based on the accounting principles used by the applicable Person; (d) “including” (and with correlative
meaning “include”) means including without limiting the generality of any description preceding or succeeding such term and
shall be deemed in each case to be followed by the words “without limitation”; (e) the words “herein,” “hereto,”
and “hereby” and other words of similar import in this Agreement shall be deemed in each case to refer to this Agreement
as a whole and not to any particular Section or other subdivision of this Agreement; (f) the word “if” and other words of
similar import when used herein shall be deemed in each case to be followed by the phrase “and only if”; (g) the term “or”
means “and/or”; (h) any reference to the term “ordinary course” or “ordinary course of business”
shall be deemed in each case to be followed by the words “consistent with past practice”; (i) any agreement, instrument,
insurance policy, Law or Order defined or referred to herein or in any agreement or instrument that is referred to herein means such
agreement, instrument, insurance policy, Law or Order as from time to time amended, modified or supplemented, including (in the case
of agreements or instruments) by waiver or consent and (in the case of statutes, regulations, rules or orders) by succession of comparable
successor statutes, regulations, rules or orders and references to all attachments thereto and instruments incorporated therein; (j)
except as otherwise indicated, all references in this Agreement to the words “Section,” “Article”, “Schedule”,
“Annex” and “Exhibit” are intended to refer to Sections, Articles, Schedules, Annexes and Exhibits to this Agreement;
and (k) the term “Dollars” or “$” means United States dollars. Any reference in this Agreement to a Person’s
directors shall include any member of such Person’s governing body and any reference in this Agreement to a Person’s officers
shall include any Person filling a substantially similar position for such Person. Any reference in this Agreement or any Ancillary Document
to a Person’s shareholders or stockholders shall include any applicable owners of the equity interests of such Person, in whatever
form. The Parties have participated jointly in the negotiation and drafting of this Agreement. Consequently, in the event an ambiguity
or question of intent or interpretation arises, this Agreement shall be construed as if drafted jointly by the Parties hereto, and no
presumption or burden of proof shall arise favoring or disfavoring any Party by virtue of the authorship of any provision of this Agreement.
To the extent that any Contract, document, certificate or instrument is represented and warranted to by the Company to be given, delivered,
provided or made available by the Company, in order for such Contract, document, certificate or instrument to have been deemed to have
been given, delivered, provided and made available to Buyer or its Representatives, such Contract, document, certificate or instrument
shall have been posted to the electronic data site maintained on behalf of the Company for the benefit of Buyer and its Representatives
at least two (2) Business Days prior to the date of this Agreement and Buyer and its Representatives have been given access to the electronic
folders containing such information. To the extent that any Contract, document, certificate or instrument is represented and warranted
to by Buyer to be given, delivered, provided or made available by Buyer, in order for such Contract, document, certificate or instrument
to have been deemed to have been given, delivered, provided and made available to the Company or its Representatives, such Contract,
document, certificate or instrument shall have been (i) filed publicly or (ii) posted to the electronic data site maintained on behalf
of Buyer for the benefit of the Company and its Representatives at least two (2) Business Days prior to the date of this Agreement and
the Company and its Representatives have been given access to the electronic folders containing such information.
9.12同行本协议可签署并交付(包括通过传真或其他电子传输方式)一份或多份副本,并可由本协议的不同当事人签署并交付单独的副本,每份副本在签署后均应视为原件,但所有副本合在一起应构成同一份协议。
9.13卖方代表。
(a)
每一卖方代表其自身及其继承人和受让人,任命Thomas Meier作为其在本协议项下的代理人、代理人、实际律师和代表
(在此身份下,“卖方代表“),并授权和指示卖方代表以卖方名义和代表卖方采取必要或适当的任何和所有行动,以行使或履行卖方在本协议或任何其他附属文件项下的权利、权力和义务,并以完全替代权完成本协议或任何其他附属文件所规定的交易,包括行使经授权的权利、权力和授权,以卖方的名义、地点和代替卖方行事。根据本协议委托并授予卖方代表
(包括根据本协议条款
代表卖方接收通知和其他文件的权利)。通过本协议的签署,每一位卖方在此授权、委托和授予卖方的代表权,以采取本协议和任何附属文件规定的卖方将采取的所有行动。卖方代表的所有
决定和行动,包括卖方代表和买方之间就本协议项下卖方可能被要求赔偿的任何索赔的抗辩或和解达成的任何协议,应对所有卖方具有约束力
,卖方无权反对、异议、抗议或以其他方式对此提出异议,买方有权在所有方面依赖这些决定和行动,且对于卖方代表根据本节采取的任何行动,卖方代表不对任何卖方承担任何责任。这一节的规定是不可撤销的,并附带利息。
(I)
每名卖方同意,卖方代表(I)不对根据本协议或任何附属文件或据此预期的交易而采取或未采取的任何行动承担责任
,且(Ii)不因卖方或公司根据本协议或任何附属文件采取的行动而对其承担任何受信责任或负有任何受信责任
。
(Ii)
每名卖方应赔偿卖方代表,并使其免受卖方代表因接受或管理本协议项下的卖方代表职责而产生或与之有关的任何损失,包括卖方代表聘请的任何法律顾问的合理费用和开支。在任何情况下,卖方代表在本合同项下或与本合同有关的情况下,不对任何间接、惩罚性、特殊或后果性损害承担责任。卖方代表应充分保护卖方不受其善意相信真实的任何书面通知、要求、证书或文件的影响,包括其传真件或副本。在履行其在本协议项下的权利和义务时,卖方代表有权在任何时候和
不时选择和聘用卖方、律师、会计师、投资银行家、顾问、顾问和文书人员,并获得卖方代表可能认为必要或适当的其他专业和专家协助、保存该等记录和产生其他自付费用。所有的赔偿,
根据本节授予卖方代表的豁免权、豁免权和权力在结案后继续有效。
文章
X
定义
10.1某些定义。就本协议而言,下列大写术语具有以下含义:
“行动“
指任何政府当局发出或提交的任何关于不遵守规定或违规的通知,或任何索赔、要求、指控、诉讼、诉讼、审计、和解、投诉、规定、评估或仲裁,或任何请求(包括任何信息请求)、查询、听证、程序或调查。
“附属公司“就任何人而言,
是指直接或间接控制、由该人控制或与该人共同控制的任何其他人。
“合计
买方普通股“指(A)交易所对价除以(B)买方普通股在成交日前第三天前十(10)天期间的十日VWAP所得的商数。
“辅助文档
“指作为本协议附件的每一份协议、文书或文件,包括竞业禁止协议和非招标协议、认购协议、B系列指定证书、禁售协议以及本协议任何一方根据本协议或根据本协议签署或交付的其他协议、证书和文书。
“福利
计划“任何人指任何和所有递延薪酬、高管薪酬、激励性薪酬、股权购买或其他基于股权的薪酬计划、雇佣或咨询、遣散费或解雇工资、假期、假期或其他奖金计划或执业、住院或其他医疗、人寿或其他保险、补充失业福利、利润分享、养老金、
或退休计划、计划、协议、承诺或安排,以及每个其他员工福利计划、计划、协议或安排,
包括根据瑞士ERISA第3(3)条或任何类似法律定义的每个”员工福利计划“。
某人为该
个人的任何雇员或被解雇的雇员的利益而维护、出资或要求出资,或该人对其负有任何责任,无论是直接或间接的、实际的还是或有的,无论是正式的还是非正式的,也无论是否具有法律约束力。
“营业日
天“指周六、周日或法定节假日以外的任何一天,纽约的商业银行机构被授权关门营业;但如果银行的电子资金转账系统(包括电汇转账)在这一天开放供客户使用,则银行不得被视为获得授权或有义务关闭
银行在任何政府当局指示下的”庇护所就位“或类似的关闭实体分行地点。
“买家
普通股“指买方的普通股,每股票面价值0.00001美元。
“买方
公司“指买方及其直接和间接子公司。
“买家
机密信息“指与买方或其任何关联公司有关的所有机密或专有文件和信息;但是,买方保密信息不应包括以下信息:(I)在公司、任何卖方或其各自的代表披露时,普遍公开且未违反本协议披露的任何信息,或(Ii)买方或其代表向本公司、任何卖方或其各自的代表披露信息时,该接收方事先已知晓的任何信息,且没有违反法律或接收该买方保密信息的人的任何保密义务。
“买方
中期资产负债表指买方在其截至2023年9月30日的季度报告10-Q表中包含的资产负债表,该报告于2023年10月20日提交给美国证券交易委员会。
“买方
优先股指买方持有的B系列优先股,每股票面价值0.00001美元。
“买方
证券“指买方普通股、买方优先股和买方股票期权,统称为。
“买方
股票期权“指购买买方普通股股份的选择权。
“CFIUS“
指美国外国投资委员会和代表该委员会行事的每个成员机构。
“CFIUS
批准“指当事各方已收到CFIUS的书面通知,大意是:(A)交易不受《DPA》约束;(B)CFIUS已确定与该交易有关的没有悬而未决的国家安全顾虑,并已根据《DPA》完成所有诉讼;(C)如果CFIUS已向美国总裁发送报告
,则(I)美国总裁应已根据
决定不使用其权力暂停、限制或禁止交易的完成,或(Ii)中分配给总统行动的期限
已过,而美国的总裁并未作出任何决定。
“代码“
指经修订的1986年《国内税法》及其任何经修订的后续法规。对《守则》某一具体章节的引用应包括该章节以及根据该章节颁布的任何有效的国库条例。
“公司
机密信息“指与本协议或本协议拟进行的交易相关而提供的有关目标公司或卖方或其任何关联公司的所有机密或专有文件和信息;但条件是,公司保密信息不应包括以下任何信息:(I)在公司或其代表披露时,一般公开且未违反本协议披露的任何信息,或
(Ii)在公司披露时,卖方代表、卖方或其各自的代表
在没有违反法律或任何保密义务的情况下,事先为买方或其代表所知的任何信息。
“公司
可转换证券“指认购或
认购或
购买本公司任何股本或可转换为或可交换的证券,或以其他方式赋予持有人任何权利以收购本公司任何股本的任何购股权、限制性股票单位、认股权证或权利。
“公司
全额稀释股份金额“指截至紧接收市前,(A)公司已发行股份总数及(B)行使已发行公司股份期权时可发行的公司股份总数的总和。
按财务会计方法计算。
“公司
流通股“指在本公司可换股证券生效后,于紧接
收市前发行及发行的本公司股份总数。
“公司
证券“统称为公司股票、任何公司股票期权和任何其他公司可转换证券。
“公司
股票“指公司的普通股,每股面值1.00瑞士法郎。
“公司
股票期权“指购买公司股票的选择权。
“同意书“
指任何政府当局或任何其他人的任何同意、批准、放弃、授权或许可,或向任何政府当局或任何其他人发出的通知或向其申报或提交的任何文件。
“合同“
指所有合同、协议、具有约束力的安排、债券、票据、契据、抵押、债务工具、购买订单、许可证
(以及与知识产权有关的所有其他合同、协议或具有约束力的安排)、特许经营权、租赁和其他文书
或任何种类的书面或口头义务(包括对其的任何修改和其他修改)。
“控制“任何人的
是指直接或间接拥有直接或间接地指导或导致该人的管理层和政策的权力
,无论是通过拥有有表决权的证券、合同还是其他方式。“受控”、“受控”和“处于共同受控状态”都有相关含义。在不限制前述规定的情况下,任何人(“受控人员
“)应被视为由(A)任何其他人控制:(I)按照《交易所法》第13d-3条的含义,实益拥有证券,使其有权投出董事选举的百分之十(10%)或以上的投票权,或有权获得受控人的利润、亏损或分派的百分之十(10%)或更多的利润、亏损或分派;(B)受控制人的高级人员、董事、普通合伙人、合伙人(有限合伙人除外)、经理或成员(不具有管理权限的成员,但不是上文(A)段所述的人);或(C)受控人的关联公司的配偶、父母、直系后裔、兄弟姐妹、阿姨、叔父、侄女、侄子、岳母、岳父、嫂子或姐夫,或受控人的关联公司或受托人的关联公司的信托。
“转换
审批” 是指在根据《特拉华州普通公司法》(修订版)和买方
组织文件召开的买方股东会议上,转换已获得买方股东的必要投票(包括
任何单独的类别或系列投票,无论是否根据买方组织文件、任何股东协议
或其他规定)的批准。
“皈依” 指
将B系列优先股的全部已发行和流通股转换为买方普通股。
“版权“
是指任何原创作品、蒙版作品及其所有版权,包括所有续展和延期、版权注册、注册和续展申请,以及未注册的版权。
“新冠肺炎“
指SARS-CoV-2或新冠肺炎,及其任何演变或任何其他相关或相关的流行病、大流行或疾病爆发。
“新冠肺炎倡议指任何政府当局(包括疾病控制中心和世界卫生组织)在每个案件中与新冠肺炎、包括冠状病毒援助、救济和经济安全法(CARE)或其任何变化有关的任何检疫、“就位避难所”、“呆在家里”、
劳动力裁减、社会隔离、关闭、关闭、扣押或任何其他法律、指令、指南或建议。
“DPA“
是指《1950年国防生产法》第721节,经修订,《美国法典》第50编§4565,以及根据其发布和生效的所有临时和最终规则和条例。
“环境法
“系指以任何方式与下列事项有关的任何法律:(a)保护人类健康和安全;(b)保护、维护或恢复环境和自然资源(包括空气、水蒸气、地表水、地下水、饮用水供应、
地表土地、地下土地、植物和动物或任何其他自然资源),或(c)暴露于或使用、储存、回收,
危险材料的处理、产生、运输、加工、搬运、贴标签、生产、释放或处置。
“环境责任
“对任何人而言,指因任何其他人的任何索赔或要求或因任何违反环境法的行为而产生的所有责任、义务、责任、补救行动、行动、命令、损失、损害、成本和开支(包括所有合理的费用、律师、专家和顾问的支出以及调查和可行性研究的费用)、罚款、处罚、制裁和利息,无论是基于合同、侵权行为、默示或明示保证、严格责任、刑事或民事法规,根据或根据任何环境法、环境许可证、命令或与任何政府当局或其他
人员签订的合同而产生的与任何环境、健康或安全状况、违反环境法或释放或威胁释放有害物质有关的行为。
“ERISA“
指经修订的《1974年美国雇员退休收入保障法》。
“交易所
法案“指经修订的1934年美国证券交易法。
“交换
比率“指商(四舍五入至小数点后四位)除以(A)买方总普通股更少
(B)本公司全数摊薄后的债权人股份数目(按折算基准计算)。
“国外
计划“指本公司或其任何一家或多家子公司在美国境外设立或维持的任何计划、基金(包括任何退休金)或其他类似计划或安排
主要为本公司或居住在美国境外的此类附属公司的雇员的利益而设立或维持的任何计划、基金或其他类似计划或安排,而该计划、基金或其他类似计划或安排提供退休收入、因预期退休或终止雇佣关系而须支付的收入延期,以及
不受ERISA或守则约束的计划或安排。
“公认会计原则“
是指美利坚合众国现行的公认会计原则。
“政府当局
“指任何联邦、州、地方、外国或其他政府、准政府或行政机构、机构、部门或机构或任何法院、法庭、行政听证机构、仲裁小组、委员会或其他类似的解决争议的小组或机构。
“危险材料
“指根据任何环境法被定义、列入或指定为”危险物质“、”污染物“、”污染物“、”危险废物“、”受管制物质“、”危险化学品“或”有毒化学品“(或任何类似术语)的任何废物、气体、液体或其他物质或材料,或根据任何环境法受管制的任何其他物质,或可能导致根据任何环境法施加责任或责任的任何废物、气体、液体或其他物质或材料,包括石油及其副产品、石棉、多氯联苯、氡、霉菌和尿素甲醛绝缘材料。
“负债“任何人的
不重复地指:(A)该人因借款而欠下的所有债务(包括未偿还本金和应计但未付利息),不论是否或有,包括本金及其应计费用和利息;(B)财产或服务的递延购买价格的所有债务(在正常业务过程中产生的贸易应付款除外);(C)该人通过票据、债券、债权证、信贷协议或类似的文书、少数股权、优先股、或其他债务担保,包括其应计的所有利息;(D)该人在租赁下的所有义务,按照公认会计原则或瑞士公认会计原则(适用于该人)应归类为资本租赁;(E)该人偿还任何额度或信用证上的任何债务人的所有义务、银行承兑汇票、担保或类似的信用交易;(F)该人就签发或产生的承兑汇票承担的所有义务;(G)利率和货币互换、上限、(H)由留置权担保的该人的任何财产上的所有债务,
(I)与支付该人的任何债务有关的任何保费、预付费或其他罚金、费用、成本或开支
和(J)该人的任何成员在违约时偿还另一人的债务或履行另一人的义务的所有担保、质押或类似保证,(K)该人的所有表外负债;及(L)上文(A)至(K)款所述任何其他人的所有债务,而该等债务是由该人直接或间接担保的,或该人已(或有或有地或以其他方式)同意购买或以其他方式收购,或以其他方式向债权人保证不会有任何损失。
“知识产权
“指存在于全球任何司法管辖区的以下所有内容:专利、商标、版权、商业秘密、互联网资产、软件和其他知识产权,以及与上述财产有关的所有许可证、再许可和其他协议或许可
。
“互联网
资产“指任何所有域名注册、网站和网址及相关权利、与之相关的物品和文件,以及注册申请。
“投资
公司法“指经修订的1940年美国投资公司法。
“知识“就本公司而言,指(A)克里斯蒂安·布吕尔曼或拉尔夫·希斯对适用标的物及任何相关账簿和记录的直接下属进行合理查询后的实际知识;(B)买方尼尔·坎贝尔和布鲁斯·哈蒙在与其负责适用标的物的直接下属进行合理查询后的实际知识
及任何相关账簿和记录;和(C)任何其他缔约方,(1)如果是实体,则为其董事和高管的实际知识,
在合理询问其负责适用主题事项的直接下属和任何相关账簿和记录后,或
(2)如果为自然人,则为该缔约方的实际知识。
“法律“
指任何联邦、州、地方、市政、外国或其他法律、法规、立法、普通法原则、条例、法典、法令、法令、公告、条约、公约、规则、条例、指令、要求、令状、强制令、和解、命令或同意,即
由或在任何政府当局的授权下发布、制定、通过、批准、颁布、制定、实施或以其他方式生效。
“负债“
是指任何性质的任何及所有负债、负债、行动或债务(不论是绝对的、应计的、或有的或有的或其他性质,
不论已知或未知、直接或间接、到期或未到期的、到期或将到期的,以及是否需要根据公认会计原则或其他适用的会计准则在资产负债表上记录或反映),包括应缴税款或应缴税款。
“留置权“
指任何抵押、质押、担保权益、附加权、优先购买权、选择权、代理权、表决权信托、产权负担、留置权或任何种类的押记(包括任何有条件出售或其他所有权保留协议或租赁)、限制(无论是对投票、出售、转让、处置或其他方面的限制),任何有利于他人的从属安排,或根据《统一商法典》或任何类似法律以债务人身份提交财务报表的任何备案或协议。
“材料
不良影响“就任何特定人士而言,指任何事实、事件、发生、改变或影响,而该事实、事件、事件、改变或影响已个别地或可合理地预期会对(A)该人及其附属公司的业务、资产、负债、经营结果、前景或状况(财务或其他方面)产生重大不利影响。或(B)
该人或其任何附属公司是否有能力及时完成其作为一方或受其约束的交易或附属文件,或履行其在本协议或本协议项下的义务;但是,就本协议而言,直接或间接归因于、导致、与下列各项有关或由此产生的任何事实、事件、事件、变化或影响(本身或与任何其他变化或影响合计)不应被视为、构成或
在确定是否已经或可能、将会或可能已经发生重大不利影响时被考虑在内:(I)金融或证券市场的一般变化(包括信用、债务、证券和资本市场)或该人士或其任何附属公司所在国家或地区的一般经济或政治状况;(Ii)一般影响该人士或其任何附属公司主要经营所处行业的变更、条件或影响;(Iii)适用法律(包括新冠肺炎措施)或公认会计原则或其他适用会计原则的变更,或适用于该人士及其子公司主要经营的任何行业的监管会计要求的强制性变更;天灾、恐怖主义、战争(不论是否宣布)、自然灾害或流行病或大流行病的任何爆发或持续(包括但不限于新冠肺炎)或其恶化所造成的状况,包括任何政府当局或其他第三方对此作出的反应的影响。(V)该人及其附属公司本身未能满足任何时期的任何内部或公布的任何预算、预测、预测或预测(但在确定重大不利影响是否已经发生或将合理预期发生的程度时,可考虑任何此类失败的根本原因,其程度不为本协议的另一例外情况所排除);(Vi)交易(包括股票交易所)的公告或悬而未决(但第(Br)(Vi)条不适用于任何陈述或担保,只要该陈述或担保与本协议的签署、公告、履行或存在产生的后果有关);及(Vii)就本公司而言,
公司截至本协议日期作出本协议所包含的任何陈述和担保的能力;此外,
然而,在确定是否已发生或可合理预期发生重大不利影响时,应将紧接上文第(I)至(Iv)款所述的任何事件、事件、事实、条件或变化考虑在内
,以使该事件、事件、事实、条件或变化对该人或其任何子公司造成与该人或其任何子公司主要开展业务的行业中的其他参与者相比不成比例的影响。尽管如此,就买方而言,未能获得股东批准不应被视为对买方或对买方造成重大不利影响。
“纳斯达克“
指的是纳斯达克资本市场。
“订单“
指由任何政府当局或在其授权下作出或已经作出的任何命令、法令、裁决、判决、禁令、令状、裁定、具有约束力的决定、裁决、司法裁决或其他行动
。
“组织文档
“就任何人而言,指经修订的公司注册证书及章程、成文法书籍、组织章程大纲及组织章程细则或类似的组织文件。
“专利“
指任何专利、专利申请及其所描述和要求的发明、设计和改进、可申请专利的发明、
和其他专利权(包括任何分割、保留、延续、部分延续、替代或重新发布,
无论是否就任何此类申请颁发专利,也不论是否对任何此类申请进行修改、修改、撤回、
或重新提交)。
“许可证“
指所有联邦、州、地方或外国或其他第三方许可、授予、地役权、同意、批准、授权、豁免、许可证、特许经营权、特许权、批准书、许可、许可、确认、背书、豁免、认证、指定、任何政府当局或任何其他人的评级、注册、资格或命令。
“允许的
融资“指买方在成交和转换期间完成并向其提供资金的一项或多项债务或股权融资交易,总收益不超过2,500万美元。
“允许
留置权“系指(A)税款或评税及类似的政府收费或征费的留置权,该等留置权(I)并非拖欠,或(Ii)以善意及适当的程序提出争议,并已就此设立足够的准备金(按公认会计原则厘定),(B)在正常业务过程中因法律的实施而征收的其他留置权,而该等留置权并非到期及应付,且总体上不会对受该留置权影响的财产的价值或使用造成重大不利影响,或对其使用造成重大不利影响,(C)在正常业务过程中产生的与社会保障相关的留置权或存款,(D)根据跟单信用证产生的运输货物的留置权,在每种情况下都是在正常的业务过程中产生的,或(E)根据本协议或任何附属文件产生的留置权。
“人“
是指个人、公司、获豁免公司、合伙(包括普通合伙、有限合伙、获豁免有限合伙或有限责任合伙)、有限责任公司、协会、信托或其他实体或组织,包括政府、国内或外国政府或其政治分支,或其机构或机构。
“个人
财产“指任何机器、设备、工具、车辆、家具、租赁装修、办公设备、厂房、部件和其他有形的个人财产。
“私人配售投资
“指对买方的私募股权投资,而某些投资者(”私人配售投资者
“)同意认购,而买方将同意根据认购协议向每名私募配售投资者发行买方的股权证券。
“发布“
指任何释放、溢出、排放、泄漏、泵送、注入、沉积、处置、排放、扩散或渗入室内或室外环境,或流入或流出任何财产。
“补救措施
“指为(I)清理、移除、处理或以任何其他方式处理任何有害物质,(Ii)防止任何有害物质的释放,使其不危及或威胁公共健康或福利或室内或室外环境,(Iii)进行补救前的研究和调查或补救后的监测和护理,或(Iv)纠正不符合环境法的情况
的所有行动。
“代表“对于任何人来说,
是指此人的关联公司以及此人或其关联公司的经理、董事、高级职员、雇员、独立承包商、顾问、顾问(包括财务顾问、律师和会计师)、代理人和其他法律代表。
“美国证券交易委员会“
指美国证券交易委员会(或任何后续政府机构)。
“证券法
“指经修订的1933年美国证券法。
“卖家
百分比“指该卖方购买的股份占附件一规定的所有卖方购买的股份总数的百分比。
“卖家代表
“具有本协定序言中规定的含义。
“软件“
指任何计算机软件程序,包括与之相关的所有源代码、目标代码和文档以及所有软件模块、工具和数据库。
“SOX“
指经修订的美国2002年萨班斯-奥克斯利法案。
“股东
审批“是指买方股东在股东特别会议上的必要表决通过批准事项。
“子公司“
就任何人而言,指任何公司、合伙企业、协会或其他商业实体,而该公司、合伙企业、协会或其他商业实体(I)如果是一家公司,
有权(不论是否发生任何意外情况)在其董事、经理或受托人选举中投票的总股本的过半数投票权,当时直接或间接由该人或该人的一家或多家其他附属公司或其组合拥有或控制的,或(Ii)如果是合伙企业、协会或其他商业实体,
合伙企业或其其他类似所有权权益的大部分当时由任何个人或其一个或多个子公司或其组合直接或间接拥有或控制。就本文而言,如果一个或多个人将被分配
合伙企业、协会或其他业务实体的多数股权,或将被视为或控制该合伙企业、协会或其他业务实体的管理董事、管理
成员、普通合伙人或其他管理人员,则该个人将被视为拥有该合伙企业、协会或其他业务实体的多数股权。个人的子公司
还将包括根据适用的会计规则与该个人合并的任何可变利益实体。
“瑞士《公认会计原则》“指根据《瑞士债务法典》有效的会计原则。
“目标
公司“指本公司及其直接和间接附属公司。
“退税
“指任何申报、声明、报告、退款要求、资料申报或其他文件(包括任何相关或支持性的附表、报表或资料),以及与任何税款的厘定、评估或征收或与任何税务有关的任何法律或行政要求的执行而提交或要求提交的任何文件。
“税费“
是指(A)所有直接或间接的联邦、州、地方、外国和其他净收入、毛收入、毛收入、销售、使用、增值、从价、转让、不动产、个人财产、特许经营权、利润、许可证、租赁、服务、服务用途、扣缴、工资、就业、社会保障和与支付雇员补偿、消费税、遣散费、印花税、职业、保险费、财产、暴利、替代最低、估计、海关、关税或其他税费、费用有关的供款。任何种类的评税或费用,连同与其有关的任何利息和任何罚金、附加税或附加金额,(B)支付(A)款所述款项的任何责任,不论其是否为附属、合并、合并或单一团体的成员,任何期间或通过法律的实施;(C)根据任何遗弃或无人认领的财产所负的责任,
规避或类似的法律规定,以及(D)支付(A)款所述款项的任何责任,(B)或(C)由于与任何其他人达成的任何税收分享、税务团体、税收赔偿或税收分配协议,或任何其他明示或默示的赔偿协议,
任何其他人。
“交易
秘密“指任何商业秘密、机密商业信息、概念、想法、设计、研究或开发
信息、流程、程序、技术、技术信息、规格、操作和维护手册、工程
图纸、方法、技术诀窍、数据、掩膜作品、发现、发明、修改、延伸、改进和其他所有权
权利(无论是否可申请专利或受版权、商标或商业秘密保护)。
“商标“
指任何商标、服务标志、商业外观、商号、品牌、互联网域名、外观设计、徽标或公司名称
(在每种情况下,包括与之相关的商誉),无论是否注册,以及所有注册和续期申请
。
“VWAP“对于截至任何日期的任何证券,
是指在纽约时间上午9:30:01开始至纽约时间下午4:00:00结束的期间内,该证券在主要证券交易所或证券市场交易的美元成交量加权平均价,如彭博通过其”HP“功能(设置为加权平均)进行报告,或者,如果上述
不适用,据彭博社报道,自纽约时间上午9:30:01开始至纽约时间下午4:00:00结束的期间内,此类证券在电子公告板上的场外交易市场上此类证券的美元成交量加权平均价格
,或者,如果彭博社在该时间内没有报告此类证券的美元成交量加权平均价格,场外交易市场
集团公司报告的该证券的任何做市商的最高收盘价和最低收盘价的平均值。如果该证券的VWAP不能在上述任何基准上在该日期计算,则该证券在该日期的VWAP应为适用发行人的无利害关系的独立董事会(或同等管理机构)的多数独立董事合理且真诚地确定的公平市场价值。所有此类决定应针对该期间的任何股票分红、股票拆分、股票合并、资本重组或其他类似交易进行适当的
调整。
10.2节参考文献。本协议中使用的下列大写术语具有与此类术语相邻的
本节中赋予它们的各自含义:
| 术语 |
|
部分 |
| 协议 |
|
前言 |
| 反垄断法 |
|
3.3 |
| 假定的选项 |
|
6.18 |
| 经审计的公司财务报表 |
|
4.7(a) |
| 买者 |
|
前言 |
| 买方福利计划 |
|
3.19(a) |
| 买方董事会 |
|
独奏会 |
| 买家董事 |
|
6.12 |
| 买方披露时间表 |
|
第三条 |
| 买方财务 |
|
3.7(b) |
| 买方基本陈述 |
|
7.3(a) |
| 买方赔付对象 |
|
7.2(a) |
| 买方IP |
|
3.13(c) |
| 买方知识产权许可 |
|
3.13(a) |
| 买方材料合同 |
|
3.12(a) |
| 购房者自有房产 |
|
3.15(b) |
| 买家许可证 |
|
3.10 |
| 买方个人财产租赁 |
|
3.16 |
| 买方不动产租赁 |
|
3.15(a) |
| 买方注册的IP |
|
3.13(a) |
| 买家排名靠前的供应商 |
|
3.26 |
| CFIUS备案 |
|
6.19 |
| 结业 |
|
2.1 |
| 截止日期 |
|
2.1 |
| 结案备案 |
|
6.10(b) |
| 闭幕新闻稿 |
|
6.10(b) |
| 普通股 |
|
1.2(a) |
| 公司 |
|
前言 |
| 公司资产负债表 |
|
4.7(a) |
| 公司资产负债表日期 |
|
4.7(a) |
| 公司福利计划 |
|
4.19(a) |
| 公司证书 |
|
1.3(b) |
| 公司可转换证券 |
|
1.4(a) |
| 公司债权人 |
|
1.2(a) |
| 公司董事 |
|
6.12 |
| 公司信息披露时间表 |
|
第四条 |
| 公司股权计划 |
|
1.4(b) |
| 公司财务 |
|
4.7(a) |
| 公司基本陈述 |
|
7.3(a) |
| 公司IP |
|
4.13(c) |
| 公司知识产权许可证 |
|
4.13(a) |
| 术语 |
|
部分 |
| 公司材料合同 |
|
4.12(a) |
| 公司许可证 |
|
4.10 |
| 公司个人物业租约 |
|
4.16 |
| 公司不动产租赁 |
|
4.15 |
| 公司注册知识产权 |
|
4.13(a) |
| 公司最大客户 |
|
4.23 |
| 公司排名靠前的供应商 |
|
4.23 |
| 债权股份 |
|
1.2(a) |
| D&O获弥偿人士 |
|
6.13(a) |
| D&O尾部保险 |
|
6.13(b) |
| 直接索赔 |
|
7.4(a) |
| EGS |
|
2.1 |
| 可执行性例外 |
|
3.2 |
| 环境许可证 |
|
3.20(a) |
| ERISA附属公司 |
|
3.19(f) |
| 交换对价 |
|
1.2(a) |
| 交易所股票 |
|
1.2(a) |
| 交易所股票价值 |
|
1.2(a) |
| 联邦证券法 |
|
6.3 |
| 过渡期 |
|
6.1 |
| 损失 |
|
8.2 |
| 禁售协议 |
|
独奏会 |
| 管理层股东 |
|
独奏会 |
| 竞业禁止和竞业禁止协议 |
|
独奏会 |
| OFAC |
|
3.24(c) |
| 现成软件 |
|
3.13(a) |
| 党(们) |
|
前言 |
| 邮政-股东批准买方董事会 |
|
6.12 |
| 优先股 |
|
1.2(a) |
| 公共认证 |
|
3.7(a) |
| 购入股份 |
|
1.1 |
| 房地产许可证 |
|
3.15(c) |
| 注册声明 |
|
6.8(a) |
| 相关人士 |
|
3.21 |
| 获释人士 |
|
8.1 |
| 美国证券交易委员会报道 |
|
3.7(a) |
| 卖主 |
|
前言 |
| 卖方受赔人 |
|
7.2(b) |
| 卖方当事人 |
|
前言 |
| 卖方代表 |
|
前言 |
| B组指定证书 |
|
1.2(a) |
| 股票交易所 |
|
独奏会 |
| 特别股东大会 |
|
6.8(b) |
| 指明的法院 |
|
9.4 |
| 股东批准事项 |
|
6.8(b) |
| 订阅协议1 |
|
2.3(d) |
| 交易记录 |
|
独奏会 |
| 转让税 |
|
6.14 |
[其余
页故意留空;签名页紧随其后]
兹证明,本协议的每一方均已签署本协议,并由其正式授权的官员于以上首次写明的日期交付。
| |
公司: |
| |
|
|
| |
PROTEOMEDIX AG |
| |
|
|
| |
发信人: |
/S/
拉尔夫·希斯 |
| |
|
姓名: |
拉尔夫·希斯 |
| |
|
标题: |
首席执行官 |
| |
|
|
|
| |
买方: |
| |
|
|
| |
蓝水生物科技有限公司。 |
| |
|
|
| |
发信人: |
/S/
尼尔·坎贝尔博士 |
| |
|
姓名: |
尼尔·坎贝尔博士 |
| |
|
标题: |
首席执行官 |
| |
|
|
|
| |
卖方代表: |
| |
|
|
| |
发信人: |
/s/
托马斯·迈耶 |
| |
|
Thomas Meier,仅以
卖方的
以下代表 |
[股票交换协议签字
页]
| |
卖家: |
| |
|
| |
卖方姓名:Ralph Scheiss博士 |
| |
|
| |
发信人: |
/s/
Ralph Scheiss博士 |
| |
卖家: |
| |
|
| |
卖方名称:Christian Briihlmann |
| |
|
| |
发信人: |
/s/
克里斯蒂安·布里赫尔曼 |
[股票交换协议签字
页]
| |
卖家: |
| |
|
|
| |
卖方名称:Thomas Cerny |
| |
|
|
| |
通过代理: |
/s/
Ralph Schiess博士 |
| |
姓名: |
Ralph Schiess博士 |
| |
|
|
| |
通过代理: |
/S/
哈里·韦尔顿 |
| |
姓名: |
哈里·韦尔滕 |
[股票交换协议签字
页]
| |
卖家: |
| |
|
|
| |
卖方名称:鲁道夫·艾内索尔德 |
| |
|
|
| |
通过代理: |
/s/
Ralph Schiess博士 |
| |
姓名: |
Ralph Schiess博士 |
| |
|
|
| |
通过代理: |
/S/
哈里·韦尔顿 |
| |
姓名: |
哈里·韦尔滕 |
[股票交换协议签字
页]
| |
卖家: |
| |
|
|
| |
卖方名称:科琳·克雷克 |
| |
|
|
| |
通过代理: |
/s/
Ralph Schiess博士 |
| |
姓名: |
Ralph Schiess博士 |
| |
|
|
| |
通过代理: |
/S/
哈里·韦尔顿 |
| |
姓名: |
哈里·韦尔滕 |
[股票交换协议签字
页]
| |
卖家: |
| |
|
|
| |
卖方名称:ETC苏黎世 |
| |
|
|
| |
通过代理: |
/s/
Ralph Schiess博士 |
| |
姓名: |
Ralph Schiess博士 |
| |
|
|
| |
通过代理: |
/S/
哈里·韦尔顿 |
| |
姓名: |
哈里·韦尔滕 |
[股票交换协议签字
页]
| |
卖家: |
| |
|
|
| |
卖方名称:Altos Venture AG |
| |
|
|
| |
通过代理: |
/s/
Ralph Schiess博士 |
| |
姓名: |
Ralph Schiess博士 |
| |
|
|
| |
通过代理: |
/S/
哈里·韦尔顿 |
| |
姓名: |
哈里·韦尔滕 |
[股票交换协议签字
页]
| |
卖家: |
| |
|
|
| |
卖方姓名:Jurg Geigy博士 |
| |
|
|
| |
通过代理: |
/s/
Ralph Schiess博士 |
| |
姓名: |
Ralph Schiess博士 |
| |
|
|
| |
通过代理: |
/S/
哈里·韦尔顿 |
| |
姓名: |
哈里·韦尔滕 |
[股票交换协议签字
页]
| |
卖家: |
| |
|
|
| |
卖方名称:哈布斯·W·舍普弗林信托基金 |
| |
|
|
| |
通过代理: |
/s/
Ralph Schiess博士 |
| |
姓名: |
Ralph Schiess博士 |
| |
|
|
| |
通过代理: |
/S/
哈里·韦尔顿 |
| |
姓名: |
哈里·韦尔滕 |
[股票交换协议签字
页]
| |
卖家: |
| |
|
|
| |
卖方名称:Zurcher Kantonalbank |
| |
|
|
| |
通过代理: |
/s/
Ralph Schiess博士 |
| |
姓名: |
Ralph Schiess博士 |
| |
|
|
| |
通过代理: |
/S/
哈里·韦尔顿 |
| |
姓名: |
哈里·韦尔滕 |
[股票交换协议签字
页]
| |
卖家: |
| |
|
|
| |
卖方名称:W.A.de Vidier Stiftung |
| |
|
|
| |
通过代理: |
/s/
Ralph Schiess博士 |
| |
姓名: |
Ralph Schiess博士 |
| |
|
|
| |
通过代理: |
/S/
哈里·韦尔顿 |
| |
姓名: |
哈里·韦尔滕 |
[股票交换协议签字
页]
| |
卖家: |
| |
|
|
| |
卖方名称:拉布拉多信托基金 |
| |
|
|
| |
通过代理: |
/s/
Ralph Schiess博士 |
| |
姓名: |
Ralph Schiess博士 |
| |
|
|
| |
通过代理: |
/S/
哈里·韦尔顿 |
| |
姓名: |
哈里·韦尔滕 |
[股票交换协议签字
页]
| |
卖家: |
| |
|
|
| |
卖方姓名:安德烈·J·穆勒 |
| |
|
|
| |
通过代理: |
/s/
Ralph Schiess博士 |
| |
姓名: |
Ralph Schiess博士 |
| |
|
|
| |
通过代理: |
/S/
哈里·韦尔顿 |
| |
姓名: |
哈里·韦尔滕 |
[股票交换协议签字
页]
| |
卖家: |
| |
|
|
| |
卖方名称:Davent Holding AG |
| |
|
|
| |
通过代理: |
/s/
Ralph Schiess博士 |
| |
姓名: |
Ralph Schiess博士 |
| |
|
|
| |
通过代理: |
/S/
哈里·韦尔顿 |
| |
姓名: |
哈里·韦尔滕 |
[股票交换协议签字
页]
| |
卖家: |
| |
|
|
| |
卖方名称:Scalis AG |
| |
|
|
| |
通过代理: |
/s/
Ralph Schiess博士 |
| |
姓名: |
Ralph Schiess博士 |
| |
|
|
| |
通过代理: |
/S/
哈里·韦尔顿 |
| |
姓名: |
哈里·韦尔滕 |
[股票交换协议签字
页]
| |
卖家: |
| |
|
|
| |
卖方姓名:Werner Schafer博士 |
| |
|
|
| |
通过代理: |
/s/
Ralph Schiess博士 |
| |
姓名: |
Ralph Schiess博士 |
| |
|
|
| |
通过代理: |
/S/
哈里·韦尔顿 |
| |
姓名: |
哈里·韦尔滕 |
[股票交换协议签字
页]
| |
卖家: |
| |
|
| |
卖方姓名:哈里·韦尔滕 |
| |
|
| |
/S/
哈里·韦尔顿 |
[股票交换协议签字
页]
| |
卖家: |
| |
|
|
| |
卖方姓名:艾萨克·科布林 |
| |
|
|
| |
通过代理: |
/s/
Ralph Schiess博士 |
| |
姓名: |
Ralph Schiess博士 |
| |
|
|
| |
通过代理: |
/S/
哈里·韦尔顿 |
| |
姓名: |
哈里·韦尔滕 |
[股票交换协议签字
页]
| |
卖家: |
| |
|
|
| |
卖方姓名:Dr. Helge Lubenow |
| |
|
|
| |
通过代理: |
/s/
Ralph Schiess博士 |
| |
姓名: |
Ralph Schiess博士 |
| |
|
|
| |
通过代理: |
/S/
哈里·韦尔顿 |
| |
姓名: |
哈里·韦尔滕 |
[股票交换协议签字
页]
| |
卖家: |
| |
|
|
| |
卖方名称:New Horizon Health Ltd |
| |
|
|
| |
通过代理: |
/s/
Ralph Schiess博士 |
| |
姓名: |
Ralph Schiess博士 |
| |
|
|
| |
通过代理: |
/S/
哈里·韦尔顿 |
| |
姓名: |
哈里·韦尔滕 |
[股票交换协议签字
页]
附件
一
卖家名单
| 卖家
姓名 |
第
个
公司
个共享
持有者
卖家
(包括
转换
个注释) |
第
个
常见
要共享的股份
发布日期:
关闭 |
第
个
首选
要共享的股份
发布日期:
关闭 |
集料
数量
常见
共享后-
转换 |
| 拉尔夫·希斯 |
|
|
|
|
| 克里斯蒂安·布鲁尔曼 |
|
|
|
|
| 托马斯·瑟尼 |
|
|
|
|
| 鲁道夫
埃伯索尔德 |
|
|
|
|
| 科琳
克莱克 |
|
|
|
|
| 苏黎世 |
|
|
|
|
| Altos
Venture AG |
|
|
|
|
| Jürg Geigy博士 |
|
|
|
|
| 舍普弗林
信任 |
|
|
|
|
| 苏尔彻
坎托纳尔班克 |
|
|
|
|
| W.A.
维吉耶基金会 |
|
|
|
|
| 拉布拉多犬
信任 |
|
|
|
|
| 安德烈
J. Mueller |
|
|
|
|
| Davent
控股 |
|
|
|
|
| Scablis
AG |
|
|
|
|
| 维尔纳
舍费尔 |
|
|
|
|
| 哈利
Welten |
|
|
|
|
| Isaac
科布林 |
|
|
|
|
| 海尔格
卢伯诺 |
|
|
|
|
| 新
宏远健康有限公司 |
|
|
|
|
| 共计 |
|
|
|
|
债权人列表
| 姓名
债权 |
第
个
常见
要共享的股份
时发表
关闭 |
第
个
首选
要共享的股份
时发表
关闭 |
聚合
数量
常见
共享后-
转换 |
| 拉卡里亚
斯科特 |
|
|
|
| 罗米·塞斯 |
|
|
|
| FINALIS
Securities LLC |
|
|
|
| 合计
|
|
|
|
附件C
公平意见

2023年12月13日
董事会
Blue
Water Biotech,Inc.
201 E.第五街,1900套房
辛辛那提,
俄亥俄州25202
女士们、先生们:
您
已要求我们从财务角度对Blue Water Biotech,Inc.的公平性发表意见。(“买方”)根据拟由买方、ProteomealsAG(一家瑞士公司)(“公司”)、其中指定的卖方代表(“卖方代表”)和协议卖方当事人签订的拟议股份交换协议(“协议”)
支付的
交换对价(定义见下文)。此处使用的大写术语具有买方于2023年12月13日向我方提供的协议草案(下称“协议草案”)中赋予的相应含义。
如
本协议中更具体规定的,并根据本协议中规定的条款、条件和调整,该协议规定
买方将根据股份交换收购公司(“股份交换”),据此,卖方
将向买方出售,买方将从卖方购买所有已购买股份,以换取具有
总价值等于75,000,000美元(“交换对价”)减去在交割前可行使公司
股票期权的公司股票的价值,再减去向公司债权人发行的债权人股票。
每股公司股份将被交换为获得根据本协议条款确定的一定数量的交换股份的权利。
在股票交易所发行的优先股将在买方收到股东批准
之日转换为买方普通股。
公司进行股票交易的义务受多项条件的限制,包括买方应
向公司交付私募投资者签署的私募投资认购协议,总金额等于或大于500万美元。出于本意见书的目的,经您批准,我们假设
私募投资按照其条款完成,买方收到500万美元的收益,
每股购买价格等于截止日期前
第三天前十(10)天内买方普通股的十天VWAP,或每股0.249美元。

在
某些条件和限制的限制下,转换时可发行的买方普通股的股份数量可能会因卖方在索赔截止日期
之前对买方或买方对公司和卖方提出的索赔而进行调整。就本意见而言,经您批准,我们假设不会发生此类调整。此外,卖方
有义务对买方的某些违约或未履行行为进行赔偿,在某些情况下,买方普通股的一部分
股份可在此类索赔解决之前支付给托管人。出于本意见的目的,经您批准,
我们假设不会向买方支付赔偿金,也不会向第三方支付买方普通股。
此外,
出于本意见的目的,经您的批准且无需独立验证,我们假设(i)债权人和
已购买股份的前持有人将在交割后以及
私募投资和转换生效后立即拥有买方87.1%的已发行股本,(ii)私募投资者将在交割后以及私募投资和转换生效后立即拥有买方7.6%的未偿
股权,及
(iii)紧接股份交易所前买方已发行股本的持有人拥有买方已发行股本的5.3%
紧随交割后及私募投资及转换生效后。
In
connection with our review of the proposed Share Exchange, and in arriving at our opinion, we have reviewed: (i) the financial terms
of the Share Exchange described in the Draft Agreement; (ii) certain information, including financial forecasts, relating to the business,
earnings, cash flow, assets, liabilities and prospects of the Company that were furnished to us by management of the Company; (iii) financial
forecasts, relating to the business, earnings, assets, liabilities, cash flow, and prospects of the Buyer, furnished to us by the Buyer’s
management; (iv) relevant market sizing projections for the assets and liabilities that will be acquired by the Buyer; (v) management
of the Buyer’s assessment of the strategic rationale for, and the potential benefits of the Share Exchange; (vi) the past and current
operations and financial condition and future prospects of the Buyer; (vii) the reporting price and trading activity for the Buyer’s
common stock; (viii) certain publicly available information, including, but not limited to, the Buyer’s recent filings with the Securities
and Exchange Commission and the financial statements set forth therein; (ix) the financial terms, to the extent publicly available, of
certain acquisition and financing transactions that we deemed to be relevant; and (x) such other analyses and such other factors as we
deemed appropriate for the purpose of rendering our opinion.
我们
已假设并依赖(但未独立核实)所有公开
可获得或提供给我们或以其他方式提供给我们或与我们讨论或由我们审查或为我们编制
本意见的信息的准确性和完整性。我们进一步假设,所提供的财务信息是由
买方和公司各自的管理层根据行业惯例在合理的基础上编制的,买方和公司
的管理层不知道任何信息或事实会使我们获得的任何信息不完整或具有误导性。在不限制
前述内容的一般性的情况下,出于本意见的目的,我们假设买方和
公司各自的管理层合理地编制了我们审查的财务预测、估计和其他前瞻性信息,基于
反映其对预期未来运营结果的最佳当前可用估计和判断的假设,以及
买方和本公司的财务状况。吾等对任何该等财务预测、估计或
前瞻性资料或其所基于的假设概不发表意见。

根据我们的意见,我们假定并依赖所有提供给我们、与我们讨论或由我们审查的财务、法律、法规、税务、会计和其他信息的准确性和完整性,而不进行独立验证。我们的意见
不涉及任何法律、法规、税务或会计问题。
在得出我们的意见时,我们假设已签署的协议在所有重大方面与我们审查的协议草案
相同。我们依赖并假设(未经独立验证):(i)协议中所有
方的陈述和保证以及其中提及的所有相关文件和文书均真实正确,(ii)协议各方将全面及时履行要求其履行的所有契约和协议,
(iii)股份交换将根据本协议的条款完成,而无需对其进行修订;及(iv)完成股份交换的所有条件
将得到满足,而任何一方不得放弃其项下的任何条件或义务。
此外,我们已假设,将以不会对公司造成不利影响的方式获得股票交易所所需的所有必要监管批准和同意。
在得出我们的意见时,我们没有对买方或公司的任何特定资产或负债(固定、或有
或其他)进行任何评估或估值,也没有向我们提供任何此类评估或估值。在不限制前述内容的
一般性的情况下,我们没有对买方、公司或其各自的任何关联公司作为当事方或可能
受其影响的任何未决或威胁的诉讼、监管行动、可能
未主张的索赔或其他或有负债进行独立分析,在您的指示和同意下,我们的意见没有做出任何假设,因此不认为,
任何此类事项可能引起的索赔、结果或损害。
本
意见必须基于我们获得的信息以及存在的事实和情况,并在本日期进行评估;
本日期后发生的事件可能会对编制本意见时使用的假设产生重大影响。我们
在此不对将在证券交易所发行的买方普通股的价值或买方普通股在证券交易所公告后或未来任何时间的交易价格
发表任何意见,我们也不
从财务角度对私募投资的买方的公平性发表任何意见。我们未承诺
重申或修订本意见或以其他方式对本报告日期后发生的任何事件发表评论,也没有任何义务
更新、修订或重申本意见。

We
have been engaged by Buyer to render this opinion. We will receive a fee in the amount of $250,000 for the provision of this opinion,
which fee is not contingent on the successful completion of the Share Exchange. The Buyer has also agreed to indemnify us against certain
liabilities and to reimburse us for certain expenses in connection with our services. In the ordinary course of business, we and our
affiliates may acquire, hold or sell, for our and our affiliates’ own accounts and for the accounts of customers, equity, debt and other
securities and financial instruments (including bank loans and other obligations) of Buyer and the Company, and, accordingly, may at
any time hold a long or a short position in such securities. Except as described below, we have not had a material relationship with,
nor otherwise received fees from, Buyer or the Company during the two years preceding the date hereof. On July 31, 2023, we acted as
the Buyer’s exclusive placement agent in connection with a warrant inducement transaction for which we received a cash fee of $230,348,
reimbursement of our expenses, a non-accountable expense allowance of $35,000, and 149,173 warrants to purchase shares of Buyer Common
Stock at an exercise price of $1.3625 per share and a six-month right of first refusal commencing on July 31, 2023 offering to act as
the sole book running manager, sole underwriter or sole placement agent on any public offering (including at the market facility) or
a private placement or any other capital raising financing of equity, equity linked or debt securities for the Buyer. We also have the
right to receive additional warrants to purchase shares of Buyer Common Stock at an exercise price of $1,3625 per share in an a amount
equal to 6% of the shares issued upon the cash exercise of any inducement preferred investment options. On March 23, 2023, we entered
into an ATM program with Buyer under which we acted as the exclusive sales agent but have received no fees in connection therewith. On
August 9, 2022, we acted as the Buyer’s exclusive placement agent in connection with a private placement of shares of Buyer Common Stock
and preferred investment rights for which we received a cash fee of $680,000, reimbursement of our expenses and warrants to purchase
220,997 warrants to purchase shares of Buyer Common Stock at an exercise price of $3.3938 per share. On April 13, 2022, we acted as the
Buyer’s exclusive placement agent in connection with a private placement of shares of Buyer’s Common Stock and preferred investment options
for which we received a cash fee of $850,009, reimbursement of our expenses and warrants to purchase 70,489 shares of Buyer Common Stock
at an exercise price of $8.46875 per share. In the future, we may provide financial advisory and investment banking services to Buyer,
the Company or their respective affiliates for which we would expect to receive compensation.
符合
适用的法律和法规要求,H.C.温赖特公司,LLC已采取政策和程序来建立
并保持我们的研究部门和人员的独立性。因此,我们的研究分析师可能持有与我们的投资银行人员不同的观点,发表
声明或投资建议和/或发布关于买方、公司和/或股票交易所的研究报告。

本
意见仅供买方董事会在考虑
股票交易时参考,并不旨在也不构成对买方任何股东的建议,即该股东
应如何就任何与股票交易有关的事项或任何其他事项进行投票。未经我们事先书面批准,不得披露、引用或发表
(全部或部分)本意见,也不得公开引用我们。本意见已由H.C.
批准发布。温赖特公司,LLC公平意见委员会
本
意见仅从财务角度考虑拟议交换对价对买方的公平性,而不涉及
股份交换或股份交换的任何替代方案的相对优点、买方进行或实施
股份交换的基本决定或股份交换的任何其他方面。本意见书不涉及合并对任何类别证券持有人、债权人或买方其他组成部分的公平性。我们不是法律、
税务、会计或监管问题方面的专家,也不发表意见。我们不对任何应付或将支付给买方的任何管理人员、董事或雇员的任何补偿的金额或性质的公平性发表意见,无论是否与股票交易所有关。
根据上述情况,我们认为,截至本协议签订之日,从财务
角度来看,交换对价对买方是公平的。
真诚地
| /s/
H.C.温赖特公司LLC |
|
| H.C.
温赖特公司,LLC |
|
财务报表索引
ONCONETIX INC.
| |
页面 |
余额
截至二零二二年九月三十日(未经审核)及十二月三十一日(经审核)的报表 |
F-2 |
| 未经审计的经营报表
截至二零二三年及二零二二年九月三十日止三个月及九个月 |
F-3 |
| 未经审计的股东报表
截至二零二三年及二零二二年九月三十日止三个月及九个月之权益 |
F-4 |
| 未经审计的现金流量表
截至二零二三年及二零二二年九月三十日止九个月 |
F-5 |
| 财务报表附注
|
F-6 |
| 独立注册会计师事务所的报告
(PCAOB ID编号199) |
F-31 |
| 截至2022年12月31日和2021年12月31日的资产负债表 |
F-32 |
| 声明
截至2022年及2021年12月31日止年度的营运成本 |
F-33 |
| 声明
截至2022年及2021年12月31日止年度的股东权益 |
F-34 |
| 声明
截至2022年及2021年12月31日止年度的现金流量 |
F-35 |
| 财务报表附注
|
F-36 |
PROTEOMEDIX AG
| |
页面 |
余额
截至二零二二年九月三十日(未经审核)及十二月三十一日(经审核)的报表 |
F-63 |
| 未经审计的经营报表
截至二零二三年及二零二二年九月三十日止三个月及九个月 |
F-64 |
| 未经审计的股东报表
截至2023年及2022年9月30日止三个月及九个月的亏损 |
F-65 |
| 未经审计的现金流量表
截至二零二三年及二零二二年九月三十日止九个月 |
F-66 |
| 财务报表附注
|
F-67 |
| 独立的审计师报告 |
F-81 |
| 截至2022年12月31日和2021年12月31日的资产负债表 |
F-82 |
| 声明
截至2022年及2021年12月31日止年度的营运成本 |
F-83 |
| 截至2022年12月31日和2021年12月31日的年度股东赤字报表
|
F-84 |
| 声明
截至2022年及2021年12月31日止年度的现金流量 |
F-85 |
| 财务报表附注
|
F-86 |
ONCONETIX,Inc.
简明资产负债表
| | |
2023年9月30日 | | |
十二月三十一日,
2022 | |
| |
(未经审计) | | |
| |
| 资产 | |
| | |
| |
| 流动资产 | |
| | |
| |
| 现金 | |
$ | 7,653,975 | | |
$ | 25,752,659 | |
| 盘存 | |
| 1,419,272 | | |
| — | |
| 预付费用和其他流动资产 | |
| 467,738 | | |
| 469,232 | |
| 关联方应收账款,净额 | |
| — | | |
| 35,850 | |
| 流动资产总额 | |
| 9,540,985 | | |
| 26,257,741 | |
| | |
| | | |
| | |
| 预付费用,长期 | |
| 55,499 | | |
| 38,617 | |
| 财产和设备,净额 | |
| 12,503 | | |
| 14,089 | |
| 递延发售成本 | |
| 366,113 | | |
| — | |
| 无形资产 | |
| 17,906,771 | | |
| — | |
| 总资产 | |
$ | 27,881,871 | | |
$ | 26,310,447 | |
| | |
| | | |
| | |
| 负债和股东权益 | |
| | | |
| | |
| 流动负债 | |
| | | |
| | |
| 应付帐款 | |
$ | 3,176,332 | | |
$ | 1,499,296 | |
| 应计费用 | |
| 1,538,544 | | |
| 2,409,128 | |
| 应付票据,扣除债务贴现净额569,907美元 | |
| 12,920,093 | | |
| — | |
| 或有认股权证负债 | |
| 10,461 | | |
| 14,021 | |
| 流动负债总额 | |
| 17,645,430 | | |
| 3,922,445 | |
| | |
| | | |
| | |
| 承付款和或有事项(见附注9) | |
| | | |
| | |
| | |
| | | |
| | |
| 股东权益 | |
| | | |
| | |
| 优先股,面值0.00001美元,2022年9月30日和2022年12月31日授权发行的1000万股;2023年9月30日和2022年12月31日分别指定为A系列可转换优先股的10,000股和0股;2023年9月30日和2022年12月31日发行和发行的0股 | |
| — | | |
| — | |
| 普通股,面值0.00001美元,于2022年9月30日和2022年12月31日授权发行的2.5亿股;分别于2023年9月30日和2022年12月31日发行的18,336,597股和15,724,957股;分别于2023年9月30日和2022年12月31日发行的17,819,198股和15,265,228股 | |
| 183 | | |
| 157 | |
| 追加实收资本 | |
| 45,297,371 | | |
| 42,331,155 | |
| 库存股,按成本计算;2023年9月30日和2022年12月31日分别为517,399股和459,729股普通股 | |
| (625,791 | ) | |
| (566,810 | ) |
| 累计赤字 | |
| (34,435,322 | ) | |
| (19,376,500 | ) |
| 股东权益总额 | |
| 10,236,441 | | |
| 22,388,002 | |
| 总负债和股东权益 | |
$ | 27,881,871 | | |
$ | 26,310,447 | |
附注是这些未经审计的简明财务报表的组成部分。
ONCONETIX,Inc.
操作简明报表
(未经审计)
| | |
截至三个月
9月30日,
2023 | | |
三个月
告一段落
9月30日,
2022 | | |
九个月
告一段落
9月30日,
2023 | | |
九个月
告一段落
9月30日,
2022 | |
| 运营费用 | |
| | |
| | |
| | |
| |
| 销售、一般和行政 | |
$ | 4,268,845 | | |
$ | 2,694,254 | | |
$ | 8,337,615 | | |
$ | 7,311,243 | |
| 研发 | |
| 219,238 | | |
| 1,175,480 | | |
| 2,148,327 | | |
| 2,924,037 | |
| 资产购买协议保证金减值 | |
| — | | |
| — | | |
| 3,500,000 | | |
| — | |
| 总运营费用 | |
| 4,488,083 | | |
| 3,869,734 | | |
| 13,985,942 | | |
| 10,235,280 | |
| 运营亏损 | |
| (4,488,083 | ) | |
| (3,869,734 | ) | |
| (13,985,942 | ) | |
| (10,235,280 | ) |
| 其他收入(费用) | |
| | | |
| | | |
| | | |
| | |
| 应付票据灭失损失 | |
| (490,000 | ) | |
| — | | |
| (490,000 | ) | |
| — | |
| 利息支出 | |
| (269,097 | ) | |
| — | | |
| (483,093 | ) | |
| — | |
| 或有认股权证负债的公允价值变动 | |
| (99,728 | ) | |
| 3,072 | | |
| (99,787 | ) | |
| 33,375 | |
| 其他收入(费用)合计 | |
| (858,825 | ) | |
| 3,072 | | |
| (1,072,880 | ) | |
| 33,375 | |
| 净亏损 | |
$ | (5,346,908 | ) | |
$ | (3,866,662 | ) | |
$ | (15,058,822 | ) | |
$ | (10,201,905 | ) |
| 累计优先股股息 | |
| — | | |
| — | | |
| — | | |
| 96,359 | |
| 适用于普通股股东的净亏损 | |
$ | (5,346,908 | ) | |
$ | (3,866,662 | ) | |
$ | (15,058,822 | ) | |
$ | (10,298,264 | ) |
| | |
| | | |
| | | |
| | | |
| | |
| 普通股股东应占每股基本亏损和稀释后每股净亏损 | |
$ | (0.31 | ) | |
$ | (0.27 | ) | |
$ | (0.92 | ) | |
$ | (0.94 | ) |
| 已发行普通股、基本普通股和稀释普通股的加权平均数 | |
| 17,521,562 | | |
| 14,338,379 | | |
| 16,452,136 | | |
| 10,949,265 | |
附注是这些未经审计的简明财务报表的组成部分。
ONCONETIX,Inc.
股东权益简明报表
(未经审计)
| | |
优先股 | | |
普通股 | | |
额外实收 | | |
库存股 | | |
累计 | | |
总计
股东的 | |
| | |
股票 | | |
金额 | | |
股票 | | |
金额 | | |
资本 | | |
股票 | | |
金额 | | |
赤字 | | |
权益 | |
| 2022年12月31日的余额 | |
| — | | |
$ | — | | |
| 15,724,957 | | |
$ | 157 | | |
$ | 42,331,155 | | |
| (459,729 | ) | |
$ | (566,810 | ) | |
$ | (19,376,500 | ) | |
$ | 22,388,002 | |
| 行使预先出资的认股权证 | |
| — | | |
| — | | |
| 646,640 | | |
| 7 | | |
| (7 | ) | |
| — | | |
| — | | |
| — | | |
| — | |
| 基于股票的薪酬 | |
| — | | |
| — | | |
| — | | |
| — | | |
| 185,578 | | |
| — | | |
| — | | |
| — | | |
| 185,578 | |
| 购买库藏股 | |
| — | | |
| — | | |
| — | | |
| — | | |
| — | | |
| (32,638 | ) | |
| (33,454 | ) | |
| — | | |
| (33,454 | ) |
| 净亏损 | |
| — | | |
| — | | |
| — | | |
| — | | |
| — | | |
| — | | |
| — | | |
| (2,846,644 | ) | |
| (2,846,644 | ) |
| 2023年3月31日的余额 | |
| — | | |
$ | — | | |
| 16,371,597 | | |
$ | 164 | | |
$ | 42,516,726 | | |
| (492,367 | ) | |
$ | (600,264 | ) | |
$ | (22,223,144 | ) | |
$ | 19,693,482 | |
| 股票期权的行使 | |
| — | | |
| — | | |
| 45,920 | | |
| — | | |
| 459 | | |
| — | | |
| — | | |
| — | | |
| 459 | |
| 发行限制性股票 | |
| — | | |
| — | | |
| 512,940 | | |
| 5 | | |
| (5 | ) | |
| — | | |
| — | | |
| — | | |
| — | |
| 基于股票的薪酬 | |
| — | | |
| — | | |
| — | | |
| — | | |
| 272,781 | | |
| — | | |
| — | | |
| — | | |
| 272,781 | |
| 购买库藏股 | |
| — | | |
| — | | |
| — | | |
| — | | |
| — | | |
| (25,032 | ) | |
| (25,527 | ) | |
| — | | |
| (25,527 | ) |
| 净亏损 | |
| — | | |
| — | | |
| — | | |
| — | | |
| — | | |
| — | | |
| — | | |
| (6,865,270 | ) | |
| (6,865,270 | ) |
| 2023年6月30日的余额 | |
| — | | |
$ | — | | |
| 16,930,457 | | |
$ | 169 | | |
$ | 42,789,961 | | |
| (517,399 | ) | |
$ | (625,791 | ) | |
$ | (29,088,414 | ) | |
$ | 13,075,925 | |
| 通过行使优先投资期权发行普通股 | |
| — | | |
| — | | |
| 1,575,000 | | |
| 16 | | |
| 2,272,822 | | |
| — | | |
| — | | |
| — | | |
| 2,272,838 | |
| 发行认股权证以交收或有认股权证 | |
| — | | |
| — | | |
| — | | |
| — | | |
| 129,184 | | |
| — | | |
| — | | |
| — | | |
| 129,184 | |
| 基于股票的薪酬 | |
| — | | |
| — | | |
| — | | |
| — | | |
| 105,402 | | |
| — | | |
| — | | |
| — | | |
| 105,402 | |
| 没收限制性股票 | |
| — | | |
| — | | |
| (168,860 | ) | |
| (2 | ) | |
| 2 | | |
| — | | |
| — | | |
| — | | |
| — | |
| 净亏损 | |
| — | | |
| — | | |
| — | | |
| — | | |
| — | | |
| — | | |
| — | | |
| (5,346,908 | ) | |
| (5,346,908 | ) |
| 2023年9月30日的余额 | |
| — | | |
$ | — | | |
| 18,336,597 | | |
$ | 183 | | |
$ | 45,297,371 | | |
| (517,399 | ) | |
$ | (625,791 | ) | |
$ | (34,435,322 | ) | |
$ | 10,236,441 | |
| | |
| | |
| | |
| | |
| | |
其他内容 | |
| | |
总计 | |
| | |
优先股 | | |
普通股 | | |
已缴费 | |
累计 | | |
股东的 | |
| | |
股票 | | |
金额 | | |
股票 | | |
金额 | | |
资本 | |
赤字 | | |
权益 | |
| 2021年12月31日的余额 | |
| 1,146,138 | | |
$ | 11 | | |
| 3,200,000 | | |
$ | 32 | | |
$ | 7,403,204 | |
$ | (5,956,670 | ) | |
$ | 1,446,577 | |
| 在首次公开募股中发行普通股,扣除290万美元的发行成本 | |
| — | | |
| — | | |
| 2,222,222 | | |
| 22 | | |
| 17,138,818 | |
| — | | |
| 17,138,840 | |
| 首次公开发行时将可转换优先股转换为普通股 | |
| (1,146,138 | ) | |
| (11 | ) | |
| 5,626,365 | | |
| 56 | | |
| (45 | ) |
| — | | |
| — | |
| 基于股票的薪酬 | |
| — | | |
| — | | |
| — | | |
| — | | |
| 19,332 | |
| — | | |
| 19,332 | |
| 净亏损 | |
| — | | |
| — | | |
| — | | |
| — | | |
| — | |
| (2,070,661 | ) | |
| (2,070,661 | ) |
| 2022年3月31日的余额 | |
| — | | |
$ | — | | |
| 11,048,587 | | |
$ | 110 | | |
$ | 24,561,309 | |
$ | (8,027,331 | ) | |
$ | 16,534,088 | |
| 在私募中发行普通股和认股权证,扣除110万美元的发行成本 | |
| — | | |
| — | | |
| 590,406 | | |
| 6 | | |
| 6,858,322 | |
| — | | |
| 6,858,328 | |
| 行使预先出资的认股权证 | |
| — | | |
| — | | |
| 590,406 | | |
| 6 | | |
| (6 | ) |
| — | | |
| — | |
| 基于股票的薪酬 | |
| — | | |
| — | | |
| — | | |
| — | | |
| 1,447,127 | |
| — | | |
| 1,447,127 | |
| 净亏损 | |
| — | | |
| — | | |
| — | | |
| — | | |
| — | |
| (4,264,582 | ) | |
| (4,264,582 | ) |
| 2022年6月30日的余额 | |
| — | | |
$ | — | | |
| 12,229,399 | | |
$ | 122 | | |
$ | 32,866,752 | |
$ | (12,291,913 | ) | |
$ | 20,574,961 | |
| | |
| | | |
| | | |
| | | |
| | | |
| | |
| | | |
| | |
| 以私募方式发行普通股和认股权证,扣除220万美元的发行成本 | |
| — | | |
| — | | |
| 1,350,000 | | |
| 14 | | |
| 8,689,302 | |
| — | | |
| 8,689,316 | |
| 股票期权的行使 | |
| — | | |
| — | | |
| 165,452 | | |
| 2 | | |
| 1,653 | |
| — | | |
| 1,655 | |
| 行使预先出资的认股权证 | |
| — | | |
| — | | |
| 945,000 | | |
| 9 | | |
| 936 | |
| — | | |
| 945 | |
| 基于股票的薪酬 | |
| — | | |
| — | | |
| — | | |
| — | | |
| 329,809 | |
| — | | |
| 329,809 | |
| 净亏损 | |
| — | | |
| — | | |
| — | | |
| — | | |
| — | |
| (3,866,662 | ) | |
| (3,866,662 | ) |
| 2022年9月30日的余额 | |
| — | | |
$ | — | | |
| 14,689,851 | | |
$ | 147 | | |
$ | 41,888,452 | |
$ | (16,158,575 | ) | |
$ | 25,730,024 | |
附注是这些未经审计的简明财务报表的组成部分。
ONCONETIX,Inc.
现金流量表简明表
(未经审计)
| | |
截至
9月30日的9个月
2023 | | |
九个月结束
9月30日,
2022 | |
| 经营活动的现金流 | |
| | |
| |
| 净亏损 | |
$ | (15,058,822 | ) | |
$ | (10,201,905 | ) |
| 对净亏损与经营活动提供的现金净额(用于)进行的调整: | |
| | | |
| | |
| 资产购买协议保证金减值 | |
| 3,500,000 | | |
| — | |
| 基于股票的薪酬 | |
| 563,761 | | |
| 1,796,268 | |
| 债务贴现摊销 | |
| 483,093 | | |
| — | |
| 应付票据灭失损失 | |
| 490,000 | | |
| — | |
| 其他长期资产减值损失 | |
| 267,019 | | |
| — | |
| 关联方应收账款损失 | |
| 265,648 | | |
| — | |
| 折旧费用 | |
| 4,886 | | |
| 4,906 | |
| 或有认股权证负债的公允价值变动 | |
| 99,787 | | |
| (33,375 | ) |
| 资产和负债变动情况: | |
| | | |
| | |
| 盘存 | |
| (299,272 | ) | |
| — | |
| 预付费用和其他流动资产 | |
| (9,526 | ) | |
| (469,278 | ) |
| 预付费用,长期 | |
| (16,882 | ) | |
| (66,357 | ) |
| 存款 | |
| — | | |
| (27,588 | ) |
| 应付帐款 | |
| 1,418,048 | | |
| 361,103 | |
| 应计费用 | |
| (976,871 | ) | |
| 2,760,734 | |
| 用于经营活动的现金净额 | |
| (9,269,131 | ) | |
| (5,875,492 | ) |
| | |
| | | |
| | |
| 投资活动产生的现金流 | |
| | | |
| | |
| 购置资产,包括79771美元的交易费用 | |
| (6,079,771 | ) | |
| — | |
| 与资产购买协议相关的保证金 | |
| (3,500,000 | ) | |
| — | |
| 购买其他长期资产 | |
| (51,744 | ) | |
| — | |
| 对关联方的净预付款 | |
| (229,798 | ) | |
| (22,149 | ) |
| 购置财产和设备 | |
| (3,300 | ) | |
| (9,339 | ) |
| 用于投资活动的现金净额 | |
| (9,864,613 | ) | |
| (31,488 | ) |
| | |
| | | |
| | |
| 融资活动产生的现金流 | |
| | | |
| | |
| 购买库藏股 | |
| (58,981 | ) | |
| — | |
| 支付递延发售费用 | |
| (205,093 | ) | |
| (51,304 | ) |
| 应付票据本金支付 | |
| (1,000,000 | ) | |
| — | |
| 行使优先投资选择权所得款项,净额 | |
| 2,298,675 | | |
| — | |
| 行使股票期权所得收益 | |
| 459 | | |
| 1,655 | |
| 首次公开发行普通股所得款项,扣除承销折扣 | |
| — | | |
| 18,400,000 | |
| 首次公开招股费用的支付 | |
| — | | |
| (926,972 | ) |
| 私募发行普通股和认股权证的收益,扣除配售代理折扣 | |
| — | | |
| 16,468,123 | |
| 支付定向增发发行费用 | |
| | | |
| (777,225 | ) |
| 行使预付资金认股权证所得收益 | |
| — | | |
| 945 | |
| 融资活动提供的现金净额 | |
| 1,035,060 | | |
| 33,115,222 | |
| 现金净增(减) | |
| (18,098,684 | ) | |
| 27,208,242 | |
| 期初现金 | |
| 25,752,659 | | |
| 1,928,474 | |
| 期末现金 | |
$ | 7,653,975 | | |
$ | 29,136,716 | |
| | |
| | | |
| | |
| 非现金投资和融资活动: | |
| | | |
| | |
| 通过发行应付票据取得的存货和无形资产 | |
$ | 12,947,000 | | |
$ | — | |
| 已交换优先投资选择权的增量公允价值 | |
$ | 2,613,011 | | |
$ | 860,204 | |
| 应付账款和应计费用中包括的递延发售成本 | |
$ | 150,000 | | |
$ | 125,000 | |
| 或有认股权证负债的确认 | |
$ | 25,837 | | |
$ | 75,431 | |
| 为交收或有认股权证而发行的认股权证 | |
$ | 129,184 | | |
$ | — | |
| 以前包括在预付费用中的递延发售成本 | |
$ | (11,020 | ) | |
$ | — | |
| 行使预先出资的认股权证 | |
$ | 7 | | |
$ | 6 | |
| 发行限制性股票 | |
$ | 5 | | |
$ | — | |
| 没收限制性股票 | |
$ | (2 | ) | |
$ | — | |
| 通过关联方应收账款支付应计奖金 | |
$ | — | | |
$ | 140,000 | |
| 私募发行成本计入应付账款 | |
$ | — | | |
$ | 67,823 | |
| 首次公开发行时将可转换优先股转换为普通股 | |
$ | — | | |
$ | 45 | |
附注是这些未经审计的简明财务报表的组成部分。
ONCONETIX,Inc.
简明财务报表附注
2023年9月30日
(未经审计)
注1--列报的组织和依据
业务的组织和性质
Onconentix,Inc.(前身为Blue水疫苗公司)(本公司)成立于2018年10月26日。在历史上,该公司的重点是研究和开发变革性疫苗,以预防全球范围内的传染病。2023年4月,该公司收购了ENTADFI®,并计划将其商业化。ENTADFI®是美国食品和药物管理局(FDA)批准的每日一次的联合非那雄胺和他达拉非治疗良性前列腺增生症的药物。这种组合使男性能够接受治疗,治疗他们的良性前列腺增生症状,而不会出现通常只服用非那雄胺的患者的负性副作用。在2023年第三季度,该公司剥夺了疫苗开发活动的努力,以追求和专注于ENTADFI®的商业化活动。2023年10月30日,该公司宣布了一项新的业务战略,将重点
努力建立肿瘤学领域的治疗、诊断和服务产品的基础,以支持和丰富临床医生的医疗实践。一旦推出,ENTADFI®将成为该公司不断扩大的肿瘤治疗产品组合中的首个治疗药物。
2023年4月21日,该公司向特拉华州州务卿提交了公司章程修正案,将公司名称从“Blue Water Vaccines,
Inc.”改为“Blue Water Vaccines,
Inc.”。给“蓝水生物科技公司”。更名自2023年4月21日起生效。与更名相关,公司修改了公司章程,以反映公司名称Blue Water Biotech,Inc.,也于2023年4月21日生效。附例没有做出其他修改。
2023年5月31日,公司董事会(“董事会”)修订了公司章程,将公司股东大会的法定人数要求从有权投票的公司流通股的多数投票权降低到有权投票的公司流通股投票权的三分之一,即日起生效。本附例未作任何其他修改。
首次公开募股
2022年2月23日,公司完成首次公开发行,发行和出售了2222,222股普通股,每股票面价值0.00001美元(“普通股”),向公众公布的价格为每股9美元。此次IPO的收益,扣除承销折扣、佣金和290万美元的发行成本后,为1710万美元。随着首次公开招股的完成,本公司所有可转换优先股的流通股
均转换为5,626,365股普通股。
陈述的基础
本公司未经审计的简明财务报表是按照美国公认会计原则(“美国公认会计原则”)编制的。
未经审计的中期财务报表
随附的截至2023年9月30日的简明资产负债表、截至2023年9月30日和2022年9月30日的三个月和九个月的简明经营报表和简明股东权益变动表,以及截至2023年9月30日和2022年9月30日的九个月的简明现金流量表未经审计。该等未经审核的中期财务报表按与经审核财务报表相同的基准编制,管理层认为,该等中期财务报表包括本公司截至2023年9月30日的财务状况、截至2023年9月30日及2022年9月30日的三个月及九个月的经营业绩,以及截至2023年9月30日及2022年9月30日的九个月的现金流量的公允报表所需的所有调整,包括正常经常性调整。这些简明财务报表的附注中披露的与三个月和九个月期间相关的财务数据和其他财务信息也未经审计。
截至2023年9月30日的三个月和九个月的经营业绩不一定代表截至2023年12月31日的年度、任何其他中期或任何未来一年或期间的预期结果。本报告中包含的未经审计的简明财务报表
应与已审计的财务报表一起阅读,并在公司截至2022年12月31日的10-K表格年度报告中包含相关说明,其中包括对公司业务及其固有风险的更广泛的讨论。
ONCONETIX,Inc.
简明财务报表附注
2023年9月30日
(未经审计)
注2-持续经营和管理层的计划
到目前为止,该公司的经营活动一直致力于申请许可证、从事研发活动以及潜在的资产和业务收购。
该公司目前正在开发的候选产品在商业化之前将需要大量额外的研究和开发工作
。自成立以来,本公司的营运资金主要来自种子投资者的收益,以及于2022年4月及8月从首次公开招股及私募发行所得的收益(“私募”,见
附注8)。于2022年,本公司完成首次公开招股及定向增发,在扣除配售代理费及其他发售开支后,本公司共收到约3,310万美元的现金收益净额。在截至2023年9月30日的三个月和九个月内,本公司收到约230万美元的净收益,这些收益与投资者行使优先投资期权有关(见附注8)。
本公司自成立以来已出现巨额营业亏损,预计在可预见的未来将继续出现重大营业亏损。截至2023年9月30日,该公司的现金约为770万美元,营运资金赤字约为810万美元,累计赤字约为3440万美元。
于2023年6月,本公司与WraSer订立资产购买协议(“WraSer APA”),以收购本公司须支付代价850万美元及100万股普通股的大部分其他资产,其中350万美元于协议签署时支付,其余450万美元及普通股将于交易完成时支付,其余500,000美元将于2024年6月13日到期。2023年9月26日,WraSer及其附属公司根据美国破产法第11章向破产法院申请救济。2023年10月4日,各方同意修改WraSer《行政程序法》。这项修订尚待法院批准,其中包括取消2024年6月13日到期的50万美元成交后付款,并错开本公司在成交时必须支付的450万美元现金
,以(I)成交时支付220万美元,(Ii)230万美元,自2024年1月起按月分期付款150,000美元和(Iii)789股A系列优先股在成交时支付。2023年10月6日,公司获悉WraSer业务中与WraSer无法生产其中一项关键资产的有效药物成分有关的某些事态发展,公司认为这一发展会构成重大不利影响(如WraSer APA中定义的那样),将使公司无法完成交易。2023年10月20日,
公司向破产法院提出动议,要求免除自动中止,以便公司可以行使经修订的WraSer APA项下的终止权。WraSer已通知公司,它不认为发生了重大不良事件。如果破产法院不批准公司的动议并要求其完成交易,公司将无法
执行其针对WraSer资产的商业化战略,因为没有Zontivity的有效药物成分
的制造商,Zontivity是收购WraSer的关键驱动因素。由于WraSer申请破产及本公司为WraSer的无抵押债权人,本公司亦不太可能收回本公司根据WraSer管理服务协议提供的服务所支付的350万美元首期付款或任何成本及资源
。此外,如果WraSer APA终止
,公司将无法收回任何此类成本。
这些因素,连同本公司预测的未来现金流量,显示本公司将无法履行其在正常业务过程中于发布该等简明财务报表后一年内到期的合约承诺及债务。除支持公司营运资金需求和业务活动所需的资金外,公司将在短期内需要大量额外资本,为其持续运营提供资金,满足现有和未来的债务和负债,包括为收购附注5所述资产和支持公司商业化计划而签订的其他合同而到期的剩余款项。这些业务活动包括ENTADFI®的商业化,以及公司当前候选产品和未来候选产品的开发和商业化。管理层的计划包括从ENTADFI®的销售中获得产品收入,该产品尚未成功商业化,这一过程将需要大量额外资本才能完成。此外,某些商业化活动不在公司的控制范围之内,包括但不限于与批发商和第三方付款人签订合同,与第三方物流提供商签订合同,在不同司法管辖区获得所需的许可,以及尝试通过股权或债务融资获得额外所需资金(如果有);然而,目前还没有进一步融资的承诺,也不能保证公司将以优惠的条款获得此类
融资,这给公司能否成功推出ENTADFI®带来重大不确定性。如果公司无法获得更多资金,如果公司决定恢复这些活动、产品和候选产品的开发和/或商业化,则可能需要推迟未来的任何临床试验
,并且可能会采取其他措施来减少费用,以节省足够维持运营和履行其义务的现金。
由于历史和预期的营业亏损以及净营业现金流赤字,本公司是否有能力在简明财务报表发布后的一年内继续经营下去存在很大的疑问,管理层的计划并没有缓解这一点。简明财务报表
是在假设公司将继续经营的前提下编制的。这些简明财务报表不包括
根据这种不确定性的结果可能需要进行的任何调整。
ONCONETIX,Inc.
简明财务报表附注
2023年9月30日
(未经审计)
附注3--主要会计政策摘要
在截至2023年9月30日的9个月内,公司在截至2022年12月31日的年度报告10-K表格中描述的公司重大会计政策发生了以下变化:
预算的使用
按照美国公认会计原则编制财务报表要求管理层作出估计和假设,以影响财务报表日期的或有资产和负债以及
报告期内的或有资产和负债的披露以及报告的费用金额。公司财务报表中最重要的估计涉及存货估值、可摊销无形资产的使用年限、用于评估减值的未来现金流估计、应计研发费用、基于股票的薪酬、优先股的估值,以及因净营业亏损而产生的递延税项资产的估值拨备。该等估计及假设乃基于当前事实、过往经验及在当时情况下认为
合理的各种其他因素,其结果构成对资产及负债的账面值作出判断的基础,并记录从其他来源不易察觉的开支。实际结果可能与这些估计值大不相同,并且
相反。如果估计与实际结果之间存在重大差异,公司未来的经营业绩将受到影响。
细分市场
信息
运营部门被定义为企业的组成部分,其独立的离散信息可供首席运营决策者(“CODM”)或决策小组进行评估,以决定如何分配资源和评估业绩。在截至2023年6月30日的季度收购ENTADFI®之前,该公司管理着一个不同的业务部门,那就是疫苗发现和开发。
在2023年第二季度,由于收购了ENTADFI®,公司正在努力推出商业
,公司在两个业务部门运营:研发和商业。在2023年第三季度,
公司剥夺了疫苗发现和开发计划的权利,因此,截至2023年9月30日,公司
只在一个细分市场运营:商业。管理层认定本公司在2023年第二季度分两个部门运营,在2023年第三季度分两个部门运营,这与CODM为评估业绩、分配资源、设定激励性薪酬目标以及规划和预测未来期间而定期审查的财务信息一致。
ONCONETIX,Inc.
简明财务报表附注
2023年9月30日
(未经审计)
注3-重要会计政策摘要(续)
盘存
库存包括原材料、包装材料和在制品。存货按成本或可变现净值中较低者列账,成本按先进先出原则厘定,但在资产收购中取得的存货则按公允价值入账。本公司定期审查库存构成,以确定过剩、陈旧、移动缓慢或以其他方式无法销售的物品,同时考虑与手头数量相比的预期未来销售量,以及手头货物的剩余保质期。如果观察到无法销售的物品,并且库存没有替代用途,公司将在首次确认价值下降的期间对可变现净值进行减记
。截至2023年9月30日和2022年12月31日,公司没有库存储备。
收购
本公司对收购进行评估,以首先确定收购的一套资产是否构成业务,是否应作为业务合并入账。如果被收购的资产
不是企业,则根据会计准则汇编(ASC)805-50将该交易记为资产收购。资产收购(“ASC 805-50”),其中要求收购实体按相对公允价值确认基于收购实体成本承担的资产和负债,不符合条件的资产除外,包括
财务资产,如存货。此外,收购成本包括转让对价的公允价值和可归因于收购的直接交易成本。商誉不会在资产收购中确认,超过收购净资产公允价值的任何额外对价将按相对公允价值分配给可识别资产。或有对价
当确定或有可能且可合理评估或有事项时,确认资产收购的付款。如果收购的资产
是一项业务,本公司将该交易作为业务合并进行会计处理。企业合并由
采用会计收购法核算。根据收购方法,收购的资产和承担的负债按其各自的公允价值入账。转让的对价公允价值超过收购净资产公允价值的部分计入商誉。或有对价债务在购置日按其公允价值入账,并在随后的每个报告期按其公允价值重新计量,直至相关或有事项得到解决。由此产生的公允价值变动计入收益
。
无形资产
无形资产按成本报告,减去累计摊销。有限寿命的无形资产在其预计使用寿命内摊销,从相关产品开始销售时开始计提。摊销是用直线法计算的。
在正常业务过程中,公司
已签订某些许可和资产购买协议。当里程碑可能实现时,记录开发、法规和商业里程碑的潜在里程碑付款。达到里程碑后,相关里程碑付款
将资本化并在已批准产品的剩余使用寿命内摊销,或作为与尚未获得FDA批准的产品相关的里程碑的研发费用。
长期资产减值准备
当事件或业务环境变化显示资产的账面金额可能无法完全收回(“触发事件”)时,本公司会审核长期资产,包括使用年限有限的无形资产的减值。本公司在决定何时进行减值审核时考虑的因素包括长期资产相对于预期表现严重欠佳、行业或经济趋势出现重大负面影响,以及资产用途的重大改变或计划改变。如果进行减值审查以评估长期资产的可回收性,则本公司将长期资产的使用和最终处置预期产生的未贴现现金流的预测与其账面价值进行比较。当资产使用预期产生的预计未贴现未来现金流量少于其账面金额时,将确认减值损失。减值亏损将根据减值资产的账面价值超过其公允价值(按贴现现金流量厘定)计算。于截至2023年9月30日止三个月及九个月期间,本公司录得减值亏损约267,000美元,涉及于截至2023年9月30日止三个月及九个月内资本化的云计算托管安排所产生的267,000美元实施成本。长期资产没有其他
减值损失。
ONCONETIX,Inc.
简明财务报表附注
2023年9月30日
(未经审计)
注3-重要会计政策摘要(续)
新会计公告s
本公司管理层不相信
任何最近发布但尚未生效的会计准则如果目前采用会对附带的简明财务报表产生重大影响。
附注4-资产负债表详情
盘存
截至2023年9月30日和2022年12月31日,库存与ENTADFI®产品相关,包括以下
:
| | |
2023年9月30日 | | |
十二月三十一日,
2022 | |
| 原料 | |
$ | 329,780 | | |
$ | - | |
| 在制品 | |
| 1,089,492 | | |
| - | |
| 总计 | |
$ | 1,419,272 | | |
$ | - | |
预付费用和其他流动资产
截至2023年9月30日和2022年12月31日,预付费用和其他流动资产包括以下
:
| | |
2023年9月30日 | | |
十二月三十一日,
2022 | |
| 预付保险 | |
$ | 277,058 | | |
$ | 148,789 | |
| 预付费研发 | |
| 89,195 | | |
| 231,981 | |
| 预付费其他 | |
| 101,485 | | |
| 88,462 | |
| 总计 | |
$ | 467,738 | | |
$ | 469,232 | |
应计费用
截至2023年9月30日和2022年12月31日,应计费用包括:
| | |
2023年9月30日 | | |
十二月三十一日,
2022 | |
| 应计研究和开发 | |
$ | 548,287 | | |
$ | 847,747 | |
| 应计补偿 | |
| 386,087 | | |
| 1,132,859 | |
| 应计延期发售成本 | |
| 125,000 | | |
| 125,000 | |
| 应计专业费用 | |
| 216,000 | | |
| — | |
| 应计执行费用 | |
| 106,287 | | |
| — | |
| 其他应计费用 | |
| 156,883 | | |
| 125,922 | |
| 应计特许经营税 | |
| — | | |
| 177,600 | |
| 总计 | |
$ | 1,538,544 | | |
$ | 2,409,128 | |
ONCONETIX,Inc.
简明财务报表附注
2023年9月30日
(未经审计)
注5--收购
企业ADFI®
于2023年4月19日,本公司与资产卖方VERU Inc.(“VERU”)订立资产购买协议(“ENTADFI®APA”)。根据ENTADFI®APA及在该等条款及条件的规限下,本公司购买了与VERU的ENTADFI®产品(“ENTADFI®”)有关的几乎所有资产,并承担了VERU的若干微不足道的负债(“交易”),可能的总代价为1亿美元。
根据ENTADFI®APA,本公司同意向Veru提供合共2,000万美元的初步代价,包括(I)于2023年4月19日交易完成时支付6,000,000美元,(Ii)额外支付4,000,000美元于2023年9月30日到期的无息票据,及(Iii)额外1,000万美元,两笔分别于2024年4月19日及2024年9月30日到期的无息票据。
此外,ENTADFI® APA
的条款要求公司在交割
后根据公司ENTADFI®的净销售额向Veru支付最多8000万美元的额外款项(“里程碑付款”)。里程碑付款的支付方式如下:(i)公司在一个日历年内首次
实现ENTADFI®净销售额1亿美元时支付1000万美元,(ii)公司在一个日历年内首次
实现ENTADFI®净销售额2亿美元时支付2000万美元,及(3)5000万美元应在公司在一个日历年内首次实现ENTADFI® 5亿美元的净销售额时支付。
关于该交易,公司还承担了Veru和Camargo Pharmaceutical Services,LLC于2017年12月11日签订的资产购买协议下的特许权使用费和里程碑义务(“Camargo义务”)。公司承担的Camargo义务
包括所有销售tadalafil-financede的6%特许权使用费和高达2250万美元的销售里程碑付款,
应向Camargo支付如下:(i)500万美元应在公司在一个日历年内首次从ENTADFI®实现1亿美元的净销售额时支付,(ii)公司在一个日历年内首次实现ENTADFI®
净销售额2亿美元时,应支付750万美元;(3)公司在一个日历年内首次实现ENTADFI®
净销售额3亿美元时,应支付1000万美元。
于2023年9月29日,本公司订立
ENTADFI® APA修订案,(“ENTADFI® APA修订”),规定原定于2023年9月30日到期的400万美元应付票据在(1)2023年9月29日向卖方支付100万美元现金,及(2)
于2023年10月3日前向卖方发行3,000股本公司A系列可换股优先股(“A系列优先股”)
(见附注8)。根据ENTADFI®APA修正案,如果获得所需的股东批准,A系列优先股将在发行之日起一年内转换为
公司的普通股。2023年9月30日之后
向卖方发行的A系列优先股最初可转换为总计5,709,935股公司普通股,但须根据指定证书中规定的调整和某些股东批准限制。根据《ENTADFI® APA修正案》,本公司同意在2023年12月31日前通过商业上合理的努力获得股东批准。公司还同意在向SEC提交的
下一份转售登记声明中包括A系列优先股转换后可发行的普通股股份。
此外,关于该交易,
根据ENTADFI® APA,公司与Veru的两名主要股东和员工(“受限制方”)签订了非竞争和非招标协议(“非竞争
协议”)。不竞争
协议一般禁止受限制方在交易完成后五年内直接或间接从事受限制业务(该术语
定义见ENTADFI® APA)。
根据ASC 805-50,收购ENTADFI®已
作为资产收购入账,因为所收购资产的绝大部分公允价值
集中于单一资产,即ENTADFI®产品权利。ENTADFI®产品权利包括商标、监管
批准和其他记录,由于它们之间存在千丝万缕的联系,因此被视为单一资产。
ONCONETIX,Inc.
简明财务报表附注
2023年9月30日
(未经审计)
附注5 -收购(续)
下表概述了本公司收购的与ENTADFI® APA相关的资产转让的总代价
:
| | |
转让代价 | |
| 结算时转让的对价 | |
$ | 6,000,000 | |
| 已发行应付票据的公允价值 | |
| 12,947,000 | |
| 交易成本 | |
| 79,771 | |
| 转移的总对价 | |
$ | 19,026,771 | |
免息应付票据
之公平值乃使用净现值模式以平均8. 2%之贴现率估计。由此产生的公允价值将
在相应的到期日内增加到票据的面值。管理层评估了里程碑付款,并确定
在交易结束时,它们被认为是不可能的,因此,公司没有在转让的代价中确认与
里程碑付款相关的任何金额。
下表汇总了使用ENTADFI®
APA获得的资产:
| | |
确认的资产 | |
| 库存 | |
$ | 1,120,000 | |
| 企业®无形资产 | |
| 17,906,771 | |
| 取得的可确认资产的公允价值总额 | |
$ | 19,026,771 | |
根据美国会计准则第805-50条,收购的存货
按公允价值入账。转移的剩余对价分配给ENTADFI®无形资产,从ENTADFI®销售开始时起,这些无形资产将在其估计使用年限内摊销。本公司原先估计使用年限为五年,但在截至2023年9月30日的三个月内,重新评估使用年限并更改为七年。由于摊销期间尚未开始,估计数的这一变化不会对会计产生影响。获得的库存由
在制品和原材料组成。在制品库存的公允价值是根据产成品的估计销售价格确定的,并根据完成制造过程的成本、销售工作的成本、剩余制造和销售工作的合理利润津贴以及持有成本的估计进行了调整。原材料的公允价值被确定为近似重置成本。库存公允价值调整约为30万美元,将在库存周转时摊销,预计约为1.5年。
管理层对Camargo债务进行了评估,并确定在交易结束时,相关的销售里程碑付款不被认为是可能的,因此,公司
在交易日期并未确认任何相关负债。此外,在产生和确认相关销售时,Camargo义务项下的特许权使用费将被记录为销售成本。
怒火中烧:
于2023年6月13日(“执行日期”),
本公司与WraSer,LLC及联属公司(“卖方”)(“WraSer
APA”)订立资产购买协议。根据WraSer APA,并受WraSer APA条款和条件的约束,公司
将在截止日期(定义如下)购买FDA批准的六项药物资产,涉及多个适应症,包括心脏病、耳科感染和疼痛治疗
(“WraSer资产”)。
根据WraSer APA条款,公司将以(I)在WraSer APA签署时以350万美元现金购买WraSer资产;(Ii)在WraSer APA签署后90天或(Y)WraSer APA下所有成交条件
得到满足或以其他方式放弃的日期(“截止日期”),以现金中的450万美元购买WraSer资产;(Iii)可于截止日期发行的100万股公司普通股(“截止日期”),及(Iv)自截止日期起一年的现金500,000美元。于2023年10月4日,本公司与WraSer同意修订WraSer APA(“WraSer APA修正案”),以修改交易的付款条款,该修订目前尚待法院批准(见附注14)。
ONCONETIX,Inc.
简明财务报表附注
2023年9月30日
(未经审计)
附注5 -收购(续)
于截止日期起计90天内,本公司将尽其最大努力(自费)向美国证券交易委员会提交一份登记说明书,以S-3表格(根据经修订的1933年证券法(“证券法”)登记
)登记结束股份的回售,并将尽其最大努力在提交后在切实可行的范围内尽快宣布该登记说明书生效。
连同WraSer APA,公司
与卖方于签立日期订立管理服务协议(“管理服务协议”)。根据
MSA的条款,公司将在执行日期至成交日期期间担任卖方业务的管理人。
在此期间,公司将根据需要向WraSer预付款。如果在成交日期,卖方的现金余额超过MSA中规定的目标金额(“现金目标”),公司将把超出的金额应用于成交时到期的450万美元现金
。相反,如果出现差额,公司将被要求在
时间内将差额汇给卖方。
WraSer APA可在关闭前按如下方式终止
:(I)经各方同意;(Ii)任何一方违反合同时,在通知后20天内未治愈。如果WraSer APA在与各方达成协议后终止,或由于公司未治愈的违约行为而终止,卖方将保留最初的350万美元付款
。如果确定卖方存在未纠正的违约行为,而WraSer APA被终止,则公司将对WraSer在签定WraSer APA时支付的350万美元拥有无担保债权。交易的完成取决于某些惯常的成交条件,包括提交FDA转让文件
以将收购产品的所有权转让给公司的监管批准。
管理层评估了WraSer APA和MSA的条款,并确定在执行日期,根据ASC 805的规定进行控制,企业合并,未转给本公司,如果交易结束,则控制权到时转移,收购日期为截止日期。管理层根据ASC 810进一步评估了要求,整合,并根据MSA的条款和公司对卖方业务的参与确定卖方是公司的可变利益实体(“VIE”)。管理层确定本公司不是VIE的主要受益人,因为WraSer APA和MSA不赋予公司指导VIE活动的权力,而这些活动对VIE的经济表现有最大的影响。在WraSer根据美国破产法院第11章(见下文)申请救济之前,本公司一直参与VIE的日常业务活动(见下文),但在MSA任期内,卖方必须
批准所有对WraSer经济表现有重大影响的业务活动和交易。此外,如果WraSer APA不关闭,本公司不需要吸收WraSer的损失。因此,本公司不需要在截至2023年9月30日的财务报表中合并WraSer。该公司将最初的350万美元作为押金入账。截至2023年9月30日,公司没有记录任何与其在卖方的可变权益相关的负债,其对卖方损失的风险敞口仅限于与卖方截至成交日的现金余额相比,现金目标金额约为110万美元的缺口(如果有)。
2023年9月26日,WraSer及其附属公司
根据美国破产法第11章向美国佛罗里达州中部地区破产法院(“破产法院”)申请救济,并于2023年10月6日提醒公司注意WraSer运营中的某些问题,该问题
公司认为构成重大不利影响(该术语在WraSer APA中定义),将阻止公司
完成交易。2023年10月20日,本公司向破产法院提出自动中止豁免动议,以便本公司能够行使经修订的WraSer APA项下的终止权。WraSer已通知公司,它
不认为发生了重大不良事件。如果破产法院不批准公司的动议并要求其完成交易,公司将无法执行其对WraSer资产的商业化战略,因为
没有Zontivity的有效药物成分的制造商,Zontivity是收购WraSer的关键驱动因素。由于本公司是WraSer的无担保债权人,因此本公司不太可能收回本公司根据WraSer MSA提供的服务所支付的350万美元的初始付款或任何成本
和资源,因此记录的押金已减值。
管理层确定导致减值的情况于2023年9月30日存在,因此,本公司在截至2023年9月30日的九个月内就350万美元的存款计入了减值损失。
ONCONETIX,Inc.
简明财务报表附注
2023年9月30日
(未经审计)
附注6--重要协议
牛津大学创新有限公司
2018年12月,本公司与牛津大学创新(OUI)签订了期权协议,该协议是2019年7月16日许可协议(“OUI协议”)的前身。根据OUI协议的条款,该公司持有某些特定专利权和生物材料的全球独家许可,这些专利权和生物材料与使用许可专利权和生物材料所涵盖的有限变异性和类似病毒的颗粒产品和实践过程有关,用于开发和商业化候选流感疫苗产品
。公司有义务按照《OUI协议》的发展计划,尽最大努力开发和销售授权产品,向OUI报告进展情况,实现以下里程碑,并在完成后支付OUI不退还的里程碑费用:启动第一阶段第一研究;启动第一阶段第二研究;启动第一阶段III/关键注册研究;首次提交监管批准申请(BLA/NDA);在美国的营销授权;在任何欧盟国家的营销授权;在日本的营销授权;在任何其他国家的首次营销授权;
在日本的首次商业销售;在任何国家/地区的首次商业销售;年销售额等于或超过特定门槛的第一年。
OUI协议还要求公司在未来发生相关或有事件时支付一定的里程碑和版税付款
。请参阅注9。OUI协议将在许可专利权中包含的最后一项专利到期后十(10)年内到期,除非提前终止。在截至2021年12月31日的一年中,OUI获得了与免疫原性成分相关的美国专利
。这项专利将于2037年8月到期。在截至2023年9月30日的三个月和九个月内,没有额外颁发任何专利。任何一方都可以因未治愈的重大违规行为而终止OUI协议。本公司可在发出六个月书面通知后,随时以任何理由终止OUI协议,直至2022年7月16日,也就是OUI协议三周年为止。如果公司提交了清盘请愿书,或通过了与债权人进行真正合并或重组以外的清盘决议,或指定了管理人或管理人,则OUI可立即终止。如果公司反对或质疑OUI协议中所定义的许可技术中的任何专利或申请的有效性,OUI也可终止;提出主张,即许可技术的专有知识不是开发和营销许可产品所必需的;或OUI合理地认为,正在采取不充分或不充分的步骤来开发或营销许可产品
,并且没有采取OUI在合理时间内通过书面通知要求的任何进一步步骤。2023年9月30日之后,该公司终止了与牛津大学创新学院的许可协议(见附注14)。终止许可协议时应支付的金额不是很大。
圣犹大儿童医院
本公司于2020年1月27日与圣犹大儿童研究医院(“圣犹大”)签订许可协议
(“圣犹大协议”)。根据圣裘德协议的条款,该公司持有与使用活的减毒肺炎链球菌有关的特定
专利权和生物材料的全球独家许可,并实践被许可的专利权和生物材料涵盖的
用于开发和商业化肺炎链球菌候选疫苗的
产品。圣裘德协议要求公司在未来发生相关或有事件时支付某些里程碑和特许权使用费
。见注9。除非提前终止,否则圣裘德协议将在许可专利权中包含的最后一个有效权利要求到期
时失效。本公司有义务使用
商业合理的努力来开发和商业化授权产品(S)。这些里程碑包括以下事件:
(I)完成IND启用研究;(Ii)启动动物毒理学研究;(Iii)提交IND;(Iv)完成第一阶段临床试验;(V)开始第二阶段临床试验;(Vi)开始第三阶段临床试验;以及(Vii)美国或国外的监管批准。
如果本公司未能实现圣裘德协议中包含的发展里程碑,且本公司和圣裘德未能就双方满意的修订时间表达成一致,圣裘德将有权终止圣裘德协议。如果另一方(A)根据《破产法》(除其他事项外)或(B)未能履行或以其他方式违反其在《圣犹大协议》项下的义务,且
未在六十(60)天内纠正此类违约或违约,则任何一方均可终止《圣犹大协议》。本公司可在三十(30)天书面通知后因任何原因终止。2022年5月11日,本公司对圣裘德协议进行了修订,修订了特许权使用费条款、里程碑付款和许可费,并商定了修订后的开发里程碑时间表。2023年3月22日,本公司
签订了圣裘德协议的另一项修正案,据此进一步修订了发展里程碑时间表,并且
没有财务影响。2023年9月30日之后,本公司终止了与圣裘德的许可协议(见附注
14)。终止许可协议时应支付的金额并不大。
ONCONETIX,Inc.
简明财务报表附注
2023年9月30日
(未经审计)
注6--重大协议(续)
辛辛那提儿童医院医疗中心
本公司于2021年6月1日与辛辛那提儿童医院医疗中心(“CHMC”)签订了许可协议
(“CHMC协议”)。根据CHMC协议的条款,本公司持有与使用许可专利权和生物材料相关的若干特定专利和生物材料的全球独家、全球许可
(不包括针对中国和诺沃克病毒引起的胃肠炎的免疫接种和预防、控制或减轻严重程度的领域),以开发
针对类似病毒的颗粒疫苗平台的CHMC专利和相关技术,该平台利用纳米颗粒递送技术可能在开发多种传染病的疫苗方面具有潜在的广泛应用。CHMC
协议的有效期从生效日期开始,并根据司法管辖区和产品的不同而延长,直至:
(I)许可专利最后到期;(Ii)首次商业销售后十(10)年;或(Iii)生物相似
或可互换产品进入市场。本公司有义务以商业上合理的努力,通过勤奋的研发、测试、制造和商业化将授权产品推向市场,尽最大努力提交所有必要的监管文件并获得所有必要的监管批准,以实现与开发和销售相关的里程碑,并向CHMC报告
进展情况。见注9。当相关或有事件发生时,公司还有义务向CHMC支付商定的开发里程碑付款和特许权使用费。为方便起见,本公司可在产品或流程首次商业销售前的任何时间向CHMC提供180(180)天的书面通知,终止CHMC协议。它还可能因CHMC未固化材料破裂而终止。CHMC可以因未治愈的公司重大违约或破产或破产而终止CHMC协议。
根据CHMC协议的条款,如果公司未能达到里程碑,并且无法与CHMC就对里程碑的修订
达成一致,则CHMC将可以选择将任何和所有此类独家许可证转换为非排他性许可证,
继续开发在任何阶段已经进入开发或公司已投资开发的适应症。
CHMC还可以在全球领土国家的法律允许的最大范围内终止CHMC协议,如果
本公司或其关联公司对《CHMC协议》中定义的任何经许可的专利的有效性或可执行性提出质疑或引诱他人提出质疑,本公司将有义务偿还CHMC的费用,包括合理的律师费。
生物服务公司(后来被National Resilience,Inc.收购)
本公司于2019年7月19日与Ologic,Inc.(以下简称“Otics”)签订了主服务协议(以下简称“主服务协议”),不时提供服务,
包括但不限于技术转让、工艺开发、分析方法优化、当前良好的制造规范(“cGMP”)、生物产品的制造、监管事务和稳定性研究。根据《OLICY MSA》,本公司和OLICE应为每个项目签订《项目附录》,受《OLICY MSA》的条款和条件管辖。
截至2022年12月31日,公司已签订两份项目附录
。最初的项目附录于2019年10月18日实施,本公司须向Ologic支付合共约400万美元。由于与新冠肺炎相关的意外延误,公司和Ologic于2020年1月9日签订了一项书面协议,停止项目工作,届时公司已向Ologic支付100,000美元以支付拟提供的服务。
第二个项目增编于2021年5月21日实施,公司有义务向Ologic支付总计约280万美元,外加材料和外包测试的补偿,费用将按成本加15%收取。
2022年期间,本公司对《业务流程管理协议》进行了三次修订,以调整《第二个项目附录》中确定的工作范围。经修订后,本公司于第二个项目附录项下的债务净增至154,000美元。2023年3月27日,对《Ologic MSA》第二个项目附录进行了进一步修订,以扩大该项目的范围,从而使本公司在Ologic MSA下的债务增加了180,000美元。
于截至2023年9月30日止三个月及九个月内,本公司分别产生约56,000美元及231,000美元的相关研发开支(净收益),而于2023年9月30日,本公司约有900,000美元记为相关应付账款及应计开支。在截至2022年9月30日的三个月和九个月内,公司分别产生了约496,000美元和988,000美元的相关研究和开发费用。
ONCONETIX,Inc.
简明财务报表附注
2023年9月30日
(未经审计)
注6--重大协议(续)
位于圣安东尼奥的德克萨斯大学健康科学中心
该公司于2022年11月18日与位于圣安东尼奥的德克萨斯大学健康科学中心(“UT Health”)签订了一项专利和技术许可协议(“UT Health协议”)。根据UT健康协议的条款,该公司持有与开发口服减毒衣原体活疫苗候选疫苗有关的特定专利
的独家全球许可(不包括UT健康协议中定义的载体领域)。本协议签署后,首次不可退还的许可费为100,000美元,后续的年度许可费如下:截至2026年12月31日的四年中,每年20,000美元;截至2028年12月31日的两年中,每年40,000美元;截至2029年12月31日的一年及之后直至UT Health
协议到期或终止为止的每一年,每年60,000美元。UT Health协议还要求公司在未来支付某些里程碑和特许权使用费,因为发生了相关的或有事件。除非提前终止,否则UT健康协议将在最后一个到期日期或专利权终止时失效。为方便起见,公司可通过向UT Health提供90天的书面通知来终止UT Health协议。如果公司(A)
拖欠款项且未在UT Health通知后30天内付款,或(B)违反任何
不付款条款且未在收到UT Health通知后60天内纠正此类违规行为,或(C)UT Health在任何12个月内就三项或三项以上实际重大违反UT健康协议向公司发出通知,或(D)在公司或其附属公司发起任何诉讼或行动以质疑有效性、可执行性、或任何许可专利的范围。
与AbVacc,Inc.共同开发协议。
2023年2月1日,本公司与AbVacc,Inc.(“AbVacc”)签订了
共同开发协议(“共同开发协议”),目的是进行
共同开发特定候选疫苗的研究,包括猴痘和马尔堡病毒病,有可能将
扩展到使用诺如病毒纳米颗粒平台的其他候选疫苗(“共同开发项目”),并管理共同开发项目的材料和
信息的共享。根据共同开发协议,AbVacc和
公司将通过联合开发委员会合作,为每个共同开发项目目标产品制定和实施开发计划或工作说明书
。根据共同开发协议,本公司或AbVacc(无论哪一方为任何最终产品(定义见共同开发协议)的主要赞助商)将有义务赔偿另一方
某些里程碑式的付款,金额在210万美元至475万美元之间,外加2%至4%的特许权使用费。
任何一方都没有固定的义务,各自承担各自的费用。共同开发协议的期限为自生效之日起三年,除非任何一方根据共同开发协议
事先终止。于截至2023年9月30日止三个月及九个月内,本公司分别产生约2,000美元及21,000美元与共同发展协议有关的研究及发展成本。截至2023年9月30日,本公司评估了公司实现指定里程碑并产生产品销售的可能性
,并确定可能性尚不可能
,因此,截至2023年9月30日不需要应计这些款项。
服务协议
于2023年7月21日,本公司与供应商订立《许可及服务总协议》(“主服务协议”)及相关工作说明书,根据该协议,供应商将向本公司提供本公司产品的商业化服务,包括招聘、管理、监督及评估销售人员,并为该等产品提供销售相关服务,在工作说明书的有效期内,费用总额最高达2,910万美元。工作说明书的有效期至2026年9月6日,除非根据主服务协议和工作说明书提前终止。2023年7月29日,与同一家供应商
就向公司提供处方市场数据访问的某些订阅服务签订了第二份工作说明书。本工作说明书下的费用总额约为80万美元,有效期至2025年7月14日。截至2023年9月30日,公司根据第一份工作说明书为
商业化服务预付了约865,000美元。截至2023年9月30日,本公司还在相关应付账款中记录了约898,000美元。由于预付款可以用来抵销供应商开出的发票金额,大约865,000美元的预付款已从附带的简明资产负债表
中的应付账款中抵销。2023年10月12日,公司终止了主服务协议和工作说明书(见附注14)。
ONCONETIX,Inc.
简明财务报表附注
2023年9月30日
(未经审计)
附注7-应付票据
关于ENTADFI®APA(见附注
5),本公司签署了三笔本金分别为4,000,000美元、5,000,000美元及5,000,000美元的无息应付票据(“票据”),到期日分别为2023年9月30日、2024年4月19日及2024年9月30日。本金
到期前不应支付;然而,公司可自愿预付票据而不受惩罚。此外,如债券定义为违约,则债券的未偿还本金金额将按年息10.0%计息。
于2023年9月29日,本公司与票据持有人签订了一项修订ENTADFI®APA的修正案,其中规定原于2023年9月30日到期的400万美元应付票据被视为已支付,并在(1)于2023年9月29日向卖方支付100万美元现金,以及(2)于2023年10月3日前向卖方发行3,000股本公司A系列优先股(见附注5和14)的情况下被视为已全部支付。关于ENTADFI®(Br)APA修正案,公司在应付票据上记录了约490,000美元的清偿亏损,这是将发行以清偿债务的A系列优先股的公允价值与截至2023年9月29日的应付票据的账面价值之间的差额
。截至2023年9月30日所附简明资产负债表中的应付票据余额已调整为已发行并于2023年10月3日解除债务的A系列优先股的公允价值。灭火损失在截至2023年9月30日的三个月和九个月的简明经营报表中的其他收入(费用)中确认。
为确定A系列优先股的公允价值,公司首先使用贴现现金流量法计算企业价值(BEV)。假设300万美元的债务转换为A系列优先股,然后将这些债务分配给
公司的证券,BEV
调整为股权价值。A系列优先股的结论价值采用布莱克-斯科尔斯期权定价模型,由于存在重大的不可观察到的输入,该模型在估值层次结构中被归类为3级。模型中使用了以下关键假设:波动率为100%,无风险利率为4.6%,预期期限为5.0年,以及公司的总股本价值。波动率是基于同业的历史和隐含波动率,无风险利率
是基于美国国债的隐含收益率,其期限与估计的预期期限相称。
本公司按8.2%的平均贴现率计入债券利息,并于发行日录得约110万美元的债务折让。债务折价反映为票据账面金额的减少,并按实际利息方法于有关到期日摊销至利息开支。在截至2023年9月30日的三个月和九个月期间,公司分别记录了约30万美元和50万美元的关联利息支出。截至2023年9月30日的未摊销债务折价约为60万美元。
截至2023年9月30日,债券的未来最低本金支付包括通过2023年10月发行A系列优先股结算的300万美元本金和2024年到期的1000万美元本金。
附注8--股东权益
授权资本
2022年2月23日,关于首次公开募股的结束,本公司向特拉华州州务卿提交了第二份修订和重述的公司注册证书
(“A&R COI”),该证书立即生效。公司的法定普通股和优先股分别为250,000,000股和10,000,000股,或面值不变,即普通股和优先股均为0.00001美元。
优先股
2023年9月29日,公司向特拉华州提交了公司A系列可转换优先股权利和优先权指定证书(“指定证书”),指定并授权发行最多10,000股A系列优先股。根据指定证书
,A系列优先股的每股股份可转换为该数目的本公司普通股
,其厘定方法为每股1,000美元的声明价值除以每股0.5254美元的换股价格(如指定证书所界定),但须受指定证书所规定的调整及股东批准的若干限制所规限。A系列优先股有权按比例分享就
本公司普通股支付的任何股息(按假设转换为普通股的基准),没有投票权,但对指定证书中指定的某些重大事项除外,并具有相当于每股1,000美元的声明价值加上
任何应计但未支付的股息的清算优先权。A系列优先股可由公司随时选择全部或部分赎回
。指定证书授权发行最多10,000股A系列优先股。截至2023年9月30日,A系列可转换优先股没有流通股(见附注5和14)。
ONCONETIX,
公司
简明财务报表附注
2023年9月30日
(未经审计)
附注8-股东权益(续)
普通股
截至2023年9月30日和2022年12月31日,已发行普通股分别为18,336,597股和15,724,957股,已发行普通股分别为17,819,198股和15,265,228股。
本公司普通股持有人有权就每持有一股登记在案的股份投一票,并有权于本公司清盘时按比例分享本公司于支付本公司所有债务及就优先于普通股的每类股份作出拨备后可供分派的净资产
。普通股不能赎回,也没有优先认购权或类似权利。
于2022年2月17日,本公司与作为包销商代表(“Boustead”)的Boustead Securities,LLC就本公司的首次公开发售(IPO)订立了一份承销协议(“包销协议”),据此,本公司同意以每股9.00美元的价格向承销商
出售合共2222,222股本公司普通股。IPO于2022年2月23日完成,在扣除8%的承销折扣和其他发行成本后,公司获得了约1,710万美元的净收益。
库存股
2022年11月10日,董事会批准了一项股票回购计划(“回购计划”),允许公司回购最多500万股普通股
,最高价格为每股1.00美元,管理层可酌情根据市场情况进行购买。2022年11月18日,董事会批准将最高价格提高到每股2.00美元。此计划没有到期日期。
在截至2023年9月30日的9个月内,该公司回购了57,670股普通股,总金额约为59,000美元,平均价格为每股1.02美元。在截至2023年9月30日的三个月内,没有回购普通股。回购的股份被归类为库存股,以待未来使用,并减少用于计算每股收益的流通股数量。截至2023年9月30日,根据回购计划,尚有约450万股可供回购。
公募股权的私人投资
2022年4月私募
2022年4月19日,根据截至2022年4月13日的证券购买协议的条款和条件,本公司完成了
私募的结束(“2022年4月私募”)。在2022年4月的私募结束时,公司发行了590,406股普通股、购买总计590,406股普通股的预融资权证以及购买总计1,180,812股普通股的优先投资期权。每股普通股连同相关的优先投资期权的收购价为6.775美元,而每份预先出资的认股权证连同相关的优先投资
期权的收购价为6.774美元。在扣除配售代理费和其他发售费用后,本公司从2022年4月定向增发中获得的现金净收益总额约为690万美元。预筹资权证的行使价为每股0.001美元,已于2022年5月24日全部行使。优先投资期权的行使价为每股6.65美元,与2022年8月的私募有关
交换,如下所述。
H.C.Wainwright&Co.,LLC(“Wainwright”)
担任2022年4月私募的独家配售代理。本公司同意向Wainwright支付配售代理费和管理费,分别相当于2022年4月私募总收益的7.5%和1.0%,并报销
某些自付费用,总额最高可达85,000美元。此外,公司还向Wainwright发行了认股权证(“4月Wainwright认股权证”),购买最多70,849股普通股。Wainwright认股权证的形式与优先投资选项基本相同,不同之处在于行使价格为8.46875美元。优先投资期权的形式为认股权证,因此优先投资期权、预筹资权证和Wainwright认股权证统称为
“2022年4月私募认股权证”。此外,在行使任何优先投资选择权时,本公司同意向Wainwright增发认股权证,以购买相当于已行使优先投资选择权的普通股总数的6.0%的普通股,行使价也为8.46875美元(“4月或有认股权证”)。根据这一规定可发行的4月份或有权证的最高数量为70 849份,这是与2022年8月私募有关的交换,如下所述。
ONCONETIX,
公司
简明财务报表附注
2023年9月30日
(未经审计)
附注8-股东权益(续)
本公司评估了2022年4月的私募认股权证的条款,并根据ASC 480提供的会计指导将其归类为股权工具。区分负债与股权(“ASC 480”)和ASC 815-40,衍生工具和套期保值-实体自有权益中的合同
(“ASC 815-40”)。由于本公司确定2022年4月的私募认股权证
属于股权分类,本公司将2022年4月的私募所得款项扣除发行成本按面值计入普通股
,并将所得款项净额记入额外实收资本。
本公司评估了
四月份或有认股权证的条款,并根据
ASC 815-40提供的会计指导确定该等认股权证应归类为负债。由于4月份的或有认股权证是对Wainwright的一种补偿形式,公司将负债的价值记录为额外实收资本的减去,随后在附带的简明经营报表中记录在其他收入(费用)
中的负债价值的变化。
2022年8月私募
2022年8月11日,根据截至2022年8月9日的证券购买协议的条款和条件,本公司完成了私募(“2022年8月私募”)的
结束。于2022年8月的私募完成时,本公司发行了1,350,000股普通股、预融资权证,以购买总计2,333,280股普通股和
购买总计4,972,428股普通股的优先投资选择权。每股普通股连同相关的优先投资期权的收购价为2.715美元,而每份预先出资的认股权证连同相关的优先投资
期权的收购价为2.714美元。扣除配售代理费和其他发售费用后,本公司从2022年8月定向增发所得的现金净额合计约为870万美元。此外,2022年8月定向增发的投资者与2022年4月定向增发的投资者
同意取消优先投资选择权,以购买2022年4月发行的总计1,180,812股本公司普通股。预筹资权证的行权价为每股0.001美元。2022年期间,总共行使了1 686 640份预筹资金认股权证。其余646,640份预融资认股权证
在截至2023年9月30日的9个月内行使。优先投资期权可在2022年8月11日或之后至2027年8月12日的任何时间行使,行权价为每股2.546美元,受协议定义的某些调整的限制。
在截至2023年9月30日的三个月和九个月内,就下文讨论的权证诱因交易而言,这些优先投资期权中的2,486,214个优先投资期权以减少的
行权价1美元行使。截至2023年9月30日,有2,486,214个优先投资选项未偿还。
温赖特担任2022年8月私募的独家配售代理
。本公司同意向Wainwright支付相当于2022年8月私募总收益的7.5%和1.0%的配售代理费和管理费,并偿还某些自付费用
,总额最高为85,000美元。此外,公司还向Wainwright发行了认股权证(“八月Wainwright认股权证”)
,以购买最多220,997股普通股。8月份的Wainwright认股权证与优先投资选项的形式基本相同,只是行使价格为3.3938美元。优先投资期权的形式是认股权证,因此
优先投资期权、预先融资的权证和8月的Wainwright权证统称为“2022年8月的私募认股权证”。此外,在行使任何优先投资期权以换取现金时,本公司同意向Wainwright增发认股权证,以购买相当于已行使优先投资期权相关普通股总数的6.0%的普通股,行使价也为3.3938美元(“8月
或有认股权证”)。根据这项规定,可发行的8月或有权证最多为298,346份,其中包括因2022年8月私募而修改的4月或有权证中的70,849份。
本公司评估了2022年8月的私募认股权证的条款,并根据ASC 480和ASC 815-40提供的会计指导确定它们应被归类为股权工具。由于本公司确定2022年8月的私募认股权证属于股权类别,本公司
将2022年8月的私募所得款项(扣除发行成本)按面值计入普通股,并将所得款项净额记入额外实收资本。
ONCONETIX,Inc.
简明财务报表附注
2023年9月30日
(未经审计)
附注8-股东权益(续)
参与2022年4月定向增发的投资者同意取消2022年4月定向增发中发行的总计1,180,812个优先投资期权,作为他们
参与2022年8月定向增发的一部分。已注销的优先投资期权在2022年8月的私募中有效地交换了1,289,148个新的优先投资期权,并相应地计入修改
或交换股权挂钩工具。根据ASC 815-40,由于优先投资选择在交换之前和之后被归类为股权工具,并且由于交换直接归因于股权发行,本公司将交换的影响确认为股权发行成本。
本公司评估了8月份的或有权证的条款,并根据ASC 815-40提供的会计指引确定应将其归类为负债。
由于交换了2022年4月私募发行的优先投资期权,将触发发行4月份或有权证的相关股权挂钩工具被替换,因此4月份的70,849份或有权证
被交换为8月份的70,849份或有权证。四月份或有认股权证负债的价值于修订当日经蒙特卡罗模拟调整至公允价值,公允价值变动于随附的简明经营报表中确认。其余227,497份8月或有权证在2022年8月私募结束时作为负债计量。由于或有认股权证是对配售代理的一种补偿形式,公司将负债的价值记录为额外实收资本的减去。
于截至2023年9月30日止三个月及九个月内,就认股权证诱因交易,本公司向Wainwright发行结算因行使相关优先投资期权而触发的与149,173份或有认股权证有关的或有认股权证负债
。参见
权证诱因以下供进一步讨论。
在市场发售协议上
于2023年3月29日,本公司于市场发售协议(“自动柜员机协议”)与作为销售代理(“代理人”)的H.C.Wainwright&Co.,LLC订立了一项
订立一项市场股权计划,根据该计划,本公司可不时透过代理人(“自动柜员机发售”)出售最多3,900,000美元的本公司普通股(“自动柜员机发售”)。根据自动柜员机协议,代理商将有权按自动柜员机协议下每次出售股份所得毛收入的3.0%的固定费率收取佣金。公司没有义务出售协议项下的任何股份,代理商也没有义务购买或出售协议项下的任何股份,并可随时暂停协议项下的要约或终止协议。自动柜员机服务将在自动柜员机协议终止时终止
协议允许。
当公司根据自动柜员机协议完成发售时,与自动柜员机协议相关的递延发售成本将按比例重新分类为额外实收资本。
如果计划的发售被放弃,任何剩余的递延成本将计入运营报表。
截至2023年9月30日,未通过自动柜员机发售任何股票。
权证诱因
于2023年7月31日,本公司与若干现有优先投资期权持有人(“持有人”)(“现有优先投资期权持有人”)订立普通股优先投资期权行使诱因要约书(“诱因函件”),以2022年8月11日发出的每股2.546美元的原始行权价格(“现有优先投资期权”)购买本公司普通股股份。根据诱因函件,持有人
同意以现金方式行使其现有首次公开发售股份,以购买合共2,486,214股本公司普通股(“诱因
首次公开发售股份”),减持行使价为每股1.09美元,以换取本公司同意发行新的优先投资期权(“诱因
投资期权”),以购买最多4,972,428股本公司普通股。诱因
PIO与现有PIO的条款基本相同。
2023年8月2日,本公司完成了诱导函(“认股权证诱因”)中预期的交易。在扣除配售代理费及本公司应付的其他发售费用后,本公司从认股权证诱因获得的净收益合共约230万美元
。
于交易完成时,本公司向持有人发行2,486,214股普通股中的1,575,000股,而该2,486,214股普通股可于行使现有首次公开招股时发行。
由于招股函件中的实益拥有权限制条款,余下的911,214股股份最初未予发行,
并为持有人的利益而搁置,直至接获持有人通知可按该等
限制发行股份。这些股票于2023年10月向持有者发行。
ONCONETIX,Inc.
简明财务报表附注
2023年9月30日
(未经审计)
附注8-股东权益(续)
本公司同意在切实可行范围内尽快提交一份涵盖因行使诱因招股而发行或可发行的诱因PIO股份的转售
的登记声明(“转售登记声明”),
并在发出诱因函件后90天内作出商业合理努力,使该转售登记声明由美国证券交易委员会宣布生效,并使转售登记声明始终有效,直至
没有诱因PIO股份为止。在认股权证诱因中登记相关股份的规定不需要支付与所提供的登记权相关的费用
。因此,虽然股份并未于诱因函件发出日期起计90天内登记,但本条款并无会计影响。
本公司聘请Wainwright担任其配售代理,并向Wainwright支付相当于行使现有PIO所得毛收入的7.5%的现金费用,以及相当于行使现有PIO所得毛收入的1.0%的管理费。公司还同意向Wainwright偿还与行使现有PIO和发放诱因PIO相关的费用,最高可偿还50,000美元的法律顾问费用和其他自付费用,并同意向Wainwright支付35,000美元的非责任费用。此外,现有PIO的现金行使触发了向Wainwright或其指定人发行认股权证,以购买149,173股普通股(“Wainwright诱导权证”),根据8月份或有权证的条款,这些认股权证可按
发行,其条款与诱因PIO相同,但行使价
等于每股1.3625美元。本公司亦同意于任何诱因首次公开发售的现金行使时向Wainwright发行认股权证,即相当于已行使的诱因首次公开发售相关普通股股份总数的6.0%的普通股数目
,行使价亦为1.3625美元(“诱因或有认股权证”)。根据本条款可发行的诱因或有权证的最高数量为298,346份。
本公司评估
诱因首次公开招股及Wainwright诱因认股权证(统称为“2023年8月诱因认股权证”)的条款,并根据ASC 480及ASC 815-40提供的会计指引确定该等招股认股权证应分类为权益工具。
本公司亦评估代表预付远期合约的未发行股份,并根据ASC 480及ASC 815-40提供的指引确定
为权益工具。
权证诱因导致现有PIO的行权价格降低和诱因PIO的发行,被视为在会计准则更新(ASU)第2021-04号指导下对现有PIO的修改。发行人对某些修改或股权交换分类书面看涨期权的会计处理。修订符合该指引下的“股票发行”分类
,因为修订的原因是促使现有首次公开发行的持有人套现行使其认股权证,
导致即将行使现有首次公开发行,为本公司筹集股本及产生约230万美元的净收益。由于现有的PIO和诱因PIO在交换前和交换后被归类为股权工具,并且由于交换直接归因于股权发行,本公司确认修订后的影响约为2.6百万美元的股权发行成本。
此外,通过发行Wainwright诱导权证结算的149,173份8月或有权证负债的公允价值变动约为122,000美元,已在随附的简明运营报表
中确认为其他收入(支出),截至结算日期,约129,000美元或有权证负债的公允价值已取消确认
。相应金额,即Wainwright诱导权证的公允价值,确认为以资本形式支付的额外款项。
ONCONETIX,Inc.
简明财务报表附注
2023年9月30日
(未经审计)
附注8-股东权益
(续)
本公司评估了诱因或有权证的条款,并根据ASC 815-40提供的会计指引
确定该等权证应归类为负债。由于激励或有权证是对Wainwright的一种补偿形式,公司将大约26,000美元的负债价值记录为额外实收资本的减去,随后负债价值的变化记录在随附的简明经营报表中的其他收入(费用)中。
认股权证
以下摘要概述了截至2023年9月30日的9个月内与公司未偿还认股权证相关的活动,不包括行使优先投资期权后可发行的或有认股权证:
| | |
| | |
| | |
加权 | |
| | |
| | |
| | |
平均值 | |
| | |
| | |
加权 | | |
剩余 | |
| | |
| | |
平均值 | | |
合同 | |
| | |
数量 | | |
锻炼 | | |
生命 | |
| | |
股票 | | |
价格 | | |
(单位:年) | |
| 截至2022年12月31日的未偿还债务 | |
| 5,910,914 | | |
$ | 2.37 | | |
| 4.7 | |
| 授与 | |
| 5,121,601 | | |
| 1.10 | | |
| | |
| 已锻炼 | |
| (3,132,854 | ) | |
| 0.865 | | |
| | |
| 取消 | |
| — | | |
| — | | |
| | |
| 截至2023年9月30日未偿还 | |
| 7,899,661 | | |
| 1.68 | | |
| 4.6 | |
| 截至2023年9月30日已授予并可行使的认股权证 | |
| 7,899,661 | | |
$ | 1.68 | | |
| 4.6 | |
截至2023年9月30日,已发行的认股权证
包括70,849份2022年4月的私募认股权证、2,707,211份2022年8月的私募认股权证和5,121,601份2023年8月的诱导权证,根据当日的收盘价
,这些认股权证可行使为7,899,661股普通股,每股公平价值为0.51美元。
此外,截至2023年9月30日和2022年12月31日,8月或有权证和诱因或有权证(统称为“或有权证”)的价值分别约为10,000美元和14,000美元。截至2023年9月30日和2023年12月31日,结算或有权证时可发行的权证最大数量分别为447,519份和298,346份。
股权激励计划
董事会及其股东于2019年7月1日通过了《公司2019年股权激励计划》(简称《2019年计划》)。根据2019年计划,公司已预留1,400,000股普通股供发行。
2022年2月23日,随着首次公开募股的结束,董事会通过了本公司2022年股权激励计划(“2022年计划”),该计划是本公司2019年计划的继任者和延续。根据2022年计划,公司可向公司的员工、董事和顾问授予股票期权、限制性股票、限制性股票单位、股票增值权和其他形式的奖励。生效后,根据2022年计划,共预留160万股普通股供发行。2022年8月,根据2022年计划预留发行的普通股数量增加到260万股,2023年5月,根据2022年计划预留发行的普通股数量增加到315万股。在截至2023年9月30日的9个月内授予的股票期权和限制性股票均根据2022年计划授予。截至2023年9月30日,根据2022年计划,可供发行的股票数量为1,146,878股。
ONCONETIX,
公司
简明财务报表附注
2023年9月30日
(未经审计)
附注8-股东权益(续)
股票期权
以下总结了截至2023年9月30日的九个月内与
公司2019年计划和2022年计划下的股票期权相关的活动:
| | |
| | |
| | |
| | |
加权 | |
| | |
| | |
| | |
| | |
平均值 | |
| | |
| | |
加权 | | |
| | |
剩余 | |
| | |
| | |
平均值 | | |
总计 | | |
合同 | |
| | |
数量 | | |
锻炼 | | |
固有的 | | |
生命 | |
| | |
股票 | | |
价格 | | |
价值 | | |
(单位:年) | |
| 截至2022年12月31日的未偿还债务 | |
| 1,392,654 | | |
$ | 3.30 | | |
$ | 670,161 | | |
| 8.2 | |
| 授与 | |
| 102,386 | | |
| 1.19 | | |
| — | | |
| — | |
| 被没收/取消 | |
| (70,265 | ) | |
| 3.35 | | |
| — | | |
| — | |
| 已锻炼 | |
| (45,920 | ) | |
| 0.01 | | |
| 45,920 | | |
| — | |
| 截至2023年9月30日未偿还 | |
| 1,378,855 | | |
| 3.25 | | |
| 274,299 | | |
| 7.8 | |
| 截至2023年9月30日已授予并可行使的期权 | |
| 1,094,563 | | |
$ | 2.95 | | |
$ | 269,994 | | |
| 7.5 | |
2023年授予的期权的公允价值是根据以下
假设估算的:
| |
|
对于
九个月
已结束
9月30日, |
|
| |
|
2023 |
|
| 行权价格 |
|
$ |
1.05 – 1.29 |
|
| 期限(年) |
|
|
5.00 – 10.00 |
|
| 预期股价波动 |
|
|
113.1% – 119.5 |
% |
| 无风险利率 |
|
|
3.5% – 3.6 |
% |
截至2023年9月30日的9个月内授予的股票期权的加权平均授予日公允价值为1.08美元。在截至2023年9月30日的三个月和九个月内,授予
的股票期权的总公允价值分别约为137,000美元和616,000美元。
限制性股票
2023年5月9日,董事会薪酬委员会批准根据公司2022年计划向公司高管、员工和公司某些顾问发行限制性股票。本次限售股份共计487,500股,其中150,000股、75,000股和150,000股分别授予公司首席执行官(“CEO”)、首席财务官和首席业务官。所有授予归属的限制性股票如下:2024年1月50%,2024年8月25%,2025年8月25%。此外,董事会薪酬委员会于2023年5月31日批准发行25,440股限制性股票,授予公司非执行董事会成员,并于2024年5月31日全面归属。
ONCONETIX,Inc.
简明财务报表附注
2023年9月30日
(未经审计)
附注8-股东权益
(续)
2023年8月16日,公司前首席执行官辞职后,没收了15万股未归属的限制性股票。
| | |
| | |
加权 | |
| | |
| | |
平均值 | |
| | |
| | |
加权 | |
| | |
| | |
平均值 | |
| | |
数量 | | |
授予日期 | |
| | |
股票 | | |
公允价值 | |
| 截至2022年12月31日未归属 | |
| — | | |
$ | — | |
| 授与 | |
| 512,940 | | |
| 1.01 | |
| 被没收/取消 | |
| (168,860 | ) | |
| 1.02 | |
| 既得 | |
| — | | |
| — | |
| 截至2023年9月30日未归属 | |
| 344,080 | | |
$ | 1.01 | |
基于股票的薪酬
截至2023年9月30日和2022年9月30日的三个月和九个月,与股票
期权和限制性股票相关的股票薪酬支出如下:
| | |
截至9月30日的三个月, | | |
在截至的9个月中
9月30日, | |
| | |
2023 | | |
2022 | | |
2023 | | |
2022 | |
| 销售、一般和行政 | |
$ | 89,832 | | |
$ | 255,115 | | |
$ | 362,191 | | |
$ | 1,193,743 | |
| 研发 | |
| 15,570 | | |
| 74,694 | | |
| 201,570 | | |
| 602,525 | |
| 总计 | |
$ | 105,402 | | |
$ | 329,809 | | |
$ | 563,761 | | |
$ | 1,796,268 | |
截至2023年9月30日,与已发行股票期权和未归属限制性股票相关的未确认
基于股票的薪酬支出分别约为394,000美元和143,000美元,
预计将分别在1.67年和1.49年的加权平均期限内确认。
ONCONETIX,Inc.
简明财务报表附注
2023年9月30日
(未经审计)
附注9--承付款和或有事项
写字楼租赁
本公司与一名非关联方在佛罗里达州棕榈滩签订了一份短期租约,开始日期为2022年5月1日,每月租金约为14,000美元。租约于2023年4月30日结束,租约由公司前首席执行官亲自担保。在截至2023年9月30日的九个月内,本公司因本次租赁产生的租金费用约为51,000美元,可变租赁费用约为4,000美元。本公司于截至2022年9月30日止三个月及九个月的租金开支分别约为53,000元及89,000元。
诉讼
公司可能会不时受到各种法律程序和在其正常业务活动过程中产生的索赔的影响。
截至2023年9月30日,公司不是任何重大法律程序的一方,也不知道有任何未决或威胁到的索赔。
注册权协议
关于2022年4月的私募
(见附注8),本公司与买方订立了于2022年4月13日生效的注册权协议(“4月
注册权协议”)。四月登记权协议规定,本公司应向美国证券交易委员会提交一份登记说明书,涵盖所有应登记证券(定义见四月登记权协议)的转售。4月注册权协议要求的S-1表格注册声明于2022年5月3日向美国证券交易委员会备案,并于2022年5月20日生效
。与此类登记声明相关的S-3表中表格S-1的生效后修正案已于2023年4月28日提交美国证券交易委员会
。
关于2022年8月的私募
(见附注8),本公司于2022年8月9日与买方订立了一份登记权协议(“8月
登记权协议”)。八月登记权协议规定,本公司须向美国证券交易委员会提交一份登记说明书,涵盖所有须登记证券(定义见八月登记权协议)的转售事宜。8月注册权协议要求的S-1表格注册声明于2022年8月29日向美国证券交易委员会备案,并于2022年9月19日生效
。与此类登记声明相关的S-3表中表格S-1的生效后修正案已于2023年4月28日向美国证券交易委员会备案。
一旦发生禁止买方在任何12个月期间内连续转售证券超过10个日历日或超过15个日历日的任何事件(如4月注册权协议和8月注册权协议定义),并且如果注册声明停止持续有效,本公司有义务在每个此类事件的每个月周年日向每位购买者支付一笔现金金额,作为部分违约金,而不是罚款,
等于2.0%乘以该购买者在定向增发中支付的总认购金额。截至2023年9月30日,本公司认定本公司根据4月注册权协议和8月注册权协议产生违约金的可能性微乎其微,因此,截至2023年9月30日,该等款项无需应计。
ONCONETIX,
公司
简明财务报表附注
2023年9月30日
(未经审计)
附注9--承付款和或有事项
(续)
里程碑和版税义务
公司已与第三方签订了各种许可协议
,要求公司支付某些开发、监管和商业里程碑,总计1.151亿美元,以及基于产品销售的特许权使用费(见附注6)。截至2023年9月30日,公司评估了
公司实现指定里程碑并实现产品销售的可能性,并确定该可能性尚不可能,并且
截至2023年9月30日无需应计这些款项。在资产负债表日之后,本公司终止了其中两份许可协议(见附注14)。
赔偿
在正常业务过程中,公司
签订包含各种陈述和保证并规定一般赔偿的合同和协议。
公司在这些协议下的风险是未知的,因为它涉及可能在
未来对公司提出但尚未提出的索赔。到目前为止,该公司尚未支付任何与其赔偿义务有关的索赔。然而,在2023年第三季度,公司收到前首席执行官和一名前会计员工的索赔,要求提前支付
某些费用,这可能会导致未来的相关费用。截至2023年9月30日,本公司记录了约91,000美元的相关应计费用,包括在所附简明资产负债表的应计费用中。根据这些赔偿协议,公司未来可能需要支付的最大潜在金额
目前无法评估。
附注10--关联方交易
根据一份自2018年10月22日开始的咨询协议,公司最初聘用了前首席执行官,他也是董事会主席,在首次公开募股结束前,他是公司唯一的普通股股东,该协议要求公司按月支付咨询服务费用。在公司首次公开募股结束时,咨询协议终止,前首席执行官的聘用协议生效。在截至2022年9月30日的九个月内,本公司根据咨询协议产生了约63,000美元的费用,这项费用在随附的简明运营说明书中确认
。
在2022年期间,公司签订了由公司前首席执行官亲自担保的租赁协议
。租约于2023年4月30日到期(见附注9)。
在截至2022年12月31日的年度内,公司薪酬委员会批准向公司前首席执行官和首席业务官分别发放140,000美元和100,000美元的一次性奖金,以表彰他们为公司首次公开募股所做的努力。这些奖金在截至2022年9月30日的9个月内确认为销售、一般和行政费用
在随附的简明运营报表中。
在截至2023年9月30日的三个月和九个月期间,公司审计委员会完成了对公司费用的审查,原因是在关联方余额方面发现了某些违规行为
。根据审核结果,本公司于2022年及2023年前三个季度支付并记录了本公司前行政总裁及一名兼任前行政总裁助理的会计雇员的销售、一般及行政开支个人开支。本公司对截至2023年9月30日的应收账款进行了评估,截至2023年9月30日,应收账款总额约为522,000美元,这是本公司预计不会向关联方追回的确认为个人性质的项目的总额
。截至2023年9月30日,公司为全额记录了相应的准备金,导致关联方应收账款净额为0美元。由于本公司得出的结论是,
金额不太可能收回,这不会导致对以前发布的财务报表进行调整。
此外,上述信用卡滥用导致关联方应收账款在截至2023年9月30日的三个月和九个月内分别亏损约100,000美元和266,000美元。
ONCONETIX,
公司
简明财务报表附注
2023年9月30日
(未经审计)
附注10-关联方交易(续)
截至2022年12月31日,本公司从关联方获得的应收账款约为36,000美元,其中包括本公司代表本公司前首席执行官
支付的杂项付款,并于2023年第一季度全额支付。
公司前董事成员,现为公司科学顾问委员会成员,现任隶属于中华医学会的辛辛那提儿童医院医学中心创新基金顾问委员会成员。如附注6所披露,本公司与中国移动拥有独家许可协议。
本董事于首次公开招股结束时辞去董事会职务,并于2023年8月28日辞去科学顾问委员会职务。
附注11--所得税
截至2023年9月30日和2022年9月30日的三个月和九个月没有记录联邦、州或外国所得税拨备
。本公司于呈列的所有期间均录得净营业亏损
,并未在随附的简明财务报表中反映该等净营业亏损结转的任何利益,原因是在其各自的结转期内使用此等税务属性存在不确定性。本公司已就其所有递延税项资产计提全额估值准备,因为该等资产不太可能在不久的将来变现。本公司的政策是将与所得税相关的利息费用和罚款确认为所得税费用。截至2023年9月30日及2022年9月30日止三个月及九个月内,本公司并未确认任何与所得税有关的利息或罚款。
附注12-每股净亏损
每股基本净亏损的计算方法为:适用于普通股的净收益或亏损除以期内已发行普通股的加权平均数。已发行普通股的加权平均数
包括(I)预筹资权证,因为它们的行使只要求交付股份的名义对价;以及(Ii)因交付股份不需要对价而被搁置的股份;它不包括任何潜在的摊薄证券或任何未归属的普通股限制性股票。某些限制性股票虽然在2023年9月30日被归类为已发行和未发行股票,但在限制失效之前被视为可或有返还,并且在股票归属之前,
不会计入每股基本净亏损。本公司受限股的未归属股份不包含不可没收的股息和股息等价物权利。稀释后每股收益按期间内已发行普通股的加权平均数和潜在已发行普通股的加权平均数计算。潜在普通股包括公司的认股权证、期权和限制性股票。每股摊薄净亏损是通过将所有潜在的普通股股份(包括认股权证、股票期权和未归属的限制性股票)在稀释程度上生效来计算的。
两级法用于根据参与证券在任何未分配收益中的参与权来确定每股收益
。
包括参与分配收益的权利的每一股优先股被视为参与证券,公司使用两级法
计算公司普通股股东可获得的每股普通股-基本和稀释后的净收入。
下列证券因列报期间发生的亏损而不计入已发行摊薄股份的计算范围,因为它们将对公司的净亏损产生反摊薄影响:
| | |
截至9月30日的三个月零九个月, | |
| | |
2023 | | |
2022 | |
| 限制性股票的未归属股份 | |
| 344,080 | | |
| — | |
| 购买普通股股份的期权 | |
| 1,378,855 | | |
| 1,383,801 | |
| 认股权证 | |
| 7,899,661 | | |
| 5,375,385 | |
| 总计 | |
| 9,622,596 | | |
| 6,759,186 | |
ONCONETIX,
Inc.简明财务报表附注
2023年9月30日
(未经审计)
附注13-退休计划
2023年5月31日,董事会投票通过了一项401(K)
安全港非选择性计划(“401(K)计划”)。401(K)计划是一项员工储蓄和退休计划,从2023年7月1日起,所有员工(包括公司指定的高管)都可以为该计划做出贡献。根据
401(K)计划,员工和公司的缴费将立即授予,但新员工的等待期为三个月。公司
被要求为符合条件的员工的401(K)计划贡献工资总额的3%。2023年11月16日,401(K)计划终止。
附注14--后续活动
Veru APA修正案
2023年10月3日,根据Veru APA修正案的条款,公司向Veru发行了3,000股A系列优先股,作为支付3,000,000美元应付票据的结算,该票据原来的到期日为2023年9月30日(见附注5)。
WraSer APA修正案
2023年10月4日,双方同意
修改WraSer《行政程序法》,这还有待法院批准。在申请破产后不久,WraSer提交了一项动议,寻求批准修订后的WraSer APA。该修正案除其他事项外,取消了2024年6月13日到期的50万美元的成交后付款,并错开了本公司在成交时必须支付的450万美元现金支付:(I)220万美元将在成交时支付,(Ii)230万美元将于2024年1月起按月分期付款150,000美元,以及(Iii)789股A系列优先股将在成交时支付。修正案还减少了我们购买的产品数量,不包括止痛药,只包括(I)美国食品和药物管理局批准的商标OTOVEL及其授权仿制药OTOVEL的0.3%环丙沙星和0.025%氟喹诺酮Otic溶液,(Ii)商标为西曲索的0.2%环丙沙星Otic溶液,以及(Iii)根据美国FDA NDA N204886批准的商标Zontivity的硫酸伏拉帕片。
2023年10月6日,公司获悉WraSer运营中的某些问题,涉及WraSer无法为WraSer的一项关键资产生产有效药物成分,公司认为这一事态发展将构成重大不利影响(该术语在WraSer APA中定义),将阻止
公司完成交易。2023年10月20日,本公司向破产法院提交了自动中止豁免动议,以便我们可以根据修订后的WraSer APA行使我们的终止权。WraSer已通知公司,它
不认为发生了重大不良事件。如果破产法院不批准公司的动议并要求其完成交易
,公司将无法执行其针对WraSer资产的商业化战略,因为没有制造商
生产Zontivity的有效药物成分,而Zontivity是收购WraSer的关键驱动因素。由于WraSer申请破产,且本公司是WraSer的无抵押债权人,本公司不太可能收回根据WraSer MSA提供的与本公司提供的服务相关的350万美元的初步付款或任何成本和资源。如果本公司未能完成对WraSer资产的购买,而WraSer APA终止,本公司将无法收回任何此类成本。
本公司就该等付款提出的任何债权将为一般无担保债权(见附注5)。
ONCONETIX,
公司
简明财务报表附注
2023年9月30日
(未经审计)
注14-后续事件(续)
首席财务官离职协议
自2023年10月4日起,乔恩·加菲尔德辞去公司首席财务官一职。公司与加菲尔德先生签订了一项离职协议,其中规定支付两个月的遣散费。
股权激励计划活动
2023年10月4日,公司董事会向公司新聘的首席执行官和首席财务官授予股票期权。授予首席执行官和首席财务官的期权总额分别为532,326和177,442,行权价为每股0.4305美元,
在三年内按季度授予。
2023年10月4日,公司前首席财务官辞职后,没收了75,000股未授予的限制性股票和50,000份股票期权。
服务协议
2023年10月12日,公司终止了与供应商的主服务协议和工作说明书,提前解约费约为230万美元。
公司将在截至2023年12月31日的季度内记录这些费用(见附注6)。
许可证终止
2023年11月15日,公司通知牛津大学创新学院和圣裘德大学终止各自的许可协议(见附注6)。终止这些许可协议时应支付的金额并不多。
ONCONETIX,Inc.
财务报表索引
| |
|
页面 |
| 财务报表
|
|
|
| 独立注册会计师事务所(PCAOB ID 199) |
|
F-31 |
| 截至2022年12月31日和2021年12月31日的资产负债表 |
|
F-32 |
| 截至2022年和2021年12月31日止年度的业务报表 |
|
F-33 |
| 截至2022年和2021年12月31日止年度的股东权益报表 |
|
F-34 |
| 截至2022年12月31日和2021年12月31日的年度现金流量表 |
|
F-35 |
| 财务报表附注 |
|
F-36至F-62 |
独立注册会计师事务所报告
致
董事会
和
Onconetix,Inc.的股东
对财务报表的几点看法
我们已审计了Onconetix,Inc.的随附资产负债表
。(原名:Blue Water Vaccines,Inc.)本公司于2022年12月31日及2021年12月31日止年度(以下简称“本公司”)的财务报表,以及截至2022年12月31日止两年各年度的相关
经营报表、股东权益报表、现金流量表
及相关附注(以下统称“财务报表”)。我们认为,财务报表
在所有重大方面公允地反映了公司截至2022年12月31日和2021年12月31日的财务状况,以及截至2022年12月31日止两年的经营成果和现金流量,符合美国普遍接受的会计原则
。
意见基础
这些财务报表由公司管理层负责。我们的责任是根据我们的审计对公司的财务报表发表意见。我们是一家在美国上市公司会计监督委员会(“PCAOB”)(“PCAOB”)注册的公共会计师事务所,根据美国联邦证券法以及美国证券交易委员会和PCAOB适用的规则和法规,我们必须对公司保持独立。
我们按照PCAOB的
标准进行审计。这些标准要求我们计划和执行审计,以获得关于财务报表是否没有重大错报的合理保证,无论是由于错误还是欺诈。本公司不需要,也没有聘请
对其财务报告的内部控制进行审计。作为我们审计的一部分,我们需要了解财务报告的内部控制,但不是为了对公司财务报告的内部控制的有效性发表意见。因此,我们不表达这样的意见。
我们的审计包括执行程序以评估财务报表重大错报的风险(无论是由于错误还是欺诈),以及执行应对这些风险的程序。这些程序包括在测试基础上审查与财务报表中的金额和披露有关的证据。
我们的审计还包括评估所使用的会计原则和管理层做出的重大估计,以及评估财务报表的整体列报。我们相信,我们的审计为我们的观点提供了合理的基础。
我们于2021年至2023年担任该公司的核数师。
书名/作者声明:[by]/Mayer Hoffman McCann P.C.
加利福尼亚州洛杉矶
2023年3月8日
ONCONETIX,
Inc.
资产负债表
| | |
2022年12月31日 | | |
2021年12月31日 | |
| 资产 | |
| | |
| |
| 流动资产 | |
| | |
| |
| 现金 | |
$ | 25,752,659 | | |
$ | 1,928,474 | |
| 预付费用和其他流动资产 | |
| 469,232 | | |
| 234,551 | |
| 递延发售成本 | |
| — | | |
| 757,646 | |
| 关联方应收账款 | |
| 35,850 | | |
| 152,524 | |
| 流动资产总额 | |
| 26,257,741 | | |
| 3,073,195 | |
| | |
| | | |
| | |
| 预付费用,长期 | |
| 38,617 | | |
| — | |
| 财产和设备,净额 | |
| 14,089 | | |
| 11,502 | |
| 总资产 | |
$ | 26,310,447 | | |
$ | 3,084,697 | |
| | |
| | | |
| | |
| 负债和股东权益 | |
| | | |
| | |
| 流动负债 | |
| | | |
| | |
| 应付帐款 | |
$ | 1,499,296 | | |
$ | 582,605 | |
| 应计费用 | |
| 2,409,128 | | |
| 1,055,515 | |
| 或有认股权证负债 | |
| 14,021 | | |
| — | |
| 流动负债总额 | |
| 3,922,445 | | |
| 1,638,120 | |
| | |
| | | |
| | |
| 总负债 | |
| 3,922,445 | | |
| 1,638,120 | |
| | |
| | | |
| | |
| 承付款和或有事项(见附注7) | |
| | | |
| | |
| | |
| | | |
| | |
| 股东权益 | |
| | | |
| | |
| 优先股,面值0.00001美元,2022年12月31日和2021年12月31日授权的1000万股 | |
| | | |
| | |
| 系列种子:分别于2022年和2021年12月31日指定为0股和1,150,000股;于2022年和2021年12月31日分别发行和发行0股和1,146,138股;于2022年和2021年12月31日分别为0美元和1,540万美元的总清算优先权 | |
| — | | |
| 11 | |
| 普通股,面值0.00001美元,于2022年和2021年12月31日授权发行2.5亿股;分别于2022年和2021年12月31日发行15,724,957股和3,200,000股;分别于2022年和2021年12月31日发行15,265,228股和3,200,000股 | |
| 157 | | |
| 32 | |
| 追加实收资本 | |
| 42,331,155 | | |
| 7,403,204 | |
| 库存股,按成本计算;2022年12月31日和2021年12月31日分别为459,729股和0股普通股 | |
| (566,810 | ) | |
| — | |
| 累计赤字 | |
| (19,376,500 | ) | |
| (5,956,670 | ) |
| 股东权益总额 | |
| 22,388,002 | | |
| 1,446,577 | |
| 总负债和股东权益 | |
$ | 26,310,447 | | |
$ | 3,084,697 | |
附注是这些财务报表的组成部分。
ONCONETIX,
Inc.
运营说明书
| | |
截至2022年12月31日的年度 | | |
截至2021年12月31日的年度 | |
| 运营费用 | |
| | |
| |
| 一般和行政 | |
$ | 9,351,552 | | |
$ | 2,092,304 | |
| 研发 | |
| 4,129,688 | | |
| 1,325,030 | |
| 总运营费用 | |
| 13,481,240 | | |
| 3,417,334 | |
| 运营亏损 | |
| (13,481,240 | ) | |
| (3,417,334 | ) |
| | |
| | | |
| | |
| 其他收入 | |
| | | |
| | |
| 或有认股权证负债的公允价值变动 | |
| (61,410 | ) | |
| — | |
| 其他收入合计 | |
| (61,410 | ) | |
| — | |
| 净亏损 | |
$ | (13,419,830 | ) | |
$ | (3,417,334 | ) |
| 累计优先股股息 | |
| 96,359 | | |
| 627,391 | |
| 适用于普通股股东的净亏损 | |
$ | (13,516,189 | ) | |
$ | (4,044,725 | ) |
| | |
| | | |
| | |
| 普通股股东应占每股基本亏损和稀释后每股净亏损 | |
$ | (1.10 | ) | |
$ | (1.26 | ) |
| | |
| | | |
| | |
| 已发行普通股、基本普通股和稀释普通股的加权平均数 | |
| 12,271,449 | | |
| 3,200,000 | |
附注是这些财务报表的组成部分。
ONCONETIX,
Inc.
股东权益表
截至2022年12月31日和2021年12月31日的年度
| | |
| | |
| | |
| | |
| | |
其他内容 | | |
| | |
| | |
| | |
总计 | |
| | |
优先股 | | |
普通股 | | |
已缴费 | | |
库存股 | | |
累计 | | |
股东的 | |
| | |
股票 | | |
金额 | | |
股票 | | |
金额 | | |
资本 | | |
股票 | | |
金额 | | |
赤字 | | |
权益 | |
| 2020年12月31日余额 | |
| 1,146,138 | | |
$ | 11 | | |
| 3,200,000 | | |
$ | 32 | | |
$ | 7,273,063 | | |
| — | | |
$ | — | | |
$ | (2,539,336 | ) | |
$ | 4,733,770 | |
| 基于股票的薪酬 | |
| — | | |
| — | | |
| — | | |
| — | | |
| 130,141 | | |
| — | | |
| | | |
| — | | |
| 130,141 | |
| 净亏损 | |
| — | | |
| — | | |
| — | | |
| — | | |
| — | | |
| — | | |
| — | | |
| (3,417,334 | ) | |
| (3,417,334 | ) |
| 2021年12月31日的余额 | |
| 1,146,138 | | |
$ | 11 | | |
| 3,200,000 | | |
$ | 32 | | |
$ | 7,403,204 | | |
| — | | |
$ | — | | |
$ | (5,956,670 | ) | |
$ | 1,446,577 | |
| 在首次公开募股中发行普通股,扣除290万美元的发行成本 | |
| — | | |
| — | | |
| 2,222,222 | | |
| 22 | | |
| 17,138,818 | | |
| — | | |
| — | | |
| — | | |
| 17,138,840 | |
| 首次公开发行时将可转换优先股转换为普通股 | |
| (1,146,138 | ) | |
| (11 | ) | |
| 5,626,365 | | |
| 56 | | |
| (45 | ) | |
| — | | |
| — | | |
| — | | |
| — | |
| 4月份私募发行普通股和认股权证,扣除发行成本后的净额为110万美元 | |
| — | | |
| — | | |
| 590,406 | | |
| 6 | | |
| 6,858,322 | | |
| — | | |
| — | | |
| — | | |
| 6,858,328 | |
| 8月份私募发行普通股和认股权证,扣除发行成本220万美元 | |
| — | | |
| — | | |
| 1,350,000 | | |
| 14 | | |
| 8,689,302 | | |
| — | | |
| — | | |
| — | | |
| 8,689,316 | |
| 股票期权的行使 | |
| — | | |
| — | | |
| 165,452 | | |
| 2 | | |
| 1,653 | | |
| — | | |
| — | | |
| — | | |
| 1,655 | |
| 行使预先出资的认股权证 | |
| — | | |
| — | | |
| 2,277,046 | | |
| 22 | | |
| 1,414 | | |
| — | | |
| — | | |
| — | | |
| 1,436 | |
| 发行受限普通股 | |
| — | | |
| — | | |
| 293,466 | | |
| 3 | | |
| 263,921 | | |
| — | | |
| — | | |
| — | | |
| 263,924 | |
| 基于股票的薪酬 | |
| — | | |
| — | | |
| — | | |
| — | | |
| 1,974,566 | | |
| — | | |
| — | | |
| — | | |
| 1,974,566 | |
| 购买库藏股 | |
| — | | |
| — | | |
| — | | |
| — | | |
| — | | |
| (459,729 | ) | |
| (566,810 | ) | |
| | | |
| (566,810 | ) |
| 净亏损 | |
| — | | |
| — | | |
| — | | |
| — | | |
| — | | |
| — | | |
| — | | |
| (13,419,830 | ) | |
| (13,419,830 | ) |
| 2022年12月31日的余额 | |
| — | | |
$ | — | | |
| 15,724,957 | | |
$ | 157 | | |
$ | 42,331,155 | | |
| (459,729 | ) | |
$ | (566,810 | ) | |
$ | (19,376,500 | ) | |
$ | 22,388,002 | |
附注是这些财务报表的组成部分。
ONCONETIX,
Inc.
现金流量表
| | |
截至十二月三十一日止的年度:
2022 | | |
截至的年度
十二月三十一日,
2021 | |
| 经营活动的现金流 | |
| | |
| |
| 净亏损 | |
$ | (13,419,830 | ) | |
$ | (3,417,334 | ) |
| 对净亏损与经营活动中使用的现金净额进行的调整: | |
| | | |
| | |
| 基于股票的薪酬 | |
| 1,974,566 | | |
| 130,141 | |
| 发行受限普通股 | |
| 263,924 | | |
| — | |
| 或有认股权证负债的公允价值变动 | |
| (61,410 | ) | |
| — | |
| 折旧费用 | |
| 6,752 | | |
| 4,890 | |
| 关联方应收账款的核销 | |
| — | | |
| 22,242 | |
| 财产和设备处置损失 | |
| — | | |
| 1,199 | |
| 经营性资产和负债变动情况: | |
| | | |
| | |
| 预付费用和其他流动资产 | |
| (234,681 | ) | |
| 8,302 | |
| 关联方应收账款 | |
| (23,326 | ) | |
| (114,961 | ) |
| 预付费用,长期 | |
| (38,617 | ) | |
| 184,934 | |
| 应付帐款 | |
| 1,093,913 | | |
| 336,715 | |
| 应计费用 | |
| 1,739,849 | | |
| 809,279 | |
| 递延租金 | |
| — | | |
| (9,642 | ) |
| 用于经营活动的现金净额 | |
| (8,698,860 | ) | |
| (2,044,235 | ) |
| | |
| | | |
| | |
| 投资活动产生的现金流 | |
| | | |
| | |
| 购置财产和设备 | |
| (9,339 | ) | |
| (1,924 | ) |
| 用于投资活动的现金净额 | |
| (9,339 | ) | |
| (1,924 | ) |
| | |
| | | |
| | |
| 融资活动产生的现金流 | |
| | | |
| | |
| 支付递延发售费用 | |
| — | | |
| (334,188 | ) |
| 首次公开发行普通股所得款项,扣除承销折扣 | |
| 18,400,000 | | |
| — | |
| 首次公开招股费用的支付 | |
| (926,972 | ) | |
| — | |
| 私募发行普通股和认股权证的收益,扣除配售代理折扣 | |
| 16,468,123 | | |
| — | |
| 支付私募发行成本 | |
| (845,048 | ) | |
| — | |
| 购买库藏股 | |
| (566,810 | ) | |
| — | |
| 行使股票期权所得收益 | |
| 1,655 | | |
| — | |
| 行使预付资金认股权证所得收益 | |
| 1,436 | | |
| — | |
| 融资活动提供(用于)的现金净额 | |
| 32,532,384 | | |
| (334,188 | ) |
| 现金净增(减) | |
| 23,824,185 | | |
| (2,380,347 | ) |
| 期初现金 | |
| 1,928,474 | | |
| 4,308,821 | |
| 期末现金 | |
$ | 25,752,659 | | |
$ | 1,928,474 | |
| | |
| | | |
| | |
| 非现金投资和融资活动: | |
| | | |
| | |
| 应付账款和应计费用中包括的递延发售成本 | |
$ | — | | |
$ | 423,458 | |
| 首次公开发行时将可转换优先股转换为普通股 | |
$ | 45 | | |
$ | — | |
| 私募发行普通股时或有认股权证负债的确认 | |
$ | 75,431 | | |
$ | — | |
| 与8月私募有关的优先投资期权交换的增量公允价值 | |
$ | 860,204 | | |
$ | — | |
| 通过关联方应收账款支付应计奖金 | |
$ | 140,000 | | |
$ | — | |
| 行使预先出资的认股权证 | |
$ | 6 | | |
$ | — | |
附注是这些财务报表的组成部分。
ONCONETIX,
Inc.
财务报表附注
注释
1 -列报的组织和基础
组织
和业务性质
Onconetix,Inc.(原名Blue
Water Vaccines,Inc.)(the“公司”)成立于2018年10月26日,专注于研究和开发转化疫苗,以预防全球传染病。该公司的主要候选疫苗BWV-201是一种减毒活疫苗,鼻内给药,不依赖血清型,靶向肺炎链球菌。肺炎引起的急性中耳炎和肺炎球菌肺炎。BWV的流感候选疫苗BWV-101和BWV-102正在作为
通用流感疫苗进行研究,它们分别具有预防所有流感病毒株和预防大流行前H1流感疫苗的潜力。除了流感疫苗应用的探索性分析外,公司的病毒样颗粒平台
还被用于研究和开发针对诺如病毒、轮状病毒、疟疾、猴痘和马尔堡病毒的候选疫苗
。最后,该公司正在开发一种口服的衣原体减毒活疫苗。公司的所有
候选疫苗均处于临床前开发阶段。
库存
拆分
于
2021年11月24日,本公司对本公司普通股
进行4:1(4:1)股份拆细(“股份拆细”),而其面值并无任何变动,该股份拆细于2021年11月24日生效。这些财务报表中所有
期间的股份和每股金额的所有引用都已追溯重述,以反映优先股转换率的股票分割和比例调整
。
首次公开募股
于
2022年2月23日,本公司完成首次公开募股(“IPO”),其中本公司以每股9.00美元的价格向公众发行并出售2,222,222股普通股。扣除承销折扣、佣金和290万美元的发行成本后,IPO收益为1710万美元。与IPO完成相关,所有可转换
优先股的流通股均转换为5,626,365股普通股。见附注6。
演示基础
公司的财务报表是按照美国公认会计原则(“美国公认会计原则”)编制的。
注
2 -流动性和财务状况
迄今为止,
公司的经营活动一直致力于寻求许可证和从事研发活动。
公司目前正在开发的候选产品在商业化之前需要大量的额外研发工作
。自成立以来,公司主要使用从种子投资者收到的收益以及从首次公开募股和两次私募发行(“私募”)收到的收益为其运营提供资金。于二零二二年,本公司
完成首次公开发售及私人配售,其中本公司于扣除配售代理费用及其他发售开支后收取现金所得款项净额合共约33,100,000元,
见附注6。
公司自成立以来已产生重大经营亏损,并预计在
可预见的未来将继续产生重大经营亏损。截至2022年12月31日,公司拥有现金约2580万美元,营运资金约2230万美元,累计赤字约1940万美元。
公司认为,截至2022年12月31日的现有现金将足以继续运营,履行其义务,并为
未来支出提供资金,这些支出将用于开展临床和监管工作,以开发这些财务报表发布日期后至少
一年的候选产品。
公司将需要大量额外资本来进行执行其长期业务计划所需的投资。本公司
预计,与其计划的临床前开发和临床
试验活动的历史支出相比,现金流出将大幅增加,因此,本公司将需要筹集额外资金以维持运营并满足自这些财务报表发布之日起一年后的长期运营要求
。公司希望通过额外的债务或股权融资寻求额外的资金;但是,目前没有进一步融资的承诺,也没有任何保证公司将以优惠的条件获得此类融资。如果公司无法获得
额外资本,则可能需要减少任何临床试验和产品开发,并采取额外措施减少
费用,以保存足够的现金以维持运营并长期履行其义务。
ONCONETIX,Inc.
财务报表附注
附注
3 -重要会计政策摘要
使用预估的
按照美国公认会计原则编制财务报表需要管理层做出估计和假设,这些估计和假设会影响
财务报表日期的资产和负债报告金额以及或有资产和负债的披露,
以及报告期间的费用报告金额。公司财务报表中最重要的估计
涉及普通股估值(对于IPO完成前发生的交易)、股票薪酬、应计
研发费用以及净经营亏损导致的递延税项资产估值备抵。该等估计
及假设乃根据现时事实、过往经验及在有关情况下相信属合理的多项其他因素而作出,
其结果构成就资产及负债的账面值及未能从其他来源即时得知的开支记录
作出判断的基础。实际结果可能与该等估计有重大不利差异。如果估计结果与实际结果之间存在重大差异,则公司未来的经营业绩将受到影响。
信用风险集中度
可能使公司面临信用风险集中的金融
工具包括金融机构的现金账户,
这些现金账户有时可能超过联邦存款保险限额250,000美元。截至2022年12月31日及2021年12月31日,本公司
未发生该等账户的亏损,管理层认为本公司未面临该等账户的重大风险。
财产
和设备
财产
和设备包括计算机和办公室家具及固定装置,所有这些都按成本入账。折旧按资产各自之可使用年期(介乎三至七年)以直线法记录。
只要有事件或情况表明长期资产的账面金额可能无法收回,就对这些资产进行减值审查。
ONCONETIX,Inc.
财务报表附注
附注
3-重要会计政策摘要(续)
公允价值计量
公允价值定义为在计量日期市场参与者之间的有序交易中因出售资产或转移负债而收到的价格
。美国公认会计准则建立了一个三级公允价值层次结构,对计量公允价值时使用的投入进行优先排序。该层次结构对相同资产或负债的活跃市场的未调整报价给予最高优先权(1级计量),对不可观察到的投入给予最低优先权(3级计量)。这些层级包括:
| ● | 级别
1,定义为可观察到的投入,如活跃市场中相同工具的报价(未经调整); |
| ● | 第
2级,定义为直接或间接可观察到的活跃市场报价以外的投入,如活跃市场中类似工具的报价或非活跃市场中相同或类似工具的报价;以及 |
| ● | 级别
3,定义为不可观察的输入,其中市场数据很少或根本不存在,因此需要实体制定自己的假设,如从估值技术得出的估值,其中一个或多个重要输入或重要价值驱动因素不可观察。 |
在某些情况下,用于计量公允价值的投入可能被归入公允价值等级的不同级别。在这些情况下,公允价值计量在公允价值层次结构中根据对公允价值计量具有重要意义的最低水平投入进行整体分类。金融工具,包括现金、预付开支、递延发售成本、关联方应收账款、应付账款及应计负债,均按成本列账,管理层认为由于该等工具属短期性质,故按公允价值计算。截至2022年12月31日,私募结束时可发行的或有认股权证负债
采用蒙特卡罗模拟(包括3级投入)按经常性基础进行估值。
见附注6。截至2022年12月31日及2021年12月31日,本公司所有非金融资产或负债均未按公允价值
在非经常性基础上记录。在本报告所述期间,没有发生级别之间的转移。
如附注6所述,对各承诺日和2022年12月31日的或有权证负债的估值采用了以下假设:
| | |
4月19日, 2022 | | |
8月11日, 2022 | | |
2022年12月31日 | |
| 行权价格 | |
$ | 8.46875 | | |
$ | 3.3938 | | |
$ | 3.3938 | |
| 期限(年) | |
| 4.00 | | |
| 5.00 | | |
| 4.61 | |
| 预期股价波动 | |
| 117.0 | % | |
| 127.8 | % | |
| 120.8 | % |
| 无风险利率 | |
| 2.86 | % | |
| 2.98 | % | |
| 4.03 | % |
按经常性基础计量的金融工具的公允价值如下:
| | |
截至2022年12月31日 | |
| 描述 | |
总计 | | |
1级 | | |
2级 | | |
3级 | |
| 负债: | |
| | |
| | |
| | |
| |
| 或有认股权证负债 | |
$ | 14,021 | | |
| — | | |
| — | | |
$ | 14,021 | |
ONCONETIX,
Inc.
财务报表附注
附注
3-重要会计政策摘要(续)
下表概述截至2022年12月31日止年度,或然认股权证负债使用不可观察
第三级输入值按第三级输入值厘定的公平值变动:
| | |
或有认股权证
负债 | |
| 2021年12月31日的余额 | |
$ | — | |
| 发行时的公允价值 | |
| 75,431 | |
| 公允价值变动 | |
| (61,410 | ) |
| 2022年12月31日的余额 | |
$ | 14,021 | |
延期的
产品成本
公司将与正在进行的股权融资直接相关的某些法律、专业会计和其他第三方费用资本化为递延发行成本,直至此类融资完成。
股权融资完成后,这些成本
作为发行所得收益的减少计入股东权益。如果放弃进行中的股权融资,则递延发行成本将立即作为经营报表中的经营费用支出。截至2022年12月31日,所有先前与IPO相关的递延发行成本(总计约80万美元,
其中30万美元已于2021年支付)已从2022年2月23日IPO结束时收到的所得款项中扣除。
研究和开发
The
Company expenses the cost of research and development as incurred. Research and development expenses include costs incurred in funding
research and development activities, license fees, and other external costs. Advance payments for goods and services that will be used
in future research and development activities are expensed when the activity has been performed or when the goods have been received
rather than when the payment is made. Upfront and milestone payments due to third parties that perform research and development services
on the Company’s behalf will be expensed as services are rendered or when the milestone is achieved. When billing terms under research
and development contracts do not coincide with the timing of when the work is performed, the Company is required to make estimates of
outstanding obligations as of period end to those third parties. Accrual estimates are based on several factors, including the Company’s
knowledge of the progress towards completion of the research and development activities, invoicing to date under the contracts, communication
from the research institution or other companies of any actual costs incurred during the period that have not yet been invoiced, and
the costs included in the contracts. Significant judgments and estimates may be made in determining the accrued balances at the end of
any reporting period. Actual results could differ from the estimates made by the Company. The historical accrual estimates made by the
Company have not been materially different from the actual costs. See Notes 5 and 7.
ONCONETIX,Inc.
财务报表附注
附注
3-重要会计政策摘要(续)
根据财务会计准则委员会(“FASB”)会计准则编纂(“ASC”)主题
730-10-25-1, 研究和开发,如果所许可的技术尚未达到商业可行性且没有其他未来用途,则在获得许可证和专利权时发生的成本计入研究和开发费用。
公司购买的许可证(见注5)需要基本完成研发、监管和营销审批工作,以达到
商业可行性,并且没有其他未来用途。因此,所获许可证的总购买价格
反映为公司运营报表中的研发费用。
或有事件
应计项目
是在可能发生负债且相关损失金额可以合理估计时,为或有损失记录的。本公司每季度评估法律诉讼和其他事项的进展,这些进展可能导致以前应计的负债金额增加或减少。考虑到评估时已知的事实,
公司确定潜在损失是否被认为是合理可能或可能的,以及它们是否是可估计的。
基于此评估,公司对披露要求进行评估,并考虑财务
报表中可能的应计项目。
基于股票的薪酬
公司根据奖励的估计授予日期
公允价值,在必要的服务期内向员工和非员工支付基于股票的薪酬。授予具有分级归属时间表的雇员的股票奖励采用加速归属法
在奖励的每个单独归属部分的所需服务期内以直线法确认。
公司使用布莱克-斯科尔斯期权定价模型和计算股票奖励公允价值时使用的假设来估计股票期权授予的公允价值,这代表了管理层的最佳估计,涉及内在不确定性和管理层判断的应用
。
预期的
期限- 期权的预期期限是指根据简化方法,本公司的股票奖励预期尚未行使的期限
,即从归属到合同期限结束的半衰期。
预期波动
- 波动性是衡量公司股价历史波动或
预期波动的幅度(即,预期波动率)。由于缺乏用于
公司普通股交易的公开市场的充分历史记录,以及缺乏充分的公司特定历史和隐含波动率数据,公司
根据可比公司的历史普通股交易价格计算预期期限内的股价波动率。对于
这些分析,公司选择了具有可比特征的公司,包括企业价值、风险状况和行业地位
。
普通
股票公允价值- 由于在首次公开募股之前,公司普通股缺乏活跃的市场,因此在首次公开募股之前授予的公司股票期权相关普通股的公允价值
在每个授予日进行估计,并在独立第三方估值专家的协助下
确定。这些估值所依据的假设是管理层的
最佳估计,其中涉及固有的不确定性和管理层判断的重要水平的应用。
IPO完成后,每股普通股的公允价值基于纳斯达克资本市场
报告的公司普通股在授予日的收盘价。
无风险
利率- 本公司的无风险利率以美国国债的隐含收益率为基础,
剩余期限与估计的预期期限相当。
预期
股息- 本公司从未就其普通股股份宣布或支付任何现金股息,并且不计划在可预见的未来支付
现金股息,因此,在其估值模型中使用预期股息收益率为零。
公司在发生股权奖励被没收时予以确认。
ONCONETIX,Inc.
财务报表附注
附注
3-重要会计政策摘要(续)
普通股公允价值
为了在首次公开招股前发行股票期权时确定本公司普通股股份的公允价值,本公司董事会考虑了第三方估值的意见,其中包括本公司普通股的同期估值。鉴于首次公开招股前本公司股本并无公开交易市场,本公司董事会作出合理判断,并考虑多项客观及主观因素以确定本公司普通股公允价值的最佳估计
,包括:
| ● | 公司优先股相对于公司普通股的价格、权利、优惠和特权; |
| ● |
公司的业务、财务状况和经营业绩,包括影响公司经营的相关行业趋势。 |
| ● | 在当时的市场条件下,实现首次公开募股或出售公司等流动性事件的可能性; |
在评估本公司普通股的公允市值时,董事会首先使用公认的估值方法确定其业务的权益价值。
公司聘请第三方估值专家进行估值,该专家以其最近的优先股融资为
起点,采用期权定价方法(OPM)基于Backsolve方法确定公司的股权价值,并根据市场法计算隐含价值。公司的股权价值是使用OPM来分配的,以估计公司股权类别的公平市场价值
。
据纳斯达克资本市场报道,首次公开募股完成后,每股普通股的公允价值以授予日公司普通股的收盘价为基础。
所得税
税
所得税
按资产负债法核算。递延税项资产和负债确认为未来税项影响
可归因于现有资产和负债的账面金额与其各自的计税基础之间的差异,以及营业亏损和税项抵免结转之间的差异。
递延
税项资产和负债采用颁布税率计量,预计适用于预计收回或结算这些临时差额的年度的应纳税所得额。税率变动对递延税项资产和负债的影响在包括颁布日期的期间内的经营中确认。递延税项资产通过使用估值津贴减少到预期变现的估计金额
。
ONCONETIX,Inc.
财务报表附注
附注
3-重要会计政策摘要(续)
综合
收益(亏损)
公司必须在确认期间的财务报表中报告全面收益(亏损)的所有组成部分,包括净收益(亏损)。全面收益(亏损)被定义为在一段时间内因来自非所有者来源的交易和其他事件和情况而发生的权益变化,包括投资的未实现损益和
外币换算调整。所有列报期间的净亏损和综合亏损相同。
认股权证
公司首先评估权证是否符合ASC 480-10的负债分类,从而确定发行的权证的会计分类为负债或权益。区分负债与股权,(“ASC480-10”),然后根据ASC815-40,衍生品和套期保值-实体自有权益的合同(“ASC
815-40”)。根据ASC 480-10,如果认股权证是可强制赎回的,发行人有义务通过支付现金或其他资产来结算权证或相关股份,或者必须或可能通过发行数量可变的股票进行结算,则认股权证被视为负债分类。
如果
认股权证不符合ASC 480-10下的负债分类,本公司将评估ASC 815-40下的要求,其中规定
要求或可能要求发行人以现金结算合同的合同是按公允价值记录的负债,而不考虑触发现金净额结算功能的交易发生的可能性。如果认股权证不需要根据ASC 815-40进行负债分类,则为了完成股权分类,本公司将评估认股权证是否按其普通股编制索引,以及认股权证是否根据ASC 815-40或其他适用的公认会计原则分类为股权。在进行所有相关评估后,公司将权证归类为负债或权益。负债分类认股权证须于发行日期及随后的会计期间结束日期按公允价值入账,发行日期后公允价值的所有变动均记作其他收入(开支)的一部分,并在经营报表中记入净额。股权分类
权证于发行日按公允价值入账,发行日后确认的公允价值无变动。截至2022年12月31日,本公司所有未发行认股权证均为股权分类认股权证,但在私募完成后可发行的或有认股权证除外。请参阅注释6。
库房
库存
公司按成本法记录库存股活动,将收购股票的成本记为库存股。
每股净亏损
基本
每股亏损的计算方法为:适用于普通股的净收益或亏损除以期内已发行普通股的加权平均数
,包括预先出资的认股权证,因为它们的行使只需要交付股份的名义对价
。稀释后每股收益按期间内已发行普通股的加权平均数和潜在普通股的加权平均数计算。潜在普通股包括公司的优先股、认股权证和期权。
稀释每股亏损不包括优先股转换后可发行的股份,以及普通股期权和认股权证,如果它们的影响是反稀释的,则不计入每股净亏损。
ONCONETIX,Inc.
财务报表附注
附注
3-重要会计政策摘要(续)
根据参与证券在任何未分配收益中的参与权,采用
两级法确定每股收益。包括参与分配收益的权利的每一股优先股都被视为参与证券,
公司使用两级法计算公司普通股股东可获得的每股普通股净收益--
基本收益和稀释收益。
以下证券不包括在本报告所述期间的已发行稀释股份的计算范围内,因为它们将对公司的净亏损产生反摊薄影响:
| | |
截至十二月三十一日止的年度, | |
| | |
2022 | | |
2021 | |
| 购买普通股股份的期权 | |
| 1,392,654 | | |
| 780,640 | |
| 认股权证 | |
| 5,264,274 | | |
| — | |
| 系列种子优先股 | |
| — | | |
| 4,584,552 | |
| 总计 | |
| 6,656,928 | | |
| 5,365,192 | |
新的
会计声明s
2012年4月,《创业创业法案》(以下简称《就业法案》)签署成为法律。《就业法案》包含了一些条款,其中包括降低新兴成长型公司的某些报告要求。作为一家新兴的成长型公司,当新的或修订的会计准则对非上市公司生效时,公司
可能会选择采用,这通常晚于上市公司必须采用该准则的时间。本公司已选择利用JOBS法案提供的延长过渡期,因此,除非本公司选择提前采用任何准则,否则将在要求非上市公司采用新的或修订的会计准则的相关日期采用此类准则。
2020年8月,FASB发布了会计准则更新(ASU)第2020-06号,债务-可转换债务和其他
期权(分主题470-20)和衍生工具和套期保值-实体自有权益中的合同(分主题815-40):将可转换工具和合同计入实体自有权益中通过删除当前GAAP要求的主要分离模型,简化了可转换工具的会计处理。ASU还取消了股权合同符合衍生品范围例外所需的某些结算条件,并在某些领域简化了稀释每股收益的计算
。本指南对公共业务实体有效,但较小的报告公司除外
这些财政年度内的过渡期,自2021年12月15日之后开始。对于所有其他实体,标准
将在2023年12月15日之后的会计年度生效,包括这些会计年度内的过渡期。允许提前采用
。本公司于2022年1月1日提前采用ASU 2020-06,采用修改后的追溯方法,采用
ASU并未影响公司的财务状况、经营业绩、现金流或每股净亏损。
ONCONETIX,Inc.
财务报表附注
附注
3-重要会计政策摘要(续)
2020年10月,FASB发布了ASU 2020-10,编撰方面的改进,它通过澄清
或改进披露要求来更新各种编纂主题,以与美国证券交易委员会的法规保持一致。自2022年1月1日起的报告期内,公司采用ASU 2020-10。这一更新的采用并未对公司的财务报表产生实质性影响。
2021年5月,FASB发布了ASU 2021-04、每股收益(主题260)、债务修改和清偿(子主题470-50)、
补偿-股票补偿(主题718)以及实体自身股权的衍生品和对冲合同(子主题
815-40):发行人对独立股权分类书面看涨期权的某些修改或交换的会计(FASB新兴问题特别工作组的共识
)。ASU澄清并减少发行人对修改或交换独立股权分类书面看涨期权(例如认股权证)的会计多样性,这些期权在修改或交换后仍保持股权分类
。ASU提供的指导将澄清发行人是否应对独立的
股权分类书面看涨期权的修改或交换进行说明,该期权在修改或交换后仍保持股权分类为:(1)对股权的调整,如果是,则相关的每股收益(EPS)影响(如果有),或(2)费用,如果是,确认的方式和模式。
新指南从2021年12月15日开始对所有实体的年度和中期有效,允许及早采用,包括在过渡期采用。公司于2022年1月1日采用ASU 2021-04,采用ASU并未影响公司的财务状况、经营业绩、现金流或每股净亏损。
2022年6月,FASB发布了ASU 2022-03号,公允价值计量(主题820):股权证券的公允价值计量
受合同销售限制(“ASU 2022-03”),适用于所有按公允价值计量、
受合同销售限制限制的股权证券。这一变化禁止实体在估计公允价值时将出售股权证券的合同限制考虑在内,并为此类交易引入了必要的披露。本指南适用于2023年12月15日之后的公共企业实体,包括这些会计年度内的过渡期。对于所有其他实体,该标准将在2024年12月15日之后的会计年度生效,包括这些会计年度内的过渡期。
允许提前采用。公司很早就采用了ASU 2022-03,自2022年7月1日起生效,采用ASU并未影响公司的财务状况、经营业绩、现金流或每股净亏损。
公司管理层不认为最近发布但尚未生效的任何其他会计准则如果目前采用
会对所附财务报表产生重大影响。
附注
4-资产负债表明细
预付
费用和其他流动资产
截至2022年12月31日和2021年12月31日,预付费用和其他流动资产包括:
| | |
截至12月31日,
2022 | | |
自.起
十二月三十一日,
2021 | |
| 预付费研发 | |
$ | 231,981 | | |
$ | 203,910 | |
| 预付保险 | |
| 148,789 | | |
| 4,842 | |
| 预付费其他 | |
| 88,462 | | |
| 25,799 | |
| 总计 | |
$ | 469,232 | | |
$ | 234,551 | |
ONCONETIX,Inc.
财务报表附注
附注
4-资产负债表明细(续)
应计费用
截至2022年12月31日和2021年12月31日,应计费用包括:
| | |
截至12月31日,
2022 | | |
自.起
十二月三十一日,
2021 | |
| 应计牌照费 | |
$ | 15,000 | | |
$ | 225,000 | |
| 应计研究和开发 | |
| 847,747 | | |
| 300,182 | |
| 应计延期发售成本 | |
| 125,000 | | |
| 246,236 | |
| 应计补偿 | |
| 1,132,859 | | |
| 234,265 | |
| 应计特许经营税 | |
| 177,600 | | |
| — | |
| 应计董事费用 | |
| 38,750 | | |
| — | |
| 应计其他 | |
| 72,172 | | |
| 49,832 | |
| 总计 | |
$ | 2,409,128 | | |
$ | 1,055,515 | |
注
5-重要协议
牛津大学创新有限公司
2018年12月,本公司与牛津大学创新学院(OUI)签订了一份期权协议,该协议是于2019年7月16日签订的许可协议(“OUI协议”)的前身。根据OUI协议的条款,该公司持有
某些特定专利权和生物材料的全球独家许可,这些专利权和生物材料涉及使用许可专利权和生物材料所涵盖的有限变异性和类似病毒的颗粒产品和实践过程
以开发和商业化流感候选疫苗产品。公司有义务根据OUI协议的发展计划,尽其最大努力开发和销售OUI协议中规定的许可产品,向OUI报告进展情况,实现以下里程碑,并在完成后支付OUI不退还的里程碑费用:启动第一阶段第一研究;启动第一阶段第二研究;启动第一阶段III/关键注册研究;首次提交监管批准申请(BLA/NDA);在美国的营销授权;在任何欧盟国家的营销授权;在日本的营销授权;在任何其他国家的首次营销授权;在日本的首次商业销售;在任何国家/地区的首次商业销售;年销售额等于或超过特定门槛的第一年。有关
里程碑付款以及OUI协议要求的版税义务的其他信息,请参阅注7。OUI协议将在许可专利权中包含的最后一项专利到期后十(10)年
到期,除非提前终止。在截至2021年12月31日的一年中,OUI获得了与免疫原性成分相关的美国专利。这项专利将于2037年8月到期。截至2022年12月31日,未颁发任何额外专利
。任何一方都可以因未治愈的重大违规行为而终止OUI协议。本公司可在发出六个月书面通知后,以任何理由随时终止OUI协议,直至2022年7月16日,即OUI协议三周年。如果本公司提出清盘呈请,或通过并非与债权人进行真正合并或重组或合并的清盘决议案,或已委任接管人或管理人,则OUI可立即终止。如果公司反对或质疑《OUI协议》中所定义的许可技术中的任何专利或应用的有效性,OUI也可以终止;提出声明,认为许可技术的专有技术不是开发和营销许可产品所必需的
;或者OUI合理地认为,正在采取不适当或不充分的步骤来开发或营销许可产品,并且没有在合理时间内采取任何OUI书面通知要求的进一步步骤。
截至2022年和2021年12月31日止年度,本公司并无就知识产权许可支付任何许可费。
见附注7。
ONCONETIX,Inc.
财务报表附注
注
5-重要协议(续)
圣犹大儿童医院
该公司于2020年1月27日与圣犹大儿童研究医院(“圣犹大”)签订了许可协议(“圣犹大协议”)。根据圣裘德协议的条款,该公司持有与使用减毒活肺炎链球菌有关的某些特定专利权和生物材料的全球独家许可,并实践许可专利权和生物材料所涵盖的工艺,以开发和商业化肺炎链球菌候选疫苗产品。圣裘德协议将在许可专利权中包含的最后一个有效权利要求
到期时失效,除非提前终止。本公司有义务使用商业上合理的努力
开发和商业化授权产品(S)。这些里程碑包括以下事件:(I)完成启用IND的研究;(Ii)启动动物毒理学研究;(Iii)提交IND文件;(Iv)完成第一阶段临床试验;(V)开始第二阶段临床试验;(Vi)开始第三阶段临床试验;以及(Vii)获得美国或国外同等的监管批准。如果本公司未能实现圣裘德协议中包含的发展里程碑,且本公司与圣裘德未能就双方满意的修订时间表达成一致,圣裘德将有权终止圣裘德协议。如果另一方(A)根据《破产法》(除其他事项外)提交或已向其提交请愿书,或(B)未能履行或以其他方式违反其在《圣犹大协议》项下的义务,且未在六十(60)天内纠正此类违约或违约,则任何一方均可终止《圣犹大协议》。公司可在三十(30)天内发出书面通知,以任何理由终止合同。2022年5月11日,公司对圣裘德协议进行了修订,修订了特许权使用费条款、里程碑付款和许可费,并商定了修订后的发展里程碑时间表
。有关这项修订的详细资料,请参阅附注7。
在截至2022年和2021年12月31日的年度中,公司分别确认了15,000美元和11,000美元的知识产权许可费用,并将其记为研发费用。有关里程碑付款以及《圣裘德协定》规定的特许权使用费义务的更多信息,见附注7。
辛辛那提儿童医院医疗中心
该公司于2021年6月1日与辛辛那提儿童医院医疗中心(“CHMC”)签订了一份许可协议(“CHMC协议”)。根据CHMC协议的条款,公司
拥有独家的全球许可证(不包括免疫接种和预防、控制、或降低
中国和香港地区轮状病毒和诺沃克病毒引起的胃肠炎的严重程度)授予与使用许可专利权和生物材料所涵盖的诺沃克纳米颗粒和实践工艺相关的特定专利和生物
材料,以开发和商业化针对病毒样颗粒疫苗的CHMC专利和相关技术
平台,该平台利用纳米颗粒递送技术来开发可能具有广泛应用前景的多种传染性
疾病的疫苗。CHMC协议的有效期从生效日期开始,并根据司法管辖区和产品的不同而延长
,直至:(I)许可专利最后到期;(Ii)首次商业销售后十(10)年;或(Iii)生物相似或可互换产品进入市场
。本公司有义务以商业上合理的努力,通过勤奋的研发、测试、制造和商业化,将授权产品推向市场,尽最大努力
提交所有必要的监管文件并获得所有必要的监管批准,以实现与开发和销售相关的里程碑
,并向CHMC报告进展情况。本公司还有义务向CHMC支付商定的开发里程碑付款以及特许权使用费,详情见附注7。为方便起见,本公司可在产品或流程首次商业销售前的任何时间,通过向CHMC提供180(180)天的书面通知
,终止CHMC协议。它也可能因CHMC未固化的材料漏洞而终止。CHMC可能会因未治愈的公司重大违约或破产或破产而终止CHMC协议。根据CHMC协议的条款,如果本公司未能实现里程碑,并且
无法与CHMC就里程碑的修订达成一致,则CHMC将有权将任何和所有此类独家
许可证转换为非独家许可证,以继续开发在任何阶段已进入开发阶段或公司已投资开发的适应症。如果本公司或其关联公司对《CHMC协议》中所定义的任何许可专利的有效性或可执行性提出质疑或引发他人提出质疑,则CHMC也可在全球范围内的法律允许的最大范围内终止《CHMC协议》,并且本公司有义务偿还CHMC的费用,包括合理的律师费。
ONCONETIX,Inc.
财务报表附注
注
5-重要协议(续)
在截至2022年12月31日和2021年12月31日的年度中,公司确认的知识产权许可和专利报销总额分别约为38,000美元和402,000美元,这些费用被记为研发费用,并计入截至2022年12月31日的应付账款和截至2021年12月31日的应计费用。请参阅注释7。
生物服务公司(后来被National Resilience,Inc.收购)
本公司于2019年7月19日与Oology,Inc.(“Oology”)
签订主服务协议(以下简称“主服务协议”),不时提供服务,包括但不限于技术转让、流程开发、分析方法优化、生物产品cGMP制造、监管事务及稳定性研究。根据《OLICY MSA》,本公司和OLICY应
为每个项目签订《项目附录》,受《OLICY MSA》的条款和条件管辖。
截至2022年12月31日,
公司已签订两份项目附录。最初的项目附录于2019年10月18日执行,本公司须向Ologic支付总计约400万美元。由于与新冠肺炎相关的意外延误,
本公司与Ologic于2020年1月9日签订了一项书面协议,停止该项目的工作,届时本公司已向Ologic支付了100,000美元以支付将提供的服务。第二个项目附录于2021年5月21日执行,公司有义务
向Ologic支付总额约280万美元,外加材料和外包测试的报销,将
按成本加15%计费。
于2022年期间,本公司对《第二个项目附录》中界定的工作范围进行了三次修订,以调整第二个项目附录中界定的工作范围。
修订导致本公司在第二个项目附录下的债务净增加154,000美元。
于截至2022年及2021年12月31日止年度内,本公司分别产生约1,329,000美元及328,000美元的相关研发开支,并于2022年12月31日分别有约476,000美元及669,000美元的相关应付账款及应计开支,
于2021年12月31日分别有约164,000美元及115,000美元的相关应付账款及应计开支入账
。
圣安东尼奥的德克萨斯大学健康科学中心
该公司于2022年11月18日与位于圣安东尼奥的德克萨斯大学健康科学中心(“UT Health”)签订了一份专利和技术许可协议(“UT Health协议”)。根据《UT健康协议》的条款,
公司持有与开发口服减毒衣原体活疫苗候选疫苗有关的特定
特定专利权的全球独家许可(不包括《UT健康协议》中定义的载体领域)。首次不可退还的许可费为100,000美元,协议签署后每年支付的许可费为20,000美元;截至2028年12月31日的两年每年为40,000美元;截至2029年12月31日的一年及之后直至UT健康协议到期或终止为止的每一年为60,000美元。有关里程碑付款以及UT健康协议要求的特许权使用费义务的信息,请参见注7。UT健康协议
将在专利权到期或终止的最后日期到期时失效,除非提前终止。为方便起见,公司可通过向UT Health提供90天的书面通知来终止UT Health协议。在以下情况下,UT Health可终止《UT Health协议》:(A)公司拖欠应付款项且未在收到UT Health通知后30天内付款,或(B)违反任何不付款条款且未在收到UT Health通知后60天内纠正此类违规行为,或(C)UT Health在任何
12个月期间内就三项或三项以上实际重大违反《UT Health协议》向公司发出通知,或(D)公司或其附属公司发起任何诉讼或行动,以质疑《UT Health协议》的有效性、可执行性、
或任何许可专利的范围。
在截至2022年12月31日的年度中,公司确认了总计100,000美元的知识产权许可费用,并将其记为研发费用,并计入截至2022年12月31日的应付帐款中。
ONCONETIX,
Inc.
财务报表附注
附注
6-股东权益
授权资本
于2022年2月23日,就首次公开招股结束事宜,本公司向特拉华州州务卿提交经修订及重述的公司注册证书(“A&R COI”),并即时生效。本公司的法定普通股和优先股分别为250,000,000股和10,000,000股,
或面值均为0.00001美元的普通股和优先股没有变化。在本次修订之前,公司已指定1,150,000股优先股,每股面值0.00001美元。此外,于2022年2月23日,为配合首次公开招股的结束,本公司董事会通过了经修订及重新修订的附例。
普通股
股票
截至2022年和2021年12月31日,已发行普通股分别为15,724,957股和3,200,000股,已发行普通股分别为15,265,228股和3,200,000股。
本公司普通股持有人
每持有一股登记在册的股份有权投一票,并有权于本公司清盘时按比例分享本公司于偿付本公司所有债务及就优先于普通股(目前包括本公司优先股)的每类股票计提拨备后可供分配的本公司净资产。普通股不能赎回,也没有优先购买权或类似权利。
于2022年2月17日,本公司与作为承销商代表(“Boustead”)的Boustead Securities,LLC就本公司的首次公开招股订立承销协议(“包销协议”),据此,本公司同意按每股9.00美元的价格,向承销商出售合共2,222,222股本公司普通股。IPO于2022年2月23日完成,在扣除8%的承销折扣和其他发行成本约1710万美元后,公司获得了净收益。根据包销协议,本公司向Boustead发行认股权证,以购买111,111股普通股,可由持有人选择行使五年,每股行使价等于
至10.35美元。
公司根据ASC 480和ASC 815-40提供的会计指引评估了IPO结束时发行的认股权证的条款,并决定将其归类为股权工具
。由于本公司确定认股权证属股权分类,
本公司将首次公开招股所得款项扣除发行成本后按面值计入普通股,并将所得款项净额
记入额外实收资本。
于2022年10月,根据与Boustead订立的和解协议,这些认股权证交换了93,466股受限制普通股(“认股权证交易所”)。见附注7.认股权证交换作为权证的修订入账,增额公允价值约为10,000美元,并在所附经营报表中记作一般及行政开支。此外,在签署与和解协议同时签订的咨询协议时,向Boustead发行了200,000股普通股限制性股票。没有归属条款的
普通股限制性股票的公允价值为254,000美元,并在随附的经营报表中作为一般和行政费用入账。请参阅注释7。
根据和解及咨询协议发行的
普通股限售股,以协议签署之日的收市价为基准进行估值,并作出调整以反映限制出售普通股的影响。
限制的价值是使用Black-Scholes模型来衡量缺乏市场时的折扣,使用以下假设:
预期期限为0.5年,预期波动率为96.36%,无风险利率为4.09%,股息收益率为0.0%。
库房
库存
2022年11月10日,董事会批准了一项股票回购计划(“回购计划”),允许公司
回购最多500万股普通股,最高价格为每股1.00美元,管理层有权根据市场情况进行购买
。2022年11月18日,董事会批准将最高价格提高到每股2.00美元。
该计划没有到期日。
于2022年期间,本公司以平均每股1.23美元的价格回购了459,729股普通股,约合60万美元。
回购的股票被归类为库存股,以备将来使用,并减少了用于计算每股收益的流通股数量。截至2022年12月31日,尚有约450万股可根据回购计划进行回购。
ONCONETIX,Inc.
财务报表附注
附注
6-股东权益(续)
私募股权投资
4月
私募
于2022年4月19日,本公司根据证券购买协议的条款及条件,于2022年4月13日完成私募(“四月私募”)的结束。于4月份私募完成时,本公司发行了590,406股普通股、预融资权证以购买总计590,406股普通股,以及优先投资期权以购买总计1,180,812股普通股。每股普通股连同相关优先投资期权的收购价为6.775美元,而每股预付资助权证及相关优先投资期权的收购价为6.774美元。在扣除配售代理费和其他发售费用后,公司从4月份的定向增发中获得的现金净收益总额约为690万美元。预筹资权证的行使价为每股0.001美元,可在2022年4月19日或之后行使,并可在预筹资权证全部行使之前行使。预筹资权证已于2022年5月24日全面行使,因此,本公司于该日发行了590,406股普通股。优先投资期权可于2022年4月19日或之后至2026年4月20日的任何时间行使,行使价为每股6.65美元,受协议中规定的某些调整的限制。
H.C.Wainwright&Co.,LLC(“Wainwright”)担任4月份私募的独家配售代理。公司同意向Wainwright支付相当于4月份私募总收益的7.5%和1.0%的配售代理费和管理费,并偿还某些自付费用,总金额最高可达85,000美元。此外,公司
向Wainwright发行了认股权证(“四月Wainwright认股权证”),购买最多70,849股普通股。Wainwright
权证的形式与优先投资选项基本相同,不同之处在于行使价格为8.46875美元。优先投资期权的形式为权证,因此优先投资期权、预筹资权证和Wainwright权证统称为“四月私募认股权证”。此外,在行使任何优先投资期权以换取现金时,本公司同意向Wainwright增发认股权证,以购买相当于已行使优先投资期权相关普通股股份总数的6.0%的普通股
,同时行使价为8.46875美元(“四月或有认股权证”)。根据这一规定,4月份可发行的或有权证的最高数量为70,849份。
关于四月份的定向增发,本公司与买方订立了一份登记权协议,日期为二零二二年四月十三日(“四月登记权协议”)。四月登记权协议规定,本公司
应不迟于四月登记权协议日期
之后的第20个历日向美国证券交易委员会(“美国证券交易委员会”)提交一份涵盖所有应登记证券(定义见四月登记权协议)转售的登记书,并在提交后尽快由美国证券交易委员会宣布生效
,但无论如何不迟于2022年4月13日之后的第45个历日,或如美国证券交易委员会进行全面审查,则不迟于4月13日之后的第75天。2022年。4月登记权协议要求的S-1表格登记声明于2022年5月3日向美国证券交易委员会备案,并于2022年5月20日生效。
在
发生禁止买方在任何12个月期间转售证券的连续十个日历日或合计超过十五个日历日的任何事件(如4月登记权协议所界定)发生时,本公司有义务在每个此类事件的每个月周年日向每位买方支付一笔现金金额,作为部分违约金,而不是罚款。等于2.0%的乘积
乘以该购买者在4月份的定向增发中支付的总认购金额。截至2022年12月31日,本公司认定本公司根据4月注册权协议发生违约金的可能性微乎其微,因此,截至2022年12月31日,不需要应计这些款项。
ONCONETIX,Inc.
财务报表附注
附注
6-股东权益(续)
根据ASC 480和ASC 815-40提供的会计指导,公司评估了4月私募认股权证的条款,并确定它们应被归类为股权工具。由于本公司确定4月份的私募认股权证
属于股权分类,本公司按面值将4月份私募的收益(扣除发行成本)计入普通股
,并将净收益的余额计入额外实收资本。
该公司评估了四月份或有认股权证的条款,并根据ASC 815-40提供的会计指导将其归类为负债。由于4月份的或有认股权证是对Wainwright的一种补偿形式,公司
将负债价值约36,000美元记录为额外实收资本的减少额,随后在所附经营报表的其他收入中记录的负债价值发生了变化。该公司在4月私募结束时使用蒙特卡洛模拟来衡量负债。请参阅注释3。
2022年8月11日,4月份定向增发的投资者同意取消4月份定向增发发行的总计1,180,812个优先投资期权
,作为他们参与8月份定向增发的一部分。在取消4月份优先投资期权(计入股权挂钩金融工具的交换)的同时,只能在行使优先投资期权时才能发行的4月份或有权证也进行了修改。有关更多详细信息,请参阅下面的《八月私募》
。
8月
私募
本公司于2022年8月11日根据证券购买协议的条款及条件(日期为2022年8月9日)完成私募(“八月私募”)的结束。于八月私募结束时,本公司发行了1,350,000股普通股、可购买2,333,280股普通股的预融资权证
及可购买最多4,972,428股普通股的优先投资期权。每股普通股
连同相关优先投资期权的收购价为2.715美元,而每份预筹资权证
连同相关优先投资期权的收购价为2.714美元。在扣除配售代理费和其他发售费用后,本公司从8月份非公开配售中获得的现金净收益总额约为870万美元。此外,8月份定向增发的投资者
与4月份定向增发的投资者
同意取消优先投资选择权
,以购买2022年4月发行的总计1,180,812股本公司普通股。预融资权证
的行使价为每股0.001美元,可在2022年8月11日或之后行使,并可在预融资权证
全部行使之前行使。优先投资期权可在2022年8月11日或之后至2027年8月12日的任何时间行使,行使价为每股2.546美元,受协议规定的某些调整的限制。于2022年期间,共行使了1,686,640份预融资权证,因此本公司发行了1,686,640股普通股。剩余的646,640份预融资权证是在2022年12月31日之后行使的。参见备注11。
Wainwright
担任8月私募的独家配售代理。公司同意向Wainwright支付配售代理费和管理费,分别相当于8月份私募总收益的7.5%和1.0%,并报销
某些自付费用,总金额最高可达85,000美元。此外,公司还向Wainwright发行了认股权证(“8月Wainwright认股权证”),购买最多220,997股普通股。8月份的Wainwright认股权证与优先投资期权的形式基本相同,只是行使价格为3.3938美元。优先投资期权的形式
为权证,因此优先投资期权、预筹资权证和8月Wainwright权证统称为“8月私募认股权证”。此外,在行使任何优先投资期权以换取现金时,本公司同意向Wainwright增发认股权证,以购买相当于已行使优先投资期权相关普通股股份总数的6.0%的普通股,行使价亦为
$3.3938(“八月或有认股权证”)。根据这项规定可发行的8月或有权证最多为298,346份,其中包括因8月私募而修改的70,849份4月或有权证。
ONCONETIX,Inc.
财务报表附注
附注
6-股东权益(续)
关于八月定向增发,本公司与买方订立一份登记权协议,日期为二零二二年八月九日(“八月登记权协议”)。8月份登记权协议规定,公司应在不迟于8月份登记权协议日期后的第30个日历日向美国证券交易委员会提交一份涵盖所有应登记证券(定义见8月注册权协议)的再销售的登记声明,并
在登记声明提交后尽快由美国证券交易委员会宣布生效,但在任何情况下,不迟于2022年8月9日之后的第45个日历日,或如果美国证券交易委员会进行全面审查,则不迟于8月9日之后的第80天。2022年。
注册权协议要求的S-1表格注册书于2022年8月29日向美国证券交易委员会备案,
于2022年9月19日生效。
在
发生禁止买方在任何12个月期间内转售证券的连续十个日历日或合计超过十五个日历日的任何事件(如8月份注册权协议所界定)发生时,本公司有义务在每个此类事件的每个月周年日向每位买方支付一笔现金,作为部分违约金,而不是罚款。等于2.0%的乘积
乘以该购买者在8月份的定向增发中支付的总认购金额。截至2022年12月31日,本公司认定本公司根据8月注册权协议发生违约金的可能性微乎其微
,因此,截至2022年12月31日,无需应计这些款项。
根据ASC 480和ASC 815-40提供的会计指导,公司评估了8月份私募认股权证的条款,并确定它们应被归类为股权工具。由于本公司确定8月份的私募认股权证
属于股权分类,本公司按面值将8月份私募的收益(扣除发行成本)计入普通股
,并将净收益的余额计入额外实收资本。
如上文所述,作为参与八月私募的一部分,私募的投资者同意取消四月私募发行的合共1,180,812份优先投资期权。已注销的优先投资选择权实际上已于八月的私募交易中交换为1,289,148个新优先投资选择权,因此,
已计入股权挂钩工具的修订或交换。根据ASC 815-40,由于优先投资
期权在交换之前和之后被归类为股权工具,并且由于交换直接归因于股权发行,本公司将交换的影响确认为股权发行成本。优先投资期权因交换而增加的公允价值约为860,000美元,采用布莱克-斯科尔斯期权定价模型确定,并有以下假设:
| | |
原创 | | |
已交换 | |
| 行权价格 | |
$ | 6.65 | | |
$ | 2.546 | |
| 期限(年) | |
| 3.67 | | |
| 5.0 | |
| 预期股价波动 | |
| 116.2 | % | |
| 120.2 | % |
| 无风险利率 | |
| 3.16 | % | |
| 2.98 | % |
该公司评估了8月份或有认股权证的条款,并根据ASC 815-40提供的会计指导将其归类为负债。由于交换了4月份私募发行的优先投资期权,将触发4月份或有权证发行的相关股权挂钩工具被替换,因此,4月份的70,849份或有权证被交换为8月份的70,849份或有权证。4月份或有认股权证负债的价值在修改之日采用蒙特卡洛模拟调整为公允价值,公允价值变动约8,000美元在所附经营报表中确认。其余227,497份8月或有认股权证在8月私募结束时作为负债计量。由于或有权证是对配售代理的一种补偿,公司将负债价值约39,000美元记录为额外实收资本的减去。
8月份的全部298,346份或有权证于2022年12月31日使用蒙特卡罗模拟重新计量,负债价值的变化
记录在随附的经营报表中的其他收入(费用)中。请参阅注释3。
ONCONETIX,
Inc.
财务报表附注
附注
6-股东权益(续)
认股权证
以下
概述了截至2022年12月31日的年度与上述公司未偿还认股权证相关的活动,不包括行使优先投资期权后可发行的或有认股权证
:
| | |
| | |
| | |
加权 | |
| | |
| | |
| | |
平均值 | |
| | |
| | |
加权 | | |
剩余 | |
| | |
| | |
平均值 | | |
合同 | |
| | |
数量 | | |
锻炼 | | |
生命 | |
| | |
股票 | | |
价格 | | |
(单位:年) | |
| 截至2021年12月31日的未偿还债务 | |
| — | | |
$ | — | | |
| — | |
| 授与 | |
| 9,479,883 | | |
| 2.43 | | |
| | |
| 已锻炼 | |
| (2,277,046 | ) | |
| 0.001 | | |
| | |
| 取消 | |
| (1,291,923 | ) | |
| 6.97 | | |
| | |
| 截至2022年12月31日的未偿还债务 | |
| 5,910,914 | | |
| 2.37 | | |
| 4.7 | |
| 截至2022年12月31日已授予并可行使的认股权证 | |
| 5,910,914 | | |
$ | 2.37 | | |
| 4.7 | |
截至2022年12月31日,已发行的认股权证包括70,849份4月的私募认股权证和5,840,065份8月的私募认股权证,根据当日的收盘价
,这些认股权证可行使为5,910,914股普通股,每股公平价值为1.10美元。
此外,截至2022年12月31日,4月或有权证和8月或有权证(统称“或有权证”)的价值约为14,000美元,尚未发行任何或有权证,因为尚未行使优先投资选择
。
优先股
股票
于首次公开招股结束前,本公司已指定1,150,000股优先股为系列种子优先股(“系列种子”),原始发行价为每股6.09美元(“原始发行价”)。截至2022年12月31日和2021年12月31日,
系列种子分别有0股和1,146,138股已发行和流通。
转换
根据持有人的选择,系列种子的每股
股票可在任何时间和不时转换为公司普通股的全缴股款和不可评估股份,换股价格为每股1.52美元,持有者无需支付任何额外代价。每股系列种子股票可自动转换为公司普通股,按当时有效的转换价格,
在稳固承销的公开募股结束时,净收益至少为5,000万美元,发行价至少为系列种子原始发行价的300%(300%)。2022年2月18日,系列种子的大多数持有人批准在IPO结束时自动转换系列种子的流通股和所有相关的应计和未支付股息。根据转换而于首次公开招股完成时将发行的普通股股份数目将根据本公司于2019年7月1日修订及重订的公司注册证书(“COI”)所提供的原始转换条款计算。这一转换发生在2022年2月23日,也就是公司首次公开募股(IPO)结束时。
ONCONETIX,
Inc.
财务报表附注
附注
6-股东权益(续)
分红
系列种子的持有者
有权从发行之日开始的初始
投资额上按每股年利率8%的年复利获得累计股息。只有在董事会宣布或在清算事件(定义见下文)时支付股息。系列种子股票的股息优先于公司普通股的任何股息。截至2021年12月31日,累计股息总额为1,489,803美元,或每股系列种子股票1.30美元,在2022年IPO结束时,累计股息总额为1,586,162美元,或每股系列种子股票1.38美元,自动转换为普通股。
清算
优先
在发生某些自愿或非自愿收购或出售交易的情况下,或在公司清算、解散或清盘时(每个“清算事件”),系列种子公司的持有人有权从公司合法可供分配给其股东的收益或资产(“收益”)中获得收益,优先于将此类清算事件的收益分配给普通股持有人。根据
公司COI的规定确定的金额(“清算优先金额”)。COI规定,清算优先金额应在发生清算事件时计算
基于公司在临床前里程碑的实现情况和符合条件的融资(两者均在COI中定义)。
根据COI的规定,如果清算事件在临床前里程碑实现之前发生,清算优先金额将等于系列种子每股原始发行价的两倍,外加未支付的累计股息。如果在达到临床前里程碑之后发生清算事件,并且在完成合格融资后发生清算事件,则
清算优先金额将等于系列种子原始发行价的一倍,外加未支付的累计股息。如果
在达到临床前里程碑之后和合格融资完成之前发生清算事件,则
清算优先金额将等于(A)该持有人在合格融资后有权获得的每股金额或(B)系列种子原始发行价的两倍,外加未支付的累计股息。
截至2021年12月31日及之前所有其他历史时期,清算优先金额等于系列种子每股原始发行价的两倍,外加未支付的累计股息。如果收益不足以向系列种子的持有人就其持有的所有优先股全额分配清算优先金额,则所有的
收益将按比例分配给系列种子的持有人
。在完成对Series Seed持有人的分配后,可供分配给股东的所有剩余
收益将按转换后的
基准在普通股和优先股持有人之间进行分配,按每个该等持有人持有的普通股数量按比例分配。然而,如果在发生清算事件时,系列种子股东有权获得的清算优先金额是每股原始发行价的两倍,加上未支付的累积股息,则可供分配给股东的剩余收益将根据每个股东持有的普通股数量按比例分配给普通股持有人。
ONCONETIX,Inc.
财务报表附注
附注
6-股东权益(续)
投票
于
于本公司任何股东大会上提交本公司股东采取行动或考虑的任何事项(或经股东书面同意代替会议)时,每名持有Series Seed流通股的股东有权投下相等于该持有人所持Series Seed股份可转换为普通股的普通股整体股数的
投票数
截至决定有权就该事项投票的股东的记录日期。系列种子的持有者将作为一个类别与普通股持有者一起投票。系列种子股票的持有者有权提名公司五名董事中的两名。
股权激励计划
公司2019年7月1日,董事会和股东通过了《2019年股权激励计划》(简称《2019年计划》)。根据2019年计划,公司已预留1,400,000股普通股供发行。截至2022年12月31日及2021年12月31日止年度内,并无根据2019年计划授予以股份为本的奖励。
此外,本公司董事会于2022年2月23日,结合首次公开募股的结束,通过了本公司2022年股权激励计划(以下简称《2022年计划》),该计划是本公司2019年计划的后续和延续。根据2022年计划,公司可向公司员工、董事和顾问授予股票期权、限制性股票、限制性股票单位、股票增值权和其他形式的奖励。生效后,根据2022年计划,共预留1,600,000股普通股
供发行。2022年8月,根据2022年计划为发行预留的普通股数量增加到260万股。在截至2022年12月31日的年度内授予的股票期权均根据2022年计划授予。截至2022年12月31日,根据2022年计划,可供发行的期权有1,041,894个。
股票
期权
以下
汇总了截至2022年12月31日的年度中与2019年计划和2022年计划下的公司股票期权相关的活动:
| | |
| | |
| | |
| | |
加权 | |
| | |
| | |
| | |
| | |
平均值 | |
| | |
| | |
加权 | | |
| | |
剩余 | |
| | |
| | |
平均值 | | |
总计 | | |
合同 | |
| | |
数量 | | |
锻炼 | | |
固有的 | | |
生命 | |
| | |
股票 | | |
价格 | | |
价值 | | |
(单位:年) | |
| 截至2021年12月31日的未偿还债务 | |
| 780,640 | | |
$ | 0.01 | | |
$ | 532,787 | | |
| 8.1 | |
| 授与 | |
| 797,223 | | |
| 5.92 | | |
| — | | |
| — | |
| 被没收/取消 | |
| (19,757 | ) | |
| 6.45 | | |
| — | | |
| — | |
| 已锻炼 | |
| (165,452 | ) | |
| 0.01 | | |
| 573,465 | | |
| — | |
| 截至2022年12月31日的未偿还债务 | |
| 1,392,654 | | |
$ | 3.30 | | |
$ | 670,161 | | |
| 8.2 | |
| 截至2022年12月31日已授予并可行使的期权 | |
| 933,888 | | |
$ | 2.99 | | |
$ | 534,006 | | |
| 8.0 | |
ONCONETIX,Inc.
财务报表附注
附注
6-股东权益(续)
2022年授予的期权的公允价值是根据以下假设估算的:
| |
|
这一年的
截至12月31日, |
|
| |
|
2022 |
|
| 行权价格 |
|
$1.06 –
6.45 |
|
| 期限(年) |
|
5.00 – 10.00 |
|
| 预期股价波动 |
|
112.6% – 121.2% |
|
| 无风险利率 |
|
2.9% – 4.3% |
|
在截至2022年12月31日的年度内授予的股票期权的加权平均授予日公允价值为3.40美元。截至2022年12月31日和2021年12月31日止年度内,归属的股票期权公允价值合计分别约为210万美元和10万美元。
在截至2022年12月31日的年度内,授予公司首席执行官(CEO)、董事长和主要股东的股票期权总额为200,000份股票期权,授予公司首席业务官(CBO)的股票期权为200,000份,授予公司首席财务官(CFO)的股票期权为100,000份。
授予CEO、CBO和CFO的股票期权截至授予日的总公允价值约为180万美元。其中约150万美元在截至2022年12月31日的年度内确认为基于股票的薪酬支出。此外,在截至2022年12月31日的年度内,本公司共向非执行董事授予72,223份购股权。授予非执行董事的股票期权于授出日期的公允价值约为20万美元,其中约20万美元在截至2022年12月31日的年度内确认为基于股票的薪酬支出。
在截至2022年12月31日的年度内,公司董事会批准加速将总计32,517份股票期权
授予一名前董事和一名前顾问,与他们从本公司分离有关。在截至2022年12月31日的一年中,该公司确认了与这些修改相关的基于股票的
薪酬支出约10万美元。
ONCONETIX,Inc.
财务报表附注
附注
6-股东权益(续)
基于股票的薪酬
截至2022年12月31日和2021年12月31日的年度基于股票的薪酬支出如下:
| | |
截至12月31日止年度, | |
| | |
2022 | | |
2021 | |
| 一般和行政 | |
$ | 1,309,687 | | |
$ | 41,061 | |
| 研发 | |
| 664,879 | | |
| 89,080 | |
| 总计 | |
$ | 1,974,566 | | |
$ | 130,141 | |
截至2022年12月31日,与已发行股票期权相关的未确认股票薪酬支出约为70万美元,
预计将在1.89年的加权平均期间内确认。
附注
7--承付款和或有事项
写字楼租赁
从2018年开始,该公司以每月约5,500美元的价格向关联方租赁办公空间。该公司被要求支付15,000美元的租金押金。本公司于2021年5月终止关联方租赁。截至
2022年和2021年12月31日止年度,与本租赁有关的租金开支分别约为0美元和26,000美元。本公司于2021年4月在俄亥俄州辛辛那提与一名非关联方签订了按月租约,每月支付约500美元。
该公司与一名非关联方在佛罗里达州棕榈滩签订了一份短期租约,租期为2022年5月1日,每月租金约为14,000美元。租赁期至2023年4月30日,由公司首席执行官亲自担保。在截至2022年12月31日的年度内,本公司为此租赁产生的租金费用约为129,000美元,可变租赁费用约为12,000美元。
诉讼
公司可能会不时受到各种法律程序和在其正常业务活动过程中产生的索赔的影响。
截至2022年12月31日,公司不是任何重大法律程序的一方,也不知道有任何未决或威胁的索赔。
2022年4月15日,公司收到了Boustead的要求函(“要求函”)。该要求函指称,该公司违反了Boustead与本公司于2022年2月17日就本公司首次公开招股订立的承销协议。要求函指,本公司于4月的私募中委任Wainwright为配售代理,违反了Boustead根据包销协议授予的作为配售代理的优先购买权(“ROFR”),并因在4月的私募中出售证券,违反了承销协议项下本公司于2023年2月17日前不得提供、出售、发行、同意或订立合约出售、发行或授出或修改任何证券出售选择权的责任(“停顿”)。
ONCONETIX,
Inc.
财务报表附注
附注
7--承付款和或有事项(续)
于2022年10月9日,本公司与Boustead订立和解协议及豁免(“和解协议”),据此Boustead同意放弃ROFR及停顿,并免除本公司与四月私募、八月私募及本公司未来所有私募、公开股权或债券发售有关的若干债权。作为放弃及终止承销协议的代价,本公司向Boustead支付1,000,000美元现金费用、50,000美元法律费用
并免除Boustead的所有索赔,但某些例外情况除外。此外,本公司向Boustead发行93,466股限制性普通股,以换取注销与IPO相关而向Boustead发行的111,111份认股权证(见附注6)。在签署和解协议的同时,本公司与Boustead Capital Markets,LLP(“Boustead Capital”)签订了一份为期三个月的咨询协议(“咨询协议”),在咨询协议签署时,向Boustead Capital发行了相当于200,000股不含归属条款的受限制普通股的代价。与这些协议相关而发行的受限普通股的公允价值合计约为264,000美元。请参阅注释6。
本公司认定,本公司根据和解协议及咨询协议应付的所有代价与清偿一项于2022年产生的负债有关,因此,于截至2022年12月31日的
年度入账约130万美元的相关开支,并在随附的经营报表中计入一般及行政开支。
注册
权利协议
参见
注6,公募股权的私人投资.
重要的
协议
牛津大学创新有限公司
根据《OUI协议》,如附注5所披露,本公司有责任在未来支付某些里程碑和特许权使用费,因为发生了相关的或有事件。具体地说,公司有义务为授权产品的所有净销售额支付6%的版税,
根据OUI协议的定义,从产品发布后开始每年最低支付250,000美元的版税,直到OUI协议到期或撤销涉及授权产品的最后一个有效索赔为止,此时将适用3%的版税费率。
第三阶段前一年和第三阶段的年度维护费分别为10,000美元和20,000美元,根据OUI协议的定义
。本公司还有义务为本公司从
任何分许可人处收到的任何款项支付25%的使用费(包括本公司从本公司就许可技术授予的任何分许可或其他
合同中收到的所有预付款、里程碑和其他一次性付款)。此外,该公司还需要支付OUI里程碑付款,总额高达5,125万美元;具体而言,在实现指定的开发里程碑约225万美元、监管里程碑约950万美元和商业里程碑约3950万美元时支付。年度维护费和里程碑费用将与RPI(英国国家统计局发布的所有项目的零售价格指数或其任何替代项)挂钩,并将根据《OUI协议》中的规定适当增加或减少。截至2022年12月31日,本公司评估了公司实现指定里程碑并实现产品销售的可能性,并确定可能性尚不大,因此,截至2022年12月31日不需要应计这些付款。
ONCONETIX,Inc.
财务报表附注
附注
7--承付款和或有事项(续)
牛津大学研究协议
根据附注5所披露的OUI协议的条款,本公司于2019年12月18日与牛津大学就与OUI协议相关的研究订立赞助研究协议,为期三年,总额为420,000 GB。公司于2020年1月向牛津大学预付了554,802美元的全部服务费,截至2022年12月31日和2021年12月31日,分别保留了约10万美元和20万美元的预付费用。2022年5月16日,本公司对《牛津大学研究协议》进行了修订,将《牛津大学研究协议》延长至2024年6月30日,并有权再延长12个月,费用为53,500 GB(约56,000美元)。
于截至2022年及2021年12月31日止年度内,本公司与牛津大学的赞助研究协议有关的研发开支分别约为51,000美元及185,000美元。
圣犹大儿童医院
根据附注5所披露的圣裘德协议,本公司有责任于日后于相关或有事件发生时支付若干里程碑及特许权使用费。2022年5月11日,本公司对圣裘德协议进行了修订,修订了特许权使用费条款、里程碑付款和许可费。具体地说,根据经修订的《圣犹大协议》条款,本公司有责任根据《圣犹大协议》有效期内的净销售额,为本公司或其联属公司销售的每件特许产品(S)支付5%的特许权使用费,并就任何再许可支付已收到代价的15%。公司
还需要额外支付5,000美元的一次性许可费和10,000美元的年度维护费,从生效日期的一周年起
(如果计划在年费到期之前完成的所有开发里程碑都已实现
),则可以免除这笔费用)。此外,公司还需要向圣裘德里程碑支付总计190万美元;具体地说,
在实现指定的开发里程碑30万美元、监管里程碑60万美元和商业里程碑
100万美元后支付。截至2022年12月31日,本公司评估了公司实现指定里程碑和实现产品销售的可能性,并确定可能性尚不大,因此,截至2022年12月31日,不需要应计这些付款。
圣犹大儿童赞助研究协议
除《圣犹大协议》外,本公司还于2021年5月3日与圣犹大就与《圣犹大协议》(“圣犹大协议”)相关的研究
订立了赞助研究协议。根据圣裘德SRA,公司有义务分两部分向圣裘德支付总计73,073美元,第一阶段为57,624美元,第二阶段为15,449美元。这个受赞助的研究项目
始于2021年。
公司于2022年8月29日与圣犹大签订了第二份赞助研究协议,根据该协议,公司有义务在协议生效之日起30天内向圣犹大支付75,603美元。
于截至2022年及2021年12月31日止年度内,本公司与圣犹大的赞助研究协议有关的研发开支分别约为27,000美元及65,000美元。
辛辛那提儿童医院医疗中心
Pursuant
to the CHMC Agreement, as disclosed in Note 5, the Company is obligated to pay certain milestone and royalty payments in the future,
as the related contingent events occur. Specifically, the Company is obligated to pay CHMC a single-digit royalty on net sales, being
5%, 4% or 2% depending on the product, until the last valid claim covering a licensed product exists, at which point the royalty rates
decrease by 50%. The Company is also obligated
to pay up to a 25% royalty on any non-royalty sublicense revenue paid to the Company by any sublicensee. The CHMC Agreement also provides
the Company with an option to license any CHMC or jointly patented modification, alteration or improvement of any invention claimed in
a Licensed Patent (“CHMC Improvement” and “Joint Improvement, respectively”), with a $50,000 option fee for each
Improvement that the Company elects to include in the license grant of the CHMC Agreement. In addition, the Company is required to pay
CHMC milestone payments of up to an aggregate of $59.75 million; specifically, upon the achievement of specified development milestones
of approximately $0.5 million, regulatory milestones of approximately $1.25 million, and commercial milestones of approximately $58 million.
As of December 31, 2022, the Company evaluated the likelihood of the Company achieving the specified milestones and generating product
sales, and determined the likelihood is not yet probable and as such, no accrual of these payments is required as of December 31, 2022.
ONCONETIX,Inc.
财务报表附注
附注
7--承付款和或有事项(续)
CHMC
赞助研究协议
除CHMC协议外,本公司还与CHMC就与CHMC协议相关的研究
订立了日期为2022年6月30日的赞助研究协议(“CHMC SRA”)。根据本研究协议,公司有义务向CHMC
支付总额不超过247,705美元的款项。CHMC SRA的有效期为一年,为方便起见,任何
方可提前60天书面通知撤销。此外,如果另一方(a)根据《破产法》(除其他事项外)向
另一方提出申请或已向
另一方提出申请,或(b)未能履行或以其他方式违反其在本协议项下的义务,
且未能在收到重大违约通知后30天内纠正此类违约行为,则任何一方均可终止CHMC SRA。
于
截至2022年12月31日止年度,本公司产生相关研发开支约111,000元,
计入2022年12月31日的应计开支。截至二零二一年十二月三十一日止年度并无产生该等开支。
生物服务公司(后来被National Resilience,Inc.收购)
参见
注释5。
圣安东尼奥的德克萨斯大学健康科学中心
根据UT Health协议(如附注5所披露),本公司有责任于未来发生相关或然事件时支付若干里程碑及特许权使用费。具体而言,公司有义务根据净销售额向UT支付一位数的特许权使用费,即5%
或3%,具体取决于产品是否包含在有效索赔中,如协议中所定义。本公司还有义务
支付本公司从任何转被许可人处收到的任何款项的20%的特许权使用费。此外,公司还需要向UT Health
支付总计约220万美元的里程碑付款;特别是在实现约70万美元的指定开发里程碑
和约150万美元的监管里程碑后。截至2022年12月31日,本公司评估了
本公司实现指定里程碑和产生产品销售的可能性,并确定该可能性尚不
可能,因此,截至2022年12月31日,无需计提这些付款。
承销商
终止协议
于
2022年2月7日,本公司与其前承销商Maxim Group(“Maxim”)订立终止协议,
双方同意终止聘用Maxim担任本公司与
本公司首次公开招股有关的主承销商及账簿管理人。根据终止协议的条款,该公司同意向Maxim支付300,000美元的终止费,
在该公司IPO结束后到期。终止费用记录为一般及行政开支,并于截至2022年12月31日止年度支付。
赔偿
在
正常业务过程中,公司签订包含各种陈述和保证的合同和协议,
并提供一般赔偿。该公司在这些协议下的风险是未知的,因为它涉及
可能在未来对该公司提出但尚未提出的索赔。迄今为止,公司尚未支付任何索赔或被要求
为任何与其赔偿义务相关的诉讼进行辩护。但是,公司可能会因
这些赔偿义务而在未来产生费用。
风险
和不确定性- COVID-19
管理层
继续评估COVID-19大流行对行业的影响,并得出结论,虽然
病毒可能对公司的财务状况、运营结果和/或候选药物的搜索产生负面影响,但
截至这些财务报表日期,具体影响尚不容易确定。财务报表不包括
因这种不确定性的结果而可能产生的任何调整。
ONCONETIX,Inc.
财务报表附注
附注
8 -关联方交易
公司最初根据2018年10月22日开始的咨询协议聘请了首席执行官,他也是董事会主席,在IPO结束前,他是
公司的唯一普通股股东,该协议要求公司支付每月执行的咨询服务费用。在公司IPO结束后,咨询协议终止,首席执行官的
雇佣协议生效。截至2022年及2021年12月31日止年度,本公司根据咨询协议分别产生约63,000美元及435,000美元的费用,该等费用于随附的经营报表中确认为一般及行政开支。
在
2022年,公司签订了一份由公司首席执行官亲自担保的租赁协议。见附注7。
公司还通过共同所有权从关联方租赁办公空间。该租赁在这些财务
报表的附注7中作了进一步说明。租赁已于二零二一年五月终止,相关按金已重新分类至应收关联方结余。
于2021年第四季度,应收该关联方的款项被确定为无法收回并已撇销。
注销总额约为22 000美元,涉及租赁押金、多付租金和水电费,
在所附业务报表中确认为一般和行政费用。
在截至2022年12月31日的
年度内,公司薪酬委员会批准分别向公司首席执行官和CBO发放140,000美元和100,000美元的一次性奖金,以表彰他们在公司IPO方面的努力。该等花红
于截至2022年12月31日止年度确认为随附经营报表中的一般及行政开支。
截至2021年12月31日止年度,公司董事会批准向首席执行官发放约200,000美元的奖金,
该奖金也在运营报表中的一般和行政费用中确认。此外,在截至2022年12月31日止年度,公司薪酬委员会批准了根据公司2022年股权激励计划向公司某些执行官授予的股票期权。见附注6。
于
2022年及2021年12月31日,本公司应收关联方款项分别约为36,000元及153,000元。截至2022年12月31日的
余额包括公司代表公司首席执行官支付的杂项付款。
于2022年12月31日后,首席执行官向本公司支付应收款项结余。截至2021年12月31日的余额主要包括向公司首席执行官预付的咨询费,金额为140,000美元。该等顾问费预付款项已于二零二二年五月偿还予本公司,以代替应付首席执行官的花红。截至2021年12月31日的余额包括公司代表首席执行官支付的杂项付款。
本公司的一位
前董事目前在本公司的科学顾问委员会任职,并在隶属于CHMC的
辛辛那提儿童医院医疗中心创新基金的顾问委员会任职。如附注5所披露,本公司与CHMC订立独家
许可协议。该董事在IPO结束后辞去了公司董事会的职务。
附注
9--所得税
本公司的主要税务管辖区是
美国和各州管辖区,本公司没有任何待审的税务审计。一般而言,公司从2019年起的联邦
申报表和从2018年起的州申报表须接受美国和州税务机关的审查;但是,
在法律允许的范围内,税务机关有能力调整公司所有年度未使用净营业亏损
和研发抵免的结转。
于2022年12月31日,本公司就联邦及州所得税目的而结转的经营亏损净额(“NOL”)分别约为1,250万美元及1,210万美元,可用于减少未来应课税收入。850万美元的联邦NOL和某些州NOL无限期结转,但以应纳税收入的80%为限。如果不使用,约370万美元的州NOL将于2024年开始到期。
NOL结转须接受国内税收署和州税务机关的审查和
可能的调整。根据《国内税收法》(“IRC”)第382和383节,根据所有权的累积变化,公司每年使用净经营亏损结转和研究信贷结转分别抵消应纳税收入和税款可能受到限制。公司尚未完成分析,以确定截至2022年12月31日是否已触发任何此类限制。年度限额的金额(如有)将根据所有权变更前公司的价值确定。随后的所有权变更可能会进一步影响未来几年的限制
。
ONCONETIX,Inc.
财务报表附注
注
9-所得税(续)
产生递延税项资产的暂时性差异和结转的
税务影响包括以下内容:
| | |
截至12月31日, | |
| | |
2022 | | |
2021 | |
| 递延税项资产: | |
| | |
| |
| 净营业亏损结转 | |
$ | 2,986,738 | | |
$ | 1,120,155 | |
| 资本化研究与开发 | |
| 885,176 | | |
| — | |
| 基于股票的薪酬 | |
| 308,552 | | |
| 106,171 | |
| 应计补偿 | |
| 186,573 | | |
| 55,500 | |
| 许可协议 | |
| 82,626 | | |
| 59,685 | |
| 其他应计费用 | |
| 65,886 | | |
| 14,636 | |
| 递延税项总资产 | |
| 4,515,551 | | |
| 1,356,147 | |
| 估值免税额 | |
| (4,512,546 | ) | |
| (1,353,673 | ) |
| 递延税项资产,扣除准备后的净额 | |
$ | 3,005 | | |
$ | 2,474 | |
| 递延税项负债: | |
| | | |
| | |
| 固定资产 | |
| (3,005 | ) | |
| (2,474 | ) |
| 递延税项负债总额 | |
$ | (3,005 | ) | |
$ | (2,474 | ) |
| 递延税项净资产 | |
$ | — | | |
$ | — | |
本公司已评估影响其递延税项资产可变现性的正面及负面证据。根据本公司自成立以来的经营亏损历史,本公司
得出结论,其递延所得税资产的利益很可能无法实现。因此,本公司
已于2022年及2021年12月31日就递延税项资产计提全额估值拨备。截至2022年12月31日止年度,
估值备抵增加约320万美元。
应缴纳所得税的收益的所得税拨备与2022年12月31日和2021年12月31日的法定联邦税率不同,
原因如下:
| | |
在过去几年里
十二月三十一日, | |
| | |
2022 | | |
2021 | |
| 按联邦法定税率计算的预期所得税优惠 | |
$ | (2,818,164 | ) | |
$ | (717,640 | ) |
| 州税和地方税,扣除联邦税收优惠 | |
| (501,277 | ) | |
| (91,233 | ) |
| 研究学分 | |
| (16,477 | ) | |
| — | |
| 永久性物品 | |
| 194,705 | | |
| 9,501 | |
| 国家费率调整 | |
| 19,600 | | |
| 119,414 | |
| 其他 | |
| (37,260 | ) | |
| 4,228 | |
| 更改估值免税额 | |
| 3,158,873 | | |
| 675,730 | |
| 所得税拨备 | |
$ | — | | |
$ | — | |
根据美国公认会计原则,不确定的收入
纳税状况对所得税申报表的影响必须以相关税务机关审计后更有可能持续的最大金额确认
。如果不确定的所得税状况持续的可能性低于50%,则不会被确认。此外,美国公认会计准则提供了关于终止确认、分类、利息和处罚的指导,并对中期、披露和过渡进行了核算。
未确认的税收优惠的期初和期末金额
对账如下:
| | |
在过去几年里
12月31日, | |
| | |
2022 | | |
2021 | |
| 期初余额 | |
$ | - | | |
$ | - | |
| 与上一年税收状况有关的增加 | |
| 11,517 | | |
| - | |
| 与本年度税收状况有关的增加 | |
| 5,493 | | |
| - | |
| 期末余额 | |
$ | 17,010 | | |
$ | - | |
截至2022年12月31日和2021年12月31日,公司未确认的税收优惠分别为17,010美元和0美元。由于估值免税额的存在,公司未确认的税收优惠未来的变化不会影响实际税率。本公司预计其未确认的税收优惠在未来12个月内不会发生重大变化
。
本公司的政策是确认与所得税支出中不确定的税收状况相关的利息和罚款。截至2022年12月31日和2021年12月31日,没有应计利息
和与不确定的税收状况相关的罚款。
ONCONETIX,Inc.
财务报表附注
附注
10-退休计划
自2022年1月1日起,本公司根据《国内税法》第401(K)节(“401(K)计划”)通过了一项固定缴款储蓄计划。401(K)计划是为了所有符合条件的员工的利益,并允许员工自愿缴费,最高可达合格薪酬的100%,但受美国国税局施加的最高限制。401(K)
计划的条款允许雇主酌情缴费。截至2022年12月31日止年度内,并无与401(K)计划有关的开支,而401(K)计划于2022年因不活动而失效。
注
11-后续事件
于2023年1月期间,合共行使了646,640份与八月私人配售有关的预筹资权证,行使价为每股0.001美元,而本公司亦据此发行了646,640股普通股。
2023年1月26日,公司董事会任命新的董事,接替于2023年1月13日辞去董事会职务的董事。新的董事获得了2386份股票期权,行权价为1.28美元。此外,公司
董事会批准加快向原董事授予总计11,504份股票期权。
2023年2月1日,本公司与AbVacc,Inc.(“AbVacc”)签订了一项共同开发协议,目的是进行
共同开发特定候选疫苗的研究,包括猴痘和马尔堡病毒病,有可能
使用诺如病毒纳米颗粒平台扩展到其他候选疫苗(“共同开发项目”),并管理共同开发项目的材料和信息共享
。根据协议,AbVacc和公司将通过联合开发委员会
合作,为每个共同开发项目
目标产品制定和实施开发计划或工作说明书。根据共同开发协议,本公司或AbVacc,无论哪一方是任何最终产品(如协议所定义)的主赞助商,将有义务赔偿另一方某些里程碑式的付款,范围为
210万至475万美元,外加2%至4%的特许权使用费。本协议的有效期为自生效之日起三年,除非事先由任何一方根据协议终止。
Proteomedex AG
简明资产负债表
(未经审计)
| | |
9月30日, | | |
十二月三十一日, | |
| 资产 | |
2023 | | |
2022 | |
| 流动资产 | |
| | |
| |
| 现金和现金等价物 | |
$ | 1,037,425 | | |
$ | 470,156 | |
| 应收账款 | |
| 116,374 | | |
| 236,683 | |
| 库存 | |
| 83,183 | | |
| 95,810 | |
| 预付费用和其他流动资产 | |
| 7,304 | | |
| 26,280 | |
| 流动资产总额 | |
| 1,244,286 | | |
| 828,929 | |
| | |
| | | |
| | |
| 财产和设备 | |
| 39,163 | | |
| 40,130 | |
| 使用权资产 | |
| 140,588 | | |
| 202,739 | |
| 总资产 | |
$ | 1,424,037 | | |
$ | 1,071,798 | |
| | |
| | | |
| | |
| 负债与企业的赤字 | |
| | | |
| | |
| 流动负债 | |
| | | |
| | |
| 可转换应付票据 | |
$ | 5,704,371 | | |
$ | 4,241,942 | |
| 应计费用 | |
| 230,329 | | |
| 510,578 | |
| 租赁负债,流动 | |
| 62,464 | | |
| 67,546 | |
| 流动负债总额 | |
| 5,997,164 | | |
| 4,820,066 | |
| | |
| | | |
| | |
| 非流动负债 | |
| | | |
| | |
| 可转换应付票据 | |
| - | | |
| 1,406,289 | |
| 应付票据 | |
| 109,251 | | |
| 108,176 | |
| 养老金福利义务 | |
| 546,259 | | |
| 393,640 | |
| 经营租赁负债 | |
| 78,124 | | |
| 135,193 | |
| 总负债 | |
| 6,730,798 | | |
| 6,863,364 | |
| | |
| | | |
| | |
| 股东亏损额 | |
| | | |
| | |
| 普通股面值1瑞士法郎,授权466,555股,于2023年9月30日和2022年12月31日发行 | |
| 466,555 | | |
| 466,555 | |
| 追加实收资本 | |
| 20,539,478 | | |
| 20,377,905 | |
| 累计综合收益 | |
| 610,627 | | |
| 606,583 | |
| 累计赤字 | |
| (26,923,421 | ) | |
| (27,242,609 | ) |
| 股东总亏损额 | |
| (5,306,761 | ) | |
| (5,791,566 | ) |
| | |
| | | |
| | |
| 总负债和股东赤字 | |
$ | 1,424,037 | | |
$ | 1,071,798 | |
附注是这些简明财务报表的组成部分。
Proteomedex AG
简明全面收益(损益)表
截至2023年和2022年9月30日的9个月
(未经审计)
| | |
2023 | | |
2022 | |
| | |
| | |
| |
| 收入 | |
$ | 2,092,761 | | |
$ | 128,773 | |
| | |
| | | |
| | |
| 销货成本 | |
| 22,548 | | |
| 28,176 | |
| | |
| | | |
| | |
| 毛利 | |
| 2,070,213 | | |
| 100,597 | |
| | |
| | | |
| | |
| 运营费用 | |
| | | |
| | |
| 市场营销和业务发展 | |
| 151,478 | | |
| 172,478 | |
| 研发 | |
| 275,020 | | |
| 262,818 | |
| 一般和行政费用 | |
| 1,240,875 | | |
| 1,633,860 | |
| 折旧 | |
| 9,293 | | |
| 12,966 | |
| 总运营费用 | |
| 1,676,666 | | |
| 2,082,122 | |
| | |
| | | |
| | |
| 营业收入(亏损) | |
| 393,547 | | |
| (1,981,525 | ) |
| | |
| | | |
| | |
| 其他收入(费用) | |
| | | |
| | |
| 利息支出 | |
| (74,359 | ) | |
| (48,257 | ) |
| | |
| | | |
| | |
| 其他收入(费用)合计 | |
| (74,359 | ) | |
| (48,257 | ) |
| | |
| | | |
| | |
| 扣除所得税准备前的净收益(亏损) | |
| 319,188 | | |
| (2,029,782 | ) |
| | |
| | | |
| | |
| 所得税拨备 | |
| - | | |
| - | |
| | |
| | | |
| | |
| 净收益(亏损) | |
| 319,188 | | |
| (2,029,782 | ) |
| | |
| | | |
| | |
| 其他全面收益(亏损) | |
| | | |
| | |
| | |
| | | |
| | |
| 外币折算调整 | |
| 172,351 | | |
| 344,957 | |
| 养恤金福利义务的变化 | |
| (168,307 | ) | |
| 369,287 | |
| | |
| | | |
| | |
| 其他全面收益(亏损)合计 | |
| 4,044 | | |
| 714,244 | |
| | |
| | | |
| | |
| 综合收益(亏损) | |
$ | 323,232 | | |
$ | (1,315,538 | ) |
附注是这些简明财务报表的组成部分。
Proteomedex AG
股东亏损简明报表
截至2023年和2022年9月30日的9个月
(未经审计)
| | |
普通股 | | |
额外缴入的
| | |
累计
全面
(亏损) | | |
累计 | | |
总计
股东的 | |
| | |
股票 | | |
面值 | | |
资本 | | |
收入 | | |
赤字 | | |
赤字 | |
| | |
| | |
| | |
| | |
| | |
| | |
| |
| 2021年12月31日的余额 | |
| 412,572 | | |
$ | 466,555 | | |
$ | 20,000,916 | | |
$ | 431,677 | | |
$ | (25,200,036 | ) | |
$ | (4,300,888 | ) |
| | |
| | | |
| | | |
| | | |
| | | |
| | | |
| | |
| 外汇平移调整 | |
| - | | |
| - | | |
| - | | |
| 344,957 | | |
| - | | |
| 344,957 | |
| | |
| | | |
| | | |
| | | |
| | | |
| | | |
| | |
| 基于股票的薪酬 | |
| - | | |
| - | | |
| 282,742 | | |
| - | | |
| - | | |
| 282,742 | |
| | |
| | | |
| | | |
| | | |
| | | |
| | | |
| | |
| 养恤金福利义务的变化 | |
| - | | |
| - | | |
| - | | |
| 369,287 | | |
| - | | |
| 369,287 | |
| | |
| | | |
| | | |
| | | |
| | | |
| | | |
| | |
| 净亏损 | |
| - | | |
| - | | |
| - | | |
| - | | |
| (2,029,782 | ) | |
| (2,029,782 | ) |
| | |
| | | |
| | | |
| | | |
| | | |
| | | |
| | |
| 2022年9月30日的余额 | |
| 412,572 | | |
$ | 466,555 | | |
$ | 20,283,658 | | |
$ | 1,145,921 | | |
$ | (27,229,818 | ) | |
$ | (5,333,684 | ) |
| | |
| | | |
| | | |
| | | |
| | | |
| | | |
| | |
| 2022年12月31日的余额 | |
| 412,572 | | |
$ | 466,555 | | |
$ | 20,377,905 | | |
$ | 606,583 | | |
$ | (27,242,609 | ) | |
$ | (5,791,566 | ) |
| | |
| | | |
| | | |
| | | |
| | | |
| | | |
| | |
| 外汇平移调整 | |
| - | | |
| - | | |
| - | | |
| 172,351 | | |
| - | | |
| 172,351 | |
| | |
| | | |
| | | |
| | | |
| | | |
| | | |
| | |
| 基于股票的薪酬 | |
| - | | |
| - | | |
| 161,573 | | |
| - | | |
| - | | |
| 161,573 | |
| | |
| | | |
| | | |
| | | |
| | | |
| | | |
| | |
| 养恤金福利义务的变化 | |
| - | | |
| - | | |
| - | | |
| (168,307 | ) | |
| - | | |
| (168,307 | ) |
| | |
| | | |
| | | |
| | | |
| | | |
| | | |
| | |
| 净收入 | |
| - | | |
| - | | |
| - | | |
| - | | |
| 319,188 | | |
| 319,188 | |
| | |
| | | |
| | | |
| | | |
| | | |
| | | |
| | |
| 2023年9月30日的余额 | |
| 412,572 | | |
$ | 466,555 | | |
$ | 20,539,478 | | |
$ | 610,627 | | |
$ | (26,923,421 | ) | |
$ | (5,306,761 | ) |
随附附注为该等简明财务报表之组成部分。
Proteomedex AG
现金流量表简明表
截至2023年和2022年9月30日的9个月
(未经审计)
| | |
2023 | | |
2022 | |
| 经营活动 | |
| | |
| |
| 净收益(亏损) | |
$ | 319,188 | | |
$ | (2,029,782 | ) |
| 对净亏损与经营活动中使用的现金净额进行的调整: | |
| | | |
| | |
| 折旧及摊销 | |
| 9,293 | | |
| 12,966 | |
| 基于股票的薪酬 | |
| 161,573 | | |
| 282,742 | |
| 养恤金福利义务的变化 | |
| (15,688 | ) | |
| 47,042 | |
| 经营性资产和负债变动情况: | |
| | | |
| | |
| 应收账款 | |
| 120,309 | | |
| 46,462 | |
| 库存 | |
| 12,627 | | |
| 10,177 | |
| 预付费用和其他流动资产 | |
| 18,976 | | |
| 63,107 | |
| 应计费用 | |
| (280,249 | ) | |
| 89,382 | |
| 经营活动提供的现金(用于) | |
| 346,029 | | |
| (1,477,904 | ) |
| | |
| | | |
| | |
| 投资活动: | |
| | | |
| | |
| | |
| - | | |
| - | |
| 用于投资活动的现金 | |
| - | | |
| - | |
| | |
| | | |
| | |
| 融资活动: | |
| | | |
| | |
| 应付票据的偿还 | |
| - | | |
| (50,000 | ) |
| 用于融资活动的现金 | |
| - | | |
| (50,000 | ) |
| | |
| | | |
| | |
| 外汇对现金的影响 | |
| 221,240 | | |
| (91,064 | ) |
| | |
| | | |
| | |
| 现金和现金等价物净变化 | |
| 567,269 | | |
| (1,618,968 | ) |
| | |
| | | |
| | |
| 现金和现金等价物--年初 | |
| 470,156 | | |
| 2,546,801 | |
| | |
| | | |
| | |
| 现金和现金等价物--年终 | |
$ | 1,037,425 | | |
$ | 927,833 | |
| | |
| | | |
| | |
| 补充现金流量披露 | |
| | | |
| | |
| 支付的利息 | |
$ | - | | |
$ | 1,965 | |
| 已缴纳的所得税 | |
$ | - | | |
$ | - | |
附注是这些财务报表的组成部分。
Proteomedex AG
简明财务报表附注
附注1-业务的组织和性质
Proteomedex AG(“公司”)是一家医疗保健公司,其使命是改变前列腺癌的诊断。Proteomedex已经确定了在前列腺癌诊断、预后和治疗管理中具有实用价值的新生物标记物签名。主导产品Proclarix®是一种基于血液的前列腺癌测试小组和风险评分,目前在欧洲可用,预计不久将在美国推出。Proteomedex
位于瑞士苏黎世-施利耶伦生物技术园。
2023年12月15日,公司被Onconentix,Inc.(前身为Blue Water Biotech,Inc.)(“母公司”)收购。母公司发行普通股以换取公司100%的已发行有表决权股权。请参阅附注10。
注2-持续经营
随附的简明财务报表
是假设本公司将继续作为一家持续经营的企业编制的,其中包括在正常业务过程中变现资产和偿还负债。在截至2023年9月30日的9个月内,公司累计亏损约27,000,000美元,营运资金赤字约4,800,000美元,且缺乏盈利运营历史。
这些问题及其他事项令人对公司作为持续经营企业的持续经营能力产生极大怀疑。
虽然公司正试图创造更大的收入,但公司的现金状况可能不足以支持公司的日常运营。管理层打算从母公司筹集更多资金以维持运营,直到收入足以支持公司的运营
。管理层相信,目前为进一步实施其业务计划和创造收入而采取的行动为公司提供了作为持续经营的企业继续存在的机会。虽然公司相信其创造收入的战略的可行性,以及母公司提供额外资金的能力,但不能保证这一点。公司能否持续经营取决于公司是否有能力进一步执行其业务计划,并根据需要从母公司获得额外的
资金。
注3-重要会计政策摘要
陈述的基础
随附的公司简明财务报表
已根据美国公认会计原则(“美国公认会计原则”)和美国证券交易委员会(“美国证券交易委员会”)的中期报告规则编制,应与截至2022年12月31日和2021年12月31日的经审计财务报表及其附注一并阅读。管理层认为,包括正常经常性调整(除非另有说明)在内的所有调整都已反映在本报告中,这些调整是公平列报财务状况和中期业务成果所必需的。中期
期间的运营结果不一定代表全年的预期结果。
公司的本位币为瑞士法郎,公司的简明财务报表以美元列报。以外币计价的交易按交易当日的汇率折算为本位币。由此产生的换算调整作为累计其他全面收益(亏损)的单独组成部分入账。
细分市场
信息
运营部门定义为企业的组成部分,其独立的离散信息可供首席运营决策者(“CODM”)或决策小组在决定如何分配资源和评估业绩时进行评估。
本公司在一个部门运营,该部门与CODM为评估业绩、分配资源、设定激励性薪酬目标以及规划和预测未来期间而定期审查的财务信息保持一致。
Proteomedex AG
简明财务报表附注
注3-重要会计政策摘要(续)
预算的使用
根据美国公认会计原则编制简明财务报表要求管理层作出估计和假设,以影响在简明财务报表日期的资产和负债的报告金额、或有资产和负债的披露以及报告期内报告的费用金额。公司简明财务报表中最重要的估计涉及存货估值、基于股票的薪酬、养老金福利义务以及净营业亏损产生的递延税项资产的估值拨备
。该等估计及假设乃基于当前事实、历史经验及在当时情况下被认为合理的各种其他因素,其结果构成对资产及负债的账面值及其他来源不易察觉的开支作出判断的基础。实际
结果可能与这些估计值大不相同。如果估计与实际结果之间存在重大差异,公司未来的经营业绩将受到影响。
现金和现金等价物
为报告现金流,本公司将现金及现金等价物定义为所有银行现金及高流动性投资,可供目前使用,初始到期日为三个月或以下为现金等价物。截至2023年9月30日和2022年12月31日,公司没有现金等价物。
公司在瑞士金融市场监督管理局(“FINMA”)承保的金融机构维持其现金余额。
公司的现金余额有时可能超过FINMA提供的保险。本公司并无在该等
账户上出现任何亏损,管理层并不认为本公司有任何与超额存款有关的重大风险。
应收帐款
公司
定期对其客户的财务状况进行信用评估,并在无抵押的基础上向几乎所有客户提供信贷
。到目前为止,信贷损失一直不大,在管理层的预期之内。本公司根据对未清应收账款、历史收款信息、预期未来亏损和现有经济状况的审查,为坏账拨备。正常应收账款应在发票开具后30天内到期。应收账款
根据管理层对个人余额的评估被视为拖欠。拖欠应收账款根据个人信用评估和客户的具体情况进行评估。截至2023年9月30日和2022年12月31日,公司坏账准备分别为零。截至2023年9月30日及2022年9月30日止期间,本公司并无将任何应收账款从坏账准备中注销。截至2023年9月30日和2022年12月31日,基本上所有应收账款都是从单一客户那里到期的。
盘存
库存包括原材料和成品
。存货按成本或可变现净值中较低者列报,成本按先进先出原则确定。公司
定期审查库存构成,以确定过剩、陈旧、移动缓慢或无法销售的物品,同时考虑与手头数量相比的预期未来销售量,以及手头货物的剩余保质期。如果观察到不可销售的项目,并且库存没有替代用途,公司将在首次确认价值下降的
期间对可变现净值进行减记。截至2023年9月30日和2022年12月31日,公司没有库存储备。
Proteomedex AG
简明财务报表附注
注3-重要会计政策摘要(续)
长期资产减值
当事件或业务环境的变化显示
资产的账面价值可能无法完全收回时(“触发事件”),本公司即会审核长期资产的减值。本公司在决定何时进行减值审查时考虑的因素包括长期资产相对于预期表现严重欠佳、行业或经济趋势出现重大负面影响,以及资产用途发生重大变化或计划中的变化。如果进行减值审查以评估长期资产的可回收性,本公司将长期资产的使用和最终处置预期产生的未贴现现金流的预测与其账面价值进行比较。当预期因使用资产而产生的估计未贴现未来现金流量
少于其账面金额时,将确认减值亏损。减值亏损将基于减值资产的账面价值超过其公允价值的超额
,这是根据贴现现金流量确定的。于截至2023年、2023年及2022年9月30日止期间,本公司并无确认任何与其长期资产相关的减值。
财产和设备
财产和设备包括计算机和办公家具及固定装置,所有这些都按成本入账。折旧按资产各自的使用年限(从两年到十年不等)采用直线法记录。只要事件或情况表明长期资产的账面价值可能无法收回,就会对这些资产进行减值审查。当财产和设备报废或以其他方式处置时,
相关成本和累计折旧计入运营。
研发成本
研发费用是指在发现、设计和开发新产品、流程或服务以及改进现有产品时发生的成本。
除非研发成本在未来有其他用途,否则研发成本按已发生的成本计入费用。这些成本包括但不限于直接用于研发活动的工资、工资、福利、材料、设备和管理费用。
合作协议
本公司定期与交易对手签订战略联盟协议,以生产产品和/或向客户提供服务。通过此类协议创建的联盟
不是法人实体,没有员工,没有资产,也没有真正的运营。这些安排创造了合同权利,公司通过在全面损失表中报告研发费用内的交易产生的成本和收到的报销,将这些联盟作为一种合作安排进行会计处理。
承付款和
或有
因索赔、评估、诉讼、罚款、罚款和其他来源引起的或有损失的负债
当管理层评估很可能已发生负债且金额可以合理估计时,记录或有损失。
基于份额的薪酬
公司
根据财务
会计准则委员会(“FASB”)会计准则汇编(“ASC”)第718号“报酬-股票
报酬”,对为从非雇员处接收商品或服务而发行的权益工具进行会计处理。成本按已收代价之估计公平值或已发行股本
工具之估计公平值计量,以较可靠计量者为准。为雇员
服务以外的对价而发行的权益工具的价值,根据ASC 718中
定义的货物或服务提供者的履约承诺或履约完成(以最早者为准)确定。
Proteomedex AG
简明财务报表附注
注3-重要会计政策摘要(续)
所得税
根据
ASC 740“所得税”,如果递延所得税资产的变现
可能性较大,则公司将确认递延所得税资产。递延所得税资产及负债乃就财务报表与资产及负债之税务基准之间之差异而计算,而该等差异将导致未来应课税或可扣税金额,并根据已颁布之税法及适用于预期影响应课税收入之期间之税率计算。评估备抵在必要时设立,以
将递延所得税资产减少至预期可实现的金额。所得税费用是指当期应付或应退还的税款加上或减去递延所得税资产和负债的当期变动。
此外,
公司管理层对在
准备公司所得税申报表的过程中采取或预期采取的所有不确定所得税状况进行评估,以确定所得税状况是否符合适用税务机关审查的“更有可能”
标准。出于联邦和州的目的,需要对所有
开放纳税年度(根据各种限制法规的定义)进行此评估。如果公司有利息或罚款
与支付的税款不足有关,则此类费用在所得税费用中报告。
收入确认
本公司在
商品或服务的控制权转移给客户时确认收入,金额反映了我们预期有权交换
这些服务的对价。ASC 606提供了五步模型,包括:
产品销售
公司通过直接向最终用户和分销商销售
产品获得收入。该公司将其产品销售给包括实验室、医院、医疗中心、医生和分销商在内的客户。公司将客户采购订单视为与客户签订的合同,在某些情况下,这些订单受主销售协议
或标准条款和条件的约束。对于每份合同,本公司将转让
产品的承诺视为已确定的履约义务,每一项产品都是不同的。在确定交易价格时,本公司评估
价格是否会受到退款或调整,以确定其预期有权获得的净对价。本公司
于产品转移至客户后即履行适用于产品销售的履约义务。
开发
服务
公司
向生命科学客户提供一系列称为“开发服务”的服务,包括生物标记物
发现测试、化验设计和开发。这些开发服务在个人名义下执行工作说明书(“SOW”)安排
具体交付成果由客户定义。开发服务通常以时间和材料为基础进行。在
履行期间以及根据SOW完成对客户的服务期间,我们有权按商定价格向客户
开具账单,并确认预计完成SOW期间的开发服务收入。我们通常将每个SOW
确定为单一履约义务。
服务的完成和SOW规定的履约义务的履行通常通过访问向客户提供的数据或测试或SOW中定义的任何其他形式或适用的交付方式来证明。但是,对于根据客户高度定制的规格执行工作的某些SOW,我们有权强制执行客户完成的工作,而不是在SOW完成时。对于这些母猪,我们根据花费的努力(投入)确认完成工作期间的收入
。由于SOW规定的履约义务已经履行,任何作为收入赚取并向客户开具账单的金额都将计入应收账款。截至简明财务报表日期,任何已赚取但尚未向客户开具帐单的收入均被记录为合同资产,并于简明财务报表日期计入预付款和其他流动资产。当客户
根据合同中的开票时间表开具发票时,合同资产中记录的金额将在我们的财务报表中重新分类为应收账款。
Proteomedex AG
简明财务报表附注
注3-重要会计政策摘要(续)
在SOW包含可变
对价部分的情况下,公司使用预期值法或最可能金额法来估计交易价格中应包含的可变对价金额,具体取决于哪种方法有望更好地预测公司有权获得的对价金额
。如果和
交易价格中包含可变对价的价值,则当与可变对价相关的不确定性
随后得到解决时,确认的累计收入很可能不会发生重大逆转。这些估计在每个报告期都会根据需要重新评估,
任何需要的调整都是以累积追赶为基础记录的,这将影响调整期间的收入和净收入。
许可收入
许可证收入是根据对许可证是否有别于可能包含在基础许可安排中的任何其他履行义务的评估来确定的。
如果客户能够从许可证中受益,而无需公司提供任何其他履行义务,并且许可证因此被视为独特的或功能性许可证,则公司将确定客户是否已获得使用许可证的权利或访问许可证的权利。对于不需要公司进一步进行实质性开发或其他持续活动的功能许可证,客户被视为在转让时以及在转让时获得使用许可证的权利,并且收入通常记录在某个时间点。对于仅与公司将提供的其他履约义务一起提供实质性价值的象征性许可,通常在许可协议期限内使用基于该许可的合同剩余时间的投入来记录收入。本公司提供的此类其他义务一般包括制成品、附加开发服务或合同约定在许可期内提供的其他可交付物。
与许可安排相关的特许权使用费在记录与商业许可方的供应协议下的销售时进行估计和确认,没有任何合同限制
或收款不确定性。版税取决于是否达到某些销售里程碑,将在很可能达到里程碑时进行记录。
下表按类型分列了截至2023年9月30日和2022年9月30日的公司收入。
| | |
识别
方法 | |
2023 | | |
2022 | |
| 产品销售 | |
时间点 | |
$ | 40,237 | | |
$ | 74,390 | |
| 许可收入 | |
时间点 | |
| 516,359 | | |
| - | |
| 开发服务 | |
随着时间的推移 | |
| 1,536,165 | | |
| 54,383 | |
| | |
| |
$ | 2,092,761 | | |
$ | 128,773 | |
金融工具
公司的
金融工具包括现金和现金等价物、应收账款和应付账款,并根据ASC主题825“金融工具”的规定进行核算。于简明财务报表中反映之该等金融工具之账面值与公平值相若。
公允价值计量
ASC主题
820“公允价值计量”要求某些金融工具在我们的资产负债表
日按公允价值确认。然而,其他金融工具(如债务责任)毋须按其公平值确认,惟美国财务报告准则第16号规定之公平值除外。
GAAP提供了选择这些工具的公允价值会计的选项。美国公认会计原则要求披露
所有金融工具的公允价值,无论它们在我们的资产负债表中是以公允价值还是账面价值确认。对于按公允价值确认的
金融工具,美国公认会计原则要求按工具类型披露其公允价值,以及
其他信息,包括在收入或其他综合收入中确认的某些金融工具的公允价值变动。
对于未按公允价值确认的金融工具,其公允价值的披露在下文“金融工具”项下提供。
非金融资产,如财产和设备,以及非金融负债在公司资产负债表中按账面价值确认。美国公认会计原则不允许非金融资产和负债按公允价值重新计量。但是,美国公认会计原则要求在发生某些事件(如不动产、厂房和设备的减值)时,按照公允价值重新计量此类资产和负债。此外,如果发生此类事件,美国公认会计原则要求披露资产或负债的公允价值以及其他信息,包括在重新计量发生期间在收入中确认的收益或损失。
蛋白质组学
AG
简明财务报表附注
注3-重要会计政策摘要(续)
本公司
于2023年9月30日及2022年12月31日并无任何资产或负债须于各报告期
重新计量。
可转换工具
本公司
根据ASC 815“衍生工具和套期保值
活动”对可转换工具中嵌入的转换期权进行评估和核算。
美国公认会计原则
要求公司将转换期权从其主工具中分离出来,并根据某些标准将其作为独立的衍生金融工具
进行核算。该标准包括以下情况:(a)嵌入式衍生工具的经济特征和风险与主合同的经济特征和风险没有明确和密切的关系,(b)
包含嵌入式衍生工具和主合同的混合工具不按
项下的公允价值重新计量其他公认会计原则与公允价值的变化报告在收益,因为他们发生和(c)一个单独的工具与相同的条款作为嵌入式
衍生工具将被视为衍生工具。
本公司
对可转换工具的会计处理如下:这些安排下的债务折扣在相关债务的期限内摊销,
直至其规定的赎回日期。这些可转换票据的收益在
现金流量表的融资部分报告。衍生工具负债的公允价值变动在随附的现金流量表中报告为调整,以调节净亏损与
经营活动所用的净现金。截至2023年9月30日止九个月,本公司并无
任何需要与主工具分开的转换期权。
已定义的
福利养老金计划
本公司赞助
一项涵盖合资格雇员的界定福利退休金计划(“计划”)。本计划根据雇员的
服务年期及薪酬水平提供退休福利。本公司在其资产负债表中确认该计划资金过剩状态的资产或资金不足状态的负债。此外,公司还将衡量其计划的资产和债务,以确定其截至年底的资金到位状态
,并在发生变化的年度确认资金到位状态的变化。该等变动于“累计其他全面亏损”中呈报。公司使用精算估值来确定其养老金和退休后福利
成本和信贷。计算的金额取决于各种关键假设,包括贴现率和计划
资产的预期回报。在选择该等假设时会考虑当前市况。
本公司的退休金计划通常
使用每股净资产值(NAV)作为实际权宜方法进行估值,以获得公允价值,前提是满足某些标准。资产净值
根据基金相关投资的公允价值确定。在不符合标准的情况下,公平
根据基金交易的基础市场(通常被视为活跃市场)确定。
最近发布的
会计准则
在截至2023年9月30日的
期间,以及随后,FASB发布了几项新的会计公告。这些
声明中的每一项(如适用)已经或将被公司采纳。管理层不认为采用任何这些会计公告
已经或将对公司的简明财务报表产生重大影响。
Proteomedex AG
简明财务报表附注
注3-重要会计政策摘要(续)
2016年6月,财务会计准则委员会发布了美国会计准则委员会第2016-13号《金融工具--信贷损失(主题326):金融工具信贷损失的计量》,其中要求本公司计量和确认所持金融资产和未按公允价值通过净收入计入的预期信贷损失。2018年11月、2019年4月和2019年5月,美国财务会计准则委员会发布了ASU第2018-19号《对第326号专题(金融工具--信贷损失)的编纂改进》、《ASU第2019-04号,对专题
326(金融工具--信贷损失)的编纂改进》、《专题815(衍生工具和套期保值)》和《ASU第2019-05号,金融工具--信贷损失(专题326):定向过渡救济》,为先前发布的ASU提供了额外的实施指导。ASU在2019年12月15日之后的财年对符合美国证券交易委员会申请者定义的公共业务实体有效,不包括符合美国证券交易委员会定义的SRC的实体。所有其他
实体,ASU编号2016-13在2022年12月15日之后的财年有效。本指引的采纳并未对本公司的简明财务报表造成实质影响。
后续事件
本公司已评估截至简明财务报表发布之日为止的所有交易,以供日后事项披露考虑。
见附注10。
附注4--债务
2010年3月3日,公司从Venture Kick获得了100,000瑞士法郎的贷款。这笔贷款没有利息,没有担保,公司可以酌情取消。
这笔贷款从属于公司的其他未附属债务。贷款仅用于业务发展,公司可自行决定将资金返还给Venture Kick,以使该组织能够继续努力。截至2023年9月30日和2022年12月31日,未偿还余额分别约为109,000美元和108,000美元。
2020年6月23日,公司向公司的一家金融机构和股东签订了一份可转换票据,年利率为0.50%,到期日期为2024年9月30日,票面利率为550,000瑞士法郎。在公司股权融资的情况下,票据为持有人提供了可选的转换功能
。在股权融资的情况下,转换价格为融资后股价的20%折扣。持有人亦有权在出售本公司时或票据到期时转换票据,而不会有任何折扣。这张票据在2023年1月10日之前一直是非从属债券,当时它也从属于所有其他非从属债务。
利率从2023年5月1日起改为2.50%。截至2023年9月30日和2022年12月31日,这张
票据的未偿还余额分别约为601,000美元和541,000美元。
2020年6月23日,公司与公司某些股东签订了一系列
应付可转换票据,年利率为0.50%,到期日为2024年9月30日,金额为800,000瑞士法郎。在股权融资超过1,000,000瑞士法郎的情况下,该票据为持有人提供了可选的转换功能。在股权融资的情况下,转换价格为融资后股价的20%折扣。持有人
也有权在公司出售时或票据到期时转换票据,而不会有折扣。
这些应付票据从属于本公司的其他非次级债务。截至2023年9月30日和2022年12月31日,这些票据的未偿还余额分别约为874,000美元和865,000美元。
2020年10月26日,公司与若干董事会成员签订了一系列
应付可转换票据(附注8),总额为161,250瑞士法郎,利率
为0.25%,到期日为2023年12月31日。如果股权融资超过1,000,000瑞士法郎,票据持有人可选择以20%的折扣
转换债券。持有人亦有权在出售本公司时兑换票据,或在上述两种情况下于票据到期日兑换票据而不收取折扣。这些应付票据从属于公司的
其他非次级债务。截至2023年9月30日和2022年12月31日,这些票据的未偿还余额分别约为177,000美元和174,000美元。
Proteomedex AG
简明财务报表附注
注4--债务(续)
2020年11月23日,公司与公司若干股东签订了一系列应付可转换票据,总金额为760,080瑞士法郎,利率为5%,
到期日期为2023年12月31日。该票据为持有者提供了可选的转换功能,如果股权融资超过1,000,000瑞士法郎,可享受30%的折扣。持有人亦有权在出售本公司时转换票据,或在上述两种情况下于票据到期日转换票据而不收取折扣。这些应付票据从属于公司的其他非从属债务。截至2023年9月30日和2022年12月31日,这些票据的未偿还余额分别约为831,000美元和822,000美元。
2021年7月19日,公司签订了总额为3,000,000瑞士法郎的可转换票据,利率为0.5%,原到期日为2023年9月30日,延期至2024年9月30日。在股权融资超过1,000,000瑞士法郎的情况下,票据为持有者提供了强制转换要求。如果实现了与单独输入的研发
协作项目相关的某些里程碑,并且截至2022年12月31日仍未达到这些项目,则还会强制转换附注。持有人亦有权在出售本公司时或在票据到期时转换该票据,而不会有折扣。这些应付票据
从属于公司的其他非次级债务。截至2023年9月30日和2022年12月31日,本票据的未偿还余额分别约为3,278,000美元和3,245,000美元。
本公司于截至2023年9月30日的九个月内并无发行任何新票据,上述结余的所有变动纯属美元兑瑞士法郎汇率变动所致。截至2022年12月31日的所有未偿还可转换票据已在母公司完成对本公司的收购时转换。请参阅附注10。
附注5--承付款和或有事项
租契
该公司以每月5,077瑞士法郎的价格租赁其主要办公室和实验室空间。租赁于2012年2月1日开始,初始租期至2015年1月31日。本租赁协议可在指定年份的3月、6月和9月底终止,并提前12个月通知。如果公司
希望在不遵守约定日期的情况下终止租赁,则有责任支付租金和其他承租人的义务,直至
租金继续,但最迟至下一个合同终止日期。如果在固定合同期限届满后,任何一方未以书面方式终止租赁协议,则在遵守通知期限的同时,将延长两年。截至2023年9月30日,租约的剩余期限约为21个月。
截至2022年9月30日、2023年和2022年的租金支出分别为57,582美元和54,653美元,并计入随附的
全面损失表中的一般和行政费用。在截至2023年、2023年和2022年9月30日的期间,公司分别支付了57,582美元和54,653美元的租赁付款,并计入了公司这两个时期的运营现金流。租赁费用和租赁现金付款的变化
。租赁费用的期间变化是由于美元和瑞士法郎之间的汇率变化,因为公司的
每月最低租赁付款是为租赁期固定的。
瑞士社会保障义务
本公司在2022年12月31日之前发行了某些股票期权。如果收件人行使这些股票期权,可能会因瑞士税务机关而获得额外的社会保障税的确认。管理层根据美国会计准则450评估了截至2022年12月31日和2021年发生这一负债的可能性。或有事件,并确定这种可能性是合理的。因此,在所附的简明财务报表中没有确认这项或有债务的应计项目。此外,管理层无法估计
如果收件人行使股票期权,可能欠下的任何金额的金额或金额范围。
Proteomedex AG
简明财务报表附注
附注6--股东亏损
股本
本公司拥有多个系列普通股
,提供以下规定。如果公司破产、清算或清盘,B3系列普通股的持有者将有权比B2系列普通股、B系列普通股和A系列普通股的持有人提前获得他们所拥有的每一股B3系列普通股65瑞士法郎。
此后,B2系列普通股的持有者将有权在B系列普通股、A系列普通股和普通股持有者之前获得他们所拥有的每一股B2系列普通股60瑞士法郎。
此后,B系列普通股的持有者将有权在A系列普通股和普通股持有者之前获得他们所拥有的每一股B系列普通股50瑞士法郎的奖励。
此后,A系列普通股的持有者将有权先于普通股持有者获得他们所拥有的每一股A系列普通股40瑞士法郎。
此后,其他普通股东将有权获得他们所拥有的每股普通股40瑞士法郎,然后任何剩余资产或收益将按比例分配给
所有股东。
如果没有足够的资产或收益向B3系列普通股持有人支付该金额,则可用金额将在B3系列普通股持有人之间按比例支付。
如果在B3系列股东全额支付后,
没有足够的资产或收益向B2系列普通股持有人支付该金额,则可用金额将在B2系列普通股持有人之间按比例支付。
如果在B2系列股东全额支付后,
没有足够的资产或收益向B系列普通股持有人支付该金额,则可用金额将在B系列普通股持有人之间按比例支付。
如果在B系列股东全额支付后,
没有足够的资产或收益向A系列普通股持有人支付该金额,则可用金额将在A系列普通股持有人之间按比例支付。
本公司和所有股东应尽最大努力
确保任何重大资产或整个公司的出售、清算、处置应符合税务效益,尤其是在适用的预扣税方面,并且对股东公平。
如果在以后的几轮融资中授予额外的优先股
权利,那么A系列普通股、B系列普通股和B2系列普通股的持有者将在新股之后获得经过必要修改的相同权利(考虑到各自的价格)。“
B3系列普通股应与B系列普通股和B2系列普通股具有与B系列普通股和B2系列普通股相同的股东协议和组织规则下的权利和义务,从而具有与B系列普通股和B2系列普通股同等的法律地位。
Proteomedex AG
简明财务报表附注
注6-股东赤字
(续)
截至2023年9月30日和2022年12月31日,每个系列的库存数量如下:
| 共享类 | |
库存 | |
| 普通 | |
| 100,000 | |
| A系列 | |
| 65,000 | |
| B系列 | |
| 84,200 | |
| B2系列 | |
| 83,334 | |
| B3系列 | |
| 80,038 | |
| 总流通股 | |
| 412,572 | |
股票期权
公司已将各种股票期权
主要授予员工作为基于激励的薪酬。于截至2023年9月30日及2022年9月30日止九个月内,本公司分别授予
5,307及-0-股票期权,并分别确认161,573美元及282,742美元与归属未偿还的
股票期权有关的开支。
累计其他综合损失
下表详细说明了在截至2022年9月30日和2021年9月30日的期间,从其他全面亏损中重新归类的金额以及随附的全面亏损报表中相关的受影响项目。
| | |
2023 | | |
2022 | | |
财务报表 |
| 项目说明 | |
金额 | | |
金额 | | |
行项目 |
| | |
| | |
| | |
|
| 摊销损益 | |
$ | (24,876 | ) | |
$ | (4,743 | ) | |
一般和行政 |
| | |
| | | |
| | | |
|
| | |
$ | (24,876 | ) | |
$ | (4,743 | ) | |
|
下表详细列出了截至2023年9月30日、2023年9月30日及2022年9月30日止期间各组成部分及公司累计其他综合亏损。
| | |
已定义 | | |
| | |
| |
| | |
效益 | | |
外国 | | |
| |
| | |
养老金 | | |
货币 | | |
| |
| | |
项目 | | |
项目 | | |
总计 | |
| 截至2021年12月31日的余额 | |
$ | 397,709 | | |
$ | 33,968 | | |
$ | 431,677 | |
| | |
| | | |
| | | |
| | |
| 改叙前的其他全面收入 | |
| 374,030 | | |
| 344,957 | | |
| 718,987 | |
| | |
| | | |
| | | |
| | |
| 从累计其他全面收益(亏损)中重新归类的金额 | |
| (4,743 | ) | |
| - | | |
| (4,743 | ) |
| | |
| | | |
| | | |
| | |
| 本期其他综合收益净额 | |
| 369,287 | | |
| 344,957 | | |
| 714,244 | |
| | |
| | | |
| | | |
| | |
| 截至2022年9月30日的余额 | |
$ | 766,996 | | |
$ | 378,925 | | |
$ | 1,145,921 | |
Proteomedex AG
简明财务报表附注
注6-股东赤字
(续)
| 截至2022年12月31日的余额 | |
$ | 577,601 | | |
$ | 28,982 | | |
$ | 606,583 | |
| | |
| | | |
| | | |
| | |
| 重新分类前的其他综合收益(亏损) | |
| (143,431 | ) | |
| 172,351 | | |
| 28,920 | |
| | |
| | | |
| | | |
| | |
| 从累计其他全面收益(亏损)中重新归类的金额 | |
| (24,876 | ) | |
| - | | |
| (24,876 | ) |
| | |
| | | |
| | | |
| | |
| 本期净其他综合收益(亏损) | |
| (168,307 | ) | |
| 172,351 | | |
| 4,044 | |
| | |
| | | |
| | | |
| | |
| 截至2023年9月30日的余额 | |
$ | 409,294 | | |
$ | 201,333 | | |
$ | 610,627 | |
附注7--界定福利养恤金计划
本公司发起了一项固定收益养老金计划,涵盖某些符合条件的员工。该计划根据服务年限和补偿水平提供退休福利。
养老金债务的价值是使用预计单位贷方(PUC)法确定的。此方法将每个服务期间视为产生额外的福利单位
权利/员工福利。在报告日期,公司在职员工的员工福利义务或预计福利义务(PBO)的价值与该日存在的权利程度的现值相同,以未来工资和养老金增加以及流动率计。养恤金领取人的养恤金债务的估值是在考虑到未来养恤金增长的情况下根据当前养恤金的现值进行的。服务成本(SC)是使用在计算的年度内赚取的员工福利权利的
现值来计算的。
在计算截至2023年9月30日和2022年12月31日的福利债务和定期福利净成本时,使用了以下重要精算假设
:
| | |
2023 | | |
2022 | |
| 贴现率 | |
| 1.90 | % | |
| 2.30 | % |
| 预期长期计划资产收益率 | |
| 1.20 | % | |
| 2.30 | % |
| 补偿增值率 | |
| 3.00 | % | |
| 3.00 | % |
这些假设的更改可能会对计划的义务和成本产生重大影响。
截至2023年9月30日和2022年9月30日期间的定期福利净成本构成如下:
| | |
2023 | | |
2022 | |
| 服务成本 | |
$ | 69,358 | | |
$ | 118,310 | |
| 利息成本 | |
| 31,506 | | |
| 8,080 | |
| 计划资产的预期回报 | |
| (25,640 | ) | |
| (6,166 | ) |
| 摊销净(损益) | |
| (24,876 | ) | |
| (4,743 | ) |
| 总计 | |
$ | 50,348 | | |
$ | 115,481 | |
Proteomedex AG
简明财务报表附注
附注8--关联方
截至2023年9月30日和2022年12月31日,公司欠某些股东和
董事的未偿还可转换票据分别约为2,422,000美元和2,422,000美元。
在截至2023年9月30日和2022年9月30日期间,本公司向董事会成员和执行管理层拥有的实体支付了约127,500美元和183,400美元,以获得专业服务。这些金额包括在随附的全面损失报表中的“一般和行政”费用
。
注9--后续活动
于2023年12月15日,母公司与本公司订立换股协议,使本公司成为母公司的全资附属公司。联交所的完成须遵守惯常成交条件
,并于2023年12月15日完成。
在换股协议完成的同时,截至2022年12月31日的所有未偿还可转换票据被转换为本公司的83,114股普通股
,然后由母公司购买。
Proteomedex AG
财务报表
和
独立审计师报告
截至2022年12月31日及2021年12月31日止年度
目录
| 独立审计师报告 |
F-81 |
| |
|
| 资产负债表 |
F-82 |
| |
|
| 全面损失表 |
F-83 |
| |
|
| 股东亏损表 |
F-84 |
| |
|
| 现金流量表 |
F-85 |
| |
|
| 财务报表附注 |
F-86至F-102 |
独立注册会计师事务所报告
股东和董事会
Proteomedex AG
苏黎世Schlieren
瑞士
对财务报表的看法
我们已审计了Proteomedex AG(“本公司”)截至2022年12月31日及2021年12月31日的资产负债表、截至2022年12月31日期间各年度的相关亏损及综合损失表、股东赤字及现金流量表,以及相关附注
(统称为“财务报表”)。我们认为,财务报表在所有重大方面都公平地反映了本公司于2022年12月31日、2022年及2021年12月31日的财务状况,以及截至2022年12月31日期间各年度的经营业绩及现金流量,符合美国公认的会计原则
。
持续经营的不确定性
随附的财务报表
是假设本公司将继续作为持续经营的企业编制的。如财务报表附注2所述,公司经常遭受经营亏损,净资本不足,这令人对其持续经营的能力产生极大的怀疑。附注2也说明了管理层在这些事项上的计划。财务报表
不包括这种不确定性的结果可能导致的任何调整。
意见基础
这些财务报表由公司管理层负责。我们的责任是根据我们的审计对公司的财务报表发表意见。我们是一家在美国上市公司会计监督委员会(“PCAOB”)(“PCAOB”)注册的公共会计师事务所,根据美国联邦证券法以及美国证券交易委员会和PCAOB适用的规则和法规,我们必须对公司保持独立。
我们按照PCAOB的标准和美国公认的审计标准进行审计。这些准则要求我们计划和执行审计,以获得财务报表是否没有重大错报的合理保证
无论是由于错误还是欺诈。本公司不需要,也不需要我们对其财务报告的内部控制进行审计。作为我们审计的一部分,我们需要了解财务报告的内部控制,但不是为了对公司财务报告内部控制的有效性发表意见。因此,
我们不表达这样的意见。
我们的审计包括执行程序以评估财务报表重大错报的风险(无论是由于错误还是欺诈),以及执行应对这些风险的程序。这些程序包括在测试基础上审查与财务报表中的金额和披露有关的证据。
我们的审计还包括评估所使用的会计原则和管理层做出的重大估计,以及评估财务报表的整体列报。我们相信,我们的审计为我们的观点提供了合理的基础。
| 瑞士苏黎世,2024年2月14日 |
|
|
| |
|
|
| BDO AG |
|
|
| |
|
|
| /发稿S/克里斯托夫·舒米 |
|
/S/Marc Furlato |
| |
|
|
| 自2023年以来,我们一直担任公司的审计师。 |
|
Proteomedex AG
资产负债表
截至2022年12月31日和2021年12月31日
| 资产 | |
2022 | | |
2021 | |
| 流动资产 | |
| | |
| |
| 现金和现金等价物 | |
$ | 470,156 | | |
$ | 2,546,801 | |
| 应收账款 | |
| 236,683 | | |
| 96,211 | |
| 库存 | |
| 95,810 | | |
| 110,584 | |
| 预付费用和其他流动资产 | |
| 26,280 | | |
| 85,632 | |
| 流动资产总额 | |
| 828,929 | | |
| 2,839,228 | |
| | |
| | | |
| | |
| 财产和设备 | |
| 40,130 | | |
| 54,003 | |
| 使用权资产 | |
| 202,739 | | |
| - | |
| 总资产 | |
$ | 1,071,798 | | |
$ | 2,893,231 | |
| | |
| | | |
| | |
| 负债与企业的赤字 | |
| | | |
| | |
| 流动负债 | |
| | | |
| | |
| 可转换应付票据 | |
$ | 4,241,942 | | |
$ | - | |
| 应计费用 | |
| 510,578 | | |
| 504,766 | |
| 经营租赁负债,流动 | |
| 67,546 | | |
| - | |
| 流动负债总额 | |
| 4,820,066 | | |
| 504,766 | |
| | |
| | | |
| | |
| 非流动负债 | |
| | | |
| | |
| 可转换应付票据 | |
| 1,406,289 | | |
| 5,726,368 | |
| 应付票据 | |
| 108,176 | | |
| 164,509 | |
| 养老金福利义务 | |
| 393,640 | | |
| 798,476 | |
| 经营租赁负债 | |
| 135,193 | | |
| - | |
| 总负债 | |
| 6,863,364 | | |
| 7,194,119 | |
| | |
| | | |
| | |
| 承付款和或有事项(附注5) | |
| | | |
| | |
| | |
| | | |
| | |
| 股东亏损额 | |
| | | |
| | |
| 普通股面值1瑞士法郎,授权590,951股,截至2022年和2021年12月31日分别为412,572股和412,572股 | |
| 466,555 | | |
| 466,555 | |
| 追加实收资本 | |
| 20,377,905 | | |
| 20,000,916 | |
| 累计综合(亏损)收益 | |
| 606,583 | | |
| 431,677 | |
| 累计赤字 | |
| (27,242,609 | ) | |
| (25,200,036 | ) |
| 股东总亏损额 | |
| (5,791,566 | ) | |
| (4,300,888 | ) |
| 总负债和股东赤字 | |
$ | 1,071,798 | | |
$ | 2,893,231 | |
附注是这些财务报表的组成部分。
Proteomedex AG
全面损失表
截至2022年12月31日和2021年12月31日的年度
| | |
2022 | | |
2021 | |
| | |
| | |
| |
| 收入 | |
$ | 392,460 | | |
$ | 140,600 | |
| | |
| | | |
| | |
| 销货成本 | |
| 48,429 | | |
| 31,977 | |
| | |
| | | |
| | |
| 毛利 | |
| 344,031 | | |
| 108,623 | |
| | |
| | | |
| | |
| 运营费用 | |
| | | |
| | |
| 市场营销和业务发展 | |
| 240,298 | | |
| 200,096 | |
| 研发 | |
| 393,274 | | |
| 312,586 | |
| 一般和行政 | |
| 1,671,960 | | |
| 1,766,843 | |
| 折旧 | |
| 17,492 | | |
| 36,866 | |
| 总运营费用 | |
| 2,323,024 | | |
| 2,316,391 | |
| | |
| | | |
| | |
| 运营亏损 | |
| (1,978,993 | ) | |
| (2,207,768 | ) |
| | |
| | | |
| | |
| 其他收入(费用) | |
| | | |
| | |
| 利息支出 | |
| (63,580 | ) | |
| (41,536 | ) |
| 其他收入(费用)合计 | |
| (63,580 | ) | |
| (41,536 | ) |
| | |
| | | |
| | |
| 未计提所得税准备前净亏损 | |
| (2,042,573 | ) | |
| (2,249,304 | ) |
| | |
| | | |
| | |
| 所得税拨备 | |
| - | | |
| - | |
| | |
| | | |
| | |
| 净亏损 | |
| (2,042,573 | ) | |
| (2,249,304 | ) |
| | |
| | | |
| | |
| 其他综合(亏损)收入 | |
| | | |
| | |
| | |
| | | |
| | |
| 福利养老金义务变化 | |
| 179,892 | | |
| 397,709 | |
| | |
| | | |
| | |
| 外币折算调整 | |
| (4,986 | ) | |
| 32,837 | |
| | |
| | | |
| | |
| 其他综合(亏损)收入合计 | |
| 174,906 | | |
| 430,546 | |
| | |
| | | |
| | |
| 综合损失 | |
$ | (1,867,667 | ) | |
$ | (1,818,758 | ) |
附注是这些财务报表不可分割的一部分。
Proteomedex AG
股东亏损表
截至2022年12月31日和2021年12月31日的年度
| | |
| | |
| | |
其他内容 | | |
累计 | | |
| | |
总计 | |
| | |
普通股 | | |
已缴入 | | |
全面 | | |
累计 | | |
股东的 | |
| | |
股票 | | |
面值 | | |
资本 | | |
(亏损)收入 | | |
赤字 | | |
赤字 | |
| | |
| | |
| | |
| | |
| | |
| | |
| |
| 2020年12月31日余额 | |
| 412,572 | | |
$ | 466,555 | | |
$ | 19,928,271 | | |
$ | 1,131 | | |
$ | (22,950,732 | ) | |
$ | (2,554,775 | ) |
| | |
| | | |
| | | |
| | | |
| | | |
| | | |
| | |
| 养恤金福利义务的变化 | |
| - | | |
| - | | |
| - | | |
| 397,709 | | |
| - | | |
| 397,709 | |
| | |
| | | |
| | | |
| | | |
| | | |
| | | |
| | |
| 基于股票的薪酬 | |
| - | | |
| - | | |
| 72,645 | | |
| - | | |
| - | | |
| 72,645 | |
| | |
| | | |
| | | |
| | | |
| | | |
| | | |
| | |
| 外汇平移调整 | |
| - | | |
| - | | |
| - | | |
| 32,837 | | |
| - | | |
| 32,837 | |
| | |
| | | |
| | | |
| | | |
| | | |
| | | |
| | |
| 净亏损 | |
| - | | |
| - | | |
| - | | |
| - | | |
| (2,249,304 | ) | |
| (2,249,304 | ) |
| | |
| | | |
| | | |
| | | |
| | | |
| | | |
| | |
| 2021年12月31日的余额 | |
| 412,572 | | |
| 466,555 | | |
| 20,000,916 | | |
| 431,677 | | |
| (25,200,036 | ) | |
| (4,300,888 | ) |
| | |
| | | |
| | | |
| | | |
| | | |
| | | |
| | |
| 养恤金福利义务的变化 | |
| - | | |
| - | | |
| - | | |
| 179,892 | | |
| - | | |
| 179,892 | |
| | |
| | | |
| | | |
| | | |
| | | |
| | | |
| | |
| 基于股票的薪酬 | |
| - | | |
| - | | |
| 376,989 | | |
| - | | |
| - | | |
| 376,989 | |
| | |
| | | |
| | | |
| | | |
| | | |
| | | |
| | |
| 外汇平移调整 | |
| - | | |
| - | | |
| - | | |
| (4,986 | ) | |
| - | | |
| (4,986 | ) |
| | |
| | | |
| | | |
| | | |
| | | |
| | | |
| | |
| 净亏损 | |
| - | | |
| - | | |
| - | | |
| - | | |
| (2,042,573 | ) | |
| (2,042,573 | ) |
| | |
| | | |
| | | |
| | | |
| | | |
| | | |
| | |
| 2022年12月31日的余额 | |
| 412,572 | | |
$ | 466,555 | | |
$ | 20,377,905 | | |
$ | 606,583 | | |
$ | (27,242,609 | ) | |
$ | (5,791,566 | ) |
附注是这些财务报表的组成部分。
Proteomedex AG
现金流量表
截至2022年12月31日和2021年12月31日的年度
| | |
2022 | | |
2021 | |
| 经营活动 | |
| | |
| |
| 净亏损 | |
$ | (2,042,573 | ) | |
$ | (2,249,304 | ) |
| 对净亏损与经营活动中使用的现金净额进行的调整: | |
| | | |
| | |
| 折旧及摊销 | |
| 17,492 | | |
| 36,866 | |
| 基于股票的薪酬 | |
| 376,989 | | |
| 72,645 | |
| 定期净收益成本 | |
| (224,944 | ) | |
| (40,881 | ) |
| 经营性资产和负债变动情况: | |
| | | |
| | |
| 应收账款 | |
| (140,472 | ) | |
| (32,009 | ) |
| 库存 | |
| 14,774 | | |
| 19,522 | |
| 预付费用和其他流动资产 | |
| 59,352 | | |
| (16,734 | ) |
| 应计费用 | |
| 5,812 | | |
| (29,661 | ) |
| 用于经营活动的现金 | |
| (1,933,570 | ) | |
| (2,239,556 | ) |
| | |
| | | |
| | |
| 投资活动: | |
| | | |
| | |
| | |
| | | |
| | |
| 用于投资活动的现金 | |
| - | | |
| - | |
| | |
| | | |
| | |
| 融资活动: | |
| | | |
| | |
| 应付票据的发行(偿还) | |
| (50,000 | ) | |
| - | |
| 发行可转换应付票据 | |
| - | | |
| 3,277,170 | |
| 融资活动提供的现金(用于) | |
| (50,000 | ) | |
| 3,277,170 | |
| | |
| | | |
| | |
| 外汇对现金的影响 | |
| (93,075 | ) | |
| (26,488 | ) |
| | |
| | | |
| | |
| 现金和现金等价物净变化 | |
| (2,076,645 | ) | |
| 1,011,126 | |
| | |
| | | |
| | |
| 现金和现金等价物--年初 | |
| 2,546,801 | | |
| 1,535,675 | |
| 现金和现金等价物--年终 | |
$ | 470,156 | | |
$ | 2,546,801 | |
| | |
| | | |
| | |
| 补充现金流量披露 | |
| | | |
| | |
| | |
| | | |
| | |
| 支付的利息 | |
$ | 2,621 | | |
$ | 2,735 | |
| 已缴纳的所得税 | |
$ | - | | |
$ | - | |
附注是这些财务报表不可分割的一部分。
Proteomedex AG
财务报表附注
附注1-业务的组织和性质
Proteomedex AG(“公司”)是一家医疗保健公司,其使命是改变前列腺癌的诊断。Proteomedex已经确定了在前列腺癌诊断、预后和治疗管理中具有实用价值的新生物标记物签名。主导产品Proclarix®是一种基于血液的前列腺癌测试小组和风险评分,目前在欧洲可用,预计不久将在美国推出。Proteomedex
位于瑞士苏黎世-施利耶伦生物技术园。
2023年12月15日,公司被Onconentix,Inc.(前身为Blue Water Biotech,Inc.)(“母公司”)收购。母公司发行普通股以换取公司100%的已发行有表决权股权。请参阅附注10。
注2-持续经营
所附财务报表的编制假设本公司将继续作为一家持续经营的企业,其中包括在正常业务过程中实现资产变现和偿还负债。截至2022年12月31日止年度,本公司累计亏损约27,200,000美元,净亏损约2,042,000美元,经营活动中使用的现金净额约为1,934,000美元,已确认收入约为392,000美元,且缺乏盈利的运营历史。这些事项及其他事项令人怀疑本公司是否有能力在这些财务报表发布后的12个月内继续经营下去。
虽然公司正试图创造更大的收入,但公司的现金状况可能不足以支持公司的日常运营。管理层打算从母公司筹集更多资金以维持运营,直到收入足以支持公司的运营
。管理层相信,目前为进一步实施其业务计划和创造收入而采取的行动为公司提供了作为持续经营的企业继续存在的机会。虽然公司相信其创造收入的战略的可行性,以及母公司提供额外资金的能力,但不能保证这一点。公司持续经营的能力取决于公司进一步实施其业务计划的能力,以及根据需要从母公司获得额外的
资金的能力。
注3-重要会计政策摘要
陈述的基础
本公司的财务报表是根据美国公认会计原则(“U.S.GAAP”)编制的,该原则要求确认和披露因折算以美元以外的货币计价的财务报表而产生的外币折算调整。
公司的本位币为
瑞士法郎。以外币计价的交易按交易当日的汇率折算为本位币。由此产生的换算调整作为累计其他综合收入(亏损)的单独组成部分入账。
预算的使用
根据美国公认会计原则编制财务报表要求管理层作出估计和假设,以影响财务报表日期的已报告资产和负债额以及或有资产和负债的披露,以及报告期内已报告的费用金额。本公司财务报表中最重要的估计
涉及因净营业亏损而产生的存货估值、股票补偿、养老金福利债务和递延税项资产的估值拨备
。该等估计及假设乃根据当前事实、历史经验及在当时情况下被认为合理的其他各种因素而作出,其结果构成对资产及负债的账面值作出判断的基础,并记录从其他来源不易察觉的开支。实际结果可能与这些估计值存在实质性差异和不利影响。如果估计与实际结果之间存在重大差异,则公司未来的经营业绩将受到影响。
Proteomedex AG
财务报表附注
附注3-重要会计政策摘要(续)
细分市场
信息
运营部门定义为企业的组成部分,其独立的离散信息可供首席运营决策者(“CODM”)或决策小组在决定如何分配资源和评估业绩时进行评估。
本公司在一个部门运营,该部门与CODM为评估业绩、分配资源、设定激励性薪酬目标以及规划和预测未来期间而定期审查的财务信息保持一致。
现金和现金等价物
为报告现金流,本公司将现金及现金等价物定义为所有银行现金及高流动性投资,可供目前使用,初始到期日为三个月或以下为现金等价物。截至2022年12月31日或2021年12月31日,公司没有现金等价物。
公司在瑞士金融市场监督管理局(“FINMA”)承保的金融机构维持其现金余额。
公司的现金余额有时可能超过FINMA提供的保险。本公司并无在该等
账户上出现任何亏损,管理层并不认为本公司有任何与超额存款有关的重大风险。
应收帐款
公司
定期对其客户的财务状况进行信用评估,并在无抵押的基础上向几乎所有客户提供信贷
。到目前为止,信贷损失一直不大,在管理层的预期之内。本公司根据对应收账款、历史收款信息和现有经济状况的审查,计提坏账准备。正常应收账款应在发票开具后30天内到期。根据管理层对个人余额的评估,应收账款被视为拖欠。拖欠的应收账款根据个人信用评估和客户的具体情况进行收款评估。截至2022年12月31日、2022年12月31日和2021年12月31日,本公司的可疑账户拨备分别为零。截至2022年12月31日及2021年12月31日止年度,本公司并无将任何应收账款从坏账准备中注销。截至2022年12月31日和2021年12月31日,该公司的所有应收账款基本上都是单一客户的应收账款。
盘存
存货包括原材料和产成品。存货按成本或可变现净值两者中较低者列账,成本按先入先出法厘定。本公司
定期审查库存的构成,以确定过剩、过时、滞销或其他不可销售的项目,同时
考虑到与现有数量相比的预期未来销售以及现有货物的剩余保质期。如果观察到不可销售
项目,并且库存没有其他用途,则本公司在首次确认价值下降的
期间将其减记为可变现净值。于2022年及2021年12月31日,本公司并无存货储备。
本公司的存货包括
以下各项在各自的资产负债表日期:
| | |
2022 | | |
2021 | |
| 原料 | |
$ | 48,408 | | |
$ | 52,942 | |
| 成品 | |
| 47,402 | | |
| 57,641 | |
| 总计 | |
$ | 95,810 | | |
$ | 110,583 | |
Proteomedex AG
财务报表附注
附注3-重要会计政策摘要(续)
长期资产减值
当业务环境的事件或变化表明
资产的账面值可能无法完全收回(“触发事件”)时,本公司
会审查长期资产的减值。本公司在决定何时进行
减值审查时考虑的因素包括:长期资产相对于预期的重大表现不佳、重大负面行业
或经济趋势,以及资产使用的重大变化或计划变化。如果进行减值审查以评估
长期资产的可收回性,则本公司将长期资产的使用和最终
处置预期产生的未贴现现金流预测与其账面价值进行比较。当使用资产预期产生的估计未贴现未来现金流量
低于其账面值时,将确认减值损失。减值亏损将以减值资产的账面值超过其公允价值的差额为基础,公允价值根据贴现现金流量确定。截至2022年12月31日及2021年12月31日止年度,本公司并无发现任何与其长期资产有关的减值。
财产和设备
财产和设备包括计算机和
办公室家具和固定装置,所有这些都按成本入账。折旧乃按资产各自之
可使用年期(介乎二至十年)以直线法入账。当有事件或情况
显示长期资产的账面值可能无法收回时,对这些资产进行减值审查。财产和设备报废或以其他方式处置后,
相关成本和累计折旧计入运营费用。估计可使用年期概要如下:
| 描述 | |
估计数
使用寿命 |
| 电脑 | |
3年 |
| 办公家具和固定装置 | |
2至10年 |
下表按重要类别汇总了截至2022年和2021年12月31日公司的
财产和设备(扣除累计折旧)。
| 班级 | |
2022 | | |
2021 | |
| 电脑 | |
$ | 79,199 | | |
$ | 75,311 | |
| 办公家具和固定装置 | |
| 341,318 | | |
| 346,040 | |
| 减去:累计折旧 | |
| (380,387 | ) | |
| (367,348 | ) |
| 总计 | |
$ | 40,130 | | |
$ | 54,003 | |
截至2022年和2021年12月31日的年度折旧费用分别为17,492美元和36,866美元。
租赁会计。
公司定期评估合同
是否符合租赁的定义,只要合同授予其在一段时间内控制已确定资产的使用权,以换取对价
。该公司的租赁协议包括办公空间。此租约通常包含两年的初始租期,并具有续订选项。如果本公司的租赁协议包括续期选择权期限,则当公司确定该等选择权合理地确定将被行使时,该公司在其估计租赁期的计算中计入该等续期选择权。当此类
续订选项被视为合理确定时,根据ASC 842确定的估计租赁期限将大于合同安排中不可撤销的
期限。
本公司于开始时将其承租人安排
分类为营运租赁或融资租赁。如果至少满足以下条件之一,则将租赁归类为融资租赁:(1)租赁将标的资产的所有权转让给承租人,(2)租赁授予承租人购买承租人合理确定将行使的标的资产的选择权,(3)租赁期限为标的资产剩余经济寿命的大部分,(4)租赁支付总额的现值等于或基本上超过标的资产的全部公允价值,或(5)标的资产具有专门性,预计在租赁期结束时不会有出租人的其他用途。如果不符合上述融资租赁分类的五个标准
,则将租赁归类为经营性租赁。截至2022年12月31日或2021年12月31日,该公司没有融资租赁。
Proteomedex AG
财务报表附注
附注3-重要会计政策摘要(续)
与经营性租赁相关的ROU资产
计入公司资产负债表上的“使用权资产”。与经营租赁相关的租赁负债的当期和长期部分
计入公司截至2022年和2021年12月31日的资产负债表上的“经营租赁负债、当期”和“经营租赁负债”
。ROU资产代表公司在预计租赁期内使用标的资产的权利,租赁负债代表公司未来租赁付款的现值。在
评估其租赁并在租赁开始或修改时确定其租赁负债时,本公司无法轻易确定其承租人安排所隐含的利率,因此使用其以抵押为基础的递增借款利率来确定租赁付款的现值。本公司的ROU资产以租赁负债加上或减去任何预付或应计租赁付款以及任何未摊销的初始直接成本的余额计量。无论付款条款是否要求公司按年、按季、按月或在整个
期限内提前付款,运营租赁费用均按
应课税基础确认。如果付款条件包括固定自动扶梯条款,则按直线方式确认此类增加的影响
。本公司计算合同预计租赁期限内的直线费用,包括公司认为合理确定将被行使的任何续期选择期,并在所附的全面亏损报表中将其确认为“一般和行政”租赁费用
。有关公司租约的进一步资料,请参阅附注5。
研发成本
研发费用是指在发现、设计和开发新产品、流程或服务以及改进现有产品时发生的成本。
除非研发成本在未来有其他用途,否则研发成本按已发生的成本计入费用。这些成本包括但不限于直接用于研发活动的工资、工资、福利、材料、设备和管理费用。
合作协议
本公司定期与交易对手签订战略联盟协议,以生产产品和/或向客户提供服务。通过此类协议创建的联盟
不是法人实体,没有员工,没有资产,也没有真正的运营。这些安排创造了合同权利,公司通过在全面损失表中报告研发费用内的交易产生的成本和收到的报销,将这些联盟作为一种合作安排进行会计处理。
承付款和
或有
因索赔、评估、诉讼、罚款、罚款和其他来源引起的或有损失的负债
当管理层评估很可能已发生负债且金额可以合理估计时,记录或有损失。
基于份额的薪酬
公司
根据财务会计准则委员会(“FASB”)会计准则(“ASC”)718,“补偿-股票
补偿”,对为换取非员工提供的货物或服务而发行的权益工具进行会计核算。成本按收到代价的估计公允价值或已发行权益工具的估计公允价值计量,以较可靠的计量为准。为员工服务以外的其他对价而发行的权益工具的价值是根据商品或服务提供者履行承诺或完成绩效中最早的一项确定的,
由FASB ASC 718“补偿-股票补偿”定义。
Proteomedex AG
财务报表附注
附注3-重要会计政策摘要(续)
所得税
根据
ASC 740“所得税”,如果递延所得税资产的变现
可能性较大,则公司将确认递延所得税资产。递延所得税资产及负债乃就财务报表与资产及负债之税务基准之间之差异而计算,而该等差异将导致未来应课税或可扣税金额,并根据已颁布之税法及适用于预期影响应课税收入之期间之税率计算。评估备抵在必要时设立,以
将递延所得税资产减少至预期可实现的金额。所得税费用是指当期应付或应退还的税款加上或减去递延所得税资产和负债的当期变动。
此外,
公司管理层对在
准备公司所得税申报表的过程中采取或预期采取的所有不确定所得税状况进行评估,以确定所得税状况是否符合适用税务机关审查的“更有可能”
标准。出于联邦和州的目的,需要对所有
开放纳税年度(根据各种限制法规的定义)进行此评估。如果公司有利息或罚款
与支付的税款不足有关,则此类费用在所得税费用中报告。
收入确认
自2021年1月1日起,公司采用了ASC主题606“与客户的合同收入”(“ASC 606”)。根据ASC 606,收入在将所执行服务的控制权转移给客户时确认,金额反映了我们预期有权
换取这些服务的对价。ASC 606提供了包括以下内容的五步模型:
产品销售
公司通过直接向最终用户和分销商销售
产品获得收入。该公司将其产品销售给包括实验室、医院、医疗中心、医生和分销商在内的客户。公司将客户采购订单视为与客户签订的合同,在某些情况下,这些订单受主销售协议
或标准条款和条件的约束。对于每份合同,本公司将转让
产品的承诺视为已确定的履约义务,每一项产品都是不同的。在确定交易价格时,本公司评估
价格是否会受到退款或调整,以确定其预期有权获得的净对价。本公司
于产品转移至客户后即履行适用于产品销售的履约义务。
开发
服务
公司
向生命科学客户提供一系列称为“开发服务”的服务,包括生物标记物
发现测试、化验设计和开发。这些开发服务在个人名义下执行工作说明书(“SOW”)安排
具体交付成果由客户定义。开发服务通常以时间和材料为基础进行。在
履行期间以及根据SOW完成对客户的服务期间,我们有权按商定价格向客户
开具账单,并确认预计完成SOW期间的开发服务收入。我们通常将每个SOW
确定为单一履约义务。
Proteomedex AG
财务报表附注
附注3-重要会计政策摘要(续)
服务的完成和SOW规定的履约义务的履行通常通过访问向客户提供的数据或测试或SOW中定义的任何其他形式或适用的交付方式来证明。但是,对于根据客户高度定制的规格执行工作的某些SOW,我们有权强制执行客户完成的工作,而不是在SOW完成时。对于这些母猪,我们根据花费的努力(投入)确认完成工作期间的收入
。由于SOW规定的履约义务已经履行,任何作为收入赚取并向客户开具账单的金额都将计入应收账款。截至财务报表日期,任何已赚取但尚未向客户开具帐单的收入将被记录为合同资产,并在财务报表日期计入预付款和其他流动资产。当根据合同中的开票时间表向客户开具发票时,合同资产中记录的金额
将在我们的财务报表中重新分类为应收账款。
在SOW包含可变
对价部分的情况下,公司使用预期值法或最可能金额法来估计交易价格中应包含的可变对价金额,具体取决于哪种方法有望更好地预测公司有权获得的对价金额
。如果和
交易价格中包含可变对价的价值,则当与可变对价相关的不确定性
随后得到解决时,确认的累计收入很可能不会发生重大逆转。这些估计在每个报告期都会根据需要重新评估,
任何需要的调整都是以累积追赶为基础记录的,这将影响调整期间的收入和净收入。
下表按类型分列了截至2022年12月31日和2021年12月31日的年度的公司收入。
| | |
识别
方法 | |
2022 | | |
2021 | |
| 产品销售 | |
时间点 | |
$ | 79,085 | | |
$ | 55,311 | |
| 开发服务 | |
随着时间的推移 | |
| 313,375 | | |
| 85,289 | |
| | |
| |
$ | 392,460 | | |
$ | 140,600 | |
公允价值计量
ASC主题
820“公允价值计量”要求某些金融工具在我们的资产负债表日期按其公允价值确认。然而,其他金融工具,如债务债务,并不要求按其公允价值确认,但美国公认会计原则提供了为这些工具选择公允价值会计的选项。美国公认会计原则要求披露所有金融工具的公允价值,无论它们在我们的资产负债表中是按公允价值还是账面价值确认的。对于按公允价值确认的金融工具,美国公认会计原则要求按工具类型披露其公允价值,以及其他信息,包括在收入或其他全面收益中确认的某些金融工具的公允价值变化。
对于未按公允价值确认的金融工具,其公允价值的披露在下文“金融工具”一节中提供。
非金融资产,如财产和设备,以及非金融负债,在公司资产负债表中按账面价值确认。公认会计原则不允许非金融资产和负债按其公允价值重新计量。然而,公认会计原则要求此类资产和负债在发生某些事件时重新计量至其公允价值,例如财产、厂房和设备的减值。此外,如果发生此类事件,GAAP要求披露资产或负债的公允价值以及其他信息,包括重新计量发生期间在收入中确认的收益或损失。
本公司于2022年12月31日、2022年12月31日及2021年12月31日并无任何资产或负债需要于各自的报告期重新计量。
Proteomedex AG
财务报表附注
附注3-重要会计政策摘要(续)
金融工具
本公司的金融工具包括现金和现金等价物、应收账款和应付账款,并根据ASC主题825“金融工具”的规定进行会计处理。财务报表中反映的这些金融工具的账面价值接近公允价值。
可转换工具
本公司
根据ASC 815“衍生工具和套期保值
活动”对可转换工具中嵌入的转换期权进行评估和核算。
美国公认会计原则
要求公司将转换期权从其主工具中分离出来,并根据某些标准将其作为独立的衍生金融工具
进行核算。该标准包括以下情况:(a)嵌入式衍生工具的经济特征和风险与主合同的经济特征和风险没有明确和密切的关系,(b)
包含嵌入式衍生工具和主合同的混合工具不按
项下的公允价值重新计量其他公认会计原则与公允价值的变化报告在收益,因为他们发生和(c)一个单独的工具与相同的条款作为嵌入式
衍生工具将被视为衍生工具。
本公司对可转换票据的会计处理如下:根据这些安排进行的债务折价在相关债务的期限内摊销至其声明的赎回日期。这些可转换票据的收益在
现金流量表的融资部分报告。于截至2022年12月31日及2021年12月31日止年度内,本公司并无任何需要从主机工具进行分流的转换选择
。
已定义的
福利养老金计划
本公司赞助
一项涵盖合资格雇员的界定福利退休金计划(“计划”)。本计划根据雇员的
服务年期及薪酬水平提供退休福利。本公司在其资产负债表中确认该计划资金过剩状态的资产或资金不足状态的负债。此外,公司还将衡量其计划的资产和债务,以确定其截至年底的资金到位状态
,并在发生变化的年度确认资金到位状态的变化。该等变动于“累计其他全面亏损”中呈报。公司使用精算估值来确定其养老金和退休后福利
成本和信贷。计算的金额取决于各种关键假设,包括贴现率和计划
资产的预期回报。在选择该等假设时会考虑当前市况。
本公司的退休金计划通常
使用每股净资产值(NAV)作为实际权宜方法进行估值,以获得公允价值,前提是满足某些标准。资产净值
根据基金相关投资的公允价值确定。在不符合标准的情况下,公平
根据基金交易的基础市场(通常被视为活跃市场)确定。
最近发布的
会计准则
在截至2022年12月31日的期间,财务会计准则委员会发布了几份新的会计声明。本公司已采纳或将采纳上述公告中的每一项,视情况而定。管理层不认为采用这些会计声明中的任何一项已经或将对公司的财务报表产生实质性影响。
2020年8月,财务会计准则委员会发布了ASU 2020-06,“债务--具有转换和其他期权的债务(分主题470-20)和衍生工具和对冲
-实体自有股权合同(分主题815-40):实体自有股权中可转换工具和合同的会计处理”(“ASU 2020-06”),简化了某些具有负债和股权特征的金融工具的会计处理。本ASU:(1)简化可转换债务工具和可转换优先股的会计核算,方法是:
删除ASC 470-20《债务:具有转换和其他选项的债务》中的现有指导,该指南要求实体将受益转换特征和现金转换特征记入权益,与托管可转换债券或优先股分开;
(2)修改了ASC 815-40中有关独立金融工具和嵌入特征的衍生会计的范围例外,这些工具和嵌入特征都是以发行人自己的股票为索引并按股东权益分类的,删除了股权分类所需的某些标准
;以及(3)修订ASC 260“每股收益”指南,要求实体使用IF-转换法计算可转换工具的稀释每股收益。此外,当票据可以现金或股票结算时,实体必须假定为计算稀释每股收益的目的进行股票结算。对于美国证券交易委员会申请者,不包括较小的报告公司,
ASU 2020-06在2021年12月15日之后开始的财年有效,包括这些财年内的过渡期。允许提前
采用,但不得早于2020年12月15日之后的财政年度。对于所有其他实体,ASU 2020-06在2023年12月15日之后的财年生效,包括这些财年内的过渡期。各实体应在通过的财政年度开始时采用该指南,不能在中期报告期采用该指南。本公司于2021年1月1日采用了ASU 2020-06。采用这一准则并未对公司的财务报表产生实质性影响。
Proteomedex AG
财务报表附注
附注3-重要会计政策摘要(续)
后续事件
公司
已评估自财务报表发布之日起的所有交易,以供后续事项披露考虑。参见
备注10。
附注4--债务
2010年3月3日,公司从Venture Kick获得了100,000瑞士法郎的贷款。这笔贷款没有利息,没有担保,公司可以酌情取消。
这笔贷款从属于公司的其他未附属债务。贷款仅用于业务发展,公司可自行决定将资金返还给Venture Kick,以使该组织能够继续努力。截至2022年12月31日和2021年12月31日,未偿还余额分别约为108,000美元和115,000美元。
2020年6月23日,公司向公司的一家金融机构和股东签订了一份可转换票据,年利率为0.50%,到期日期为2024年9月30日,票面利率为550,000瑞士法郎。在公司股权融资的情况下,票据为持有人提供了可选的转换功能
。在股权融资的情况下,转换价格为融资后股价的20%折扣。持有人亦有权在出售本公司时或票据到期时转换票据,而不会有任何折扣。这张票据在2023年1月10日之前一直是非从属债券,当时它也从属于所有其他非从属债务。
利率从2023年5月1日起改为2.50%。截至2022年12月31日和2021年12月31日,本票据的未偿还余额分别约为541,000美元和548,000美元。本公司还于2020年4月16日从该金融机构获得了一笔50,000瑞士法郎的新冠肺炎贷款,利率为0%。截至2021年12月31日,未偿还余额约为50,000美元。截至2022年4月,此类
贷款已全部偿还。
2020年6月23日,公司与公司某些股东签订了一系列
应付可转换票据,年利率为0.50%,到期日为2024年9月30日,金额为800,000瑞士法郎。在股权融资超过1,000,000瑞士法郎的情况下,该票据为持有人提供了可选的转换功能。在股权融资的情况下,转换价格为融资后股价的20%折扣。持有人
也有权在公司出售时或票据到期时转换票据,而不会有折扣。
这些应付票据从属于本公司的其他非次级债务。截至2022年12月31日和2021年12月31日,这些票据的未偿还余额分别约为865,000美元和877,000美元。
2020年10月26日,公司与若干董事会成员签订了一系列
应付可转换票据(附注8),总额为161,250瑞士法郎,利率
为0.25%,到期日为2023年12月31日。如果股权融资超过1,000,000瑞士法郎,票据持有人可选择以20%的折扣
转换债券。持有人亦有权在出售本公司时兑换票据,或在上述两种情况下于票据到期日兑换票据而不收取折扣。这些应付票据从属于公司的
其他非次级债务。截至2022年12月31日和2021年12月31日,这些票据的未偿还余额分别约为174,000美元和177,000美元。
Proteomedex AG
财务报表附注
注4--债务(续)
2020年11月23日,公司与公司若干股东签订了一系列应付可转换票据,总金额为760,080瑞士法郎,利率为5%,
到期日期为2023年12月31日。该票据为持有者提供了可选的转换功能,如果股权融资超过1,000,000瑞士法郎,可享受30%的折扣。持有人亦有权在出售本公司时转换票据,或在上述两种情况下于票据到期日转换票据而不收取折扣。这些应付票据从属于公司的其他非从属债务。截至2022年12月31日和2021年12月31日,这些票据的未偿还余额分别约为822,000美元和834,000美元。
2021年7月19日,公司签订了总额为3,000,000瑞士法郎的可转换票据,利率为0.5%,到期日为2023年9月30日。在股权融资超过1,000,000瑞士法郎的情况下,该票据为持有人提供了强制性转换要求。如果实现了与单独输入的研发协作项目相关的某些里程碑,且截至2022年12月31日仍未达到这些里程碑,则也会强制
转换附注。持有人亦有权在出售本公司时或在票据到期时转换票据,而不会有折扣。这些应付票据从属于公司的其他非次级债务。截至2022年12月31日和2021年12月31日,本票据的未偿还余额分别约为3,245,000美元和3,290,000美元。此后
至2022年12月31日,本票据的到期日延长至2024年9月30日。
截至2022年12月31日的所有未偿还可转换票据已在母公司完成对本公司的收购时转换。请参阅附注10。
附注5--承付款和或有事项
租契
该公司以每月5,077瑞士法郎的价格租赁其主要办公和实验室空间。租赁于2012年2月1日开始,初始租期至2015年1月31日。本租赁协议可在指定年份的3月、6月和9月底终止,并提前12个月通知。如果公司希望
在不遵守约定日期的情况下终止租赁,则有责任支付租金和其他承租人义务,直至租金
继续,但最迟至下一个合同终止日期为止。如果在固定合同期限届满后,任何一方没有以书面形式终止租赁协议,则在遵守通知期限的同时,将延长两年。截至2022年12月31日,租约剩余期限约为30个月。
自2020年1月1日起至2021年4月30日止,本公司临时延长上述租约
,以包括额外空间。该空间的月租金为2,843瑞士法郎。
公司适当地行使了本次租赁的终止权,对出租人没有进一步的义务。
公司于2022年1月1日采用ASC主题842《租赁》
。ASC 842确立了确认、计量、提交和披露租赁的原则,以确保承租人和出租人提供有关其租赁交易的相关信息。本公司采用采用修订追溯
方法的ASC 842,并选择使用有效方法于生效日期将此标准适用于所有符合认可准则的剩余租约。以前的比较期间不会重列,并按ASC 840列报。在应用修改后的追溯法时,公司选择了ASC 842允许的一揽子实际权宜之计,其中包括:
| - | 现有租约:该公司没有重新评估现有合同是租约还是包含租约。 |
| | | |
| - | 初始直接成本:公司没有重新评估现有租赁的初始直接成本。 |
| | | |
由于采用ASC 842,公司
在资产负债表上确认了约250,000美元的使用权资产和租赁负债,其租赁根据先前的指导被归类为
经营租赁。此次采用并未对公司的全面亏损或现金流报表产生实质性影响。
Proteomedex AG
财务报表附注
附注5--承付款和或有事项(续)
最初,该公司使用以下投入来衡量与其办公室租赁相关的使用权
资产和负债:
本公司
根据相关租赁条款以直线方式记录租金。截至2022年12月31日,根据租约估计的未来最低租赁付款如下:
| 截至十二月三十一日止的年度: | |
金额 | |
| 2023 | |
$ | 67,632 | |
| 2024 | |
| 67,632 | |
| 2025 | |
| 67,632 | |
| 剩余租赁付款总额 | |
| 202,896 | |
| 减去:推定利息 | |
| 157 | |
| 剩余租赁付款的现值 | |
$ | 202,739 | |
截至
12月31日、2022年和2021年的年度的租金支出分别为65,535美元和68,409美元,并计入随附的
全面损失表中的“一般和行政”费用。本公司于截至2022年、2022年及2021年12月31日止年度分别支付65,535美元及68,409美元的租赁付款,并计入本公司于两个期间的营运现金流。租赁费用和租赁期间的现金支付的变化是由于美元和瑞士法郎之间的汇率变化,因为公司的最低月租付款
在租赁期限内是固定的。
瑞士社会保障义务
本公司在2022年12月31日之前的
期间发行了某些股票期权。如果收件人行使这些股票期权,则可能会因瑞士税务当局的规定而确认额外的社会保障税。管理层根据ASC 450评估了截至2022年12月31日和2021年12月31日发生这一负债的可能性,或有事件,并确定这种可能性是合理的。因此,
未在所附财务报表中确认这项或有债务的应计项目。此外,如果收件人行使股票期权,管理层无法估计与可能欠下的任何金额相关的金额或金额范围。
联邦新冠肺炎助力
在截至2021年12月31日的年度内,由于新冠肺炎疫情,本公司和许多其他实体收到了瑞士政府的薪资援助。本公司收到的总金额约为171,000美元,主要用于削减工资和薪金,主要是在随附的全面亏损报表中的“一般和行政”及“研发”费用。
附注6--股东亏损
股本
本公司拥有多个系列普通股
,提供以下规定。如果公司破产、清算或清盘,B3系列普通股的持有者将有权比B2系列普通股、B系列普通股和A系列普通股的持有人提前获得他们所拥有的每一股B3系列普通股65瑞士法郎。
Proteomedex AG
财务报表附注
附注6--股东赤字(续)
此后,B2系列普通股的持有者将有权在B系列普通股、A系列普通股和普通股持有者之前获得他们所拥有的每一股B2系列普通股60瑞士法郎。
此后,B系列普通股的持有者将有权在A系列普通股和普通股持有者之前获得他们所拥有的每一股B系列普通股50瑞士法郎的奖励。
此后,A系列普通股的持有者将有权先于普通股持有者获得他们所拥有的每一股A系列普通股40瑞士法郎。
此后,其他普通股东将有权获得他们所拥有的每股普通股40瑞士法郎,然后任何剩余资产或收益将按比例分配给
所有股东。
如果没有足够的资产或收益向B3系列普通股持有人支付该金额,则可用金额将在B3系列普通股持有人之间按比例支付。
如果在B3系列股东全额支付后,
没有足够的资产或收益向B2系列普通股持有人支付该金额,则可用金额将在B2系列普通股持有人之间按比例支付。
如果在B2系列股东全额支付后,
没有足够的资产或收益向B系列普通股持有人支付该金额,则可用金额将在B系列普通股持有人之间按比例支付。
如果在B系列股东全额支付后,
没有足够的资产或收益向A系列普通股持有人支付该金额,则可用金额将在A系列普通股持有人之间按比例支付。
本公司和所有股东应尽最大努力
确保任何重大资产或整个公司的出售、清算、处置应符合税务效益,尤其是在适用的预扣税方面,并且对股东公平。
如果在以后的几轮融资中授予额外的优先股
权利,则A系列普通股、B系列普通股和B2系列普通股的持有者将在新股后面经过必要修改后获得相同的权利(考虑到各自的价格)。
B3系列普通股应与B系列普通股和B2系列普通股具有与B系列普通股和B2系列普通股相同的股东协议和组织规则下的权利和义务,从而具有与B系列普通股和B2系列普通股同等的法律地位。
截至2022年12月31日和2021年12月31日,每个系列的普通股数量如下:
| 共享类 | |
库存 | |
| 普通 | |
| 100,000 | |
| A系列 | |
| 65,000 | |
| B系列 | |
| 84,200 | |
| B2系列 | |
| 83,334 | |
| B3系列 | |
| 80,038 | |
| 总流通股 | |
| 412,572 | |
Proteomedex AG
财务报表附注
附注6--股东赤字(续)
股票期权
公司发起了一项股票期权计划(
“计划”),该计划向董事会确定的某些个人授予普通股期权。
公司所有员工和顾问都有资格获得本计划下的奖励。每项购股权的条款由
董事会决定,并由董事会批准后向承授人提供的授出通知证明。一般而言,根据本计划发行的
期权的期限少于11年,并提供四年的归属期,在此期间,承授人必须
继续为公司服务。期权通常在每年1月1日或7月1日授予,行使价由董事会
在各自的时间确定。在被授予人行使时,公司从其
法定资本中发行新的普通股以满足行使。
本公司主要向员工授予各种股票期权,作为激励性薪酬。根据该计划发行的股票使用
布莱克-斯科尔斯期权定价模型按公允价值计量,详见下文。行使时,公司从其授权资本中发行新股。以下概述截至2022年及
2021年12月31日止年度与本公司股票期权有关的活动:
| | |
| | |
| | |
| | |
加权 | |
| | |
| | |
| | |
| | |
平均值 | |
| | |
| | |
加权 | | |
| | |
剩余 | |
| | |
| | |
平均值 | | |
| | |
合同 | |
| | |
数量 | | |
锻炼 | | |
固有的 | | |
生命 | |
| | |
库存 | | |
价格 | | |
价值 | | |
(单位:年) | |
| 截至2020年12月31日的未偿还债务 | |
| 37,573 | | |
$ | 4.54 | | |
$ | 18.11 | | |
| 5.99 | |
| 授与 | |
| 23,084 | | |
| 1.10 | | |
| 33.14 | | |
| 10 | |
| 被没收/取消 | |
| (7,792 | ) | |
| 1.41 | | |
| 26.50 | | |
| 9.56 | |
| 已锻炼 | |
| - | | |
| - | | |
| - | | |
| - | |
| 截至2021年12月31日的未偿还债务 | |
| 52,865 | | |
| 3.40 | | |
| 24.57 | | |
| 8.60 | |
| 授与 | |
| - | | |
| - | | |
| - | | |
| - | |
| 被没收/取消 | |
| - | | |
| - | | |
| - | | |
| - | |
| 已锻炼 | |
| - | | |
| - | | |
| - | | |
| - | |
| 截至2022年12月31日的未偿还债务 | |
| 52,865 | | |
$ | 3.35 | | |
$ | 24.62 | | |
| 7.89 | |
| 截至2022年12月31日已授予并可行使的期权 | |
| 42,459 | | |
$ | 3.52 | | |
$ | 34.34 | | |
| 6.52 | |
在截至2022年12月31日和2021年12月31日的年度内授予的期权的公允价值是使用以下一系列假设进行估计的:
| | |
2022 | | |
2021 | |
| 行权价格 | |
$ | 1.08至27.04美元 | | |
$ | 1.10至27.42美元 | |
| 期限(年) | |
| 3 | | |
| 3 | |
| 预期股价波动 | |
| 70% | | |
| 70% | |
| 无风险利率 | |
| 1.15% | | |
| -0.73% | |
于截至2022年12月31日及2021年12月31日止年度内授予的股票期权的加权平均授予日期
分别为0美元及33.14美元。本公司根据受赠人没收的历史模式对没收进行估计,并在发生没收时予以确认。本公司采用直线
法计量与股票期权授出有关的补偿成本,该方法规定授出按发行日期的公允价值计量,相关成本按所需服务期间计量,因为期权归属,每个归属期间被视为确认补偿的单一授予。截至2022年12月31日,约有16,800份期权未归属
,其公允价值为940,702美元,将在未来期间确认为期权归属。在截至2022年12月31日和2021年12月31日的年度内,归属的股票期权的总公允价值分别约为329,000美元和68,000美元。
Proteomedex AG
财务报表附注
附注6--股东赤字(续)
累计其他综合损失
下表详细介绍了各组成部分以及公司截至2022年12月31日和2021年12月31日的累计其他综合亏损。
| | |
已定义 | | |
| | |
| |
| | |
效益 | | |
外国 | | |
| |
| | |
养老金 | | |
货币 | | |
| |
| | |
项目 | | |
项目 | | |
总计 | |
| 2020年12月31日的余额 | |
$ | - | | |
$ | 1,131 | | |
$ | 1,131 | |
| | |
| | | |
| | | |
| | |
| 改叙前的其他全面收入 | |
| 562,461 | | |
| 32,837 | | |
| 595,298 | |
| | |
| | | |
| | | |
| | |
| 从累积的其他综合收入中重新分类的金额
| |
| (164,752 | ) | |
| - | | |
| (164,752 | ) |
| | |
| | | |
| | | |
| | |
| 本期其他综合收益净额 | |
| 397,709 | | |
| 32,837 | | |
| 430,546 | |
| | |
| | | |
| | | |
| | |
| 截至2021年12月31日的余额 | |
| 397,709 | | |
| 33,968 | | |
| 431,677 | |
| | |
| | | |
| | | |
| | |
| 改叙前的其他全面收入 | |
| 475,487 | | |
| (4,986 | ) | |
| 470,501 | |
| | |
| | | |
| | | |
| | |
| 从累积的其他综合收入中重新分类的金额
| |
| (295,595 | ) | |
| - | | |
| (295,595 | ) |
| | |
| | | |
| | | |
| | |
| 本期其他综合收益净额 | |
| 179,892 | | |
| (4,986 | ) | |
| 174,906 | |
| | |
| | | |
| | | |
| | |
| 截至2022年12月31日的余额 | |
$ | 577,601 | | |
$ | 28,982 | | |
$ | 606,583 | |
下表详细说明了在截至2022年12月31日和2021年12月31日的年度中,从其他全面亏损中重新归类的金额以及随附的全面亏损报表中相关的受影响项目。
| | |
2022 | | |
2021 | | |
财务报表 |
| 项目说明 | |
金额 | | |
金额 | | |
行项目 |
| | |
| | |
| | |
|
| 摊销损益 | |
$ | 6,303 | | |
$ | - | | |
一般和行政 |
| | |
| | | |
| | | |
|
| 聚落 | |
| 289,292 | | |
| 164,752 | | |
一般和行政 |
| | |
| | | |
| | | |
|
| | |
$ | 295,595 | | |
$ | 164,752 | | |
|
Proteomedex AG
财务报表附注
附注7--界定福利养恤金计划
本公司发起了一项固定收益养老金计划,涵盖某些符合条件的员工。该计划根据服务年限和补偿水平提供退休福利。
养老金债务的价值是使用预计单位贷方(PUC)法确定的。此方法将每个服务期间视为产生额外的福利单位
权利/员工福利。在报告日期,公司在职员工的员工福利义务或预计福利义务(PBO)的价值与该日存在的权利程度的现值相同,以未来工资和养老金增加以及流动率计。养恤金领取人的养恤金债务的估值是在考虑到未来养恤金增长的情况下根据当前养恤金的现值进行的。服务成本(SC)是使用在计算的年度内赚取的员工福利权利的
现值来计算的。
在计算截至2022年和2021年12月31日的福利债务和定期福利净成本时,使用了以下重要精算假设
:
| | |
2022 | | |
2021 | |
| 贴现率 | |
| 2.30 | % | |
| 0.35 | % |
| 预期长期计划资产收益率 | |
| 2.30 | % | |
| 0.35 | % |
| 补偿增值率 | |
| 3.00 | % | |
| 3.00 | % |
这些假设的更改可能会对计划的义务和成本产生重大影响。
截至2022年12月31日和2021年12月31日的年度的定期福利净成本构成如下:
| | |
2022 | | |
2021 | |
| 服务成本 | |
$ | 157,225 | | |
$ | 218,298 | |
| 利息成本 | |
| 10,737 | | |
| 3,563 | |
| 计划资产的预期回报 | |
| (8,195 | ) | |
| (2,366 | ) |
| 摊销净(损益) | |
| (6,303 | ) | |
| - | |
| 结算(收益)/损失 | |
| (289,292 | ) | |
| (164,752 | ) |
| 总计 | |
$ | (135,828 | ) | |
$ | 54,743 | |
截至2022年12月31日和2021年12月31日的年度,公司养老金计划的累计综合亏损构成如下:
| | |
2022 | | |
2021 | |
| 净亏损(收益) | |
$ | (475,487 | ) | |
$ | (562,461 | ) |
| 净收益摊销 | |
| 6,303 | | |
| - | |
| 授产安排的效力 | |
| 289,292 | | |
| 164,752 | |
| 期内录得的合计 | |
| (179,892 | ) | |
| (397,709 | ) |
| | |
| | | |
| | |
| 总计 | |
$ | (577,601 | ) | |
$ | (397,709 | ) |
截至2022年12月31日和2021年12月31日,该计划的资金状况和资产负债表中确认的金额如下:
| | |
2022 | | |
2021 | |
| 预计福利义务 | |
$ | 1,981,655 | | |
$ | 3,321,683 | |
| 计划资产的公允价值 | |
| 1,588,015 | | |
| 2,523,207 | |
| 资金过剩(资金不足)状态 | |
$ | (393,640 | ) | |
$ | (798,476 | ) |
在截至2022年和2021年12月31日的年度内,公司对该计划的捐款分别为89,192美元和95,527美元。
Proteomedex AG
财务报表附注
附注7-固定收益养老金计划(续)
下表提供了累计福利债务的期初余额和期末余额的对账:
| 截至2020年12月31日 | |
$ | 3,681,625 | |
| 服务成本 | |
| 218,298 | |
| 利息成本 | |
| 3,563 | |
| 精算(收益)损失 | |
| (365,169 | ) |
| 已支付的福利 | |
| (22,148 | ) |
| 投稿 | |
| 1,131,779 | |
| 聚落 | |
| (1,326,265 | ) |
| 截至2021年12月31日的预计福利义务 | |
| 3,321,683 | |
| 精算(收益)/假设变化造成的损失 | |
| (173,094 | ) |
| 精算(收益)/因计划经验而产生的损失 | |
| (192,074 | ) |
| 截至2021年12月31日的累计福利义务 | |
| 2,956,515 | |
| | |
| | |
| 截至2021年12月31日 | |
| 3,321,683 | |
| 服务成本 | |
| 157,225 | |
| 利息成本 | |
| 10,737 | |
| 精算(收益)损失 | |
| (817,009 | ) |
| 已支付的福利 | |
| (20,470 | ) |
| 投稿 | |
| 220,604 | |
| 聚落 | |
| (891,115 | ) |
| 截至2022年12月31日的预计福利义务 | |
| 1,981,655 | |
| 精算(收益)/假设变化造成的损失 | |
| (594,309 | ) |
| 精算(收益)/因计划经验而产生的损失 | |
| (222,700 | ) |
| 截至2022年12月31日的累计福利义务 | |
$ | 1,164,646 | |
下表提供了计划资产的期初和期末余额
对账:
| 截至2020年12月31日 | |
$ | 2,444,559 | |
| 计划资产的实际回报 | |
| 199,755 | |
| 雇主支付的缴款 | |
| 95,527 | |
| 雇员支付的普通缴款 | |
| 95,527 | |
| 计划参与人支付的缴款 | |
| 1,036,252 | |
| 已支付的福利 | |
| (22,148 | ) |
| 聚落 | |
| (1,326,265 | ) |
| 截至2021年12月31日 | |
| 2,523,207 | |
| 计划资产的实际回报 | |
| (333,403 | ) |
| 雇主支付的缴款 | |
| 89,192 | |
| 雇员支付的普通缴款 | |
| 89,192 | |
| 计划参与人支付的缴款 | |
| 131,412 | |
| 已支付的福利 | |
| (20,470 | ) |
| 聚落 | |
| (891,115 | ) |
| 截至2022年12月31日 | |
$ | 1,588,015 | |
Proteomedex AG
财务报表附注
附注7-固定收益养老金计划(续)
截至2023年12月31日的未来五年的预计福利支出
如下:
| 截至12月31日止的年度, | |
| |
| 2023 | |
$ | - | |
| 2024 | |
| - | |
| 2025 | |
| 87,623 | |
| 2026 | |
| 88,704 | |
| 2027 | |
| 89,786 | |
| 此后 | |
| 627,421 | |
| 总计 | |
$ | 893,534 | |
附注8--关联方
如附注4所述,本公司从股东和董事会成员那里借了几笔钱。
在截至2022年12月31日和2021年12月31日的年度内,本公司向一名执行管理层成员和两名董事会成员拥有的实体支付了约319,000美元和289,000美元的专业服务。这些金额包括在随附的
全面损失表中的一般和行政费用中。
附注9--所得税
本公司已设立递延税项资产及负债,以确认未来的扣减或应课税金额及营业亏损结转。递延联邦收入
由于本年度递延税项资产或负债的变化,采用当前颁布的税法和税率确认税费或福利,该税法和税率适用于预期影响应纳税所得期的税法和税率。如有需要,可设立估值免税额,以将递延税项资产减至更有可能变现的数额。
在截至2022年12月31日和2021年12月31日的年度内,按24.85%的法定税率计算的所得税支出与按公司实际税率计算的所得税支出的对账情况如下:
| | |
2022 | | |
2021 | |
| 法定税率所得税优惠 | |
$ | (507,647 | ) | |
| (24.85 | )% | |
$ | (559,026 | ) | |
| (24.85 | )% |
| 暂时性差异 | |
| - | | |
| 0 | % | |
| - | | |
| 0 | % |
| 永久性差异 | |
| 59,955 | | |
| 2.94 | % | |
| 41,796 | | |
| 1.85 | % |
| 估值免税额 | |
| 447,692 | | |
| 21.92 | % | |
| 517,230 | | |
| 23.00 | % |
| 关于联邦所得税的规定 | |
$ | - | | |
| 0 | % | |
$ | - | | |
| 0 | % |
截至2022年12月31日,本公司有约18,361,000美元未使用净营业亏损结转用于联邦用途,可能结转长达七年。未使用的
净营业亏损结转可能会提供未来的税收优惠,尽管不能保证这些净营业亏损
将在未来实现。该等亏损结转所带来的税务优惠已由估值津贴完全抵销。这些损失
可以用来抵销未来的应税收入,如果没有完全利用,将于2023年开始到期。本公司唯一重大的递延税项资产是与其净营业亏损结转和养老基金债务相关的资产。截至2022年12月31日和2021年12月31日,公司没有重大的
递延税项负债。
Proteomedex AG
财务报表附注
注9--所得税(续)
下表详细说明了公司截至2022年12月31日的净营业亏损结转和相关的预期到期日。
| 截至12月31日止的年度, | |
| |
| 2023 | |
$ | 2,126,000 | |
| 2024 | |
| 2,647,000 | |
| 2025 | |
| 2,928,000 | |
| 2026 | |
| 3,356,000 | |
| 2027 | |
| 3,416,000 | |
| 2028 | |
| 2,240,000 | |
| 2029 | |
| 1,648,000 | |
| 总计 | |
$ | 18,361,000 | |
在适用的财政年度结束后的五年内,本公司的税款仍可由相关税务机关进行审查
。截至2022年12月31日,
唯一需要税务机关审查的开放年是截至2022年12月31日的年度。
附注10--后续活动
于2023年12月15日,母公司与本公司订立换股协议,使本公司成为母公司的全资附属公司。联交所的完成须遵守惯常成交条件
,并于2023年12月15日完成。
在换股协议完成的同时,截至2022年12月31日的所有未偿还可转换票据被转换为本公司的83,114股普通股
,然后由母公司购买。
F-102


















