

2024 年 2 月 Larimar Therapeutics Nomlabofusp (CTI-1601) 项目更新附录 99.3

本演示文稿包含前瞻性陈述,这些陈述基于Larimar Therapeutics, Inc.(“公司”)的信念和假设以及管理层目前可获得的信息。除历史事实陈述外,本演示文稿中包含的所有陈述均为前瞻性陈述,包括但不限于Larimar开发和商业化nomlabofusp(CTI-1601)和其他计划候选产品的能力、Larimar的计划研发工作,包括其nomlabofusp临床试验和总体发展计划的时机以及与Larimar的业务战略、筹集资金的能力、资本使用、经营业绩有关的其他事项财务状况以及计划和目标未来的运营。在某些情况下,你可以通过这些术语或其他类似术语的 “可能”、“将”、“可能”、“应该”、“期望”、“打算”、“预测”、“相信”、“估计”、“预测”、“项目”、“潜在”、“继续”、“持续” 或否定词语或其他类似术语来识别前瞻性陈述,尽管并非所有前瞻性陈述都包含这些词语。这些陈述涉及风险、不确定性和其他因素,这些因素可能导致实际业绩、业绩或成就与这些前瞻性陈述所表达或暗示的信息存在重大差异。这些风险、不确定性和其他因素包括Larimar产品开发活动、非临床研究和临床试验的成功、成本和时机,包括nomlabofusp的临床里程碑和与美国食品药品管理局的持续互动;初步临床试验结果可能与最终临床试验结果不同,早期的非临床和临床数据以及nomlabofusp的测试可能无法预测后来的临床试验和评估的结果或成功;美国食品药品管理局最终可能不会同意 Larimar 的观点nomlabofusp 发展战略;公共卫生危机对拉里玛未来临床试验、制造、监管、非临床研究时间表和运营以及总体经济状况的潜在影响;Larimar 和第三方制造商 Larimar 参与优化和扩展 nomlabofusp 制造流程的能力;Larimar 获得 nomlabofusp 和未来候选产品的监管批准的能力;Larimar 发展销售和营销能力的能力,无论是单独还是与潜在的未来合作者一起,以及成功将任何经批准的候选产品商业化;Larimar筹集必要资金以开展其产品开发活动的能力;以及Larimar向美国证券交易委员会(SEC)提交的文件中描述的其他风险,包括但不限于Larimar的定期报告,包括10-K表年度报告、10-Q表季度报告以及向美国证券交易委员会提交或提供并可用的8-K表最新报告在 www.sec.gov。这些前瞻性陈述是基于Larimar目前已知的事实和因素及其对未来的预测的组合,目前尚无法确定这些事实和因素。因此,前瞻性陈述可能不准确。本演示文稿中的前瞻性陈述仅代表拉里玛管理层截至本文发布之日的观点。除非法律要求,否则Larimar没有义务出于任何原因更新任何前瞻性陈述。前瞻性陈述

Nomlabofusp(CTI-1601)的 Topline 2 期数据阳性皮肤和颊细胞中组织弗拉他辛(FXN)水平的剂量依赖性增加 Nomlabofusp 在反复皮下注射长达 28 天后,总体耐受性良好。参与者使用 50 mg 治疗 14 天,然后每隔一天再治疗 14 天,直到第 28 天皮肤细胞中的基线 FXN 水平

临床阶段的新型蛋白质替代疗法平台主要候选药物nomlabofusp*(CTI-1601)是一种重组融合蛋白,旨在通过将蛋白质输送到线粒体来直接解决弗里德赖希共济失调(FA)患者的frataxin缺乏问题。在一项为期4周的安慰剂对照的2期研究和一项多升剂量的1期研究中,Nomlabofusp被授予孤儿药(美国和欧盟)、罕见儿科疾病(美国)、Fast Track(美国)和PRIME(欧盟)称号,总体耐受性良好,表现出皮肤和口腔细胞中frataxin(FXN)水平与基线相比的剂量依赖性增加 2024年第一季度,中期数据预计将于2024年第四季度公布。由于持续的局部临床试验,将提交25毫克的治疗数据供FDA审查。为了有可能增加OLE研究的剂量预计持有8,680万美元现金余额(2023年12月31日),预计现金流将持续到2025年第一季度,潜在的首种提高弗拉他辛水平的疗法一致的1期和2期研究结果打算加快批准使用短期催化剂的FDA OLE研究强劲的财务基础*截至2023年10月,nomlabofusp作为 CTI-1601 的INN(国际非专利名称)和USAN(美国采用的名称)发布。**该估计未经审计,由于我们2023财年结算程序的完成,初步和实际结果可能会有所不同。因此,不应将这一估计视为我们根据美国公认会计原则编制的完整经审计的财务报表的替代品。美国食品和药物管理局承认,FXN缺乏似乎对FA的致病机制至关重要,而且针对潜在疾病病理生理学的治疗需求仍未得到满足。支持加快批准的讨论仍在进行中。BLA 的提交计划于 2025 年下半年提交

弗里德赖希共济失调(FA):一种罕见的进展性疾病 5 * E.C. Deutsch 等人。分子遗传学与代谢 101 (2010) 238—245。根据组织、采样技术和所考虑的化验,大多数FA患者产生的frataxin水平仅为正常水平的20-40%左右*两个等位基因的遗传缺陷都会降低frataxin水平进行性疾病初期症状包括姿势不稳定和频繁跌倒,患者最终只能在轮椅上预期寿命为30-50年,通常由心脏病引起的过早死亡影响全球约2万名患者约有5,000名美国患者欧盟剩余的大多数患者约 70% 的患者在 14 岁之前就诊未获批准的疗法增加 frataxin 水平只有获准用于 FA 的治疗才能解决弗拉他辛缺乏的问题
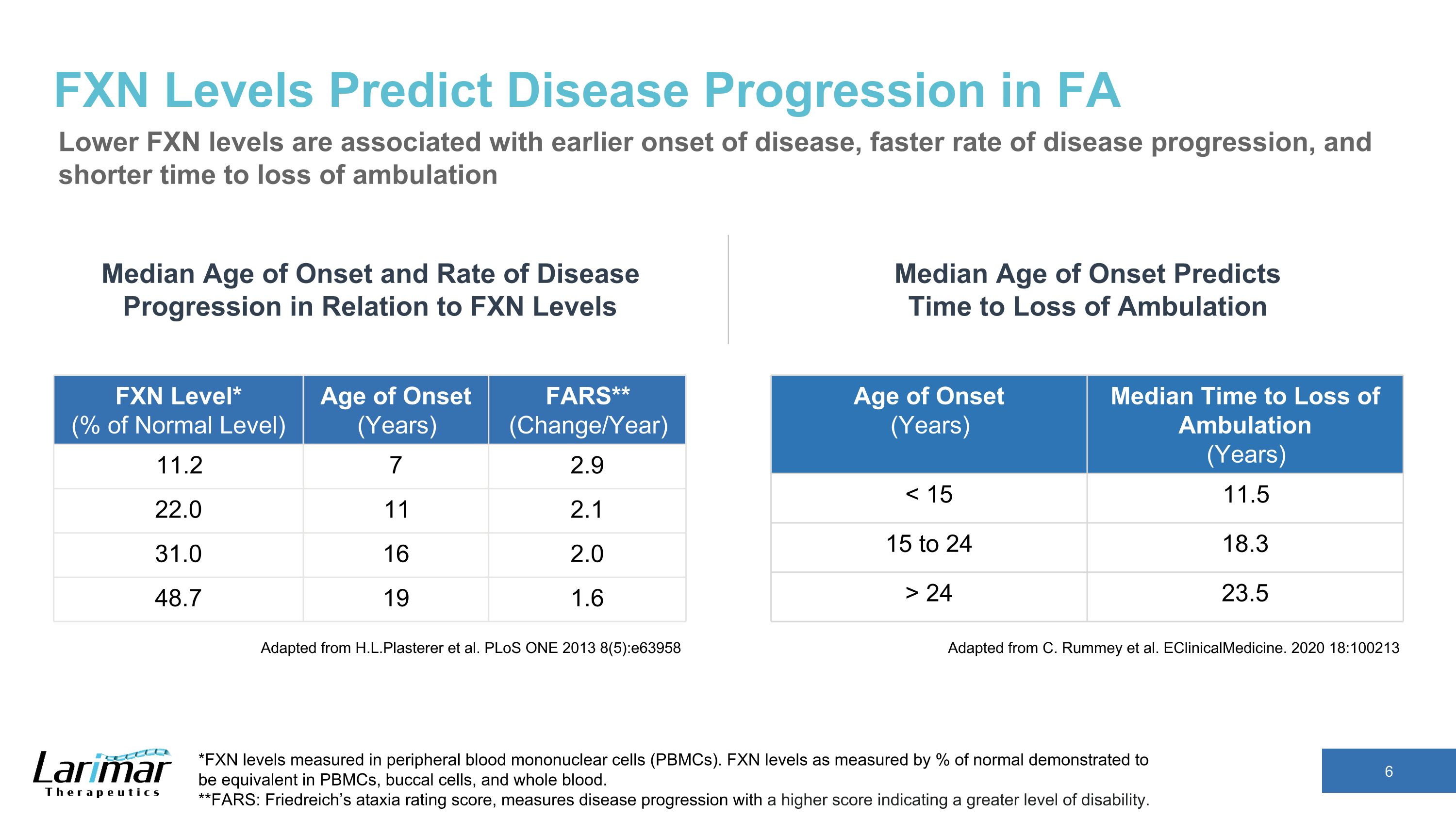
FXN 水平可预测 FA 中的疾病进展较低的 FXN 水平与较早发病、更快的疾病进展速度和更短的丧失行动时间有关。改编自 H.L.Plasterer 等人。PloS ONE 2013 8 (5): e63958 发病年龄(年)中位数无法行走的时间(年)24 23.5 发病年龄和疾病进展速度与FXN水平的平均发病年龄和进展速度 *以外周血单核细胞(PBMC)测得的FXN水平。以正常水平的百分比衡量的 FXN 水平被证明在 PBMC、口腔细胞和全血中是相同的。**FARS:弗里德赖希的共济失调评级分数用于衡量疾病进展,分数越高表示残疾程度越高。FXN 级别*(正常水平的百分比)发病年龄(年)FARS**(变化/年)11.2 7 2.9 22.0 11 2.1 2.1 31.0 16 2.0 2.0 16 2.0 2.0 2.0 2.0 2.0 2.0 48.7 19 1.6 改编自 C. Rummey 等人。eClinicalMedicine. 2020 18:100213 发病年龄中位数预测了停止行走的时间

针对 25 和 50 mg 队列的 2 期剂量探索研究目标:进一步表征 PK/PD 并评估安全性,为长期剂量和剂量方案治疗时间表提供信息-nomlabofusp (CTI-1601) 或安慰剂 28 天治疗期 16 17 18 19 15 20 21 22 23 24 25 26 27 28 2 3 4 5 1 6 7 8 9 10 11 12 13 14 = 皮下给药 nomlabofusp (CTI-1601) 或安慰剂 = 无给药研究详情人群流动和非流动性弗里德赖希共济失调患者 ≥18 岁 Nomlabofusp (CTI-1601) 治疗天真或参与过(如果符合条件)先前的 Larimar 研究剂量队列 1:25 mg 队列 2:50 mg 关键终点外周组织中的弗拉他辛水平、PK、安全性和耐受性;其他探索性终点包括脂质和基因表达水平患者人数 1:入组 13 名参与者(9 名服用 nomlabofusp;4 名使用安慰剂)队列 2:入组 15 名参与者(10 名服用 nomlabofusp;5 名服用安慰剂)
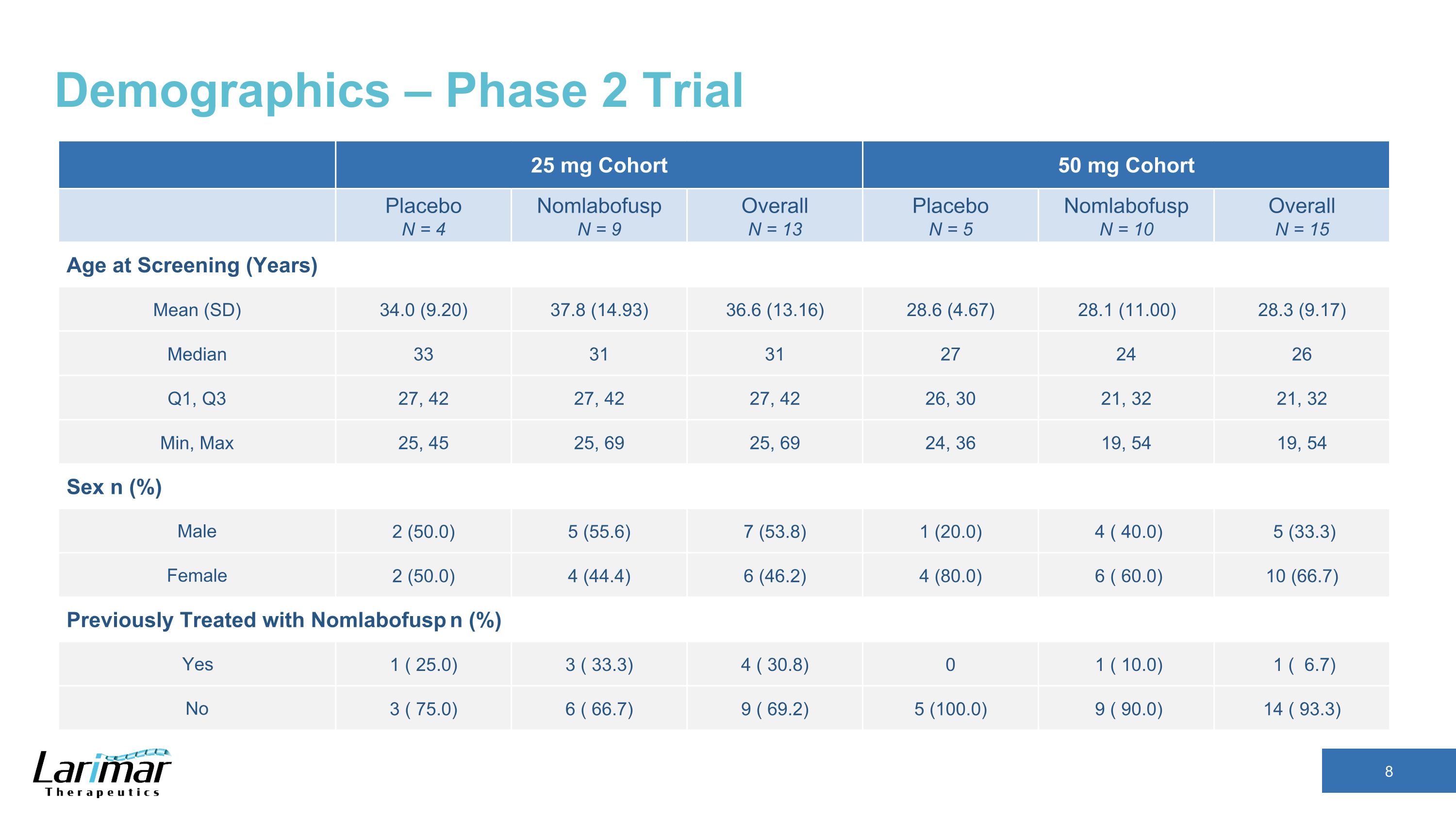
人口统计 — 2 期试验 25 mg 队列 50 mg 队列安慰剂 N = 4 Nomlabofusp N = 9 总体 N = 13 安慰剂 N = 5 Nomlabofusp N = 10 总体 N = 15 总体年龄(年)平均值(SD)34.0(9.20)37.8(14.93)36.6(4.67)28.1(11.00)28.3(9.17)中位数 33 31 31 27 24 26 Q1、Q3 27、42 27、42 27、42 26、30 21、32 min、Max 25、45 25、69 25、69 24、36 19、54 19、54 性别 n (%) 男 2 (50.0) 5 (55.6) 7 (53.8) 1 (20.0) 4 (43.3) 女 2 (50.0) 4 (43.3) 女 2 (50.0) 4 (43.3) 4.4) 6 (46.2) 4 (80.0) 6 (60.0) 10 (66.7) 之前曾接受过 Nomlabofusp n (%) 治疗过 Nomlabofusp n (%) 是 1 (25).0) 3 (33.3) 4 (30.8) 0 1 (10.0) 1 (6.7) No 3 (75.0) 6 (66.7) 9 (69.2) 5 (100.0) 9 (100.0) 9 (90.0) 14 (93.3)
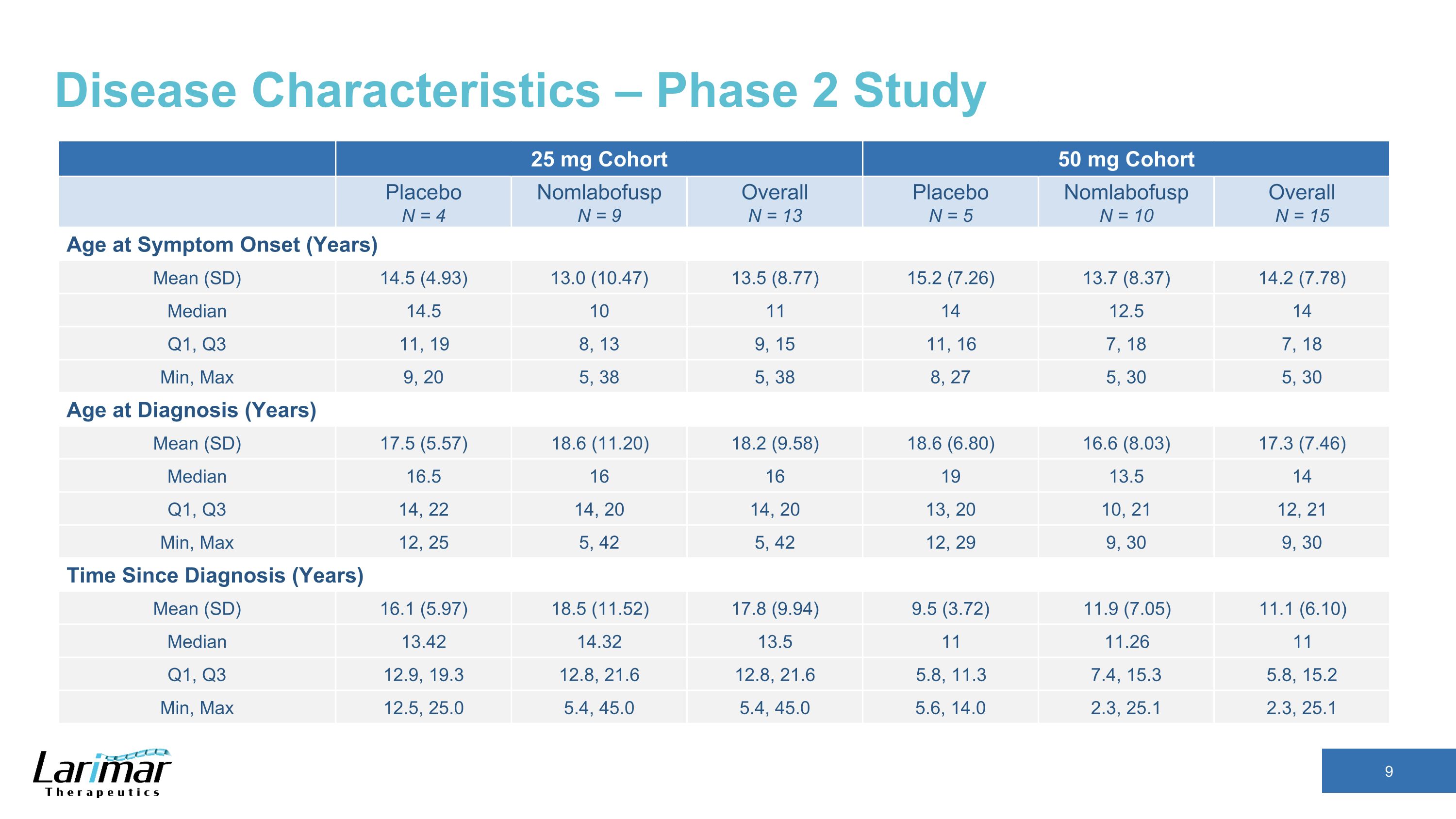
疾病特征 — 2 期研究 25 mg 队列 50 mg 队列安慰剂 N = 4 nomlabofusp N = 9 总体 N = 13 安慰剂 N = 5 Nomlabofusp N = 10 总体年龄 N = 15 症状发作时的年龄(年)平均值(SD)14.5(4.93)13.5(8.77)15.2(7.26)13.2(8.37)14.2(7.78)中位数 14.5 10 11 14 12.5 14 第一季度、第三季度 11、19 8、13 9、15 11、16 7、18 7、18 分钟、最大 9、20 5、38 5、38 8、27 5、30 5、30 诊断时年龄(年)平均值(SD)17.5(5.57)18.2(9.58)18.6(6.80)16.6(8.03)17.3 (7.46) 中位数 16.5 16 16 19 13.5 14 第一季度、第三季度 14、22 14、20 14、20 13、20 10、2112、21 分钟、最大值 12、25 5、42 5、42 12、29 9、30 9、30、30 自诊断(年)平均值(SD)16.1(5.97)18.5(11.52)17.8(9.94)9.5(3.72)11.9(3.72)11.9(7.05)11.1(6.10)中位数 13.42 14.32 13.5 11 11.26 11 第一季度、第三季度 12.9、19.3 12.8、21.6 12.8、21.6 5.8、11.3 7.4、15.3 5.8、15.2 分钟、最大值 12.5、25.0 5.4、45.0 5.4、45.0 5.4、45.0 5.6、14.0 2.3、25.1
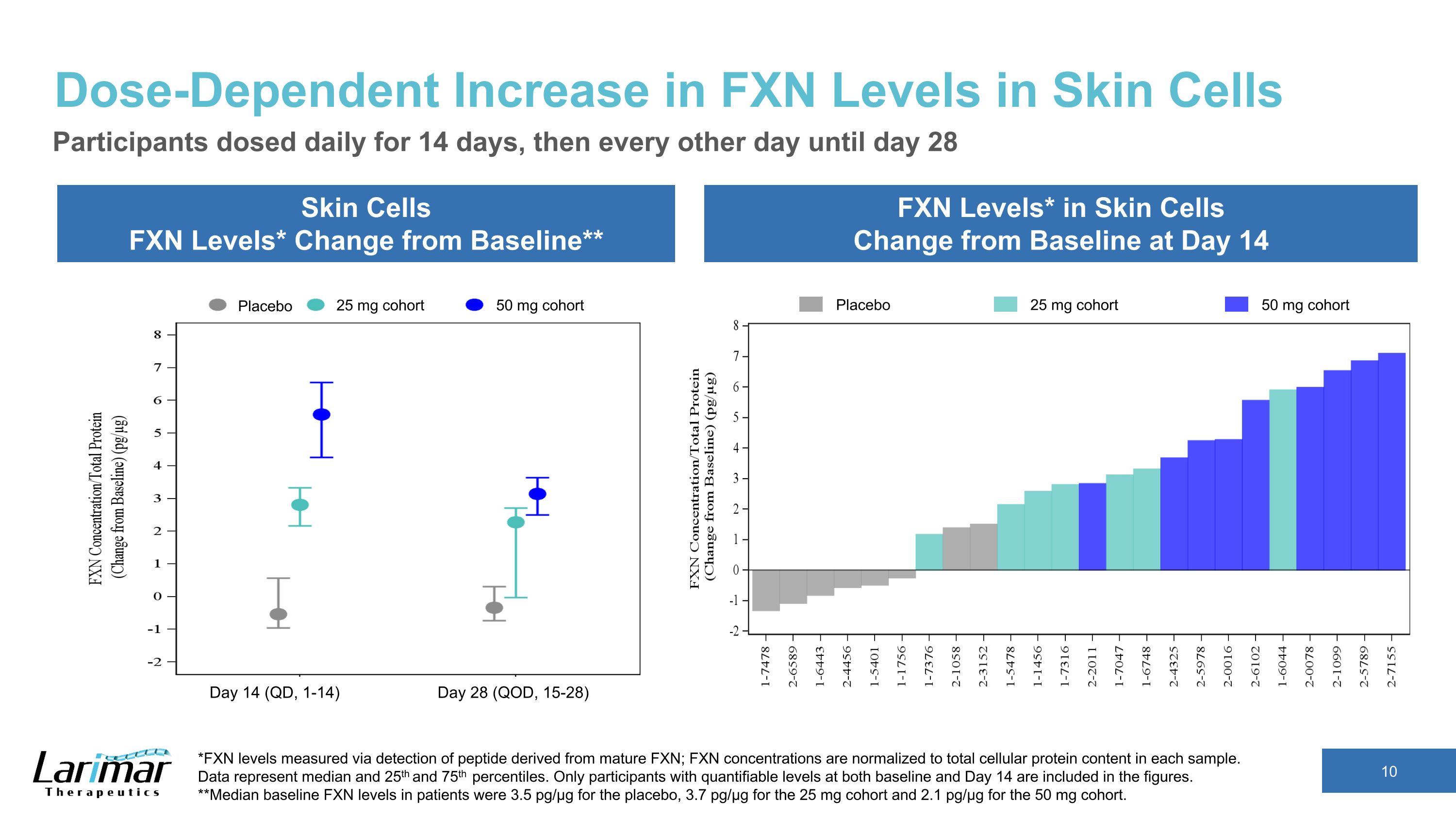
皮肤细胞中 FXN 水平的剂量依赖性增加皮肤细胞 FXN 水平* 与基线相比** FXN 水平*变化参与者在第 14 天每天给药 14 天,然后每隔一天给药一次,直到第 28 天 *FXN 水平通过检测源自成熟 FXN 的肽测量;FXN 浓度归一化为每个样本中的细胞蛋白总含量。数据代表中位数、第 25 和第 75 个百分位数。数字中仅包括基线和第14天均具有可量化水平的参与者。**安慰剂患者的基线FXN水平中位数为3.5 pg/µg,25 mg队列的3.7 pg/µg,50 mg队列的2.1 pg/µg。安慰剂 25 mg 队列 50 mg 队列安慰剂 25 mg 队列 50 mg 队列第 14 天(QD,1-14)第 28 天(QD,15-28)
口腔细胞中FXN水平的剂量依赖性增加口腔细胞FXN水平*与基线的变化**口腔细胞中的FXN水平*与基线的变化参与者在第14天每天给药14天,然后每隔一天给药直到第28天*通过检测源自成熟FXN的肽测得的FXN水平;FXN浓度归一化为每个样本中的细胞蛋白总含量。数据表示中位数以及第 25 和第 75 个百分位数。数字中仅包括基线和第14天均具有可量化水平的参与者。**安慰剂患者的基线FXN水平中位数为2.1 pg/µg,25 mg队列的1.8 pg/µg,50 mg队列的1.6 pg/µg。安慰剂 25 mg 队列 50 mg 队列安慰剂 25 mg 队列 50 mg 队列第 14 天(QD,1-14)第 28 天(QD,15-28)
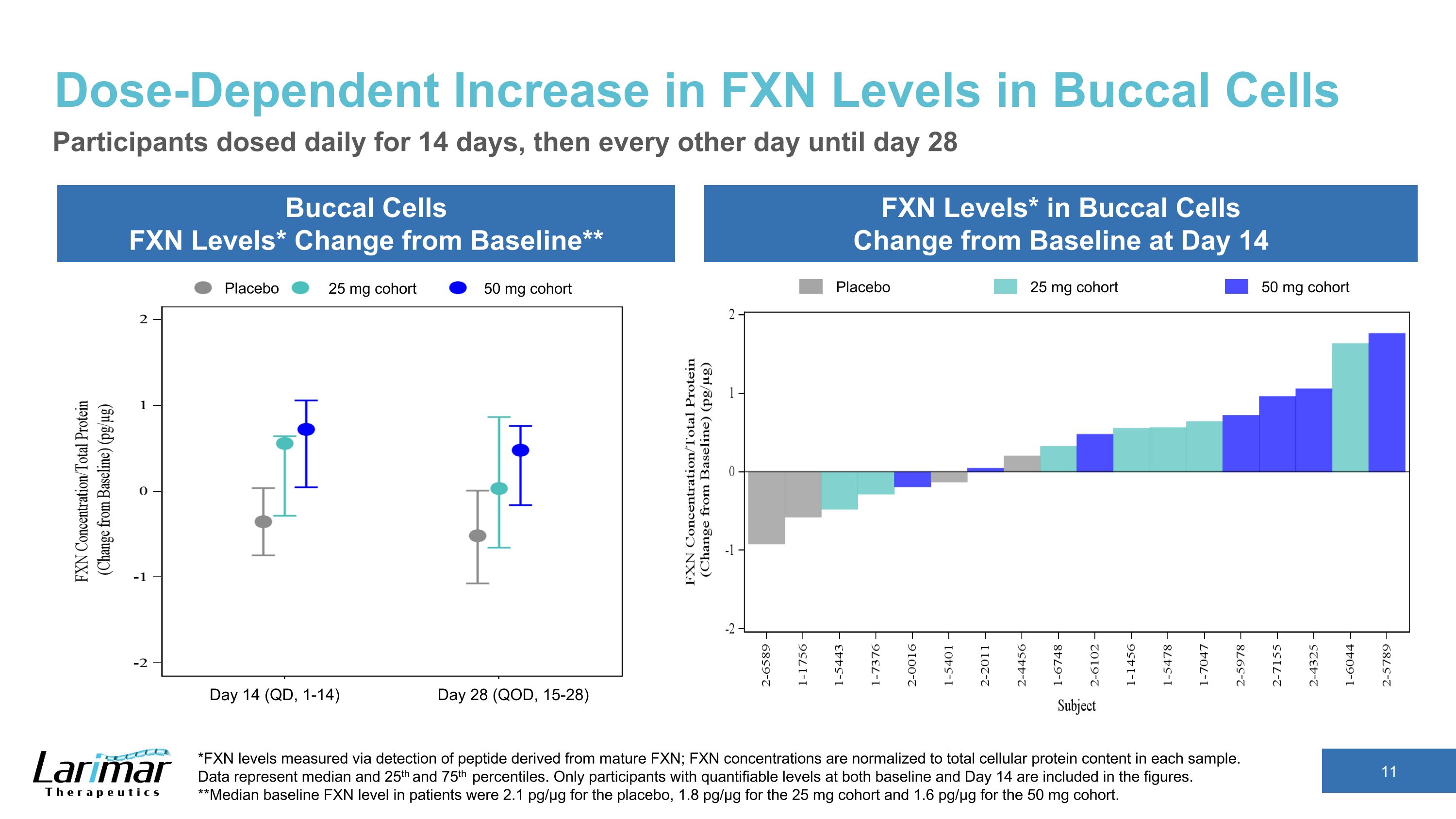
皮肤 FXN 水平的绝对增加第 14 天皮肤 FXN 水平剂量访问绝对值 (pg/µg) 中位平均值 25 mg 基线 3.70 3.38 天 14 5.53 6.40 与基线的变化 2.81 3.02 50 mg 基线 2.12 2.08 第 14 天 7.40 7.32 与基线的变化 5.57 5.24 组织剂量反应 FXN 浓度以及给药后与基线相比的增加仅包括在基线、第 14 天和第 28 天具有可量化水平的参与者在表格中。第 28 天皮肤 FXN 水平剂量访问绝对值 (pg/µg) 中位数平均值 25 mg 基线 3.70 3.38 天 28 4.39 4.80 与基线的变化 2.28 1.41 50 mg 基线 2.12 2.08 天 28 5.23 5.24 与基线的变化 3.14 3.17
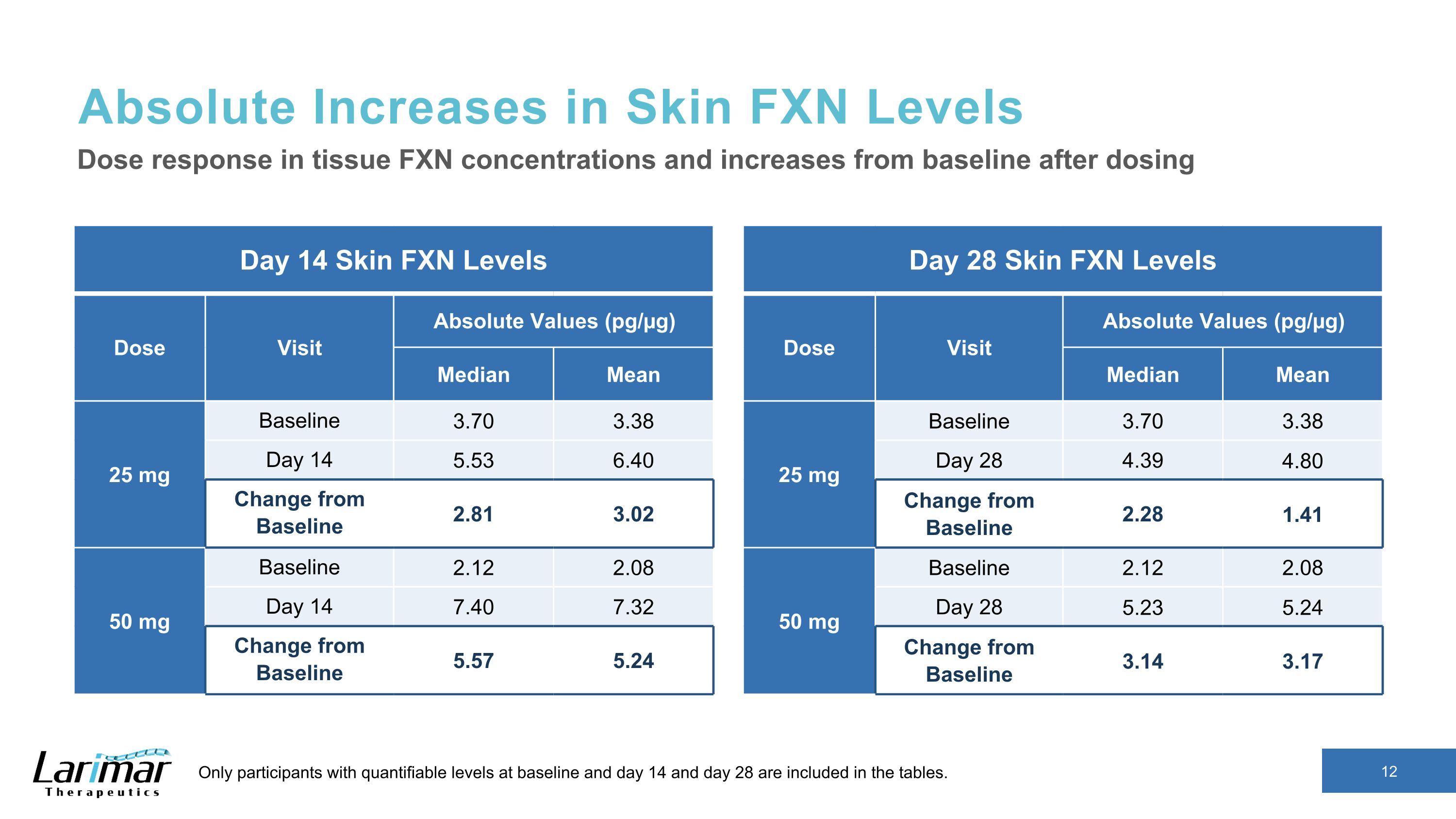
Buccal FXN 水平的绝对增加第 14 天 Buccal FXN 水平剂量访问绝对值 (pg/µg) 中位数平均值 25 mg 基线 1.78 1.80 天 14 2.24 2.22 与基线的变化 0.56 0.42 50 mg 基线 1.61 1.69 第 14 天 2.44 2.38 与基线相比的变化 0.72 0.69 组织剂量反应以及给药后与基线相比的增加只有在基线和第 14 天有可量化水平的参与者以及第 28 天包含在表格中。第 28 天 Buccal FXN 水平剂量就诊绝对值 (pg/µg) 中位数平均值 25 mg 基线 1.70 1.65 天 28 1.73 1.76 与基线的变化 0.03 0.11 50 mg 基线 1.76 1.77 第 28 天 2.15 2.15 与基线的变化 0.48 0.38
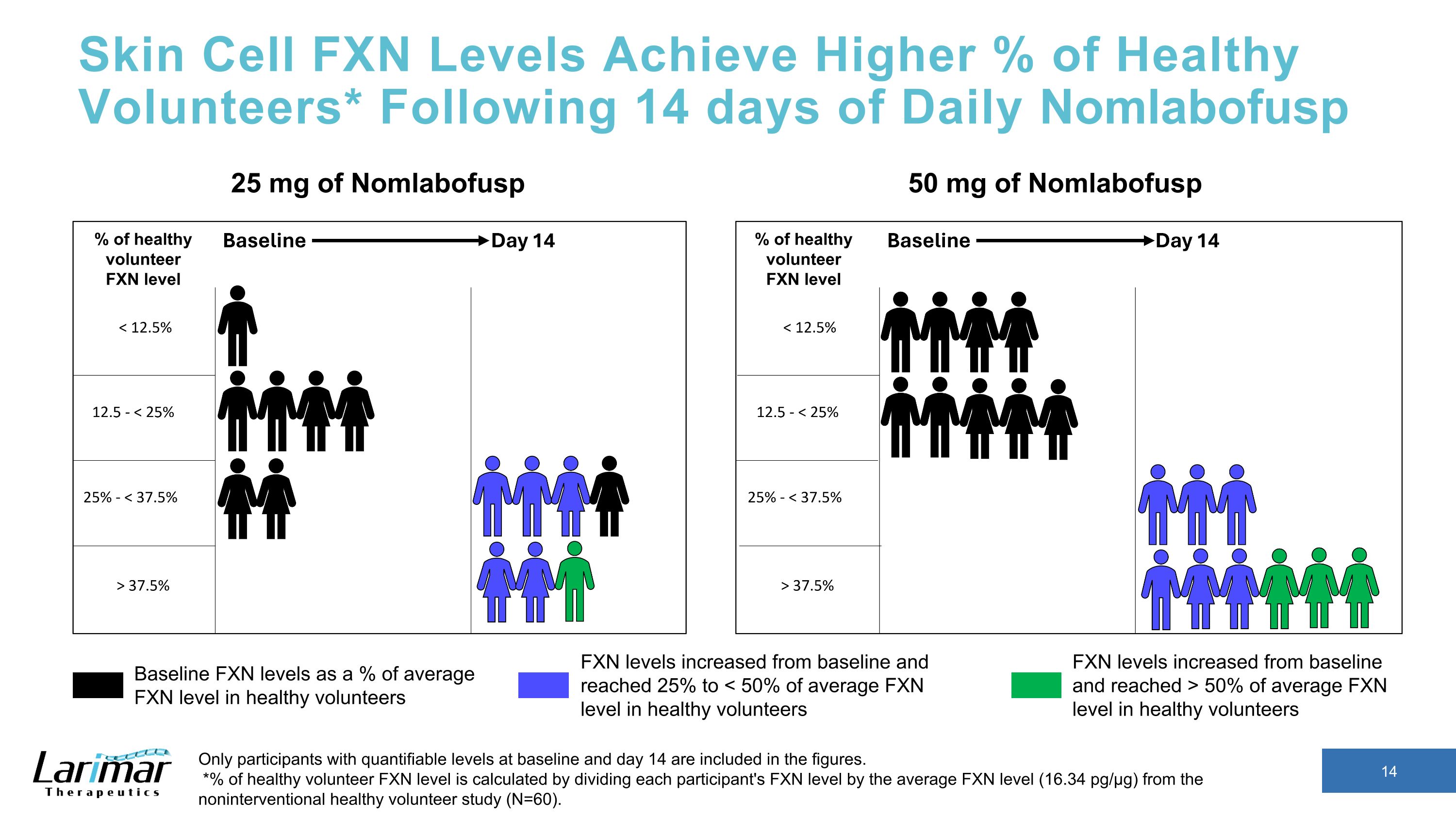
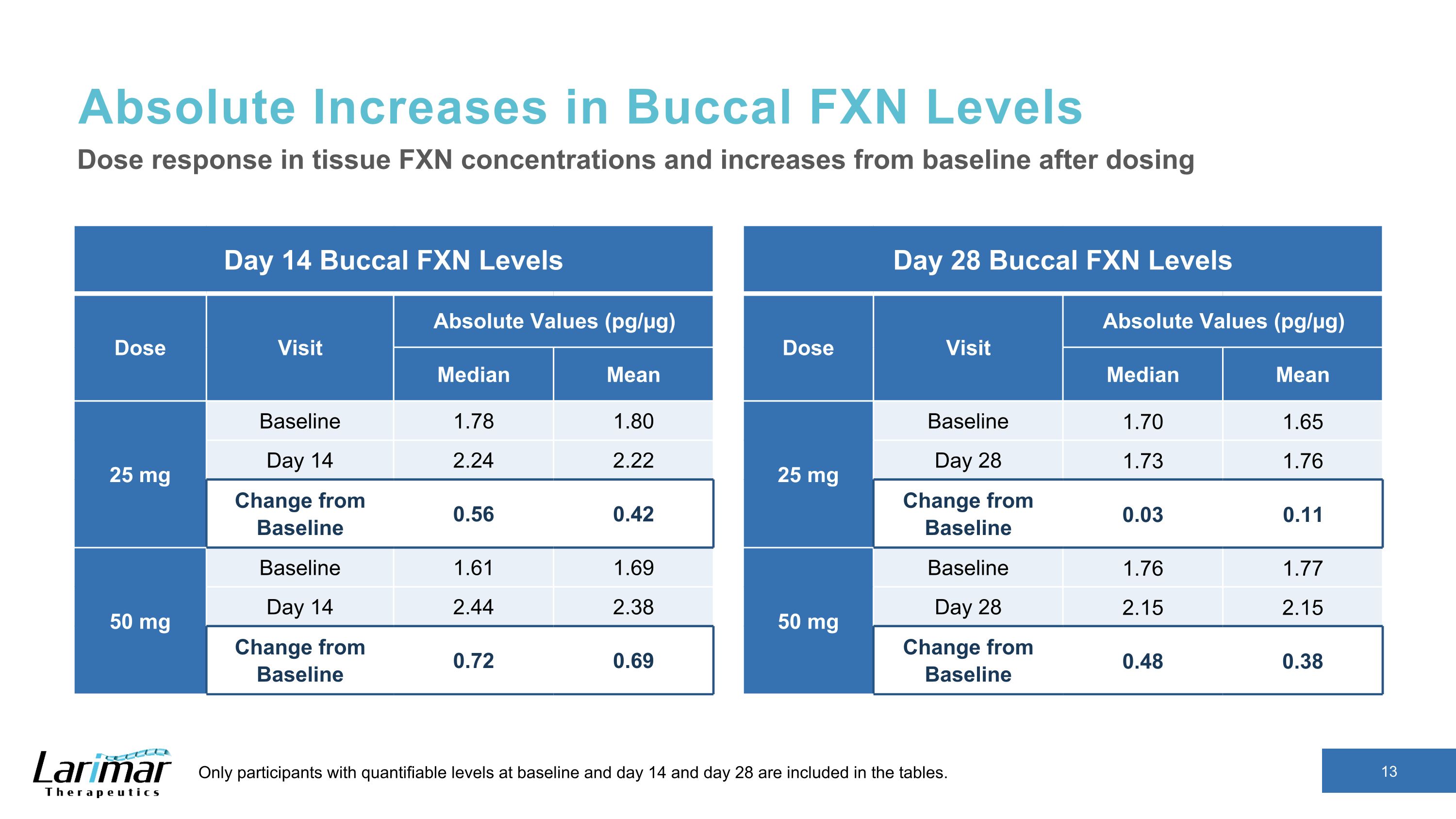
皮肤细胞 FXN 水平达到更高的健康志愿者百分比* 每日 Nomlabofusp 14 天后,数字中仅包含基线和第 14 天可量化水平的参与者。*健康志愿者 FXN 水平的百分比是通过将每位参与者的 FXN 水平除以非介入性健康志愿者研究(N = 60)的平均 FXN 水平(16.34 pg/µg)计算得出。25 mg Nomlabofusp 50 mg 的 Nomlabofusp 基线 FXN 水平占健康志愿者平均 FXN 水平的百分比 FXN 水平高于基线,达到平均 FXN 水平的 50% 以上健康志愿者 FXN 水平从基线提高到 25% 至
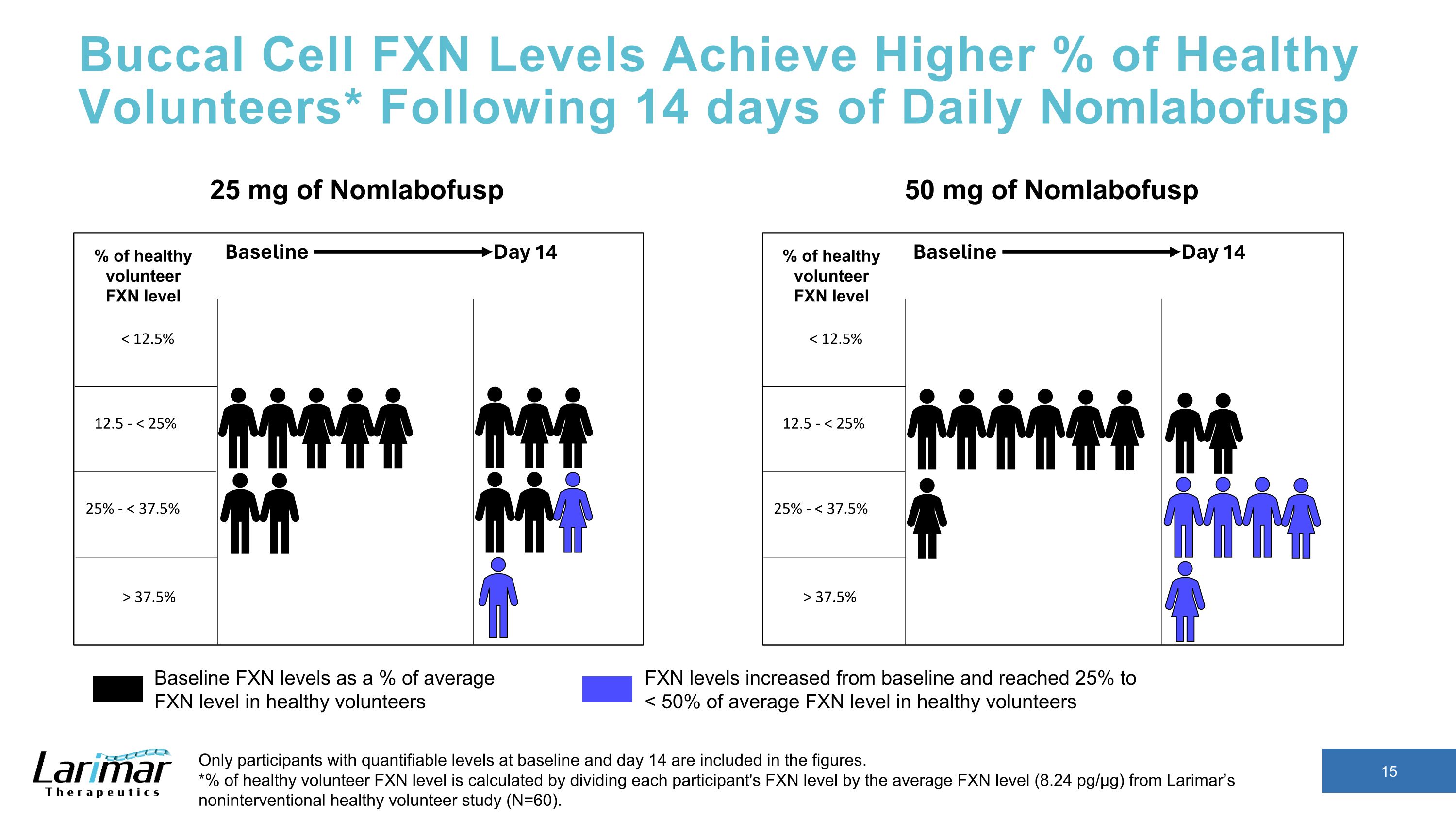
口腔细胞 FXN 水平达到更高的健康志愿者百分比* 在每日服用 Nomlabofusp 14 天后,数字中仅包含基线和第 14 天可量化水平的参与者。*健康志愿者 FXN 水平的百分比是通过将每位参与者的FXN水平除以拉里玛非干预性健康志愿者研究(N = 60)中的平均FXN水平(8.24 pg/µg)计算得出。50 mg Nomg labofusp 基线 FXN 水平占健康志愿者平均 FXN 水平的百分比 FXN 水平从基线上升并达到 25% 至
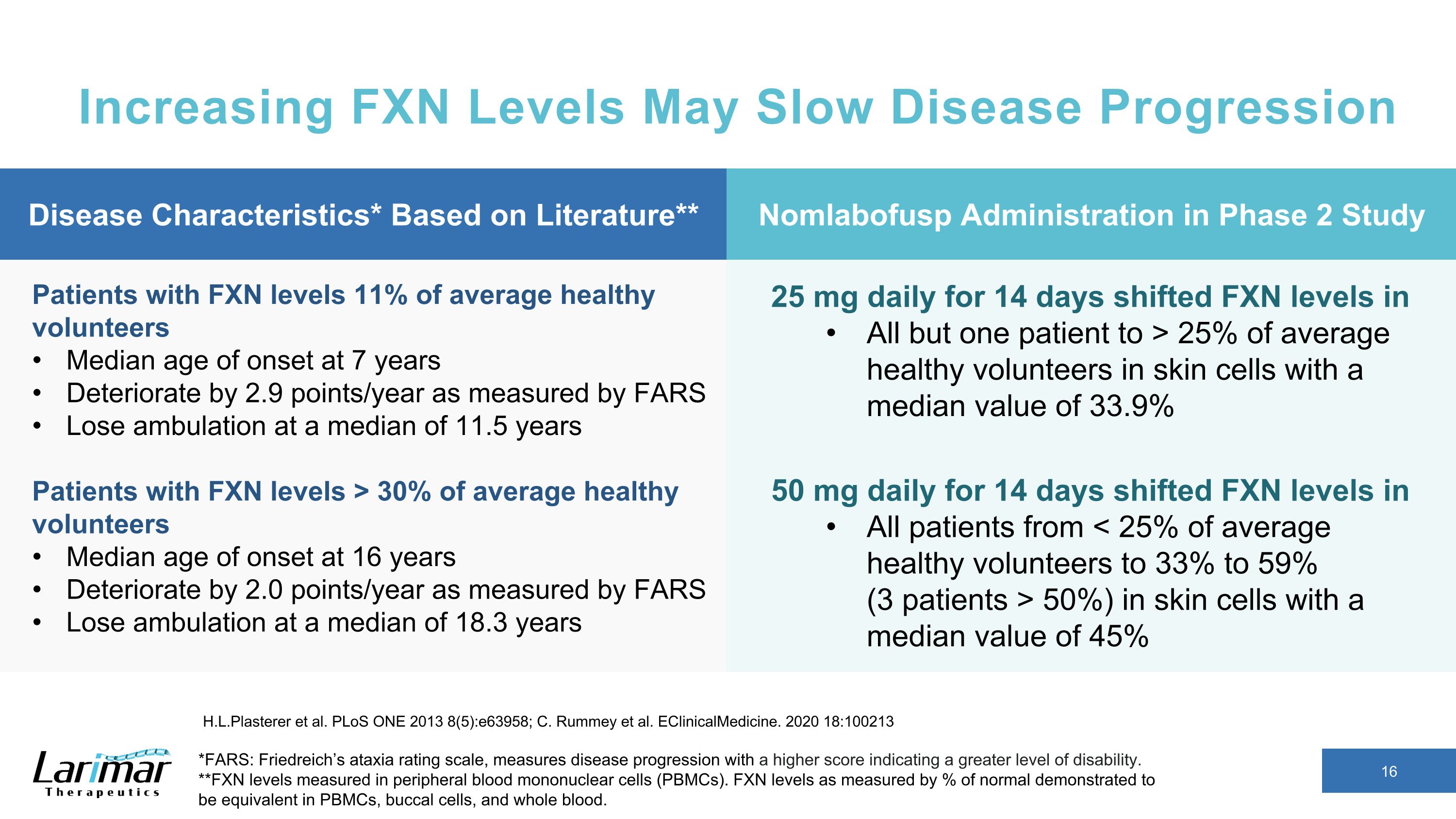
提高FXN水平可能会减缓疾病进展 *FARS:弗里德赖希的共济失调评级量表以较高的分数来衡量疾病进展,表示残疾程度越高。**在外周血单核细胞 (PBMC) 中测得的 FXN 水平。以正常水平的百分比衡量的 FXN 水平被证明在 PBMC、口腔细胞和全血中是相同的。H.L.Plasterer 等人PLoS ONE 2013 8 (5): e63958;C. Rummey 等人eClinicalMedicinicalMedicine。2020 18:100213 FXN 水平的患者平均健康志愿者的 11% 发病年龄中位数在 7 岁时恶化了 2.9 个百分点/年下降平均值为 11.5 岁 FXN 水平的患者平均发病年龄在 16 岁时发病年龄中位数恶化 2.0 个百分点每天 18.3 岁 25 mg,持续 14 天将除一名患者外所有患者的 FXN 水平转移到皮肤细胞中平均健康志愿者的 25% 以上,14 名患者中位数为 33.9%,每天 50 mg天数使所有患者的皮肤细胞中的FXN水平从50%(50%)发生了变化,疾病特征中位数为45%*基于文献** Nomlabofusp在2期研究中给药的Nomlabofusp

鼓励 Nomlabofusp 的治疗潜力继续 nomlabofusp 临床开发多项研究中使用 nomlabofusp 使弗拉他辛水平的剂量依赖性增加 Frataxin 缺乏是疾病的根本原因较低的弗拉他辛水平与疾病负担相关动物模型表明,增加弗拉他辛会减轻临床结果

Nomlabofusp:可预测的药代动力学皮下给药后快速吸收 1 2 3 观察到的暴露量与剂量成比例的增加 cc 药代动力学特征与 1 期研究一致

Ph1 和 Ph2 数据:Nomlabofusp 的耐受性总体良好 46 名服用 nomlabofusp 的临床试验参与者中,有 44 名完成了各自的研究 25 mg 队列中的一名 2 期参与者因过敏反应通过标准治疗而退出 50 mg 队列中的一期受试者因轻度至中度恶心和呕吐而退出 61 名患者参与了我们的 1 期和 2 期研究,没有出现任何严重的不良事件 labofusp 临床研究。一种严重的不良事件(过敏反应通过下文提及的标准治疗得到缓解)。最常见的不良事件(AE)为轻度和中度注射部位反应(ISR)。没有因ISR而中止研究,且均已解决
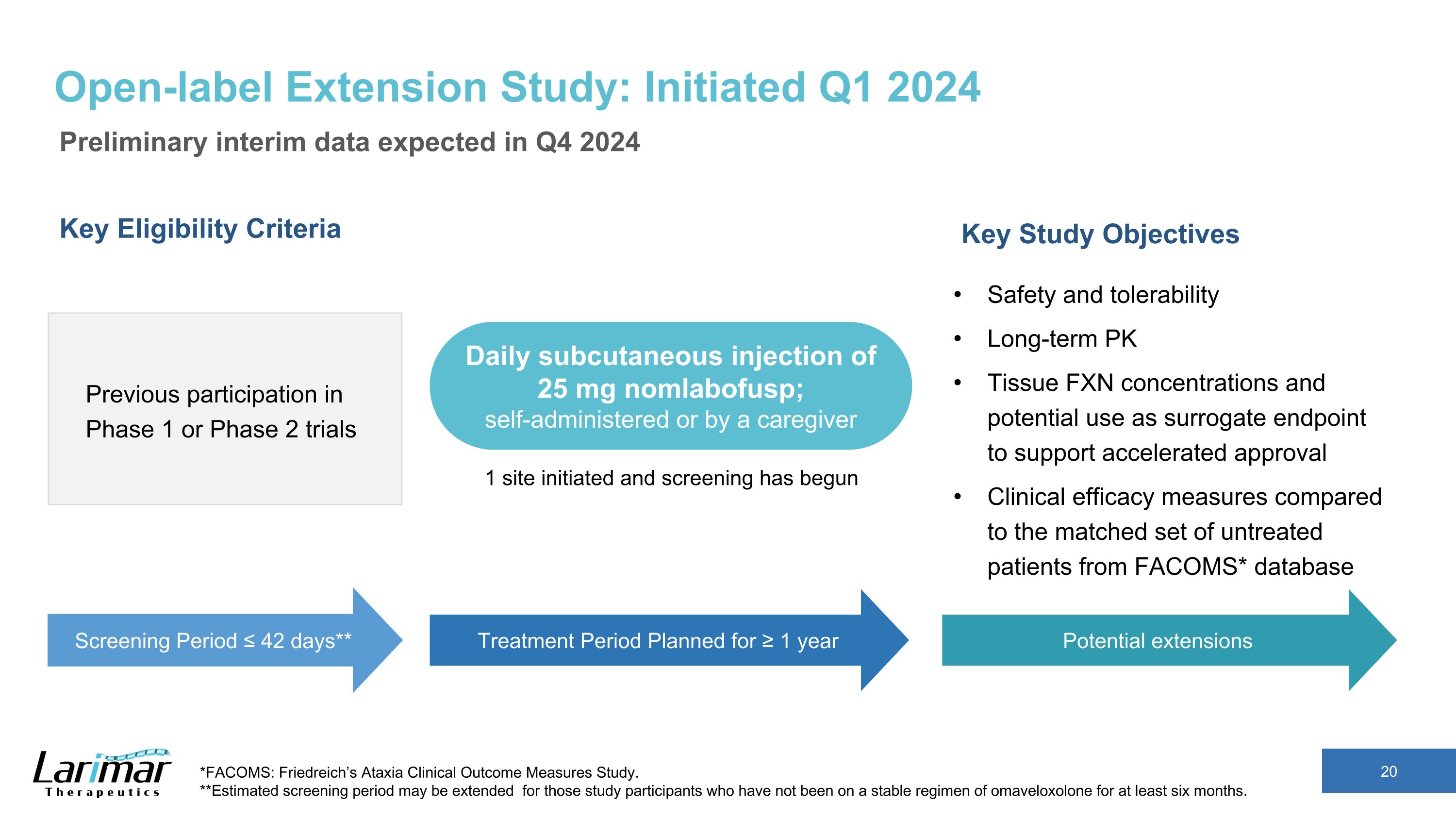
开放标签延期研究:2024年第一季度启动初步中期数据预计将于2024年第四季度公布关键资格标准先前参与的1期或2期试验关键研究目标安全性和耐受性长期PK组织FXN浓度以及可能用作替代终点以支持加快批准的替代终点与FACOMS*数据库中未经治疗的患者相比临床疗效衡量标准*FACOMS:弗里德赖希的共济失调临床结果衡量研究。**对于那些至少六个月未接受稳定奥马维洛索龙疗法的研究参与者,预计筛查期可能会延长。筛查期 ≤ 42 天** 治疗期计划为 ≥ 1 年每日皮下注射 25 mg nomlabofusp;自行给药或由护理人员注射 1 个部位已启动筛查已开始可能延长

Nomlabofusp 临床开发计划计划进行全球双盲安慰剂对照注册/确认研究** 计划在 2 至 17 岁患者中进行儿科 MAD 试验* 打算加快批准路径,预计在 2025 年下半年提交 BLA *公司正在与 FDA 讨论如何最好地将 2 至 17 岁的患者纳入临床开发。**公司开始与美国食品和药物管理局讨论FXN级别在支持加速批准方面的作用。此外,该公司正计划与美国以外的监管机构和调查人员进行讨论,将临床项目扩展到国际地区。由于部分临床搁置,其他美国临床试验的启动取决于美国食品药品管理局对临床数据的审查。正在进行的开放标签延期研究,对参与SAD、MAD和/或为期四周的剂量探索研究的符合条件的患者,每日剂量为25 mg OLE BLA提交的目标是2025年下半年有资格筛查OLE试验的参与者初始数据预计将于2024年第四季度发布

2024年第一季度监管更新:2024年第四季度OLE研究中首位患者的剂量:来自OLE研究的初步数据;启动于2024年第一季度2024年下半年:最终的2阶段数据计划在2025年下半年的会议上公布:BLA提交预期里程碑一致的Ph1和Ph2研究结果启动了与FDA的讨论以支持加快批准的意向加速批准,可能在2025年下半年提交BLA开始准备工作将 nomlabofusp 临床项目扩展到美国以外的地区 Nomlabofusp 通常是在长达 4 周的测试剂量下耐受性良好 50 mg 队列中 FXN 水平与基线相比的剂量依赖性升高皮肤细胞中的基线 FXN 水平为