
根据规则424(B)(4)提交
注册号:333-276502
| 招股说明书 |
1,375,000股普通股
3,750,000系列认股权证购买最多3,750,000股普通股
1,875,000股B系列认股权证购买最多1,875,000股普通股
2,375,000股预筹资金 认股权证最多购买2,375,000股普通股
800万股普通股作为标的 A系列权证、B系权证和预筹资权证
150,000份配售代理认股权证购买最多150,000股普通股
15万股普通股作为标的 配售代理认股权证

Cingate Inc.
我们 发行1,375,000股普通股,每股票面价值0.0001美元,连同A系列认股权证,购买最多3,750,000股普通股,我们将其称为“A系列认股权证”,以及B系列认股权证,购买最多1,875,000股普通股,我们将其称为“B系列认股权证”,公开发行价格为每股2美元,并附带认股权证。A系列认股权证和B系列认股权证在下文中称为“认股权证”。我们的普通股每股将与一份A系列认股权证和一份B系列认股权证一起出售,A系列认股权证购买一股普通股,B系列认股权证购买一半普通股。A系列认股权证的行权价格为每股2.00美元,并可立即行权。A系列认股权证将于发行之日起五年内到期。B系列认股权证的行权价为每股2.00美元,并可立即行使。 B系列认股权证将在发行之日起两年内到期。本招股说明书亦与发行A系列及B系列认股权证后可发行的普通股股份有关。
我们 也向那些在本次发售中购买我们普通股股份的投资者(如果有)提供机会,使该投资者 连同其关联公司和某些关联方在本次发售完成后实益拥有我们已发行普通股超过4.99%(或在投资者选择时为9.99%) ,有机会购买普通股 ,否则将导致投资者的实益所有权超过4.99%(或在投资者选择时为9.99%), 预资金权证,每份以0.0001美元的行使价购买我们普通股的一股,我们称之为“预资金权证”。每份预先出资的认股权证在发行时即可行使,并将在全部行使时到期。每个预筹资权证 将与一份A系列认股权证和一份B系列认股权证一起出售,前者购买一股普通股,后者购买一半 普通股。每份预筹资权证和随附认股权证的公开发行价等于本次发行中向公众出售的普通股和随附认股权证的每股价格减去0.0001美元。本招股说明书还涉及在行使预筹资认股权证时可发行普通股的发售。
此 产品将于2024年2月14日终止,除非我们决定在该日期之前终止产品(我们可以随时酌情终止) 。我们将对在此次发行中购买的所有证券进行一次成交。在本次发行期间,每股 股(或预融资权证)和配套认股权证的综合公开发行价将保持不变。
普通股及/或预筹资权证的股份及随附的认股权证只能在本次发售中一并购买,但将会 分开发行,并可于发行后立即分开。
We have engaged H.C. Wainwright & Co., LLC, or the placement agent, to act as our exclusive placement agent in connection with this offering. The placement agent has agreed to use its reasonable best efforts to arrange for the sale of the securities offered by this prospectus. The placement agent is not purchasing or selling any of the securities we are offering and the placement agent is not required to arrange the purchase or sale of any specific number or dollar amount of securities. We have agreed to pay to the placement agent the placement agent fees set forth in the table below, which assumes that we sell all of the securities offered by this prospectus. Since we will deliver the securities to be issued in this offering upon our receipt of investor funds, there is no arrangement for funds to be received in escrow, trust or similar arrangement. There is no minimum offering requirement as a condition of closing of this offering. Because there is no minimum offering amount required as a condition to closing this offering, we may sell fewer than all of the securities offered hereby, which may significantly reduce the amount of proceeds received by us, and investors in this offering will not receive a refund in the event that we do not sell an amount of securities sufficient to pursue our business goals described in this prospectus. In addition, because there is no escrow account and no minimum offering amount, investors could be in a position where they have invested in our company, but we are unable to fulfill all of our contemplated objectives due to a lack of interest in this offering. Further, any proceeds from the sale of securities offered by us will be available for our immediate use, despite uncertainty about whether we would be able to use such funds to effectively implement our business plan. See the section entitled “Risk Factors” for more information. We will bear all costs associated with the offering. See “Plan of Distribution” on page 137 of this prospectus for more information regarding these arrangements.
我们 于2023年11月30日实施了20股1股的反向股票拆分,据此,我们每20股已发行和已发行普通股 被重新分类为一股普通股。反向股票拆分不影响我们普通股的面值或我们普通股的 法定股数。除非另有说明,本招股说明书中的所有股票和每股信息都进行了调整,以反映反向股票拆分。
我们的 普通股在纳斯达克上挂牌交易,代码为“CING”。我们普通股2024年2月2日在纳斯达克的收盘价为每股1.33美元。预融资权证、A系列权证或B系列权证还没有成熟的公开交易市场,我们预计不会发展这样的市场。我们不打算申请在任何证券交易所或其他国家认可的交易系统上市预融资权证、A系列权证或B系列权证。如果没有活跃的交易市场,预融资权证、A系列权证和B系列权证的流动性将受到限制。
根据美国证券交易委员会适用的规则,我们 是一家“新兴成长型公司”,并将遵守降低的上市公司报告要求。
投资 我们的证券具有高度投机性,涉及高度风险。请参阅本 招股说明书第7页开始的“风险因素”,以了解投资我们的证券时应考虑的信息的讨论。
| 每股及附随认股权证 | 每份预付资金的认股权证和随附的认股权证 | 总计 | ||||||||||
| 公开发行价 | $ | 2.00 | 1.9999 | $ | 7,499,762.50 | |||||||
| 安置代理费(1) | $ | 0.1560 | 0.1560 | $ | 585,000.00 | |||||||
| 扣除费用前的收益给我们(2) | $ | 1.8440 | 1.8439 | $ | 6,914,762.50 | |||||||
| (1) | 我们 已同意向配售代理支付相当于本次发行所筹总收益7.8%的现金费用。我们还同意向配售代理偿还与其发售相关的某些费用,包括最高50,000美元的非责任 费用报销、最高100,000美元的法律费用和费用,以及15,950美元的结算费用。此外,吾等已同意发行配售代理或其指定人认股权证,按每股2.50美元的行使价购买相当于本次发售中出售的普通股股份的4.0%的普通股 股份(包括行使预付资权证后可发行的普通股股份),行使价为每股2.50美元,相当于公开发售价格及随附认股权证的125%。有关安置代理将收到的补偿的说明,请参阅“分配计划 ”以了解更多信息。 |
| (2) | 由于本次发行没有最低证券数量或募集金额作为完成发行的条件,因此目前无法确定实际的公开发售金额、配售代理费和向我们提供的募集资金(如果有),可能会大大低于上述总的最高发售金额。有关详细信息,请参阅“分配计划”。 |
美国证券交易委员会或任何州证券委员会都没有批准或不批准这些证券,也没有因本招股说明书的准确性或充分性而通过 。任何相反的陈述都是刑事犯罪。
在满足惯常的成交条件的前提下,本次发售的证券预计将于2024年2月6日左右交割。
H.C. Wainwright & Co.
本招股说明书的日期为2024年2月2日。
目录表
| 页面 | |
| 招股说明书摘要 | 1 |
| 供品 | 5 |
| 风险因素 | 7 |
| 有关前瞻性陈述的警示性说明 | 58 |
| 市场价格和股利信息 | 59 |
| 生意场 | 60 |
| 管理层对财务状况和经营成果的讨论与分析 | 100 |
| 担保所有权和某些受益所有人和管理 | 115 |
| 某些关系和关联人交易 | 117 |
| 管理 | 119 |
| 高管和董事薪酬 | 121 |
| 收益的使用 | 128 |
| 稀释 | 129 |
| 股本说明 | 130 |
| 我们提供的证券说明 | 133 |
| 配送计划 | 137 |
| 法律事务 | 140 |
| 专家 | 140 |
| 在那里您可以找到更多信息 | 141 |
| 财务报表索引 | F-1 |
您 应仅依赖此招股说明书中包含的信息。未授权任何人向您提供与本招股说明书中包含的信息 不同的信息。本招股说明书的日期为本招股说明书封面所列日期。您不应 假设本招股说明书中包含的信息在该日期以外的任何日期都是准确的。
对于美国以外的投资者:我们没有采取任何措施允许在除美国以外的任何司法管辖区发行或拥有或分发本招股说明书。您必须告知 您自己,并遵守与此次发行和分发本招股说明书相关的任何限制。
| i |
招股说明书 摘要
此 摘要重点介绍了本招股说明书中其他部分包含的信息,并不包含您在做出投资决策之前应考虑的所有信息。在投资我们的证券之前,您应该仔细阅读整个招股说明书,包括本招股说明书中的“风险因素”部分。如果任何风险成为现实,我们的业务、财务状况、经营业绩和前景都可能受到实质性的不利影响。在这种情况下,我们的证券价格可能会下跌,而您 可能会损失部分或全部投资。除非我们另有说明或文意另有所指外,术语“我们”、“我们”、“我们的业务”、“本公司”及“cingate”均指及类似的参考 指:(1)于重组合并(定义见下文)完成之时或之后,包括本公司首次公开招股在内,向cingate Inc.及其合并附属公司,包括cingate Treateutics LLC,或CTX;及(2)于重组合并(包括我们的首次公开发售)完成前,向CTX及其合并附属公司。
概述
我们 是一家生物制药公司,使用我们专有的Precision定时释放TM(“PTRTM“)药物 提供平台技术,以构建和推进下一代药物产品管道,旨在改善患有以繁重的日常给药方案和次优治疗为特征的常见诊断疾病患者的生活 。我们最初的重点是注意力缺陷/多动障碍(ADHD)的治疗,我们正在确定并评估其他治疗领域,在这些领域,我们的PTR技术可能被用于开发未来的候选产品,例如焦虑症 。我们的PTR平台采用了专有的侵蚀阻隔层(“EBL”),旨在允许以特定的、预定义的时间间隔释放药物物质,从而释放每日一次、多剂量片剂的可能性。
我们的目标是ADHD治疗市场,截至2023年11月,美国市场规模估计超过230亿美元,其中186亿美元可归因于兴奋剂 。兴奋剂是治疗ADHD的最常见的处方类药物,约占美国所有ADHD处方的88%。相比之下,非兴奋剂药物通常只在二线或辅助治疗环境中使用,约占所有ADHD药物处方的12%。缓释或长效刺激性药物剂型最常被用作ADHD的一线治疗药物,约占ADHD市场总支出的160亿美元,占所有兴奋剂处方的54%。这些缓释剂 大多数都被批准在早上每天给药一次,旨在消除白天重复给药的需要。然而, 使用目前的‘每日一次’缓释剂型,大多数患者仍然会在当天晚些时候(通常是下午早些时候)接受第二剂或“助推剂” 剂量,以实现有效日覆盖,并因此遭受多种不良副作用 。我们认为,在当前的治疗模式中,存在着重大的、未得到满足的需求,即真正的每日一次的ADHD刺激性药物,其持续时间可提供整个有效日覆盖范围,并可改善副作用,以更好地满足患者众多未得到满足的需求。
我们正在开发两种专有的一线兴奋剂药物:CTX-1301(醋酸二甲酯)和CTX-1302(右旋苯丙胺), 用于治疗三个主要患者群体的ADHD:儿童(6-12岁)、青少年(13-17岁)和成人(18岁以上)。CTX-1301和CTX-1302旨在通过以下方式解决目前批准的兴奋剂疗法的主要缺点:提供立即起效(在30分钟内);提供“整个工作日”的持续时间;消除了对“助推剂/恢复” 剂量的短效兴奋剂药物的需求;最大限度地减少或消除与早期药物“磨损”相关的反弹/崩溃症状; 并提供良好的耐受性,同时控制药物血液水平的下降。此外,我们相信,通过取消多达60%的ADHD患者与其主要药物一起使用的‘助推器’剂量,我们相信我们的候选产品将提供 重要的社会和经济效益:减少与短效兴奋剂药物相关的滥用和转移;允许医生开一种药物而不是两种;允许患者为一种药物而不是两种药物付费;允许付款人报销一种药物而不是两种药物。
| 1 |
最近的发展
债务转换
2022年8月,我们发行了以Werth Family Investment Associates LLC(“WFIA”)为受益人的500万美元(“原始本金”)本票(“原始票据”),并于2023年5月发行了修订和重新发行的本票(“WFIA票据”) 将原始票据下的本金金额增加了300万美元至800万美元。2023年9月8日,Cingate Inc.和CTX 与WFIA订立票据转换协议,据此,WFIA同意将WFIA票据项下的原始本金金额连同其所有应计利息,或5,812,500美元,转换为预资金权证(“9月WFIA预资资权证”) ,以按每份预资资权证的转换价17.00美元购买341,912股普通股。
于2024年1月25日,吾等 与WFIA订立票据转换协议(“2024年1月票据转换协议”),并将余下的300万美元本金加所有应计利息,或3,287,500美元转换为预资金权证(“2024年1月WFIA预资资权证”) ,按每份2024年1月WFIA预资资权证的转换价4.785美元购买687,043股普通股(“2024年1月债务转换”)。我们普通股在2024年1月24日的收盘价为4.35美元。1月份的WFIA预筹资认股权证没有到期日,可立即以每股0.0001美元的行使价行使,条件是根据交易法第13(D)条的规定,WFIA及其关联公司将实益拥有不超过我们普通股已发行股份的19.99% 。在转换剩余本金金额加上其所有应计利息及发行预付资金认股权证后,本公司已悉数支付WFIA票据,本公司根据 WFIA票据并无其他责任。
任命首席财务官
2024年1月25日,我们任命詹妮弗·L·卡拉汉为我们的高级副总裁兼首席财务官。Callahan女士将担任我们的首席财务官和首席会计官。关于Callahan女士的任命,CTX于2024年1月25日与Callahan女士签订了雇佣协议。雇佣协议规定了每年35万美元的基本工资。然而,鉴于2023年12月15日披露的成本控制措施,Callahan女士的年度基本工资减少了40%,降至21万美元。 与此相关,我们将在CTX-1301的新药申请向联邦药品管理局提交日期 三个月后的日期向Callahan女士支付一笔金额,相当于截至支付 因减薪而未支付给她的基本工资的美元总额加上减薪金额的20%。此外,卡拉汉有资格获得年度奖金,目标金额为卡拉汉年度基本工资的25%(25%)。每笔奖金的实际金额将由我们的薪酬委员会自行决定,并将根据我们的业绩 和首席执行官建议的Callahan女士的个人业绩来确定。
授权演练和自动取款机销售
从2023年10月1日开始至本招股说明书发布之日止的这段时间内,投资者已行使我们若干已发行的预付资金认股权证,购买260,261股我们的普通股(该等行使,即“认股权证行使”)。
于 自2023年10月1日起至本招股说明书日期止期间,吾等根据与H.C.Wainwright&Co.,LLC订立的市场发售协议(“ATM协议”),售出283,800股普通股,净收益为3,115,303美元(“ATM销售”)。
反向拆分股票
我们于2023年11月30日实施了20股1股的反向股票拆分,据此,我们每20股已发行和已发行普通股被重新分类 为1股普通股。反向股票拆分对我们普通股的面值或我们普通股的授权数量没有影响。除非另有说明,否则本招股说明书中的所有股票和每股信息都将进行调整,以反映反向股票拆分。
| 2 |
正在进行 关注
本次发售是以最大努力进行的,我们出售的证券可能少于所有在此发售的证券,从本次发售中获得的净收益也可能大幅减少。我们相信,根据我们目前的业务计划,此次发行的净收益加上我们手头的现金, 将满足我们到2024年第二季度末的资本需求。此次发行后, 我们将需要筹集更多资金来支持我们的运营,并继续支持我们计划的开发和商业化活动 。
纳斯达克
我们的普通股和权证目前已在纳斯达克挂牌交易。2023年5月16日,我们收到纳斯达克上市资格 工作人员(以下简称“工作人员”)的通知,通知我们不再符合《纳斯达克证券市场上市规则》第5550(B)(1)条(“最低股东权益规则”)规定的250万美元的最低股东权益要求,无法继续上市。我们于2023年6月30日向纳斯达克提交了合规计划。2023年7月28日,纳斯达克 证券市场通知我们,它批准延长至2023年11月13日,以重新遵守最低股东权益规则,条件是实现之前提交给纳斯达克证券市场的合规计划中包括的某些里程碑,包括筹集额外资本的计划。于2023年11月14日,吾等收到纳斯达克的函件,指示 基于吾等持续违反最低股东权益规则,职员决定根据吾等要求在纳斯达克聆讯小组(下称“委员会”)进行聆讯,将吾等的证券从纳斯达克退市。
We timely requested a hearing before Panel and Nasdaq granted our request. At the Panel hearing, which is expected to take place in February 2024, we will submit our plan to regain compliance, as well as our ability to sustain long-term compliance, with all applicable requirements for continued listing on Nasdaq, including compliance with the Minimum Stockholders’ Equity Rule and the Independent Director Rule (defined below). The delisting action by the Staff will be stayed pending the hearing and the expiration of any additional extension period granted by the Panel following the Panel hearing. We intend to continue to take definitive steps in an effort to evidence compliance with the Minimum Stockholders’ Equity Rule, the Independent Director Rule and other Nasdaq listing requirements; however, there can be no assurance that the Panel will grant our request for continued listing or that we will be able to evidence compliance with the Minimum Stockholders’ Equity Rule, the Independent Director Rule and other Nasdaq listing requirements within any extension period that may be granted by the Panel. Even if we regain compliance with the Minimum Stockholders’ Equity Rule, to remain listed we will need to evidence the ability to maintain long term compliance with the Minimum Stockholders’ Equity Rule.
2023年7月28日,我们收到纳斯达克股票市场的通知,表明我们没有遵守 将每股最低买入价维持在1.00美元才能继续在纳斯达克上市的要求。根据纳斯达克上市规则第5810(C)(3)(A)条,我们获得了180个日历 天的合规期,自通知之日起或至2024年1月24日,以重新遵守最低成交报价要求。2023年11月30日,我们对我们的普通股进行了反向拆分, 2023年12月15日,我们收到纳斯达克股票市场的通知,我们已经重新遵守了最低收盘价 投标价格要求。不能保证我们将继续遵守最低收盘价要求 或其他纳斯达克上市要求。
于2023年12月26日,我们收到一封员工函件,表示基于三名董事会成员分别于2023年12月12日及2023年12月13日辞职,我们不再遵守董事上市规则第5605条(“独立董事规则”)所载的独立纳斯达克上市委员会、审计委员会、薪酬委员会及纳斯达克对董事提名的独立监督规定。我们的董事会目前由两名董事组成,他们都不是独立的。
| 3 |
我们 正在寻找潜在的新董事,并打算在小组听证会之前展示在遵守独立董事规则方面的进展 。不能保证我们会重新遵守《董事独立规则》。
我们 必须满足纳斯达克的持续上市要求,其中包括最低股东权益规则 和独立董事规则 ,否则将有可能对我们的业务产生重大不利影响的风险退市。如果我们的普通股和认股权证从纳斯达克退市,可能会大幅减少我们的普通股和认股权证的流动性,并导致我们的普通股和认股权证的价格相应 大幅下降,原因是与纳斯达克相关的市场效率丧失 和失去联邦证券法的优先购买权。此外,退市可能会损害我们以我们可以接受的条款或根本不接受的条款通过替代融资来源筹集资金的能力,并可能导致投资者、供应商、客户和员工 潜在地失去信心,减少业务发展机会。如果我们的普通股和认股权证被摘牌,我们的普通股和认股权证可能更难买卖或获得准确的报价,我们的普通股和认股权证的价格可能会大幅下跌 。退市还可能削弱我们以可接受的条件筹集资金的能力,如果有的话。
我们的 组织结构
Cingate Inc.是特拉华州的一家公司,成立时是一家控股公司。关于我们的首次公开募股,我们完成了 某些组织交易。2021年9月29日,Cingate通过将Cingate的全资收购子公司与CTX合并(“重组合并”),收购了Cingate Treateutics LLC或CTX。作为重组合并的结果,CTX成为cingate的全资子公司。除另有说明或上下文另有规定外,本招股说明书中的所有信息均反映重组合并的完成。
企业信息
我们的主要执行办公室位于西47号1901号这是Pace,堪萨斯城,堪萨斯州66205,我们的电话号码是(913)9422300.我们的网站地址是Www.cingulate.com。我们网站 上包含的或可以通过其访问的信息不是本招股说明书的一部分,不应作为本招股说明书的一部分或在决定是否购买我们的证券时考虑。
Cingate、PTR、Cingate Treeutics、Enfoqis、Enfoqus、Trodesca、Ivoqus、Taylerza、Tymprezi、Finish、Master和我们的徽标是本招股说明书中使用的一些商标。本招股说明书还包括属于其他 组织财产的商标、商号和服务标志。仅为方便起见,本招股说明书中提及的我们的商标和商标名可能不带®和 ™符号,但这些引用并不意味着我们不会根据适用法律在最大程度上主张我们或适用许可人对这些商标和商标名的权利。
作为一家新兴成长型公司的影响
作为一家在我们最近结束的财年收入低于12.35亿美元的公司,我们符合《2012年快速启动我们的企业创业法案》或《JOBS法案》中所定义的“新兴成长型公司”的资格。新兴成长型公司可能会利用免除某些报告要求和其他一般适用于上市公司的负担的优势。这些规定 包括:
| ● | 减少财务数据方面的债务,包括在本招股说明书中仅列报两年的经审计财务报表和仅两年的选定财务数据; | |
| ● | 遵守经修订的《2002年萨班斯-奥克斯利法案》第404条或《萨班斯-奥克斯利法案》的审计认证要求的例外情况。 | |
| ● | 减少在定期报告、委托书和注册说明书中披露高管薪酬安排;以及 | |
| ● | 豁免 就高管薪酬或黄金降落伞安排举行不具约束力的咨询投票的要求。 |
我们 可能会利用长达五年的豁免或更早的时间,使我们不再是一家新兴的成长型公司。因此, 此处包含的信息可能与您从您持有股票的其他上市公司收到的信息不同。 我们将在以下最早出现的情况下停止成为新兴成长型公司:(1)我们的年度毛收入超过12.35亿美元的会计年度的最后一天;(2)2026年12月31日;(3)我们被认为是1934年证券交易法(经修订)或交易法中定义的“大型加速申报公司”的日期;以及(4)我们在之前的三年期间发行了超过10亿美元的不可转换债务证券的日期。
就业法案还允许我们作为一家新兴成长型公司利用延长的过渡期来遵守适用于上市公司的新会计准则或修订后的会计准则,从而允许我们推迟采用这些准则,直到这些准则适用于非上市公司。我们已不可撤销地选择利用这一豁免,因此,我们将不会 遵守与其他非新兴成长型公司的上市公司相同的新或修订的会计准则。
| 4 |
产品
下面的 摘要包含有关此产品的基本信息。本摘要由本招股说明书中包含的更详细信息 完整限定。在对我们的证券作出投资决定之前,您应仔细阅读整个招股说明书,包括“风险因素”、“管理层对财务状况和经营结果的讨论和分析”项下的信息,以及本招股说明书其他部分包含的财务报表。
| 发行普通股 | 1375,000股。 | |
| 提供预先出资的 认股权证 | 我们 还向投资者提供预融资认股权证,以购买最多2,375,000股普通股,而这些投资者在本次发行中购买我们普通股的股份将导致该投资者及其关联公司和某些关联方 在本次发行完成后实益拥有我们已发行普通股的4.99%以上(或在投资者选择时,为9.99%),以取代否则将导致该超额的普通股。每个预先出资的权证将与一份A系列认股权证和一份B系列认股权证一起出售,前者购买一股普通股,后者购买一半的普通股 。每份预筹资权证和附属认股权证的综合公开发行价等于本次发行中出售的普通股和附属认股权证的每股综合公开发行价减去0.0001美元,而每份预先出资认股权证的行使价将为每股0.0001美元。本招股说明书 还涉及在行使预筹资认股权证时可发行普通股的发行。有关更多信息,请参阅我们提供的证券说明 。 | |
| 认股权证 提供 | 每股普通股或预筹资权证将与一份A系列认股权证和一份B系列认股权证一起发售,前者用于购买一股普通股 ,后者用于购买一半的普通股。A系列认股权证的行使价为每股2.00美元,并可立即行使。A系列认股权证将于发行之日起五年内到期。B系列认股权证的行权价为每股2.00美元,并可立即行使。 B系列认股权证将在发行之日起两年内到期。有关更多信息,请参阅《我们提供的证券说明》。 | |
| 普通股 本次发行前的未偿还股票(1) | 1,450,171股。 | |
| 本次发行后的普通股 (1) | 5,200,171股,假设所有预筹资金的认股权证均已行使,且未行使任何认股权证。 | |
| 使用收益的 | 我们估计,在扣除配售代理费和估计发售开支后,假设 不行使认股权证,是次发售的净收益约为650万美元。我们打算将从此次发行中获得的所有净收益用于CTX-1301的持续研发和商业化活动,以及营运资本、资本支出和一般企业用途,包括进一步投资于研发工作。我们相信,根据我们目前的业务计划,此次发行的净收益加上我们手头的现金, 将满足我们到2024年第二季度末的资本需求。此次发行后,我们将需要筹集更多资金来支持我们的运营,并继续 以支持我们计划的开发和商业化活动。请参阅“收益的使用”。 |
| 5 |
| 纳斯达克 资本市场符号 | 我们的 普通股在纳斯达克上挂牌交易,代码为“CING”。我们不打算申请在任何证券交易所或其他国家认可的交易系统上市预融资的 权证、A系列权证或B系列权证。如果没有活跃的交易市场,预融资权证、A系列权证和B系列权证的流动性将受到限制。 | |
| 锁定 | 除某些例外情况外,我们所有的董事和高管已同意,在本次发售结束后的90天内,不得直接或间接出售、转让或处置我们的任何普通股或可转换为或可行使或可交换为我们普通股的证券。有关更多信息,请参阅“分配计划”。 | |
| 配售 代理权证 | 我们 已同意向配售代理或其指定人发行认股权证或配售代理认股权证,以购买最多4.0% 本次发行中出售的普通股股份总数(包括 预先注资认股权证的行使),行使价相当于每股公开发售价的125%及随附认股权证 在这次发售中出售。配售代理权证将于发行时可行使,并将于开始后五年届满 在此优惠下的销售。有关更多信息,请参见“分销计划”。 | |
| 风险因素 | 投资 我们的证券涉及高度风险,并可能导致您的全部投资损失。请参阅“风险因素” 从本招股说明书第7页开始,讨论您在决定投资前应仔细考虑的因素 我们的安全。 |
(1) 本次发行后立即发行的普通股数量是基于截至2024年1月25日的1,450,171股普通股 ,不包括截至该日的以下股票:
| ● | 73,647 行使时可发行的普通股股份 根据我们的2021年股权激励计划(“2021年计划”)发行的未行使股票期权的加权平均行使 每股59.72美元; | |
| ● | 174,479 我们的普通股股份 根据2021年计划,未来发行; | |
| ● | 786,710 行使认股权证时可发行的普通股,加权平均行使价为每股46.40美元;以及 | |
| ● | 1,028,955 行使时可发行的普通股 的预先注资认股权证,加权平均行使价为每股0.0007314元。 |
除非 另有明确说明或文义另有所指,否则本招股章程中的所有资料均假设(i)本公司并无发行预拨资金认股权证 及(ii)本招股章程所提呈的认股权证并无行使。
| 6 |
风险因素
Investment in our securities involves risk. You should carefully consider the following risk factors in addition to the other information included in this prospectus, including matters addressed in the section entitled “Cautionary Note Regarding Forward-Looking Statement.” These risk factors are not exhaustive, and investors are encouraged to perform their own investigation with respect to our business, financial condition and prospects. We may face additional risks and uncertainties that are not presently known to us, or that we currently deem immaterial, which may also impair our business or financial condition. If any of these risks actually occur, our business, financial condition and results of operations could be materially and adversely affected and we may not be able to achieve our goals, the value of our securities could decline and you could lose some or all of your investment. Additional risks not presently known to us or that we currently believe are immaterial may also significantly impair our business operations. If any of these risks occur, our business, results of operations or financial condition and prospects could be harmed. In that event, the market price of our common stock and the value of the warrants could decline, and you could lose all or part of your investment. The following discussion should be read in conjunction with the financial statements and notes to the financial statements included herein.
风险总结
以下总结了可能对我们产生重大不利影响的主要风险和不确定性。您应结合 下面对每个风险因素的更详细描述阅读本摘要。
| ● | 我们 是一家经营历史有限的生物制药公司,需要额外资本来继续运营,包括 推进和商业化我们的候选产品。 | |
| ● | 我们 已经产生了经营亏损的历史,并预计将继续在可预见的未来产生大量成本。我们是 目前没有盈利,我们可能永远不会实现或维持盈利。 | |
| ● | 以下 此次发行,我们将需要筹集大量额外资金以继续运营,包括完成开发 以及CTx-1301、CTx-1302和/或CTx-2103的商业化努力。如果我们无法筹集到额外的资本,我们可能会 要求寻求破产保护或其他可能导致我们的证券持有人失去部分或全部 他们对我们的投资。 | |
| ● | 如果 如果我们未能重新遵守纳斯达克的持续上市要求,我们的普通股和/或认股权证可能会被摘牌 我们的普通股和/或认股权证的价格以及我们进入资本市场的能力可能会受到负面影响。 | |
| ● | 我们 主要取决于我们的候选产品CTx-1301和CTx-1302的成功开发和商业化, ADHD治疗和CTx-2103治疗焦虑症,这两种药物均处于产品/早期临床开发阶段 (CTx-2103)、临床开发(CTx-1301)或计划用于未来产品开发(CTx-1302),但尚未 参阅会议过程我们无法保证此类候选产品或任何其他产品将获得监管批准 候选人,这是必要的,然后才能商业化。 | |
| ● | 偶数 如果我们获得CTx-1301、CTx-1302和CTx-2103监管批准,此类批准可能有限,我们将受到严格的, 持续的政府监管。我们候选产品的商业成功(如果获得批准)部分取决于能否进入市场 医生、患者、第三方付款人和医疗界的接受。 | |
| ● | 社交 围绕滥用阿片类药物和兴奋剂的问题,包括对转移的执法关切和打击滥用的监管努力 滥用,可能会减少我们候选产品的潜在市场。 |
| ● | 我们的 业务受到广泛的监管要求的约束,我们获得批准的候选产品将受到持续 以及持续的监管审查,这可能会导致大量费用,并限制我们将此类产品商业化的能力。 | |
| ● | 我们 CTX-1301和CTX-1302的供应来源有限,因为这些都是预定产品,供应链的任何中断都可能影响CTX-1301和CTX-1302的生产和销售,并导致我们的候选产品开发和商业化的延迟 。 | |
| ● | 我们 依赖第三方制造和包装我们的候选产品,并为我们的候选产品进行临床试验和提交监管申请,而这些第三方的表现可能不令人满意,包括未能在制造和交付我们的候选产品的最后期限 、完成此类试验和/或监管提交。 |
| 7 |
| ● | 我们 将依赖第三方将我们的候选产品商业化,我们可能会依赖第三方为我们商业化的任何产品提供许多基本服务 ,包括分销、客户服务、应收账款管理、现金收款 和不良事件报告。如果这些第三方未能按预期运行或未遵守法律和法规要求, 我们将CTX-1301、CTX-1302和/或CTX-2103商业化的能力将受到严重影响,我们可能会受到监管部门的 制裁。 | |
| ● | 我们 未来将需要进一步增加我们组织的规模和复杂性,我们在执行增长战略和管理任何增长方面可能会遇到困难。 | |
| ● | 我们的研究和开发专注于发现和开发候选产品,这可能无法推向市场。 | |
| ● | 我们 越来越依赖信息技术,我们的系统和基础设施面临一定的风险,包括网络安全 和数据泄露风险。 | |
| ● | 如果我们与我们的产品或候选产品相关的知识产权不足,我们可能无法在我们的市场上有效竞争 。 | |
| ● | 我们证券的活跃交易市场可能无法持续。 |
与我们的财务状况和资金需求相关的风险
我们 是一家经营历史有限的生物制药公司。
我们 是一家生物制药公司,运营历史有限,您可以据此评估我们的业务和前景。我们必须完成 临床研究并获得监管部门的批准,然后才能开始产品的商业销售。我们的业务计划成功的可能性必须考虑到在发展和扩大早期业务以及我们所处的监管和竞争环境方面经常遇到的问题、巨额费用、困难、并发症和延误。 医药产品开发是一项高度投机性的工作,涉及很大程度的风险,是一项资本密集型业务 。
因此, 您应该考虑我们的前景,考虑到公司在开发的早期阶段,特别是像我们这样的早期制药公司经常遇到的成本、不确定性、延误和困难。潜在投资者应仔细考虑一家经营历史有限的公司将面临的风险和不确定性。特别是,潜在投资者应考虑 我们不能向您保证我们将能够:
| ● | 成功实施或执行我们的业务计划,并且我们不能向您保证我们的业务计划是健全的; | |
| ● | 成功 完成CTX-1301、CTX-1302和/或CTX-2103的产品开发/配方和临床试验,以及任何或所有产品的营销。 | |
| ● | 成功地 制造或已经制造了临床产品,并根据我们在以前的合同制造机构(“CMO”)在CTX-1301临床供应方面经历的制造延迟 建立了商业药物供应; | |
| ● | 在资本市场或其他方面筹集足够的资金,以实施我们的业务计划,包括完成我们的CTX-1301第三阶段临床计划; | |
| ● | 为我们的产品提供足够的知识产权保护; |
| 8 |
| ● | 鉴于高管和其他雇员将于2023年12月离职,吸引并保留一支经验丰富的管理和咨询团队 ; | |
| ● | 确保我们的候选药物在医学界以及第三方付款人和消费者中得到接受; | |
| ● | 启动我们候选药物的商业销售,无论是单独销售还是与他人合作; | |
| ● | 遵守上市后监管要求;以及 | |
| ● | 利用我们已有和/或未来筹集的资金来有效执行我们的业务战略。 |
如果 我们不能成功执行上述任何一项,我们的业务、财务状况、经营业绩和未来增长前景都将受到重大不利影响 。
我们 已经遭受了运营亏损的历史,并预计在可预见的未来将继续产生巨额成本。我们目前没有盈利,我们可能永远不会实现或保持盈利。
我们 从未从运营中产生收入,几年内不太可能产生收入,目前运营处于亏损状态 ,预计我们的运营成本将大幅增加,因为我们会产生与配方/制造开发、候选药物的临床试验和上市公司运营相关的成本。我们预计会在没有相应收入的情况下产生费用,除非且 直到我们能够获得监管部门的批准并成功将我们的候选产品CTX-1301、CTX-1302和CTX-2103商业化。 我们可能永远无法在美国或国际上以任何适应症营销我们的候选药物获得监管部门的批准。即使我们获得了CTX-1301、CTX-1302和/或CTX-2103的监管批准,任何未来资产的开发费用也将继续 增加。当我们为争取联邦药品管理局(“FDA”)的批准而进行CTX-1301第三阶段临床试验时,我们将产生额外的临床开发费用。
我们 自成立以来发生了经常性亏损,截至2023年9月30日累计亏损约8,600万美元。 这些情况令人对我们作为持续经营企业的能力产生很大怀疑,这意味着我们可能无法在可预见的未来继续运营,或在正常运营过程中实现资产和清偿负债。如果我们无法 获得进一步的资金,我们可能无法继续运营。尽管我们继续执行这些计划,但不能保证我们将成功地以我们可接受的条款获得足够的资金,为持续运营提供资金(如果有的话)。
我们 将在可预见的未来继续投入大量现金资源,用于我们候选产品的临床开发 以及我们可能选择的任何其他适应症和候选产品的开发。这些支出将包括与制造和临床开发相关的成本,如进行临床试验、制造运营和候选产品供应,以及营销和销售任何获准销售的产品。特别是,我们在美国的第三阶段试验需要大量资金才能完成。由于任何临床试验的进行和结果都高度不确定,我们无法合理估计成功完成我们当前和任何未来候选产品的开发和商业化所需的实际金额。
我们 不确定何时或是否能够实现或保持盈利。如果我们在未来实现盈利,我们可能无法 在后续时期持续盈利。未能实现并保持盈利将削弱我们维持运营的能力 ,并对我们证券的价格和我们筹集资金的能力产生不利影响。
| 9 |
此次发行后,我们将需要筹集 大量额外资本以继续运营。如果我们无法筹集资金,我们可能被要求寻求破产保护或其他替代方案,这可能会导致我们的证券持有人失去对我们的部分或全部投资。
此次发行后,我们将需要筹集大量额外资金以继续运营,并继续支持我们计划的开发和商业化活动。我们相信,根据我们目前的业务计划,此次发行的净收益加上我们手头的现金,将满足我们到2024年第二季度末的资本需求。我们未来资金需求的数额和时间将取决于许多因素,包括:
| ● | 我们当前和 开发、许可或收购的任何候选产品的临床试验和其他制造/产品开发活动的时间、进度和成本; | |
| ● | 我们的候选产品在美国和任何其他国家的临床试验结果; | |
| ● | 我们的候选产品获得FDA批准和任何外国监管机构批准的时间安排和涉及的成本; | |
| ● | 我们开发或获得的任何其他未来候选产品的数量和特征; | |
| ● | 我们 建立和维护战略合作、许可、共同推广或其他安排的能力,以及此类安排的条款和时间 ; | |
| ● | 如果我们当前或任何未来的候选产品被批准销售,商业化活动的成本,包括制造、营销、销售和分销成本; | |
| ● | 任何经批准的产品的市场接受度和接受率; | |
| ● | 根据我们的第三方制造和供应安排,为当前和未来的任何候选产品以及我们 商业化的任何产品支付的成本; | |
| ● | 成本 以及我们可能建立的任何其他外包商业制造或供应安排的完成时间; | |
| ● | 我们的第三方服务提供商基于我们有限的流动性和那些不需要为服务预付费的服务提供商继续提供服务的意愿。 | |
| ● | 准备、提交、起诉、维护、辩护和执行与我们的候选产品相关的任何专利主张和其他知识产权的费用 ; | |
| ● | 与起诉或辩护我们正在或可能卷入的任何诉讼相关的费用,以及我们因此类诉讼而应支付的任何损害赔偿 ; | |
| ● | 与可能发生的任何产品召回相关的成本 ; | |
| ● | 上市公司的运营成本 ; | |
| ● | 替代性和竞争性产品或治疗的出现、批准、可获得性、感知优势、相对成本、相对安全性和相对有效性; | |
| ● | 与产品和候选产品、技术或业务的任何收购或许可内相关的成本;以及 | |
| ● | 人员、设施和设备要求。 |
| 10 |
我们 无法确定是否会以可接受的条款提供额外资金,或者根本不能。此外,我们可能进入的未来债务融资可能会对我们施加限制我们业务的契约,包括对我们产生留置权或额外债务、支付股息、赎回股票、进行某些投资和从事某些合并、合并或资产出售交易的能力的限制。
在2023年末,我们启动了几项成本削减措施。这些措施包括降低员工基本工资和审查基本供应商。此外,董事会的非管理层成员同意将现金董事会的费用推迟到未来某个日期。如果我们无法在需要时或按可接受的条款 筹集额外资金,或者如果我们无法与CTX-1301、 CTX-1302和/或CTX-2103达成战略合作,我们可能需要进一步限制我们的运营或通过签订不具吸引力的 条款协议来获得资金,这可能会对我们的业务、股价和我们与 我们有业务关系的第三方的关系产生实质性的不利影响,至少在获得额外资金之前是这样。
筹集 额外资本可能会稀释我们的股东、限制我们的运营或要求我们放弃产品的权利 候选产品。
在 我们能够产生可观的产品收入之前,我们预计将通过公共或私募股权或债务融资、第三方融资、营销和分销安排以及其他合作、战略联盟和许可安排,或这些方法的任何组合来满足我们的现金需求。我们没有任何承诺的外部资金来源。如果我们通过出售股权或可转换债务证券来筹集额外资本,您在我们公司的所有权权益可能会被稀释 ,这些证券的条款可能包括清算或其他优惠,对您作为股东的权利产生不利影响。 债务和股权融资(如果可用)可能涉及一些协议,其中包括限制或限制我们采取特定 行动的能力的协议,例如赎回我们的股票、进行投资、产生额外债务、进行资本支出、宣布股息 或限制我们获取、出售或许可知识产权的能力。此外,WFIA持有预先出资的认股权证,可购买1,028,955股我们的普通股。一旦行使此类预先出资的认股权证,您在我们公司的所有权权益将被稀释。
如果 我们通过未来的合作、战略联盟或第三方许可安排筹集更多资本,我们可能不得不 放弃对我们的知识产权、未来收入流、研究计划或候选产品的宝贵权利,或者以可能对我们不利的条款授予许可证 。如果我们无法在需要时筹集更多资金,我们可能会被要求推迟、限制、减少或终止我们的候选产品的开发或未来的商业化努力,或者授予开发和营销我们本来会自行开发和营销的候选产品的权利。
| 11 |
税法的变化 可能会对我们的业务、财务状况、经营结果和现金流产生重大不利影响。
我们 受我们开展业务的司法管辖区的税收法律、法规和政策的约束,这些司法管辖区可能包括美国 联邦、州和地方政府以及外国司法管辖区的税务当局。税法的变化,以及其他因素,可能会导致我们的纳税义务出现波动,并以其他方式对我们的纳税状况和/或纳税义务产生不利影响。 税务机关和其他政府机构正在不断审查我们所在司法管辖区的所得税规则。税法的变化(这些变化可能具有追溯力)可能会对我们或我们的股东产生不利影响。我们无法 预测未来可能会提出或颁布什么税收提案,或者这些变化会对我们的业务产生什么影响,但这些 变化,如果它们被纳入税务法律、法规、政策或实践,可能会影响我们的财务状况和我们所在司法管辖区未来的整体有效税率,并增加税务合规的复杂性、负担和成本 。
我们利用净营业亏损来抵消未来应税收入的能力可能会受到一定的限制。
由于美国税法的限制,我们的 净营业亏损结转(“NOL”)和某些其他税务属性可能无法用于抵消未来的 所得税负债。根据减税和就业法案(TCJA),在截至2017年12月31日的纳税年度产生的联邦NOL 可以无限期结转。结转不得超过随后 年度净收入的80%。
此外,《守则》第382和383节还包含了一些规则,这些规则限制了经历“所有权变更”(通常是指在三年期间内公司股票所有权超过50%的任何变更)的公司利用变更前的NOL和税收抵免结转来抵消未来应纳税所得额的能力。这些规则通常侧重于涉及直接或间接拥有公司5%或以上股票的股东的所有权变更,以及公司新发行股票引起的所有权变更 。一般来说,如果发生所有权变更,使用NOL和税收抵免结转以及某些固有损失的年度应纳税所得额限制等于适用的长期免税税率 与紧接所有权变更前的公司股票价值的乘积。因此,任何此类所有权变更后, 我们可能无法在此类亏损和抵免到期之前用亏损抵消我们的应税收入,或无法用抵免抵消我们的纳税义务, 在这种情况下,我们可能会产生比我们没有经历所有权变更时更大的联邦和州所得税负债 。
我们独立注册会计师事务所截至2022年12月31日和2021年12月31日的财年报告 包含一段解释性的 段落,说明我们是否有能力继续作为一家持续经营的企业。
我们的独立注册会计师事务所关于我们截至2022年12月31日和2021年12月31日的财务报表的报告 包括一段说明,表明我们作为一家持续经营的企业继续经营的能力存在很大疑问。自成立以来,我们经历了经常性的运营亏损和负现金流,我们预计在可预见的未来将继续产生运营亏损并消耗大量现金资源。如果没有额外的融资,这些条件 会让人对我们作为持续经营企业的能力产生很大的怀疑,这意味着我们可能无法在可预见的未来继续运营,也可能无法在正常运营过程中实现资产和债务清偿。如果我们无法获得资金, 我们可能无法继续运营。尽管我们继续执行这些计划,但不能保证我们将成功地以我们可接受的条款获得足够的资金,为持续运营提供资金(如果有的话)。
与开发、临床测试、制造和监管审批相关的风险
我们主要依赖于我们的候选产品CTX-1301和CTX-1302的成功开发和商业化,CTX-1301和CTX-1302用于治疗ADHD,CTX-2103用于治疗焦虑,这些产品正在进行产品/早期临床开发(CTX-2103)、临床开发 (CTX-1301)或计划未来的产品开发(CTX-1302),尚未获得批准。我们不能保证我们 将获得监管机构对此类候选产品或任何其他候选产品的批准,这在它们可以商业化之前是必要的。
我们 尚未完成任何候选产品的开发和/或获得监管部门的批准。开发将需要投入大量的财政资源、广泛的候选产品开发和临床试验。这一过程需要多年的努力,但没有任何最终成功的保证。
| 12 |
我们从候选产品中获得收入的能力将在很大程度上取决于它们的成功开发、监管批准和最终的商业化,我们预计这在几年内都不会发生。我们候选产品的成功将取决于许多因素,包括但不限于:
| ● | 成功完成产品开发和必要的临床试验; | |
| ● | 在我们的临床试验中成功地完成和实现终点; | |
| ● | 证明我们的候选产品所涉及的风险大于收益; | |
| ● | 成功地 为我们的候选产品开发制造流程,包括与第三方制造商签订和维护安排; | |
| ● | 成功 完成FDA对用于生产我们的候选产品的设施的审批前检查,以及选择临床 试验点; |
| ● | 收到来自适用监管机构的及时上市批准,包括美国药品监督管理局(DEA)考虑到FDA的建议,确定候选产品的受控物质时间表; | |
| ● | 为我们的候选产品获得和维护专利、商标和商业秘密保护以及法规排他性,并在其他方面保护我们在知识产权组合中的权利; | |
| ● | 保持遵守法规要求,包括当前良好的制造规范或cGMP; | |
| ● | 在获得批准后,单独或与其他公司合作,启动候选产品的商业销售; | |
| ● | 如果患者、医学界和第三方付款人批准了我们的候选药物,则接受 ; | |
| ● | 与其他疗法有效竞争; | |
| ● | 获得并维持医疗保险和适当的报销;以及 | |
| ● | 在批准后保持药物产品持续可接受的安全性和有效性。 |
如果我们不能及时或根本实现上述一个或多个因素(其中许多是我们无法控制的),我们可能会遇到重大延误和成本增加,或者无法获得监管部门的批准或将我们的候选产品商业化。 即使获得监管部门的批准,我们也可能永远无法成功地将我们的任何候选产品商业化。因此, 我们不能向您保证,我们将能够通过销售我们的候选产品或任何未来的候选产品来产生足够的收入以继续运营。
我们针对CTX-1301、CTX-1302和/或CTX-2103的产品开发工作可能会因多种原因而失败,包括但不限于:
| ● | 候选产品在临床研究中失败; | |
| ● | 患者对候选产品的不良反应或其他安全问题的适应症; | |
| ● | 临床试验数据不足,无法支持候选产品的有效性或优越性; | |
| ● | 无法及时、经济高效地生产足够数量的可供开发或商业化活动使用的产品;以及 | |
| ● | 监管环境的变化 ,包括定价和报销,使得开发新产品或现有产品以适应新的适应症不再具有吸引力。 |
| 13 |
FDA或其他监管机构对我们的候选产品进行售前审查是一个漫长且不确定的过程,审批可能会被推迟、 受限或被拒绝,其中任何一项都会对我们产生运营收入的能力产生不利影响。
我们 不允许在美国销售我们的候选药物产品,直到我们分别获得FDA对新药申请(“NDA”)的批准。获得FDA批准所需的时间(如果有的话)是不可预测的,但临床试验开始后通常需要数年时间,这取决于许多因素,包括监管机构的重大自由裁量权以及所涉及的候选产品的类型、复杂性和新颖性。我们尚未向FDA或任何司法管辖区的任何其他监管机构提交 NDA等营销申请或任何类似申请。
FDA在药品审批流程中拥有相当大的自由裁量权,包括出于多种原因可以推迟、限制或拒绝批准候选产品 。例如,FDA:
| ● | 能否确定我们不能依赖于CTX-1301、CTX-1302、CTX-2103或我们可能确定和开发的任何其他候选产品的505(B)(2)监管审批途径; | |
| ● | 能否 确定我们作为IND或NDA的一部分提供的信息不充分、包含临床缺陷或其他方面 无法证明我们的任何候选产品对于任何适应症的安全性和有效性; | |
| ● | 可能 不认为生物等效性研究和/或临床试验的数据足以支持提交保密协议或在美国获得 上市批准,包括任何发现安全风险超过我们的 候选产品的临床和其他好处; | |
| ● | 可能 要求我们进行额外的研究,以证明我们产品的安全性、有效性、药代动力学或其他特性 候选产品在获得批准之前,或要求将此类研究作为批准的条件; | |
| ● | 可能 不同意我们的临床试验设计或我们对来自产品开发制造数据、生物等效性研究和/或临床试验的数据的解释,或者可能更改审批要求,即使在它审查和评论了我们的试验设计 之后; | |
| ● | 可以 确定我们的505(B)(2)保密协议不适当地依赖于某一上市药物或某些药物,或者我们的CTX-1301、CTX-1302、CTX-2103或任何其他候选产品的申请因上市药物的专利或非专利排他性而被阻止批准 ; | |
| ● | 是否可以 找出我们与之签订协议的第三方制造商的制造工艺或设施中的缺陷,以供应我们的候选产品中使用的活性药物成分(“原料药”); | |
| ● | 可以 找出我们自己的制造工艺中的不足之处,或者我们为生产我们的候选产品而提议的扩大制造工艺或设施的建议; | |
| ● | 可能 批准我们的候选产品的适应症比我们要求的更少或更有限,或者可能根据昂贵的批准后临床试验的表现 批准; | |
| ● | 可以 改变审批政策或采用新的法规;或 | |
| ● | 可能 不批准我们认为对我们的候选产品成功商业化是必要或可取的标签声明。 |
审批过程的时间和费用,以及未来临床试验结果的不可预测性和其他促成因素,可能会导致我们无法在美国或其他司法管辖区获得监管部门的批准,在美国或其他司法管辖区,CTX-1301、CTX-1302、CTX-2103、 或我们正在开发或未来可能寻求开发的任何其他候选药物,这将严重损害我们的业务、运营结果和前景。在这种情况下,我们也可能没有资源进行新的临床试验和/或我们可能确定 任何此类候选药物的进一步临床开发是不合理的,并可能停止任何此类计划。
| 14 |
临床测试费用昂贵,难以设计和实施,可能需要数年时间才能完成,而且结果不确定。我们可能会在完成或最终无法完成候选产品的商业化过程中产生额外的 成本或遇到延迟。
无法预测我们的任何候选产品何时或是否会在人体上证明有效或安全,并将获得监管部门的 批准。在从监管部门获得销售任何候选产品的市场批准之前,我们必须完成产品/制造 开发,然后进行临床试验,以证明我们的候选产品在人体上的安全性和有效性。临床试验 昂贵,难以设计和实施,可能需要数年时间才能完成,而且结果不确定。 一个或多个临床试验的失败可能发生在开发的任何阶段。早期临床试验的结果可能不能预测后续临床试验的成功,临床试验的中期结果也不一定能预测最终结果。对早期研究结果的解释需要谨慎,这些研究通常规模较小,表明某些受试者出现了积极的趋势。招募更多受试者的临床试验后期的结果 可能无法显示预期的安全性和有效性结果,或者与相同候选产品的早期试验结果不一致。后期临床试验结果可能无法复制早期临床试验 ,原因有很多,包括试验设计不同、试验终点不同或研究中缺少试验终点、受试者 人群、受试者数量、受试者选择标准、试验持续时间、药物剂量和配方以及早期研究缺乏统计能力 。此外,临床数据往往容易受到不同解释和分析的影响,许多公司认为他们的候选产品在早期和后期临床试验中表现令人满意,但仍未能获得 对其产品的上市批准。
我们 在临床试验期间或由于临床试验的结果可能会遇到许多不可预见的事件,这些事件可能会延迟或阻止我们获得市场批准或将我们的候选产品商业化,包括但不限于:
| ● | 无法产生令人满意的临床前、毒理学或其他体内或体外数据,以支持临床试验的启动或继续 ; | |
| ● | 监管机构或机构审查委员会不得授权我们或我们的调查人员根据需要开始临床试验、在预期试验地点进行临床试验或修改临床试验方案; | |
| ● | 我们 可能会在与预期试验地点和合同研究组织或CRO就可接受的临床试验合同或临床试验方案 达成协议方面遇到延迟或无法达成协议; | |
| ● | 无法、 延迟或未能确定和维护足够数量的试验站点,其中许多可能已经参与了其他临床项目 ; | |
| ● | 我们候选产品的临床试验可能会产生否定或不确定的结果,包括在需要的情况下无法证明统计意义 ,我们可能决定或监管机构可能要求我们进行额外的临床试验或放弃药物开发计划。 | |
| ● | 我们候选产品的临床试验所需的受试者数量可能比我们预期的多,这些临床试验的登记人数可能比我们预期的要慢,或者参与者退出这些临床试验的速度可能比我们预期的要高; | |
| ● | 患者未能完成试验或返回治疗后随访; | |
| ● | 无法在治疗期间或治疗后充分监测患者; | |
| ● | 临床站点和调查人员偏离试验方案、未按法规要求进行试验或退出试验的; | |
| ● | 我们的 第三方承包商可能无法遵守法规要求或试用协议,或未能及时履行其对我们的合同义务,或者根本不遵守; |
| 15 |
| ● | 监管机构或机构审查委员会可能会要求我们或我们的调查人员出于各种原因暂停或终止临床研究,包括不符合监管要求或发现参与者面临不可接受的健康风险 ; | |
| ● | 该 我们候选产品的临床试验成本可能高于我们的预期,包括如果我们无法寻求505(b)(2) 批准我们候选产品的NDA途径; | |
| ● | 由于观察到的安全发现或其他原因,FDA或类似监管机构实施的临床搁置导致未能启动或推迟或无法完成临床试验。 | |
| ● | 监管部门可能不同意我们的试验设计或实施; | |
| ● | 无法生产足够数量的质量可接受的候选药物以用于临床试验;以及 |
| ● | 我们的 候选产品可能具有不良副作用或其他意外特征,导致我们或我们的调查人员、监管机构 或机构审查委员会暂停或终止试验。 |
如果 我们被要求对我们的候选产品进行超出我们目前预期的额外临床试验或其他测试, 如果我们无法成功完成我们候选产品的临床试验或其他测试,如果这些试验或测试的结果不呈阳性或仅为轻度阳性,或者如果存在安全问题,我们可能会:
| ● | 在为我们的候选产品获得市场批准方面被延迟了 ; | |
| ● | 根本没有 获得上市批准; | |
| ● | 获得 批准的适应症或患者群体不像预期或期望的那样广泛; | |
| ● | 获得 批准,但没有我们成功将候选产品商业化所需的声明; | |
| ● | 获得包括重大使用或分发限制或安全警告在内的标签的批准; | |
| ● | 接受额外的上市后测试、监督或其他要求;或 | |
| ● | 在获得市场批准后将该产品 下架。 |
如果我们在测试、临床试验、制造或获得上市批准方面遇到延迟,我们的开发成本也可能增加。 例如,CTX-1301的开发成本增加,原因是第三阶段固定剂量研究的生产 延迟了该研究所需的最终剂量强度。我们不知道我们的任何临床试验是否会按计划开始, 是否需要重组或按计划完成,或者根本不知道。2023年末,我们根据FDA的反馈,宣布更改CTX-1301的临床开发计划,并相应地停止了CTX-1301的两个3期试验的登记。我们可能需要 重新启动这些试验和/或开始新的试验,才能获得监管部门对CTX-1301的批准。我们可能会发现很难或不可能重新开始或开始这样的临床试验。重大的产品制造或临床试验延迟也可能缩短我们拥有将候选产品商业化的独家权利或允许竞争对手先于我们将产品推向市场的任何期限 ,并削弱我们成功将候选产品商业化的能力。
针对儿童和青少年的CTX-1301和CTX-1302临床试验获得监管批准可能需要额外的研究和/或更长的研究持续时间,因为对儿科人群的监管批准要求更严格。
儿科药物开发可能需要额外的研究来确定安全剂量和长期安全性。这些额外的研究可能需要投入大量的额外资源,而不是监管机构批准成人用药所需的资源。虽然我们已经停止了CTX-1301的关键的3期固定剂量儿科和青少年安全性和有效性研究以及CTX-1301的3期儿科剂量优化 开始和持续时间研究,但我们可能必须重新开始并完成这些试验和其他试验才能获得批准。由于这些额外要求,CTX-1301和CTX-1302的审批可能会被推迟,这可能会对CTX-1301和CTX-1302的商业前景产生不利影响 ,并可能严重推迟我们创造产品收入的能力。此外,由于新冠肺炎(或其他潜在的流行病),我们可以登记参加临床试验的儿童人数可能会减少。我们 不能保证我们将获得监管部门的批准,将我们的候选产品在儿科人群或成人人群中商业化。
| 16 |
更改候选产品制造或配方的方法 可能会导致额外成本或延迟。
由于 候选产品是通过非临床测试和早期和后期临床试验来开发的,因此可能会在开发计划的各个方面进行更改,例如制造方法和配方,以努力优化流程和结果。这样的变化可能无法实现这些预期目标。这些更改中的任何一项都可能导致我们的候选产品 表现不同,并影响计划中的临床试验或使用更改材料进行的其他未来临床试验的结果,或者它们可能会改变候选产品的安全性或风险状况,这可能涉及FDA或其他监管机构的进一步询问。这样的变化还可能需要额外的测试、FDA通知或FDA批准。这可能会推迟 临床试验的完成,需要执行过渡临床试验或重复一项或多项临床试验,增加临床 试验成本,推迟我们候选产品的批准,并危及我们开始产品销售和创造收入的能力。
我们的候选产品CTX-1301和CTX-1302含有受控物质,其制造、使用、销售、进口、出口、处方和分销均受DEA的监管。
在 我们可以将我们的候选产品商业化之前,DEA将需要确定受控物质时间表,并考虑 FDA的建议。这可能是一个漫长的过程,可能会延迟我们对候选产品的营销,并可能 减少我们可能有资格获得的任何监管独占期。如果获得批准,我们的CTx-1301和CTx-1302候选产品 将按照1970年《受控物质法》(“CSA”) 和DEA实施条例中的定义作为“受控物质”进行监管,这些条例规定了注册、安全、记录保存、报告、储存、分销、 进口、出口、库存、配额和DEA管理的其他要求。这些要求适用于我们、我们的 合同制造商和分销商以及我们候选产品的处方者和配药者。DEA通过一个封闭的分销链管理受控物质的处理 。这一管制延伸到 制造和包装中使用的设备和原材料,以防止损失和转入非法商业渠道。一些州和外国 国家也独立地将这些药物作为受控物质进行监管。
DEA将受控物质作为附表I、II、III、IV或V物质进行管理。根据滥用和身体或心理依赖的可能性,批准的药品可被列为附表II、III、IV或V,其中附表II物质被认为存在最高的滥用风险,而附表V物质被认为存在最低的滥用相对风险。附表II药物 是指符合以下特征的药物:
| ● | 这种药物有很高的滥用潜力; | |
| ● | 该药物目前在美国治疗中被接受的医疗用途或在严格限制下当前被接受的医疗用途; 和 | |
| ● | 滥用药物可能会导致严重的心理或身体依赖。 |
CTX-1301和CTX-1302中的活性药物成分(醋酸二甲酯和右旋苯丙胺)目前被列为附表二产品。我们预计,我们未来的一些候选产品也可能被DEA列为CSA下的附表II受控物质 。因此,如果获得批准,产品的制造、运输、储存、销售和使用将受到高度监管。附表二药品在注册、安全、记录保存和报告方面受到最严格的要求,这些药品的分发、处方和分发受到严格监管。
任何制造、分销、分发、进口或出口任何受管制物质的设施都需要进行年度登记。注册是针对特定地点、活动和受控物质时间表进行的。
此外,DEA配额制度控制和限制受控物质的供应和生产,我们的产品可能受到DEA生产和采购配额计划的 约束。DEA根据DEA对满足合法科学和医药需求所需数量的估计,为美国总共可以生产多少受管制物质 建立了总配额。受控物质的生产商必须按年申请配额。如果我们或我们的合同 制造商或供应商没有从DEA获得足够的配额,如果我们的候选产品获准上市,我们可能无法获得足够数量的这些受控 物质来完成我们的临床试验或满足商业需求。
由于 的限制性,这些法律法规可能会限制我们的候选产品包含受控制的 物质的商业化。不遵守这些法律和法规还可能导致我们的DEA注册被撤销、制造和分销活动中断、同意法令、刑事和民事处罚以及国家行动等后果。
| 17 |
如果我们在临床试验的受试者登记过程中遇到延迟或困难,我们收到必要的监管批准可能会被推迟或阻止。
如果我们无法根据FDA或美国以外的类似监管机构的要求找到并招募足够数量的合格受试者参与这些试验,我们 可能无法启动或继续对我们的候选产品进行临床试验 。我们无法预测我们在未来的临床试验中招募受试者的成功程度。如果我们在一项临床试验中未能成功招募 名受试者,可能会影响我们何时能够启动下一项临床试验,这可能会导致我们寻求监管机构批准我们的候选产品并将其商业化的努力出现重大 延误。此外,我们的一些竞争对手 正在进行临床试验,以治疗与我们的候选产品相同的适应症,而原本有资格参加我们的临床试验的受试者可能会转而参加我们竞争对手的临床试验。科目招生受其他因素影响,包括, 但不限于:
| ● | 试验方案中规定的受试者群体的规模和性质; | |
| ● | 有关研究的资格标准; | |
| ● | 接受研究的候选产品的 感知的风险和收益; | |
| ● | 候选产品可能是受控物质这一事实; | |
| ● | 受试者在临床试验中经历的严重或意想不到的药物相关不良事件; | |
| ● | 获得批准用于治疗正在研究的疾病或状况的药物的供应情况; | |
| ● | 为促进及时登记临床试验所做的努力程度; | |
| ● | 医生的患者转诊做法; |
| ● | 获得和维护受试者知情同意的能力; | |
| ● | 在临床试验中保留受试者以及他们返回进行后续治疗的能力; | |
| ● | 临床试验设计,包括所需的测试、程序和后续行动; | |
| ● | 在治疗期间和治疗后充分监测受试者的能力; | |
| ● | 延迟添加新的研究人员和临床站点 ; | |
| ● | 将临床试验站点从临床试验中撤回 ; | |
| ● | 用于相同适应症的临床开发中的其他候选药物的存在;以及 | |
| ● | 潜在受试者的临床试验地点的近似性和可用性。 |
我们无法招募足够数量的受试者参加临床试验,这将导致严重的延误,并可能要求我们完全放弃 一项或多项临床试验。这些临床试验的注册延迟可能会导致我们候选产品的开发成本增加,这可能会导致我们的价值下降,并限制我们获得额外融资的能力。
我们的 临床试验可能无法证明我们的候选产品的安全性和有效性,或者可能在我们的候选产品的开发过程中发现严重的不良或不可接受的副作用 ,这可能会阻止或推迟监管部门的批准和商业化, 增加我们的成本,或者有必要放弃或限制我们的部分或所有候选产品的开发。
在获得监管部门对我们的候选产品商业销售的批准之前,我们必须证明,我们的候选产品在每个目标适应症中都是安全有效的,并且在开发的任何阶段都可能出现故障。临床试验经常无法证明针对目标适应症而研究的候选产品的安全性和有效性。
| 18 |
由于有许多医药产品,我们候选产品的治疗可能会产生不良副作用或不良反应或 事件。尽管我们的候选产品包含已获批准的活性药物成分,这意味着在我们的候选产品中使用活性药物成分或药物类别所产生的副作用是众所周知的,但我们的候选产品仍可能导致不良副作用。
如果我们的候选产品在临床试验中存在严重的副作用或具有意想不到的特征,我们可能需要 将开发限制在副作用或其他特征不太普遍、不太严重或从风险收益角度来看更容易接受的更狭隘的用途或子群。FDA或机构审查委员会还可能要求我们根据安全信息暂停、中断或限制我们的临床试验,以限制对登记受试者的潜在严重伤害。此类调查结果 可能会进一步导致监管机构无法为我们的候选产品提供营销授权。
我们的 候选产品可能会造成不良影响或具有其他特性,可能会延迟或阻止其监管批准,或限制任何批准的标签或市场接受度的范围,或在上市批准后导致重大负面后果(如果有)。
如果我们的任何产品在获得市场批准后导致严重或意想不到的副作用,可能会导致一些潜在的重大负面后果,包括但不限于:
| ● | FDA可能需要额外的临床测试或临床试验,或昂贵的上市后测试和监测,以监测产品的安全性和有效性; | |
| ● | 监管部门可以撤回对该产品的批准或对其分销施加限制; | |
| ● | 我们 可能需要创建药物指南,概述此类副作用的风险,以便分发给患者,或者我们可能 需要实施风险评估和缓解策略(“REMS”),以确保产品的益处大于风险 ; | |
| ● | 监管当局可能要求添加标签声明,如警告或禁忌症; | |
| ● | 我们 可能被要求更改产品的分发或管理方式; | |
| ● | 我们 可能需要自愿召回产品; | |
| ● | 我们 可能会被起诉,并对接触或服用我们的产品候选产品的个人造成的伤害承担责任;或 | |
| ● | 我们的声誉可能会受到影响。 |
这些事件中的任何一个都可能阻止我们实现或保持市场对受影响产品或候选产品的接受程度,并可能 大幅增加我们的产品和候选产品的商业化成本。
如果FDA没有得出结论认为我们的候选产品与批准的 参考药物具有足够的生物等效性或具有类似的生物利用度,或者如果FDA不允许我们按照预期的505(B)(2)NDA途径进行审批,我们候选产品的审批路径可能会比 预期的要长得多,成本也会高得多,带来的并发症和风险也会比预期的大得多,FDA可能不会最终批准我们的候选产品。
联邦食品、药物和化妆品法案(“FDCA”)第505(B)(2)条允许在以下情况下提交保密协议:至少一些批准所需的信息来自不是由申请人或为申请人进行的调查,并且 申请人没有从进行调查的人那里获得参考或使用的权利。FDA对FDCA第505(B)(2)节的解释是,为了批准NDA,允许申请人部分依赖已发表的文献或FDA之前对批准产品的安全性和有效性的调查结果。FDA还可能要求申请人进行额外的临床试验或测量,以支持与先前批准的产品的任何偏差。然后,FDA可以为所有或部分已批准参考产品的标签适应症以及第505(B)(2)条申请人寻求的任何新适应症批准新产品候选。FDA可要求申请人的产品标签上包含所有或部分限制、禁忌症、警告或注意事项,包括黑框警告,或要求标签上附加限制、禁忌症、警告或注意事项。我们战略的一个关键要素是通过505(B)(2)NDA途径寻求FDA对我们当前的候选产品CTX-1301、CTX-1302和CTX-2103的批准。如果FDA确定我们的候选产品不符合第505(B)(2)节的要求,或者如果我们无法证明我们的候选产品与经批准的产品具有生物等效性或类似的生物利用度,我们可能需要进行额外的临床试验,提供 其他数据和信息,并满足适用于根据第505(B)(1)节提交的传统NDA的监管批准的额外标准。此外,即使FDA确实允许我们遵循505(B)(2)NDA途径,这取决于候选产品, 我们可能仍然需要进行额外的临床试验,包括评估产品安全性或有效性的临床试验。如果发生这种情况,为我们的候选产品获得FDA批准所需的时间和财政资源以及与我们的候选产品相关的并发症和风险可能会大幅增加。
| 19 |
此外,如果无法遵循505(B)(2)保密协议路径,可能会导致新的竞争产品比我们的候选产品更快地投放市场,这可能会损害我们的竞争地位和业务前景。即使我们被允许采用505(B)(2)保密协议 途径,我们也不能保证我们的候选产品将及时获得必要的商业化批准(如果有的话)。其他公司可能会在我们之前获得类似产品的产品批准,这将推迟我们获得产品 批准的能力,并使我们面临更激烈的竞争。
此外,尽管FDA在过去几年中根据505(B)(2)批准了许多产品,但一些制药公司和其他公司反对FDA对FDCA 505(B)(2)的解释,以允许依赖FDA先前的安全性和有效性调查结果。如果FDA改变其对第505(B)(2)条的解释,或者如果FDA对505(B)(2)的解释在法庭上被成功挑战,可能会推迟甚至阻止FDA批准我们未来提交的任何505(B)(2)NDA 。此外,FDA通过了对三年排他性条款的解释,根据这一解释,505(B)(2)申请可以被排他性阻止,即使它不依赖于先前批准的具有排他性的药物(或关于该药物的任何安全性或有效性信息)。根据FDA的解释,我们一个或多个候选产品的批准可能会被授予与我们候选产品具有某些创新特征的先前批准的药物产品的排他性 阻止, 即使我们的505(B)(2)申请没有将之前批准的药物产品识别为上市药物或依赖其任何安全性或疗效数据。如果我们的候选产品未能获得监管部门的批准,将极大地限制我们创造收入的能力 ,而我们认为合适的所有适应症和标签声明如果未能获得此类批准,可能会减少我们的潜在收入 。
即使 如果我们的候选产品根据505(B)(2)法规途径获得批准,批准可能会受到产品可能上市的指定用途的限制,包括比我们要求的更有限的受试人群,可能要求在产品标签中包含禁忌症、 警告或预防措施,包括黑盒警告,可能受到其他批准条件的限制, 或者可能包含昂贵的上市后临床试验、测试和监督的要求,以监控产品的安全性或有效性,或其他上市后要求,如REMS。FDA也可能不会批准标签包含 该候选产品成功商业化所必需或需要的标签。
在一个司法管辖区获得并保持对我们候选产品的监管批准并不意味着我们将在其他司法管辖区成功获得 我们候选产品的监管批准。
即使我们在一个司法管辖区获得并保持对我们的候选产品的监管批准,此类批准也不能保证我们 将能够在任何其他司法管辖区获得或保持监管批准,但在一个司法管辖区未能或延迟获得监管批准 可能会对其他司法管辖区的监管审批流程产生负面影响。例如,即使FDA批准在美国境内销售候选产品,外国司法管辖区的可比监管机构也必须 批准候选产品在这些国家/地区的制造、营销和推广。审批程序因司法管辖区而异 ,可能涉及与美国不同的要求和行政审查期限,包括额外的非临床研究或临床试验,因为在一个司法管辖区进行的调查可能不会被其他司法管辖区的监管机构接受。
获得外国监管批准并遵守外国监管要求可能会给我们带来重大延误、困难和 成本,并可能推迟或阻止我们的产品在某些国家/地区推出。如果我们未能遵守国际市场的监管要求和/或获得相应的营销批准,我们的目标市场将减少,我们实现候选产品全部市场潜力的能力将受到损害。
此外,FDA或适用的外国监管机构接受在美国或其他司法管辖区以外进行的临床试验的研究数据可能会受到某些条件的限制。如果外国临床试验的数据旨在用作在美国上市批准的依据,FDA通常不会仅根据外国数据批准申请,除非(I)数据适用于美国人口和美国医疗实践,以及(Ii) 试验由具有公认能力的临床研究人员进行,并符合GCP规定。此外,还必须满足FDA的临床试验要求,包括足够大的患者群体和统计能力。许多外国监管机构都有类似的审批要求。此外,任何外国审判将受进行审判的外国司法管辖区适用的当地法律管辖。不能保证FDA或任何适用的外国监管机构会 接受在美国或适用司法管辖区以外进行的试验数据。
| 20 |
我们 可能无法成功完成CTX-1301的第三阶段临床试验或任何其他候选产品的未来临床试验。
进行3期临床试验是一个复杂的过程。尽管我们的管理团队成员过去曾在其他公司工作时进行过三期临床试验,但作为一家公司,我们以前没有进行过三期临床试验,因此 可能需要比我们预期的更多的时间和更大的成本。未能在我们的第三阶段临床试验中包括正确的治疗方案、完成或延迟 ,可能会阻止或推迟我们开始CTX-1301的未来临床试验,从而获得监管部门对我们候选产品的批准并将其商业化,这将对我们的财务业绩产生不利影响。此外,我们的一些竞争对手目前正在对治疗与CTX-1301相同适应症的候选产品进行临床试验,本来有资格参加我们临床试验的患者 可以转而注册我们竞争对手的候选产品的临床试验。
患者 登记受其他因素影响,包括:
| ● | 正在调查的疾病的严重程度; | |
| ● | 有关研究的资格标准; | |
| ● | 接受研究的候选产品的 感知的风险和收益; | |
| ● | 促进及时登记临床试验的努力; | |
| ● | 医生的患者转诊做法; | |
| ● | 在治疗期间和治疗后充分监测患者的能力; |
| ● | 为潜在患者提供临床试验地点的距离和可用性;以及 | |
| ● | 我们可能无法控制的因素 ,例如可能限制受试者、主要研究人员或工作人员或临床站点可用性的潜在大流行。 |
我们 最近根据FDA的反馈宣布更改CTX-301的临床开发计划,并相应地停止了CTX-1301的两个阶段3试验的登记 。我们可能需要重新启动这些试验和/或开始新的试验,以获得监管部门对CTX-1301的批准。我们可能会发现很难或不可能重新启动或启动这样的临床试验。
即使我们获得了CTX-1301、CTX-1302和/或CTX-2103的监管批准,这种批准也可能是有限的,我们将受到严格的、持续的政府监管 .
即使 如果监管部门批准CTX-1301、CTX-1302和/或CTX-2103商业化,FDA也可能批准的适应症或标签声明范围小于我们寻求或以其他方式要求对其使用或销售进行特别警告或其他限制的范围。监管机构可能会限制我们或其他公司销售CTX-1301、CTX-1302、 和/或CTX-2103的目标人群,或限制我们其他候选产品的目标人群。CTX-1301、CTX-1302和/或CTX-2103的优势可能不会得到FDA或其他监管机构的同意,或者这些机构可能会反对在产品标签或广告中包含相关的 声明,因此,与其他类似产品相比,CTX-1301、CTX-1302和/或CTX-2103可能没有我们预期的竞争 优势。特别是,FDA可能会根据我们产品的 有效期限制标签声明。此外,任何解决药品安全问题的新立法都可能导致产品开发或商业化的延迟,或者增加确保合规的成本。
| 21 |
如果我们获得监管部门对我们任何候选产品的批准,产品的制造流程、标签、包装、分销、不良事件报告、储存、广告、促销和记录保存等活动将受到广泛的 和持续的监管要求的约束。这些要求包括提交安全性和其他上市后信息和报告, 注册,以及继续遵守cGMP。 FDA或类似的监管机构还可能要求昂贵的上市后非临床研究或临床试验 (通常称为“第四阶段试验”)和上市后监测,以监测产品的安全性或有效性。如果我们或监管机构发现产品存在以前未知的问题,例如意外严重性或频率的不良事件, 生产问题或产品生产或加工设施的问题,例如产品污染或严重不符合适用的cGMP,监管机构可能会对该产品、制造设施或我们施加限制。因此,我们和我们的CMO将接受持续的审查和检查,以评估cGMP的合规性和遵守提交给FDA的任何保密协议或任何其他类型的国内或国外营销申请中做出的承诺。如果我们或我们的第三方提供商,包括我们的CMO未能完全遵守适用的法规,我们可能会被要求召回或撤回我们的 产品。
此外,如果后来发现产品存在以前未知的问题,包括预料不到的严重程度或频率的不良事件,或者与我们的第三方制造商或制造流程有关的问题,或者未能遵守监管要求,则可能会导致以下情况,其中包括:
| ● | 对产品的制造、经批准的制造商或制造过程的限制; | |
| ● | 对产品标签或营销的限制 | |
| ● | 产品分销或使用限制 ; | |
| ● | 要求进行上市后研究或临床试验; | |
| ● | 将该产品从市场上撤回 ; | |
| ● | 产品 召回; | |
| ● | 警告或FDA的无标题信件或外国监管机构的类似违规通知; | |
| ● | 拒绝FDA或其他适用的监管机构批准待处理的申请或已批准申请的补充; | |
| ● | 罚款、返还或返还利润或收入; | |
| ● | 暂停或撤回上市审批; | |
| ● | 暂停我们正在进行的任何临床试验; | |
| ● | 产品 扣押、扣留或拒绝允许进出口产品;以及 | |
| ● | 同意 法令、禁令或施加民事或刑事处罚。 |
此外,FDA或其他监管机构的政策可能会发生变化,可能会颁布额外的政府法规,以阻止、限制或推迟对我们候选药物的监管审批。如果我们缓慢或无法适应现有 要求的变化或新要求或政策的采用,或者如果我们无法以其他方式保持合规性,我们可能会 失去我们可能获得的任何营销批准,这将对我们的业务、前景和实现或 持续盈利的能力产生不利影响。
FDA的政策可能会改变,可能会颁布额外的政府法规,以阻止、限制或推迟我们候选产品的上市审批 。如果我们缓慢或无法适应现有要求的变化或新要求或政策的采用,或者如果我们无法保持法规遵从性,我们可能会失去我们可能获得的任何营销批准,这 将对我们的业务、前景和实现或维持盈利的能力产生不利影响。
| 22 |
我们的 员工、独立承包商、主要调查人员、顾问、供应商、CRO、CMO以及我们可能与之合作的任何合作伙伴 可能从事不当行为或其他不当活动,包括不遵守监管标准和要求。
我们 面临员工、独立承包商、主要调查人员、顾问、供应商、CRO、CMO以及我们可能合作的任何合作伙伴可能从事欺诈或其他非法活动的风险。这些人员的不当行为可能 包括故意、鲁莽或疏忽的行为或违反法律或法规的未经授权的活动,包括要求向FDA或其他监管机构报告真实、完整和准确信息的法律;制造标准;联邦、 州和外国医疗欺诈和滥用法律;数据隐私法律法规;或要求真实、完整和准确报告财务信息或数据的法律。特别是,医疗保健行业的销售、营销和其他业务安排受到旨在防止欺诈、回扣、自我交易和其他滥用行为的广泛法律的约束。这些法律可能限制或禁止广泛的商业活动,包括研究、制造、分销、定价、折扣、营销和 促销、销售佣金、客户激励计划和其他商业安排。受这些法律约束的活动还涉及 在临床试验过程中获得的信息的不当使用或虚假陈述,或非法挪用药品, 如果不遵守此类法律或法规,可能导致监管处罚或其他行动或诉讼,并对我们的声誉造成严重损害。此外,联邦采购法对与政府合同有关的不当行为进行了实质性处罚,并要求某些承包商遵守商业道德和行为准则。此外,我们还面临这样的风险,即个人或政府可能会指控此类欺诈或其他不当行为,即使没有发生。如果对我们提起任何此类 诉讼,而我们未能成功为自己辩护或维护我们的权利,这些诉讼可能会对我们的业务、财务状况、运营结果和前景产生实质性和不利的影响,包括施加民事、刑事和行政处罚、损害赔偿、金钱罚款、交还、监禁、失去获得FDA营销批准的资格 、可能被排除在Medicare、Medicaid和其他联邦医疗保健计划之外、合同损害、 声誉损害、利润减少和未来收益,如果遵守公司诚信协议或其他协议,以解决有关不遵守任何这些法律的指控,并削减或重组我们的业务, 任何可能对我们的业务运营能力和我们的经营业绩产生不利影响的额外报告要求。
由于政府调查或其他执法活动,我们 可能被要求修改我们的业务做法、支付罚款和巨额费用或遭受其他损失。
我们 可能会在美国和/或外国司法管辖区因开展业务而受到诉讼或政府调查 。像我们行业的许多公司一样,我们可能会不时收到政府当局的询问和传票以及其他 类型的信息请求,我们可能会受到与我们的业务活动相关的索赔和其他诉讼的影响。
虽然调查和法律程序的最终结果很难预测,但这些问题的不利解决或和解 可能导致:
| ● | 重大 损害赔偿、罚款、罚款或其他付款,以及行政补救措施,如排除和/或取消政府项目的资格,或其他禁止我们以某种方式经营业务的裁决; | |
| ● | 更改我们的业务运营,以避免与此类诉讼或调查相关的风险; | |
| ● | 产品 召回; | |
| ● | 声誉受损,对我们产品的需求减少;以及 | |
| ● | 花费 大量时间和资源,否则将可用于运营我们的业务。 |
虽然 我们为某些风险提供保险,但我们的保险金额可能不足以覆盖所有不利的 解决方案以及索赔和债务结算的总金额。也不可能获得针对所有潜在风险和责任的保险。
| 23 |
我们 或我们当前和未来的合作伙伴在未来可能会受到产品召回的影响,这可能会损害我们的品牌和声誉,并且 可能会对我们的业务产生负面影响。
如果我们的任何候选产品被批准上市、不符合规格或被认为会导致受伤或疾病,或者如果我们被指控违反了 政府法规,包括与制造、标签、促销、销售或分销相关的法规,我们 或我们当前和潜在的合作伙伴可能会受到产品召回、撤回或扣押的影响。未来的任何召回、撤回或扣押都可能对消费者对我们品牌的信心造成重大负面影响,并导致对我们 批准的产品的需求减少。此外,召回、撤回或扣押我们批准的任何产品将需要管理层的高度关注,可能会导致巨额和意想不到的支出,并将损害我们的业务、财务状况和运营 结果。
对于获得上市批准的候选产品名称,我们 需要获得FDA的批准,与此命名批准相关的任何失败或延迟 都可能对我们的业务产生不利影响。
无论我们是否已获得美国专利商标局(“USPTO”)的正式商标注册,我们打算用于候选产品的任何名称都需要获得FDA的批准。FDA通常对建议的产品名称进行审查,包括评估建议的名称是否可能与其他产品名称混淆。如果FDA认为我们提交的任何产品名称不适当地暗示医疗索赔,它可能会反对该名称。如果FDA反对我们建议的任何产品名称,我们可能会被要求为我们的候选产品采用替代名称,这可能会导致对 建议名称的进一步评估,可能会导致额外的延迟和成本。
FDA和其他政府机构因资金短缺或全球健康问题造成的中断 可能会阻碍他们招聘、保留 或部署关键领导层和其他人员的能力,或者以其他方式阻止新的或修改的产品和服务及时开发、批准 或商业化,这可能会对我们的业务产生负面影响。
FDA审查和批准新产品的能力可能受到各种因素的影响,包括政府预算和资金 水平、雇用和留住关键人员以及接受用户费用支付的能力、法律、法规和政策变化以及其他可能影响FDA履行常规职能能力的 事件。因此,该机构的平均审查时间近年来一直在波动 。此外,政府对资助研发活动的其他政府机构的资助受到政治过程的影响,这一过程本质上是不稳定和不可预测的。
FDA和其他机构的中断 还可能减慢必要的政府机构审查和/或批准或批准新药所需的时间,这将对我们的业务产生不利影响。例如,在过去的几年里,美国政府已经关闭了几次,某些监管机构,如FDA,不得不让FDA的关键员工休假,并停止关键的 活动。
为应对全球新冠肺炎疫情和美国突发公共卫生事件,美国食品药品监督管理局于2020年3月暂时推迟了对外国制造设施和产品的大部分检查,推迟了对国内制造设施的例行监督检查,并对临床试验的进行提供了指导。FDA利用评级系统来帮助其根据给定州和地区的病毒轨迹数据以及州和地方政府制定的规则和指南来确定在何时何地进行此类检查是最安全的。FDA使用类似的数据来通知恢复 优先在海外的业务。
如果 政府长期停摆或放缓,或者如果全球健康问题阻止FDA或其他监管机构进行定期检查、审查或其他监管活动,可能会严重影响FDA或 其他监管机构及时审查和处理监管提交的能力,这可能对我们的业务产生重大不利影响。
| 24 |
我们未来的增长在一定程度上取决于我们打入海外市场的能力,在那里我们将受到额外的监管负担和其他风险和不确定性的影响。
我们未来的盈利能力将在一定程度上取决于我们将候选产品在国外市场商业化的能力,我们打算 依赖于与第三方的合作。如果我们将其他候选产品在国外市场商业化,我们将面临额外的风险和不确定性,包括:
| ● | 我们的 客户能够在国外市场为我们的候选产品获得市场准入和适当的报销; | |
| ● | 我们无法直接控制商业活动,因为我们依赖第三方; | |
| ● | 遵守复杂多变的外国监管、税务、会计和法律要求的负担; | |
| ● | 外国不同的医疗实践和风俗习惯影响市场接受度; | |
| ● | 进口或出口许可要求; | |
| ● | 应收账款收款时间较长 ; | |
| ● | 发货的交货期更长; | |
| ● | 语言障碍 技术培训; | |
| ● | 减少国外一些国家对知识产权的保护; | |
| ● | 外国货币汇率波动;以及 | |
| ● | 在发生合同纠纷时,受外国法律管辖的合同条款的解释。 |
我们候选产品的海外销售也可能受到政府管制、政治和经济不稳定、贸易限制和关税变化的不利影响,其中任何一项都可能对我们的运营结果产生不利影响。
大流行、流行病或传染病(如新冠肺炎)的爆发可能会中断我们候选产品的开发。
大流行或类似疫情等公共卫生危机可能会对我们的业务产生不利影响。2019年12月,新冠肺炎风靡全球。冠状病毒大流行导致实施了各种应对措施,包括政府强制隔离、旅行限制和其他公共卫生安全措施。传染病的大流行、流行或暴发对我们的运营或我们第三方合作伙伴的运营(包括我们的开发研究或临床试验运营)的影响程度 将取决于未来发生的事件,这些事件具有高度的不确定性,无法自信地预测,包括任何疫情的持续时间以及控制或处理其影响的行动等。尽管我们的大部分业务是在美国进行的,但传染病在全球的传播可能会对我们在美国和海外的候选产品开发或临床试验运营造成不利影响。传染病对患者登记或治疗或我们候选产品的执行产生的任何负面影响都可能导致临床试验活动的代价高昂的延迟,这可能会对我们获得监管部门对我们候选产品的批准并将其商业化的能力产生不利影响,增加我们的运营费用,并对我们的 财务业绩产生重大不利影响。
在大流行、流行病或传染病爆发的情况下,可能会推迟或以其他方式对我们的候选产品以及我们的业务产生不利影响的一些 因素包括:
| ● | 延迟 获得当地监管机构的批准以启动我们计划的临床试验; | |
| ● | 在我们的临床试验中招募或留住参与者时出现延迟或困难; |
| 25 |
| ● | 临床站点启动延迟或困难,包括招聘临床站点调查员和临床站点工作人员的困难; | |
| ● | 临床站点延迟接收进行临床试验所需的物资和材料,包括可能影响临床试验材料运输的全球运输中断 ; | |
| ● | 作为应对大流行、流行病或传染病的一部分,地方法规发生变化 ,这可能要求我们改变进行临床试验的方式,这可能会导致意外成本,或者完全停止临床试验; | |
| ● | 将医疗资源从临床试验的进行中转移,包括将作为我们临床试验地点的医院和支持我们进行临床试验的医院工作人员进行转移; | |
| ● | 由于联邦或州政府、雇主和其他人强加或建议的旅行限制,或临床试验参与者访问和研究程序中断,如临床试验地点监测等关键临床试验活动中断, 发生可能影响临床试验数据完整性的情况; | |
| ● | 我们临床试验的参与者在临床试验进行期间感染传染病的风险 可能会影响临床试验的结果,包括增加观察到的不良事件的数量; | |
| ● | 由于我们研发机构的操作受限或有限,导致临床前研究中断 ; | |
| ● | 对我们第三方制造商运营的潜在负面影响; | |
| ● | 由于员工资源限制或员工被迫休假,与当地监管机构、道德委员会和其他重要机构和承包商的必要互动延迟 ; | |
| ● | 第三方CRO的员工资源受到限制,否则将专注于我们的临床试验的进行,包括员工或其家人生病或员工希望避免与大群人接触。 | |
| ● | FDA或其他监管机构拒绝接受受影响地区的临床试验数据;以及 | |
| ● | FDA审批前检查延迟 ,这是审批的先决条件。 |
商业化相关风险
最近颁布和未来的政策和立法可能会增加我们获得候选产品营销批准并将其商业化的难度和成本 ,并可能影响我们获得营销批准的任何候选产品的报销。
影响政府处方药采购和报销计划的立法和监管行动相对频繁。在美国。例如,2010年颁布了《患者保护和平价医疗法案》(PPACA),以扩大医疗保健覆盖范围,并对药品报销做出了重大改变。自PPACA颁布以来,美国已经提出并通过了其他影响制药业的立法修改 。例如,《2022年通货膨胀率降低法案》包括 一项条款,授权医疗保险和医疗补助服务中心(CMS)每年为有限数量的高成本、单一来源的药物谈判一个 “最高公平价格”,以及另一项条款,该条款要求 制药公司在价格上涨快于通胀的情况下向联邦医疗保险支付回扣。遵守任何新法规都可能非常耗时且成本高昂,从而对我们的业务产生重大不利影响。
| 26 |
此外,许多州提出或颁布了旨在间接或直接规范药品定价的立法,例如要求生物制药制造商公开报告专有价格信息,或对州机构购买的药品设置 最高价格上限。例如,2017年,加利福尼亚州州长 签署了一项处方药价格透明度州法案,要求处方药制造商对某些药品超过指定门槛的涨价提前 提供通知和解释。国会和州立法机构 正在考虑各种法案,这些法案将改革药品采购和价格谈判,允许更多地使用使用管理工具来限制Medicare Part D承保范围,促进从美国以外的低价药品进口,并鼓励使用仿制药。此类举措和立法可能会对我们的 产品造成额外的定价压力。
联邦或州一级的医疗补助计划更改 也可能对我们的业务产生实质性的不利影响。可能影响我们产品的承保范围和报销范围的提案,包括给予各州更大的灵活性来管理Medicaid计划涵盖的药品,以及允许从加拿大或其他国家/地区重新进口处方药,可能会通过限制我们产品的使用和承保范围而产生实质性的不利影响 。此外,由于联邦基本医疗补助退税的增加,州医疗补助计划可能会要求对我们的产品进行额外的补充退税 。如果私营保险公司或管理型医疗保健计划 跟踪医疗补助覆盖范围和付款发展,他们可以利用这些增加的返点对我们的产品施加定价压力,而他们采用较低的付款时间表可能会放大不利影响。
我们无法预测美国或国外未来的立法或行政或行政行动可能产生的政府监管的可能性、性质或程度。我们预计未来将采取更多的州和联邦医疗改革措施,其中任何一项都可能限制联邦和州政府为医疗产品和服务支付的金额。此外,拜登政府,包括美国人类和卫生服务部部长,已经表示降低处方药价格是优先事项,但我们还不知道政府将采取什么步骤,或者这些步骤是否会 成功。
影响制造商的其他拟议监管行动 可能会对我们的业务产生重大不利影响。很难预测任何此类 拟议的立法和监管行动或由此产生的州政府行动对我们产品在美国的使用和报销的影响(如果有的话) ,但我们的运营结果可能会受到不利影响。
不利的 定价法规、第三方报销做法或医疗改革举措可能会损害我们未来的业务。
制药公司面临着越来越大的压力,要求它们降低医疗成本。在美国,这些压力来自各种来源,例如管理型医疗集团以及机构和政府采购商。代表联邦医疗保健计划和私营部门受益人进行谈判的实体的购买力增加,可能会增加未来的定价压力。这种压力 还可能增加政府在定价计算方面提起诉讼或进行调查的风险。制药行业未来可能会面临更严格的监管以及政治和法律行动。
不利的 定价限制可能会阻碍我们收回在一个或多个未来候选产品上的投资的能力,即使我们未来的候选产品 获得监管部门的批准。审批前的不利定价限制也将降低我们的商业潜力,从而对我们产生不利影响。我们成功将任何潜在产品商业化的能力还将在一定程度上取决于这些产品和相关治疗的承保范围和报销范围在多大程度上可从第三方付款人处获得,包括政府卫生行政当局、私人健康保险公司和其他组织。第三方付款人决定他们将支付哪些药物,并建立 报销级别。适用于医药产品的获得保险和报销的类似挑战也将适用于伴随诊断。
美国医疗保健行业和其他地方的一个重要趋势是成本控制。第三方付款人试图通过限制特定药物的承保范围和报销金额来控制成本。越来越多的第三方付款人 要求公司在标价的基础上向他们提供预先确定的折扣,并对医疗产品的收费提出挑战。我们不能确保将来我们商业化的任何产品都可以获得保险和报销,如果可以报销,报销级别是多少。报销可能会影响我们未来获得市场批准的任何 产品的需求或价格。如果无法获得报销或仅限于有限级别, 我们可能无法成功将我们成功开发的任何候选产品商业化。
| 27 |
在获得批准产品的报销方面可能会出现重大延误,并且覆盖范围可能比FDA或其他国家/地区的监管机构批准该产品的用途更为有限。此外,获得报销资格并不意味着在所有情况下都会为任何产品付款,或以覆盖我们的成本(包括研发、制造、销售和分销)的费率付款。新产品的临时付款(如果适用)也可能不足以支付我们的成本,可能不会成为永久性付款 。付款率可能会因产品的使用和临床环境的不同而有所不同,可能基于已报销的低成本产品所允许的付款 ,并可能合并到其他服务的现有付款中。产品的净价 可以通过第三方付款人要求的强制性折扣或回扣,以及未来任何法律的放松来降低,因为法律 目前限制从产品销售价格低于美国的国家/地区进口产品。第三方付款人 在设置他们自己的报销政策时通常依赖于Medicare承保政策和支付限制,但除了Medicare承保范围和报销决定之外,还有他们自己的 方法和审批流程。因此,一个第三方付款人决定为某一产品提供保险并不能保证其他付款人也会为该产品提供保险。我们无法 迅速从第三方付款人那里获得批准产品的承保范围和足够的补偿,这可能会对我们的经营业绩、我们筹集将潜在产品商业化所需的资金的能力以及我们的整体财务状况产生实质性的不利影响。
我们 可能会花费有限的资源来追求特定的候选产品或指示,而无法利用可能更有利可图或成功可能性更大的候选产品或指示 。
由于 我们的财务和管理资源有限,因此我们专注于针对特定 适应症确定的开发计划和候选产品。因此,我们可能会放弃或推迟寻求其他候选产品的商机,或寻求后来被证明具有更大商业潜力的其他迹象。我们的资源分配决策可能会导致我们无法利用可行的商业药物或有利可图的市场机会。我们在当前和未来研发计划和特定适应症候选产品上的支出可能不会产生任何商业上可行的产品。如果我们没有准确评估特定候选产品的商业潜力或目标市场,我们可能会通过协作、 许可或其他版税安排向该候选产品放弃宝贵的权利,而在这种情况下,我们保留对该候选产品的独家开发和 商业化权利会更有利。
我们候选产品的商业成功(如果获得批准)在一定程度上取决于是否获得医生、患者、第三方付款人和医学界的市场认可。
我们创造产品收入的能力将在很大程度上取决于我们成功获得候选产品的最终营销批准并将其商业化的能力。
即使我们的任何候选产品CTX-1301、CTX-1302和/或CTX-2103获得监管部门的批准,也可能无法在医生、患者、第三方付款人和医疗保健社区中获得足够的市场接受度。未能获得市场认可将限制我们的创收能力,并将影响我们的运营结果。CTX-1301、CTX-1302和/或CTX-2103的市场接受度将取决于许多因素,包括:
| ● | CTX-1301、CTX-1302和/或CTX-2103的疗效和潜在优势,以及与替代疗法或竞争产品的比较; | |
| ● | 我们的第三方合作者努力教育医生和患者有关CTX-1301、CTX-1302和/或CTX-2103的潜在益处和 优势的有效性; | |
| ● | 医疗保健社区和患者采用新技术的意愿; | |
| ● | 在我们获得监管批准并拥有商业权的地区,基于我们目标患者群体的规模,此类候选药物的市场规模。 | |
| ● | 任何副作用的流行率和严重程度; |
| 28 |
| ● | 通过广泛的商业分销证明候选药物的安全性; | |
| ● | 能够以具有竞争力的价格销售我们的候选产品; | |
| ● | 我们的候选产品相对于竞争产品的成本效益 ; | |
| ● | 有能力生产我们所有的产品CTX-1301、CTX-1302以及CTX-2103; | |
| ● | 医生、患者和医疗保健社区(包括第三方付款人)对CTX-1301、CTX-1302和/或CTX-2103与竞争产品或疗法相比的安全性、有效性和潜在益处的看法。 | |
| ● | 与其他产品审批有关的任何此类上市审批的时间; | |
| ● | 任何 限制合并使用其他药物; | |
| ● | 支持 患者权益团体; | |
| ● | 相对 与替代治疗相比,给药方便和容易;以及 | |
| ● | 该 从政府医疗计划和第三方支付者以及定价相关机构获得足够的保险和报销的可用性 其他竞争产品和疗法。 |
如果 我们的候选药物获得批准,但未能获得关键市场参与者的充分认可,我们将无法 产生可观的收入,我们可能无法实现或保持盈利,这可能需要我们寻求额外的融资。
我们 为我们的候选产品协商、获取和维护第三方承保和报销的能力可能会受到美国和其他司法管辖区的政治、 经济和监管发展的影响。各国政府继续实施成本控制措施, 第三方支付者越来越多地质疑药品的价格,并审查其成本效益以及安全性和有效性。这些和其他类似的发展可能会大大限制我们未来获得上市批准的任何候选产品 的市场接受程度。
我们 可能面临来自其他制药公司的激烈竞争,如果我们无法有效竞争,我们的经营业绩将受到影响。
制药行业竞争激烈,且易受快速而重大的技术变革的影响。如果我们不能站在技术变革的 前沿,我们可能无法有效地竞争。我们的竞争对手 开发的技术进步或产品可能会使我们的技术或候选产品过时、竞争力下降或不经济。
We expect to have competitors both in the United States and internationally, including major multinational pharmaceutical companies. For example, amphetamine XR is currently marketed in the United States by Shire under the brand name Adderall XR, and methylphenidate is marketed in the United States by Janssen under the brand name Concerta, and by Novartis under the brand names Focalin XR and Ritalin LA. Further, makers of branded drugs could also enhance their own formulations in a manner that competes with our enhancements of these drugs. Many of our competitors have substantially greater financial, technical and other resources, such as larger research and development staff and more experienced marketing and manufacturing organizations. Mergers and acquisitions in the biotechnology and pharmaceutical industries may result in even more resources being concentrated in our competitors. As a result, these companies may obtain regulatory approval more rapidly than we are able and may be more effective in selling and marketing their products as well. Smaller or early-stage companies may also prove to be significant competitors, particularly through collaborative arrangements with large, established companies. Competition may increase further as a result of advances in the commercial applicability of technologies and greater availability of capital for investment in these industries. Our competitors may succeed in developing, acquiring or licensing on an exclusive basis drug products or drug delivery technologies that are more effective or less costly than our PTR platform, or any product candidate that we are currently developing or that we may develop. In addition, our competitors may file citizens petitions with the FDA in an attempt to persuade the FDA that our products, or clinical trials that support their approval, contain deficiencies or that new regulatory requirements be placed on the product candidate or drug class of the product candidate. Such actions by our competitors could delay or even prevent the FDA from approving any NDA that we submit under Section 505(b)(2).
| 29 |
即使 我们成功获得监管批准,先于竞争对手将候选产品商业化,我们未来的药品 也可能面临来自仿制药和其他后续药品的直接竞争。未来可能获得监管 批准的任何候选产品都可能比预期更早或更激烈地面临仿制药的竞争,这取决于 此类获批产品在美国处方药市场的表现。在许多情况下,我们的竞争能力也可能受到保险公司或其他第三方付款人鼓励使用仿制药的影响。仿制药预计将在未来几年内上市 。即使我们的候选产品获得了上市批准,它们的定价也可能比竞争对手 仿制药高出很多,如果届时有任何仿制药已获得批准的话。
除了创建505(b)(2)NDA途径外,FDCA的Hatch-Waxman修正案还授权FDA批准仿制药,这些仿制药与先前根据法规的NDA条款批准上市的药物相同,并符合已批准的简化新药申请(“ANDA”)。ANDA依赖于对先前批准的 参考上市药物(“RLD”)进行的临床前和临床试验,并且必须向FDA证明其与RLD“生物等效”。当某些营销或数据独占保护适用于RLD时,法规禁止 FDA批准ANDA。如果任何此类 竞争对手或第三方能够证明生物等效性而不侵犯我们的专利,则该竞争对手或第三方可以 将竞争仿制药推向市场。
我们 认为,我们成功竞争的能力将取决于但不限于:
| ● | 我们的产品和候选产品的 有效性和安全性,包括与第三方正在开发的上市产品和候选产品的有效性和安全性 ; | |
| ● | 我们的候选产品完成临床开发和获得上市批准所需的时间; | |
| ● | 与监管机构保持良好关系的能力; | |
| ● | 将我们获得监管部门批准的任何候选产品进行商业化和营销的能力; | |
| ● | 我们产品和获得监管批准的候选产品的价格,包括与品牌或仿制药竞争对手的比较; | |
| ● | 私人和政府医疗保险计划(包括医疗保险)是否提供覆盖范围和适当的报销水平; | |
| ● | 保护与我们的产品和候选产品相关的知识产权的能力; | |
| ● | 在成本效益的基础上制造和销售我们的产品和获得监管批准的候选产品的商业数量的能力;以及 | |
| ● | 接受我们的任何产品和获得医生和其他医疗保健提供者监管批准的候选产品。 |
如果我们的竞争对手销售比我们的产品更有效、更安全或更便宜的产品(如果有),或者比我们的产品更早上市的产品(如果有),我们可能会在周期中进入市场太晚,可能无法取得商业成功,或者我们可能不得不降低价格,这将影响我们的创收和盈利能力。
此外,成功的商业化还取决于我们是否能够充分保护和有效应对专利和其他知识产权持有者提出的任何索赔 我们的产品侵犯了他们的权利,我们的产品是否产生了任何意想不到的不利影响或负面宣传,以及作为竞争对手出现的新产品或现有产品, 这可能被证明是更具临床效果和成本效益的。如果我们无法成功完成这些任务,我们可能会 无法及时商业化,或者根本无法产生足够的收入来维持 和发展我们的业务。
| 30 |
我们 无法预测潜在后续竞争对手的兴趣,也无法预测其他竞争对手寻求以多快的速度将竞争产品推向市场, 是作为ANDA的直接竞争对手获得批准,还是作为505(B)(2)保密协议参考我们未来的药物产品之一。如果FDA未来批准我们候选药物的仿制药 版本,如果它们被批准用于商业营销,则此类竞争产品可能会在我们的候选产品可能已获得批准的每个适应症上立即与我们竞争,这可能会对我们未来的收入、盈利能力和现金流产生负面 影响,并极大地限制我们从对这些候选产品的投资中获得回报的能力。
围绕阿片类药物和兴奋剂滥用的社会问题,包括执法部门对分流的担忧以及打击滥用的监管努力,可能会降低我们候选产品的潜在市场。
媒体 关于处方药物滥用以及阿片类药物、兴奋剂和其他受控物质转移的报道屡见不鲜。 执法和监管机构可能会采取政策,试图限制阿片类药物和兴奋剂的供应。这些努力可能会抑制我们将候选产品商业化的能力。有关阿片类药物的激进执法和不利宣传, 滥用威慑配方的限制,对处方药滥用的公众询问和调查,诉讼或监管活动,我们产品的销售、营销、分销或储存可能会损害我们的声誉。如果获得批准,这种负面宣传可能会缩小我们候选产品的潜在市场规模,并减少我们能够从它们的销售中获得的收入。
此外,国会、州立法机构、FDA和其他监管机构目前和未来打击阿片类药物和兴奋剂滥用的努力可能会对我们的候选产品市场产生负面影响。立法者或FDA可能会在任何时候宣布新的立法或监管举措,这可能会增加我们的产品候选产品的监管负担或减少商业机会。
与我们依赖第三方相关的风险
如果 我们未能及时按要求批量生产我们的产品或候选产品,或未能遵守适用于制药制造商的严格规定 ,我们可能会在候选产品的开发和商业化过程中面临监管处罚和延迟 。
我们 目前依赖第三方供应商为我们的候选产品提供原料药和辅料。原材料供应方面的任何短缺都可能导致生产或其他延误,从而对我们造成不利影响。此外,由于监管部门通常必须批准医药产品的原材料来源,因此原材料供应商的变更可能会 导致生产延迟或原材料成本上升。任何此类延误都可能引发处罚,这将对我们的业务产生负面影响 。如果我们的原材料制造商遇到困难或未能履行对我们的义务 ,我们获得FDA批准并销售我们的产品和候选产品的能力将受到威胁。此外,临床试验供应的任何延迟或中断都可能延迟或禁止完成我们的生物等效性和/或临床 试验,增加与进行我们的生物等效性和/或临床试验相关的成本,并根据延迟的时间段, 要求我们开始新的试验,并支付巨额额外费用或终止试验。
制药产品的制造需要大量的专业知识和资本投资,包括开发先进的制造技术和工艺控制。制药公司在扩大生产规模方面可能会遇到困难。这些问题 包括与生产成本和产量有关的制造困难、质量控制(包括产品的稳定性和质量保证测试)、合格人员短缺以及遵守联邦、州和外国法规。我们可能还需要 购买其他设备,其中一些设备可能需要几个月或更长时间来采购、设置和验证,并增加我们的软件和计算能力以满足不断增长的需求。如果管理不好这种增长或过渡,可能会导致周转时间延迟、产品成本上升、产品质量下降或对竞争挑战的响应速度变慢。这些领域中的任何一个领域的失败都可能使我们难以满足市场对我们产品的期望,并可能损害我们的声誉和业务前景。
| 31 |
药品制造商 需要遵守FDA通过其设施检查计划执行的cGMP要求。 cGMP要求包括质量控制、质量保证、记录和文档的维护 以及调查和纠正任何与法规要求不符的情况的义务。未能遵守这些要求 可能会导致罚款和民事处罚、暂停生产、暂停或延迟产品审批、产品扣押或自愿召回,或撤回产品审批。如果我们的任何产品或候选产品的安全因未能遵守适用法律或其他原因而受到损害,我们可能无法获得或保持对该 候选产品的监管批准,或无法成功将此类产品或候选产品商业化,并且我们可能需要对由此造成的任何伤害负责。这些因素中的任何一个都可能导致我们的产品或候选产品的临床开发、监管提交、审批或商业化的延迟 ,导致成本上升或导致我们无法有效地将我们的候选产品商业化。
我们 CTX-1301和/或CTX-1302的供应来源有限,因为这些都是预定产品,供应链的任何中断都可能影响CTX-1301和/或CTX-1302的生产和销售,并导致我们的候选产品开发和商业化的延迟 。
我们计划为 CTX-1301和/或CTX-1302提交的NDA将包括我们为每个候选产品建议的制造工艺。对我们的制造流程、设施或供应商的任何更改都可能需要我们修改保密协议。对我们的制造流程、设施或供应商的任何更改都可能需要我们修改保密协议。此外,由于我们用于生产候选产品的专有工艺,我们无法立即将药品的生产活动 转移到替代供应商,更换生产设施将耗时 且可能是一项代价高昂的工作。例如,在2022年10月,我们宣布了一个新的CMO。CTX-1301固定剂量研究被推迟了 ,同时建立了使用新CMO的制造工艺,以生产固定剂量研究所需的最终剂量强度 。未来生产设施的潜在变化还要求我们补充我们的保密协议文件,以包括 生产地点的变化。为我们的候选产品或产品确定任何一种或多种成分 物质的适当合格替代供应来源可能非常耗时,而且我们可能无法做到这一点而不会在我们候选产品的开发和商业化过程中招致重大延误。任何替代供应商还需要通过NDA补充剂获得资格,并可能需要接受FDA的检查才能批准补充剂,这可能会导致进一步的延迟, 包括与其他临床试验相关的延迟。
这些 因素可能会导致我们候选产品的临床试验、监管提交、所需审批或商业化的延迟, 导致我们产生更高的成本,并阻止我们将其成功商业化。此外,如果我们的供应商未能及时以商业合理的价格交付所需的商业数量的组件和原料药,包括如果我们的供应商 没有获得足够的DEA配额来供应某些预定的组件,并且我们无法获得一个或多个能够以基本相同的成本生产、我们候选产品的商业化和未来潜在候选产品的临床试验的替换 供应商,则可能会延迟或我们可能会损失潜在收入,我们的业务、财务状况、运营结果和声誉可能会受到不利影响。
我们 依赖并预计将继续完全依赖第三方来制定和生产我们的临床前、临床试验和商业药品供应。我们任何候选药物的开发和商业化可能会被停止、推迟或利润下降 如果这些第三方未能向我们提供足够数量的此类药物供应或未能以可接受的质量水平提供此类药物, 包括根据适用的法规要求或合同义务,我们的运营可能会因此受到损害。
我们 目前没有也不计划在内部收购基础设施或能力(如我们自己的生产设施), 来生产临床前和临床药物供应,用于我们的临床试验和临床前研究或商业数量的 可能获得监管批准的任何候选药物。我们从唯一来源、第三方供应商处采购散装原料药, 已与CMO签订合同,在其工厂生产候选药物,我们预计在 可预见的未来将继续这样做。因此,我们缺乏资源和专业知识来配制或生产我们自己的候选药物,我们对第三方的依赖增加了我们无法以可接受的成本获得足够数量的散装原料药或候选产品的风险,这可能会延迟、阻止或损害我们及时进行临床试验或我们的其他开发或商业化努力的能力。例如,由于前CMO的运营资源问题,我们在CTx-1301固定剂量研究的临床供应品 的生产和交付中出现延迟。临床供应品的生产进一步延迟,而我们的新CMO确立了CTx-1301的生产工艺。
| 32 |
我们 已与一家CMO签订协议,并计划由该CMO生产我们的候选药物CTx-1301的所有临床、注册和商业批次,我们计划与一家或多家生产商签订协议,为我们未来的临床试验和/或商业销售生产、供应、储存和 分销药品。我们打算建立或继续这些关系 以供应我们的候选药物;但是,无法保证我们能够以商业上合理的条款 保留这些关系(如果有的话)。如果我们无法维持这些关系,我们在寻找和鉴定新CMO时可能会遇到开发工作延迟 。如果我们目前的任何候选药物或我们将来可能开发或收购的任何候选药物 获得监管批准,我们将依赖一个或多个CMO生产此类药物的商业供应。
即使 我们能够维持现有的第三方关系或与其他第三方制造商建立任何此类协议, 依赖第三方制造商也会带来额外的风险,包括但不限于:
| ● | 信赖 对第三方进行FDA和DEA法规遵从性和质量保证; | |
| ● | 我们的专有信息可能被盗用,包括我们的商业秘密和专有技术; | |
| ● | 中断 和与更换供应商相关的成本,包括额外的监管申报; | |
| ● | 第三方可能在代价高昂或给我们带来不便的时间违反、终止或不续订协议; | |
| ● | 延迟或无法采购或扩大足够的制造能力; | |
| ● | 无法在商业上合理的条件下与第三方谈判制造协议; | |
| ● | 以对我们造成代价或损害的方式或时间终止或不续订与第三方的制造协议;以及 | |
| ● | 产品组件依赖有限数量的来源,在某些情况下依赖单一来源,因此,如果我们无法 确保这些产品组件的充足供应,我们将无法以及时的 方式、充足的数量或可接受的条件制造和销售我们的候选产品。 |
这些风险中的每一个都可能推迟我们的临床试验、我们候选药物的批准(如果有的话)或我们候选药物的商业化, 可能导致更高的成本或可能剥夺我们潜在的产品收入。其中一些事件可能是FDA采取行动的基础,包括禁令、召回、扣押或完全或部分暂停生产。
虽然我们对我们的候选产品的制造负有最终责任,但我们并不自己制造我们的产品, 我们依赖我们的CMO来遵守CGMP。我们与CMO签订的协议要求他们按照某些cGMP要求执行 ,例如与质量控制、质量保证和合格人员相关的要求,但我们无法控制我们CMO的行为以执行和维护这些标准。如果我们的CMO不能成功生产符合我们规格和 FDA或其他监管机构严格监管要求的材料,我们将被阻止获得我们候选药物的监管批准 ,除非我们聘请能够符合此类要求的替代CMO,而我们可能无法 做到这一点。我们的任何CMO的任何此类失败都将严重影响我们开发、获得营销批准或营销我们的候选产品的能力(如果获得批准)。
此外, 如果我们的候选产品获得批准,我们的供应商将接受监管要求,包括制造、测试、质量控制和与我们候选产品相关的记录保存,并接受监管机构的持续检查。 我们的任何供应商未能遵守适用的法规可能会导致我们的制造能力长时间延误和中断 我们正在寻求另一家符合所有法规要求的供应商,以及与任何必要的 召回或其他纠正措施相关的市场中断。
| 33 |
第三方 制造商可能无法遵守cGMP法规或美国以外的类似法规要求。我们未能遵守适用法规或第三方制造商未能遵守相关法规可能导致对我们实施制裁, 包括警告信、临床暂停或终止临床试验、罚款、禁令、归还、退还、民事处罚、 延迟、暂停或撤回批准或其他许可、FDA拒绝批准待定申请、产品扣留、FDA 同意法令对生产和分销业务施加重大限制或暂停、禁止、拒绝允许进口或出口、产品扣留、不良宣传、亲爱的医疗保健提供者信函或其他警告,吊销许可证、扣押或召回候选产品、操作限制、拒绝政府合同或现有合同下的未来订单,以及 民事和刑事责任,包括虚假索赔法案责任、被排除在联邦医疗保健计划之外以及 公司诚信协议等后果,任何这些后果都可能对我们的产品供应产生重大不利影响。
如果我们的第三方合同制造商未能遵守与受控物质相关的DEA法规,可能会导致他们的许可证被吊销 ,我们的产品和候选产品的生产可能会中断或停止。这将影响我们开发、 获得市场批准或营销我们的候选产品(如果获得批准)的能力。
我们的 候选产品和我们可能开发的任何药品可能会与其他候选产品和药品争夺制造设施的使用权,而我们可能无法以优惠条款获得这些设施的使用权。
在cGMP法规下运营并拥有DEA许可证以采购、持有和使用受管制物质的制造商数量有限。我们现有或未来制造商的任何性能故障都可能推迟临床开发或营销审批 。我们目前没有安排多余的供应或第二个合同制造商。如果我们当前的合同 制造商不能按约定履行,我们可能需要更换此类制造商,并且在确定 和任何此类更换的资格时,我们可能会产生额外的成本和延迟。例如,由于我们以前的CMO的运营资源问题,我们在生产和交付CTX-1301固定剂量研究的临床用品方面遇到了延误。临床用品的生产进一步推迟了 而我们的新CMO建立了CTX-1301的制造工艺。
我们 预计将依赖第三方为我们的候选产品进行临床试验和监管提交,而这些第三方的表现可能不令人满意,包括未能在截止日期前完成此类试验和/或监管提交。
我们 希望为我们计划的临床试验和我们的候选产品的监管提交与CRO合作。我们希望依靠CRO以及其他第三方(如临床数据管理组织、监管策略师、医疗机构和临床研究人员)进行我们计划的临床试验,为我们的候选产品准备适当的监管提交文件,并协助确保遵守适用的监管要求。与此类第三方的协议可能会因各种原因而终止,包括第三方未能履行。如果我们需要达成替代安排,我们的药物开发活动将被推迟。
我们对这些第三方进行临床开发活动的依赖可能会减少我们对这些活动的控制,但不会减轻我们的责任。例如,我们将继续负责确保我们的每一项临床试验都按照试验的总体研究计划和方案进行。此外,FDA要求我们遵守进行、记录和报告临床试验结果的监管标准,即通常称为良好临床实践或GCP,以确保数据和报告的结果可信和准确,并保护试验参与者的权利、完整性和机密性 。监管机构通过定期检查试验赞助商、主要调查人员和试验场地来执行这些GCP。我们还被要求在指定的时间范围内注册指定的正在进行的临床试验,并在政府资助的 数据库ClinicalTrials.gov上公布已完成的临床试验结果。此外,我们必须使用根据cGMP要求生产的产品进行临床试验。如果不遵守这些规定,我们可能需要重复进行临床试验,这将推迟监管部门的审批流程。未能遵守与我们、我们的CRO或临床试验站点相关的适用要求还可能导致临床暂停和终止临床试验、取消资格、FDA拒绝批准基于临床数据的申请、警告信、如果产品已获得批准则撤回上市批准、罚款和其他金钱处罚、 延迟、不利宣传以及民事和刑事制裁等后果。
| 34 |
此外, 这些第三方还可能与其他实体有关系,其中一些可能是我们的竞争对手。如果这些第三方 没有按照法规要求或我们规定的规程成功履行其合同职责、在预期期限内完成或进行我们的临床试验,我们将无法获得或可能延迟获得我们候选产品的营销批准,并且我们将无法成功地将我们的候选产品商业化,或者可能会推迟我们的努力。
此外,我们临床试验的首席研究人员可能会不时担任我们的科学顾问或顾问, 可能会因此类服务获得现金或股权补偿。如果这些关系和任何相关的赔偿导致感知或实际的利益冲突,或者FDA得出结论认为财务关系可能影响了研究的解释 ,则在适用的临床试验地点生成的数据的完整性可能会受到质疑,临床试验本身的效用可能会受到威胁,这可能会导致FDA提交的任何保密协议被推迟或拒绝。任何此类延迟或拒绝 都可能阻止我们将候选产品商业化。此外,我们与主要调查人员的安排也受到其他医疗监管法律的审查,例如联邦反回扣法规。
我们 还希望依赖其他第三方来存储和分发我们临床试验的产品供应。我们的分销商如果出现任何性能故障或不遵守适用的法规要求(包括FDA或DEA的要求),可能会延误我们候选产品的临床开发或营销审批或产品的商业化,造成额外损失 并剥夺我们潜在的产品收入。
如果 与我们签约的第三方未能成功履行其合同职责或义务或未能在预期期限内完成 ,或者如果他们获得的临床数据的质量或准确性因未能遵守我们的临床方案或法规要求或其他原因而受到影响,我们的临床试验可能会被延长、推迟或终止,我们可能需要进行额外的 试验,并且我们可能无法获得监管部门的批准或将我们的候选产品成功商业化。因此,我们候选产品的商业前景将受到损害,我们的成本可能会增加,我们的创收能力可能会 延迟。如果我们未来无法成功识别和管理第三方服务提供商的业绩,我们的业务可能会受到不利影响。
我们 依赖与第三方的合作来开发我们的候选产品并将其商业化。如果这些协作 不成功,我们可能无法利用这些候选产品的市场潜力。
2023年3月7日, 我们与Indegene,Inc.(“Indegene”)签订了联合商业化协议(“商业化协议”) 。根据商业化协议,Indegene将为我们提供CTX-1301的商业化服务,包括与以下相关的服务:(A)医疗事务和药物警戒;(B)定价、报销和市场准入;(C)商业运营;以及(D)营销。
我们 还可能为我们的候选产品的开发和商业化寻找更多的第三方合作伙伴,包括 用于我们的任何获准在美国境外营销的候选产品的商业化。潜在的合作伙伴 包括共同商业化合作伙伴以及地区、国家和国际大中型制药公司。
我们 可能对我们当前和未来的任何合作者专门用于开发我们的候选产品或将其商业化的资源的数量和时间进行有限的控制。我们从这些安排中创造收入的能力将取决于我们的合作者 成功履行这些安排中分配给他们的职能的能力。根据商业化协议,我们和Indegene将签订工作声明,其中将列出Indegene将提供的服务、此类服务的可交付内容以及我们将支付的费用。我们可能无法按照我们可以接受的条款协商工作说明书的条款,包括Indegene将提供的服务或我们应支付的费用,或者根本无法协商。如果我们无法做到这一点,我们将不得不为CTX-1301的商业化寻求其他合作,这可能会推迟商业化。
我们的 当前合作构成风险,未来任何涉及我们候选产品的合作都将带来以下风险,包括但不限于:
| ● | 我们 可能不得不放弃对我们的知识产权、未来收入来源、研究计划或候选产品的宝贵权利, 或以可能对我们不利的条款授予许可; | |
| ● | 协作者 在确定他们将应用于这些协作的工作和资源方面有很大的自由裁量权; |
| 35 |
| ● | 协作者 可能未按预期履行义务; | |
| ● | 协作者 不得对获得监管部门批准的任何候选产品进行开发和商业化,也不得基于临床试验结果、协作者战略重点或可用资金的变化或外部因素(如收购)而选择不继续 或续订开发或商业化计划; | |
| ● | 合作者 可以推迟临床试验,为临床试验计划提供资金不足,停止临床试验或放弃候选产品,重复或进行新的临床试验,或要求新的候选产品配方进行临床测试; | |
| ● | 与我们合作发现的候选产品 可能会被我们的合作者视为与他们自己的候选产品 竞争,这可能会导致合作者停止投入资源将我们的候选产品商业化; | |
| ● | 获得监管批准的、对我们的一个或多个候选产品拥有营销和分销权限的 合作者可能 没有投入足够的资源用于此类产品的营销和分销; | |
| ● | 与合作者的分歧 ,包括在专利权、合同解释或首选开发过程上的分歧, 可能会导致候选产品的研究、开发或商业化的延迟或终止,可能会导致我们对候选产品承担额外的 责任,或者可能导致诉讼或仲裁,其中任何一项都将耗时 且成本高昂; | |
| ● | 合作者 可能无法正确维护或捍卫我们或他们的知识产权,或可能以 方式使用我们或他们的专有信息,从而招致诉讼,从而危及或使此类知识产权或专有信息无效,或使我们面临潜在的诉讼; | |
| ● | 合作者 可能会侵犯第三方的知识产权,这可能会使我们面临诉讼和潜在的责任; | |
| ● | 如果我们终止合作,我们 可能需要支付终止费;以及 | |
| ● | 为了协作者的方便,可能会终止合作 ,如果终止,我们可能需要筹集额外资金以 进一步开发适用的候选产品或将其商业化。 |
商业化协议和任何未来的协作协议可能不会以最有效的方式或根本不会导致候选产品的开发或商业化。如果我们现在或未来的合作伙伴参与业务合并,我们对药物开发或商业化计划的持续追求和重视可能会被推迟、减少或终止。
如果 我们无法保持或建立协作,我们可能不得不更改我们的开发和商业化计划。
根据商业化协议,Indegene将为我们提供CTX-1301的商业化服务,包括与(A)医疗事务和药物警戒有关的服务;(B)定价、报销和市场准入;(C)商业运营;以及(D)营销。
我们的候选产品和临床项目的开发以及潜在的商业化将需要大量的额外资金。 对于我们的一些候选产品,我们可能需要与合作商业合作伙伴或制药公司保持并进一步合作,以开发和/或商业化这些候选产品。
| 36 |
我们在寻找合适的合作者方面面临着激烈的竞争。我们是否就协作达成其他最终协议 将取决于我们对协作者的资源和专业知识的评估、提议的协作的条款和条件以及提议的协作者对多个因素的评估。这些因素可能包括临床试验的设计或结果,FDA或美国以外的类似监管机构批准的可能性,候选产品的潜在市场,制造和向患者交付候选产品的成本和复杂性,竞争产品的潜力,关于我们技术所有权的不确定性的存在,如果对这种所有权提出挑战,而不考虑挑战的是非曲直,以及一般的行业和市场状况。 合作伙伴还可以考虑替代候选产品或技术,以获得可能可供协作的类似指示,以及此类协作是否会比我们与我们的候选产品协作更具吸引力。
根据商业化协议,我们和Indegene将签订工作声明,其中将列出Indegene将提供的服务、此类服务的可交付内容以及我们将支付的费用。我们可能无法按照我们可以接受的条款协商工作说明书的条款 ,包括Indegene将提供的服务或我们应支付的费用,或者根本无法进行谈判。如果我们无法做到这一点,我们将不得不为CTX-1301的商业化寻求其他合作,这可能会推迟商业化。
我们 可能无法及时、按可接受的条款或根本无法协商协作。如果我们无法做到这一点,我们可能需要 减少候选产品的开发,减少或推迟我们的一个或多个开发计划,推迟潜在的商业化 或缩小任何销售或营销活动的范围,或者增加我们的支出并自费开展开发或商业化活动 。如果我们选择增加我们的支出来为自己的开发或商业化活动提供资金, 我们可能需要获得额外的资本,这些资本可能无法以可接受的条款提供给我们,或者根本无法获得。如果我们没有足够的 资金,我们可能无法进一步开发我们的候选产品或将其推向市场并产生产品收入。
我们 依赖第三方为我们商业化的任何产品提供许多基本服务,包括分销、客户服务、应收账款管理、现金催收和不良事件报告。如果这些第三方未能按预期执行或 遵守法律和法规要求,我们将CTX-1301、CTX-1302和/或CTX-2103商业化的能力将受到严重影响 ,我们可能会受到监管制裁。
根据商业化协议,Indegene将为我们提供CTX-1301的商业化服务,包括与(A)医疗事务和药物警戒有关的服务;(B)定价、报销和市场准入;(C)商业运营;以及(D)营销。
我们 可以保留额外的第三方服务提供商来执行与销售和分销我们的任何或所有产品有关的各种功能,包括CTX-1301、CTX-1302和CTX-2103,如果获得批准,这些产品的关键方面将不在我们的直接控制范围内。 这些服务提供商可能会提供与分销、客户服务、应收账款管理和现金收款相关的关键服务。
我们将在很大程度上依赖Indegene,并将在很大程度上依赖任何未来的第三方提供商为我们提供服务。如果这些 第三方服务提供商未能遵守适用的法律法规、未能在预期的最后期限内完成工作,或者没有履行其合同义务,我们交付产品以满足商业需求的能力可能会受到严重影响。此外,我们还可以聘请第三方为我们提供与不良事件报告、安全数据库管理、满足有关我们候选产品的医疗信息请求和相关服务相关的各种其他服务。如果这些服务提供商维护的数据的质量或准确性不足,或者他们未能满足各种要求,我们可能会受到监管部门的制裁。
如果 我们无法为我们的产品或候选产品实现并保持足够的承保和报销水平,如果获得批准, 他们的商业成功可能会受到严重阻碍。
我们的产品和任何获得监管部门批准的候选产品的成功销售取决于第三方付款人是否提供足够的保险和 报销。服用处方药治疗其病情的患者通常依赖第三方付款人来报销与其处方药相关的全部或部分费用。政府医疗保健计划(如Medicare和Medicaid)和商业付款人的充分覆盖和报销 对于新产品的接受度至关重要。覆盖范围 可能取决于临床和经济标准,当更成熟或成本更低的治疗替代产品已经可用或随后可用时,这些标准不利于新药产品。假设我们获得了特定产品的承保范围,因此产生的报销费率可能不够高,或者可能需要患者认为不可接受的高共付额。患者不太可能使用我们的 产品,除非提供保险并且报销足以支付我们产品的大部分成本。
| 37 |
此外,CTX-1301、CTX-1302和CTX-2103的市场将在很大程度上取决于能否获得第三方付款人的药物处方 或第三方付款人提供保险和报销的药物清单。行业竞争将被纳入此类 配方,往往会给制药公司带来下行定价压力。此外,当有成本较低的仿制药或其他替代品时,第三方付款人可以拒绝在其处方中包括特定的 品牌药物,或通过处方控制或以其他方式限制患者接触品牌药物。
第三方付款人,无论是国外的还是国内的,或者政府的还是商业的,都在开发越来越复杂的方法来控制医疗成本。 此外,在美国,第三方付款人之间对药品的承保和报销没有统一的政策要求。因此,药品的承保范围和报销范围因付款人而异。因此,承保范围确定过程通常是一个耗时且昂贵的过程,需要我们分别为每个付款人提供使用我们的产品的科学和临床支持,但不能保证将始终如一地应用承保范围和充分的报销 或首先获得。
此外, 我们认为,未来的保险和报销可能会在美国和国际市场受到更多限制。我们可能获得监管部门批准的候选产品的第三方承保范围和报销可能无法在美国或国际市场获得或不够用,这可能会对我们的业务、运营结果 、财务状况和前景产生重大不利影响。
第三方付款人可能无法充分覆盖或补偿消费者购买我们产品的费用。
我们未来的收入和从运营中产生正现金流的能力可能会受到政府和第三方付款人通过各种手段控制或降低医疗成本的持续努力的影响。在某些国外市场,处方药的定价受到政府的管制。在美国,已经有并预计将继续有许多联邦和州政府提出实施类似的政府控制措施。我们无法确定将采用什么立法提案,或者联邦、州或私人医疗产品和服务的付款人可能会对任何药品定价改革提案或立法采取什么行动 。此类改革可能会使我们难以完成产品的开发和测试,因此 可能会限制我们从销售中获得收入并实现盈利的能力。此外,如果此类改革可能会影响我们的业务和合作伙伴,我们将产品商业化的能力可能会受到损害。
在 美国和其他地方,处方药产品的销售在很大程度上仍然取决于消费者能否从第三方付款人(如政府和私人保险计划)获得报销。第三方付款人对医疗产品的收费提出了越来越多的挑战。CTX-1301、CTX-1302和/或CTX-2103的市场将在很大程度上取决于第三方付款人是否提供保险和报销。行业为获得报销资格而展开的竞争往往会导致药品的价格下行压力 。此外,当有价格较低的仿制药或其他替代品可用时,第三方付款人可能会拒绝报销特定品牌的药物或产品。在美国,第三方付款人之间没有统一的药品 产品承保和报销政策。由于每个第三方付款人分别批准承保范围和报销级别,因此获得承保范围和足够的报销是一个既耗时又昂贵的过程。我们将被要求为使用我们的产品分别向每个第三方付款人提供科学和临床支持,但不保证会获得批准。这一过程可能会推迟市场对我们产品的接受程度,并可能对我们未来的收入和经营业绩产生负面影响。即使我们 成功地将CTX-1301、CTX-1302和/或CTX-2103推向市场,我们也不能确定它是否具有成本效益,或者 是否可以为患者提供覆盖范围和足够的补偿。患者可能不太可能使用CTX-1301、CTX-1302和/或CTX-2103,除非提供保险,并且报销足以支付其大部分费用。
此外,在许多外国,特别是欧盟内的国家,处方药的定价受到政府的管制。在美国以外的一些司法管辖区,药物的建议定价必须获得批准,才能 合法上市。各国对药品定价的要求差别很大。例如,欧盟为其成员国提供了选项,以限制其国家医疗保险系统提供报销的医疗产品的范围,并控制供人使用的医疗产品的价格。成员国可以批准医药产品的具体价格, 也可以对将医药产品推向市场的公司的盈利能力采取直接或间接控制制度。此外,在收到产品的上市批准后,与这些国家/地区的政府当局进行定价谈判可能需要相当长的时间。为了在美国以外的国家获得报销或定价批准,我们 可能需要进行额外的临床试验,专门比较我们产品的成本效益 CTX-1301、CTX-1302和/或CTX-2103与其他可用的疗法。我们可能会面临国外低价产品对CTX-1301和/或CTX-1302的竞争,这些产品对药品实行价格管制。此外,可能有进口的外国产品与CTX-1301、CTX-1302和/或CTX-2103竞争,这可能会对我们的盈利能力产生负面影响。
| 38 |
我们 认为CTX-1301、CTX-1302和CTX-2103的价格需要与当前的疗法具有竞争力,才有资格在美国和国际市场获得全额报销 。如果我们无法从第三方付款人那里获得CTX-1301、CTX-1302、 和/或CTX-2103的承保范围和足够的支付水平,医生可能会限制他们开多少药或在什么情况下开这种药,患者 可能会拒绝购买。这反过来可能会影响我们将任何或所有产品成功商业化的能力,并损害我们的业务。
如果 我们无法支持对CTX-1301、CTX-1302和/或CTX-2103以及任何未来候选产品的需求,包括确保我们有足够的能力来满足不断增长的需求,或者我们无法成功管理我们药物输送技术的发展 ,我们的业务可能会受到影响。
随着我们数量的增长,我们将需要扩展我们的平台,以在预期的周转时间内支持更大规模的产品生产。 我们可能需要更多经过认证的实验室科学家以及技术和制造人员来处理更大数量的CTX-1301、 CTX-1302和/或CTX-2103(如果获得批准)。我们可能还需要购买其他设备,其中一些设备可能需要几个月或更长时间来采购、设置和验证。不能保证这些规模的增加、人员、设备的扩展或流程改进将成功实施,也不能保证我们的设施中是否有足够的空间来容纳所需的 扩展。
我们与客户和第三方付款人的关系受到适用的反回扣、欺诈和滥用以及其他医疗法律和法规的约束 ,这可能会使我们面临刑事制裁、民事处罚、合同损害、声誉损害以及利润和未来收益的减少。
对于 我们的产品以及获得监管批准并在美国销售的任何候选产品(如果有),我们与第三方付款人和客户的安排 可能会使我们面临广泛适用的欺诈和滥用以及其他医疗法律和法规, 可能会约束我们营销、销售和分销我们获得营销批准的任何产品的业务或财务安排和关系。此外,我们可能受到美国健康信息隐私和安全法规的约束。 联邦和州政府以及我们开展业务的外国司法管辖区。可能影响我们运营能力的法律包括:
| ● | 联邦反回扣条例,除其他事项外,禁止任何人直接或间接故意招揽、接受、提供或支付报酬,以引荐个人,或购买或推荐可根据联邦医疗保健计划(如联邦医疗保险和医疗补助计划)支付费用的项目或服务;个人或实体不需要实际了解该法规或具体意图违反该法规,即可 实施违规行为; | |
| ● | 联邦民事和刑事虚假报销法和民事金钱惩罚法,包括联邦《虚假报销法》,它对故意向联邦政府提交或导致提交给联邦政府的个人或实体施加刑事和民事处罚,包括联邦医疗保险和医疗补助计划, 为避免、减少或隐瞒向联邦政府支付资金的义务, 减少或隐瞒向联邦政府支付资金的义务;诉讼可由政府或举报人提起 ,并可包括断言,因违反联邦反回扣法令而导致的联邦医疗保健计划对物品和服务的付款索赔构成了虚假索赔或欺诈性索赔; |
| ● | 1996年《联邦医疗保险可转移性和责任法案》(HIPAA)对实施诈骗任何医疗福利计划的计划,或故意伪造、隐瞒或掩盖重大事实,或就医疗福利、项目或服务的交付或付款作出任何重大虚假陈述,施加刑事和民事责任;与美国 联邦反回扣法规类似,个人或实体不需要实际了解该法规或 违反该法规的具体意图即可实施违规;HIPAA,经2009年《健康信息技术和临床健康法》(“HITECH”)及其各自的实施条例修订,在保护个人可识别健康信息的隐私、安全和传输方面,对承保医疗保健提供者、健康计划和医疗保健信息交换所及其业务伙伴施加了某些义务,包括强制合同条款; | |
| ● | 作为PPACA的一部分颁布的《医生支付阳光法案》,该法案要求根据Medicare、Medicaid或儿童健康保险计划可报销的药品、设备、生物制品和医疗用品的某些制造商每年向CMS报告与向医生和教学医院支付和以其他方式转移价值有关的信息,以及医生及其直系亲属持有的所有权和投资权益;以及 | |
| ● | 类似的州和外国法律法规,如州反回扣和虚假索赔法律,可能适用于销售或营销 涉及由非政府第三方付款人(包括私营保险公司)报销的医疗项目或服务的安排和索赔,以及在某些情况下管理健康信息隐私和安全的州和外国法律,其中许多法律在重大方面彼此不同,并且往往不会被HIPAA先发制人,从而使合规工作复杂化。 |
| 39 |
确保我们与第三方的业务安排符合适用的医疗法律法规的努力 可能涉及巨额 成本。政府当局可能会得出结论,我们的业务实践可能不符合当前或未来的法规、 法规或涉及适用欺诈和滥用或其他医疗保健法律法规的判例法。如果我们的业务被发现违反了任何这些法律或任何其他可能适用于我们的政府法规,我们可能会受到重大的民事、刑事和行政处罚,包括但不限于损害赔偿、罚款、监禁、被排除在政府资助的医疗保健计划(如Medicare和Medicaid)之外,以及削减或重组我们的业务。如果我们预计与之开展业务的任何医生或其他医疗保健提供者或实体被发现不符合适用法律,他们 可能会受到刑事、民事或行政处罚,包括被排除在参与政府资助的医疗保健计划之外。
产品责任诉讼可能会转移我们的资源,导致大量责任,并降低我们产品的商业潜力。
尽管我们从临床试验参与者那里获得了适当的 知情同意,但我们 仍面临由于我们的候选产品进行临床测试而导致的固有产品责任索赔风险。如果我们获得CTX-1301、CTX-1302和/或CTX-2103或任何其他候选产品的营销批准并进行商业销售,我们将面临更大的风险。例如,如果我们开发的任何产品在临床测试、制造、营销或销售过程中据称造成伤害或被发现不适合,我们可能会被起诉。任何此类产品责任索赔 可能包括对制造缺陷、设计缺陷、未能警告产品固有危险、疏忽、严格责任或违反保修的指控。根据州消费者保护法,索赔也可以主张。如果我们不能 成功地针对产品责任索赔为自己辩护,我们可能会承担巨额责任或被要求限制我们候选产品的商业化 。无论案情如何或最终结果如何,赔偿责任可能会导致:
| ● | 减少了用于我们管理层执行业务战略的资源; | |
| ● | 减少了对我们的候选产品或我们可能开发的产品的需求; | |
| ● | 损害我们的声誉和媒体的重大负面关注; | |
| ● | 临床试验参与者退出; | |
| ● | 监管机构启动调查; | |
| ● | 产品 召回、撤回或贴标签、营销或促销限制; | |
| ● | 为由此产生的诉讼辩护的巨额费用; | |
| ● | 向试验参与者或患者发放巨额 金钱奖励; | |
| ● | 收入损失;以及 | |
| ● | 无法将我们可能开发的任何产品商业化。 |
如果我们的任何候选产品获准商业销售,我们将高度依赖消费者对我们的看法以及我们产品的安全性和质量。如果我们受到负面宣传,我们可能会受到不利影响。如果我们的任何产品或由其他公司制造和分销的任何类似产品被证明对患者有害或被断言对患者有害,我们也可能受到不利影响 。由于我们依赖消费者的看法,患者使用或误用我们的产品或其他公司分销的任何类似产品而导致的与疾病或其他不良影响相关的任何负面宣传 都可能对我们的财务状况或运营结果产生重大不利影响。
我们的产品责任保险覆盖范围可能不足以覆盖我们可能产生的任何和所有责任。
我们 目前总共有1,000万美元的产品责任保险,这可能不足以覆盖我们可能产生的任何和所有 责任。保险范围越来越贵。我们可能无法以合理的 成本或足以支付可能出现的任何责任的金额维持保险范围。在基于 具有意想不到的副作用的药物的集体诉讼中,已经做出了大量判决。成功的产品责任索赔或针对我们提出的一系列索赔,特别是 如果判决超出我们的保险范围,可能会减少我们的现金并对我们的业务产生不利影响。此外,我们可能无法 以可接受的费用获得或保持足够的保险范围,或以其他方式针对潜在的产品责任索赔提供保护 这些索赔可能会阻止或抑制我们产品的商业生产和销售。
| 40 |
如果 我们未能遵守环境、健康和安全法律法规,我们可能会受到罚款或处罚,或产生 成本,这可能会对我们的业务成功产生重大不利影响。
我们 受众多环境、健康和安全法律法规的约束。我们的行动可能涉及使用危险和易燃材料,包括化学品和生物材料。我们的业务产生危险废物产品。我们希望与第三方签订合同,处理这些材料和废物。我们无法消除这些材料造成污染或伤害的风险。 如果因使用危险材料而造成污染或伤害,我们可能会对由此造成的任何损害负责。 任何责任都可能超出我们的资源范围。我们还可能产生与民事或刑事罚款和处罚相关的巨额费用。
虽然 我们维持工人补偿保险,以支付因使用危险材料或其他与工作有关的伤害而对员工造成的伤害所产生的成本和开支,但该保险可能无法为潜在的 责任提供足够的保险。此外,为了遵守当前或未来的环境、健康和安全法律和法规,我们可能会产生巨额成本。这些现行或未来的法律法规可能会损害我们的研究、开发或生产努力。不遵守这些法律法规也可能导致巨额罚款、处罚或其他制裁。
与管理我们的增长、员工和运营相关的风险
我们 未来将需要进一步增加我们组织的规模和复杂性,我们在执行增长战略和管理任何增长方面可能会遇到困难。
我们现有的 管理、人员、系统和设施不足以支持我们的业务计划和短期未来增长。我们将需要进一步扩大我们的制造团队、临床团队、管理、运营、财务和其他资源,以支持我们计划的研究、开发和商业化活动。
要 有效管理我们的运营、增长和各种项目,我们需要:
| ● | 继续 改进我们的业务、财务、管理和监管合规控制以及报告系统和程序; | |
| ● | 吸引和留住足够数量的优秀员工; | |
| ● | 发展市场营销、销售和分销能力; | |
| ● | 有效且经济高效地管理我们的候选产品的商业化活动; | |
| ● | 与开发和商业化合作伙伴建立和维护关系; | |
| ● | 有效管理我们的临床试验; | |
| ● | 以经济高效的方式管理我们的第三方供应和制造运营,同时将我们当前候选产品的生产能力 提高到商业水平;以及 | |
| ● | 有效管理我们的开发工作,同时履行对合作伙伴和其他第三方的合同义务。 |
此外,从历史上看,我们一直并将继续利用兼职外部顾问的服务为我们执行多项任务,包括与产品开发和临床测试相关的任务。我们的增长战略还可能需要扩大我们 顾问的使用,以实施这些和其他未来任务。我们依赖顾问来履行我们业务的某些职能, 需要对这些顾问进行有效管理,以确保他们成功履行合同义务并在预期的截止日期前完成工作。不能保证我们能够管理现有的顾问或找到其他称职的外部顾问, 根据需要,以经济合理的条款,或者根本不能。如果我们不能通过招聘新员工和扩大顾问的使用来有效地管理我们的增长和扩大我们的组织 ,我们可能无法成功地执行有效执行我们计划的研发和商业化活动所需的任务,因此可能无法实现我们的研发 和商业化目标。
| 41 |
如果 我们无法建立销售和营销能力,或无法与第三方达成协议来营销和/或销售我们的候选产品 ,我们可能无法产生任何收入。
我们 目前没有销售、营销或分销CTX-1301、CTX-1302或CTX-2103的组织。因此,为了将CTX-1301、CTX-1302和/ 或CTX-2103商业化,我们必须 建立该组织,或与第三方进行营销协作。我们在美国建立和发展自己的销售队伍来销售CTX-1301、CTX-1302和/或CTX-2103将是昂贵和耗时的,可能会推迟任何产品的发布。我们不能确定我们是否能够成功开发这一能力,即使我们这样做了,建立和维护这样一个组织的成本也可能超过这样做的好处。
建立和管理销售组织存在重大风险,包括我们是否有能力聘用、保留和激励合格的 个人、产生足够的销售线索、为销售和营销人员提供充分的培训、有效管理分散在不同地理位置的销售和营销团队以及成功地与托管服务和第三方付款人进行谈判。我们内部销售、营销和分销能力的开发 的任何失败或延迟都将对这些产品的商业化产生不利影响。
根据商业化协议,Indegene将为我们提供CTX-1301的商业化服务,包括与(A)医疗事务和药物警戒有关的服务;(B)定价、报销和市场准入;(C)商业运营;以及(D)营销。
我们 还可能与第三方建立额外的战略合作伙伴关系,将我们的候选产品商业化。
根据商业化协议,我们和Indegene将签订工作声明,其中将列出Indegene将提供的服务、此类服务的可交付内容以及我们将支付的费用。我们可能无法按照我们可以接受的条款协商工作说明书的条款 ,包括Indegene将提供的服务或我们应支付的费用,或者根本无法进行谈判。如果我们无法做到这一点,我们将不得不为CTX-1301的商业化寻求其他合作,这可能会推迟商业化。 我们也可能难以按照我们可以接受的条款与第三方建立关系,或者在我们希望将产品商业化的所有地区 ,或者根本无法建立关系。如果我们不能建立足够的销售、营销和分销能力, 无论是独立还是与第三方合作,我们都可能无法产生足够的产品收入,也可能无法盈利。 我们将与许多目前拥有广泛且资金雄厚的营销和销售业务和/或根深蒂固的分销渠道的公司竞争。如果没有内部团队或第三方的支持来执行营销和销售职能,我们可能无法 成功地与这些更成熟的公司竞争。
如果 我们无法吸引和留住管理层和其他关键人员,我们可能无法继续成功开发或商业化我们的候选产品,或以其他方式实施我们的业务计划。
我们能否在竞争激烈的制药行业中竞争,取决于我们能否吸引和留住高素质的管理、科学、医疗、销售和营销及其他人员。我们高度依赖我们的管理和科学人员。失去这些个人的服务 可能会阻碍、延迟或阻止我们产品线的成功开发、我们计划的临床试验的完成、我们候选产品的商业化或许可内或新资产的获得,并可能对我们成功实施业务计划的能力产生负面影响。如果我们失去了这些人员中的任何一个人的服务,我们可能无法及时或根本无法找到合适的替代人员,我们的业务可能会因此受到损害。2023年12月,包括首席财务官在内的两名高管和两名临床运营员工辞职。2024年1月25日,我们任命 卡拉汉女士为我们的高级副总裁兼首席财务官。
2023年12月,我们董事会的四名独立成员辞职。我们董事会的两名现任成员不是独立的,我们目前没有审计委员会、薪酬委员会或提名和公司治理委员会。由于我们的董事会目前仅由非独立董事组成,其中一位是我们的首席执行官,因此我们无法获得对正在采取的行动进行独立监督的好处。此外,缺乏占多数的独立董事会成员可能会使我们难以 维护和发展内部控制,弥补内部控制中的任何重大弱点,并在金融市场筹集资金。于2023年12月26日,我们收到一封员工函件,表示基于三名董事会成员分别于2023年12月12日及2023年12月13日辞职,我们不再遵守董事上市规则 5605(“独立董事规则”)所载的独立纳斯达克上市规则、审计委员会、薪酬委员会及董事对董事提名的独立监督要求。我们正在物色新董事,但不能保证我们能够吸引新董事、保持独立董事会的多数席位或重新遵守独立的董事规则。
我们对特定个人的人寿保险,而不是对所有关键员工的人寿保险,都有“关键人物”的保单。为了留住我们公司有价值的员工,除了工资和现金奖励外,我们还可能提供随时间推移而授予的股票期权。随着时间的推移,授予员工的股票期权的价值将受到我们股价波动的重大影响,这些波动超出了我们的控制范围,并且在任何时候都可能不足以抵消其他公司的报价。
| 42 |
由于生物技术、制药和其他行业对 人才的激烈竞争,我们 未来可能无法吸引或留住合格的管理层和其他关键人员。我们可能很难吸引有经验的人员 到我们的公司,并且可能需要花费大量的财务资源来招聘和留住员工。与我们竞争合格人才的许多其他制药公司 拥有比我们更多的财务和其他资源、不同的 风险状况和更长的行业历史。它们还可能为职业发展提供更多样化的机会和更好的机会。如果我们无法吸引和留住实现业务目标所需的人员,我们可能会遇到 限制,这将损害我们实施业务战略和实现业务目标的能力。
此外,我们还拥有科学和临床顾问,帮助我们制定开发和临床策略。这些顾问 不是我们的员工,可能与其他实体签订了承诺、咨询或咨询合同,这可能会限制他们对我们的可用性 。此外,我们的顾问可能会与其他公司达成协议,协助这些公司开发可能与我们竞争的产品或技术。
我们的研发重点是发现和开发候选产品,但这些候选产品可能无法 投放市场。
迄今为止,我们的 开发研究和临床开发工作已经产生了用于治疗ADHD的候选产品CTx-1301和CTx-1302,以及用于治疗焦虑症的候选产品CTx-2103。作为我们增长战略的一部分,我们打算确定、开发和销售其他 候选产品。我们正在为我们的管道和专有技术探索各种治疗机会。我们可能会花费 年的时间来完成任何特定的当前或未来内部候选产品的开发,并且失败可能发生在任何阶段。 我们可能无法开发生物等效、安全有效和/或比已批准药物有商业上显著改进的药物。 我们分配资源的候选产品最终可能不会成功。 这一战略的成功部分取决于我们识别、选择、发现和获得有前景的候选产品和产品的能力。
提出、协商和实施许可证或收购候选产品或已批准产品的 流程漫长且 复杂。其他公司,包括一些拥有更多财务、营销和销售资源的公司,可能会与我们竞争 许可或收购候选产品和批准产品。我们的资源有限,无法确定和执行第三方产品、业务和技术的收购 或许可,并将其集成到我们当前的基础架构中。此外,我们 可能会将资源投入到从未完成的潜在收购或许可机会中,或者我们可能无法实现此类努力的 预期收益。我们可能无法以我们认为 可接受的条款获得其他候选产品的权利,或者根本无法获得这些权利。
此外,未来的收购可能会带来许多运营和财务风险,包括:
| ● | 暴露于未知债务的风险; | |
| ● | 更高 超过预期的收购和整合成本;以及 | |
| ● | 难度 将任何收购业务的运营和人员与我们的运营和人员相结合。 |
此外, 我们获得的任何候选产品在商业销售之前可能需要额外的开发工作,包括广泛的临床 测试和FDA及其他监管机构的批准。
如果 我们未能成功开发和商业化基于我们的Precision Timed Release平台技术的候选产品,我们将 无法在未来期间获得产品收入,这可能会对我们的财务状况造成重大损害,并 对我们的股价产生不利影响。
| 43 |
我们的 经营业绩可能波动很大,这使得我们未来的经营业绩难以预测,并可能导致我们的经营 业绩低于预期。
迄今为止,我们的 业务主要局限于制定和开发我们的候选产品以及对我们的候选产品进行临床试验。我们尚未获得任何候选产品的监管批准。因此,如果我们有更长的运营历史或市场上批准的产品, 对我们未来成功或生存能力的任何预测都可能不那么准确。此外,我们的经营业绩可能会因各种其他因素而波动,其中许多因素超出我们的控制范围 ,可能难以预测,包括以下因素:
| ● | 推迟我们的候选产品的开始、注册和临床测试的时间; | |
| ● | 我们的候选产品或竞争候选产品的临床试验的时机和成功或失败,或行业竞争格局中的任何其他变化,包括我们的竞争对手或合作伙伴之间的整合; | |
| ● | 临床开发中对候选产品的监管审查和批准方面的任何延误; | |
| ● | 与我们的候选产品相关的研究和开发活动的时间、成本和投资水平,可能会 不时发生变化; | |
| ● | 制造我们的候选产品的成本,可能会根据FDA的指导方针和要求以及生产数量而有所不同; | |
| ● | 我们 有能力获得额外资金来开发我们的候选产品; | |
| ● | 我们将获得或可能产生的用于获取或开发其他候选产品和技术的支出 ; | |
| ● | 如果我们的候选产品获得批准,对它们的需求水平可能会有很大差异; | |
| ● | 我们的候选产品的潜在副作用,可能会推迟或阻止商业化,或导致批准的药物退出市场 ; | |
| ● | 如果获得批准,患者或医疗保健提供者获得我们的候选产品的覆盖范围或足够的补偿的能力; | |
| ● | 我们对第三方制造商供应或制造我们的候选产品的依赖; | |
| ● | 我们能够及时建立或外包有效的销售、营销和分销基础设施; | |
| ● | 市场接受我们的候选产品(如果获得批准),以及我们预测这些候选产品的需求的能力; | |
| ● | 我们 在美国以外获得批准并将我们的候选产品商业化的能力; | |
| ● | 我们建立和维护协作、许可或其他安排的能力; | |
| ● | 我们保护知识产权的能力和第三方的能力; | |
| ● | 与潜在诉讼或其他纠纷有关的费用和结果; | |
| ● | 我们有能力充分支持未来的增长; | |
| ● | 我们 有能力吸引和留住关键人员以有效管理我们的业务; | |
| ● | 与危险材料相关的潜在责任; | |
| ● | 我们 有能力维持足够的保险单;以及 | |
| ● | 未来 我们的会计政策中的会计声明或变更。 |
| 44 |
我们的经营业绩和流动性需求可能会受到市场波动和经济低迷的负面影响。
我们的经营业绩和流动性可能会普遍受到美国和世界其他地区的经济状况的负面影响。非必需医疗产品和程序的市场可能特别容易受到不利经济条件的影响 。一些患者可能认为我们的某些候选产品是可自由支配的,如果此类产品无法获得全额报销,对这些产品的需求可能会与我们目标患者群体的可自由支配支出水平挂钩。基于国内和国际经济状况和担忧,国内和国际股票和债务市场已经并可能继续经历高度的波动和动荡。如果这些经济状况和担忧持续或恶化, 市场继续波动,我们的经营业绩和流动性可能会在许多方面受到这些因素的不利影响,包括对我们某些产品的需求减弱,使我们在必要时更难筹集资金,我们的股价可能会下跌。此外,尽管我们计划主要在美国销售我们的产品,但我们的合作伙伴拥有广泛的全球业务,这间接使我们面临风险。
如果我们的内部计算机系统出现故障,我们的业务和运营将受到影响。
尽管实施了安全措施,但我们的内部计算机系统以及我们当前和未来合作伙伴、承包商和顾问的计算机系统容易受到计算机病毒、未经授权的访问、自然灾害、恐怖主义、战争和电信以及电气故障的破坏。虽然我们到目前为止还没有遇到任何此类重大系统故障、事故或安全漏洞,但如果发生此类事件并导致我们的运营中断,可能会导致我们的制造活动、开发计划和业务运营发生重大中断。例如,已完成的 或未来临床试验的生产记录或临床试验数据的丢失可能会导致我们的监管审批工作延迟,并显著增加我们恢复或复制数据的成本。如果任何中断或安全漏洞导致我们的数据或应用程序丢失或损坏, 或不适当地披露机密或专有信息,我们可能会招致责任,我们的产品和候选产品的进一步商业化和 开发可能会被推迟。
我们 越来越依赖信息技术,我们的系统和基础设施面临一定的风险,包括网络安全 和数据泄露风险。
我们的信息技术系统发生重大中断或信息安全遭到破坏,可能会对我们的业务产生不利影响。在正常的业务过程中,我们收集、存储和传输大量机密信息,因此我们必须以安全的方式 确保此类机密信息的机密性和完整性。我们的信息技术 系统以及与我们签订合同的第三方供应商的系统的规模和复杂性使得此类系统可能容易受到服务中断和安全破坏的影响,原因包括我们的员工、合作伙伴或供应商的疏忽或故意行为、恶意第三方的攻击,或者我们或第三方维护的系统基础设施的故意或意外物理损坏。对这些机密、专有或商业秘密信息进行保密对于我们的竞争业务地位非常重要。虽然我们 已采取措施保护此类信息并投资于信息技术,但不能保证我们的努力将 防止系统中的服务中断或安全漏洞,或可能对我们的业务运营产生不利影响或导致关键或敏感信息丢失、传播或误用的机密信息的未经授权或无意中的错误使用或泄露。违反我们的安全措施或意外丢失、无意披露、未经批准的传播、挪用或滥用商业秘密、专有信息或其他机密信息,无论是由于盗窃、黑客攻击、欺诈、 欺骗或其他形式的欺骗或任何其他原因,都可能使其他人生产竞争产品、使用我们的专有技术或信息,或对我们的业务或财务状况产生不利影响。此外,任何此类中断、安全漏洞、机密信息的丢失或泄露都可能对我们造成财务、法律、业务和声誉损害,并可能对我们的业务、财务状况、运营结果或现金流造成重大不利影响。
| 45 |
与我们知识产权相关的风险
如果我们与我们的产品或候选产品相关的知识产权不足,我们可能无法在我们的市场上有效竞争。
我们 依靠专利、商业秘密保护和保密协议的组合来保护与我们的产品、候选产品和技术相关的知识产权。第三方对我们的机密或专有信息的任何披露或挪用都可能使竞争对手复制或超过我们的技术成就,从而侵蚀我们在市场上的竞争地位。
由于涉及专利性、有效性、可执行性和权利要求范围的法律标准,涵盖制药和生物技术发明的专利涉及复杂的法律、科学和事实问题。像我们这样具有复杂释药特征的药物产品的配方 是一个密集的研究、出版和专利领域,这限制了任何新的专利申请的范围。因此,我们获得、维护和实施专利的能力 不确定,任何现有专利下的任何权利,或我们可能获得或许可的任何专利, 可能无法为我们的产品和候选产品提供足够的保护,从而提供相对于竞争对手 产品或工艺的商业优势。我们拥有的专利申请可能无法在美国或外国颁发专利。 即使专利确实成功颁发,第三方也可能会挑战其专利性、有效性(例如,通过发现以前未确定的 先前技术,或专利禁止事件,如发明的事先公开披露、使用、销售或要约出售)、可执行性 或范围,这可能会导致此类专利缩小、无效或无法强制执行。例如,美国专利 可能会被第三方通过各方间美国专利商标局和欧洲专利局的审查、授权后审查、派生或干扰程序可通过欧洲专利局的反对程序提出质疑。此外,如果我们针对竞争对手主张我们的专利权,竞争对手可能会质疑所主张的专利权的有效性和/或可执行性。 虽然已授予的美国专利有权享有法定的有效性推定,但其颁发并不是关于其有效性或可执行性的确凿结论 ,它可能无法为我们提供足够的专有保护或针对具有类似产品的竞争对手 的竞争优势。
如果 我们持有或追求的专利和专利申请对我们的产品和候选产品提供的保护的广度或强度受到成功挑战 ,我们可能面临意想不到的竞争,这可能会对我们的业务产生实质性的不利影响。即使它们没有受到挑战,我们的专利和专利申请也可能无法充分保护我们的知识产权,或者 阻止其他人围绕我们的主张进行设计。例如,第三方可能开发一种具有竞争力的产品,该产品提供与我们的产品或候选产品相似的治疗 益处,但有足够的不同,不属于我们的专利保护范围。
此外, 如果我们在特定司法管辖区的临床试验或进入市场方面遇到延迟,我们可以销售受专利保护的特定产品的时间将会缩短。
即使在法律提供保护的情况下,也可能需要昂贵且耗时的诉讼来强制执行和确定我们的专有权利的范围,而此类诉讼的结果将是不确定的。如果我们或我们未来的合作伙伴之一对第三方提起法律诉讼,以强制执行涵盖产品或我们技术的专利,被告可以反诉我们的专利无效和/或不可强制执行。在美国的专利诉讼中,被告声称无效和/或不可执行的反诉很常见 。质疑有效性的理由可能是据称未能满足几项法定要求中的任何一项,包括 缺乏新颖性、明显、缺乏书面描述、未启用或专利禁令事件,如在申请提交日期前一年以上公开披露、使用或销售发明。不可执行性主张的理由可以是, 例如,与专利诉讼有关的人在起诉期间向美国专利商标局隐瞒了重要信息,或 做出了误导性陈述。法律断言无效和不可强制执行后的结果是不可预测的。 例如,关于有效性,我们不能确定没有无效的先前技术,而我们和专利审查员在起诉期间并不知道,或者挑战我们的一项专利的第三方不会断言已经发生了专利禁止事件 。如果原告或被告在针对我们的一项或多项专利的无效和/或不可执行性的法律主张中胜诉,我们将失去对我们的一项或多项产品或候选产品的至少部分甚至全部专利保护。 这种专利保护的丧失可能会对我们的业务产生实质性的不利影响。
| 46 |
此外, 我们可能会接受第三方向USPTO提交的现有技术的发行前提交,或参与复审,各方间 审查,或干扰诉讼挑战我们的专利权。基于我们将来提交的申请的专利也可能 受到派生和/或授予后审查程序的约束。任何此类提交、程序或诉讼 中的不利决定可能会缩小我们的专利权范围或使其无效,并允许第三方将我们的技术或产品商业化并与我们直接竞争 。此外,如果我们的专利和专利申请提供的保护的广度或强度受到威胁, 可能会阻止公司与我们合作,以许可、开发或商业化当前或未来的候选产品。
我们 可能不会在世界各地的所有司法管辖区寻求保护我们的知识产权,即使在我们寻求保护的司法管辖区,我们也可能无法充分 执行我们的知识产权。
在全世界所有国家和司法管辖区申请、 起诉和维护候选产品的专利将是极其昂贵的,而且我们在美国以外的一些国家的知识产权不如在美国广泛。 此外,一些外国的法律对知识产权的保护程度不能与美国的联邦和州法律 相同。因此,即使我们选择在美国以外的地方寻求专利权,我们也可能无法获得 相关权利要求和/或我们可能无法阻止第三方在美国以外的所有国家/地区实施我们的发明,或在美国或其他司法管辖区销售或进口使用我们的发明制造的产品。
竞争对手 可能会在我们不寻求和获得专利保护的司法管辖区使用我们的技术来开发自己的产品, 还可能会将侵权产品出口到我们有专利保护的地区,但执法力度不如 美国。这些产品可能与我们的产品竞争,我们的专利或其他知识产权可能不 有效或不足以阻止它们竞争。即使我们在特定司法管辖区寻求并获得已颁发的专利,我们的 专利声明或其他知识产权可能无法有效或足以阻止第三方与我们竞争。
一些外国的 法律对知识产权的保护程度不如美国的法律。许多 公司在某些外国司法管辖区保护和捍卫知识产权时遇到了重大问题。 一些国家的法律制度,特别是发展中国家,不利于专利和其他知识产权保护的实施。这可能会使我们难以阻止对我们专利的侵犯(如果获得)或对我们其他知识产权的盗用。例如,许多外国有强制许可法,根据该法律,专利所有人 必须向第三方授予许可。此外,许多国家限制专利对第三方(包括 政府机构或政府承包商)的可撤销性。在这些国家,专利可能提供有限或没有好处。
专利 保护最终必须在逐个国家的基础上寻求,这是一个昂贵且耗时的过程,结果不确定。 因此,我们已经并可能在将来选择不在某些国家寻求专利保护。此外,虽然我们打算 在某些市场保护我们产品的知识产权,但我们无法确保我们能够在我们可能希望销售我们产品的所有司法管辖区发起或 保持类似的努力。因此,我们在这些国家保护知识产权的努力可能是不够的。
获得和维护我们的专利保护取决于遵守政府专利机构提出的各种程序、文件提交、费用支付和其他要求 ,如果不符合这些要求,我们的专利保护可能会减少或取消。
USPTO和各种外国政府专利代理机构要求在专利过程中遵守许多程序、文件、费用支付和其他 规定。在某些情况下,不遵守可能导致专利或专利申请的放弃或失效,从而导致在相关司法管辖区内部分或全部丧失专利权。在这种情况下,竞争对手可能 能够比其他情况更早地进入市场。
| 47 |
如果 我们因侵犯第三方的知识产权而被起诉,这将是昂贵和耗时的,并且该诉讼的不利结果 将对我们的业务产生重大不利影响。
我们的 商业成功取决于我们和我们的合作者开发、制造、营销和销售其批准的 产品和我们的候选产品以及使用我们的专有技术而不侵犯第三方专有权利的能力。 在我们开发候选产品的 领域中,存在许多由第三方拥有的美国和外国已颁发的专利和待审批的专利申请。随着制药行业的扩张和更多专利的发布, 我们的产品和候选产品可能会引起侵犯他人专利权的索赔的风险也会增加。例如, 我们的产品或候选产品可能会侵犯我们目前不知道的第三方颁发的专利, 这可能会阻止我们将我们的产品或候选产品分别商业化。由于专利申请 可能需要许多年才能发布,因此目前可能有一些待决的申请,这些申请可能会导致我们的产品 或候选产品可能会侵犯已发布的专利。
制药行业充斥着专利持有人与后续药品生产商之间的专利诉讼。阻止FDA批准竞争对手的产品长达30个月的可能性 增加了对橙皮书专利提起诉讼的动机, 但涉及非橙皮书专利的诉讼在ADHD领域也很常见。有多个专利诉讼涉及几乎所有治疗ADHD的药物。这一趋势可能会持续下去,因此,我们可能会成为日常业务过程中产生的法律问题和 索赔的一方。
我们 可能会面临或受到第三方未来诉讼的威胁,这些第三方声称我们的产品或候选产品侵犯了他们的知识产权 。如果我们的一个产品或候选产品被发现侵犯了第三方的知识产权,我们或我们的合作者可能会被法院责令并支付损害赔偿金,并且可能无法将适用的经批准的产品和候选产品进行商业化,除非我们获得专利许可证。根据可接受的条款,我们可能无法获得许可证(如果有的话)。此外,在诉讼期间,专利持有者可以获得初步禁令或其他公平的 救济,禁止我们制造、使用或销售我们批准的产品,等待对案情的审判,这可能在几年内不会发生 。
制药行业普遍存在大量涉及专利和其他知识产权的诉讼。 如果第三方声称我们或我们的合作者侵犯了其知识产权,我们可能会面临一些问题,包括, 但不限于:
| ● | 侵权 和其他知识产权索赔,无论案情如何,提起诉讼都可能既昂贵又耗时,并可能转移我们管理层对核心业务的注意力。 | |
| ● | 第三方对我们提起诉讼的当事人可能比我们有更多的资源对我们提起诉讼; | |
| ● | 侵权的巨额损害赔偿,如果法院判定争议产品侵犯或违反第三方的权利,我们可能必须支付,如果法院认定侵权是故意的,我们可能被勒令支付三倍损害赔偿金和专利所有者的律师费; | |
| ● | 法院禁止我们销售我们的产品或未来批准的任何候选产品(如果有),除非第三方将其权利许可给我们,而这并不是必需的; | |
| ● | 如果从第三方获得许可,我们可能需要为我们的知识产权支付大量使用费、费用或授予交叉许可 ;以及 | |
| ● | 重新设计 我们的任何产品和候选产品,使它们不会侵权,这可能是不可能的,或者可能需要大量的金钱 支出和时间。 |
| 48 |
我们的药物开发战略在很大程度上依赖于505(B)(2)监管审批途径,这要求我们证明我们没有 侵犯已批准药物的第三方专利。此类认证通常会导致第三方对知识产权侵权提出索赔,辩护费用高昂且耗时,任何诉讼中的不利结果都可能阻止 或推迟我们的开发和商业化努力,这将损害我们的业务。
我们的商业成功在很大程度上取决于我们避免侵犯第三方对现有 批准的药物产品的专利和专有权利。由于我们使用505(B)(2)监管审批途径来批准我们的产品和候选产品, 我们全部或部分依赖于第三方进行的与这些批准的药物产品相关的研究。因此,在向FDA申请批准我们的候选产品时,我们将被要求向FDA证明:(1)FDA的橙皮书中没有列出与我们的NDA有关的专利信息;(2)橙皮书中列出的专利已经过期;(3)列出的 专利没有过期,但将在特定日期到期,并在专利到期后寻求批准;或(4)列出的专利 无效或不会因我们建议的药物产品的制造、使用或销售而受到侵犯。如果我们向FDA证明专利 无效或未被侵犯,或第四款认证,也必须在我们的505(B)(2)保密协议被FDA接受备案后向专利 所有者发送第四款认证的通知。然后,第三方可以对我们提起诉讼,指控我们侵犯了通知中确定的专利。在收到通知后45天内提起专利侵权诉讼将自动阻止FDA批准我们的保密协议,直到30个月内或专利到期之日、诉讼达成和解或法院在侵权诉讼中做出对我们有利的裁决。如果第三方未在规定的45天期限内提起专利侵权诉讼,我们的保密协议将不受30个月缓期的限制。然而,即使第三方没有在45天的期限内提起诉讼,从而援引30个月的缓期,它仍然可能挑战我们在FDA批准后销售我们产品的权利; 因此,即使在45天的期限过后,仍存在一些侵权诉讼的风险。
我们 可能无法充分防止商业秘密和其他专有信息的泄露。
我们 依靠商业秘密来保护我们的专有技术诀窍和技术进步,特别是在我们认为专利保护 不合适或无法获得的情况下。然而,商业秘密很难保护。我们部分依赖与我们的 员工、顾问、外部科学合作者、赞助研究人员和其他顾问签订的保密协议来保护我们的商业秘密和其他 专有信息。这些协议可能无法有效阻止机密信息的泄露,也可能无法在未经授权披露机密信息的情况下提供适当的补救措施。此外,其他人可能会独立发现我们的交易秘密和专有信息。执行和确定我们 专有权的范围可能需要昂贵且耗时的诉讼。如果不能获得或维护商业秘密保护,竞争对手可能会利用我们的专有信息 来开发与我们的产品竞争的产品,或对我们的竞争业务地位造成额外的重大不利影响。
我们 可能会受到第三方的索赔,这些第三方声称我们的员工或我们挪用了他们的知识产权,或要求 拥有我们认为是我们自己的知识产权。
我们的一些员工以前曾受雇于其他公司,包括实际或潜在的竞争对手。我们还可以聘请同时受雇于其他组织或为其他实体提供服务的顾问 和顾问。尽管我们努力确保我们的员工、顾问和顾问在为我们工作时不使用他人的专有信息或专有技术,但我们可能会 受到指控,即我们或我们的员工、顾问或顾问使用或披露了任何此类当事人的前雇主的知识产权,包括商业机密或其他专有信息,或违反了与另一方达成的协议或违反了对另一方的法律义务 。可能有必要提起诉讼来抗辩这些指控。
此外,虽然我们通常要求可能参与知识产权开发的员工、顾问、顾问和承包商签署将此类知识产权转让给我们的协议,但我们可能无法成功地与 实际开发我们视为自己的知识产权的每一方执行此类协议。我们和他们的转让协议可能不是自动执行的 或可能被违反,我们可能被迫向第三方提出索赔,或他们可能对我们提出的索赔进行抗辩,以确定我们视为我们的知识产权的所有权。同样,我们可能会受到索赔,即员工、顾问或顾问 为我们执行的工作与该人对第三方(如雇主或前雇主)的义务相冲突,因此,第三方对为我们执行的工作产生的知识产权拥有所有权利益。可能需要 诉讼来对抗这些索赔。
如果我们未能起诉或辩护任何此类索赔,除了支付金钱损害赔偿外,我们还可能失去宝贵的知识产权 权利或人员。即使我们成功地起诉或抗辩此类索赔,诉讼也可能导致巨额成本,并分散管理层的注意力。
我们 根据505(B)(2)寻求批准CTX-1301、CTX-1302和/或CTX-2103及其他候选产品的决定可能会增加针对我们提起专利侵权诉讼的风险,这将推迟FDA对此类候选产品的批准。
对于我们根据505(B)(2)法规路径提交的任何保密协议,如果有专利声称批准的药物在我们的候选产品中包含 ,并在我们的505(B)(2)保密协议中被引用,我们必须向FDA证明并通知专利持有人FDA橙皮书出版物中为批准的药物列出的任何专利 无效、不可强制执行或不会因制造、使用或销售我们的药物而受到侵犯。如果在收到我们的认证通知后45天内对我们提起专利侵权诉讼,则FDA将自动阻止批准我们的505(B)(2)保密协议,直至最早30个月、专利到期、诉讼和解或侵权案件中对我们有利的法院裁决,或法院可能下令的更短或更长的期限 。这类诉讼通常由专利所有者提起。因此,我们可能会在候选产品的开发上投入大量时间和费用 ,但在将候选产品商业化之前,我们可能会受到重大延迟和专利诉讼。 我们可能无法成功地对任何专利侵权索赔进行辩护。即使我们被发现没有侵权,或者原告的专利主张被发现无效或不可强制执行,为任何此类侵权索赔辩护也将是昂贵和耗时的,并且会推迟我们的产品或我们的其他候选产品的发布,并分散管理层的正常责任。
| 49 |
与此次发行、证券市场和我们证券的所有权有关的风险
如果我们未能重新遵守纳斯达克的持续上市要求,我们的普通股和/或认股权证可能会被摘牌, 我们的普通股和/或认股权证的价格以及我们进入资本市场的能力可能会受到负面影响。
我们的普通股和权证目前已在纳斯达克挂牌交易。2023年5月16日,我们收到工作人员的通知,指出我们不再符合《纳斯达克股票市场上市规则》第5550(B)(1)条(《最低股东权益规则》)关于继续上市的最低股东权益要求。我们于2023年6月30日向纳斯达克提交了合规计划。2023年7月28日,纳斯达克通知我们,它批准延长至2023年11月13日,以重新遵守最低股东权益规则,条件是 实现了之前提交给纳斯达克的合规计划中包括的某些里程碑,包括筹集额外资本的计划。于2023年11月14日,吾等收到纳斯达克的函件,指出基于吾等持续不遵守最低股东权益规则 ,工作人员已决定将吾等的证券从纳斯达克退市,惟须待吾等要求纳斯达克聆讯小组(下称“委员会”)进行聆讯。
我们 及时要求在专家组和纳斯达克批准我们的请求之前举行听证会。在预计将于2024年2月举行的专家小组听证会上,我们将提交我们的计划,以重新遵守我们对继续在纳斯达克上市的所有适用的 要求的合规,以及我们保持长期合规的能力,包括遵守最低股东权益规则和独立 董事规则(定义如下)。工作人员的除名行动将暂缓进行,等待听证和小组在听证后批准的任何额外的延长期届满。我们打算继续采取最终步骤,以证明 遵守了最低股东权益规则、独立董事规则和其他纳斯达克上市要求;但是, 不能保证陪审团会批准我们继续上市的请求,也不能保证我们能够在陪审团可能批准的任何延期 期间内证明 遵守最低股东权益规则、独立董事规则和其他纳斯达克上市要求。要继续上市,我们需要证明有能力保持长期遵守最低股东权益规则 。我们可以在听证会之前改善财务状况的方法有限 ,以证明符合最低股东权益规则。我们可能会尝试以不太优惠的条款进一步筹集 资本,这可能会进一步稀释您和我们现有股东的权益。我们可能无法成功 筹集更多资本,或以其他方式满足最低股东权益规则。
2023年7月28日,我们收到纳斯达克的通知,指出我们不符合在纳斯达克继续上市必须保持每股1.00美元的最低买入价的要求。根据纳斯达克上市规则第 第5810(C)(3)(A)条,我们获提供180个历日的合规期,自通知发出之日起计,或至2024年1月24日止,以重新遵守最低成交报价要求。2023年11月30日,我们对普通股进行了反向拆分,2023年12月15日,我们收到纳斯达克的通知 ,我们重新遵守了最低收盘价要求。不能保证我们将继续 遵守最低收盘价要求或其他纳斯达克上市要求。
于2023年12月26日,我们收到员工函件,表示基于三名董事会成员分别于2023年12月12日及2023年12月13日辞职,我们不再遵守董事上市规则第5605条(董事上市规则 “独立董事规则”)所载的独立纳斯达克上市委员会、审计委员会、薪酬委员会及纳斯达克对董事提名的独立监督规定。我们的董事会目前由两名董事组成,这两名董事都不是独立的。
我们 正在寻找潜在的新董事,并打算在小组听证会之前展示在遵守独立董事规则方面的进展 。不能保证我们会重新遵守《董事独立规则》。
我们 必须满足纳斯达克的持续上市要求,其中包括最低股东权益规则 和独立董事规则 ,否则将有可能对我们的业务产生重大不利影响的风险退市。如果我们的普通股和认股权证从纳斯达克退市,可能会大幅减少我们的普通股和认股权证的流动性,并导致我们的普通股和认股权证的价格相应 大幅下降,原因是与纳斯达克相关的市场效率丧失 和失去联邦证券法的优先购买权。此外,退市可能会损害我们以我们可以接受的条款或根本不接受的条款通过替代融资来源筹集资金的能力,并可能导致投资者、供应商、客户和员工 潜在地失去信心,减少业务发展机会。如果我们的普通股和认股权证被摘牌,我们的普通股和认股权证可能更难买卖或获得准确的报价,我们的普通股和认股权证的价格可能会大幅下跌 。退市还可能削弱我们以可接受的条件筹集资金的能力,如果有的话。
此次发行是在尽最大努力的基础上进行的,我们出售的证券可能少于在此发行的所有证券,并且从此次发行中获得的净收益可能会大幅减少,这将仅为我们提供有限的营运资金
本次发售是以最大努力进行的,我们出售的证券可能少于所有在此发售的证券,从本次发售中获得的净收益也可能大幅减少。我们相信,根据我们目前的业务计划,此次发行的净收益加上我们手头的现金, 将满足我们到2024年第二季度末的资本需求。此次发行后, 我们将需要筹集更多资金来支持我们的运营,并继续支持我们计划的开发和商业化活动 。
由于 管理层对本次发行的净收益的使用拥有广泛的自由裁量权,您可能不同意我们如何使用这些净收益,因此此类 收益可能无法成功应用。
我们的管理层将对此次发行所得资金的使用拥有相当大的自由裁量权。我们目前打算将此次发行的净收益 用于CTX-1301的持续研发和商业化活动,并用于营运资本、资本支出和一般企业用途,包括进一步投资于研发工作。然而,我们的管理层 将在运用此次发行的净收益方面拥有广泛的自由裁量权,并可以将收益用于不一定 改善我们的运营业绩或提升我们证券价值的方式,或您不同意的方式。您将依赖我们管理层对这些用途的判断,作为您投资决策的一部分,您将没有机会评估收益是否得到了适当的使用。如果我们的管理层未能有效地运用这些资金,可能会导致不利的回报和对我们前景的不确定性,这些都可能导致我们证券的价格下跌 。
如果您在此次发行中购买证券,您的投资将立即受到稀释。
您的 将因此次发售而立即遭受重大稀释。普通股及附属认股权证的每股公开发售价格及每股预筹资权证及附属认股权证的公开发售价格将大幅高于本次发售后普通股的调整后每股有形账面净值。因此,如果您在此次发行中购买证券,您将在此次发行后支付的普通股每股价格大大超过我们的预计有形账面净值 。根据普通股每股2.00美元的公开发行价和附带的 认股权证,以及我们截至2023年9月30日的预计有形账面净值,您将立即经历每股0.15美元的稀释,这代表我们的预计每股有形账面净值在本次发行生效后调整后的每股有形账面净值与公开发行价之间的差额。
| 50 |
我们提供的预融资权证或认股权证没有公开市场。
预融资权证或认股权证尚无既定的公开交易市场,我们预计不会发展这样的市场。此外, 我们不打算申请在任何国家证券交易所或其他国家认可的交易系统中上市预融资权证或权证。如果没有活跃的交易市场,预融资权证和认股权证的流动性将受到限制。
在本次发行中购买的预资金权证和认股权证的持有人 在行使其预资资权证或认股权证并收购我们的普通股之前,将不享有普通股股东的权利。
在预筹资权证和认股权证的持有人在行使时获得我们普通股的股份之前,该等持有人将不享有与预融资权证和认股权证相关的普通股股份的权利。在行使预付资金认股权证及认股权证后,持有人将只有权行使普通股股东的权利,有关事项的记录日期 在行使日期之后。
这些认股权证具有投机性。
认股权证并不赋予持有人任何普通股所有权权利,例如投票权或收取股息的权利。 只是代表在有限时间内以固定价格取得普通股股份的权利。此外,在此次发行后,认股权证的市值(如果有的话)将是不确定的,也不能保证 认股权证的市值将等于或超过其推定的发行价。认股权证将不会在任何市场或交易所上市或报价交易。 不能保证我们普通股的市场价格将永远等于或超过认股权证的行使价,因此,认股权证可能到期时毫无价值。
根据证券购买协议在本次发行中购买我们证券的购买者 可能拥有购买者在没有证券购买协议的情况下购买该证券所不具备的权利。
除了根据联邦证券和州法律向本次发售的所有购买者提供的权利和补救措施外, 签订证券购买协议的购买者还可以向我们提出违约索赔。对违约提出索赔的能力为这些投资者提供了执行证券购买协议中为他们提供的独特契约的手段,包括:(I)及时交付股票;(Ii)同意在成交后一年内不进行浮动利率融资,但某些例外情况除外;(Iii)同意在成交后90天内不进行任何融资; 和(Iv)违约赔偿。
此 是尽力而为的产品,没有要求出售证券的最低金额,并且我们可能不会筹集我们的业务计划(包括我们的近期业务计划)所需的资金。
配售代理已同意尽其合理的最大努力征求购买本次发行中的证券的要约。配售代理没有义务从我们手中购买任何证券,也没有义务安排购买或出售任何特定数量或金额的证券。完成本次发售没有必须出售证券的最低数量的要求。 由于本次发售的完成没有最低发售金额的要求,因此我们的实际发售金额、配售代理费和收益目前无法确定,可能会大大低于上述最高金额。 我们可能会少于在此发售的所有证券,这可能会显著减少我们收到的收益金额,如果我们出售的证券数量不足以支持我们的 持续运营(包括我们近期的持续运营),则此次发行的投资者将不会获得退款。因此,我们可能不会在短期内筹集我们认为的运营所需的资本额 ,并且可能需要筹集额外的资金,这些资金可能无法获得或无法以我们可以接受的条款获得 。
由于发行没有最低要求才能完成,因此,如果我们卖出的证券数量不足以实现本招股说明书中概述的业务目标,本次发行的投资者将不会获得退款。
我们 尚未指定最低发售金额,也没有或将建立与此次发售相关的托管帐户。由于没有托管帐户和最低发售金额,投资者可能已经投资了我们的公司,但由于对此次发售缺乏兴趣,我们无法实现我们的目标。此外,由于在 运营中没有托管帐户,也没有最低投资额,我们出售证券所得的任何收益将可供我们立即 使用,尽管我们是否能够使用这些资金有效实施我们的业务计划仍存在不确定性。投资者资金 在任何情况下都不会退还,无论是在上市期间还是上市后。
| 51 |
我们普通股或认股权证的活跃交易市场可能无法持续。
我们普通股或认股权证的活跃交易市场可能无法持续。我们的普通股或认股权证缺乏活跃的市场 可能会削弱投资者在他们希望出售的时间或以他们认为合理的价格出售普通股或认股权证的能力,可能会降低其普通股或认股权证的公平市场价值,并可能会削弱我们通过出售证券筹集 资本以继续为运营提供资金的能力,并可能会削弱我们以证券为对价获得额外知识产权资产的能力 。
我们证券的价格可能会波动,这可能会使我们受到证券集体诉讼,我们的股东可能会遭受重大损失。
我们普通股和认股权证的市场价格可能波动较大,受以下因素影响而大幅波动:
| ● | 本公司季度或年度经营业绩的实际或预期波动; | |
| ● | 我们公司成就的速度或相对于竞争对手的增长率的实际变化或预期变化; | |
| ● | 未能达到或超过投资界或我们向公众提供的财务估计和预测; | |
| ● | 发布证券分析师新的或最新的研究报告或报告; | |
| ● | 可归因于我们普通股或认股权证交易量水平不一致的股价和成交量波动; | |
| ● | 关键管理层或其他人员的增加或离职; | |
| ● | 纠纷 或与专有权相关的其他发展,包括专利、诉讼事项以及我们为我们的技术获得专利保护的能力 ; | |
| ● | 宣布 或预期进行额外的债务或股权融资努力; |
| ● | 我们、我们的内部人或其他股东出售我们的普通股或认股权证;以及 | |
| ● | 美国或其他地方的一般经济、市场或政治状况(包括但不限于新冠肺炎大流行引起的状况)。 |
特别是,像我们这样的临床阶段公司的市场价格一直非常不稳定,原因包括但不限于 :
| ● | 我们候选产品的临床试验中的任何延迟或失败,或获得FDA和其他监管机构的批准; | |
| ● | 产品知识产权方面的事态发展或纠纷; | |
| ● | 我们 或我们竞争对手的技术创新; | |
| ● | 投资者认为与我们相当的公司估值波动 ; | |
| ● | 我们或我们的竞争对手宣布重大合同、收购、战略合作伙伴关系、合资企业、资本承诺、新技术或专利; | |
| ● | 未能完成重大交易或与供应商合作生产我们的产品;以及 | |
| ● | 建议立法限制医疗治疗的价格。 |
| 52 |
这些 以及其他市场和行业因素可能会导致我们的普通股和认股权证的市场价格和需求大幅波动,而不管我们的实际经营业绩如何,这可能会限制或阻止投资者出售其普通股或认股权证的股份 ,否则可能会对我们的普通股和认股权证的流动性产生负面影响。此外,股票市场,特别是纳斯达克和新兴成长型公司,经历了极端的价格和成交量波动, 往往与这些公司的经营业绩无关或不成比例。在过去,当证券的市场价格波动时,该证券的持有者会对发行该证券的公司提起证券集体诉讼。 如果我们的任何股东对我们提起诉讼,我们可能会产生巨额的诉讼辩护费用。这样的诉讼也可能 转移我们管理层的时间和注意力。
我们 是一家“新兴成长型公司”,将能够利用降低适用于“新兴成长型公司”的披露要求,这可能会降低我们的证券对投资者的吸引力。
我们 是JOBS法案中定义的“新兴成长型公司”,只要我们继续是“新兴成长型公司”,我们就打算利用适用于其他上市公司但不适用于“新兴成长型公司”的各种报告要求的某些豁免,包括但不限于,不被要求遵守萨班斯-奥克斯利法案第404条的审计师认证要求,减少我们定期报告和委托书中关于高管薪酬的披露义务。免除对高管薪酬进行不具约束力的咨询投票的要求,以及免除股东批准之前未批准的任何黄金降落伞付款的要求。我们可以是一家“新兴成长型公司”,最长可达五年,或直至(I)我们的年度总收入超过12.35亿美元的第一个财年的最后一天,(Ii)我们成为交易法第12b-2条所定义的“大型加速申报公司”之日,或(Iii)我们在之前三年期间发行了超过10亿美元不可转换债券的日期。
我们 打算利用上述报告豁免,直到我们不再是“新兴成长型公司”为止。 根据就业法案,“新兴成长型公司”还可以推迟采用新的或修订后的会计准则,直到这些准则适用于非上市公司的时间 。我们已不可撤销地选择利用这一豁免来遵守新的或修订的会计准则 ,因此,我们将不会受到与其他不是 “新兴成长型公司”的上市公司相同的新或修订的会计准则的约束。
我们 无法预测,如果我们选择依赖这些豁免,投资者是否会发现我们的证券吸引力降低。如果一些投资者发现我们的证券因任何减少未来披露的选择而变得不那么有吸引力,我们的证券交易市场可能会变得不那么活跃,我们普通股和认股权证的价格可能会更加波动。
作为一家上市公司,我们有义务制定并保持对财务报告的适当和有效的控制。如果我们未来未能保持对财务报告的适当和有效的内部控制,我们编制准确和及时财务报表的能力可能会受到损害 ,这可能会损害我们的经营业绩、投资者对我们的看法,从而损害我们证券的价值。
萨班斯-奥克斯利法案第404节要求我们评估和确定财务报告内部控制的有效性,并提供财务报告内部控制的管理报告。当我们失去JOBS法案中定义的“新兴成长型公司”的地位并达到加速申报门槛时,我们的独立注册公共会计师事务所将被要求证明我们对财务报告的内部控制的有效性。然而,只要我们仍然是一家新兴成长型公司,我们就打算利用新兴成长型公司可获得的豁免,不受这些审计师认证要求的 限制。管理管理层评估财务报告内部控制所必须达到的标准的规则非常复杂,需要大量的文档、测试和可能的补救措施。为了符合《交易法》中作为报告公司的要求,我们需要升级我们的系统,包括信息技术;实施额外的财务和管理控制、报告系统和程序;以及雇用额外的会计和财务人员。如果我们或我们的审计师无法断定我们对财务报告的内部控制是有效的,投资者可能会对我们的财务报告失去信心,我们普通股或认股权证的交易价格可能会下降。
| 53 |
我们 不能向您保证,未来我们对财务报告的内部控制不会存在重大缺陷或重大缺陷 。任何未能对财务报告进行内部控制的行为都可能严重抑制我们准确报告财务状况、运营结果或现金流的能力。如果我们无法得出我们对财务报告的内部控制有效的结论 ,或者如果我们的独立注册会计师事务所确定我们的财务报告内部控制存在重大弱点或重大缺陷 一旦该事务所开始其第404条审查,我们可能会失去投资者对我们财务报告的准确性和完整性的信心,我们的普通股或认股权证的市场价格可能会下跌,我们可能 受到纳斯达克、美国证券交易委员会或其他监管机构的制裁或调查。未能纠正财务报告内部控制的任何重大缺陷或重大缺陷,或未能实施或维护上市公司所需的其他有效控制系统 ,也可能限制我们未来进入资本市场。
我们 将因此而大幅增加成本,并投入大量管理时间作为上市公司运营。
作为上市公司,我们将产生巨额的法律、会计和其他费用。例如,我们将遵守经修订的1934年证券交易法的报告要求,并将被要求遵守 萨班斯-奥克斯利法案和多德-弗兰克华尔街改革和消费者保护法案的适用要求,以及美国证券交易委员会随后实施的规则和法规,包括建立和维持有效的披露和财务控制,改变公司治理做法,以及要求提交关于我们的业务和经营业绩的年度、季度和当前报告。这些要求 将增加我们的法律和财务合规成本,并将使某些活动更加耗时和成本高昂。此外,我们的 管理层和其他人员需要将注意力从运营和其他业务事务上转移,以便投入大量时间 这些上市公司要求。我们还需要聘请更多具有适当上市公司经验和技术会计知识的会计和财务人员,并可能需要建立内部审计职能。我们还预计,作为上市公司运营将使我们获得董事和高级管理人员责任保险的成本更高,我们可能被要求接受降低的承保范围或产生更高的承保成本。这也可能使我们更难吸引和留住合格的人员加入我们的董事会、我们的董事会委员会或担任高管。此外,在我们 不再符合JOBS ACT定义的“新兴成长型公司”资格后,我们预计将产生额外的管理时间和成本,以遵守适用于被视为加速申请者或大型加速申请者的更严格的报告要求,包括遵守《萨班斯-奥克斯利法案》第404节的审计师认证要求。我们才刚刚开始编译符合此类要求所需的系统和处理文档的过程。我们可能无法及时完成我们的评估、测试和任何必要的补救。在这方面,我们目前没有内部审计 职能,我们将需要雇用或合同增加具有适当上市公司经验和技术会计知识的会计和财务人员 。
我们 无法预测或估计因成为上市公司而可能产生的额外成本或此类成本的时间。
如果证券或行业分析师不发表有关我们业务的研究报告或发表不准确或不利的研究报告,我们的股价和交易量可能会下降。
我们普通股和权证的交易市场将在一定程度上取决于证券或行业分析师 发布的关于我们或我们业务的研究和报告。我们目前对证券和行业分析师的研究报道有限。如果我们未能保持证券或行业分析师的充分报道,我们股票的交易价格可能会受到负面影响。如果追踪我们的一位或多位分析师下调了我们的股票评级,或者发表了关于我们业务的不准确或不利的研究报告,我们的股价可能会下跌。如果这些分析师中的一位或多位停止对我们的报道或未能定期发布有关我们的报告,对我们股票的需求可能会减少,这可能会导致我们的股价和交易量下降。
| 54 |
未来 出售我们的普通股、认股权证或可转换为普通股的证券可能会压低我们的股价。
我们的普通股或认股权证的价格可能会因大量出售我们的普通股或认股权证的股票或认股权证而下跌 或认为这些出售可能会发生。这些出售,或这些出售可能发生,也可能使我们在未来以我们认为合适的价格出售股权证券变得更加困难。
此外,未来我们可能会发行额外的普通股、认股权证或其他可转换为普通股的股票或债务证券,用于融资、收购、诉讼和解、员工安排或其他方面。任何此类发行 都可能导致我们现有股东的股权大幅稀释,并可能导致我们普通股或认股权证的价格下跌。 WFIA持有预先出资的认股权证,以购买我们普通股的1,028,955股。一旦行使此类预先出资的认股权证,您在本公司的所有权权益将被稀释。
反收购 我们的公司证书和章程中包含的条款,以及特拉华州法律的条款,可能会破坏收购尝试。
我们修订和重述的公司注册证书、章程和特拉华州法律包含的条款可能会使 变得更加困难,推迟或阻止我们董事会认为不可取的收购。我们的公司治理文件包括 条款:
| ● | 将我们的董事会分为三类; | |
| ● | 授权 “空白支票”优先股,可由我们的董事会发行,无需股东批准,并可能包含 投票权、清算、股息和其他优于我们普通股的权利; | |
| ● | 限制董事和高级管理人员的责任,并向其提供赔偿; | |
| ● | 限制我们的股东在特别会议之前召集和开展业务的能力; | |
| ● | 要求在我们的股东会议上提前通知股东的业务建议,并提名我们董事会的候选人 ; | |
| ● | 控制董事会和股东会议的召开和安排程序;以及 | |
| ● | 为我们的董事会提供明确的权力,可以推迟以前安排的年度会议,并取消以前安排的特别会议。 |
这些 条款单独或一起可能会推迟或阻止敌意收购、控制权变更或管理层变动。
作为一家特拉华州公司,我们还必须遵守特拉华州法律的条款,包括特拉华州通用公司法律的第203条,该条款禁止持有我们已发行普通股超过15%的一些股东在未经我们几乎所有已发行普通股持有人批准的情况下进行某些业务合并 。
我们修订和重述的公司注册证书、章程或特拉华州法律中任何具有延迟或威慑控制权变更效果的条款 都可能限制我们的股东从其普通股或认股权证中获得溢价的机会 ,还可能影响一些投资者愿意为我们的普通股和认股权证支付的价格。
| 55 |
我们 预计在可预见的未来不会为我们的普通股支付任何现金股息。
我们 预计在可预见的未来不会为我们的普通股支付任何现金股息。我们目前打算保留未来的任何收益 为我们的业务运营和扩张提供资金,我们预计在可预见的未来不会宣布或支付任何股息。 因此,股东必须在价格上涨后依赖出售他们的普通股和认股权证,这可能永远不会发生,因为 这是实现他们的投资未来任何收益的唯一途径。不能保证我们普通股或认股权证的股票会 升值,甚至维持股东购买其股票或认股权证的价格。
我们的 董事、高管和主要股东对我们拥有相当大的控制权,可能会推迟或阻止公司控制权的变更。
截至2024年1月25日,我们的董事、现任高管和超过5%的普通股持有者,连同他们的关联公司,总共实益拥有我们已发行普通股的约27%。因此,这些股东一起行动,将有能力控制提交给我们股东批准的事项的结果,包括选举董事和任何合并、合并或出售我们所有或几乎所有资产。此外,这些股东共同行动,将有能力控制我们公司的管理和事务。因此,这种所有权集中可能通过以下方式损害我们普通股和认股权证的市场价格:
| ● | 延迟, 延迟或阻止我们的控制权变更; | |
| ● | 阻碍涉及我们的合并、合并、接管或其他业务合并;或 | |
| ● | 令人沮丧 潜在的收购方提出要约收购或以其他方式试图获得我们的控制权。 |
请参阅下面的 “某些受益所有人和管理层的证券所有权”,了解有关我们的执行官、董事和持有我们5%以上普通股的持有人及其关联公司对我们 流通股所有权的更多信息。
我们的 经修订和重述的公司注册证书指定特拉华州衡平法院为我们的股东可能发起的某些类型的诉讼和程序的唯一和排他性 法庭,这可能会限制我们的股东 获得与我们或我们的董事、管理人员或其他员工发生争议的有利司法法庭的能力。
我们的 经修订和重述的公司注册证书要求,除非我们书面同意选择其他法院,否则 特拉华州衡平法院将在法律允许的最大范围内,作为以下 项的唯一和专属法院:
| ● | 代表我们提起的任何派生诉讼或法律程序; |
| ● | 任何 因我们的任何董事、高级管理人员或其他雇员违反对公司的任何信托责任而提出索赔的诉讼 或者我们的股东 |
| ● | 任何 针对我们或我们的任何董事或高级管理人员提出索赔的诉讼,或针对我们或我们的任何董事提出索赔的诉讼 或高级职员,就DGCL、我们的公司注册证书或 附例;或 | |
| ● | 任何 主张受内部事务原则管辖的主张的诉讼; |
但条件是,如果且仅当特拉华州衡平法院因缺乏管辖权而驳回上述任何诉讼时,才可向特拉华州的另一家州法院提起任何此类诉讼。
| 56 |
专属法院规定仅限于法律允许的范围,不适用于根据《交易法》或任何其他规定联邦专属管辖权的联邦证券法提出的索赔。
此外, 《证券法》第22条规定,联邦法院和州法院对所有此类《证券法》诉讼具有并行管辖权。因此, 州法院和联邦法院都有受理此类索赔的管辖权。为了避免在多个司法管辖区提起诉讼 以及不同法院的裁决不一致或相反的威胁,除其他考虑因素外,我们修订和重申的公司注册证书 规定,美利坚合众国联邦地区法院将是解决 任何声称根据《证券法》提起诉讼的投诉的唯一论坛。虽然特拉华州法院已确定此类法院选择条款表面上有效,但股东仍可根据《证券法》向 我们、我们的董事、高级职员或其他雇员在美国联邦地区法院以外的其他地方提出此类索赔。 在这种情况下,我们希望大力维护我们经修订的 和重述的公司注册证书的排他性法院规定的有效性和可撤销性。
虽然 我们认为该条款有利于我们提高特拉华州法律在其适用的诉讼类型中的一致性, 但该条款可能会限制或阻碍股东在司法法庭上提出索赔的能力, 这有利于与我们或我们的董事、管理人员或其他员工的纠纷,这可能会阻碍针对我们和 我们的董事的此类诉讼,管理人员和其他雇员,并可能导致投资者提出索赔的成本增加。或者,如果法院 发现我们修订和重述的公司注册证书中包含的法院选择条款在诉讼中不适用或不可执行 ,我们可能会产生与在其他司法管辖区解决此类诉讼相关的额外费用,这可能会对 我们的业务和财务状况产生不利影响。
我们 注意到,法院是否会执行该条款存在不确定性,投资者不能放弃遵守联邦证券法及其下的规则和法规。尽管我们相信这一条款对我们有利,因为它使特拉华州法律在其适用的诉讼类型中的适用更加 一致,但该条款可能会起到阻止 针对我们董事和高管的诉讼的效果。
| 57 |
有关前瞻性陈述的警示性说明
本 招股说明书可能包含某些涉及重大风险和不确定性的前瞻性陈述。在某些情况下,您可以通过“可能”、”将“、“应该”、“预期”、“计划"、 “预期”、“可能”、“打算”、“目标”、”项目”、“估计"、 “相信”、“估计”、”预测“等术语来识别 前瞻性陈述,““潜在的”或“继续”或否定 这些术语或其他类似的表达,旨在确定有关未来的声明。这些陈述仅反映截至本招股说明书日期 的情况,涉及已知和未知的风险、不确定性和其他重要因素,这些因素可能导致我们的实际结果、 业绩或成就与 前瞻性陈述中明示或暗示的任何未来结果、业绩或成就存在重大差异。这些前瞻性陈述主要基于我们对 未来事件和财务趋势的当前预期和预测,我们认为这些事件和财务趋势可能会影响我们的业务、财务状况和经营业绩。这些前瞻性 陈述包括但不限于以下内容:
| ● | 我们 有能力重新遵守纳斯达克的持续上市要求; | |
| ● | 我们 缺乏运营历史,需要额外资本; | |
| ● | 我们的 计划开发和商业化我们的候选产品; | |
| ● | 我们计划的CTX-1301、CTX-1302和CTX-2103临床试验的时间; | |
| ● | 我们提交CTX-1301、CTX-1302和CTX-2103保密协议的时间; | |
| ● | 获得和保持CTX-1301、CTX-1302、CTX-2103或任何其他未来候选产品的监管批准的时间和能力 ; | |
| ● | 我们的候选产品的临床实用性; | |
| ● | 我们的商业化、营销和制造能力和战略; | |
| ● | 我们的 预期现金使用;
| |
| ● | 我们与竞争对手或行业相关的竞争地位和预测; | |
● |
我们识别、招聘和留住关键人员的能力; | |
| ● | 法律法规的影响; | |
| ● | 我们对根据《就业法案》成为新兴成长型公司的时间的预期; | |
| ● | 我们的 计划确定与我们的商业目标一致的、具有重大商业潜力的其他候选产品; 和 | |
| ● | 我们对未来收入和支出的 估计。 |
由于前瞻性陈述固有地受到风险和不确定性的影响,其中一些风险和不确定性无法预测或量化,而有些则是我们无法控制的,因此您不应依赖这些前瞻性陈述作为对未来事件的预测。我们的前瞻性表述中反映的事件和情况可能无法实现或发生,实际结果可能与前瞻性表述中预测的结果大不相同。有关可能导致我们的实际结果与前瞻性陈述中明示或暗示的结果大不相同的重要因素的讨论,请参阅本招股说明书中的“风险因素”部分。此外,我们在一个不断发展的环境中运营。新的风险因素和不确定因素可能会不时出现,管理层不可能预测所有的风险因素和不确定因素。由于这些因素,我们不能向您保证本招股说明书中的前瞻性陈述将被证明是准确的。除非适用法律另有要求,我们不打算因任何新信息、未来事件、 情况变化或其他原因而 公开更新或修改本文中包含的任何前瞻性陈述。但是,您应该审阅我们在招股说明书公布之日后不时向美国证券交易委员会提交的报告中描述的因素和风险以及其他信息。
您 应阅读本招股说明书,包括其中包含的财务报表和财务报表附注,但应了解我们未来的实际结果可能与我们预期的大不相同。我们通过这些警示性声明来限定我们所有的前瞻性声明。
| 58 |
市场 价格和股利信息
市场信息
我们的普通股在纳斯达克上交易,代码是“CING”。
记录持有者
截至2024年1月5日,我们共有206名普通股持有者。我们普通股的实际持有者人数超过这一记录持有者的数量,包括作为实益所有者的股东,但其股票由经纪商以街头名义持有 或由其他被指定人持有。这一数量的登记持有人也不包括其股份可能由其他 实体以信托形式持有的股东。
分红政策
除 股票股息于2021年9月20日生效,目的是根据我们首次公开发行(“IPO”)前的估值确定正确的已发行股票数量 ,我们从未宣布或支付过我们普通股的任何股息 。我们目前打算保留所有可用资金和任何未来收益(如果有的话),为我们业务的发展和扩张提供资金,我们预计在可预见的未来不会支付任何现金股息。未来任何派发股息的决定将由本公司董事会酌情决定。
| 59 |
生意场
概述
我们 是一家生物制药公司,使用我们专有的Precision定时释放TM(PTR)TM)药物输送平台 技术,以建立和推进下一代医药产品的管道,该管道旨在改善患有 频繁诊断病症的患者的生活,这些病症的特征是繁重的每日给药方案和次优的治疗结果。我们最初 专注于治疗注意力缺陷/多动障碍(“ADHD”)和焦虑症,正在确定和评估 其他治疗领域,我们的PTR技术可用于开发未来的候选产品。我们的PTR平台采用了 专有的腐蚀屏障层(EBL),设计用于在特定的预定义时间间隔释放原料药, 释放每日一次、多剂量片剂的潜力。
我们瞄准了ADHD治疗市场,截至2023年11月,美国市场规模估计超过230亿美元,其中186亿美元可归因于兴奋剂。 兴奋剂是治疗ADHD最常用的药物类别,约占美国所有ADHD药物处方的88%。相比之下,非兴奋剂药物通常只在二线或辅助治疗环境中使用,约占所有ADHD药物处方的12%。缓释或长效刺激性药物剂型最常被用作ADHD的一线治疗药物,约占ADHD市场总支出的160亿美元,占所有兴奋剂处方的54%。这些缓释剂 大多数都被批准在早上每天给药一次,旨在消除白天重复给药的需要。然而, 使用目前的‘每日一次’缓释剂型,大多数患者仍然会在当天晚些时候(通常是下午早些时候)接受第二剂或“助推剂” 剂量,以实现有效日覆盖,并因此遭受多种不良副作用 。我们认为,在当前的治疗模式中,存在着重大的、未得到满足的需求,即真正的每日一次的ADHD刺激性药物,其持续时间可提供整个活动日覆盖范围,并可改善副作用 ,以更好地满足患者众多未得到满足的需求。
我们的两种专有一线兴奋剂药物:CTX-1301(醋酸二甲酯)和CTX-1302(右旋苯丙胺)正在 开发,用于治疗所有三个患者群体的ADHD:儿童(6-12岁)、青少年(13-17岁)和成人 (18岁以上)。CTX-1301和CTX-1302都旨在解决目前批准的兴奋剂疗法的主要缺点: 提供即时起效(在30分钟内);提供完整的“有效日”持续时间;不再需要额外的兴奋剂药物的“助推剂/恢复”剂量;最大限度地减少或消除与早期药物“疲劳”相关的反弹/崩溃症状 ;以及提供良好的耐受性,并控制药物 的血浓度下降。此外,我们相信,通过取消多达60%的ADHD患者与其主要药物一起使用的“助推剂”剂量,我们相信我们的候选产品将提供重要的社会和经济效益:减少与短效兴奋剂药物相关的滥用和转移;允许医生开一种药物而不是两种; 允许患者为一种药物而不是两种药物付费;允许付款人报销一种药物而不是两种药物。
我们 在人类受试者身上完成了一项概念验证试验,以验证我们的PTR平台,并于2020年10月宣布了CTX-1301在ADHD患者中的1/2期研究的积极结果,确定了CTX-1301与福卡林®XR的耐受性、比较生物利用度和剂量比例。为了满足CTX-1301 NDA提交的药理学要求,我们于2022年10月完成了一项食品效应研究,证明CTX-1301可以与食物一起服用,也可以不与食物一起服用。
一项旨在评估CTx-1301在ADHD成人中的疗效和安全性以及起效和持续时间的III期成人剂量优化 研究于2022年12月启动,并于2023年6月完成。结果在2023年心理大会上公布,并将于2024年1月在2024年美国ADHD及相关疾病专业协会(APSARD)上公布。这项3期CTx-1301研究(NCT 05631626)在成人实验室教室环境中评估了21名ADHD成人(年龄范围:18-55岁)接受CTx-1301治疗的疗效 和安全性以及发作和持续时间。其在主要疗效终点上未达到统计学显著性,但与安慰剂相比,CTx-1301在改善永久性产品性能指标(“PERMP”)评分方面显示出显著性趋势 。与安慰剂相比,CTx-1301的临床 总体印象量表(“CGI-S”)评分也显示出显著改善, 对于该次要终点确实具有统计学显著性。本试验中CTx-1301的治疗效应量显著 -从30分钟开始,并证明了CTx-1301在整个活动 天内改善患者ADHD症状的能力。
此外,我们于2023年第三季度在儿童和青少年患者中启动了两项 CTx-1301 III期临床研究-一项固定剂量研究(NCT 05286762)和一项在实验室教室环境中进行的剂量优化起效和 持续时间研究(NCT 05924594)。根据从 FDA收到的关于我们CTx-1301临床项目的指南,我们停止了这两项研究的入组。这些研究中的所有入组 患者均可以完成研究,并将相应报告数据。此外,根据本指南,我们 预计将在2025年上半年根据第505(b)(2)条途径提交CTx-1301的NDA,并将Focalin® XR作为参比药物,使用FDA存档的疗效和安全性数据作为批准依据,以及我们CTx-1301临床项目的生物利用度/生物等效性 数据和疗效/安全性数据。如果CTx-1301获得FDA批准,我们可能会进行4期试验。
我们计划最快于2025年启动CTx-1302(苯丙胺)的临床 计划,CTx-1302是我们治疗ADHD的第二种研究资产,等待额外的 资本资源。
| 60 |
我们 相信,我们的PTR平台有潜力为患者和医生提供差异化的药物治疗选择 ,这将提高患者的依从性,并改善其他几个治疗领域的健康结局。我们打算利用我们的PTR 平台技术,通过在其他治疗 领域中识别和开发额外资产来扩展和增强我们的临床阶段管道,在这些领域中,一种或多种API需要在特定的预定义时间间隔内每天多次交付,并以 一种能够显著改善现有疗法的方式发布。我们选择其他未来管道 候选产品的标准将包括年销售额达到10亿美元或以上的潜力、提供明显差异化 治疗优势的潜力以及克服未满足医疗需求的潜力。
根据《联邦食品、药品和化妆品法案》第505(b)(2)条,我们正在为我们的焦虑候选药物CTx-2103(丁螺环酮)构建临床项目,这可能会缩短NDA提交时间。作为这项工作的一部分,我们于2022年9月在年度心理学大会上展示了CTx-2103的人体制剂研究结果。评价该三模式片剂的药代动力学,提供 三个精确定时剂量的丁螺环酮与一个立即释放剂量。此外,造影成像可视化了 片剂通过胃肠道的转运,以确认释放的位点和开始,然后将其与药代动力学 数据相关联,以建立CTx-2103制剂的完整释放曲线。
CTx-2103被设计为 一种新型丁螺环酮缓释片剂,其中包含我们专有的PTR™药物递送平台。丁螺环酮, 一种氮杂匹隆衍生物和5-HT 1A部分激动剂,是第一种用于治疗广泛性焦虑症的非苯二氮卓类抗焦虑药。与其他抗焦虑治疗相比,丁螺环酮可能表现出降低的副作用特征。与苯二氮卓类药物 和巴比妥类药物不同,由于对γ-氨基丁酸 受体无影响,使用丁螺环酮不会产生身体依赖或戒断风险。
来自 人体制剂研究的积极结果提供了所需的关键信息,并允许我们要求与FDA举行IND前会议,以讨论 我们在2023年第四季度进行的CTx-2103临床和监管项目的设计。我们收到了FDA关于CTx-2103监管途径的意见 ,以及IND备案的临床研究设计。基于此 FDA反馈,我们认为我们可以根据505(b)(2)途径寻求并赢得CTx-2103的批准,这通常需要 比505(b)(1)完整NDA途径更少的时间和资源。
2020年,美国各种形式的丁螺环酮销售额在52亿美元的焦虑症市场中占20亿美元以上。CTx-2103将 设计为每日一次的缓释片剂,与标准治疗方案相比,具有明显的差异化和令人信服的优势, 标准治疗方案必须每天多次服用,以最大限度地发挥疗效。我们正在积极进行许可证谈判,在最终 协议和额外资本资源尚未达成之前,用于治疗焦虑症的CTx-2103(丁螺环酮)的开发可能最快 于2025年开始。
| 61 |
我们的 临床开发管道
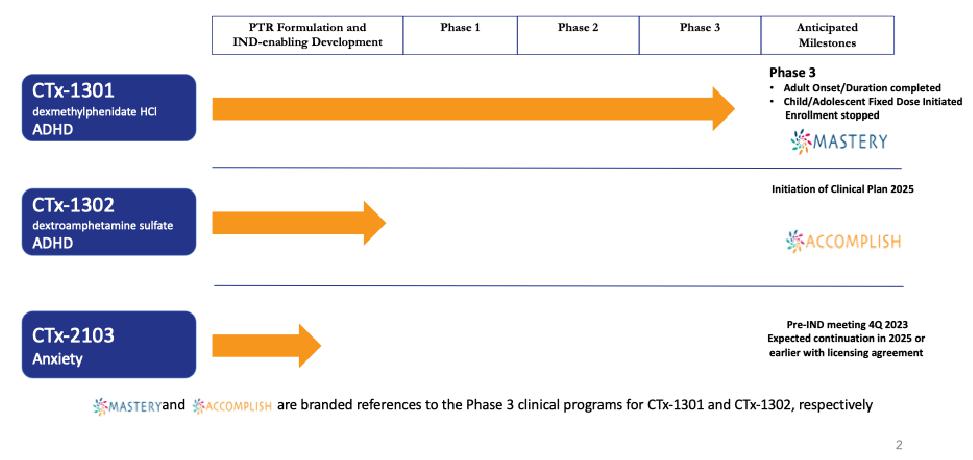
我们的 战略
我们的 目标是成为一家领先的创新型生物制药公司,专注于下 代医药产品的开发、制造和商业化,这些产品利用我们的PTR药物输送平台技术来创建给药方案和药物释放 曲线,从而改善患有多种常见疾病的患者的生活。我们实现这一目标的业务战略的关键初始要素 包括:
| ● | 完成 开发并获得CTx-1301治疗ADHD的监管批准。
在 2020年10月,我们宣布了CTx-1301在ADHD患者中进行的1/2期研究的积极结果,以确定耐受性, 比较生物利用度和CTx-1301与Focalin® XR的剂量比例。一项III期成人剂量优化研究 评估CTx-1301在ADHD成人中的疗效和安全性,以及起效和持续时间,于2022年12月启动 并于二零二三年六月完成。结果在2023年心理学大会上公布。此外,我们还启动了两个CTx-1301阶段 在儿童和青少年患者中开展的3项临床研究-一项固定剂量研究和一项实验室剂量优化起效和持续时间研究 教室设置-在2023年第三季度。根据FDA关于我们临床 CTx-1301(右哌甲酯)计划,入组这两项研究。这些研究中所有入组的患者都可以完成 将相应报告研究和数据。此外,根据本指南,我们预计将提交CTx-1301的NDA 2025年上半年,根据第505(b)(2)条途径,使用Focalin® XR作为参比上市药物,使用其疗效 作为批准依据的FDA存档的安全性数据,以及生物利用度/生物等效性数据和疗效/安全性 CTx-1301临床项目的数据。 | |
| ● | 成功 商品化CTx-1301.
如果CTx-1301获得FDA批准,我们计划在Indegene公司的协助下将我们的主要候选药物商业化。于二零二三年三月,我们与Indegene订立联合商业化协议,据此,Indegene将按服务收费基准为CTx-1301提供商业化服务,包括市场推广、销售、市场准入及分销。 |
| 62 |
| ● | 提前 CTx-2103治疗焦虑症的临床试验。 2022年9月,我们宣布,来自人体配方的数据 对CTx-2103的研究证明了其递送三重释放丁螺环酮的单次给药的能力。我们将使用这些 结果设计CTx-2103的临床项目,CTx-2103将被设计为每日一次、多剂量片剂,我们认为 与标准治疗方案相比,将有明显的区别和令人信服的优势。我们正在进行有效的许可证谈判, 在达成最终协议之前,CTx-2103(丁螺环酮)用于治疗焦虑症的开发可能最早于2025年开始,待定 额外的资本资源。 | |
| ● | 提前 开发CTx-1302用于治疗ADHD。 我们计划最早在2025年启动CTX-1302(右旋苯丙胺)的临床 计划,这是我们治疗ADHD的第二种研究资产,等待额外的资本资源。
| |
| ● | 最大化 我们的PTR平台在新适应症中开发其他候选产品的潜力,这些新适应症具有显著的未满足的医疗需求 和数十亿美元的收入潜力。 我们打算使用我们的PTR药物输送平台技术和简化的505(b)(2) 开发途径,以在其他治疗领域开发额外的治疗资产,其中一种或多种活性药物成分 需要在特定的、预定义的时间间隔内每天给药数次,并以能够提供显著 对现有疗法的改进。我们相信这将提高患者的依从性和更好的健康结果。进一步 我们打算评估的适应症包括失眠、非阿片类疼痛、阿尔茨海默氏症、甲状腺功能减退症、精神病、抑郁症、心血管疾病 疾病、帕金森病、偏头痛、口腔肿瘤、口干症(口干)和双相情感障碍等。 |
| ● | 获取 或许可证中的其他资产或计划,以补充我们的产品组合和/或利用我们的技术.我们 不断评估潜在的合作机会或资产收购,以支持我们当前的候选产品组合 并为我们的组织提供实质性的价值。我们打算将重点放在早期到中期的开发候选产品上,以产生 临床数据,并可能进入后期开发阶段,最终进入商业化阶段。 | |
| ● | 许可证过期 将我们的PTR平台提供给其他公司,并在美国以外的地区授权我们的候选产品。我们正在积极寻求 并评估将我们的现有资产和PTR药物输送平台技术许可给其他寻求 服务于需求未得到满足和/或希望将每日多次给药改为一次给药的大量患者群体 每日服用,以满足患者的需要。我们还在持续进行对话,以寻求和评估许可机会 将我们的候选产品提供给第三方在美国境外使用。 | |
| ● | 进一步 加强我们知识产权组合。我们打算继续管理和扩大我们多样化的知识产权组合,并维护我们的商业秘密和技术诀窍,重点放在我们的PTR平台、当前和未来的候选管道以及专有的 制造工艺。我们相信,这些活动对于保护我们的平台和候选产品免受可能试图与我们的治疗资产和压缩片剂方法竞争的潜在竞争对手 至关重要。 | |
| ● | 利用我们现有的cGMP专业知识。我们开发了一种专有、可靠、高产量的专用制造设备 ,具有实时测试和发布的潜力,供我们的第三方制造合作伙伴使用。我们的流程 旨在创建一个可以包含其他药物物质的平台,从而允许扩展到其他 适应症和治疗领域。我们预计,我们对这些制造能力和设备的投资将大幅 缩短我们的开发时间表以及当前和未来资产的总体开发成本。我们目前使用商业制造 设备,不需要技术转让或大规模流程来满足临床或商业制造需求。 2022年10月,我们宣布,我们已选择Social CDMO,Inc.(“Social”)作为我们的新合同开发 和制造组织(“CDMO”),该组织将生产我们的主要候选CTX-1301的所有临床、注册和商业批次 。Social已在其位于佐治亚州盖恩斯维尔的工厂和装备中专门配备了由我们提供的专有设备。 |
| 63 |
我们的 团队
我们的创始人和管理团队在生物制药领域拥有多年的经验,曾在领先的生物制药 公司担任管理职务,包括辉瑞、诺华国际股份公司、杜邦公司和赛诺菲公司等。我们的团队在药物开发和药品商业化方面拥有 丰富的经验和专业知识,包括多种精神和神经系统产品。
谢弗,我们的联合创始人、董事长兼首席执行官,曾在辉瑞、诺华国际股份公司和赛诺菲公司担任高级领导职务,并在药物开发和商业化方面拥有超过25年的经验。马修·布拉姆斯博士是我们的联合创始人兼首席医疗官,他在成人和儿童精神病学领域拥有30多年的临床患者管理经验, 参与了多种ADHD药物的研究、开发和评估。劳尔·R·席尔瓦博士是我们的联合创始人兼首席科学官,是一名执业的儿童和青少年精神病学家,曾担任纽约大学医学院儿童和青少年精神病学副教授和副主席。我们的首席运营官劳里·A·迈尔斯曾在包括辉瑞、诺华国际股份公司、杜邦公司和赛诺菲公司在内的全球领先制药公司担任过领导职务 ,并在药物开发、营销和商业化方面拥有超过25年的经验。
ADHD 当前治疗方法的概述和缺陷
ADHD是一种慢性神经行为和发育障碍,影响数百万儿童、青少年和成年人。在美国,4-17岁的儿童和青少年中约有640万人,即11%,被诊断出患有ADHD。在这一群体中,80%的人接受了治疗,65%的人表现出持续到成年的临床ADHD症状。据估计,美国成人ADHD患病率约为1,100万名患者,占总人口的4.4%,几乎是儿童和青少年人口总和的两倍。 目前,大约20%的成人ADHD人口正在接受治疗,然而,越来越多的成人患者被诊断为ADHD并寻求治疗,这导致成人ADHD市场每年增长约10%。美国的ADHD药物总销售额持续增长,截至2023年11月的12个月中,所有ADHD药物的销售额超过230亿美元。
ADHD 的特点是持续的注意力不集中和/或多动--干扰功能和/或发育的冲动。 根据美国儿童和青少年精神病学学会,ADHD在儿童和青少年中的常见表现包括:
多动: 孩子们似乎总是在运动。一个多动症的孩子可能会四处走动,触摸或玩耍周围的任何东西,或者不断地说话。在讲故事的时间或学校的课程,孩子可能会蠕动,坐立不安,或起床,在房间里走动。有些孩子 扭动他们的脚或轻敲他们的手指。多动症的青少年或成年人可能会感到不安,需要一直保持忙碌。
冲动: 孩子们经常不假思索地脱口而出。他们可能经常毫无节制地表达自己的情绪。他们也可能 不考虑自己行为的后果。这样的孩子可能会发现很难排队或轮流。冲动的青少年和 成年人倾向于做出有小的即时回报的选择,而不是为更大的延迟回报而努力。
注意力不集中: 注意力不集中的孩子可能很快就会对一项他们不喜欢的活动感到厌烦。组织和完成 一项任务或学习新的东西对他们来说是困难的。作为学生,他们经常忘记写作业或带书回家。完成作业可能是一个巨大的挑战。在任何年龄,注意力不集中的人可能经常容易分心,犯粗心的错误, 忘记事情,难以遵循指示,或者从一个活动跳到另一个活动而没有完成任何事情。
成人ADHD患者通常患有躁动、冲动、时间管理困难、情绪调节困难和财务管理困难。患有ADHD的成年人报告说,他们内心有一种坐立不安和不安的感觉,并经历了更大的沟通困难 。进入就业市场后,许多成年人很难找到工作,而且由于一再迟到或旷工,被解雇的风险增加。与未受影响的同龄人相比,患有ADHD的成年人收入低约30%,就业可能性低10%。此外,患有ADHD的成年人更有可能表现出各种共病,包括滥用药物和酗酒、社交焦虑和抑郁。
| 64 |
儿童和成人的ADHD不仅对个人,而且对他们的家人、朋友和同龄人都有影响,因为它的流行 作为最常见的诊断行为障碍之一,对社会、医疗体系和整个经济都有严重影响。在社会层面上,与对照组相比,ADHD患者经历的车辆事故发生率高40%以上,离婚率高2倍 ,意外死亡的发生率高2倍,前瞻性研究表明,患有ADHD的儿童和成年人的监禁率大约是对照组的两倍。在经济层面上,仅在美国,全国每年增加的ADHD成本从1430亿美元到2660亿美元不等。
尽管没有针对ADHD的单一医学、体格或基因测试,但合格的精神卫生保健专业人员和医生能够 从多种来源收集信息,包括ADHD症状清单、标准化行为评定表、过去和当前功能的详细病史,以及从近亲或重要的其他人那里获得的信息,从而提供诊断评估。一些从业者还将对认知能力和学习成绩进行测试,以排除可能的学习障碍。
兴奋剂 是治疗ADHD最常用的处方类药物,约占所有ADHD药物处方的88%。 兴奋剂是附表II受控物质,据信通过增强大脑中多巴胺和去甲肾上腺素神经递质的作用而起作用。在截至2023年11月的12个月里,大约开出了8200万张兴奋剂处方。相比之下,非兴奋剂药物通常作为二线或辅助疗法使用,占所有ADHD药物处方的12%。目前,ADHD市场由四种主要的兴奋剂药物主导:Vyvanse®、Adderall®XR、Concerta®和Focalin®XR。 这些产品在2000年至2007年期间获得批准并上市,被认为是ADHD治疗范式的革命性变化 最终提供了一种解决方案,避免了ADHD患者当时需要的上午晚些时候的第二剂兴奋剂药物。
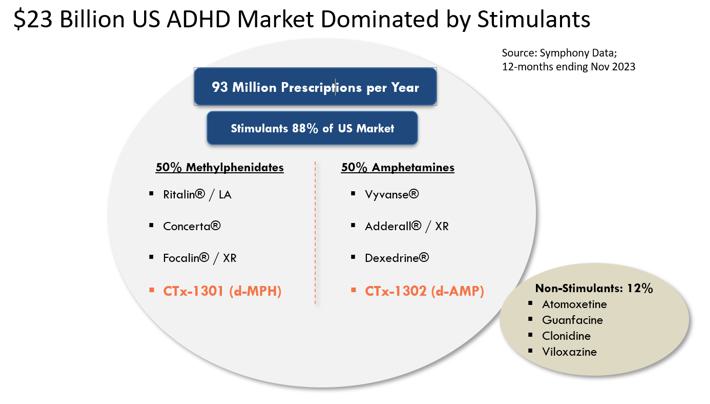
不幸的是, 按照设计,所有四种最常用的处方兴奋剂都在早上提供所有的药物物质。因此,大多数患者仍然需要额外的药物来覆盖他们一天中剩余的时间。目前,60%的ADHD患者 由于持续时间短、见效慢以及下午早些时候的崩溃或反弹效应,需要下午的‘增强/恢复’剂量 。此外,它们的PK-PD释放曲线使患者即使在治疗过程中也会受到碰撞和反弹效应的严重影响。
| 65 |
患者和从业者报告说,理想的ADHD刺激性药物将提供全具有以下特点:整个活动日持续时间;立即开始行动(在30分钟内);能够最大限度地减少或避免与药物血液水平快速下降相关的崩溃/反弹效应;以及消除了对短效兴奋剂助推剂/恢复剂量的需要。
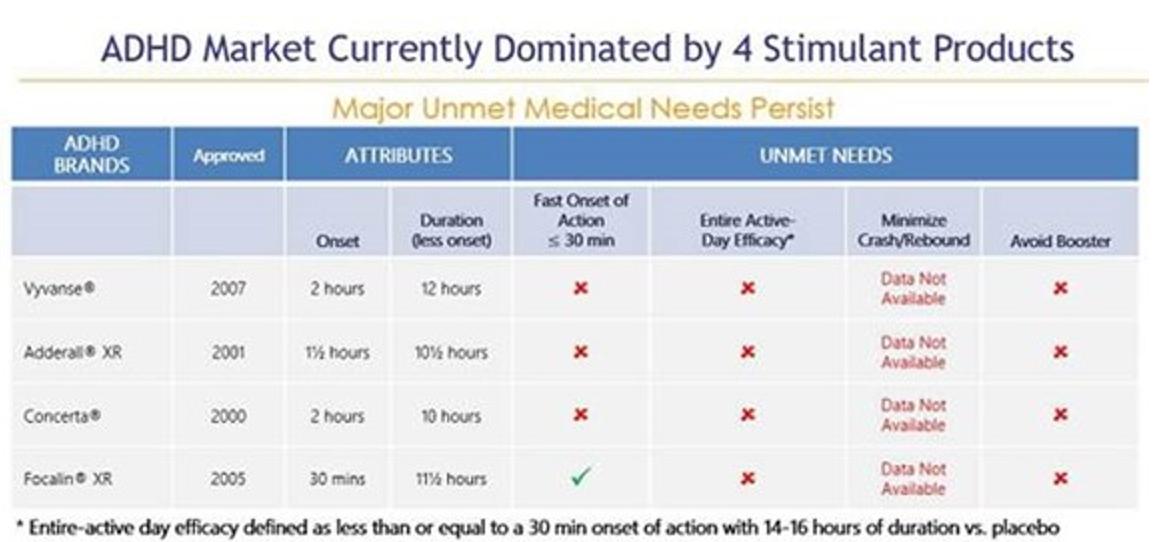
上面的 图表基于已批准产品的包装插入和审批摘要基础。
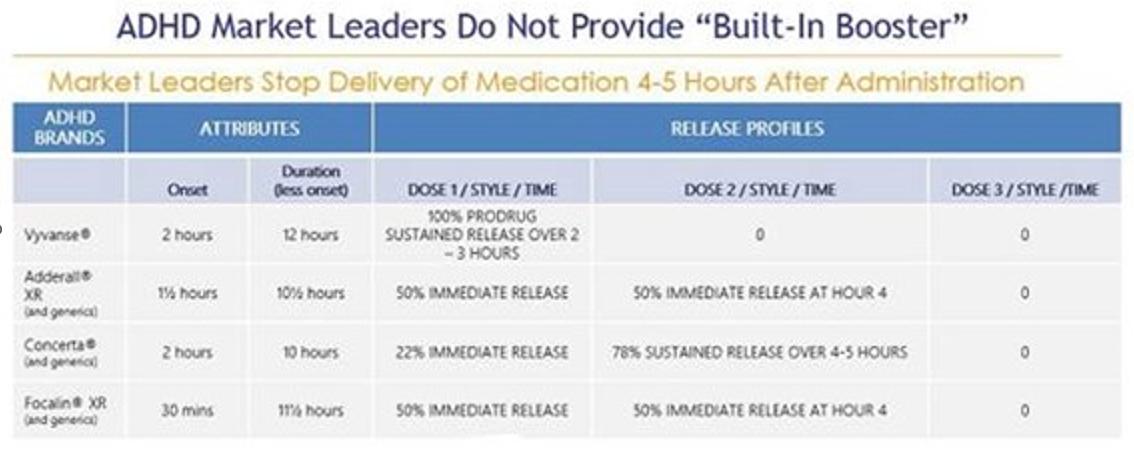
上面的 图表基于已批准产品的包装插入和审批摘要基础。
近年来,FDA批准了额外的兴奋剂药物,旨在满足一些剩余的未得到满足的需求。咀嚼片、液体和口腔崩解片已经上市,还有一种产品具有晚间给药时间表,旨在提供清晨起效。这些产品没有一种能够满足ADHD患者和处方者所有未得到满足的需求,因此 都未能获得作为一线代理的吸引力。此外,根据市场份额,这些最近的刺激性药物似乎没有为医疗从业者和他们的患者提供比广泛可用的仿制药更多的优势。事实证明,它们是利基药物,占2020年美国ADHD处方总数的2.0%。因此,对于提供快速起效、最大限度地减少或消除崩溃/反弹、消除助推器/恢复剂量以及最重要的是提供整个“有效日”功效的真正每日一次剂量,存在着未得到满足的需求。
| 66 |
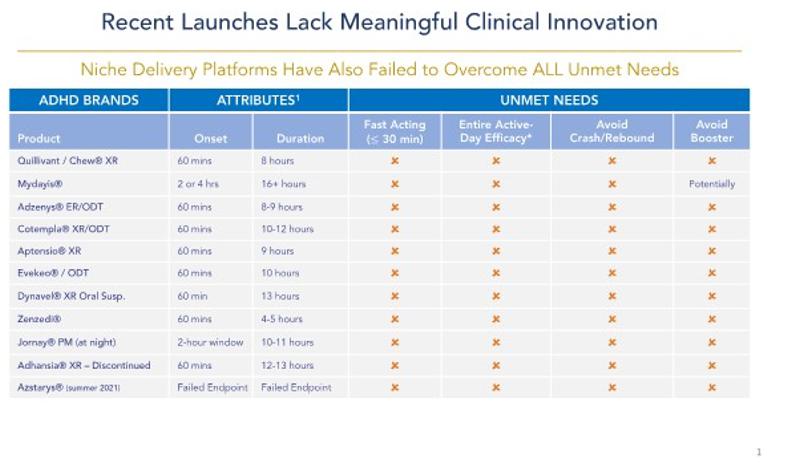
上面的 图表基于已批准产品的包装插入和审批摘要基础。
我们的 解决方案:我们专有的精密定时释放药物传递平台技术
我们 正在使用我们内部开发的PTR药物传递平台技术开发能够实现真正的每日一次给药的药物。 我们的CTX-1301、CTX-1302和CTX-2103候选药物包含三种释放的活性药物成分,并将其组合成一个小的 片剂剂型(比许多可比的单剂量ADHD产品更小)。每一次释放的原料药都由专有的EBL分隔, 一种功能赋形剂,设计为在一天中逐渐侵蚀,以特定时间间隔提供受控药物释放, 允许良好的靶向效应期。
图解:我们的PTR平台薄膜包衣片
| 67 |
CTX-1301片剂与普通ADHD和其他药物的大小比较
我们 相信,与目前可用的ADHD治疗方法相比,我们的PTR技术为我们的候选药物提供了以下优势:
快速 开始。许多目前可用的疗法通常需要长达60分钟或更长的时间才能开始起效,因此可能会让患者在服药和起效之间有很长的间隔。为了尽量减少这种发病差距,患者通常会早早起床服药 并试图回到睡眠状态,直到药物生效。我们设计的候选药物是快速起效的,因此可以在患者开始一天的早上服用,而不是在黎明前等待发病。
消除了对额外兴奋剂助推器的需求。凭借整个活动日覆盖范围,我们相信我们的技术将使患者无需在当前处方的治疗用完时服用下午强化剂量。我们相信,通过消除对增强剂量的需求,我们的候选对象将减少患者的尴尬,尤其是儿童和青少年患者,他们经常被迫在学校与同学一起服用第二剂,并提高患者的依从性,尤其是在ADHD人群中,因为在ADHD人群中, 患者容易忘记服用他们需要的额外剂量来度过他们的一天。
降低 滥用潜力。我们相信,如果获得批准,我们针对ADHD患者的快速起效和完整的活动日解决方案将降低短效兴奋剂滥用和转移的发生率。我们相信,通过消除对短效兴奋剂强化剂量的需求,由于患者携带短效附表II控制的药物到学校或单位进行下午剂量的 非法销售和娱乐使用的可能性将会减少。
消除 崩溃和反弹症状。使用目前可用的治疗方法的患者可能会报告不良反应或ADHD症状的爆发 当他们的药物失效时;这些影响被称为“崩溃”和“反弹”。利用我们精确的给药时间、给药比例和给药方式,我们相信我们的候选药物可以控制血液水平的下降,消除患者的这种不适体验 .
| 68 |
更低的 成本。通过提供整个有效日疗效,我们的候选药物不再需要医生开一种以上的药物 ,从而降低了单个患者和整个医疗保健系统的总体疾病成本。此外,兴奋剂ADHD类别中的仿制药并不比其他类别的非受控药物便宜得多。非专利兴奋剂药物的成本是品牌药物成本的55%-90%。我们相信,如果获得批准,我们的候选药物将为患者提供更具成本效益的解决方案。
显著提高了耐受性。由于我们药物的PK和PD特征,我们相信患者将经历较少的与现有兴奋剂疗法相关的治疗相关不良事件,包括失眠、食欲抑制、极度不安、烦躁不安、易怒、疲劳和情感平缓。
上市时提供8种剂量强度的可用性和单一对映体原料药选择。我们的CTX-1301和CTX-1302候选产品都是圆形薄膜包衣片,我们打算提供八种匹配的剂量强度。我们认为,为从业者提供适当滴定和优化患者日常剂量需求的能力至关重要。通过推出八种剂量强度,从业者 将不必不断地将患者切换到其他药物或为患者补充更多的短效强化药物。 此外,我们相信八种剂量强度将允许医疗从业者在他们的实践中适当地治疗从幼儿到成年的各种患者 。已经推出三种剂量强度的药物通常被忽略或避免,直到至少有六到七种剂量才可用。CTX-1301和CTX-1302都含有受附表II管制的原料药。两种候选产品的原料药只使用多种对映体中的一种,这可能会导致效力、不良事件(AES)和药物相互作用情况的改善,以及增强的治疗指数。
我们的主要候选药物CTX-1301:哌醋地塞米松治疗6年及以上的ADHD
我们 相信我们最先进的候选药物CTX-1301将成为治疗ADHD的第一个真正的每日一次的哌醋地塞米松片剂,在30分钟内起效,并具有完整的“有效日”疗效。CTX-1301是一种基于片内技术的三模缓释片,它以精确的 释放次数、比例和释放方式提供了三种不同的盐酸地塞米松释放。我们的CTX-1301版本简介如下:
释放#1:最初的即刻释放剂量,或IR,在给药后5至6分钟内开始提供每日总剂量的35%,旨在30分钟内达到治疗效果;以及
释放#2:给药3小时后,第一次延迟缓释(DR1)提供超过90分钟的每日释放总量的45%;以及
释放#3:在给药7小时后,第二次延迟、立即释放(DR2,内置助推器)提供约30分钟内释放的每日总剂量的20%。
| 69 |
CTX-1301与福卡林XR(参考上市药物)的释放情况比较

我们的 专有三模式释放配置文件旨在为患者提供快速缓解症状的方法,并在整个活动日中保持这种缓解。此外,我们相信CTX-1301将继续表现出更有利的耐受性 ,这是由这种专门的三释放设计和独特的35%-45%-20%释放谱产生的,而不是目前可用的50%-50%或33%-33%释放谱,如果患者以相同的 毫克强度单独服用三剂地塞米松,将产生更好的耐受性。CTX-1301提供了商业上可获得的(品牌或非专利)短效和长效配方所无法复制的释放配置文件,并且经过精确的设计和设计,以满足ADHD患者和提供者的特定需求。
我们 预计CTX-1301薄膜包衣片将有8种剂量,从6.25毫克到50毫克的地塞米松。所有的赋形剂都是药典和/或非新药,广泛用于口服制剂,并且在药物产品中的含量 远低于FDA非活性成分数据库(IID)中列出的最大效价。
我们的CTX-1301临床开发计划
CTX-1301的拟议临床计划包括两个1/2期临床药理学研究和我们的3期临床疗效和安全性试验。
我们的1/2期生物利用度试验结果
2020年10月,我们宣布了禁食条件下ADHD受试者1/2期比较生物利用度研究的积极结果,并显示了与我们的RLD Focalin XR相似的 生物利用度。调整后的主要曝光参数的几何平均比率(C最大值,AUC0-信息、 和AUC最后的在高剂量和低剂量下,CTX-1301和福卡林XR之间的剂量均在所需的80%至125%范围内, 显示出与RLD之间的桥梁以及剂量比例。在这项研究中,没有意外的不良事件,没有严重的不良事件,没有死亡,也没有观察到其他安全信号。
主要调查结果
将 桥接到福卡林®XR
| ● | 确认了与福卡林XR类似的生物利用度,并确认了我们利用505(B)2途径的能力 | |
| ● | 证明了剂量比例,使我们无需评估所有个人强度体内 | |
| ● | 消除了 任何非临床研究的要求和利用福卡林XR标签现有安全性的能力,可能会导致 更快地进入市场 |
| 70 |
展示了与福卡林®XR相比的血浆水平
| ● | CTX-1301血液水平显示出发病快、有效日持续时间长和良好的耐受性的可能性。 | |
| ● | 按设计执行了 ,其精确20%的内置助推器第三次交付证实,如果获得批准,CTX-1301将消除患者对短效兴奋剂的需求,并避免可能影响正常睡眠和食欲的非理想血液水平 |
展示了与福卡林®XR相比,血浆水平可控下降
| ● | 精确的20%第三次分娩阻止了下午三点左右血液水平的暴跌,控制了下降。 |
显著降低了治疗的紧急不良事件
| ● | 患者 通过PTR平台以精确的时间、独特的比率多接受25%的药物治疗 | |
| ● | 与福卡林XR相比,CTX-1301患者与研究药物相比,TEAE降低了28.6% |
图1、图2和图3显示了我们与福卡林XR的生物利用度数据对比研究
图1:禁食条件下CTX-1301与福卡林XR在成人ADHD受试者中的生物利用度比较研究(低剂量比较)

| 71 |
图2:禁食条件下(大剂量)CTX-1301与福卡林XR在成人ADHD受试者中的生物利用度比较研究
图3:禁食条件下(低剂量和高剂量)CTX-1301与福卡林XR在成人ADHD受试者中的生物利用度比较研究
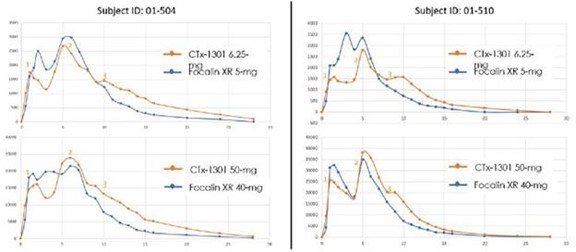
我们的 其他第一阶段研究
我们 于2022年10月完成了第一阶段食品效应研究。主要终点表明,CTX-1301可以与食物一起服用,也可以不与食物一起服用。
| 快速美联储 研究 | |
| ● | 在23名18-50岁的健康成年受试者中进行了一项第一阶段的开放标签、随机、单剂、两个周期、两个疗程(喂食和禁食)、两个序贯的交叉研究,以评估食物对CTX-1301吸收和生物利用度的影响。本研究的目的是评估食物对单剂CTX-1301的吸收速率和吸收程度以及总体生物利用度的影响。第二个目标是提供禁食和喂食状态下CTX-1301血浆浓度的药代动力学数据,并评价单剂量CTX-1301 25 mg片剂的安全性。考察目标是在选定的时间间隔内进一步考察CTX-1301 25 mg片剂的特性。 |
| 72 |
我们的第3阶段掌握测试
一项评估CTX-1301在成人ADHD患者中的疗效和安全性以及起效和持续时间的第三阶段成人剂量优化研究于2022年12月启动,并于2023年6月完成。研究结果已在2023年精神病学大会上公布,并将在2024年1月举行的2024年美国ADHD及相关疾病专业学会(APSARD)上公布。这项第三阶段CTX-1301研究 (NCT05631626)在成人实验室教室环境中评估了21名成人(年龄范围:18-55岁)CTX-1301的疗效和安全性以及CTX-1301的发病和持续时间。它在主要疗效终点上没有达到统计学意义,但与安慰剂相比,CTX-1301显示出在改善PERMP评分方面有显着改善的趋势。与安慰剂相比,使用CTX-1301的cgi-S评分也显示出显著的改善,这对这个次要终点确实具有统计学意义。CTX-1301在本试验中的治疗效果显著--从30分钟开始,并证明了CTX-1301能够在一整天的活动中改善患者的ADHD症状。
主要调查结果
PERMP是在此阶段3研究中部署的技能调整数学测试。PERMP分数是尝试的数学问题数 加上在10分钟会话中正确回答的数学问题数之和。得分范围从0到800,得分越高表示 表现更好。
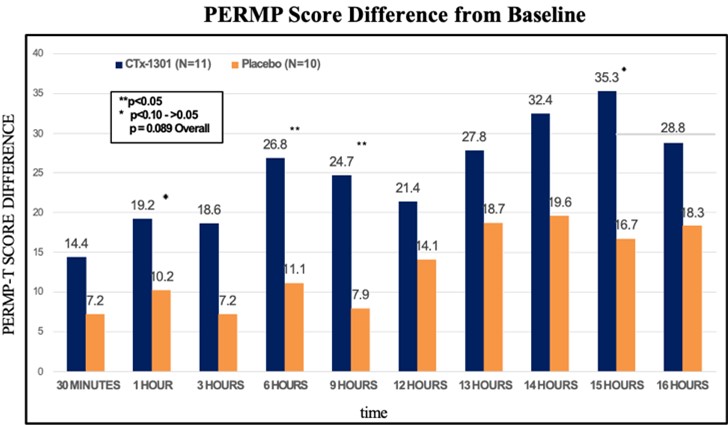
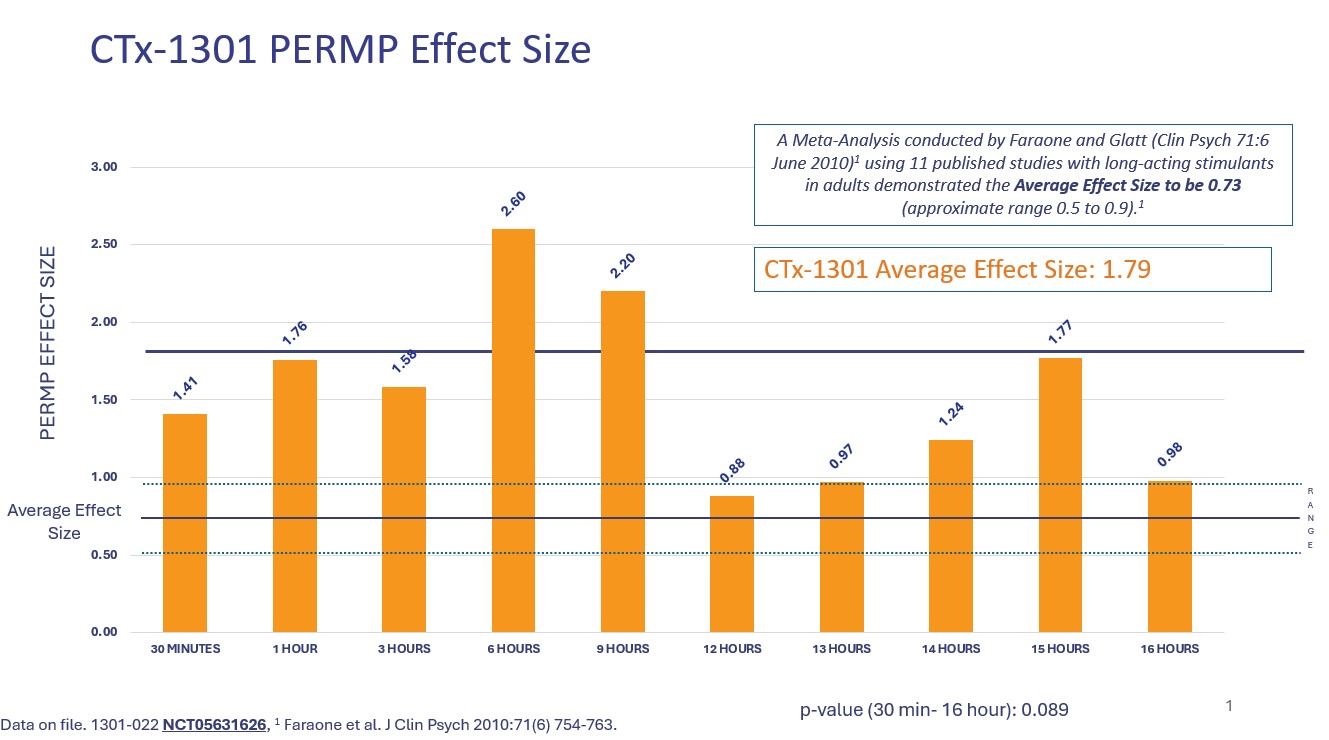
CGI-S是一种单项量表,从1到7衡量精神病理学的严重程度,在这项第三阶段研究中对成年人进行了测量。
| 73 |

*RPCP:随机、双盲、安慰剂控制期
AISRS,或ADHD 评价表是基于《精神疾病诊断和统计手册》第5版(DSM-5)(美国精神病学协会2013)的18个条目的量表,它评估ADHD的标准,并对症状进行4分制评级,并在这项成人研究中进行测量。 每个条目使用严重程度和频率评级的组合进行评分,从0(反映没有症状或从未出现或很少出现)到3(反映严重症状或非常频繁),因此AISRS-5的总分从0到 54。
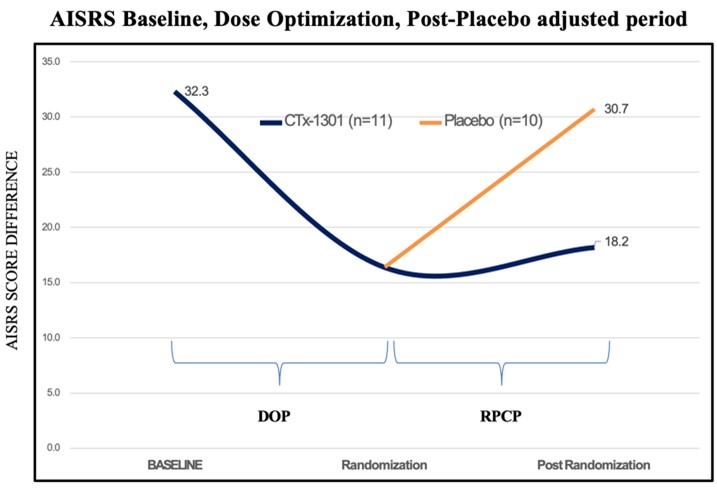
这些3期CTX-1301诊断工具和ADHD评估,包括AISRS-5、CGI-S和PERMP,通常用作支持保密协议备案的研究终点。
我们的第三阶段CTX-1301临床安全性和有效性研究还包括两项儿童和青少年研究,这两项研究于2023年第三季度启动:
| ● | A阶段3,剂量优化、随机、双盲、安慰剂对照、单中心、平行组疗效和安全性实验室 课堂研究患有ADHD的儿童(6-12岁)。主要目的是在使用PERMP的实验室课堂研究中,评估CTX-1301与安慰剂治疗ADHD儿童的疗效。次要目标是确定CTX-1301的临床疗效的起效时间和持续时间,并确定CTX-1301与安慰剂相比的安全性和耐受性。 | |
| ● | A阶段3,随机、双盲、安慰剂对照、多中心、固定剂量、平行组,对患有ADHD的儿童和青少年(6-17岁/o)进行疗效和安全性研究。主要目标是使用ADHD-RS-5评估固定剂量的CTX-1301与安慰剂相比的疗效。次要目标是评估固定剂量CTX-1301与安慰剂相比的疗效,使用CGI-S,固定剂量CTX-1301的安全性和耐受性,以及单剂和稳定状态下的PK水平。 |
| 74 |
| 将在成人剂量优化研究中评估探索性目标,以确定和评估使用CTX-1301的优化治疗相对于以前使用患者报告的结果(“PRO”)进行优化治疗的独特益处和满意度。专业评估 将包括: |
| ● | 受试者 要求使用“助推剂”剂量,以达到有效日的全部功效、避免疲劳、碰撞/反弹以及滥用/转移短效兴奋剂。 | |
| ● | 将之前治疗的总体治疗满意度与CTX-1301进行比较。 | |
| ● | 将以前治疗的不良事件与CTX-1301进行比较。 | |
| ● | 评估每天一次的ADHD真正治疗的重要性。 | |
| ● | 评估 滥用和/或转移短效强化剂量的发生率。 | |
| ● | 为需要ADHD治疗的患者评估 重要的独特之处,方法是提供完整的解决方案,具有完整的有效日疗效、快速起效、避免崩溃/反弹以及消除所需的短效兴奋剂助推剂/恢复剂量。 |
这些 探索性措施不仅将为临床医生提供关键信息,还将为付款人和市场准入团队提供重要数据。
根据从FDA收到的有关我们的CTX-1301临床计划的指导,我们停止了这两项研究的登记。 所有参加这些研究的患者都可以完成研究,并将相应地报告数据。此外,根据这一指南,我们预计将在2025年上半年根据第505(B)(2)条路径提交CTX-1301的保密协议,以福卡林®XR作为上市药物的参考 ,使用FDA备案的疗效和安全性数据作为批准的基础,以及我们的CTX-1301临床计划的生物利用度/生物等效性 数据和有效性/安全性数据。如果我们获得FDA对CTX-1301的批准,我们可能会进行4期试验。
CTX-1302: 右旋苯丙胺治疗6岁及以上ADHD
我们 相信我们的候选药物CTX-1302将成为治疗ADHD的第一个真正的每日一次的右旋苯丙胺片,在30分钟内起效,并在整个活动日内有效。CTX-1302是一种三模缓释片,基于片内片剂技术,可在准确的释放时间、比例和释放方式下提供三种释放的右旋苯丙胺。我们的CTX-1302版本 简介如下:
| ● | 释放#1:提供每日总剂量45%的初始立即释放剂量在给药后5至6分钟内开始 旨在30分钟内达到治疗效果;以及 | |
| ● | 释放#2:给药三小时后,DR1提供超过90分钟的每日释放总量的35%; | |
| ● | 释放#3:在给药7小时后,内置助推器提供约30分钟内释放的每日总剂量的20%。 |
我们 预计CTX-1302片剂将提供八种剂量强度,从6.25毫克到50毫克的右旋苯丙胺。所有辅料 都是药典和/或非新药,已被广泛用于口服制剂,并且在药物产品中的含量远低于FDA IID中列出的最大效价。
我们的CTX-1302临床开发计划
我们建议的CTX-1302临床方案包括1/2期临床药理学研究和3期临床疗效和安全性 试验。我们计划在2025年启动CTX-1302在ADHD患者中的1/2期生物利用度研究,如果这项研究的结果 成功,随后将在2025年底或2026年初启动关键的3期临床试验,即品牌实现试验;所有 都取决于资本资源。我们的1/2期试验预计将包括大约100名患者,而第三阶段临床计划将包括大约500名患者。
| 75 |
我们的 计划第一阶段试验
我们提议的1期CTX-1302临床药理学研究包括:
| ● | 第1/2期比较生物利用度研究:评价和比较CTX-1302与RLD、Dexedine在成人ADHD(18+y/o)患者中的药代动力学特征。 | |
| ● | 阶段 1食物效应研究:评价CTX-1302在成人(18+y/o)进食和禁食条件下的药动学特征。 | |
| ● | 第1期单剂、完全重复交叉研究:为了评估CTX-1302在成人(18+y/o)中对RLD,Dexedine Spansule的体内药代动力学曲线的受试者内变异性。 |
计划的 第三阶段完成试验
| ● | A阶段3,固定剂量,平行设计,安慰剂对照,为期5周的儿童和青少年患者研究(6-17y/o)。主要的疗效终点是ADHD-RS-5。临床全球改善严重程度量表(CGI-S)将作为次要终点进行评估。 | |
| ● | 第3阶段,成人模拟工作场所疗效和安全性研究(18+):主要的疗效终点是PERMP。起效时间和效果持续时间也将被评估为关键的次要终点。 | |
| ● | 一项长期的剂量优化安全性研究将评估儿科人群(6-17岁/岁)的安全性,为期六个月。本研究 将收集和监测研究期间发生的任何不良事件。 |
重要信息:模拟第三阶段协议中包含的探索性终端将定义和评估CTX-1302优化治疗相对于使用类似于CTX-1301第三阶段计划中的PRO的先前治疗的独特优势和满意度。
我们 预计CTX-1302的505(B)(2)保密协议将使用Dexedine®Spansule®作为参考药物,将该药物的有效性和安全性数据与我们的CTX-1302临床计划中的生物利用度/生物等效性数据和有效性/安全性数据一起作为批准的基础。
如果CTX-1302需要完整的第三阶段安全性和有效性研究包,我们可以预期类似的诊断工具和包括ADHD-RS-5、CGI-S和PERMP在内的ADHD评估将被纳入CTX-1301。然而,基于我们目前对CTX-1301临床计划的了解,我们可能会再次与FDA联系,寻求他们对CTX-1302的替代、更省时、更有效的方法的指导。
CTX-2103:治疗焦虑相关障碍的候选丁螺环酮产品
我们已经启动了一项计划 开发用于治疗焦虑的CTX-2103(丁螺环酮),这是美国最常见的精神健康问题 我们相信CTX-2103有可能成为丁螺环酮的第一个每日一次的配方,丁螺环酮是焦虑市场上最广泛的处方药物之一 。CTX-2103是一种新型缓释片,它含有有效的药物成分盐酸丁螺环酮,是一种非苯二氮类药物,没有证据表明其会发生依赖或存在依赖风险。然而,由于丁螺环酮的半衰期很短,处方中规定每天服用几次丁螺环酮来控制焦虑,这对患者来说可能是一种挑战,并可能导致 次优治疗结果。CTX-2103将被设计为一天一次的多剂量片剂,我们相信它将提供明显的差异化 和与目前可用的治疗方案相比的引人注目的优势。
| 76 |
我们的CTX-2103临床开发计划
2022年6月,我们完成了CTX-2103的人体配方研究。CTX-2103的第一项人体受试者研究是一项单中心、开放标签、四臂交叉研究,涉及10名健康受试者。每位参与者在不同的评估访问中接受了四种不同剂量的丁螺环酮 :一个延迟4小时后的定时释放10 mg片剂,一个延迟8小时的定时释放10 mg片剂 ,一个三脉冲10 mg片剂在0、4和8小时释放药物,以及一个普通丁螺环酮10 mg片剂(参考产品,这是一种商业配方)。
主要目的是评估延时制剂中丁螺环酮的吸收和代谢产物1-嘧啶基哌嗪(1-PP)在血浆中的存在,并将其与闪烁时间和释放数据相关联。该研究的次要目标将比较延时丁螺环酮产品与市售制剂的药代动力学性能。此外,该研究还将评估丁螺环酮的吸收情况以及三次释放产品在血浆中代谢产物1-PP的存在情况。
安全性 评估表明CTX-2103是安全的,耐受性良好。在这项研究中,没有发生严重的、严重的或有临床意义的治疗紧急不良事件(“TEAE”)。大多数TEAE的严重程度较轻,与丁螺环酮的预期事件一致。对TEAE、实验室检查、体检、心电记录和生命体征(血压和脉率)的评估显示丁螺环酮没有安全性问题。
根据处方研究数据中看到的药代动力学曲线,CTX-2103实现了盐酸丁螺环酮的三次释放。这项人体配方研究的阳性结果 为我们要求与FDA召开IND前会议讨论我们的CTX-2103临床和监管计划的设计提供了所需的关键信息。IND前会议在2023年第四季度 举行。我们从FDA收到了关于CTX-2103的调控途径的意见,以及临床研究的设计,以提交研究新药(“IND”)。根据FDA的反馈,CTX-2103可能能够在505(B)(2)途径下寻求并获得批准,这通常比505(B)(1)全NDA途径需要更少的时间和资源。
商业化
鉴于我们所处的发展阶段,我们目前没有任何内部销售、营销或分销基础设施或能力。如果CTX-1301和/或CTX-1302获得批准,我们计划将我们的候选产品在美国商业化,我们预计 将成为我们获得市场授权的第一个国家/地区。我们需要一个商业协作合作伙伴来受益于他们的 能力,为我们提供更直接的营销、销售、市场准入和分销基础设施,使我们能够与大多数ADHD药物的大批量神经学和精神病学处方者以及高处方ADHD儿科医生和家庭医生进行 交流。
此外,我们预计将使用多渠道策略,包括非个人策略,以适当的频率接触医生、付款人、患者和患者护理人员,以帮助推动行为。除了个人推广外,我们还打算通过医学教育、直接营销、期刊广告和电子健康记录交流来接触医生。倡导团体、患者和照顾者在ADHD领域非常活跃和直言不讳。我们预计,直接面向患者的策略将使我们能够通过有针对性的教育和广告,以及通过使用适当的社交媒体倾听和参与来接触 这一社会群体 以告知这些患者和照顾者。
2023年3月,我们与Indegene签订了商业化协议 。如果我们获得FDA对CTX-1301的批准,Indegene将根据工作说明书为CTX-1301提供商业化 服务,其中包括Indegene将执行的服务、此类服务的交付内容以及我们将支付的费用。Indegene预计将提供的主要服务包括:(A)医疗事务和药物警戒;(B)定价、报销和市场准入;(C)商业运营;以及(D)营销(包括现场力量)。见“材料协议--与Indegene,Inc.的联合商业化协议”。下面。Cingate还在考虑建立战略制药合作伙伴关系,根据该合作伙伴关系,Cingate将在美国、美国以外或两者兼而有之地共同推广或获得CTX-1301的许可。Cingate正在所有方面寻找机会,我们 已与著名的业务发展公司全球制药合作伙伴(GPP)建立了合作伙伴关系。他们正在积极 寻找可行的许可合作伙伴。
| 77 |
制造业
概述
我们 目前不拥有或运营制造工厂。此前,我们使用制药制造研究服务公司 作为我们的CDMO,用于生产用于临床前研究和临床试验的产品。2022年10月,我们保留了社会CDMO,Inc.(“社会”)作为我们的新CDMO,它将生产我们的主要候选CTX-1301的所有临床、注册和商业批次。Social将在其位于佐治亚州盖恩斯维尔的工厂内专门制造一套设备,并为其配备我们拥有的专有设备。
在我们的临床试验中使用的任何第三方制造商、设施以及所有批次的药品和药品都必须 符合cGMP。CGMP规定包括与人员、建筑物和设施的组织、设备、组件和药品容器和封闭的控制、生产和过程控制、包装和标签控制、持有和分配、实验室控制、记录和报告以及退回或回收的产品有关的要求。生产我们产品的制造设施必须满足cGMP要求和FDA的满意,才能批准任何产品,我们才能生产商业产品 。任何第三方制造商还将接受FDA和其他机构对设施的定期检查,包括测试和生产我们产品时使用的程序和操作,以评估我们是否符合适用的法规。此外,我们的药品被归类为II类受控物质,要求任何未来的第三方制造商都必须 获得DEA的批准和监管。
药物 物质
我们目前从美国的第三方制造商购买CTX-1301(醋酸二甲酯)、CTX-1302(右旋苯丙胺)和CTX-2103中使用的原料药 以及辅料。我们预计未来将与其中许多制造商签订商业供应协议。 CTX-1301和CTX-1302的原料药均受美国联邦法律管制。DEA将醋酸二甲酯和右旋苯丙胺归类为附表II管制物质。与所有刺激性药物一样,存在滥用的可能性。因此, 我们候选产品的采购、制造、运输、分配和储存将受到监管, 本招股说明书中其他部分的“DEA法规”部分对此进行了更详细的描述。CTX-2103(丁螺环酮)的原料药 不是预定的受控物质,因此不适用额外的DEA规定。
知识产权
专有 保护
我们的商业成功在一定程度上取决于我们是否有能力为我们的候选药物获得和维护专利保护、制造和处理发现和其他技术,在不侵犯他人专有权的情况下运营,并防止 其他人侵犯我们的专有权。我们一直在构建并继续构建与我们的ADHD候选药物相关的知识产权组合,以及我们创新的专有PTR药物传递平台技术和我们的技术平台。我们的政策是 寻求通过提交与我们的专有技术、发明和改进有关的美国和某些外国专利申请来保护我们的专有地位,这些专利申请对我们的业务发展和实施非常重要。 我们还打算依靠商业秘密、技术诀窍、持续的技术创新和潜在的许可内机会来发展 并保持我们的专有地位。我们不能确定是否会就我们的任何未决专利申请或我们未来提交的任何专利申请授予专利,也不能确保我们的任何现有专利或未来可能授予我们的任何专利 将在保护我们的技术方面具有商业用途。
| 78 |
专利 权利
我们拥有或已经从BDD Pharma(定义如下)获得许可,在美国拥有6项专利和2项专利申请,在国外和地区拥有92项专利和17项专利申请。除美国外,我们还在澳大利亚、巴西、加拿大、中国、埃及、欧洲(向欧洲专利局提交了未决申请,并与欧洲专利组织的某些成员国进行了专利验证)、香港、以色列、印度、日本、墨西哥、俄罗斯、沙特阿拉伯和韩国 。专利和专利申请描述并声称我们的候选产品、我们的PTR药物传递平台和我们的EBL的某些特性,包括对候选产品的声明、制造候选产品的方法以及使用 候选产品的治疗方法。
我们 一直并将继续积极保护我们的知识产权,包括为我们的创新提交专利申请,起诉我们未决的专利申请,以及维护和执行我们已颁发的专利。不能保证待处理的专利申请 将导致专利颁发,或者审查过程不会要求我们缩小索赔范围。此外,已颁发的专利可能会被第三方规避,或者在法院或行政机构提出异议时被发现不可执行或无效。 因此,我们可能无法成功地针对第三方执行我们的专利权。不能保证其他公司不会围绕可能授予我们的任何专利独立开发类似或竞争的技术或设计。
专利寿命的确定取决于申请的提交日期和专利法颁布的其他因素,如专利期限的调整和延长。在包括美国在内的大多数国家/地区,专利期一般为自适用国家/地区非临时专利申请的最早提交日期起计20年。我们拥有或许可的专利和专利申请 的有效期从2031年到2036年。
我们拥有和授权的专利和专利申请摘要如下。
| 家庭/PCT 应用 | “标题”/(专利保护类型 ) | 申请人/业主 | 待定 应用 | 已发布 专利 | 专利 届满 | |||||
| WO2011107750 | “延迟 延长的药物递送”(用于活性剂的延迟释放,随后延长释放的压制包衣片剂制剂) | 药物 国际快递有限公司 | 德国, 大不列颠, 法国, 日本、 瑞士, 美国 |
3月 2031 | ||||||
| WO2011107749 | “脉动 “药物释放”(用于活性剂的延迟释放,然后脉冲释放的压制包衣片剂制剂) | 药物 国际快递有限公司 | 奥地利, 比利时、 保加利亚, 捷克共和国, 丹麦, 芬兰、 法国, 德国、 很好 英国,希腊, 匈牙利, 爱尔兰、 意大利、日本、 荷兰、挪威、 波兰、葡萄牙、 罗马尼亚、斯洛伐克、 斯洛文尼亚、西班牙、 瑞典、瑞士、 土耳其, 美国 |
3月 2031 | ||||||
| WO2011107755 | “立即 延迟释放”(一种用于延迟释放的压片配方,然后脉冲释放活性物质) | 药物 国际快递有限公司 | 奥地利, 比利时、 保加利亚, 捷克共和国, 丹麦, 芬兰、 法国, 德国、 很好 英国,希腊, 匈牙利, 爱尔兰、 意大利、日本、 荷兰、挪威、 波兰、葡萄牙、 罗马尼亚、斯洛伐克、 斯洛文尼亚、西班牙、 瑞典、瑞士、 土耳其, 美国 |
3月 2031 | ||||||
| WO2016075496 | “制药 加工”(一种制造控释材料的方法) | 药品国际递送有限公司 | 欧洲 | 美国 美国 | 2035年11月 |
| 79 |
| 家庭/PCT 应用 | “标题”/(专利保护类型 ) | 申请人/业主 | 待定 应用 | 已发布 专利 | 专利 届满 | |||||
| WO2016075495 | “组合物” (用于有效成分延迟释放的压片) | 药品国际递送有限公司 | 埃及 |
澳大利亚、奥地利、 比利时,巴西,保加利亚, 加拿大、捷克共和国、丹麦、 芬兰、法国、 德国,英国, 希腊、香港 匈牙利,印度,爱尔兰, 意大利、日本 墨西哥,荷兰, 挪威、波兰、 葡萄牙,罗马尼亚, 俄罗斯、沙特阿拉伯 斯洛伐克、斯洛文尼亚; 韩国、西班牙、瑞典、 瑞士、土耳其、 美国 |
2035年11月 | |||||
| WO2016075497 | “片剂” (由蜡、崩解剂和治疗剂组成的缓释片) | 药品国际递送有限公司 | 欧洲 | 美国 美国 | 2035年11月 | |||||
| WO2016138440 | “TriPulse 释放兴奋剂配方” | 扣带治疗有限责任公司 |
中国,欧洲, 香港、印度、 日本, 韩国、美国 |
澳大利亚、 加拿大 以色列 |
2036年2月 (发布时) | |||||
| WO2022/240849 | 三模, 精确定时脉冲释放片 | 扣带治疗有限责任公司 | 澳大利亚、巴西、加拿大、中国、欧洲、以色列、印度、韩国、墨西哥、美国 | 2042年5月(发布时) | ||||||
| WO2023/158694 | 三模, 精确定时释放片剂 | 扣带治疗有限责任公司 | 国际百分比 | 2043年2月(发布时) |
交易机密和其他保护
除了专利知识产权之外,我们还依靠商业秘密和专有技术来保护我们的技术和保持我们的竞争地位,尤其是当我们不相信专利保护是适当的或可以获得的时候。我们的政策是: 要求我们的每位员工、顾问和顾问在开始与我们建立雇佣、咨询或咨询关系之前签署保密和发明转让协议。协议一般规定,个人必须保密,除非在有限的情况下,否则不得向其他各方披露个人在与我们的关系过程中开发或了解到的任何机密信息。这些协议一般还规定,我们将拥有个人在向我们提供服务的过程中构思的所有发明。
其他 知识产权
我们 在适当的时候在美国寻求商标保护。我们已为我们在药物研发和产品中使用的扣带、扣带 治疗商标和商标申请商标保护,以及可能与我们的潜在产品一起使用的商品名称。我们目前在美国拥有Cingate、Cingate Treeutics、CTX和MASTHY以及我们的PTR技术的注册商标。
我们可能会不时发现从第三方知识产权持有者那里获得许可是必要的或谨慎的。
| 80 |
竞争
我们的行业以先进的技术、激烈的竞争和对专有产品的高度重视为例证。我们可能面临来自制药公司和仿制药公司的竞争,因为有几种短效和缓释品牌产品 具有各种配方,其中一些非常创新,以及这些产品的仿制药版本尚未满足医疗 需求。我们相信,影响我们候选产品开发和商业成功的关键竞争因素包括: 口服给药、包括即刻起效和整个有效日持续时间在内的治疗效果、安全性和耐受性、 市场准入和定价。一些竞争对手比我们拥有更多的财力、技术和人力资源;然而,我们认为品牌竞争的水平正在下降,并将随着Vyvanse独家经营权的丧失而继续下降。此外,我们的潜在竞争对手在获得FDA和外国监管机构的营销批准方面也可能拥有更多的经验和专业知识。除了产品开发、测试、审批和推广之外,制药行业的其他竞争因素还包括整合、产品质量和价格、产品技术、声誉、客户服务和技术信息的获取。 因此,我们的潜在竞争对手可能能够开发出竞争对手或更优秀的产品,进行更积极的竞争,并在比我们更长的时间内保持其竞争优势。面对竞争,我们的产品可能会过时或缺乏经济效益 。
如果获得批准,CTX-1301和CTX-1302都将与目前市场上销售的、品牌的和非专利的哌醋甲酯和苯丙胺产品 竞争治疗ADHD。其中一些目前可用的产品包括Janssen的Concerta、诺华的Focalin XR和武田的Adderall XR和Vyvanse,这些产品都已经失去了独家经营权。
近年来,ADHD市场出现了许多创新但专注于利基市场的ADHD产品,这些产品没有占据以前口服兴奋剂,特别是缓释口服兴奋剂的市场份额。我们意识到,我们面临着来自专注于ADHD的小型生物技术公司的竞争,这些公司的利基产品包括Aytu、Tris、Clom、Ironshore和Rhodes。然而,我们并不认为这些公司中的大多数是重要的竞争对手,因为它们的产品仅能够占据整个市场的一小部分 ,并且没有投入大量的商业努力;而我们相信我们的候选产品具有克服大多数ADHD患者长期未得到满足的需求的潜力。此外,Cingate与潜在的商业化或战略合作伙伴 计划利用适当的资源成功地将其资产商业化。
FDA最近发布了关于非专利缓释片哌醋甲酯生物等效性试验的修订指南。这一新的指南使新的仿制药更难证明与参考产品的生物等效性。我们认为,这将限制哌醋甲酯市场上的仿制药竞争。对于仿制药来说,可能很难显示出与CTX-1301等具有完整有效日有效期的新品牌、缓释哌醋地塞米松 药物的生物等效性。
政府 法规
美国联邦、州和地方各级以及其他国家的政府当局对药品的研究、开发、测试、制造、质量控制、批准、标签、包装、储存、记录保存、促销、广告、分销、批准后的监督和报告、营销和进出口等方面进行监管。通常,在新药 可以上市之前,必须获得大量证明其质量、安全性和有效性的数据,组织成针对每个监管机构的特定格式 ,提交审查并最终获得适用监管机构的批准。
美国 药物开发
In the United States, the FDA regulates drugs under the FDCA and its implementing regulations. Drugs are also subject to other federal, state, and local statutes and regulations. The process of obtaining regulatory approval and maintaining subsequent compliance with applicable federal, state and local statutes and regulations requires the expenditure of substantial time, personnel, and financial resources. These agencies and other federal, state and local entities regulate research and development activities and the testing, manufacture, quality control, labeling, storage, packaging, recordkeeping, tracking, approval, import, export, distribution, advertising and promotion of pharmaceutical products. Failure to comply with the applicable United States regulatory requirements at any time during product development, the approval process, or after approval may subject an applicant to administrative or judicial sanctions. These sanctions could include, among other actions, the FDA’s refusal to approve pending applications, withdrawal of an approval, a clinical hold, untitled or warning letters, voluntary product recalls or market withdrawals, product seizures, total or partial suspension of production or distribution injunctions, fines, consent decrees, refusals of government contracts, restitution, disgorgement, or civil and criminal penalties. Any agency or judicial enforcement action could have a material adverse effect on us.
| 81 |
药品 候选产品必须通过NDA流程获得FDA批准,然后才能在美国合法上市和销售。 Cingulate打算根据505(b)(2)监管批准途径提交我们的NDA。药物的开发和批准通常涉及 以下内容:
| ● | 根据良好实验室规范(“GLP”)或其他适用法规完成临床前实验室测试、动物研究和配方研究。 | |
| ● | 向FDA提交IND,它必须在涉及人类的临床试验开始之前生效。 |
| ● | 在每个临床试验地点启动试验之前,得到每个临床试验地点的独立机构审查委员会(“IRB”)或伦理委员会的批准。 | |
●
● |
根据适用的IND法规进行充分且受控良好的人体临床试验, 其他良好临床实践(“GCP”)和其他与临床试验相关的规定,以评估针对每个建议的适应症的研究产品的安全性和有效性。
汇编证明产品可以正确配方、制造和储存的信息; |
| ● | 向FDA提交保密协议以获得上市批准,包括支付应用程序使用费; |
| ● | 令人满意的 完成FDA对生产药物的一个或多个制造设施的批准前检查,以评估 是否符合cGMP,并确保设施、方法和控制足以保持药物的特性、强度、质量和纯度; | |
| ● | FDA可能对临床试验地点进行审计,以确保符合GCP,并确保在NDA支持中提交的临床数据的完整性;以及 | |
| ● | FDA 审查和批准NDA,包括在适当或适用的情况下,在产品在美国进行任何商业营销或销售之前,满意地完成FDA顾问委员会对候选产品的审查。 |
临床前研究
在人体上测试任何候选药物之前,必须经过严格的临床前测试。临床前开发阶段通常包括药物化学、制剂和稳定性的实验室评估,以及对动物的毒性评估研究,这些研究支持后续的临床试验。赞助商必须将临床前研究的结果与生产信息、分析数据、任何可用的临床数据或文献以及拟议的临床方案一起作为IND的一部分提交给FDA。IND是FDA授权给人类使用研究产品的请求,必须在人类临床试验开始之前生效。
临床前研究包括对候选产品化学和配方的实验室评估,以及体外和动物研究,以评估不良事件的可能性,并在某些情况下建立治疗使用的理论基础。临床前研究的进行受联邦法规和要求的约束,包括GLP关于安全性和毒理学研究的规定。一些长期的临床前测试,如生殖不良事件和致癌性的动物测试,可能会在研究药物的IND提交给FDA并启动人体临床试验后继续进行。
在测试数据支持505(B)(2)NDA的情况下,部分或全部必要的临床前数据可能会在文献或FDA之前关于RLD安全性和有效性的发现中被引用。
| 82 |
临床试验
所有临床试验必须在合格研究人员的监督下进行。临床试验是根据详细说明研究目标、用于监测要评估的安全性和有效性标准的参数的方案进行的。每项协议都必须作为IND的一部分提交给FDA。研究对象在参与临床试验前必须签署知情同意书。对向公共注册机构报告正在进行的临床试验和临床试验结果也有要求。 IND在FDA收到后30天自动生效,除非在此之前FDA对一项或多项拟议的临床试验提出担忧或问题,并将临床试验搁置。在这种情况下,IND赞助商和FDA必须在临床试验开始之前解决任何悬而未决的问题。因此,提交IND可能不会导致FDA允许临床试验开始。出于安全考虑或不符合要求,FDA还可以在研究之前或研究期间的任何时间强制实施临床搁置。
此外,代表参与临床试验的每个机构的IRB必须在临床试验在该机构开始之前审查和批准任何临床试验的计划,此后IRB必须至少每年进行持续审查和重新批准试验。IRB必须审查和批准提供给临床试验受试者的试验方案和知情同意信息等。IRB的运作必须符合FDA的规定。有关某些临床试验的信息,包括方案的细节和最终的研究结果,也必须在特定的时间框架内提交给美国国立卫生研究院,以便在ClinicalTrials.gov数据注册表上公开传播。作为临床试验注册的一部分,将公开与产品、患者群体、调查阶段、研究地点和研究人员以及临床试验的其他方面相关的信息。赞助商也有义务在完成后披露其临床试验的结果。在某些情况下,这些试验结果的披露可推迟至试验完成之日后长达两年。未能及时 按照法律规定注册所涵盖的临床研究或提交研究结果可能会导致民事罚款,并且 还会阻止不合规方获得联邦政府未来的拨款。美国国立卫生研究院(NIH)关于ClinicalTrials.gov注册和报告要求的最终规则于2017年生效,NIH和FDA都表示,政府愿意开始对不符合要求的临床试验赞助商执行这些要求。
为支持NDA而进行的临床试验通常分三个连续阶段进行,这些阶段可能会重叠,也可能会合并。
| ● | 阶段1-临床试验通常涉及数量相对较少的健康志愿者,他们最初接触单剂或多剂候选产品。这些临床试验的主要目的是评估安全性、剂量耐受性、构效关系、作用机制、吸收、代谢、分布和排泄。适用于候选产品或特定患者群体的通用格式更改可能会发生,但通常会事先征得FDA的同意。 | |
| ● | 第2阶段-临床试验通常涉及在有限的患者群体中进行研究,以确定可能的不良反应和安全风险, 初步评估该产品对特定目标疾病的疗效,并确定剂量耐受性和最佳剂量。 | |
| ● | 第三阶段-在更大的受试者群体中进行临床试验,以进一步评估扩大的患者群体中的剂量、临床疗效和安全性,通常是在地理上分散的临床研究地点。这些研究旨在确定候选产品的总体风险-收益比率,并在适当的情况下为产品标签提供充分的基础。这些试验可能包括与安慰剂和/或其他对照治疗的比较。治疗期限通常会延长,以模拟产品在营销过程中的实际使用情况。这些试验可以在全球进行,以支持全球注册,只要全球站点也具有美国人口的代表性,并且在全球站点进行的研究符合FDA的法规和指南,例如遵守GCP。 |
| 83 |
通过 遵循505(B)(2)监管审批路径,申请人可以通过依赖不是由申请人进行且申请人没有获得参考权的调查来减轻药物开发的一些负担,例如涉及RLD的先前调查。在这种情况下,一些临床试验可能不是必需的,或者可能受到限制;但是,通常需要确定候选产品的生物利用度和药代动力学特征的第一阶段试验和至少一项第三阶段关键试验以支持 505(B)(2)保密协议。
审批后 试验,有时称为阶段4,可在初始营销审批后进行。这些试验用于从预期治疗适应症患者的治疗中获得额外的 经验。在某些情况下,FDA可能会强制要求将4期临床试验的性能作为批准NDA的条件。
在新药产品的开发期间,赞助商有机会在某些时候与FDA会面,包括在提交IND之前、在第二阶段结束时以及在提交NDA之前。这些会议可以为赞助商提供机会,让赞助商共享有关迄今收集的数据的信息,让FDA提供建议,并让赞助商和FDA就下一阶段的开发达成一致。赞助商通常在启动3期临床试验之前与该机构会面,提出他们的关键试验计划,他们认为这将支持新药产品的批准。
在临床试验的同时,公司通常完成额外的动物研究,还必须开发有关药物产品物理特性的额外信息,并根据cGMP要求最终确定商业批量生产产品的工艺。制造过程必须能够始终如一地生产高质量的候选产品批次,此外,制造商还必须开发测试最终药物产品的特性、强度、质量和纯度的方法。 此外,必须选择和测试适当的包装,并且必须进行稳定性研究,以证明候选产品在保质期内不会发生不可接受的变质。
NDA和FDA审查流程
假设 成功完成所需的临床测试,临床前研究和临床试验的结果以及产品的化学、制造和控制的详细说明、建议的标签和其他相关信息将作为请求批准该产品上市的保密协议的一部分提交给FDA。准备和提交保密协议的成本是巨大的。根据联邦法律,大多数NDA的提交还需要缴纳高额的申请使用费,目前包含临床信息的NDA的使用费超过324万美元,而已批准的NDA下的制造商和/或赞助商也需要缴纳计划年费 ,目前约为394,000美元。这些费用通常每年都会增加。在某些情况下可以减免费用 。一种此类费用减免适用于小型企业的申请者,这意味着申请者(包括任何附属公司) 雇员少于500人,对于已经引入或交付以引入州际商业的产品没有获得批准的营销申请 ,并且正在提交其第一个营销申请。
《FDCA》第505(B)(1)节和第505(B)(2)节是关于可根据FDCA提交的国家发展援助的类型的规定。第505(B)(1)节是当没有其他新药含有相同的有效药物成分或活性部分,即负责药物物质作用的分子或离子尚未获得FDA批准时,新化学实体的传统途径。作为FDA批准以前批准的产品的新配方或改进配方的替代途径,公司可以提交505(B)(2)条 保密协议。第505(B)(2)条允许提交保密协议,如果批准所需的至少部分信息来自并非由申请人或为申请人进行的研究,并且申请人没有获得参考权。
一旦FDA收到申请,在接受备案申请之前,它有60天的时间审查保密协议,以确定其是否基本上完成了允许进行实质性审查,并可能要求提供更多信息,而不是接受申请。一旦提交的申请被接受,FDA就会开始对保密协议进行深入审查。根据FDA根据《处方药使用费法案》(PDUFA)VI商定的目标和政策,FDA寻求在申请受理之日起 10个月内审查标准审查药物产品的申请,并在申请受理日起6个月内审查优先审查药物的申请。 FDA可向旨在治疗严重疾病的药物授予优先审查指定,并且该机构确定 在治疗方面取得重大进展,或在没有适当治疗的情况下提供治疗。FDA并不总是达到标准和优先NDA的PDUFA目标日期 ,FDA可能会将标准和优先审查的审查过程再延长三个月 ,以考虑额外的延迟提交的信息,或旨在澄清已在针对FDA审查问题的提交中提供的信息的信息 。
| 84 |
在 批准NDA之前,FDA通常会对候选产品的生产设施进行批准前检查 ,以确定它们是否符合cGMP,除非该设施最近接受了FDA检查。FDA将不会批准该产品 ,除非其确定生产工艺和设施符合cGMP要求,并足以确保 产品生产符合质量标准。此外,FDA可能会将存在安全性或有效性难题的新型药品或药品 的申请提交给咨询委员会(通常是包括临床医生 和其他专家的小组),以进行审查、评估并就是否应批准该申请以及在何种条件下批准该申请提出建议。FDA不受咨询委员会建议的约束,但在做出决定时会仔细考虑这些建议。 根据第505(b)(2)节提交的NDA通常不会提交给咨询小组进行审议,除非在审查周期中发现新的安全信息 。
作为NDA审查过程的 一部分,FDA可能会重新分析临床试验数据,这可能会导致 FDA和申请人之间的广泛讨论。此外,FDA通常会检查一个或多个临床研究中心,以确保符合GCP和IND方案要求,并确保提交给FDA的临床数据的完整性。FDA对 NDA的审查和评估是一项广泛而耗时的工作,可能需要比原计划更长的时间才能完成,我们可能无法及时获得 批准(如果有的话)。
After the FDA evaluates an NDA, it will issue either an approval letter or a complete response letter (“CRL”). An approval letter authorizes the commercial marketing of the drug with prescribing information for specific indications. A CRL indicates that the review cycle of the application is complete, and that the application will not be approved in its present form. A CRL generally describes the deficiencies in the NDA identified by the FDA and may require substantial additional clinical data or other significant and time-consuming requirements related to clinical trials, nonclinical studies or manufacturing. Additionally, the CRL may include recommended actions that the applicant might take to place the application in a condition for approval. If a CRL is issued, the applicant may either resubmit the NDA, addressing all of the deficiencies identified in the letter, or withdraw the application. If, or when, those deficiencies have been addressed to the FDA’s satisfaction in a resubmission of the NDA, the FDA will issue an approval letter to the applicant. The FDA has committed to reviewing such resubmissions in response to an issued CRL in either two or six months depending on the type of information included. Even with the submission of this additional information, however, the FDA may decide that the NDA does not satisfy the regulatory criteria for approval. Data obtained from clinical trials are not always conclusive, and the FDA may interpret data differently than the sponsor interprets the same data.
不能保证FDA将批准候选产品上市,申办者在审查过程中可能会遇到重大困难或 成本。即使产品获得上市批准,批准也可能明显限于特定的 疾病和剂量,或者使用适应症可能受到限制,这可能会限制产品的商业价值。此外, FDA可能会要求在产品标签中包含某些禁忌症、警告或注意事项,或者它可能会以拟议标签的变更为条件 批准。FDA还可能以制定适当的生产控制和质量标准 以及承诺进行上市后检测和监督以监测潜在影响和疗效为批准条件。 例如,FDA可能要求进行旨在进一步评估药物安全性和有效性的4期试验。
除了批准的标签外, FDA还可以以REMS计划的形式对产品分销、处方或分发施加限制和条件,以帮助确保药物的获益超过其风险。REMS可包括 患者用药指南、医疗保健专业人员沟通计划和/或确保安全使用的要素(“ETASU”)。ETASU可 包括但不限于处方或分发的特殊培训或认证、受限分发要求、 仅在特定情况下分发、特殊监控和患者登记的使用。FDA根据具体情况确定REMS的要求 以及具体的REMS规定。如果FDA认为需要REMS计划,NDA的申办者 必须提交拟议的REMS计划。如果需要,FDA将不会批准未批准REMS的NDA。根据含有与我们的候选产品(右哌甲酯 和苯丙胺)相同原料药的制剂获批标签中包含的必要 警告,我们预计,作为NDA审查和批准过程的一部分,FDA将要求我们的至少一些候选产品 (特别是CTx-1301和CTx-1302)在其标签中包含黑框警告。
| 85 |
上述审批或营销限制中的任何一项都可能限制产品的商业推广、分销、处方或分发 ,从而限制商业成功。如果不符合法规要求,或者在初始营销后出现问题,可能会撤回营销审批。
在 NDA批准后,对已批准产品的某些类型的更改,如增加新的适应症、制造更改和附加标签声明,将受到进一步的测试要求、FDA通知和FDA审查和批准的约束。此外,如果出现新的安全信息,可能需要额外的测试、产品标签或FDA通知。
《哈奇-瓦克斯曼法案》与新药营销排他性
根据1984年《药品价格竞争和专利期限恢复法》,也称为《食品药品监督管理局的哈奇-瓦克斯曼修正案》,国会 授权FDA批准与FDA以前根据《药品价格竞争和专利期限恢复法》法规的保密协议条款批准的药品相同的仿制药,并颁布了《食品药品监督管理局》第505(B)(2)条。要获得仿制药的批准,申请人必须向该机构提交ANDA, 。为支持此类应用,仿制药制造商可依赖对以前根据保密协议(称为RLD)批准的药物产品进行的临床前和临床测试。具体地说,为了使ANDA获得批准,FDA必须发现仿制药在有效成分、给药途径、剂型、 和药物强度方面与RLD相同。相比之下,第505(B)(2)条允许提交保密协议,如果需要批准的信息至少有一些来自不是由申请人进行的或为申请人进行的研究,并且申请人没有获得参照权。 第505(B)(2)条申请人可以消除进行某些临床前或临床研究的必要性,如果它可以确定对先前批准的产品进行的研究的依赖 在科学上是合适的。与生物等效型创新药物的开发商使用的ANDA途径不同,ANDA途径不允许申请者提交除生物利用度或生物等效性数据以外的新临床数据,505(B)(2)监管途径不排除后续申请者需要进行额外的 临床试验或非临床研究的可能性;例如,他们可能正在寻求批准将先前批准的药物用于新的适应症 或用于需要新的临床数据来证明安全性或有效性的新患者群体。然后,FDA可针对RLD已获批准的全部或部分标签适应症,或适用于 第505(B)(2)条申请人寻求的任何新适应症,批准新产品。
在寻求批准NDA或其附录时,NDA赞助商必须向FDA列出涵盖赞助商的产品或批准的产品使用方法的每项专利。在NDA批准后,该药物申请 中列出的每一项专利都将在FDA出版物《已批准的具有治疗等效性评估的药物产品》(通常称为《橙色手册》)中公布。当ANDA申请人向FDA提交申请时,申请人需要向FDA证明RLD橙皮书中列出的任何 专利,但后续申请人未寻求批准的使用方法的专利除外。如果第505(B)(2)条的申请人依赖对已获批准的产品进行的研究,则此类申请人 还需要向FDA证明橙色手册中列出的该获批准产品的任何专利,其程度与ANDA申请人的程度相同。
具体地说, 任何随后提交ANDA或505(B)(2)NDA引用橙皮书中所列药物的申请人必须向FDA证明,对于每项已发表的专利,(I)RLD的原始申请人尚未提交所需的专利信息;(Ii)所列专利已过期;(Iii)所列专利未过期,但将在指定日期过期,并且在专利过期后寻求批准;或者(四)所列专利无效、不可强制执行或者不会因新产品的制造、使用或销售而受到侵犯。这些认证分别称为第I、II、III和IV段认证。
| 86 |
如果提交了第一段或第二段认证,FDA可在完成审查后立即批准申请。如果提交了第三款证明,批准可以在申请中指定的专利到期日生效,但暂定批准可以在该日期之前发布。如果申请包含第四款认证,将触发一系列事件,其结果将决定ANDA或505(B)(2)申请的批准生效日期。
新产品不会侵犯RLD列出的专利或此类专利无效的认证称为第(Br)段IV认证。如果后续申请人已向FDA提供了第四段认证,则在FDA接受申请人的NDA备案后,申请人还必须将第四段认证的通知 发送给NDA和RLD的专利持有人。然后,NDA和专利持有人可以对第四款认证发起法律挑战。在收到第四款认证后45天内提起专利侵权诉讼,将自动阻止FDA批准ANDA或505(B)(2)NDA,直到收到第四款通知、专利到期或侵权案件中对ANDA或505(B)(2)申请人有利的裁决后30个月。或者,如果所列专利持有人没有在要求的45天期限内提起专利侵权诉讼,后续申请人的ANDA或505(B)(2)NDA将不受 30个月缓期的限制。
此外,根据Hatch-Waxman修正案,FDA可能不会批准ANDA或505(B)(2)NDA,直到引用的RLD的任何适用的非专利专有期到期。FDCA下的这些市场排他性条款还可能推迟某些申请的提交或批准。FDCA为第一个获得含有新化学物质的药物的NDA批准的申请人提供了五年的美国境内非专利营销排他性。如果FDA 以前没有批准任何其他包含相同活性部分的新药,则药物是一种新的化学实体,该活性部分是负责该药物物质的作用的分子或离子。在排他期内,FDA可能不接受另一家公司为该药物的另一版本提交的ANDA或505(B)(2)NDA,如果申请人不拥有或拥有合法的参考权利以获得批准所需的所有数据 。然而,如果申请包含专利无效或不侵权的证明,则可以在四年后提交。
如果FDA认为申请人进行或赞助的新的临床研究(生物利用度研究除外)对于批准申请 至关重要,则FDCA还为NDA、505(B)(2)NDA或现有NDA的补充提供三年的市场排他性,例如现有药物的新适应症、剂量或强度。这项为期三年的专营权仅涵盖与新的临床研究相关的使用条件,并不禁止FDA批准含有原始活性成分的药物的后续申请 。五年和三年的排他性也不会推迟提交或批准根据FDCA第505(B)(1)条提交的传统保密协议。然而,提交传统保密协议的申请者将被要求 进行或获得参照权,以证明安全性和有效性所需的所有临床前研究和充分且受控的临床试验。
专利延期
在国家药品监督管理局批准后,相关药物专利的所有者可以申请最长五年的专利期延长。允许的专利期限延长 计算为药物测试阶段的一半-IND生效和NDA提交之间的时间- 和所有审查阶段-NDA提交和批准之间的时间,最长为五年。如果FDA确定申请人没有经过尽职调查寻求批准,则可以缩短时间 。展期后的总专利期不得超过 14年。对于在申请阶段可能到期的专利,专利权人可以请求临时专利延期。临时专利延期可将专利期限延长一年,最多可续订四次。每授予一项临时专利展期,批准后专利展期将减少一年。专利商标局(专利商标局)的董事必须确定 申请专利延期的专利所涵盖的药物很可能获得批准。对于尚未提交保密协议的药物,临时专利延期不可用。
| 87 |
儿科 临床试验和排他性
根据《儿科研究公平法》(“PREA”),NDA或某些类型的NDA补充剂必须包含数据,以 评估该药物在所有相关儿科亚群中声称的适应症的安全性和有效性,并支持该产品安全有效的每个儿科亚群的剂量和给药。FDA可能会批准推迟提交儿科数据,或给予全部或部分豁免。
为了满足PREA的要求,需要研究的适当年龄范围可能有所不同,具体取决于药物或生物制品的药理作用、疾病在不同年龄组中的表现以及衡量治疗反应的能力。PREA要求收集儿科评估,“使用需要评估的每个年龄组的适当配方”(该法第505B(A)(2)(A)节)。根据PREA,申请人必须提交申请批准其儿科研究中使用的儿科配方 ,如果不提交此类请求,可能会导致产品品牌错误(该法第505B(D)节)。 FDA将“请求批准儿科配方”一语解释为,申请人必须提交用于进行儿科研究的任何未经批准的配方(S)的申请 或补充申请。
2012年7月9日签署成为法律的《食品和药物管理局安全与创新法案》对FDCA进行了修订,要求计划提交新活性成分、新适应症、新剂型、新给药方案或新给药途径的NDA的 赞助商在第二阶段会议结束后60天内提交初步儿科研究计划(IPSP),如果没有此类会议,则在第三阶段或第二/3阶段试验开始之前尽早提交初步儿科研究计划。初始PSP必须包括 赞助商计划进行的儿科试验(S)的概要,包括目标和设计、年龄段、相关终点和统计方法,或不包括此类信息的理由,以及任何推迟儿科评估的请求 或全部或部分免除提供儿科试验数据的要求以及支持信息。FDA和赞助商必须就PSP达成协议,但如果需要根据从非临床研究、早期临床试验和其他临床开发计划收集的数据考虑儿科计划的变化,赞助商可以随时提交对商定的初始PSP的修正案。我们已经提交了我们的IPSP,它被接受了。我们继续与FDA就我们的PREA义务进行讨论。
《儿童最佳药品法》规定,如果满足某些条件,包括满足与FDA达成的儿科书面请求的儿科试验(S),则NDA持有者可以将该药物的任何独家专利或非专利 延长六个月。 儿科独家试验的条件包括FDA确定与在儿科人群中使用新药有关的信息可能对该人群的健康产生益处,FDA提出儿科临床试验的书面请求,以及申请人同意在法定时间内进行并报告所请求的临床试验。如果NDA赞助商提交的儿科数据公平地回应了FDA对此类 数据的书面请求,则可以授予这项为期六个月的排他性 。这些数据不需要证明该产品在研究的儿科人群中有效;相反,如果临床试验被认为是公平地回应了FDA的要求,则给予额外的保护。虽然这不是专利期限的延长,但它有效地延长了FDA不能批准另一项申请的监管期限。
临床试验信息披露
FDA监管产品的临床试验赞助商 必须在网站 www.Clinicaltrials.gov上注册并披露某些临床试验信息。然后,作为注册的一部分,与产品、患者群体、调查阶段、试验地点和调查人员、临床试验的其他方面相关的信息被公开。赞助商还有义务在完成后披露其临床试验的结果。在某些情况下,临床试验结果的披露可推迟至试验完成之日起 至两年。竞争对手可以使用这些公开的信息来了解有关临床开发计划和临床试验设计的进展情况。
审批后要求
药品批准后,制造商和已批准的药品将受到FDA的普遍和持续的监管,其中包括监测和记录保存活动、报告产品不良反应、产品 抽样和分销限制、遵守促销和广告要求,其中包括限制为未经批准的用途或患者群体推广 药物(即“非标签使用”),以及限制行业赞助的科学和教育活动。虽然医生可能会开合法的产品用于标签外的用途,但制造商不得销售或推广此类用途。FDA和其他机构积极执行禁止推广标签外使用的法律和法规, 被发现不当推广标签外使用的公司可能会承担重大责任,包括不良宣传、FDA的执法行动、纠正广告、同意法令以及FDA可获得的全部民事和刑事处罚。处方药宣传材料也必须在首次使用时提交给FDA。此外,如果 批准的药物产品有任何修改,包括适应症、标签或生产工艺或设施的更改,则可能要求申请人提交并获得FDA批准新的NDA或NDA补充剂,这可能需要申请人开发 额外的数据或进行额外的临床前研究或临床试验。
| 88 |
FDA 法规要求产品必须在特定的经批准的设施中生产,并符合cGMP。CGMP条例 包括与人员、建筑物和设施、设备、成分和药品容器和封口的控制、生产和过程控制、包装和标签控制、持有和分配、实验室控制、记录和报告以及退回或回收的产品有关的要求。我们候选产品的制造设施必须满足cGMP要求 并满足FDA或类似的外国监管机构的要求,然后才能批准任何产品并生产我们的商业产品 。这些制造商必须遵守cGMP,要求质量控制和质量保证,维护记录和文件,并有义务调查和纠正任何偏离cGMP的情况。制造商和参与生产和分销批准药品的其他实体必须向FDA和某些州机构登记其机构,并接受FDA和某些州机构的定期突击检查,以确保 遵守cGMP要求和其他法律。因此,制造商必须继续在生产和质量控制方面花费时间、金钱和精力,以保持符合cGMP。发现违规情况,包括不符合cGMP, 可能会导致执法行动,包括停止制造活动。在批准后发现产品问题 可能会导致对产品、制造商或已批准的保密协议持有人的限制,包括召回和产品扣押。
此外, 生产流程的更改受到严格监管,在实施之前通常需要FDA批准或FDA通知。 如果药物有任何修改,包括适应症、标签或生产工艺或设施的更改, 申请人可能被要求提交并获得FDA对补充NDA或新NDA的批准,这可能需要申请人开发 额外的数据或进行额外的药物开发/配方研究、非临床研究或临床试验。
一旦批准了处方药,如果不能保持符合法规要求和标准,或者产品上市后出现问题,FDA可能会撤回批准。如果后来发现产品存在以前未知的问题, 包括未预料到的严重程度或频率的不良事件,或生产工艺,或未能遵守监管要求,可能会导致对批准的标签进行强制修订以添加新的安全信息;实施上市后或临床试验以评估新的安全风险;或根据REMS计划实施分销或其他限制。其他潜在的 后果包括:
| ● | 限制产品的销售或制造、产品完全退出市场或产品召回; | |
| ● | 对批准后的临床试验处以罚款、警告信或其他与执行有关的信或临床搁置; | |
| ● | FDA拒绝批准待批准的NDA或已批准的NDA的补充剂,或暂停或撤销产品批准; | |
| ● | 产品 扣押或扣押,或者拒绝允许产品进出口的; | |
| ● | 禁止令或施加民事或刑事处罚; | |
| ● | 同意法令、公司诚信协议、取消联邦医疗保健计划的资格或将其排除在外;以及 | |
| ● | 强制 修改宣传材料和标签并发布更正信息。 |
| 89 |
此外,处方药产品(包括样品)的分销受《处方药营销法》(“PDMA”)的约束,该法案规范了联邦一级的药品和药品样品的分销,并为各州对药品分销商的注册和监管设定了最低标准。PDMA和州法律都对处方药产品样品的分配进行了监管,并规定了确保分配责任的要求。
此外,《药品供应链安全法案》(DSCSA)于2013年颁布,旨在建立一个电子系统来识别和追踪在美国分销的某些处方药。DSCSA要求药品制造商、批发商和分销商在10年内履行分阶段的资源密集型义务,预计将于2023年11月结束。有时,可能会实施新的立法和法规,以显著改变规范FDA监管的处方药产品审批、制造和营销的法定条款 。无法预测 是否会颁布进一步的立法或监管变化,或FDA的法规、指南或解释是否会发生变化,或者此类变化的影响(如果有的话)。
DEA 法规
我们目前的候选药物中的有效成分被DEA列为CSA下的受控物质。CSA及其实施条例为处理受控物质的实体建立了一个封闭的分销链,并对这类实体提出了登记、记录保存和报告、安保、储存、采购、制造、分销、进口、出口、标签、包装和其他要求。DEA要求处理受控物质的个人或实体遵守这些要求,以确保合法使用受控物质,并防止将受控物质转移到非法商业渠道。
CSA根据滥用的可能性和对身体或心理的依赖,将受控物质归类为五个附表之一,即附表一、附表二、附表三、附表四或附表五。根据定义,附表一物质有很高的滥用可能性,目前在美国没有被接受用于治疗的医疗用途,并且在医疗监督下使用缺乏公认的安全性。不得在美国制药产品中销售 或销售给患者,这些产品具有当前接受的医疗用途,并且 以其他方式获准上市的可能被列为附表II、III、IV或V物质,其中附表II物质具有最高的滥用和身体或心理依赖的可能性,而附表V物质具有最低的滥用和依赖的相对可能性 。附表二物质(以及任何附表中定义为麻醉品的物质)在登记、安全、记录保存和报告方面受到最严格的 要求,这些物质的分配和分配受到严格的管制。例如,所有附表二的药物处方必须由医生签署,在大多数情况下必须亲自提交给药剂师,除非它们是根据DEA规定以电子方式开出的,并且不能重新灌装。 我们的候选产品(醋酸地塞米酯和右旋苯丙胺)中的活性成分是附表II管制物质,受到各种限制。 因此,产品的采购、制造、运输、储存、销售和使用如果获得批准,将受到高度的 监管。
制造、分销、进口或出口受管制物质的设施必须每年向DEA登记。登记是针对特定地点、活动和受控物质时间表的。例如,进口和制造需要单独注册,每一次注册都将明确授权哪些受控物质的附表。同样,单独的设施也需要单独注册 。
DEA检查制造商、分销商、进口商和出口商,以审查CSA和DEA法规的合规性,包括安全、记录保存和报告,然后在发布受控物质注册之前并定期进行。具体安全要求 因商业活动类型以及注册人处理的受控物质的时间表和数量而异,其中最严格的要求适用于附表一和附表二。所需的安全措施包括对员工的背景调查 以及通过保险库和库存对账等措施对库存进行实物控制。制造商和分销商还必须 定期向禁毒署提交关于附表一和附表二管制物质、附表三麻醉物质和其他指定物质的分配情况的报告。必须保存处理所有受控物质的记录,例如,制造、接收、销售、交付或以其他方式处置的每种物质的完整和准确的记录。所有DEA登记人员还必须报告任何受控物质被盗或重大损失,并必须获得销毁或处置受控物质的授权。除了保持进口商和/或出口商的登记外,受控物质的进口商和出口商还必须为每一次进口或出口附表一或二所列物质和附表三、四和五所列麻醉物质获得许可证。对于附表三、四和五所列所有其他药物,进出口商必须提交进出口申报单。
| 90 |
此外,DEA配额系统控制和限制附表I或II中受控物质的可获得性和生产。DEA 根据DEA对满足合法科学和医药需求所需数量的估计,制定了美国每年可生产多少受控物质的总配额。DEA每年允许在美国生产的阿片类药物和兴奋剂的有限总数是在各个公司之间分配的,这些公司必须 每年向DEA提交个人生产和采购配额的申请。我们必须从DEA 获得年度配额,才能生产或采购用于制造我们的产品和候选产品的附表II物质。禁毒署可在年内不时调整总生产配额及个别生产和采购配额,但该局在是否作出调整方面拥有相当大的自由裁量权。分发任何附表I或II受控物质还必须 附上特别订购表,并向DEA提供副本。
如果 未能遵守适用的DEA要求,特别是在损失或转移或受管制物质方面表现出来的要求,可能会导致行政、民事或刑事执法行动。缉毒局可以寻求民事处罚,拒绝续签必要的登记, 或提起行政诉讼以撤销这些登记。在某些情况下,违规行为可能会导致刑事起诉。
各州和哥伦比亚特区也对受控物质进行监管,并对处理受控物质的实体实施类似的许可、记录保存和报告要求。除联邦受控物质要求外,实体还必须独立遵守 中的各种州要求。
药品 覆盖范围、定价和报销
对于我们可能获得监管部门批准的任何候选产品的承保范围和报销状态存在重大不确定性。 在美国,药品的销售在很大程度上取决于第三方付款人(例如州和联邦政府当局,包括管理Medicare和Medicaid计划的机构、管理保健组织和私人保险公司)是否提供承保和足够的报销 。我们将逐个计划地决定为我们的每个候选产品提供的保险范围和报销金额。医疗保险和医疗补助计划经常被私人付款人和其他政府付款人用作制定他们的药品保险和报销政策的范本。然而,一个付款人决定为产品提供保险并不能保证其他付款人也会为该产品提供保险和足够的 报销。每个第三方付款人决定是否为药物提供保险,将为药物向提供者支付多少金额,以及药物将被放置在其处方的哪一层。这些决定受治疗类别中是否存在多个药物产品以及该计划的净成本的影响,包括药物制造商回扣的处方价格金额(如果有)。通常,仿制药被放在首选的级别。 药物在处方中的位置通常决定了患者获得该药物所需的自付费用,并可能强烈影响患者和医生对药物的采用。根据自己的病情接受处方治疗的患者和执行处方服务的提供者通常依赖第三方付款人来报销全部或部分相关医疗费用。患者 不太可能使用我们的产品,除非提供保险,而且报销足以支付我们产品的大部分成本。此外,第三方付款人决定为药品提供保险并不意味着将批准适当的报销比率 。此外,第三方支付者正在开发越来越复杂的方法来控制医疗成本。因此,承保范围、报销和安置决定非常复杂,通常是付款人和药物所有者之间进行广泛谈判的主题。
除非 我们达成战略协作,由我们的合作者负责为给定产品寻求覆盖范围和报销,否则我们将负责为我们的候选产品协商覆盖范围、报销和安置决定。新产品的报销和安置决定基于许多因素,包括用于相同或类似适应症的已上市品牌药物的覆盖范围、报销和安置 、新产品的安全性和有效性、可用于类似适应症的仿制药 、对新产品的临床需求以及产品的成本效益。
| 91 |
在联邦医疗保险计划内,CTX-1301、CTX-1302和CTX-2103,如果获得批准,很可能是自我管理的药物,可能会根据扩展的处方药福利(称为联邦医疗保险D部分)获得报销。该计划是由私人 计划管理的自愿医疗保险福利,根据与联邦政府的合同运作。这些计划制定了确定哪些产品适用于承保药品以及哪些自付费用适用于承保药品的处方。这些计划在建立配方和分级共同支付结构方面有相当大的自由裁量权, 与制造商谈判返点,并对特定产品的使用施加事先授权和其他限制, CMS将审查歧视性做法。这些D部分计划与药品制造商协商折扣,通过降低保费,这些折扣将全部或部分转嫁给该计划的每个参与者。
如果药品由联邦医疗保险或联邦医疗补助报销,定价和返点计划必须符合适用的《联邦医疗保险处方》 2003年《药品改进和现代化法案》以及经修订的《1990年综合预算调节法》(简称《Obra》)和1992年《退伍军人医疗法案》的医疗补助退税要求。除其他事项外,Obra要求药品制造商向州医疗补助计划支付处方药回扣,并授权各州谈判药品价格回扣,这可能会导致我们未来产品的价格可能低于我们本来可能获得的价格。如果产品 提供给总务署联邦供应时间表的授权用户,则适用其他法律和要求 。
包括美国政府在内的第三方付款人继续对医药产品的报销施加下行压力。 例如,2022年的通胀削减法案降低了美国政府对一些药品的报销。此外,美国管理医疗保健的趋势以及健康维护组织等组织的同时增长可能会导致药品报销减少。我们预计,随着这些付款人实施各种提案或监管政策,这些趋势将持续下去。目前,我们预计将继续有许多联邦和州提案直接或间接地实施对报销和定价的控制。
其他 医疗保健法律和合规要求
由于我们正在将我们的候选产品商业化,如果它们获得FDA或类似的外国监管机构的批准进行营销, 我们将受到额外的医疗保健法律和监管要求以及联邦政府和我们开展业务所在司法管辖区的州和外国政府的强制执行。医疗保健提供者、医生和第三方付款人将在推荐和处方我们获得营销批准的任何其他候选产品时发挥主要作用。 我们与第三方付款人和客户的安排使我们面临广泛适用的欺诈和滥用以及其他医疗法律和 法规,这些法规约束我们营销、销售和分销我们获得营销批准的任何 产品的业务或财务安排和关系。
适用的联邦和州医疗保健法律法规的限制 包括:
| ● | 除其他事项外,《联邦反回扣条例》禁止任何人直接或间接故意提供、招揽、收受或提供报酬,以引荐个人购买商品或服务,或购买或订购商品或服务,并根据联邦医疗保健计划(如Medicare和Medicaid计划)进行支付。联邦反回扣法规可能会有不同的解释。在过去,政府 执行联邦反回扣法规,基于虚假咨询和与医生的其他财务安排与医疗保健公司达成大规模和解。个人或实体不需要实际了解法规或具体意图即可违反法规,即可实施违规。此外,政府可以断言,违反联邦反回扣法规而产生的包括物品或服务的索赔,就民事 虚假索赔法案而言,构成虚假或欺诈性索赔; |
| 92 |
| ● | 联邦民事和刑事虚假索赔法律,包括《民事虚假索赔法案》和民事罚款法律,除其他事项外,禁止在知情的情况下向美国政府提交或导致提交虚假、虚构或欺诈性的付款索赔,明知而制作、使用或导致制作或使用虚假记录或陈述来向美国政府虚假或欺诈性索赔,或故意进行虚假陈述以避免、减少或隐瞒向美国政府付款的义务。根据这些法律提起的诉讼可以由总检察长提起,也可以由个人以政府的名义提起诉讼。联邦政府利用这些法律和附带的重大责任威胁,对全美的制药和生物技术公司进行调查和起诉,例如,与推广未经批准的用途的产品和其他据称非法的销售和营销行为有关; | |
| ● | HIPAA制定了新的联邦、民事和刑事法规,禁止明知和故意执行或试图执行欺诈任何医疗福利计划的计划,包括 私人第三方付款人明知和故意挪用或窃取医疗福利计划,故意阻碍对医疗违规行为的刑事调查,以及明知和故意伪造、隐瞒或掩盖重大事实,或做出与提供或支付医疗福利、项目或服务有关的任何重大虚假、虚构或欺诈性陈述。与联邦反回扣法规类似,个人或实体不需要对法规有实际了解,也不需要有违反法规的具体意图即可实施违规; | |
| ● | 除其他事项外,PPACA还要求FDA批准的药品、设备、生物制品和医疗用品制造商 联邦医疗保险、医疗补助或儿童健康保险计划 每年向CMS报告与向医生(定义为包括医生、牙医、视光师、足科医生、脊椎按摩师以及从2022年开始为前一年提供的付款和其他价值转移 某些高级非医生医疗从业者)支付和其他价值转移有关的信息。以及医生及其直系亲属持有的所有权和投资权益。 | |
| ● | 经HITECH修订的HIPAA及其各自的实施条例 对个人可识别健康信息的隐私、安全和传输提出了具体要求。除其他事项外,HITECH使HIPAA的隐私和安全标准直接适用于“业务伙伴”,其定义 为承保实体的独立承包商或代理,包括某些医疗保健提供者、健康计划和医疗信息交换所, 创建、接收、维护或传输与为承保实体或代表承保实体提供服务相关的受保护健康信息。HITECH还增加了对覆盖实体、商业伙伴和可能的其他人施加的民事和刑事处罚,并赋予州总检察长新的权力,可以向联邦法院提起民事诉讼,要求损害赔偿或禁制令,以执行HIPAA并寻求与提起联邦民事诉讼相关的律师费和费用; | |
| ● | 类似的国家和外国法律法规,如国家反回扣和虚假索赔法律,可能适用于销售或营销安排,以及涉及由非政府第三方付款人(包括私营保险公司)报销的医疗项目或服务的索赔; | |
| ● | 州法律,要求制药公司遵守制药行业的自愿合规指南和联邦政府颁布的相关合规指南,并可能要求药品制造商报告与向医生和其他医疗保健提供者支付和以其他方式转移价值或营销支出有关的信息, 这些法律施加的要求比《医生支付阳光法案》以及要求药品销售代表注册的州和地方法律 更严格;以及 | |
| ● | 国家法律和外国法律法规(特别是与欧洲个人相关的个人数据的欧盟法律),这些法律和法规在某些情况下管理健康信息的隐私和安全,其中许多法律和外国法律法规在很大程度上彼此不同,从而使合规工作复杂化。 |
| 93 |
2020年11月,美国卫生与公众服务部(DHHS)完成了对实施《反回扣法规》的法规的重大修改,目的是为医疗行业提供更大的灵活性,并减轻与这些欺诈和滥用法律相关的监管负担,尤其是在行业参与者之间的基于价值的安排方面。
确保我们当前和未来与第三方的业务安排符合适用的医疗法律法规,这涉及到大量成本。政府当局可能会得出结论,我们的业务行为可能不符合当前或未来涉及适用的欺诈和滥用或其他医疗保健法律和法规的现行或未来法规、法规、机构指导或判例法。 如果我们的运营被发现违反了任何这些法律或任何其他可能适用于我们的政府法规,我们可能会 受到重大的民事、刑事和行政处罚,包括金钱损失、罚款、返还、监禁、失去获得FDA批准的资格、被排除在参与政府合同、医疗保险报销或其他政府项目之外,包括Medicare和Medicaid、声誉损害、利润减少和未来收益,或者如果我们受到公司诚信协议或其他协议的约束,以解决对我们违反任何这些法律的指控,以及我们业务的缩减或重组,则需要额外的 报告要求。如果我们预计与之开展业务的任何医生或其他医疗保健提供者或实体被发现不符合适用法律,他们可能会受到刑事、民事或行政制裁,包括被排除在政府资助的医疗保健计划之外。
医疗保健 改革和医疗保健法律的潜在变化
美国和一些外国司法管辖区正在考虑或已经颁布了一系列立法和监管建议,以改变医疗保健系统,其方式可能会影响我们未来销售产品的盈利能力。在美国和其他地方的政策制定者和支付者中,有很大的兴趣推动医疗保健系统的变革,以控制医疗保健成本、提高质量或扩大准入为既定目标。在美国,制药业一直是这些努力的重点 ,并受到重大立法倡议的重大影响。FDA和其他监管机构的 政策可能会改变,可能会颁布额外的政府法规,以阻止、限制或推迟监管部门对我们候选产品的审批。如果我们缓慢或无法适应现有要求的变化或新要求或政策的采用, 或者如果我们无法保持监管合规性,我们可能会失去原本可能获得的任何营销批准,我们 可能无法实现或保持盈利,这将对我们的业务、前景、财务状况和运营结果产生不利影响。 此外,美国和其他地方的政策制定者和付款人对推动医疗保健系统的变革非常感兴趣,以控制医疗保健成本、提高质量和/或扩大准入为既定目标。
例如,PPACA于2010年3月颁布,对美国的医疗保健行业产生了重大影响。PPACA 扩大了未参保人群的覆盖范围,同时控制了整体医疗成本。在生物制药产品方面,除其他事项外,PPACA解决了一种新的方法,即针对吸入、输注、滴注、植入或注射的药物计算制造商在Medicaid药品返点计划下的返点,提高 制造商在Medicaid药品返点计划下的最低医疗补助返点,并将返点计划扩大到参加Medicaid托管护理 组织的个人,建立对某些品牌处方药制造商的年费,并创建新的Medicare Part D Coverage Gap折扣计划。
另一个例子是,《2021年综合拨款法案》于2020年12月27日签署成为法律,纳入了广泛的医疗条款和对现有法律的修订, 包括要求联邦医疗保险B部分涵盖的所有药品和生物制品制造商从2022年1月1日起向国土安全部报告产品的 平均销售价格,并通过民事罚款强制执行。
此外,自PPACA以来,美国还提出并通过了影响医疗保健支出的其他立法变化。这些变化包括: 根据2011财年的《预算控制法案》,向医疗保险提供者支付的医疗保险总金额减少了2%,该法案于2013年生效,除非国会采取进一步行动,否则该法案将一直有效到2030年。冠状病毒援助、救济和经济安全法案,(“CARE法案”)于2020年3月27日签署成为法律,旨在为受新冠肺炎大流行影响的个人和企业提供 财政支持和资源,从2020年5月1日至2020年12月31日暂停实施2%的联邦医疗保险自动减支 ,并将自动减支延长一年至2030年,以抵消2020年取消自动减支带来的额外费用 。2021年综合拨款法案随后于2020年12月27日签署成为法律,并将CARE法案的暂停期延长至2021年3月31日。2021年3月11日签署成为法律的2021年《美国救援计划法案》(American Rescue Plan Act)是最新颁布的疫情缓解立法,其中还包括重大的医疗体系改革和旨在加强根据PPACA建立的保险市场的计划等。此外,自ACA颁布以来,美国还提出并通过了影响制药业的其他立法修订。例如,2022年的《降低通货膨胀法案》包括一项条款,授权CMS每年为有限数量的高成本、单一来源的药品谈判一个“最高公平价格”,以及另一项条款,该条款要求制药公司在价格上涨快于通胀的情况下向联邦医疗保险支付回扣。
| 94 |
此外, 政府对制造商为其市场产品设定价格的方式进行了更严格的审查,这导致了几次国会调查,并提出并颁布了旨在 提高产品定价透明度、审查定价与制造商患者计划之间的关系以及改革政府 药品报销方法的联邦和州立法。国土安全部已就一些旨在降低药品价格和降低药品自付成本的各种措施征求反馈意见,并根据其现有权限实施了其他措施。例如,2019年5月,国土安全部 发布了一项最终规则,允许Medicare Advantage计划从2020年1月1日开始选择对B部分药物使用阶梯疗法。这一最终规则编纂了2019年1月1日生效的国土安全部政策变更。国会和行政部门各自表示,将继续寻求新的立法和/或行政措施来控制药品成本,这使这一领域面临持续的不确定性。
美国的个别州也越来越多地通过立法并实施旨在控制药品 产品定价的法规,包括价格或患者报销限制、折扣、对某些产品准入和营销的限制 成本披露和透明度措施,在某些情况下,旨在鼓励从其他国家进口和批量购买。 2020年12月,美国最高法院一致裁定,联邦法律不妨碍 各州对药品福利经理(“PBM”)和医疗保健和药品供应链的其他成员进行监管的能力。这一重要决定可能会导致各国在这一领域做出进一步和更积极的努力。
FDA和其他监管机构的政策也可能改变,可能会颁布额外的政府法规,以阻止、限制或推迟对我们候选药物的监管批准。例如,2016年12月,《21世纪治愈法案》( 《治愈法案》)签署成为法律。除其他事项外,《治疗法案》旨在使药品和设备的监管现代化,并鼓励创新,但其最终实施情况尚不确定。此外,2017年8月,FDA重新授权 法案被签署为法律,该法案重新授权FDA的用户费用计划,并包括 在《治疗法案》基础上建立的额外药物和设备条款。如果我们缓慢或无法适应现有要求的变化或采用新要求或政策,我们可能无法实现或保持盈利,这将对我们的业务、前景、财务状况和 运营结果产生不利影响。
我们 预计PPACA以及未来可能采取的其他医疗改革措施可能会导致更严格的覆盖标准和更低的报销,并对我们获得批准的任何产品的价格造成额外的下行压力。任何减少联邦医疗保险或其他政府资助计划的报销 都可能导致私人付款人支付的类似减少。 一旦获得监管部门的批准,实施成本控制措施或其他医疗改革可能会阻止我们创造收入、实现盈利或将我们的药品商业化。我们无法预测美国或国外未来的立法或行政或行政行动可能产生的政府监管的可能性、性质或程度。 我们预计未来将采取更多的州和联邦医疗改革措施,其中任何一项都可能限制联邦和州政府为医疗产品和服务支付的金额,包括我们获得上市批准的任何未来医药产品。
数据隐私和个人信息保护
我们 受适用于我们的业务和相关数据处理活动的数据隐私、安全和个人信息(包括健康信息)保护的法律法规的监管。隐私和数据保护的立法和监管格局 继续发展,全球对隐私和数据保护问题的关注也越来越多 这些问题将继续影响我们的业务。在美国,我们可能受到州数据泄露通知法、州 保护健康和个人信息隐私和安全的法律以及监管个人信息收集、使用、披露和传输的联邦和州消费者保护法的约束。这些法律可能会相互重叠和冲突,这些法律中的每一项都会受到法院和政府机构的不同解释,给我们带来了复杂的合规问题。如果我们未能遵守适用的数据保护法律和法规,我们可能会受到惩罚或制裁,包括刑事处罚 。我们当前和未来的客户和研究合作伙伴必须遵守管理健康信息隐私和安全的法律,包括HIPAA和州健康信息隐私法。如果我们在知情的情况下获取受HIPAA保护的健康信息(称为“受保护的健康信息”),而没有遵守正确的协议,其中可能包括执行业务 关联协议、实施隐私或安全措施以及其他义务,则我们的客户或研究合作者可能会 受到执法行动的影响,并且我们可能因非法接收受保护的健康信息或协助、教唆违反HIPAA而承担直接责任。
| 95 |
保护健康和个人信息的州法律正变得越来越严格。例如,加利福尼亚州实施了《加州医疗信息保密法》,该法案对健康信息和其他个人身份信息的使用和披露提出了限制性要求。华盛顿已经颁布了《我的健康我的数据法案》,该法案将于2024年3月31日(某些例外情况下)生效,而内华达州的消费者健康隐私法将于2024年3月31日生效。普通州隐私法的发展甚至更快。2020年,加州实施了《2018年加州消费者隐私法》(CCPA)。CCPA反映了欧洲联盟一般数据保护条例(GDPR)中包含的几个关键概念。CCPA通过以下方式为涵盖的企业建立新的隐私框架:创建个人信息的扩展定义,为加利福尼亚州的消费者建立新的数据隐私权,对从未成年人收集消费者数据实施特殊规则,并为违反CCPA和未能实施合理安全程序和实践以防止数据泄露的企业创建新的、可能 严重的法定损害赔偿框架。2023年1月1日,《加州隐私权法案》(“CPRA”) 生效,并对《加州隐私权法案》进行了重大修改。这可能会导致更多的不确定性、合规工作中的额外成本和开支,以及不合规的额外潜在危害和责任。除加利福尼亚州外,其他12个州颁布了州数据隐私法,其中5个州-科罗拉多州、康涅狄格州、内华达州、犹他州和弗吉尼亚州-这些法律已于2023年生效。美国其他州也在考虑类似CCPA/CPRA的隐私法和其他州隐私法。
当我们在英国或欧洲经济区开展业务和/或进行 临床试验时(即,欧盟以及列支敦士登、挪威和冰岛),我们受GDPR以及 根据英国《2018年欧盟(退出)法案》第3条和英国《2018年数据保护法案》(“DPA 2018”)(“英国GDPR”)保存在英国法律中的GDPR的约束。GDPR和英国GDPR适用于业务 同事、员工、服务提供商、试验参与者和其他个人,如英国或欧洲经济区居民 的研究者或CRO员工。违反英国GDPR和/或GDPR的行为可能会被处以高达2000万欧元/1750万英镑的巨额罚款或上一财年全球年收入总额的4% ,以较高者为准。
美国《反海外腐败法》
In general, the Foreign Corrupt Practices Act of 1977, as amended, or the FCPA, prohibits offering to pay, paying, promising to pay, or authorizing the payment of money or anything of value to a foreign official in order to influence any act or decision of the foreign official in his or her official capacity or to secure any other improper advantage in order to obtain or retain business for or with, or in order to direct business to, any person. The prohibitions apply not only to payments made to “any foreign official,” but also those made to “any foreign political party or official thereof,” to “any candidate for foreign political office” or to any person, while knowing that all or a portion of the payment will be offered, given, or promised to anyone in any of the foregoing categories. “Foreign officials” under the FCPA include officers or employees of a department, agency, or instrumentality of a foreign government. The term “instrumentality” is broad and can include state-owned or state-controlled entities. Importantly, United States authorities deem most healthcare professionals and other employees of foreign hospitals, clinics, research facilities and medical schools in countries with public healthcare and/or public education systems to be “foreign officials” under the FCPA. When we interact with foreign healthcare professionals and researchers in testing and marketing our products abroad, should any of our product candidates receive foreign regulatory approval in the future, we must have policies and procedures in place sufficient to prevent us and agents acting on our behalf from providing any bribe, gift or gratuity, including excessive or lavish meals, travel or entertainment in connection with marketing our products and services or securing required permits and approvals. The FCPA also obligates companies whose securities are listed in the United States to comply with accounting provisions requiring us to maintain books and records that accurately and fairly reflect all transactions of the corporation, including international subsidiaries, and to devise and maintain an adequate system of internal accounting controls for international operations.
| 96 |
材料 协议
与Indegene,Inc.的联合 商业化协议
2023年3月7日, 我们签订了Indegene联合商业化协议。
如果我们应我们的请求获得FDA对CTX-1301的批准,则商业化协议管辖Indegene将为CTX-1301提供商业化服务的一般条款。根据商业化协议,双方将签订工作声明,其中将列出Indegene将提供的服务、此类服务的可交付内容以及我们将支付的费用。除非在《工作说明书》中明确修改,否则每一份《工作说明书》均受《商业化协议》条款的约束。 我们可以选择接受Indegene的以下服务:(A)医疗事务和药物警戒;(B)定价、报销 和市场准入;(C)商业运营;(D)营销(包括现场力量)。双方将真诚协商因我们确定的情况或优先顺序的变化而对Indegene提供的服务进行的任何 更改。
商业化协议将在CTX-1301发射三年后到期。我们可以在提前六(6)个月书面通知Indegene时终止商业化协议,而Indegene可以在提前十二(12)个月书面通知我们时终止商业化协议 。此外,在以下情况下,任何一方均可提前三十(30)天书面通知终止商业化协议:(I)FDA通知我们不会批准我们的CTX-1301的NDA; 或(Ii)我们暂停或终止CTX-1301在美国的临床开发计划。任何一方均可提前三十(30)天终止《商业化协议》,对重大、未治愈的违规行为发出书面通知,或在另一方破产时立即终止。
在 期间根据《商业化协议》,除医疗信息服务、同行评审文章的开发和发表以及药物警戒服务外,Indegene不会向除我们以外的任何一方提供战略性医疗保健服务和/或患者营销支持(或任何其他类型的同类服务),但我们不会就任何ADHD产品向我们提供 。在发出终止商业化协议的通知或终止特定服务的通知之前,我们不会在未经Indegene书面批准的情况下,就CTX-1301的商业化提供与Indegene向我们提供的任何服务类别相同的任何服务 ,不得无理扣留,但某些例外情况除外。
商业化协议包含声明、保证、保密和赔偿义务 此类协议的惯例义务。
大师级 与社会CDMO,Inc.签订的服务协议。
自2022年10月24日起,我们与社会签订了主服务协议(“制造协议”)。《制造协议》规定了Social或其附属公司将在我们位于佐治亚州盖恩斯维尔的制造工厂提供制造服务的一般条款 。此类服务根据商定的工作报表 执行。根据制造协议的条款,我们同意按照每个适用的工作说明书中的规定为社会履行服务支付费用。
| 97 |
制造协议将于2027年10月终止或完成 工作说明书(“初始期限”)所需的较晚日期,此后将自动续订 连续十二(12)个月(“续期”),除非任何一方在初始 期限或任何续期结束前至少十二(12)个月(如果在成功完成第一个产品的过程验证批次之前) 或二十四(24)个月(在成功完成第一个产品的验证批次之后)终止 。除非提前终止,否则每个工作说明书的期限在该工作说明书下的服务完成时终止。我们可以在向社会发出书面通知后九十(90)天终止制造协议或任何工作说明书。社会可因某些延迟或不活动 或该工作陈述下提供的服务不能按照适用的法规要求执行而终止工作陈述;但条件是,在任何此类终止之前,社会应采取商业上合理的努力与我们进行有意义的讨论。如果所有工作说明书均已终止,社会可提前六(6)个月书面通知终止本协议。制造协议或工作说明书可由任何一方因重大、未治愈的违规行为或在另一方 破产的情况下终止。
《制造协议》包括与赔偿、知识产权保护、保密性、补救措施和保证等相关的惯例条款。
与BDD Pharma Limited签订专利和专有技术许可协议
我们 于2018年8月与BDD Pharma Limited(“BDD Pharma”)签订了专利和专有技术许可协议,我们将该协议称为BDD Pharma许可协议。根据BDD Pharma许可协议,我们在BDD Pharma拥有或控制的技术项下拥有独家许可, 专利和专有技术与受控药物释放阻隔层有关,以开发、制造、销售、使用、进口、销售或以其他方式供应和商业化以下产品:(I)提供三种不同剂量的右旋苯丙胺、哌甲酯或任何以哌醋甲酯为基础或以苯丙胺为基础的药物,(Ii)体外释放超过8小时或(Iii)以其他方式被专利涵盖或制造,根据专有技术开发或使用的。我们 也有权申请上市批准和进行临床试验,以获得此类产品的上市批准 。授予我们的权利是全球性的,在治疗人类任何疾病或障碍方面都是独家的 可以用以哌醋甲酯或安非他明为基础的药物或其混合物或其组合进行治疗。我们有权在符合某些条件的情况下,对授予我们的权利进行再许可。
BDD Pharma有权因签署BDD Pharma许可协议而获得198,625美元的付款。我们可能需要为与临床试验和监管里程碑相关的每个产品向BDD Pharma里程碑支付总计750,000美元(其中250,00美元已经支付),对于里程碑付款而言,同一产品的不同剂量强度被视为 。我们可能被要求为产品的总净销售额支付BDD Pharma低至中个位数的版税。我们 还可能被要求根据产品的总净收入向BDD Pharma支付低至中个位数的版税,这是基于我们的分被许可人的销售额和我们收到的非版税分许可对价。
除非 提前终止,否则BDD Pharma许可协议的期限将持续到我们获得的所有专利的最后一个到期日期或我们的所有付款义务的最后一个到期日期中的较晚者。我们的专利使用费支付义务将在产品首次在一个国家/地区商业销售或涵盖该产品在一个国家/地区的制造、使用或销售的最后一个到期专利 到期后10年内按产品 和国家/地区到期。目前,BDD Pharma授权的最后一个到期专利将于2035年11月到期。在我们的版税支付义务到期后,授予我们的许可将成为全额支付、不可撤销和永久的。
我们或BDD Pharma可以终止BDD Pharma许可协议,如果另一方存在未治愈的重大违约或与另一方的破产有关。如果我们、任何分被许可人或相关方或附属公司直接质疑或协助第三方质疑BDD Biophma拥有的专利的有效性或强制执行,BDD Pharma可在发出书面通知后立即终止BDD Pharma许可协议。
| 98 |
人力资源 资本资源
要实现我们的目标,吸引和留住有才华的员工至关重要。为了促进这一点,我们努力保持一个安全和 有回报的工作场所,让我们的员工有机会在他们的职业生涯中成长和发展,并得到有竞争力的薪酬、全面的福利和健康计划以及在我们员工之间建立联系的计划的支持。我们的薪酬计划包括 授予股票期权以吸引、留住和激励员工。
截至2023年12月31日,我们雇用了十三(13)名员工。其中,六(6)人从事研发和制造活动,七(Br)(7)从事一般和行政职能。我们所有的员工都在美国。我们利用外部顾问和独立承包商来补充我们的全职员工队伍。我们的员工中没有一个是由劳工组织代表的,也没有 在集体谈判安排下。我们认为我们的员工关系很好。
企业信息
Cingate Inc.是一家特拉华州公司,成立于2021年5月,是一家控股公司。CTX是特拉华州的一家有限责任公司,成立于2012年11月。关于本公司首次公开募股的完成,于2021年9月29日,Cingate Inc.通过将Cingate Inc.的全资收购子公司与CTX合并并并入CTX(“合并”)而收购了CTX。 由于合并,CTX成为Cingate Inc.的全资子公司。除非另有声明或上下文另有要求,本招股说明书中的所有信息均反映重组合并和IPO的完成。
我们的主要执行办公室位于西47号1901号这是Pace,堪萨斯城,堪萨斯州66205,我们的电话号码是(913)9422300.我们的网站地址是Www.cingulate.com。本招股说明书中包含或可通过我们网站访问的信息不构成本招股说明书的一部分。我们在这份年度报告中包括了我们的网站地址,只是作为一个不活跃的文本参考。
属性
我们的公司总部位于堪萨斯州堪萨斯城,在那里我们租用了大约14,205平方英尺的办公空间。我们的租约 将于2025年5月到期,并可选择续签。我们的制造活动发生在我们位于佐治亚州盖恩斯维尔的社会CDMO。 我们相信我们目前的办公室、实验室和制造空间足以满足我们的需求。我们可能会寻求协商新的 租约,或评估额外或替代空间以容纳运营。我们相信,以商业上合理的条款提供合适的替代空间是很容易的。
法律诉讼
我们不是任何等待法律程序的重大事项的一方。在正常业务过程中,我们可能会不时受到法律程序和索赔的影响。
| 99 |
管理层对财务状况和经营结果的讨论和分析
以下对我们财务状况和经营结果的讨论和分析应与本招股说明书其他部分包含的合并财务报表和相关注释一起阅读。本讨论和分析中包含的一些信息或本招股说明书中其他地方陈述的信息,包括与我们的业务计划和战略有关的信息,包括 涉及风险和不确定性的前瞻性陈述。您应阅读本招股说明书的“风险因素”部分 ,讨论可能导致实际结果与以下讨论和分析中包含的前瞻性陈述中描述或暗示的结果大相径庭的重要因素。
概述
我们 是一家生物制药公司,使用我们专有的Precision定时释放TM(“PTRTM“)药物 提供平台技术,以构建和推进下一代药物产品管道,旨在改善患有以繁重的日常给药方案和次优治疗为特征的常见诊断疾病患者的生活 。我们最初的工作重点是ADHD的治疗。我们的PTR平台 包含专有的侵蚀阻隔层(“EBL”),旨在允许以特定的预定义时间间隔释放药物物质,从而释放每日一次、多剂量片剂的可能性。我们认为,在当前的治疗模式中,仍有一个重要的、未得到满足的 需求,即真正的每日一次、持续时间长、副作用突出的ADHD刺激性药物,以更好地满足患者整个活动日的需求。
自2012年成立以来,我们的运营一直专注于开发我们的候选产品、组织和配备我们的公司、业务规划、 筹集资金、建立我们的知识产权组合和进行临床试验。我们没有任何候选产品 获准销售,也没有产生任何收入。我们通过筹集公共和私人资本为我们的业务提供资金。截至2023年9月30日,从这些来源筹集的累计资本(包括债务融资)约为7900万美元。
我们 自成立以来遭受了重大损失。我们能否产生足以实现盈利的产品收入,将 取决于我们的一个或多个候选产品的成功开发和商业化。截至2023年9月30日和2022年9月30日的三个月期间,我们的净亏损分别为600万美元 和400万美元,截至2023年9月30日和2022年9月30日的九个月期间,我们的净亏损分别为1660万美元和1310万美元。有关我们净亏损波动的说明,请参阅下面的“经营业绩”。截至2023年9月30日,我们的累计赤字为8600万美元。
我们 预计在短期内将继续产生巨额费用并增加运营亏损。我们预计与持续活动相关的费用将大幅增加,因为我们:
| ● | 寻求监管部门对CTX-1301的批准; |
| ● | 继续为我们现有的和新的候选产品(主要是CTX-1301)进行研发活动; |
| ● | 为我们的临床前研究和临床试验制造用品,主要是CTX-1301; |
| ● | 外包商业基础设施以支持CTX-1301的销售和营销;以及 |
| ● | 将 作为上市公司运营。 |
截至2023年9月30日,我们拥有200万美元的现金和现金等价物。我们相信,根据我们目前的业务计划,此次发行的净收益,加上我们手头的现金,将满足我们到2024年第二季度末的资本需求 。此外,为了在2025年上半年提交CTX-1301的保密协议以获得FDA的潜在批准,我们认为我们将需要大约800-1,000万美元的额外资本。我们还需要额外的资金来推进我们的其他计划和商业化努力。见下文“流动资金和资本资源”。
| 100 |
我们创造产品收入的能力将取决于我们一个或多个候选产品的成功开发、监管批准和最终商业化。在我们能够从产品销售中获得可观收入之前,我们预计 将通过出售股权、债务融资或其他资本来源(包括与其他公司的潜在合作或其他战略交易)为我们的运营提供资金。在可接受的条件下,我们可能无法获得足够的资金,或者根本没有。如果我们未能在需要时筹集资金或达成此类协议,我们可能不得不大幅推迟、缩减或停止我们候选产品的开发和商业化。
临床, 制造和业务更新
CTX-1301: 评估CTX-1301在成人ADHD患者中的疗效和安全性以及起效和持续时间的第三阶段成人剂量优化研究于2022年12月启动,并于2023年6月完成。研究结果已在2023年精神病学大会上公布,并将在2024年1月举行的2024年美国ADHD及相关疾病专业协会(APSARD)上公布。这项第三阶段CTX-1301研究 (NCT05631626)在成人实验室教室环境中评估了21名成人(年龄范围:18-55岁)CTX-1301的疗效和安全性以及CTX-1301的发病和持续时间。它在主要疗效终点上没有达到统计学意义,但CTX-1301显示出与安慰剂相比,在改善永久产品绩效衡量(“PERMP”)分数方面有显著改善的趋势。与安慰剂相比,使用CTX-1301CTX-1301的临床总体印象量表(“cgi-S”)得分也显示出显著的改善,对于这个次要终点确实具有统计学意义。在这项试验中,CTX-1301的治疗效果显著--从30分钟开始,证明了CTX-1301能够在一整天的活动中改善患者的ADHD症状。
此外,我们在2023年第三季度启动了两项针对儿童和青少年患者的CTX-1301第三阶段临床研究-固定剂量研究(NCT05286762)和实验室课堂环境中的剂量优化起效和持续时间研究(NCT05924594)。基于从FDA收到的关于CTX-1301临床计划的指导,我们停止了这两项研究的登记。这些研究中所有登记的患者都可以完成研究,并将相应地报告数据。此外,根据这一指南,我们预计 将在2025年上半年根据第505(B)(2)节路径提交CTX-1301的保密协议,将福卡林®XR作为参考上市药物,将其有效性和安全性数据与我们的CTX-1301临床计划的生物利用度/生物等效性数据 和有效性/安全性数据一起作为批准的基础。如果我们获得FDA对CTX-1301的批准,我们可能会进行4期试验。
我们计划最早在2025年启动CTX-1302(右旋苯丙胺)的临床计划,这是我们治疗ADHD的第二种研究资产,等待额外的资本资源。
Social,一家致力于解决复杂配方和制造挑战的CDMO,主要是在小分子治疗 开发方面,将生产我们的主要ADHD候选药物CTX-1301的所有临床、注册和商业批次。2023年4月,我们成功地完成了将我们的主要候选CTX-1301(哌酸地塞米松)的专有PTR™制造工艺移交给Social,这为我们在Social位于佐治亚州盖恩斯维尔的制造套件中的第三阶段试验生产了可扩展的CTX-1301供应,该工厂配备了我们提供的设备。
2023年3月,我们宣布与综合性生命科学商业化公司Indegene达成联合商业化协议,为我们的主要候选药物CTX-1301(哌酸地塞米松)提供商业支持。该协议通过独特的全方位渠道营销方法 涵盖跨职能服务,旨在成功管理我们第三阶段临床试验期间的商用前支持 ,并在FDA可能批准后在全国范围内有效地将CTX-1301商业化。
CTX-2103: 我们已经启动了一项开发CTX-2103(丁螺环酮)的计划,用于治疗焦虑,这是美国最常见的心理健康问题之一。我们完成了一项配方研究,其中评估了这种提供三个精确定时剂量的丁螺环酮与一个即时释放剂量的三模丁螺环酮的药代动力学。此外,闪烁成像显示了片剂在胃肠道中的转运,以确认释放的位置和开始,然后将其与药代动力学数据相关联,以建立CTX-2103制剂的完全释放曲线。根据数据中看到的药代动力学曲线,CTX-2103实现了丁螺环酮的三次释放。这些结果提供了所需的关键信息,使我们能够 请求与FDA召开IND前会议,讨论我们的CTX-2103临床和监管计划的设计,该计划于 2023年第四季度举行。我们从FDA收到了关于CTX-2103调控途径的意见,以及临床研究的设计,以提交IND。根据FDA的反馈,我们相信我们可以在505(B)(2) 途径下寻求并获得CTX-2103的批准,这通常比505(B)(1)全NDA途径需要更少的时间和资源。
| 101 |
CTX-1302: 我们计划最早在2025年启动CTX-1302(右旋苯丙胺)的临床计划,这是我们治疗ADHD的第二种研究资产,等待额外的资本资源。
PTRTM 平台:我们继续评估超越我们的PTR平台的许可以及在美国以外地区许可我们的候选产品的机会。此外,我们正在评估扩大与BDD Pharma Limited的关系的机会。
证券发行
自动柜员机 协议
吾等 于2023年1月与H.C.Wainwright&Co.,LLC(“HCW”) 订立经2023年5月修订的市场发售协议(“ATM协议”),根据该协议,吾等可不时透过HCW发售及出售普通股股份,总收益最高达497万美元(按ATM协议所载条款及条件及限制)。在截至2023年9月30日的三个月内,我们根据自动柜员机协议出售了76,943股普通股,在扣除对HCW的49,502美元补偿和其他行政费用后,净收益为1,595,429美元。于截至2023年9月30日止九个月内,吾等根据自动柜员机协议售出82,410股普通股,扣除向本公司支付的59,898美元补偿及其他行政费用后,所得款项净额为1,696,407美元。2023年9月30日之后,我们根据自动柜员机协议出售了283,300股普通股 ,扣除对HCW的97,512美元补偿和其他管理费用后,净收益为3,115,303美元
股权 信用额度
2023年4月,我们与林肯公园资本基金有限责任公司(“林肯公园”)签订了购买协议(“林肯公园协议”)。根据林肯公园协议,林肯公园已同意在林肯公园协议的36个月期限内,根据林肯公园协议中规定的条款和条件和限制,不时并由我们自行决定从我们购买总计1200万美元的普通股 。在截至2023年9月30日的三个月中,我们根据林肯公园协议出售了12,000股普通股,净收益为196,167美元。在截至2023年9月30日的9个月内,我们根据林肯公园协议出售了25,500股普通股,净收益为450,427美元。此后至2023年9月30日,我们没有根据林肯公园协议出售任何普通股。
私人配售
于2023年8月11日,吾等与WFIA订立证券购买协议(“2023年8月购买协议”) ,并根据纳斯达克证券市场规则,以私募方式按市场定价发行91,158股本公司普通股,每股收购价为10.97美元,为吾等带来约100万美元的毛收入( “WFIA私募”)。
债务 折算
2022年8月,Cingate Inc.的全资子公司CTX向WFIA发行了本金为500万美元(“原始本金”)的原始票据,并于2023年5月发行了经修订和重订的承诺票 票据(“WFIA票据”),将原始票据下的本金金额增加了300万美元至800万美元( “2023年WFIA债务融资”)。
于2023年9月8日,Cingate Inc.及CTX与WFIA订立票据转换协议,据此,WFIA同意将WFIA票据项下的原始本金金额连同其所有应计利息,或5,812,500美元,转换为预资金权证 (下称“9月WFIA预资资权证”),以购买341,912股本公司普通股,换算价为每股1,341,912股WFIA预资资权证,折算价为17.00美元。2023年9月8日,我们普通股在纳斯达克的收盘价为每股11.55美元。九月份的WFIA预筹资认股权证没有到期日,可立即以每股0.002美元的行使价行使,但在行使后,就交易法第13(D)节的目的而言,WFIA及其关联公司将实益拥有不超过19.99%的普通股流通股。
于2024年1月25日,Cingate Inc.及CTX与WFIA订立票据转换协议(“2024年1月票据转换协议”) ,据此,WFIA同意将WFIA票据项下剩余的3,000,000美元本金连同其所有应计利息(或3,287,500美元)转换为预资金权证(“1月WFIA预资金权证”),以购买687,043股普通股,按每1月WFIA预资金权证4.785美元的转换价计算。2024年1月24日,纳斯达克普通股的收盘价为4.35美元。1月份的WFIA预筹资认股权证没有到期日,可立即以每股0.0001美元的行使价行使,条件是根据交易法第13(D)条的规定,WFIA及其关联公司将实益拥有不超过我们普通股已发行股份的19.99%。
| 102 |
WFIA票据为无抵押债券,年利率为15%。未偿还本金以及所有应计和未付利息应于2025年8月8日到期并支付,除非因违约事件而加速。WFIA有权在每个日历季度的前五个营业日内要求我们在通知我们后120天内支付所有未偿还的本金和利息。我们 获准预付全部或部分WFIA票据,没有溢价或罚款;前提是不允许再借入任何已偿还的金额 。截至2023年9月30日,WFIA票据的本金为300万美元,应计利息为20万美元。 在转换剩余本金金额加上其所有应计利息并发行1月份WFIA预融资权证后,WFIA票据已全额支付,本公司根据WFIA票据不再承担任何义务。请参阅下面的“流动性和资本资源”。
公开服务
于2023年9月11日,吾等与一名机构投资者订立证券购买协议,根据该协议,吾等发行86,000股普通股、预融资权证以购买合共260,260股普通股、A系列认股权证 购买最多346,260股普通股及B系列认股权证购买最多173,130股普通股( “2023年9月发售”)。2023年9月的股票发行于2023年9月13日结束。普通股及配套A系列和B系列认股权证的合并购买价为每股11.55美元。每股预筹资权证和配套A系列和B系列认股权证的合并购买价为11.55美元,代表普通股和配套认股权证的每股公开发行价减去每股预融资认股权证的每股0.002美元的行权价。预筹资权证可在发行日期后的任何时间行使,且没有到期日。如果预筹资权证持有人连同其联属公司在行使认股权证后将实益拥有超过4.99%(或在持有人选择时,为9.99%)的已发行普通股数目 ,则该持有人不得行使该等认股权证。A系列认股权证的行使价为每股11.55美元,可于2023年11月3日,即股东批准发行可在行使认股权证时发行的股份的生效日期行使,并将在初始行使日后五年到期;而B系列认股权证的行使价为每股11.55美元,可于2023年11月3日,即股东批准行使认股权证可发行股份的生效日期开始行使,并将在初始行使日后两年到期。根据2023年9月的发售,在扣除配售代理费和其他发售费用之前,我们收到了约400万美元的毛收入。
经营成果的组成部分
收入
自 成立以来,我们没有产生任何收入,也不希望在不久的将来从产品销售中产生任何收入。 如果我们对候选产品的开发工作取得成功并获得监管部门的批准,或者如果我们与第三方签订了协作 或许可协议,我们未来可能会从产品销售或 协作许可协议的付款中获得收入。
运营费用
研究和开发费用
研究和开发费用包括发现和开发我们的候选产品所产生的成本,主要包括:
| ● | 根据与进行或将进行我们的临床试验和部分临床前活动的CRO和调查地点的第三方协议而发生的费用; |
| 103 |
| ● | 原材料成本,以及我们用于临床试验和其他开发测试的材料的制造成本; |
| ● | 费用,包括从事研究和开发活动的员工的工资和福利; |
| ● | 制造设备成本、折旧和其他分摊费用;以及 |
| ● | 为合同监管服务支付的费用 ,以及支付给监管机构(包括FDA)审批我们的候选产品的费用 。 |
我们 按已发生的费用支出所有研发成本,但研发中使用的制造设备除外,这些设备已资本化并在其预计使用寿命内摊销。外部开发活动的成本是根据使用供应商提供给我们的信息对完成特定任务的进度进行评估而确认的。这些活动的付款基于单个协议的条款,这些条款可能与发生的成本模式不同,并作为预付或应计成本反映在我们的合并财务报表中。
研究和开发活动是我们业务模式的核心。我们预计,在可预见的未来,随着我们继续为我们的候选产品进行临床开发,我们的研发费用将继续增加。随着产品进入临床开发的后期阶段,它们的开发成本通常会高于临床开发的早期阶段,这主要是因为后期临床试验的规模和持续时间都有所增加。从历史上看,我们的研发成本主要与CTX-1301的开发有关。随着我们推进CTX-1301、CTX-1302和CTX-2103,以及确定任何其他潜在的候选产品,我们将继续将我们的直接外部研发成本分配给这些产品。我们预计将从我们目前的现金和现金等价物以及任何未来的股权或债务融资或其他资本来源中为我们的研发费用提供资金。
一般费用 和管理费用
一般费用和行政费用主要包括员工在行政、行政和财务职能方面的工资和相关成本 。一般和行政费用还包括法律、会计、审计、税务和咨询服务的专业费用,以及保险、办公室和差旅费用。
我们 预计未来我们的一般和管理费用将增加,因为我们增加了一般和管理人员 以支持我们不断增长的运营,包括我们候选产品的潜在商业化。我们经历了与上市公司相关的费用增加,包括会计、审计、法律、监管和税务合规服务的成本; 董事和高管保险;以及投资者和公关成本。
利息 和其他收入(费用),净额
利息 和其他收入(支出),净额包括应付关联方票据的利息支出以及我们的现金和现金等价物(包括货币市场基金)所赚取的利息。我们投资政策的主要目标是流动性和保本。
关键的会计政策和重要的判断和估计
我们的 合并财务报表是根据美国公认会计原则(“U.S. GAAP”)编制的。根据美国公认会计原则编制合并财务报表要求管理层作出估计 和假设,以影响报告的资产和负债额、截至合并财务报表的日期的或有资产和负债的披露以及报告期内的报告的费用金额。实际结果可能 与估计不同。
| 104 |
虽然我们的主要会计政策在我们的综合财务报表附注2中有更详细的描述,但我们认为以下会计政策对我们编制综合财务报表所使用的判断和估计是最关键的。
研究和开发成本
研究和开发成本在发生时计入费用,包括与我们的候选产品开发相关的所有直接和间接成本 。这些费用包括支付给第三方的研发和制造服务、人员成本和制造设备的折旧。在报告期末,我们将向第三方服务提供商支付的款项与在完成研究或开发目标方面的估计进度进行比较。随着更多 信息可用,此类估计可能会发生变化。根据向服务提供商付款的时间和我们估计由于所提供的服务而取得的进展,我们可能会记录与这些成本相关的预付或应计费用净额。
基于股票的薪酬
根据2021年计划,我们在2022年和2021年向某些员工和董事授予了非限制性股票期权。这些期权在2022年以每股20美元至31.4美元的行使价授予,2021年的行使价为每股120.00美元,这是与我们的首次公开募股相关的普通股向公众发行的价格。这些期权的期限为十年,归属期限从即期到四年不等。
在截至2022年12月31日和2021年12月31日的年度内,根据授予期权的授予日期公允价值,我们 分别记录了800,796美元和43,835美元的股票薪酬支出。每个期权授予的公允价值是在授予之日使用布莱克-斯科尔斯期权定价模型估计的。公允价值在奖励的必要服务期间(通常是归属期间)按直线摊销为补偿成本。
有关使用布莱克-斯科尔斯期权定价模型估计授予的股票期权的公允价值的假设,请参阅我们的合并财务报表脚注11。
经营成果
截至2023年9月30日和2022年9月30日的三个月的比较:
下表汇总了截至2023年9月30日和2022年9月30日的三个月的运营结果:
| 截至三个月 个月 | % | |||||||||||||||
| 9月30日 | 增加 | 增加 | ||||||||||||||
| (单位:千) | 2023 | 2022 | (减少) | (减少) | ||||||||||||
| 运营费用 : | ||||||||||||||||
| 研发 | $ | 3,924 | $ | 2,123 | $ | 1,801 | 84.8 | % | ||||||||
| 常规 和管理 | 1,826 | 1,845 | (19 | ) | -1.0 | % | ||||||||||
| 运营亏损 | (5,750 | ) | (3,968 | ) | 1,782 | (44.9 | )% | |||||||||
| 利息 和其他收入(费用),净额 | (229 | ) | (59 | ) | (170 | ) | NM | |||||||||
| 净亏损 | $ | (5,979 | ) | $ | (4,027 | ) | $ | 1,612 | (40.0 | )% | ||||||
| 105 |
研发费用
下表汇总了截至2023年9月30日和2022年9月30日的三个月的研发(R&D)费用:
| 截至三个月 个月 | % | |||||||||||||||
| 9月30日 | 增加 | 增加 | ||||||||||||||
| (单位:千) | 2023 | 2022 | (减少) | (减少) | ||||||||||||
| 临床 手术 | $ | 2,346 | $ | 581 | $ | 1,765 | 303.8 | % | ||||||||
| 药品 生产和配方 | 817 | 673 | 144 | 21.4 | % | |||||||||||
| 人事费用 | 644 | 860 | (216 | ) | (25.1 | )% | ||||||||||
| 监管成本 | 117 | 9 | 108 | NM | ||||||||||||
| 研发费用总额 | $ | 3,924 | $ | 2,123 | $ | 1,801 | 84.8 | % | ||||||||
截至2023年9月30日的三个月,研发费用为390万美元,比截至2022年9月30日的三个月增加了180万美元,增幅为84.8%。这一变化主要是与2022年同期相比临床活动增加的结果。 在2023年第三季度,我们启动了CTX-1301的两项第三阶段研究,即儿科剂量优化开始和持续时间研究 以及固定剂量儿科和青少年安全性和有效性研究。此外,CTX-1301的第三阶段成人剂量优化研究已于2023年6月完成。
一般费用和管理费用
下表汇总了截至2023年9月30日和2022年9月30日的三个月的一般和行政(G&A)费用:
| 一般费用 和管理费用 | ||||||||||||||||
| 截至三个月 个月 | % | |||||||||||||||
| 9月30日 | 增加 | 增加 | ||||||||||||||
| (单位:千) | 2023 | 2022 | (减少) | (减少) | ||||||||||||
| 人事费用 | $ | 672 | $ | 595 | $ | 77 | 12.9 | % | ||||||||
| 律师费和律师费 | 511 | 373 | 138 | 37.0 | % | |||||||||||
| 入住率 | 144 | 109 | 35 | 32.1 | % | |||||||||||
| 保险 | 398 | 669 | (271 | ) | (40.5 | )% | ||||||||||
| 其他 | 101 | 99 | 2 | (2.0 | )% | |||||||||||
| 一般和行政费用合计 | $ | 1,826 | $ | 1,845 | $ | (19 | ) | (1.0 | )% | |||||||
截至2023年9月30日的三个月的G&A总支出与截至2022年9月30日的三个月持平,这主要是由于保险成本下降,这与2022年12月续签的年度董事和高级管理人员保单保费下降有关,但被2023年第三季度与筹资活动相关的法律费用增加所抵消。
利息 和其他收入(费用),净额
下表汇总了截至2023年9月30日和2022年9月30日的三个月的利息和其他收入(费用)净额:
| 利息 和其他收入(费用): | ||||||||||||||||
| 截至三个月 个月 | % | |||||||||||||||
| 9月30日 | 增加 | 增加 | ||||||||||||||
| (单位:千) | 2023 | 2022 | (减少) | (减少) | ||||||||||||
| 利息 和其他收入(费用),净额 | $ | (229 | ) | $ | (59 | ) | $ | (171 | ) | (289.8 | )% | |||||
截至2023年9月30日止三个月的利息及其他收入(开支)净额总额主要与WFIA票据项下800万美元本金的利息有关,其中500万美元本金已于2023年9月初转换为权益。
截至2022年9月30日止三个月的利息及其他收入(开支)净额总额主要与日期为2022年8月的WFIA票据项下初始500万美元本金的利息有关,并被期内赚取的利息抵销。
| 106 |
截至二零二三年九月三十日止九个月与二零二二年九月三十日止九个月的比较 :
下表概述我们截至2023年9月30日及2022年9月30日止九个月的经营业绩:
| 截至9个月 个月 | % | |||||||||||||||
| 9月30日 | 增加 | 增加 | ||||||||||||||
| (单位:千) | 2023 | 2022 | (减少) | (减少) | ||||||||||||
| 运营费用 : | ||||||||||||||||
| 研发 | $ | 10,508 | $ | 7,064 | $ | 3,444 | 48.8 | % | ||||||||
| 常规 和管理 | 5,454 | 5,963 | (509 | ) | (8.5 | )% | ||||||||||
| 运营亏损 | (15,962 | ) | (13,027 | ) | 2,935 | (22.5 | )% | |||||||||
| 利息 和其他收入(费用),净额 | (638 | ) | (44 | ) | 594 | NM | ||||||||||
| 净亏损 | $ | (16,600 | ) | $ | (13,071 | ) | $ | 3,529 | (27.0 | )% | ||||||
研发费用
下表汇总了截至2023年9月30日和2022年9月30日的9个月的研发费用:
| 截至9个月 个月 | % | |||||||||||||||
| 9月30日 | 增加 | 增加 | ||||||||||||||
| (单位:千) | 2023 | 2022 | (减少) | (减少) | ||||||||||||
| 临床 手术 | $ | 5,071 | $ | 2,082 | $ | 2,989 | 143.6 | % | ||||||||
| 药品 生产和配方 | 3,254 | 2,827 | 427 | 15.1 | % | |||||||||||
| 人事费用 | 1,902 | 2,097 | (195 | ) | (9.3 | )% | ||||||||||
| 监管成本 | 281 | 58 | 223 | 384.5 | % | |||||||||||
| 研发费用总额 | $ | 10,508 | $ | 7,064 | $ | 3,444 | 48.8 | % | ||||||||
截至2023年9月30日的9个月,研发费用为1,050万美元,比截至2022年9月30日的9个月增加了340万美元,增幅为48.8%。这一增长主要是由于与2022年同期相比,临床活动显著增加所致。我们于2022年底启动了CTX-1301的第三阶段成人剂量优化研究,并于2023年6月完成。此外,我们还产生了与关键的第三阶段儿童和青少年固定剂量安全性和有效性研究以及第三阶段儿童剂量优化开始和持续时间研究有关的费用,这两项研究都是在2023年第三季度启动的CTX-1301。制造业活动在2023年也有所增加,因为我们完成了CTX-1301第三阶段研究的临床用品的制造。
一般费用和管理费用
下表汇总了截至2023年9月30日和2022年9月30日的9个月的G&A费用:
| 截至9个月 个月 | % | |||||||||||||||
| 9月30日 | 增加 | 增加 | ||||||||||||||
| (单位:千) | 2023 | 2022 | (减少) | (减少) | ||||||||||||
| 人事费用 | $ | 2,023 | $ | 1,803 | $ | 220 | 12.2 | % | ||||||||
| 律师费和律师费 | 1,495 | 1,422 | 73 | 5.1 | % | |||||||||||
| 入住率 | 396 | 353 | 43 | 12.2 | % | |||||||||||
| 保险 | 1,173 | 2,013 | (840 | ) | (41.7 | )% | ||||||||||
| 其他 | 367 | 372 | (5 | ) | (1.3 | )% | ||||||||||
| 一般和行政费用合计 | $ | 5,454 | $ | 5,963 | $ | (509 | ) | (8.5 | )% | |||||||
| 107 |
截至2023年9月30日的9个月,G&A总支出为540万美元,比截至2022年9月30日的9个月减少了50万美元,降幅为8.5%。这一变化主要是由于2022年12月续签的年度董事和高级管理人员保单保费下降导致保险成本减少80万美元,但因增加临床人员和增加年度薪酬而导致的人员费用增加 抵消了这一影响。
利息 和其他收入(费用),净额
下表汇总了截至2023年9月30日和2022年9月30日的9个月的利息和其他收入(费用)净额:
| 截至9个月 个月 | % | |||||||||||||||
| 9月30日 | 增加 | 增加 | ||||||||||||||
| (单位:千) | 2023 | 2022 | (减少) | (减少) | ||||||||||||
| 利息 和其他收入(费用),净额 | $ | (638 | ) | $ | (44 | ) | $ | (594 | ) | NM | ||||||
截至2023年9月30日止九个月的净利息及其他收入(支出)总额,主要与日期为2022年8月的WFIA票据项下最初500万美元本金的利息有关,其后于2023年5月增加至800万美元,并因2023年9月初转为股权而减少500万美元,但投资结余赚取的利息抵销了这笔利息。
截至2022年9月30日的九个月的净利息和其他收入(支出)总额,主要与日期为2022年8月的WFIA票据项下500万美元初始本金的利息相抵销。
截至2022年12月31日和2021年12月31日的年度比较
下表概述我们截至二零二二年及二零二一年十二月三十一日止年度的经营业绩:
| 年 结束 | % | |||||||||||||||
| 12月31日, | 增加 | 增加 | ||||||||||||||
| (单位:千) | 2022 | 2021 | (减少) | (减少) | ||||||||||||
| 运营费用 : | ||||||||||||||||
| 研发 | $ | 8,995 | $ | 8,410 | $ | 585 | 7.0 | % | ||||||||
| 常规 和管理 | 8,507 | 12,269 | (3,762 | ) | (30.7 | )% | ||||||||||
| 运营亏损 | (17,502 | ) | (20,679 | ) | (3,177 | ) | 15.4 | % | ||||||||
| 利息 和其他收入(费用),净额 | (174 | ) | (31 | ) | 143 | 461.3 | % | |||||||||
| 净亏损 | $ | (17,676 | ) | $ | (20,710 | ) | $ | (3,034 | ) | 14.6 | % | |||||
研发费用
下表汇总了截至2022年12月31日和2021年12月31日的年度研发费用:
| 年 结束 | % | |||||||||||||||
| 12月31日, | 增加 | 增加 | ||||||||||||||
| (单位:千) | 2022 | 2021 | (减少) | (减少) | ||||||||||||
| 临床 手术 | $ | 3,534 | $ | 1,086 | $ | 2,448 | 225.4 | % | ||||||||
| 药品 生产和配方 | 2,840 | 1,429 | 1,411 | 98.7 | % | |||||||||||
| 人事费用 | 2,521 | 5,874 | (3,353 | ) | (57.1 | )% | ||||||||||
| 监管成本 | 100 | 21 | 79 | 376.2 | % | |||||||||||
| 研发费用总额 | $ | 8,995 | $ | 8,410 | $ | 585 | 7.0 | % | ||||||||
| 108 |
截至2022年12月31日的年度研发费用为900万美元,比截至2021年12月31日的年度增加60万美元或7.0%。这一增长与CTX-1301的临床和制造成本显著增加有关,因为我们在2022年第四季度完成了食品 效应研究,并于2022年底启动了第三阶段成人剂量优化研究。此外,与生产CTX-1301第三阶段试验的临床用品相关,我们的制造成本在2022年有所增加。这些增加被 由于将460万美元计入2021年研发费用而导致的人员费用减少所抵消,这是因为修改PIUS的一次性非现金补偿费用 。由于一次性非现金费用导致的人员支出减少被2022年的年度加薪和预计临床活动增加而在2021年末增加的人员所抵消。
一般费用和管理费用
下表汇总了截至2022年12月31日和2021年12月31日的年度G&A费用:
| 年 结束 | % | |||||||||||||||
| 12月31日, | 增加 | 增加 | ||||||||||||||
| (单位:千) | 2022 | 2021 | (减少) | (减少) | ||||||||||||
| 人事费用 | $ | 2,590 | $ | 9,729 | $ | (7,139 | ) | (73.4 | )% | |||||||
| 律师费和律师费 | 2,233 | 1,443 | 790 | 54.7 | % | |||||||||||
| 入住率 | 478 | 484 | (6 | ) | (0.01 | ) | ||||||||||
| 保险 | 2,611 | 325 | 2,286 | 703.4 | % | |||||||||||
| 其他 | 595 | 288 | 307 | 106.6 | % | |||||||||||
| 一般和行政费用合计 | $ | 8,507 | $ | 12,269 | $ | (3,762 | ) | (30.7 | )% | |||||||
截至2022年12月31日止年度,G&A费用总额为850万美元,较截至2021年12月31日止年度减少380万美元或30. 7%。人员开支减少710万元或73.4%,主要与2021年将810万元计入G&A人员开支有关,该笔一次性非现金补偿费用与利润权益单位(“PIU”)的修改有关。 由于非现金补偿费用导致的人员费用减少被由于 2021年底我们准备作为上市公司运营而增加的人员导致的工资费用增加所抵消。人员开支的减少被其他开支的增加所抵销,包括法律费用及审计费用,主要由于2022年底为准备未来资本筹集而增加的活动。此外,由于董事和高级管理人员的保险费 比上市公司高得多,保险成本同比大幅增加。
利息 和其他收入(费用),净额
下表概述截至二零二二年及二零二一年十二月三十一日止年度的利息及其他收入(开支)净额:
| 年 结束 | % | |||||||||||||||
| 12月31日, | 增加 | 增加 | ||||||||||||||
| (单位:千) | 2022 | 2021 | (减少) | (减少) | ||||||||||||
| 利息 和其他收入(费用),净额 | $ | (174 | ) | $ | (31 | ) | $ | 143 | 461.3 | % | ||||||
2022年及2021年的利息及其他收入(开支)净额总额 主要与未偿还应付票据产生的利息有关, 被投资结余赚取的利息抵销。2022年的利息支出大幅增加,原因是2022年8月应付WFIA的500万美元关联方票据产生了30万美元的利息。
| 109 |
现金流
截至9月30日的九个 月, | ||||||||
| 2023 | 2022 | |||||||
| 净额 现金(用于)经营活动 | $ | (12,472 | ) | $ | (11,676 | ) | ||
| 净额 用于投资活动的现金 | (37 | ) | (10 | ) | ||||
| 净额 融资活动提供的现金 | 9,139 | 4,989 | ||||||
| 现金和现金等价物净减少 | $ | (3,370 | ) | $ | (6,697 | ) | ||
经营活动的现金流
截至2023年9月30日止九个月,经营活动所用现金净额为1250万美元。经营活动中使用的现金 主要是由于在我们的运营中使用资金来开发我们的候选产品,导致净亏损1660万美元, 这是两个非现金项目的影响,即70万美元的股票补偿费用和40万美元的折旧费用。运营资产和负债的变化 包括杂项应收款减少20万美元,主要是由于收取了一笔保险索赔的可收回金额,该金额截至2022年12月31日已记录为应收款,预付费用 和其他流动资产减少$140万美元主要是由于使用了向我们的CMO和合同研究组织提供的存款, 由于临床和制造费用增加,导致贸易应付账款和应计费用增加150万美元 开发活动增加、WFIA票据应计利息增加以及与主要与资本筹集活动有关的法律活动相关的应付法律费用增加。
截至2022年9月30日止九个月,经营活动所用现金净额为1170万美元。经营活动中使用的现金 主要是由于在我们的运营中使用资金开发我们的候选产品,导致净亏损1280万美元, 这是两个非现金项目的影响,即60万美元的股票补偿费用和30万美元的折旧。经营 资产和负债的变化包括由于2022年初收到了拖欠我们的大部分工资和研发税收抵免而导致的杂项应收款项减少,以及与临床开发活动预付款项相关的预付费用和其他流动资产增加。
投资活动的现金流
截至2023年9月30日及2022年9月30日止九个月期间投资活动所用现金净额与 购买设备以支持我们的研发有关。
融资活动的现金流
截至2023年9月30日的九个月,融资活动提供的净现金主要与2023年9月发行的约400万美元的总收益、WFIA私募配售的约100万美元的总收益以及根据林肯公园协议和ATM协议发行普通股的收益有关。此外,我们还从2023年WFIA债务融资中获得了300万美元。
截至2022年9月30日止九个月,融资活动提供的现金净额主要与2022年8月收到的500万美元 WFIA票据的所得款项有关。
| 年 结束 | ||||||||
| 12月31日, | ||||||||
| 2022 | 2021 | |||||||
| 净额 现金(用于)经营活动 | $ | (15,882 | ) | $ | (10,432 | ) | ||
| 净额 用于投资活动的现金 | (153 | ) | (815 | ) | ||||
| 净额 融资活动提供的现金 | 4,899 | 26,542 | ||||||
| 现金和现金等价物净增加(减少) | $ | (11,136 | ) | $ | 15,295 | |||
| 110 |
经营活动的现金流
截至2022年12月31日止年度,经营活动所用现金净额为1,590万美元。经营活动中使用的现金主要是 由于我们在运营中使用资金开发我们的候选产品,导致净亏损1,770万美元, 未考虑两个重要的非现金项目的影响,即80万美元的股票补偿费用和40万美元的折旧费用。 经营资产和负债的变化包括由于2022年收取研究和 开发和员工保留税抵免而导致的杂项应收款项减少50万美元,以及由于向临床和制造供应商支付的与启动CTx-3期研究有关的存款而导致的预付费用增加40万美元。1301,并将存款存入我们的新CMO以进行制造 活动。
截至2021年12月31日止年度,经营活动所用现金净额为1040万美元。经营活动中使用的现金主要是 由于我们在运营中使用资金开发我们的候选产品,导致净亏损2070万美元, 在两个重要的非现金项目,一次性非现金PIU费用1270万美元和折旧费用70万美元的影响之前。运营资产和负债的变动 包括应付账款和应计费用减少130万美元,主要是由于支付了 2021年12月支付的所有拖欠员工的递延工资。预付费用也增加了120万美元 ,主要与我们年度董事和高级职员保险费的首付款有关,该保险费在我们完成IPO时大幅增加。
投资活动的现金流
截至2022年12月31日及2021年12月31日止年度,投资活动所用现金净额主要与购买设备以支持我们的研发有关。
融资活动的现金流
截至2022年12月31日止年度,融资活动提供的现金净额主要与应付WFIA的500万美元关联方票据的所得款项有关。
截至2021年12月31日止年度,融资活动提供的净 现金主要与发行208,333股 普通股及随附认股权证有关,该发行与我们的IPO有关,每股普通股及随附认股权证的股价为120.00美元。我们收到的总收益为2500万美元,扣除承销商折扣和我们支付的发行费用后,净收益为2040万美元。我们还收到了710万美元,涉及在我们IPO之前发行CTx的3,243,201个股权单位。我们于2021年12月支付了 50万美元用于偿还关联方的应付票据。
流动性 与资本资源
流动资金来源
自2012年成立以来至2023年9月30日,我们没有产生收入,并因运营而出现重大运营亏损和负现金流 。我们相信,根据我们目前的业务计划,此次发行的净收益,加上我们手头的现金,将满足我们到2024年第二季度末的资本需求。此次发行后,我们将需要筹集 额外资金来支持我们的运营,并继续支持我们计划的开发和商业化活动。
在截至2023年9月30日的三个月内,我们根据ATM协议出售了76,943股普通股,扣除向HCW支付的49,502美元赔偿金和其他行政费用后,所得款项净额为1,595,429美元。在截至2023年9月30日的九个月内,我们根据ATM协议出售了 82,410股普通股,扣除向 HCW支付的59,898美元补偿金和其他行政费用后,所得款项净额为1,696,407美元。于二零二三年九月三十日后,我们并无根据自动柜员机协议出售任何普通股股份。
| 111 |
在截至2023年9月30日的三个月内,我们根据林肯公园协议出售了12,000股普通股,净收益为196,167美元。在截至2023年9月30日的九个月内,我们根据林肯公园协议出售了25,500股普通股,净收益为450,427美元。在2023年9月30日之后,我们根据ATM协议出售了283,800股普通股, 扣除向HCW支付的97,512美元赔偿金和其他行政费用后,所得款项净额为3,115,303美元。
2023年8月11日,根据WFIA私募,我们收到了约100万美元的总收益。
在 2023年9月13日,根据2023年9月的发行,我们收到了约400万美元的总收益,扣除配售代理的费用和其他 发行费用之前。
管理层 还在评估获得资金的其他策略,其中可能包括额外的股权发行、债券发行或其他 资本来源,包括与其他公司的潜在合作或其他战略交易。
为了在2025年上半年完成CTx-1301的NDA备案, 对于FDA 的潜在批准,在此次发行之后,我们相信我们将需要大约800万至1000万美元的额外资本。我们 还需要额外资金来推进我们的其他计划和商业化努力。然而,在获得FDA批准之前,很难预测我们在候选产品上的支出。此外,不断变化的情况可能会导致我们花费现金的速度比我们目前预期的要快得多,而且由于我们无法控制的情况,我们可能需要花费比目前预期更多的现金。
我们的 政策是将任何超出我们当前需求的现金投资于旨在保持本金余额和提供流动性的投资,同时产生适度的投资回报。因此,我们的现金等价物主要投资于货币市场基金 ,在当前的利率环境下,这些基金目前只提供最低回报。
我们 预计至少在未来几年内,随着我们继续开发我们的候选产品并寻求市场批准,并在获得批准后最终将我们的产品 商业化,我们将继续招致大量的额外运营亏损。如果我们的候选产品获得市场批准,我们将产生大量的销售、营销和外包制造费用 。此外,我们预计会产生额外费用来增加运营、财务和信息系统以及人员,包括支持我们计划的产品商业化努力的人员。我们还预计在遵守适用于我们作为上市公司的公司治理、内部控制和类似要求方面会产生巨额成本。
我们 未来运营现金和资本需求的使用将取决于许多前瞻性因素,包括:
| ● | 生产我们的候选产品的临床供应的成本和时间; |
| ● | 我们候选产品的临床试验的启动、进度、时间、成本和结果; |
| ● | 我们为每个候选产品制定的临床开发计划; |
| ● | 我们开发或可能获得许可的候选产品的数量和特征; |
| ● | 我们可能选择执行的任何协作或许可协议的条款; |
| ● | 满足FDA或其他类似外国监管机构制定的监管要求的结果、时间和成本; |
| ● | 提交、起诉、辩护和执行我们的专利主张和其他知识产权的费用; |
| ● | 为知识产权纠纷辩护的费用,包括第三方对我们提起的专利侵权诉讼; |
| ● | 实施商业规模制造活动的成本和时间;以及 |
| 112 |
| ● | 将我们的商业化工作外包的成本和时间,包括我们选择将产品商业化的地区可能获得监管批准的任何候选产品的销售、营销和分销能力 。 |
为了使我们的业务长期持续增长,我们计划投入大量资源进行研发,包括我们候选产品的临床 试验,以及其他运营和潜在的产品收购和许可。我们已经进行了评估,并预计 将继续评估一系列战略交易,作为我们收购或授权和开发其他产品和候选产品的计划的一部分,以增强我们的内部开发渠道。我们可能寻求的战略交易机会可能会对我们的流动性和资本资源产生重大影响,并可能要求我们产生额外的债务或寻求股权资本,或两者兼而有之。此外, 我们可能会在新的或现有的治疗领域对已批准或正在开发的产品进行开发、收购或授权,或者继续 扩展我们现有的业务。因此,我们预计将继续机会主义地寻求获得额外资本的途径,以 许可或收购其他产品、候选产品或公司,以扩大我们的业务,或用于一般公司目的。 战略交易可能需要我们通过一项或多项公共或私人债务或股权融资来筹集额外资本,或者 可以被构建为合作或合作安排。我们目前没有达成任何收购、许可或类似战略业务交易的安排、协议或谅解。2023年3月,我们与Indegene,Inc.签订了 联合商业化协议,该协议将在FDA批准的情况下为我们提供CTX-1301的商业化服务,包括营销、销售、市场准入和分销,并收取服务费。
如果 我们通过发行股权证券筹集额外资金,或者如果我们的债务转换为股权,我们的股东将面临稀释。 债务融资(如果可用)将导致固定支付义务增加,并可能涉及一些协议,其中包括限制 或限制我们采取特定行动的能力的协议,例如产生额外债务、进行资本支出或宣布股息。 我们筹集的任何债务融资或额外股本可能包含对我们或我们现有股东不利的条款,如清算和其他优惠。如果我们通过与第三方的协作和许可安排筹集更多资金, 可能需要放弃对我们的技术、未来收入流或候选产品的宝贵权利,或者以可能对我们不利的条款授予许可证 。在可接受的条件下,我们可能无法获得足够的资金,或者根本没有。如果我们未能在需要时筹集资金或达成此类协议,我们可能不得不大幅推迟、缩减或停止我们候选产品的开发和商业化 。
合同义务
以下 汇总了我们截至2023年9月30日的合同义务,这些义务将影响我们未来的流动性。
我们 于2018年8月与BDD Pharma Limited签订了专利和专有技术许可协议。有关本协议的说明,请参见本招股说明书的“业务-材料协议” 部分。我们需要向BDD Pharma支付与 临床试验和法规里程碑相关的一定金额。第一笔25万美元的里程碑式付款是在2023年2月支付的,当时CTX-1301的第三阶段成人发病和持续时间研究中的第一名患者服用了药物。额外付款将在完成协议中定义的某些里程碑后 到期。
我们 已与CRO就CTx-1301的关键III期固定剂量儿科和青少年安全性和疗效研究 (于2023年7月下旬开始)以及III期儿科剂量优化、起效和持续时间研究 (于2023年8月上旬开始)达成协议。我们已与CDMO和其他第三方就CTx-1301注册批次的生产达成协议, 提交NDA需要CTx-1301。我们还与Indegene,Inc.达成了联合商业化协议,根据 该协议,Indegene将在获得FDA批准后为CTx-1301提供商业化服务,包括营销、销售、市场 准入和分销,并按服务收费。这些合同不包含任何最低购买承诺,我们可以在事先书面通知的情况下取消。取消时的应付款项仅包括所提供服务的付款或所产生的费用, 包括我们服务提供商的不可取消义务,直至取消日期,以及在某些情况下,逐步减少的成本和恢复成本 。此类债务的确切金额取决于终止的时间和相关协议的条款, 目前尚不清楚。
| 113 |
正在进行 关注
Since inception we have been engaged in organizational activities, including raising capital and research and development activities. We have not generated revenues and have not yet achieved profitable operations, nor have we ever generated positive cash flow from operations. There is no assurance that profitable operations, if achieved, could be sustained on a continuing basis. We are subject to those risks associated with any pre-clinical stage pharmaceutical company that has substantial expenditures for research and development. There can be no assurance that our research and development projects will be successful, that products developed will obtain necessary regulatory approval, or that any approved product will be commercially viable. In addition, we operate in an environment of rapid technological change that is largely dependent on the services of our employees and consultants. Further, our future operations are dependent on the success of our efforts to raise additional capital. These uncertainties raise substantial doubt about our ability to continue as a going concern for one year after the issuance date of our financial statements. The accompanying consolidated financial statements have been prepared on a going concern basis. The consolidated financial statements do not include any adjustments to reflect the possible future effects on the recoverability and classification of assets or the amounts and classification of liabilities that may result from the possible inability of the company to continue as a going concern, which contemplates the continuation of operations, realization of assets and liquidation of liabilities in the ordinary course of business. We have incurred a net loss for the three and nine-month periods ending September 30, 2023 and 2022 and had accumulated losses of $86.0 million since inception to September 30, 2023. We anticipate incurring additional losses until such time, if ever, that we can generate significant revenue from our product candidates currently in development. Our sources of capital have included private capital raises in various classes of units of CTx prior to the Reorganization Merger, the issuance of equity securities in connection with our initial public offering, the ATM Agreement, the Lincoln Park Agreement, the WFIA Debt Financing, the WFIA Private Placement and the September 2023 Offering. Additional financings will be needed by us to fund our operations and to complete development of and commercialize our product candidates. See “Liquidity and Capital Resources” above for details relating to these agreements which we have entered into in 2023 as potential sources of additional capital. There is no assurance that such financing will be available when needed or on acceptable terms.
最近 发布的会计准则
2016年6月,FASB发布了ASU 2016-13,金融工具信用损失的计量这显著改变了实体确认许多金融资产减值的方式,要求立即确认预计在其剩余寿命内发生的估计信贷损失,而不是发生时。2018年11月,FASB发布了ASU 2018-19,对主题326《金融工具--信贷损失》的编纂改进 修订了小主题326-20(由ASU 2016-13创建),明确指出 经营租赁应收账款不在小主题326-20的范围内。此外,在2019年4月,FASB发布了ASU 2019-04,编纂 对主题326(金融工具--信贷损失)、主题815(衍生工具和对冲)和主题825(金融工具)的改进; 2019年5月,FASB发布了ASU 2019-05,金融工具--信贷损失(专题326):定向过渡救济;2019年11月,FASB发布了ASU 2019-10,金融工具-信贷损失(主题326)、衍生工具和对冲(主题 815)和租赁(主题842):生效日期和ASU 2019-11,对主题326《金融工具--信贷损失》的编纂改进 ;2020年3月,FASB发布了ASU 2020-03,金融工具法典化的改进,对ASU 2016-13的某些方面提供进一步的 澄清。这些变化(经修订)在2022年12月15日后开始的会计年度内的年度和中期 生效。本公司预计采用ASU 2016-13年度不会对其合并财务报表产生实质性影响 。
工作 法案
2012年4月5日,《就业法案》签署成为法律。JOBS法案包含的条款除其他外,降低了对“新兴成长型公司”的某些报告要求 。作为一家“新兴成长型公司”,我们选择利用《就业法案》延长的过渡期来实施新的或修订的会计准则,因此,我们将在新兴成长型公司需要采用此类准则的相关日期遵守 新的或修订的会计准则。
在符合JOBS法案中规定的某些条件的情况下,作为一家“新兴成长型公司”,除其他事项外,我们不需要 (I)根据第404条提供关于我们财务报告内部控制制度的审计师证明报告, (Ii)提供根据多德-弗兰克华尔街改革和消费者保护法可能要求非新兴成长型上市公司披露的所有薪酬。(Iii)遵守上市公司会计监督委员会可能采纳的有关强制性审计公司轮换或提供有关审计和财务报表(审计师讨论和分析)补充信息的审计师报告的任何要求,以及(Iv)披露某些与高管薪酬相关的项目,如高管薪酬与业绩之间的相关性,以及首席执行官薪酬与员工薪酬中值的比较 。这些豁免将一直适用到我们的IPO完成五周年,或者直到我们不再 满足作为一家“新兴成长型公司”的要求,以较早发生的为准。
| 114 |
安全 所有权和某些受益所有者和管理
下表列出了截至2024年1月25日我们普通股的受益所有权信息(除非另有说明 ),具体如下:
| ● | 每个 我们所知的个人或团体,实益拥有我们5%以上的普通股; | |
| ● | 我们的每一位董事; | |
| ● | 每个 我们指定的执行官;以及 | |
| ● | 作为一个团队,我们所有的董事和现任高管。 |
我们 根据美国证券交易委员会的规则确定了实益权属。根据这些规则,受益所有权包括个人或实体拥有单独或共享投票权或投资权的任何普通股 。在计算个人或实体实益拥有的 股份数量和该人的持股百分比时,受期权限制的普通股或该人持有的认股权证目前可行使或将于2024年1月25日起60天内可行使的普通股或认股权证被视为已发行股份,尽管在计算任何其他人的持股百分比时,该等股份并不被视为已发行股份。
| 姓名 实益拥有人(1) | 实益拥有的股份数量 | 百分比 的 类别 (二) | ||||||
| 任命了 名执行干事和董事 | ||||||||
| Shane J. Schaffer,药学博士 | 53,305 | (3) | 3.65 | % | ||||
| Laurie A.迈尔斯 | 5,346 | (4) | * | |||||
| Matthew Brams,MD | 33,126 | (5) | 2.28 | % | ||||
| 路易 G. Van Horn,MBA | 10,170 | (6) | * | |||||
| Craig S.吉尔加伦先生 | 12,333 | (7) | * | |||||
| Peter J. Werth | 327,085 | (8) | 19.99 | % | ||||
| 全体董事和高管(6人)(9人) | 451,480 | (10) | 27.24 | % | ||||
| * | 表示 不到1%。 |
| (1) | 除非 除此之外,所有上市股东的地址都是1901 W。堪萨斯州堪萨斯城47号,邮编66205。每个列出的股东 对股东实益拥有的股份拥有唯一的投票权和投资权,除非另有说明, 适用的夫妻财产法。 |
| (2) | 我们 已根据1934年《证券交易法》(经修订)下的规则13d-3确定受益所有权,该规则通常由证券的投票权和/或处置权确定。所有权百分比是基于截至2024年1月25日已发行和已发行的普通股1,450,171股,加上该人在2024年1月25日60天内可行使的期权或认股权证所发行的任何股份。 |
| (3) | 包括 (I)在行使目前可行使的认股权证时可发行的3537股我们的普通股,(Ii)在2024年1月25日起60天内可行使的股票期权可发行7,301股我们的普通股,以及(Iii)Fountainhead Shruged,LLC持有的40,392股普通股。 Schaffer博士是Fountainhead Shirded,LLC的经理,对Fountainhead持有的证券拥有投票权和投资权。不包括在2024年1月25日起60天内不可行使的股票期权行使时可发行的普通股9,558股 。 |
| 115 |
| (4) | 包括可在2024年1月25日起60天内行使的股票期权行使时可发行的2,932股普通股。不包括在2024年1月25日起60天内不可行使的股票期权行使后可发行的3,937股普通股。 |
| (5) | 包括可在2024年1月25日起60天内行使的股票期权行使时可发行的普通股614股。。不包括在2024年1月25日起60天内不可行使的股票期权行使后可发行的986股普通股。 |
| (6) | 包括 (I)Louis G.Van Horn Trust持有的7,081股普通股,19年12月23日。Van Horn先生是Louis G.Van Horn Trust的受托人,19年12月23日,对Louis G.Van Horn Trust持有的证券拥有投票权和投资权。截至2023年12月13日,即Van Horn先生从本公司退休的生效日期,通过行使股票期权可发行2,339股我们的普通股。 |
| (7) | 包括 (I)在行使目前可行使的认股权证时可发行的251股我们的普通股,(Ii)截至2023年12月15日,也就是吉加隆先生从本公司辞职的生效日期,可因行使股票期权而发行的普通股2,339股,以及(3)利默里克集团持有的9,265股普通股。吉尔加隆先生是利默里克集团有限责任公司的唯一成员,对利默里克集团持有的证券拥有投票权和投资权。 |
| (8) | 包括 (I)185,400股可在行使目前可行使的认股权证时发行的普通股,(Ii)675可在2024年1月25日起60天内行使的股票期权可发行的普通股,以及(Iii)由Werth Family Investment Associates持有的139,917股普通股。Werth先生是Werth Family Investment Associates LLC的经理,对Werth Family Investment Associates LLC持有的证券拥有投票权和投资权。不包括(X)975股在行使股票时可发行的普通股 在2024年1月25日起60天内不能行使的期权,以及(Y)843,970股我们普通股的股票由Werth Family Investment Associates LLC持有的预资金权证,该权证禁止持有人在行使后生效后在 范围内行使该等认股权证,持有人(连同持有人的联属公司及与持有人或持有人的任何联营公司作为一个集团行事的任何其他人士)将实益拥有超过19.99%的已发行普通股股份,而该等股份将于紧接本公司于行使预筹资认股权证后可发行的普通股股份的发行生效后发行。 |
| (9) | 包括 名董事和现任高管。 |
| (10) | 不包括在2024年1月25日起60天内不可行使的股票期权行使时可发行的17,284股普通股,以及2024年1月25日起60天内不可行使的843,970股普通股预筹资权证 。 |
| 116 |
某些 关系和关联方交易
以下是自2021年1月1日以来我们参与的交易的描述,其中涉及的金额超过 或将超过(I)120,000美元和(Ii)在过去两个已完成的财政年度中我们的任何董事、高管或超过5%的有投票权证券的持有者或他们的直系亲属的任何成员曾经或将拥有直接或间接重大利益(薪酬安排除外)的最后两个财政年度年底总资产平均值的1%。
相关的 当事人备注
2020年2月26日,CTX向我们的首席医疗官Matthew Brams发行了一张314,000美元的期票(“2月票据”)。 2020年9月30日,我们向Brams先生发行了一张40,000美元的期票(“9月票据”,与2月票据一起, “Brams票据”)。BRAMS债券的应计利息为年息8%。根据Brams博士的选择权,BRAMS票据的本金和应计利息可按转换时报价的25%(25%)的折扣转换为CTX的优先单位。我们有权提前支付这些票据,而不收取违约金或溢价。在2020年12月30日和2020年7月1日,我们分别偿还了100,000美元的2月期票据。2月份的票据最初于2021年2月24日到期,之后又延长了12个月,至2022年2月24日。9月票据最初于2021年9月30日到期,延期至2022年2月24日。2021年7月1日,我们为2月票据支付了10万美元,2021年8月17日,我们为2月票据支付了50,000美元。截至首次公开募股结束,我们分别欠BRAMS票据104,000美元和37,025美元的本金和利息 ,并于2021年12月用IPO所得款项全额支付。
2020年7月25日,CTX向执行副总裁总裁和首席科学官劳尔·R·席尔瓦发行了一张100,000美元的期票(“7月票据”)。七月期票据的应计利息年利率为8%。根据席尔瓦博士的选择,7月份票据的本金和应计利息可转换为CTX的优先单位,价格比转换时的报价有25%(25%)的折扣。我们有权预付这张票据,不收取违约金或保险费。7月份的票据最初于2021年7月24日到期,后来又延长了7个月,至2022年2月24日。截至IPO结束时,我们分别欠7月份票据100,000美元和11,047美元的本金和利息,该票据已于2021年12月用IPO所得全额支付。
2020年2月1日,CTX向CTX前成员Dresch,Inc.发行了一张500,000美元的本票(“成员票据”,与BRAMS票据和7月票据一起,称为“关联方票据”)。会员票据的本金及利息可在贷款人通知后按转换时的报价单位转换为CTX的优先单位。2020年9月30日,根据成员说明的条款,353,665美元按当前单价转换为CTX的246,096个优先单位,留下了146,335美元的应付金额。成员票据最初于2021年2月1日到期,延期12个月至2022年2月1日。截至首次公开招股结束时,我们分别欠会员票据146,335美元和39,941美元的本金和利息,该票据已于2021年12月用首次公开募股所得全额支付。
首次公开募股
帕特里克·加拉格尔,董事会成员,莱德洛公司董事高级董事总经理,莱德洛风险投资公司管理合伙人。莱德洛公司(英国)有限公司担任我们IPO的联席主承销商,IPO于2021年12月10日结束。向Laidlaw&Company(UK)Ltd.支付的与IPO相关的折扣和佣金约为500,000美元。
WFIA 备注
2022年8月9日,CTX发行了一张500万美元(“原始本金”)的本票,以WFIA为收款人(“原始 票据”)。我们的董事会成员Peter Werth是WFIA的经理。原来的票据是无抵押的,利息按年息15%计提。2025年8月8日,或WFIA在2023年4月1日开始的日历季度的前五个工作日内提出书面要求后120天,未偿还本金和所有应计及未付利息均已到期和应付。CTX获准 全部或部分预付原始票据,无需支付溢价或罚款;但不得再借入任何已偿还的金额。
| 117 |
于 2023年5月9日,CTx以WFIA为受益人执行经修订及重列的承兑票据(“WFIA票据”),将原始票据的本金 金额从500万美元增加至800万美元。
于2023年9月8日,我们 与WFIA订立票据转换协议,据此,WFIA同意将WFIA票据项下的原有本金金额 连同其所有应计利息,或5,812,500美元,转换为预资金权证(“9月WFIA 预资金权证”),以购买341,912股本公司普通股,每股预资金权证的转换价为17美元。根据9月的WFIA预资金权证,无到期日,可立即以每股0.002美元的行使价 行使。就《证券交易法》第13(D)节而言,WFIA及其关联公司将实益拥有不超过本公司普通股流通股 的19.99%。
2024年1月25日,我们签订了2024年1月票据转换协议,并将应付给WFIA的票据项下剩余的3,000,000美元本金外加所有应计利息,或3,287,500美元, 转换为1月份的WFIA预资金权证,以购买687,043股普通股,每份预资金权证的转换价格为4.785美元。我们普通股在2024年1月24日的收盘价为4.35美元。2024年1月的预融资权证 没有到期日,可立即以每股0.0001美元的行使价行使,条件是根据交易法第13(D)条的规定,在行使该等行权证后,本公司及其关联公司将实益拥有不超过19.99%的普通股流通股。
未偿还本金以及所有应计和未付利息应于2025年8月8日到期并支付,除非因 违约事件而加速。从2023年7月1日开始,WFIA有权在每个日历季度的前五个工作日内要求在通知CTX后120天内支付所有未偿还本金和利息。CTX获准预付WFIA票据的全部或部分,而无需支付溢价或罚款;条件是,偿还的金额不得再借款。 截至2023年9月30日,WFIA票据下有3,000,000美元的本金和157,339美元的应计利息未偿还。截至本公告日期,WFIA票据已全额支付,本公司不再承担WFIA票据项下的其他义务。
WFIA 2023年8月私募
于2023年8月11日,吾等与WFIA订立证券购买协议(“2023年8月购买协议”),并以私募方式发行51,158股本公司普通股,每股收购价为10.97美元,扣除吾等应付的交易费用(“WFIA私募”)。 WFIA私募于2023年8月11日结束。
对高级管理人员和董事的赔偿
我们 已经与我们每一位现任董事和高管签订了赔偿协议。这些协议要求我们在特拉华州法律允许的范围内最大限度地赔偿这些个人因他们向我们提供服务而可能产生的责任,并预支因任何针对他们的诉讼而产生的费用,以便他们能够获得赔偿。我们 还打算与我们未来的董事和高管签订赔偿协议。
关联方交易的政策和程序
我们 采取了关联方交易的政策和程序,禁止我们的高管、董事、被提名为董事的候选人、任何类别普通股超过5%的实益所有者、任何上述人员的直系亲属成员、任何前述人员受雇于其或作为合伙人或委托人或处于类似职位的任何公司、公司或其他实体,或该人拥有5%或更大实益所有权权益的任何公司、公司或其他实体,或关联方。未经本公司董事会透过审核委员会行事或在 某些情况下,审核委员会主席事先同意而与吾等订立交易。任何要求我们与关联方达成交易的请求,如所涉金额将超过或可能超过100,000美元,且该关联方将拥有直接或间接利益,则必须首先提交我们的审计委员会,或在某些情况下提交我们的审计委员会主席进行审查, 考虑和批准。在批准或拒绝任何此类建议时,我们的审计委员会将考虑交易的重要事实,包括但不限于,交易条款是否不低于在相同或类似情况下非关联第三方通常可以获得的条款 ,对我们的好处的程度,可比产品或服务的其他来源 ,以及相关人士在交易中的利益程度。2023年12月,我们董事会的四名独立成员辞职,我们目前没有审计委员会、薪酬委员会或提名 和公司治理委员会。
| 118 |
管理
执行官员和董事
下表提供了截至2024年1月25日我们的高管和董事的年龄信息:
| 名字 | 年龄 | 职位 | ||||
| 执行官员 : | ||||||
| 谢恩·J·谢弗,制药公司 | 49 | 首席执行官兼董事会主席 | ||||
| 詹妮弗·L·卡拉汉 | 53 | 高级副总裁和财务总监 | ||||
| 劳里·A·迈尔斯,博士 | 67 | 执行副总裁总裁和首席运营官 | ||||
| 医学博士劳尔·R·席尔瓦 | 66 | 执行副总裁总裁兼首席科学官 | ||||
| Matthew Brams,MD | 60 | 执行副总裁兼首席医疗官 | ||||
| 董事: | ||||||
| Peter J. Werth | 85 | 董事 | ||||
谢恩·J·谢弗,制药公司。2012年共同创立了Cingate,此后一直担任我们的首席执行官和董事会主席。在Cingate工作之前,Schaffer博士于2009年7月至2012年12月担任Sabre Science Solutions董事董事总经理。在此之前,Schaffer博士 于2008年9月至2009年5月在PRI-Med Access担任董事国民财务部经理, 于2004年2月至2007年12月在赛诺菲担任高级市场营销经理,并于2001年6月至2003年10月在诺华担任营销经理。从1999年7月至2001年6月, 他担任罗格斯制药行业奖学金计划首席研究员,并在华纳·兰伯特/帕克·戴维斯和辉瑞公司担任高级研究员。1997年6月至1999年7月,他在Hoechst Marion Roussel担任临床研究助理。Schaffer博士在药物开发、商业化和生物技术商业运营方面拥有超过25年的经验。Schaffer博士从堪萨斯大学药学院获得药学博士学位。我们相信,Schaffer博士对制药行业的广博知识,他在广泛治疗领域的临床和商业背景,以及他担任我们首席执行官的经验,都使他有资格在我们的董事会任职。
詹妮弗·L·卡拉汉 于2024年1月25日任高级副总裁兼首席财务官。她自2017年1月以来一直在公司担任会计职务 并于2019年1月被任命为公司副总监总裁。在担任本公司职务之前, 卡拉汉女士自2014年以来一直担任堪萨斯城当地会计师事务所子午线商务服务公司会计董事会计 她为各种业务提供外包控制器服务,包括初创公司和需要改进流程的公司。 在她的职业生涯中,卡拉汉女士为不同行业和阶段的公司提供过咨询服务。她从1992年6月至1998年12月在德勤开始了她的职业生涯,在那里她在审计业务中担任过各种职务。Callahan女士拥有注册会计师资格,并获得克雷顿大学会计和金融学学士学位
Laurie A.Myers,博士,MBA。自2018年4月起担任我们的执行副总裁总裁兼首席运营官,并于2013年6月至2018年4月担任我们的董事会成员,于2017年11月至2018年4月担任我们的运营总监高级副总裁。迈尔斯博士还担任Linea System,LLC顾问委员会成员,她自2020年9月以来一直担任该职位。迈尔斯博士之前曾在2014年9月至2017年11月期间担任菲迪亚制药美国公司的市场营销主管,该公司是菲迪亚制药公司的全资子公司。 迈尔斯博士于2012年1月至2014年12月担任新泽西商学院兼职教授,并于2010年1月至2014年9月担任总裁和哈莱特David战略集团董事会成员。迈尔斯博士从罗格斯医学院和罗格斯药学院获得毒理学哲学博士学位,从圣约瑟夫大学获得工商管理硕士学位,从斯克兰顿大学获得理学硕士和学士学位。
劳尔·R·席尔瓦,医学博士2013年与他人共同创立Cingate,自2018年1月起担任公司执行副总裁总裁兼首席科学官。自2009年以来,他一直在私人执业。在此之前,席尔瓦博士曾在2006年至2009年担任罗克兰儿童精神病学中心的董事高管。2005年至2009年,他还担任纽约大学儿童研究中心的副主席。席尔瓦博士于1999年至2006年在贝尔维尤医院中心担任儿童精神病学董事副主任医师。在此之前,他从1995年到1990年在纽约市圣卢克/罗斯福医院担任儿童和青少年精神病科的董事教授。他于1990年在哥伦比亚大学圣卢克/罗斯福医院中心完成了儿童和青少年精神病学的研究,并在纽约大学医学中心完成了精神药理研究的研究。席尔瓦博士在普通、儿童和青少年精神病学方面获得了董事会认证。席尔瓦博士在罗斯大学获得医学博士学位,在费尔利·迪金森大学获得生物学理学学士学位。
马修·布拉姆斯,马里兰州他于2013年联合创立Cingate,自2018年1月起担任我们的执行副总裁总裁兼首席医疗官,并从2018年1月至2021年7月担任Cingate的董事。布拉姆斯博士在1999年4月至2021年1月期间担任Bayou City Research的负责人。在此之前,他曾在多家医疗机构担任医学董事顾问和/或入院精神病学家 ,包括泰勒康复中心(2019年4月至今)、莱克维尤健康康复中心(2018年至2019年)、德克萨斯州休斯敦PARC(2012年至2015年)、老年精神科单位墨西哥湾医院(2009年至今)。布拉姆斯博士一直是参与ADHD临床领域的所有主要制药公司的研究团队中不可或缺的一员。布拉姆斯博士分别在贝勒医学院完成成人精神病学和儿童精神病学的实习和奖学金。他拥有成人和儿童精神病学委员会证书(1994) ,是美国精神病学和神经病学委员会的代理高级委员会审查员。他从德克萨斯大学科学中心获得医学博士学位,并从德克萨斯大学获得生物学文学学士学位。
| 119 |
彼得·J·沃思自2018年6月以来一直在我们的董事会任职。韦斯先生是Chemwerth Inc.的创始人兼首席执行官,该公司是一家提供全方位服务的仿制药开发和供应公司,向全球受监管的市场提供活性药物成分。 韦斯先生曾于1975年3月至1982年5月在齐格弗里德化工公司的子公司甘斯化工公司担任总裁副董事长。 从1965年至1975年,韦斯先生在Upjohn制药公司(现为辉瑞公司)的研发部门工作。此外,Werth先生自2010年12月起担任Vm Pharma LLC、自2012年5月起担任VM Treateutics LLC、自2012年6月起担任Alopexx Vaccines LLC、自2014年8月起担任VM Oncology LLC、自2015年1月起担任Perseus Science Group LLC、自2017年8月起担任Likarda LLC、自2017年9月起担任Techtona LLC、自2018年6月起担任MedRhythms LLC及自2020年9月起担任Bastion Healthcare LLC的董事。他在斯坦福大学获得有机化学理学硕士学位,在海斯堡州立大学获得化学和数学理学学士学位。我们相信,Werth先生在生命科学行业的丰富经验,以及他在商业和国际市场的知识,使他有资格在我们的董事会任职。
家庭关系
我们的任何董事或高管之间没有家族关系。
董事会 组成
我们的 董事会目前由两名成员组成。我们的董事任期直至他们的继任者选出并获得资格 或直到他们辞职或罢免的较早者为止。
根据我们修订和重述的公司注册证书和章程的条款,我们的董事会分为 三类,即I类、II类和III类,每类交错任职三年。某类董事任期届满后,该类董事有资格在任期届满的当年的股东年会上当选为新的三年任期。我们的董事分为以下三类:
| ● | 一级董事是彼得·J·韦思;他的任期将于2025年召开的股东年会 上届满。 |
| ● | 董事第三类人物是谢恩·J·谢弗,他的任期将于2024年召开的股东年会上届满。 |
我们 目前没有任何II类董事。我们预计,由于增加 名董事而增加的任何额外董事职位将在这三个级别之间分配,以便每个级别将尽可能由三分之一的董事组成。 将我们的董事会分为三个级别并交错三年任期可能会推迟或阻止我们管理层的更换 或控制权的更改。
本公司经修订及重述的公司注册证书及经修订及重述的章程规定,只有经本公司董事会通过决议,才可更改获授权的董事人数。我们经修订及重述的公司注册证书及经修订及重述的附例亦规定,我们的董事只能因任何理由而被免职,而我们董事会的任何空缺,包括因董事会扩大而产生的空缺,只能由我们当时在任的董事以过半数投票方式填补。
我们 在确定董事被提名者时没有考虑多样性的正式政策。董事会在整个董事会范围内评估每一位 个人,目的是组建一个能够最好地保持 业务成功的集团,并通过利用其在这些不同领域的不同经验进行合理判断来代表股东利益。
董事 独立
根据纳斯达克的规则,只有在董事董事会认为该人在履行董事责任时不存在会干扰行使独立判断的关系的情况下,该公司才有资格成为“独立的董事”。
我们的董事会已经确定, 我们目前没有任何符合纳斯达克商城规则5605(A)(2)所定义的“独立董事”资格的董事。由于华通以董事为收款人的期票,董事会认定韦思先生不是独立的支付宝。此外,谢恩·谢弗并不是独立的董事公司,因为他是公司的首席执行官。于2023年12月6日从董事会辞职的Scott Applebaum、于2023年12月12日从董事会辞职的Patrick Gallagher以及于2023年12月13日从董事会辞职的Gregg Givens和Curt Medeiros分别被视为独立董事。
我们目前没有审计 委员会、薪酬委员会,也没有提名和公司治理委员会,公司正在挑选其他董事。一旦我们的董事会任命了更多的董事会成员,我们将根据纳斯达克规则的 上市标准进行独立性分析。
2023年12月26日,我们收到了员工的一封信,信中指出,基于三名董事会成员分别于2023年12月12日和2023年12月13日辞职,我们将不再遵守独立的董事上市规则5605(“独立董事规则”)所述的纳斯达克上市规则 对纳斯达克提名的监督要求。 我们正在寻找潜在的新董事,并打算在小组听证会之前展示在遵守独立董事规则方面的进展 。不能保证我们会重新遵守《董事独立规则》。
| 120 |
高管薪酬
下表和随附的披露说明了我们指定的高管在2023年期间所赚取的薪酬信息。我们任命的高管包括我们的首席执行官、截至2023年12月31日担任高管的两名薪酬最高的高管(除了我们的首席执行官 ),以及两名前高管,如果他们在2023年12月31日担任高管的话,他们将成为薪酬最高的两名高管(不包括我们的首席执行官),如下所述:
| ● | 首席执行官兼董事会主席谢恩·谢弗; | |
| ● | 劳瑞·A·迈尔斯,执行副总裁总裁,首席运营官; | |
● |
马修·N·布拉姆斯,常务副主任总裁,首席医疗官; | |
| ● | 路易斯·G·范霍恩,前执行副总裁总裁兼首席财务官;以及 | |
| ● | 克雷格·S·吉尔加隆,Esq.,原常务副总裁,总法律顾问兼秘书长。 |
汇总表 薪酬表
下表列出了我们指定的每位高管在所示年份中获得、赚取或支付的薪酬信息。
名称 和 负责人 职位 | 年 | 薪金 ($) | 奖金 ($)(1) | 库存 奖项 ($) | 选择权 奖项 ($)(2) | 非股权 激励 平面图 补偿 ($) | 所有 其他 补偿 ($) | 总计 ($) | |||||||||||||||||||||||
| 谢恩·J·谢弗, | 2023 | 491,961 | - | - | 137,610 | - | - | 629,571 | |||||||||||||||||||||||
| 董事长兼首席执行官 | 2022 | 475,000 | 29,688 | - | 78,503 | - | - | 583,191 | |||||||||||||||||||||||
| Laurie A.迈尔斯 | 2023 | 415,167 | - | - | 61,160 | - | - | 476,327 | |||||||||||||||||||||||
| 执行副总裁 和首席运营官 | 2022 | 400,000 | 25,000 | - | 34,890 | - | - | 459,890 | |||||||||||||||||||||||
| 马修·N·布拉姆斯 | 2023 | 244,792 | - | - | 22,935 | - | - | 267,727 | |||||||||||||||||||||||
| 执行副总裁 和CMO | |||||||||||||||||||||||||||||||
| 路易 G.范霍恩, | 2023 | 382,205 | - | - | 76,450 | - | - | 458,655 | |||||||||||||||||||||||
| 前 执行副总裁兼首席财务官(3) | 2022 | 380,000 | 23,750 | - | 34,890 | - | - | 438,640 | |||||||||||||||||||||||
| Craig S.吉尔加伦 | 2023 | 385,250 | - | - | 61,160 | - | - | 446,410 | |||||||||||||||||||||||
| 前 执行副总裁、总干事和秘书(4) | 2022 | 380,000 | 23,750 | - | 34,890 | - | - | 438,640 | |||||||||||||||||||||||
| (1) | 该 花红金额指我们指定的行政人员于2022年赚取的年度花红。 |
| (2) | 该 金额反映非合格股票期权奖励于2023年2月28日、2022年2月25日及 2021年7月7日,根据FASB ASC主题718。期权奖励的公平市场价值采用柏力克-舒尔斯期权定价法 模型请参阅我们截至2021年12月31日止年度的综合财务报表附注10,了解用于估计 2021年12月的股票期权奖励的授出日期公允价值。请参见我们的合并财务报表附注11, 截至2022年12月31日止年度,用于估计股票期权授出日期公允价值的加权平均假设 2022年获奖用于估计二零二三年二月购股权奖励授出日期公平值的假设如下: |
无风险 利率 |
0.04% | |
| 预期的 期限(以年为单位) | 6.08 | |
| 预期 波动 | 1.13 | |
| 预期 股息率 | 0% | |
| 授予 日期的公平值 | $30.58 |
| (3) | 先生 Van Horn于2023年12月13日从本公司退休。 |
| (4) | 先生 Gilgallon辞去了公司高管职务,并终止了与Cingulate Therapeutics LLC(“CTx”)的雇佣关系, 二零二三年十二月十五日Gilgallon先生声称,根据其雇用条款第4(e)节,他的终止是有“充分理由”的。 于2021年9月23日与CTx签订的协议。公司对吉尔加伦先生的索赔提出异议。以执行一般 有利于公司的释放,根据吉尔加伦先生的就业协议,因“充分理由”终止 将使他有权在 终止日期。此外,如果吉尔加伦先生 在其终止日期后继续受雇额外四(4)个月的,应归属并可行使 截至终止日期,所有已授予的股票期权将在其整个期限内行使。 |
| 121 |
员工 福利计划
我们 目前为所有员工(包括指定的执行官)提供广泛的健康和福利, 包括医疗、牙科和视力保险。
401(K) 计划
我们 为所有符合条件的员工发起401(k)储蓄计划(“401(k)计划”)。根据401(k)计划,我们不向401(k)计划提供匹配 供款,但每年所需的安全港供款除外。
或有 奖金计划
关于 自2023年12月16日起降低所有员工的年度基本工资,并激励员工 继续留在公司,董事会独立成员批准了一项或有奖金计划。根据该计划, 公司将在向FDA提交CTx-1301新药申请后三个月的日期(“支付日期”)向每位员工支付一笔金额,该金额等于截至支付日期 因减薪而未支付给员工的基本工资总额加上减薪金额的20%。
与我们指定的执行官的雇佣 安排
谢恩·J·谢弗
2021年9月23日,我们与Schaffer博士签订了雇佣协议。根据谢弗博士的雇佣协议条款,他担任首席执行官一职。雇佣协议最初规定的基本工资为每年475,000美元, 从2023年1月1日起增加到503,500美元。在成本控制措施方面,谢弗的年基本工资降至226,350美元,自2023年12月16日起生效。此外,谢弗博士有资格获得年度奖金,目标金额相当于谢弗博士年度基本工资的25%(25%)。每笔奖金的实际金额将由我们的薪酬委员会自行决定,并将基于公司的业绩和Schaffer博士的个人业绩。根据他的雇佣协议条款,Schaffer博士还有资格参加公司其他高管或高级管理人员可获得的所有激励计划和递延薪酬计划,并有资格参加我们可能采用的任何 员工福利计划和股权计划,这些计划可由公司随时酌情修订。
在向Schaffer博士发出书面通知后,我们 可随时无故终止Schaffer博士的雇佣,Schaffer博士可随时以任何理由终止其雇佣关系,包括正当理由(该术语在Schaffer博士的雇佣协议中有定义)。
| 122 |
如果Schaffer博士的雇佣被公司无故终止或被Schaffer博士以正当理由终止,Schaffer博士将有权 在终止之日起二十一(21)天内以及在终止后七(7)天到期后,在Schaffer博士的基本工资和年度目标奖金的1.5倍(1.5)倍的现金中,获得以公司和相关个人和实体为受益人的全面索赔。在终止之日起60天内。此外,Schaffer博士所持有的所有股票期权和股票增值权,如果他在终止合同之日后再受雇四(4)个月,将会被授予,并在终止合同之日起可在其全部任期的剩余时间内行使。如果Schaffer博士在控制权变更后十二(12)个月内被公司无故终止雇用或因正当理由被Schaffer博士终止雇佣关系,则Schaffer博士将有权在终止之日起二十一(21)天内以及之后七(7)天到期后,获得一笔相当于Schaffer博士基本工资和年度目标奖金两(2)倍的现金的遣散费。在终止之日起60天内;如果 然而,如果任何付款或福利将构成《国内税法》第280(G)节所定义的“降落伞付款”,则该付款将以(I)最大金额中较大者为准,以确保该等付款的任何部分均不受《国内税法》第4999节征收的消费税和(Ii)全额付款的金额减去所有税项,包括根据《国内税法》第4999节征收的 消费税。此外,Schaffer博士持有的所有股票期权和股票增值权将自终止之日起在其完整任期的剩余时间内归属并可行使。
劳里·A·迈尔斯
2021年9月23日,我们与Myers女士签订了雇佣协议。根据迈尔斯女士的聘用协议条款,她担任执行副总裁总裁和首席运营官。雇佣协议最初规定的基本工资为年薪400,000美元,从2023年1月1日起增加到424,000美元。在成本控制措施方面,迈尔斯女士的年基本工资降至21.2万美元,自2023年12月16日起生效。此外,迈尔斯有资格获得年度奖金,目标金额为迈尔斯年度基本工资的25%(25%)。每笔奖金的实际金额将由我们的薪酬委员会自行决定,并将根据公司的业绩和首席执行官建议的Myers女士的个人业绩确定。根据雇佣协议的条款,Myers女士还有资格参加公司其他高管或高级管理人员可获得的所有奖励和递延薪酬计划,并有资格参加我们可能采用的任何员工福利计划和股权计划,这些计划可能会 由公司全权酌情修改。
在向Myers女士发出书面通知后,我们 可随时无故终止对Myers女士的雇用,Myers女士可随时以任何理由终止其雇用,包括正当理由(Myers女士的雇佣协议中对该术语的定义)。
如果公司无故终止雇用迈尔斯女士或有充分理由终止雇用迈尔斯女士,迈尔斯女士将有权在终止之日起二十一(21)天内签署有利于公司及相关个人和实体的全面索赔,并在终止后七(7)天内收到一笔相当于迈尔斯女士基本工资和年度目标奖金一(1)倍的现金的遣散费。 此外,Myers女士持有的所有股票期权和股票增值权,如果她在终止合同之日起再受雇四(4)个月,将在终止合同终止之日起归属并可在其全部任期的剩余时间内行使。如果迈尔斯女士在控制权变更后十二(12)个月内被公司无故终止雇用或被迈尔斯女士以正当理由终止雇用,迈尔斯女士将有权在终止之日起二十一(21)天内以及在终止后七(7)天届满后,获得一(1)乘以迈尔斯女士基本工资和年度目标奖金为一(1)倍的现金遣散费。在终止之日起60天内;但是,如果任何付款或福利 构成《国内税法》第280(G)节所定义的“降落伞付款”,则支付的金额将是(I)最大金额中较大的一个,以确保这些付款的任何部分不受《国内税法》第499节征收的消费税 和(Ii)全额付款的金额减去所有税项,包括根据《国内税法》第4999节征收的消费税的影响。此外,Myers女士持有的所有股票期权和股票增值权将于其全部剩余期限终止之日起归属并可行使。
| 123 |
马修·N·布拉姆斯
2021年9月23日,我们与布拉姆斯先生签订了雇佣协议。根据布拉姆斯先生的聘用协议条款,他担任执行副总裁总裁和首席医疗官。雇佣协议最初规定的基本工资为年薪200,000美元,从2023年1月1日起增加到250,000美元。在成本控制措施方面,布拉姆斯先生的年基本工资从2023年12月16日起降至125,000美元。自2024年1月1日起,Brams先生的雇佣协议进行了修订(I)将Bram先生的年度基本工资修改为允许(A)Brams先生向401(K)计划贡献国税局允许的最高金额,以及(B)本公司扣留法定最低金额以支付联邦、州和地方税,以及(Ii)规定本公司将根据本公司的2021年综合股权激励计划,在每个日历季度的最后一个营业日向Brams先生授予1,000股非合格股票 期权。
布拉姆斯先生有资格获得年度奖金,目标金额为布拉姆斯先生年基本工资的25%(25%)。每笔奖金的实际金额将由我们的薪酬委员会自行决定,并将根据首席执行官的建议,同时基于公司业绩和BRAMS的个人业绩。根据雇佣协议的条款,布拉姆斯先生还有资格参加公司其他高管或高级管理人员可获得的所有奖励和递延薪酬计划,并有资格参加我们可能采用的任何员工福利计划和股权计划,这些计划可由公司随时酌情修订。
在向Brams先生发出书面通知后,我们 可随时终止Brams先生的雇佣关系,而Brams先生可随时以任何理由终止其雇佣关系,包括有充分理由(该术语在Brams先生的雇佣协议中有定义)。
If Mr. Brams’s employment is terminated by the Company without cause or by Mr. Brams for Good Reason, Mr. Brams will be entitled to receive, subject to his signing a general release of claims in favor of the Company and related persons and entities within twenty-one (21) days of the date of termination and following the expiration of seven (7) days thereafter, a severance payment in twelve (12) equal monthly payments equal to one (1) times Mr. Brams’s base salary, within 60 days following the date of termination. In addition, all stock options and stock appreciation rights held by Mr. Brams, which would have vested if he had remained employed for an additional four (4) months following the date of termination, shall become vested and exercisable as of the date of termination for the remainder of their full term. If Mr. Brams’s employment is terminated by the Company without cause or by Mr. Brams for Good Reason within twelve (12) months of a Change of Control, Mr. Brams will be entitled to receive, subject to his signing a general release of claims in favor of the Company and related persons and entities within twenty-one (21) days of the date of termination and following the expiration of seven (7) days thereafter, a severance payment of a lump sum amount in cash equal to one (1) times Mr. Brams’s base salary, within 60 days following the date of termination; provided however, if any payment or benefits would constitute an “parachute payment” as defined in Section 280(G) of the Internal Revenue Code, the payments will be the greater of (i) the largest amount to ensure that no portion of those payments be subject to the excise tax imposed by Section 4999 of the Internal Revenue Code and (ii) the amount of the full payment, less all taxes, including the excise tax imposed by Section 4999 of the Internal Revenue Code. In addition, all stock options and stock appreciation rights held by Mr. Brams shall become vested and exercisable as of the date of termination for the remainder of their full term.
路易斯·G·范·霍恩
2021年9月23日,我们与Van Horn先生签订了雇佣协议。根据Van Horn先生的雇佣协议条款, 他担任执行副总裁兼首席财务官。雇佣协议最初规定的基本年薪为380,000美元,从2023年1月1日起增加到406,600美元。此外,Van Horn先生有资格获得 年度奖金,目标金额相当于Van Horn先生年度基本工资的百分之二十五(25%)。每笔奖金的实际金额 由我们的薪酬委员会全权酌情决定,并根据首席执行官的建议,基于公司的业绩 和Van Horn先生的个人业绩。根据其雇佣 协议的条款,Van Horn先生也有资格参与公司其他高管 或高级职员的所有激励和递延薪酬计划,并有资格参与我们采用的任何员工福利计划和股权计划。
我们 有权在向Van Horn先生提供书面通知后随时无故终止与Van Horn先生的雇佣关系, Van Horn先生有权随时以任何理由终止与其雇佣关系,包括正当理由(该术语的定义见 Van Horn先生的雇佣协议)。
| 124 |
If Mr. Van Horn’s employment was terminated by the Company without cause or by Mr. Van Horn for Good Reason, Mr. Van Horn would have been entitled to receive, subject to his signing a general release of claims in favor of the Company and related persons and entities within twenty-one (21) days of the date of termination and following the expiration of seven (7) days thereafter, a severance payment of a lump sum amount in cash equal to one (1) times Mr. Van Horn’s base salary and annual target bonus, within 60 days following the date of termination. In addition, all stock options and stock appreciation rights held by Mr. Van Horn, which would have vested if he had remained employed for an additional four (4) months following the date of termination, would have become vested and exercisable as of the date of termination for the remainder of their full term. If Mr. Van Horn’s employment had been terminated by the Company without cause or by Mr. Van Horn for Good Reason within twelve (12) months of a Change of Control, Mr. Van Horn would have been entitled to receive, subject to his signing a general release of claims in favor of the Company and related persons and entities within twenty-one (21) days of the date of termination and following the expiration of seven (7) days thereafter, a severance payment of a lump sum amount in cash equal to one (1) times Mr. Van Horn’s base salary and annual target bonus, within 60 days following the date of termination; provided however, if any payment or benefits would have constituted a “parachute payment” as defined in Section 280(G) of the Internal Revenue Code, the payments would have been the greater of (i) the largest amount to ensure that no portion of those payments be subject to the excise tax imposed by Section 4999 of the Internal Revenue Code and (ii) the amount of the full payment, less all taxes, including the excise tax imposed by Section 4999 of the Internal Revenue Code. In addition, all stock options and stock appreciation rights held by Mr. Van Horn would have become vested and exercisable as of the date of termination for the remainder of their full term.
先生 Van Horn于2023年12月13日从我们的首席财务官一职退休。
Craig S.吉尔加伦先生
2021年9月23日,我们与吉尔加隆先生签订了雇佣协议。根据吉加隆先生的聘用协议条款,他担任常务副总裁和总法律顾问。雇佣协议最初规定的基本工资为每年380,000美元,从2023年1月1日起增加到402,800美元。此外,吉尔加隆有资格获得年度奖金,目标金额相当于吉尔加隆年度基本工资的25%(25%)。按照首席执行官的建议,每笔奖金的实际金额将由我们的薪酬委员会根据公司的业绩和吉加隆先生的个人业绩自行决定。根据他的雇佣协议的条款,吉尔加隆先生还有资格参加所有激励和递延薪酬计划,以及公司其他高管或高级管理人员可获得的其他高管退休计划,并有资格参加我们通过的任何 员工福利计划和股权计划,这些计划可由公司随时酌情修订。
我们有权在向吉尔加隆先生发出书面通知后,随时无故终止对吉尔加隆先生的雇用,而吉尔加隆先生有权随时以任何理由,包括以正当理由终止其雇用(这一术语在吉尔加隆先生的雇用协议中有定义)。
如果吉尔加隆先生被公司无故终止雇用或被吉尔加隆先生以正当理由终止雇用,则吉尔加隆先生将有权在终止之日起二十一(21)天内以及在终止之日起七(7)天届满后,在终止合同之日起60天内,获得一笔相当于吉尔加隆先生基本工资和年度目标奖金一(1)倍现金的遣散费 。此外,GilGallon先生持有的所有股票期权和股票增值权,如果他在终止合同之日起再受雇四(4)个月,将会被授予,并在终止合同之日起在其全部任期的剩余时间内可行使。如果吉加隆先生在控制权变更后十二(12)个月内被公司无故终止雇用或被吉加隆先生以正当理由终止雇用,吉加隆先生将有权在终止之日起二十一(21)天内以及之后七(7)天届满后,获得一笔相当于吉加隆先生基本工资和年度目标奖金一(1)倍的现金遣散费,条件是他签署了以公司及相关个人和实体为受益人的索赔。自终止之日起60天内;然而,如果任何付款或福利将构成《国税法》第280(G)节所定义的“降落伞付款”,则支付的金额将是(I)最大金额中的较大者,以确保这些付款的任何 部分不受《国税法》第499节征收的消费税和(Ii)全额付款的金额减去所有税项,包括根据《国税法》第4999条征收的消费税。此外,GilGallon先生持有的所有股票期权和股票增值权将于终止之日起在其完整期限的剩余时间 内归属并可行使。
吉尔加隆先生辞去了公司高级管理人员的职务,并于2023年12月15日起终止了在Cingate Treateutics LLC的工作。吉尔加隆先生辞去了公司高级管理人员的职务,并于2023年12月15日起终止了在CTX的雇佣关系。Gilgaron先生声称,根据他于2021年9月23日与CTX签订的雇佣协议第4(E)条,他被解雇是有“充分理由”的。公司驳斥了吉尔加隆先生的索赔。在签署以本公司为受益人的一般豁免的前提下,根据GilGallon先生的雇佣协议,以“充分理由” 终止合同将使他有权在终止合同之日起60天内获得相当于其基本工资(402,800美元) 和目标奖金(100,500美元)的一次性付款。此外,如果吉加隆先生在被解聘之日起再受雇四(4)个月,他的任何未偿还的 股票期权将在解聘之日起被授予并可行使,所有已授予的股票期权将可在其 完整期限内行使。
| 125 |
未偿还的 2023财年年底的股权奖励
| 名字 | 授予日期 | 可行使的未行使期权标的证券数量(#)(1) | 未行使期权标的证券数量(#)不可行使(1) | 期权 行权价(美元)(1) | 选项 到期日期 | |||||||||||||
| 谢恩·J·谢弗 | 2-28-2023 | (2) | - | 4,500 | 35.80 | 2-28-2033 | ||||||||||||
| 2-25-2022 | (2) | 1,544 | 1,831 | 27.60 | 2-25-2032 | |||||||||||||
| 12-7-2021 | (3) | 4,492 | 4,492 | 120.00 | 12-7-2031 | |||||||||||||
| Laurie A.迈尔斯 | 2-28-2023 | (2) | - | 2,000 | 35.80 | 2-28-2033 | ||||||||||||
| 2-25-2022 | (2) | 685 | 815 | 27.60 | 2-25-2032 | |||||||||||||
| 12-7-2021 | (3) | 1,685 | 1,684 | 120.00 | 12-7-2031 | |||||||||||||
| 马修·N·布拉姆斯 | 2-28-2023 | (2) | - | 750 | 35.80 | 2-28-2033 | ||||||||||||
| 2-25-2022 | (2) | 287 | 338 | 27.60 | 2-25-2032 | |||||||||||||
| 12-7-2021 | (3) | 113 | 112 | 120.00 | 12-7-2031 | |||||||||||||
| 路易斯·G·范·霍恩(4) | 2-28-2023 | (2) | - | 2,500 | 35.80 | 2-28-2033(4) | ||||||||||||
| 2-25-2022 | (2) | 654 | 846 | 27.60 | 2-25-2032(4) | |||||||||||||
| 12-7-2021 | (3) | 1,685 | 1,684 | 120.00 | 12-7-2031(4) | |||||||||||||
| 克雷格·S·吉尔加隆(4) | 2-28-2023 | (2) | - | 2,000 | 35.80 | 2-28-2033(4) | ||||||||||||
| 2-25-2022 | (2) | 654 | 846 | 27.60 | 2-25-2032(4) | |||||||||||||
| 12-7-2021 | (3) | 1,685 | 1,684 | 120.00 | 12-7-2031(4) | |||||||||||||
(1)
|
我们普通股的股票数量 标的股票期权和期权行权价反映了我们已发行和已发行普通股的20股1股反向股票拆分,该拆分于2023年11月30日生效。 |
| (2) | 期权的归属如下:于授出日期的一年周年日起计25%,其余股份在初始归属日期后的36个月期间内按月分期付款 。 |
| (3) | 从授予之日起, 期权分为四个等额的年度分期付款。 |
|
(4) |
根据《2021年计划》,范·霍恩先生和吉尔加隆先生可以行使既得股票期权,直至其各自的终止日期后90天。在90天 期限届满后,Van Horn先生和Gilgaron先生持有的所有股票期权将被没收,包括2023年2月28日授予的股票期权。吉加隆先生辞去了公司高级管理人员的职务,并从2023年12月15日起终止了与CTX的雇佣关系。吉尔加隆先生声称,根据他于2021年9月23日与CTX签订的雇佣协议第4(E)条,他的离职是有充分理由的。该公司对吉加隆先生的索赔提出异议。在签署了以公司为受益人的全面解除合同的前提下,根据吉尔加隆先生的雇佣协议,以“充分理由”终止合同将使他有权在终止合同之日起60天内获得相当于其基本工资(402,800美元)和目标奖金(100,500美元)的一次性付款。 此外,如果吉加隆先生在离职后继续受雇 四(4)个月,他所持有的任何未行使的股票期权将在终止日期 日起归属并可行使,所有已授予的股票期权将在其全部期限内行使。 |
| 126 |
董事 薪酬
下表列出了本公司董事会每位非雇员成员于2023年以董事身份获得、赚取或支付的补偿 ,但报销出席本公司董事会及委员会会议的合理开支除外。
2023年董事补偿表
| 名字 | 费用 赢得的 或 已支付 以 现金 ($)(1) | 选择权 奖项 ($)(2) | 总计 ($) | |||||||||
| 斯科特·阿普尔鲍姆(3) | 43,341 | 12,938 | 56,279 | |||||||||
| Jeff(Br)康罗伊(3) | 0 | 0 | 0 | |||||||||
| 帕特里克·加拉格尔(3) | 46,470 | 12,938 | 59,408 | |||||||||
| 格雷格 吉文斯(3) | 71,332 | 12,938 | 84,270 | |||||||||
| Curt Medeiros(3) | 48,030 | 12,938 | 60,968 | |||||||||
| 彼得·沃思 | 35,000 | 12,938 | 47,938 | |||||||||
| (1) | 在成本控制措施方面,董事会推迟支付2023年第二、第三和第四季度的现金费用 。 |
| (2) | 金额反映了根据FASB ASC主题718,于2023年6月15日授予非雇员董事的非限定股票期权截至该日的公允价值。期权奖励的公平市场价值是使用布莱克-斯科尔斯模型确定的。用于估计2023年6月股票期权奖励授予日期公允价值的假设如下:
无风险利率 0.04% 预期 年数(Years)5.51 预期 波动率1.28 预期 股息收益率0% 授予 日期公允价值17.25美元
Messrs. Applebaum、Gallagher、Givens和Medeiros可在其 各自的辞职日期。在该90天期限届满时,Applebaum、Gallagher、Givens先生持有的所有股票期权 和Medeiros将被没收,包括2023年6月15日授予的股票期权。截至2023年12月31日:康罗伊先生 没有股票期权; Applebaum先生持有1,350份股票期权,其中600份已归属; Gallagher先生, Givens,Medeiros和Werth持有1,650份股票期权,其中675份已归属。 |
| (3) | 该 截至所示日期,以下董事从我们的董事会辞职:Applebaum先生(2023年12月6日); Conroy先生(2023年1月1日) 5,2023);加拉格尔先生(2023年12月12日);吉文斯先生(2023年12月13日);和梅代罗斯先生(2023年12月13日)。 |
2023董事薪酬计划
我们的 薪酬委员会和董事会批准了针对非员工董事的董事薪酬计划,自2023年6月 15日起生效。该计划提供以下年度现金补偿:
| ● | 主管 固定-35 000美元 | |
● |
销售线索 独立董事保留-55,000美元 | |
| ● | 委员会 座椅固定器: |
| ○ | 审核 - 一万五 | |
| ○ | 补偿 - 一万块 | |
| ○ | 提名 公司治理-8000元 |
| ● | 委员会 会员保留人: |
| ○ | 审核 - 七千五百块 | |
| ○ | 补偿 - 五千块 | |
| ○ | 提名 公司治理-4000元 |
所有 现金费用将每季度支付一次,并应根据一个日历 年内服务的整月或部分月数按比例计算。虽然董事不收取会议费,但如果董事会或委员会会议的次数超过年度内的典型会议次数,首席独立董事(如有)和薪酬委员会主席 可决定为一次或多次会议支付会议费。我们还将报销非雇员董事因出席董事会和委员会会议而产生的合理费用。非雇员董事将获得年度股票期权奖励,该奖励将在授予日期的第一个周年日 一次性授予。截至2023年6月15日,每位非雇员董事在该日获得了750份非合格 股票期权奖励。新任命的非雇员董事会收到初始非合格股票 期权奖励1,000个期权。
博士 我们的首席执行官Schaffer担任我们的董事会主席,但 他作为董事的服务没有获得额外的报酬。请参阅薪酬汇总表,了解Schaffer博士2023年薪酬的描述。
| 127 |
使用收益的
我们 估计,扣除配售代理费和 我们应付的估计发行费用,并假设没有出售任何预先注资的认股权证,也没有行使认股权证,本次发行的净收益将约为650万美元。但是,由于 这是一次尽最大努力的发行,没有将最低证券数量或收益金额作为成交条件,因此实际发行 金额、配售代理费用和我们的净收益目前无法确定,并且可能远低于本招股说明书封面所列的 最高金额,我们可能不会出售我们正在发行的全部或任何证券。 因此,我们的净收益可能会大幅减少。
我们 打算将我们从此次发行中获得的所有净收益用于CTX-1301的持续研发和商业化活动,以及营运资本、资本支出和一般企业用途,包括进一步投资于研究和开发工作。
尽管我们目前预计将如上所述使用此次发行的净收益,但在某些情况下可能需要重新分配资金。我们实际支出的金额和时间将取决于许多因素,包括我们的销售和营销 和商业化努力、对我们产品的需求、我们的运营成本以及本招股说明书中“风险因素” 项下描述的其他因素。因此,我们的管理层将可以灵活地运用此次发行的净收益。投资者 将没有机会评估经济、财务或其他信息,我们根据这些信息做出决定,以决定如何使用 收益。
在我们使用本次发行的净收益之前,我们打算将净收益投资于各种保本投资,包括短期、投资级、计息工具和美国政府证券。
| 128 |
稀释
如果您在此次发行中投资于我们的证券,您的所有权权益将立即稀释至本次发行后每股合并公开发行价和随附的认股权证与我们普通股的调整后每股有形账面净值之间的差额。
截至2023年9月30日,我们的有形账面净赤字约为10万美元,或每股普通股约0.11美元。我们每股的有形账面净赤字等于我们的总有形资产减去总负债,除以截至2023年9月30日我们的普通股流通股数量。
在认股权证 行使和ATM销售生效后,截至2023年9月30日,我们的备考有形账面净值约为300万美元,或每股普通股约2.14美元,每股普通股增加约2.25美元。
After giving effect to the sale of 1,375,000 shares of common stock and accompanying warrants at an offering price of $2.00 per share and accompanying warrants and pre-funded warrants to purchase up to 2,375,000 shares of common stock and accompanying warrants at an offering price of $1.9999 per pre-funded warrant and accompanying warrants in this offering, and after deducting placement agent fees and estimated offering expenses payable by us, and assuming all of the pre-funded warrants offered in this offering are exercised, no exercise of the warrants being offered in this offering, that no value is attributed to such warrants and that such warrants are classified as and accounted for as equity, our pro forma as adjusted net tangible book value as of September 30, 2023 would have been approximately $9.6 million, or approximately $1.85 per share of common stock. This amount represents an immediate decrease in pro forma as adjusted net tangible book value of $0.29 per share to our existing stockholders and an immediate dilution of $0.15 per share to investors participating in this offering. We determine dilution per share to investors participating in this offering by subtracting the pro forma as adjusted net tangible book deficit per share after giving effect to this offering from the public offering price per share and accompanying warrants paid by investors participating in this offering. The following table illustrates this dilution:
| 公开发行每股价格和配套认股权证 | $ | 2.00 | ||||||
| 历史 截至2023年9月30日的每股普通股有形账面净亏损 | $ | (0.11 | ) | |||||
| 可归因于认股权证演练和自动取款机销售的有形账面净赤字增加 | $ | 2.25 | ||||||
| 预计认股权证实施和自动取款机销售后的有形账面净值 | $ | 2.14 | ||||||
| 可归因于此次发行的预计每股有形账面净值下降 | $ | (0.29 | ) | |||||
| 作为本次发行后的调整后每股有形账面净值 | $ | 1.85 | ||||||
| 对购买本次发行股票的新投资者的每股摊薄 | $ | 0.15 |
以上表格和讨论基于截至2023年9月30日我们已发行的868,940股普通股(在权证行使和自动取款机销售生效后,预计已发行的普通股为1,413,001股 ),截至 该日期不包括以下内容:
| ● | 根据2021年计划发行的已发行股票期权行使后可发行的72,638股普通股,加权平均行权价为每股59.80美元; |
| ● | 根据2021年计划可供未来发行的66,679股我们的普通股; |
| ● | 786,710股普通股,可通过行使已发行认股权证发行,加权平均行权价为每股46.40美元; |
| ● | 602,173股普通股(在认股权证行使和2024年1月债务转换生效 后按形式计算为1,028,955股),可在行使 未发行的预筹资权证时发行,加权平均行权价为每股0.002美元。 |
以上讨论的 信息仅供参考,将根据定价时确定的实际公开发行价和本次发行的其他条款进行调整。
| 129 |
股本说明
下面的描述总结了我们证券中最重要的术语。由于它只是一个摘要,因此不包含可能对您重要的所有 信息。对于完整的描述,您应参考我们修订和重述的公司注册证书和重述的章程,其副本作为注册说明书的证物存档,本招股说明书是其中的一部分。
授权的 资本化
根据我们经修订及重述的公司注册证书,我们拥有250,000,000股法定股本,包括240,000,000股每股面值为0.0001美元的普通股及10,000,000股每股面值为0.0001美元的优先股。
截至2024年1月25日,已发行普通股为1,450,171股,未发行优先股。
普通股 股票
我们普通股的持有者 有权从我们董事会宣布的用于该用途的合法资金中分红。 普通股既不能赎回也不能转换。普通股持有人没有优先认购权或认购权 购买我们的任何证券。
我们普通股的每位持有者有权就其名下发行的每一股普通股投一票。普通股持有者无权在投票选举董事时累计投票数。
在我们清算、解散或清盘的情况下,我们普通股的持有者有权在偿还所有债务和其他债务后,按比例获得我们资产的按比例份额,这些资产可以合法地进行分配。我们普通股的所有流通股 均已缴足股款且不可评估。
优先股 股票
我们的 董事会有权在不需要股东采取进一步行动的情况下,在一个或多个类别或系列中发行最多10,000,000股优先股,并确定其指定、权利、优惠、特权和限制,而不需要股东进一步投票 或采取行动。这些权利、优先权和特权可能包括股息权、转换权、投票权、赎回条款、清算优先权、偿债基金条款以及构成或指定此类类别或系列的股份数量,其中任何或全部可能大于普通股的权利。发行我们的优先股可能会对普通股持有人的投票权以及该等持有人在我们清算时获得股息和付款的可能性产生不利影响。此外,优先股的发行可能会延迟、推迟或阻止我们公司控制权的变更或其他公司行动。没有优先股流通股,我们目前也没有计划发行任何优先股 。
反收购 特拉华州法律和我们的公司注册证书和附则的影响
特拉华州法律、我们修订和重述的公司证书以及我们修订和重述的以下法律的条款 可能会延迟、推迟或阻止另一方获得对我们的控制。
特拉华州一般公司法203节
我们 受特拉华州公司法第203条的约束,该条款禁止特拉华州公司在股东成为利益股东之日起三年内与该股东进行任何业务合并,但下列情况除外:
| ● | 在该日之前,公司董事会批准了导致股东成为利害关系人的企业合并或交易; |
| 130 |
| ● | 在导致股东成为有利害关系的股东的交易完成后,有利害关系的股东在交易开始时拥有公司至少85%的已发行有表决权股票,为了确定 已发行的有表决权的股票(但不包括相关股东拥有的已发行的有表决权的股票),不包括(I)担任董事和高级管理人员的 人所拥有的股份,以及(Ii)雇员参与者无权 秘密决定按该计划持有的股份是否将在投标或交换要约中被投标的股份;或 | |
| ● | 在 或之后,企业合并由董事会批准,并在股东年度会议或特别会议上批准,而不是通过书面同意,以至少662/3%的已发行有表决权股票的赞成票批准, 不为感兴趣的股东拥有。 |
一般而言,第203节对企业合并的定义包括以下内容:
| ● | 涉及公司和利益相关股东的任何合并或合并; | |
| ● | 将公司10%或以上的资产出售、转让、质押或以其他方式处置,涉及利害关系的股东; | |
| ● | 除某些例外情况外,导致公司向利益相关股东发行或转让公司任何股票的任何交易。 | |
| ● | 涉及该公司的任何交易,而该交易的效果是增加该公司股票或利益相关股东实益拥有的该公司任何类别或系列的股份的比例;或 | |
| ● | 利益相关股东收到公司或通过公司获得的任何损失、垫款、担保、质押或其他财务利益。 |
一般而言,第203条将“有利害关系的股东”定义为与此人的关联公司及联营公司一起实益拥有或在确定有利害关系的股东身份确定前三年内确实拥有公司已发行有表决权股票的15%或以上的实体或个人。
公司注册证书和附例
我们修订和重述的公司注册证书和修订和重述的章程规定:
| ● | 将我们的董事会分为三类; | |
| ● | 授权 发行“空白支票”优先股,其条款可以确定,其股票可以在没有股东批准的情况下发行 ; | |
| ● | 限制股东罢免董事; | |
| ● | 要求股东以绝对多数票修改我们的章程或公司注册证书的某些条款; | |
| ● | 禁止股东在书面同意下采取行动,从而要求所有股东行动必须在我们的股东会议上进行; | |
| ● | 取消股东召开股东特别会议的权利; | |
| ● | 规定提名董事会成员或提出可在股东大会上采取行动的事项的事先通知要求;以及 | |
| ● | 将特拉华州确立为针对我们的某些股东诉讼的独家管辖权。 |
| 131 |
授权但未发行股票的潜在影响
根据我们修订和重述的公司注册证书,我们有普通股和优先股可供未来发行 无需股东批准。我们可能会将这些增发的股份用于各种公司目的,包括未来的公开发行 以筹集额外资本,以促进公司收购或作为股本股息支付。
未发行和未保留的普通股和优先股的存在可能使我们的董事会能够向对当前管理层友好的人发行股票,或者发行优先股,其条款可能会使通过合并、要约收购、代理竞争或其他方式获得对我们的控制权的第三方尝试变得更加困难或受阻,从而保护我们管理层的连续性。 此外,董事会还有权决定指定、权利、优先股、特权和限制, 包括投票权、股息权、转换权、赎回权和清算优先股在内的每一系列优先股 ,在特拉华州公司法允许的最大范围内,并受我们的公司注册证书中规定的任何限制的约束。授权董事会发行优先股并确定适用于此类优先股的权利和优惠 的目的是消除与股东对特定发行进行表决有关的延误。发行优先股 虽然为可能的融资、收购和其他公司目的提供了理想的灵活性,但可能会 使第三方更难收购或阻止第三方收购我们已发行的有表决权股票的多数 。
论坛选择
除非 我们书面同意选择替代法院,否则特拉华州衡平法院应是任何股东提起(I)代表公司提起的任何衍生诉讼或法律程序,(Ii)声称公司任何董事、公司高管或其他员工或公司股东违反受托责任的任何诉讼, (Iii)任何针对公司或董事或公司高管提出索赔的唯一和排他性法院。或针对本公司或任何董事或本公司高级管理人员的索赔,对于DGCL任何条款的解释或适用, 我们的公司注册证书或章程,或(Iv)任何主张受内部事务原则管辖的索赔的诉讼,但在上述每一诉讼中,特拉华州衡平法院认定其没有管辖权的任何索赔除外。 本条款不适用于根据《交易法》产生的索赔,或任何其他规定具有专属联邦管辖权的联邦证券法。然而,独家法院条款规定,除非我们以书面形式同意选择替代法院,否则美利坚合众国联邦地区法院将是解决任何根据证券法提出的诉因的独家法院。因此,这一条款可以适用于属于专属法院条款中列举的一个或多个类别并根据证券法主张索赔的诉讼,因为证券法第22条规定联邦法院和州法院对执行证券法或其下的规则和法规规定的任何义务或责任的所有诉讼同时拥有管辖权。法院是否会对《证券法》下的债权执行这一排他性法院规定还存在不确定性。
我们 注意到,法院是否会执行该条款存在不确定性,投资者不能放弃遵守联邦证券法及其下的规则和法规。尽管我们相信这一条款对我们有利,因为它使特拉华州法律在其适用的诉讼类型中的适用更加 一致,但该条款可能会起到阻止 针对我们董事和高管的诉讼的效果。
转接 代理
我们普通股的转让代理是北卡罗来纳州的ComputerShare Trust Company。
| 132 |
我们提供的证券说明
我们 将以每股2.00美元的综合公开发行价发售1,375,000股普通股,并附带 认股权证。我们还提供预融资权证,以购买最多2,375,000股普通股 向在本次发售中购买我们普通股股份将导致买方及其关联公司和某些关联方在本次发售完成后实益拥有超过4.99% (或在买方选择时,9.99%)我们已发行普通股的购买者 代替将导致该超额所有权的普通股股份的购买者。每股我们的普通股或预融资认股权证 将与一份A系列认股权证和一份B系列认股权证一起出售,前者购买一股普通股,后者购买一半 普通股。本公司普通股及/或预筹资权证及相关认股权证的股份将另行发行。 本公司亦登记本公司普通股股份,可在行使本公司提供的预筹资权证及认股权证后不时发行。
普通股 股票
我们普通股的主要条款和规定在本招股说明书中的“股本说明”标题下进行了说明。
认股权证
在此提供的A系列权证和B系列权证的某些条款和条款的摘要 并不完整,受权证条款的约束,并受权证条款的限制,其形式作为证物提交给 注册说明书,本招股说明书是其中的一部分。潜在投资者应仔细审阅认股权证表格的条款和条款 ,以获得认股权证条款和条件的完整说明。
持续期 和行权价
A系列认股权证的行使价为每股2.00美元,可立即行使。A系列认股权证 将在发行之日起五年内到期。B系列认股权证的行权价为每股2.00美元,可立即行使。B系列认股权证将在发行之日起两年内到期。在股票分红、股票拆分、重组或类似事件影响我们的普通股和行使权证价格的情况下,认股权证的行使价格和可发行普通股的数量将进行适当的 调整。认股权证将与普通股和预筹资权证分开发行,并可在此后立即单独转让 。认股权证将只以经证明的形式发出。
可运动性
根据每位持有人的选择,认股权证将可全部或部分行使,方法是向吾等递交正式签署的行权通知 ,并就行权时所购买的普通股股数支付全数款项(以下讨论的无现金行权除外)。持有人(及其联属公司)不得行使该等持有人认股权证的任何部分至 持有人在行使后立即拥有超过4.99%的已发行普通股,但如持有人于 向吾等发出至少61天的事先通知,持有人可在行使该等认股权证后将已发行普通股的拥有量增加至紧接行使后已发行普通股的9.99%,该百分比拥有权乃根据认股权证的条款厘定。
| 133 |
无现金锻炼
如果, 在持有人行使认股权证时,登记根据证券法发行或转售普通股的登记声明 当时并未生效或不适用于发行该等股份,则持有人可选择在行使认股权证时收取(全部或部分)根据认股权证所载公式而厘定的普通股股份净额,以代替预期在行使认股权证时向吾等支付的现金款项。
基本交易
在 认股权证所述的基本交易的情况下,一般包括我们普通股股份的任何重组、资本重组或 重新分类,出售、转让或以其他方式处置我们的全部或几乎所有财产 或资产,我们与另一人的合并或合并,获得我们已发行股本所代表的超过50%的投票权,任何个人或团体成为我们已发行股本所代表的超过50%投票权的实益所有者,任何与另一实体的合并或进入另一实体的收购要约或交换要约,或经我们已发行股本所代表的投票权超过50%的 批准的要约或交换要约,则在随后的任何认股权证行使时,持有人 将有权就紧接该基本交易发生前因行使认股权证而可发行的每股普通股收取继承人或 收购公司或本公司的普通股股数作为替代对价,以及持有者在紧接该事件发生前 可行使认股权证的普通股股份数目的交易中或因该交易而应收的任何额外代价。尽管如上所述,如果发生基本交易,认股权证持有人有权在基本交易完成的同时或在完成基本交易后30天内,要求吾等或后续实体赎回认股权证,以换取认股权证未行使部分的布莱克-斯科尔斯价值(定义见各认股权证) 。
然而, 如果发生不在我们控制范围内的基本交易,包括未经本公司董事会批准的基本交易,则权证持有人将仅有权在基本交易完成之日从我们或我们的后续实体获得相同类型或形式(且按相同比例)的对价,按与基本交易相关的向我们普通股持有人提供和支付的权证的未行使部分的布莱克·斯科尔斯价值, 无论该对价是以现金形式,股票或现金和股票的任何组合,或者我们普通股的持有者是否可以选择接受与基本面交易相关的其他形式的对价。
可转让性
在符合适用法律的情况下,权证持有人在将权证连同适当的转让文书交回本行时,可自行选择转让权证。
零碎的 股
认股权证行使时,不会发行普通股的零碎股份。相反,根据我们的选择,将发行的普通股数量将向上舍入到下一个完整的份额,或者我们将就该最后的 份额支付现金调整,金额等于该份额乘以行使价。
交易 市场
权证还没有成熟的交易市场,我们预计不会有这样的市场发展。我们不打算申请在任何证券交易所或其他国家认可的交易系统上市 权证。如果没有活跃的交易市场,权证的流动性将极其有限。
| 134 |
权利 作为股东
除非 认股权证另有规定或凭藉持有人对本公司普通股股份的所有权,否则该认股权证持有人 不享有本公司普通股持有人的权利或特权,包括任何投票权,直至该持有人行使该等 持有人认股权证。认股权证将规定,认股权证持有人有权参与我们普通股的分派或股息。
豁免和修正案
经吾等同意及至少 大部分未清偿认股权证持有人同意,可修改或修订该等认股权证或放弃该等认股权证的规定。
预付资金 认股权证
以下提供的预资资权证的某些条款和条款摘要并不完整,受预资资权证条款的约束,并受预资资权证条款的全部限制,其形式将作为注册说明书的证物存档,本招股说明书是其中的一部分。潜在投资者应仔细阅读预融资权证表格的条款和条款 ,以获得预融资权证的条款和条件的完整说明。
持续期 和行权价
在此发售的每一份预付资助权证的每股普通股初始行权价将相当于0.0001美元。预融资认股权证 将立即可行使,并将在全部行使时到期。行权时可发行普通股的行权价格和股数在发生分红、股份拆分、重组或类似事件影响我们的普通股和行权价格时,将进行适当调整。
可运动性
预筹资权证将可由每名持有人选择全部或部分行使,方法是向吾等递交正式签立的行使权证通知,并就行使权证时所购买的普通股股数支付全数款项(以下讨论的无现金行使除外)。持有人(及其关联公司)不得行使预筹资权证的任何部分,条件是持有人在行使后立即拥有超过4.99%的普通股流通股,但 在持有人向我们发出至少61天的事先通知后,持有人可在行使预资资权证后立即将实益所有权增加至我们已发行普通股数量的9.99% 。因此,所有权百分比是根据预资金权证的条款确定的。 本次发行中预资资权证的购买者也可以选择在预资金权证发行之前将初始行使限额设定为我们普通股流通股的9.99%。
无现金锻炼
持股人可选择于行使时收取(全部或部分)普通股股份净额,以代替预期于行使该等行权时向吾等支付的现金支付,而非根据预付资助权证所载公式而厘定的普通股股份净额。
零碎的 股
在行使预筹资权证时,不会发行普通股的零碎股份。相反,在本公司的选择下,将发行的普通股数量将向上舍入到下一整股,或者本公司将支付现金调整 ,金额等于该分数乘以行使价格。
可转让性
在符合适用法律的情况下,预资金权证可在持有人将预资金权证连同适当的转让文书交还给我们时根据持有人的选择进行转让。
| 135 |
交易 市场
权证还没有成熟的交易市场,我们预计不会有这样的市场发展。我们不打算申请在任何证券交易所或其他国家认可的交易系统上市 预融资权证。如果没有活跃的交易市场,预融资权证的流动性将极其有限。
权利 作为股东
除 预资金权证另有规定或凭藉该持有人对普通股股份的所有权外,预资资权证持有人 在行使其预资资权证前,并不享有本公司普通股持有人的权利或特权,包括任何投票权。预融资权证将规定,预融资权证的持有人有权 参与我们普通股的分派或派息。
基本交易
如预付资权证所述发生基本交易,一般包括我们普通股股份的任何重组、资本重组或重新分类,出售、转让或以其他方式处置我们的全部或几乎所有财产 或资产,我们与另一人合并或合并,收购我们已发行股本所代表的超过50%的投票权,任何个人或团体成为我们已发行股本所代表的超过50%投票权的实益拥有者,任何与另一实体的合并或并入另一实体的收购要约或交换要约,或由我们已发行股本所代表的投票权的50%以上的收购要约或交换要约批准的,则在随后行使任何预先出资的认股权证时,持有人将有权就紧接该基本交易发生前的行使本应发行的普通股的每股普通股,获得作为替代对价的继承人或收购公司或本公司的普通股数量 或收购公司(如果是尚存的公司)的普通股数量,以及因持有者在紧接事件发生前可行使预筹资权证的普通股股份数目的交易而应收的任何额外代价 。
配售 代理权证
我们 还同意向配售代理(或其指定人)发行认股权证,以购买最多150,000股普通股 。配售代理权证将可即时行使,其条款与上述认股权证基本相同,不同之处在于,配售代理权证的行使价为每股2.50美元(相当于每股发行价及随附认股权证发行价的125%),终止日期为根据本次发售开始出售起计五年 年。请参阅下面的“分配计划”。
| 136 |
分销计划
根据日期为2023年12月27日(经修订)的聘用协议,我们已聘请H.C.Wainwright&Co.,LLC或配售代理作为我们的独家配售代理,以合理的最大努力 征求购买根据本招股说明书发售的证券的要约。合约协议并不会促使配售代理承诺购买本公司的任何证券,而根据合约协议,配售代理将无权约束我们。配售代理 不会购买或出售我们根据本招股说明书提供的任何证券,也不需要安排购买 或出售任何特定数量或金额的证券。这是一项尽力而为的促销活动,没有最低发售金额要求 作为本次发售结束的条件。配售代理已同意尽合理最大努力安排我们出售证券。因此,我们可能不会出售所有普通股、预融资权证和认股权证。本次发售的条款取决于市场状况以及我们、配售代理和潜在投资者之间的谈判。配售代理不保证它将能够在任何预期的发行中筹集新资本。配售代理可以聘请子代理或选定的交易商来协助此次发售。
购买此处提供的证券的投资者 将有权与我们签署证券购买协议。除了根据联邦证券和州法律向本次发售的所有购买者提供的权利和 补救措施外,签订证券购买协议的购买者还可以向我们提出违约索赔。对于本次发售中的较大购买者来说,要求违约索赔的能力是至关重要的,以此作为一种手段,以执行根据证券购买协议向他们提供的以下独特契约:(I)在发售结束后一年内不进行浮动利率融资的契约,除某些例外情况外;以及(Ii)在发售结束后90天内不进行任何股权融资的契约,但某些例外情况除外。证券购买协议中的陈述、担保和契诺的性质应包括:
| ● | 就组织、资格、授权、无冲突、无需政府备案、美国证券交易委员会备案中的现行事项、无诉讼、劳工或其他合规问题、环境、知识产权和所有权事项以及对《反海外腐败法》等各种法律的合规性作出标准的陈述和保证;以及 | |
| ● | 关于认股权证登记、不得与其他发行整合、无股东权利计划、无重大非公开信息、收益的使用、购买者的赔偿、普通股的保留和上市以及90天内不得 后续股权出售等事项的契约。 |
我们 将在收到投资者资金后向投资者交付正在发行的证券,以购买根据本招股说明书 提供的证券。我们预计将在2024年2月6日左右交付根据本招股说明书发行的证券。 本次发行没有最低证券数量或收益金额的限制。
费用 和费用
我们 已同意向配售代理支付相当于此次发行所得总收益7.8%的总现金费用。 我们将向配售代理偿还与此次发行相关的50,000美元的非实报实销费用津贴、最高100,000美元的法律费用和费用以及最高15,950美元的清算费用。我们估计,不包括配售代理费和费用,本次发行的总费用约为216,237美元。
配售 代理权证
此外,吾等已同意向配售代理或其指定人或配售代理权证发行认股权证,以购买本次发售的普通股股份总数的4.0%(包括任何预先出资认股权证的相关股份), 行使价相当于本次发售的每股公开发行价的125%及随附的认股权证。 配售代理权证将于发行时行使,并于根据本次发售开始发售后五年届满。
| 137 |
如果在行使时没有有效的登记声明登记,或其中所载的招股说明书无法供配售代理权证持有人转售认股权证股份,则配售代理权证可于此时以“无现金行使”的方式全部或部分行使,即持有人有权收取按配售代理权证计算的数目 认股权证股份。
配售代理权证根据FINRA规则5110规定了惯常的反稀释条款(适用于股票分红、拆分和资本重组等) 。
尾巴
如果在吾等与配售代理的合约协议期限内,配售代理(或与本公司就发售事宜举行会议)向本公司介绍的任何投资者在吾等与配售代理的合约终止或到期后二十四(24)个月内,以公开或非公开发售或集资交易的形式向吾等提供任何资本,吾等将向配售代理支付上文就该等 投资者的总收益所提供的现金及认股权证补偿。根据FINRA规则2010,安置代理只有在当事人由安置代理直接介绍给我们的范围内才有权获得此类费用。
优先购买权
在完成发售的情况下,吾等已向配售代理授予优先购买权,据此,如吾等决定通过公开发售 (包括场内融资)或私募或任何其他股本、股权挂钩或债务证券的筹资方式筹集资金,吾等有权在本次发售完成后二十四(24)个月前的任何时间聘用投资银行或经纪/交易商作为唯一账簿管理人、承销商或配售代理。
锁定协议
我们的 高级管理人员和董事已与配售代理达成协议,在本次 发售结束后有90天的禁售期。这意味着,在适用的禁售期内,该等人士不得直接或间接要约出售、订立合约出售、出售、分销、授予购买、质押、质押或以其他方式处置本公司普通股的任何股份或可转换为或可行使或交换本公司普通股的任何证券的任何期权、权利或认股权证。如果受让方同意这些锁定限制,则允许在禁售期内进行某些有限转让。我们还同意在本次发行结束后90天内对我们的证券的发行和销售进行类似的锁定 限制,但某些例外情况除外。配售代理可全权酌情决定放弃任何此等锁定协议的条款,而无须另行通知。
此外,除某些例外情况外,吾等已同意在本次发售结束后一年内,不发行任何根据本公司普通股交易价格或未来特定或或有事件进行价格重置的证券,或签订任何协议,以未来确定的价格发行证券。
赔偿
我们 已同意对配售代理的某些责任(包括《证券法》规定的某些责任)进行赔偿,或 对配售代理可能被要求就这些责任进行的付款作出贡献。
此外,我们将保障本次发行中证券的购买者免于承担以下责任:(i)违反 任何陈述、保证、我们在证券购买协议或相关文件中订立的契约或协议 或(ii)第三方对购买者提起的任何诉讼(与该购买者有关联的第三方除外)就证券购买协议或相关文件及其预期的交易,但某些例外情况除外
| 138 |
遵守规则 M
配售代理可被视为《证券法》第2(a)(11)节所指的承销商,其收取的任何费用 以及其作为委托人出售我们的证券所实现的任何利润可被视为《证券法》规定的承销折扣或佣金。配售代理将被要求遵守《证券法》和《交易法》的要求,包括但不限于《交易法》下的规则10 b-5和条例M。这些规则和条例 可能会限制配售代理购买和出售我们证券的时间。根据这些规则和条例,配售 代理人不得(i)从事与我们的证券有关的任何稳定活动;以及(ii)投标或购买我们的任何证券 或试图诱使任何人购买我们的任何证券,但《交易法》允许的除外,直到他们完成 参与分销。
其他 关系
在与我们或我们的关联公司的正常业务过程中,配售代理及其关联公司已经并可能在未来从事投资银行交易和其他商业交易。配售代理已收到或将来可能收到这些交易的惯常费用和佣金。
此外,在正常的业务活动中,配售代理及其联营公司可进行或持有多种投资,并积极为其本身及客户的账户进行债务及股权证券(或相关衍生证券)的交易。该等投资及证券活动可能涉及吾等或吾等联属公司的证券及/或票据。配售代理及其附属公司亦可就该等证券或金融工具提出投资建议及/或发表或发表独立研究意见,并可持有或建议客户持有该等证券及工具的多头及/或空头仓位。
根据我们在市场上提供的服务,配售代理充当配售代理。就自动柜员机协议而言,配售代理有权根据该协议按每次出售本公司普通股股份所得毛收入的3.0%收取佣金。关于签订自动柜员机协议,我们向配售代理退还了50,000美元的费用。此外,我们同意在每一次尽职调查更新会议上向安置代理报销最高2,500美元的法律顾问费用和任何附带费用。
配售代理在2023年9月的发售中担任配售代理。关于2023年9月的发售,配售代理收到(I)280,000.01美元的配售代理费,或2023年9月发售所筹总收益的7.0%,以及(Ii)偿还 非实报实销费用50,000美元、律师费和开支100,000美元,以及结算费用15,950美元。此外,在2023年9月发售的截止日期,我们向配售代理(或其指定人)发行了配售代理权证,向配售代理(或其指定人)购买总计17,316股普通股。此类配售代理权证的行使价为14.44美元,将于2028年9月11日到期。
电子分发
可在配售代理维护的网站上提供电子格式的招股说明书,且配售代理可以电子方式分发招股说明书。除电子形式的招股说明书外,这些网站上的信息不是本招股说明书的一部分,也不是本招股说明书的一部分,未经我们或配售代理的批准和/或背书 ,投资者不应依赖。
转接 代理
我们普通股的转让代理和登记机构是北卡罗来纳州的ComputerShare Trust Company。
纳斯达克 上市
我们的 普通股在纳斯达克上挂牌交易,代码是“CING”。
| 139 |
法律事务
此招股说明书提供的证券的有效性将由纽约Lowenstein Sandler LLP为我们传递。Ellenoff Grossman&Schole LLP,New York,New York,是与此次发行相关的安置代理的法律顾问。
专家
我们截至2022年12月31日、2022年12月31日和2021年12月31日的合并财务报表,以及截至2022年12月31日的两年期间内的每一年的综合财务报表,都是根据本文其他部分出现的独立注册会计师事务所毕马威会计师事务所的报告 以及该事务所作为会计和审计专家的权威 计入的。涵盖2022年12月31日和2021年12月31日合并财务报表的审计报告包含一个解释性段落,其中指出,我们的经常性运营亏损和净资本不足使人对该实体作为持续经营企业的能力产生了极大的怀疑。合并财务报表 不包括这种不确定性的结果可能导致的任何调整。
| 140 |
此处 您可以找到详细信息
本招股说明书是我们向美国证券交易委员会提交的注册声明的一部分。本招股说明书并不包含注册说明书中所列的所有信息以及注册说明书的证物。有关我们和我们在本招股说明书下提供的证券的更多信息,请参阅注册声明以及作为注册声明的一部分提交的证物和时间表。你应该只依赖本招股说明书中包含的信息。我们未授权其他任何人向您提供不同的信息。我们不会在任何不允许要约的司法管辖区对这些证券进行要约。 您应假定本招股说明书中包含的信息仅在相关文件的日期是准确的,无论本招股说明书的交付时间或我们证券的任何出售时间。
我们 遵守《交易法》的信息要求,并根据《交易法》向委员会提交年度、季度和其他报告、 委托书和其他信息。此类报告、委托书和其他信息,包括登记声明、证物和时间表,可通过委员会的网站www.sec.gov向公众查阅。
我们 在我们以电子方式向证监会提交或以其他方式向证监会提交这些材料后,在合理可行的情况下,尽快在我们的网站上或通过我们的网站免费提供我们的年度报告Form 10-K、Form 10-Q季度报告、Form 8-K当前报告 以及根据1934年《证券交易法》第13(A)或15(D)节提交或提供的报告修正案。本招股说明书中包含的信息或 可能通过本网站访问的信息不是本招股说明书的一部分,也不包含在本招股说明书中。
| 141 |
Cingate, Inc.
合并财务报表索引
| 经审计的 合并财务报表 | |
| 独立注册会计师事务所报告 | F-4 |
| 截至2022年和2021年12月31日的合并资产负债表 | F-5 |
| 截至2022年和2021年12月31日止年度的综合业务报表 | F-6 |
| 截至2022年12月31日和2021年12月31日止年度股东权益变动表 | F-7 |
| 截至2022年12月31日和2021年12月31日的年度现金流量表 | F-8 |
| 财务报表附注 | F-9 |
| 未经审计的 合并财务报表 | |
| 截至2023年9月30日和2023年12月31日的合并资产负债表 | F- 25 |
| 截至2023年9月30日和2022年9月30日的三个月和九个月的综合经营报表 | F-26 |
| 截至2023年9月30日和2022年9月30日的9个月股东权益合并报表 | F-27 |
| 截至2023年9月30日和2023年9月30日的9个月合并现金流量表 | F-28 |
| 合并财务报表附注 | F-29 |
| F-1 |
Cingate Inc.
合并财务报表
截至2022年12月31日和2021年12月31日的年度
(附独立注册会计师事务所报告)
| F-2 |
Cingate Inc.
合并财务报表
截至及截至2022年和2021年12月31日止年度
目录表
| 页面 | |
| 独立注册会计师事务所报告(PCAOB ID:185) | F-4 |
| 合并资产负债表 | F-5 |
| 合并经营报表和全面亏损 | F-6 |
| 合并股东权益变动表 | F-7 |
| 合并现金流量表 | F-8 |
| 合并财务报表附注 | F-9 |
| F-3 |
独立注册会计师事务所报告
致 股东和董事会
Cingate Inc.:
关于合并财务报表的意见
我们 已审计所附Cingate Inc.(本公司)截至2022年12月31日及2021年12月31日的综合资产负债表、截至2022年12月31日止两年内各年度的相关综合经营报表及全面亏损、股东权益及现金流量,以及相关附注(统称为综合财务报表)。我们认为, 综合财务报表按照美国公认会计原则,公平地反映了公司截至2022年12月31日、2022年12月31日和2021年12月31日的财务状况,以及截至2022年12月31日的两年内各年度的经营成果和现金流。
正在进行 关注
随附的综合财务报表已于 编制时假设本公司将继续作为持续经营企业。如综合财务报表附注1所述,本公司已出现营运亏损,累积亏损,并需要额外资金以进行营运及发展, 所有这些都令人对其作为持续经营企业的持续经营能力产生重大怀疑。附注1也说明了管理层关于这些事项的计划。合并财务报表不包括可能因这种不确定性的结果而产生的任何调整 。
征求意见的依据
这些 合并财务报表由公司管理层负责。我们的责任是根据我们的审计对这些合并财务报表发表意见 。我们是一家在美国上市公司会计监督委员会(PCAOB)注册的公共会计师事务所,根据美国联邦证券法以及美国证券交易委员会和PCAOB的适用规则和法规,我们必须对公司保持独立。
我们 按照PCAOB的标准进行审计。这些标准要求我们计划和执行审计,以获得关于合并财务报表是否没有重大错报的合理保证,无论是由于错误还是欺诈。我们的审计包括执行程序 以评估合并财务报表重大错报的风险,无论是由于错误还是欺诈,以及执行应对这些风险的程序。这些程序包括在测试基础上审查关于合并财务报表中的金额和披露的证据 。我们的审计还包括评估管理层使用的会计原则和作出的重大估计,以及评估合并财务报表的整体列报。我们相信,我们的审计 为我们的观点提供了合理的基础。
/s/毕马威律师事务所
我们 自2020年起担任本公司的审计师。
密苏里州堪萨斯市
2023年3月10日,除注19日期为2024年1月12日外
| F-4 |
Cingate Inc.
合并资产负债表
2022年12月31日和2021年12月31日
| 2022 | 2021 | |||||||
| 资产 | ||||||||
| 流动资产: | ||||||||
| 现金和现金等价物 | $ | 5,356,276 | $ | 16,492,745 | ||||
| 短期投资 | - | 933 | ||||||
| 杂项应收账款 | 234,432 | 690,248 | ||||||
| 预付费用和其他流动资产 | 2,278,944 | 1,698,353 | ||||||
| 流动资产总额 | 7,869,652 | 18,882,279 | ||||||
| 财产和设备,净额 | 2,904,787 | 3,145,378 | ||||||
| 经营性租赁使用权资产 | 630,618 | 858,600 | ||||||
| 总资产 | 11,405,057 | 22,886,257 | ||||||
| 负债和股东权益 | ||||||||
| 流动负债: | ||||||||
| 应付帐款 | 762,357 | 264,687 | ||||||
| 应计费用 | 894,635 | 601,300 | ||||||
| 应付票据 | 5,000,000 | - | ||||||
| 融资租赁负债,流动 | 16,053 | 15,096 | ||||||
| 经营租赁负债,流动 | 339,755 | 295,595 | ||||||
| 流动负债总额 | 7,012,800 | 1,176,678 | ||||||
| 长期负债: | ||||||||
| 融资租赁负债,当期净额 | 21,487 | 37,534 | ||||||
| 经营租赁负债,当期净额 | 488,748 | 828,503 | ||||||
| 长期负债总额 | 510,235 | 866,037 | ||||||
| 总负债 | 7,523,035 | 2,042,715 | ||||||
| 股东权益 | ||||||||
| 普通股,面值0.0001美元;截至2022年12月31日和2021年12月31日,批准发行2.4亿股,发行和发行股票565,470股 | 57 | 57 | ||||||
| 优先股,面值0.0001美元;截至2022年12月31日和2021年12月31日,授权发行股票10,000,000股,发行和发行股票为0股 | - | - | ||||||
| 额外实收资本 | 73,290,461 | 72,575,584 | ||||||
| 累计其他综合收益 | - | 165 | ||||||
| 累计赤字 | (69,408,496 | ) | (51,732,264 | ) | ||||
| 股东权益总额 | 3,882,022 | 20,843,542 | ||||||
| 总负债和股东权益 | $ | 11,405,057 | $ | 22,886,257 | ||||
见 合并财务报表附注。
| F-5 |
Cingate Inc.
合并经营报表和全面亏损
截至2022年和2021年12月31日的年度
| 2022 | 2021 | |||||||
| 运营费用: | ||||||||
| 研发 | $ | 8,995,280 | $ | 8,410,489 | ||||
| 一般和行政 | 8,506,438 | 12,268,909 | ||||||
| 营业亏损 | (17,501,718 | ) | (20,679,398 | ) | ||||
| 利息和其他费用,净额 | (174,514 | ) | (30,593 | ) | ||||
| 所得税前亏损 | (17,676,232 | ) | (20,709,991 | ) | ||||
| 所得税优惠(费用) | - | - | ||||||
| 净亏损和综合亏损 | $ | (17,676,232 | ) | $ | (20,709,991 | ) | ||
| 普通股基本每股净亏损和稀释后每股净亏损 | $ | (31.26 | ) | $ | (55.87 | ) | ||
| 用于计算基本普通股和稀释后普通股每股净亏损的加权平均股数 | 565,470 | 370,679 | ||||||
见 合并财务报表附注。
| F-6 |
Cingate Inc.
股东权益合并报表
截至2022年和2021年12月31日的年度
| 累计 | ||||||||||||||||||||||||||||
| 普通股 | 额外的实收- | 成员的 | 累计 | 其他综合 | 股东的 | |||||||||||||||||||||||
| 股票 | 金额 | 资本 | 资本 | 赤字 | 收入 | 权益 | ||||||||||||||||||||||
| 余额2021年1月1日 | - | - | $ | 32,314,543 | $ | (31,022,273 | ) | $ | 165 | $ | 1,292,435 | |||||||||||||||||
| 会员的出资 | - | - | - | 7,104,957 | - | - | 7,104,957 | |||||||||||||||||||||
| 短期投资的未实现亏损 | - | - | - | - | - | - | - | |||||||||||||||||||||
| IPO发行的普通股,扣除发行成本4,627,079美元 | 208,333 | 21 | 20,374,197 | - | - | - | 20,374,218 | |||||||||||||||||||||
| 基于股票的薪酬费用 | - | - | 43,835 | - | - | - | 43,835 | |||||||||||||||||||||
| 与重组合并有关的有限责任公司单位转换为普通股 | 357,137 | 36 | 39,419,464 | (39,419,500 | ) | - | - | (0 | ) | |||||||||||||||||||
| 与重组合并有关的利润利益单位的变更 | - | - | 12,738,088 | - | - | - | 12,738,088 | |||||||||||||||||||||
| 净亏损 | - | - | - | - | (20,709,991 | ) | - | (20,709,991 | ) | |||||||||||||||||||
| 余额2021年12月31日 | 565,470 | 57 | $ | 72,575,584 | $ | - | $ | (51,732,264 | ) | $ | 165 | $ | 20,843,542 | |||||||||||||||
| 可供出售的投资 | - | - | - | - | - | (165 | ) | (165 | ) | |||||||||||||||||||
| 基于股票的薪酬费用 | - | - | 800,796 | - | - | - | 800,796 | |||||||||||||||||||||
| IPO成本 | - | - | (85,919 | ) | - | - | - | (85,919 | ) | |||||||||||||||||||
| 净亏损 | - | - | - | - | (17,676,232 | ) | - | (17,676,232 | ) | |||||||||||||||||||
| 余额2022年12月31日 | 565,470 | 57 | $ | 73,290,461 | $ | - | $ | (69,408,496 | ) | $ | - | $ | 3,882,022 | |||||||||||||||
见 合并财务报表附注
| F-7 |
Cingate Inc.
合并现金流量表
截至2022年和2021年12月31日的年度
| 2022 | 2021 | |||||||
| 经营活动: | ||||||||
| 净亏损 | $ | (17,676,232 | ) | $ | (20,709,991 | ) | ||
| 对净亏损与经营活动中使用的现金净额进行的调整: | ||||||||
| 折旧 | 394,011 | 708,317 | ||||||
| 与利润利息单位变动有关的非现金补偿费用 | - | 12,738,088 | ||||||
| 基于股票的薪酬 | 800,796 | 43,835 | ||||||
| 经营性资产和负债变动情况: | ||||||||
| 杂项应收账款 | 455,816 | (538,476 | ) | |||||
| 预付费用和其他流动资产 | (580,591 | ) | (1,258,857 | ) | ||||
| 经营性租赁使用权资产 | 227,982 | 100,124 | ||||||
| 应付贸易账款和应计费用 | 791,005 | (1,324,686 | ) | |||||
| 经营租赁负债的当期部分 | 44,160 | 61,427 | ||||||
| 经营租赁负债的长期部分 | (339,755 | ) | (228,938 | ) | ||||
| 其他负债 | - | (23,615 | ) | |||||
| 用于经营活动的现金净额 | (15,882,808 | ) | (10,432,772 | ) | ||||
| 投资活动: | ||||||||
| 购置财产和设备 | (153,420 | ) | (814,736 | ) | ||||
| 出售短期投资所得收益 | 933 | - | ||||||
| 其他 | (165 | ) | - | |||||
| 用于投资活动的现金净额 | (152,652 | ) | (814,736 | ) | ||||
| 融资活动: | ||||||||
| 首次公开发行普通股所得款项净额 | - | 20,374,218 | ||||||
| IPO发行成本 | (85,919) | |||||||
| 会员的出资 | - | 7,104,957 | ||||||
| 应付票据的付款 | - | (500,335 | ) | |||||
| 应付票据收益 | 5,000,000 | - | ||||||
| 融资租赁债务的本金支付 | (15,090 | ) | (436,259 | ) | ||||
| 融资活动提供的现金净额 | 4,898,991 | 26,542,581 | ||||||
| 现金和现金等价物: | ||||||||
| 现金和现金等价物净减少 | (11,136,469 | ) | 15,295,073 | |||||
| 年初现金及现金等价物 | 16,492,745 | 1,197,672 | ||||||
| 年终现金及现金等价物 | $ | 5,356,276 | $ | 16,492,745 | ||||
| 非现金活动 | ||||||||
| 应计财产和设备在年终时未支付 | $ | - | $ | 279,730 | ||||
| 现金支付: | ||||||||
| 支付的利息 | $ | 19,000 | $ | 114,725 | ||||
见 合并财务报表附注
| F-8 |
Cingate Inc.
合并财务报表附注
截至2022年12月31日和2021年12月31日的年度
(1)业务性质和流动资金
组织
Cingulate Inc.是一家生物制药公司,专注于利用其药物输送平台技术开发产品,使 能够 配制和制造每日一次的多剂量疗法片剂,最初专注于治疗注意力缺陷/多动障碍(ADHD)。该公司正在开发两种专有的一线兴奋剂药物CTX-1301(醋酸地塞米松)和CTX-1302(右旋苯丙胺),用于治疗ADHD,适用于所有患者群体:儿童、青少年和成人。CTX-1301和CTX-1302采用灵活的核心压片技术和目标产品配置文件,旨在提供快速起效和持续整个活动 天,血浆药物水平可控下降,并具有良好的耐受性。该公司已经启动了CTX-1301的第三阶段临床试验,成人剂量优化研究中的第一批患者于2023年初投药。此外,该公司还有第三种治疗焦虑的产品,CTX-2103,正在研制阶段。
2012年11月14日,特拉华州有限责任公司Cingate Treateutics LLC(CTX)成立。2021年5月10日,CTX的特拉华州公司和全资子公司Cingate Inc.(Cingate,或本公司)成立,作为控股公司, 预期本公司将上市。通过2021年第三季度发生的重组合并,Cingate 有效地收购了CTX,CTX的所有已发行单位均转换为Cingate普通股。CTX仍是公司开展业务的实体 。
CTX 是Cingate的前身,用于财务报告目的。截至2022年12月31日和2021年12月31日止年度的综合财务报表和附注代表Cingate及其附属公司(包括CTX)的全面合并,而所有提及 公司的内容均代表此项全面合并。
流动性
公司自成立以来在运营中出现了亏损和负现金流。作为一家收入前实体,公司依赖于 筹集资金支持运营的能力,直到正在开发的候选产品获得美国食品和药物管理局(FDA)的批准、生产、上市并产生收入。首次公开募股于2021年12月完成,使公司有能力继续其研发活动。此外,如附注7所述,本公司于2022年8月从本票获得500万美元的收益。然而,本公司将需要额外的 资金用于运营和开发。于2023年1月,本公司与作为销售代理(“Wainwright”)的H.C.Wainwright&Co.,LLC订立市场发售协议(“ATM 协议”),据此,本公司可不时透过Wainwright发售其普通股股份,总收益最高可达2,650,000美元。此外,管理层正在评估获得资金的各种战略,可能包括额外发行普通股、发行债务或其他资本来源,包括与其他公司的潜在合作或其他战略交易。成功实施这些计划既需要公司的努力,也需要公司控制之外的因素,例如市场因素和FDA对候选产品的批准。本公司不能保证其计划将以有效实施的方式得到有效实施,从而使上述条件和事件得到充分缓解或缓解,这导致人们对本公司在财务报表发布之日起一年内继续经营的能力产生很大怀疑。随附的综合财务报表 乃以持续经营为基础编制,考虑正常业务过程中的资产变现及负债清偿情况 。合并财务报表不反映这种不确定性的结果 可能导致的任何调整。
| F-9 |
(2)重要会计政策摘要
(A)列报基础和合并原则
随附的综合财务报表是根据美国公认会计原则(“美国公认会计原则”)编制的。合并财务报表包括Cingate及其全资子公司的账目。所有跨公司 账户和交易已在合并中取消。
(B)预算的使用
根据美国公认会计原则编制合并财务报表要求管理层作出估计和假设,以影响报告期间资产和负债的报告金额、合并财务报表日期的或有资产和负债的披露以及报告期内报告的费用金额。实际结果可能与估计的不同。
估计 及假设会被定期检视,而修订的影响会反映在确定为有需要的 期间的综合财务报表内。
(三)信用风险集中
公司持有现金等值存款,在整个财政年度内,这些存款在不同时间超过了联邦存款保险公司投保的250,000美元限额(不考虑对账项目)。管理层监督这些金融机构的稳健性,并不认为本公司与存款中未投保部分相关的任何重大信用风险。
(D)现金和现金等价物
银行 活期存款账户和初始到期日不超过三个月的短期流动投资被视为现金和现金等价物。截至2022年12月31日和2021年12月31日的现金和现金等价物包括银行存款和短期货币市场基金。 现金和现金等价物按公允价值的成本列账。
(E)杂项应收款
杂项 应收账款包括公司2021年和2020年联邦所得税申报单(尚未收到)产生的工资税抵免,以及这两年发生的工资成本的员工留成税抵免。该公司分析了IAS 20,政府补助金的会计核算和政府援助的披露 “,在对这些应收款进行会计处理时。截至2022年12月31日和2021年12月31日,本公司确定不需要与这些应收账款相关的拨备。
(F)财产和设备,净额
财产和设备净额按成本减去累计折旧列报。保养和维修在发生时计入费用。物业及设备按估计剩余使用年限采用直线折旧,或如属租赁改善 或融资租赁项下租赁资产,则按租赁年期(如较短)计提折旧。
(G)租契
公司是两份不可撤销的经营租约中的承租人,这两份租约涉及堪萨斯城总部办公室和新泽西办公室的办公空间,以及两份某些家具和设备的融资租赁,其中一份租期于2021年12月31日结束。
| F-10 |
公司在合同开始时确定安排是否为租约或包含租约。本公司在租赁开始日确认ROU资产和租赁负债。就经营租赁而言,租赁负债最初及其后按租赁开始日未付租赁付款的现值 计量。就融资租赁而言,租赁负债最初以与营运租赁相同的 方式及日期计量,其后按实际利息法按摊销成本计量。
公司确定用于将未付租赁付款贴现到现值的贴现率,这需要管理层判断。 ASC 842要求承租人使用租赁中隐含的利率对未付租赁付款进行贴现,如果该利率无法 轻易确定,则使用其递增借款利率进行贴现。隐含利率在本公司其中一份租约的协议中列明;但对于其他租约,由于本公司无法获得出租人的估计剩余价值或出租人的递延初始直接成本金额,因此隐含利率无法确定。因此,公司使用其递增借款利率作为这些租赁的贴现率。本公司租赁的递增借款利率是指其在抵押基础上借入等同于类似条款下的租赁付款的金额所需支付的利率。由于本公司一直无法在抵押的基础上借款,因此它根据信用评级机构在确定实体的信用评级时通常会分析的因素来确定综合信用评级。由于本公司为收入前实体,本公司 决定其递增借款利率应基于租赁计量日期的综合CCC和较低的债券利差 加上基于特定租赁到期日的无风险利率。
投资收益资产初步按成本计量,包括按租赁开始日或租赁开始日之前支付的租赁付款调整后的租赁负债初始金额,加上产生的任何初始直接成本减去收到的任何租赁激励。
对于 经营租赁,ROU资产随后在整个租赁期内按租赁负债的账面价值加上 初始直接成本,加上(减去)任何预付(应计)租赁付款,减去收到的累计租赁激励的未摊销余额 。租赁费用在租赁期限内以直线方式确认,包括租赁负债的增加和ROU资产的摊销。
对于融资租赁,除非租赁将标的资产的所有权转让给本公司,或本公司合理确定将行使标的资产的选择权转让给本公司,否则ROU资产随后将使用直线方法从租赁开始日起至其使用年限结束或租赁期结束前的 摊销。在这些情况下,ROU资产将在标的资产的使用年限内摊销。ROU资产的摊销与租赁负债的利息支出 分开确认和列报。
ROU 经营和融资租赁的资产评估减值损失。根据ASC分主题 360-10中的长期资产减值指导,财产和设备--总体。ROU资产与其所在的资产组一起评估减值。
经营性租赁ROU资产在合并资产负债表中作为经营性租赁使用权资产列示。经营租赁负债的当期和长期部分 在综合资产负债表中分别列示。融资租赁ROU资产包括房地产、厂房和设备。融资租赁负债的当期部分和长期部分分别列于综合资产负债表 。
(H)长期资产减值
当事件或情况显示其长期资产(包括物业及设备)的账面价值可能无法收回时,公司会评估该等资产的账面价值。这些事件或环境变化可能包括经营业绩显著恶化、业务计划发生变化或预期未来现金流发生变化。如果存在减值指标,本公司将通过将资产的账面价值与资产预期产生的未贴现现金流量进行比较来评估可回收性。如果预期未来现金流的总和少于账面金额,公司将确认减值损失。减值损失将通过比较账面价值超过长期资产组公允价值的金额来计量。截至2022年12月31日或2021年12月31日止年度并无确认减值。
| F-11 |
五、(一)研发
研究和开发成本在发生时计入费用,包括与公司的 候选产品开发相关的所有直接和间接成本。这些费用包括向第三方支付的研发和制造服务、人员成本和制造设备的折旧。在报告期末,该公司将向第三方服务提供商支付的款项与在完成研发目标方面的估计进度进行比较。当获得更多信息时,此类估计可能会发生变化。根据向服务提供商付款的时间以及公司估计所提供的服务取得的进展,公司可能会记录与这些成本相关的预付或应计费用净额。
(J)基于股票的薪酬
公司使用布莱克-斯科尔斯期权定价模型,根据员工授予日期的公允价值 衡量所有股票奖励的员工和董事股票薪酬支出。对于有服务条件的股票奖励,股票薪酬费用在必要的服务期限内采用直线法进行确认。没收行为在发生时予以确认。请参阅附注11中的其他信息 。
*(K)Paycheck保护计划
2020年3月27日,美国联邦政府颁布了《冠状病毒援助、救济和经济安全法案》(简称《CARE法案》)。 CARS法案包括一项关于Paycheck保护计划(PPP)的条款,该计划由美国小企业管理局(SBA)管理,并由2020年6月5日颁布的Paycheck保护计划灵活性法案(“PPP灵活性法案”)进一步修订。2020年4月,公司获得了312,500美元的购买力平价贷款。2021年2月,该公司获得了第二笔购买力平价贷款236,457美元。根据经PPP灵活性法案修订的CARE法案的要求,如果将收益用于支付符合条件的工资成本、租金、抵押贷款利息和水电费,则PPP贷款可完全免除。
2021年7月,公司接到通知,第一笔购买力平价贷款被小企业管理局免除;2021年10月,公司接到通知,第二笔购买力平价贷款被小企业管理局免除。该公司分析了IAS 20,政府补助金的会计核算和政府援助的披露“, 这些贷款的会计处理。
(L)片断
运营部门是公司的组成部分,有单独的财务信息可用,并由公司的首席运营决策者在决定如何分配资源和评估业绩时定期进行评估。该公司目前在 一个运营业务部门--药品开发开展业务。
*(M)所得税
Cingate Inc.根据《国内税法》作为C类公司征税。Cingate Inc.记录递延所得税,以反映财务报告中记录的资产和负债金额与税务法律和法规计量的此类金额之间的临时差异的影响。截至2022年12月31日,CTX是Cingate Inc.的全资豁免实体,CTX及其全资子公司Cingate Works Inc.的所有活动均包括在Cingate Inc.的当期和 递延税项资产和负债的计算中。该公司确定,根据历史收入水平和未来应纳税所得额等项目,它更有可能无法实现 其递延税项资产,因此记录了 全额估值准备。
| F-12 |
公司尚未确定任何不确定的税务状况。合并财务报表中未确认与不确定税务状况相关的利息或罚金。此外,不存在未确认税收优惠总额在未来12个月内有合理可能大幅增加或减少的税务头寸。
公司在联邦和各州司法管辖区提交所得税申报单。这些联邦所得税无关紧要。公司 在2019年前的几年内不再接受美国税务机关的联邦所得税审查。
(N)普通股认购权证
该公司于2021年12月发行了与其IPO相关的认股权证。这些权益工具在发行时按公允价值估值。请参阅附注12中的其他信息。
(O)每股净亏损
基本每股净亏损是通过将净亏损除以期内已发行普通股的加权平均数计算得出的。 不考虑潜在的稀释证券。每股普通股摊薄净亏损的计算方法为:用简化方法将净亏损除以期内已发行普通股的加权平均数加上期内潜在摊薄工具数量的总和 。稀释每股净亏损与每股基本净亏损相同,因为潜在摊薄证券的影响是反摊薄的。
(3) 预付 费用和其他流动资产
预付 费用
截至2022年12月31日和2021年12月31日,预付费用和其他流动资产包括:
预付费用明细表
| 2022 | 2021 | |||||||
| 研发 | $ | 1,377,391 | $ | 643,917 | ||||
| 保险 | 472,152 | 761,594 | ||||||
| 活性药物成分 | 209,156 | 264,361 | ||||||
| 递延筹资成本 | 100,339 | - | ||||||
| 专业费用 | 61,524 | - | ||||||
| 会费和订阅费 | 37,684 | - | ||||||
| 其他 | 20,698 | 28,481 | ||||||
| 预付费用总额 | $ | 2,278,944 | $ | 1,698,353 | ||||
| F-13 |
(4)物业及设备
截至2022年12月31日和2021年12月31日,财产和设备净值如下:
财产和设备附表
| 估计数 | ||||||||||||
| 使用寿命 | ||||||||||||
| (单位:年) | 2022 | 2021 | ||||||||||
| 装备 | 2-7 | $ | 2,565,997 | $ | 2,509,126 | |||||||
| 家具和固定装置 | 7 | 145,754 | 145,754 | |||||||||
| 计算机设备 | 5 | 41,898 | 41,898 | |||||||||
| 租赁权改进 | 5 | 471,505 | 471,505 | |||||||||
| 在建设备 | - | 1,739,699 | 1,643,150 | |||||||||
| 财产和设备,毛额 | 4,964,853 | 4,811,433 | ||||||||||
| 减去:累计折旧 | (2,060,066 | ) | (1,666,055 | ) | ||||||||
| 财产和设备, 净额 | $ | 2,904,787 | $ | 3,145,378 | ||||||||
截至2022年12月31日和2021年12月31日的年度折旧费用分别为394,011美元和708,317美元
(5)应计费用
应计 截至2022年12月31日和2021年12月31日的费用包括:
应计费用明细表
| 2022 | 2021 | |||||||
| 利息 | $ | 292,339 | $ | - | ||||
| 专业费用 | 314,446 | 71,570 | ||||||
| 研发 | - | 250,000 | ||||||
| CIP-设备 | - | 279,730 | ||||||
| 员工奖金 | 175,625 | - | ||||||
| 其他 | 112,225 | - | ||||||
| 应计费用合计 | $ | 894,635 | $ | 601,300 | ||||
(6)或有事项
公司可能会不时受到在正常业务过程中及其他方面引起的法律程序和索赔的影响。 针对我们的重大法律责任可能会对我们的业务、财务状况和运营结果产生不利影响。
公司记录与发生的或有损失相关的法律成本,并在这些事项出现重大或有损失时建立准备金 根据美国会计准则450,管理层确定重大或有损失既可能又合理地进行评估,“意外情况。” 如果估计了一个损失范围,并且该范围内的某个金额似乎比该 范围内的任何其他金额的估计值更好,则应计该金额。如果该范围内的任何金额都不能被确定为比任何其他金额更好的估计值,我们将累加该范围内的最小金额。这些金额不会减去根据保险或向第三方索赔可收回的金额 ,但如果认为有可能收回,来自保险公司或其他第三方的未贴现应收款可能会单独计提。 由于结果难以预测,最终的 解决方案可能与我们当前的分析不同,因此需要管理层对或有损失做出判断。本公司会根据新资料修订应计项目。虽然不可能确切地预测或有损失的结果,但管理层认为,财务报表中已为与任何此类事项相关的潜在损失计提了足够的准备金。
| F-14 |
(7) 应付关联方票据
相关 应付当事人票据
2022年8月10日,公司从Werth Family Investment Associates LLC(WFIA)获得了5,000,000美元的债务融资。WFIA经理Peter Werth是公司董事会成员。本期票为无担保票据,年利率为15%。 未偿还本金和所有应计及未付利息将于2025年8月8日到期,或在2023年4月1日开始的一个日历季度的前五个工作日内由WFIA提出书面要求后120天内支付。本公司可预付全部或部分票据,不收取溢价或罚款;但所偿还的款项不得再借入。截至2022年12月31日,钞票上的500万美元全部未偿还。
在截至2022年12月31日的年度内,公司确认了与本票据相关的292,339美元的利息支出。这笔利息支出 计入2022年12月31日综合资产负债表的应计费用。
(8)会员资本
在重组合并前,本公司拥有多种类别的成员资本,包括创始单位、B类、D类、E类、F类和G类优先股以及C类利润权益。B、E、F和G类优先股拥有与作为投资资本回报的现金分配相关的类似权利。D类优先股拥有创办人和其他类优先股的所有权利 外加以下所述的一些额外权利。所有级别的成员资本都有投票权。该公司为每个成员维护资本 账户。于截至2021年12月31日的年度内,于重组合并前发行了3,243,201个F类及G类单位。
F类首选单位
CTX董事会分两批批准了6,984,985个F类优先股;所有授权的F类股都是在重组 合并之前发行的。该公司通过发行F类单位总共筹集了1130万美元。新创建的F级机组,经CTX董事会授权,并反映在3研发修改和重新签署了运营协议,以反映F类机组的创建 于2018年12月14日生效。
G类首选单位
CTX董事会批准了12,000,000个G类优先股;在重组合并之前发行了2,998,184个。该公司通过发行G类单位共筹集了670万美元。CTX董事会授权的新设立的G类单位于2021年2月9日生效 。
本公司将首先向B、D、E、F和G类优先股的持有人进行分配(如有),按该等成员未退还的出资额按比例进行分配。然后向所有成员进行分配,包括创始单位,按每个成员持有的单位数量比例按比例进行分配,同时考虑到每个成员发行时适用的C类利润权益的分配门槛,并如 附注9中进一步描述的那样,在每个利润利益单位协议中披露。
与单位发行相关的成本 无关紧要。根据重组合并的条款,所有单位均转换为Cingate的普通股 股,详情见附注1。
(9)利润利息计划
于2017年内,CTX董事会制定并通过了Cingate Treeutics LLC股权激励计划(以下简称“计划”),以提供 用于向 计划中界定的公司员工、CTX成员、董事会成员和服务提供商发放C类PIU,作为该计划下有资格获得PIU的激励。PIU由本公司董事会酌情决定,在某些情况下由本公司首席执行官根据董事会授权酌情决定。 PIU的发行门槛等于公司在发行之日的货币前公平市场估值。 分派门槛是指按比例向所有成员(如果有)进行的现金分配必须超过 ,才能使特定PIU持有人参与超出该门槛的分配。根据授标条款,分配门槛被视为财务报表确认的业绩条件。PIU在服务条件方面的归属期限在PIU授予协议中定义,范围为30天至三年,所有PIU授予的平均归属期限为107天。根据公司运营协议的定义,根据该计划发行的所有PIU有权按比例分享超过规定分配门槛的公司利润(如果有的话)。 假设一般向所有成员进行现金分配,取决于其他类别单位的任何偏好或优先顺序。 C类PIU还以一对一的方式持有投票权。
| F-15 |
紧接重组合并前,本公司已批准及发出8,500,000及PIU的没收净额。该公司在FASB ASC主题718项下对这些奖项进行了核算,薪酬-股票薪酬,作为股权分类奖励。在重组合并前,并无记录与PIU相关的补偿 费用,因为未来不可能达到门槛和目标 (业绩条件)以实现派息。这项评估是基于本公司经营亏损的历史,以及在筹集必要股本为营运提供资金方面的持续挑战而作出的。关于重组 合并,如附注1中进一步描述,850万股PIU被交换为57,900股Cingate普通股。PIU与普通股的交换产生了PIU的条款、性质和权利的修改,绩效的实现被认为是可能的 。这导致公司确认了一笔相当于1,270万美元的非现金改装费用,该费用 是根据公司对修订当日扣式普通股股票的公允价值的评估计算的。 这笔费用中的820万美元计入了一般和行政费用,450万美元计入了研发费用 。
以下 总结了公司计划的活动:
股票期权活动摘要
| 分布 | ||||||||
| 利润利息 | 阈值 | |||||||
| 单位 | (以百万为单位) | |||||||
| 在2021年1月1日未偿还 | 8,142,461 | $25-$120 | ||||||
| 已发布 | 357,539 | $ | 160 | |||||
| 被没收 | - | |||||||
| 重组合并时转换为普通股 | (8,500,000 | ) | ||||||
| 截至2021年12月31日的未偿还债务 | - | |||||||
在重组合并前,本公司已发行该计划下所有可供使用的单位,并已根据PIU协议中概述的归属 期间归属所有单位。
在重组合并之前(也是修改日期),在各种分配门槛下的PIUS 已发行和未偿还金额如下:
各种分发阈值的时间表
| 分发阈值$(百万): | |||||||||||||||||||||||||||||||||
| 授予的年份 | $25 | $40 | $75 | $80 | $90 | $120 | $160 | 总计 | |||||||||||||||||||||||||
| 2017 | 4,753,000 | 125,200 | - | - | - | - | - | 4,878,200 | |||||||||||||||||||||||||
| 2018 | - | 661,525 | 217,725 | 22,883 | - | - | - | 902,133 | |||||||||||||||||||||||||
| 2019 | - | - | - | - | 377,524 | 458,924 | - | 836,448 | |||||||||||||||||||||||||
| 2020 | - | - | - | 1,476,126 | - | 49,554 | - | 1,525,680 | |||||||||||||||||||||||||
| 2021 | 357,539 | 357,539 | |||||||||||||||||||||||||||||||
| 总计 | 4,753,000 | 786,725 | 217,725 | 1,499,009 | 377,524 | 508,478 | 357,539 | 8,500,000 | |||||||||||||||||||||||||
(10)股东权益
本公司于2022年12月31日及2021年12月31日批准发行面值0.0001美元普通股240,000,000股及面值0.0001美元优先股10,000,000股,其中已发行及发行普通股565,470股。本公司尚未发行任何 股优先股。
| F-16 |
357,137股已发行及已发行普通股与重组合并有关,以换算紧接重组合并前已发行的CTX已发行普通股单位 ,并反映下文所述的股票股息及反向股票拆分。
208,333股普通股以每股120.00美元的价格向公众发行,与公司的首次公开募股相关,该首次公开募股于2021年12月完成。扣除承销折扣、佣金和其他发售费用后,公司获得净收益约2,040万美元。
普通股持有者每持有一股普通股可享有一票投票权。如本公司发生任何自动或非自愿清盘、解散或清盘,则在本公司所有债务及负债清偿或拨备清偿后,普通股持有人有权分享本公司可供分配的剩余资产(如有)。普通股的持有者在董事会宣布时有权获得股息。
股票 股息
于2021年9月30日,本公司实施每股已发行普通股换0.0015股普通股的股息(“股息”),或总计22,402股普通股。并无发行与股票股息有关的普通股零碎股份,而所有该等零碎权益已四舍五入至最接近的整数。
截至2022年12月31日,未宣布任何其他股息。
反向 股票拆分
2021年10月12日,Cingate对其已发行普通股和已发行普通股进行了反向股票拆分,比例为0.0350:1, ,并于2021年11月29日对其已发行普通股和已发行普通股进行了第二次反向股票拆分,比率为 :0.0321:1(“反向股票拆分”)。并无发行与任何一项反向股份分拆有关的普通股零碎股份,而所有该等零碎权益已四舍五入至最接近的整数。随附的综合财务报表所载所有期间的所有股份数据、每股数据及相关资料均已回溯调整 以反映反向股票拆分的影响,其后按反向股票拆分进行调整,如附注 1所述。
(11)基于股票的薪酬
2021年9月,公司董事会和股东通过了《2021年股权激励计划》(《2021年计划》),其中规定授予激励性股票期权和非限制性股票期权,以购买公司普通股、股票增值权、限制性股票单位、普通股限制性或非限制性股票、业绩股票、业绩单位、激励红利奖励、其他股票奖励和其他现金奖励。在2031年9月24日或之后,不能根据2021计划颁发任何奖励,但2021计划将在此之后继续进行,而之前授予的奖励仍未完成。
根据2021年计划授予的与期权和其他奖励相关的可供发行的普通股最高数量为96,391股,截至2022年12月31日,根据2021年计划可供发行的普通股为53,340股。根据2021年计划可供发行的普通股数量将在每年1月1日自动增加,直至2021年计划到期,数额相当于上一历年12月31日已发行普通股总数的5%,按完全稀释的基础计算,除非董事会在此之前采取行动 规定该年度的普通股储备不会增加,或该年度的普通股储备增加的普通股数量将少于其他情况下发生的情况。根据2021年计划,本公司为满足行使价或预扣税款、回购或以其他方式终止而没收、取消、扣留或结算奖励的任何奖励将重新计入根据2021计划可供发行的普通股股份 。
在截至2022年12月31日和2021年12月31日的年度内,公司记录的基于股票的薪酬支出分别为800,796美元和43,835美元,与已发行期权相关。截至2022年12月31日和2021年12月31日,有2,089,509美元和2,637,895美元的未确认薪酬成本与根据2021计划授予的基于非既得性股份的薪酬安排有关,预计将在未来一到 四年内确认。
| F-17 |
在截至2022年12月31日和2021年12月31日的年度内,该计划下的备选方案活动摘要如下:
选项活动摘要
| 加权平均 | 集料 | |||||||||||||
| 加权平均 | 剩余 | 固有的 | ||||||||||||
| 股票 | 行权价格 | 合同条款 | 价值 | |||||||||||
| 在2021年1月1日未偿还 | - | |||||||||||||
| 赠款 | 26,173 | $ | 120.00 | 9.94年 | - | |||||||||
| 已锻炼 | - | |||||||||||||
| 没收或期满 | - | |||||||||||||
| 截至2021年12月31日的未偿还债务 | 26,173 | |||||||||||||
| 赠款 | 20,882 | $ | 34.40 | 9.17年 | ||||||||||
| 已锻炼 | - | |||||||||||||
| 没收或期满 | (3,995 | ) | $ | 69.20 | ||||||||||
| 在2022年12月31日未偿还 | 43,060 | $ | 83.20 | 9.05年 | - | |||||||||
| 已归属,预计将于2022年12月31日归属 | 43,060 | |||||||||||||
| 可于2022年12月31日行使 | 8,451 | |||||||||||||
公司发行的股票期权符合ASC 718规定的权益会计处理条件,并相应地以 授予日的公允价值计量。购股权之公平值乃使用柏力克-舒尔斯模式估计。本公司 用于估计授予员工和董事的股票期权的授予日公允价值的假设如下,以加权平均 为基础显示截至各年度:
公允价值假设附表
| 2022 | 2021 | |||||||
| 无风险利率 | 1.889 | % | 0.012 | % | ||||
| 预期期限(以年为单位) | 5.98 | 6.25 | ||||||
| 预期波动率 | 1.126 | 1.134 | ||||||
| 预期股息收益率 | 0 | % | 0 | % | ||||
无风险 利率:本公司基于期权预期期限内的无风险利率,该利率基于截至授予日期具有类似到期日的美国国债的固定到期日 。
预期 期限:预期年期指已授出购股权预期尚未行使的期间,并使用 简化方法(基于归属日期与合约年期结束之间的中点)厘定。
预期波动 :本公司使用生物技术 和制药行业内可比上市公司的平均历史股价波动率,这些公司被视为未来股价趋势的代表,因为本公司的普通股没有足够的 交易历史。本公司将继续应用此流程,直至获得足够数量的有关其自身股票价格波动性的历史信息。
预期 股息收益率:本公司尚未支付,也不预期在不久的将来支付任何股息。因此,预期 股息收益率为零。
截至2022年12月31日的年度内授予的期权的公允价值为17.20美元至23.20美元,截至2021年12月31日的年度授予的期权 的公允价值为102.60美元。
股票期权的 总内在价值计算为股票期权的行使价与公司普通股公允价值之间的差额。 由于没有行使价格低于 公司普通股公允价值的股票期权,因此截至2022年和2021年12月31日,总内在价值为零。
| F-18 |
(12) 普通股认购权证
对于与本公司首次公开招股相关发行的208,333股普通股, 还发行了一份普通股认购权证,并计入120.00美元的单价。这些权证立即可以分离和交易。尽管承销商 没有行使15%的超额配售选择权购买额外的普通股,但他们确实以每份认股权证减承销折扣和佣金的价格购买了31,250份额外的普通股认购权证。这些239,583股普通股 认购权证的行使价为每股120.00美元,如果在认股权证行使时没有有效的登记声明或当前的招股说明书来发行普通股,则提供无现金行权特征。这些认股权证的有效期为2021年12月10日至2026年12月10日。在终止日期,这些认股权证将通过无现金行使自动行使。
除上述普通股认购权证外,本公司根据承销协议向承销商发行10,417份普通股认购权证,供本公司首次公开发售。这些权证的行权价为每股150.00美元,并为无现金行权功能提供了 。这些认股权证的有效期为2022年6月7日至2026年12月10日。
权证的估值采用布莱克-斯科尔斯模型,无风险利率为0.0082%,期限为5.0年,波动率为1.24。本公司普通股于计量日期的估计波动率是基于生物科技及制药行业内可比上市公司的平均历史股价波动率,该等上市公司被视为代表未来股价趋势 因为本公司的普通股没有足够的交易历史。无风险利率基于认股权证的预期 期限,基于截至授予日具有类似到期日的美国国债的持续到期日。已使用认股权证的合同期限估计了预期期限。
下表汇总了公司截至2022年12月31日和2021年12月31日的未偿还认股权证:
未偿还认股权证摘要
| 授予日期 | 授予日期 | |||||||||||||||
| 数量 | 锻炼 | 公允价值 | 公允价值 | |||||||||||||
| 认股权证 | 价格 | 每个授权书 | 总计 | |||||||||||||
| 余额-2021年1月1日 | ||||||||||||||||
| 承销的公开发行 | 239,583 | $ | 120.00 | $ | 95.4000993 | $ | 22,856,242 | |||||||||
| 发行承销权证 | 10,417 | $ | 150.00 | $ | 92.7968705 | 966,665 | ||||||||||
| 余额-2021年12月31日 | 250,000 | $ | 23,822,907 | |||||||||||||
2022年没有发行或行使任何认股权证。
公司已将这些权证列为ASC子主题815-40项下的股权分类工具,实体自有权益中可转换工具和合同的会计处理 因为它们是以公司普通股为索引的,并且它们 满足所有其他股权分类条件。首次公开招股交易的总收益按以下相对公允价值方法分配给普通股和普通股认购权证。认股权证的公允价值 计入公司资产负债表的额外实收资本。
认股权证公允价值附表 附加实收资本
| 百分比 | ||||||||||||
| 公平 | 占总数的 | 金额 | ||||||||||
| 价值 | 公允价值 | 已分配 | ||||||||||
| 普通股 | $ | 25,000,000 | 51.2 | % | $ | 12,800,000 | ||||||
| 普通股认购权证 | 23,822,907 | 48.8 | % | 12,200,000 | ||||||||
| 总计 | $ | 48,822,907 | 100 | % | $ | 25,000,000 | ||||||
(13)所得税
Cingate Inc.根据《国内税法》作为C类公司征税。Cingate Inc.记录递延所得税,以反映财务报告中记录的资产和负债金额与税务法规计量的此类金额之间的临时差异的影响 。CTX是Cingate Inc.的全资忽略实体,CTX及其全资子公司Cingate Works Inc.的所有活动都包括在Cingate Inc.的流动和递延税项资产和负债的计算中。截至2022年12月31日或2021年12月31日,没有记录联邦或州所得税的递延所得税优惠或费用。
| F-19 |
所得税 税费与通过适用美国联邦所得税税率计算的预期费用不同,如下所示:
有效所得税率对账明细表
| 2022年12月31日 | 2021年12月31日 | |||||||
| 法定税率的联邦所得税优惠 | $ | (3,712,008 | ) | $ | (563,519 | ) | ||
| 州所得税优惠 | (977,496 | ) | (148,393 | ) | ||||
| 永久性差异 | 11,935 | 44,804 | ||||||
| 更改估值免税额 | 4,733,324 | 713,701 | ||||||
| 其他 | (55,755 | ) | (46,593 | ) | ||||
| 所得税总支出 | $ | - | $ | - | ||||
评估 递延税项资产估值准备的必要性和金额通常需要对每个司法管辖区的所有可用证据进行重大判断和广泛分析 。该等判决要求本公司解释现行税法及适用于其情况的其他已公布指引。作为此次评估的一部分,公司考虑了有关其盈利能力和税务状况的正面和负面证据。如果根据现有证据,递延税项资产的全部或部分更有可能无法变现,则提供估值拨备。根据过往收入水平及未来应课税收入预测,除其他项目外,本公司确定其递延税项资产更有可能无法变现 。本公司于2022年12月31日及2021年12月31日分别计提递延税项净资产计5,580,595美元及847,269美元的减值准备,并在所附综合经营报表及其他全面亏损中记作所得税支出的组成部分。
该公司在美国联邦和各州司法管辖区提交所得税申报单。这些公司在2018年前不接受美国联邦和州税务机关的所得税审查。
公司遵循FASB ASC 740的规定,所得税,以评估不确定的税收状况。本主题规定了对纳税申报单中已采取或预期采取的纳税头寸的财务报表确认和计量的确认阈值和计量属性。截至2022年12月31日,本公司尚未发现任何需要在合并财务报表中确认的重大不确定税务状况 。
| F-20 |
递延税项资产负债表
| 2022年12月31日 | 2021年12月31日 | |||||||
| 递延所得税资产: | ||||||||
| 当前: | ||||||||
| 研发成本 | $ | 343,087 | $ | - | ||||
| 其他 | 59,018 | 4,050 | ||||||
| 非当前: | ||||||||
| 净营业亏损 | 3,381,215 | 1,201,974 | ||||||
| 研发成本 | 1,762,716 | - | ||||||
| 非既得性股票期权 | 204,380 | 11,835 | ||||||
| 专利 | 92,417 | 90,480 | ||||||
| 使用权资产 | 63,563 | 49,606 | ||||||
| 递延所得税总资产 | 5,906,396 | 1,357,945 | ||||||
| 减去:估值免税额 | (5,580,595 | ) | (847,269 | ) | ||||
| 递延所得税净资产 | 325,801 | 510,676 | ||||||
| 递延所得税负债: | ||||||||
| 当前: | ||||||||
| 应计现金 | (11,228 | ) | (105,075 | ) | ||||
| 非当前 | ||||||||
| 财产和设备 | (314,573 | ) | (405,601 | ) | ||||
| 递延所得税总负债 | (325,801 | ) | (510,676 | ) | ||||
| 递延税项净资产(负债) | $ | - | $ | - | ||||
(14)租契
本公司于2019年6月签订租约,其中包括对先前租用的堪萨斯城写字楼空间进行扩建和翻新。 租期为五年,从2020年5月1日开始,即收到扩建和新翻新空间的入住证之日。根据这份租约,租金总额由每月30,453元至33,145元不等。本租约为承租人提供总计201,600美元的租赁奖励。
如附注17所述,该公司从关联方为其新泽西州员工租赁办公空间。该租赁的基本租金为2022年和2021年的每月3,000美元。租约于2021年1月签订,租期为三年。
于2018年,本公司签订了为期18个月的制造设备经营租约。临时租金是在设备安装期间发生的,租赁从2018年6月开始。这些租赁设备的每月租金为61786美元。2019年12月,本租约续期24个月,每月租金37,072美元。于该日,本租赁经修订 以作会计处理,其分类被评估为融资型租赁,因管理层认定出租人对租赁资产无其他未来用途 。与租赁机器相关的ROU资产在租赁期内摊销。2021年12月,租赁期结束,本公司与出租人签订购买协议,购买制造设备。
于2020年4月,本公司订立一项为期60个月的办公家具租赁协议,该租赁被分类为融资租赁,即在租赁期结束时转让给本公司的家具所有权。每月的租金是1,491美元。租赁的家具 按直线摊销,超过7年。与租赁义务相关的推定利率为6.12%,到期日为2025年3月。
| F-21 |
截至2022年12月31日和2021年12月31日止年度的租赁费用 构成如下:
租赁成本构成汇总表
| 2022 | 2021 | |||||||
| 经营租赁成本 | $ | 338,787 | $ | 338,787 | ||||
| 融资租赁成本: | ||||||||
| 使用权资产摊销 | 10,990 | 409,927 | ||||||
| 租赁负债利息 | 2,804 | 26,504 | ||||||
| 融资租赁总成本 | 13,794 | 436,431 | ||||||
| 总租赁成本 | $ | 352,581 | $ | 775,218 | ||||
截至2022年12月31日和2021年12月31日,综合资产负债表中报告的金额 如下:
综合资产负债表中报告的租赁摘要
| 2022 | 2021 | |||||||
| 经营租赁: | ||||||||
| 经营性租赁使用权资产 | $ | 630,618 | $ | 858,600 | ||||
| 其他流动负债 | 339,755 | 295,595 | ||||||
| 经营租赁负债 | 488,748 | 828,503 | ||||||
| 经营租赁负债总额 | 828,503 | 1,124,098 | ||||||
| 融资租赁: | ||||||||
| 财产和设备 | 76,928 | 76,928 | ||||||
| 累计摊销 | (44,988 | ) | (29,602 | ) | ||||
| 财产和设备,净额 | 31,940 | 47,326 | ||||||
| 融资租赁项下债务的本期分期付款 | 16,053 | 15,096 | ||||||
| 债务的长期部分 | ||||||||
| 融资租赁 | 21,487 | 37,534 | ||||||
| 融资租赁负债总额 | $ | 37,540 | $ | 52,630 | ||||
于二零二二年及二零二一年十二月三十一日,与租赁有关的其他 资料如下:
与租约有关的其他资料摘要:
| 2022 | 2021 | |||||||
| 补充现金流信息: | ||||||||
| 为计量租赁负债所包括的金额支付的现金: | ||||||||
| 营业租赁产生的营业现金流 | $ | 36,000 | $ | 433,172 | ||||
| 融资租赁的营业现金流 | 3,698 | 26,504 | ||||||
| 融资租赁产生的现金流 | 15,090 | 436,259 | ||||||
| 租赁负债减少导致的使用权资产减少: | ||||||||
| 经营租约 | 227,981 | 196,245 | ||||||
| 融资租赁 | 10,990 | 409,927 | ||||||
| 加权平均剩余租期: | ||||||||
| 经营租约 | 25个月 | 39个月 | ||||||
| 融资租赁 | 27个月 | 39个月 | ||||||
| 加权平均贴现率: | ||||||||
| 经营租约 | 11.62 | % | 11.57 | % | ||||
| 融资租赁 | 6.12 | % | 6.12 | % | ||||
| F-22 |
截至2022年12月31日,不可撤销租赁项下租赁负债的到期日 如下:
租赁负债到期汇总表
| 运营中 | 金融 | |||||||
| 租契 | 租契 | |||||||
| 2023 | 414,800 | 17,900 | ||||||
| 2024 | 393,005 | 17,900 | ||||||
| 2025 | 132,580 | 4,475 | ||||||
| 此后 | - | - | ||||||
| 未贴现的租赁付款总额 | 940,385 | 40,275 | ||||||
| 扣除计入的利息 | (111,882 | ) | (2,742 | ) | ||||
| 租赁总负债 | $ | 828,503 | $ | 37,533 | ||||
(15)每股净亏损
下表列出了截至2022年12月31日和2021年12月31日止年度每股基本及摊薄净亏损的计算方法:
每股基本和摊薄净亏损明细表
| 2022 | 2021 | |||||||
| 分子: | ||||||||
| 净亏损 | $ | (17,676,232 | ) | $ | (20,709,991 | ) | ||
| 分母: | ||||||||
| 加权平均已发行普通股 | 565,470 | 370,679 | ||||||
| 每股基本和稀释后净亏损 | $ | (31.26 | ) | $ | (55.87 | ) | ||
潜在的 稀释证券不包括在每股摊薄计算中,因为它们是反稀释的,如下所示:
潜在稀释证券明细表
| 2022 | 2021 | |||||||
| 根据2021年股权激励计划发行的股票期权 | 43,060 | 26,164 | ||||||
| 未偿还普通股认购权证 | 250,000 | 250,000 | ||||||
| 总计 | 293,060 | 276,164 | ||||||
(16)许可协议
CTX 与一家公司签订了一项许可协议,涉及用于开发CTX-1301、CTX-1302、 和CTX-2103的专利和许可技术。CTX将在发生以下里程碑事件时支付以下费用:
| ● | 根据现场每个产品的3期临床试验中的第一名患者的剂量支付250,000美元里程碑付款 ,按产品支付。 | |
| ● | 在被许可方为该领域的每种产品提交新药申请时支付250,000美元里程碑付款, 按产品支付。 | |
| ● | CTX-1301和CTX-1302的里程碑付款为250,000美元,CTX-2103的里程碑付款为500,000美元,在收到FDA的首次上市批准后,按产品支付。 | |
| ● | 收到欧洲药品管理局(European Medicines Agency)的首次上市批准后,购买CTX-2103的250,000美元里程碑付款 |
截至2021年12月31日,该公司为CTX-1301积累了250,000美元的里程碑,这与第三阶段临床试验中的第一名患者的剂量有关。 管理层认为这一里程碑是可能的。本公司未记录任何与这两种产品的其他里程碑相关的费用,因为公司认为截至2022年12月31日不可能发生这些费用。
| F-23 |
(17)关联方交易
本公司董事会成员,董事高级董事,莱德洛公司(英国)有限公司。莱德洛公司(英国)有限公司担任本公司首次公开募股的联席主承销商。2021年,支付给Laidlaw& Company(UK)Ltd.与IPO相关的折扣和佣金约为50万美元。
本公司总法律顾问是一家律师事务所的合伙人,该律师事务所提供本公司租赁的办公设施空间。2022年和2021年,公司支付给律师事务所的租金支出为36,000美元。截至2022年12月31日和2021年12月31日,该公司欠本租约0美元。
公司董事会成员Peter Werth是WFIA的经理,该实体在2022年为公司提供了500万美元的债务融资,如附注7所述。截至2022年12月31日的年度确认了292,339美元的利息支出。截至2022年12月31日,本金余额为500万美元,应计利息为292,339美元。
(18)后续事件
管理层 对2022年12月31日至2023年3月10日期间发生的事件进行了评估,2023年3月10日是财务报表的发布日期。
于2023年1月,本公司与作为销售代理(“Wainwright”)的H.C.Wainwright& Co.,LLC订立于市场发售协议(“ATM协议”),据此,本公司可不时透过Wainwright发售及出售其普通股 股,总收益最高可达2,650,000美元(“股份”)。该公司将向Wainwright支付一笔佣金,相当于每次出售普通股总收益的3%。截至本申请日期,本公司并未根据自动柜员机协议进行任何销售 。
2023年3月7日,公司与Indegene,Inc.签订了联合商业化协议,根据该协议,Indegene将应公司的要求为CTX-1301提供商业化服务。双方将签订工作说明,其中将列出Indegene将执行的服务、此类服务的交付内容以及公司将支付的费用。
(19) 反向拆股
2023年11月30日,本公司完成了一次二十股一股的反向股票拆分(“反向股票拆分”),减少了在反向股票拆分生效之前发行和发行的公司普通股的数量。公司法定普通股的数量不受反向股票拆分的影响,公司普通股的面值保持不变,为每股0.0001美元。没有发行与反向股票拆分相关的零碎股份。除披露外,所有与股份数目及每股金额有关的金额均已在该等财务报表中追溯重述。
| F-24 |
第 部分-财务信息
项目1.财务报表。
Cingate Inc.
合并 资产负债表(未经审计)
| 9月30日, | 十二月三十一日, | |||||||
| 2023 | 2022 | |||||||
| 资产 | ||||||||
| 流动资产: | ||||||||
| 现金和现金等价物 | $ | 1,986,313 | $ | 5,356,276 | ||||
| 杂项应收账款 | 5,836 | 234,432 | ||||||
| 预付费用和其他流动资产 | 910,286 | 2,278,944 | ||||||
| 流动资产总额 | 2,902,435 | 7,869,652 | ||||||
| 财产和设备,净额 | 2,531,330 | 2,904,787 | ||||||
| 经营性租赁使用权资产 | 436,493 | 630,618 | ||||||
| 总资产 | 5,870,258 | 11,405,057 | ||||||
| 负债和股东权益 | ||||||||
| 流动负债: | ||||||||
| 应付帐款 | 1,670,436 | 762,357 | ||||||
| 应计费用 | 692,008 | 894,635 | ||||||
| 应付票据 | 3,000,000 | 5,000,000 | ||||||
| 融资租赁负债,流动 | 16,805 | 16,053 | ||||||
| 经营租赁负债,流动 | 353,183 | 339,755 | ||||||
| 流动负债总额 | 5,732,432 | 7,012,800 | ||||||
| 长期负债: | ||||||||
| 融资租赁负债,当期净额 | 8,792 | 21,487 | ||||||
| 经营租赁负债,当期净额 | 225,368 | 488,748 | ||||||
| 长期负债总额 | 234,160 | 510,235 | ||||||
| 总负债 | 5,966,592 | 7,523,035 | ||||||
| 股东权益 | ||||||||
| 普通股,面值0.0001美元;截至2023年9月30日和2022年12月31日,已发行和已发行普通股分别为2.4亿股和868,940股和565,470股 | 88 | 57 | ||||||
| 优先股,面值0.0001美元;截至2023年9月30日和2022年12月31日,授权发行股票10,000,000股,发行和发行股票为0股 | - | - | ||||||
| 额外实收资本 | 85,912,324 | 73,290,461 | ||||||
| 累计赤字 | (86,008,746 | ) | (69,408,496 | ) | ||||
| 股东权益总额 | (96,334 | ) | 3,882,022 | |||||
| 总负债和股东权益 | $ | 5,870,258 | $ | 11,405,057 | ||||
见 合并财务报表附注。
| F-25 |
Cingate Inc.
合并 营业和全面亏损报表(未经审计)
| 截至9月30日的三个月, | 截至9月30日的9个月, | |||||||||||||||
| 2023 | 2022 | 2023 | 2022 | |||||||||||||
| 运营费用: | ||||||||||||||||
| 研发 | $ | 3,923,852 | $ | 2,123,114 | $ | 10,508,395 | $ | 7,063,626 | ||||||||
| 一般和行政 | 1,825,822 | 1,845,248 | 5,453,643 | 5,963,067 | ||||||||||||
| 营业亏损 | (5,749,674 | ) | (3,968,362 | ) | (15,962,038 | ) | (13,026,693 | ) | ||||||||
| 利息和其他收入(费用),净额 | (229,380 | ) | (58,885 | ) | (638,212 | ) | (44,512 | ) | ||||||||
| 所得税前亏损 | (5,979,054 | ) | (4,027,247 | ) | (16,600,250 | ) | (13,071,205 | ) | ||||||||
| 所得税优惠(费用) | - | - | - | - | ||||||||||||
| 净亏损 | (5,979,054 | ) | (4,027,247 | ) | (16,600,250 | ) | (13,071,205 | ) | ||||||||
| 其他全面收益(亏损): | ||||||||||||||||
| 短期投资未实现亏损变动 | - | 3,249 | - | (166 | ) | |||||||||||
| 综合损失 | $ | (5,979,054 | ) | $ | (4,023,998 | ) | $ | (16,600,250 | ) | $ | (13,071,371 | ) | ||||
| 普通股基本每股净亏损和稀释后每股净亏损 | $ | (6.05 | ) | $ | (7.12 | ) | $ | (23.24 | ) | $ | (23.12 | ) | ||||
| 用于计算基本普通股和稀释后普通股每股净亏损的加权平均股数 | 988,333 | 565,470 | 714,397 | 565,470 | ||||||||||||
见 合并财务报表附注。
| F-26 |
Cingate Inc.
合并的股东权益报表(未经审计)
| 普通股 | 其他内容 | 累计 | 累计 其他
| 股东的 | ||||||||||||||||||||
| 股票 | 金额 | 实收资本 | 赤字 | 收入 | 权益 | |||||||||||||||||||
| 余额2022年1月1日 | 565,470 | 57 | $ | 72,575,584 | $ | (51,732,264 | ) | $ | 165 | $ | 20,843,542 | |||||||||||||
| 截至2022年3月31日的三个月内的活动: | ||||||||||||||||||||||||
| 可供出售投资未实现损失 | - | - | - | - | (2,948 | ) | (2,948 | ) | ||||||||||||||||
| 基于股票的薪酬费用 | - | - | 181,518 | - | - | 181,518 | ||||||||||||||||||
| 净亏损 | - | - | - | (5,003,511 | ) | - | (5,003,511 | ) | ||||||||||||||||
| 余额2022年3月31日 | 565,470 | $ | 57 | $ | 72,757,102 | $ | (56,735,775 | ) | $ | (2,783 | ) | $ | 16,018,601 | |||||||||||
| 截至2022年6月30日的三个月内的活动: | ||||||||||||||||||||||||
| 可供出售投资未实现损失 | - | - | - | - | (466 | ) | (466 | ) | ||||||||||||||||
| 基于股票的薪酬费用 | - | - | 207,186 | - | - | 207,186 | ||||||||||||||||||
| 净亏损 | - | - | - | (4,040,447 | ) | - | (4,040,447 | ) | ||||||||||||||||
| 余额2022年6月30日 | 565,470 | $ | 57 | $ | 72,964,288 | $ | (60,776,222 | ) | $ | (3,249 | ) | $ | 12,184,874 | |||||||||||
| 截至2022年9月30日的三个月内的活动: | ||||||||||||||||||||||||
| 可供出售投资未实现损失 | - | - | - | - | 3,249 | 3,249 | ||||||||||||||||||
| 基于股票的薪酬费用 | - | - | 205,656 | - | - | 205,656 | ||||||||||||||||||
| 净亏损 | - | - | - | (4,027,247 | ) | - | (4,027,247 | ) | ||||||||||||||||
| 余额2022年9月30日 | 565,470 | $ | 57 | $ | 73,169,944 | $ | (64,803,469 | ) | $ | - | $ | 8,366,532 | ||||||||||||
| 余额2023年1月1日 | 565,470 | 57 | 73,290,461 | $ | (69,408,496 | ) | $ | - | $ | 3,882,022 | ||||||||||||||
| 截至2023年3月31日的三个月的活动: | ||||||||||||||||||||||||
| 基于股票的薪酬费用 | - | - | 204,479 | - | - | 204,479 | ||||||||||||||||||
| 净亏损 | - | - | - | (4,004,887 | ) | - | (4,004,887 | ) | ||||||||||||||||
| 余额2023年3月31日 | 565,470 | $ | 57 | $ | 73,494,940 | $ | (73,413,383 | ) | $ | - | $ | 81,614 | ||||||||||||
| 截至2023年6月30日的三个月的活动: | ||||||||||||||||||||||||
| 在市场发售和购买协议中发行普通股,扣除费用后的净额 | 37,369 | 4 | 218,794 | 218,798 | ||||||||||||||||||||
| 基于股票的薪酬费用 | - | - | 217,376 | - | - | 217,376 | ||||||||||||||||||
| 净亏损 | - | - | - | (6,616,309 | ) | - | (6,616,309 | ) | ||||||||||||||||
| 余额2023年6月30日 | 602,839 | $ | 61 | $ | 73,931,110 | $ | (80,029,692 | ) | $ | - | $ | (6,098,521 | ) | |||||||||||
| 截至2023年9月30日的三个月的活动: | ||||||||||||||||||||||||
| 在市场发售和购买协议中发行普通股,扣除费用后的净额 | 88,943 | 9 | 1,621,930 | 1,621,939 | ||||||||||||||||||||
| 与WFIA的私募有关的普通股发行 | 91,158 | 9 | 999,991 | 1,000,000 | ||||||||||||||||||||
| 发行普通股和预筹资权证,在公开发行中以现金出售,扣除费用 | 86,000 | 9 | 3,310,542 | 3,310,551 | ||||||||||||||||||||
| 发行与转换关联方应付票据有关的预融资权证 | - | - | 3,949,765 | 3,949,765 | ||||||||||||||||||||
| 与转换关联方应付票据有关的出资额 | 1,862,735 | 1,862,735 | ||||||||||||||||||||||
| 基于股票的薪酬费用 | - | - | 236,251 | - | - | 236,251 | ||||||||||||||||||
| 净亏损 | - | - | - | (5,979,054 | ) | - | (5,979,054 | ) | ||||||||||||||||
| 余额2023年9月30日 | 868,940 | $ | 88 | $ | 85,912,324 | $ | (86,008,746 | ) | $ | - | $ | (96,334 | ) | |||||||||||
见 合并财务报表附注
| F-27 |
Cingate Inc.
合并 现金流量表(未经审计)
| 截至9月30日的9个月, | ||||||||
| 2023 | 2022 | |||||||
| 经营活动: | ||||||||
| 净亏损 | $ | (16,600,250 | ) | $ | (13,071,205 | ) | ||
| 对净亏损与经营活动中使用的现金净额进行的调整: | ||||||||
| 折旧 | 410,593 | 304,287 | ||||||
| 基于股票的薪酬 | 658,106 | 594,360 | ||||||
| 经营性资产和负债变动情况: | ||||||||
| 杂项应收账款 | 228,596 | 642,899 | ||||||
| 预付费用和其他流动资产 | 1,368,658 | (293,140 | ) | |||||
| 经营性租赁使用权资产 | 194,125 | 167,828 | ||||||
| 应付贸易账款和应计费用 | 1,517,952 | 197,462 | ||||||
| 其他流动负债 | 13,428 | 31,147 | ||||||
| 经营租赁负债 | (263,380 | ) | (249,952 | ) | ||||
| 用于经营活动的现金净额 | (12,472,172 | ) | (11,676,314 | ) | ||||
| 投资活动: | ||||||||
| 购置财产和设备 | (37,136 | ) | (10,400 | ) | ||||
| 出售短期投资所得收益 | - | 933 | ||||||
| 其他 | - | (165 | ) | |||||
| 用于投资活动的现金净额 | (37,136 | ) | (9,632 | ) | ||||
| 融资活动: | ||||||||
| 发行普通股和预先出资的普通股认购权证所得款项,扣除费用 | 6,151,288 | - | ||||||
| 应付票据收益 | 3,000,000 | 5,000,000 | ||||||
| 融资租赁债务的本金支付 | (11,943 | ) | (11,229 | ) | ||||
| 融资活动提供的现金净额 | 9,139,345 | 4,988,771 | ||||||
| 现金和现金等价物: | ||||||||
| 现金和现金等价物净减少 | (3,369,963 | ) | (6,697,175 | ) | ||||
| 年初现金及现金等价物 | 5,356,276 | 16,492,745 | ||||||
| 期末现金及现金等价物 | $ | 1,986,313 | $ | 9,795,570 | ||||
| 现金支付: | ||||||||
| 支付的利息 | $ | 10,266 | $ | 10,291 | ||||
见 合并财务报表附注
| F-28 |
Cingate Inc.
合并财务报表附注 (未经审计)
(1) 业务性质和流动性
组织
Cingulate Inc.是一家生物制药公司,专注于利用其药物输送平台技术开发产品,使 能够 配制和制造每日一次的多剂量疗法片剂,最初专注于治疗注意力缺陷/多动障碍(ADHD)。该公司正在开发两种专有的一线兴奋剂药物CTX-1301(醋酸地塞米松)和CTX-1302(右旋苯丙胺),用于治疗ADHD,适用于所有患者群体:儿童、青少年和成人。CTX-1301和CTX-1302采用灵活的核心压片技术和目标产品配置文件,旨在提供快速起效和持续整个活动 天,血浆药物水平可控下降,并具有良好的耐受性。该公司完成了CTX-1301的第一个第三阶段临床试验,另外两个第三阶段试验正在进行中。此外,该公司还有第三种治疗焦虑的产品,CTX-2103, 处于配方阶段。
2012年11月14日,特拉华州有限责任公司Cingate Treateutics LLC(CTX)成立。2021年5月10日,CTX的特拉华州公司和全资子公司Cingate Inc.(Cingate,或本公司)成立,作为控股公司, 预期本公司将上市。通过2021年第三季度发生的重组合并,Cingate 有效地收购了CTX,CTX的所有已发行单位均转换为Cingate普通股。CTX仍是公司开展业务的实体 。
截至2023年9月30日及2022年9月30日止期间的综合财务报表及附注代表Cingate及其附属公司(包括CTX)的全面合并,而对本公司的所有提及均代表此项全面合并。
流动性
公司自成立以来在运营中出现了亏损和负现金流。作为一家收入前实体,公司依赖于 筹集资金支持运营的能力,直到正在开发的候选产品获得美国食品和药物管理局(FDA)的批准、生产、上市并产生收入。首次公开募股于2021年12月完成,提供了约2,040万美元的净收益。此外,公司于2022年8月从一张期票获得500万美元的收益,并在2023年5月对本票进行修订和重述时额外获得300万美元的收益 ,其中一部分随后转换为股权,如附注7所述。公司利用了与H.C.Wainwright的市场协议和2023年与林肯公园资本有限责任公司的购买协议,截至2023年9月30日提供了总计约210万美元的净收益。2023年第三季度筹集的额外资本包括发行和出售普通股和与公开发行相关的预先出资的普通股认股权证,提供了约330万美元的净收益 ,以及与100万美元的非公开配售相关的普通股的发行和出售,详情见 附注9。然而,公司将需要额外的资金用于运营和发展。管理层正在评估获得额外资金的各种战略 ,其中可能包括额外发行股票、发行债券或其他资本来源,包括与其他公司的潜在合作或其他战略交易。成功实施这些计划既涉及公司的努力,也涉及其无法控制的因素,如市场因素和FDA对候选产品的批准。 公司不能保证其计划的有效实施方式足以缓解 或缓解上述条件和事件,这导致人们对公司在财务报表发布后一年内作为持续经营企业的能力产生极大怀疑。随附的综合财务报表 是以持续经营为基础编制的,考虑了正常业务过程中的资产变现和负债清偿。合并财务报表不反映这种不确定性的结果可能导致的任何调整。
| F-29 |
(2) 重要会计政策摘要
(A)列报基础和合并原则
所附合并财务报表是根据美国公认会计原则(美国公认会计原则)编制的。合并财务报表包括Cingate及其全资子公司的账目。所有公司间账户 和交易已在合并中取消。
(B)未经审计的中期财务资料
随附的截至2023年9月30日的综合资产负债表、截至2023年和2022年9月30日的三个月和九个月期间的综合经营报表和综合亏损表、截至2023年和2022年9月30日的三个月和九个月期间的综合股东权益表、截至2023年和2022年9月30日的九个月期间的综合现金流量表以及相关的中期披露均未经审计。这些未经审计的综合财务报表 包括所有必要的调整,仅包括正常经常性调整,以根据美国公认会计原则公平陈述中期运营和现金流量的财务状况和结果 。中期业绩不一定代表全年或其后任何中期的经营业绩或现金流。随附的综合财务报表 应与本公司截至2022年12月31日止年度的经审核综合财务报表及其附注一并阅读。
(三)信用风险集中
公司持有现金等值存款,在整个财政年度内,这些存款在不同时间超过了联邦存款保险公司投保的250,000美元限额(不考虑对账项目)。管理层监督这些金融机构的稳健性,并不认为本公司与存款中未投保部分相关的任何重大信用风险。
(D)杂项应收款
截至2022年12月31日的杂项应收账款,主要包括2020年发生的工资成本的员工留用税抵免,以及研究和开发税抵免。该公司类似于国际会计准则20,政府补助金的会计核算和政府援助的披露, 在这些应收款的会计处理中。截至2022年12月31日,本公司确定不需要与这些应收账款相关的拨备。截至2023年9月30日,所有员工留用税收抵免和研发税收抵免均已征收完毕。
(E)长期资产减值
当事件或情况显示其长期资产(包括物业及设备)及租赁使用权(ROU)资产的账面价值可能无法收回时,公司会评估该等资产的账面价值。这些事件或情况的变化 可能包括经营业绩的显著恶化、业务计划的变化或预期未来现金流的变化。 如果存在减值指标,本公司将通过将资产的账面价值与资产预期产生的未贴现现金流进行比较来评估可回收性。如果预期未来现金流的总和少于账面金额,公司将确认减值损失。减值损失将通过比较账面价值超过长期资产组公允价值的金额来计量。截至2023年9月30日或2022年9月30日止三个月或九个月期间并无确认减值。
(F)基于股票的薪酬
公司使用布莱克-斯科尔斯期权定价模型,根据员工授予日期的公允价值 衡量所有股票奖励的员工和董事股票薪酬支出。对于有服务条件的股票奖励,股票薪酬费用在必要的服务期限内采用直线法进行确认。没收行为在发生时予以确认。请参阅附注11中的其他信息 。
| F-30 |
(3) 预付费用
预付费 截至2023年9月30日和2022年12月31日的费用包括:
预付费用明细表。
| 9月30日, | 十二月三十一日, | |||||||
| 2023 | 2022 | |||||||
| 研发 | $ | 413,431 | $ | 1,377,391 | ||||
| 保险 | 339,676 | 472,152 | ||||||
| 活性药物成分 | 77,422 | 209,156 | ||||||
| 递延筹资成本 | - | 100,339 | ||||||
| 专业费用 | 20,775 | 61,524 | ||||||
| 会费和订阅费 | 38,284 | 37,684 | ||||||
| 其他 | 20,698 | 20,698 | ||||||
| 预付费用总额 | $ | 910,286 | $ | 2,278,944 | ||||
(4)物业及设备
截至2023年9月30日和2022年12月31日,财产和设备净值如下:
财产和设备明细表
| 估计数 | ||||||||||||
| 使用寿命 | 9月30日, | 十二月三十一日, | ||||||||||
| (单位:年) | 2023 | 2022 | ||||||||||
| 装备 | 2-7 | $ | 4,342,832 | $ | 2,565,997 | |||||||
| 家具和固定装置 | 7 | 145,754 | 145,754 | |||||||||
| 计算机设备 | 5 | 41,898 | 41,898 | |||||||||
| 租赁权改进 | 5 | 471,505 | 471,505 | |||||||||
| 在建设备 | - | - | 1,739,699 | |||||||||
| 财产和设备,毛额 | 5,001,989 | 4,964,853 | ||||||||||
| 减去:累计折旧 | (2,470,659 | ) | (2,060,066 | ) | ||||||||
| 财产和设备,净额 | $ | 2,531,330 | $ | 2,904,787 | ||||||||
截至2023年9月30日的9个月的折旧费用为410,593美元,截至2022年9月30日的9个月的折旧费用为304,287美元。截至2023年9月30日的三个月的折旧费用为154,663美元,截至2022年9月30日的三个月的折旧费用为101,429美元。
| F-31 |
(5) 应计费用
于2023年9月30日及2022年12月31日,应计费用包括以下各项:
应计费用附表
| 9月30日, | 十二月三十一日, | |||||||
| 2023 | 2022 | |||||||
| 利息 | $ | 157,339 | $ | 292,339 | ||||
| 研发 | 253,524 | - | ||||||
| 专业费用 | 15,000 | 314,446 | ||||||
| 员工奖金 | 175,625 | 175,625 | ||||||
| 活性药物成分 | 62,393 | - | ||||||
| 其他 | 28,127 | 112,225 | ||||||
| 应计费用 | $ | 692,008 | $ | 894,635 | ||||
(6) 或有
公司可能会不时受到在正常业务过程中及其他方面引起的法律程序和索赔的影响。 针对我们的重大法律责任可能会对我们的业务、财务状况和运营结果产生不利影响。
公司记录与发生的或有损失相关的法律成本,并在这些事项出现重大或有损失时建立准备金 根据美国会计准则450,管理层确定重大或有损失既可能又合理地进行评估,意外开支。 如果估计了一个损失范围,并且该范围内的某个金额似乎比该范围内的任何其他金额更好,则该金额应计。如果在该范围内没有任何金额可以被确定为比任何其他金额更好的估计,则我们应计 该范围内的最小金额。这些金额不会因保险或向第三方索赔而可能收回的金额而减少,但如果认为有可能收回,则来自保险公司或其他第三方的未贴现应收款可以单独计提。 需要管理层对或有损失做出判断,因为结果难以预测,最终 解决方案可能与我们当前的分析不同。本公司根据新资料修订应计项目。虽然无法 确定地预测或有损失的结果,但管理层认为,已在综合财务报表中就与任何此类事项相关的潜在损失 作出充分拨备。
(7) 应付关联方票据
2022年8月,公司从Werth Family Investment Associates LLC(WFIA)获得500万美元的债务融资。WFIA经理Peter Werth是公司董事会成员。这张日期为2023年8月9日的期票是无抵押的,年利率为15%。2023年5月,本公司通过修改和重申该附注,将本金增加到800万美元,从WFIA获得了额外的300万美元债务融资。该照会的所有其他条款都保持不变。
于2023年9月8日,本公司及华通证券与WFIA订立票据转换协议(票据转换协议),据此,WFIA同意转换票据项下的原始本金金额500万美元,外加原始本金的所有应计利息 ,或发行预资金权证(WFIA预资金权证)5,812,500美元,以购买341,912股本公司普通股 ,每股WFIA预资金权证的转换价为17.00美元。 本公司普通股于2023年9月8日在纳斯达克的收市价。每股11.55美元。WFIA预筹资认股权证没有到期日,可立即以每股0.002美元的行使价行使,但在行使后,就1934年证券交易法(经修订(Exchange Act))第 13(D)节而言,WFIA及其关联公司将实益拥有不超过19.99%的公司普通股流通股 。
该公司考虑使用ASC 470-60,Debtors的问题债务重组,在核算这一债务转换时。已发行的预融资权证的公允价值与交易中结算的债务的账面价值之间的差额 在股东权益表中确认为1,862,735美元的出资。
票据的剩余未偿还本金300万美元以及所有应计和未付利息将于2025年8月8日或WFIA在一个日历季度的前五个工作日提出书面要求后120天到期并支付。WFIA没有要求在票据上付款 。本公司可预付全部或部分票据,不收取溢价或罚款;但不得再借入任何已偿还的款项。
| F-32 |
截至2023年9月30日和2022年12月31日,票据上的未偿还本金分别为300万美元和500万美元。
在截至2023年9月30日的三个月内,公司确认了与该票据相关的利息支出237,500美元。在截至2023年9月30日的九个月内,公司确认了与该票据有关的利息支出677,500美元。与票据有关的所有利息支出 均计入合并资产负债表的应计费用。
(8) 股东权益
公司已于2023年9月30日和2022年12月31日授权发行240,000,000股面值为0.0001美元的普通股和10,000,000股面值为0.0001美元的优先股 ,其中868,940股和565股,截至 2023年9月30日和2022年12月31日,已发行和流通的普通股分别为470股。本公司并无发行任何优先股。
普通股持有者每持有一股普通股可享有一票投票权。如本公司发生任何自动或非自愿清盘、解散或清盘,则在本公司所有债务及负债清偿或拨备清偿后,普通股持有人有权分享本公司可供分配的剩余资产(如有)。普通股的持有者在董事会宣布时有权获得股息。
(9) 出售证券
私人配售
于 2023年8月11日,本公司与WFIA订立证券购买协议,并根据纳斯达克规则以 市场定价的私募发行91,158股普通股,每股购买价为10.97美元,为本公司带来约100万美元的总收益 。公司董事会成员Peter Werth是WFIA的经理。
公开服务
On September 11, 2023, the Company entered into a Securities Purchase Agreement with an institutional investor (September 2023 Offering) pursuant to which the Company issued 86,000 shares of its common stock at a combined price of $11.55 per share and accompanying Series A and Series B warrants and pre-funded warrants (Pre-Funded Warrants) to purchase up to an aggregate of 260,261 shares of its common stock at a combined purchase price of $11.55 per Pre-Funded Warrant, and accompanying Series A and Series B warrants, which represents the public offering price for the common stock less the $0.002 per share exercise price per share for each Pre-Funded Warrant. The September 2023 Offering closed on September 13, 2023. The Pre-Funded Warrants are exercisable at any time after the date of issuance and have no expiration date. The holder of Pre-Funded Warrants may not exercise the warrants if the holder, together with its affiliates, would beneficially own more than 4.99% (or, at the election of the holder, 9.99%) of the number of shares of common stock outstanding immediately after giving effect to such exercise. The September 2023 Offering resulted in gross proceeds to the Company of $3,999,480 before deducting $688,929 of placement agent fees and other offering expenses. See Note 10 for a description of Series A and Series B warrants issued in the September 2023 Offering.
关联方票据折算
于 2023年9月8日,本公司发行WFIA预先注资认股权证以购买341,912股本公司普通股,作为票据转换协议的 部分,如附注7所述。 WFIA预配资金认股权证没有到期日,可立即以每股 0.002美元的行使价行使,但在行使后,WFIA及其关联公司将根据《交易法》第13(d)节实益拥有不超过19.99%的公司普通股流通股。
| F-33 |
与林肯公园购买 协议
于 2023年4月,本公司与Lincoln Park Capital Fund,LLC(林肯公园)订立购买协议(LP购买协议)及注册权协议(注册权 协议)。根据LP购买协议的条款,Lincoln Park已同意 从公司购买高达1200万美元的公司普通股,但须 满足LP购买协议中规定的条件。根据《登记权协议》的条款,公司向美国证券交易委员会提交了一份登记声明,根据《证券法》登记转售根据《LP购买协议》已经或可能向林肯公园发行的225,000股普通股。
根据LP购买协议的条款,在公司签署LP购买协议和注册权协议时, 公司向Lincoln Park发行了18,402股普通股,作为其承诺购买LP购买协议下普通股的代价。承诺股份的价值 为400,409美元,并记录为发行普通股的权益增加,并作为LP购买协议下筹集的资本成本的权益减少。
在截至2023年9月30日的季度,公司根据LP购买协议出售了12,000股普通股,净收益为196,167美元。在截至2023年9月30日的九个月内,公司根据LP购买协议出售了25,500股普通股,所得款项净额为450,427美元。
在 市场产品
于 2023年1月,本公司与H.C.订立公开发售协议(“公开发售协议”)。温赖特公司,有限责任公司(HCW) ,据此,公司可不时发行和出售公司普通股股份,其总发行价格 最高可达497万美元。HCW将作为销售代理,并将根据ATM协议获得每次销售3%的佣金。本公司的普通股将以出售时的现行市场价格出售,因此,价格将有所不同。在截至2023年9月30日的季度内,公司根据ATM协议出售了76,943股普通股,所得款项净额为1,595,429美元。在截至2023年9月30日的九个月内,本公司根据ATM协议出售了82,410股普通股,所得款项净额为1,696,407美元。
(10) 普通股认购权证
除了2023年9月发行的346,261股普通股和预融资权证 外,公司还发行了A系列认股权证和B系列认股权证,分别购买最多346,261股普通股和最多173,131股普通股。A系列和B系列认股权证的行使价为每股11.55美元,并可在股东批准根据认股权证发行的股份的生效日期 行使。A系列权证的有效期为五年 ,而B系列权证的期限为自初始行使日起计的两年 。
本公司根据ASC主题480的规定,评估了预先注资认股权证的负债或权益分类, 区分负债与股权和ASC主题815, 衍生工具和套期保值,并确定股权处理 合适。该公司根据发行日期3,006,008美元的公允价值,对购买260,260股普通股的预筹资权证进行估值。截至2023年9月30日,所有预先出资的权证均未行使。
关于2023年9月的发售,本公司发行了配售代理权证,以购买最多17,313股普通股。 配售代理权证的行使价为每股11.55美元。这些认股权证的有效期为五年,至2028年9月11日结束。
2023年9月发行的A系列、B系列和配售代理权证采用布莱克-斯科尔斯模型进行估值,无风险利率为4.5%-5.3%,期限分别为五年和两年,波动率为1.29-1.32。本公司普通股在计量日期的估计波动率是基于生物技术和制药行业内可比上市公司的平均历史股价波动率,这些公司被视为代表未来的股价趋势,因为本公司的普通股没有足够的交易历史。无风险利率基于认股权证的预期期限 ,基于截至授权日具有类似到期日的美国国债的持续到期日。预期期限已使用认股权证的合同条款进行了 估计。
| F-34 |
下表汇总了公司截至2023年9月30日的已发行普通股认购权证:
未清偿认股权证及权利附表
| 发行日期 | 发行日期 | |||||||||||||||
| 数量 | 锻炼 | 公允价值 | 公允价值 | |||||||||||||
| 认股权证 | 价格 | 每个授权书 | 总计 | |||||||||||||
| 2021年12月首次公开募股 | 239,584 | $ | 120.00 | $ | 95.3997 | $ | 22,856,242 | |||||||||
| 2021年12月承销商认股权证 | 10,417 | $ | 150.00 | $ | 92.7969 | 966,665 | ||||||||||
| 2023年9月WFIA预筹资权证 | 341,912 | $ | 0.0001 | $ | 16.9999 | 5,812,500 | ||||||||||
| 2023年9月公开发售预筹资权证 | 260,261 | $ | 0.0001 | $ | 11.5460 | 3,006,008 | ||||||||||
| 2023年9月公开发行A系列认股权证 | 346,261 | $ | 11.60 | $ | 10.7999 | 3,739,612 | ||||||||||
| 2023年9月公开发行B系列认股权证 | 173,131 | $ | 11.60 | $ | 8.3999 | 1,454,294 | ||||||||||
| 2023年9月配售代理认股权证 | 17,313 | $ | 14.40 | $ | 10.6000 | 183,518 | ||||||||||
| 余额-2023年9月30日 | 1,388,879 | $ | 38,018,839 | |||||||||||||
公司根据ASU 2020-06将这些权证作为股权分类工具进行会计处理,可转换工具和实体自有权益中的合同的会计处理,因为它们是以公司普通股为索引的,并且它们满足ASU 2020-06中为股权分类定义的所有其他条件 。2023年9月公开发售的总收益按以下相对公允价值方法分配给普通股/预筹资权证和普通股认购权证。认股权证的公允价值计入公司资产负债表的额外实收资本。
认股权证对额外实收资本的公允价值
| 百分比 | ||||||||||||
| 公平 | 占总数的 | 金额 | ||||||||||
| 价值 | 公允价值 | 已分配 | ||||||||||
| 普通股和预筹资权证 | $ | 3,999,480 | 42.7 | % | $ | 1,707,778 | ||||||
| A系列、B系列和配售代理认股权证 | 5,377,424 | 57.3 | % | 2,291,702 | ||||||||
| 总计 | $ | 9,376,904 | 100 | % | $ | 3,999,480 | ||||||
(11) 股票薪酬
2021年9月,公司董事会和股东通过了《2021年股权激励计划》(2021年计划),其中规定了 授予激励性股票期权和非限制性股票期权,以购买公司普通股、股票增值权、限制性股票单位、普通股限制性或非限制性股票、业绩股票、业绩单位、激励红利奖励、其他股票奖励和其他现金奖励。在2031年9月24日或之后,不能根据2021计划颁发任何奖励,但2021计划将在此之后继续执行,而之前授予的奖励仍未完成。
根据2021年计划授予的与期权和其他奖励相关的可供发行的普通股最高数量为139,116股,截至2023年9月30日,根据2021年计划可供发行的普通股为66,678股。根据2021年计划可供发行的普通股数量将在每年1月1日自动增加,直至2021年计划到期为止,金额相当于我们在上一历年12月31日已发行普通股总数的5%,按完全稀释的基础计算,除非董事会在此之前采取行动,规定该年度的普通股储备不会增加,或该年度的普通股储备增加的普通股数量将少于其他情况。根据2021年计划,本公司为满足行使价或预扣税款、回购或以其他方式终止的任何奖励而被没收、 取消、行使或结算奖励时扣留的普通股股份将重新计入根据2021计划可供发行的普通股股份中。
| F-35 |
在截至2023年9月30日的9个月中,公司的股票薪酬支出为658,105美元,在截至2022年9月30日的9个月中,公司的股票薪酬支出为594,363美元。在截至2023年9月30日的三个月内,公司记录的基于股票的薪酬支出为236,251美元,在截至2022年9月30日的三个月内记录的股票薪酬支出为205,656美元,均与2021年、2022年和2023年期间发行的期权有关。截至2023年9月30日和2022年12月31日,分别有2,133,614美元和2,637,895美元的未确认薪酬成本与2021计划下授予的基于非既得性股份的薪酬安排有关,预计将在未来一到四年内确认。
截至2023年9月30日止三个月及九个月,该计划项下的期权活动 摘要如下:
期权活动总结
| 加权平均 | 集料 | |||||||||||||||
| 加权平均 | 剩余合同 | 固有的 | ||||||||||||||
| 股票 | 行权价格 | 期限(年) | 价值 | |||||||||||||
| 截至2023年1月1日未偿还 | 43,060 | |||||||||||||||
| 授与 | 19,225 | $ | 35.00 | 9.92 | ||||||||||||
| 已锻炼 | - | |||||||||||||||
| 没收或期满 | (281 | ) | ||||||||||||||
| 截至2023年3月31日的未偿还债务 | 62,004 | $ | 63.20 | 9.01 | ||||||||||||
| 授与 | 6,388 | $ | 19.20 | 9.98 | ||||||||||||
| 已锻炼 | - | |||||||||||||||
| 没收或期满 | (899 | ) | ||||||||||||||
| 截至2023年6月30日的未偿还债务 | 67,493 | $ | 63.20 | 9.01 | ||||||||||||
| 授与 | 5,204 | $ | 12.20 | 9.89 | ||||||||||||
| 已锻炼 | - | |||||||||||||||
| 没收或期满 | (50 | ) | ||||||||||||||
| 截至2023年9月30日的未偿还债务 | 72,647 | $ | 59.80 | 8.84 | $ | 10,607 | ||||||||||
| 已归属及预期于二零二三年九月三十日归属 | 72,647 | |||||||||||||||
| 可于2023年9月30日行使 | 16,816 | |||||||||||||||
公司发行的股票期权符合ASC 718规定的股权会计处理资格,薪酬-股票薪酬, 并相应地按授予日的公允价值计量。期权的公允价值使用Black-Scholes 模型进行估计。在截至2023年9月30日的九个月期间,公司用来估计授予员工的股票期权的授予日期公允价值的假设如下,按加权平均显示:
公允价值假设附表
| 无风险利率 | 4.073 | % | ||
| 预期期限(以年为单位) | 5.9 | |||
| 预期波动率 | 1.27 | |||
| 预期股息收益率 | 0 | % |
无风险 利率:本公司基于期权预期期限内的无风险利率,该利率基于截至授予日期具有类似到期日的美国国债的固定到期日 。
预期 期限:预期年期指已授出购股权预期尚未行使的期间,并使用 简化方法(基于归属日期与合约年期结束之间的中点)厘定。
预期波动 :本公司使用生物技术 和制药行业内可比上市公司的平均历史股价波动率,这些公司被视为未来股价趋势的代表,因为本公司的普通股没有足够的 交易历史。本公司将继续应用此流程,直至获得足够数量的有关其自身股票价格波动性的历史信息。
| F-36 |
预期 股息收益率:本公司尚未支付,也不预期在不久的将来支付任何股息。因此,预期 股息收益率为零。
截至2023年9月30日止三个月内授出的购股权于授出日的公允价值介乎10.20美元至12.80美元,而于截至2023年9月30日的九个月内授出的购股权的授出日期公允价值介乎10.20美元至30.60美元。
股票期权的合计内在价值按股票期权的行权价与公司普通股的公允价值之间的差额计算。根据我们普通股在纳斯达克资本市场的收盘价,截至2023年9月30日,普通股每股公允价值为14.20美元,截至2022年12月31日,每股公允价值为20.00美元。
(12) 所得税
扣带 公司根据国内税收法,公司被列为C类公司。扣带公司记录递延所得税,以反映为财务报告目的记录的资产和负债金额与税法和法规衡量的金额之间的暂时性差异的影响。CTx是Cingulate Inc.的全资子公司,以及CTx的所有活动, 以及其全资子公司Cingulate Works Inc.,计算Cingulate Inc.的即期及递延税项资产及负债时已计入。截至2023年及2022年9月30日止三个月期间或截至2023年及2022年9月30日止九个月期间,并无就联邦或州所得税录得递延所得税利益或开支。
所得税 费用与应用美国联邦所得税税率计算的预期费用不同,如下所示:
有效所得税率调节表
| 截至 2023年9月30日的三个月 | 截至三个月 2022年9月30日 | 九个月结束 2023年9月30日 | 九个月结束 2022年9月30日 | |||||||||||||
| 法定税率的联邦所得税优惠 | $ | (1,255,601 | ) | $ | (845,722 | ) | $ | (3,486,052 | ) | $ | (2,733,779 | ) | ||||
| 州所得税优惠 | (330,642 | ) | (222,707 | ) | (917,994 | ) | (719,896 | ) | ||||||||
| 永久性差异 | 6,154 | 3,157 | 14,457 | 11,920 | ||||||||||||
| 更改估值免税额 | 2,218,188 | 1,132,895 | 5,089,875 | 3,572,189 | ||||||||||||
| 上一期间调整数 | (620,630 | ) | - | (620,630 | ) | - | ||||||||||
| 其他 | (17,469 | ) | (67,623 | ) | (79,656 | ) | (130,434 | ) | ||||||||
| 所得税总支出 | $ | - | $ | - | $ | - | $ | - | ||||||||
评估 递延税项资产估值准备的必要性和金额通常需要对每个司法管辖区的所有可用证据进行重大判断和广泛分析 。该等判决要求本公司解释现行税法及适用于其情况的其他已公布指引。作为此次评估的一部分,公司考虑了有关其盈利能力和税务状况的正面和负面证据。如果根据现有证据,递延税项资产的全部或部分更有可能无法变现,则提供估值拨备。根据过往收入水平及未来应课税收入预测,除其他项目外,本公司确定其递延税项资产更有可能无法变现 。本公司于2023年9月30日及2022年12月31日分别计提10,988,821美元及5,580,595美元的递延税项净资产的减值准备,并在所附的综合经营报表及其他全面亏损中作为所得税支出的一部分入账。
该公司在美国联邦和各州司法管辖区提交所得税申报单。在2018年前,本公司不需要接受美国联邦和州税务机关的所得税审查。
公司遵循FASB ASC 740的规定,所得税,以评估不确定的税收状况。本主题规定了对纳税申报单中已采取或预期采取的纳税头寸的财务报表确认和计量的确认阈值和计量属性。截至2023年9月30日或2022年12月31日,本公司尚未发现任何需要在合并财务报表中确认的重大不确定税务状况。
| F-37 |
递延税项资产负债表
| 2023年9月30日 | 2022年12月31日 | |||||||
| 递延所得税资产: | ||||||||
| 当前: | ||||||||
| 研发成本 | $ | 723,577 | $ | 343,087 | ||||
| 其他 | 59,126 | 59,018 | ||||||
| 非当前: | ||||||||
| 净营业亏损 | 5,862,906 | 3,381,215 | ||||||
| 研发成本 | 3,645,038 | 1,762,716 | ||||||
| 研发税收抵免 | 756,122 | - | ||||||
| 非既得性股票期权 | 405,739 | 204,380 | ||||||
| 专利 | 99,118 | 92,417 | ||||||
| 使用权资产 | 45,265 | 63,563 | ||||||
| 递延所得税总资产 | 11,596,891 | 5,906,396 | ||||||
| 减去:估值免税额 | (10,988,821 | ) | (5,580,595 | ) | ||||
| 递延所得税净资产 | 608,070 | 325,801 | ||||||
| 递延所得税负债: | ||||||||
| 当前: | ||||||||
| 应计现金 | - | (11,228 | ) | |||||
| 非当前 | ||||||||
| 财产和设备 | (608,070 | ) | (314,573 | ) | ||||
| 递延所得税总负债 | (608,070 | ) | (325,801 | ) | ||||
| 递延税项净资产(负债) | $ | - | $ | - | ||||
(13) 每股净亏损
基本每股净亏损是通过普通股股东应占净亏损除以普通股加权平均数和期内已发行预筹资权证的加权平均数计算得出的。预筹资权证计入加权平均已发行股份数目 ,因为它们的行使只需要交付股份的名义代价。下表 列出了截至2023年9月30日和2022年9月30日的三个月和九个月的基本和稀释后每股净亏损的计算方法:
每股基本和摊薄净亏损明细表
| 截至2023年9月30日的三个月 | 截至三个月 2022年9月30日 | 九个月结束 2023年9月30日 | 九个月结束 2022年9月30日 | |||||||||||||
| 分子: | ||||||||||||||||
| 净亏损 | $ | (5,979,054 | ) | $ | (4,027,247 | ) | $ | (16,600,250 | ) | $ | (13,071,205 | ) | ||||
| 分母: | ||||||||||||||||
| 加权平均流通股 | 988,333 | 565,470 | 714,397 | 565,470 | ||||||||||||
| 每股基本和稀释后净亏损 | $ | (6.05 | ) | $ | (7.12 | ) | $ | (23.24 | ) | $ | (23.12 | ) | ||||
在截至2023年9月30日和2022年9月30日的三个月和九个月期间,未包括在稀释后每股计算中的潜在稀释证券 如下:
潜在稀释证券明细表
| 2023年9月30日 | 2022年9月30日 | |||||||
| 根据2021年股权激励计划发行的股票期权 | 72,647 | 44,190 | ||||||
| 未偿还普通股认购权证 | 786,704 | 250,000 | ||||||
| 总计 | 859,351 | 294,190 | ||||||
| F-38 |
(14) 许可协议
CTX 与一家公司签订了一项许可协议,涉及用于开发CTX-1301、CTX-1302、 和CTX-2103的专利和许可技术。应在发生下列里程碑事件时付款:
| ● | 根据现场每个产品的3期临床试验中的第一名患者的剂量支付250,000美元里程碑付款 ,按产品支付。 | |
| ● | 在被许可方为该领域的每种产品提交新药申请时支付250,000美元里程碑付款, 按产品支付。 | |
| ● | CTX-1301和CTX-1302的里程碑付款为250,000美元,CTX-2103的里程碑付款为500,000美元,在收到FDA的首次上市批准后,按产品支付。 | |
| ● | 收到欧洲药品管理局(European Medicines Agency)的首次上市批准后,购买CTX-2103的250,000美元里程碑付款 |
截至2022年12月31日,CTX-1301与3期临床试验中第一名患者剂量有关的250,000美元里程碑已累计 ,因为管理层认为这一里程碑很可能发生。2023年初,该公司支付了这笔款项,因为CTX-1301第三阶段临床试验的第一名患者接受了剂量治疗。本公司并无就任何其他产品记录与其他里程碑有关的任何开支,因为本公司并不认为截至2023年9月30日有可能发生该等开支。
(15) 关联方交易
本公司总法律顾问是一家律师事务所的合伙人,该律师事务所提供本公司租赁的办公设施空间。本公司于截至2023年及2022年9月30日止九个月的租金开支为27,000美元,而截至2023年9月30日及2022年9月30日止三个月的租金开支为9,000美元,接近公允价值。截至2023年9月30日和2022年12月31日,本公司 没有本租约项下的未偿还款项。
公司董事会成员Peter Werth是WFIA的经理,该实体向公司提供了800万美元的债务 融资,其中500万美元于2023年9月转换为股权,如附注7所述。截至2023年9月30日,尚未偿还本金余额300万美元,截至2022年12月31日,尚未偿还初始本金余额500万美元。截至2023年9月30日和2022年9月30日的三个月分别确认利息支出237,500美元和104,838美元。在截至2023年9月30日和2022年9月30日的9个月内,分别确认利息支出677,500美元和104,838美元。截至2023年9月30日和2022年12月31日,与该票据相关的应计利息中有157,339美元和292,339美元未偿还。
于2023年8月11日,本公司与WFIA订立证券购买协议,并根据纳斯达克规则以私募方式发行91,158股其普通股,每股收购价为10.97美元,为本公司带来约1,000,000美元的毛收入。
(16) 后续事件
管理层 评估2023年9月30日至2023年11月13日期间发生的事件,这是中期财务报表的发布日期 。
(17)股票反向拆分
2023年11月30日,公司 完成了一项二十股一股的反向股票拆分(“反向股票拆分”),减少了紧接反向股票拆分生效之前发行和发行的公司普通股的数量。公司法定普通股的数量不受反向股票拆分的影响,公司普通股的面值保持不变,为每股0.0001美元。没有发行与反向股票拆分相关的零碎股份。除披露外,所有与股份数目及每股金额有关的金额均已在该等财务报表中追溯重述。
| F-39 |
1,375,000股普通股
3,750,000系列认股权证购买最多3,750,000股普通股
1,875,000股B系列认股权证购买最多1,875,000股普通股
2,375,000股预筹资金 认股权证最多购买2,375,000股普通股
A系列认股权证、B系列认股权证和预先出资认股权证相关的800万股普通股
150,000份配售代理认股权证购买最多150,000股普通股
150,000股普通股 配售代理认股权证

招股说明书
2024年2月2日