

Olema Oncology 摩根大通会议 2024

前瞻性陈述本演示文稿包含根据1995年《私人证券诉讼改革法》的安全港条款做出的前瞻性陈述。本演示文稿中非历史事实陈述的陈述均为前瞻性陈述。此类前瞻性陈述包括但不限于有关我们的研究和临床开发计划、开发我们的候选产品或任何其他未来候选产品的范围、进展、结果和成本、战略、监管事宜的陈述,包括获得药物批准的时机和成功可能性、帕拉西司朗(OP-1250)作为单一疗法和联合试验(包括公司的关键三期单一疗法 OPERA-01)的潜在临床研究结果和临床试验的时间表临床试验,以及OPERA-02,该公司潜在的关键性3期联合临床试验,palazestrant作为单一疗法和联合试验中的潜在有益特征、安全性、耐受性、疗效和治疗效果,片剂配方的潜在有益特性和耐受性,palazestrant有可能成为ER+/HER2-转移性乳腺癌的同类最佳治疗选择和乳腺癌女性的主要疗法,可组合性 palazestrant 与其他药物一起使用,潜在药物的时间表我们的KAT6抑制剂的临床前研究和临床工作、市场规模和机会、我们完成某些里程碑的能力、我们的财务状况、现金状况、资金来源和财务资源的充足性以及管理团队的充足性。诸如 “相信”、“预测”、“计划”、“期望”、“打算”、“将”、“可能”、“目标”、“项目”、“估计”、“潜力” 等词语和类似表述旨在识别前瞻性陈述,尽管并非所有前瞻性陈述都一定包含这些识别词。这些前瞻性陈述基于公司管理层的信念以及公司做出的假设和目前可获得的信息。此类陈述反映了公司当前对未来事件的看法,并受已知和未知风险的影响,包括业务、监管、经济和竞争风险、不确定性、突发事件和对公司的假设,包括但不限于开发产品和技术所固有的风险、公司正在进行和计划中的临床试验的未来结果、公司获得足够资金以资助其计划临床试验和其他费用的能力、行业趋势、法律和行业和未来支出的监管框架,以及影响公司的其他风险和不确定性,包括 “风险因素” 标题下以及公司10-Q表季度报告、10-K表年度报告以及公司未来向美国证券交易委员会提交的文件和报告中其他地方描述的风险和不确定性。鉴于这些风险和不确定性,前瞻性陈述中提及的事件或情况可能不会发生。实际结果可能与预期结果有所不同,并且差异可能是重大的。不应将这些前瞻性陈述视为预测或承诺,也不应将其视为暗示任何迹象、保证或保证,表明此类前瞻性陈述所依据的假设是正确或详尽的,或者就假设而言,在本演示文稿中已得到充分陈述。提醒您不要过分依赖这些前瞻性陈述,这些陈述仅代表截至本演示文稿发表之日。本演示文稿讨论了正在进行临床研究且尚未获得美国食品药品监督管理局批准上市的候选产品。没有就这些候选产品的安全性或有效性作出任何陈述,以供研究此类候选产品的用途。本演示文稿包含我们尚未独立验证的公开第三方数据。进行跨审比较存在固有的风险,应谨慎解释结果。此类第三方数据的呈现并不代表对palazestrant与任何其他第三方候选药物或研究的表现进行正面比较。相反,此类第三方数据是我们从公开来源中提取的,仅用于补充信息的目的。我们提醒您,不应将此处列出的第三方数据的任何比较视为并排比较,并且您不应依赖我们在这些幻灯片中展示的任何第三方候选药物结果的完整性或准确性,这是由于研究设计、其他公司量化或合格标准的方式、结果的记录方式以及其他区别因素和不确定性的差异。由于我们可能没有意识到或可能无法充分呈现各种区别因素和不确定性,因此此处提出的比较可能无法正确呈现此类第三方数据,这些数据可能与此处提供的数据存在重大差异。鼓励投资者独立审查第三方数据,不应将我们提供的此类数据(包括与palazestrant的业绩进行比较的任何此类数据)作为评估我们业务的单一衡量标准。此处包含的商标是其所有者的财产,仅用于参考目的。此类使用不应被解释为对此类产品的认可。
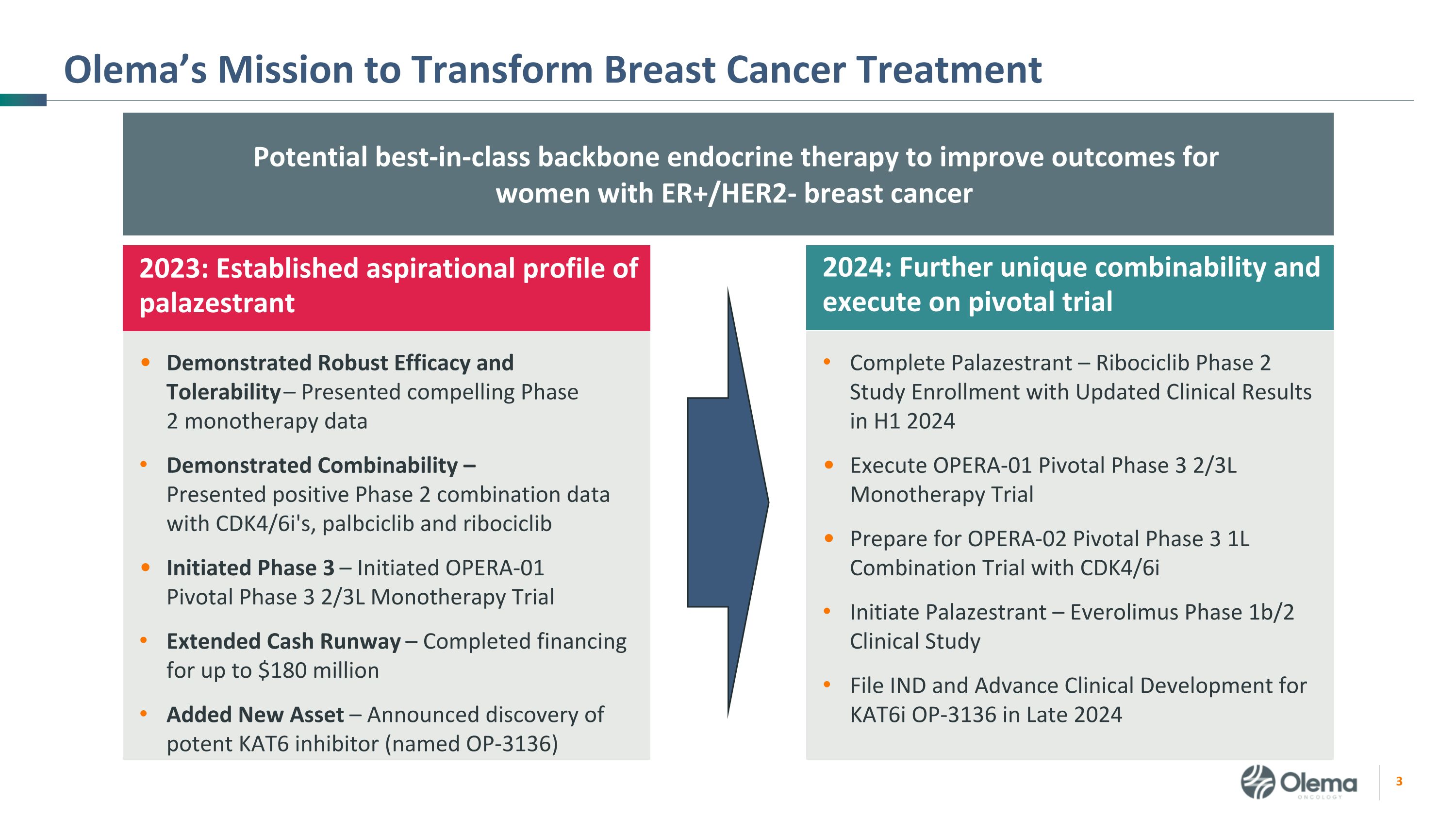
Olema 的使命是改变乳腺癌治疗的潜在一流骨干内分泌疗法,以改善 2024 年 ER+/HER2-乳腺癌女性的预后:进一步独特的组合性并执行关键试验完成 Palazestrant — Ribociclib 2 期研究入组,更新临床结果 2024 年上半年执行 OPERA-01 关键期 2/3L 单一疗法试验,为使用 CDK4/6i 的 OPERA-02 关键期 1L 联合试验做准备 Everolimus 1b/2 期临床研究档案 Kat6i OP 的临床研究和高级临床开发2024 年末的 -3136:已确立的 palazestrant 吸气概况显示出强劲的疗效和耐受性 — 提供了令人信服的 2 期单一疗法数据,显示了可组合性 — 提供了积极的 2 期联合数据,启动了 OPERA-01 关键第 3 期 2/3L 单一疗法试验,延长了现金流 — 完成了高达 1.8 亿美元的融资,新增了资产 — 宣布发现强效的 KATC 6 抑制剂(命名为 OP-3136)

Palazestrant:一种差异化的下一代内分泌疗法 Palazestrant,一种完整的雌激素受体 (ER) 拮抗剂 (CERAN),可有效完全灭活 ER,阻断 ER 驱动的转录活性,抑制 ER 驱动的乳腺癌细胞生长,并强力诱导 ER 降解。完成 ER 拮抗剂关闭 AF2 并招募 N-cor 来灭活 AF1 Palazestrant Palazestrant Estrant (CERAN/SERD) Complete ER Antagonism CERAN 可完全阻断急诊室的生长和增殖信号,从而推动野生型和突变体 ER 中更深、更持久的反应极具吸引力的药代动力学、口服生物利用度和 8 天半衰期良好的耐受性对大量预处理的患者具有良好的耐受性稳健的肿瘤收缩率临床前模型中野生型和突变体急诊中有意义的抗肿瘤活性在临床环境中具有持久的益处组合性可与全剂量ribociclib或palbociclib联合使用——不含DDI*,总体耐受性与CDK4/6i plus的预期特征一致内分泌疗法中枢神经系统渗透在非临床大脑中表现出活性转移模型 *在 SABCS 2023 上对 Palbociclib 或 Ribociclib 联合研究的临时更新。缩略语:AF1,活化因子 1;AF2,活化因子 2;CDK4/6i,细胞周期蛋白依赖激酶 4/6 抑制剂;DDI,药物相互作用参考文献:Shang 和 Brown,《科学》,2002 年:第 295 卷,第 5564 期,第 2465-2468 页;Webb、Nguyen 和 Kushner,JBC,2003 年:第 278 卷,第 6912—6920 页

2/3L 和 1L MBC 治疗的竞争项目和市场机会当前活性项目 2L/3L ER+/HER2-MBC 1L Combo ER+/HER2-MBC * *美纳里尼的药物 ORSERDU(elacestrant)于 2023 年 1 月 27 日获得美国食品药品管理局批准,用于治疗初始荷尔蒙疗法后的 ER+/HER2-ESR1 突变转移性乳腺癌。/患者 ~15万疗程持续时间2~2-12个月以上的市场潜力3 50亿美元以上的患者约11.5万疗程持续时间2 ~6-36个月以上的市场潜力3 100亿美元以上的市场潜力根据ER+/HER2-1 12025年发病率预测估算的100亿美元以上的市场机会。Olema内部数据,基于Informa ER+/HER2-BC患病率的市场预测。2Olema内部数据。总内分泌疗法市场(美国和欧盟5国)的32025年机会估计。Olema 内部数据。w/palbociclib w/palbociclib w/palbociclib
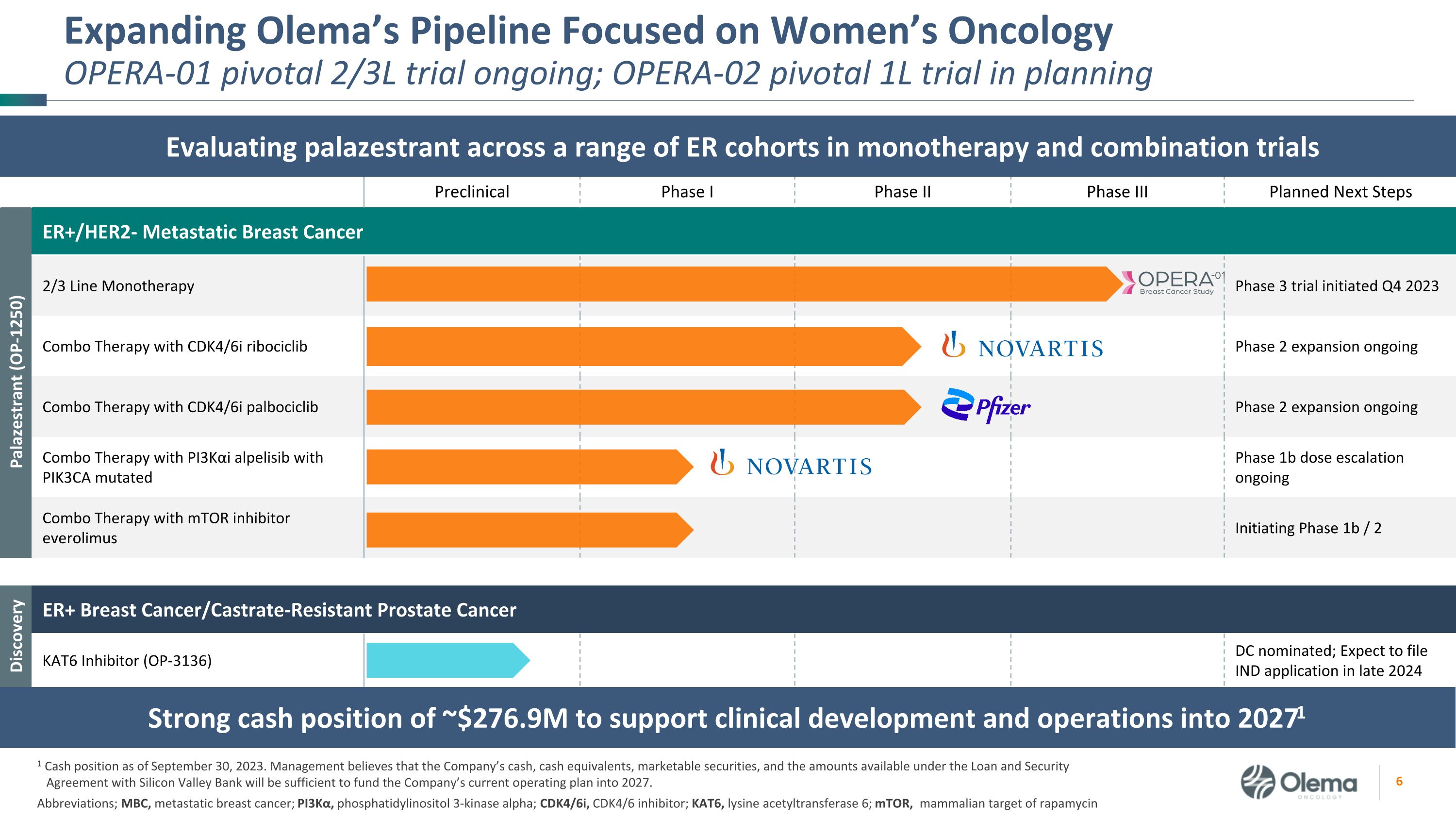
临床前 I 期 II 期 II 期 III II 期计划进行后续步骤 Palazestrant (OP-1250) ER+/HER2-转移性乳腺癌 2/3 系单一疗法 3 期试验于 2023 年第四季度启动 CDK4/6i ribociclib 的组合疗法 2 期扩展正在进行中 PI3KαI alpelisib 与 PIK3CA 突变 1b 期剂量递增的组合疗法正在进行的 mTOR 抑制剂 everolimus 联合疗法启动 1b/2 阶段 Discovery ER+ 乳腺癌/去势抗性前列腺癌发现 KAT6 抑制剂 (OP-3136) DC 提名;预计将在2024年底提交IND申请,扩大Olema的产品线,专注于女性肿瘤学Opera-01的关键2/3L试验正在进行中;OPERA-02 关键1L试验正在规划缩写中;MBC,转移性乳腺癌;PI3Kα,磷脂酰肌醇3-激酶 α;CDK4/6i,CDK4/6抑制剂;KAT6,赖氨酸乙酰转移酶 6;mmTOR,雷帕霉素的目标在单一疗法和联合试验中评估一系列急诊室群组中的帕拉西司坦的强劲现金状况约为2.769亿美元,用于支持20271年的临床开发和运营 1 截至20271年的现金状况2023 年 9 月 30 日。管理层认为,公司的现金、现金等价物、有价证券以及与硅谷银行签订的贷款和担保协议下的可用金额将足以为公司当前的2027年运营计划提供资金。

Palazestrant 2 期单一疗法临床结果 (ESMO 2023)
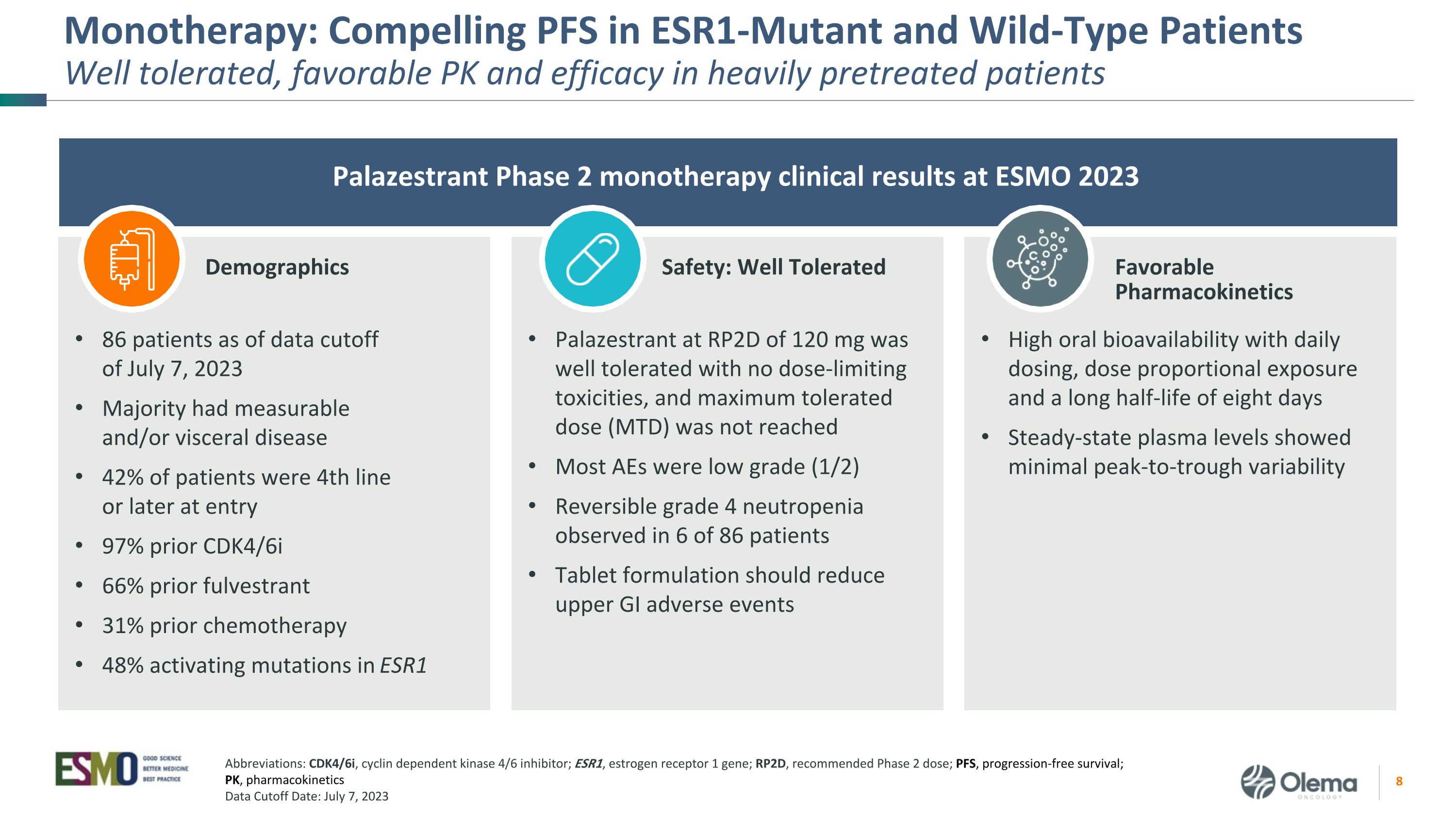
单一疗法:ESR1突变体和野生型患者具有良好的耐受性、良好的PK值和疗效 Palazestrant 2023 年 ESMO 2 期单一疗法临床结果口服生物利用度高,每日剂量、剂量比例暴露和长达八天的半衰期,稳态血浆水平显示出最小的峰谷变异性截至 2023 年 7 月 7 日数据截止日期 86 名患者进行了可测量和/或内脏疾病 42% 的患者在入院时处于第 4 线或晚期 97% 之前是 CDK4/6i 66% 之前是 fulvestrant 31%化疗 RP2D 为 120 mg 的 ESR1 Palazestrant 中有 48% 的激活突变耐受性良好,没有剂量限制毒性,未达到最大耐受剂量 (MTD)。大多数 AE 为低级 (1/2) 可逆的 4 级中性粒细胞减少在 86 名患者中观察到 4 级中性粒细胞减少症片剂配方应减少上消化道不良事件人口统计学安全性:耐受性良好有利药代动力学缩写:CDK4/6i,细胞周期蛋白依赖性激酶 4/6 抑制剂;ESR1,雌激素受体 1 基因;RP2D,推荐的 2 期剂量;PFS,无进展存活率;PK,药代动力学数据截止日期:2023 年 7 月 7 日
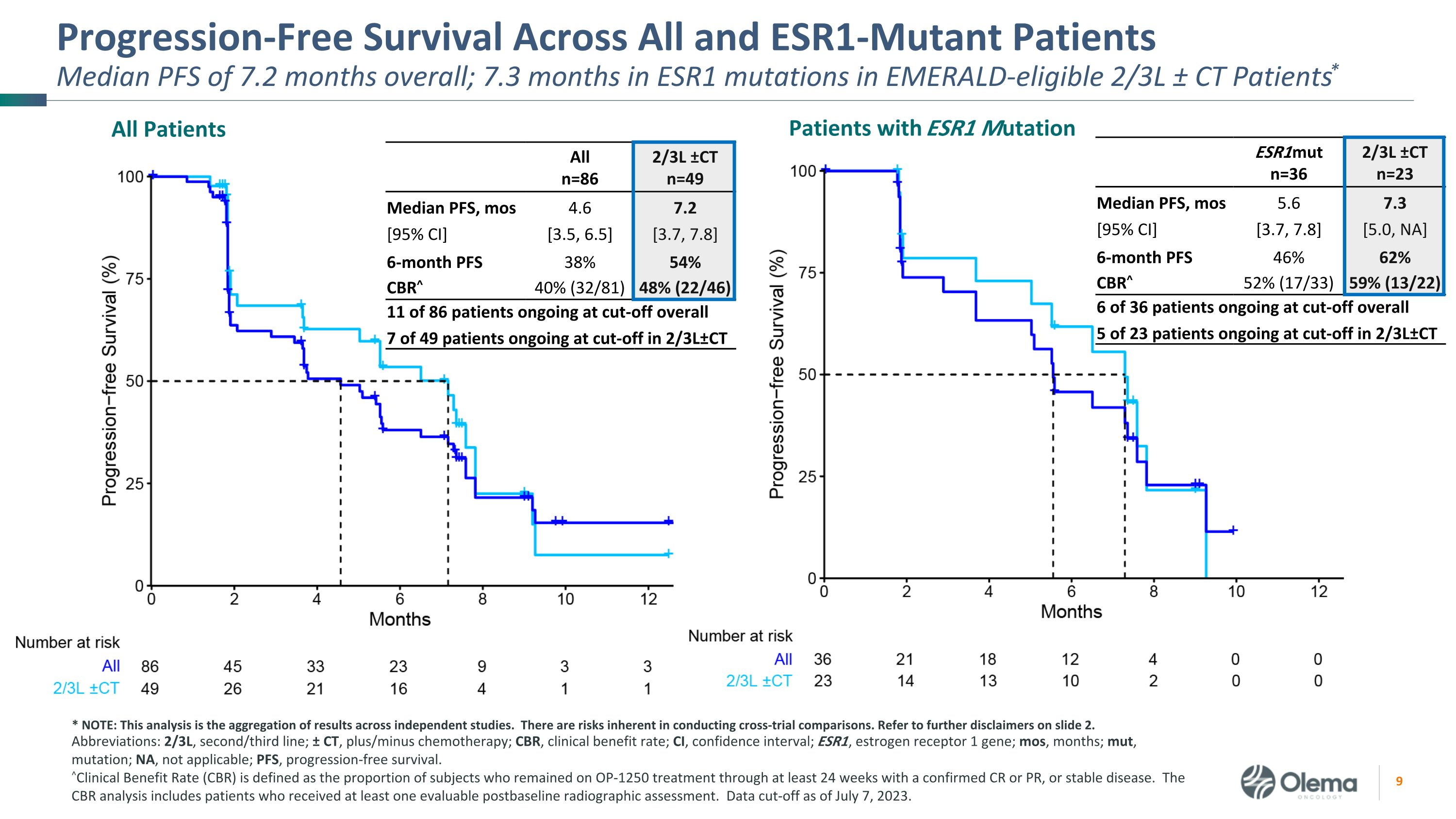
所有和 ESR1 突变患者的无进展存活率总计 7.2 个月;符合 Emerald 条件的 2/3L ± CT 患者的 ESR1 突变中位数 7.3 个月* 所有 ESR1 突变患者 Alln=86 2/3L ±ctn=49 中位数 PFS,mos [95% 置信区] 4.6 [3.5, 6.5] 7.2 [3.7, 7.8]6 个月 PFS 38% 54% CBR^ 40% (32/81) 48% (22/46) 86 名患者中 11 名患者中总共有 11 名患者在 2/3L±CT 处于截止期 ESR1mutn=36 2/3L ±ctn=23 中位数 PFS,mos [95% 置信区] 5.6 [3.7, 7.8] 7.3 [5.0,不是]6 个月 PFS 46% 62% CBR^ 52% (17/33) 59% (13/22) 36 名患者中有 6 名患者在 2/3L±CT 处于截止期 23 名患者中 5 名缩写:2/3L,二线/三线;± CT,加/减化疗;CBR,临床获益率;CI,置信区间;ESR1,雌激素受体 1 基因;mos,月份;,突变;NA,不适用;PFS,无进展存活。^临床受益率 (CBR) 定义为在至少 24 周内仍在接受 OP-1250 治疗且确诊为 CR 或 PR 或病情稳定的受试者比例。CBR 分析包括接受过至少一次可评估的基线后射线照相评估的患者。截止日期为 2023 年 7 月 7 日。* 注:该分析是独立研究结果的汇总。进行交叉试验比较存在固有的风险。请参阅幻灯片 2 中的更多免责声明。
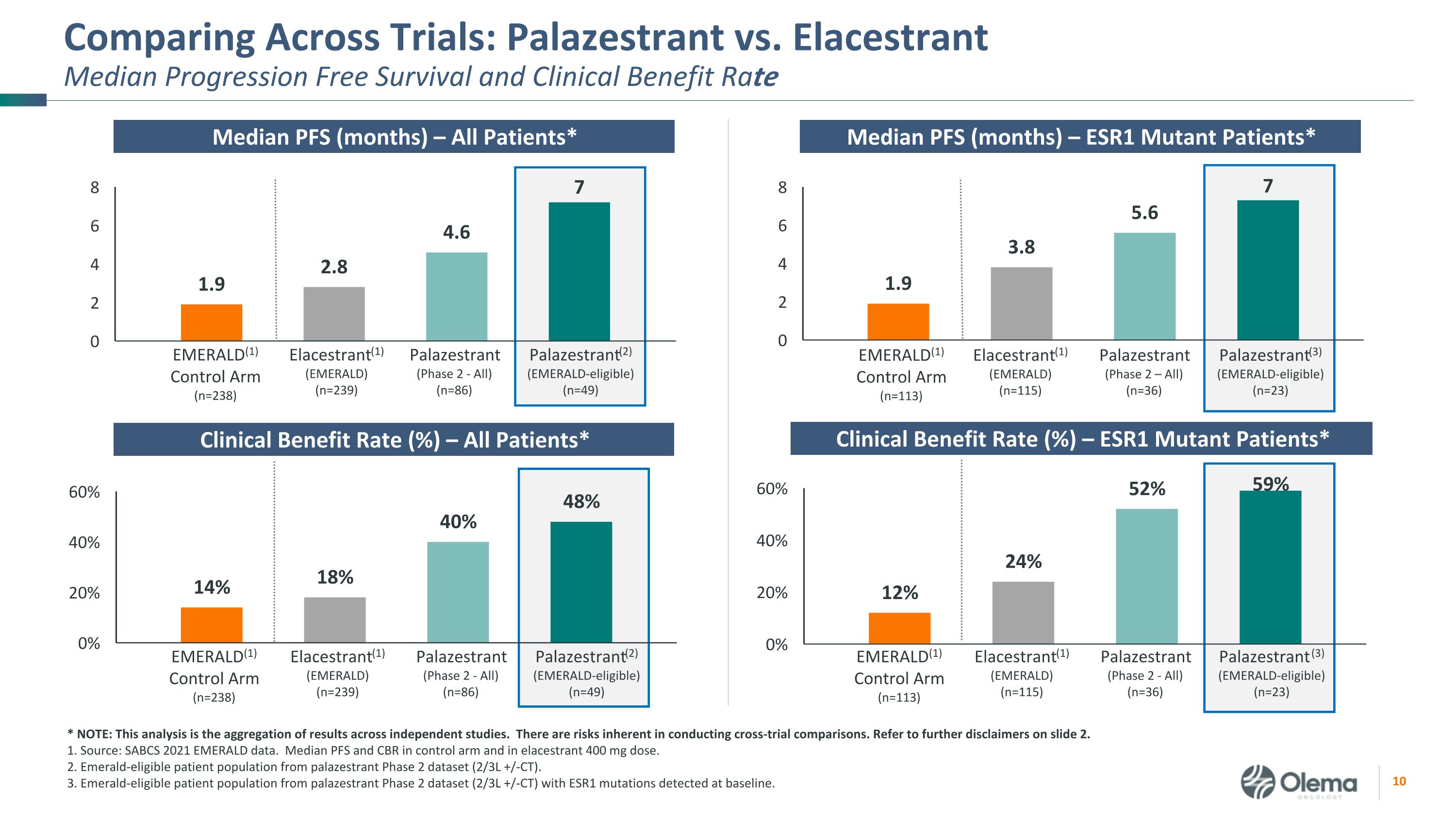
对比试验:Palazestrant 与 Elastrant 中位数自由进展存活率和临床受益率 EMERALD (1) 对照组 (n=238) Elastrant (1) (EMERALD) (n=239) Palazestrant (2)(符合 Emerald 资格)(n=49)Palazestrant(2 期——全部)(n=86)EMERALD (1) 控制臂(n=113)Elastrant (1) (EMERALD) (n=115) Palazestrant (3)(符合 Emerald 资格)(n=23)Palazestrant(第 2 阶段 — 全部)(n=36)中位数 PFS(月)— 所有患者* PFS 中位数(月)— ESR1 突变患者* 临床获益率(%)— ESR1 突变患者* EMERALD (1)) 控制臂 (n=238) Elastrant (1) (EMERALD) (n=239) Palazestrant (2)(符合 Emerald 资格)(n=49)Palazestrant(第 2 阶段-全部)(n=86) EMERALD (1) 控制臂 (n=113) Elacestrant (1) (EMERALD) (n=115) Palazestrant (3) Emerald (1) Emerald (1) (EMERALD) (1) (EMERALD) (n=115) Palazestrant (3) (Emerald) (3) Emerald (符合ALD资格)(n=23)Palazestrant(第二阶段——全部)(n=36)*注:该分析汇总了独立研究的结果。进行交叉试验比较存在固有的风险。请参阅幻灯片 2.1 中的更多免责声明。资料来源:SABCS 2021 年 EMERALD 数据。对照组和弹性剂量的 PFS 和 CBR 中位数 400 mg。2.来自 palazestrant 2 期数据集(2/3L +/-CT)的 Emerald 合格患者群体。3.来自 palazestrant 2 期数据集(2/3L +/-CT)的 Emerald 合格患者群体,基线时检测到 ESR1 突变。
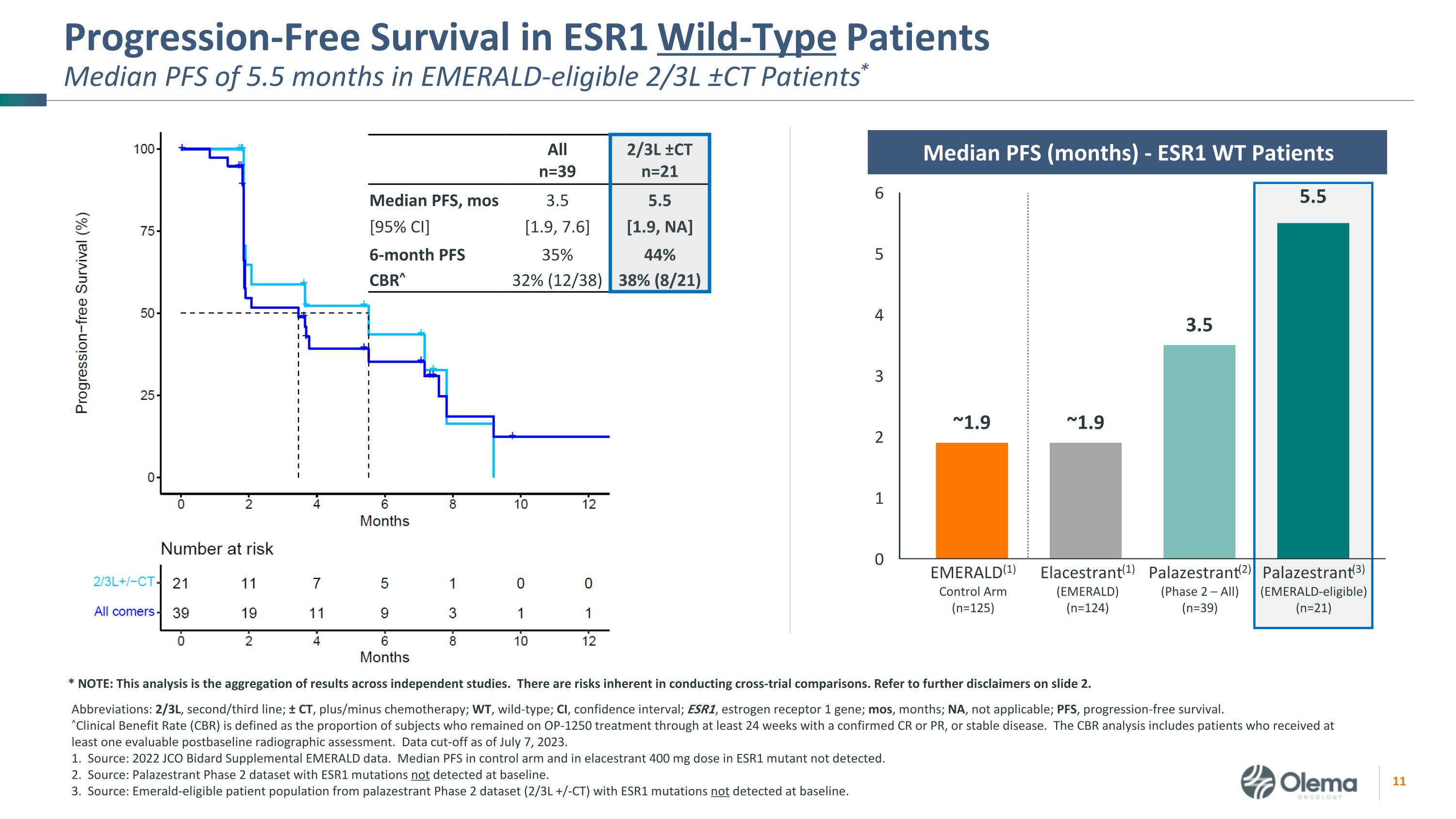
ESR1 野生型患者的无进展存活率符合Emerald条件的2/3L ±CT患者中位PFS为5.5个月*缩写:2/3L,第二/三线;± CT,加/减化疗;WT,野生型;CI,置信区间;ESR1,雌激素受体 1 基因;mos,月;NA,不适用;PFS,无进展生存。^临床受益率 (CBR) 定义为在至少 24 周内仍在接受 OP-1250 治疗且确诊为 CR 或 PR 或病情稳定的受试者比例。CBR 分析包括接受过至少一次可评估的基线后射线照相评估的患者。截止日期为 2023 年 7 月 7 日。1.资料来源:2022年JCO Bidard补充绿宝石数据。未检测到 ESR1 突变体中对照组和弹性剂中 400 mg 剂量的 PFS 中位数。2.来源:Palazestrant 第 2 期数据集,基线时未检测到 ESR1 突变。3.来源:palazestrant 2期数据集(2/3L +/-CT)中符合Emerald条件的患者群体,其ESR1突变在基线时未检测到。Alln=39 2/3L ±ctn=21 中位数 PFS,mos [95% 置信区] 3.5 [1.9, 7.6] 5.5 [1.9,不适用]6 个月 PFS 35% 44% CBR^ 32% (12/38) 38% (8/21) EMERALD (1) 控制臂 (n=125) Elastrant (1) (EMERALD) (n=124) Palazestrant (3)(符合绿宝石资格)(n=21)Palazestrant(2)(第 2 阶段 — 全部)(n=39)Pfs 中位数(月)-ESR1 WT 患者 * 注意:该分析是独立研究结果的汇总。进行交叉试验比较存在固有的风险。请参阅幻灯片 2 中的更多免责声明。
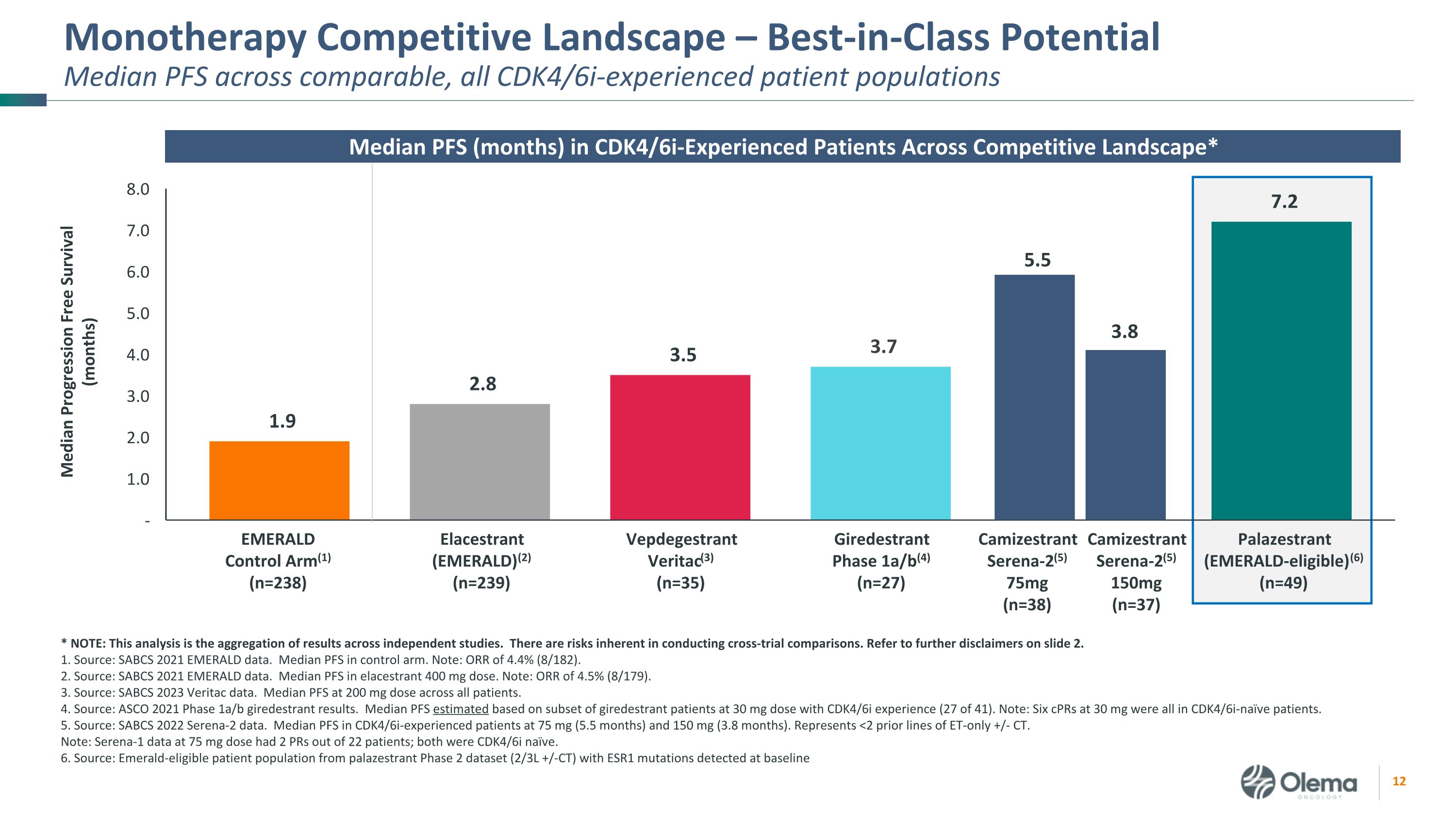
单一疗法的竞争格局——在所有具有CDK4/6I经验的同类患者群体中,潜在的中位PFS处于同类中位数。*注:该分析汇总了独立研究的结果。进行交叉试验比较存在固有的风险。请参阅幻灯片 2.1 中的更多免责声明。资料来源:SABCS 2021 年 EMERALD 数据。控制臂的 PFS 中位数。注意:ORR 为 4.4% (8/182)。2.资料来源:SABCS 2021 年 EMERALD 数据。400 mg 剂量的 PFS 中位数。注意:ORR 为 4.5% (8/179)。3.资料来源:SABCS 2023 Veritac 数据。所有患者的 PFS 中位数为 200 mg。资料来源:ASCO 2021 年第 1a/b 阶段 giredestrant 结果。PFS中位数是根据剂量为30 mg且有CDK4/6i经历的吉瑞司朗患者子集(41例中的27例)估算得出的。注意:六次 30 mg 的 CPR 均为 CDK4/6I-naive 患者。5.资料来源:SABCS 2022 Serena-2 数据。经历过CDK4/6I的患者的PFS中位数为75毫克(5.5个月)和150毫克(3.8个月)。代表

1b/2 期联合临床结果(SABCS 2023)
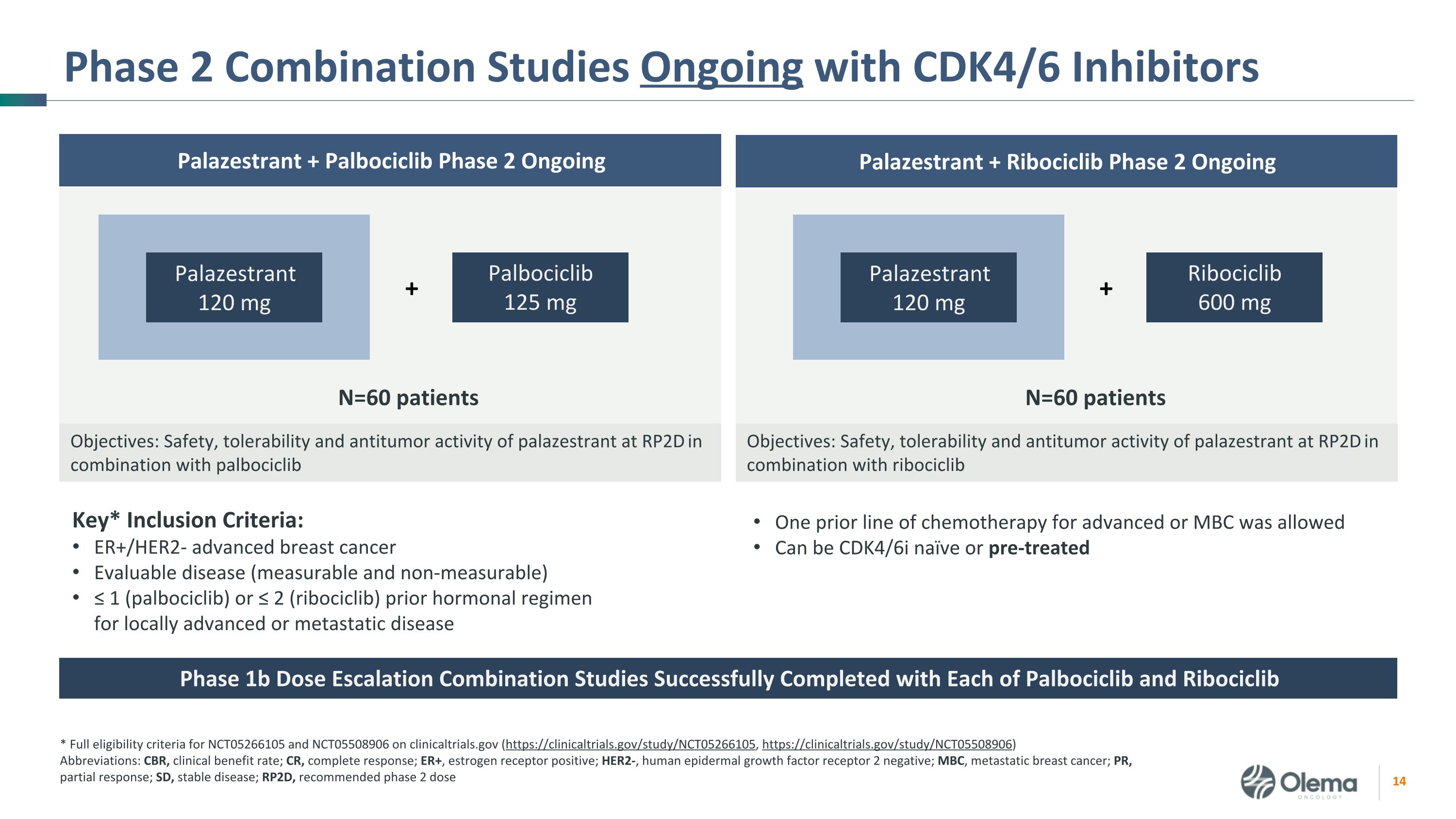
正在进行的使用 CDK4/6 抑制剂的 2 期联合研究关键* 纳入标准:ER+/HER2-晚期乳腺癌可评估疾病(可测量且不可测量)≤ 1(palbociclib)或 ≤ 2(ribociclib)先前针对局部晚期或转移性疾病的激素方案 * clinicaltrials.gov 上的 NCT05266105 和 NCT05508906 的完整资格标准(https://clinicaltrials.gov/study/NCT05266105,https://clinicaltrials.gov/study/NCT05508906)缩写:CBR,临床受益率;CR,完全反应;ER+,雌激素受体阳性;HER2-,人类表皮生长因子受体 2 阴性;MBC,转移性乳腺癌;PR,部分反应;SD,稳定疾病;RP2D,推荐的 2 期剂量 Palazestrant + Ribociclib 第 2 期持续目标:palazestrant 与 palbociclib 联合使用 120 mg Palbociclib 125 mg + N=60 患者的安全性、耐受性和抗肿瘤活性:Palazestrant 与 ribociclib Palazestrant + Palbociclib 2 期联合使用 RP2D 时的安全性、耐受性和抗肿瘤活性 Palazestrant 120 mg Ribociclib 600 mg + 前一线允许对晚期或 MBC 进行化疗可以是 CDK4/6i 天真或经过预治疗的 1b 期剂量递增联合研究 Palbociclib 和 Ribociclib 均成功完成
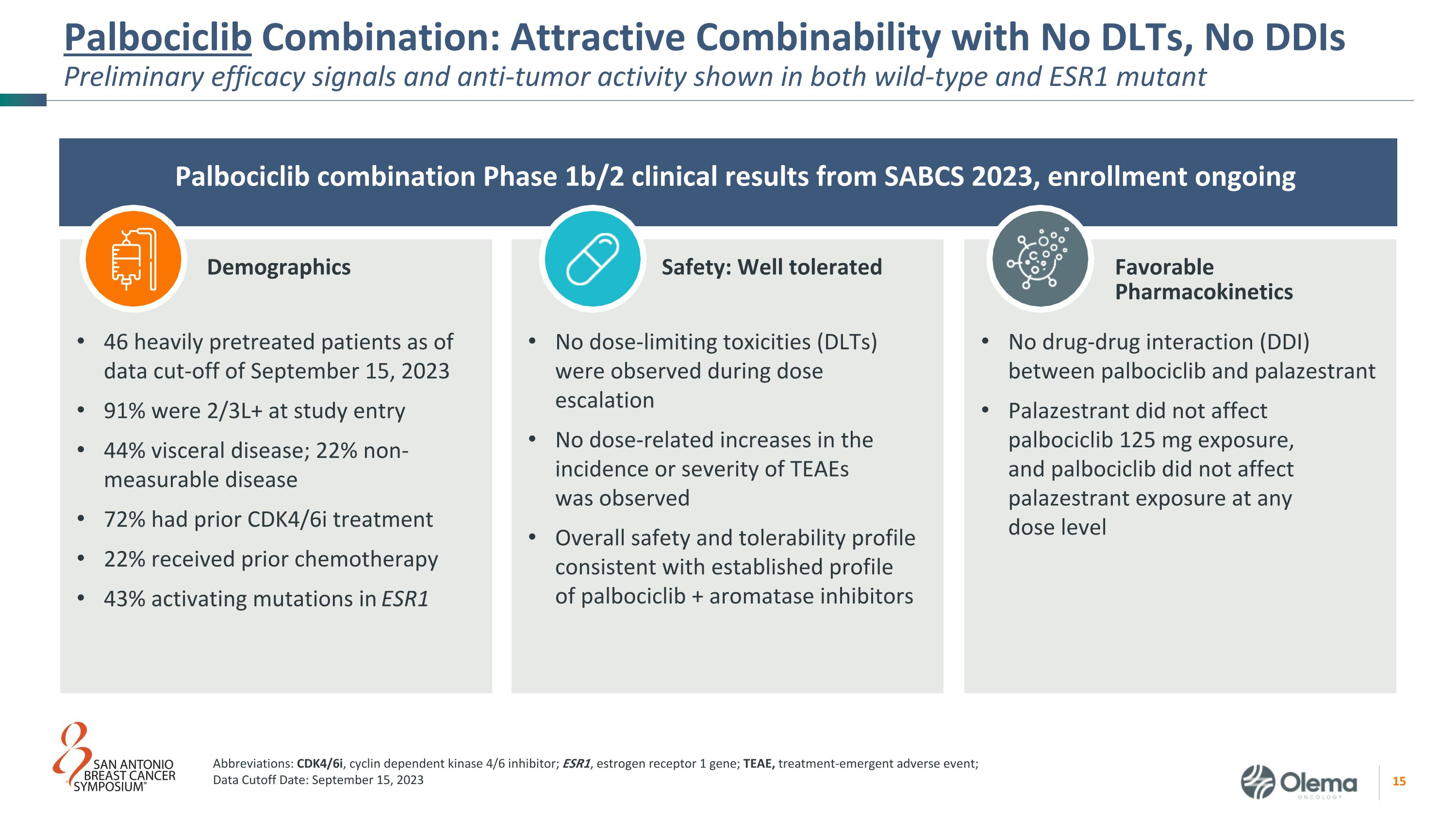
Palbociclib 组合:野生型和 ESR1 突变体 Palbociclib 组合中均显示出诱人的组合性,无 DDIS初步疗效信号和抗肿瘤活性 SABCS 2023 年 1b/2 期临床结果,正在进行中 palbociclib 和 palazestrant 之间没有药物相互作用 (DDI) Palbociclib 125 mg 的暴露量,palbociclib 没有影响任何剂量水平下的palazestrant暴露截至2023年9月15日数据截止日期,46名经过大量预治疗的患者在研究进入时为2/3L+,44% 为内脏疾病;22% 不可测量的疾病 72% 之前曾接受过 CDK4/6i 治疗 22% 之前接受过化疗 43% 的 ESR1 激活突变,剂量递增期间未观察到剂量限制毒性 (DLT) 未观察到与剂量相关的发病率或严重程度增加总体安全性和耐受性概况与 palbociclib + 芳香化酶抑制剂的既定概况一致缩写:CDK4/6i,细胞周期蛋白依赖型酶 4/6 抑制剂;ESR1,雌激素受体 1 基因;TEAE,治疗紧急不良事件;数据截止日期:2023 年 9 月 15 日人口统计学安全:耐受性良好良好的药代动力学
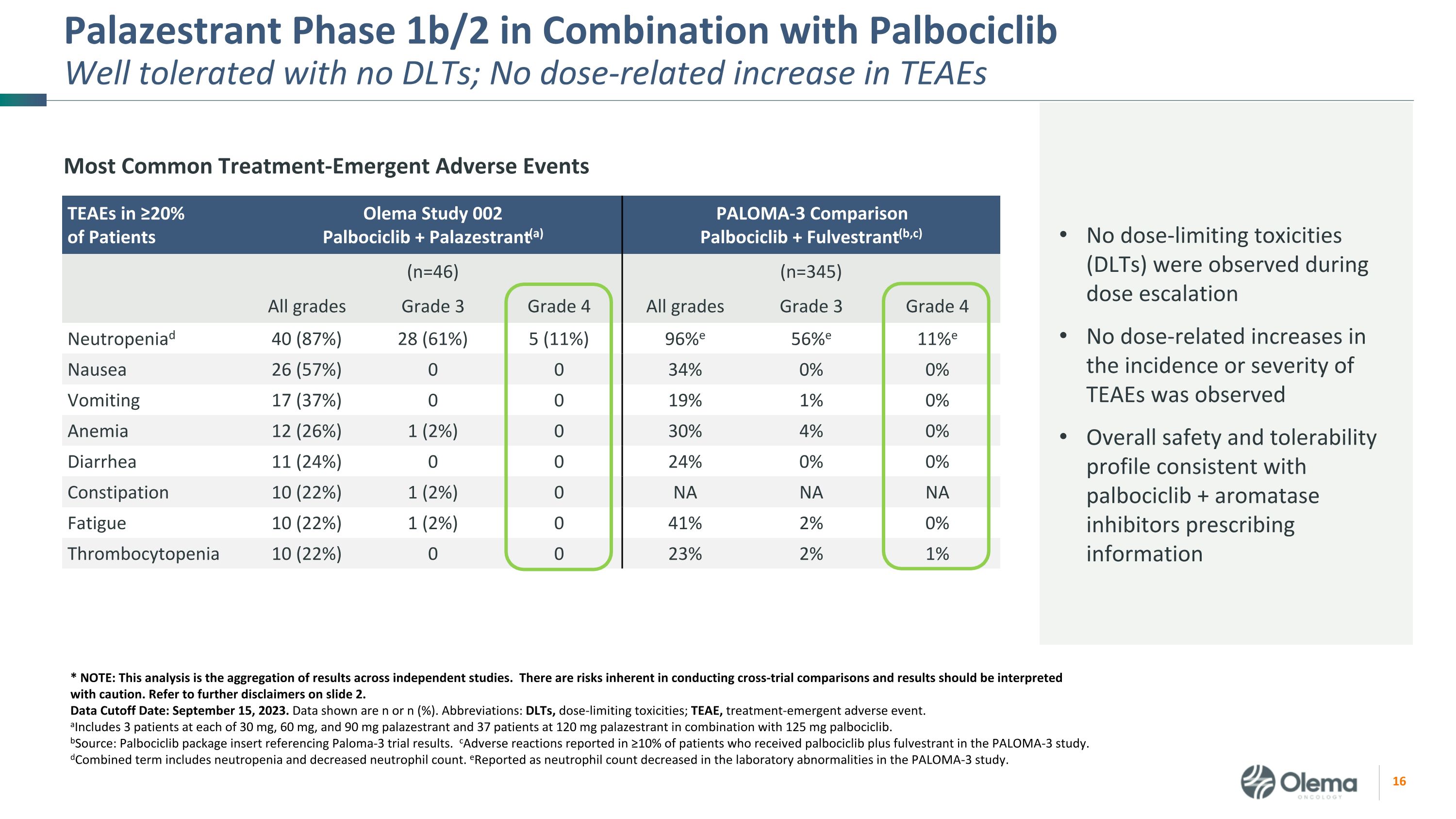
Palazestrant 1b/2 期与 Palbociclib 联合使用耐受性良好,无 DLT;TEAE 没有剂量相关增加 ≥ 20% 的患者中最常见的治疗紧急不良事件 TEAE Olema 研究 002Palbociclib + Palazestrant (a) PALOMA-3 对比 Palbociclib + Fulvestrant (b, c) (n=46) (n=345) 全部三年级四年级所有年级 3 年级 4 级中性粒细胞减少症 40 (87%) 28 (61%) 5 (11%) 96% e 56% e 11% e 恶心 26 (57%) 0 0 34% 0% 0% 呕吐 17 (37%) 0 0 19% 0% 贫血 12 (26%) 0 30% 腹泻 11 (24%) 0 24% 0% 便秘 10 (22%) 0 24% 0% 0% 便秘 10 (22%)%) 1 (2%) 0NA NA NA 疲劳 10 (22%) 1 (2%) 0 41% 2% 0% 血小板减少症 10 (22%) 0 23% 2% 1% * 注:该分析是独立研究结果的汇总。进行跨审比较存在固有的风险,应谨慎解释结果。请参阅幻灯片 2 中的更多免责声明。数据截止日期:2023 年 9 月 15 日。显示的数据为 n 或 n (%)。缩写:DLT,剂量限制毒性;TEAE,治疗紧急不良事件。a包括 30 mg、60 mg 和 90 mg palazestrant 各有 3 名患者,37 名服用 120 mg palazestrant 和 125 mg palbociclib 的患者。bSource:参考了 Paloma-3 试验结果的 Palbociclib 包装说明书。在 ≥ 10% 的接受治疗的患者中报告了不良反应 PALOMA-3 研究中的 palbociclib 加氟维司朗。d组合术语包括中性粒细胞减少和中性粒细胞计数减少。e报告为实验室异常中性粒细胞计数下降所致PALOMA-3 研究。剂量递增期间未观察到剂量限制毒性(DLT)未观察到TEAE的发生率或严重程度与剂量相关的增加。总体安全性和耐受性概况与palbociclib +芳香化酶抑制剂的处方信息一致
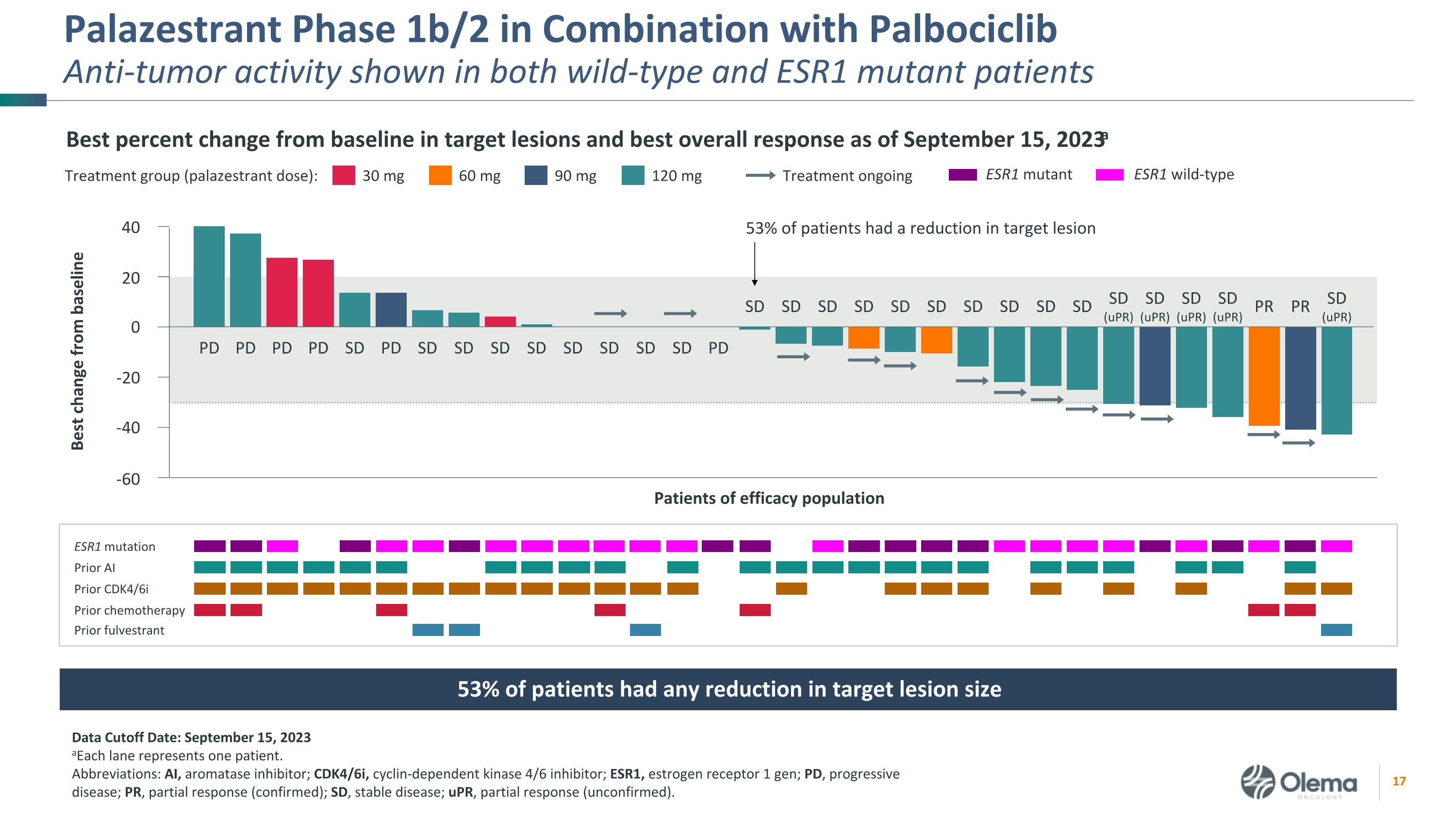
Palazestrant 1b/2 期联合使用 palboCiclibanti-Tumor 活性在野生型和 ESR1 突变患者中均显示出截至2023年9月15日的靶损与基线相比的最佳变化百分比和最佳总体反应a 数据截止日期:2023 年 9 月 15 日 a每个通道代表一名患者。缩写:AI,芳香化酶抑制剂;CDK4/6i,周期蛋白依赖性激酶 4/6 抑制剂;ESR1,雌激素受体 1 代;PD,进行性疾病;PR,部分反应(确认);SD,稳定疾病;uPR,部分反应(未经证实)。30 mg 治疗组(palazestrant 剂量):60 mg 90 mg 120 mg 正在进行的 ESR1 突变 Prior AI Prior k4/6i 之前的化疗先前有疗效的患者群体 PD PD PD PD SD SD SD SD SD SD SD SD SD SD SD SD SD SD SD SD SD SD SD SD SD SD SD SD SD SD SD SD SD SD SD SD (uPR) SD (uPR) SD (uPR) 53% 的患者有目标病变减小 40 20 0 -20 -40 -60 与基线 ESR1 突变体 ESR1 野生型相比的最佳变化 53% 的患者目标病变大小减小
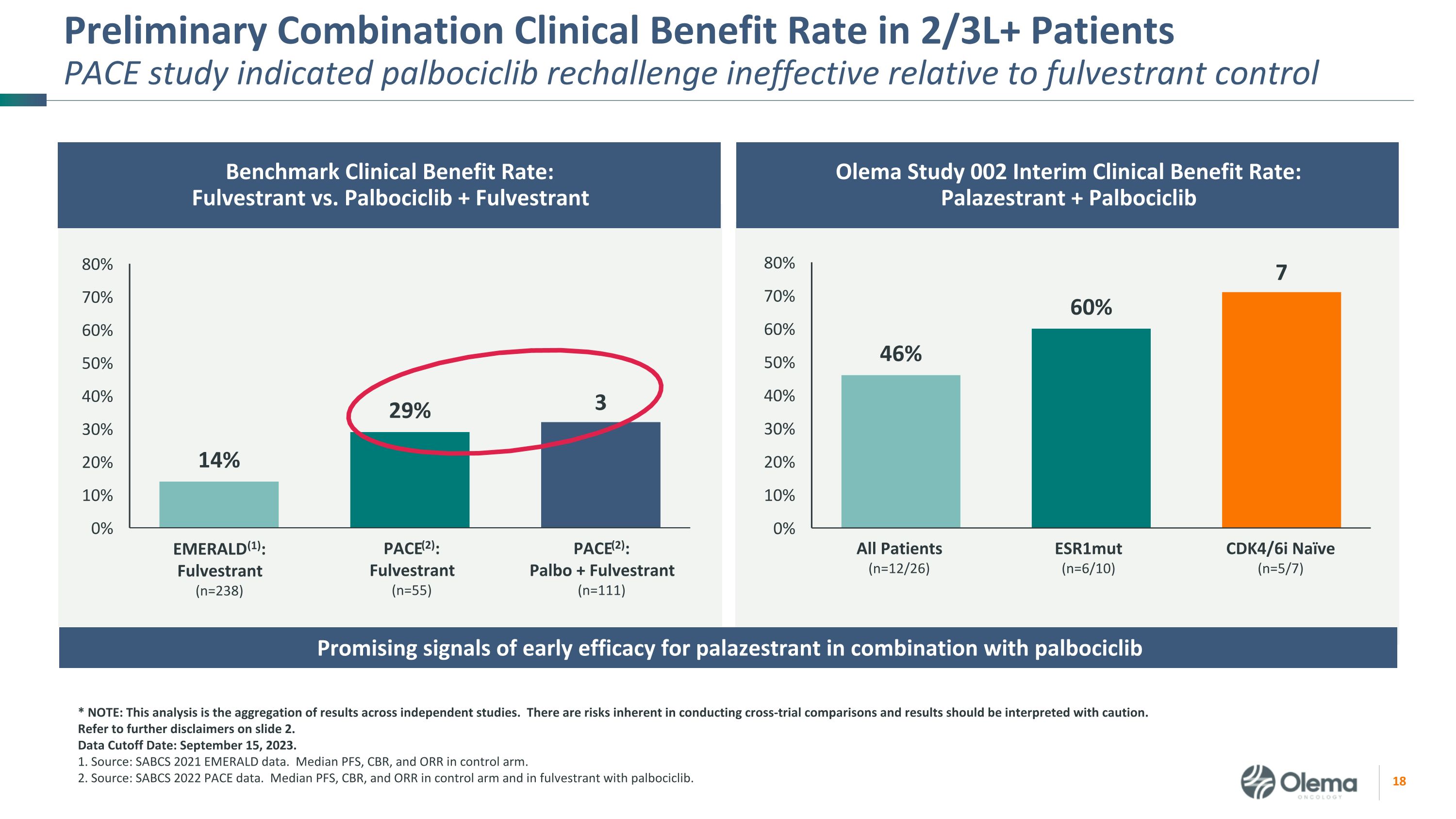
2/3L+ PatientSpace 研究的初步联合临床受益率表明 palbociclib 再挑战相对于氟维司群控制无效所有患者 (n=12/26) esr1mut (n=6/10) cdk4/6i Naive (n=5/7) 基准临床受益率:Fulvestrant 与 palbociclib + Fulvestrant Olema 研究 002 中期临床受益率:Palazestrant + Palbociclib * 注:该分析是独立研究结果的汇总。进行交叉试验比较存在固有的风险,应谨慎解释结果。请参阅幻灯片 2 中的更多免责声明。数据截止日期:2023 年 9 月 15 日。1.来源:SABCS 2021 年翡翠数据。控制臂中位数 PFS、CBR 和 ORR。2.来源:SABCS 2022 PACE 数据。对照组中PFS、CBR和ORR的中位数,以及使用palbociclib的fulvestrant。PACE (2):Fulvestrant (n=55) PACE (2):Palbo + Fulvestrant (n=111) EMERALD (1):Fulvestrant (n=238) palazestrant 与 palbociclib 联合使用可获得早期疗效的好信号
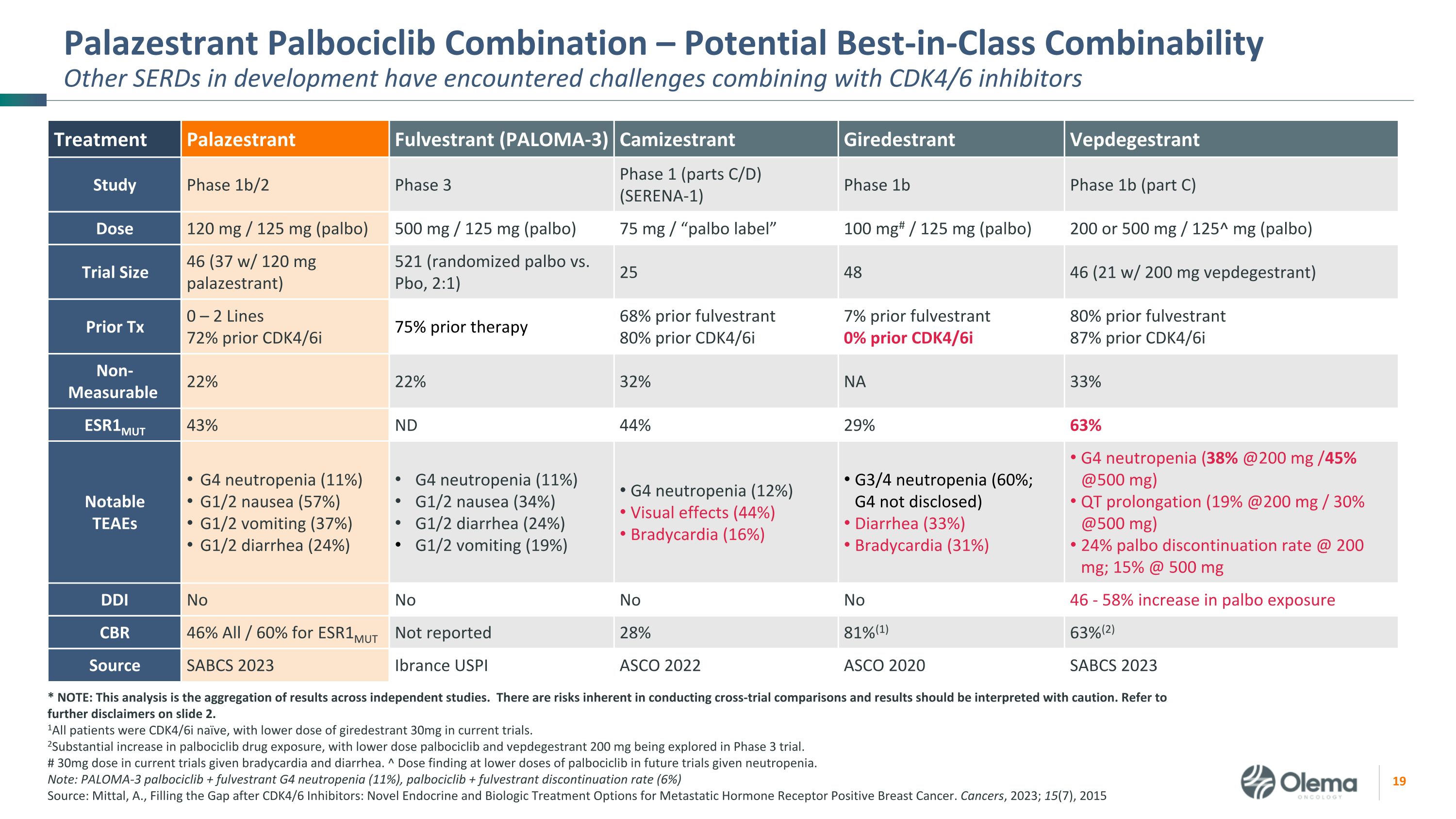
Palazestrant Palbociclib组合——潜在的同类最佳组合性其他正在开发的SERD在与CDK4/6抑制剂联合使用时遇到了挑战 * 注意:该分析汇总了独立研究的结果。进行跨审比较存在固有的风险,应谨慎解释结果。请参阅幻灯片2中的更多免责声明。1所有患者均为CDK4/6i天真,目前的试验中girestrant 30mg的剂量较低。2palbociclib药物暴露量大幅增加,3期试验中正在探索低剂量的palbociclib和vepdegestrant 200 mg。在当前试验中,考虑到心动过缓和腹泻,剂量为30mg。^ 在较低剂量的palbociclib下发现剂量在未来的试验中,ciclib将用于中性粒细胞减少症。注意:PALOMA-3 palbociclib + fulvestrant G4 中性粒细胞减少症(11%),palbociclib + fulvestrant停药率(6%)来源:A.米塔尔,填补CDK4/6抑制剂之后的空白:转移激素受体阳性乳腺癌的新型内分泌和生物治疗选择。癌症,2023;15(7),2015 年治疗 Palazestrant Fulvestrant(PALOMA-3)Camizestrant Giredestrant Vepdegestrant 研究 1b阶段 3阶段(C部分)1b 阶段(C 部分)剂量 120 mg/125 mg(palbo)500 mg/125 mg(palbo)75 mg/“palbo 标签” 100 mg#/125 mg(palbo)200 或 500 mg/125^ mg(palbo)试验规模 46(37 w/ 120 mg palazestrant)521(随机 palbo 与 Pbo,2:1)25 48 46(21 含 200 mg vepdegestrant)Prior Tx 0 — 2 系 72% 之前的 CDK4/6i 75% 之前的治疗 68% 之前的氟维司朗 80% 之前的治疗 6i 7% 之前的氟维司汀 0% 之前的 CDK SERENA-14/6i 80% 之前的氟维司坦 87% 之前的 CDK4/6i 不可测量 22% 22% 32% NA 33% ESR1MUT 43% ND 44% 29% 63% 值得注意的 TEAE G4 中性粒细胞减少症 (11%) G1/2 恶心 (57%) G1/2 呕吐 (37%) G1/2 腹泻 (24%) G4 中性粒细胞减少 (11%) G1/2 恶心 (34%) G1/2 腹泻 (24%) G1/2 腹泻 (24%) G1/2 腹泻 (24%) G1/2 恶心 (24%) G1/2 腹泻 (24%)) G1/2 呕吐 (19%) G4 中性粒细胞减少 (12%) 视觉效果 (44%) 心动过缓 (16%) G3/4 中性粒细胞减少 (60%;G4 未披露) 腹泻 (33%) 心动过缓 (31%) G4 中性粒细胞减少 (38% @200 mg /45% @500 mg) QT 延长 (19% @200 mg/30% @500 mg) 24% palbo 停药比率 @ 200 mg;15% @ 500 mg DDI 不不不不 46-palbo 曝光量增加 58% CBR 46% 全部/60% 未报告 28% 81% (1) 63% (2) 来源 SABCS 2023 Ibrance USPI ASCO 2022 ASCO 2020 SABCS 2023 ESR1MUT

Ribociclib 组合:可与 CDK4/6i-of-Preference 组合无显著的 DDI,没有 DLT,总体安全性与来自 SABCS 23 的 ribociclib 和 ET Ribociclib 1b 期组合数据的预期一致,正在进行的入组 Palazestrant 不影响患者的 ribociclib 药物暴露,利博西利布对帕拉西司朗药物暴露没有临床意义的影响 19 截至 2023 年 11 月 1 日数据截止日期,接受治疗的患者在研究录入时为 2/3L+ 37% 的内脏疾病 89% 之前接受过 CDK4/6i 治疗 26% 之前接受过化疗 29%,ESR1 中有激活突变的总体安全性和耐受性概况与 ribociclib + 内分泌疗法一致,剂量递增期间未观察到 DLT 且未达到 MTD 未观察到与剂量相关的发病率或严重程度增加 4 级 TEAE 未报告 qtCF 值在任何时间点均未观察到 >500 msec 缩写:CDK4/6i,周期蛋白依赖激酶 4/6 抑制剂或;ESR1,雌激素受体 1 基因;DLT,剂量限制毒性;MTD,最大耐受剂量;TEAE,治疗紧急不良事件数据截止日期:2023 年 11 月 1 日人口统计学安全:耐受性良好,没有 DLT 有利的药代动力学
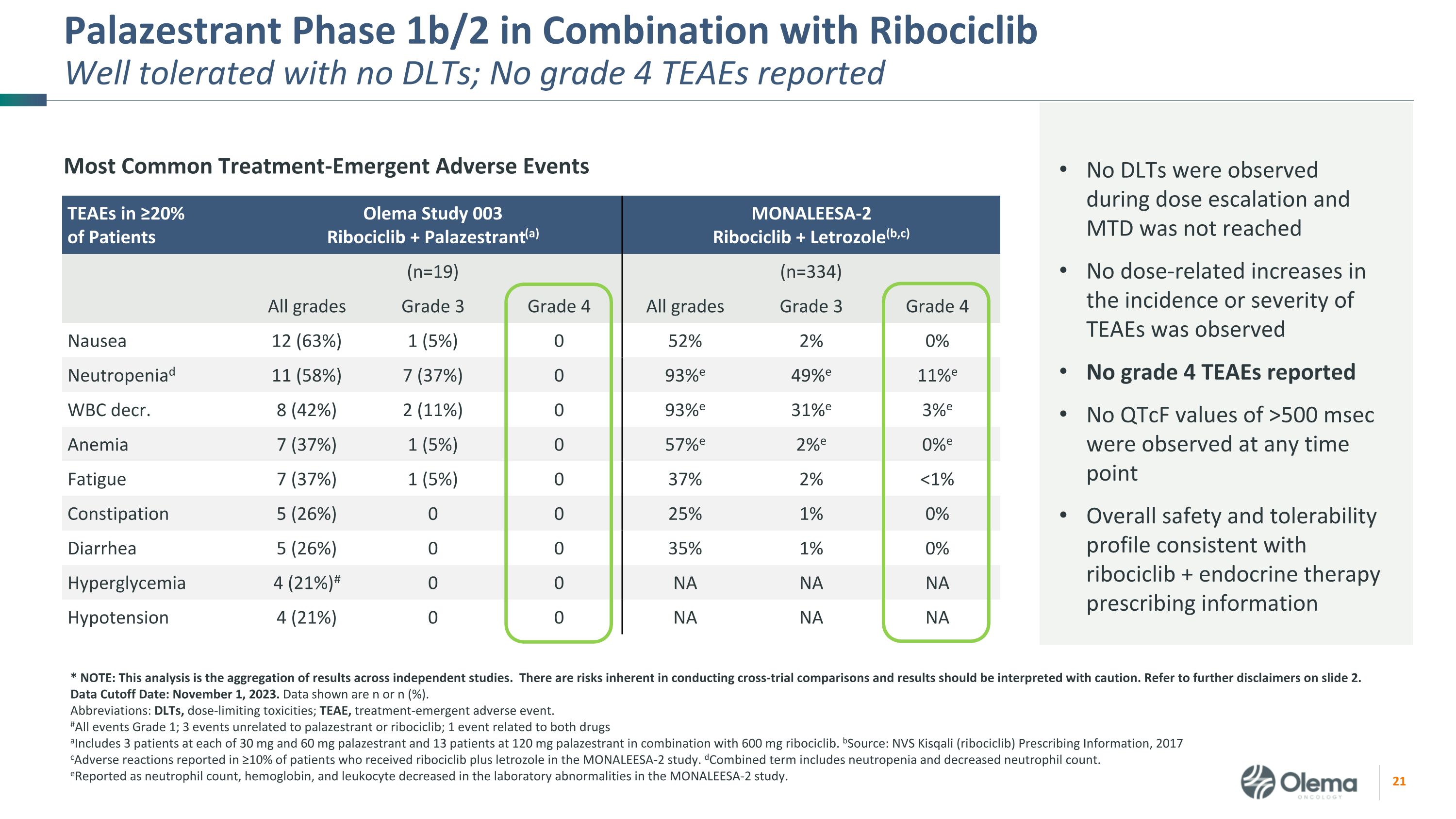
Palazestrant 1b/2 期与 Ribociclib 联合使用耐受性良好,无 DLT;无 4 级 TEAE 报告 ≥ 20% 患者中最常见的治疗紧急不良事件 TEAE Olema 研究 003Ribociclib + Palazestrant (a) monaleesa-2ribociclib + Letrozole (b, c) (n=19) (n=334) 所有等级三年级 4 级所有年级 3 级 4 级恶心 12 (63%) 1 (5%) 0 52% 2% 0% 中性粒细胞减少症 11 (58%) 7 (37%) 0 93% e 49% e 11% e 11% e WBC decr. 8 (42%) 2 (11%) 0 93% e 31% e 3% e 贫血 7 (37%) 1 (5%) 0 57% e 2% e 0% e 0% e 2% e 0% e 疲劳 7 (5%) 0 57% e 2% e 0% e 0% e 0% e 0% e 疲劳 7 (5%) 37%) 1 (5%) 0 37% 2% 500 毫秒在任何时间点观测到总体安全性和耐受性概况与 ribociclib + 内分泌疗法处方信息一致
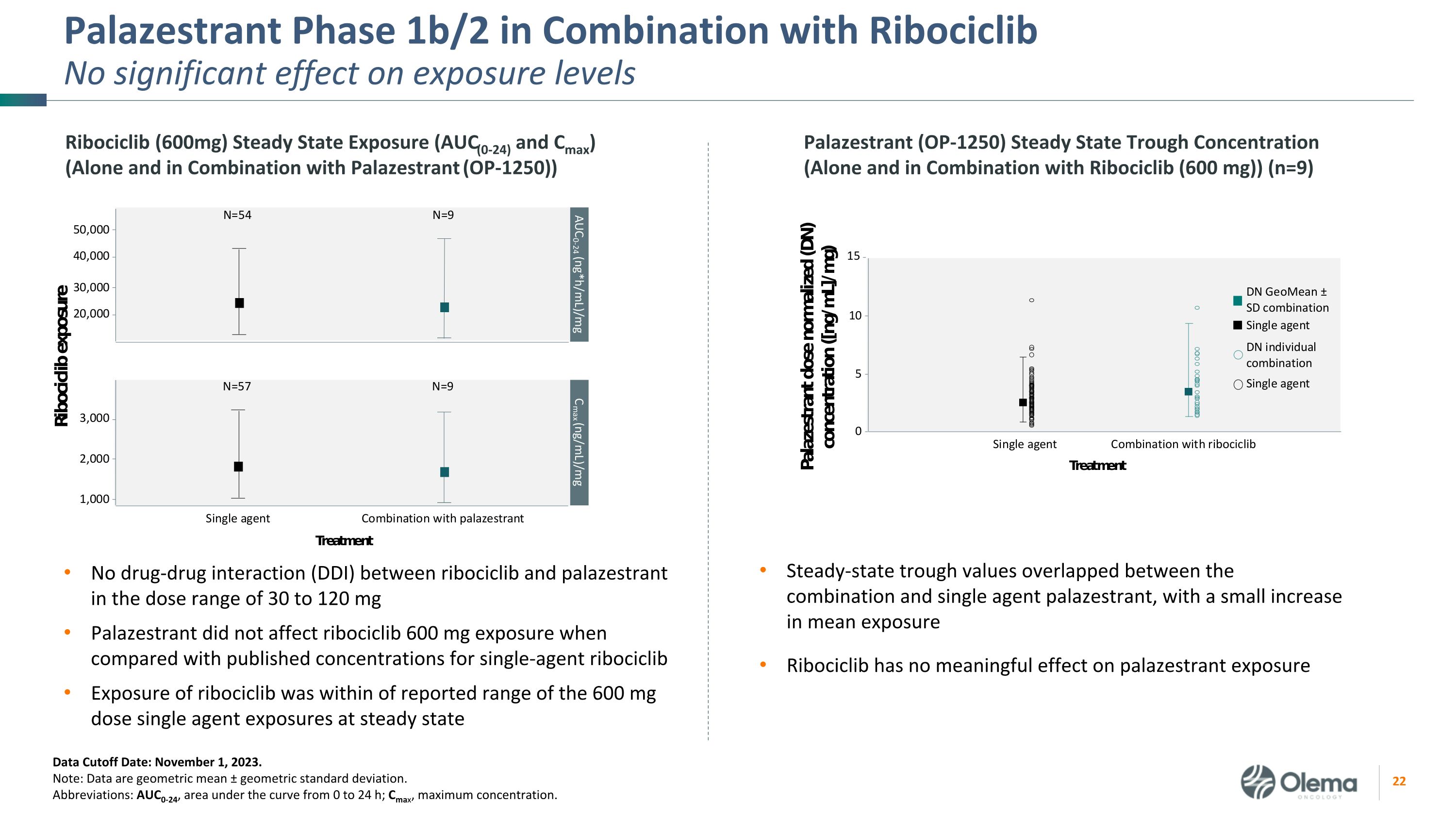
Palazestrant 1b/2 期与 Ribociclib 联合使用对暴露水平没有显著影响在 30 至 120 mg 剂量范围内 ribociclib 和 palazestrant 之间没有药物相互作用 (DDI) Palazestrant 与公布的单剂瑞博西利布浓度相比,瑞博西利布的暴露量在报告的 600 mg 剂量范围内稳定状态下的曝光量数据截止日期:2023 年 11 月 1 日。注意:数据是几何平均值 ± 几何标准差。缩写:AUC0-24,曲线下方面积从 0 到 24 h;Cmax,最大浓度。稳态低谷值在组合和单剂帕拉西斯特兰特之间重叠,平均暴露量略有增加 Ribociclib 对缓解剂暴露没有实质性影响 Ribociclib(600mg)稳态暴露(AUC(0-24)和 Cmax)(单独使用和与 Palazestrant 联合使用(OP-1250))Palazestrant(OP-1250)稳态槽浓度(单独和组合)使用 Ribociclib (600 mg) (n=9)
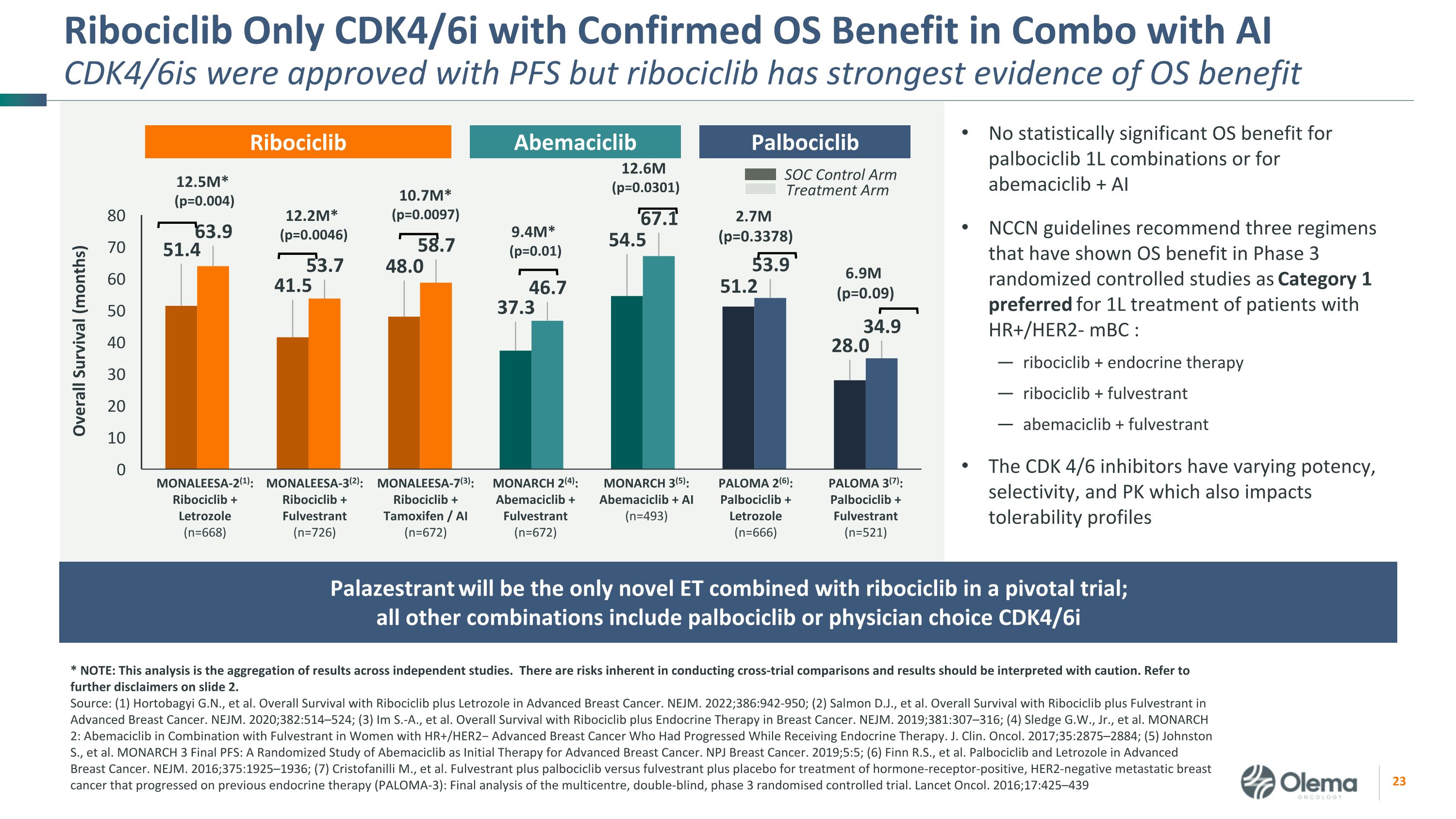
Ribociclib 只有经证实的操作系统益处的CDK4/6i与AICDK4/6I的组合才获准与PFS一起使用,但ribociclib有最强的操作系统益处证据 * 注意:本分析是独立研究结果的汇总。进行跨审比较存在固有的风险,应谨慎解释结果。请参阅幻灯片 2 中的更多免责声明。资料来源:(1) Hortobagyi G.N. 等人使用Ribociclib加来曲唑治疗晚期乳腺癌的总体存活率。NEJM. 2022;386:942-950;(2) Salmon D.J.,等在晚期乳腺癌中使用 Ribociclib 和 Fulvestrant 的总体存活率。NEJM. 2020;382:514 —524;(3) 我是 S.A.,等使用Ribociclib加内分泌疗法治疗乳腺癌的总体存活率。NEJM. 2019;381:307 —316;(4) Sledge G.W.,Jr. 等MONARCH 2:对于在接受内分泌治疗期间出现进展的HR+/HER2− 晚期乳腺癌女性,将阿贝马西利布与氟维司兰联合使用。J. Clin。Oncol. 2017;35:2875 —2884;(5) Johnston S.,等人MONARCH 3 Final PFS:一项关于阿贝马西利布作为晚期乳腺癌初始疗法的随机研究。NPJ 乳腺癌。2019;5:5;(6) Finn R.S. 等晚期乳腺癌中的帕博西利布和来曲唑。NEJM. 2016;375:1925 —1936;(7) Cristofanilli M.,等Fulvestrant加palbociclib对比氟维司朗加安慰剂治疗激素受体阳性、HER2阴性的转移性乳腺癌,这些乳腺癌在先前的内分泌疗法(PALOMA-3)上取得了进展:多中心、双盲、3期随机对照试验的最终分析。Lancet Oncol. 2016;17:425 —439 palbociclib 1L 组合或 abemaciclib + AI NCCN 指南推荐了三种在第 3 期随机对照研究中显示操作系统益处为 HR+/HER2-mBC 患者 1L 治疗的首选方案:ribociclib + 内分泌疗法 ribociclib + fulvestrant abemcc aciclib + fulvestrant CDK 4/6 抑制剂具有不同的效力、选择性和 PK,这也会影响耐受性概况 Ribociclib MONARCH 2 (4):Abemaciclib + Fulvestrant (n=672) MONARCH 3 (5):Abemaciclib + AI (n=493) MONALEESA-2 (1):Ribociclib + Letrozole (n=668) MONALEESA-3 (2):Ribociclib + Fulvestrant (n=726) PALOMA 2 (6):Palbociclib + Letrozole (n=666) PALOMA 3 (7):Palbociclib + Fulvestrant (n=526) PALOMA 2 (6):Palbociclib + Letrozole (n=666) PALOMA 3 (7):Palbociclib + Fulvestrant (n=56) 21) MONALEESA-7 (3):Ribociclib + 他莫昔芬/AI (n=672) 9.4M* (p=0.01) SOC 控制臂治疗臂 12.5M* (p=0.004) 12.2M* (p=0.0046) 10.7M* (p=0.0046) 10.7M* (p=0.0097) 12.6M (p=0.09) 2.7M (p=0.09) 6.9M (p=0.09)) Abemaciclib Palbociclib Palazestrant 将是关键试验中唯一一款与 ribociclib 联合使用的新型 ET;所有其他组合包括 palbociclib 或医生选择 cdk4/6i

关键三期试验取得进展
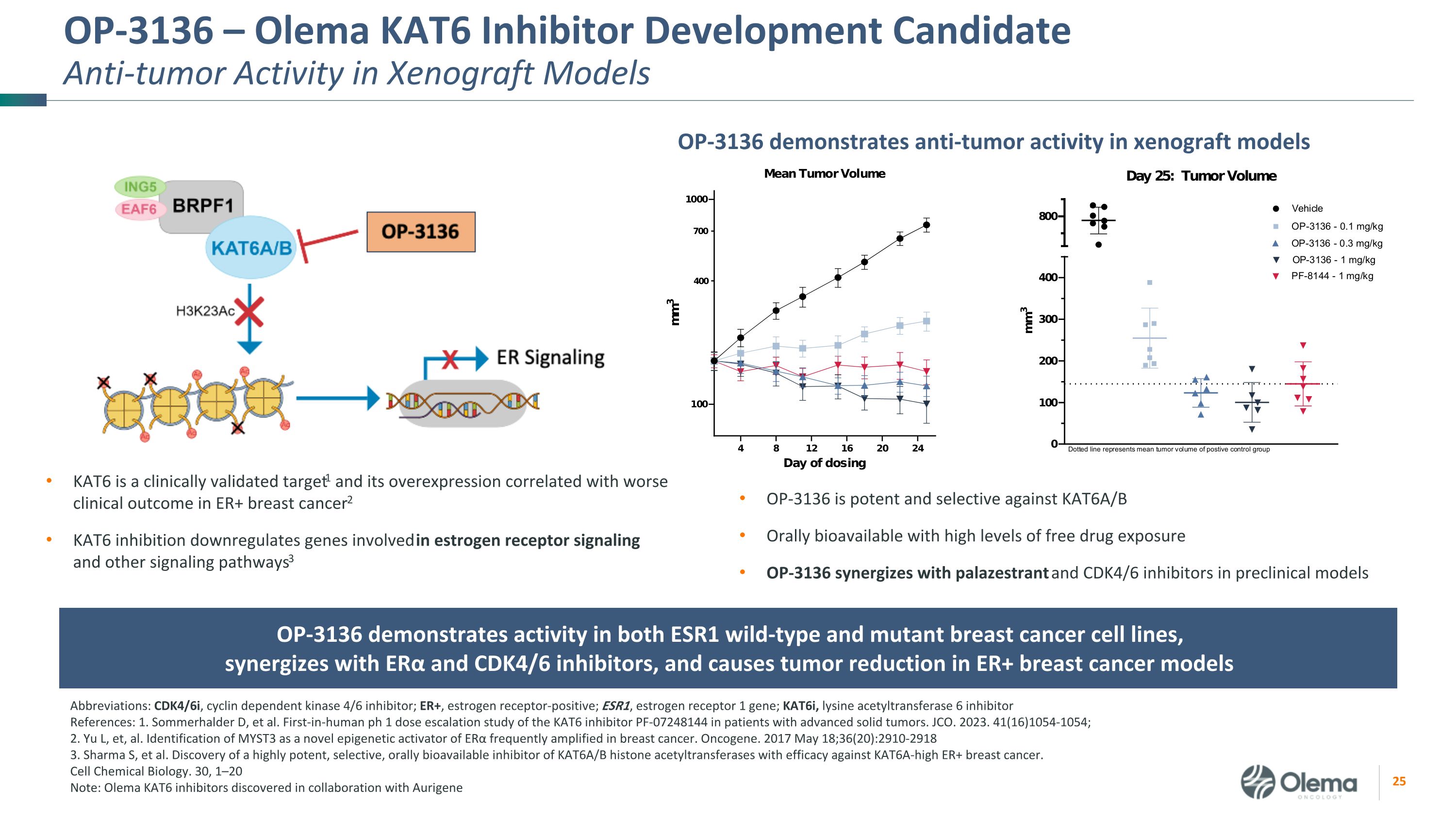
OP-3136 — Olema KAT6 抑制剂开发候选药物异种移植模型中的抗肿瘤活性 OP-3136 在异种移植模型中表现出抗肿瘤活性 KAT6 是经过临床验证的靶标1,其过度表达与 ER+ 乳腺癌的较差临床预后相关2 KAT6 抑制下调参与雌激素受体信号传导和其他信号通路的基因3 缩写:CDK4/6i,细胞周期蛋白依赖激酶 4/6 抑制剂;ER+,雌激素受体阳性;ESR1,雌激素受体 1 基因;kat6i,赖氨酸乙酰转移酶 6 抑制剂参考文献:1.Sommerhalder D 等人。首次对晚期实体瘤患者进行 KAT6 抑制剂 PF-07248144 的人类 ph 1 剂量递增研究。JCO. 2023. 41 (16) 1054-1054;2.Yu L等。将 MYST3 鉴定为乳腺癌中经常扩增的 ERα 的新型表观遗传学激活剂。癌基因。2017 年 5 月 18 日;36 (20): 2910-2918 3.Sharma S 等人。发现了一种高效、选择性、口服生物可利用的KAT6A/B组蛋白乙酰转移酶抑制剂,可有效对抗KAT6A高ER+乳腺癌。细胞化学生物学。30、1—20 注:与 Aurigene OP-3136 合作发现的 Olema KAT6 抑制剂对 KAT6A/B 具有有效和选择性,具有高游离药物暴露量的口服生物利用度 OP-3136 与 palazestrant 和 CDK4/6 抑制剂协同作用 OP-3136 在 ESR1 野生型和突变乳腺癌细胞系中均表现出活性,与 ERα 和 CDK4/6 抑制剂协同作用,并导致 ER+ 乳腺癌模型中的肿瘤减少
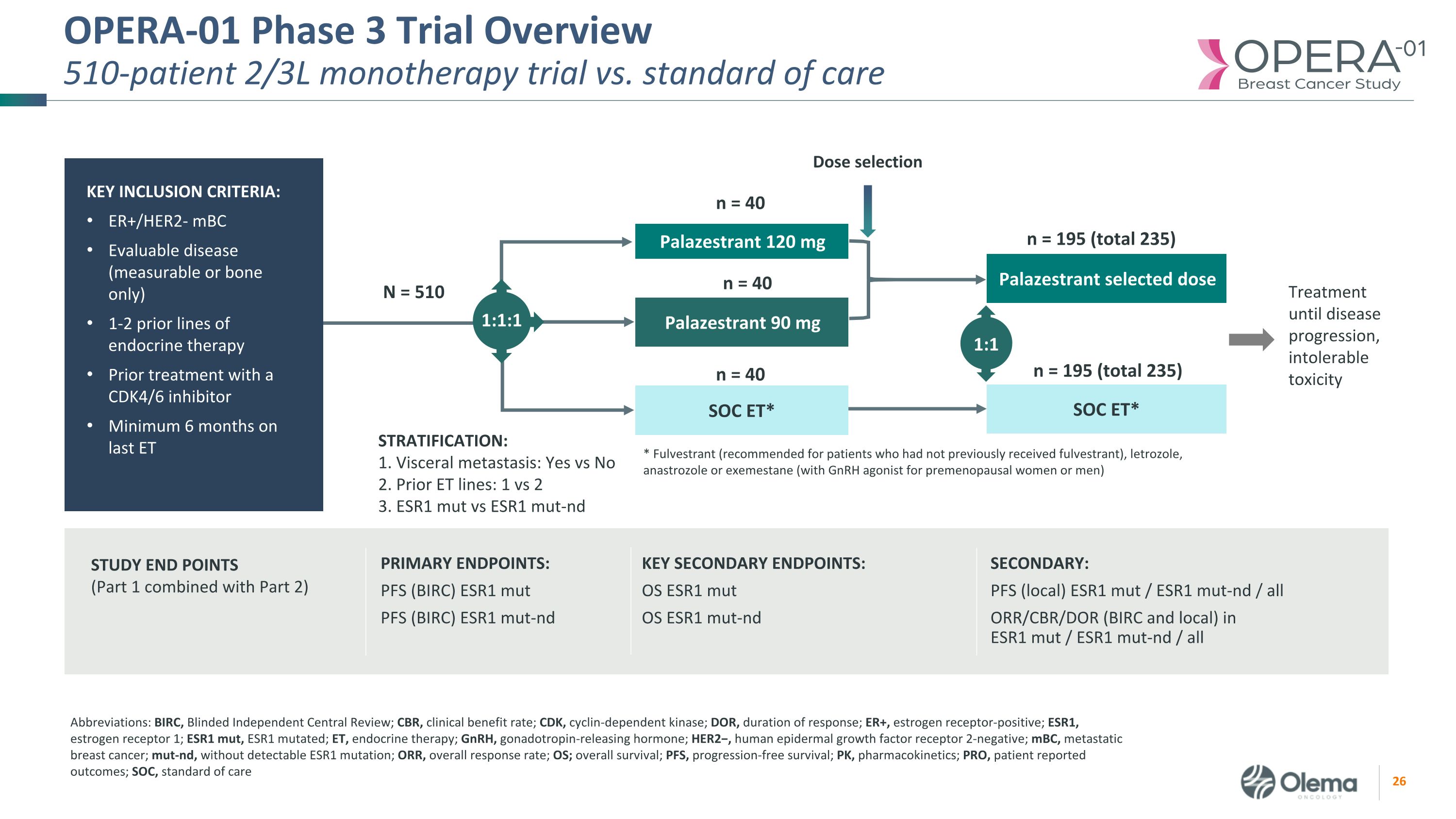
OPERA-01 三期试验概述510位患者 2/3L 单一疗法试验与标准护理的主要终点:PFS(BIRC)ESR1 mut PFS(BIRC)ESR1 mut-nd ESR1 mut-nd:PFS(本地)ESR1 mut/ESR1 mut-nd/ESR1 mut-nd/ESR1 mut-nd /所有 ORR/CBR/DOR(BIRC 和本地)/所有研究终点(第 1 部分与第 2 部分合并)关键次要终点:OS ESR1 mut OS ESR1 mut OS ESR1 mut-nd Palazestrant 120 mg SOC ET* * Fulvestrant(推荐给以前未接受氟维司群的患者)、来曲唑、阿那曲唑或依西美坦(与GnRH激动剂一起用于绝经前女性或男性)分层:1。内脏转移:是 vs 否 2。之前的 ET 线路:1 对 2 3。ESR1 mut vs ESR1 mut-nd Palazestrant 90 mg N = 510 Palazestrant 选定剂量选择 1:1 1:1 n = 40 治疗直到疾病进展,不可耐受的毒性 SOC ET* n = 40 n = 195(总计 235)n = 195(总计 235)缩写:BIRC,盲目独立中心评论;CBR,临床获益率;CDK,周期蛋白依赖激动蛋白酶;DOR,反应持续时间;ER+,雌激素受体阳性;ESR1,雌激素受体 1;ESR1 mut,ESR1 突变;ET,内分泌治疗;GnRH,促性腺激素释放激素;HER2−,人类表皮生长因子受体 2-阴性;mBC,转移性乳腺癌;mut-nd,无可检测到的 ESR1 突变;ORR,总缓解率;OS;总存活率;PFS,无进展存活率;PK,药代动力学;PRO,患者报告的结局;SOC,护理标准关键纳入标准:ER+/HER2-mBC 可评估疾病(仅可测量或仅限骨骼)先前使用 CDK4/6 的内分泌疗法 1-2 系先前使用 CDK4/6 进行治疗抑制剂最后一次 ET 至少服用 6 个月

Olema:女性肿瘤学领域一个引人注目的后期机遇截至2023年9月30日,Palazestrant拥有约2.769亿美元的现金和现金等价物。截至2023年9月30日,Palazestrant与CDK4/6抑制剂的全剂量组合使其成为一线适应症Palazestrant在新一类内分泌疗法中存在高度差异1的现金状况。管理层认为,公司的现金、现金等价物、有价证券以及与硅谷银行签订的贷款和担保协议下的可用金额将足以为公司当前的2027年运营计划提供资金。令人信服的 2 期单一疗法数据使 OPERA-01 3 期试验取得成功,管理层和董事会拥有丰富的经验和成功历史
