附录 99.2

靶向淋巴结以增强免疫疗法 2024 年 1 月

免责声明前瞻性陈述本演示文稿包含前瞻性
陈述,该术语的定义见经修订的 1933 年《证券法》第 27A 条、经修订的 1934 年《证券交易法》第 21E 条和 1995 年《私人证券诉讼改革法》(即 PSLRA)。
本演示文稿中不纯属历史陈述均为前瞻性陈述。除其他外,此类前瞻性陈述包括有关我们计划中的临床项目的陈述,包括计划中的临床试验
和候选产品的潜力、候选产品的未满足需求和潜在潜在市场、候选产品的潜在临床效用、潜在益处和市场接受度、候选产品相对于现有疗法和/或竞争对手的潜在优势、临床数据的预期收到情况、我们的启动时间计划的临床试验,以及
我们总体开发计划的推进和资助。由于多种因素,实际结果可能与任何前瞻性陈述中的预测有所不同。除其他外,这些因素包括:我们是否有能力筹集
继续推行业务和产品开发计划所需的额外资金;我们对所得款项的预期用途;与开发新产品或技术以及作为开发阶段公司运营(包括
与其他方的合作)相关的固有不确定性;我们开发、完成临床试验、获得批准和商业化任何候选产品的能力,包括我们招募和注册的能力我们研究中的患者;我们的
处理美国食品药品监督管理局或其他监管机构的请求的能力;我们对知识产权的依赖;我们经营所在行业的竞争;由于 COVID-19 或地缘政治
问题(包括乌克兰和中东冲突)导致的延误或中断;以及市场状况。这些前瞻性陈述是截至本演示之日作出的,除非法律要求,否则我们没有义务更新前瞻性陈述,也没有义务更新实际业绩可能与前瞻性陈述中预测的结果不同的原因。您应查阅此处列出的所有信息,还应参考我们在www.sec.gov上向美国证券交易委员会(SEC)提交的报告和其他文件中列出的风险因素
披露,包括但不限于公司于2023年6月2日提交的8-K表最新报告、
公司截至2023年6月30日和2023年9月30日的季度10-Q表季度报告,以及该公司不时向美国证券交易委员会提交的其他文件。2

公司亮点临床阶段生物技术开创性的新型淋巴结靶向癌症
免疫疗法 3 全新的免疫疗法 Amphile 或 “AMP” 平台将有效载荷传输到淋巴结以产生强大的免疫反应 ELI-002:一种独特的淋巴结靶向疫苗专为靶向 7 种 KRAS 突变而设计
,其中 ELI-002 可以治疗 88% 的发病肿瘤 1a 期临床数据 84% 的患者表现出 T 细胞反应,T 细胞数量平均增加 58 倍 84% 的患者
显示肿瘤生物标志物下降,24% 已完全清除 24% 获得大 T 细胞反应的患者进展或死亡风险降低了 86% 预计近期催化剂正在进行中:两项 1 期试验,2024-2025 年前可获得更多
数据 2024 年第一季度启动 2 期 PDAC 单一疗法 2024 年第一季度开始

Pipeline创新型癌症免疫疗法管线解决严重未满足的
需求 4 CRC:结直肠癌 | PDAC:胰腺胰腺导管腺癌 mKRA:突变体克尔斯滕大鼠肉瘤 | mbraf:快速加速纤维肉瘤的突变同系物 B | mtp53:突变肿瘤蛋白
p53 候选靶标适应症临床前 1 期 2 期 3 ELI-002 mkras PDAC、CRC ELI-007 mbraf 胃肠肿瘤 ELI-008 mtp53 胃肠道肿瘤 PDAC PDAC PDAC 计划进行中

Elicio:增强免疫疗法

AMP 平台利用淋巴结尚未开发的潜力进行
免疫疗法 6 大多数免疫细胞都位于淋巴结中,但这些关键位点不被传统的免疫疗法所吸收 AMP 通过 “白蛋白搭便车” 促进有效载荷定向输送到淋巴结 AMP 利用
独特的淋巴结生物学来增强免疫反应的强度、血液效力和耐久性小分子大分子(例如白蛋白)血管淋巴管淋巴结血液循环组织
注射部位靶向淋巴结免疫

ELI-002 组合淋巴结靶向治疗疫苗由 AMP 肽和
AMP-CPG 7 G12X G13X D R V C S A D ELI-002 淋巴结靶向 cpG DNA 的白蛋白结合脂质组成:TLR-9 激动剂 X X 用于淋巴结靶向的白蛋白结合脂质 mkRA 肽 PEG Linker • 2 或 7 个 AMP-PETIDES • CD8 和
CD4 表位 • 强效 TLR-9 免疫激活剂 AMP-MKRAS 肽抗原 AMP-CPG 辅助剂 NH NH O O O
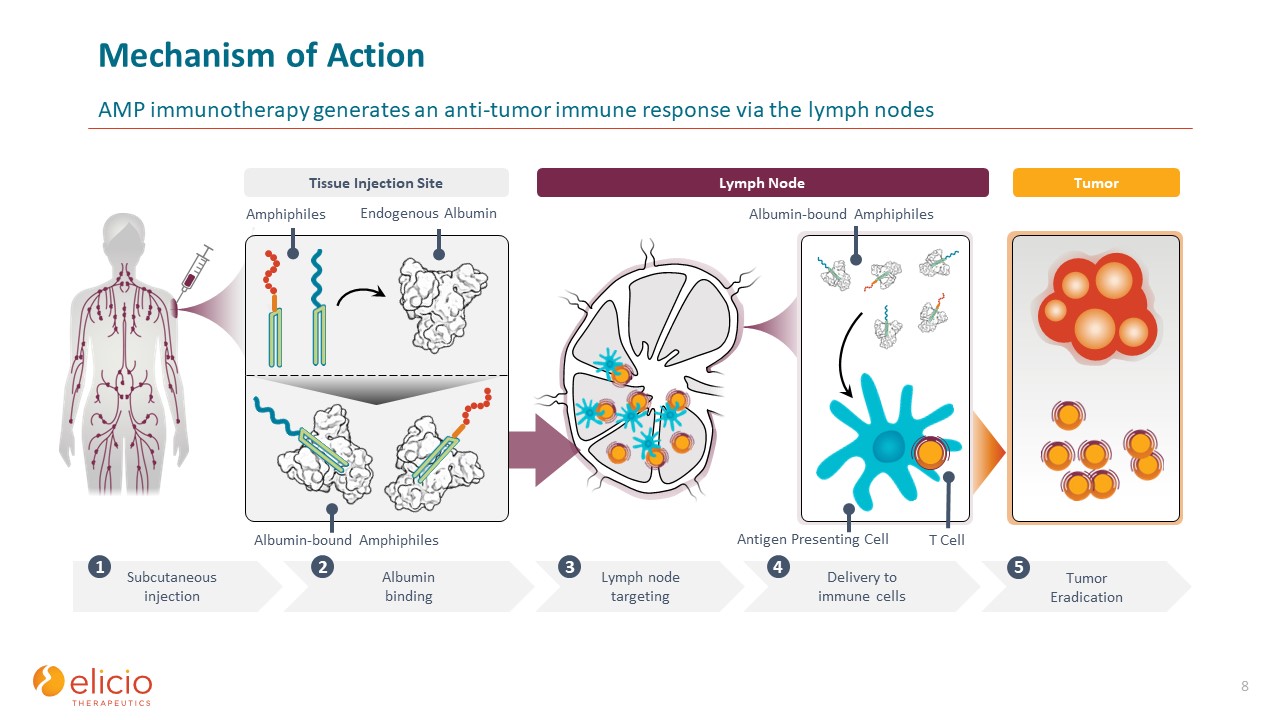
ActionAmp 免疫疗法的机制通过
淋巴结产生抗肿瘤免疫反应 8 肿瘤根除 5 皮下注射 1 淋巴结淋巴结靶向 3 抗原呈递细胞向免疫细胞递送 4 白蛋白结合的两亲细胞内源性
白蛋白两亲组织注射部位白蛋白结合 2 肿瘤 T 细胞
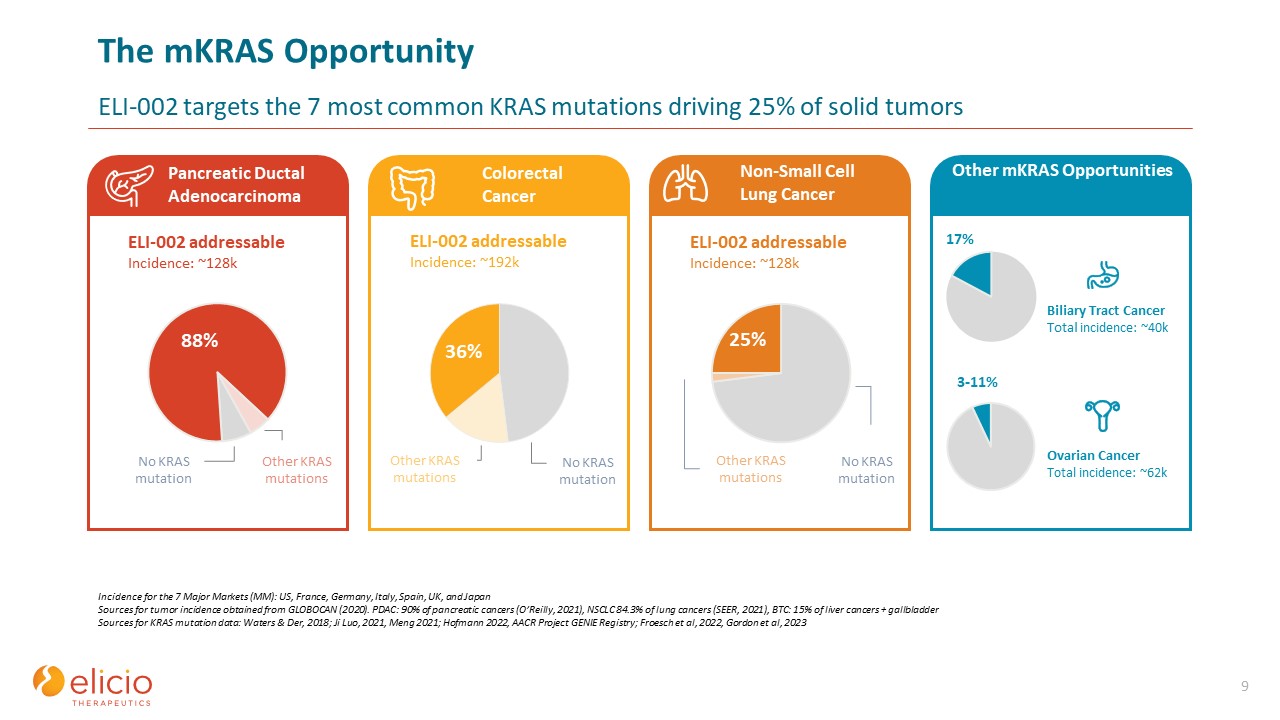
MKRAS OpportunityeLi-002靶向7个主要市场(MM)驱动25%的
实体瘤9发病率的7种最常见的KRAS突变:美国、法国、德国、意大利、西班牙、英国和日本肿瘤发病率来源于GLOBOCAN(2020年)。PDAC:90% 的胰腺癌(O'Reilly,2021 年),非小细胞肺癌 84.3% 的肺癌(SEER,2021 年),BTC:15% 的肝癌 + GallbladderKRAS 突变数据来源:Waters & Der,2018 年;Ji Luo,2021,Meng 2021;Hofmann,AACR 项目精灵登记处;Froesch 等人,2022年,Gordon 等人,2023 年 ELI-002 可寻址发病率:~128k 其他 KRAS 突变 88% 胰腺导管腺癌 ~ 88% 结直肠癌 ~ 88% 非小细胞肺癌其他 MKRA 机会 36% 其他 KRAS 突变 25% 17% 3-11% 没有 KRAS
突变 ELI-002 可寻址发病率:~192k 否KRAS 突变 ELI-002 可寻址发病率:~128k 没有 KRAS 突变 ~ 88% 胆道癌总发病率:约 40k 卵巢癌总发病率:约 62k 其他 KRAS 突变
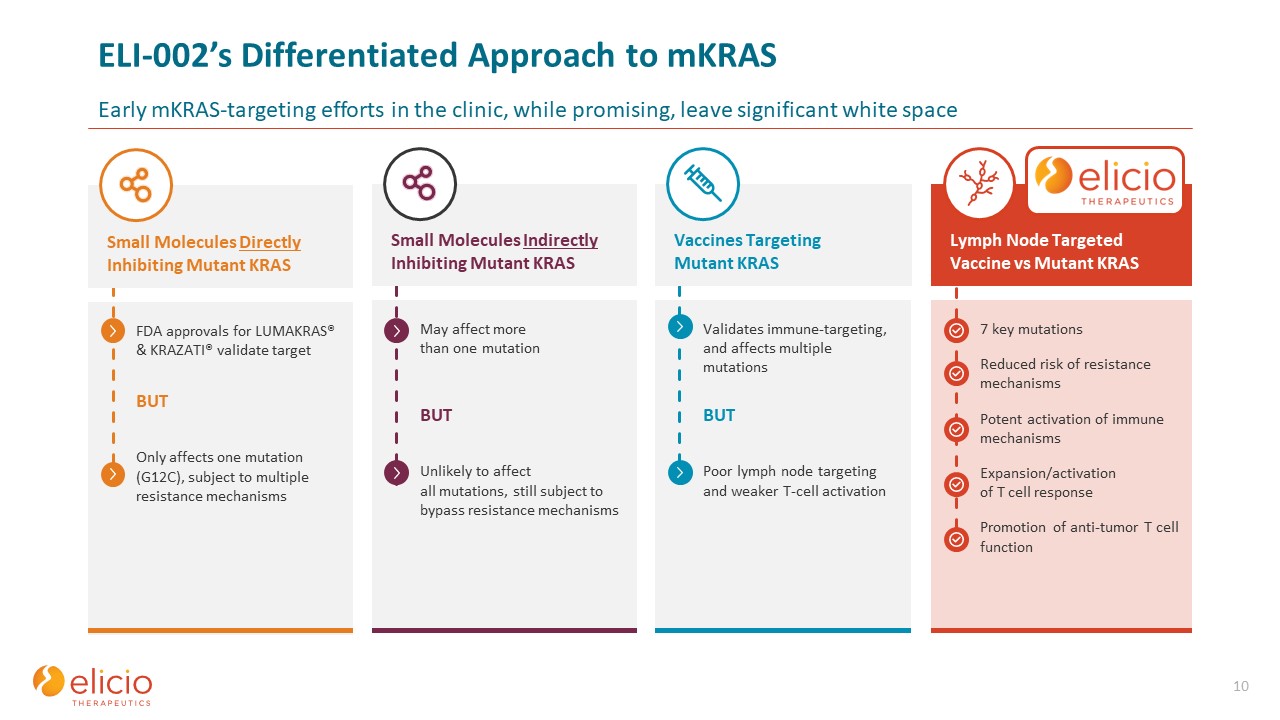
ELI-002 的差异化方法临床上的 mkrasearly 靶向 mkras 的努力虽然很有希望,但仍留下了显著的空白 10 7 个关键突变降低了抵抗机制的风险强效激活免疫机制扩展/激活 T 细胞反应促进抗肿瘤 T 细胞功能可验证
免疫靶向并影响多种突变,但淋巴结靶向不佳和 T 细胞激活较弱可能会影响多个突变,但不太可能影响所有突变,仍需通过绕过耐药机制 FDA
的批准对于 LUMAKRAS® 和 KRAZATI® 验证靶标但仅影响一种突变 (G12C),受多种耐药机制影响,淋巴结靶向疫苗与突变体 KRAS 疫苗间接靶向突变 KRAS 小分子
抑制突变体 KRAS 小分子直接抑制突变体 KRAS

ELI-002:临床开发计划

ELI-002 At-a-glanceMKRAS 免疫疗法利用
AMP 平台的淋巴结靶向设计激发强大的 T 细胞活性 12 2 肽 (2P) 和 7 肽 (7P) 制剂 2P 用于临床概念验证,而 7P CMC 最终定稿项目现已切换到完整的 7P 配方,以
最大限度地提高疗效和机会 AMPLIFY 临床项目进行中 1 期 AMPLIFY-201 完全入组肿瘤阳性和与临床结果相关的作用机制(T 细胞)生物标志物反应报告了 1/2 期 AMPLIFY-7P 入组 AMPLIFY-201正在进行中,PDAC的随机第二阶段预计将于2024年启动,与同类疫苗相比,具有明显的临床和操作优势,包括靶向驱动突变和 “现成的” 疫苗
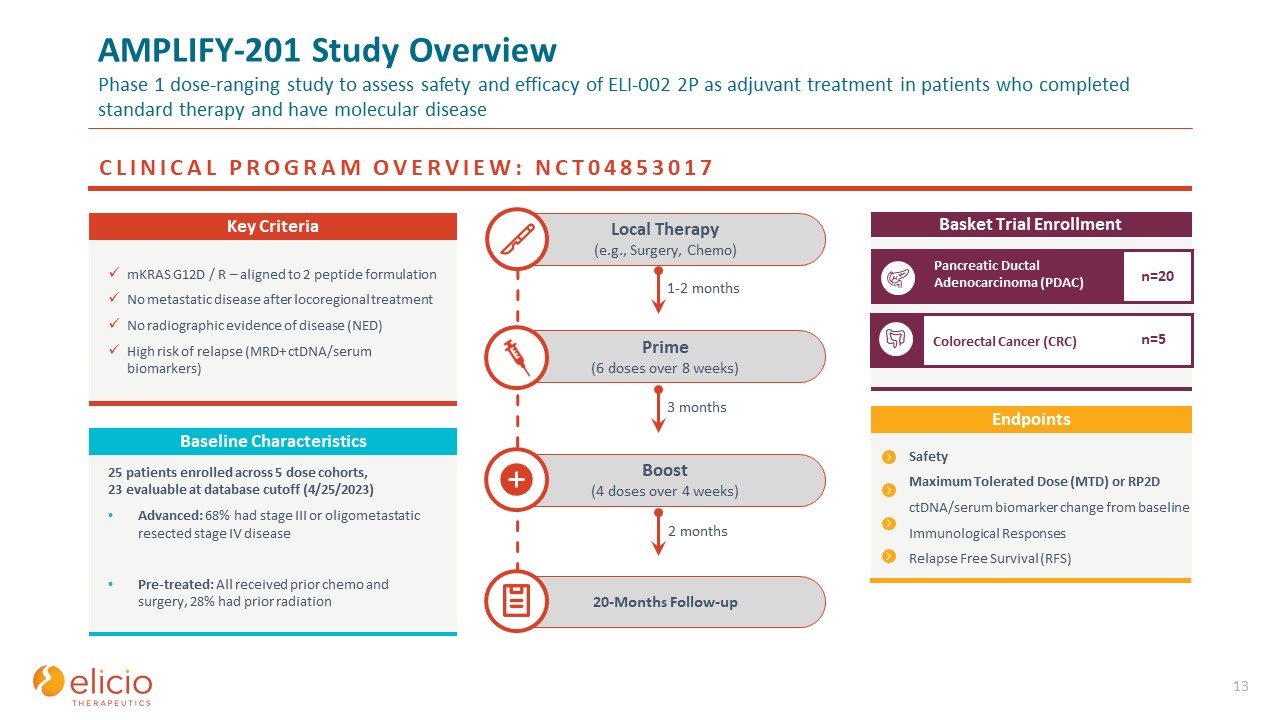
AMPLIFY-201 研究概述第 1 期剂量范围研究,旨在评估
ELI-002 2P 作为辅助治疗对完成标准治疗并患有分子疾病的患者的安全性和有效性 13 20 个月随访强化(4 周内 4 剂)Prime(8 周内 6 剂)局部治疗(例如手术、化疗)临床项目
概述:NCT04853017 篮子试验注册胰腺导管腺癌 (PDAC) 结直肠癌 (PDAC) CRC) n=20 n=5 mKRAS G12D/R — 与 2 种肽配方一致,局部区域治疗后无转移性疾病否
射线照相疾病证据 (NED) 复发风险高(MRD+ ctDNA/血清生物标志物)关键标准 1-2 个月 3 个月 2 个月安全最大耐受剂量 (MTD) 或 RP2D ctDNA/血清生物标志物与基线的变化免疫学
反应无复发生存 (RFS) 终点 25 名患者入组,23 名患者可在数据库截止时进行评估(2023 年 4 月 25 日)晚期:68% 患有 III 期或寡转移性切除的 IV 期疾病预先治疗:所有患者均接受过
之前接受过化疗和手术,28% 之前有放射治疗基线特征
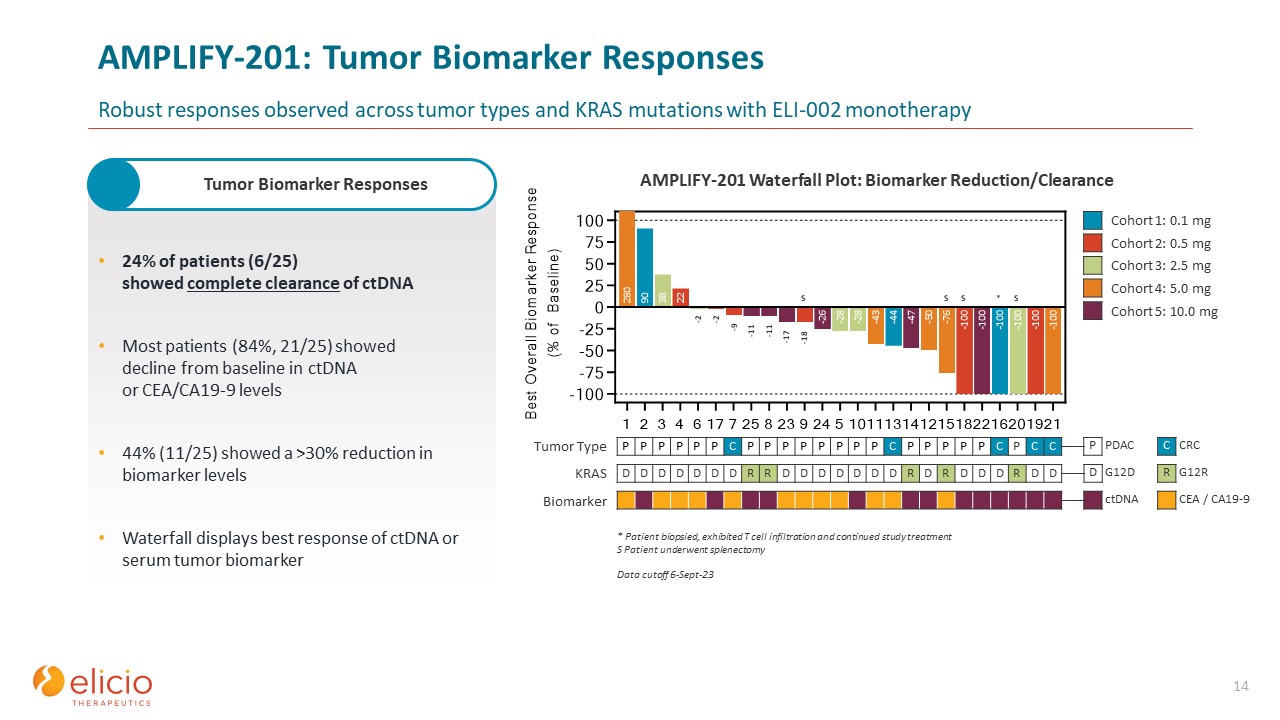
AMPLIFY-201:肿瘤生物标志物反应在 ELI-002 单一疗法下,在所有肿瘤类型和
KRAS 突变中观察到的强劲反应 14 24% 的患者(6/25)显示 ctDNA 完全清除。大多数患者(84%,21/25)的ctDNA或CEA/CA19-9水平比基线下降 44%(11/25)显示生物标志物
水平降低超过 30% 瀑布显示ctDNA或血清生物肿瘤的最佳反应标记 * 患者活检,表现出 T 细胞浸润并继续接受研究治疗 S 患者接受了脾切除术数据截止日期
6-9 月 23 日 P P P P P P P P P P P P P P P P P P P P P P P P P P P P P P P P P P P P P P P P P P P P P P P P P P P P P P P P P P P PP C P P P P P P P C C C 肿瘤 D D D D D D D D D D D D D D D D D D D R D D D KRAS 生物标志物 D G12D R G12R P PDAC CRC CRC ctDNA CRC ctDNA CEA/
CA19-9 -9 -11 -18 -2 S S S S * -2 -11 -17 队列 1:0.1 mg 队列 2:0.5 mg 队列 2:0.5 mg 队列第 3 组:2.5 mg 队列 4:5.0 mg 队列 5:10.0 mg AMPLIFY-201 瀑布图:生物标志物减少/清除肿瘤生物标志物反应

AMPLIFY-201:84% 的患者产生了 mKRA 特异性 T 细胞 15 84% 的患者在两个最高剂量队列中表现出 100% 的 T
细胞反应,包括 RP2D(10 mg)与基线(中位数 13x;范围 2-423x)相比 T 细胞数的平均倍数变化 58 倍(中位数 13x;范围 2-423x),
无需扩展 AMP-CPG 剂量体外 T 细胞反应水平 (n,%) 平均折叠变化 0.1 mg 2/3 (67%) 30 0.5 mg 4/6 (67%) 101 2.5 mg 4/5 (80%) 113 5.0 mg 5/5 (100%) 19 10.0 mg 6/6 (100%) 36 总计 21/25 (84%) 58 个反应显示的是评估期间任何时间点每位患者的最佳总体反应与基线对比。数据截止时间 23 年 9 月 6 日中位数 = 13 倍 AMPLIFY-201 T 细胞折叠的剂量水平变化 mkras T 细胞
反应基线最大反应每剂量水平的最大反应体外 T 细胞反应反应的直接体外 T 细胞反应反应
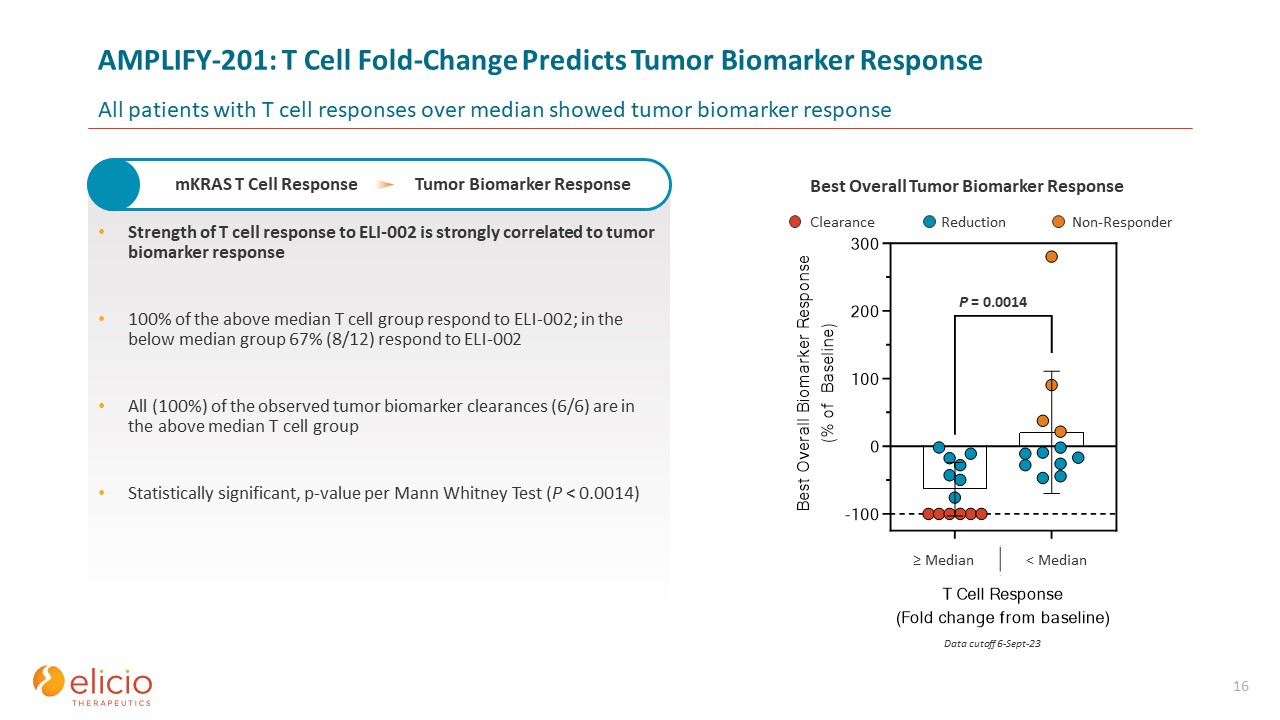
清除率减少无反应者 AMPLIFY-201:T 细胞折叠变化预测肿瘤
生物标志物反应高于中位数的所有患者都表现出肿瘤生物标志物反应 16 T 细胞对 ELI-002 的反应强度与肿瘤生物标志物反应密切相关 100% 上述中位数 T 细胞组对
ELI-002 有反应;在低于中位数的组中,67% (8/12) 对观察到的肿瘤生物标记物的所有反应 ELI-002 (100%) (6/6) 属于上述中位数 T 细胞组具有统计学显著性,根据曼恩惠特尼检验 (P
) 得出 p 值
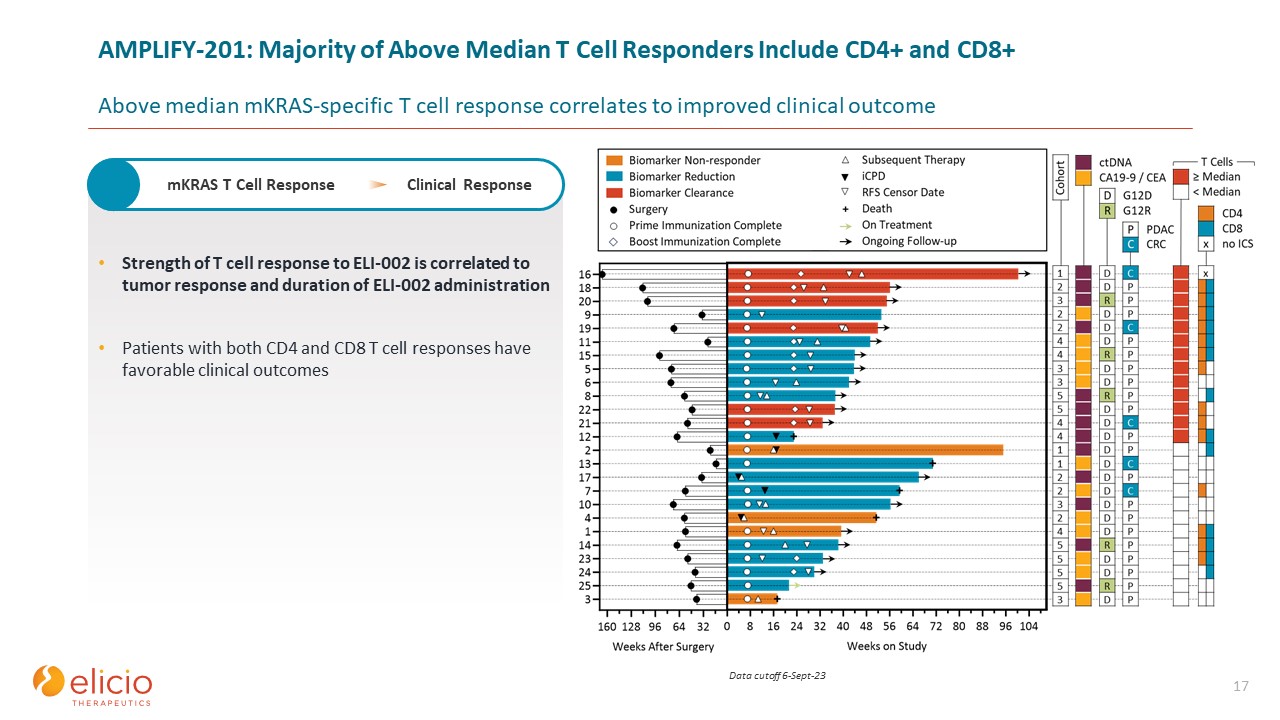
17 T 细胞对 ELI-002 的反应强度与肿瘤反应和 ELI-002 给药持续时间相关
同时有 CD4 和 CD8 T 细胞反应的患者具有良好的临床结果 mkras T 细胞反应临床反应 AMPLIFY-201:大多数中位数 T 细胞反应者包括 CD4+ 和 CD8+ 高于中位数
MKRAS 特异性 T 细胞反应与临床疗效改善相关数据截止日期 23 年 9 月 6 日
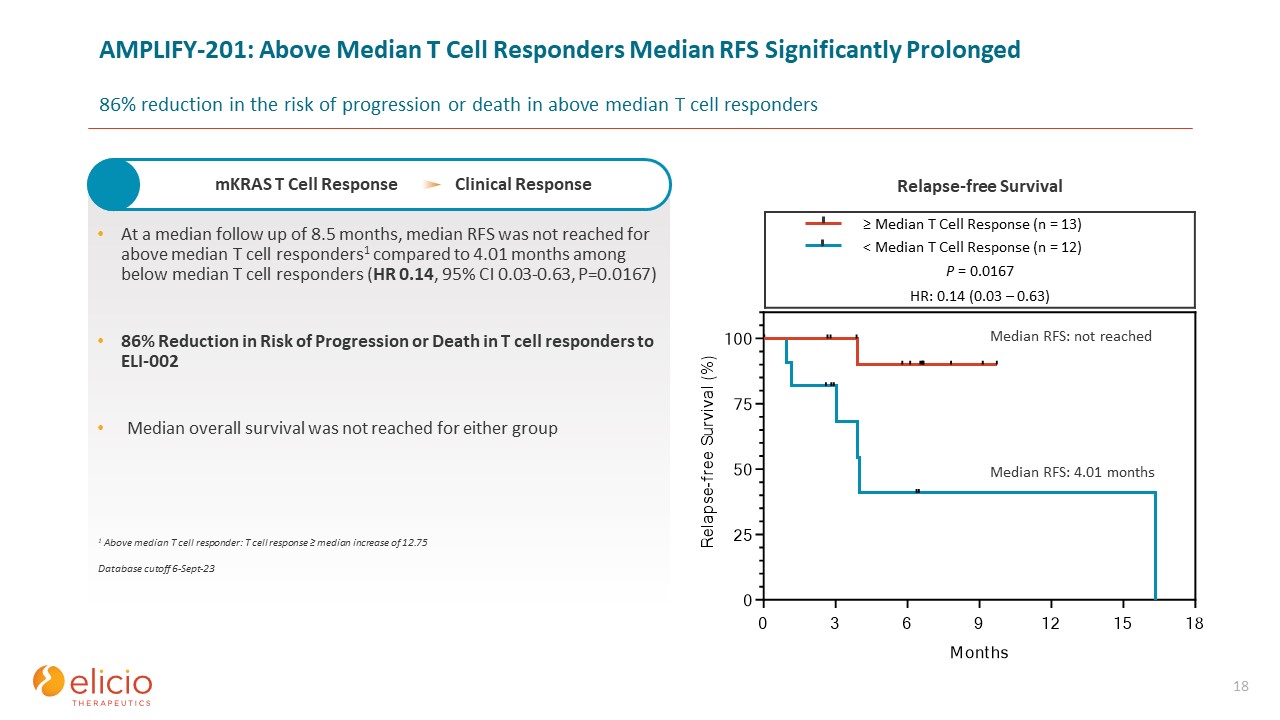
AMPLIFY-201:高于中位数 T 细胞反应者中位数 RFS 显著延长 T 细胞应答者进展或死亡风险降低 86%
。18 在随访中位数为 8.5 个月时,高于中位数 T 细胞
反应者的 RFS 中位数为 4.01 个月(HR 0.14,95% 置信区间 0.03-0.63,P=0.0167)风险降低 86% ELI-002 的 T 细胞反应者的进展或死亡两组均未达到中位总存活率 ≥ T 细胞反应中位数 (n = 13)
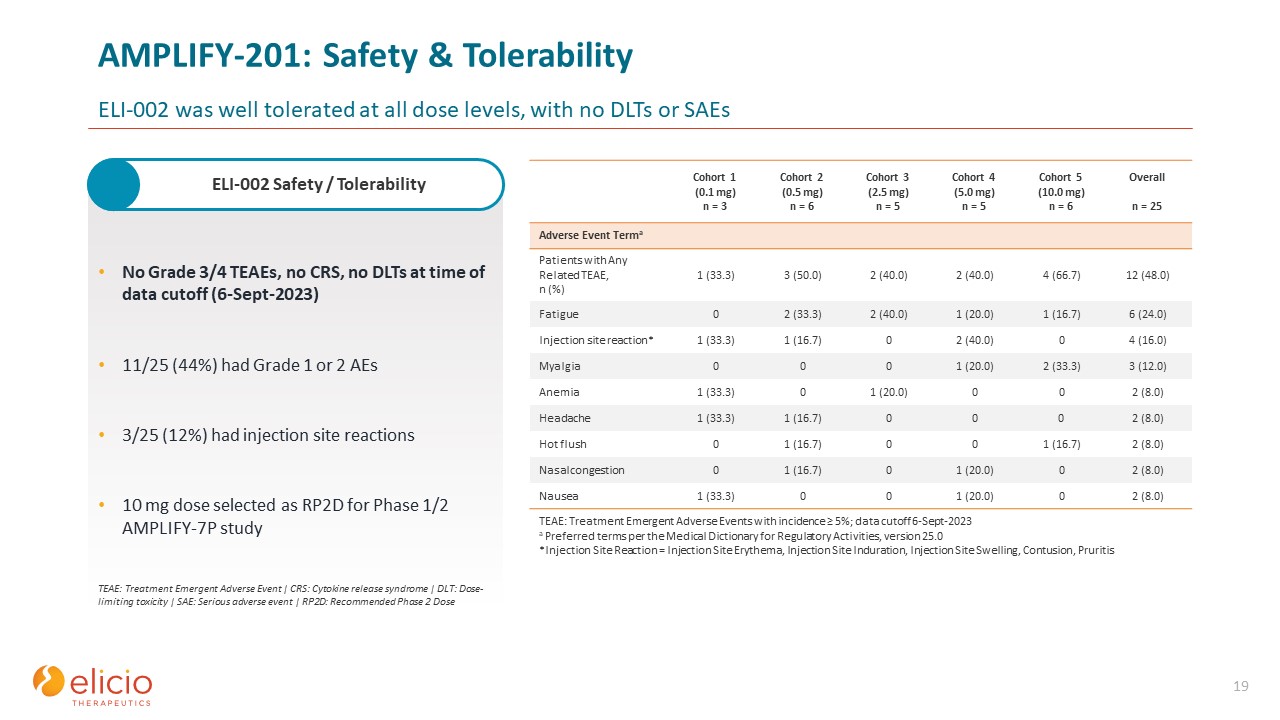
AMPLIFY-201:安全性与耐受性Yeli-002 在所有剂量水平下都具有良好的耐受性,
没有 DLT 或 SAE 19 没有 3/4 级 TEAE,没有 CRS,没有 DLT,在数据截止时(2023 年 9 月 6 日)11/25 (44%) 有 1 级或 2 级 AEs 3/25 (12%) 的注射部位反应 10 mg 剂量作为 1/2 期 AMPLIFY-7P 研究 TEAE 的 RP2D:
治疗紧急不良事件 | CRS:细胞因子释放综合征 | DLT:剂量限制毒性 | SAE:严重不良事件 | RP2D:推荐的第 2 阶段剂量队列 1 (0.1 mg) n = 3 队列 2 (0.5 mg) n = 6 队列 3 (2.5 mg) n =
5 队列 4 (5.0 mg) n = 5 队列 5 (10.0 mg) n = 6 总体 n = 25 名不良事件 Terma 患者出现任何相关 TEAE,n (%) 1 (33.3) 3 (50.0) 2 (40.0) 2 (40.0) 4 (66.7) 12 (48.0) 2 (48.0) 2 (40.0) 2 (40.0) 1 (16.7) 6 (24.0) 注射部位反应* 1 (33.3) 1 (16.7) 0 2 (40.0) 0 4 (16.0) 肌痛 0 0 0 0 1 (20.0) 2 (33.3) 3 (12.0) 贫血 1 (33.3) 0 1 (20.0) 0 0 2 (20.0) 0 0 2 (8.0) 0 0 2 (16.7) 0 0 1 (16.7) 0 1 (16.7) 2 (8.0) 鼻塞 0 1 (16.7) 0 1 (20.0) 0 2 (8.0) 恶心 1 (33.3) 0 0 1 (20.0) 0 1 (20.0) 0 2 (8.0) TEAE:治疗紧急不良发病率 ≥ 5% 的事件;数据截止
2023 年 9 月 6 日 a《监管活动医学词典》25.0 版的首选术语 *注射部位反应 = 注射部位红斑、注射部位硬化、注射部位肿胀、挫伤、瘙痒 ELI-002 安全性/
耐受性
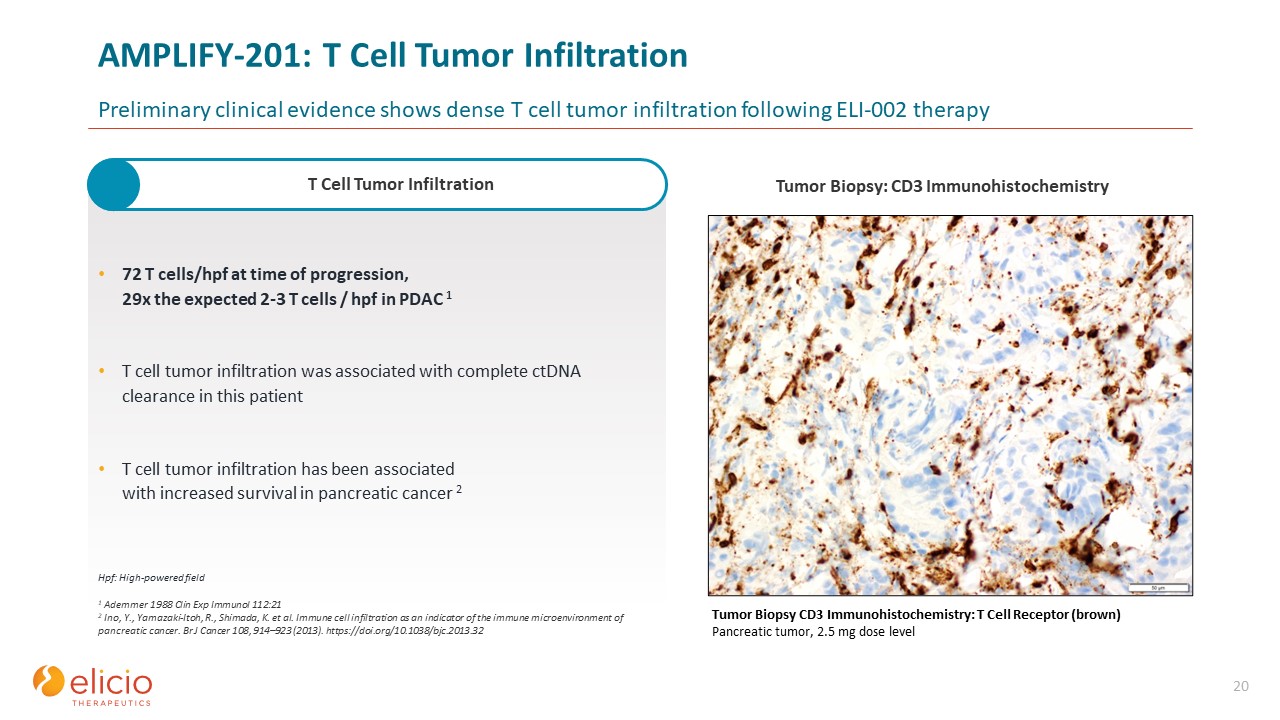
AMPLIFY-201:T 细胞肿瘤浸润初步临床证据显示,在 ELI-002 治疗后,T 细胞
肿瘤浸润密集 20 72 个 T 细胞/hpf,PDAC 1 T 细胞肿瘤浸润中预期 2-3 个 T 细胞/hpf 的 29 倍与该患者完全清除 ctDNA 有关 T 细胞肿瘤
浸润与胰腺癌存活率提高有关 2 肿瘤活检 CD3 ImmunstoHIBOSY 化学:T 细胞受体(棕色)胰腺肿瘤,2.5 mg 剂量等级 1 Ademmer 1988 Clin Exp Immunol 112:21 2 Ino,Y.,
Yamazaki-Itoh、R.、Shimada、K. 等人免疫细胞浸润是胰腺癌免疫微环境的指标。Br J Cancer 108,914—923(2013)。https://doi.org/10.1038/bjc.2013.32 Hpf:高功率场 T 细胞肿瘤
浸润肿瘤活检:CD3 免疫组织化学

AMPLIFY-201:临床数据摘要Yeli-002 单一疗法可产生强大的免疫反应
,与临床益处相关 21 耐受性良好,无剂量限制毒性,无 3/4 级 TEAE,无 CRS,无 DLT;11/25 (44%) 有 1 级或 2 级 AE 有望初步数据 T 细胞反应显著降低进展或
死亡的风险肿瘤生物标志物减少、不同肿瘤类型和 KRAS 突变的清除率 T 细胞反应与肿瘤生物标志物减少/清除和无复发生存益处密切相关 Robust
mkRas T在 AMPLIFY-201 中观察到的细胞反应 T 细胞反应和肿瘤浸润历史上与 PDAC 存活率有关能够在大多数大 T 细胞反应的患者中产生 KRAS 特异性 CD4+ 和 CD8+ 反应
在可评估的患者中,100% 的患者在增强后维持较高的 KRAS 特异性 T 细胞反应 90% 的患者对两种或更多 KRAS 抗原 RP2D 精选 AMPLIFY-7P IDMC 推荐了 ELI-002 7的第 2 期剂量
P 随机化 PDAC 第 2 阶段研究的下一部分即将开始(2024 年第一季度)

ELI-002 差异化*与同类
癌症疫苗相比具有明显的临床和操作优势 22 ELI-002 SLATE-KRAS---GRANITE---**-autogene-cevumeran--**-mRNA-4157--增强免疫反应,无脾脏要求与驱动突变相比覆盖范围最广,限制耐药性快,
可预测,成本更低,无制造风险 *** 针对肿瘤新抗原的免疫原性激活系统虽然仍然强大 4 7 个抗肿瘤免疫反应临床项目在早期疾病淋巴结参与中专门针对 KRAS
突变 “现成” 共享的 KRAS 新抗原疫苗个性化新抗原疫苗 * 基于公开信息** 个性化新抗原疫苗可编码多种新抗原,这些新抗原可能包含也可能不包含 KRAS 新抗原,但不完全针对 KRAS 驱动突变 *** 与影响可用性的 “准时” 生产无风险;候选产品未在正面研究中评估;基于
的比较公共信息 KRAS 突变靶向:Elicio 7P:G12D、G12R、G12V、G12C、G12A、G12A、G12S、G13D,SLATE: G12C、G12D、G12V、Q61H

2024 年持续执行势头 23 AMPLIFY-201 更新的临床数据
(2024 年第一季度)AMPLIFY-7P PDAC 第 2 阶段启动(2024 年第 1 季度)AMPLIFY-7P 1a 期数据(1H-2024)AMPLIFY-201 临床免疫(1H-2024)反应随访 2024 年预期里程碑 AMPLIFY-201 已完成 1a 期
入组 AMPLIFY-7P 启动的 1a 期研究 AMPLIFY-201 提交了 1a 期研究 (ASCO) 的初步安全、免疫和生物标志物反应数据获得第二份 GIRF 拨款 53/ BRAF 程序 AMPLIFY-201 呈现 T 细胞
反应和复发免费生存数据(AACR 特别会议 Pancreas)为 p53/BRAF 项目(SITC)提供了积极的临床前数据(SITC)提供了 AMPLIFY-201 免疫反应耐久性数据(SITC)

靶向淋巴结以增强免疫疗法 2024 年 1 月