
治愈心理健康障碍,让世界各地的每个人都能过上更充实的生活。公司概述公司概述 — 2024 年 1 月

除非上下文另有要求,否则本演示文稿中所有提及 “我们”、“我们的”、“atai” 或 “公司”
的内容均指ATAI Life Sciences N.V. 及其合并子公司。本演示文稿包含1995年《私人证券诉讼改革法》所指的前瞻性陈述。我们
打算将此类前瞻性陈述纳入经修订的1933年《证券法》第27A条和经修订的1934年《证券交易法》(
)第21E条所载的前瞻性陈述的安全港条款中。除本演示文稿中包含的历史事实陈述以外的所有陈述,包括有关我们未来的经营业绩和财务状况、行业动态、业务战略和计划以及我们未来运营的
目标的陈述,均为前瞻性陈述。这些陈述代表了我们对未来的观点、期望、信念、意图、估计或战略,这些观点可能无法实现。在某些情况下,您可以使用 “可能”、“将”、“应该”、“计划”、“预期”、“预期”、“可能”、“打算”、“目标”、“项目”、“考虑”、“相信”、“估计”、“预测”、“潜在” 或 “继续” 等术语或其他类似表述的
否定词来识别前瞻性陈述旨在识别前瞻性陈述。前瞻性陈述主要基于我们当前对未来事件和财务趋势的预期和预测
,我们认为这些预期和预测可能会影响我们的财务状况、经营业绩、业务战略、短期和长期业务运营和目标以及财务需求。这些前瞻性陈述受多种风险、
不确定性和假设的影响,包括但不限于我们最近向美国证券交易委员会(“SEC”)提交的10-K表年度报告中标题为 “风险因素” 的部分中描述的重要因素,这些因素可能导致我们的实际业绩、业绩或成就与前瞻性陈述所表达或暗示的业绩、业绩或成就存在重大不利差异。此外,我们在竞争激烈、瞬息万变的环境中运营。新的风险不时出现。我们的管理层无法预测所有风险,也无法评估所有因素对我们业务的影响,也无法评估任何因素或
因素组合在多大程度上可能导致实际业绩与我们可能做出的任何前瞻性陈述中包含的结果存在重大差异。鉴于这些风险、不确定性和假设,本演示文稿中讨论的前瞻性事件和情况
可能不会发生,实际结果可能与前瞻性陈述中的预期或暗示存在重大和不利的差异。因此,我们提醒您不要依赖这些前瞻性
陈述,我们用这些警示性陈述来限定所有前瞻性陈述。本演示文稿中包含的前瞻性陈述仅截至本文发布之日作出。尽管我们认为前瞻性陈述中反映的预期
是合理的,但我们不能保证前瞻性陈述中反映的未来业绩、活动水平、业绩或事件和情况能够实现或发生。
此外,我们和我们的顾问以及任何其他人均不对前瞻性陈述的准确性和完整性承担责任。除非法律要求,否则我们和我们的顾问均没有义务在本演示文稿发布之日后出于任何原因更新任何前瞻性陈述
,以使这些陈述与实际业绩或我们的预期变化保持一致。您应该在阅读本演示文稿的前提下,我们的
实际业绩、活动水平、业绩以及事件和情况可能与我们的预期存在重大差异。除非另有说明,否则本演示文稿中包含的有关我们的行业、竞争地位
和我们经营的市场的信息均基于来自独立行业和研究机构、其他第三方来源的信息以及管理层的估计。管理层的估计来自独立行业分析师和其他第三方来源发布的公开信息
以及我们的内部研究数据,并基于我们在审查此类数据时做出的假设,以及我们在此类行业和市场方面的经验和知识,
我们认为这是合理的。此外,对我们经营所在行业或任何单个竞争对手的未来表现以及我们未来表现的预测、假设和估计必然受包括上述因素在内的各种因素造成的不确定性和风险的影响。这些因素和其他因素可能导致结果与独立各方和我们在估算中表达的结果存在重大差异。行业
出版物、研究、调查和研究通常表示,它们所包含的信息是从被认为可靠的来源获得的,但不能保证此类信息的准确性和完整性。从这些来源获得的预测和
其他前瞻性信息与本演示文稿中的其他前瞻性陈述具有相同的限定条件和不确定性。本演示文稿包含在第三方研究或其他背景下使用我们候选产品所含化合物的化合物或衍生物治疗的
个人的证词摘录,这些证词仅用于说明而不能代表此类化合物
可能产生的有益结果。我们的候选产品处于临床前或临床开发阶段,我们的候选产品均未获得 FDA 或任何其他监管机构的批准。此处包含的任何商标
均为其所有者的财产,仅用于参考目的。此类使用不应被解释为对公司产品或服务的认可。免责声明 02

1 心理健康障碍是全球最大的健康负担之一;2019年,全球每8人中就有1人,即9.7亿人,患有精神障碍1 3 八个临床阶段的药物开发计划和战略投资,每个项目都有大量的先前临床证据 2 atai 的
目标是通过开发快速有效的持久疗法,为心理健康患者实现具有临床意义和持续的行为改变 tics 4 经过验证的运营模式和获取价值的能力:COMPASS Pathways 在
的首次公开募股2020年以及大冢与atai子公司Perception Neuroscience在2021年达成的许可协议 5 预计将为20262年提供资金 atai Life Sciences:治愈心理健康
障碍,使世界各地的每个人都能过上更加充实的生活 03 世界卫生组织承诺的定期贷款资金包括4500万美元的额外资金,这些资金可以在不受Hercules
资本机制下的里程碑限制的情况下提取;合格证券包括货币市场基金、美国国库证券、商业票据、公司票据/债券、美国政府机构证券和公开股票

我们的战略将通过强大的迷幻药和
非迷幻药物开发计划和战略投资组合来实现 04 迷幻项目和战略投资 Preclin 第一阶段第二阶段第 3 阶段计划/投资 RL-007/专业认知神经调节剂3 GRX-917 /氘化
etifoxine COMP3601/迷幻药 VLS-01/DMT DMX-1002/Ibogaine EMP-01/R-MDMA EGX-A & EGX-A X-B/新型 5-HT2A 受体激动剂 BPL-0032/5-MEO-DMT ELE-1012/Psilocin 主要适应症与
精神分裂症相关的认知障碍全身性焦虑症耐药性抑郁症耐药性抑郁症阿片类药物使用障碍创伤后应激障碍及其他未公开的耐药性抑郁症重度抑郁症
非迷幻项目 2 对贝克利心理科技的战略投资 1 对康帕斯途径 3 的战略投资 RL-007 化合物是 (2R, 3S) -2-氨基-3-羟基-3-吡啶-4-基-1-吡咯烷-1-基-1-吡咯烷-1-基-1-丙烷-1-酮 (L)-(+) 酒石酸盐
盐战略投资

我们预计将在未来 18 个月内在关键项目
中实现几个有意义的研发里程碑3 05 atai 生命科学:运营重点和计划指南 2023 年第三季度第一阶段初步结果在 24 年上半年提交 FDA 会议请求 23 年第二季度第一阶段的初始结果 2023 年第三季度的 Ph 1b 首位
参与者在 23 年第 1 季度延迟突破在 2023 年 SOBP 年会上发表演讲 CIAS Ph 2b 的 Ph 2a 试验成功结果 2a 在 23 年第一季度第一季度给药 Topline Ph 2b 数据 25 年中期 RL-007(Pro-Cognitive
神经调节剂)GRX-917(氘化依替福辛)VLS-01(DMT)DMX-1002(Ibogaine)EMP-01(R-MDMA)COMP3601(Psilocybin)Ph 1 试验于 22 年第 3 季度启动 Ph 1 的试验 2013 年第四季度在 TRD Ph 2(创伤后应激障碍)中取得成功结果 — 数据
24 年春季 Ph 3 (TRD) — 关键试验 1 的顶线数据 '24 年夏季 Ph 3 (TRD)-关键试验 2 的头条数据 25 年中期 BPL-0032 (5-MEO-DMT) 在 24 年中期 Ph 2a OL (AUD) 数据中,Ph 1 试验 Ph 2a OL (TRD) 在 24 年中期 Ph 2a OL (AUD) 数据中的成功结果 2H 2b
(TRD) 在 2H'24 ELE-1012 (Psilocin) Ph 1/2a OL (MDD) 数据中 — 1H'24 PSYDELCHEIC 中的数据计划与战略投资非迷幻项目对Compass Pathways的战略投资
对贝克利心理科技的投资提供的所有日期均为估计的缩写:创伤后应激障碍;CIAS = 与精神分裂症相关的认知障碍;TRD = 耐药性抑郁症;澳元 = 酒精使用
障碍;MDD = 重度抑郁症

BPL-003 (5-meo-DMT) 用于治疗TRD和酒精使用障碍 06

12mg (n=5) 10mg (n=5) 8mg (n=5) 6mg (n=4) 4mg (n=4) 2.5mg (n=4) 1mg
(n=4) 平均血浆浓度水平 (ng/ml) 给药后时间 (分钟) BPL-003 1 期药代动力学概况主要发现安全性所有不良事件 (AE) 均为轻度 (89.5%) 或中度 (10.5%) 5%);未发生严重不良反应最常见的不良反应
(> 10%):鼻部不适、恶心、呕吐和头痛药代动力学(PK)暴露量与剂量成比例快速发作:平均Tmax为6-17分钟短时间:15-30分钟药效学(PD)受试者为迷幻
天真所有受试者剂量 ≥6mg 达到强度分数 ≥7 感知效应通常在 60-90 分钟内完全消除 BPL-003 第 1 阶段主观强度评级 0 12 30 60 90 12mg (n=5) 10mg (n=5) 8mg (n=5) 6mg
(n=4) 剂量后时间 (分钟) 平均主观药物强度 (SDI) 已完成的 1 期 SAD 研究的结果显示 BPL-003 具有良好的安全性且状况良好耐受同时证明剂量成比例的 PK/PD 分布 BPL-003:
鼻内 5-meo-DMT 0 12 30 60 90 缩写:SAD = 单次升序剂量;PK = 药代动力学;PD =药效学 7 07

BPL-003 2a 期是一项针对 TRD 患者的开放标签单一疗法研究 BPL-003 第
2a 期临床试验设计缩写:MADRS = 蒙哥马利—阿斯伯格抑郁评级量表;CGI-S = 临床全球印象严重程度;PGIC = 患者对变化的全球印象;EQ-5D = EuroQOL-5D 8 筛查 10mg(n=12)打开
标签第 2 天 85 预计将出现 Ph 2a (TRD) 的数据在 1H24 核心研究(12 周)中 57 29 8 关键纳入标准中度至重度耐药性抑郁症患者蒙哥马利-阿斯伯格抑郁评级量表(MADRS)分数
≥24 愿意且有能力停用目前的抗抑郁药关键目标:主要终点:BPL-003 单一疗法的安全性和耐受性关键次要终点:第 2、8、29、57 和 85 天的 MADRS 变化 CGI-S、PGIC、EQ-5D 08
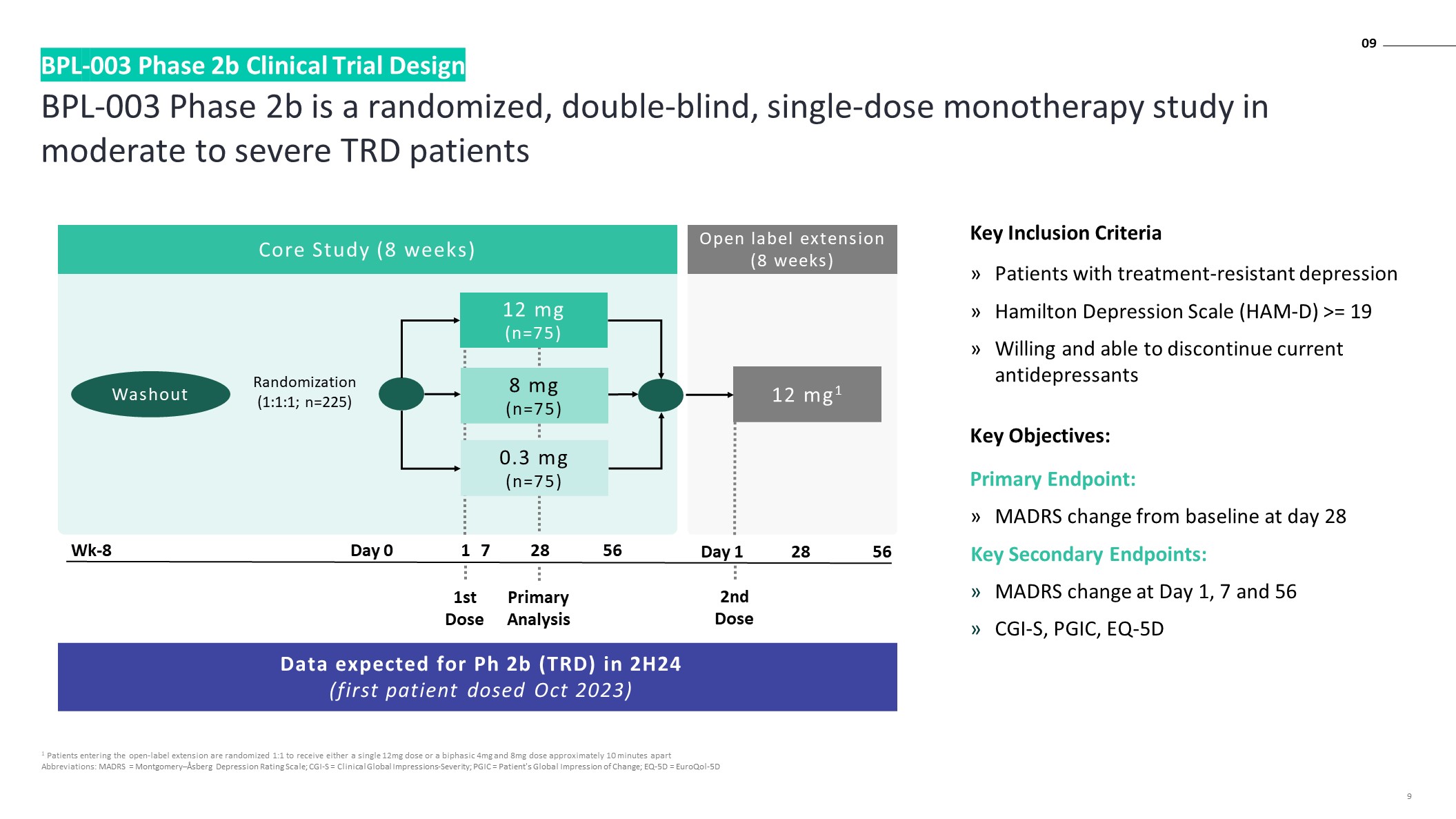
BPL-003 2b 期是一项针对
中度至重度 TRD 患者的随机、双盲、单剂量单一疗法研究 BPL-003 2b 期临床试验设计 1 进入开放标签延期的患者按 1:1 随机分配 12mg 单剂量或双相 4mg 和 8mg 剂量
缩写:MADRS = 蒙哥马利—阿斯伯格抑郁评级量表;CGI-S = 临床全球印象严重程度;PGIC = 患者对变化的全球印象;EQ-5D = euroqol-5D 9 随机化 (1:1:1;n=225) 第 0 天 1 28 56
Wk-8 Washout 12 mg1核心研究(8 周)初步分析第 1 天 28 56 预计在 24 年下半年 Ph 2b (TRD) 的数据(首位患者给药 2023 年 10 月)开放标签延期(8 周)0.3 mg(n=75)8 mg(n=75)12 mg(n=75)第一剂第二剂量关键纳入标准耐药性抑郁症患者汉密尔顿抑郁量表(HAM-D)>= 19 愿意并能够停用当前的抗抑郁症 sants 关键目标:主要终点:
MADRS 与基线相比在第 28 天发生变化关键次要终点:第 1、7 和 56 天 MADRS 变化 CGI-S、PGIC、EQ-5D 7 09

适用于 TRD 10 的 VLS-01 (DMT)

世界卫生组织 Salzer,“
严重精神疾病康复和缓解的全国估计”,《精神病学在线》(2018)健康志愿者研究旨在通过单剂量快速持续减轻抑郁症状产品概述:VLS-01 抑郁症主要适应症
概述 2019 年全球约3亿抑郁症患者1 33% 患者在当前治疗后反应不足或复发2 抑郁症是一种情绪障碍影响个人的思想和行为,导致
心理、生理,以及社会问题耐药性抑郁症(TRD)是在两个疗程的抗抑郁药失败后被诊断出来的 FDA 批准的抑郁症治疗可表现为发作缓慢、长期副作用和
反应率不足 11 全球疾病负担 VLS-01 关键产品特性专为单剂量后快速发作和持续疗效而设计迷幻效果持续时间短(约 30 到 45 分钟),耐受性提高,
相对于其他迷幻药来说,OTF 给药更方便抑郁症药物正在开发中 DMT (N, N-口服经粘膜薄膜(OTF)中的二甲基色胺)领先:耐药性抑郁症潜在扩展:饮食失调、物质
使用障碍23年第三季度第一阶段最终数据1b预计将在243年上半年第一位参与者产品适应症当前状态知识产权授予涵盖OTF管理DMT的美国专利,并得到多个
待处理的美国专利和PCT专利申请的支持
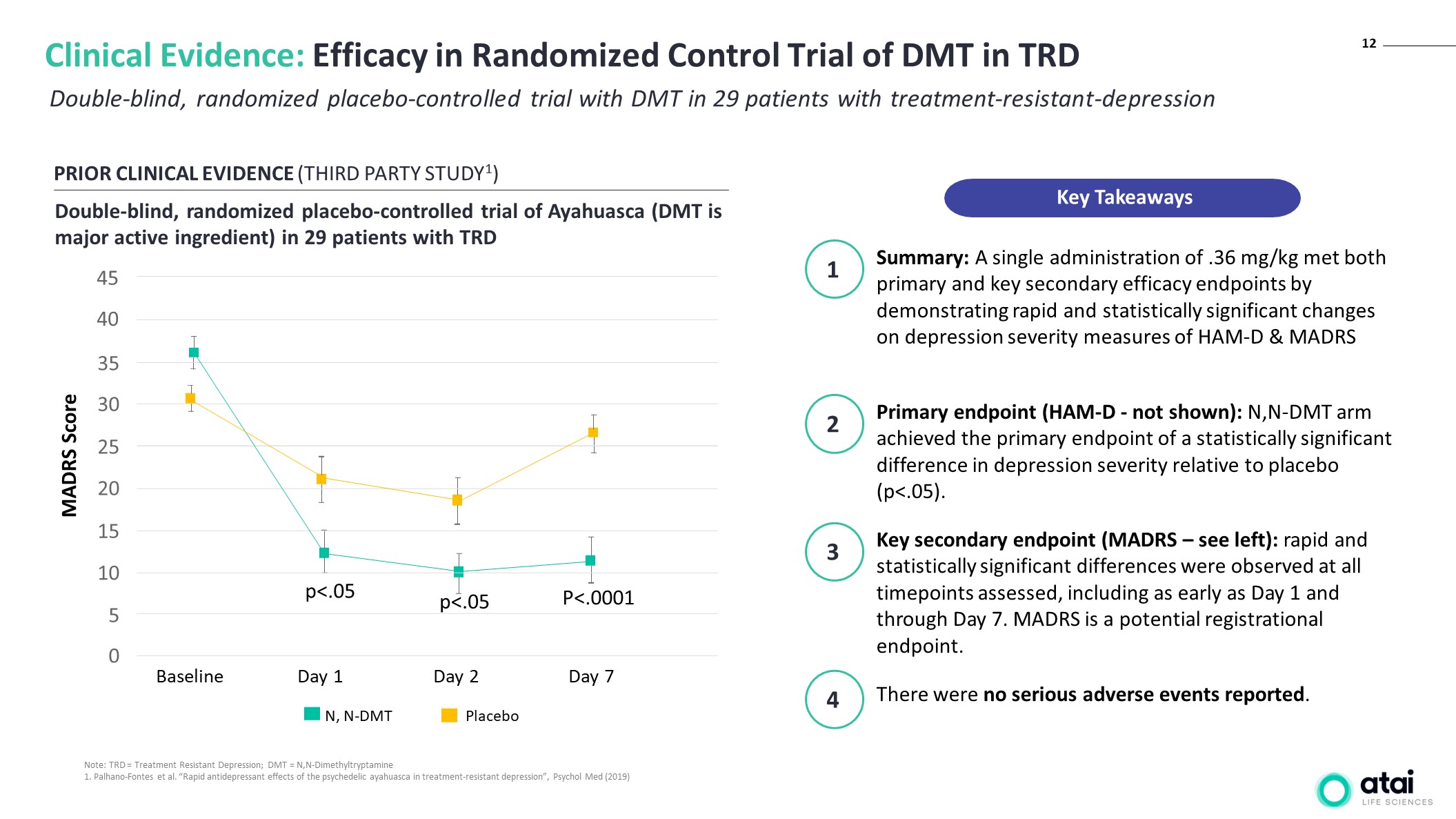
12 对 29 名
耐药性抑郁患者进行双盲、随机安慰剂对照试验 DMT 临床证据:DMT 在 TRD 中的随机对照试验的疗效先前的临床证据(第三方 STUDY1)双盲、随机安慰剂对照试验 Ayahuasca(DMT 是主要活性成分)
对 29 名患者 TRD 安慰剂 N, N-DMT P<.0001 score trd="Treatment" resistant depression dmt="N,N-Dimethyltryptamine 1." palhano-fontes et al. antidepressant e of the psychedelic ayahuasca in treatment-resistant psychol med a single administration .36 mg met both primary and key secondary efficacy endpoints by demonstrating rapid statistically significant changes on severity measures ham-d madrs endpoint not shown n arm achieved difference relative to placebo were no serious adverse events reported. see left differences observed at all timepoints assessed including as early day through is potential registrational endpoint. takeaways>

13 VLS-01 第 1 阶段:临床试验设计与结果 VLS-01 耐受性良好,安全性良好,剂量依赖性增加已得到证实。注:IV = 静脉注射;OTF = 口服透粘膜薄膜;PK/PD = 药代动力学/药效学;DMT = N,N-二甲基色胺计划
状态:1b 期 FSI 预计于 24 年 1 小时 VLS-01:PK/PD 结果与 DMT 的已知药理特征一致,使受试者的迷幻体验强度因暴露而大幅增加。第 3 部分(OTF
VLS-01)第 2 部分(OTF VLS-01)第 1 部分(IV VLS-01)研究设计:OTF VLS-01:暴露量普遍呈剂量依赖性增加,接近静脉给药时的剂量依赖性增加,并且
大多数患者有主观的迷幻体验。OTF VLS-01:与其他OTF队列相比,通过口腔给药加衬层的160mg的暴露量和主观影响增幅最大、最为稳定,结果与30毫克静脉注射的DMT队列相当。第 1 阶段 PK/PD 结果:

COMP 360(psilocybin)用于治疗创伤后应激障碍、创伤后应激障碍和厌食症 14

COMP360 2b 期试验显示抑郁症
症状可快速、持续减轻产品制药生态学产品特征适应症现状知识产权口服迷幻药 (COMP360) 5-HT2A-R 激动剂快速发作,单剂量后可能持续疗效。初级:耐药性
抑郁症、神经性厌食症、创伤后应激障碍潜力:重度抑郁症、自闭症、双相情感障碍、慢性丛集性头痛 1 期临床试验预计将于夏季数据 -24 第 3 阶段关键试验 2 的数据预计在 25 年中期
的专有配方合成迷幻药,COMP360 摘要:COMP360 亮点 COMP360 在 2b 期研究中表现出可有效减轻抑郁症状严重程度,反应迅速持久;人类先前证据(COMP360 阶段
2b)15.5% 1 所有权注:MADRS = 蒙哥马利-阿斯伯格抑郁评级量表;COMP360 = 专有的高纯度多态性迷幻药晶制剂;在 COMPASS 的迷幻药疗法模型中,COMP360 由
与经过专门训练的治疗师的心理支持一起给药。截至2023年9月30日的所有权百分比事后分析显示,在列出的其他时间点的25mg剂量结果也为阳性,但是,10mg组和1mg组之间比较的微不足道的
结果终止了基于预先规定的分层测试程序对所有后续关键次要疗效终点的显著性测试。15 主要终点

16 COMPASS Pathways 目前正在进行第三阶段的关键计划,
预计将在 2024 年夏季和 2025 年中期提供数据第 6 周主要终点1 第 3 周进行长期随访关键研究 1 单剂量单一疗法 (COMP 005) COMP360 25mg 安慰剂随机化 = 2:1 目标 N2 = 255 Topline
数据预计:2024 年夏季关键研究 2 固定重复剂量单一疗法 (COMP 006) COMP360 25mg COMP360 25mg COMP360 10mg COMP360 10mg COMP360 1mg COMP360 1mg 随机分配 = 2:1:1 目标 N2 = 568 预计顶线数据:
2025 年中期 0 周 0 周来源:截至2023年5月11日,Compass Pathways资本市场日演讲主要终点 = 第6周MADRS总分与基线相比变化参与者群体(TRD定义和核心纳入/
排除标准)与2b阶段相比保持不变进行长期随访Pivotal 3阶段试验设计第6周主要终点1

适用于 MDD 17 的 ELE-101(psilocin)

psilocybin活性部分在优化给药和
治疗模型中的潜在益处 ELE-01:静脉迷幻药1迷幻菌素模拟基于布朗等人2017年、Madsen等人(2019年)、Hasler等人(1997年)和Carhart-Harris等人(2011年)的主要数据。2 Holze F. 等人(2023)的主要数据。健康参与者口服迷幻药的药代动力学和药效学
。Clin Pharmacol Ther.静脉注射迷幻药的迷幻药代动力学(模拟)与口服 psilocybin1 有效剂量为 25mg 的典型血浆迷幻药浓度
psilocybin1 感知阈值2 静脉注射迷幻药对比口服迷幻药的预期益处:变异性缩短半衰期 = 更短的迷幻效果持续时间,预计为

对健康志愿者进行随机 1 期剂量递增研究,随后在 MDD 中进行
2a 期开放标签研究 ELE-101 1/2a 期临床试验设计 19 ELE-101 1/2a 阶段 — A 部分关键目标:PK 和 PD 的安全性和耐受性评估
中迷幻星的目标浓度

用于药物使用障碍的 DMX-1002(ibogaine)20

分别是创伤后应激障碍和创伤性脑损伤,世界
卫生组织 Salzer,“全国严重精神疾病康复缓解估计”,《在线精神病学》(2018)旨在通过迷幻效果快速、持续地减轻抑郁症状产品概述:
DMX-1002 阿片类药物使用障碍主要适应症概述 2022 年美国约 300 万例阿片类药物相关死亡人数 >10 万例阿片类药物使用相关死亡疾病非常普遍,其特征是无法控制
合法药物的使用或非法药物,例如阿片类药物(包括处方阿片类药物)或酒精。OUD 的当前护理标准主要包括心理支持和合成的全和部分阿片类药物受体激动剂(美沙酮和
丁丙诺啡),其中大约 30% 的患者获得治疗成功(定义为 > 80% 的非法阿片类药物无周期)。此外,长效阿片类药物拮抗剂(纳曲酮)使一定比例的患者成功获得治疗
。21 全球疾病负担 DMX-1002 关键产品特点在监测环境中给予的单剂量伊博加因可能支持阿片类药物使用障碍患者的戒断和长期复发预防先前的临床证据:
在第三方开放标签研究中,伊博加因与阿片类药物的渴望显著减少有关,无论是在出院时还是在治疗后一个月,OUD 患者的情绪都有所改善此外,针对可卡因使用障碍受试者的双盲
安慰剂对照研究显示,与安慰剂相比,经证实单次给药伊博加因复发的尿液具有统计学上的显著益处。阿片类药物使用障碍(“OUD”)潜在扩展:Add'l 药物使用障碍、创伤后应激障碍、TBI1 阶段结果预计将在24年上半年提交FDA会议请求产品适应症当前状态知识产权已发布和待处理的治疗方法索赔
OUD DMX-1002 是伊博加因的口服制剂,它是一种吲哚生物碱有可能通过神经元效应获得临床益处

22 对寻求阿片类药物和可卡因排毒的患者进行 8-12 mg/kg ibogaine 的开放标签研究的结果临床证据:伊博加因在开放标签安全性和有效性研究中的功效先前的临床证据(第三方 STUDY1)注:TRD = 耐药性抑郁症;DMT = N,N-二甲基色胺 1 Mash 等人,“伊博加因排毒过渡阿片类药物依赖和禁欲之间的药物和可卡因滥用者:临床观察和治疗结果”(2018)1 2 安全性:据报道,Ibogaine 耐受性良好,没有严重的
不良事件。4 个关键要点 HCQ-29 亚量表预剂量(N=75)5 4 3 2 1 0 出院(N=74)1 个月(N=37)情绪(负面情绪状态)强迫性(对戒烟能力缺乏信心)目的性(使用
的意愿)预期(吸毒的预期积极益处)自我报告的渴望疗效维度 — 急性后戒断综合症:体征和症状与剂量前的基线戒断严重程度
衡量标准相比,剂量后评估有所降低。阿片类药物戒断的客观症状较轻,在以后的时间点没有加剧。3 疗效 — 复发预防(左图):阿片类药物依赖患者在项目出院时测得的四个 HCQ-29 渴望域的平均分数显著降低,而持续完成研究的患者的平均分数降至一个月。渴望是复发的重要媒介。概要:单剂量的依博加因显示 74 名阿片类药物依赖患者对阿片类药物
的渴望有所降低。

DMX-1002 的安全水平和血浆浓度与先前试验 1 期研究一致:DMX-1002 试验设计和结果摘要已完成第 1 期试验:单次递增剂量未报告严重不良事件几乎所有不良事件均为轻度至中度(> 94%),与先前对伊博加因的
试验一致。潜在治疗血浆水平 DMX-1002 的 9 mg/kg 达到的血浆浓度与先前观察到治疗效果的研究中描述的无症状 qtC 延期的两个
参与者之一队列 3,观察到无症状 qTc 延长,无心律失常。在没有干预或后遗症的情况下,90-94ms的qtcf变化得到缓解第一阶段结果摘要队列 1 N = 12 3 mg/kg 队列 2 N = 6 6 mg/kg 队列 3 N = 2 9 mg/kg 第 1 天:单次口服剂量

DMX-1002 有可能成为首款也是同类最佳的
OUD 治疗方法,最大限度地降低复发风险摘要 DMX-1002 有可能成为阿片类药物使用障碍 (OUD) 的转变疗法 OUD 的当前护理标准是药物疗法,需要具有显著
副作用的阿片类药物替代品持续预防复发在监控环境下给药单剂,提供戒断支持和促进持续缓解的单剂量治疗发作极少滥用可能性不含阿片类药物
效果高依从性/低复发风险胆碱能、谷氨酸能和单胺能受体调节剂作用机制 Ibogaine (DMX-1002) 疗法药物辅助疗法1 在
门诊环境中每天进行阿片类药物替代疗法,试图戒掉阿片类药物 MU 激动剂部分 MU 拮抗剂美沙酮丁丙诺啡纳曲芬 xone 戒断支持2 在监督戒断期间给予症状管理的疗法
(解毒)Alpha-2 激动剂 Alpha-2 激动剂 Clonidine Lofexidine 当前的戒断策略支持的复发率很高注意:OUD = 阿片类药物使用障碍来源:公开信息,包括公司网站
和clinicaltrials.gov、GlobalData、Evaluate Pharma(均截至2022年)当前护理标准鉴于复发率高,很少使用。主要用于机构或监狱环境 demerX 24

用于认知障碍的 RL-007 25

世界卫生组织博拉等人,《精神分裂症和
情感性精神病的认知障碍:对DSM-V标准及其他方面的影响 GlobalData(截至2023年6月1日)4。Schaffer 等人,2013 年在先前的临床试验中表现出持续的促认知作用,对超过 500 名受试者具有良好的安全性产品概述:RL-007 用于认知障碍主要适应症概述约 2400 万全球精神分裂症患者¹ > 80% 的精神分裂症患者出现严重的认知障碍2 与精神分裂症 (CIAS) 相关的认知障碍
以注意力、学习、记忆和执行力为特征功能缺陷此类缺陷导致认知功能比平均值低约 2.5 个标准差普通人群4 CIAS 是精神分裂症中常见的主要致残原因,超过 80% 的患者表现出严重损伤2 未获美国食品药品管理局批准的治疗方法3 26 全球疾病负担 RL-007 关键潜在产品特征
在先前的四项临床研究,包括两项 1 期和两项 2 期试验,临床和临床前研究中均显示出一致的 “倒置U” 剂量反应在没有证据的情况下表现出安全性和耐受性针对 500 多名受试者的10项临床研究的镇静剂
副作用口服、促认知神经调节剂领导:与精神分裂症相关的认知障碍潜在扩展:认知障碍包括阿尔茨海默氏痴呆和/或
自闭症 2a 期 CIAS 试验在 H2'21Phase 2b 的首位患者给药于 23 年第 1 季度 2b 期数据预计在 25 年中期产品适应症当前状态知识产权发布的物质成分、配方和使用方法 IP

27 DPNP 的第三方 2 期研究显示出具有统计学意义的阳性
认知信号(探索性终点)注意:* = P

2a 期试验-成分 MCCB 复合信号的功效数据
改善 n=7 n=8 n=8 cohen's d*(符号编码):20 mg:0.79 40 mg:0.56 80 mg:0.38 *活性与 pbo T 分数(按年龄、性别和教育水平进行标准化)atai 在 CIAS 的 2a 期研究显示 MCB 子集出现了阳性认知信号
神经认知终点临床证据:CIAS研究的2a期研究中重现的疗效信号显示,每个MCCB神经认知终点都有与剂量相关的改善趋势,包括科恩的d效应
大小为0。在 BACS 符号编码测试中,20mg、40mg 和 80mg 分别为 79、0.56 和 0.38。1 重要的是,符号编码是最敏感的子成分,与 MCCB 神经认知
复合材料的整体表现相关,后者是正在进行的 RL-007 2b 期研究的注册终点和主要终点。2 此外,qEEG 数据与先前的临床证据一致显示出
α波段和α-慢波指数的振幅增加,警觉性标志被认为与之相关认知方面。3 对四个 RL-007 群组(10、20、40 和 80 毫克)的 31 名 CIAS 患者的认知功能进行了评估。患者
在 4 天内接受了四剂安慰剂,然后接种了六剂 RL-007。将第 2 天 “在 RL-007 之前” 与第 4 天 “之后 RL-007” 进行了比较。这项单盲研究的主要目标是确认SOC的安全性,并确定CIAS患者有认知益处的信号
,包括三项MCCB子成分神经认知测试,HVLT1,BACS符号编码和类别流畅度背景关键要点1。霍普金斯口头学习测验 28

29 临床试验设计:RL-007 2b 期研究说明:MCCB = MATRICS 共识
认知电池;BACS = 精神分裂症认知简要评估;CIAS = 与精神分裂症相关的认知障碍;TID = 每天 3 次给药试验状态:首位患者在 23 年第一季度给药,Topline 数据预计在 25 年中期随机,
安慰剂对照研究 RL-007 约 234 名 CIAS RL-007 TID (40 mg) RL-007 TID (20 mg) 安慰剂 R 随机 1:1:1 主要终点患者:第 6 周的 MCB 神经认知综合评分关键次要终点:选择个人
MCCB 的组成部分,包括 BACS 符号编码临床全球印象分数第 6 周第 1 天

用于焦虑症的 GRX-917 30

美国世界卫生组织焦虑与抑郁协会
(2021)GlobalData(截至 2023 年 6 月 1 日)——美国食品药品管理局最近批准的所有批准都是对长期存在的抗抑郁药和苯二氮卓类药物的重新配方,旨在快速产生抗焦虑活性,但不会产生苯二氮卓类药物的负面副作用
产品概述:用于焦虑症的 GRX-917 主要适应症概述约3亿焦虑症患者 20191 #1 最常见的心理健康障碍1 焦虑症是在忧虑感
和不安情绪会持续很长一段时间,并可能随着时间的推移而恶化 50% 的美国患者由于次优的治疗方案而得不到治疗2 在过去十年中没有获得美国食品药品管理局批准的新疗法3 31 全球疾病
负担 GRX-917 关键产品特征显示出抗焦虑活性的快速起效活性(法国批准了非氘化依托福克辛)对法国约1400万张处方的审查突显了
etifox的良好安全记录耐受性差异,镇静剂有限、成瘾和/或认知障碍特性,与苯二氮卓类药物盐酸氘代依替福辛口服剂型(GRX-917)不同。导致:焦虑症(例如 GAD、SAD、PTSD、
等)第 1 阶段试验于 H2'22 完成探索伙伴关系和外部融资机会产品指标当前状态知识产权发布了关于氘化依替福辛(GRX-917)和相应的
使用方法的物质成分

32 注意:PK/PD = 药代动力学/药效学;qeeg = 定量
脑电图;BID = 每日两次表现出快速且剂量依赖性的 PK/PD 效应以及良好的安全性 1 期研究:GRX-917 试验设计和结果摘要已完成第 1 阶段试验第 2 部分:多次
递增剂量第 1 部分:单次递增剂量 42 名健康受试者:5 组 25mg 至 500 PD 终点:qeeg 60 名健康受试者:5 组 100mg 至 300 mg BID PD 终点:qeeg 安全性/PK/PD 治疗安全性/PK/PD 治疗安全性/PK/PD 治疗安全
且耐受性良好-可耐受,无剂量限制毒性,不良反应与安慰剂相当。靶向参与显示,与安慰剂同用的安慰剂镇静
相比,qeeg β功率的剂量依赖性增加镇静剂量,这与脑电图结果一致,且未显示 qeeg α功效下降第 1 阶段结果摘要
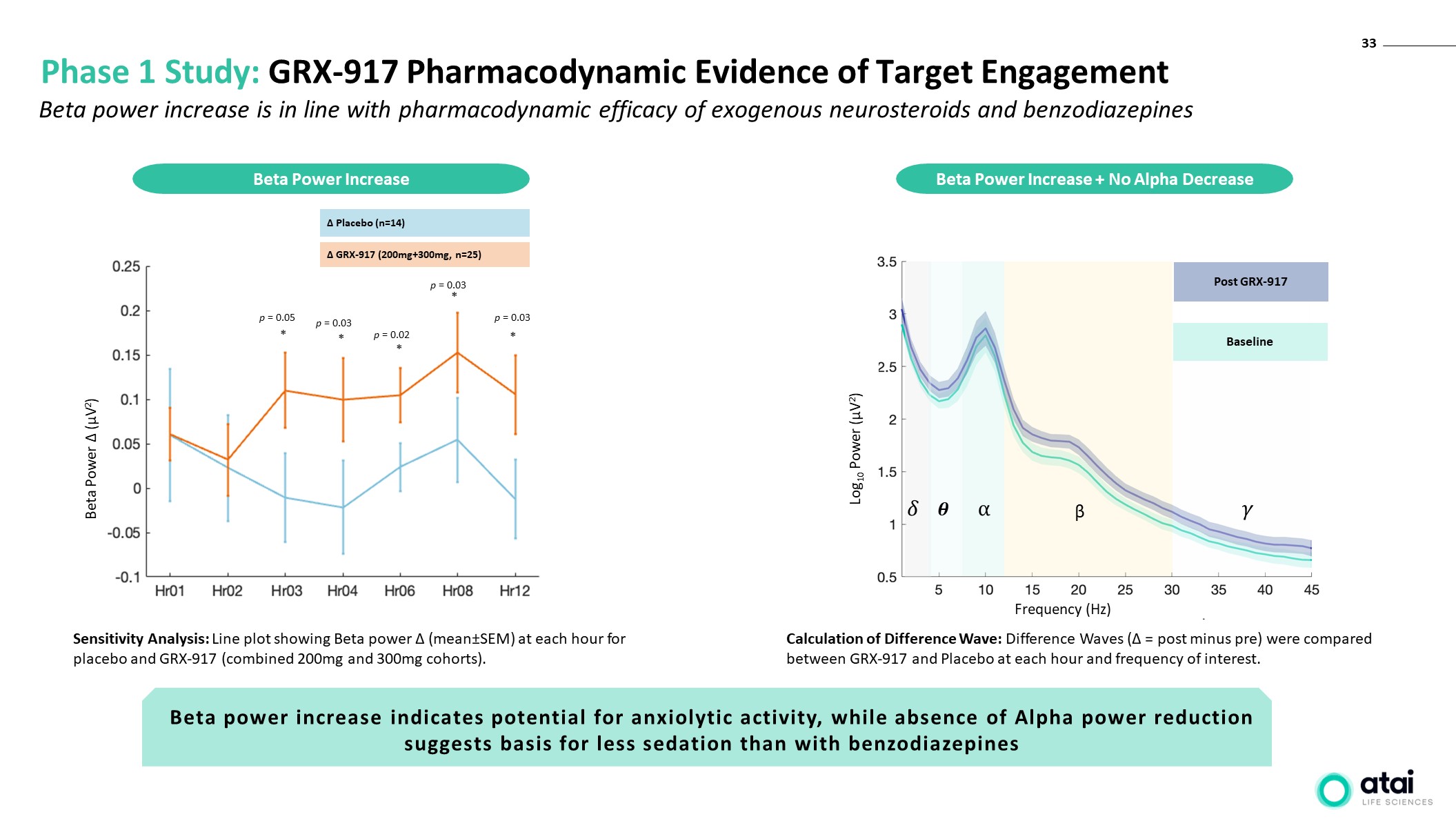
33 第 1 阶段研究:GRX-917 靶向参与的药效学证据 Beta
功率 (µV2) 安慰剂 (n=14) GRX-917 (200mg+300mg,n=25) p = 0.05 p = 0.03 p = 0.03 p = 0.03 p = 0.03 p = 0.03 p = 0.03 * * * * 灵敏度分析:线形图显示安慰剂和 GRX-917(组合
200 毫克和 300 毫克队列)。Beta 功率增加 Beta 能量增加 + 不降低 β 在 GRX-917 后基线 Log10 功率 (µV2) 频率 (Hz) Beta 功率增加符合外源
神经类固醇和苯二氮卓类药物的药效学功效 β功率的增加表明存在抗焦虑活性的潜力,而没有 Alpha 能量降低表明镇静效果低于苯二氮卓类药物差异计算波动差异:差异
对比了 GRX-917 和安慰剂在每个小时和感兴趣频率下的波浪(= 后减去前)。

纳斯达克:ATAI