
附录 99.1

1 TriSalus 生命科学 2024 年 1 月

2 免责声明本演示文稿中的某些陈述可能构成适用的美国联邦证券法所指的 “前瞻性陈述”。前瞻性陈述包括但不限于有关TriSalus对未来的预期、希望、信念、意图或战略的声明,包括但不限于以下方面的陈述:TriSalus的业务战略和临床开发计划;TriSalus候选产品的安全性和有效性;TriSalus在临床试验、临床试验注册和临床试验结果方面的计划和预期时机;规模和增长潜力 TriSalus 产品的市场和 TriSalus 的服务能力这些市场;TriSalus与其他公司竞争的能力;TriSalus截至2023年12月31日的年度和季度的预期财务业绩;TriSalus的预计财务业绩和预期的现金流;TriSalus与其他公司合作的能力;以及TriSalus的产品继续受到有利的报销环境的影响。此外,任何涉及未来事件或情况的预测、预测或其他描述的陈述,包括任何基本假设,均为前瞻性陈述。“预期”、“继续”、“可能”、“估计”、“期望”、“可能”、“计划”、“可能”、“潜在”、“预测”、“项目”、“应该”、“str ive”、“将” 等词语以及类似的表述可以识别前瞻性陈述,但这些词语的缺失并不意味着该陈述不是前瞻性的。前瞻性陈述是关于未来事件的预测、预测和其他陈述,这些陈述基于当前的预期和假设,因此受风险和不确定性的影响。此类陈述受许多已知和未知的风险、不确定性和假设的影响,由于各种重要因素,实际结果可能与前瞻性陈述中表达或暗示的结果存在重大差异,包括但不限于:业务、市场、最终保险、政治和法律条件的变化;TriSalus产品的报销环境的不利变化;TriSalus的候选产品在临床前或临床前未取得成功临床试验或无法获得监管部门的批准,请点击此处及时或根本不一致;未来的临床试验结果/数据可能与先前临床前研究或临床试验的中期、初步或初步结果/数据或结果/数据不一致;TriSalus维持和增加其市场份额的能力;TriNav和TriSalus候选产品的潜在市场规模小于TriSalus的估计;TriSalus成功商业化任何候选产品的能力获得批准的;TriSalus继续为其候选产品的临床前和临床试验提供资金的能力;未来的经济和市场状况;竞争对TriSalus业务的影响;与TriSalus预计财务信息的不确定性相关的风险;公司筹集资金为未来运营融资的能力;以及任何潜在诉讼、政府和欧盟法律程序、调查和调查的结果。您应仔细考虑TriSalus截至2023年9月30日的季度10-Q表季度报告的 “风险因素” 部分以及TriSalus不时向美国证券交易委员会提交的其他文件中描述的风险和不确定性。这些文件识别并解决了其他重要的风险和不确定性,这些风险和不确定性可能导致行为事件和结果与前瞻性陈述中明示或暗示的结果存在重大差异。前瞻性陈述只能从发表之日起才有效。提醒读者不要过分依赖前瞻性陈述,TriSalus及其代表不承担任何义务,也不打算更新或修改这些前瞻性陈述,无论是由于新信息、未来事件还是其他原因。TriSalus及其任何代表均未保证TriSalus将实现其预期。本演示文稿中包含的某些财务信息和数据可能未经审计,可能不符合经修订的1933年《证券法》规定的S-X条例。因此,此类信息和数据不得包含在向美国证券交易委员会提交的任何文件中,也不得在其中进行调整,也可能以不同的方式呈现。

3 `克服实体瘤治疗中的关键机械和生物学瓶颈商业高增长的医疗科技业务具有潜在的上升空间,设备+免疫疗法组合整合独特的设备和治疗方法以克服肝脏和胰腺肿瘤药物输送的关键挑战牵头项目:TLR9激动剂SD-101:1期数据为机制和耐受性良好的安全性概况提供概念验证多种价值——创造机会(临床数据、销售增长和新产品))预计将在未来 18 个月内推出与克服肿瘤微环境(TME)中的机械和生物屏障相关的所有知识产权的全球独家版权1
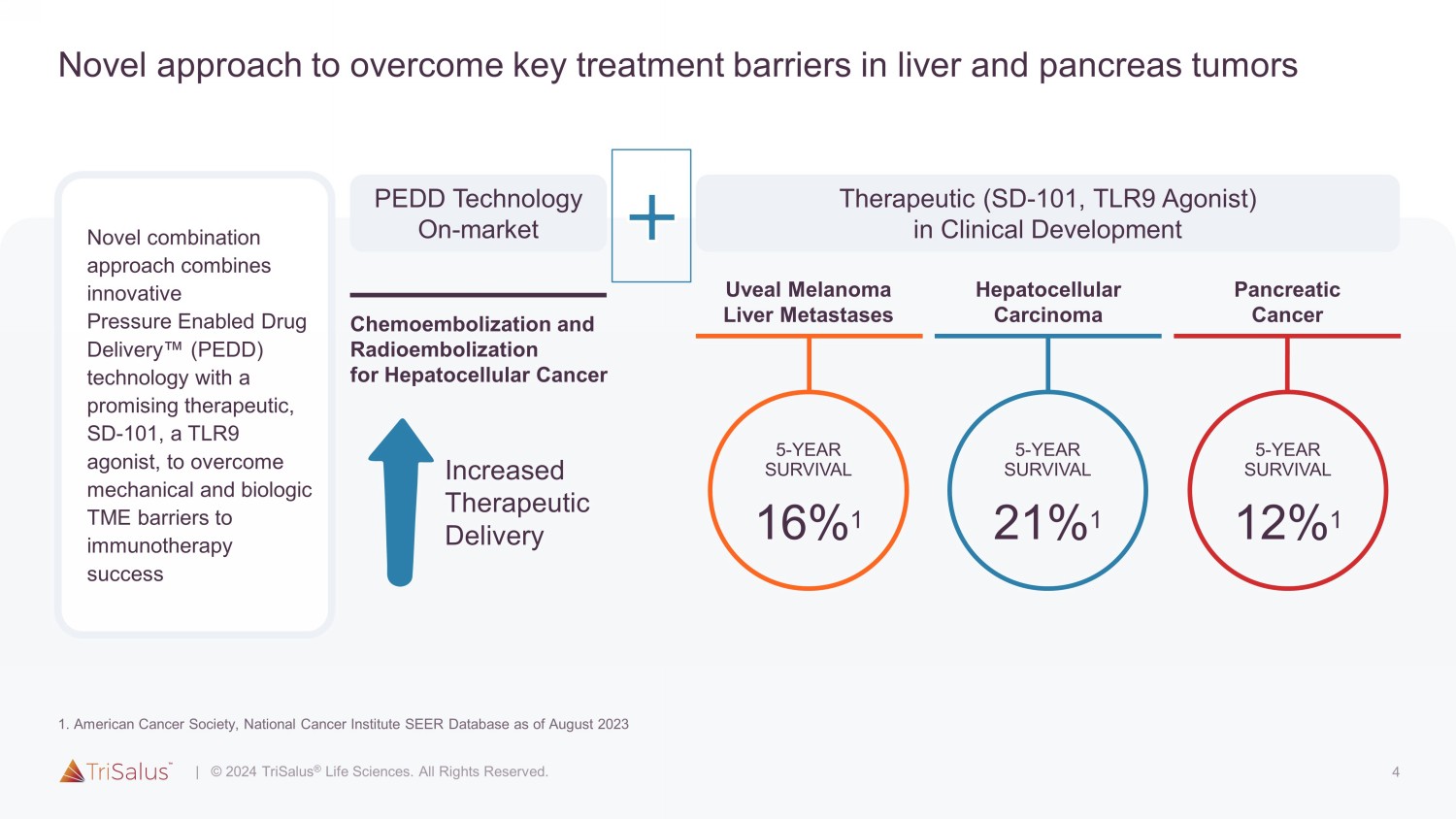
4 克服肝脏和胰腺肿瘤关键治疗障碍的新方法新的组合方法将创新的压力赋能药物输送(PEDD)技术与前景看好的治疗药物 SD-101(一种TLR9激动剂)相结合,以克服免疫疗法成功的机械和生物学障碍 PEDD 技术临床开发中的市场治疗(SD-101,TLR9 激动剂)葡萄膜黑色素瘤肝转移肝细胞癌肝细胞癌的肿瘤化学栓塞术和放射栓塞术胰腺癌 5-年存活率 16% 1 5-年存活率 21% 1 5-年存活率 12% 1 增加治疗量

5 肝脏和胰腺肿瘤免疫疗法成功的两个重要障碍 1.机械屏障 1-3 H 实体瘤中的高肿瘤内压限制了向肿瘤 2 的有效药物输送。TME 中的 Biologic Barrier 4 免疫抑制限制了治疗药物的活性血管塌陷导致的药物摄取受限 (
6 6 PEDD:压力驱动的药物递送第 1 节克服向肝脏和胰腺肿瘤输送药物的机械屏障

7 解决肝脏和胰腺肿瘤 TME 中的机械和生物屏障机械屏障:实体瘤内的高压 • 限制标准导管或静脉输送足够的治疗剂生物屏障:免疫抑制 TME 限制了疗法的疗效 • 限制 TME 中检查点抑制剂和其他免疫调节剂的有效性一种新型药物——设备组合 • PEDD 设备可克服肿瘤内高压,允许可能前所未有地向肿瘤输送药物 • TLR9激动剂可克服免疫抑制性 TME,增强治疗效果提议的 TRISALUS 解决方案
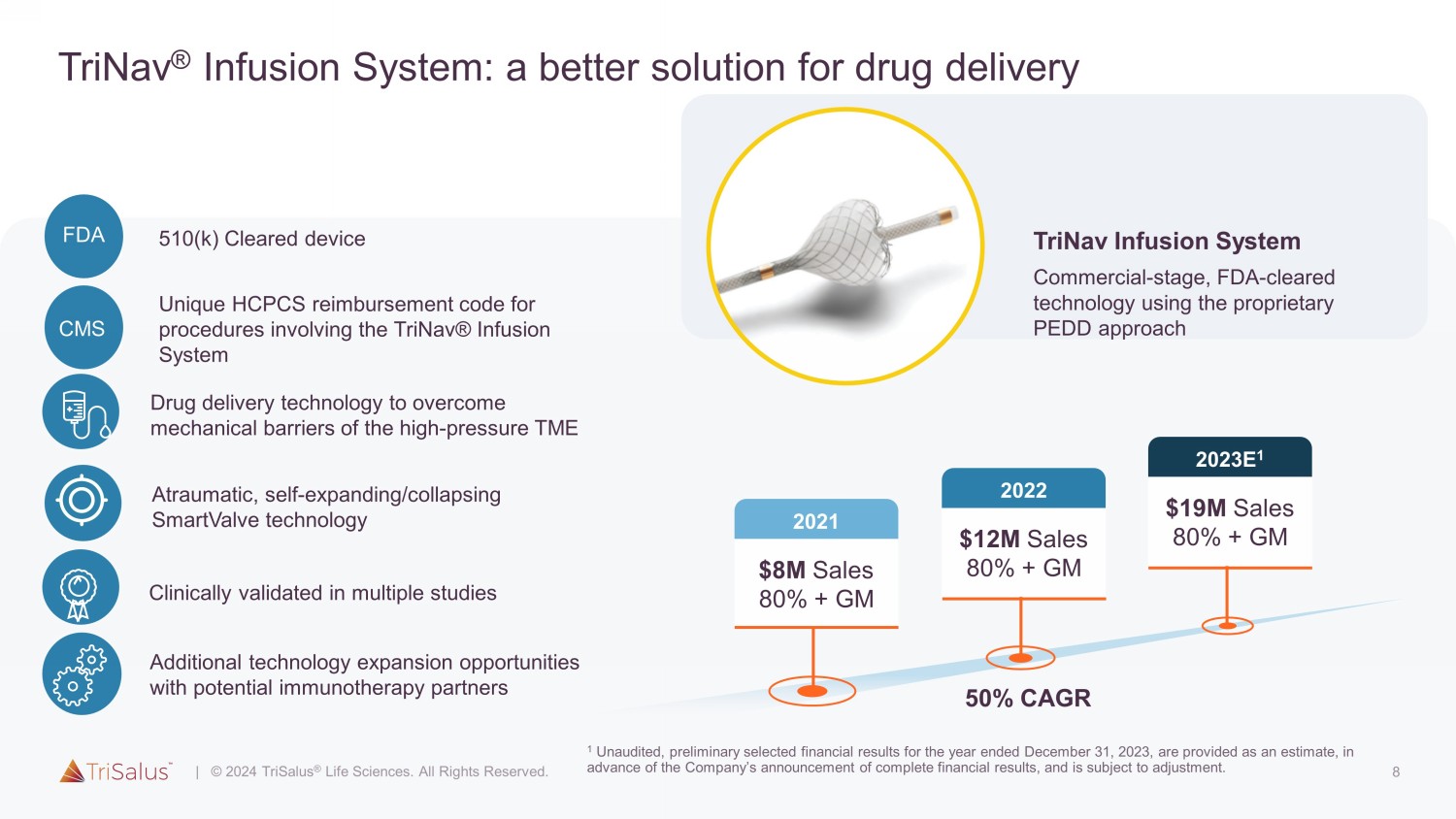
8 TriNav® 输液系统:更好的药物输送解决方案与潜在的免疫疗法合作伙伴有更多技术扩展机会经多项研究的临床验证无创伤、自膨胀/崩溃 SmartValve 技术 SmartValve 技术克服高压机械屏障 TME 510 (k) 批准的设备 FDA TriNav 输液系统商用阶段、FDA 批准的技术使用专有的 PEDD 方法 80% 销售额 80% + GM 2021 50% 复合年增长率 $120 M 销售额 80% + GM 2022年 1900 万美元销售额 80% + GM 2023E 1 Unique HCPCS涉及 TriNav® 输液系统 CMS 的手术的报销代码
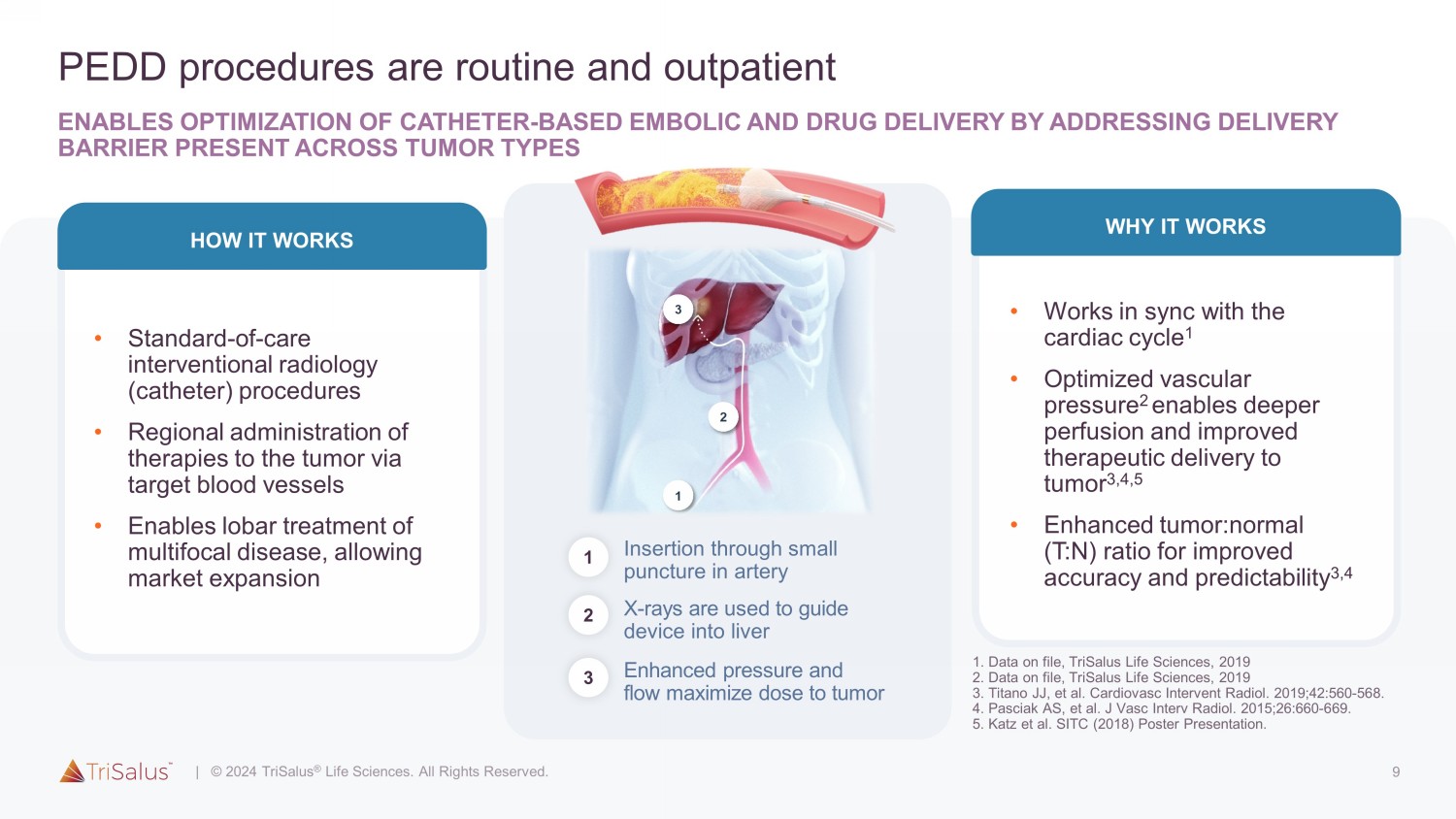
9 PEDD 手术是常规手术,门诊患者可通过解决肿瘤类型中存在的递送障碍,优化基于导管的栓塞和药物输送 • 标准护理介入放射学(导管)手术 • 通过靶血管对肿瘤进行区域治疗 • 支持多灶性疾病的肺叶治疗,从而扩大市场运作方式 • 与心脏周期 1 同步 • 优化血管压力 2 可深度灌注,改善治疗输送肿瘤 3,4,5 • 增强型肿瘤:正常(T: N)比率可提高准确性和可预测性 3,4 它起作用的原因增强的压力和流量最大化肿瘤剂量 3 X 射线用于引导设备进入肝脏 2 通过小穿刺插入动脉 1
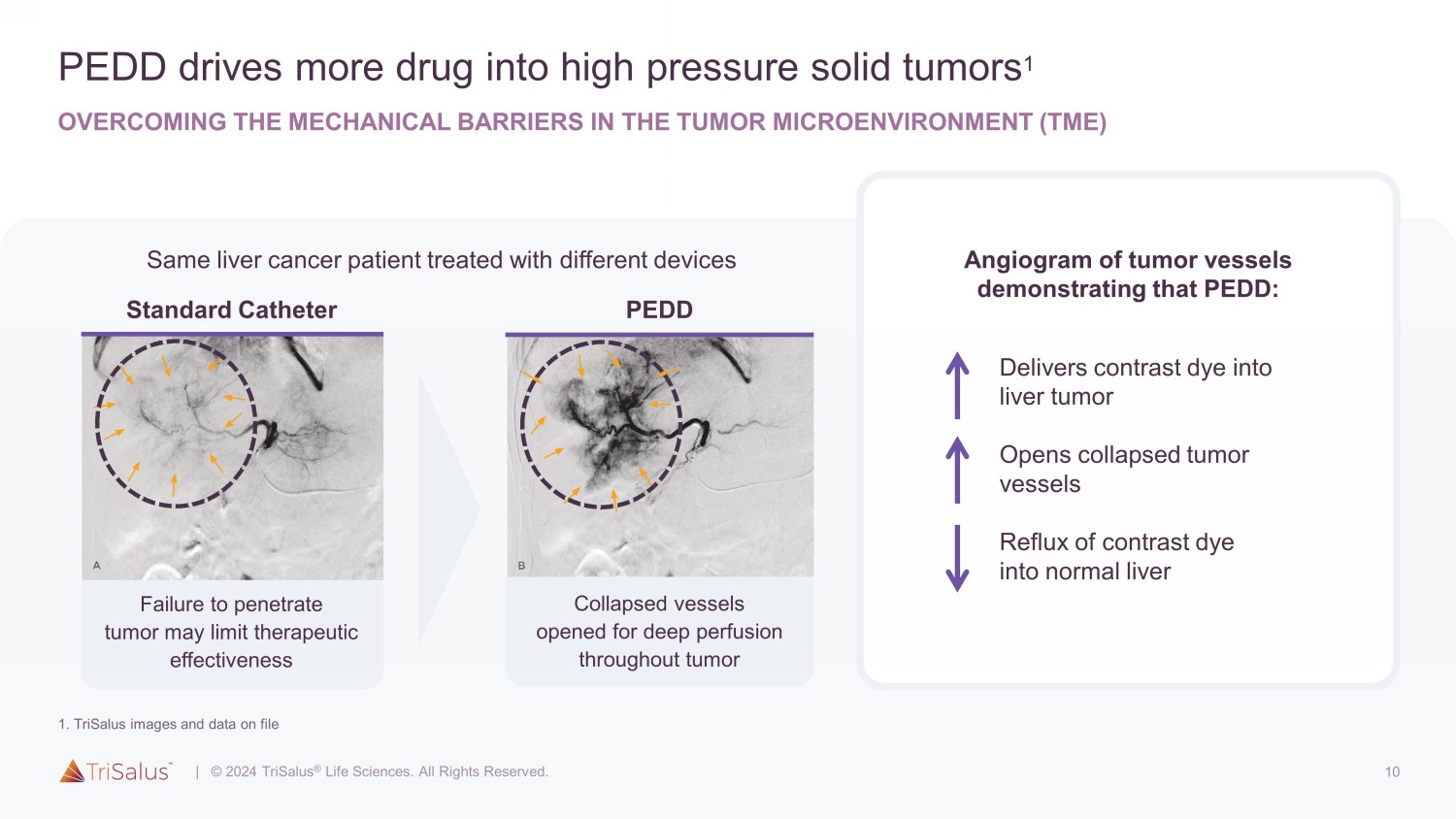
10 PEDD 推动更多药物进入高压实体瘤 1 克服肿瘤微环境 (TME) 肿瘤血管血管造影中的机械屏障,证明 PEDD:向肝肿瘤输送造影剂打开塌陷的肿瘤血管对比剂回流到正常肝脏必然会增加输液期间的压力,克服肿瘤压力 6 PEDD 标准端孔导管 (EH) Surefire 在输液期间增加压力,克服肿瘤压力 6 PEDD 标准导管失效穿透肿瘤可能会限制治疗功效 PEDD Surefire 会增加输液期间的压力,克服肿瘤压力 6 PEDD 标准端孔导管 (EH) Surefire 在输液期间增加压力,克服肿瘤压力 6 PeddStandard 导管在整个肿瘤中打开可进行深度灌注的血管收缩使用不同的设备治疗相同的肝癌患者
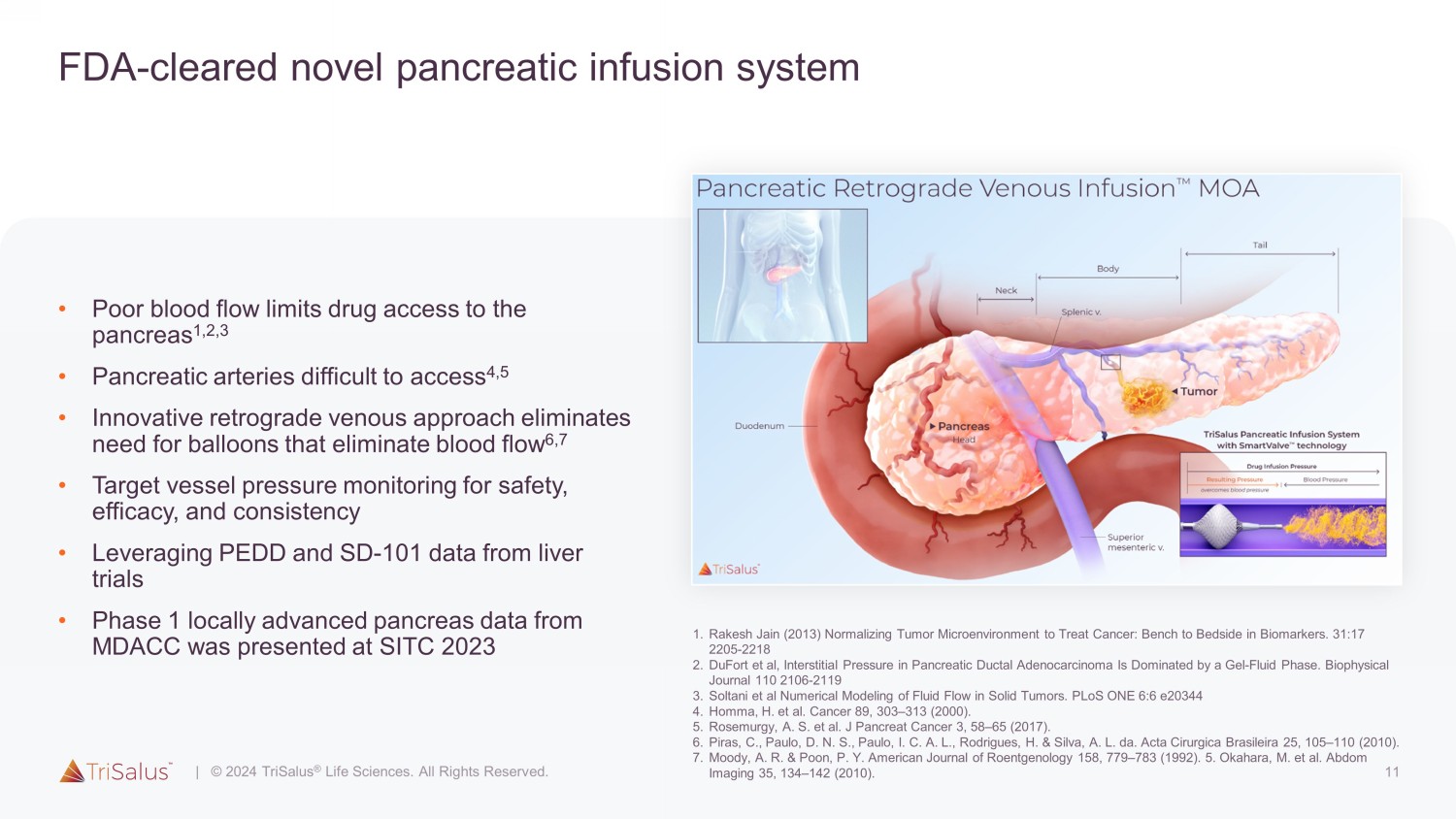
11 美国食品药品管理局——批准的新型胰腺输液系统 • 血流不畅限制了药物进入胰腺 1,2,3 • 胰腺动脉难以进入 4,5 • 创新的逆行静脉方法无需使用可消除血流的气球 6,7 • 目标血管压力监测以确保安全性、有效性和一致性 • 利用 PEDD 和 SD-来自肝脏试验的 101 个数据 • 来自 MDACC 的 1 期局部晚期胰腺数据已在 SITC 上公布 2023

12 临床和临床前数据表明,PEDD 具有利用多种疗法克服机械时间屏障的优势 TriNav 与标准导管 TACE 相比,在肝肿瘤的治疗交付方面 60% ↑ 临床肝脏研究 TARE(Y-90)33%-90% ↑ 肝肿瘤中 MAA 沉积 2 与标准导管临床肝脏研究免疫疗法(SD-101)血清暴露量低的肝组织中的高浓度 97% 的患者 4 小时后血清中无法检测到 3 临床肝脏研究化疗6.7 — 10.1 倍 ↑ 与全身输注相比改善的输液 4 临床前胰腺研究
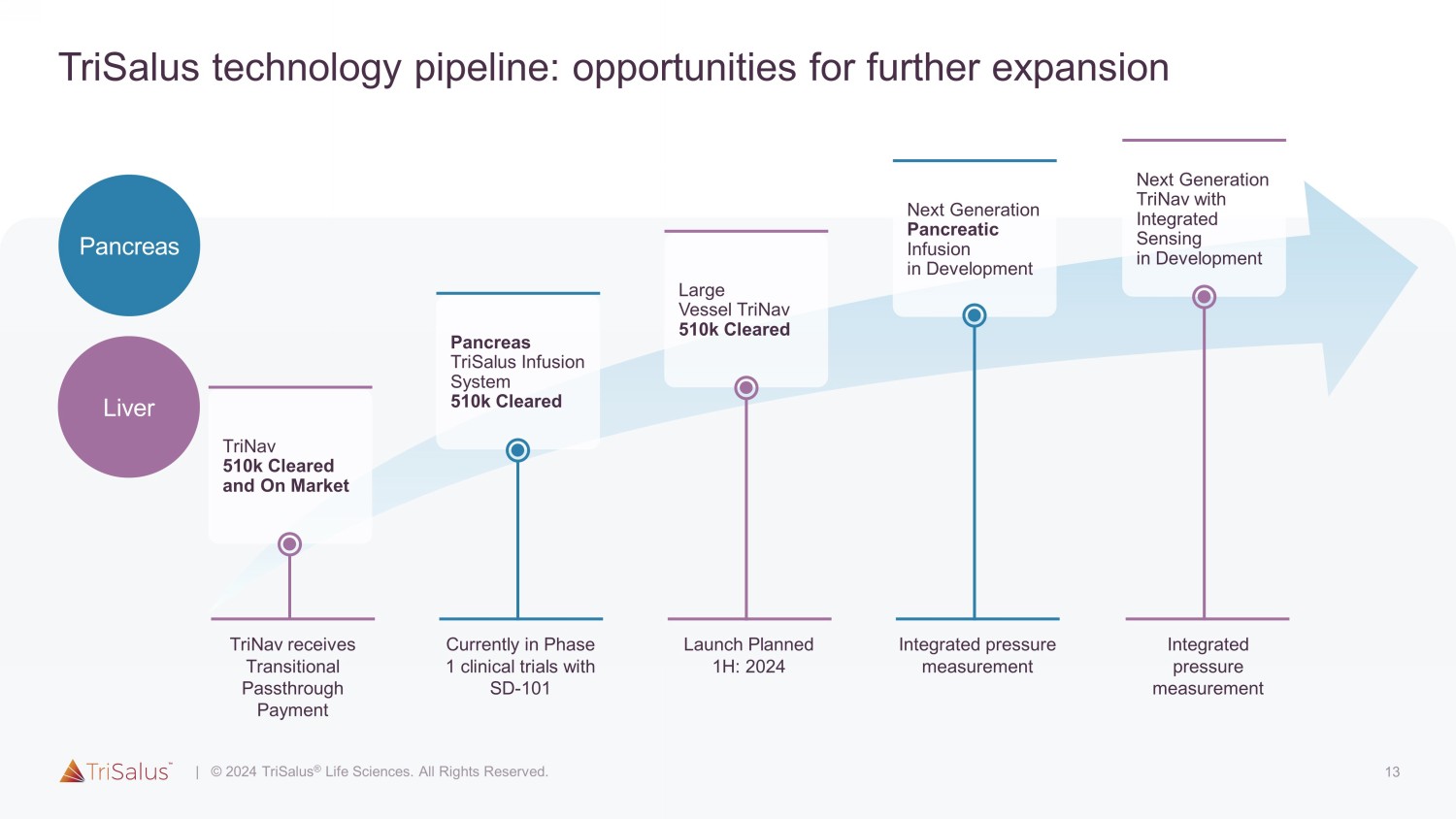
13 TriSalus 技术管道:进一步扩张的机会肝胰腺综合压力测量下一代胰腺输液正在开发中计划于上半年推出:2024 年大型血管 triNav 510k 已获批准目前正处于 SD-101 胰腺的 1 期临床试验 TriSalus 输液系统 510k 已获批准 TriNav 510k 已获批准和上市集成压力测量的下一代 TriNav 具有集成传感功能的下一代 TriNav 发展

14 14 SD-101:C 类 TLR9 激动剂第 2 部分克服肝脏和胰腺肿瘤中的生物屏障
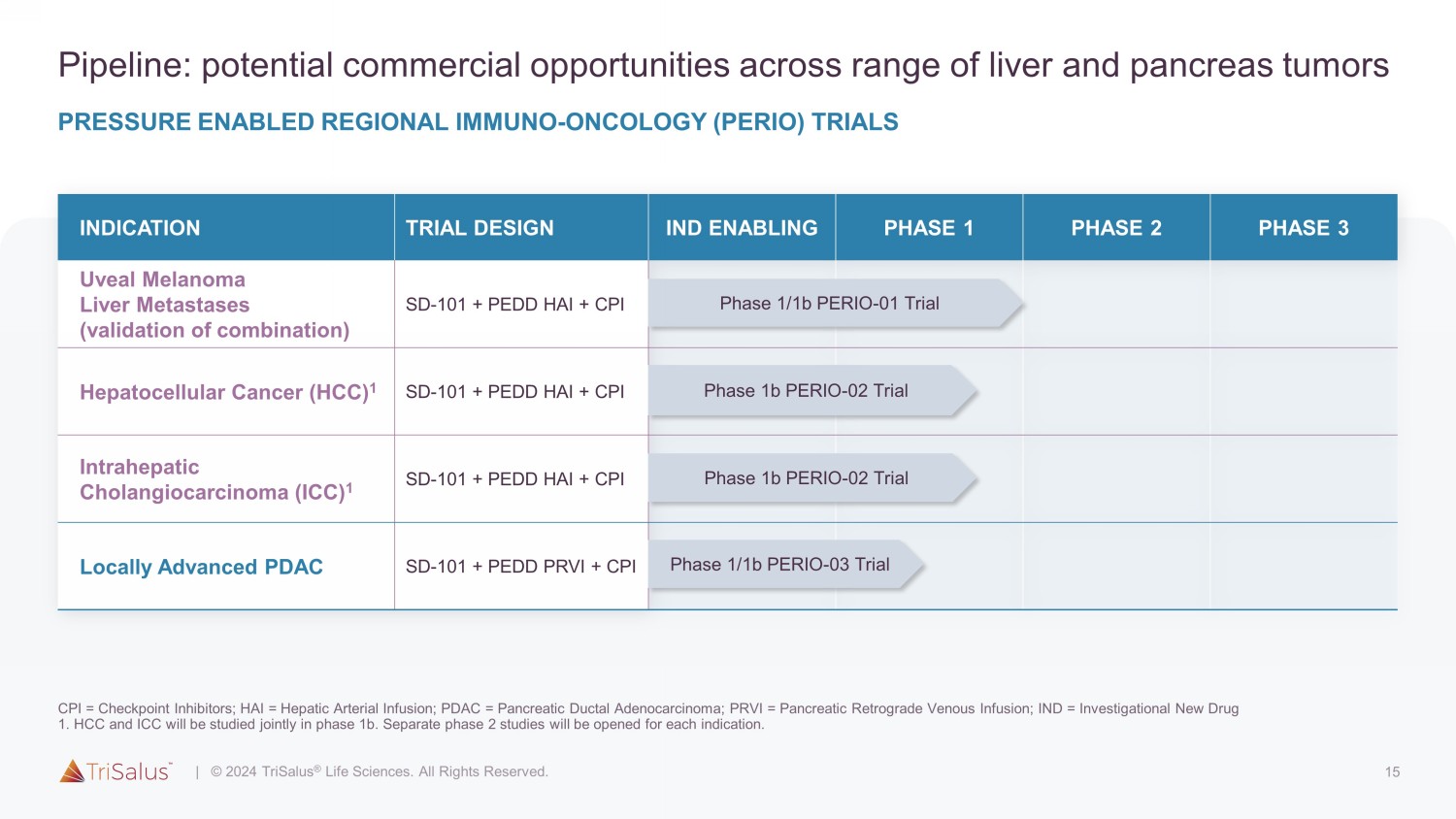
15 个管道:一系列肝脏和胰腺肿瘤适应症的潜在商业机会试验设计 IND 启用第 1 阶段 2 期 3 期葡萄膜黑色素瘤肝转移(组合验证)SD-101 + PEDD HAI + CPI 肝细胞癌 (HCC) 1 SD-101 + PEDD HAI + CPI 肝内胆管癌 (ICC) 1 SD-101 + PEDD HAI + CPI 局部晚期 PDAC SD-101 + PEDD PRVI + CPI 1/1b 阶段 PERIO-01 试验 1b 阶段 PERIO-02 试验 1b 阶段 PERIO-02 试验 1/1b 阶段 PERIO-02 试验 1/1b 阶段-03 试验压力启用区域免疫肿瘤学 (PERIO)审判

16 项临床试验利用已确立的 SD 生物学-101 入组标准 • 肝脏或胰腺的主要疾病部位 • 标准治疗失败或拒绝 • 表现良好试验设计 • 单独使用 SD-101/PEDD + IV 检查点的队列 • 红外套件终点中六次门诊 SD-101 次输液 • 安全性和剂量确定 • 疗效 — 自由生存 • ctDNA — 总体相关性强存活率 1,2,3 • 免疫分析确认 MoA PEDD 支持区域免疫——肿瘤学(PERIO)研究
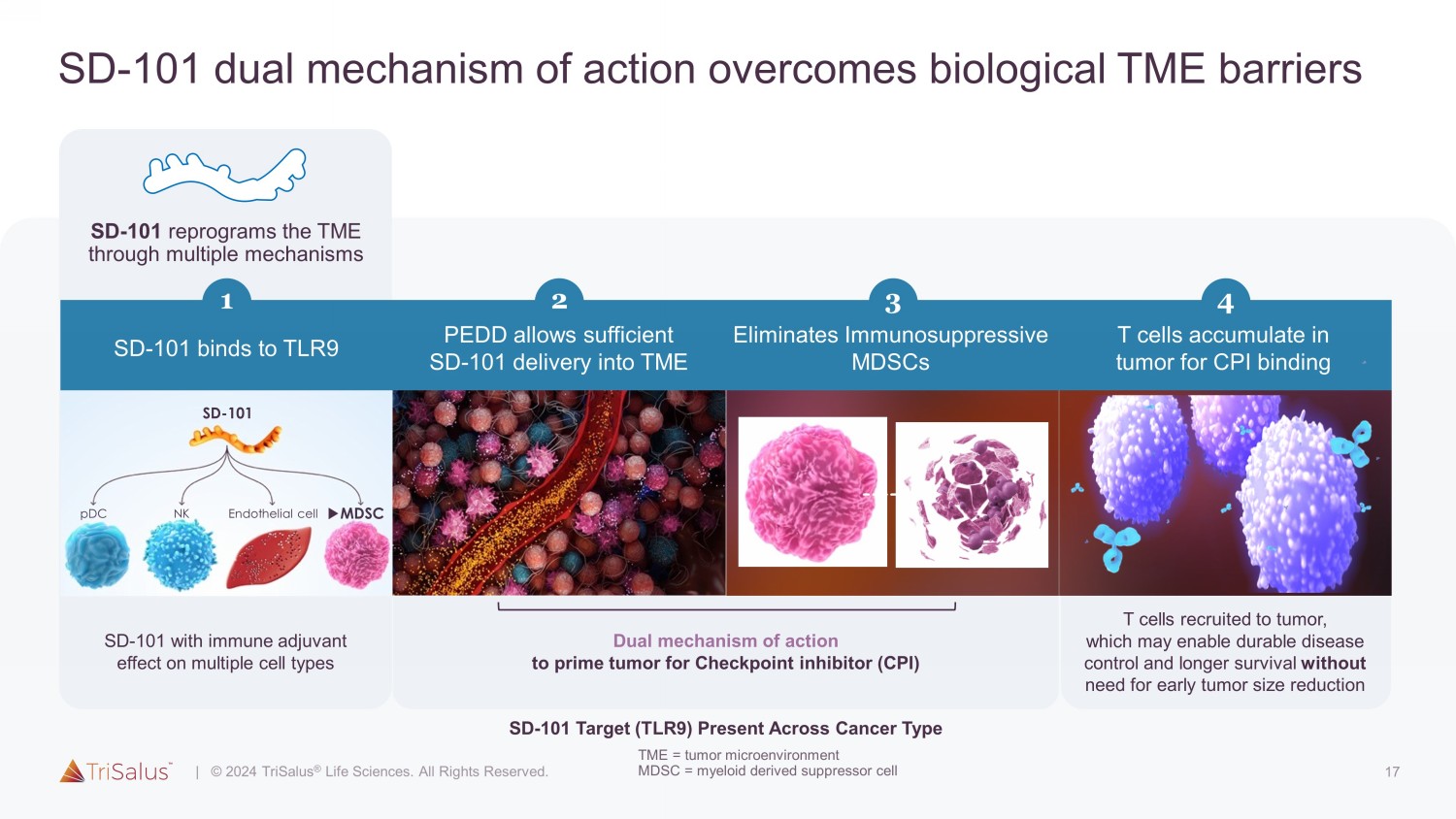
17 SD-101 双重作用机制克服了生物学 TME 屏障 SD-101 与 TLR9 结合 MDSC SD-101 内皮细胞 3 NK pdC 可消除免疫抑制性 MDSC 1 2 PEDD 允许足够的 SD-101 输送到 TME SD-101 对多种细胞类型具有免疫辅助作用的双重作用机制检查点抑制剂 (CPI) SD-101 靶标 (T LR9) 在癌症中,4型T细胞被招募到肿瘤中,这可以实现持久的疾病控制和更长的存活时间,而无需早期缩小肿瘤大小,T细胞会积聚在肿瘤中对于 CPI 绑定 SD-101 通过多种机制对 TME 进行重新编程

18 临床证据-概念上的双重MOA有可能增强TME和系统无反应的 “冷” 肿瘤中的检查点活性 pre-SD-101 靶器官和系统反应性 “热” 肿瘤后的CPI效应增强-SD-101 PEDD + SD-101 MDSC积累 T细胞缺乏免疫疗法失败全身性免疫刺激,疾病控制下ctDNA的下降和自由生存进展的早期证据证明了这一点 2 MDSC 耗竭 T 细胞浸润增强 CPI 活性 PEDD 解锁了肝脏和肝脏中的双重作用机制胰腺 1.

19 SD-101 与既定药物作用机制一致的临床数据SD-101可缓解TME中的免疫抑制,在没有比成像(RECIST ORR)更准确的存活预测指标的可靠RECIST ORR液体活检(ctDNA水平)的情况下,可能产生PFS/OS益处 1,2,3 SD-101的最佳剂量确定应由药物的生物学效应而不是MTD/DLT 1驱动。由临床前模型和已知的作用机制(MoA)预测的最佳剂量范围,该方法与美国食品药品管理局的Optimus项目一致,后者支持基于最佳生物剂量(基于OBD)的决策•适应非线性剂量效应 2.用于确认 SD-101 moA 的免疫标志物和液体活检 (ctDNA) 是基于传统扫描的 RECIST ORR 评估不太可靠(当免疫细胞浸润扭曲肿瘤大小时)• 当成像不可靠时,血液中的 ctDNA 水平被证明可以高度预测 PFS 和操作系统 1,2,3

20 SD-101 与其他 TLR9 激动剂 PEDD 使能作用机制 (MOA) 截然不同,它与肝脏和胰腺生物学 MDSC(骨髓衍生抑制细胞 1)一致。Trisalus 未出版 2.Ghosh SITC 2022 3.Ghosh 癌症基因疗法 2022 4.Montazeri ASCO 2023 5.与肝转移模型中的A类或B类TLR9相比,Patel SITC 2023 SD-101诱导的基因表达变化明显更大 1,免疫抑制剂MDSC 2 1也会消耗。激活的 STAT3 可促进肝脏 MDSC 的扩张、存活和功能 2。MDSC(TME 中的关键免疫抑制细胞)表达 TLR9 3。由 SD-101 触发的 TLR9 信号传导可失活 STAT3 • 肝转移模型 3 中可见肝脏 MDSC 消耗和 CPI 效应增强 • 第 1 阶段出现的 MDSC 耗竭(缓解 TME 免疫抑制)• 由临床前模型预测并得到第 1 阶段数据的支持的 Dual MoA 4、5 基于所需免疫效果的最佳剂量选择
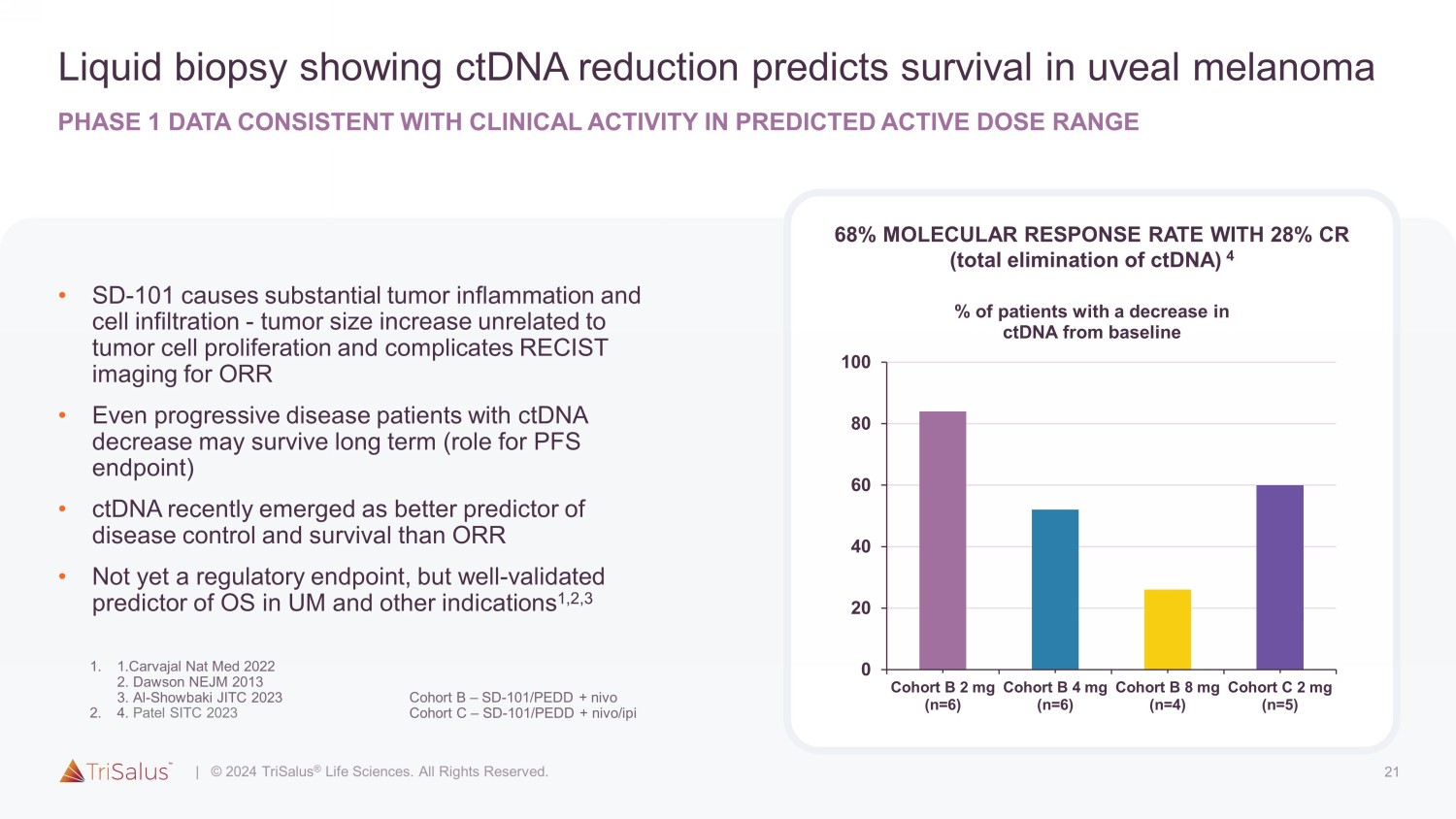
21 液体活检显示 ctDNA 减少可预测葡萄膜黑色素瘤的存活率 1 期数据与预测活性剂量范围内的临床活性一致 • SD-101 会导致严重的肿瘤炎症和细胞浸润-肿瘤大小增加与肿瘤细胞增殖无关,并使 ORR 的 RECIST 成像复杂化 • 即使是 ctDNA 减少的进展性疾病患者也可以长期存活(作为 PFS 终点的作用)• ctDNA 最近成为比 ORR 更好的疾病控制和存活预测指标 • 尚未成为监管终点,但已得到充分验证UM 和其他适应症中操作系统的预测因子 1,2,3 Patel SITC 2023 分子反应率为 68%,CR 28%(完全消除 ctDNA)4 0 20 40 60 80 100 队列 B 2 mg (n=6) 队列 B 4 mg (n=6) 队列 B 8 mg (n=4) 队列 C 2 mg (n=5) ctDNA 较基线减少的患者百分比
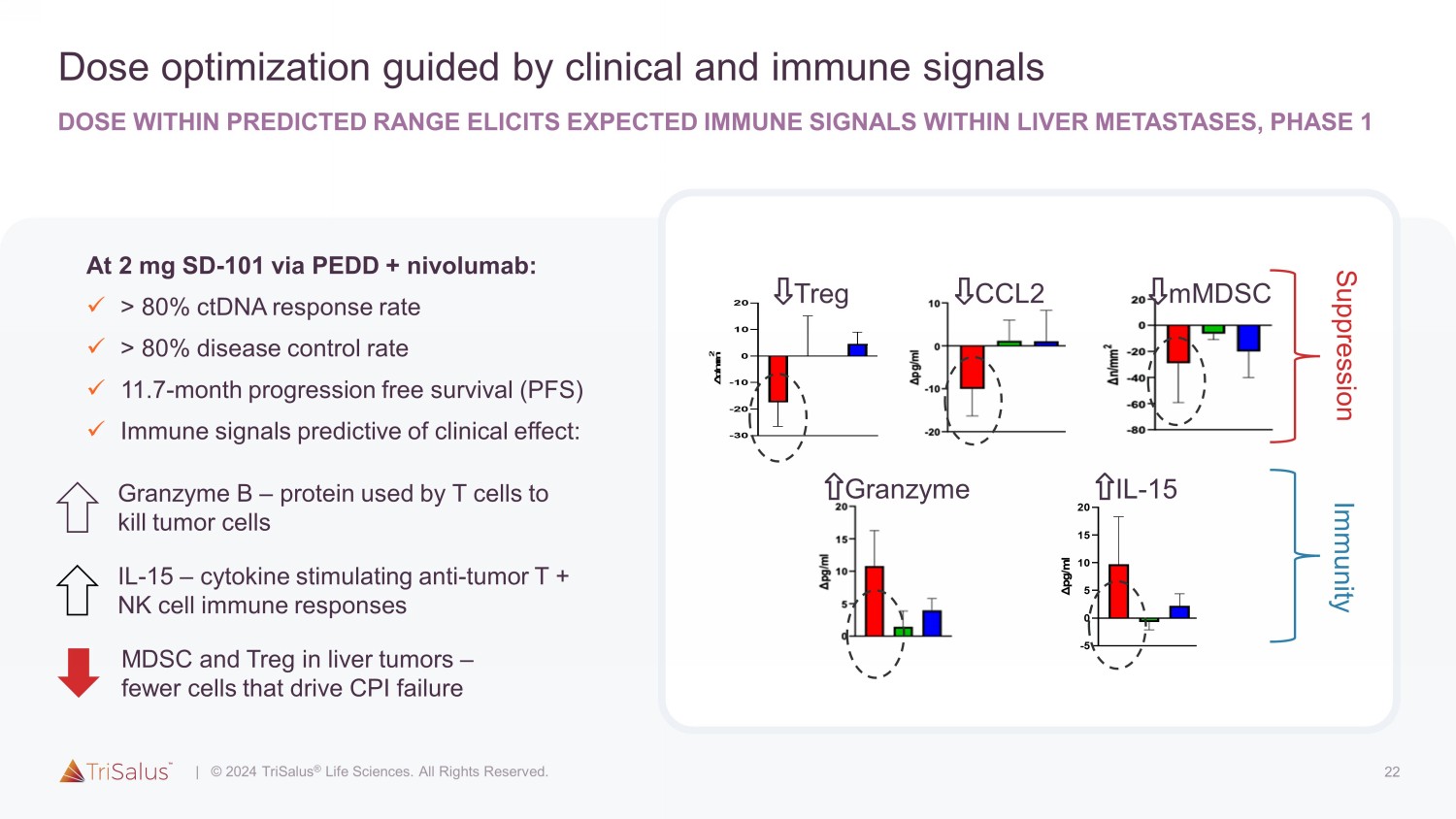
22 以临床和免疫信号为指导的剂量优化剂量在预测范围内的剂量在肝转移中引发预期的免疫信号,第一阶段 2 mg SD-101 通过 PEDD + nivolumab:x > 80% ctDNA 反应率 x > 80% 疾病控制率 x 11.7 个月无进展存活率 (PFS) x 临床效果预测的免疫信号:-30 -20 -10 0 10 20 PERIO1:Tregs 变化(第 1 天-57) △ n/m m 2 SD-101 8mg (n=4) SD-101 2mg (n=6) SD-101 4mg (n=5) ¹ 4mg (n=5) † Treg ¹ CCL2 ¹ mmdSC Granzyme IL-15 免疫抑制 Granzyme B — T 细胞用来杀死的蛋白质肿瘤细胞 IL-15 — 细胞因子刺激抗肿瘤 T + NK 细胞免疫反应 MDSC 和 Treg 肝肿瘤中的 Treg — 导致 CPI 失败的细胞较少
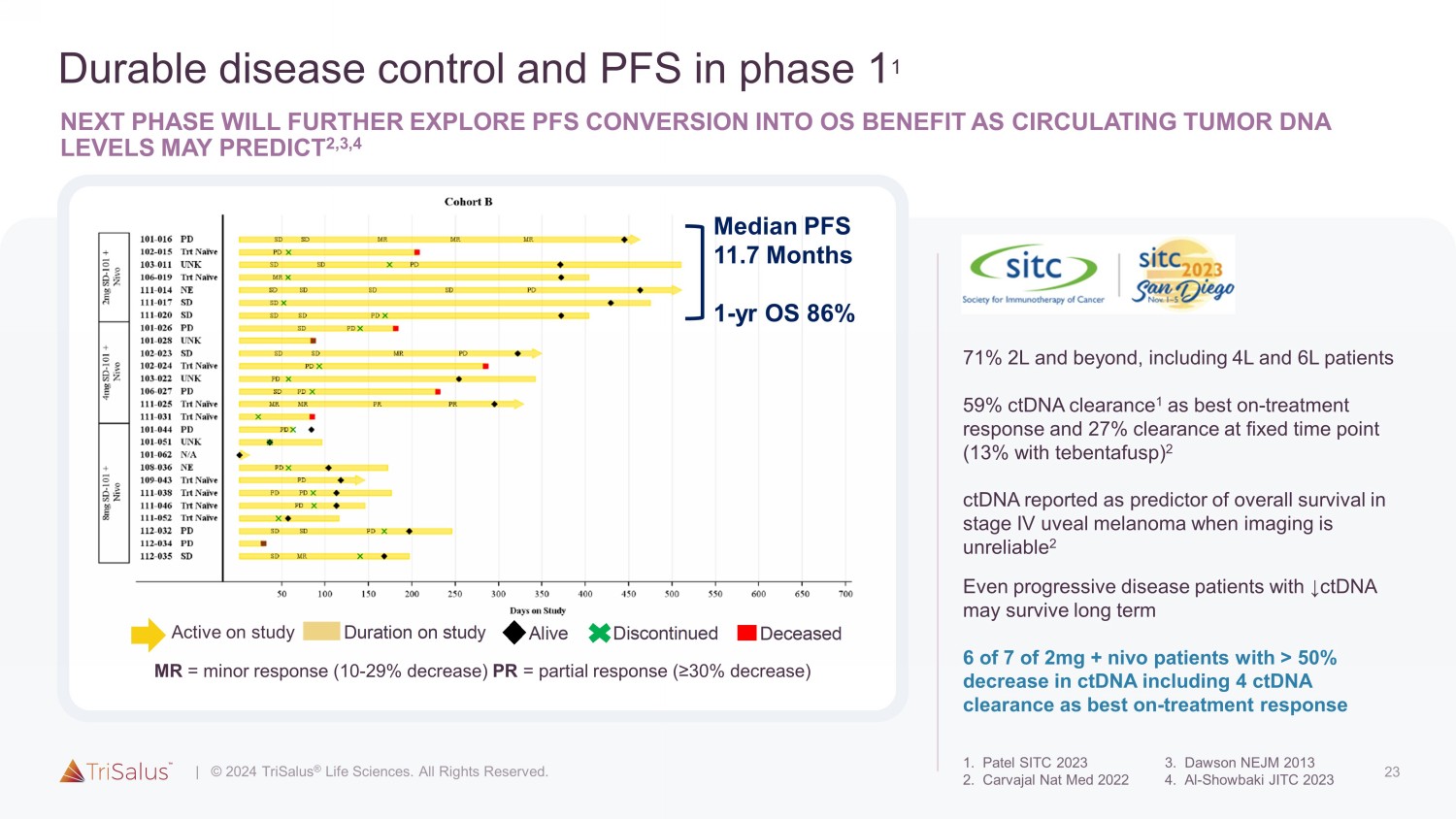
23 持久的疾病控制和 PFS 处于第 1 阶段下一阶段将进一步探索 PFS 转化为操作系统益处 A S 循环肿瘤 DNA 水平可能预测 2,3,4 71% 2L 及以上,包括 4L 和 6L 患者 59% ctDNA 清除率 1 为治疗反应最佳,固定时间点清除率为 27%(tebentafusp 为 13%)2 ctDNA 被报告为第四期葡萄膜黑色素总体存活率的预测指标影像学不可靠时出现肿瘤 2 即使是 ↓ ctDNA 的进展性疾病患者在 2mg + nivo 患者中 7 人中有 6 人也能长期存活,其中 ctDNA 下降超过 50%,包括 4ctDNA 清除率最佳-治疗反应活体死亡中止研究时长 MR = 轻微反应(降低 10-29%)PR = 部分反应(降低 ≥ 30%)活跃研究中位数 PFS 11.7 个月 1 年操作系统 86%
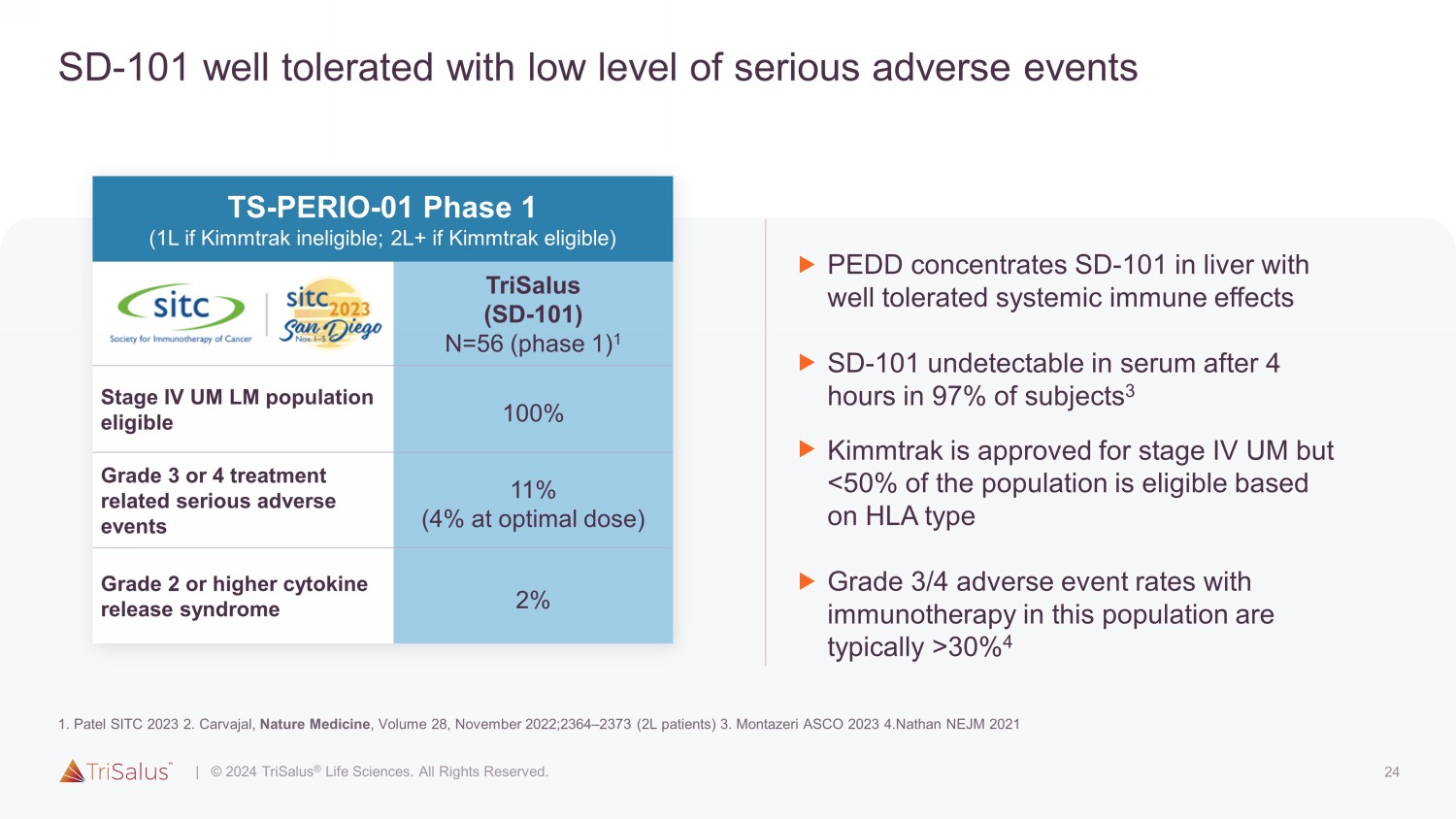
24 SD-101 耐受性良好,严重不良事件水平低 TS-PERIO-01 第 1 阶段(如果 Kimmtrak 不符合资格,则为 1L;如果符合 Kimmtrak 资格,则为 2L+)Trisalus(SD-101)N=56(第 1 阶段)1 IV 期 UM LM 人群符合条件 100% 3 或 4 级治疗相关的严重不良事件 11%(最佳剂量为 4%)2 级或更高细胞因子释放综合征 PE2% DD 将 SD-101 浓缩在肝脏中,具有良好的耐受性全身免疫作用 97% 的受试者 4 小时后血清中无法检测到 SD-101 3 Kimmtrak 获准进入第四阶段 UM 但是 30% 4
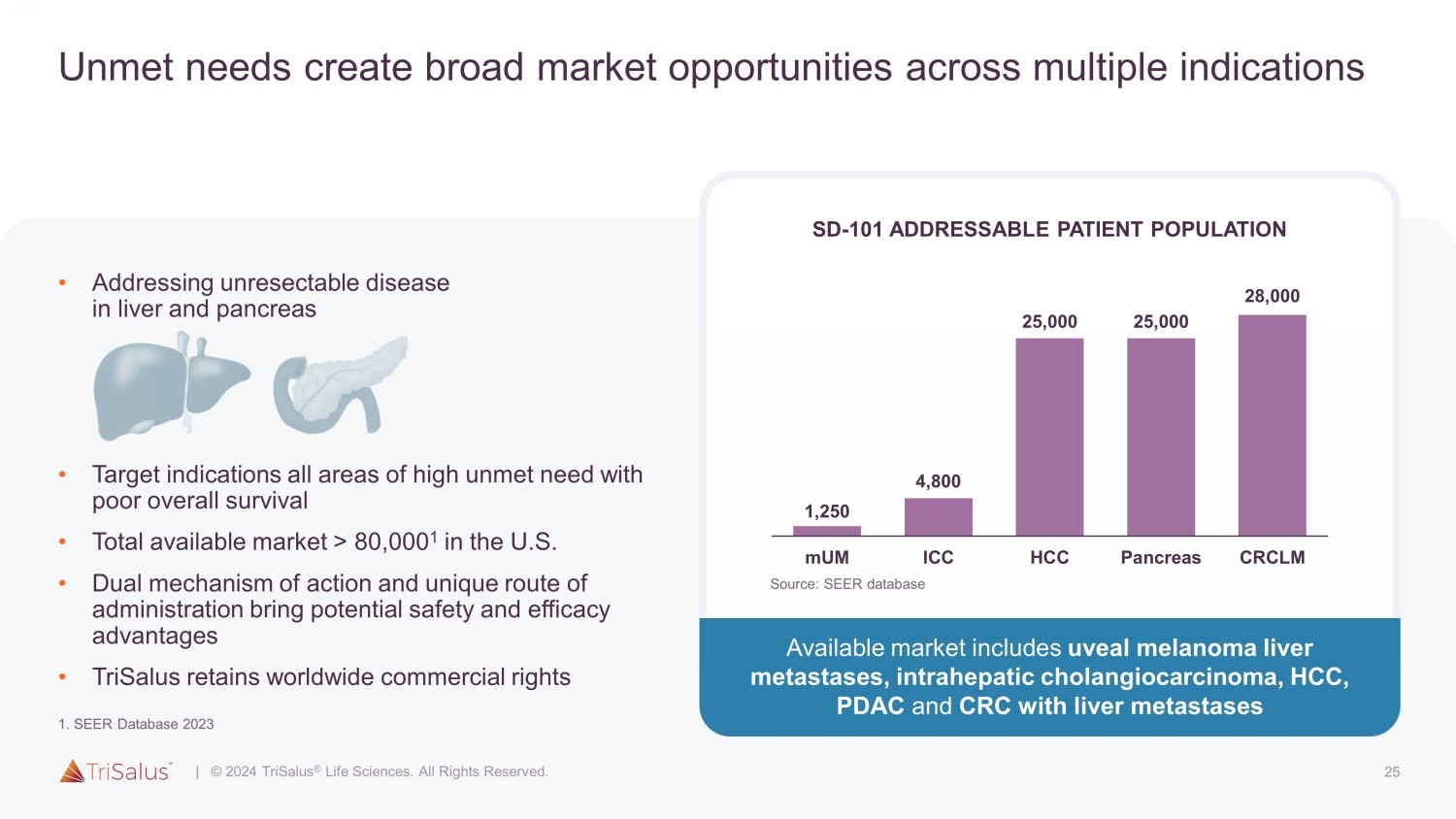
25 未满足的需求为多种适应症创造了广阔的市场机会 • 解决肝脏和胰腺中不可切除的疾病 • 靶向所有需求高且总体存活率低的领域 • 美国的总可用市场 > 80,000 1 • 双重作用机制和独特的给药途径带来潜在的安全性和有效性优势 • TriSalus 保留全球商业权利 SD-101 可解决的患者群体 1,250 4,800 25,000 25,000 28,000 muM ICC HCC 胰腺癌 CRCLM 现有市场包括葡萄膜黑色素瘤肝脏转移、肝内胆管癌、HCC、PDAC 和伴有肝转移的结直肠癌
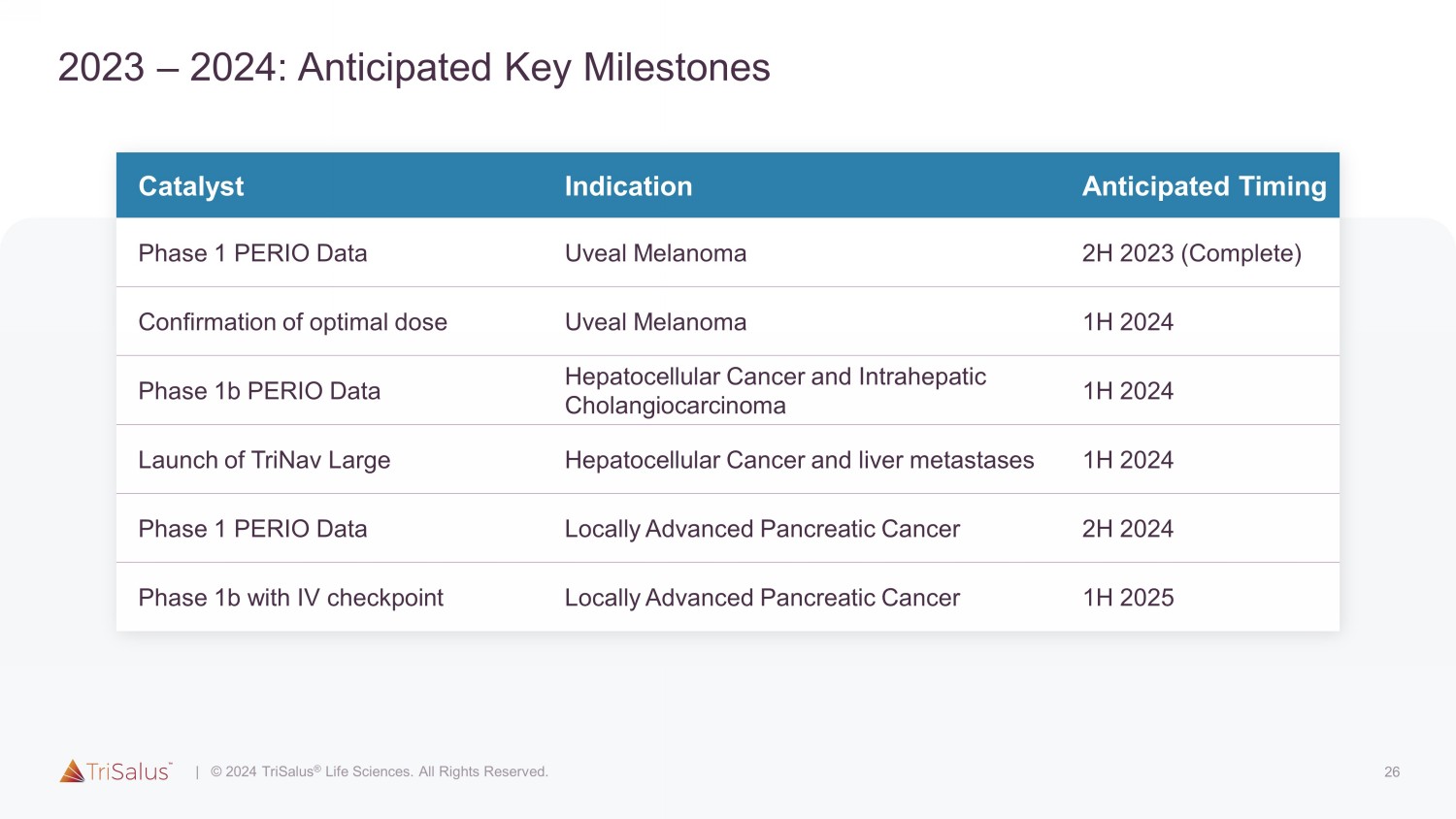
2023 — 2024 年 26 日:预期关键里程碑催化剂指标预计时间第 1 阶段 PERIO 数据 2023 年下半年(完成)确认最佳剂量葡萄膜黑色素瘤 2024 年 1H 第 1b 期 PERIO 数据肝细胞癌和肝内胆管癌 2024 年上半年 TriNav 大型肝细胞癌和肝转移 2024 年 1H 1 期 PERIO 数据局部晚期胰腺 2024 年下半年有 IV 检查点的 1b 期局部晚期胰腺癌 2025 年上半年

27 执行团队 Jodi Devlin 总裁、Therapeutics Mary Szela 首席执行官兼总裁肖恩·墨菲首席财务官史蒂芬·卡茨医学博士、FACS 首席医学官、SAB 主席詹妮弗·史蒂文斯首席监管官布莱恩·考克斯、博士研究主管理查德·马沙克、VMD 业务发展和战略高级副总裁 Jim Young 投资者关系高级副总裁兼财务主管

28 截至2023年9月30日的资本结构和流动性股票上市——当前TLSI(纳斯达克)普通股流通股2630万股已发行优先股已发行40万股认股权证未偿还1430万美元现金和现金等价物2140万美元债务 0美元

29 `克服实体瘤治疗中的关键机械和生物学瓶颈商业医疗技术业务实现持续增长和潜在上升空间整合独特的设备和治疗方法以克服肝脏和胰腺肿瘤药物输送的关键挑战牵头项目:SD-101,TLR9激动剂:1期数据为机制和耐受性良好的安全性概况提供概念验证多种价值——创造机会(临床数据、销售增长和新产品推出)预计将于未来18个月与克服肿瘤微环境(TME)中的机械和生物屏障相关的所有知识产权的全球独家版权1
30 Argot Partners 纽约第三大道 767 号,34 楼,纽约州纽约 10017 212.600.1902 trisalus@argotpartners.com | © 2024 TriSalus® 生命科学。版权所有。
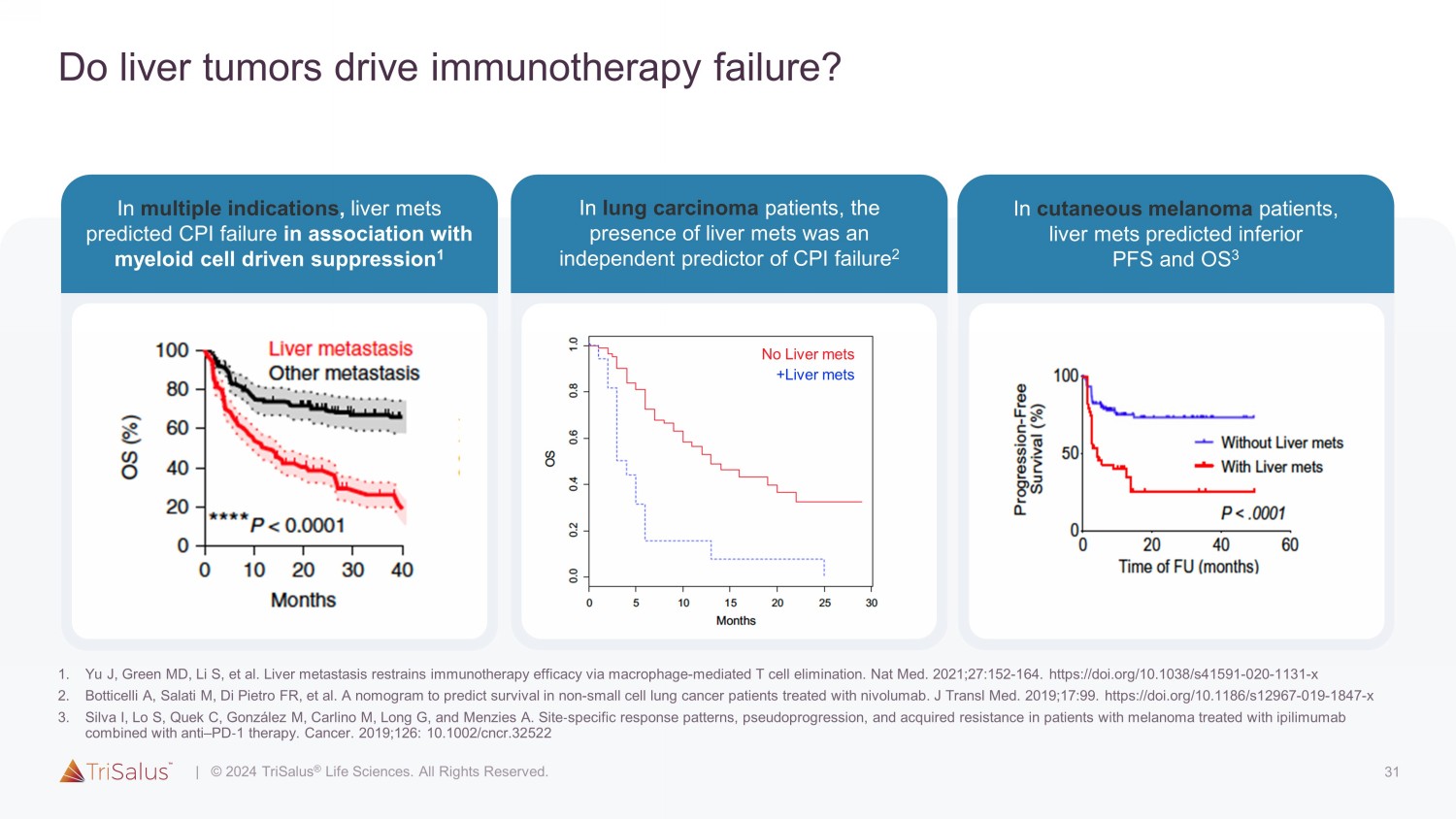
31 肝肿瘤会导致免疫疗法失败吗?在多种适应症中,肝脏与骨髓细胞驱动的抑制相关的预计 CPI 失效 1 在皮肤黑色素瘤患者中,肝脏会预测低下 PFS 和 OS 3 在肺癌患者中,肝脏代谢的存在是 CPI 失效的独立预测指标 2 +肝脏不会
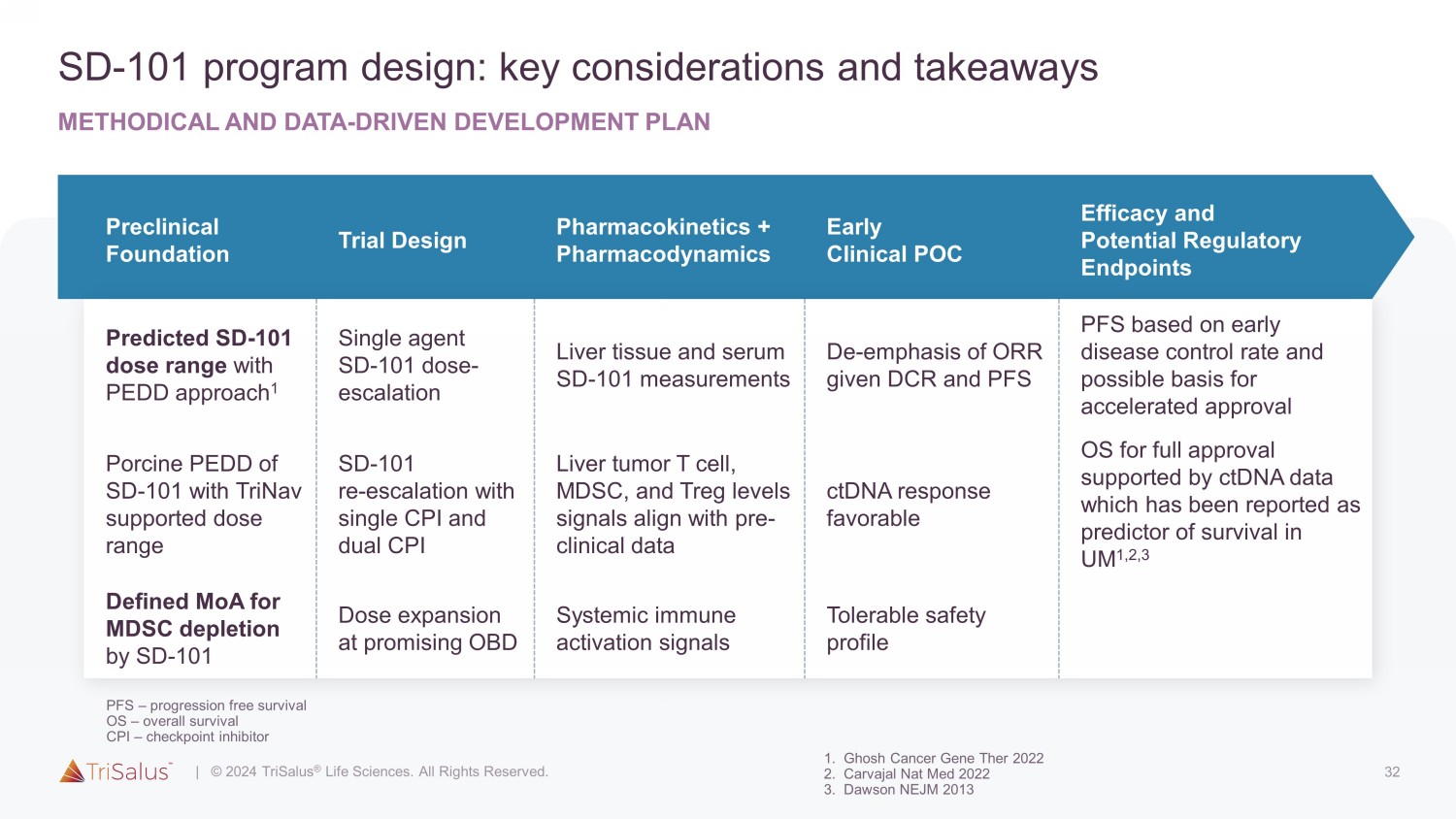
32 SD-101 项目设计:关键考虑因素和总结方法和数据驱动的开发计划临床前基础试验设计药代动力学 + 药效学 PEDD 方法的早期临床 POC 疗效和潜在的监管终点预测 SD-101 剂量范围 1 单剂 SD-101 剂量-递增肝组织和血清 SD-101 次测量 DCR 和 PFS PFS 根据早期疾病控制率和可能的加速依据批准 SD-101 的 Porcine PEDD,支持 TriNav 的剂量范围 SD-101 re-单一 CPI 和双 CPI 水平升高肝脏肿瘤 T 细胞、MDSC 和 Treg 水平信号与临床前数据一致 ctDNA 反应有利于获得全面批准的操作系统 ctDNA 数据支持,该数据被报道为 UM 1,2,3 中存活率的预测指标由 SD 定义 MoA-101 剂量扩大 OBD 系统免疫激活信号可容忍的安全性
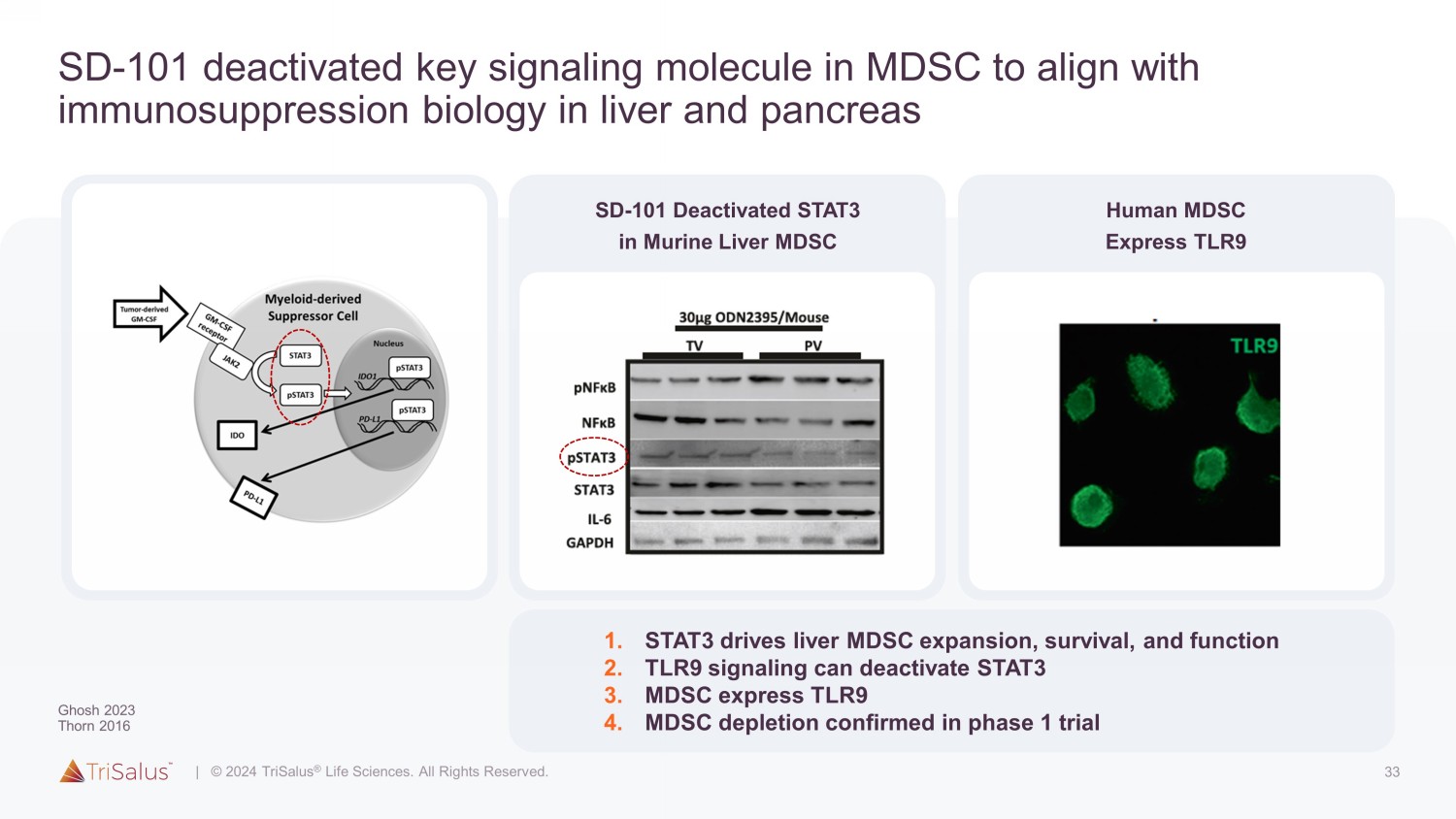
33 SD-101 在 MDSC 中失活的关键信号分子以符合肝脏和胰腺中的免疫抑制生物学 SD-101 在小鼠肝脏中失活 STAT3 MDSC 人类 MDSC Express TLR9 1。STAT3 可促进肝脏 MDSC 的扩张、存活和功能 2。TLR9 信令可以停用 STAT3 3。MDSC 快递 TLR9 4.MDSC 消耗已在 1 期试验中得到证实
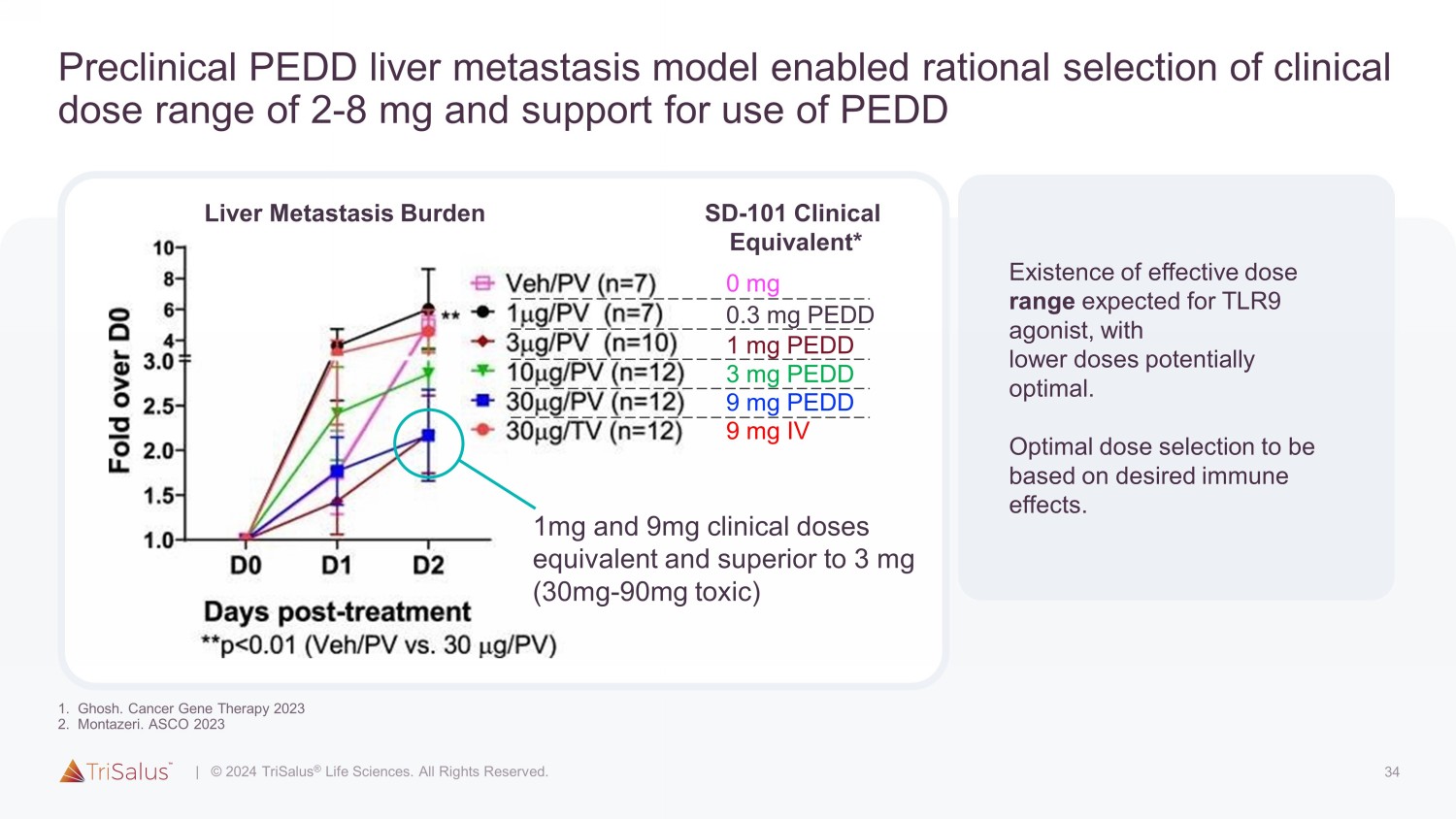
34 临床前PEDD肝转移模型允许合理选择2-8 mg的临床剂量范围,并支持使用PEDD TLR9激动剂预计存在有效剂量范围,较低的剂量可能是最佳剂量范围。最佳剂量选择应基于所需的免疫效果。肝转移负担 SD-101 临床当量* 0 mg 0.3 mg PEDD 1 mg PEDD 3 mg PEDD 9 mg PEDD 9 mg IV 1mg 和 9mg 临床剂量等效且优于 3 mg(30mg-90 mg 毒性)
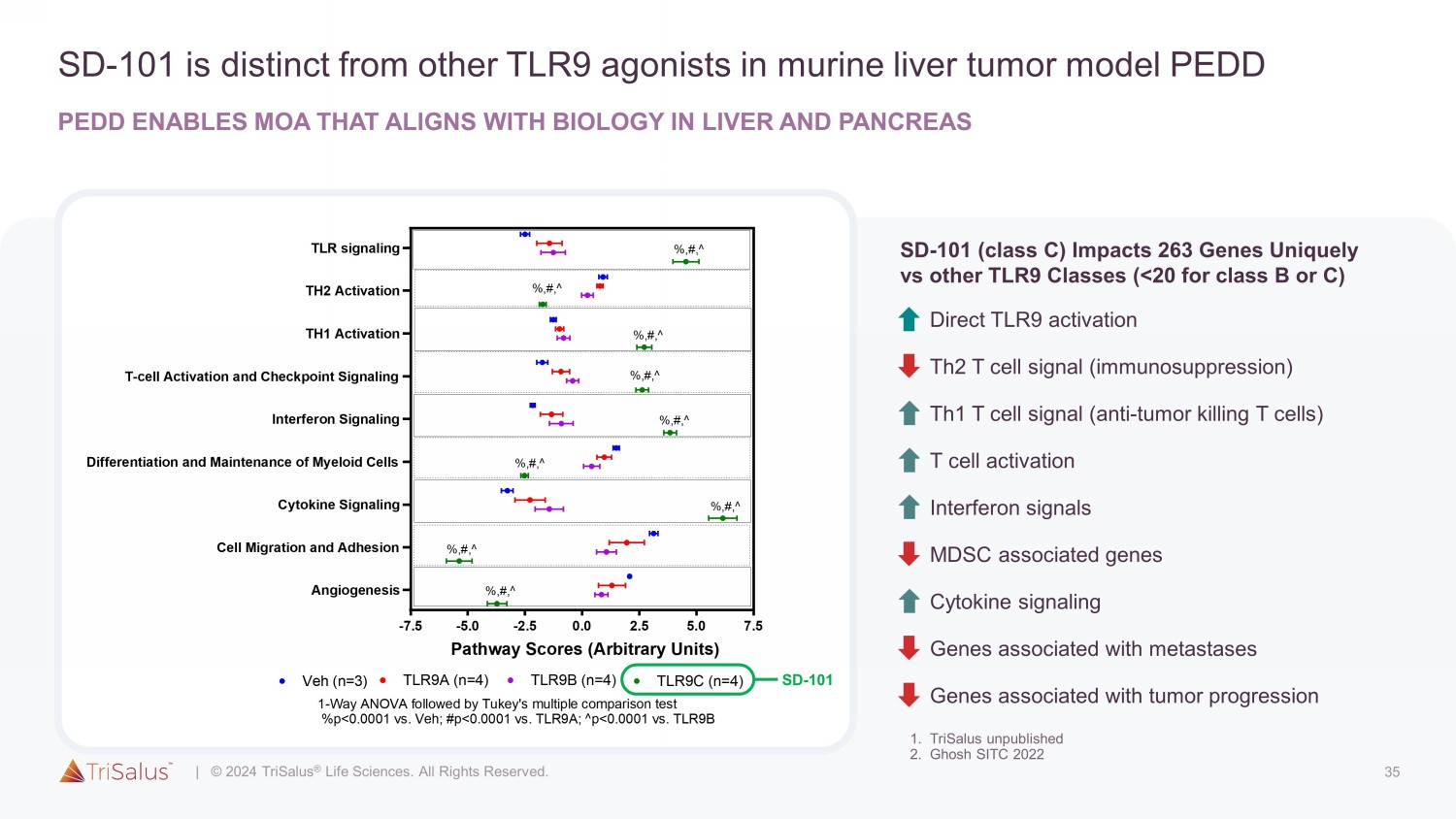
35 SD-101 不同于小鼠肝肿瘤模型中的其他 TLR9 激动剂 PEDD PEDD 可实现符合肝脏和胰腺生物学的 MOA -7.5 -5.0 -2.5 0.0 2.5 5.0 7.5 血管生成细胞迁移和粘附细胞因子信号分化和维持髓系细胞干扰素信号 T 细胞激活和检查点信号 TH1 激活 TH2 激活 TLR 信号 Veh (n=3)) TLR9B (n=4) TLR9C (n=4) TLR9A (n=4) 路径分数(任意单位)%、#、^%、#、^%、#、^%、#、^%、#、^%、#、^%、#、^%、#、^ 1 向方差分析,然后是 Tukey 倍数比较测试 %p