
摩根大通医疗保健会议 2024 年 1 月 8 日 1 丹·奥康奈尔,首席执行官

前瞻性陈述 2 本演示文稿包含1995年《私人证券诉讼改革法》所指的前瞻性陈述。任何描述Acumen的目标、预期、财务或其他预测、意图或信念的陈述均为前瞻性陈述,应被视为风险陈述。诸如 “相信”、“期望”、“预期”、“可能”、“将”、“寻求”、“目标”、“计划”、“潜力”、“将” 等词语以及类似的表述旨在识别前瞻性陈述,尽管并非所有前瞻性陈述都包含这些识别词。前瞻性陈述包括有关Acumen业务的陈述,以及Acumen实现其战略和财务目标的能力,包括其预计的现金、现金等价物和有价证券的使用情况以及到2026年下半年的预期现金资源充足程度、Acumen候选产品 ACU193 的治疗潜力(包括对抗其他抗体的治疗潜力)、启动 ACU193 二期临床试验和支持潜伏的1期试验的预期时间表 ACU193 的皮肤给药选项,以及预期的剂量信贷额度收益的使用。这些陈述基于Acumen管理层当前的信念和期望,受某些因素、风险和不确定性的影响,尤其是发现、开发和商业化安全有效的人体疗法过程中固有的因素、风险和不确定性。COVID-19 疫情的影响可能会加剧此类风险。Acumen向美国证券交易委员会(“SEC”)提交的文件中进一步详细描述了与Acumen计划有关的这些风险和其他风险,包括Acumen最新的10-K年度报告表以及Acumen未来的文件和报告。这些文件和其他文件的副本可从 Acumen 获得。其他信息将在Acumen不时向美国证券交易委员会提交的其他文件中提供。这些前瞻性陈述仅代表截至本文发布之日,Acumen明确表示没有义务更新或修改任何前瞻性陈述,除非法律另有要求,无论是由于新信息、未来事件还是其他原因。在本演示文稿中,提及的现金还包括现金等价物。

2023 年下半年公布了阳性 1 期临床试验结果 3 推进针对早期阿尔茨海默氏病 (AD) 的潜在同类最佳抗体 (AβO) 需要更多治疗选择的大型市场 ACU193:单克隆抗体 (maB) 对毒性 AβOS 具有高度选择性的经验丰富的领导团队具有丰富的 AD 药物开发经验丰富的资产负债表支持 ACU193 的临床开发计划预计将启动第 2 期 (IV) 和阶段 2024 年 1 项(皮下)研究 $

早期 AD 患者群体代表着重要的市场机会 AD 进展的四个阶段和特征严重痴呆中度痴呆轻度认知障碍 (MCI) 临床前 AD 约 500 万1 ~200 万1 早期阿尔茨海默氏病认知衰退行为和心理并发症功能衰退 1. 2021 年阿尔茨海默氏症协会对第一代、疾病修复、抗β淀粉样蛋白治疗方案的采用率预计将增加,而大量未得到满足的需求和改善的余地仍将存在

β淀粉样低聚物(AβO)在 AD 病理生理学 5 1 中被广泛认为是剧毒物质。Cleary 等人,2005 年;Townsend 等人,2006 年;Poling 等人,2008 年;Reed 等人,2011 年;Batista 等人,2018 年。2.S.T. Ferreira 和 W.L. Klein,2011 年。3.De Felice 等人,2008 年;Zempel 等人,2010 年;Ochalek 等人,2017 年。突触功能受损1 导致记忆和认知障碍2 诱导 tau 过度磷酸化3 单体低聚物原纤维原纤维斑块神经毒性可溶性淀粉样蛋白不溶性淀粉样蛋白成熟海马神经元和与树突状脊柱结合的毒性 AβO Image Lacor 等人,2004 年。

ACU193:针对早期 AD ACU193 对毒性 AβO 的高选择性的潜在一流免疫疗法可能提供有意义的认知功效和更高的安全性 6 单体低聚物原纤维原纤维斑块可溶性淀粉样蛋白不溶性淀粉样蛋白人源化、亲和力成熟的单抗专为靶向毒性 Aβ 低聚物而开发 > 500 倍于 Aβ 单体 > 85 倍 AβOS 的选择性优于 Aβ 纤维 IgG2 亚类单抗体 ACU193 是与默沙东公司合作发现的由于默沙东 FDA 快速通道被指定用于治疗早期阿尔茨海默氏病 FDA 第 2 阶段会议将于 2023 年第四季度结束 ACU193 iGG2 为提高疗效和安全性而合理设计鼓励美国食品药品管理局互动,Acumen 拥有独家项目权利,未来不承担任何财务或其他义务

差异化安全性 INTERCEPT-AD 1 期数据支持潜在差异化疗效 ACU193 具有一流的疗效和安全性 7 引人注目的安全性低在 ApoE4 纯合子中观察到 ARIA-E 缺失 ARIA-E 的广泛治疗指数,便于每月给药的第一种表现出 AβO(毒性最强的 Aβ 形式)选择性靶点参与的单克抗可与当前市场领先者相媲美的斑块减少速度快、显著减少点脑脊液中 AD 生物标志物的运动以及血浆有力地表明了下游效应 — 淀粉样蛋白、tau、突触 INTERCEPT-AD 的关键要点
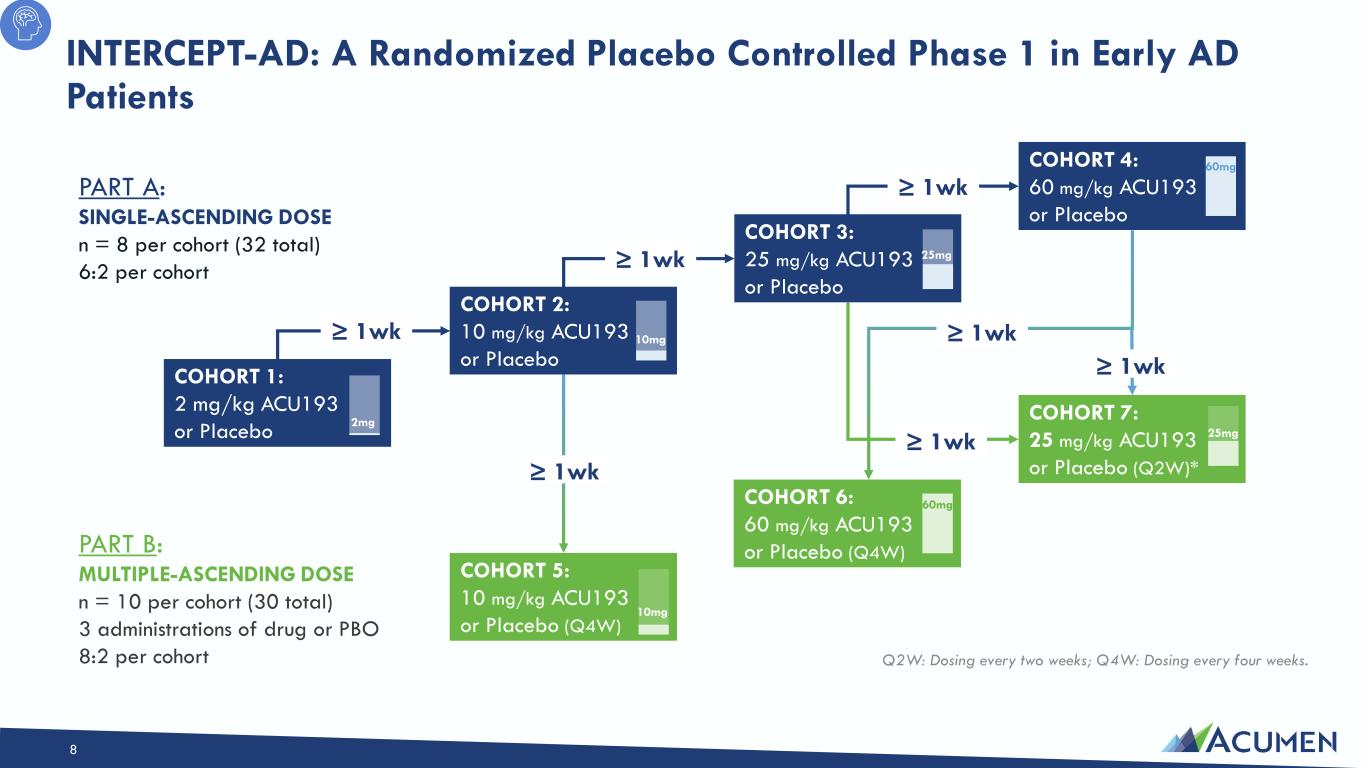
8 Q2W:每两周给药一次;Q4W:每四周给药一次。A 部分:单次递增剂量 n = 8(总计 32)每个队列 6:2 第 B 部分:多重上升剂量 n = 每个队列 10 次(总计 30 次)3 次药物或 PBO 8:2 队列 1:2 mg/kg ACU193 或安慰剂 2mg 队列 2:10 mg/kg ACU193 或安慰剂 10mg 队列 3:25 mg/kg ACU193 或安慰剂 25mg 队列 4:60 mg/kg ACU193 或安慰剂 60mg 队列 5:10 mg/kg ACU193 或安慰剂(Q4W)10mg 队列 6:60 mg/kg ACU193 或安慰剂(Q4W)60 mg 队列 7:25 mg/kg ACU193 或安慰剂(Q2W)* ≥ 1wk ≥ 1wk ≥ 1wk ≥ 1wk ≥ 1wk ≥ 1wk ≥ 1wk ≥ 1wk ≥ 1wk ≥ 1wk ≥ 1wk ≥ 1wk ≥ 1wk: 随机安慰剂早期 AD 患者的对照期 1

接近最大目标参与度的剂量支持 ACU193 AβO 机制并帮助指导下一次研究第 9 阶段单剂量和多剂量队列的剂量选择-暴露反应关系(Emax 模型)Emax:22.7 au/mL 复合物 EC50:136 ng/mL ACU193 *排除在队列 5(10 mg/kg Q4W)的一名患者因只接受了一次药物(空隙梗塞后研究停药)。0 600 1200 0 10 20 30 CSF [ACU193](ng/mL) A C U1 93-A βO C om pl ex (A U /m L) SAD 2 mg/kg SAD 10 mg/kg SAD 25 mg/kg SAD 60 mg/kg MAD 10 mg/kg Q4W MAD 60 mg/kg Q4W MAD 25 mg/kg Q4W MAD 25 mg/kg Q2W 目标交战 ACU193-AβO 复合目标交战

在高剂量 MAD 队列中,几乎所有接受过 ACU193 治疗的患者在 63 或 70 天服用三剂后斑块负荷均有所降低 10 斑块负荷 0 15 30 45 60 75 0 25 50 75 100 125 mg/kg Q2W MAD days c en til oi ds 20 21 22 23 24 25 26 27 0 15 30 60 75 75 0 25 60 mg/kg Q4W MAD days c en til oi ds 20 21 22 23 24 26 27 0 15 30 60 75 75 60 mg/kg Q4W MAD days oi ds 28 29 30 31 32 33 34 35 25 mg/kg Q2W MAD 60 mg/kg Q4W MAD 斑块减少平均减少淀粉样蛋白斑块(绝对值,质心)13.7(%,centiloids)20.6% 淀粉样蛋白斑块的平均减少量(绝对值,质子蛋白)18.1 (%,centiloid) 25.6%

ACU193 最大剂量减少淀粉样蛋白斑块的速度和幅度与 Lecanemab 相似 6% 认知衰退减缓 8% 认知能力下降减缓 -2% 认知能力下降减缓 22% 认知下降减缓 27% 认知下降减缓 23% 认知下降减缓 29% 减缓认知衰退减速斑块减缓 Ef fic ac y ev ed 淀粉样蛋白斑块(centiloids)的平均减少* Acumen Pharmicals,存档数据;van Dyck(2023)、NEJM(根据图表估算的淀粉样蛋白PET减少量)。*上面列出的候选产品之间没有正面交锋的临床试验。每个候选产品的研究设计和方案都不同,因此,候选产品之间的结果可能不具有可比性。11

与 AD 病理学相关的关键流体生物标志物的重要性 12 Tau 病理学:ptau181 ptaU217 神经元损伤:全部 tau 突触损伤:Neurogranin VAMP2 淀粉样蛋白病理学:Aβ 42/40 星形细胞激活:GFAP • 来自脑脊液和血浆的生物标志物捕获神经元、突触和轴突损伤,并反映 AD1 中不同病理底物的累积结果 • 证据表明与单独的成像相比,生物标志物可能更能预测 AD 的潜在病理2 • 在仅给药三次 ACU193 之后,患者早期的 AD 显示与 AD 病理相关的生物标志物有所改善 1.Tarawneh,R. Biomarkers:我们的阿尔茨海默病治疗之路。《生物标记物见解》第 15 卷:1—15。2020;2.Blennow K、Zetterberg H.《阿尔茨海默氏病液体生物标志物的过去和未来》。《阿尔茨海默氏杂志》,2018;62 (3):1125-1140。Aβ 低聚物淀粉样蛋白斑块

脑脊液淀粉样蛋白、Tau 和突触生物标志物的持续变化表明 ACU193 在仅接种三剂后出现下游药理学 13 脑脊液生物标志物 ptau181 NeuroGraninaβ 42/40 比率 VAMP2 Tau 病理学亚米样病理突触损伤

在 60 mg/kg MAD 队列中,血浆生物标志物中观察到一致的药物作用给药完成后,生物标志物反弹,支持 ACU193 药物效应血浆 Aβ 42/40(药物干扰测试待定)未观察到一致的趋势;在 10 mg/kg Q4W 或 25 mg/kg Q2W PtaU181 Q4W(n = 8)中未观察到一致的趋势 SEM ptau217gfap 等离子体生物标志物 14

ACU193 在早期的 CSF Aβ 42/40 比率、ptau181 和 Neurogranin 与 Lecanemab* 15 Lacanemab 值相比处于有利地位,根据 AAIC 2023 演示文稿估计,CSF 生物标志物 Aβ 42/40 比率 50 100 -20 0 20 40 60 80 周 C SF A β 42 /4 0 (M ea n% C ha ng e fr om b as el in e) = ACU193 60 mpk Q4W 10 mpk Q4W 25 mpk Q2W ACU193 Placebo Lecanemab 安慰剂 Lecanemab Placebo Lecanemab(Q2W 10 mpk)*ACU193 和 Lecanemab 之间没有正面交锋的临床试验。每种候选产品的研究设计和方案都不同,候选产品的结果可能不具有可比性。ptau181 Neurogranin

关键要点:ACU193 显示出具有一流疗效的潜力斑块减少靶在脑脊液生物标志物效应中的作用 p = 0.001 p = 0.03 毒性 β 淀粉样低聚物在脑脊液中以剂量成比例的方式作用并达到近乎最大效果最大剂量的 ACU193 显示淀粉样斑块在相似时间点的减少可与莱卡内布相媲美* 在短短三次 ACU193 给药后,早期 AD 患者表现出改善与 AD 病理学相关的生物标志物的变化 -30 -25 -20 -15 -10 -5 0 天 0 天 0 天 63 天 70 天 70 天 90 (18.1) (13.7) (13.7) (20.0) ACU193 60 mg/kg Q4W (n=8) ACU193 25 mg/kg Q2W (n=8) Lecanemab 10 mg/kg Q2W (n=344) * 吸收毒性 AβO,以与市场领导者相当的速率减少牙菌斑,表现出强大的下游药理学标志物 • 淀粉样蛋白 PET 负荷(Centiloids)• CSF A42/β tau 病理学的 40 比率标志物 • 脑脊液和血浆 p-tau181 • 突触和神经元损伤的血浆 p-tau217 标志物 • 脑脊液神经颗粒 • 脑脊液 VAMP-2 • 血浆 GFAP *ACU193 和 Lecanemab 之间尚未进行过正面临床试验。每个候选产品的研究设计和方案都不同,候选产品的结果可能不具有可比性。16

ACU193 显示出一流安全性的潜力引人注目的总体安全性,ARIA-E 17 安全限发病率低 ARIA-E 的发病率 • 10 mg/kg Q4W:1 例无症状病例 • 25 mg/kg Q2W:1 例无症状病例 • 60 mg/kg Q4W:2 例无症状病例;1 例有症状的病例尽管占研究的 13%,但在 ApoE4 纯合子(n=6)中未观察到 ARIA-E • 与其他研究有区别 E4-Homozygotes 参与者中 ARIA-E 率约为 30% 至 40% 的抗体治疗指数宽泛,每月给药方便 • 安全概况可能支持为大部分患者提供有吸引力的益处/风险选择 5 0 总数 ARIA-E 病例,或 apoE4 纯合子中约 10% 的 ARIA-E 病例 N=6 0 死亡,与研究药物 INTERCEPT-AD 1 期安全数据相关的SAE

18 珍妮丝·希区柯克博士监管事务副总裁 ROBERT DEAN,医学博士,生物标志物和分析方法高级开发顾问 ERIC SIEMERS,医学博士首席医学官罗素·巴顿首席运营官丹尼尔·奥康奈尔总裁兼首席执行官 LIEAN SCHENK 副总裁兼首席执行官 LIEAN SCHENK 副总裁、CMC 负责人萧天甘临床运营主管经验丰富的临床、监管和开发领导者,在阿尔茨海默氏病早期至后期试验的执行方面具有丰富经验 JASNA JERECIC,博士高级董事生物分析方法在 2023 年的强劲执行力实现了第一阶段的成功成果,鼓励 FDA 就未来开发计划提供 EOP2 反馈,并合作开发 ACU193 皮下给药

19 Acumen 拥有将 ACU193 推向2026年下半年的专业知识和资源截至2023年9月30日约2.83亿美元现金、现金等价物和有价证券高达5000万美元的债务融资 2023 年 11 月由 K2 HealthVentures 担保的债务融资强劲的资产负债表和高质量的生命科学投资者辛迪加

Ra nd om iz at io n 1:1:1 ACU193 35mg/kg Q4W(n ~180)ACU193 50mg/kg Q4W(n ~180)安慰剂 Q4W(n ~180)18 个月时 iADRS1 的主要终点变化次要终点1 CDR-SB、ADAS-COG13、ADCS-ADL、AD 生物标志物开放标签扩展目标:评估临床疗效,ACU193 患者群体的安全性和耐受性:早期 AD 患者(MCI 或早期 AD 引起的轻度痴呆)潜在的临时扩展分析 ALTITUDE-AD 2/3 期研究设计 1. iADR:综合阿尔茨海默氏病评级量表;CDR-SB:临床痴呆评级 — 总和方框;ADAS-Cog:阿尔茨海默氏病评估量表——认知子量表;ADCS-ADL:阿尔茨海默氏病合作研究——日常生活活动 20

ACU193 皮下配方正在与 Halozyme 合作开发,有望扩大患者可及性和提高治疗便利性 • 2023 年 11 月宣布与 Halozyme 合作,开发 ACU193 的皮下给药方案 • Halozyme 的药物递送技术ENHANZE® 已在七种获批准的疗法中获得商业验证,全球合作涵盖 60 多个治疗靶点 • 当前 ACU193 潜在的靶点产品概况包括不超过一期的启动每周注射计划 1 生物利用度2024 年中期的研究比较了皮下形式的 ACU193 与 IV 形式 21 的药代动力学

摘要 22 大量且不断增长的阿尔茨海默氏症患者需要额外的治疗方案 ACU193 对于 AD 患者中毒性 AβO 表现出高选择性经验丰富的临床、监管和开发领导者推动 ACU193 的开发潜力得到积极的 1 期数据增强 ACU193 提供一流疗效和安全性的潜力关键要点后续步骤预计 2/3 期临床研究 ALTITUDE-AD 将于 2024 年上半年启动两个治疗组对比安慰剂:50 mg/kg Q4W 和 35 mg/kg Q4W 预计第 1 阶段皮下治疗临床研究于 2024 年中期启动

谢谢 www.acumenpharm.com 23