

附录 99.1 和 42 年度摩根大通医疗保健会议 JA NUA RY 9, 2 02 4

安全港声明本演示文稿包含前瞻性 陈述。Crinetics Pharmaceutics, Inc.(“Crinetics”、“公司”、“我们” 或 “我们的”)提醒您,本演示文稿中有关非历史事实事项的陈述是 前瞻性陈述。这些陈述基于公司当前的信念和期望。此类前瞻性陈述包括但不限于以下方面的陈述:帕替索汀对 肢端肥大症患者和类癌综合征患者的潜在益处;PATHFNDR 计划支持所有需要药物治疗的肢端肥大症患者注册帕替索汀的可能性; 帕图索汀和 CRN04894 的临床开发计划和时间表,包括治疗潜力和临床益处或安全性其中;头条数据的预期时间以及 PATHFNDR-2 研究的完整结果以及针对类癌综合征患者的二期研究 ,并与美国食品药品管理局分享结果,以协调和设计第三阶段计划;提交用于治疗肢端肥大症的帕图索汀新药申请和相关的开放标签扩展研究的预期时间以及潜在的 监管机构批准;CRN04894 对库欣氏病或先天性肾上腺增生症患者的潜在益处以及预期的计划和计划获取正在进行的临床研究数据的时机;PTH 受体 拮抗剂的潜在益处甲状旁腺功能亢进患者、促甲状旁腺激素拮抗剂对格雷夫斯病或甲状腺眼病的潜在益处;我们正在进行的任何临床研究显示出安全性或有效性的可能性;我们 正在进行的发现工作有可能瞄准多囊肾病或糖尿病/肥胖的未来适应症,以及此类候选药物选择和临床开发的预期计划和时机;我们识别和创建新候选药物的计划 其他疾病的候选药物;以及我们的预期计划和时机尚待监管部门批准的帕图索汀和其他候选产品的商业化,包括处方者、市场研究、付款人 参与和分销渠道方面的工作。在某些情况下,你可以通过诸如 “可能”、“相信”、“预期”、“可能”、“应该”、“估计”、 “期望”、“打算”、“计划”、“项目”、“将”、“考虑”、“继续”、“预测”、“奠定基础”、“导致”、“目标” 等术语来识别前瞻性陈述 “潜力”、“抱负”、“目标” 或否定词和其他类似用语。这些陈述仅代表截至本演讲之日,涉及已知和 未知的风险、不确定性、假设和其他重要因素,这些因素可能导致我们的实际业绩、业绩或成就与 前瞻性陈述所表达或暗示的任何未来业绩、业绩或成就存在重大差异,包括但不限于:在对与临床研究和此类数据相关的数据进行更全面的审查后,我们报告的标题和初始数据可能会发生变化可能无法准确反映完成临床研究的 结果,FDA 和其他监管机构可能不同意我们对此类结果的解释;临床前研究或临床研究的初步结果不一定能预测最终结果的风险 ,随着患者入组的继续、对数据进行更全面的审查之后,以及随着更多患者数据的出现,一项或多项临床结果可能发生重大变化;可能出现不利的新临床数据以及 对现有临床数据的分析;潜力延迟开始、注册和完成临床研究以及相关数据的报告;美国食品和药物管理局或其他监管机构可能要求对 paltusotine进行额外的临床研究,或者建议在批准新药申请或适用的外国监管批准之前修改我们计划的3期临床研究;国际冲突可能会干扰我们的业务以及我们所依赖的 第三方的业务,包括延迟或以其他方式干扰我们的业务临床研究和临床前研究,制造业和供应链,或降低员工工作效率;我们在产品 制造、研究、临床前和临床测试方面对第三方的依赖;我们对帕图索汀、CRN04894 的临床研究、非临床研究和临床前研究的成功;我们在甲状旁腺功能亢进、多囊肾、格雷夫斯 病和甲状腺眼病或糖尿病/肥胖候选产品方面的发现工作;监管或价格的发展美国和国外的限制;意想不到的不良副作用或我们的候选产品的功效不足, 可能会限制其开发、监管批准和/或商业化;我们为候选产品获得和维持知识产权保护的能力;我们可能比预期的更快地使用我们的资本资源;以及我们不时向美国证券交易委员会(“SEC”)提交的文件中 “风险因素” 标题下描述的其他风险 。由于前瞻性陈述本质上受风险和不确定性的影响,其中一些 无法预测或量化,有些是我们无法控制的,因此您不应依赖这些前瞻性陈述作为对未来事件的预测。我们的前瞻性陈述 中反映的事件和情况可能无法实现或发生,实际结果可能与前瞻性陈述中的预测存在重大差异。所有前瞻性陈述均受本警示声明的全部限定,该声明是根据1995年《私人证券诉讼改革法》的安全 港条款作出的,除非适用法律要求,否则我们不计划公开更新或修改此处包含的任何前瞻性陈述,无论是由于任何新的 信息、未来事件、情况变化还是其他原因。本演示文稿还包含独立方和我们提供的与可寻址患者和潜在市场规模和增长相关的估计和其他统计数据,以及 有关我们行业的其他数据。这些数据涉及许多假设和局限性,提醒您不要过分重视此类估计。此外,对我们未来表现的预测、假设和估计以及我们经营所在市场的未来表现必然受到高度的不确定性和风险的影响。2 2

制定以内分泌为重点的首屈一指的全整合制药公司 公司战略方针以实现长期价值增长 3

2023 年 Paltusotine 的肢端肥大症 3 期阳性结果为 Paltusotine 类癌综合征的 2 期阳性结果奠定了 基础 2024-2025 年第二期 3 期研究已完成注册肢端肥大症启动了第二项临床资产 (CRN04894) 3.5 亿美元 股票发行 4 4

Crinetics Way:内分泌促进健康内分泌学的深层根基 精心打造的变革承诺 = 人们的生活药物世界一流的内部研发帕图索汀是目前正在临床研究中的在研候选药物 5 |

研发变革性候选药物的深度渠道临床前 第 1 期第 2 阶段 3 期计划预期里程碑肢端肥大症 (PATHFNDR-1) NDA 提交 (2H24) 肢端肥大症 (PATHFNDR-2) Paltusotine (SST2 激动剂) 主要结果 (24 年第 1 季度) 完整的 2 期数据发布 (1H24) 类癌综合征库欣的 疾病第 2 期数据 (1H24) CRN04894 (ACH) TH 拮抗剂) 2 期数据 (1H24) 先天性肾上腺增生甲状旁腺功能亢进候选人选择 (1H24) PTH 拮抗剂候选选择 (1H24) 多囊肾病 SST3 激动剂(探索 全球伙伴关系) 扩展到高度流行的适应症格雷夫斯病和 TED 候选药物选择 (2024) 促甲状腺激素拮抗剂糖尿病/肥胖口服 GLP-1 非肽候选药物精选 (2025) 口服 GIP 非肽糖尿病/肥胖 SST: 生长抑素受体类型;ACTH:促肾上腺皮质激素;PTH:甲状旁腺激素;TSH:甲状腺刺激素;6 6 | TED:促甲状腺激素眼部疾病;GLP-1:胰高血糖素样肽 1 受体激动剂;GIP:胃抑制性多肽

世界一流的开发导致全球商业化 Paltusotine: 肢端肥大症和类癌综合征的主要临床资产 PATHFNDR-1 类癌综合征 3 期结果 2 期结果 7

Paltusotine:旨在让肢端肥大症和类癌 综合征患者专注于可靠、不良的帕替苏汀*护理的当前标准益处,症状和持久控制控制 77% 报告没有注射,VS 部位反应耐受良好 每日一次,口服片剂不方便的治疗选择 *等待帕图索汀获得监管部门的批准。支持监管部门批准申请的临床研究正在进行中。参考文献 1.Geer EB、Sisco J、Adelman DT 等患者 报告了在常规临床实践中接受可注射的生长抑素受体配体 (SRL) 治疗的肢端肥大症患者的预后数据。BMC Endocr Disord. 2020;20 (1): 117. doi: 10.1186/s12902-020-00595-4;2.Strasburger CJ、Karavitaki N、 Störmann S 等人。8 位患者报告的195名肢端肥大症患者肠外生长抑素类似物注射的疗效。Eur J Endocrinol。2016;174 (3): 355-62。doi: 10.1530/eje-15-1042;3.Fleseriu 等人《内分泌学前沿》;2021 年 3 月,第 12 卷

肢端肥大症第 3 阶段的积极结果为 2025 年首次 商业发射*奠定了坚实的基础 100% 83% (25/30) p
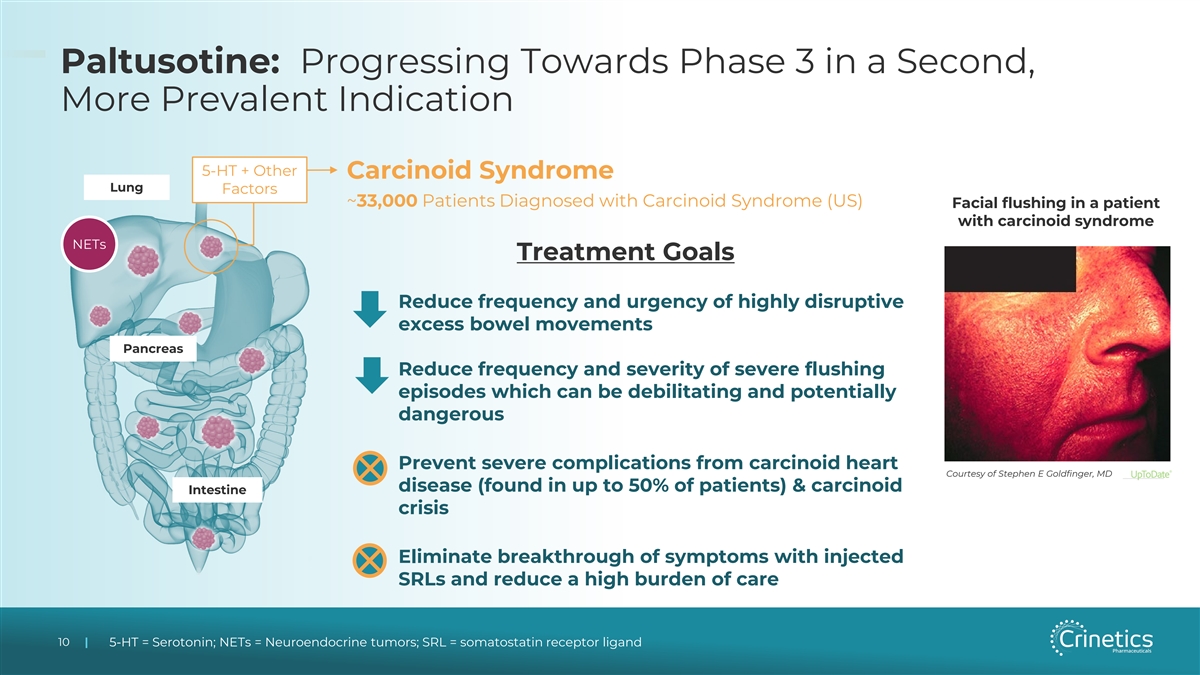
Paltusotine:第二个更普遍的 适应症 5-HT + 其他类癌综合征肺因子 ~33,000 名被诊断为类癌综合征的患者(美国)类癌综合征患者面部潮红 NET 治疗目标 1。降低高破坏性 过度排便的频率和紧迫性 Pancreas 2.降低严重潮红发作的频率和严重程度,这可能会使人衰弱并具有潜在危险 3.预防类癌心脏的严重并发症由医学博士 Stephen E Goldfinger 提供(在多达 到 50% 的患者中发现)和类癌肠危机 4.注射 SRL 可消除症状突破并减轻高额护理负担 10 10 | 5-HT = 血清素;NET = 神经内分泌肿瘤;SRL = 生长抑素受体配体

类癌综合征研究参与者示例:消除潮红 和体重正常化 10 9 8 帕图索汀 80 mg/天 7 过量 BM 6 >3/d bmS 冲洗 5 4 3 No Prior 2 正常 BM 疗法 3/d 至 3/w 1 0 -1 -30 -20 -10 0 10 20 30 40 50 60 研究日 11 BM = 排便频率(每天)

Paltusotine 降低了两种关键类癌综合征核心症状的发生频率 症状:BM 过多和潮红冲洗频率过度排便* 基线 ≥1 天的患者的频率 3.0 p 3/day 的患者,每日频率(7d 平均值)每日频率(7d 平均值)

Paltusotine: 肢端肥大症和类癌综合征的初始美国市场机遇为数十亿美元肢端肥大症类癌综合征诊断患病率 27,000 33,000 名可寻患者 11,000 33,000 名未经手术治愈的 SRL 现有患者 10,000 名内分泌疗法* 年均加息量** 7万美元注射剂1万美元当前市场7亿美元用于内分泌治疗(美国)内分泌疗法的潜在市场总额为8亿美元33亿美元(美国)*内分泌疗法包括SRL、多巴胺激动剂和生长激素 拮抗剂。13 **WAC:批发收购成本;来源:公司存档数据

机密为帕图索汀的多种 适应症奠定商业成功基础地图市场研究 • 200 个 HCP 启动了 80% 的 • 营销集团的骨干肢端肥大症脚本已经到位 • 两者有 40 个重叠中心 • 市场研究表明 垂体和 NCCN 的护理负担是关键 • 拥有顶级处方者的广告板克服惯性 • 扩大医疗事务团队 • 引人注目的 PATHFNDR-1 数据正在增强分销渠道付款人的认识参与 • 最终确定的第三方物流供应商合同医疗补助Medicare B 部分 • 谈判专业药房网络合同 9.8% • 市场准入团队的骨干 1.1% • 建立 Crinetics 的提供商和患者服务中心 。• 聘请了 50% 的美国主要付款人 • 付款人对口服约 50 名首选期权付款人的价值品牌服务中心第三方专业医疗保健商业医疗保险 D 部分药房从业人员 30.9% 57.9% 患者 NCCN: 全国综合癌症网络 14 来源:动力学访谈和市场研究

世界一流的发现将扩大临床管道世界一流的 发现将扩大临床管道遵循 Crinetics 开发药物以帮助越来越多的人群的方法 15

CRN04894:后期开发中的第二项临床资产巧妙 精心打造,旨在帮助患者实现治疗目标压力下丘脑主要适应症:先天性肾上腺增生 (CAH) 昼夜节律约27,000名患者流行/确诊为经典 CAH(美国)CRF CRF 时钟 AVP AVP 治疗目标: 糖皮质激素 1.正常化/消除肾上腺雄激素的产生垂体 CRF 2.恢复女性的正常月经周期和生育能力 ✓ 拮抗剂 3.缩小睾丸肾上腺休息肿瘤,缓解疼痛,恢复 男性 CRN04894(ACTH 拮抗剂)4 的生育能力。✓预防儿童雄激素过多的后果:ACTH 非典型生殖器、性早熟、身材矮小、多毛症 5.避免糖皮质激素过多的并发症(体重增加、A4 高血压、骨骼 疾病...),并启用生理学的 17-OHP 肾上腺置换水平 AVP:精氨酸加压素,CRF:促肾上腺皮质激素释放因子;A4:雄烯二酮;16 | 17-OHP:17-羟孕酮,ACTH:促肾上腺皮质激素释放因子;A4:雄烯二酮;16 | 17-OHP:17-羟孕酮,ACTH:促肾上腺皮质激素

CRN04894:旨在提供最大的 A4 抑制效果的瞄准机制。初步数据预计 24 年第二季度 A4 抑制和类固醇保留对不同作用机制的预期 700 服用糖皮质激素 600 平均 CRF 500 依赖性 A4 预期促肾上腺皮质激素 400 患者气相色谱剂量减少取决于 GC + CRF A4 拮抗剂* 300 200 CRN04894 100(目标概况)正常范围 0 0 5 10 15 20 2 GC 剂量(氢化可的松当量)(mg/m/天)17 | CRF:促肾上腺皮质激素释放因子;GC:糖皮质激素;A4:雄烯二酮 17 | 机密 雄烯二酮水平 (A4) (ng/dL)

两项新项目预计将于2024年开始首次人体授权研究 甲状旁腺功能亢进的甲状旁腺功能亢进的促甲状旁腺激素拮抗剂和TED*车辆载体或/或拮抗剂拮抗剂 PO PO 2.0 1.8 载体 3 mg/kg 拮抗剂 M22 载体激动剂 10 mg/kg 拮抗剂 抗体 1.6 10 mg/kg 拮抗剂 30 mg/kg 抗体激动剂 30 mg/kg 拮抗剂 1.4 PTH 输液 1.2 连续 SC 10 μg/kg/天 PTH (1-34) 0 -24 -12 0 12 24 36 48 60 时间 (h) 潜在主要候选药物的临床前疗效数据临床前疗效 数据对于潜在候选人 18 18 | PTH:甲状旁腺激素;TSH:甲状腺刺激激素;TED:甲状腺眼病电离钙(mmol/L)

打造一家专注于内分泌的顶级全整合制药公司 • 上半年开始 CAH 第 3 阶段 • 2H Paltusotine 肢端肥大症 ** ** PDUFA 并上市 • 来自新药的人类 POC • 2H 提交肢端肥大症新药候选药物 • 第二季度初始阶段数据 • 新候选药物在 CAH 中进入读数,以及 • 2026 年其他多个-开发(肥胖)** Cushings 2030 商业发布 • 2H Start Caricoid • 产品收入 * Syndrome 3 期销售以支持增长 • 新候选药物问世 • 持续开发(PTH、TSH)临床催化剂2025 • 从发现到开发的新资产到2024年的长期价值增长战略方针 * 有待与 FDA 19 保持一致 ** 待提交保密协议和 监管部门批准

谢谢