| 纳斯达克:PASG © 2024 Passage Bio。版权所有。 公司介绍 2024 年 1 月 |
| 2 前瞻性陈述 本演示文稿包括根据1995年《私人证券 诉讼改革法》的安全港条款作出的 “前瞻性陈述”,包括但不限于:我们对预期里程碑的时间和执行的预期,包括 临床试验的进展和此类试验的临床数据的可用性;我们对合作者和合作伙伴执行关键举措能力的期望;我们的 } 对制造计划的期望和策略;我们对现金跑道的期望;我们对与 PBGM01、PBKR03 和 PBML04 相关的潜在合作伙伴关系的期望,以及我们的主要候选产品治疗各自靶向单基因中枢神经系统疾病的能力的预期。这些前瞻性陈述可能伴随着诸如 “目标”、“预测”、“相信”、“可能”、“估计”、“预期”、“预测”、“目标”、“打算”、“可能”、“可能”、“计划”、“潜在”、“可能”、“将” 等词语以及其他具有类似含义的词语和术语。这些陈述涉及风险和不确定性, 可能导致实际结果与此类陈述中反映的结果存在重大差异,包括:我们开发 候选产品并获得监管部门批准的能力;临床前研究和临床试验的时间和结果;与临床试验相关的风险,包括我们充分 管理临床活动的能力、临床试验期间获得的其他数据或分析可能产生的意外问题,监管机构可能需要 额外信息或进一步研究,或可能无法批准或可能延迟批准我们的候选药物;不良安全 事件的发生;临床前研究或临床试验的阳性结果可能无法在后续试验中复制或在早期临床试验中取得成功的风险 可能无法预测后期临床试验的结果;未能保护和执行我们的知识产权和其他专有权利;我们对合作者和其他所有权的依赖 开发和制造产品的第三方候选人和我们 无法完全控制的业务的其他方面;与当前和潜在延误、停工或供应链中断相关的风险;以及公司不时向美国证券交易委员会 (SEC) 提交的文件中 “风险因素” 部分描述的其他风险和不确定性,以及向美国证券交易委员会 (SEC) 提交的其他 报告。Passage Bio没有义务公开更新 可能不时发表的任何前瞻性陈述,无论是书面还是口头陈述,无论是由于新信息、未来发展还是其他原因。 |
| 3 我们的愿景 通过提供可永久重新定义 病程的 基因药物,改善患有神经退行性 疾病的患者的生活。 潜在的同类最佳计划筹资 FTD-GRN 基因疗法计划 建立了制造和工艺 分析能力 强劲的现金状况,预计 将投资组合扩展到其他成人 神经退行性疾病 * 基于截至2023年9月30日的现金、现金等价物和有价证券 |
| 4 种有可能解决多种 神经退行性疾病 项目适应症美国/欧盟 患病率发现临床前1/2期关键 PBFT02 额膜痴呆- GRN 18,0001-3 额睑痴呆- c9orf72 21,0002-4 肌萎缩侧索硬化 72,6005-6 阿尔茨海默氏病伴有 rs5848 SNP 3.9M48 7-8 未命名的亨廷顿氏病 60,0009 PBGM01 GM1 神经节苷脂症 PBKR03 Krabbe 病 PBML04 异色性白质营养不良症 追求潜在的 合作伙伴关系 来源: [1]格里夫斯简历等J Neurol 2019;266:2075-2086, [2]Galvin JE 等人。神经病学 2017; 89:2049-2056, [3]Onyike CU 等。2013 年精神病学国际修订版;25:130-137, [4]Moore KM, 等Lancet Neurol 2020;19:145—156, [5]布朗等Neuroepi 2021;55:342-353, [6]CDC ALS 注册表板, [7]Sheng J 等基因 2014; 141-145, [8]Alz Assoc. 2023 年阿尔茨海默氏病事实与数据。阿尔茨海默氏痴呆症 2023; 19, [9]克罗威尔等Neuroepi. 2021; 55:361-368 |
| 5 • 一次性疗法 • 经久耐用的超生理学脑脊液 PGRN 水平 • 通过非手术注射直接给脑脊液 主要临床项目:PBFT02 在 FTD-GRN 中表现出同类最佳潜力 差异化、潜力 最佳产品概况 来自前 3 名接受治疗 患者的初始数据 • 治疗后 30 天 (n=3) 所有患者的超生理脑脊液 PGRN 水平高于基线 4x-7 倍 (n=3) • 超生理学脑脊液 PGRN 水平 在 治疗 (n=1) 后维持长达 6 个月 全球剂量-FTD-GRN 中 PBFT02 的升级研究 |
| 6 Discovery uPenn GTP 研究分析 和矢量 工程 过程/分析 开发 Passage CMC 研发实验室 成熟的分析 综合流程 开发 GMP 质量控制能力 强大的监管 CMC 科学专业知识 扩大规模 GMP 制造业 与 Catalent 的长期合作关系 端到端临床 供应链 通过混合方法领先 CMC 能力 外部 制造 合作伙伴关系和 端到端 供应链 关键战略 伙伴关系 内部最先进的 CMC 能力 内部合作伙伴关系 内部维护的关键分析和开发能力 |
| PBFT02 额室痴呆 — GRN |
| 8 FTD-GRN:一种毁灭性的成人病 10pt Calibri footer 概述 • 由 GRN 基因突变 引起的毁灭性痴呆 导致前列腺素 (PGRN) 缺乏和单倍功能不全 • 目前没有批准任何改善疾病的疗法 流行病学 • 所有 FTD 中大约 5-10% 由 GRN mun 引起,在美国和欧盟, 估计患病率约为18,000名患者 临床症状 • 疾病进展迅速且具有退行性,包括言语丧失、 表达丧失、严重的行为改变以及静止不动的 |
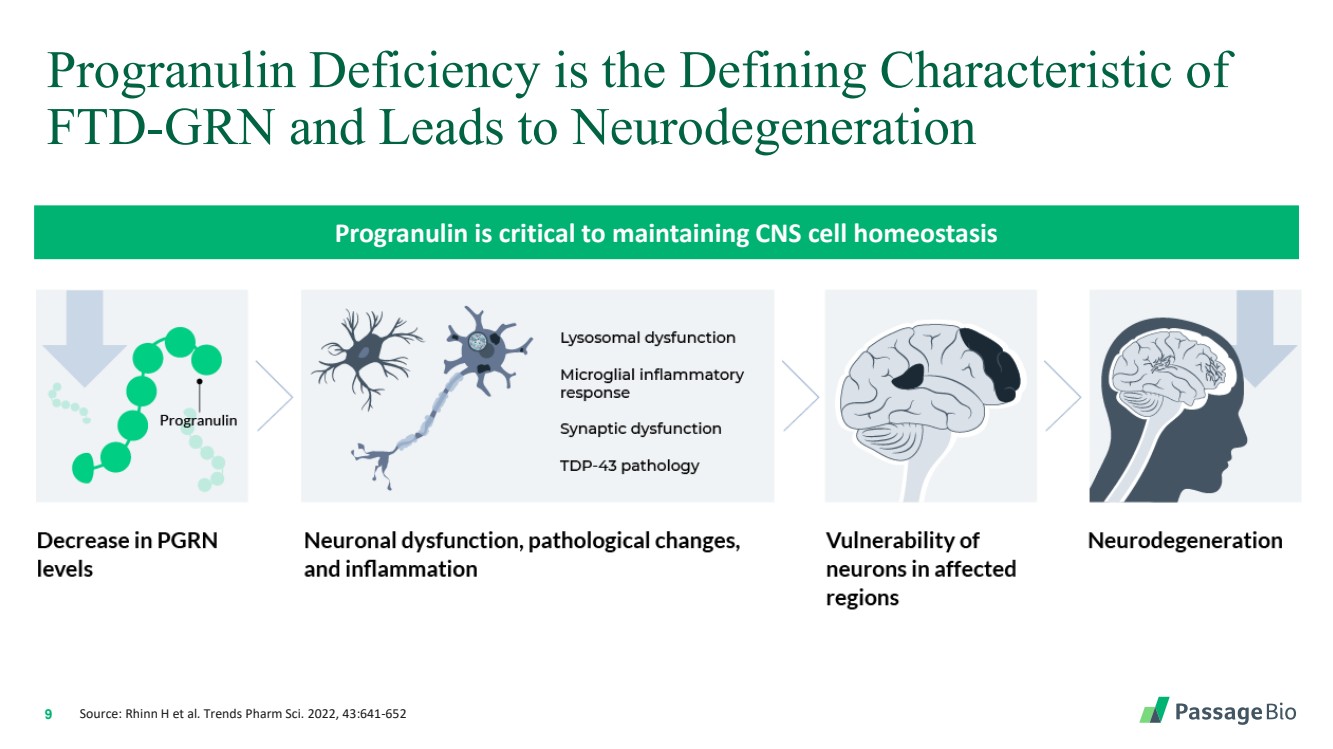
| 9 Progranulin 缺乏是 FTD-GRN 的决定性特征,会导致神经变性 Progranulin 对维持中枢神经系统细胞动态平衡至关重要 来源:Rhinn H 等人。Trends Pharm Sci.2022,43:641-652 |
| 10 PBFT02 • 专有的 AAV1 结构提供功能性 GRN 基因编码 progranulin (PGRN) • 一次性疗法的潜在治疗益处 • 通过单次水箱内注射 (ICM) 直接输送到脑脊液: — 允许广泛的中枢神经系统生物分布 —与静脉注射相比,剂量更低 —减少中性影响抗体 • 基于 临床前和初步临床证据,能够达到脑脊液progranulin的超生理水平 • 获得美国食品和药物管理局的孤儿药和快速通道认定欧共体 认定为孤儿 潜在的变革疗法 |
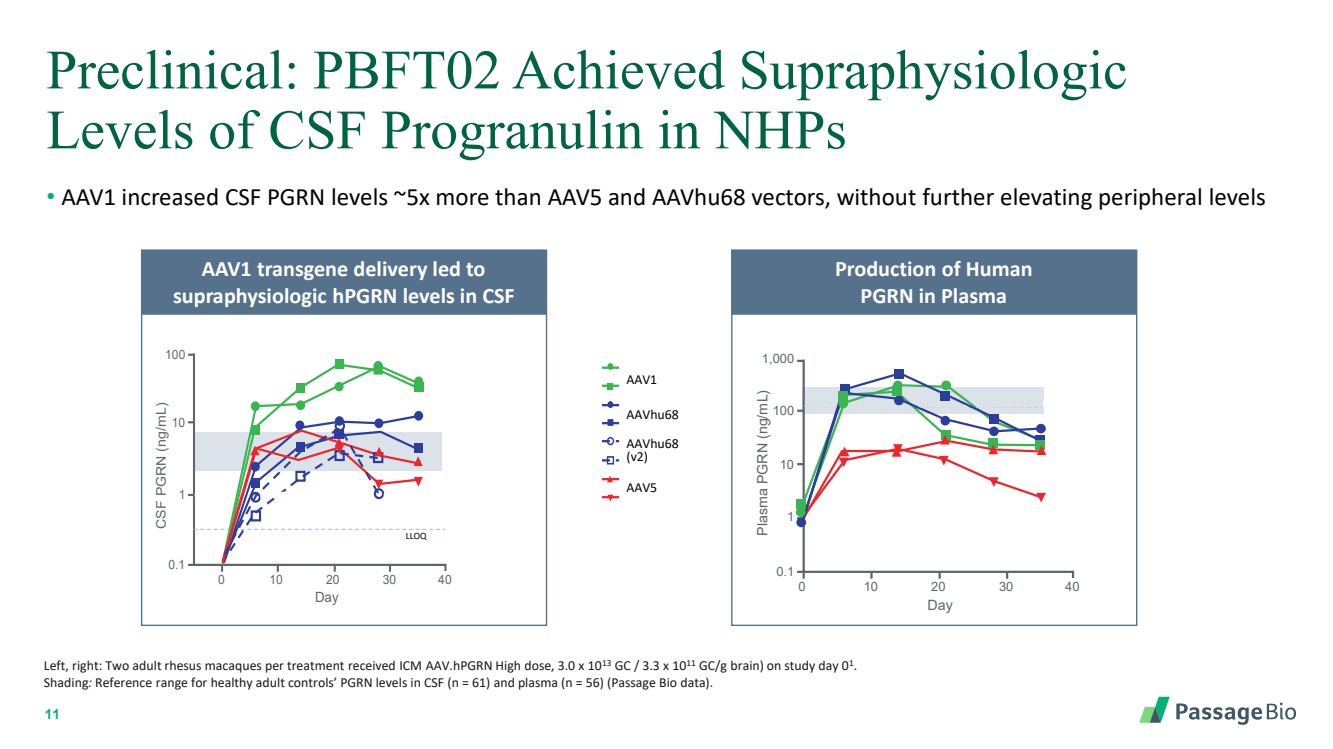
| 11 临床前:PBFT02 在 NHP 中达到超生理学 的脑脊液预聚素水平 • AAV1 使脑脊液 PGRN 水平提高了约 5 倍,但没有进一步升高外周水平 左,右:每次接受治疗有两只成年恒河猴 ICM AAV.HPGRN 高剂量,3.0 x 1013 GC/3.3 x 1011 gc/g(大脑)(第 01 天)。 阴影:健康成人对照组脑脊液(n = 61)和血浆(n = 56)中的PGRN水平的参考范围(Passage Bio数据)。 血浆中人类 PGRN 的产生 AAV1 转基因输送导致脑脊液 脑脊液 PGRN (ng/mL) 0 10 20 30 40 CSF 0.1 1 10 100 LLOQ 正常 日 RA2981 RA2982 RA3027 RA3153 RA3151 RA3170 RA3155 RA3160 aavHu68 aavHu68 (v2) AAV1 AAV5 RA2981 RA2982 RA3027 RA3153 RA3151 RA3160 RA2981 aavHu68 aavHu68 (v2) AAV1 AAV5 (v2) AAV1 AAV1 AAV5 (v2) RA3151 RA3170 RA3155 RA3155 RA3160 AAVHu68 (v2) AAV1 AavHu68 AAV5 AAV5 AAV5 AAvHu68 (v2) AAV1 AavHu68 AAV5 AAV5 v2) AAV5 AAV1 正常 LLOQ 等离子 血浆 PGRN (ng/mL) 0 10 20 30 40 0.1 RA3170 RA3155 RA2982 RA3027 RA31531 10 100 普通 日 1,000 |
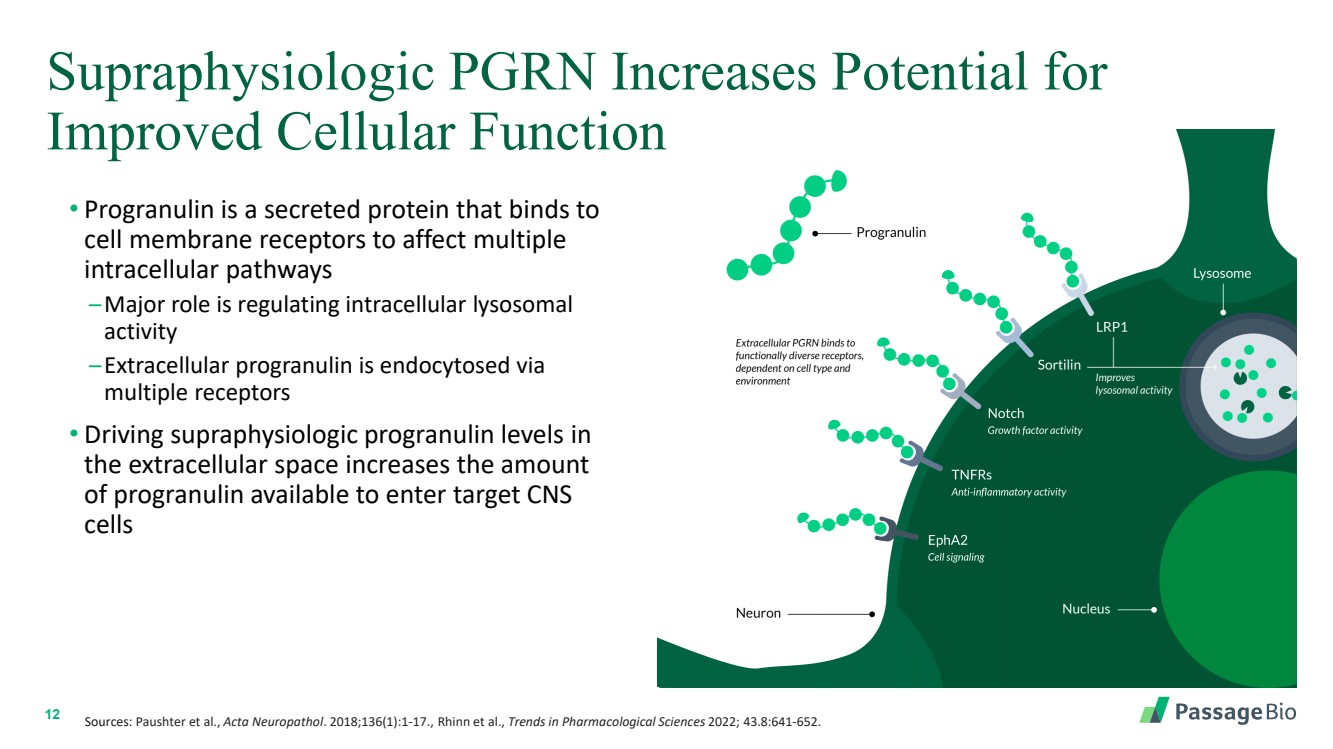
| 12 超生理学 PGRN 增加了 改善细胞功能的可能性 • Progranulin 是一种分泌蛋白,可与 细胞膜受体结合,影响多个 细胞内通路 — 主要作用是调节细胞内溶酶体 活性 — 细胞外程序通过 多重内吞细胞受体 • 推动 细胞外空间的超生理程序蛋白水平会增加 可用于进入靶中枢神经系统 细胞 细胞的程序蛋白量 来源:Paushter 等人,Acta Neuropathol。2018;136 (1): 1-17.,Rhinn等人,《2022年药理科学趋势》;43. 8:641-652。 |
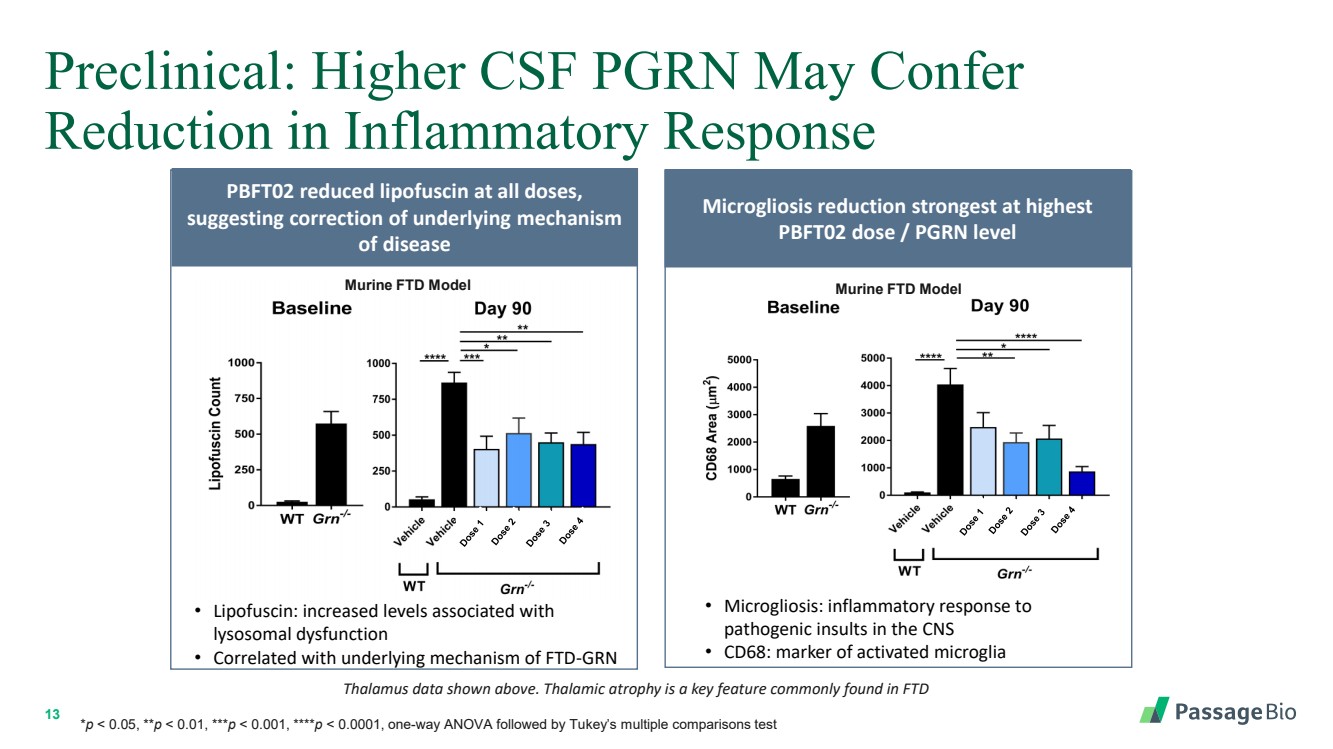
| 13 临床前:较高的脑脊液 PGRN 可能使 炎症反应降低 上面显示的丘脑数据。丘脑萎缩是常见于 FTD PBFT02 降低所有剂量的脂褐素中的一个关键特征, 提示纠正疾病的潜在机制 • 脂褐素:与 溶酶体功能障碍相关的水平升高 • 与 FTD-GRN 的潜在机制相关 *p |
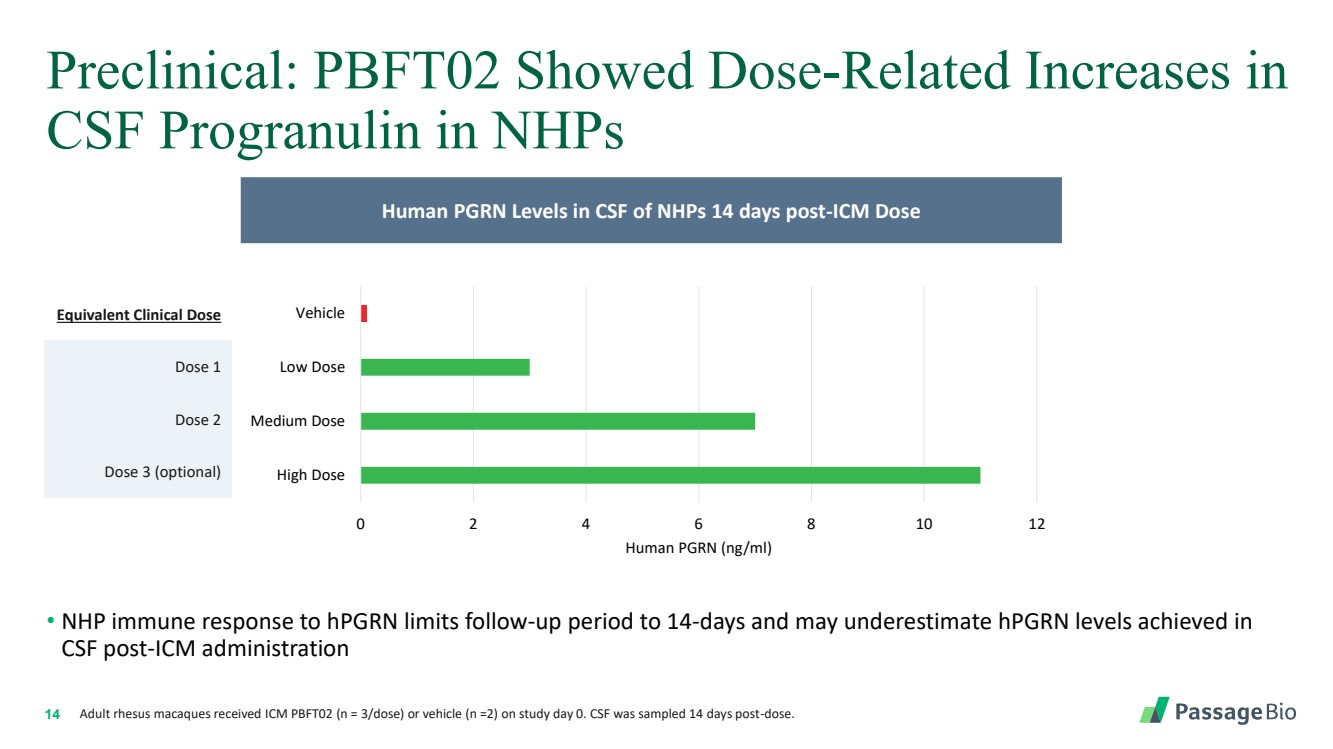
| 14 临床前:PBFT02 在研究第 0 天接受了 ICM PBFT02(n = 3 次剂量)或载体(n =2)的 nHP 成年恒河猴中 脑脊液中丙氨酸的剂量相关增加。在给药 14 天后,对脑脊液进行了采样。 ICM 剂量 14 天后 NHP 脑脊液中人类 PGRN 水平 0 2 4 6 8 10 12 高剂量 中剂量 低剂量 载体 人类 PGRN (ng/ml) 等效临床剂量 剂量 1 剂量 3(可选) • NHP 对 hpGRN 的免疫反应将随访期限制为 14 天和可能低估了 CSF 后 ICM 管理中达到的 hpGRN 水平 |
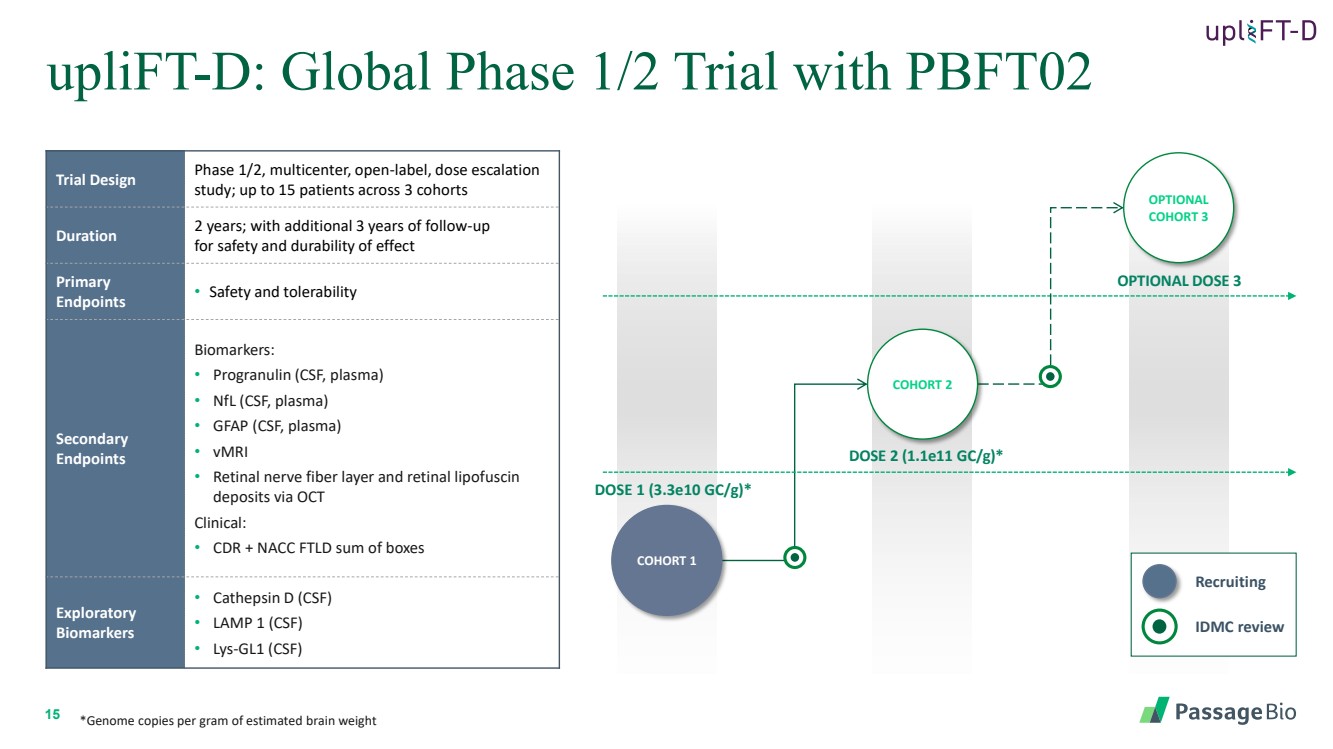
| 15 uplift-D:全球 1/2 期试验,包括 PBFT02 可选剂量 3 剂量 2 (1.1e11 gc/g) * 剂量 1 (3.3e10 gc/g) * 队列 1 队列 2 可选 队列 3 试验设计 1/2 期,多中心、开放标签、剂量递增 研究;3 个队列中最多 15 名患者 持续两年;另加 2 年 3 年随访 检查效果的安全性和耐久性 主要 终点 • 安全性和耐受性 次要 终点 生物标志物: • Progranulin(脑脊液、血浆) • nFL(脑脊液、血浆) • 视网膜神经纤维层以及通过 OCT 临床研究的视网膜脂褐素 沉积物: • CDR + NACC FTLD 盒子总和 探索性 • Catepsin D (CSF) • LAMP 1 (CSF) • lys-gL1 (CSF) *每克估计脑重量的基因组拷贝 IDMC 评论 招聘 |
| 16 uplift-D:来自前 3 名接受治疗患者的中期数据 • 患者 1 经历了两次与免疫反应一致的 SAE;对 方案进行了修订,增加了类固醇治疗方案 • 患者 2 和患者 3 接受了更高水平的类固醇免疫抑制,且 没有出现 SAE;仅报告了轻度至中度治疗的紧急不良反应 • 没有证据 DRG 毒性,经测量通过神经传导研究 • 未观察到与 ICM 给药相关的并发症 SAE:严重不良事件;AE:不良事件;DRG:背根神经节;ICM:intracisterna magna;NHP:非人类灵长类动物 *截至 2024 年 1 月 3 日数据截止日期,患者随访时间介于 2 至 6 个月之间。安全* 疗效/目标 • 中期数据显示,PBFT02 在低剂量 下有可能获得同类最佳疗效。• 在所有患者中,1 剂量达到了超生理学脑脊液 PFS 第 30 天的 GRN 水平:基线 4-7 倍 • 脑脊液 PGRN 水平超过了 NHP 中观察到的水平 |
| 17 在更新了增加类固醇的协议后,患者 2 和 3 没有 SAE 或明显免疫反应的证据 患者 1 患者 2 患者 3 免疫抑制1 天 -1-60:60 mg 口服泼尼松第 1-3 天:1,000 mg 静脉注射甲泼尼松 第 4-60 天:60 mg 口服泼尼松 LFTs 第 14-21 天和第 51-55 天:升高无症状与基线 影像学检查结果与基线没有显著变化 无症状无 DRG 毒性无 ICM 并发症无 ICM 并发症无 随访时长 (截至 2024 年 1 月 3 日) 2 个月 (受试者在第 10 周退出研究)6 个月 3 个月 摘要 • 2 个 SAE:均无症状且 与免疫反应一致 1。肝毒性(用 甲基泼尼松龙解决) 2.静脉窦血栓形成 • 无 SAE • 与基线相比无肝毒性或显著的 LFT 变化 • 核磁共振成像 无静脉窦血栓形成或炎症 • 无临床显著免疫反应需要调整 免疫抑制方案 • 所有急诊急性轻度至中度 LFT:肝功能试验;严重不良事件 1 天减去一是指给药的前一天。 2 第 14-21 天 LFT 升高为轻度且可自行解决;第 51-55 天 LFT 升高:ALT 16x 正常上限 (ULN),AST 4x ULN,碱性 磷酸酶 2x ULN,GGT 10x ULN;总胆红素正常。在患者撤回研究时使用甲基泼尼松龙解决。 |
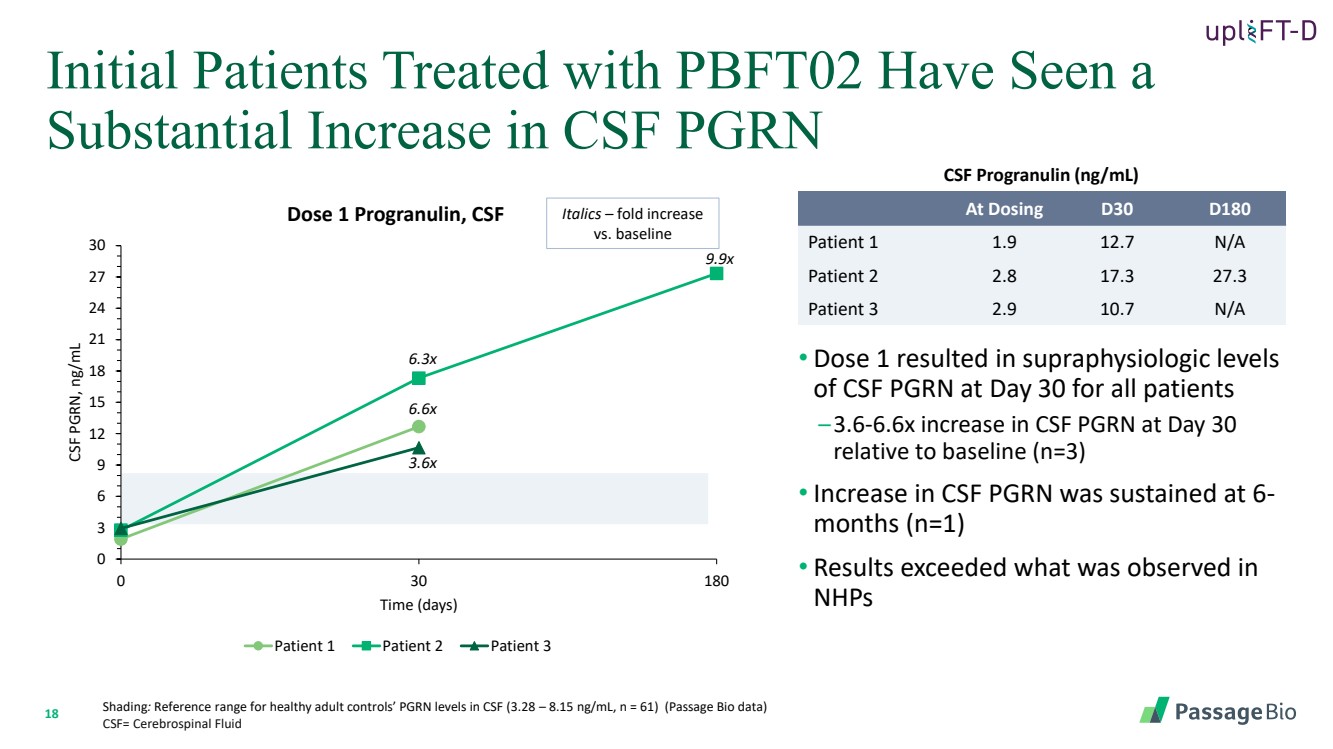
| 18 • 剂量 1 导致所有患者在第 30 天脑脊液 PGRN 的超生理水平 —第 30 天脑脊液 PGRN 相对于基线 (n=3) 增加了 3.6-6.6 倍 • 脑脊液 PGRN 在 6- 个月 (n=1) 时持续升高 • 结果超过 nHP 中观察到的水平 阴影:健康成人对照组脑脊液中 PGRN 水平的参考范围(3.28 — 8.15 ng/mL,n = 61)(通道生物数据) CSF= 脑脊液 最初接受 PBFT02 治疗的患者的脑脊液 PGRN 0 3 6 9 12 15 18 21 24 27 30 0 30 180 CSF PGRN,nbr} 0 3 6 9 12 15 18 21 24 27 30 0 30 180 CSF PGRN,nGRN g/mL 时间(天) 剂量 1 Progranulin,CSF 患者 1 患者 2 患者 3 在给药时 D30 D180 患者 1 1.9 12.7 N/A 患者 2 2.8 17.3 27.3 患者 3 2.9 10.7 N/A 6.3x 6.6x 3.6x 斜体 — 折叠增加 与基线 脑脊液程序输入 (ng/mL) 9.9x |
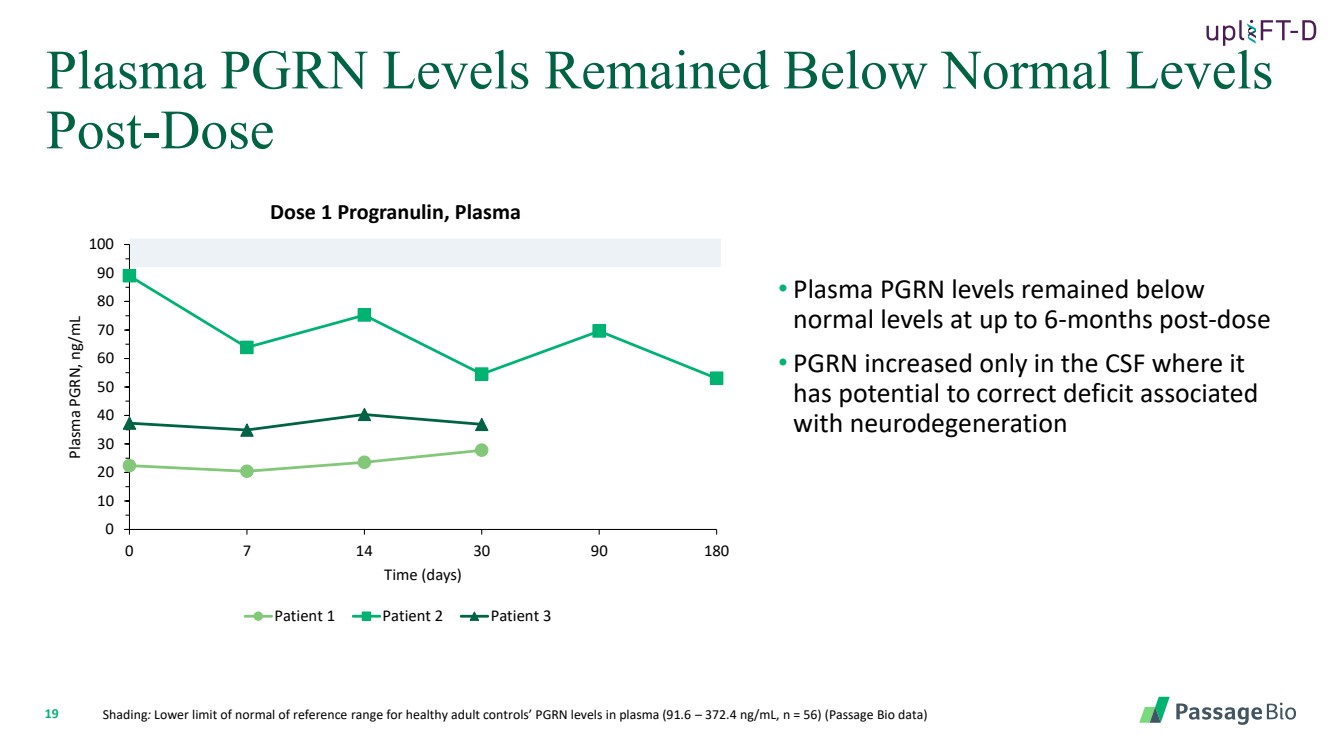
| 19 阴影:健康成人对照组血浆中 PGRN 水平参考范围的下限(91.6 — 372.4 ng/mL,n = 56)(Passage Bio 数据) • 在给药后长达 6 个月内,血浆 PGRN 水平保持在 正常水平以下 • PGRN 仅在脑脊液中增加,其 有可能纠正与神经变性相关的缺陷 血浆 PGRN 水平仍低于正常水平 剂量后 0 10 20 30 40 50 60 70 80 90 100 0 0 7 14 30 90 180 血浆 PGRN,ng/mL 时间(天) 剂量 1 progranulin,血浆 患者 1 患者 2 患者 3 |
| 20 摘要 AES=不良事件;ICM=intra-cisterna magna * 截至2024年1月3日数据截止日期,患者随访时间在给药后2至6个月不等。 SAFETY* PBFT02 迄今为止,第 1 剂量对患者 2 和 3 的耐受性总体良好,他们在 协议修正后接受了修订的 类固醇方案 • 所有 AE 的 强度均为轻度至中度 • 没有证据表明临床 有显著的免疫反应、 肝毒性或静脉窦 血栓 sis • 没有证据 DRG 毒性 • 没有观察到与 ICM 注射 相关的并发症 生物标志物 有证据表明 在第 30 天所有参与者中 靶向 参与的脑脊液progranulin 增加 3.6-6.6 倍 治疗 • 在 此剂量水平 表现优于 NHP 数据 至第 180 天血浆 PGRN 水平不升高超生理脑脊液 PGRN 水平维持在 6 个月 (n=1) 预期 后续步骤 •在 2024 年上半年开始对队列 2 患者进行给药 • 其他 6 个月的数据 来自 2024 年下半年的队列 1 • 来自 2025 年上半年 1 组患者的 12 个月随访数据 •来自 2025 年上半年 第 2 组的初始数据 |
| 展望未来 |
| 22 PBFT02 有可能纠正 FTD-GRN、FTD-c9orf72 和 ALS 中的基础病理 提升 TDP-43 模型中的 PGRN 结果: • 归一化细胞质 TDP-43 累积 • 提高存活率 临床前模型中的 TDP-43 病理学 1Rhinn 他等人。Trends Pharm Sci.2022,43:641-652;2Beel S 等人。Mol Neurodeg. 2018,13:55。 TDP-43 病理学是多种 神经退行性疾病的标志1 • TDP-43 从细胞核错定位到细胞质 • 形成与 神经变性相关的包涵体 |
| 23 PBFT02 有可能调节阿尔茨海默氏病 • GRN SNP rs5848 携带者降低了 PGRN 水平,增加了 AD 的风险 • GRN SNP rs5848 的 AD 患者表现出 PGRN 水平降低和 CSF tau 遗传风险1 SNP:单核苷酸多态性 第三方临床前数据。资料来源:1Chen Y等人。J Neurol. 2015,262:814-22;Takahashi H 等人。Acta Neuropathol。2017,133:785-807。2Fenoglio C 等人。J Alzheimers Dis. 2009, 18:603-612。3Hosokawa M 等人。J Neuropath Exp Neurol. 2015,74:158-65;Minami SS 等人。Nat Med. 2014,20:1157-64;Van Kampen JM & Kay DG。PLOs ONE 2017,12:e0182896 支持 临床前 Evidence3 患病率 • PGRN 消融会加剧小鼠的 AD 病理 • PGRN 过度表达减轻了 AD 模型的病理负担 • GRN SNP rs5848 估计发生在 30% 的普通人群中,AD 患者的患病率与 相似2 |
| 24 TIMING MILESTONE FTD-GRN 2024 年上半年启动队列 2 患者的给药 2024 年下半年 队列 1 患者 6 个月的安全性和生物标志物数据 2025 年上半年来自队列 1 患者的初始安全和生物标志物数据 2024 年下半年获取监管反馈 治疗 FTD-c9orf72 和 ALS 患者的临床路径 即将到来的里程碑和企业 更新 PIPELINE • 寻求潜在的合作伙伴关系,以 推进儿科临床阶段 项目 (GM1, PBFT02Krabbe & MLD) • 优先通过GTP合作伙伴关系推进 亨廷顿氏病计划 资产负债表 • 截至9月30日的 现金余额为1.33亿美元* • 截至2023年9月30日的现金预计将为 运营提供资金至2025年第四季度* * 现金、现金等价物和有价证券 |
| 25 我们的愿景 通过提供可永久重新定义 病程的 基因药物,改善患有神经退行性 疾病的患者的生活 。 潜在的同类最佳计划筹资 FTD-GRN 基因疗法计划 建立了制造和工艺 分析能力 强劲的现金状况,预计 将投资组合扩展到多种成人 神经退行性疾病 * 基于截至2023年9月30日的现金、现金等价物和有价证券 |
| 谢谢 passagebio.com | 纳斯达克:PASG |
| 27 Demonstrated Leadership LEADERSHIP TEAM Deep experience in rare disease, CNS disorders and genetic medicines Chip Cale General Counsel & Corporate Secretary Eden Fucci SVP Technical Operations BOARD OF DIRECTORS Maxine Gowen, Ph.D. Chairwoman Athena Countouriotis, M.D. Avenzo Therapeutics Derrell Porter, M.D. cTRL Therapeutics Dolan Sondhi, Ph.D. Weill Cornell Medicine Sandip Kapadia Harmony Biosciences Saqib Islam, J.D. SpringWorks William Chou, M.D. President & Chief Executive Officer William Chou, M.D. President & Chief Executive Officer Stuart Henderson SVP Corporate Development & Investor Relations Kathleen Borthwick SVP Finance & Interim CFO Mark Forman, M.D., Ph.D. Chief Medical Officer |
| 28 Intra-Cisterna Magna (ICM) Administration • Directly deliver vector into the CSF via a single injection to reach both CNS and peripheral tissues* –Allows for broad CNS biodistribution –Lower doses compared to IV systemic delivery –Reduced impact of neutralizing antibodies • Administered under anesthesia using modern neuroimaging to allow for precise delivery • Currently being used in several clinical studies in both pediatric and adult populations Cisterna magna *Hinderer et. al, Human Gene Therapy. 2018 Jan; 29(1):15-24 |