

2024 年 1 月公司演示附录 99.2

前瞻性陈述本 演示文稿包含1995年《私人证券诉讼改革法》中定义的前瞻性陈述,内容涉及替比培南HBr的潜在监管路径以及 美国食品药品监督管理局(FDA)可能批准替比培南HBr及其未来价值、可能获得的里程碑付款和特许权使用费根据葛兰素史克知识产权 tebipenem HBr 的未来销售 (No.3) Limited(GSK)许可协议;公司的现金跑道;SPR206 和 SPR720 的未来开发和商业化;可以接受替比培南 HBr 和 SPR720 治疗的潜在患者数量以及市场对替比培南 HBr 和 SPR720 的总体需求;替比培南 HBr 的有效性及其对医疗资源利用的潜在影响;预计替比培南可通过付款人渠道获得广泛的准入 HBr;预期的 患者治疗从静脉注射转向口服;开始、时机、进展和结果公司的临床前研究和临床试验及其研发计划,包括管理层对此类结果的 评估;公司临床试验数据可用时间;公司向监管机构申报的时间;产品候选的好处;竞争地位;业务 战略;管理目标;潜在的增长机会;潜在的市场规模;报销事项;可能或假设的未来经营业绩;预计成本和可用性的额外除任何最初资助的奖励外,来自 政府机构的非稀释性资金。在某些情况下,前瞻性陈述可以通过诸如 “可能”、“将”、“应该”、“预期”、“计划”、 “目标”、“预期”、“可能”、“意图”、“目标”、“项目”、“考虑”、“相信”、“估计”、“预测”、 “潜力” 或 “继续” 等术语来识别,或者这些条款或其他术语的否定值类似的表情。本演示文稿中除历史事实陈述以外的所有陈述均为前瞻性陈述。 公司可能无法实际实现这些前瞻性陈述中披露的计划、意图或预期。由于各种因素,实际结果或事件可能与这些 前瞻性陈述中披露的计划、意图和预期存在重大差异,包括 FDA 最终是否会批准替比培南 HBr,如果是,任何此类批准的时机;美国食品和药物管理局是否要求任何额外的临床数据或对替比培南氢溴酸的使用施加标签 限制,这将增加公司成本、推迟批准和/或降低商业用途 tebipenem HBr 的前景;公司对额外资金的需求;漫长的 临床药物开发过程昂贵且不确定;如果获得批准,公司依赖第三方制造、开发和商业化其候选产品;如果获得批准,公司候选产品的开发和商业化的能力; COVID-19 疫情的潜在影响;公司留住关键人员的能力;临床前研究和临床试验中获得的结果是否表示未来临床试验取得的结果,以及是否 来自公司临床试验的初步数据将预测此类试验的最终结果;公司对筹集资金的依赖,以及公司的候选产品是否会及时推进 临床前开发和临床试验流程,或根本没有考虑到可能的监管延误的影响、患者入组慢于预期、制造挑战、临床试验 设计、临床数据要求和临床结果等因素;此类临床试验的结果是否值得提交批准来自 FDA或同等外国监管机构;美国食品和药物管理局和 同等外国监管机构就公司候选产品的开发和商业化做出的决定;公司候选产品的商业潜力;公司 为其候选产品获得足够的第三方补偿的能力;公司是否将满足根据其各种许可和合作协议获得里程碑付款的所有先决条件;BARDA是否选择行使 这是第二个公司与BARDA协议下的期权;公司实施其战略计划的能力;公司为其候选产品获得、维护和执行知识产权和其他专有权利的能力 ;与市场状况相关的风险和不确定性;公司的现金资源是否足以为预期时期和/或试验的持续经营提供资金;以及公司提交的定期报告 “风险因素” 部分中讨论的其他因素 与美国证券交易所合作委员会(SEC),以及公司未来可能向美国证券交易委员会提交的其他文件中描述的风险。本演示文稿中包含的 前瞻性陈述代表公司截至本演示文稿之日的观点。该公司预计,随后的事件和事态发展将导致其观点发生变化。但是,尽管 公司可能会选择在未来的某个时候更新这些前瞻性陈述,但它明确表示不承担任何更新这些前瞻性陈述的义务。不应依赖这些前瞻性陈述来代表本演示之日后任何日期 的公司观点。

多元化的临床阶段产品组合 开发罕见和耐多药传染病的疗法 SPR720,为短期转折做好准备。伙伴关系里程碑和现金等价物预计将持续到2025年底 NTM: 非结核分枝杆菌;NTM-PD:非结核分枝杆菌肺病;Tebipenem HBr:氢溴酸替比培南(前身为 SPR994);QIDP: 合格的传染病产品 1.Winthrop KL 等Ann Am Thorac Soc 2020; 17:178-85。后期开发管线侧重于口服、小分子药物在可解决的患者群体中需求量高的适应症孤儿药和/或 QIDP 名称强大的全球知识产权潜力 非结核分枝杆菌肺病 (NTM-PD) 新型口服一线疗法发达市场约有24.5万名确诊患者1 预计在 2024 年下半年未获批准的一线疗法概念验证收入数据由世界级合作伙伴支持
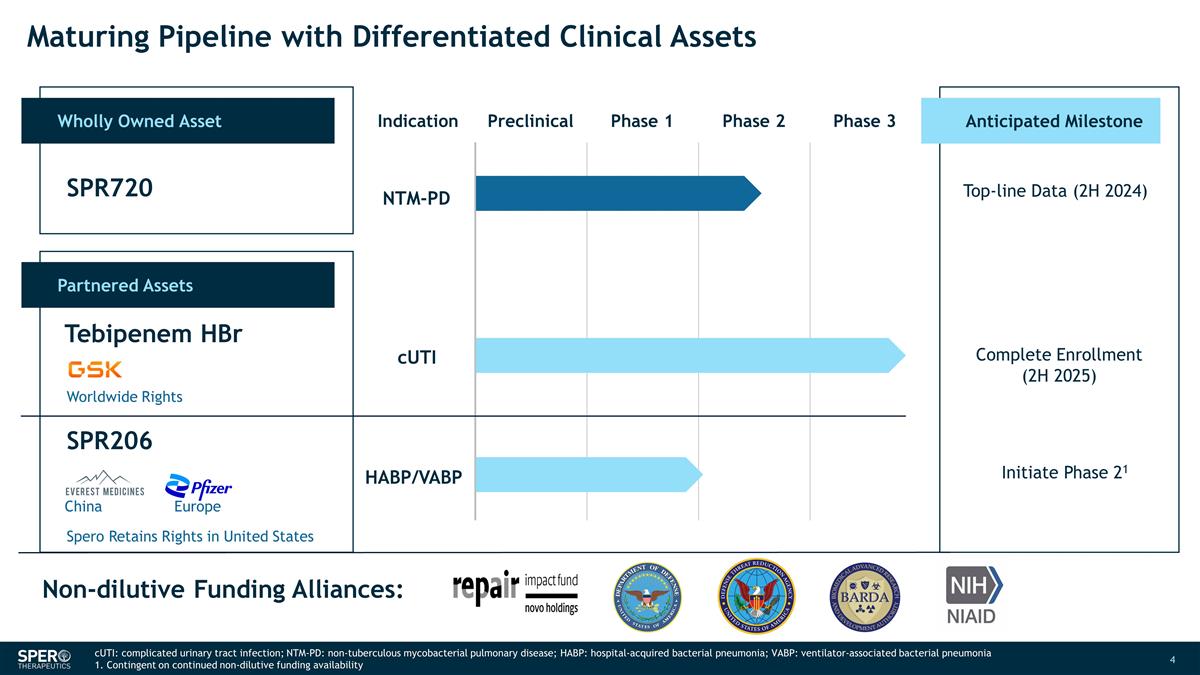
具有差异化 临床资产的成熟管道全资资产适应症临床前第一阶段第二阶段第三阶段合作资产 SPR720 替比培南 HBR SPR206 预期里程碑 NTM-PD 收入数据(2024 年下半年)完成注册(2025 年下半年)启动第 21 阶段非稀释性融资 联盟:全球权利 Spero 保留在美国的权利 CUTi HABP/VABP 中国欧洲 CUTi:复杂尿路感染;NTM-PD:非结核性分枝杆菌肺病;HABP:医院获得性细菌性肺炎;VABP: 呼吸机相关细菌性肺炎 1.视持续的非摊薄资金供应情况而定
SPR720
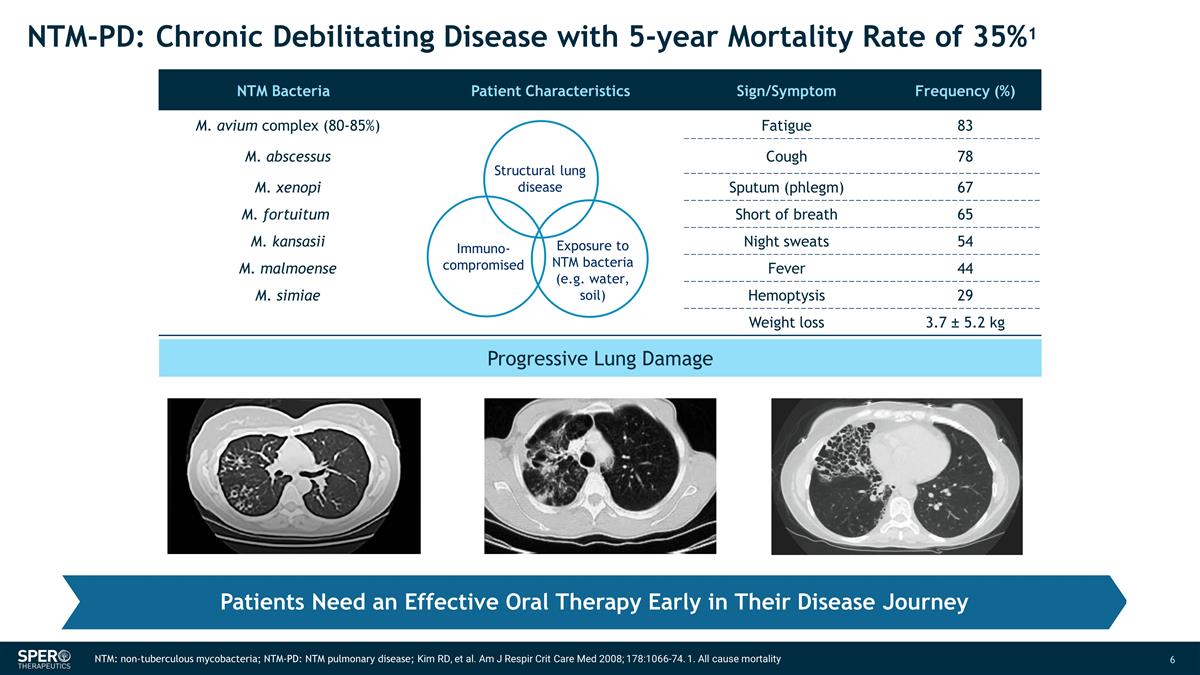
进行性肺损伤 NTM: 非结核分枝杆菌;NTM-PD:NTM 肺部疾病;Kim RD 等人Am J Respir Crit Care Med 2008;178:1066-74。1.所有原因死亡患者在疾病旅程的早期都需要有效的口服治疗 NTM-PD:慢性衰弱 疾病,5 年死亡率为 35% 1 NTM 细菌患者特征体征/症状频率 (%) m. avium complex (80-85%) 疲劳 83 M. 脓肿咳嗽 78 M. xenopi 痰(痰)67 M. fortuitum 呼吸急促 65 M. kansasii 夜间盗汗 54 M. malmoense Fever 44 M. simiae Heoptysis 29 减肥 3.7 ± 5.2 kg 结构性肺部疾病暴露于 NTM 细菌(例如水、土壤)免疫受损
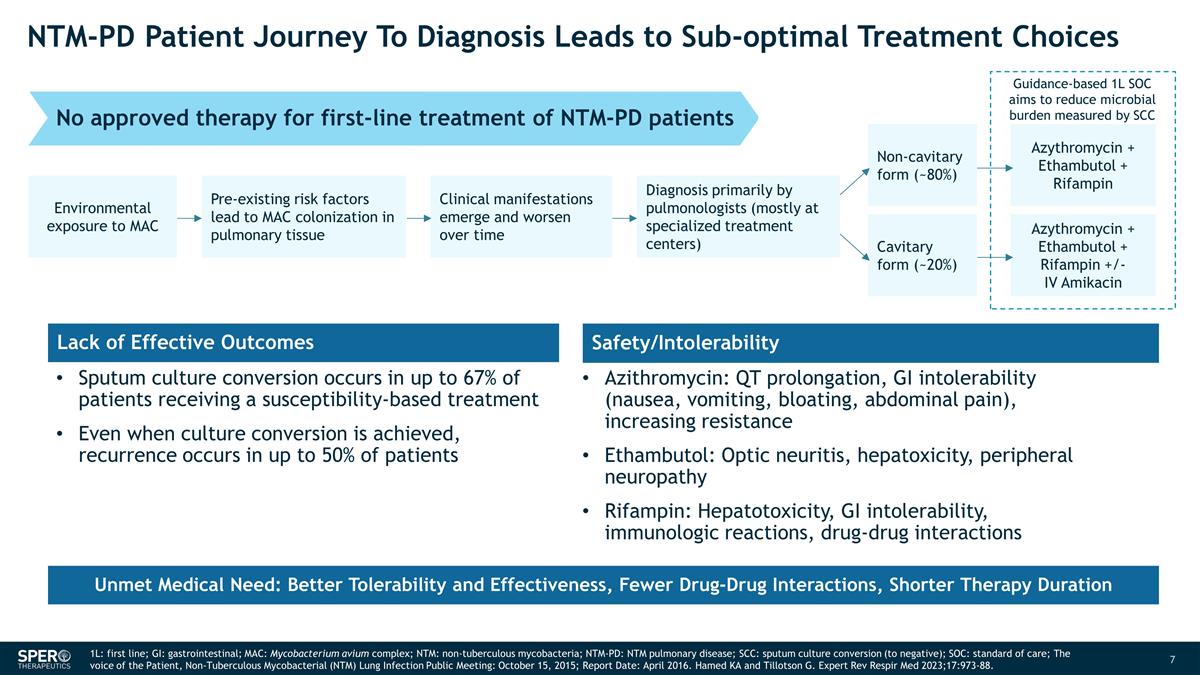
NTM-PD 患者的诊断之旅 导致次优治疗选择基于指南的 1L SOC 旨在减轻微生物负担 MAC 的环境暴露会导致 MAC 在肺组织中定植临床表现和 随着时间的推移而恶化主要由肺科医生(主要在专业治疗中心)非空洞形式(约 80%)空腔形式(约 20%)阿齐霉素 + 乙胺素丁醇 + 利福平阿齐霉素 + 乙胺丁醇 + 利福平 +/-IV 阿米卡星痰液培养 转化率高达 67%接受敏感性治疗的患者中,即使实现培养转化,仍有高达 50% 的患者会复发。缺乏有效疗效安全性/不耐受性阿奇霉素:QT 延长、胃肠道不耐受(恶心、呕吐、腹胀、腹痛)、耐药性增强 Ethambutol:视神经炎、肝毒性、周围神经病变利福平:肝毒性、胃肠道不耐受可行性、免疫学反应、药物 相互作用未获批准用于一线治疗 NTM-PD 患者未获批准的疗法未满足的医疗需求:更好的耐受性和有效性,更少的药物相互作用,更短的治疗时间 1L:一线;GI:胃肠道;MAC: 鸟分枝杆菌复合物;NTM:非结核分枝杆菌;NTM-PD:NTM 肺部疾病;SCC:痰培养转换(阴性);SOC:护理标准;患者的声音,非结核分枝杆菌(NTM)肺部感染 公开会议:2015 年 10 月 15 日;报告日期:2016 年 4 月。Hamed KA 和 Tillotson G. Expert Rev Respir Med 2023;17:973-88。
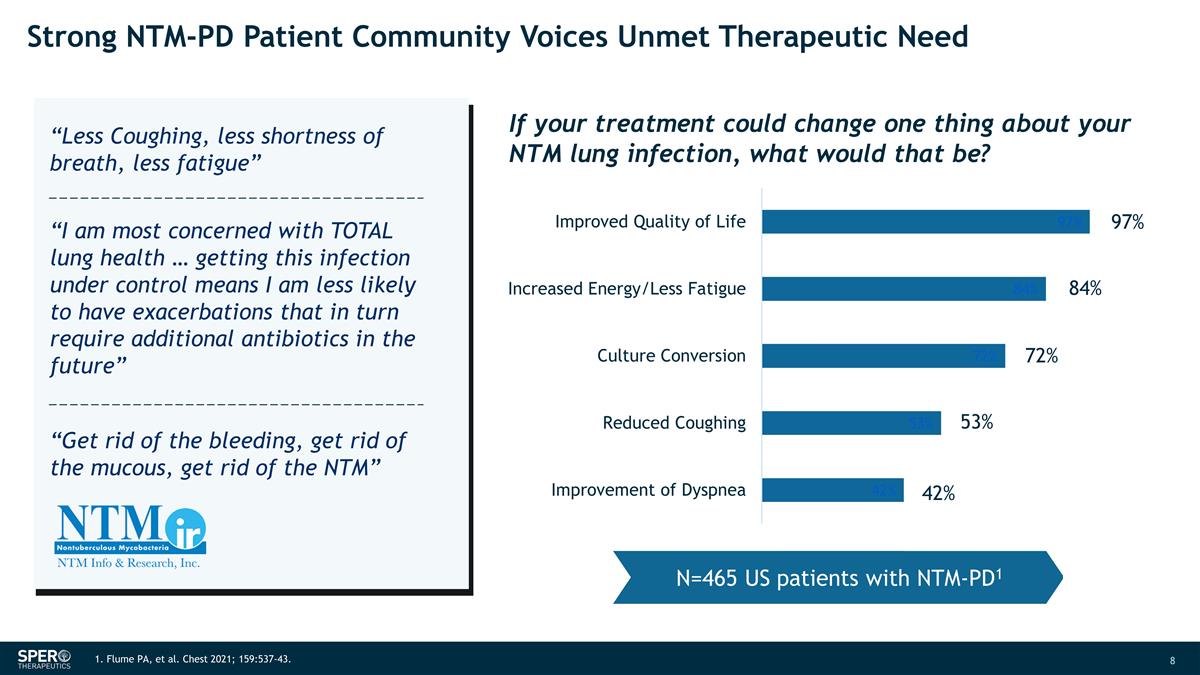
NTM-PD 患者社区的强烈声音 未满足的治疗需求 97% 84% 72% 53% 42% 42% 1.Flume PA 等人胸部 2021;159:537-43。N=465 名 NTM-PD1 美国患者如果你的治疗可以改变你的 NTM 肺部感染的一件事,那会是什么?“减少咳嗽,减少 呼吸急促,减少疲劳” “我最关心的是肺部的整体健康... 控制这种感染意味着我将来不太可能出现需要额外抗生素的发作” “摆脱 出血,清除粘液,清除 NTM”
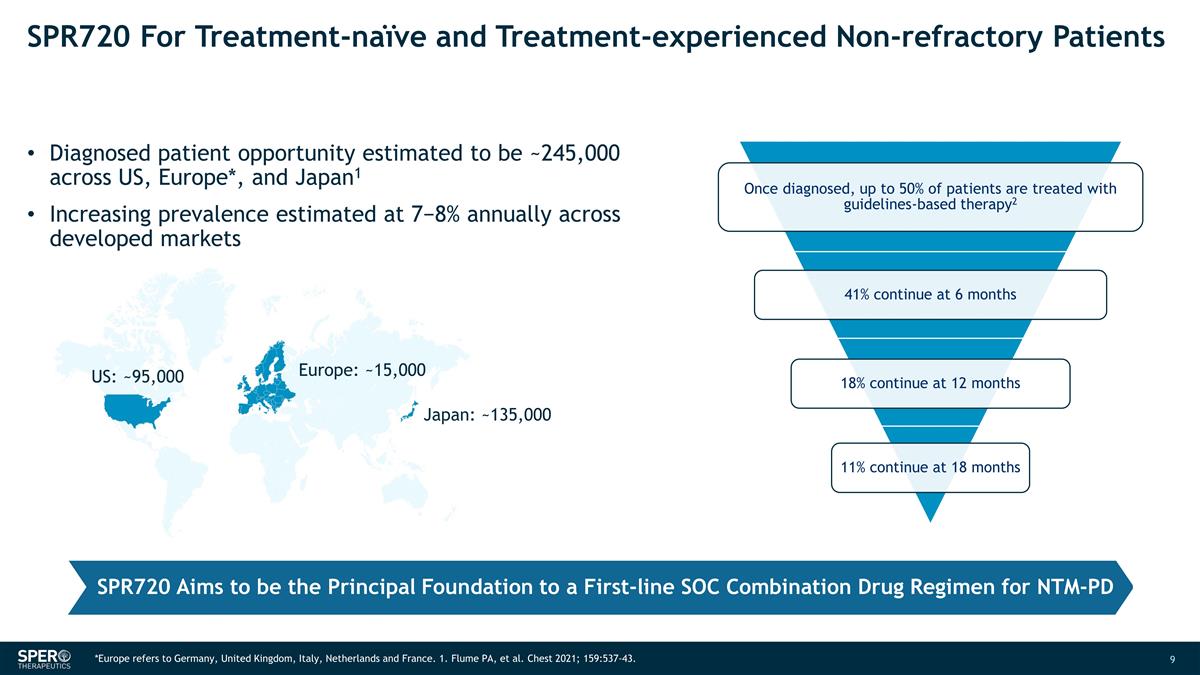
SPR720 适用于未接受治疗和 经历过治疗的非难治性患者在美国、欧洲*和日本确诊的患者机会约为24.5万人1 发达市场的患病率估计每年增长 7−8% 欧洲:~15,000 日本:~135,000 美国: ~95,000 SPR720 旨在成为 NTM-PD 一线 SOC 联合药物方案的主要基础 *欧洲是指德国、英国、意大利,荷兰和法国。1.Flume PA 等人胸部 2021;159:537-43。

SPR720 在一线环境中完全有能力满足未得到满足的 患者需求 M.:分枝杆菌;MAC:M. avium 复合物;NTM:非结核分枝杆菌;SOC:护理标准;QIDP:合格的传染病产品;1.Brown-Elliott BA 等Antimicrob Agents Chemother。2018 62: e01503-18. 2.同上,3。Aragaw WW 等人Microbiol Spectr 2022;10:e0132121。改善一线 SOC 方案对多种 NTM 病原体(包括 MAC 和 M. abscessuss)的效力1 新的作用机制有证据表明对 上市的抗生素有交叉耐药性2且选择耐药性的倾向低3 迄今为止的数据支持疗效、巨噬细胞渗透率和安全性/耐受性的潜在支持可通过 2033 授予的孤儿药与食物成分专利一起使用称号和 QIDP 名称
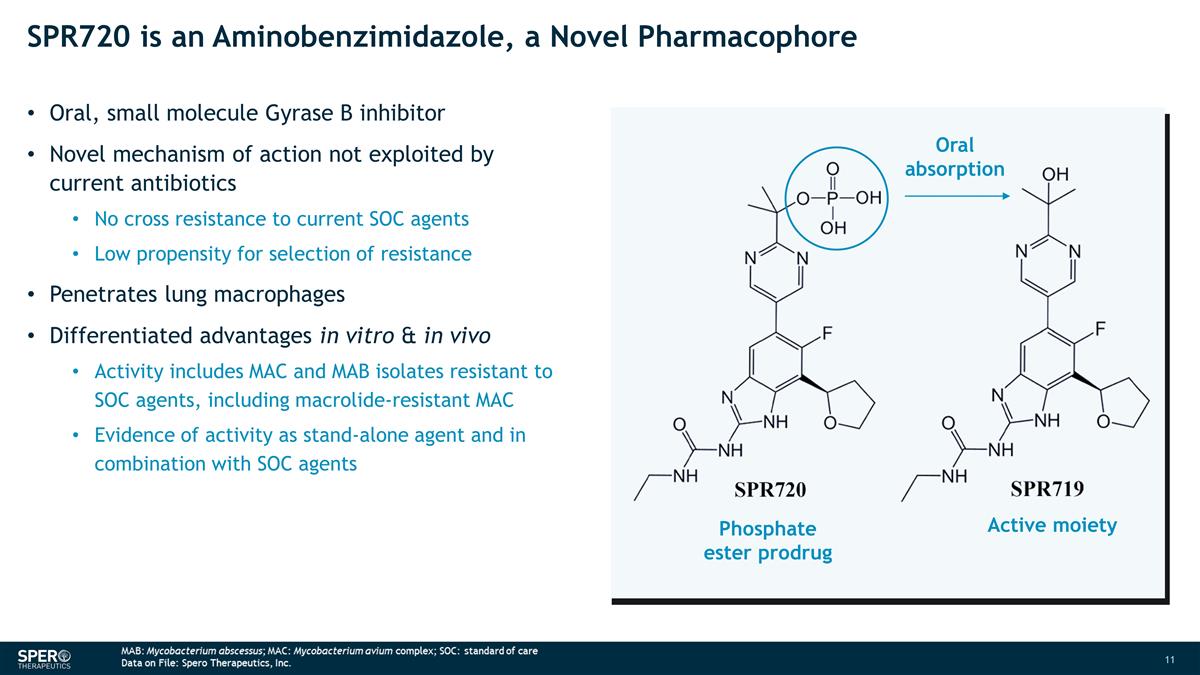
SPR720 是一种氨基苯并咪唑,一种 新型药效团口服、小分子 Gyrase B 抑制剂当前抗生素未利用的新作用机制对当前 SOC 药物没有交叉耐药性低选择耐药倾向低穿透肺巨噬细胞 体外和体内的差异化优势活性包括 MAC 和 MAB 分离物对大环内酯类药物具有耐药性,包括耐大环内酯的 MAC 和 MAB 分离物作为独立药物的活性证据与 SOC 药物联合使用磷酸酯 前药活性部分口服吸收
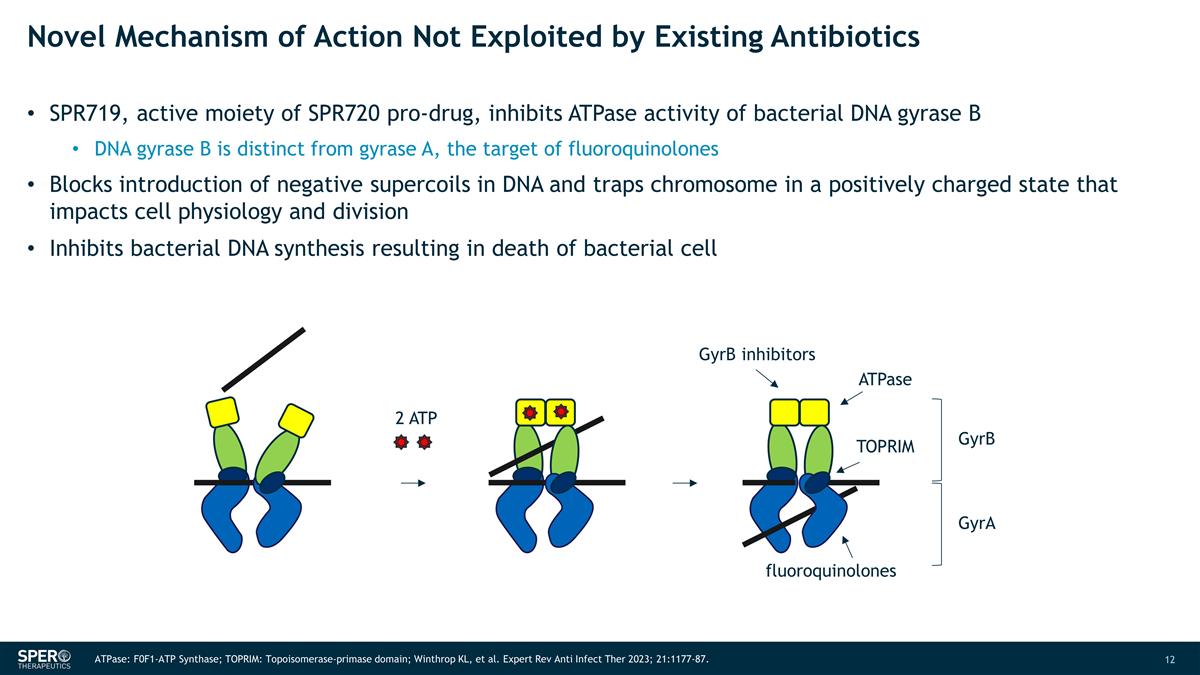
未被现有抗生素利用的新作用机制 SPR719 是 SPR720 前药的活性部分,可抑制细菌 DNA 回旋酶 B 的 ATPase 活性 DNA 回旋酶 B 与回旋酶 A 不同,氟喹诺酮类药物的靶标阻止 DNA 中负超线圈的引入,将染色体困在正电荷状态,从而影响细胞生理和分裂抑制细菌 DNA 合成导致细菌死亡细胞 2 ATP GyrB 抑制剂 ATPase TOPRIM 氟喹诺酮类 gyrB gyrA ATPase:F0F1-ATP 合成酶;TOPRIM:拓扑异构酶-primase primase域;Winthrop KL 等Expert Rev Anti Infect Ther 2023;21:1177-87。
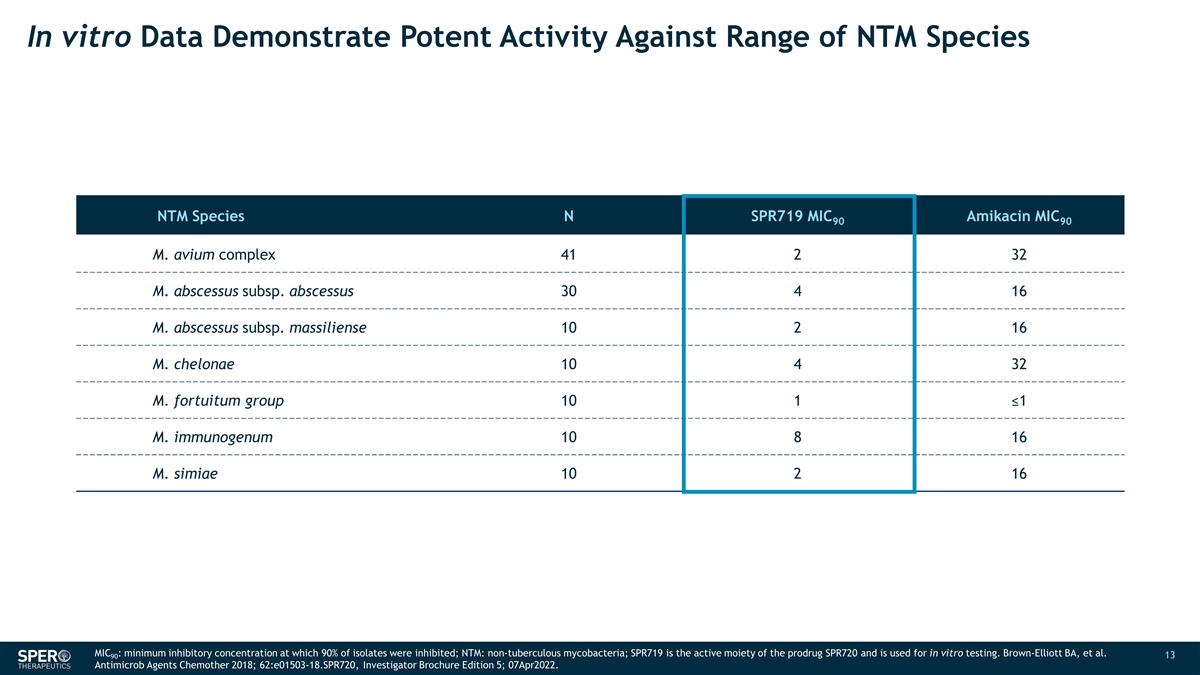
体外数据显示 对一系列 NTM 物种 N SPR719 MIC90 Amikacin MIC90 M. avium 复合体 41 2 32 M. abscessus subsps. abscessus subscessus subsps。massiliense 10 2 16 M. chelonae 10 4 32 M. fortuitum 组 10 1 ≤1 M. 免疫原 10 8 16 M. simiae 10 2 16 M. chelonae 10 4 32 M. 2 16 MIC90:最低抑制浓度,90% 的分离物受到抑制;NTM:非结核分枝杆菌;SPR719 是前药 SPR720 的活性部分,用于体外试验。 Brown-Elliott BA,等Antimicrob Agents Chemother 2018;62:e01503-18.spr720,研究者手册第 5 版;2022年4月7日。
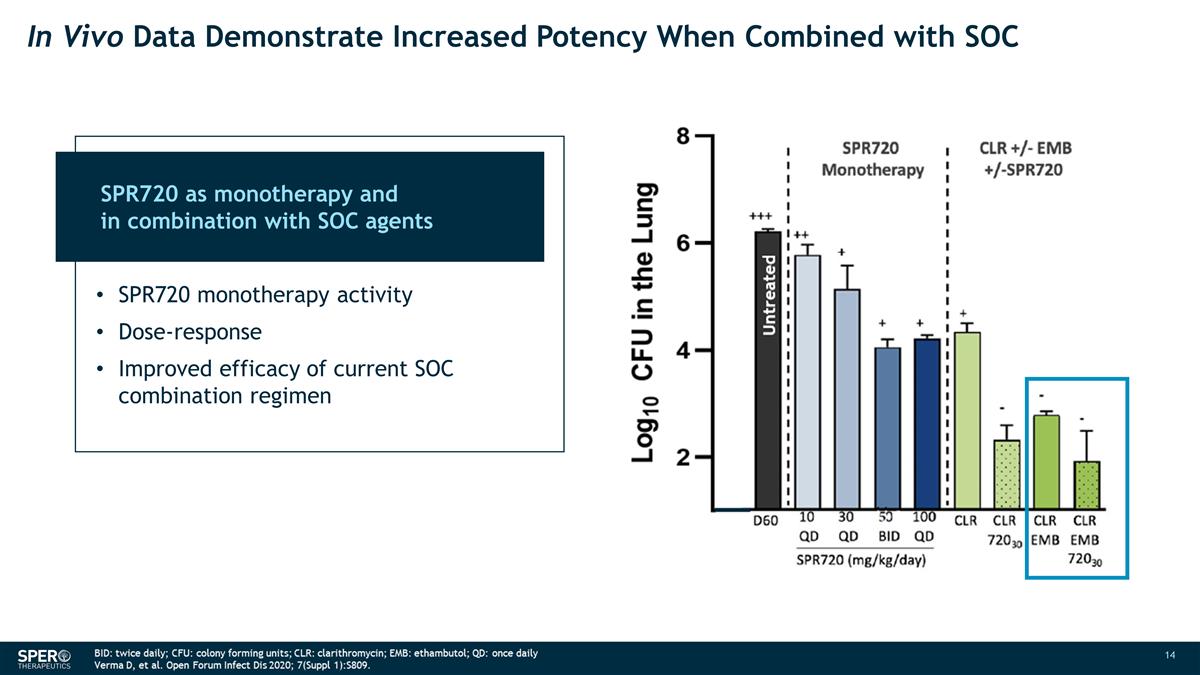
体内数据表明,与 SOC 联合使用未经治疗的 SPR720 作为单一疗法以及与 SOC 药物联合使用时, 效力会提高 SPR720 单一疗法活性剂量反应当前 SOC 组合方案的疗效得到改善
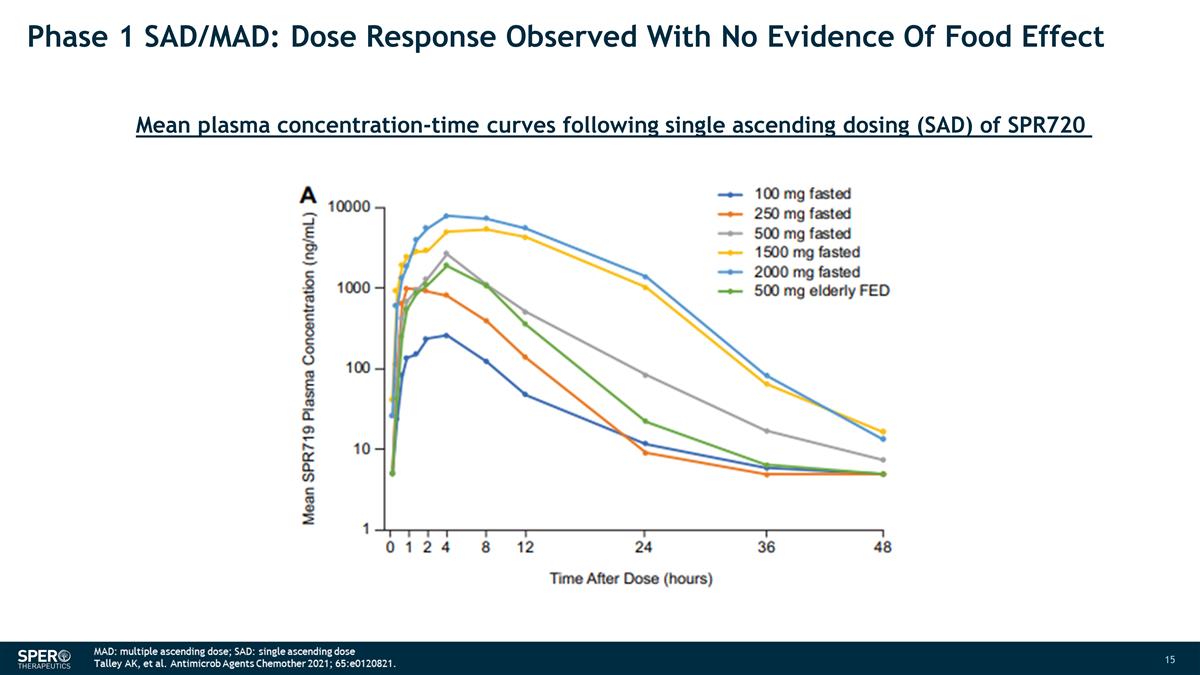
第 1 阶段 SAD/MAD:在没有食物效应证据的情况下观察到剂量反应 SPR720 单次上升剂量 (SAD) 后的平均血浆浓度时间曲线

第 1 阶段 SAD/MAD:良好的 安全性/耐受性概况 500 mg 和 1000 mg 剂量在 7 天和 14 天内进行了评估。血浆暴露的剂量依赖性增加未报告 SAE;剂量 ≥ 1500 mg 时出现轻度胃肠道症状一次停药:无症状、可监测和可逆的 2 级胰腺酶 升高 1 期结果显示 SPR720 耐受性良好,暴露量高于预期的治疗水平
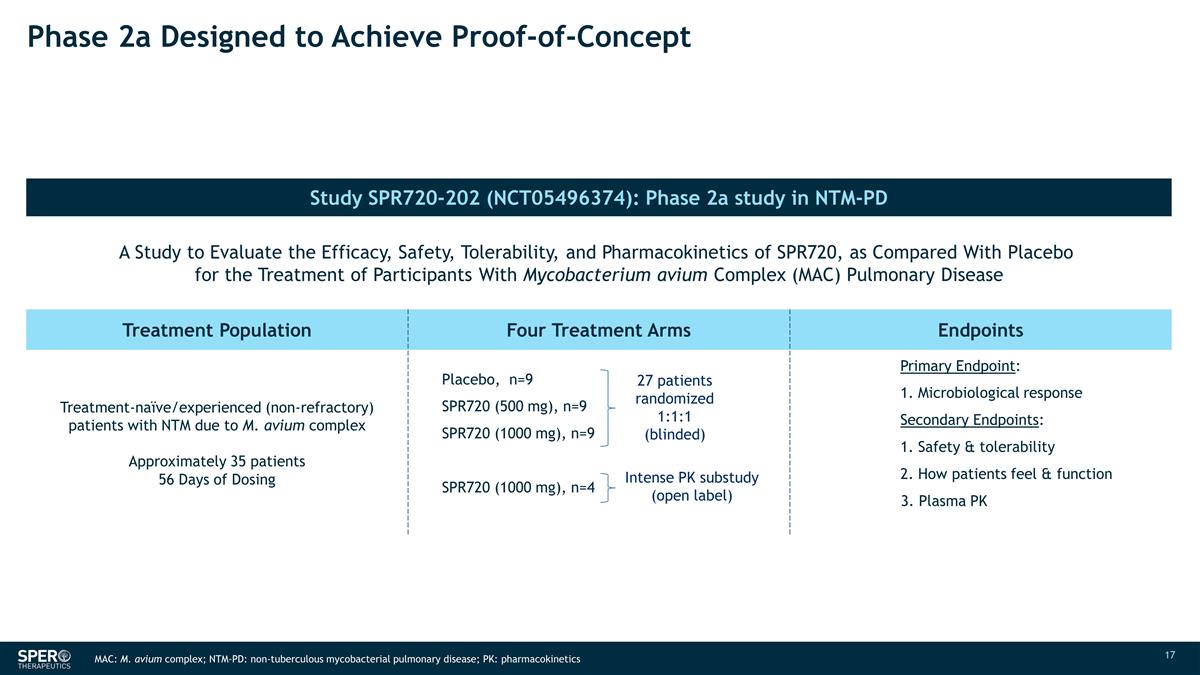
2a 期旨在实现 概念验证研究 SPR720-202 (NCT05496374):NTM-PD N SPR719 MIC50 的 2a 期研究旨在评估 SPR720 与安慰剂相比,用于治疗 航空分枝杆菌复合物 (MAC) 肺部疾病参与者的疗效、安全性、耐受性和药代动力学 30 2 治疗群体四个治疗组终点治疗——天真/有经验(非难治性)患者大约 35 名患者服用 安慰剂量 56 天,n=9 SPR720(500 mg),n=9(500 mg),n=9 SPR720(1000 mg),n=9(1000 mg),n=9 SPR720 (1000 mg),n=4 主要终点:1。微生物反应次要终点:1. 安全性和耐受性 2.患者的感觉和功能 3.血浆 PK 27 名患者随机 1:1:1(失明)强度 PK 子研究(开放标签)MAC:M. avium 复合物;NTM-PD:非结核分枝杆菌肺部疾病;PK: 药代动力学

预计将在 2024 年下半年推出综合数据集 我们预计将有一个强大的数据集为 SPR720 作为 NTM-PD 微生物反应一线疗法的注册路径提供信息,以证明患者报告的结局具有抗 NTM 活性,为 后期试验中的主要终点提供信息 患者药代动力学来自支气管肺泡灌洗 (BAL) 研究的肺内 PK,健康志愿者确定共同给药 SPR720 的 PK,azithromythromythromythromy{ br} 健康志愿者体内的素和乙胺丁醇确认了先前研究中证实的安全性/耐受性MAC:M. avium 复合物;NTM-PD:非结核分枝杆菌肺部疾病;PK:药代动力学
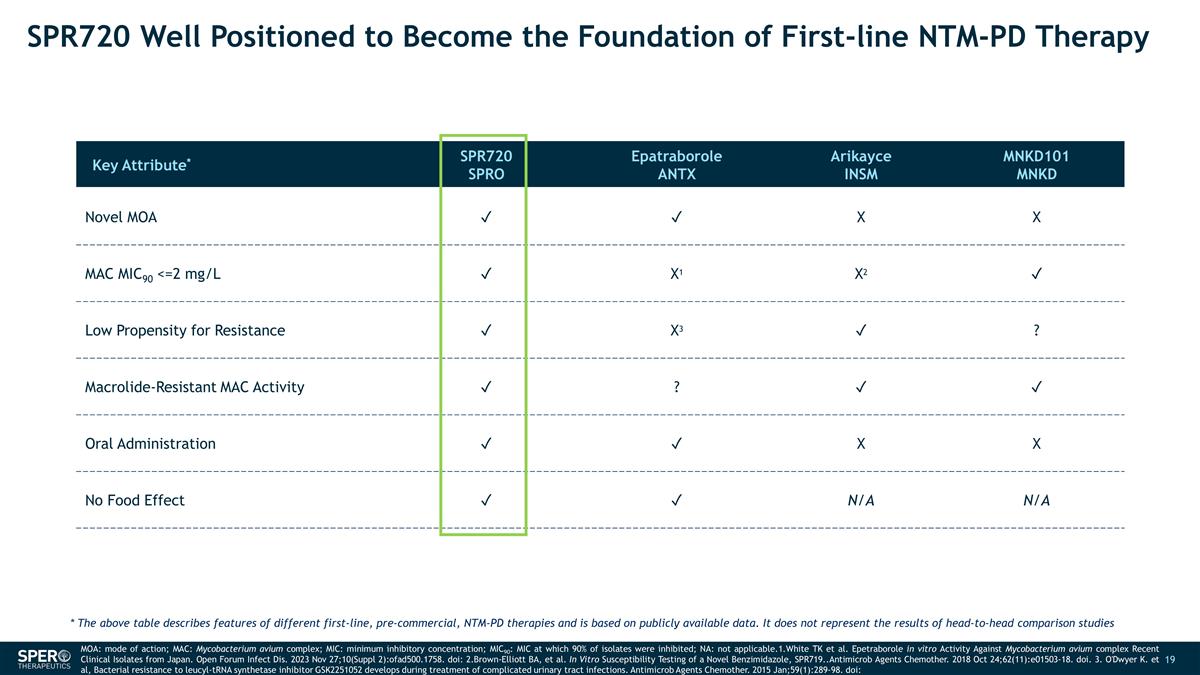
SPR720 完全有能力成为 一线 NTM-PD 疗法的基础关键属性* SPR720 SPRO Epatraborole ANTX Arikayce INSM MNKD101 MNKD Novel MOA ✓ ✓ X X MAC MIC90
替比培南 HBr 口服 碳青霉烯
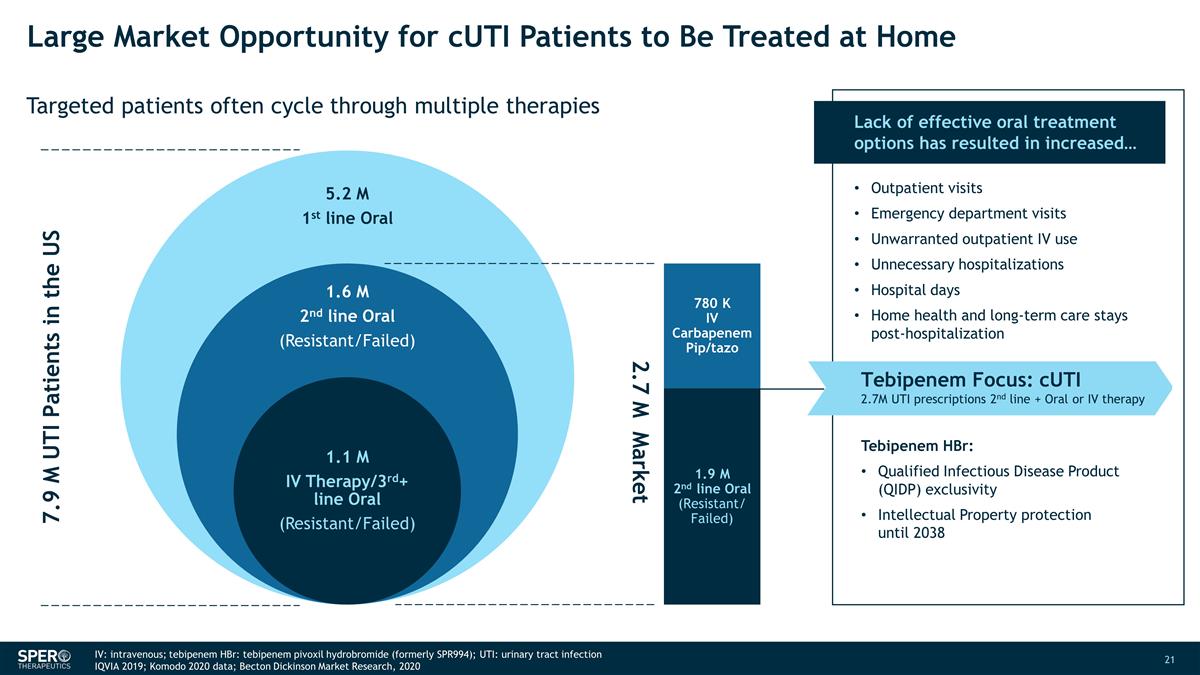
CUTi 患者在家接受治疗的巨大市场机会靶向患者经常循环使用多种疗法 790 万名美国尿路感染患者 270 万市场 780 K IV Carbapenem pip/Tazo 190 万二线口服(耐药/失败)缺乏有效的口服治疗选择 导致... 门诊就诊急诊室就诊不必要的门诊静脉注射不必要的住院天数家庭健康和长期住院住院后继续护理 Tebipenem Focus:CUTi 270 万 UTI 处方二线 + 口服或静脉注射疗法替比培南 HBr:合格传染病产品(QIDP)专属权2038年前的知识产权保护 IV:静脉注射;替比培南 HBr:氢溴酸替比培南(前身为 SPR994); UTI:尿路感染 IQVIA 2019;Komodo 2020 年数据;Becton Dickinson 市场研究,2020

Tebipenem HBr:如果获得批准,可能有 CUTi的差异化口服疗法潜在的首次上市口服碳青霉烯第三期注册全球商业合作伙伴关系门诊环境中复杂尿路感染的潜在治疗除了传染性 疾病专家以外的广泛处方者基础广泛的处方者基础广泛的处方者基础 2038 年 QIDP 认证获美国食品药品管理局特别协议评估 (SPA) 注册批准的 PIVOT-PO 试验方案始于 2023 年第四季度的 “第一位患者,第一剂量” 将全球商业权 外包给葛兰素史克稳健的财务条款,包括潜力开发、监管和商业里程碑以及分级销售特许权使用费 CUTi:复杂尿路感染;IP:知识产权;tebipenem HBr:tebipenem pivoxil 氢溴酸替比培南 (前身为 SPR994);QIDP:合格的传染病产品
与 葛兰素史克签订的 Tebipenem HBr 和股权投资独家许可协议全球合作财务条款葛兰素史克获得了在除日本和某些其他亚洲国家以外的所有地区开发和商业化替比培南 pivoxil 和 tebipenem HBr 的独家许可协议 (明治精工地区)Spero 负责美国替比培南 HBr 后续第 3 阶段的执行和费用葛兰素史克是负责 tebipenem HBr 在美国的商业活动的执行和成本,以及 以及所有开发和商业活动在美国以外地区(不包括明治精工领地)的活动交易于2022年11月7日结束 Spero收到了6600万美元的预付款,葛兰素史克向Spero额外投资了900万美元 普通股,有资格获得高达5.25亿美元的开发、商业和销售里程碑款项(迄今为止符合条件的1.25亿美元),剩余2500万美元,将是 根据葛兰素史克提交替比培南 HBr 的新药申请 (NDA) 付费。潜在投资额高达1.5亿美元基于首次商业销售的商业里程碑高达2.25亿美元的销售相关里程碑付款 Spero 将获得分级 从低个位数到低两位数(如果销售额超过10亿美元)的分层特许权使用费

三期临床试验 PIVOT-PO: 关键设计经美国食品药品管理局谈判达成特别协议评估协议(SPA):美国食品药品管理局表示,PIVOT-PO的积极和有说服力的结果以及先前完成的研究,可能足以支持批准替比培南 HBr 作为 CUTi(包括肾盂肾炎)的治疗药物,用于有限用途适应症研究 Tebipenem HBr(NCT06059846):3期临床试验 CUTi N SPR719 MIC50 A 3 期试验,旨在评估口服 疗效和安全性的随机、双盲、双假人、多中心研究与静脉注射亚胺培南-西拉斯汀相比,在复杂尿路感染 (CUTi) 或急性肾盂肾炎 (AP) 的患者中给药 Tebipenem Pivoxil (tbp-PI-HBR) 30 2 治疗 人群两个治疗组终点被诊断为 cUTi 或 AP 的患者大约 2648 名患者(按年龄、基线诊断等分层)7-10 天剂量 1.TBP-PI-HBR(600 mg)口服和 “虚拟” 静脉输液,每 6 小时一次,第 1-10 天(n=1324)2。亚胺培南-西拉斯汀(500 mg)静脉注射和相应的 “假人” 片剂,每 6 小时口服一次,第 1-10 天,(n=1324)主要终点:1。微型 ITT 人群中 TOC 的总体反应初步分析:1. 评估微型ITT人群的非劣势(NI),基于10%的NI利润率 AP:急性肾盂肾炎;cUTi:复杂尿路感染;tbp-pi-HBR/Tebipenem HBR:氢溴酸替比培南(前身为 SPR994)
SPR206 直动式 IV 增压器

SPR206:正在进行的临床 开发有可能解决尚未满足的重大需求 SAD/MAD 1 期试验在预测的治疗剂量水平下没有肾毒性的证据支气管肺泡灌洗 1 期试验耐受性良好评估和实现的肺部暴露量与预测的治疗水平一致临床前 研究支持提高疗效除了传统抗生素和潜在的单一药物活性之外,肾功能损害 1 期试验在后续试验中支持对受肾功能差异影响的患者进行肾脏剂量 ✓ ✓ ✓ ✓ 2 期 HABP/VABP 概念验证研究:IND 于 2023 年第四季度提交 ✓ SPR206 有可能满足对耐碳青霉烯类病原体耐受性良好、有效的单药治疗未得到满足的需求 当前的护理标准涉及以下药物组合:通常与肾毒性有关 HABP: 医院获得性细菌性肺炎;MAD:多次递增剂量;SAD:单次递增剂量;VABP:呼吸机相关细菌性肺炎 1。Bruss J 等人。Antimicrob Agents Chemother 2021;65: e0073921. 2.Rodvold KA 等。Antimicrob Agents Chemother 2023;67:e0042623。3.Bruss JB 等Antimicrob Agents Chemother 2023;67:e0050523。

领导团队 Timothy Keutzer 首席运营官此前是 Spero 的首席开发官,前任项目和投资组合管理副总裁,Cubist 拥有丰富的抗生素开发经验,从临床前到获批在制药 行业工作超过 30 年 James Brady 首席人力资源官曾在 UniQure Therapeutics 任首席人力资源官;Intarcia Therapeutics 人力资源副总裁 30 多年的高级人力资源领导经验,在生命科学领域工作超过 17 年 Sath Shukla 总裁兼首席执行官前首席财务官在 Spero Therapeutics 任职;Ziopharm Oncology 前首席财务官;Vertex 副总裁兼全球企业融资主管 20 多年的财务领导经验,曾在商业和临床 公司任职 Tamara Joseph,JD,LLM 首席法务官在生物技术领域拥有 20 多年的领导和法律经验,包括美伦多疗法、Enzyvant Therapeutics、Invivo Therapeutics 和 Cubist 等多家生物技术公司的总法律顾问 Kamal Hamed,医学博士、公共卫生硕士、工商管理硕士首席医学官前首席营销官(Lysovant Sciences)、开发与医疗主管事务(巴西利亚)治疗领域负责人(诺华)领导了抗菌药、抗病毒药物、抗疟药和抗真菌药物的各种抗感染临床 开发项目 Esther Rajavelu 在制药行业工作超过 20 年,首席财务官首席商务官在生命科学领域拥有二十多年的经验, 将股票研究、投资银行、战略咨询和并购相结合。曾任过 Fulcrcr首席财务官疗法。瑞银、奥本海默和德意志银行的高级股票研究分析师。美国银行的医疗保健投资银行家。 *商标是其各自所有者的财产

谢谢