
INF904:第一阶段 MAD 研究的头条结果,2024 年 1 月 4 日

重要声明和免责声明本演示文稿由InflarX
N.V.(“InflarX” 或 “公司”)编写。本演示仅供参考,不构成卖出要约或购买证券要约的邀请。
购买或出售任何证券时不得依赖本演示文稿,也不得解释为投资建议。前瞻性陈述本演示文稿包含前瞻性陈述。除历史事实陈述以外的所有陈述均为
前瞻性陈述,通常用 “可能”、“将”、“应该”、“期望”、“计划”、“预期”、“可能”、“打算”、“目标”、“项目”、“估计”、“预测”、“潜在” 或 “继续” 等术语来表示。
前瞻性陈述出现在本新闻稿的多个地方,可能包括有关我们的意图、信念、预测、展望、分析和当前预期的陈述,除其他外,涉及 COVID-19 患者和美国医院对戈希比奇(维洛贝利单抗)作为 COVID-19 治疗药物的接受程度以及医疗/保健机构和其他第三方组织的相关治疗建议、我们成功商业化的能力以及 Gobic 的接受程度 Hibic(维洛贝利单抗)作为治疗方法COVID-19 患者和美国医院或我们的其他候选产品的 COVID-19;我们对患者群体规模、市场
机会、承保范围和报销、预计回报和应计回报以及其批准或授权适应症或维洛贝利单抗和任何其他候选产品的临床用途的预期,在
紧急使用授权下以及未来获准商业用途后美国或其他地方;我们未来临床试验的成功vilobelimab 对 COVID-19 和其他使人衰弱或危及生命的
炎症适应症(包括坏疽性脓皮病)和任何其他候选产品(包括 INF904)的治疗,以及此类临床结果是否会反映先前进行的临床前研究和临床试验的结果;
候选产品的临床前研究和临床试验的时机、进展和结果,以及关于启动和完成研究或试验及相关试验时机的声明准备工作,在此期间
试验结果将公布,此类试验的费用和我们的总体研发计划;我们与监管机构就临床试验结果和潜在的监管批准途径进行的互动,
包括我们提交的维洛贝利单抗上市许可申请和我们提交的Gohibic(维洛贝利单抗)生物制剂许可申请,以及我们获得和维持维洛贝利单抗全面监管批准的能力
或戈希比奇(维洛贝利单抗)以获取任何适应症;无论是美国食品和药物管理局、欧洲药品管理局或任何类似的外国监管机构将接受或同意我们临床试验的数量、设计、规模、进行或
实施,包括此类试验的任何拟议主要或次要终点;我们对维洛贝利单抗任何批准适应症范围的期望;我们利用专有的抗C5a
和 C5ar 技术来发现和开发治疗补体介导的自身免疫疗法的能力;以及炎症性疾病;我们保护、维持和对维洛贝利单抗和任何其他候选产品
及其保护范围实施知识产权保护;我们的制造能力和战略,包括制造方法和工艺的可扩展性和成本以及制造方法和工艺的优化,以及我们
继续依赖现有第三方制造商的能力,以及我们聘请更多第三方制造商参与我们计划的未来临床试验和维洛贝利单抗商业供应的能力完成的产品
Gohibic(vilobelimab);我们对支出、持续损失、未来收入、资本要求以及我们获得额外融资的需求或能力的估计;我们对候选产品在临床测试
或任何商业销售获得批准后提出的责任索赔进行辩护的能力;如果我们的任何候选产品获得监管部门的批准,我们遵守和履行持续义务的能力以及持续的监管概述;我们的
在寻求时遵守已颁布和未来立法的能力上市批准和商业化;我们未来的增长和竞争能力,这取决于我们留住关键人员和招聘更多合格人员;
和我们的竞争地位以及与竞争对手在开发C5a和C5ar抑制剂或我们的行业相关的发展和预测;以及我们向美国证券交易委员会提交的定期文件中 “风险
因素” 标题下描述的风险、不确定性和其他因素。这些陈述仅代表截至本演讲之日,涉及已知和未知的风险、不确定性和其他重要因素,这些因素可能导致
我们的实际业绩、业绩或成就与前瞻性陈述所表达或暗示的任何未来业绩、业绩或成就存在重大差异。鉴于这些风险、不确定性和其他因素,您
不应过分依赖这些前瞻性陈述,除非法律要求,否则即使将来有新的信息,我们也没有义务更新这些前瞻性陈述。

重要声明和免责声明信息和来源本演示文稿中包含的某些信息
涉及或基于从第三方来源获得的研究、出版物、调查和其他数据以及InflarX自己的内部估计和研究。尽管InflarX认为截至本演示之日,这些第三方来源
是可靠的,但它尚未独立核实,也没有对从第三方来源获得的任何信息的充分性、公平性、准确性或完整性做出任何陈述。此外,本演示文稿中包含的所有
市场数据都涉及许多假设和局限性,无法保证此类假设的准确性或可靠性。此外,尽管我们认为我们自己的内部研究是可靠的,但此类研究尚未得到任何独立来源的证实。Avacopan 数据我们尚未在临床试验中对 Avacopan 与 INF904 进行正面比较,但已将 Avacopan 公布的数据与
我们 INF904 一期临床试验的数据进行了比较。为了进行临床前研究(仓鼠中性粒细胞减少症研究),我们合成了Avacopan并进行了并排比较。虽然我们认为这种与 Avacopan 的比较很有用且
是恰当的,但本演示文稿中这种比较以及与 Avacopan 的其他比较的价值可能有限,因为它们不是来自正面交锋试验,而是来自根据不同协议在不同的
地点和不同时间进行的试验。如果没有正面交锋的数据,我们无法对 INF904 和 Avacopan 做出比较主张。关于InflarX InflarX GmbH(德国)和InflarX Pharmicals Inc.(美国)是
InflarX N.V.(合称 “InflarX”)的全资子公司。InflarX(纳斯达克股票代码:IFRX)是一家生物技术公司,通过应用其专有的抗C5a和抗C5ar技术来发现、开发和商业化补体激活因子C5a及其受体C5ar的同类首创、强效和特异性抑制剂。C5a 是一种强大的炎症介质,参与各种炎症性疾病的进展。InflarX 的主要候选产品 vilobelimab 是一种新型的、静脉注射的、同类首创的抗 C5a 单克隆抗体,可选择性地与游离 C5a 结合,并在不同适应症的多项
临床研究中显示出改善疾病的临床活性和耐受性。InflarX成立于2007年,该集团在德国耶拿和慕尼黑以及美国密歇根州安娜堡设有办事处和子公司。欲了解更多信息,请访问 www.inflarx.com。

演讲嘉宾第4页郭仁峰教授,首席科学官,创始人,
InflarX 教授尼尔斯·里德曼教授,医学博士,首席执行官、创始人、InflarX 创始人托马斯·塔普肯博士首席财务官 InflarX Camilla Chong,医学博士 InflarX 演讲嘉宾问答

INF904:第一阶段多剂量递增剂量 (MAD) 的主要结果第
5 AGENDA 安全结果 pk 成果 pk 结果 pd 结果研究设计背景和临床前工作摘要

INF904:第一阶段多剂量递增剂量 (MAD) 的主要结果
6 AGENDA 安全结果 pk 成果 pk 结果 pd 结果研究设计背景和临床前工作摘要

补体系统和 C5a 激活页面
7 经典凝集素替代补体途径膜攻击复合物 (MAC) 触发病原体裂解抗体结合甘露糖结合外来表面 C3 激活 C5b-9 =
MAC c5-转化酶 c5b 终端互补激活 C5 Arg751/ Leu752 外在途径是裂解 C55 的另一种途径来自 C5 的 a---C5a 主要通过 C5ar 外在
“路径” 酶学 C5 裂解炎症 c5ar C5L2 c5a = 强效过敏毒素 C5 凝血酶起作用,胰蛋白酶、弹性蛋白酶等。剪刀结合其他配体:C3a、ASP、C4a 等 Vilobelimab INF904 X X

第 8 页 C5ar 是一种在粒细胞和
上高度表达的 G 蛋白偶联受体,介导 C5a 的主要病理生理作用。在急性和慢性环境中的许多临床前疾病模型以及临床研究中,阻断C5ar显示出强大的抗炎作用。C5ar
拮抗剂有望成为各种炎症性疾病的独立治疗或辅助疗法。只有一种上市的候选药物,其PK/PD概况有待改进,根据I期临床
试验的公布数据 a. c5ar:一个有前途的药物靶标 Abekker 等人。2016,PLOS ONE 11 (10):E0164646 c5ar 在临床前和临床研发中的作用 c5ar 是
炎症免疫皮肤病学肾脏/血管炎呼吸神经病学的有效药物靶标及相关风湿病学及相关 CVS 和急性损伤其他
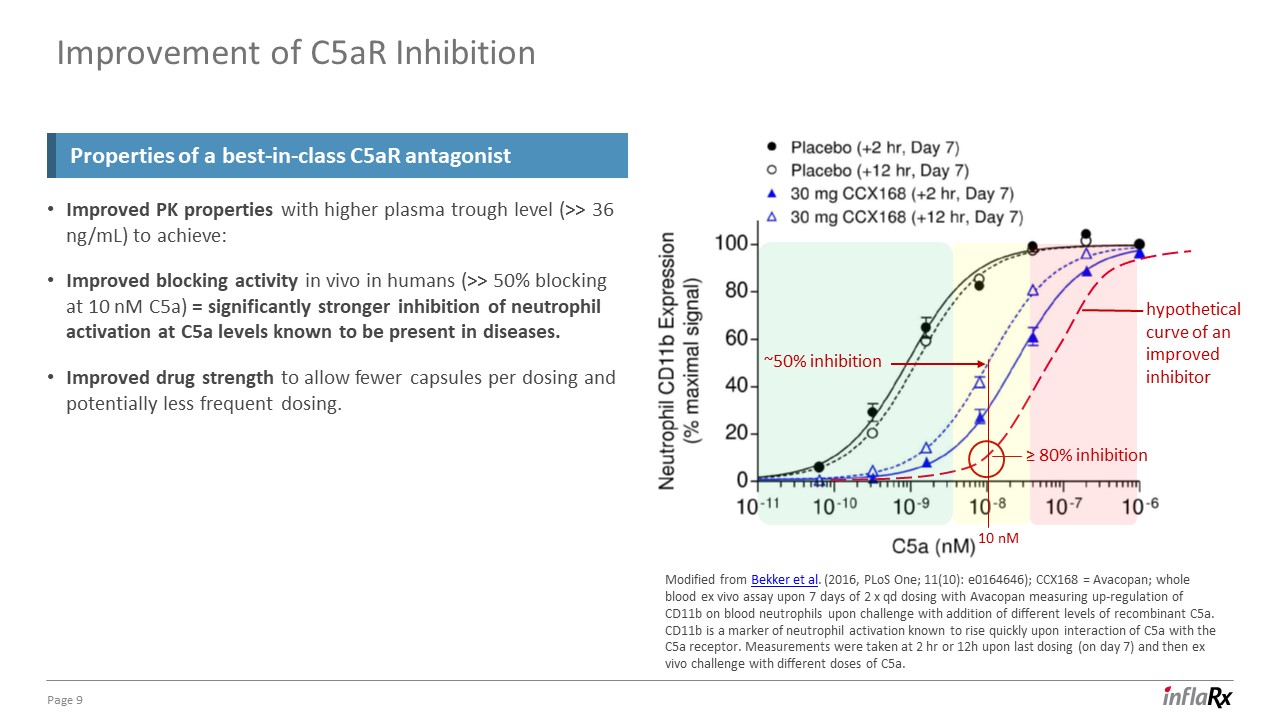
第 9 页通过提高血浆槽水平(>> 36 ng/mL)来改善 PK 特性:改善人体体内阻断活性(在 10 nM C5a 时阻断 >50%)= 在已知疾病中存在的 C5a 水平下,对中性粒细胞激活的抑制力明显增强。药物强度提高到
可以减少每次给药的胶囊,并可能降低给药频率。一流的 C5AR 拮抗剂的抑制特性改自 Bekker 等人(2016 年,pLoS One;11 (10):e0164646);CCX168 = Avacopan;使用 AvacoPan;使用 AvacoPan;在 7 天内进行全血 ex
活体试验 Opan 通过添加不同水平的重组 C5a 来测量血液中性粒细胞上 CD11b 的上调情况。CD11b 是中性粒细胞激活的标志物,已知在 C5a 与 C5a 受体相互作用时会迅速升高
。测量是在最后一次给药(第 7 天)后的 2 小时或 12 小时进行的,然后使用不同剂量的 C5a 进行体外试验。抑制剂改良的假设曲线改善 C5ar
抑制力约为 50%

INF904:临床前摘要 INF904 与
C5ar 中明确定义的变构位点结合。INF904 具有新颖的分子结构。美国专利于2021年10月颁发;其他特定国家(PCT)的专利处于全国阶段。INF904 事实第 10 页临床前发现即使在最高剂量
组(大鼠和猴子;最高 300 mg/kg)中也没有明显的毒性发现。体外效力高,符合所需的 IC50 (

第 11 页 INF904 SAD 和 MAD 3mg SAD 的一期研究设计(N = 8,比例为 6:2)安全性评估安全性评估安全性评估安全性评估 30mg QD MAD N=8(按 6:2 比例)安全性评估安全性评估单次升序剂量(SAD)多次升序剂量
(MAD) 脚注:N= 每个给药队列的参与者,显示了 INF904 的随机化比例:匹配安慰剂;* 在交叉设计中测试了 3 种不同的胶囊强度 10mg SAD(N = 8,比例为 6:2)30mg SAD(N = 8,比例为 6:2)60mg* SAD(N = 22,比例为 18:4)120 mg SAD(N = 22,比例为 18:4)120mg SAD(N = 8,比例为 6:2)240mg SAD(N = 8,按照 6:2 的比例)30mg BID MAD N=8(按照 6:2 的比例)90mg BID MAD N=8(按 6:2 的比例)注册总数:N = 62 注册总数:N = 24

INF904:第一阶段多剂量递增剂量 (MAD) 的主要结果
12 AGENDA 安全结果 pk 成果 pk 结果 pd 结果研究设计背景和临床前工作摘要

第 13 页 INF904 被发现耐受性良好,在 3 mg 到 240 mg 的单次递增剂量下,没有出现
安全隐患的信号。安慰剂组不良事件(AE)的总体百分比(85.7%)高于活跃治疗的受试者(58.3%)。AE 严重程度:轻度:78;中度:9;重度:0。在任何剂量水平下,均未报告
严重不良反应(SAE)。1 名中度不良反应被评为可能与安慰剂(头痛)有关,2 例轻度不良反应可能与研究药物(腹泻、胀气)有关。1.4(60 mg)队列中有1名受试者因无关的
AE 而退出。INF904 I 期研究:来自 MAD(和 SAD)部分的安全性结果——主要目标 INF904 被发现具有良好的耐受性,在涉及 30 mg QD、30 mg BID 和 90 mg
BID 的多个递增剂量中,没有出现安全隐患信号。安慰剂组中不良反应的总百分比为83.3%,而在活跃治疗的受试者中,AE的总百分比为77.8%。AE 严重程度:轻度:52;中度:5;重度:0。在任何剂量水平下均未报告任何SAE。2例AE,均为轻度强度,且均在1名受试者(队列3.3/90 mg BID)中,被评为可能与研究药物(腹泻、胀气)有关。没有受试者退出治疗/研究。悲伤部分疯狂部分

INF904:第一阶段多剂量递增剂量 (MAD) 的主要结果
14 AGENDA 安全结果 pk 成果 pk 结果 pd 结果研究设计背景和临床前工作摘要
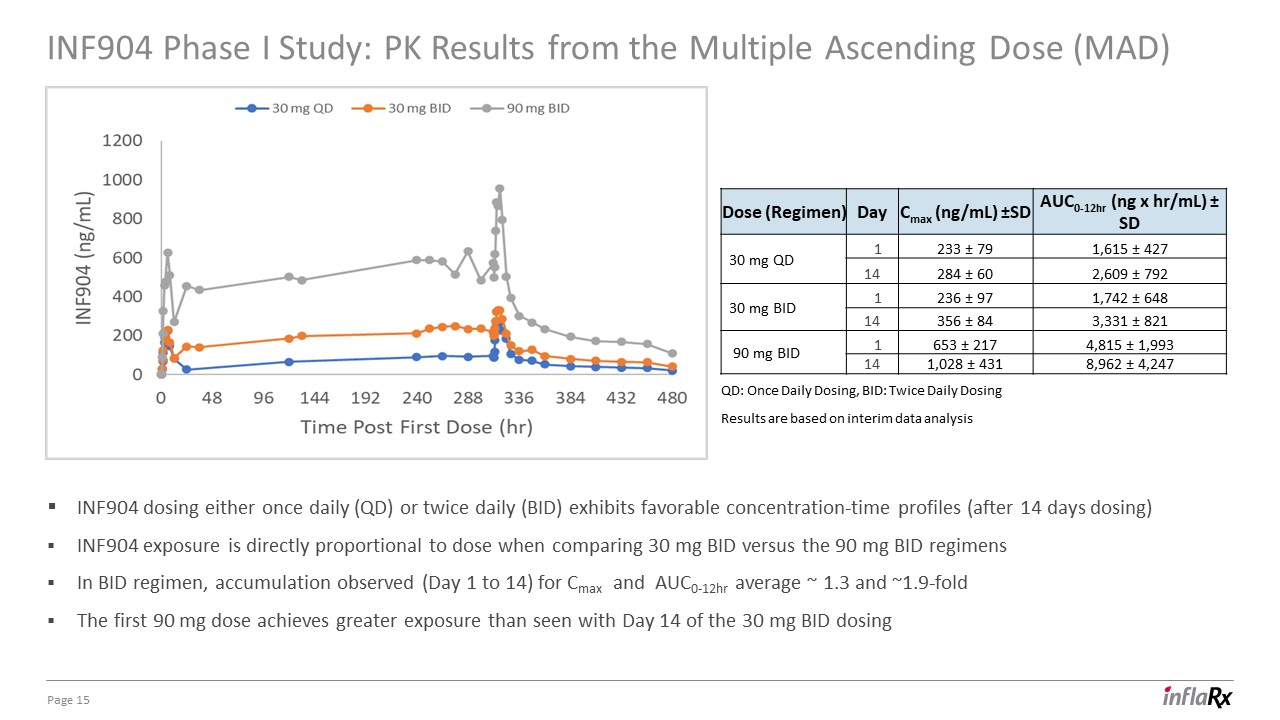
INF904 I 期研究:多重递增剂量 (MAD) 的 PK 结果第
15 页:每日一次,BID:每日两次给药结果基于中期数据分析 INF904 剂量每天一次 (QD) 或每天两次 (BID) 的剂量表现出良好的浓度时间分布情况(给药 14 天后),在比较 30 mg BID 与 BID 90 mg BID 方案时,INF904 暴露
与剂量成正比方案,观察到 Cmax 和 AUC0-12 小时的累积量(第 1 天到第 14 天)平均值约为 1.3 倍和约 1.9 倍。前 90 mg 剂量的暴露量大于
从 30 mg BID 给药剂量(方案)第 14 天 Cmax (ng/mL) ±SD auc0-12hr (ng x hr/mL) ± SD 30 mg QD 1 233 ± 79 1,615 ± 427 B1 14 284 ± 60 2,609 ± 792 30 mg BID 1 236 ± 97 1,742 ± 648 B2 14 356 ± 821 mg 84 3,331 ± 821 mg 90 mg 出价 1 653 ± 217 4,815 ± 1,993 14 1,028 ± 431 8,962 ± 4,247

INF904:第一阶段多剂量递增剂量 (MAD) 的主要结果
16 AGENDA 安全结果 pk 成果 pk 结果 pd 结果研究设计背景和临床前工作摘要
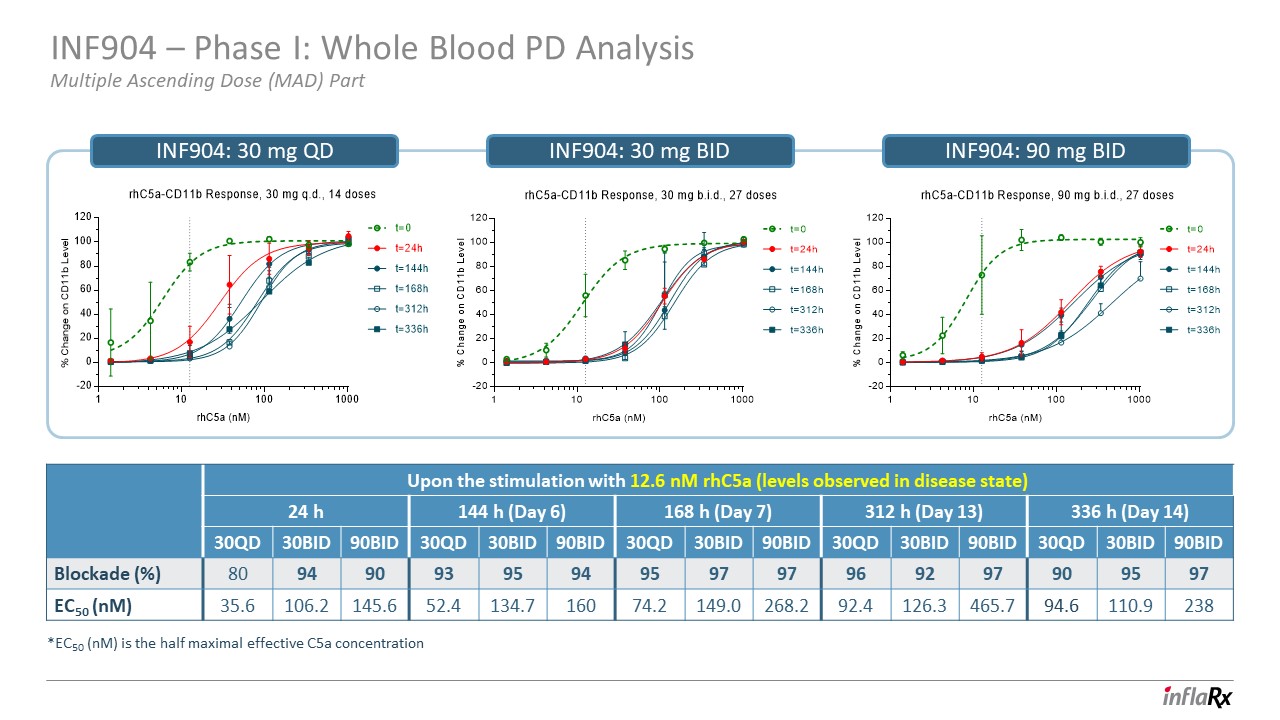
INF904 — 第一阶段:全血 PD 分析多次递增剂量 (MAD)
第 INF904 部分:30 mg QD INF904:30 mg BID INF904:90 mg BID 在 12.6 nM(疾病状态下观察到的水平)刺激后 24 h 144 h(第 6 天)168 h(第 13 天)336 h(第 14 天)c5a
(nM) 30QD 30BID 90BID 30QD 30BID 90BID 30QD 30BID 30QD 30BID 30QD 30BID 30QD 90BID 封锁 (%) 80 94 90 93 95 95 97 97 97 97 97 97 97 97 97 97 97 95 97 95 97 EC50 (nM) 35.6 106.2 145.6 52.4 134.2 149.0 268.2 94.6 110.9 238 *EC50 (nM) 是半数最大有效 C5a专注

INF904:第一阶段多剂量递增剂量 (MAD) 的主要结果
18 AGENDA 安全结果 pk 成果 pk 结果 pd 结果研究设计背景和临床前工作摘要

摘要 INF904 I 期 MAD 研究的结果第 19 页关键
结果 INF904 被发现耐受性良好,在从 30 毫克 QD 到 90 mg BID 不等的多个递增剂量下,没有安全隐患的信号。INF904 表现出良好的药效特征,有可能达到慢性免疫炎性疾病所需的治疗暴露
(AUC 和 Cmax)。在人类疾病中观察到的 C5a 浓度下,INF904 的 C5a 阻断电位超过 90%。在这项
I 期多次递增剂量研究中,INF904 证实了其同类最佳的 C5ar 抑制剂潜力

INF904:后续步骤第 20 页进一步的药物研发步骤:介绍
为二期临床项目开发的商业上可行的配方完成长期慢性毒理学研究计划在 2024 年底启动二期临床研究亮点

德国耶拿温泽拉尔街 207745 电子邮件:IR@inflarx.com 电话:
+49-3641-508180 传真:+49-3641-508180 传真:+49-3641-508181 InflarX N.V. www.inflarx.com

第 22 页临床前数据(先前报告)附录 SAD 数据
(先前报道)

INF904:8 小时采样
的潜在同类最佳 C5AR 抑制剂血浆浓度:INF904 = 538 ng/mL Avacopan 样分子 = 119 ng/mL 第 23 页 INF904 与 AVACOPAN 的临床前体内疗效比较* 与类阿瓦考潘相比 INF904 抑制体内中性粒细胞激活* 来源:InflarX 存档数据。*Avacopan 根据已发布的结构和公开数据合成。实验:用C5a挑战啮齿类动物会激活中性粒细胞,进而
中性粒细胞粘附(粘附)血管内皮细胞壁=模仿中性粒细胞减少症(载体)。当阻止 C5ar 激活时,此效果可以完全抑制。结果:INF904 在阻断 C5aR 方面明显优于相同剂量的 Avacopan*
,导致该啮齿动物模型体内中性粒细胞抑制作用大约翻了一番。注意:与 Avacopan* 的
相同剂量相比,本实验中的 INF904 剂量在给药 8 小时后施加的血浆水平高出约 4.5 倍。

INF904 I 期研究:来自 SAD 第 24 部分的 PK 结果与
公布的 Avacopan 数据相比,INF904 在可比剂量(3、10、30 mg)下的 Cmax 高出大约 3 倍,全身暴露 (aucLast) 高 10 倍。参数单位剂量 INF904 Avacopan* AucinF h.ng/ml 3 mg 285 25 10 mg 1264 130 30 mg 5956 628 aucLast h.nlast h.nlast g/ml 3 mg 254 23 10 mg 1117 122 30 mg 5197 557 Cmax ng/ml 3 mg 21.5 9 10 mg 74.8 25 mg 289 79 tmax hr 3 mg 3.5 1.2 10 mg 4 1.7 30 mg 5.01 INF904 240mg INF904 60mg INF904 30mg INF904 120mg Avacopan* 30mg INF904 240mg INF904 60mg INF904 30mg INF904 120mg 来源:Bekker 等人(2016 年,PLoS One;11 (10):e0164646)*请注意:Avacopan 数据取自 Bekker 等人(2016 年,PLoS One;11 (10):
e0164646)在方向图中叠加;Avacopan 未作为比较器纳入 INF904 第一阶段研究。

第 25 页接受治疗的健康志愿者对 INF904 的耐受性良好,在从 3mg 到 240 mg 的单次递增剂量中,
没有出现令人担忧的安全信号。安慰剂组不良事件(AE)的总体百分比高于活跃治疗的受试者。AE 严重程度:81 中度:9 重度:0 在任何剂量水平下均未报告
严重急性脑炎(SAE)。1 名中度 AE 被评为可能与研究药物(头痛)有关,但受试者接受了安慰剂。队列中有 1 名受试者因无关 AE 而退出 1.4(60 mg)。INF904 第一阶段
研究亮点:SAD 部分的安全结果

INF904 I 期研究:给药后 24 小时体外 SAD 部分 C5A 介导的 CD11b 上调
的 PD 结果第 26 页 INF904 阻断人血浆中 C5A 诱导的中性粒细胞激活的活性达到了设定目标,与唯一上市的
比较物 INF904 的阻断活性有明显区别:对于 12.64 nM 的 C5a,阻断活性≥ 90% 为在 PD 分析中观察到,在给药后 24 小时的时间点剂量范围为 30-240 mg。Avacopan:针对约12.64 nM的C5a,在给药后12小时时间点发布的30mg给药数据中,观察到约50%的
阻断活性。(贝克尔等人。PloS One 2016;11 (10):e0164646) 12.6 nM ≥ 90% 阻断 c5a (nM) INF904(阻断活性百分比与
安慰剂)c5a (nM) 3mg 10mg 30mg 60mg 60mg 120mg 240mg 12.6 9.6 74.7 95.7 95.2 98.7

INF904 证实了其在本期 I 期
单一递增剂量研究中其同类最佳的 C5ar 抑制剂潜力。摘要 INF904 I 期 SAD 研究的标题结果第 27 页关键结果 INF904 在接受治疗的健康志愿者中耐受性良好,在 3mg 至 240mg 的单次递增剂量
中没有出现任何令人担忧的安全信号。INF904 表现出良好的 PK 特征:Tmax 6 小时,剂量比例暴露在 3 到 240mg 之间。在人类疾病中观察到的 C5a 浓度下,INF904 显示出很强的 C5a 阻断潜力。INF904 可以采用更高的药物强度配制,每粒胶囊 30 毫克,而市售比较器每粒胶囊 10 毫克。