

正在进行的paltusotine类癌综合征开放标签2期研究的初步结果一项评估类癌综合征受试者帕图索汀治疗的安全性、药代动力学和剂量反应的随机平行小组研究表现为99.2

安全港声明本演示文稿包含前瞻性陈述。Crinetics Pharmicals, Inc.(“Crinetics”、“公司”、“我们” 或 “我们的”)提醒您,本陈述中包含的有关非历史事实事项的陈述是前瞻性陈述。这些陈述基于公司当前的信念和期望。此类前瞻性陈述包括但不限于以下方面的陈述:帕图西汀和 CRN04894 的临床开发计划和时间表,包括其治疗潜力和临床益处或安全性;正在进行的肢端肥大症帕图西汀第 3 期临床研究和类癌综合征帕图西汀第 2 期研究的预期发布时间;提交新药申请的预期时间 paltusotine 用于治疗肢端肥大症及相关的开放标签延长研究;帕曲索汀治疗类癌综合征第二阶段研究全部结果的计划和时机,并与美国食品药品管理局共享结果,以协调和设计第三期计划;进一步开发类癌综合征中的帕图索汀或对类癌综合征中的帕图索汀进行3期研究的计划和时机;我们正在进行的任何临床研究都可能显示出安全性或有效性;以及我们确定和开发新候选药物的计划用于其他疾病。在某些情况下,您可以用 “可能”、“相信”、“预期”、“可能”、“应该”、“估计”、“预期”、“打算”、“计划”、“项目”、“将”、“考虑”、“继续”、“预测”、“抱负”、“目标”、“潜力”、“目标” 或负面因素等术语来识别前瞻性陈述其他类似的术语。这些陈述仅代表截至本陈述之日,涉及已知和未知的风险、不确定性、假设和其他重要因素,这些因素可能导致我们的实际业绩、业绩或成就与前瞻性陈述所表达或暗示的任何未来业绩、业绩或成就存在重大差异,包括但不限于:在对与临床研究相关的数据进行更全面的审查后,我们报告的标题和初始数据可能会发生变化,此类数据可能无法准确反映完整情况临床研究的结果以及美国食品药品管理局和其他监管机构可能不同意我们对此类结果的解释;临床前研究或临床研究的初步结果不一定能预测最终结果,在对数据进行更全面的审查之后,随着患者入组的继续,以及随着更多患者数据的出现,可能出现不利的新临床数据和对现有临床数据的进一步分析,一项或多项临床结果可能会发生重大变化;开始、注册和完成临床研究并报告相关数据;在批准新药申请或适用的外国监管批准之前,美国食品药品管理局或其他监管机构可能要求对帕曲索汀进行额外的临床研究,或者建议修改我们计划中的3期临床研究;国际冲突可能会干扰我们以及我们所依赖的第三方的业务,包括延迟或以其他方式扰乱我们的临床研究和临床前研究、生产和供应连锁或削弱员工的工作效率;我们在产品制造、研究、临床前和临床测试方面对第三方的依赖;我们对帕曲西汀的临床研究、非临床研究和临床前研究的成功;美国和国外的监管发展或价格限制;我们的候选产品的意外不良副作用或疗效不足,可能会限制其开发、监管批准和/或商业化;我们获得和维护知识产权的能力保护我们的候选产品;我们可能比预期更快地使用我们的资本资源;以及我们不时向美国证券交易委员会(“SEC”)提交的文件中在 “风险因素” 标题下描述的其他风险。由于前瞻性陈述本质上会受到风险和不确定性的影响,其中一些无法预测或量化,有些则超出了我们的控制范围,因此您不应依赖这些前瞻性陈述作为对未来事件的预测。我们的前瞻性陈述中反映的事件和情况可能无法实现或发生,实际结果可能与前瞻性陈述中的预测存在重大差异。本警示声明根据1995年《私人证券诉讼改革法》的安全港条款对所有前瞻性陈述进行了全面限定,除非适用法律要求,否则我们不打算公开更新或修改此处包含的任何前瞻性陈述,无论是由于任何新信息、未来事件、情况变化还是其他原因。本演示文稿还包含独立各方和我们对潜在患者和潜在市场规模的估计。这些数据涉及许多假设和局限性,提醒您不要过分重视此类估计。

当每日口服帕图索汀在类癌综合征患者中显示出强劲的初步结果安全性帕图索汀耐受性良好,没有严重或严重的治疗相关不良事件,与先前的研究一致。总体PK总体上与健康志愿者的预期一致,40mg和80mg药代动力学药代动力学疗效安全性概况和疗效已进入类癌综合征的3期研究(待获得完整数据,预计 2024 年上半年)✓ ✓ ✓

类癌综合征是一种严重的疾病,患者需要更好的治疗选择肺胰腺神经内分泌腺肿瘤 5-HT + 其他因素类癌综合征 ~33,000 名被诊断患有类癌综合征的患者(美国)类癌综合征患者面部潮红由医学博士斯蒂芬·戈德芬格提供,排便过多(>3 天)会造成严重的破坏性目标:减少频率和紧迫性(正常值为 ≤3 天)严重的潮红发作可能使人衰弱并具有潜在危险目标:降低频率和严重性(正常值为

随机治疗阶段 (RTP) 筛查基线长期延长 40 或 80 或 120 mg 帕图索汀 80 mg 帕图西汀 40 mg 帕图索汀 R 随机分配至 40 mg 或 80 mg/d 0d w2 w4 w8 +/-40 mg 剂量调整必要时不改变剂量 w58 EoT 关键资格标准:治疗天真或目前未接受治疗且症状活跃 — 或者 — 受 SRL 治疗和症状控制洗完治疗后会恶化。SSTR 阳性 1 级或 2 级 NET 2 期研究设计:评估帕图索汀在类癌综合征患者中的安全性、PK 和疗效方案:8 周、开放标签、平行、随机 2 剂量研究,然后长期延长 40、80 和 120 mg 剂量帕图西汀次要终点药代动力学探索性终点排便和冲洗频率、奥曲肽救援用量、生物标志物、粪便稠度、腹痛,PRO 测量 1 2 SSTR = 生长抑素受体;SRL = 生长抑素受体配体 EoT = 治疗结束;PRO = 患者报告的预后 -7d 冲洗/恶化 SRL 未接受治疗的参与者
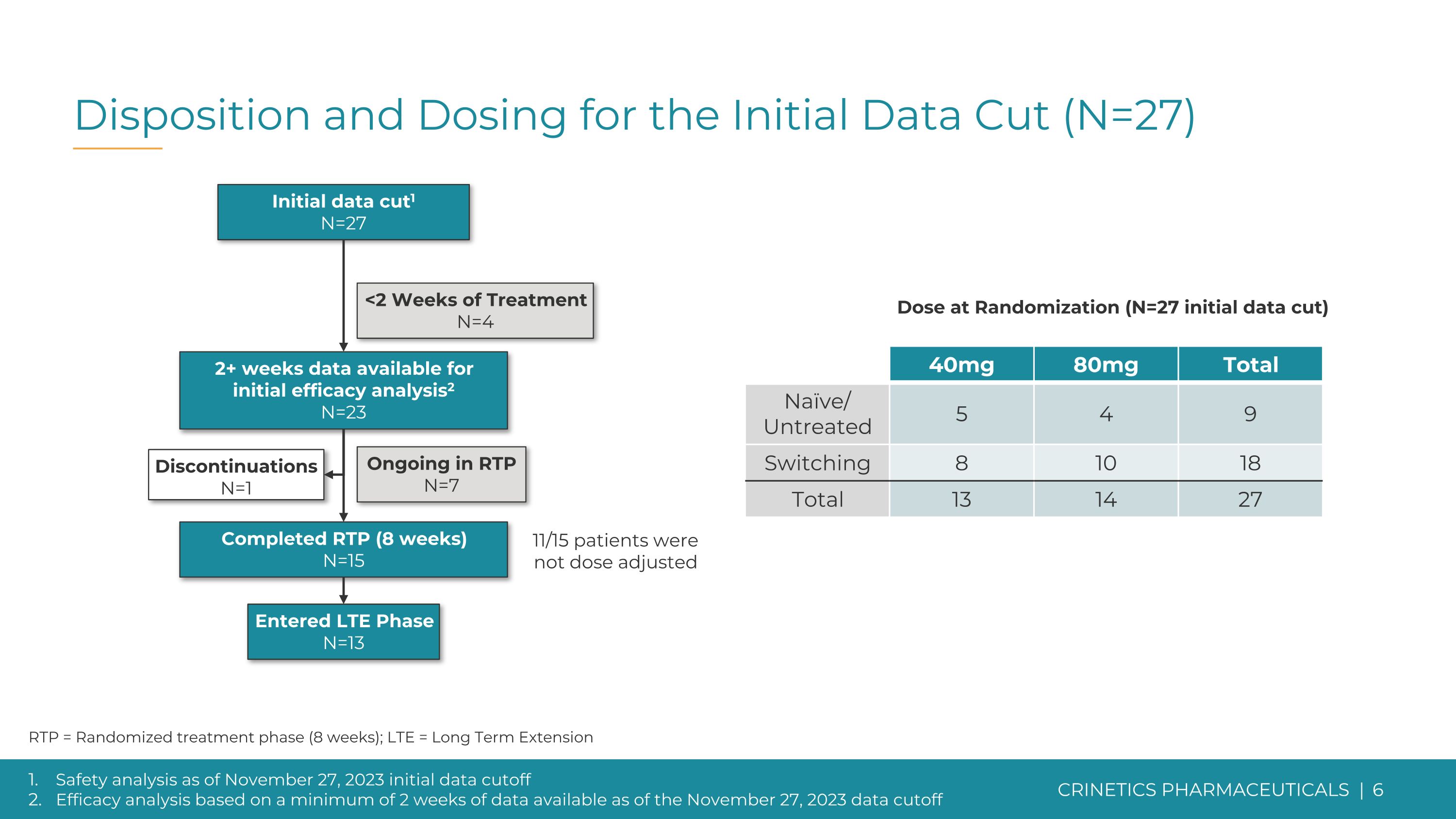
截至2023年11月27日初始数据截止的处置和剂量(N=27)安全性分析初始数据截止时间根据截至2023年11月27日至少2周的可用数据进行功效分析 RTP = 随机治疗阶段(8 周);LTE = 长期延期中止 N=1 初始数据切断1 N=27 已完成 RTP(8 周)N=15 已进入 LTE 阶段 N=15 13 在 RTP 中持续 N=7 2 周以上的数据可供初始疗效分析2 N=23 40mg 80mg 总计 Naive/未治疗 5 4 9 切换 8 10 18 总计 13 14 27 随机分组的剂量(N = 27初始数据剪切)
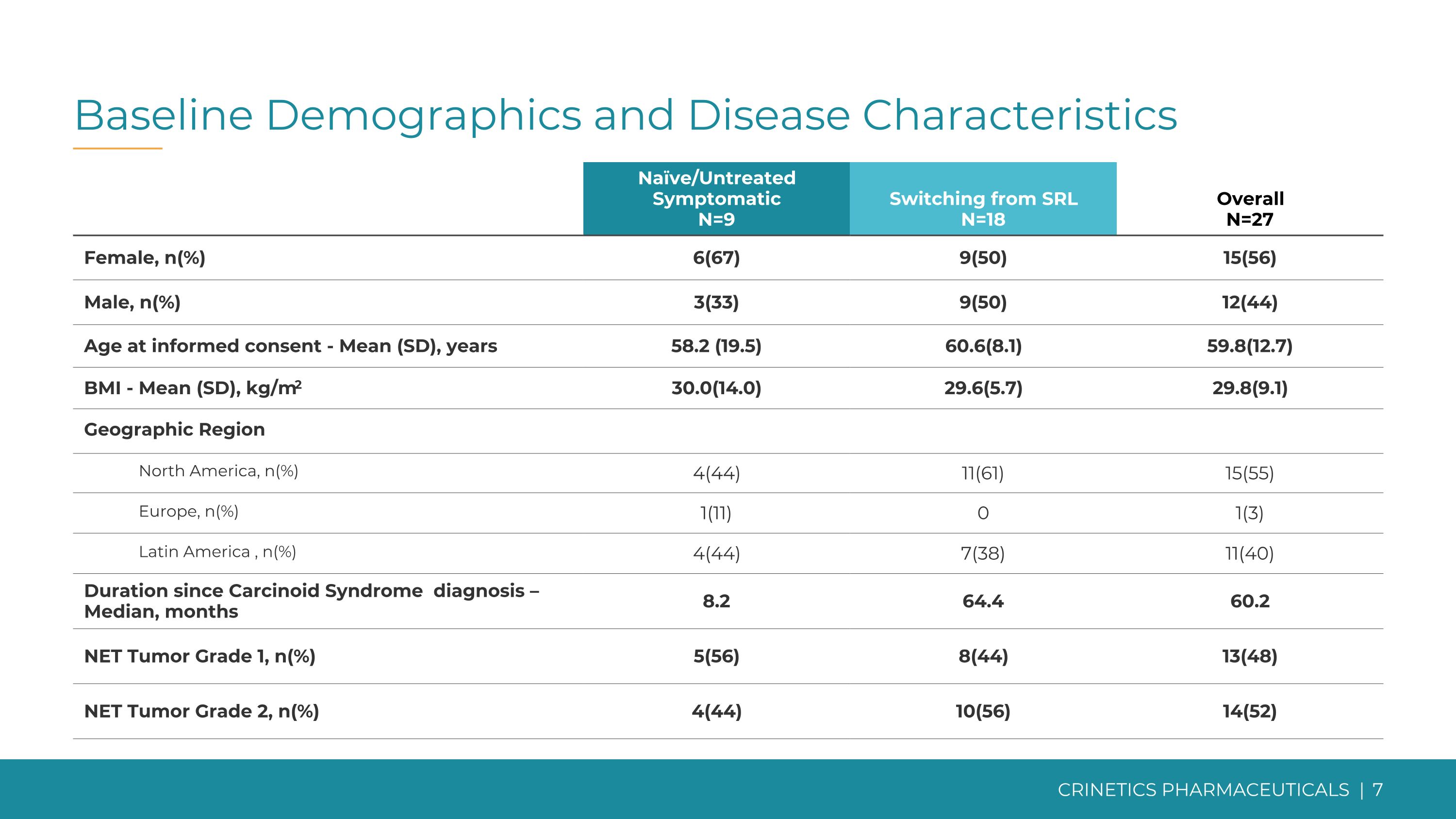
基线人口统计学和疾病特征天真/未经治疗的症状 N=9 从 SRL 切换 N=18 总体 N=27 女性,n (67) 9 (50) 15 (56) 男性,n (%) 3 (33) 9 (50) 12 (44) 知情同意时的年龄——平均值 (SD),58.2 (19.5) 60.6 (8.1) 59.8 (12.7) 体重指数——平均值 (SD),kg/m2 30.0 (14.0) 29.6 (5.7) 29.8 (9.1) 地理区域北美,n (%) 4 (44) 11 (61) 15 (55) 欧洲,n (%) 1 (11) 0 1 (3) 拉丁美洲,n (%) 4 (44) 7 (38) 11 (40) 自类癌综合征诊断以来的持续时间 — 中位数,8.2 64.4 60.2 NET 肿瘤等级 1,n (%) 5 (56) 8 (44) 13 (48) NET 肿瘤等级 2,n (%) 4 (44) 10 (56) 14 (52)
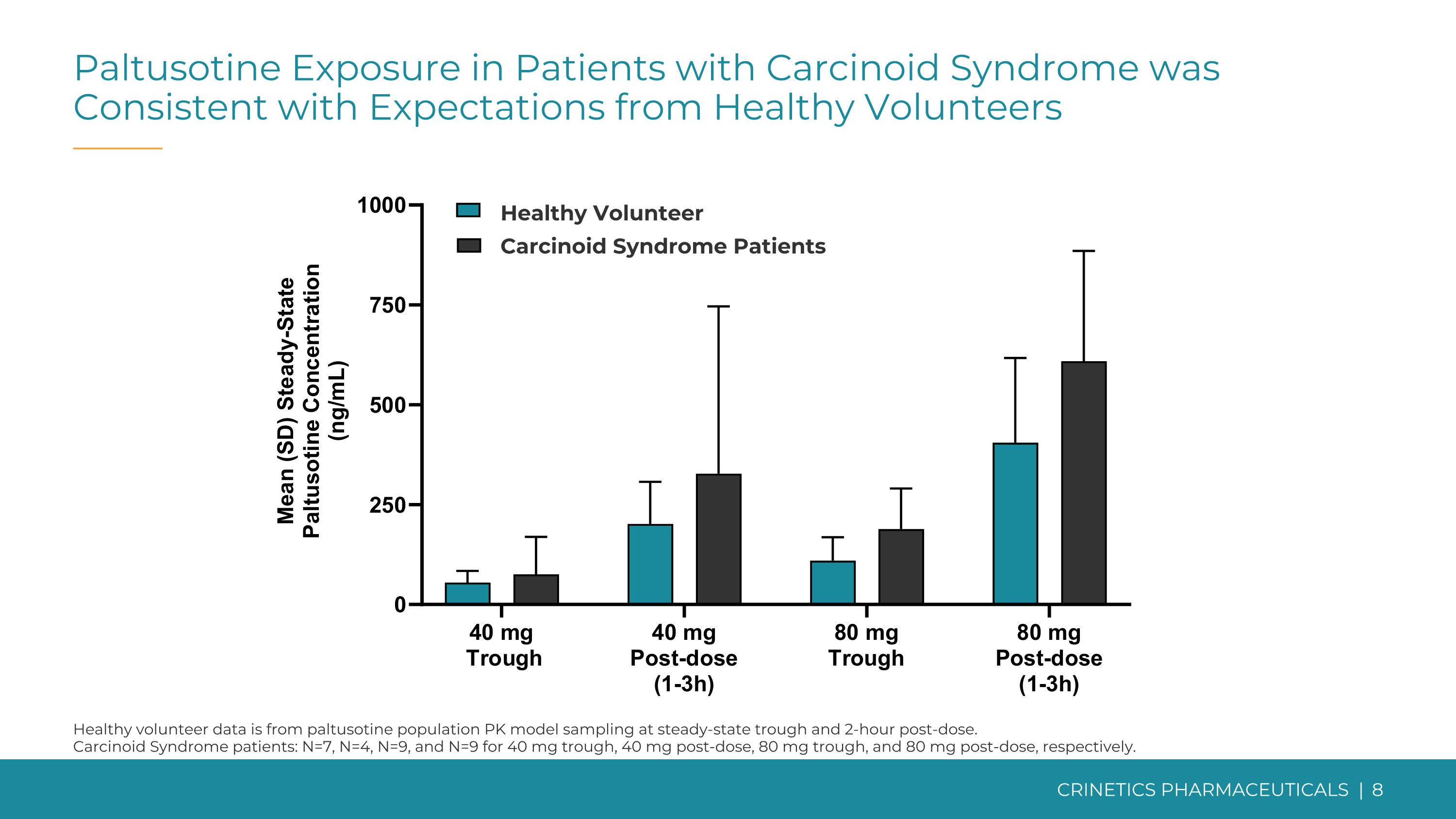
类癌综合征患者的帕图西汀暴露量与健康志愿者的期望一致健康志愿者数据来自稳态低谷和给药后2小时的帕图西汀人群 PK 模型采样。类癌综合征患者:40 mg 低点、给药后 40 mg、80mg 低点和给药后 80 mg 分别为 N=7、N=4、N=9。健康的志愿类癌综合征患者

帕曲索汀耐受性良好,没有严重或严重的治疗相关不良事件* 一种 SAE(心力衰竭,很可能是继发于类癌心脏病)的致命后果发生在停药 26 天后,并且与治疗无关。治疗紧急不良事件 paltusotine N = 27 任意 18 (66.7) 轻度 9 (33.3) 中度 7 (25.9) 严重 2 (7.4) 严重 3 (11.1) 死亡 1 (3.7) * 治疗相关 15 (55.6) 轻度 9 (33.3) 中度 6 (22.2) 严重 0 严重 0 死亡 0 正在进行的类癌综合征 2 期研究的初步安全性摘要帕图索汀耐受性良好,没有与治疗相关的严重或严重的治疗相关不良事件最常报告的不良事件包括腹泻、头痛和腹痛帕图西汀剂量 40% 和 80% 的不良事件发现相似mg 在研究监测生命体征、心电图或安全实验室值期间未观察到新的安全信号
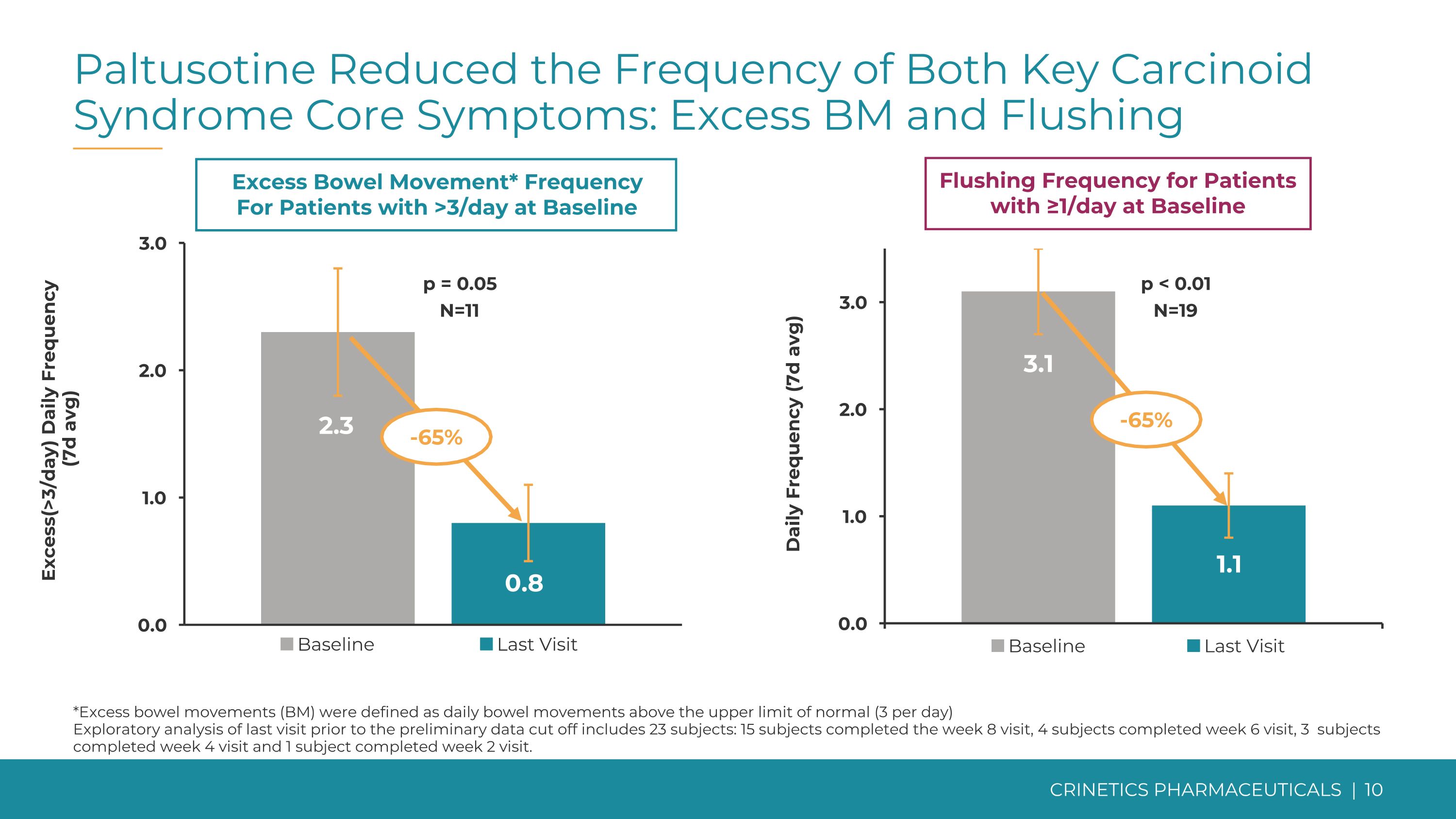
Paltusotine 降低了两种关键类癌综合征核心症状的发生频率:血管过多和潮红过多(>3 天)基线排便次数≥1 天的患者的每日冲洗频率(7d 平均值)* 基线每日频率 >3 次的患者(7d 平均值)p = 0.05 N=11 p

Paltusotine 对从治疗基线到最后一周的排便频率变化较高的受试者有明显的益处(患者按基线值排序)每日排便频率(从基线到最后一次就诊)基线排便次数 >3 基线排便 =3 正常每周 BM 3 至每天 3 次上次就诊基线 (1) 每个箭头的末尾表示 23 名受试者中每人最后一周的可用治疗数据。15 名受试者本周完成 8 个访问,4 个科目完成第 6 周访问,3 个科目完成第 4 周访问和 1 个科目已完成第 2 周的访问。每天超出 BM >3 平均变化 -1.9 bm/天 (N=11) 平均变化 -0.1 bm/天

Paltusotine 显示大多数受试者的潮红频率有所改善,从基线到上周、基线和上周(患者按基线值排序)潮红每日频率(从基线到最后一次就诊)基线冲洗频率 =1 控制良好的上次就诊基线(1)每个箭头的末尾表示 23 名受试者中每人最后一周的治疗数据。15 名受试者完成第 8 周就诊,4 名受试者完成第 6 周就诊,完成了第 4 周访问的 3 个科目和 1 个科目完成了第 2 周的访问。平均变化为 -2.0 次刷新事件/天 (N=19) 平均变化为 0.1 次刷新事件/天

在治疗后 2 周内,观察到所有参与者的排便频率迅速改善(N=23)无论基线是否出现过多 BMs 6 8 筛查基线 4 2 研究周排便频率/日排便频率/第 6 天 8 基线(冲洗)4 2 研究周 8 8 8 8 7 5 15 15 15 15 14 12 10 未接受治疗的参与者人数频率测量基于 14 筛选期内的平均值和所有其他时间点基线前 7 天的平均值 SRL =生长抑素受体配体冲洗期从先前的 SRL 帕图索汀帕图西汀筛查转到 SRL 访问的参与者人数

所有参与者的潮红频率(N=23)无论是否在基线时出现潮红研究周 6 8 4 2 冲洗频率/日参与者从之前的 SRL 切换 6 8 筛查基线 4 2 研究周未接受治疗的参与者潮红频率/第 8 天 8 8 8 7 5 15 15 15 14 12 10 在治疗冲洗期后的 2 周内观察到冲洗频率迅速提高到达访问帕勒索托的参与者人数 Paltusotine Paltusotine 基线(冲洗)筛查 SRL 频率测量基于 14 天筛查期内的平均值和所有其他时间点基线前 7 天的平均值 SRL = 生长抑素受体配体

Paltusotine 还降低了关键类癌综合征症状的严重程度 N=15 谁完成了随机治疗期 BM = 每日排便频率(7d 平均值)潮红严重程度 BM 急性发作 N = 23 N = 23 N = 23 N = 23 N = 23 N = 23 N = 23 严重程度(0-10 数字评分量表)p = 0.01 p = 0.001
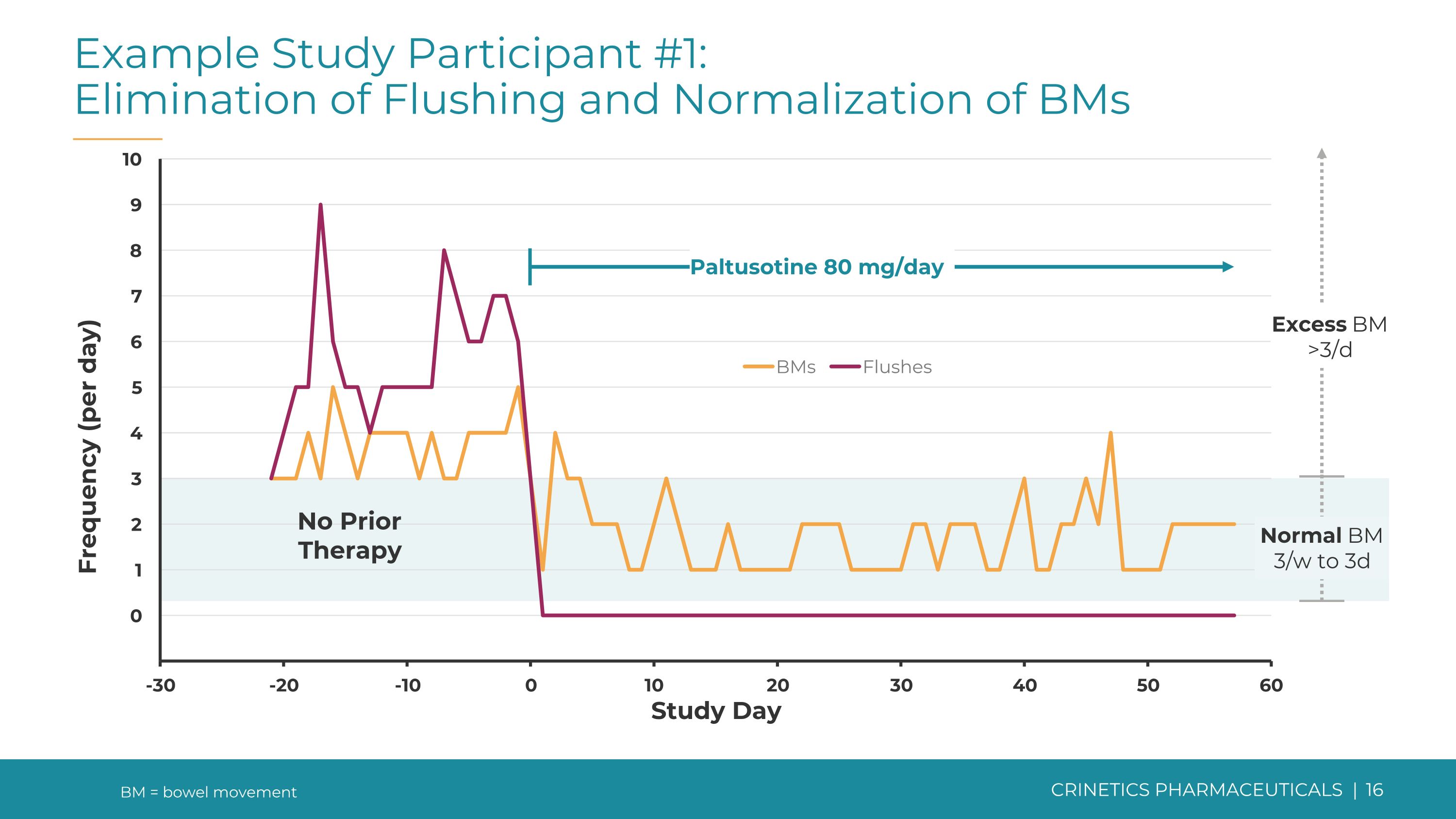
研究参与者示例 #1:消除潮红并使基因正常化 bms Paltusotine 80 mg/天未接受治疗正常 BM 3/w 到 3d 过量 BM >3/d BM = 排便

Paltusotine 40 mg/天 80 mg/天示例研究参与者 #2: 奥曲肽体重和冲洗频率的显著改善 Octreotide 正常 BM 3/w 到 3d 过量 BM >3/d BM = 排便

后续步骤:初始数据支持生物标志物和患者报告的补充结果数据的3期分析准备该研究已完成入组(N=36),完整研究的标题数据预计将于2024年上半年提交完整的数据集并与FDA合作一旦每日口服帕图西汀在类癌综合征患者中显示出强劲的初步结果摘要:频率和严重程度显著降低使用 40 毫克和 80 毫克 Paltusotine 进行排便和潮红效果很好-耐受性强,没有严重或严重的治疗相关不良事件。总体而言,PK 与健康志愿者的期望一致

预期的帕图索汀里程碑 1Q24 1H24 2H24 针对未经治疗的肢端肥大症患者的 PATHFNDR-2 3 期研究结果类癌综合征 2 期研究的头条结果 (N=36) 肢端肥大症 NDA 提交的类癌综合征 3 期开始等待与 FDA 一致正在进行的开放标签延期研究 N > 175 名参与者,并且增加 26 名患者使用帕曲索汀治疗时间超过 3 年,35 名患者大于 2 年

问答 Scott Struthers,博士创始人兼首席执行官 Dana Pizzuti,医学博士首席医学与发展官艾伦·克拉斯纳,医学博士首席内分泌学家