
附录 99.2

GSBR-1290 综合计划更新机密信息 2023 年 12 月 18 日

2 位与会者 • 雷蒙德·史蒂文斯博士,首席执行官 • 马克·巴赫,医学博士,首席医学官 • Blai Coll,医学博士,临床开发副总裁 • Jun Yoon,首席财务官 • Danielle Keatley,《投资者关系机密》

3 前瞻性陈述本演示文稿包含1995年《私人证券诉讼重审法》中 “安全港” 条款所指的 “前瞻性陈述”。除历史事实陈述外,所有陈述均可被视为前瞻性陈述,包括但不限于有关公司未来计划和前景的陈述,以及基于GSBR-1290和其他正在开发的候选药物的安全性、有效性或耐受性的任何期望,这些预期基于对T2DM和肥胖症患者的GSBR-1290 2a期研究的头条和中期临床数据,包括随着治疗持续时间的延长,疗效效果有可能保持或提高,GSBR-1290治疗2型糖尿病、肥胖症或相关适应症的能力,公司针对T2DM和肥胖患者的GSBR-1290的2b期研究的计划启动和研究设计及其时机;GSBR-1290的药代动力学(PK)/配方研究的最新情况及其计划时间;公司数据的计划时机仍在继续 GSBR-1290和下一代组合GLP-1R候选药物的开发以及对针对GLP-1R的新片剂配方的期望。此外,无论何时或如果在本演示中使用 “可能”、“可能”、“应该”、“预期”、“相信”、“估计”、“期望”、“打算”、“计划”、“p red ict” 等词语以及与公司相关的类似表达方式及其变体,都可能识别前瞻性陈述。前瞻性陈述既不是历史事实,也不是未来表现的保证。尽管该公司认为此类前瞻性陈述中反映的预期是合理的,但该公司无法保证这种预期会被证明是正确的。提醒读者,由于存在各种风险和不确定性,包括但不限于研究时间长短和样本量与结果初步性质相关的风险和不确定性,实际结果、活动水平、安全性、绩效和情况可能与公司前瞻性陈述中表达或暗示的存在重大差异,临床试验的中期结果无法预测最终结果的风险随着患者入组的继续,对数据进行更全面的审查,对任何特定患者的结果进行后续跟踪之后,以及随着更多患者数据的获得,公司推进GSBR-1290、LTSE-2578、ANPA-0073及其其他候选治疗药物、获得监管部门批准并最终实现公司候选疗法商业化的能力,clin ica l的结果可能会发生重大变化,临床前和临床试验的时间和结果,任何数据收集遗漏的影响我们的任何临床试验基地、公司为开发活动提供资金和实现开发目标的能力、Comp any对第三方的依赖,包括临床研究机构、制造商、供应商和合作者(可能无法完全控制这些机构)、任何全球疫情、通货膨胀和供应链问题对公司业务、保护其知识产权和其他风险的能力以及公司向美国提交的文件中描述的不确定性证券交易委员会(SEC),包括公司于2023年3月30日向美国证券交易委员会提交的截至2022年12月31日止年度的10-K表年度报告、2023年11月17日向美国证券交易委员会提交的截至2023年9月30日的季度报告以及公司可能不时向美国证券交易委员会提交的未来报告。本演示文稿中包含的所有前瞻性陈述仅提及截至发表之日,并基于管理层截至该日的假设和估计。除非法律要求,否则公司没有义务更新此类陈述以反映在声明发表之日后发生的事件或存在的情况。

4 议程 • 开幕词和概述(雷·史蒂文斯)• GSBR-1290 计划更新(Blai Coll)-第 2a 阶段安全性和耐受性摘要-第 2a 期功效摘要-第 2b 阶段-支持研究-日本过渡研究-6 个月和 9 个月毒理学更新 • 总体概况和后续步骤(马克·巴赫)• GSBR-1290 闭幕(雷·史蒂文斯)• 问答机密

5 GSBR-1290 计划更新和 2a 阶段验证——关键发现的概念数据摘要 • 令人鼓舞的疗效、安全性和耐受性结果 • 总体上耐受性良好,12周内没有与药物相关的严重不良事件(SAE),停药率极低 • 结果支持 2 型糖尿病 (T2DM) 和肥胖安全性和耐受性每天给药一次 • 所有不良反应均已报告事件 (AE) 为轻度或中度 • 总体耐受性良好,不超过 120 mg 的研究药物相关的 SAE • 没有因以下原因而中止研究2a 期肥胖队列中的不良反应 • 1 项研究因与 2a 期 T2DM 队列中的研究药物相关的不良反应而中止 • 具有临床意义的 2a 期 2 型糖尿病数据(n=54,12 周)-12 周时 Hba1c 和体重有统计学意义的降低 • 具有临床意义的 2a 期肥胖数据(n=40,中期 8 周)-具有统计意义的 8 周体重下降,研究持续 12 周 2b 期支持性研究 • 具有临床意义的 1 期日本精益健康志愿者桥接数据(n=18,4 周)-充分4 周后体重减轻 • 在 6 个月的啮齿动物和 9 个月的灵长类动物研究中没有重大发现 — 支持长期 2b 期计划机密

6 GSBR-1290 项目更新 Blai Coll,医学博士,副总裁,临床开发机密副总裁
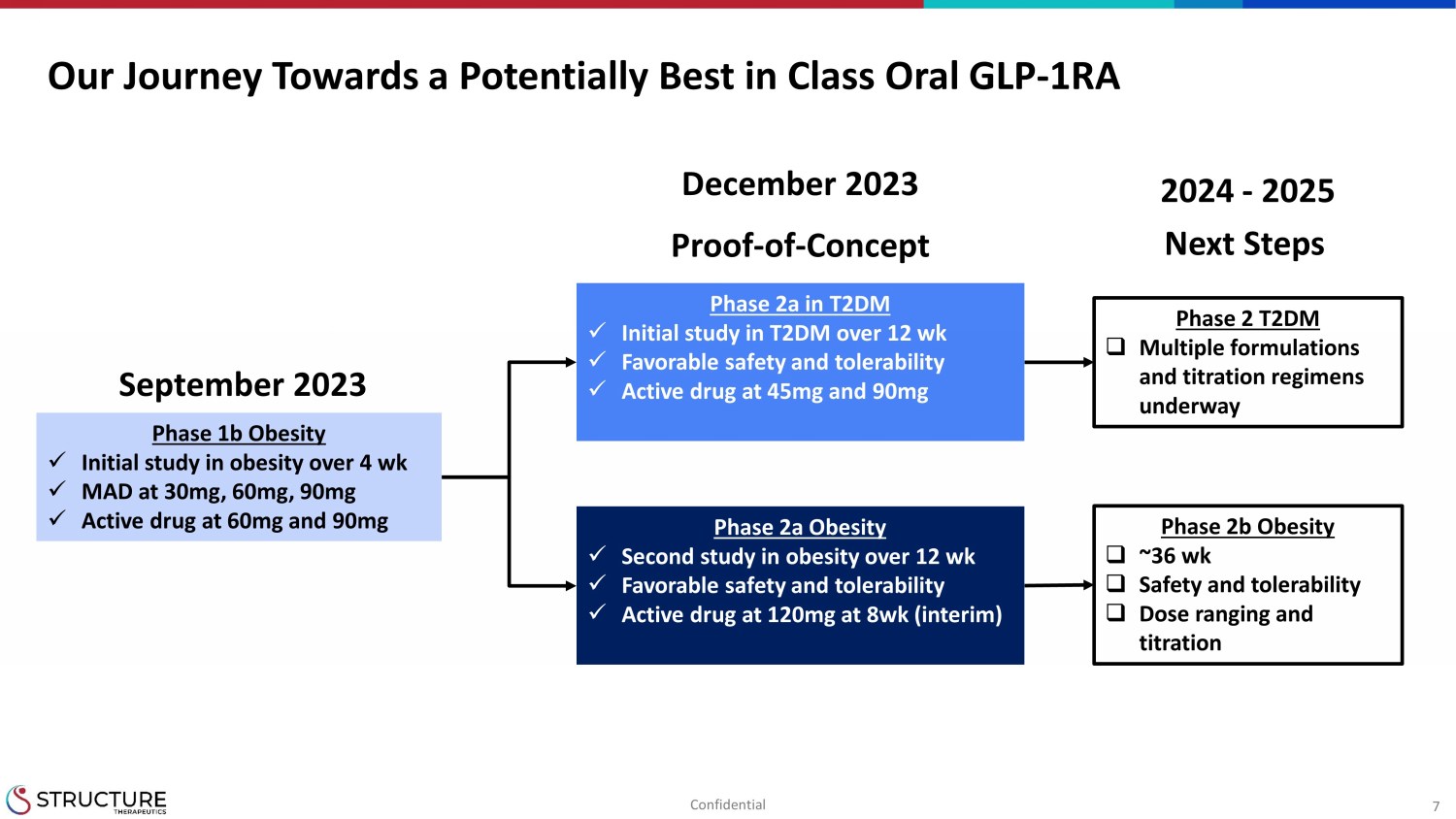
7 我们迈向一流口服 GLP 的旅程-1RA T2DM 2a 期 x 12周以上 T2DM 的初步研究 x 有利的 s 安全性和耐受性 x 45mg 和 90mg 的活性药物 2a 肥胖 x 第二项研究 12 周以上肥胖 x 有利的安全性和耐受性 x 活性药物 8 周时为 120 毫克(临时)1b 期肥胖 x 对于 4 岁以上肥胖的初步研究 wk x MAD 30mg、60mg、90mg x 活性药物 60mg 和 90mg 2023 年 9 月验证——概念 2023 年 12 月 2 期 T2DM □ 多种配方和滴定方案正在开发中 2b 期肥胖 □~36wk □ 安全性和耐受性 □ 剂量范围和滴定 2024-2025 年后续步骤保密

8 GSBR-1290 T2DM 和肥胖 2 周的 2a 期研究设计主要终点:S 安全性和耐受性次要终点:证实 Hba1c 下降显示体重下降显示体重下降显示混合膳食耐受性测试后代谢参数的变化主要终点:安全性和耐受性次要终点:证明体重降低 2 型糖尿病关键资格标准 • T2DM 大于等于 6 个月成人男性和女性 • 体重指数 ≥27.0 和 ≤40.0 kg/m2 • 二甲双胍的稳定剂量 • Hba1c ≥ 7.0% 和 ≤10.5% • 年龄 ≥18 岁和 ≤75 岁健康超重/肥胖关键资格标准 • 健康超重/肥胖成年男性和女性 • 体重指数 ≥27.0 和 ≤40.0 kg/m2 • HbA1c ≤ 6.5% • 年龄 ≥18 岁和 ≤75 岁保密

9 第 2a 期 (12 周) 第 2a 期 (12 周) 特征 N (%) T2DM 不含 T2DM 的肥胖 45 mg (N=10) 90 mg (N=26) 安慰剂 (N=18) 120 mg (N=24) 安慰剂 (N=16) 年龄,年龄 60.5 (7.5) 55.9 (11.0) 59.4 (9.3) 45.8 (14) 46 (14) 性别,女性 N (%) 4 (40) 12 (46) 7 (39) 13 (54) 4 (25) 西班牙裔或拉丁裔,N (%) 8 (80) 19 (73) 12 (66) 10 (41) 7 (43) 体重,Kg 94.3 (13.7) 90.3 (15.8) 90.3 (11.4) 93.4 (13.9) kg/m 2 33.7 (4.7) 32.6 (3.5) 34 (4.2) 31.5 (3.4) 31.2 (3.2) 糖尿病持续时间,12 年 11.6 12.7--二甲双胍剂量,mg/天 1490 (561) 1796 (400) 1563 (611)--Hba1c,% 8.08 (0.95) 7.98 (0.83) 7.96 (0.86) 5.5 (0.3) 5.4 (0.4) 空腹血糖,mmol/L 9.61 (2.23) 8.76 (1.86) 9.43 (2.65) 5.3 (0.4) 5.3 (0.4) 心率,bpm 67.1 (9.2) 72.3 (13) 73.1 (11) 68.1 (9.3) 70.6 (6.3) 收缩压,mmHg 124.3 (14) 124 (11) 124 (11) 124.8 (10.7) 127.8 (12.6) 舒张压,mmHg 75.4 (8.9) 76.3 (6.8) 76.7 (6.8) 80.1 (7.6) 83.1 (8) GSBR-1290 第 2a 期研究:人口统计和基线特征数据为除非另有说明,否则均值 (SD)。机密

10 GSBR-1290 2a 期研究:参与者配置 2a 期 (12 周) 2a 期 (12 周) N (%) 没有 T2DM 的肥胖 45 mg (N=10) 90mg (N=26) 安慰剂 (N=18) 120mg (N=24) 安慰剂 (N=16) 由于 aE 而停止研究 2 (20) * 0 0 0 0 与研究药物 1 (10) ** 0 0 0 0 0 停药、向下滴定或保持 4 (40) 11 (42) 0 9 (37) 0 已完成研究 8 (80) 26 (100) 17 (89.5) 研究仍在进行中 GSBR-1290 期 2a T2DM 研究随机化 (N=54) GSBR-1290 期 2a 肥胖研究随机化 (N=40) * 1 个主题由于 COVID-19 而停止研究和 1 个受试者因胃肠道相关不良而停止研究** 1 个受试者因与 GI 相关的 AE 机密信息而中止

11 GSBR-1290 计划更新安全性和耐受性摘要 2a 期 — T2DM 2a 期第一项研究的头条数据 —《肥胖机密》的中期结果
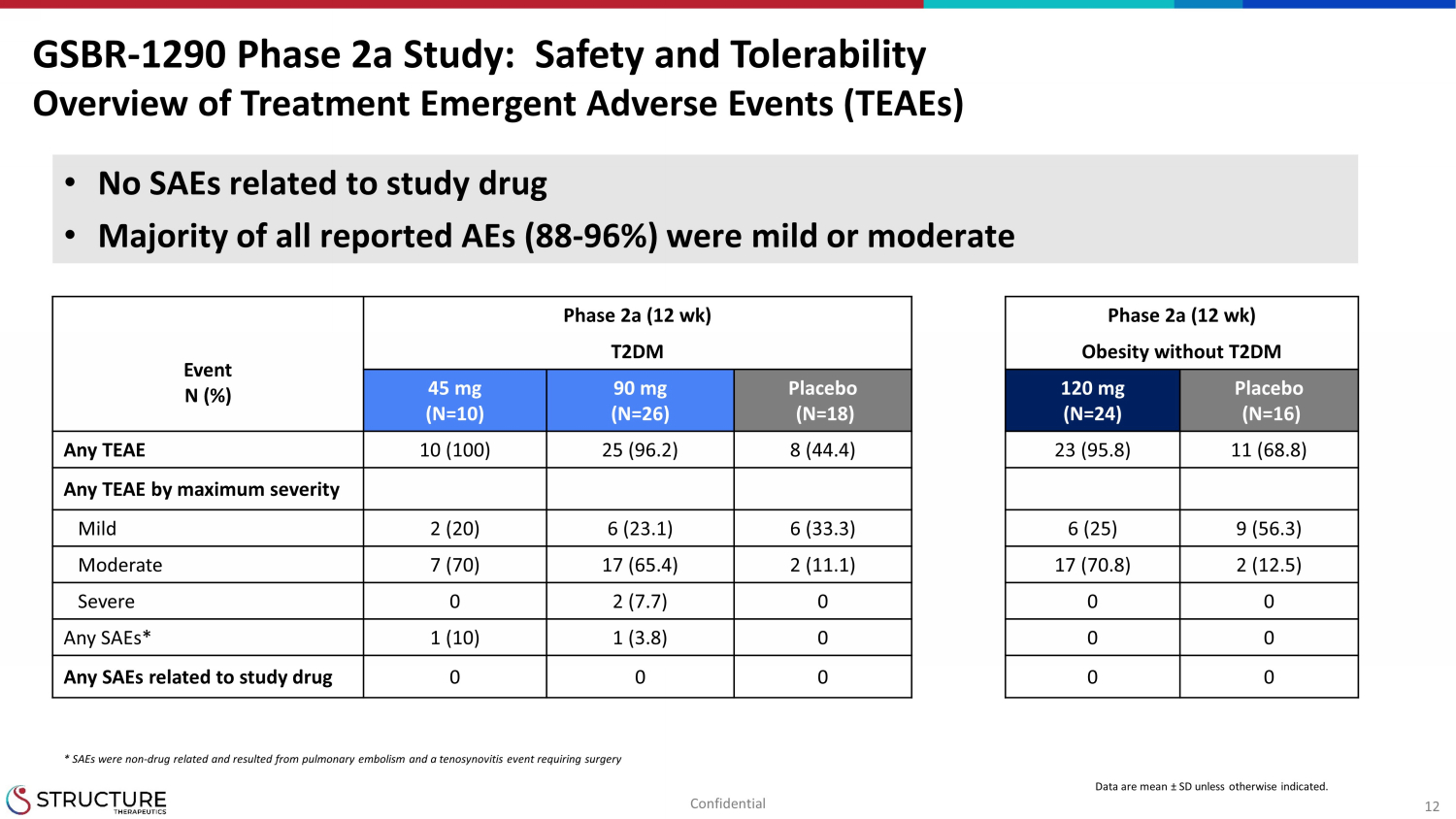
12 第 2a 期 (12 周) 第 2a 期 (12 周) 事件 N (%) 没有 T2DM 的 T2DM 肥胖 45 mg (N=10) 90 mg (N=26) 安慰剂 (N=18) 120 mg (N=24) 安慰剂 (N=16) 任意 TEAE 10 (100) 25 (96.2) 8 (44.4) 23 (95.8) 11 (68.8) 任意按最大严重程度划分的 TEAE 轻度 2 (20) 6 (23.1) 6 (33.3) 6 (25) 9 (56.3) 中度 7 (70) 17 (65.4) 2 (11.1) 17 (70.8) 2 (12.5) 严重 0 2 (7.7) 0 0 0 0 任意 saeS* 1 (3.8) 0 0 0 0 与研究药物 0 0 0 0 0 GSBR-1290 2a 期研究:安全性和耐受性治疗紧急不良事件 (TEAE) 数据均为平均值 ± SD,除非另有说明表明。• 没有与研究药物相关的 SAE • 在所有报告的不良反应中,大多数(88-96%)为轻度或中度* SAE 与药物无关,是由肺栓塞和需要手术的腱鞘炎事件引起机密
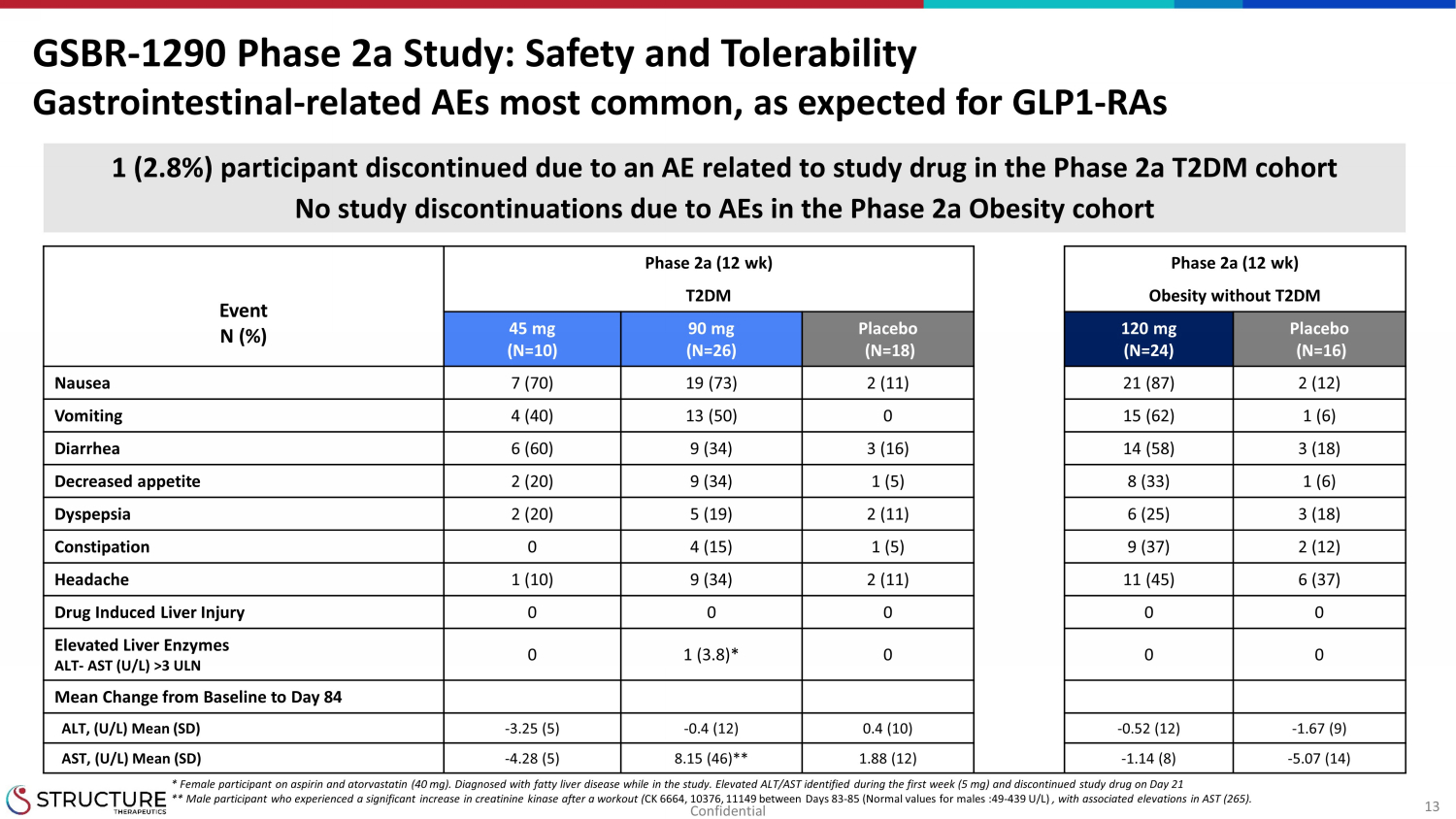
13 第 2a 期 (12 周) 第 2a 期 (12 周) 事件 N (%) 没有 T2DM 的 T2DM 肥胖 45 mg (N=10) 90 mg (N=26) 安慰剂 (N=18) 120 mg (N=24) 安慰剂 (N=24) 恶心 7 (70) 19 (73) 2 (11) 21 (87) 2 (12) 呕吐 4 (40) 13 (50) 0 15 (62) 1 (6) 腹泻 6 (60) 9 (34) 3 (16) 14 (58) 3 (18) 食欲不振 2 (20) 9 (34) 1 (5) 8 (33) 1 (6) 消化不良 2 (20) 5 (19) 2 (11) 6 (25) 3 (18) 便秘 0 4 (15) 1 (5) 9 (37) 2 (12) 头痛 1 (10) 9 (34) 2 (11) 11 (45) 6 (37) 药物引起的肝损伤 0 0 0 0 0 0 肝酶升高 ALT-AST (U/L) >3 ULN 0 1 (3.8) * 0 0 0 均值变化从基线到第 84 天 ALT,(U/L) 平均值 (SD)-3.25 (5)-0.4 (12) 0.4 (10)-0.52 (12)-1.67 (9) AST,(U/L) 平均值 (SD)-4.28 (5) 8.15 (46) ** 1.88 (12)-1.14 (8)-5.07 (14) GSBR-1290 第 2a 阶段研究:安全性和耐受性胃肠道相关不良反应最为常见,正如预期的那样,GLP1-raS 1(2.8%)受试者因与2a期研究药物相关的不良反应而停药 2a期肥胖队列中没有因不良反应而终止研究* 服用阿司匹林和阿托伐他汀的女性参与者(40 mg)。在研究中被诊断出患有脂肪肝疾病。第一周发现ALT/A ST升高(5 mg),并在第21天停药。** 锻炼后肌酐激酶显著增加的男性参与者(CK 6664、10376、11149,男性正常值:49-439 U/L),AST(265)升高。机密
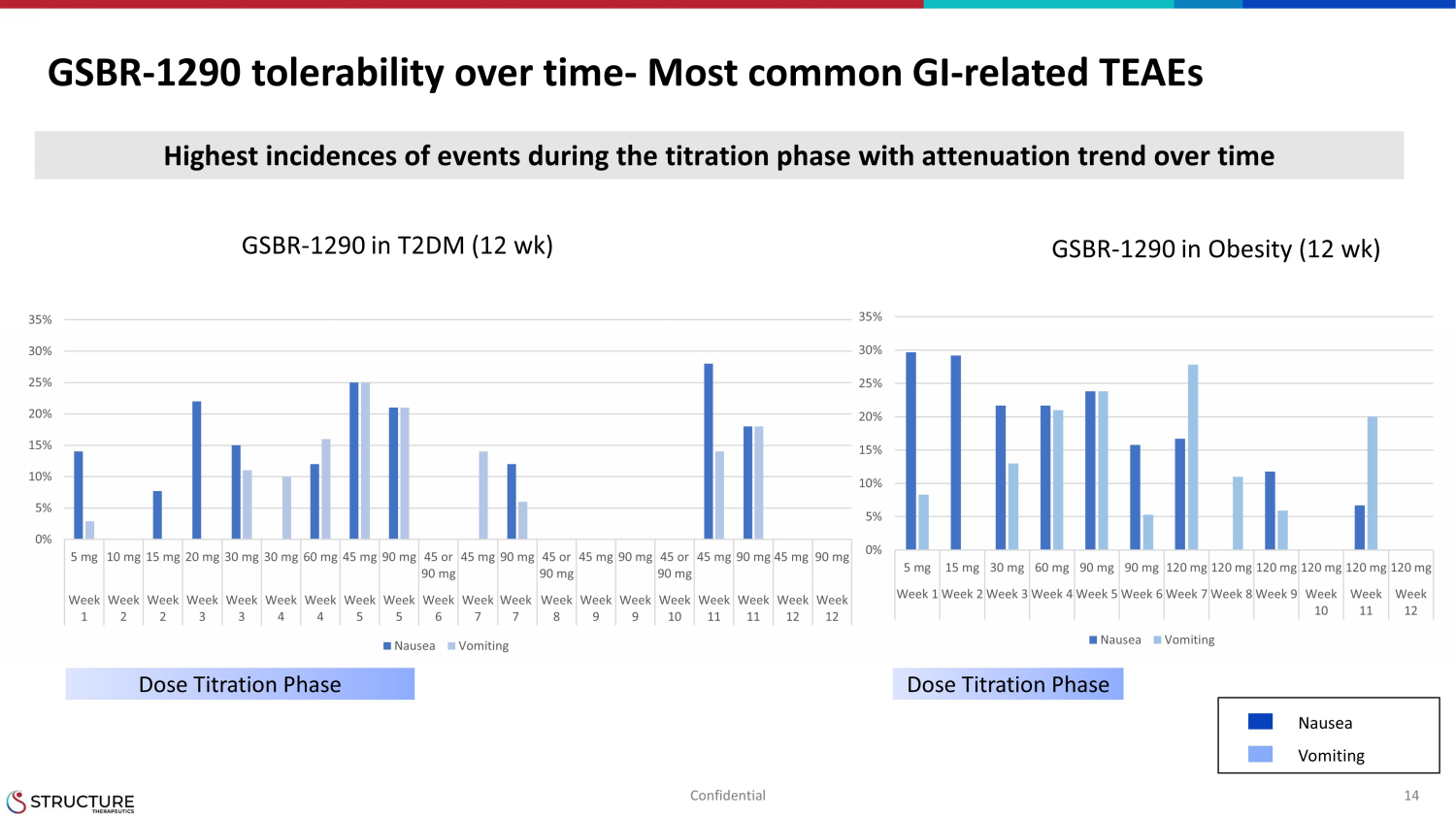
GSBR-1290 随时间推移而来的耐受性-最常见的胃肠道相关性 TeaEs 14 机密滴定阶段事件发生率最高,随着时间的推移呈衰减趋势 GSBR-1290 T2DM(12 周)GSBR-1290 肥胖(12 周)剂量滴定期剂量滴定期恶心呕吐 0% 10% 15% 20% 30% 35% 5 mg 30 mg 30 mg 60 mg 90 mg 120 mg 120 mg 120 mg 120 mg 120 mg 120 mg 第 1 周第 2 周第 3 周第 4 周第 6 周第 7 周第 8 周第 11 周恶心呕吐 0% 5% 10% 15% 25% 35% 5 mg 10 mg 15 mg 20 mg 30 mg 30 mg 60 mg45 mg 90 mg 45 或 90 mg 45 mg 45 或 90 mg 45 mg 90 mg 45 或 90 mg 45 mg 90 mg 45 mg 90 mg 90 mg 90 mg 第 1 周第 2 周第 3 周第 4 周第 5 周第 6 周第 7 周第 9 周第 11 周第 12 周恶心呕吐

GSBR-1290 2a 期研究(12 周):心率变化 15 机密 • 使用 GSBR 观测到的脉搏率更高(5 到 8 bpm)——与全班预期的一样 1290 • 上升幅度与其他 GLP 一致——1raS 1,2、2 Granhall C、Donsmark M、Blicher TM 等Clin Pharmackoinet。2019;58 (6): 781-791。Pratt E、Max、Liu R 等Diabetes Obes Me 选项卡。2023;25:2634 — 2641。每分钟心跳次数 (BPM) 0 1 2 3 4 5 6 7 8 9 GSBR-1290 45 mg GSBR-1290 90 mg GSBR-1290 120 mg 从心率 (bpm) 的基线变化到第 12 周,经安慰剂调整的 T2DM 不使用 T2DM 肥胖

16 GSBR-1290 项目更新疗效摘要 2a 期 — 针对 T2DM 患者的第一项研究 2a 期的头条数据 — 肥胖患者的中期结果机密
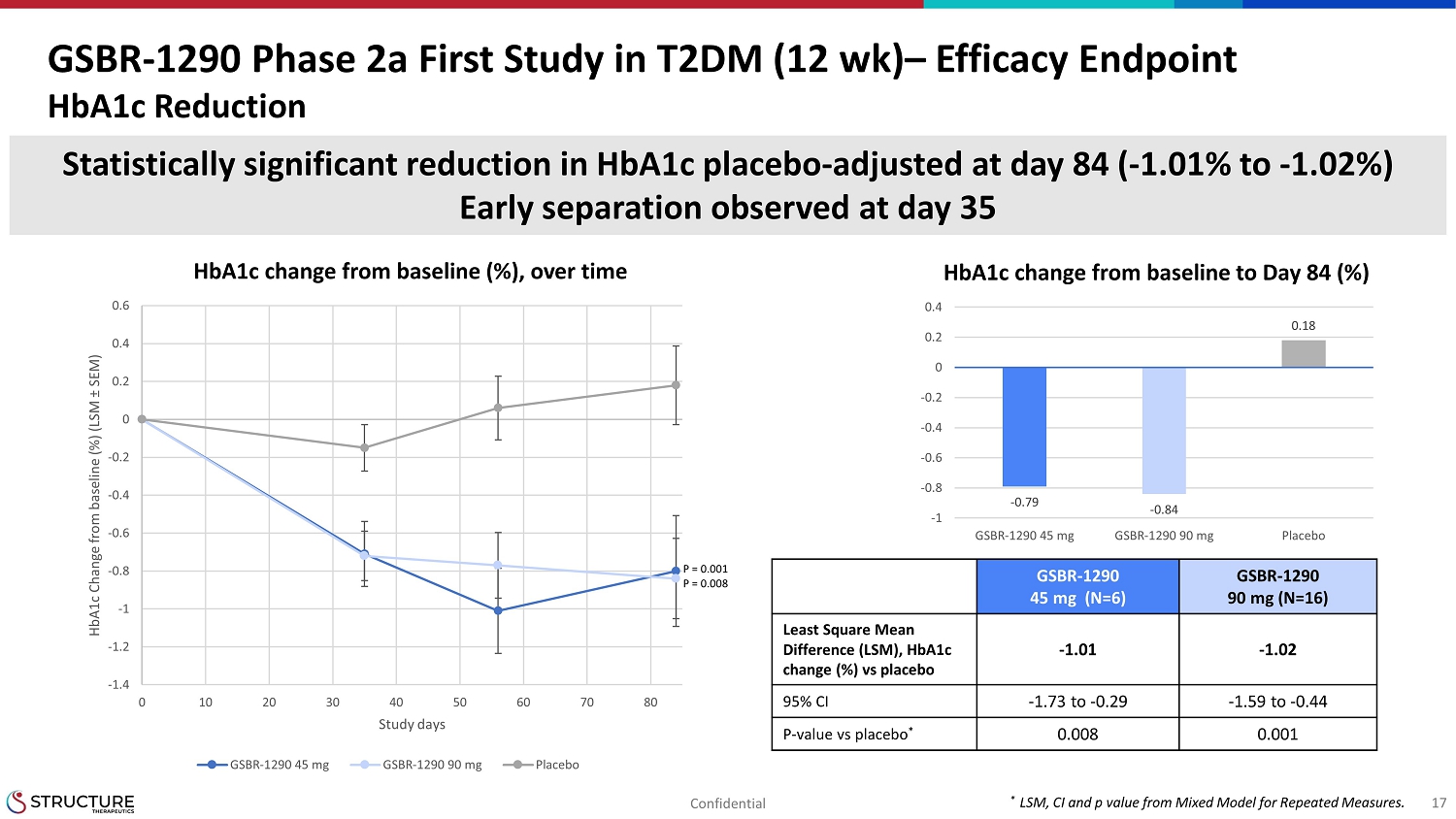
GSBR1290 第 2a 期首次研究 T2DM(12 周)疗效终点降低 Hba1c 在第 84 天调整后安慰剂有统计学显著降低(1.01% 至 1.02%)在第 3517Hba1c 从基线到第 84 天观察到的早期分离随时间推移而变化(%)1.4-1.2-1-0.6-0.4-2000 .20.40.60 10 20 30 40 60 70 80Hba1c 与基线的变化 (%) (LSM SEM) 研究日sgsbr-1290 45 mg GSBR-1290 90 mg 安慰剂br129045 mg (N=6) GSBR129090 mg (N=16) 最小二乘均差 (LSM)、Hba1cChange (%) 与安慰剂-1.01 -1.0295% CI-1.73 至 0.0 29 -1.59到 0.44P 值与安慰剂 0.0080.001*LSM、CI 和 p 值来自重复测量混合模型。-0.79-0.840.18-1-0.8-0.6-0.200.20.4gsbr-1290 45 mg GSBR-1290 90 mg 安慰剂,N=17P = 0.008机密

18GSBR129045 mg (N=6) GSBR129090 mg (N=16) 最小二乘均差 (LSM)、体重变化 (%) 与安慰剂-3.51 -3.2695% CI-5.58 至 1.43 -5.17 至 1.36Pvalue 与安慰剂 0.00190.0013体重与基线的变化 (%)、第 84 天*LSM、CI 和 p 值来自混合模型的变化重复测量-3.32 -3.220.04-3.50-3.00-2.00-1.50-1.00-0.500.000.50GSBR-1290 45 mg GSBR-1290 90 mg 安慰剂调整后的体重在统计学上显著降低 84 天(3.26% 至 3.51%)第 2a 阶段体重持续下降 84GSBR1290T2DM 研究(12 周)功效终点减重 5-4-3-2-10120 10 20 30 40 50 60 70 80体重与基线相比的变化(kg)(LSM SEM)研究日 sgsbr-1290 45 mg GSBR-1290 90 mg Placebop = 0.0007Contiveriat

-1.61-1.281.21-2.00-1.00-0.500.000.501.001.50GSBR 45 mg GSBR 90 mg 安慰剂-4-3-2-10120 20 40 60 80空腹血糖与基线的变化 (mmol/L) (LSM SEM) 研究日sgsbr1290 45 mg GSBR-1290 90 mg 安慰剂Br1290 期 2a:T2DM 中的第一项研究 (12 周) 功效 Endpoint空腹血糖统计学上空腹血糖显著降低 19空腹血糖与基线相比的变化 (mmol/L),第 84 天空腹血糖与基线的变化 (mmol/L),随时间推移Gsbr129045 mg (N=6) GSBR129090 mg (N=16) 最小二乘均差 (LSM),变化 FPG(mmol/L) vs 安慰剂-2.70 -2.5095 CI-4.82 至 0.56 -3.90 至 1.08P 值 vs 安慰剂 0.010.0008P = 0.0008P = 0.01*来自重复测量混合模型的 LSM、CI 和 p 值机密

GSBR-1290 第 2a 期:T2DM 的首次研究(12 周)— 疗效终点混合膳食耐量测试安慰剂调整后的第 84 天 BL 的变化(LSM)GSBR-1290 显示餐后葡萄糖、胰岛素和胰岛素抵抗标志物血浆葡萄糖(mmol/L*Hour)、AUC 0-4(胰岛素 miu/l*Hour)、AUC 0-4 HOMA-IR,AUC 0-4-19.4-113.7-78.3-20.4-47.5-49.0 -120 -100 -80 -60 -40 -20 0 GSBR-1290 45 mg,N=6 GSBR-1290 90 mg,N=16 P 值 = 0.0008 P 值 = 0.02 P 值 = 0.05 P 值
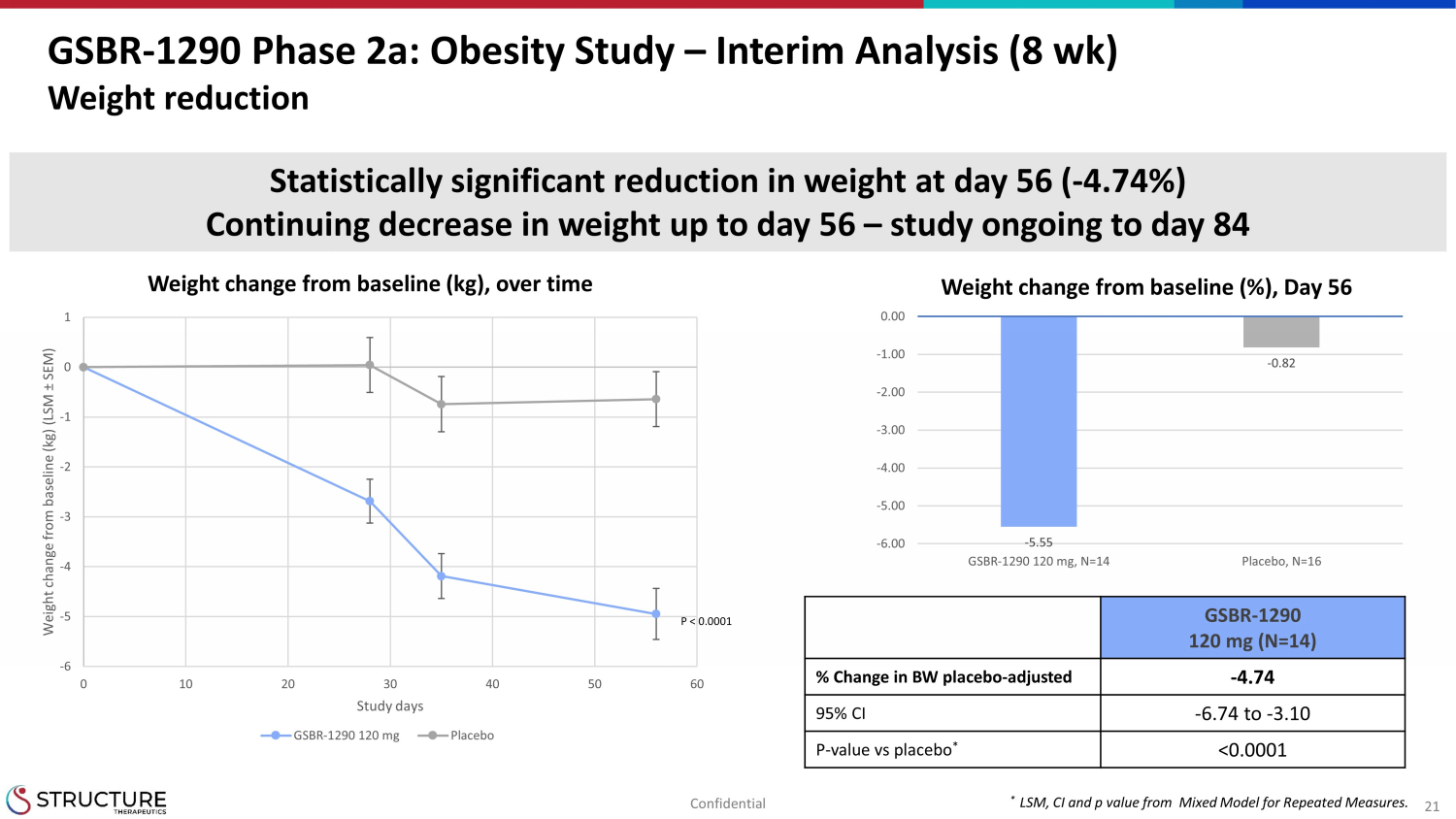
21 GSBR-1290 第 2a 阶段:肥胖研究 — 中期分析(8 周)减肥随着时间的推移体重与基线(kg)的变化* 重复测量混合模型中的 LSM、CI 和 p 值。-6 -5 -4 -3 -1 0 10 20 30 40 50 60 体重与基线相比的变化(kg)(LSM ± SEM)研究日 GSBR-1290 120 mg 安慰剂-5.55-0.82 -6.00 -6 5.00 -4.00 -3.00 -2.00 -1.00 0.00 GSBR-1290 120 mg,N=14 安慰剂,N=16 体重与基线相比有显著变化(%),第 56 天体重在统计学上显著降低(-4.74%)直到第 56 天体重持续下降 — 研究仍在进行中至第 84 天 GSBR-1290 120 mg (N=14)% 体重安慰剂变化——调整后——4.74 95% 置信区间——6.74 至-3.10 P——与安慰剂的对比值 *

22 GSBR-1290 减肥摘要在 T2DM 和肥胖中观察到的具有临床意义且具有统计学意义的减重 22% 与基线相比 -6 -5 -4 -3 -2 0 0 10 20 30 40 50 70 80 90 90 体重与基线相比的变化 (%) 肥胖 90mg (ph1b) 肥胖 120mg (ph2a) 研究天数非 T2DM 安慰剂 (ph2DM) (ph1b) 安慰剂(ph2a 肥胖)安慰剂(日本桥接)肥胖 30mg(ph1b)安慰剂 T2DM 90mg(ph2a)T2DM 45mg(ph2a)T2DM 精益非日本 60mg(桥接)肥胖 60mg(ph1b)

23GSBR1290 在口服小分子背景下 GLP 1RA-14-12-10-6-4-2020.0 4.0 8.0 12.0 16.0 20.0 28.0 32.0 36.0体重与基线相比变化 (%) 研究时间 (周) 体重与基线相比变化 (%) GSBR1290 120mgobesitygsbr1290 45/90mgt2dmorforglipron 24/45mg2obesityorglipron 肥胖的 12mg2dmorforGlipron 12mg2obesityorforGlipron 24/45mg1t2dmplaceBogsbr1290 肥胖期 120 毫克与肥胖中的 Orforglipron 相比具有竞争力。改编自 1《柳叶刀》(https://doi.org /10.1016/S0140 6736 (23) 01302 8)和 2《新英格兰医学杂志》10.1056/nejmoMogs2 8 a2302392*没有头已经进行了头部研究,评估了GSBR 1290与其中包含的Orforglipron的对比。研究设计和条件之间存在差异,在比较不同研究的数据时应谨慎行事

GSBR-1290 项目更新 2b 阶段-支持活动阶段 1 — 日本过渡研究临床前 GLP-毒理学研究 24 机密

25 GSBR-1290 第 1 阶段(4 周):日本和非日本桥接研究 • 所有参与者都完成了研究 • 没有停药或减少剂量 • 没有 SaeS N (%) 日本队列非日本队列 60mg (N=9) 安慰剂 (N=3) 60mg (N=6) 恶心 6 (66.7) 0 3 (50.0) 食欲下降 6 (66.7) 0 1 (16.7) 早期饱腹感 3 (33.3) 0 1 (16.7) 呕吐 3 (33.3) 0 0 腹泻 1 (11.1) 0 0 肝酶升高 0 0 0-3.91-5.13-1.67 -5 -4 -2 -1 0 GSBR-1290 60mg 日本人(n=9)GSBR-1290 60mg 非日本人(n=6)-3.5 -3 -2 -1.5 -1-0.5 0 0 5 10 15 20 25 30 与基线相比,平均体重变化 (kg) GSBR-1290 日本人(n=9)GSBR-1290 非日本人(n=6)日本安慰剂(N=3)观察到健康志愿者体重在 4 周后显著减轻(%)机密参与者体重变化 • 基线体重指数为 22 至 23 kg/m 2 • 年龄:34 至 46 岁 • 主要是女性(67%)

26 6/9 月 GLP-毒理学研究初步结果 x 6 个月的啮齿类动物研究(N = 216)• 每日口服剂量 6 个月(10、100、1000 mg/kg/天),外加 1 个月的恢复期 • 每组动物(治疗+恢复):n=15+5/组/性别 • 无观测不良效应水平为 1000 mg/kg/天,在120 mg治疗剂量下,安全窗口大于 100 倍 • 没有增加 ALT/AST 且无试验 — 与文章相关的肝脏变化 x 对人类灵长类动物的健康 n 的研究 9 个月(N = 60)• 每日口服剂量 9 个月(3、10、30 mg/kg/天),外加 1 个月的恢复期 • 每组动物(治疗+ 恢复):n=5+4/组/性别(高剂量)和 n=4+2/组/性别(其他剂量)• 剂量-依赖性体重与基线相比减少多达 -20% • ALT/AST 未增加且未进行测试-文章相关肝脏变化 NOAEL:未观察到不良反应等级机密

27 GSBR-1290 总体概况和下一步行动马克·巴赫,医学博士,首席营销官机密文件

28 GSBR-1290 — 2a期临床数据概述功效:每天服用 120 毫克,8 周体重显著减轻(4.74%)。研究持续到12周。安全性:无 SAE;不会因不良反应而停药 12 周耐受性:大多数 AE(96%)轻度至中度秘密肥胖:可能是同类中最好的 2 型糖尿病:鼓励 Hba1c 疗效进一步评估以优化 T2DM 减肥功效:12 周后 Hba1c(1.02%)和体重(3.51%)有统计学意义的安全性:没有 sa1c es;因研究药物相关不良反应而停药一次,耐受性可长达 12 周耐受性:大多数 AE(88 — 90%)轻度 — 中度 x 6 个月和 9 个月的临床前毒理学研究支持更高的剂量和更长的治疗时间

29 后续步骤:配方桥接和滴定优化研究胶囊对片剂配方并探索其他滴定方案第 2 部分:• 评估片剂不同滴定方案的耐受性 • 研究治疗剂量(60 mg)的胶囊和片剂的比较生物利用度状态:方案最终确定预计时间表:-按第二季度排列的最高结果筛查检查-入剂量检查-电话检查-输入剂量-退出 EOS 访问 PK 评估 PK 评估日-28-2-1 1 2 3 4 5 7 8 9 10 1117 ///胶囊片剂片剂胶囊研究禁闭期研究门诊期健康超重/肥胖参与者 N= 54 队列 3 12:3 筛查 5mg 15mg 30mg 60mg 胶囊 60mg 片剂后续服用 60mg 片剂 60mg 胶囊-4-3-1 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 队列 2 12:3 筛查 15mg 30mg 60mg 120mg 随访队列 1 12:3 3 筛查 10mg 20mg 30mg 60mg 90mg 120mg 后续检查第 1 部分:比较胶囊与片剂(10 mg 剂量)的 PK,N=16 x 注册完成 □ 第 12 行预计将在 2024 年第二季度发布第 12 周的研究结果机密

30 GSBR-1290 闭幕雷蒙德·史蒂文斯博士,首席执行官机密

31 GSBR-1290:2023 年计划进展和预期里程碑 2024 年 x 第 1b/MAD 阶段数据(4 周)• N=24,健康的超重/肥胖参与者,最多 90 mg • 无不良事件-相关停药,最高可达 90 mg • 60 和 90 mg 时,体重显著降低(调整后高达 4.9% 的安慰剂)x 2a 期 T2DM 数据(12 周)• N=54,T2D 参与者,不超过 90 mg • 1 项研究因与研究药物相关的不良反应而中止(2.8%)• 45mg 和 90 mg x 2a 期肥胖数据时,体重明显降低(调整后安慰剂调整后可达 3.51%)(临时 8 周)• N=40,健康的超重/肥胖参与者,最多 120 mg • 无不良事件-不超过 120 mg • 8wks 时体重显著降低(安慰剂调整后,为 120 mg)x 日本 pk/ethno-过渡数据(4 周)• N=18 非肥胖、健康的日本和非日本成年参与者,最多 60 mg • 无不良事件-相关停药,最高可达 60 mg • 体重显著降低(3.91% 至 5.13%,未调整安慰剂),4 周 x Clean 6/9 个月 GLP-毒素报告 □ 第 2a 期肥胖数据 (12)wk) • N=64 名参与者,最多 120 mg • 招收了 24 名替补参与者 • 预计于 2024 年第二季度完成 □ 胶囊到片剂 pk/配方数据(12 周)• N= 54 名参与者,最多 120 mg • 已完全入组并预计于 2024 年第二季度完成 □ 肥胖临床研究(约 36 周)• 修改剂量优化耐受性的滴定方案 • 在美国和欧洲约有 275 名参与者 • 计划于 2024 年下半年启动 □ 新增 2 期 T2DM 临床研究 •评估使用更高剂量、延长滴定时间以增加目标剂量患者百分比、替代配方以优化 T2DM 疗效的可能性 • 计划于 2024 年下半年启动保密

32 我们迈向潜在最佳口服 GLP-1R 激动剂 x 2a 期 T2DM(12wk)x 2a 期肥胖(临时)x 1b 期 MAD(4wk)2023 年 9 月 2b 期肥胖(约 36wk)证明概念阶段 2b T2DM(约 26wk)剂量-范围调查/优化 3 期肥胖(>52wk)期 3 T2DM (>52wk) 关键研究/相邻适应症 2023 年 12 月 2024-2025 年 2026 年及以后包括其他配方、滴定、给药方案 M ASH 慢性肾脏病心力衰竭成瘾阿尔茨海默氏症 2 期 T2DM 增加的重要机会可及性和治疗 2 型糖尿病和肥胖症* 注:代表公司当前预期的未来发展计划,这些计划可能会发生变化,包括根据研究结果进行更改机密
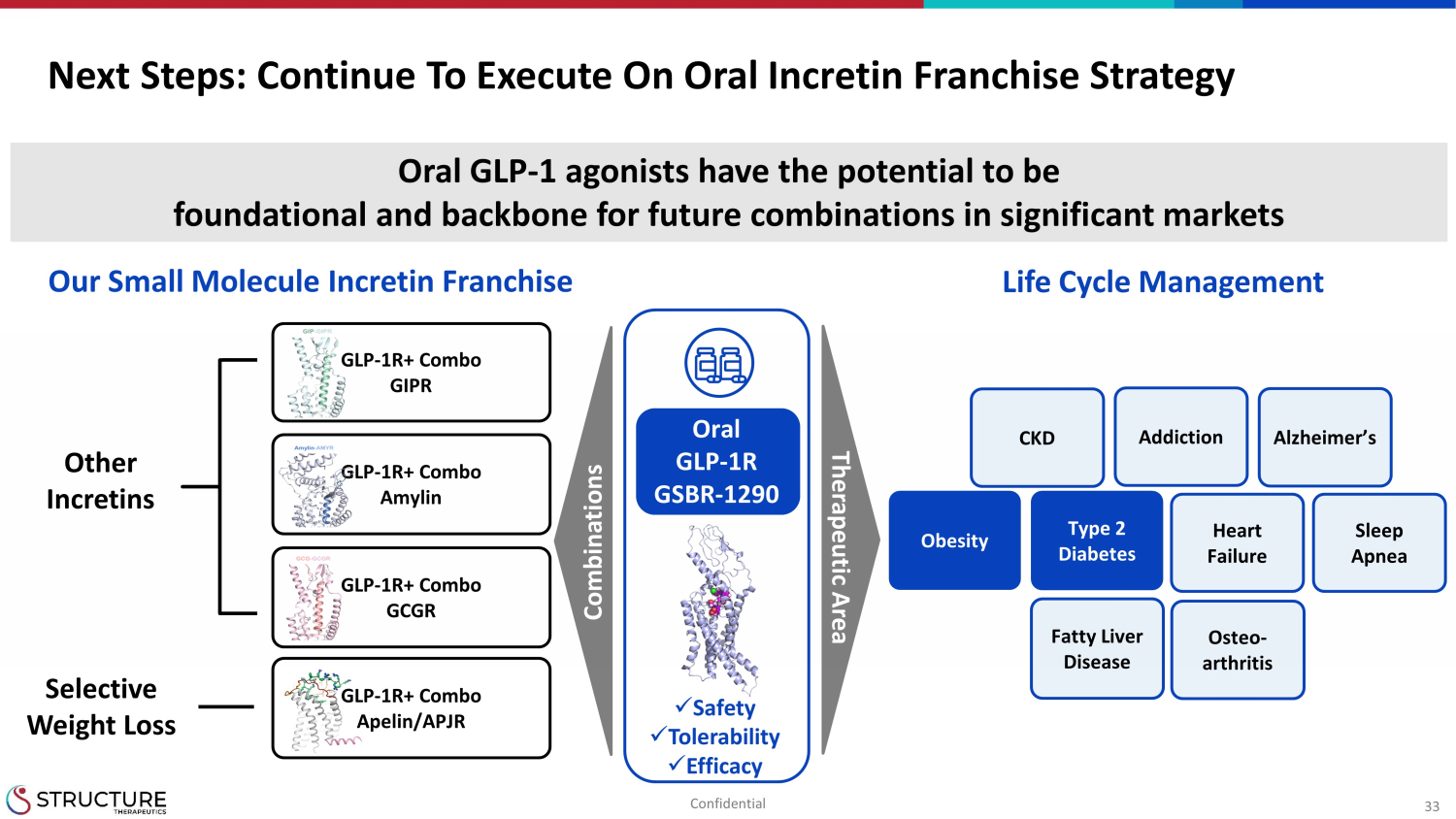
33 后续步骤:继续执行口服肠促胰岛素特许经营策略 GLP-1R+ 组合 GIPR GLP-1R+ 组合 Apelin/Apjr GLP-1R+ 组合 GCGR 骨关节炎脂肪肝病肥胖 2 型糖尿病 CKD 阿尔茨海默氏心力衰竭睡眠呼吸暂停其他肠促素选择性减肥 x 安全性 x 耐受性 x 疗效口服 GLP-1 agpenia 参与者有可能成为重要市场未来组合的基础和支柱组合治疗区域生命周期管理我们的小分子肠促胰岛素特许经营口服 GLP-1R GSBR-1290 机密

34 GSBR-1290 背景下 • 口服 GLP-1 激动剂在治疗肥胖、2 型糖尿病、慢性肾脏病、MASH 等心脏代谢疾病方面具有巨大的未来市场机会 • 口服 GLP-1 激动剂有可能成为未来组合的基础和支柱 — 安全性和耐受性是结合不同作用机制的关键要求,可以优化疗效、安全性和耐受性 — 前景广阔机制包括其他肠促胰岛素和肌肉维持目标 • 基于当今的全面更新,GSBR-1290 似乎具有前景良好的口服 GLP 的特征——在这个重要市场上有 1 种激动剂 x 总体上耐受性良好,没有与研究药物相关的严重不良事件 (SAE) 高达 120 mg x 2a期肥胖研究中没有因不良反应而中止研究 x 1项研究因与2a期研究药物相关的不良反应而中止(2.8%)x 无主要在为期6个月的啮齿动物和9个月的灵长类动物研究中发现的结果——允许在2b期计划中进行长期评估 x 具有临床意义和具有统计学意义的肥胖和 2 型糖尿病体重减轻 x 在未来的 2 b 期研究中使用额外的剂量和滴定方案,优化有前景的安全性、耐受性和疗效特征机密

谢谢!联系我们获取更多信息:电子邮件:ir@structuretx.com http://www.structuretx.com 机密