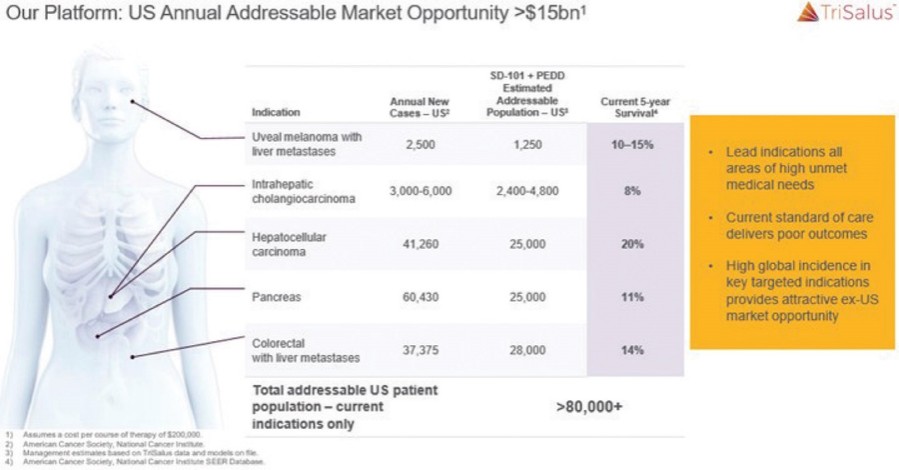
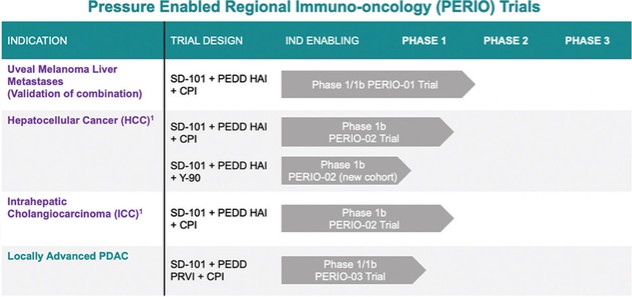
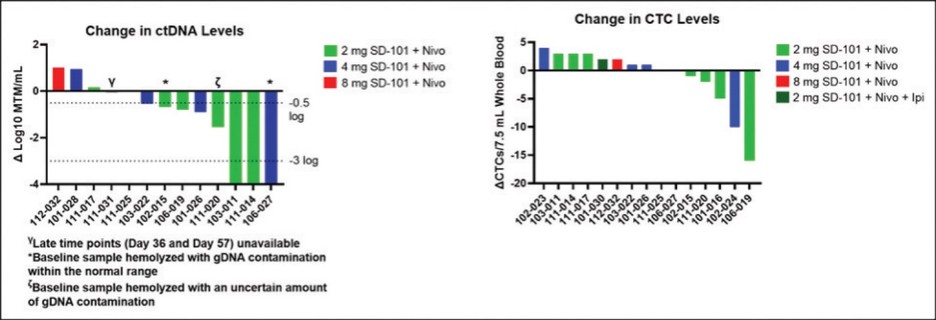
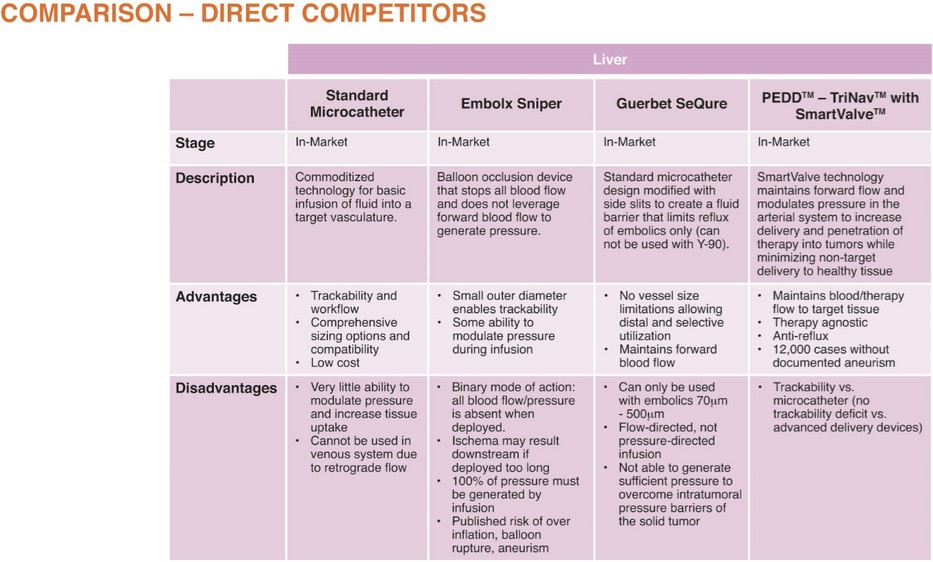
这份初步招股说明书中的信息不完整,可能会被更改。在提交给美国证券交易委员会的注册声明生效之前,我们和出售证券的持有人都不能出售这些证券。这份初步招股说明书不是出售这些证券的要约,也不寻求在任何不允许要约或出售的司法管辖区购买这些证券的要约。
目录表
完成日期为2023年12月15日
初步招股说明书

5859,375股普通股
本招股说明书涉及本招股说明书中指定的出售证券持有人(“出售证券持有人”)或其许可受让人不时提供和出售最多5,859,375股我们的普通股,每股面值0.0001美元(“普通股”),这是我们可以根据与TriSalus Life Sciences签订的日期为2023年10月2日的备用股权购买协议,酌情选择向YA II PN,Ltd.(“约克维尔”)发行和出售的普通股数量。公司(下称“公司”或“TriSalus”)和约克维尔(下称“SEPA”)在本招股说明书发布之日后,按照国家环保总局规定的条款和条件不时发行。见本招股说明书标题为“出售证券持有人“了解有关出售证券持有人的其他信息。
根据SEPA,该公司同意不时向约克维尔发行和出售普通股,约克维尔同意从该公司购买至多3000万美元的普通股。本公司不应影响根据SEPA进行的任何销售,约克维尔没有根据SEPA购买普通股的任何义务,前提是在实施此类购买和出售后,根据SEPA发行的普通股以及与可能被视为同一系列交易一部分的任何其他相关交易发行的普通股的总数,其中此类销售的平均价格将低于5.12美元,且截至2023年10月2日,已发行的普通股数量将超过已发行有投票权普通股的19.9%(“交易所上限”)。因此,该公司可能无权将价值3000万美元的普通股全部出售给约克维尔。
关于国家环保总局,我们在此登记5,859,375股普通股,相当于根据国家环保总局可发行的最高股份数量,假设按照纳斯达克的“最低价格规则”未经股东批准,并假定国家环保总局规定的实益所有权限制。如本公司拟发行超过5,260,704股普通股,每股平均价不超过或不超过5.12美元(相当于以下较低者):(I)紧接国家环保总局日期前五个交易日的纳斯达克官方收市价(在纳斯达克反映);或(Ii)紧接国家环保总局日期前五个交易日的纳斯达克官方收市价平均值),根据纳斯达克上市规则,须取得股东批准。
这些股票将根据两种定价选项中的一种发行并出售给约克维尔,由公司选择。根据第一个方案(“定价方案1”),公司将在自收到约克维尔预先通知开始至下午4:00结束的任何期间内,以市价的96%(定义见下文)向约克维尔出售普通股。适用的提前通知日期(“选项1定价期”)的纽约市时间。根据第二个方案(“定价方案2”),公司将在预告日期(“方案2定价期”)开始的任何连续三个交易日(“方案2定价期”)内,以市价的97%向约克维尔出售普通股。“市场价”的定义是,对于任一期权1定价期,指纳斯达克普通股在期权1定价期内的日成交量加权平均价格;对于任一期权2定价期,指纳斯达克普通股在期权2定价期内的日最低成交量加权平均价格。
假设(I)市价为5.12美元,(Ii)没有实益拥有权限制,以及(Iii)收到股东批准超过交易所上限,吾等可根据定价方案1发行最多6,103,515股普通股及根据定价方案2发行最多6,040,592股普通股,这将分别反映本公司于发行生效日期的普通股流通股约18.79%及18.63%。
由于上述原因,我们可能无法获得SEPA下的全部3,000万美元。见本招股说明书标题为“受控股权融资了解更多有关国家环保总局的信息。