

2023 年 12 月广泛性焦虑症 (GAD) 2b 期附录 99.2 MM-120 标题数据

免责声明本演示文稿(“演示文稿”)由 Mind Medicine (MindMed) Inc.(“MindMed” 或 “公司”) 编写,仅供参考。此处包含的任何商标均为其所有者的财产,仅用于参考目的。此类使用 不应被解释为对MindMed产品或服务的认可。关于前瞻性陈述的警示说明本演示文稿包含1995年《美国私人证券诉讼改革法》的安全港条款和其他适用的证券法所指的 “前瞻性陈述”,我们的官员和代表可能会不时作出。前瞻性陈述通常可以用诸如 “计划”、“期望”、“预期”、“预期”、“预期”、“估计”、“预测”、“打算”、“预期”、 会”、“项目” 或 “相信” 或此类词语和短语的变体(包括负面变体)或陈述来识别 “可能”、“可以”、 “将”、“可能” 或 “将” 采取、发生或实现,以及对未来时期的类似提法。除历史事实陈述外,前瞻性陈述的示例包括与以下内容有关的 陈述:公司针对广泛性焦虑症(“GAD”)的 MM-120 2b 期研究 12 周数据的预期时间和结果、MM-120 在 GAD 或任何其他适应症中的安全性或有效性、 对 MM-120 第 3 期试验的预期、任何候选产品或治疗的开发和商业化或安全性或上述任一措施的功效,我们开发的成功与时机活动;我们计划中的临床试验的成功 和时机;我们实现此处规定的里程碑的能力;任何临床试验成功或获得FDA或其他监管部门批准的可能性;获得专利或此类专利获得后的功效 的可能性,以及MindMed预计进入的市场的潜力。前瞻性陈述既不是历史事实,也不是对未来表现的保证。相反,它们仅基于我们当前的信念、 对业务未来、未来计划和战略、预测、预期事件和趋势、经济以及截至本演示之日的其他未来状况的预期和假设。尽管MindMed认为这些 假设是合理的,但这些假设本质上受重大的商业、社会、经济、政治、监管、竞争和其他风险和不确定性的影响,这些风险和不确定性难以预测,其中许多风险和不确定性不在 MindMed的控制范围内,实际业绩和财务状况可能与前瞻性陈述中指出的结果和财务状况存在重大差异。因此,您不应依赖任何这些前瞻性陈述。可能 导致实际业绩和财务状况与前瞻性陈述中指出的存在重大差异的重要因素包括:MindMed筹集资金以完成其计划并为其研究提供资金的能力; 正在开发的药物和治疗方法的医疗和商业可行性;MindMed的负现金流历史;MindMed的运营历史有限;未来出现亏损;缺乏收入;遵守 法律法规;与之相关的困难研发;与临床试验或研究相关的风险;与审批程序中受控物质相关的监管审查得到加强;产品开发 的早期阶段;临床试验风险;监管批准程序;迷幻药行业的新颖性;以及MindMed 最近向美国证券交易委员会(“SEC” 提交的10-K表年度报告)中讨论或提及的风险因素”),10-Q 表的季度报告截至2023年9月30日向美国证券交易委员会提交的期限以及我们在未来 向美国证券交易委员会和加拿大所有省份和地区的证券监管机构提交的其他文件中,可在SEDAR上的公司简介下查阅,网址为www.sedar.com。MindMed在本演示文稿中发表的任何前瞻性陈述均以 为基础,仅代表截至发表之日的信息。MindMed没有义务公开更新任何可能不时发表的前瞻性陈述,无论是书面还是口头陈述,无论是由于新信息、未来发展还是其他原因。关于监管事项的警示说明美国联邦政府通过《管制物质法》对药品进行监管。MM-120 是 lysergide d-tartrate 的专有形式, 经过药物优化。Lysergide 是《管制物质法》下的一种附表一物质。尽管该公司专注于使用迷幻或致幻化合物以及这些化合物的非致幻剂 衍生物的项目,包括在其 MM-120 和 MM-402 候选产品中,但该公司没有直接或间接参与其经营所在司法管辖区内任何物质的非法销售、生产或分销。该公司是一家神经药物开发公司,除非在批准的监管框架内进行的实验室和临床试验环境中,否则不处理迷幻或致幻物质。 公司的产品在适用的监管批准之前不会商业化,只有成功开发出预期用途的安全性和有效性的临床证据,才会获得批准。市场和行业数据本 演示文稿包括从第三方来源(包括行业出版物)获得的市场和行业数据。MindMed 认为行业数据是准确的,估计和假设是合理的,但是 无法保证这些数据的准确性或完整性。第三方消息来源通常表示,其中包含的信息是从据信可靠的来源获得的,但无法保证所含信息的准确性或 完整性。尽管据信这些数据是可靠的,但MindMed尚未独立验证本演示文稿中提及的来自第三方来源的任何数据,也没有确定这些来源所依赖的基本经济假设 。本演示文稿中提及的研究报告或文章和出版物不应被解释为描述了整个参考报告或文章的完整发现。MindMed 不对此类信息的准确性做出任何 陈述。2023 年 12 月 2 来自 MMED008 研究的头条数据

今天的议程演讲者主题简介 Schond Greenway——首席执行官 2b 期 GAD 试验结果摘要罗布·巴罗——首席执行官 2b 期 GAD 试验结果分析丹·卡林,医学博士——首席医学官 MM-120 发展计划罗布·巴罗——首席执行官摘要和闭幕 备注问题与解答罗布·巴罗——首席执行官丹·卡林,医学博士——首席医学官 Miri Halperin Wernli-执行总裁弗朗索瓦·利林塔尔,医学博士-首席商务官 Schond Greenway-首席财务官 2023 年 12 月 3 来自 MMED008 研究的头条数据

MM-120 2023 年 12 月 广泛性焦虑症 (GAD) 2b 期 LSD d-tartrate GAD 试验结果摘要 4 来自研究 MMED008 的标题数据

MM-120 | 有可能满足 广泛性焦虑症 (GAD) 中大量未得到满足的机会需求 1 • GAD 是成人中第二常见的精神障碍,但潜在的同类最佳治疗选择有限 • 症状可能使人衰弱,治疗 失效会导致缓解不完全和副作用无法忍受。1 大市场 650 万人对大约 2,000 万美国成年人没有反应有 1300 万加元 3 2 1 一线治疗 77% 中度至重度机会接受治疗 3 SSRI/SNRI:50% 失败经常出现不良副作用的比率苯二氮卓类药物:成瘾、耐受风险;通常用于短期新疗法的显著需求 4 丁螺环酮:疗效不佳抗精神病药:短期和长期风险; 耐受性差 1.精神和药物滥用障碍患病率研究:2023 年发现报告。2.Kessler RC、Chiu WT、Demler O 等。《全国合并症调查复制》中12个月的DSM-IV疾病的患病率、严重程度和合并症。 2005 Arch Gen Psychiatry;62 (6):617-627。2023 年 12 月 5 3.安萨拉,耐药性广泛性焦虑症管理,Ment Health Clin,2020年11月;10(6)326-334)美国人口普查局,公司计算。来自研究 MMED008 的头条数据 4.Garakani A等人,(2020)焦虑症的药物疗法:当前和新兴的治疗选择。正面。精神病学 11:595584。doi:10.3389/fpsyt.2020.595584 MOA——作用机制;SSRI——选择性血清素再摄取抑制剂; SNRI-血清素和去甲肾上腺素再摄取抑制剂

1 Topline 第 2b 阶段结果摘要 • 达到具有统计学意义的主要终点 ;MCP-Mod 分析结果支持 GAD 2,3 中 MM-120 的剂量反应关系 • 100 µg 剂量水平下观测到的大效应量为 d=0.88 是护理标准的两倍多 • 统计学上 ,截至第 4 周,HAM-A 分数在临床上显著提高 21.3 个百分点,在 100 微克剂量水平下观察到的最大活性为 2 (p=0.001) o 快速而持久的临床活动在观察期内没有失去效果 4 o 78% 临床反应率在观察期内 5 o 在观察期内,所有分析的次要终点在临床和统计学上均有显著改善 • MM-120 耐受性良好,没有相关的严重不良事件 事件 o 与药物类别和先前的研究一致,主要是短暂的、轻度至中度的不良事件(发生在给药日)6 o 无药物相关严重不良事件 (SAE) 或自杀相关安全信号 • 数据支持 GAD 1 进入第 3 阶段开发。资料来源:MMED008 研究内部研究文件和计算结果。2.基于 100 微克剂量组;HAM-A 分数基于 ANCOVA LS 平均值。效应大小基于研究统计学家使用各组之间的 LS Mean 变化和各组结束 HAM-A 分数的合并标准差进行事后计算。3.检查所有研究的基线组分配(20项研究使用HAM-A(汉密尔顿焦虑量表),1项研究使用PARS (儿科焦虑量表)进行主要结果测量。资料来源:RB Hidalgo,J Psychopharmacol。2007 年 11 月;21 (8): 864-72。2023 年 12 月 6 4.响应定义为 HAM-A 分数比基线提高 50% 以上 5。代表第 4 周顶线分析中所有时间点分析的次要 端点,包括 HAM-A、CGI-S 和 MADRS。来自 MMED008 研究的头条数据 6.根据报告的不良事件进行自杀评估。MCP-Mod — 多重比较程序 — 建模,μg-微克;HAM-A-汉密尔顿焦虑量表

1 观测到的大效应量超过护理标准的两倍 1 广泛性焦虑症中报告的效果规模 2b 期结果主要亮点 2 ▶ 最大观测效果量为 MM-120 100 µg 0.88 0.88 是 2,3 2 标准护理标准的两倍多 MM-120 200 µg 0.64 ▶ 快速且 持久的临床反应 4 3 苯二氮卓类药物单次给药后为 0.38 4 ssRis 0.36 ▶ 临床活性,未进行心理治疗干预 4 丁螺环酮 0.17 0 0.2 0.4 0.6 0.8 p 值未显示 1.来源:Study MMED008 内部研究文件和计算结果。2.MMED008 研究中的 HAM-A 分数基于 ANCOVA LS 均值。效应大小基于事后计算,使用组间的 LS 平均变化以及 组间 HAM-A 分数的合并标准差。2023 年 12 月 7 3.基于 100 微克剂量组。来自 MMED008 研究的头条数据 4.资料来源:RB Hidalgo,J Psychopharmacol。2007 年 11 月;21 (8): 864-72 μg——微克;HAM-A——汉密尔顿焦虑量表;SSRI——选择性血清素再摄取 抑制剂;

MM-120 2b 期 GAD 试验 LSD d-tartrate 广泛性焦虑症 (GAD) 的关键设计要素 2023 年 12 月 8 来自研究 MMED008 的标题数据

1 2b 期试验设计概述 • 具有 个终点的标准 GAD 研究设计,支持注册批准的药物 • 随机、双盲、安慰剂对照、12 周试验 o 单次给药 MM-120 或安慰剂 o 没有心理治疗干预 o 试验设计与 非常一致的试验设计随后发布了 FDA 2023 年关于在随机分组之前退出焦虑药物治疗的患者指南草案 • 招收了 198 名 GAD 患者 • 五臂剂量优化设计采用 1:1 1:1:1:1 随机化 • 主要 终点:汉密尔顿的变化第 4 周的焦虑量表 (HAM-A) 由对治疗任务视而不见的中心评分进行评估,第 1 次就诊。来源:MMED008 研究内部研究文件和计算结果。2023 年 12 月 2.FDA 2023 年指南草案: 迷幻药物:临床研究注意事项。9 项主要数据来自 MMED008 研究 FDA-美国食品药品监督管理局

1 2b 期试验设计概述精神病学 | MM-120(LSD d-tartrate)| 适应症:GAD | 2b 期研究 MMED008 | MM-120 适用于 GAD 198 名参与者总数(实际)A 2b 期剂量优化研究,对广泛性焦虑症筛查中单剂量 MM-120 进行后续剂量输入 标准 MM-120 200 µg • 男性和女性 MM-120 100 g • 18 岁 74 • GAD 的诊断 MM-120 50 µg • HAM-A ≥ 20 µg 安慰剂额外终点 • MADRS• • CGI-S/ I• PSQI • PGI-S/C• ASEX 随机化主要终点次要终点 MM-120 EQ-5D-5L终端 • SDS (HAM-A) (HAM-A) 1.来源:MMED008 研究内部研究文件。2023 年 12 月 μg:微克;HAM-A:汉密尔顿焦虑评级量表;MADRS: 蒙哥马利-阿斯伯格抑郁评级量表;CGI-S:全球临床印象——来自 MMED008 严重程度研究的 10 条主要数据;SDS:希恩残疾量表;EQ-5D-5L:EuroQOL-5 维度;PSQI:匹兹堡 睡眠质量指数;ASEX:亚利桑那州性经历规模

1 2b 期治疗交付方案详情 • 旨在 展示仅限药物的效果,无需心理治疗干预 2 • 符合 2023 年 FDA 指南草案的给药方案 • 治疗前 治疗后 ✓ 全面的知情同意程序 ✓ 通过 ✓ 后续访问对参与者进行持续监测,以确保安全性和有效性给药会话监视器评估患者 ✓ 资格评估 ✓ 参与者提供音乐、眼影遮蔽的旅程,读写材料 MMED008 ✓ 当出院标准符合时,参与者将解除观察 x 否 “准备” — 预治疗 x 否 “辅助治疗” x 没有 “整合” 患者活动仅包括标准 x 没有心理治疗也没有治疗 x 没有持续的治疗参与,因为除了 研究药物部分之外,还没有持续的治疗参与 MMED008 知情同意过程干预 1.来源:MMED008 研究内部研究文件。2023 年 12 月 2.FDA 2023 年指南草案:迷幻药物:临床研究注意事项。11 项主要数据来自 MMED008 研究 FDA-美国 美国食品药品监督管理局

MM-120 2b 期 GAD 试验 广泛性焦虑症 (GAD) LSD d-tartrate 结果分析 2023 年 12 月来自研究 MMED008 的关键数据

1 第 2b 阶段 GAD 受试者体质-包含在 FAS 人群中: 100% 200 µg-已完成 4 周 (n=39) (n=40)-随时停药 (n=8) 97.5% 4 周完成率-包括在 FAS 人群中:尽管需要随访,但高剂量组中仍为 100% 2 100 µg-已完成 4 周 (n=39) (n=40) 次访问 额外治疗-随时停药 (n=6) 随机分组-包含在 FAS 人群中:90% 50 µg-已完成 4 周 (n=35) (n=198) (n=40)-随时停药 (n=11) • 安全套装 (n=198) • 全面分析 套装 (FAS) 89.4% 4 周完成率 (n=194)-包括在 FAS 人群中:尽管需要 25 µg,但仍有 100% 的随机受试者-已完成 4 周 (n=34) 的随访而没有进行额外治疗 (n=39)-随时停止 (n=10)-包含在 FAS 人群中:100% 安慰剂-已完成 4 周 (n=39)-随时停药 (n=13) 1。来源:MMED008 研究内部研究文件和计算结果。安全人群。2023 年 12 月 2.高剂量组包括 100 和 200 µg 剂量组。13 项主要数据来自研究 MMED008 μg-微克;HAM-A-汉密尔顿焦虑量表

1 人口统计学和基线特征各组参与者人口统计 和基线特征通常保持平衡 MM-120 安慰剂人口统计学 (n=194) 25 µg 50 µg 100 µg 200 µg (n=39) (n=39) (n=40) (n=40) (n=39) 平均年龄(岁)38.0 45.3 42.7 42.1 38.7 性别,女性(%)51.3% 55.6% 40.0% 70.0% 66.7% 种族(% 白人)84.6% 80.6% 90.0% 82.5% 76.9% Baseline HAM-A 分数 30.2 30.3 31.0 30.3 Baseline CGI-S 分数 4.9 4.9 4.9 1。来源:MMED008 研究内部研究文件和计算结果。完整的分析集合人群。 2023 年 12 月 14 μg-微克;HAM-A-汉密尔顿焦虑量表;CGI-S-来自 MMED008 研究的临床全球严重程度印象标线数据

1 主要终点 | 统计学上第 4 周的 HAM-A 分数变化 以及第 4 周 100 和 200 微克剂量组中 HAM-A 分数在临床上显著降低 HAM-A 从基线 0 变化到第 4 周 ▶ 100 µg:-21.3 分 ▶ 200 µg:-19.3 分 -5 比安慰剂改善 -10 ▶ 100 µg:-7.6 分,p=0.0004 ▶ 200 µg:-5.5 分,p=0.01 -15 ** -20 *** -25 0 1 2 3 4 基线第 1 周第 2 周 4 安慰剂 25 μg 100 μg 200 μg **p≤0.01 ***p≤0.001 1。 来源:Study MMED008 内部研究文件和计算结果。完整的分析集合人群。2023 年 12 月 µg-microgram;HAM-A-汉密尔顿焦虑评级量表 15 条标题数据来自 MMED008 注意:尽管研究并没有 为这些成对比较提供支持,但仍取得了显著性。HAM-A 分数中的 LS 均值变化 (SEM)

1 探索性终点 | 第 4 周的 HAM-A 反应和缓解剂量依赖性反应增加,100 和 200 微克剂量组的反应者为 78%;50% 的参与者在 100 µg 剂量组 2 中实现缓解 2 2 HAM-A 在第 4 周的缓解率 60 90 50 78 78 80 70 40 58 60 51 30 30 40 31 20 20 10 0 0 0 安慰剂 25 µg 50 µg 100 µg 200 µg 安慰剂 25 µg 50 µg 100 µg 200 µg p 值未显示 p 值未显示 1。来源:研究 MMED008 内部研究 文件和计算结果。完整分析集合人群。2023 年 12 月 2.反应被定义为 HAM-A 分数提高 50% 或以上;缓解被定义为 HAM-A 分数小于 7。16 来自研究 MMED008 µg- 微克的顶线数据;HAM-A-汉密尔顿焦虑评级量表% 应答者% 汇款人

1 初步分析 | 多重比较程序 — 建模 HAM-A 的 (MCP-mod) 具有统计学意义的剂量反应关系以及靶治疗范围的确定 2 MCP-Mod 分析的关键要点 ▶ 具有多个模型拟合的统计学显著剂量反应关系 ▶ 支持在 GAD 的后续临床研究中选择 50 µg 以上的剂量 ▶ 预先指定的模型估计值和观察到的反应可推动剂量选择 3 期研究剂量 1。来源:研究 MMED008 内部研究文件和 的计算。完整的分析集合人群。2023 年 12 月 2.资料来源:诺华。“MCP-Mod 方法论 — 剂量反应的统计方法。来自研究 MMED008 µg-微克;HAM-A-汉密尔顿焦虑 评级量表模型均值

1 次要终点 | 临床全球印象 — 严重程度 (CGI-S) 统计学上截至第 4 周 100 和 200 微克剂量组的临床全球严重程度印象 (CGI-S) 量表显著降低 2 100 和 200 微克组 CGI-S 改善 CGI-S 分数 6 — 重病 ▶ 统计学和临床显著改善 5 — 病情明显并维持至第 4 周 4 — 中等 Ill ▶ 第 4 周 CGI-S 分数提高超过 2 个单位 3 — 病情轻微 ***** ▶ 参与者平均只有 2 个 — 边缘病情边缘-第 4 周病情至轻度 1 — 正常,根本没有生病基线第 4 周安慰剂 25 μg 100 μg 200 μg **p≤0.01 ***p≤0.001 1。来源:MMED008 研究内部研究文件和计算结果。完整分析集合人群。2023 年 12 月 2.尽管研究没有为这些成对比较提供支持,但还是取得了显著意义。18 项主要数据来自研究 MMED008 µg-microgram;CGI-S-临床 全球印象——严重性

1 次要终点 | 合并抑郁症分数与基线的变化 分数 (MADRS) 2 在第 4 周 100 和 200 微克剂量组中,MADRS 评分在统计学和临床上均有显著降低 2 MADRS 从基线 0 变化到第 4 周 -2 ▶ 100 µg:-18.1 分 -4 ▶ 200 µg:-18.3 分 -6 比安慰剂改善 -8 ▶ 100 µg:-18.3 分 -6 比安慰剂改善 -8 100 µg:-18.3 分 -6 比安慰剂改善 -8 100 µg:-5.7 点积分,p

1 安全性概述 MM-120 耐受性良好,大多为短暂性的 轻度至中度不良事件,符合药物类别预期 • 几乎所有 AE(> 98%)的严重程度均为轻度至中度耐受性 2 • 极低(2.5%)TeaE 导致研究退出(高剂量组中没有) 概况 • 没有与药物相关的严重不良事件 • 只有 50 µg 剂量组并被视为严重不良事件不相关的研究药物 • AE 特征与历史研究和药物类别一致 • 没有 自杀或自残行为否自杀行为 • 在研究期间,每只手臂 ≤ 1 名参与者报告了自杀意念 3 或自杀信号 • 没有迹象表明自杀率增加或与自杀相关的风险 1.来源: Study MMED008 内部研究文件和计算结果。安全人群。2.高剂量组包括 100 和 200 微克剂量组。2023 年 12 月 20 3.根据报告的不良事件进行自杀评估。来自 MMED008 研究的主要数据 AE -不良事件;TEAE-治疗紧急不良事件;

1,2 给药日最常见的 TEAE(高剂量组中超过 10%) MM-120 在所有剂量组中耐受性良好,主要是短暂的、轻度至中度的不良事件 MM-120 安慰剂首选术语 25 µg 50 µg 100 µg 200 µg 受试者(%)AE(n=39)(n=40)(n=40)Illusion 12(30.8)18 (45.0) 23 (57.5) 30 (75.0) 3 (7.7) 幻觉,视觉 6 (15.4) 9 (22.5) 9 (22.5) 6 (15.0) 1 (2.6) 欣快心情 2 (5.1) 5 (12.5) 11 (27.5) 6 (15.0) 1 (2.6) 焦虑 1 (2.6) 3 (7.5) 4 (10.0) 5 (12.5) 0 (0) 思维异常 0 (0) 2 (5.0) 4 (10.0) 5 (12.5) 0 (0)头痛 4 (10.3) 9 (22.5) 10 (25.0) 10 (25.0) 8 (20.5) 麻醉 2 (5.1) 2 (5.0) 3 (7.5) 9 (22.5) 2 (5.1) 头晕 3 (7.7) 2 (5.0) 2 (5.0) 0 (7.5) 2 (20.0) 0 (0) 恶心 3 (7.7) 11 (27.5) 16 (40.0) 24 (60.0) 1 (2.6) 呕吐 0 (0) 2 (5.0) 2 (5.0) 5 (12.5) 0 (0) 3 感觉异常 1 (2.6) 2 (5.0) 1 (2.5) 1 (2.5) 1 (2.6) 7 (17.5) 8 (20.0) 4 (10.0)) 1 (2.6) 多汗症 1 (2.6) 4 (10.0) 9 (22.5) 5 (12.5) 0 (0) 1。来源:MMED008 研究内部研究文件和计算结果。安全人群。2.高剂量组包括 100 和 200 微克剂量组。2023 年 12 月 21 3.研究期间,200 µg 剂量组的发病率大于 10%,但给药当天所有剂量组的发病率低于 10%。来自研究的主要数据 MMED008 µg-微克;AE-不良事件;TEAE — 治疗紧急不良事件

1,2 最常见的 TeaE(高剂量组中大于 10%)MM-120 在所有剂量组中耐受性良好,主要是短暂的、轻度至中度的不良事件 MM-120 安慰剂首选术语 25 µg 50 µg 100 µg 200 µg 受试者(%)AE(n=39)(n=40)(n=40)(n=39)Illusion 12 (30.8) 18 (45.0) 24 (60.0) 30 (75.0) 3 (7.7) 幻觉,视觉 6 (15.4) 9 (22.5) 9 (22.5) 6 (15.0) 1 (2.6) 欣快心情 2 (5.1) 5 (12.5) 11 (27.0) 6 (15.0) 1 (2.6) 焦虑 4 (10.3) 5 (12.5) 4 (10.0) 6 (15.0) 2 (5.1) 思维异常 0 (0) 2 (5.0) 4 (10.0) 5 (12.5) 0 (0) 头痛 5 (12.8) 9 (22.5) 14 (35.0) 11 (27.5) 8 (20.5) 麻醉 2 (5.1) 2 (5.0) 3 (7.5) 9 (22.5) 3 (7.7) 头晕 3 (7.7) 2 (5.0) 3 (7.5) 0 (0) 5 (12.5) 1 (2.6) 震颤 0 (0) 3 (7.5) 8 (20.0) 0 (0) 0 (0) 恶心 3 (7.7) 11 (27.5) 16 (40.0) 24 (60.0) 3 (7.7) 呕吐 0 (0) 2 (5.0) 2 (5.0) 5 (12.5) 0 (0) 感觉异常 1 (2.6) 2 (5.0) 1 (2.5) 5 (12.5) 2 (5.1) 散瞳孔 1 (2.6) 7 (17.5) 8 (20.0) 4 (10.0) 1 (2.6) 多汗症 1 (2.6) 4 (10.0) 9 (22.5) 5 (12.5) 0 (0) 1。 来源:Study MMED008 内部研究文件和计算结果。安全人群。2023 年 12 月 2.高剂量组包括 100 和 200 微克剂量组。22 项主要数据来自研究 MMED008 µg-微克;AE-不良事件;TEAE — 治疗紧急不良事件

MM-120 MM-120 发展计划 LSD 酒石酸用于治疗广泛性焦虑 障碍 (GAD) 2023 年 12 月 23 来自研究 MMED008 的关键数据

多项研究支持 MM-120 1 的第 3 阶段开发 • 已实现 2 期开发目标 o 特征剂量反应为 GAD 中的剂量选择提供依据 o 在 GAD 中取得了巨大的、具有统计学意义且具有临床意义的效果 o 在经过验证的 终点上显示出快速而持久的治疗效果 o 在没有心理治疗干预的情况下表现出独立的药物效果 • 多项研究支持 GAD 中 MM-120 o 2b 期随机、安慰剂对照剂量优化试验的活性 (研究 MMED008) o 先前一项 现代,随机化,安慰剂对照的焦虑症中莱瑟吉德的IIT o 20多项针对焦虑症和其他神经质疾病的莱瑟吉德的传统研究 • 公司认为,2b期数据支持剂量选择和进入 3期开发 1.来源:MMED008 研究内部研究文件和计算结果。2023 年 12 月 24 日 GAD ——广泛性焦虑症;印度理工学院——来自 MMED008 研究的研究者启动的试验标题数据

MM-120 发展路径 • 汉密尔顿焦虑量表 (HAM-A) 第 2 期 b 期和 3 期研究的关键设计要素在第 4 周预计主要终点 o 关键纳入/排除标准的变化有限 o 剂量监测方案没有计划更改 • 两项计划进行 12 周随机、安慰剂对照的主要疗效研究设计 o 开放标签延期以确定再治疗参数 o 预计将启动 3 期的开发在 2024 年下半年 2023 年 12 月 1.第 3 阶段及随后的临床研究设计尚待监管部门讨论和审查,包括可能的 2 期末会议。来自 MMED008 研究的 25 条主要数据

MM-120 计划的后续步骤和预期里程碑 2023 年第 4 季度 2024 年第 4 季度 2024 年第 2 季度 MM-120 GAD MM-120 GAD MM-120 GAD 2b 期在科学会议上发布的完整数据 4-wk Topline 12-wk Topline MM-120 GAD Zydis ODT PK 桥接数据 MM-120 GAD EOP2 会议 MM-120 GAD 第 3 期启动 2023 年 12 月 26 来自研究的头条数据 MM-120 MM-120 MMED008

问答 2023 年 12 月 27 来自研究 MMED008 的头条数据

附录 — 2023 年 12 月 2b 期 GAD 研究 28 来自 研究 MMED008 的标题数据

1 2b 期试验设计符合随后的 FDA 指南草案 FDA 发布的 2023 年迷幻药物临床试验指南草案 • 明确监管预期和研发注意事项 • 指南将 “帮助研究人员设计能够产生可解释结果的研究 1,能够支持未来的药物应用” 2b 期设计符合美国食品药品管理局的指导方针 • 不进行并行心理治疗—— “心理治疗干预措施有 1 种可能提高预期和 表现偏见” 1 • 安慰剂对照 —”可以更好地了解安全性发现的情境” • 剂量范围 — “大多数迷幻药物的剂量反应关系知之甚少。 赞助商应采取适当措施来表征 1 剂量反应关系。”2023 年 12 月 1.FDA 2023 年指南草案:迷幻药物:临床研究注意事项。来自 MMED008 研究的 29 条主要数据
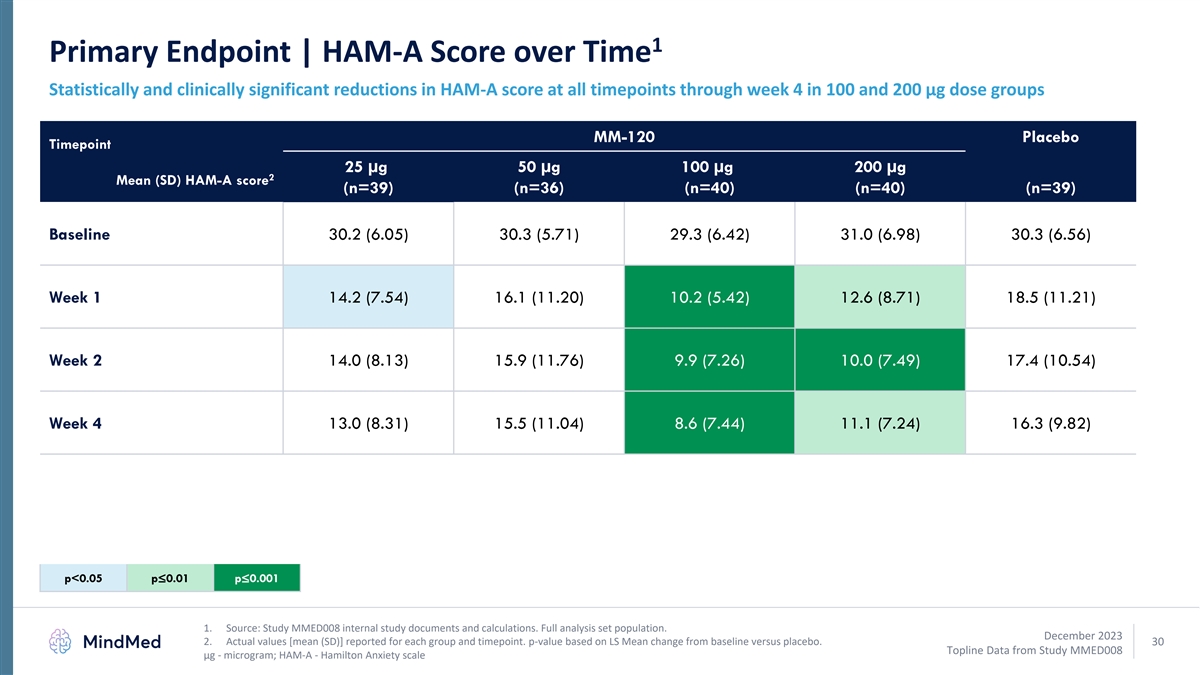
1 主要终点 | HAM-A 一段时间内的统计和临床分数 在 100 和 200 微克剂量组中,截至第 4 周所有时间点的 HAM-A 分数均显著降低 MM-120 安慰剂时间点 25 µg 50 µg 100 µg 200 µg 2 平均值 (SD) HAM-A 分数 (n=39) (n=40) 基线 30.2 (6.05) 30.3 (5.71) 29.3 (6.42) 31.0 (6.98) 30.3 (6.56) 第 1 周 14.2 (7.54) 16.1 (11.20) 10.2 (5.42) 12.6 (8.71) 18.5 (11.21) 第 2 周 14.0 (8.13) 15.9 (7.26) 10.0 (7.49) 17.4 (10.54) 第 4 周 13.0 (8.31)) 15.5 (11.04) 8.6 (7.44) 11.1 (7.24) 16.3 (9.82) p

探索性终点 | 一段时间内的 HAM-A 反应率在 100 µg 剂量组中达到 75% 或以上 第 1-4 周 2 HAM-A 随时间推移的反应率 90 78 78 78 78 70 70 54 53 51 50 47 50 38 40 33 31 20 10 0 0 第 1 周第 2 周 4 安慰剂 25 μg 50 μg 200 μg p 值未显示 1。来源:MMED008 研究内部研究文件和计算结果。完整分析集合人群。2023 年 12 月 2.反应被定义为 HAM-A 分数提高 50% 或以上。31 项主要数据来自研究 MMED008 µg-微克;HAM-A-汉密尔顿焦虑量表% 回应者

1 次要终点 | 临床全球印象 — 第 4 周的严重程度 从统计学上看,在第 4 周 100 和 200 微克剂量组中,临床全球严重程度印象 (CGI-S) 量表在所有时间点均有显著降低 2 CGI-S 分数随时间推移而变化 6 — 重症 5 — 明显疾病 4 — 中度疾病 * * **** ** ** ** 2 — 临界病情 1 — 正常,未生病全部基线第 2 天第 1 周第 2 周第 4 周 *p

1 主要终点 | 统计学上第 4 周的 HAM-A 分数变化 以及 100 µg 剂量组 2 HAM-A 分数随时间推移而来的临床显著降低 50 45 40 35 30 25 20 15 10 5 0 基线第 1 周第 2 周 4 周 p 值未显示 1。来源:MMED008 研究内部研究文件和计算结果。完整分析集合人群。2023 年 12 月 2.实际值 [平均值 (SD)]每个时间点都报告。33 条来自研究 MMED008 的头条数据 µg-微克;HAM-A-汉密尔顿焦虑评分量表 HAM-A 分数

1 次要终点| 一段时间内的合并抑郁评分 (MADRS) 2,3 在 100 和 200 微克剂量组中,截至第 4 周所有时间点的 MADRS 分数在统计学和临床上均有显著降低 MM-120 安慰剂时间点 25 µg 100 µg 200 µg 2 平均值 (SD) MADRS 分数 (n=39) (n=40) (n=40) (n=40) (n=40) (n=40) (n=40) (n=40) (n=40) (n=40) (n=40) (n=40) (n=40) (n=40) (n=40) (n=40) (n=40) (n=40) (n=40) 39) 基准 25.4 (7.58) 27.7 (8.30) 26.5 (7.99) 28.9 (8.31) 27.6 (9.69) 第 1 周 13.2 (9.62) 16.5 (13.50) 8.6 (6.74) 10.6 (8.96) 16.6 (8.96) 16.6 (8.35) 16.6 (12.35) 00) 第 4 周 13.4 (11.37) 15.4 (13.60) 8.4 (9.52) 10.4(8.23) 14.8 (10.74) p

1 次要终点 | 一段时间内的合并抑郁评分 (MADRS) 100 µg 剂量组 2,3 GAD 的合并抑郁症状在第 4 周有所改善,75% 的缓解率超过 75%,反应者超过 75% 2 随着时间的推移分数 50 45 40 35 30 25 20 15 10 0 基线第 1 周第 2 周 p 值未显示 1。 来源:Study MMED008 内部研究文件和计算结果。完整分析集合人群。2. 100 µg 剂量组。2023 年 12 月 35 3.反应被定义为MADRS分数提高50%或以上;缓解被定义为MADRS分数 ≤ 10。来自 MMED008 研究的头条数据 µg——微克;MADRS——蒙哥马利-奥斯伯格抑郁症评级量表 MADRS 分数

1 任何剂量组中发生率≥ 10% 的最常见的 TEAE MM-120 安慰剂首选术期受试者 (%) AE 25 µg (n=39) 50 µg (n=40) 100 µg (n=40) 200 µg (n=40) (n=39) 错觉 12 (30.8) 18 (45.0) 24 (60.0) 30 (75.0) 3 (7.7) 幻觉,视觉 6 (15.4) 9 (22.5) 9 (22.5) 6 (15.0) 1 (2.6) 欣快心情 2 (5.1) 5 (12.5) 11 (27.5) 6 (15.0) 1 (2.6) 焦虑 4 (10.3) 5 (12.5) 4 (10.0) 6 (15.0) 2 (5.1) 情绪低落 0 (0) 3 (7.5) 4 (10.0) 0) 0 (0) 思维异常 0 (0) 2 (5.0) 4 (10.0) 5 (12.5) 0 (0) 情绪困扰 2 (5.1) 0 (0) 1 (2.5) 4 (10.0) 1 (2.6)) 头痛 5 (12.8) 9 (22.5) 14 (35.0) 11 (27.5) 8 (20.5) Pareastehisia 2 (5.1) 2 (5.0) 3 (7.5) 9 (22.5) 3 (7.5) 3 (7.5) 8 (20.0) 头晕 3 (7.5) 8 (20.0) 0 (0) 平衡 障碍 0 (0) 4 (10.0) 2 (5.0) 2 (5.0) 1 (2.6) 注意力障碍 1 (2.6) 7 (17.5) 1 (2.5) 0 (0) 0 (0) 0 (0) 恶心 3 (7.7) 11 (27.5) 16 (40.0) 24 (60.0) 3 (7.7) 呕吐 0 (0) 2 (5.0) 2 (5.0) 2 (5.0) 2 (7.7) 5.0) 5 (12.5) 0 (0) 疲劳 2 (5.1) 6 (15.0) 4 (10.0) 4 (10.0) 1 (2.6) 感觉异常 1 (2.6) 2 (5.0) 1 (2.5) 5 (12.5) 2 (5.1) 感觉很热 0 (0) 4 (10.0) 0 (0) 1(2.5) 1 (2.6) 散瞳症 1 (2.6) 7 (17.5) 8 (20.0) 4 (10.0) 1 (2.6) 血压升高 3 (7.7) 5 (12.5) 4 (10.0) 3 (7.5) 0 (0) 多汗症 1 (2.6) 4 (10.0) 9 (22.5) 5 (12.5) 0 (0) 食欲下降 1 (2.6) 1 (2.5) 1 (2.5) 4 (10.0) 0 (0) 1。来源:MindMed 内部研究文件和计算结果。安全人群。2023 年 12 月 36 TEAE-治疗紧急不良反应 事件标题数据来自 MMED008 研究

附录 — 知识产权 2023 年 12 月 37 项摘要数据 来自研究 MMED008

1 MM-120 | 多层知识产权和 进入壁垒 2 监管壁垒新化学实体排他性 30 个月停留 +1y +2y +4y +5y +7y +9y... 2043+ MM-120 发布专利保护 API:多晶型、盐型使用方法/治疗方法:失调药物的治疗: 制造/工艺交付方法:交付方法,PK/PD • 供应链可用性• 商业秘密和专有技术其他 • 关键技术的专有权利• 差异化产品性能进入壁垒 • 生命周期管理改善 • 差异化组合性能(药物和/或器械产品)1.取决于美国食品药品管理局的批准和美国专利商标局对索赔的批准。2.《联邦食品、药品和化妆品法》第 505 条,《美国法典》第 21 篇第 355 节。2023 年 12 月 38 PK——药代动力学;PD——来自 MMED008 研究的药效学头条数据

MM-120 | 多管齐下的市场保护策略 1 • 专利保护战略要点 o 治疗 GAD 的方法 o 稳定性和原料药(盐型和多晶型)的制造方法 o 通过更快的吸收、更少的变异性和可能更短的持续时间来提高产品性能 o 与 ODT 配方、GAD 治疗和其他患者预后相关的 使用方法 o 与剂量识别、患者监测、数字技术和其他相关的其他索赔 • 亮点美国食品药品管理局批准的 NCE 的非专利保护策略 对仿制药申请人的排他性或居留30个月(附第四段声明)o 供应链可用性有限 2 o 关键技术(例如 Catalent Zydis® ODT)的专有权 o 商业秘密和专有技术 1.资料来源:美国专利和贸易 办公室 (https://ppubs.uspto.gov/)。2.Catalent已授予Zydis® for lysergide(LSD)的知识产权专有权。2023 年 12 月 39 日 FDA — 美国食品药品监督管理局;API — 活性药物成分;ODT — 口服分解片;NCE — 来自 MMED008 研究的新化学实体标题数据

MM-120 | 知识产权组合亮点 1 1 1 2 专利/ 申请标题/概述状态预计到期临时待定 [基于ODT桥接研究的药代动力学发现的说法]2043 申请暂定待定 [基于ODT桥接研究的药效学发现的说法]2043 申请暂定待定 [基于2b期GAD研究的临床发现的索赔]2043 申请美国和 PCT 20230285384 使用基因或表型来调整 LSD 剂量 2043 出版物美国和 PCT 20230330085 LSD 剂量识别 2043 出版物美国和 PCT 20220348575 LSD 盐晶体 2042 出版物美国和 PCT 20230064429 立即发布用于治疗应用的 d-麦角酰二乙酰胺配方 2042 美国出版物 & PCT 20230107398 立即 发布用于治疗应用的 D-麦角酸二乙酰胺配方 2042 出版物冻干口服分解片剂 d-麦角酸的冻干口服分解片剂配方适用于美国的二乙酰胺和 PCT 20230122949 2042 3 种治疗应用 出版物美国和 PCT 20230000431 监测改变意识的治疗疗程的系统和方法 2042 出版物麦角酸二乙酰胺 (LSD) 和迷幻药类似物对美国心理治疗的影响以及 PCT 20220273628 2042 广泛性焦虑症或其他与之无关的焦虑危及生命的疾病出版物 1.资料来源:美国专利和贸易局 (https://ppubs.uspto.gov/)。2.以非临时申请日期后的20年为基准。对于基于MindMed管理层预计申请日期的临时 申请。2023 年 12 月 3.Catalent 已授予 Zydis® for lysergide (LSD) 的专有知识产权。40 项标题数据来自 MMED008 PCT — 专利 合作条约

MM-120 | 最近加入知识产权组合 • 与 Catalent 签订独家许可协议,该专利技术可与 MM-120 一起使用 Zydis® 1 快速溶解技术 o 在美国、 英国和欧盟以及其他关键地区使用 Zydis® 技术开发所有盐和多形态的莱瑟吉德的专有权 ODT 配方几乎可以立即在口中溶解,有可能绕过首次代谢它的技术平台表现出优于其他 ODT 的优势,它在 发布更多产品中的使用就说明了这一点超过 60 个国家的 36 种产品 2,3 • 至少在 2042 年之前可能获得专利保护 1.Catalent 已授予 Zydis® for lysergide (LSD) 的知识产权专有权。2.资料来源:美国专利和贸易 办公室 (https://ppubs.uspto.gov/)。2023 年 12 月 41 3.基于非临时申请日期后的20年。对于基于MindMed管理层预计申请日期的临时申请。来自 MMED008 ODT 研究的标题数据——口服 分解片。

MM-120 | 强大的创新知识产权现任护城河 职位 505 (b) (1) 505 (b) (2) 505 (j) ANDA /仿制原始 “独立” 保密协议 “后续保密协议” 1 描述• 包含完整的安全性调查报告 • 包含完整的安全性调查报告和 • 通常与先前批准的药物或有效性相重复,其中至少有一些药物和依赖于申请人的安全调查结果或 批准所需的申请人信息的来源和有效性所列参考药物拥有参考权或使用非申请人或非申请人为申请人进行的研究,且申请人未获得参考权或使用权(RLD)需要从头到尾进行完整 临床计划,• 取决于与参考药物的相似性• 产品等效性包括:• 可能绕过临床前和第一阶段研究• 生物等效性 • 两项充分控制的 研究• 试验要求对象由 FDA 自行决定 • 完整的临床药理学报告 • 完整的毒理学报告 • 完整的安全药理学报告 • 完整的非临床药理学报告 • 完整的化学、 制造和控制报告 2 3 3 开发时间约 10 年以上 6-8 年 1-2 年 3 开发成本 3 亿美元至 15 亿美元 + 100-1 亿美元 100 万美元至 500 万美元以及 3 名申请人的诉讼成本/风险 1000万至2千万美元 + 陪审团审判 + 三重损害赔偿 10000 万美元至 2000 万美元 + 庭审费 + 损害赔偿如果风险启动市场准入壁垒 IP、CD/DE、SP/L、EDC、MFG、LCM OB、IP、RME、CD/DE、SP/L、EDC、MFG、LCM、RLD OB、IP、RME、CD/DE、SP/L、EDC、MFG、LCM、RLD 1。资料来源:美国食品药品管理局药物评估中心和 研究 (https://www.fda.gov/regulatory-information)。2.BIO、PharmainTelligence和QLS Advisors的 “2011-2020年临床开发成功率和影响因素”。精神适应症的估计。和 3. 公司根据过去的先例对2位参赛者的开发成本、诉讼成本和时间的估计。据估计,将2023年12月的新药推向市场所需的研发投资42,2009-201 JAMA。 2020;323 (9): 844-853。doi: 10.1001/jama.2020.1166 来自 MMED008 研究的头条数据 OB = 橙皮书,IP = 知识产权,RME = 监管市场的排他性,CD/DE = 临床开发和数据排他性,SP/L = 战略伙伴关系和 许可,EDC = 大量开发成本(505 (b) (1)),MFF G = 供应链和卓越制造,LCM = 生命周期管理,RLD = 要求证明与参考清单药物具有等效性。

MM-120 | 新化学实体 (NCE) 的益处 First Filment Filer 1 预计可为 MM-120 提供 保护,NCE 初始申报人法律/监管排他性 • Lysergide 此前未获批准,可获得 NCE 资格;与完整保密协议一揽子计划相比的关键区别因素。所有由申请人或代表申请人进行的临床 研究,依赖先前批准的参考上市药物的申请包括:• 根据哈奇·瓦克斯曼法案的五年上市独家经营权 • 两项充分控制的研究 • 在随后的505(b)(2)或505(j)申报人中停留30个月 • 完整的临床药理学报告 • 如果后续申报人有风险上市,则可能获得三倍的赔偿,无论路径如何 • 完整的毒理学报告 • 完整 安全药理学报告知识产权 • 完整的非临床药理学报告 4 •超过10份美国和PCT专利申请,涵盖批准/标签的关键索赔 • 完整的化学、制造和控制报告 • 所有知识产权索赔(包括OB中列出的和未列出的知识产权索赔)• 广泛性焦虑症的治疗方法 2 典型的开发包可能从3亿美元到15亿美元以上 • 原料药(盐型和多晶型)的 制造方法和产品索赔3,从一开始需要10年以上精神适应症的平均值 • DP(MM-120 ODT)的制造方法和产品声明 •涵盖产品性能的关键 方面(例如更快的吸收、更少的变异性和可能更短的持续时间)• 与 ODT 配方、GAD 治疗和其他患者预后相关的使用方法 • 与剂量 识别、患者监测、数字技术和其他额外的结构保护和福利有关的其他索赔 • 供应链可用性有限 5 • 关键技术(例如 Catalent Zydis® ODT)的专有权 • 差异化交付、文件和报销支持 • 敏感性和特定性受控物质分类的要求•商业秘密和专有技术 1.取决于美国食品药品管理局的批准和 美国专利商标局对索赔的批准。2.管理层根据过去的先例对开发成本的估计。估计将新药推向市场所需的研发投资,2009-201 JAMA。2020;323 (9): 844-853。doi: 10.1001/jama.2020.1166。2023 年 12 月 3.BIO、PharmainTelligence 和 QLS Advisors 撰写的《2011-2020 年临床开发成功率和影响因素》。43 4.包括三份临时申请摘要数据来自 MMED008 5 号研究。Catalent已授予Zydis® for lysergide(LSD)的专有知识产权 。NCE:新化学实体;OB:橙皮书;ODT:口服分解片