

LYFGENIA™ 美国食品药品管理局于 2023 年 12 月 8 日批准纳斯达克:蓝色附录 99.1

这些幻灯片和随附的口头 演示文稿包含某些前瞻性陈述,这些陈述符合经修订的1933年《证券法》第27A条和经修订的1934年《证券交易法》第21E条的含义,涉及风险和 不确定性,包括但不限于有关公司运营计划和预期的陈述,包括与LYFGENIA的商业启动和潜在潜在市场有关的陈述 LYFEGNIA; 完成出售该公司的优先审查代金券;我们对2023年创新支付示范的期望;以及公司QTC网络的预期增长及其时机。使用 “期望”、 “预期”、“相信”、“可能”、“将” 等词语和类似术语的陈述也是前瞻性陈述。此类报表存在许多风险和不确定性,包括但不限于公司 商业化和产品制造过程中的延误和挑战;正在进行和计划中的活动所需的内部和外部成本以及由此产生的对现金支出和使用的影响已经高于预期,也可能在将来可能高于预期,这导致 导致公司使用现金的速度超出预期或修改或削减其部分计划或两者兼而有之;对此存在重大疑问公司继续作为持续经营企业的能力; 公司对支出、现金使用量和现金需求的预期可能因其他原因而被证明不正确,例如计划变化或实际事件与其假设不同; 公司先前和正在进行的临床试验的疗效和安全性结果可能无法持续或出现在更多使用候选产品治疗的患者身上;插入致癌或其他再造的风险与慢病毒载体、药物 产物或骨髓消融相关的便携事件;公司任何一种或多种产品或候选产品(包括Skysona、Zynteglo或Lyfgenia)无法成功商业化的风险,以及 公司向美国证券交易委员会提交的10-K表年度报告和10-Q表季度报告以及其他报告中可能不时详述的其他风险。除非法律要求,否则公司没有义务对本演示文稿中包含的 前瞻性陈述进行任何修改,也没有义务对其进行更新以反映本陈述之日之后发生的事件或情况,无论是由于新信息、未来发展还是其他原因造成的。前瞻性 陈述

欢迎辞和开幕词 Andrew Obenshain,首席执行官临床数据和标签亮点 Rich Colvin,医学博士,首席医学官 Rich Colvin 商业发布计划 Tom Klima 闭幕词首席执行官 Andrew Obenshain 问答

LYFGENIA:现已获得食品药品管理局批准

LYFGENIA 临床数据与标签 亮点 Rich Colvin,医学博士,首席医学官

的患有SCD的成年人有末端器官 损伤,尽管SCD患者的平均死亡年龄仅为45岁,但仍有24%的多器官受损1 1/4的直接医疗费用4 1。Chaturvedi S 等人Am J Hemool。2018 3;2.Kato GJ、Piel FB、Reid CD 等镰状细胞病。Nat Rev Dis Primers。2018;4:18010。3.Gallagher ME 等人,J Med Econ。2022 年 1 月至 12 月 4 日。Holdford 等人 2021 年 SCD 患者在 452 岁之前会出现中风。患者平均为 400 万至 600 万美元 ~ 65% 50% 到 60%
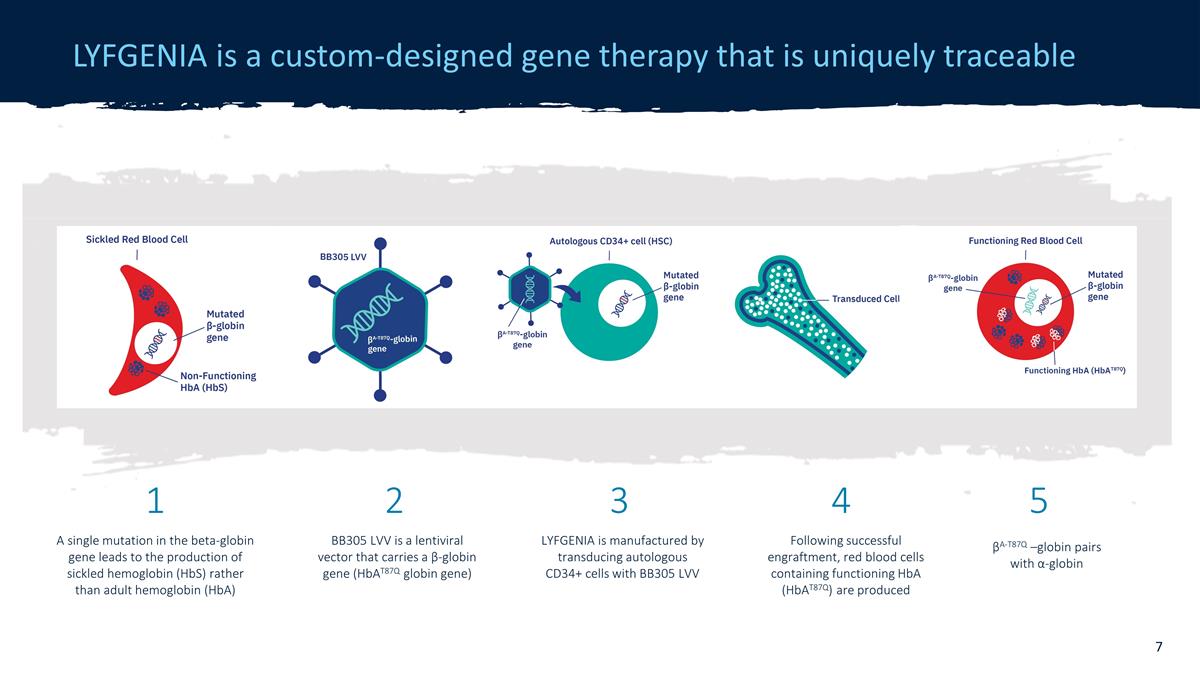
LYFGENIA 是一种定制设计的基因 疗法,具有独特的可追溯性 β-珠蛋白基因的单一突变会导致产生病态血红蛋白 (HbA),而不是成人血红蛋白 (HbA) LYFGENIA 是通过将自体 CD34+ 细胞与 α-珠蛋白配对转导来制造的事实上,会产生含有功能性 HbA (hbat87q) 的红细胞 BB305 LVV 是一种携带 β-珠蛋白基因(Hbat87q 珠蛋白基因)1 2 3 4 5 的慢病毒载体 BB305
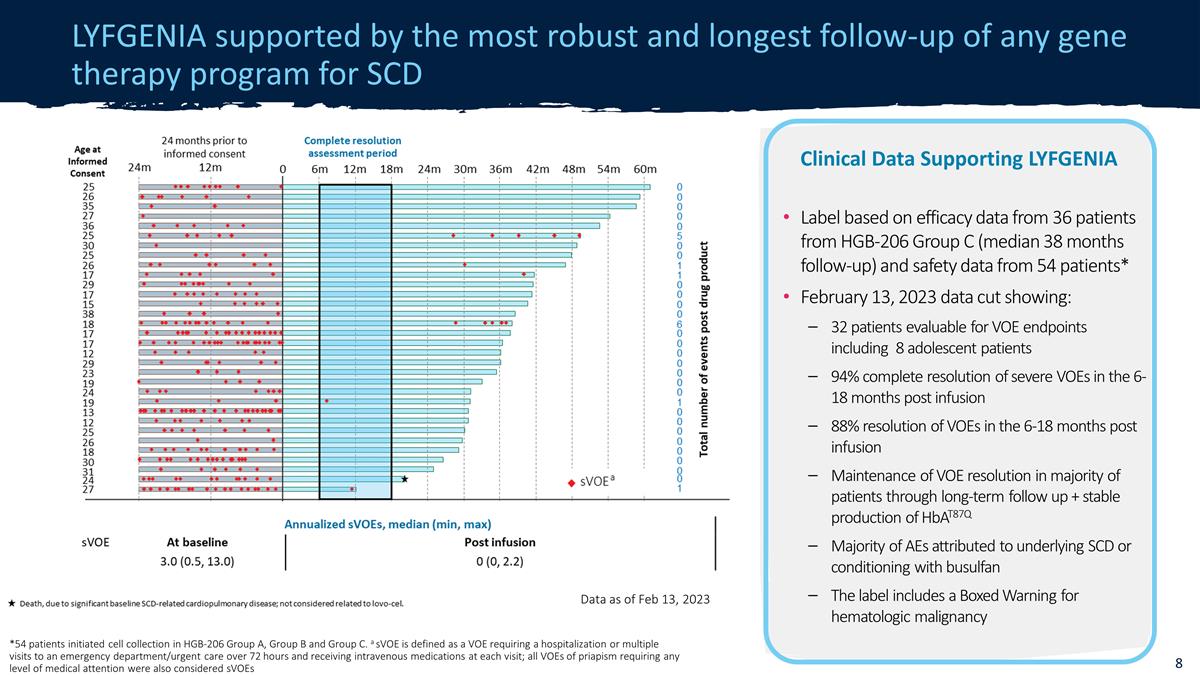
截至 2023 年 2 月 13 日,LYFGENIA 得到了所有 SCD 数据基因治疗项目中最强大 和随访时间最长的 *54 名患者在 HGB-206 组 A、B 组和 C 组中开始了细胞采集。sVoE 被定义为需要住院或多次就诊 急诊室/急诊室超过 72 小时且每次就诊时接受静脉注射药物的 VOE;所有阴茎异常勃起的 VOE 都需要任何药物根据来自 HGB-206 的 36 名患者的疗效 数据,SVoE 的临床数据支持 LYFGENIA 标签也被视为就医水平C 组(平均随访 38 个月)和来自 54 名患者的安全性数据* 2023 年 2 月 13 日数据剪辑显示:32 名患者 VOE 终点可评估,包括 8 名青少年患者,在输液后 6-18 个月内,重度 VOE 完全消退 88% 通过长期随访维持大多数患者 VOE 分辨率 + 稳定产生 Hbat87q 大多数不良反应归因于潜在的 SCD 或使用白消安进行调理标签上有血液学恶性肿瘤的盒装警告

商业启动计划 Tom Klima, 首席商务和运营官
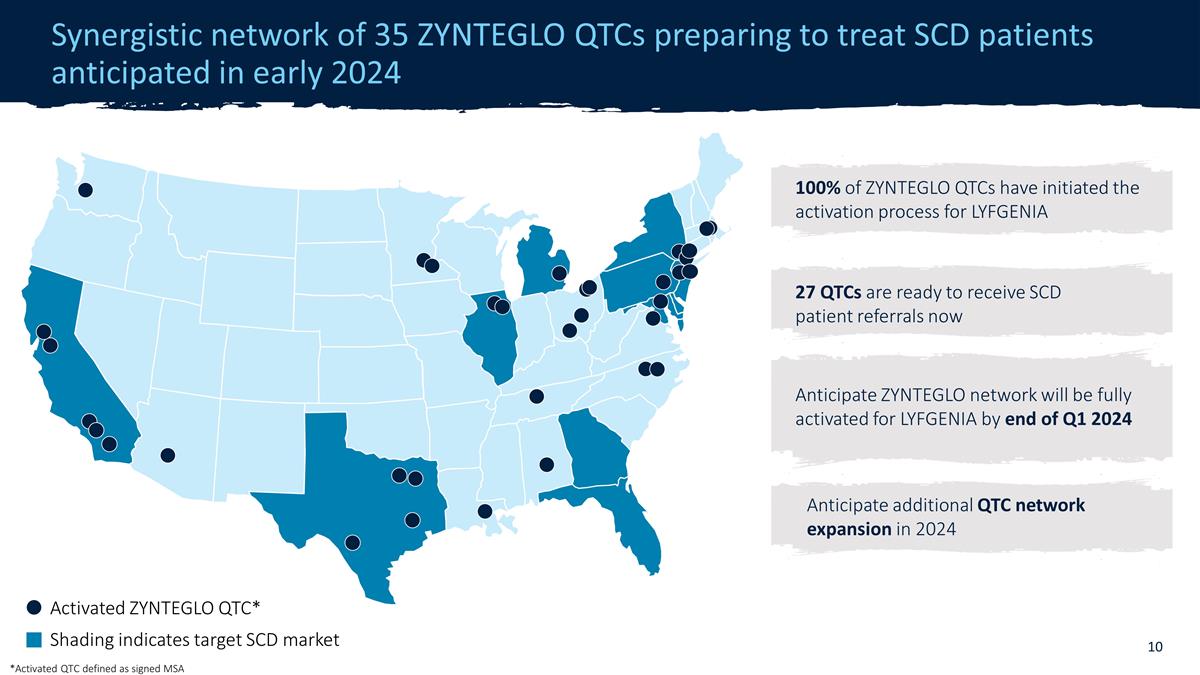
由 35 个 ZYNTEGLO QTC 组成的协同网络预计于 2024 年初开始治疗 SCD 患者 27 个 QTC 已准备好接受 SCD 患者转诊现已激活 ZYNTEGLO QTC* Shading 表示目标 SCD 市场预计 QTC 在 2024 年将进一步扩大 ZYNTEGLO QTC 的激活程序到 2024 年第一季度末,LYFGENIA 的 GLO 网络将完全激活 *已激活 QTC 定义为签名的 MSA
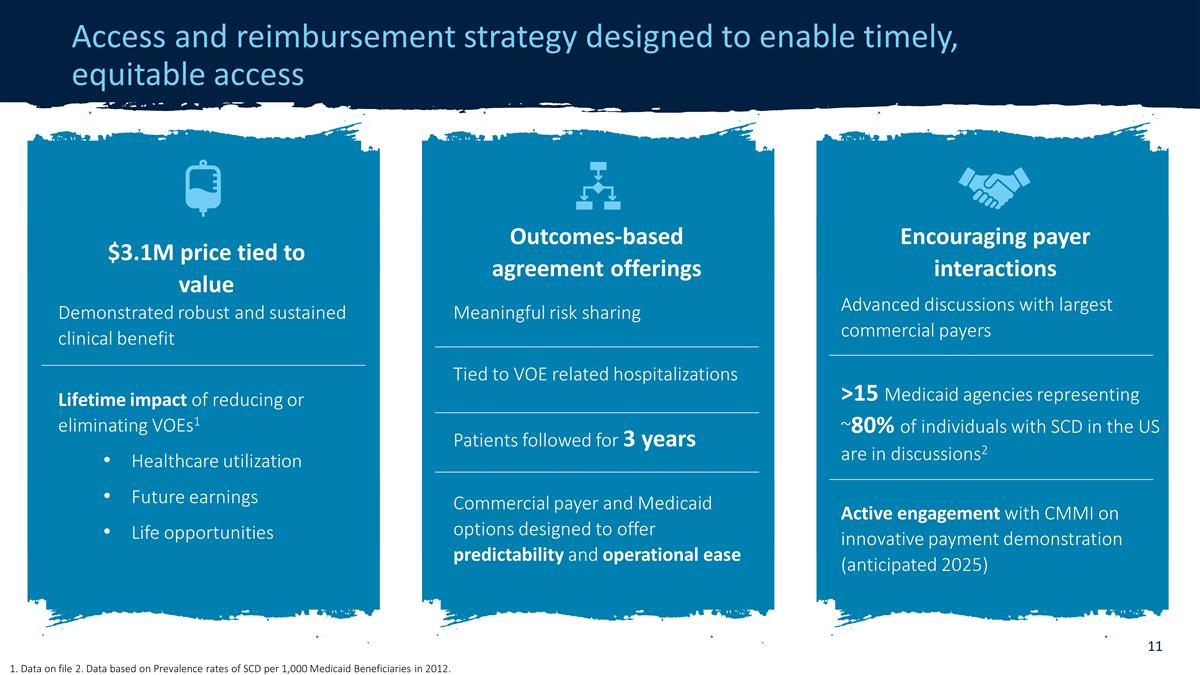
准入和报销策略 旨在实现及时、公平的准入和补偿策略 与占美国SCD患者约80%的15家以上的最大商业支付机构进行高级讨论2 积极参与CMMI的创新支付 演示(预计在2025年)鼓励付款人互动显示出稳健而持续的临床收益减少或取消VoeS1医疗保健利用率的终身影响未来收益生活机会310万美元价格与价值挂钩 与VOE相关的有意义的风险共担相关住院患者关注了3年的商业付款人和医疗补助选项,旨在提供可预测性和操作便利性基于结果的协议产品 1.文件中的数据 2.数据基于 ,该数据基于2012年每1,000名医疗补助受益人中SCD的患病率。
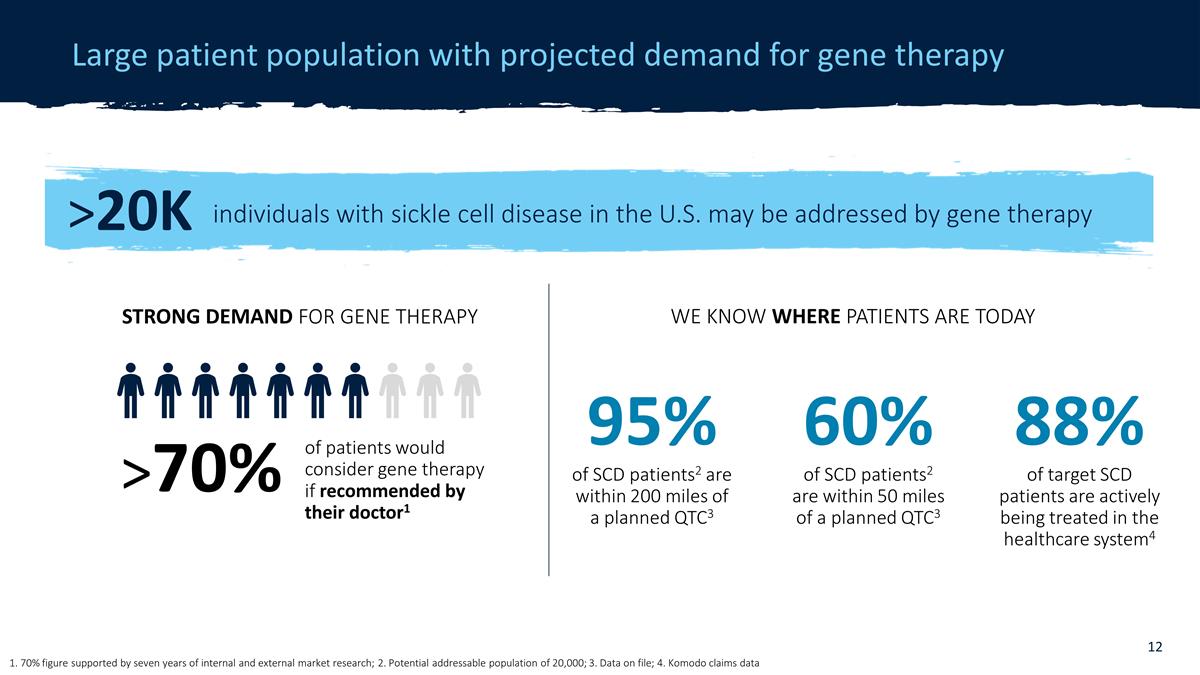
患者群体庞大, 预计对基因疗法的需求 1. 70% 的数字得到了七年的内部和外部市场研究的支持;2.潜在的可寻址人口为2万人;3.存档数据;4.科莫多声称数据 >2万名 美国镰状细胞病患者可以接受基因疗法治疗,如果医生推荐患者会考虑进行基因治疗1 > 70% 对基因疗法的强烈需求我们知道患者现在在哪里 60% 的 SCD 患者2 距离 计划的 QTC3 不到 50 英里 95% 的 SCD 患者2 距离计划的 QTC3 在 200 英里以内 88% 的目标 SCD 患者正在医疗保健系统中积极接受治疗4

2 潜在的数十亿美元 机会在美国有 20,000 名可寻址患者强有力的商业战略和预计的患者和医生需求经验丰富的商业基因治疗团队完全有条件推出 LYFGENIA™ 18 个月的商业先机 利用显著的 ZYNTEGLO 发布协同效应——预计会有同样的治疗医生、相同的治疗中心、相同的付款人 1 3 丰富的基因疗法专业知识,包括制造经验和成熟的商业 基础设施
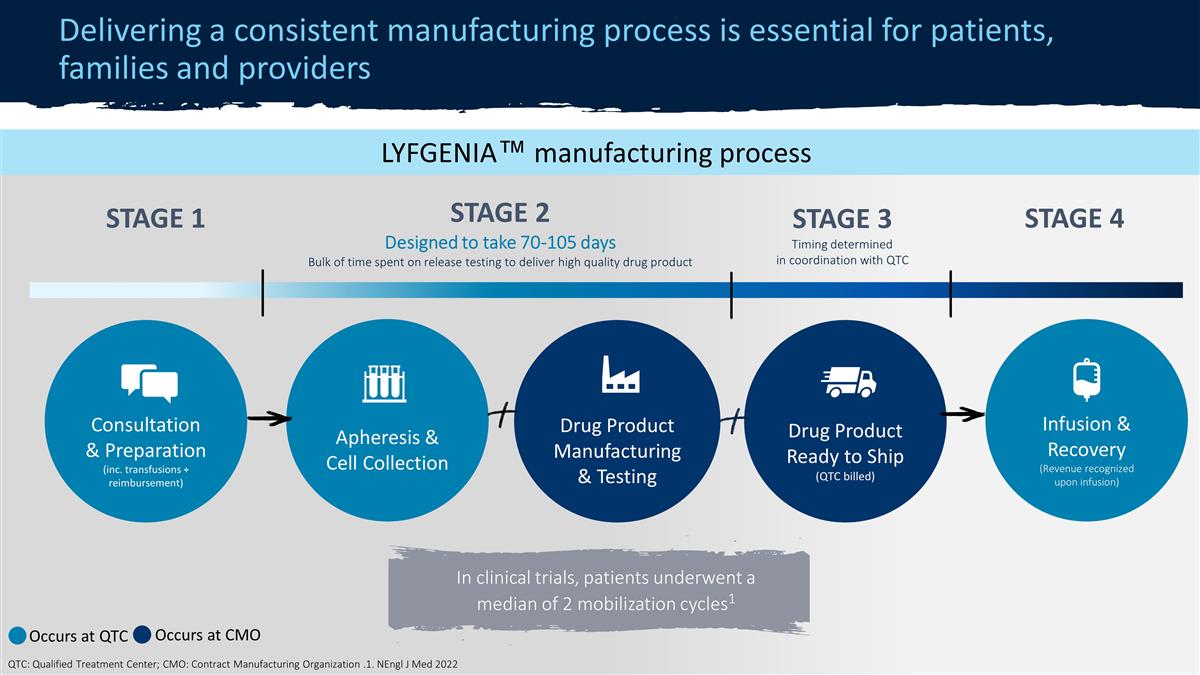
ZYNTEGLO® 制造 流程提供一致的生产流程对患者、家属和提供者至关重要 STAGE 2◇ 70-90 天用于交付高质量药品血液分离和细胞收集药物 产品制造和测试药物产品准备发货(QTC 计费)输液和恢复(输液时确认收入)咨询和准备(包括超级输血 + 报销确认)阶段 1* 第 3* 阶段 *发生在 QTC ◇ 发生在 CMO QTC:合格治疗中心;CMO:合同制造组织在临床试验中,大约有20%的病例进行了回忆。在商业环境中,所有患者都有 [已完成]回忆后的 治疗过程。LYFGENIA™ 制造过程第 2 阶段设计为耗时 70-105 天用于交付高质量药物的释放测试的大部分时间血液分离和细胞采集药物产品 生产和测试药物产品准备发货(QTC 计费)输液和恢复(输液时确认收入)咨询和准备(包括输血+报销)第 1 阶段 4 在临床试验中,患者经历的动员周期中位数为 2 1 发生在 QTC 发生在 CMO QTC:合格治疗中心;CMO:合同制造组织。1.NenGL J Med 2022 第 3 阶段时机由 QTC 协调确定

知名基因疗法领导者 有望释放股东价值建立临床领导地位 10 多年的基因疗法研究 180 多名患者治疗 8 项临床试验经验丰富的团队 100% 专注于在美国成功实现基因疗法商业化 在监管方面取得成功建立了良好的记录 3 美国食品药品管理局批准的基因疗法商业化基因疗法领导者 3 商业发布移植和细胞疗法基础设施久经考验的报销

致使这一里程碑成为可能的SCD战士、护理人员、 倡导者、医疗保健提供者、调查人员、HCP和我们的蓝鸟团队。

Rich Colvin,医学博士,首席医学 官安德鲁·奥本沙因首席执行官汤姆·克利马首席商务和运营官