| 纳斯达克:MRNS @MarinusPharma 照片来源:Kelly Crews 摄影 Ryan(中) 患有 CDKL5 缺乏症 公司简报 2023 年 11 月 |
| ©2023 马里纳斯制药公司。版权所有 I 如果本演示文稿中包含的陈述不是对有关Marinus的历史事实的描述,则它们是前瞻性陈述,反映了管理层根据1995年《私人证券诉讼改革法》的安全港条款做出的当前信念和 期望。诸如 “可能”、“将”、“期望”、“预期”、“估计”、 “打算”、“相信” 和类似表达(以及引用未来事件、条件或情况的其他词语或表达)之类的词语旨在识别前瞻性陈述。 本演示文稿中包含的前瞻性陈述示例包括有关我们预期收入和支出的陈述; ZTALMY® 的商业化计划和ganaxolone的临床开发计划及其预期时机;我们的预期和潜在融资计划;临床开发时间表和里程碑; 临床试验的预期剂量;我们开始和完成临床试验的预计时间;预期的试验设计,我们的目标患者群体和终点临床 试验;对ganaxolone使用的科学依据的解释;提供和发布数据的时间;ganaxolone的潜在安全性、有效性和治疗潜力;关于ZTALMY将为患者和医生带来的潜在益处的时机和 期望;监管沟通和提交的时间和期望;对我们与BARDA协议的期望 ;对我们当前和计划与前美国合作伙伴合作的期望,包括潜在的好处和时机其中;对候选产品潜在市场机会的预期 ;对患者群体的预期;对潜在商业联盟的预期;对我们的现金流、现金预测和现金流道的预期 ;对ZTALMY持续普及的预期;对正在进行的科学和临床 研究投资对我们候选产品的影响的预期;ZTALMY的估计患者净定价以及相关的市场准入和付款人覆盖范围;对长期的预期ZTALMY的患者反应和 留存率;优化成本和支出的计划和预期;对营业利润率的预期;商业投资计划;利用我们现有的 基础设施和知识的计划;我们的全球准入计划及其预期收益和时机;以及我们对口服和静脉注射 ganaxolone未来机会的预期。本演示文稿中的前瞻性陈述涉及重大风险和不确定性,可能导致我们的临床开发计划、未来业绩、业绩或 成就与前瞻性陈述所表达或暗示的显著差异。此类风险和不确定性包括与 患者和医生接受 ZTALMY 相关的不确定性和延迟;我们为 ZTALMY 获得充足市场准入的能力;我们在规定的时间范围内遵守美国食品药品监督管理局(“FDA”)要求进行更多上市后研究的能力;监管申报的时间安排;监管机构的潜力,包括FDA和欧洲药品管理局 (“EMA”),可能不会批准或可能延迟批准我们的候选产品;不确定性和与临床试验的设计、注册、完成和结果相关的延迟;意料之外的 成本和支出;早期临床试验可能无法反映后续临床试验的结果;临床试验结果可能不支持特定 适应症的监管批准或进一步开发;FDA或EMA的行动或建议可能会影响临床试验的设计、启动、时机、持续和/或进展,或导致需要进行额外的临床试验;我们 获得和维持监管部门批准的能力对于我们的候选产品;我们获得、维护、保护和捍卫候选产品的知识产权的能力;第三方专利对我们的合作者或我们商业化ganaxolone的能力可能产生的 负面影响;候选产品的生产和供应延迟、中断或失败; 候选产品的市场规模和增长潜力,以及我们为这些市场服务的能力;我们的现金和现金等价物只要有以下时间,就可能不足以支持我们的运营 计划预期;我们对支出、未来收入、资本要求以及额外融资可用性和需求的预期、预测和估计; 我们获得额外资金以支持我们的商业和临床开发计划的能力;我们对前美国合作伙伴在美国境外将 ZTALMY 商业化的依赖;我们的前美国合作伙伴可能违反我们的合作协议或终止协议;COVID-19 疫情对我们的业务、医疗的影响社区、监管机构 和全球经济;以及针对我们目标疾病的替代产品或治疗方法的可用性或潜在可用性,这些产品或治疗方法可能会影响我们候选产品的可用性或商业潜力 。Marinus没有义务更新或修改任何前瞻性陈述。有关可能导致 实际业绩与这些前瞻性陈述中表达的结果不同的风险和不确定性以及与我们的总体业务相关的风险的进一步描述,请参阅我们向美国证券交易所 委员会提交的文件。您可以通过访问美国证券交易委员会网站www.sec.gov上的EDGAR免费访问这些文件。 安全港声明 2 |
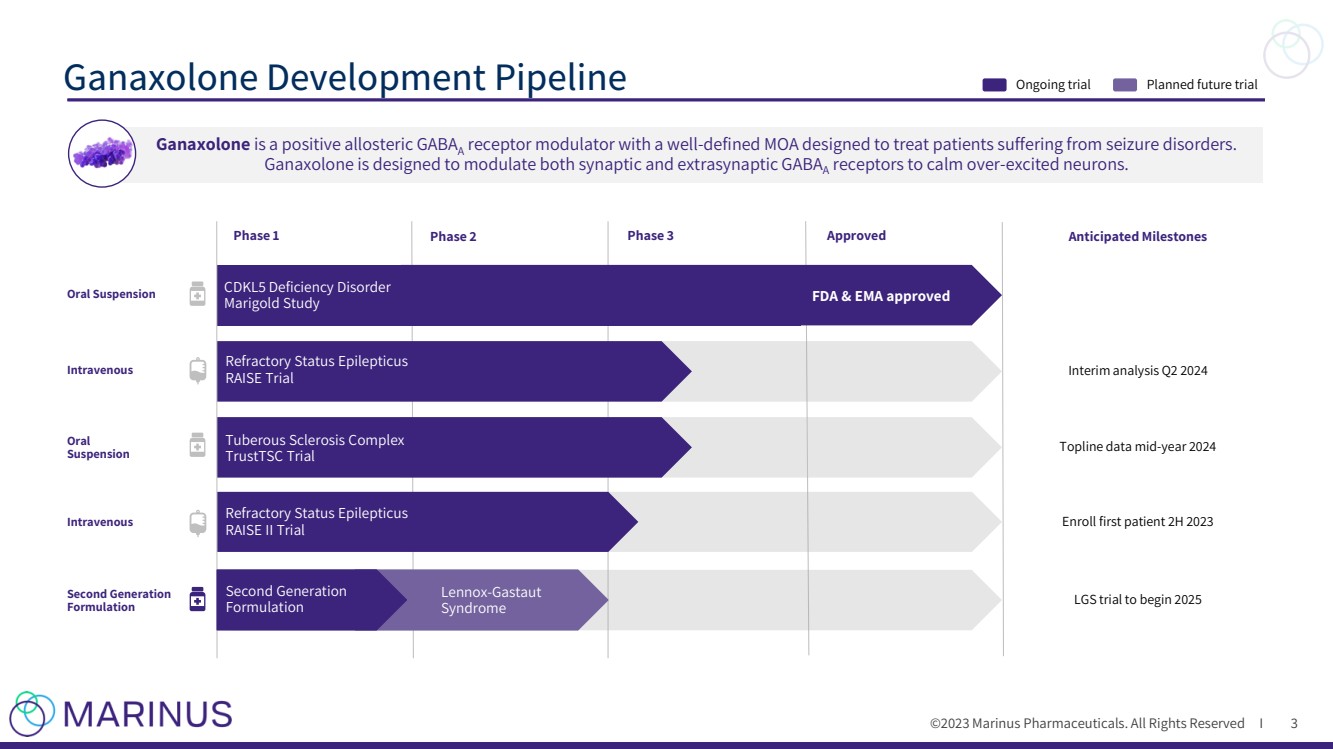
| ©2023 马里纳斯制药公司。版权所有 I Ganaxolone 开发管道 3 Ganaxolone 是一种阳性的变构体 GABAA 受体调节剂,具有明确定义的 MOA,旨在治疗癫痫发作障碍患者。 Ganaxolone 旨在调节突触和突触外的 GABAA 受体,以平息过度兴奋的神经元。 正在进行的试验计划中的未来试验 PDUFA 日期 2022 年 3 月 MAA 申请验证 2021 年第四季度口服悬液 静脉注射 第二代 配方 口服 悬浮液 万寿菊研究 FDA 和 EMA 批准 2024 年第 2 季度中期分析 2025 年开始 Topline 数据 2024 年中期难治性癫痫持续状态 RAISE 试验 结节性硬化症复合体 TrustTSC 试验 难治性癫痫持续状态 RAISE II 试验 Lennox-Gastaut 第 1 期 2 期 CDKL53 批准的预期里程碑 第二代 配方 |
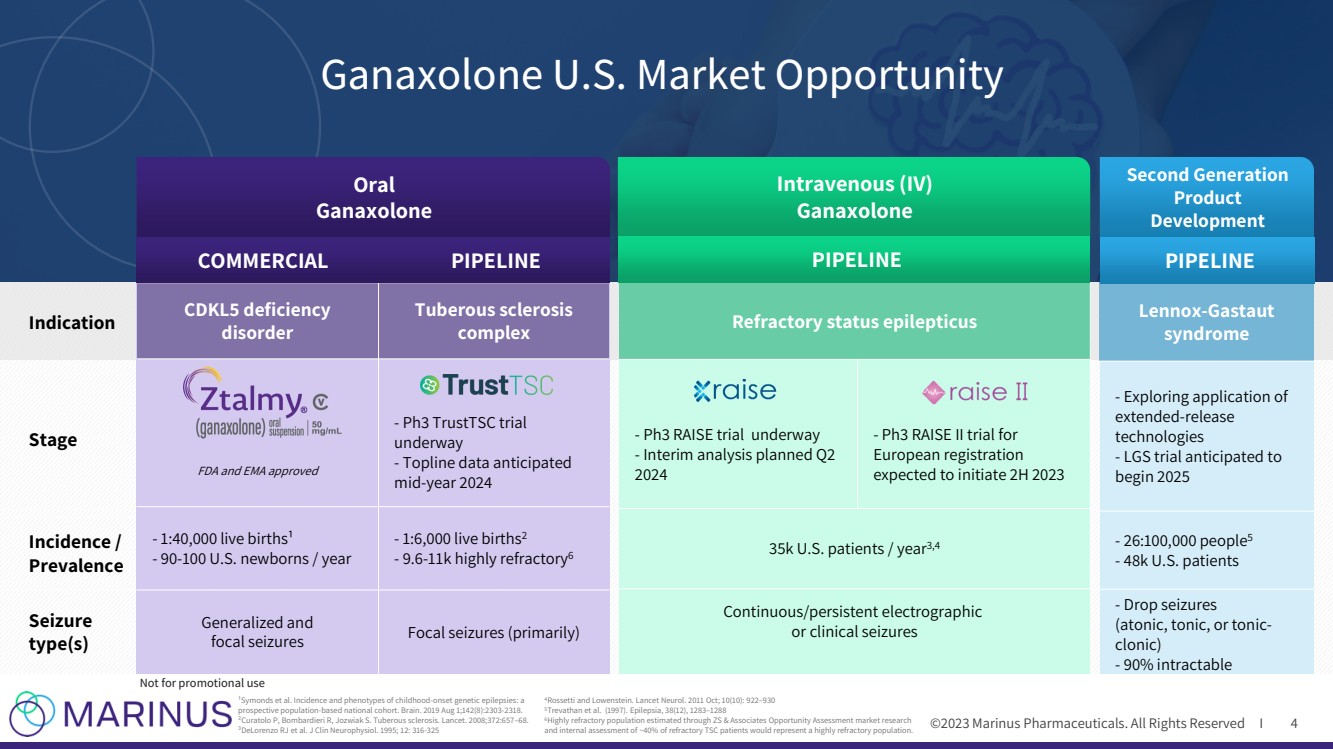
| ©2023 马里纳斯制药公司。版权所有 I 4 ¹ Symonds 等人。儿童期发作遗传性癫痫的发病率和表型: 基于人群的前瞻性全国队列。Brain。2019 年 8 月 1 日;142 (8): 2303-2318。 ²Curatolo P、Bombardieri R、Jozwiak S. 结节性硬化症。《柳叶刀》。2008;372:657 —68。 ³ DeLorenzo RJ 等人。J Clin Neurophysiol。1995;12:316-325 4Rossetti 和 Lowenstein。Lancet Neurol。2011 年 10 月;10 (10):922—930 5Trevathan 等人(1997)。癫痫,38(12),1283—1288 6通过ZS & Associates机会评估市场研究 估算的高难治性人群,以及对约40%的难治性TSC患者的内部评估,将代表高度难治性人群。 Ganaxolone 美国市场机会 口服 ganaxolone 静脉注射(IV) 第二代 产品 开发 阶段 发病率/ 发病率 发作 类型 } complex FDA 和 EMA 批准 -Ph3 TrustTSC 试验 正在进行中 -预计在 2024 年中期 -1:40,000 例活产¹ -90-100 名美国新生儿/年 -1:6,000 例活产2-9.6-11k 高度难治性6 全身性和 局灶性发作(主要是) CDKL5难治性癫痫持续状态 -Ph3 RAISE 试验正在进行中 -计划于 2024 年第二季度进行中期分析-Ph3 RAISE II 试验 欧洲注册 预计将启动 2023 年 2 月 3.5 万名美国患者/年 3,4 持续/持续电图 或临床发作 -探索 延期释放 的应用 technologies -LGS 试验预计 将于 2025 年开始-26:100,000 人5-4.8 万名美国患者 -抽搐 (失神性、强直性或强直阵挛) -90% 难以治愈 商业管道管道 不用于促销用途 |
| ZTALMY®(ganaxolone)口服混悬液 CV 万寿菊临床数据和商业发布 不用于促销用途 |
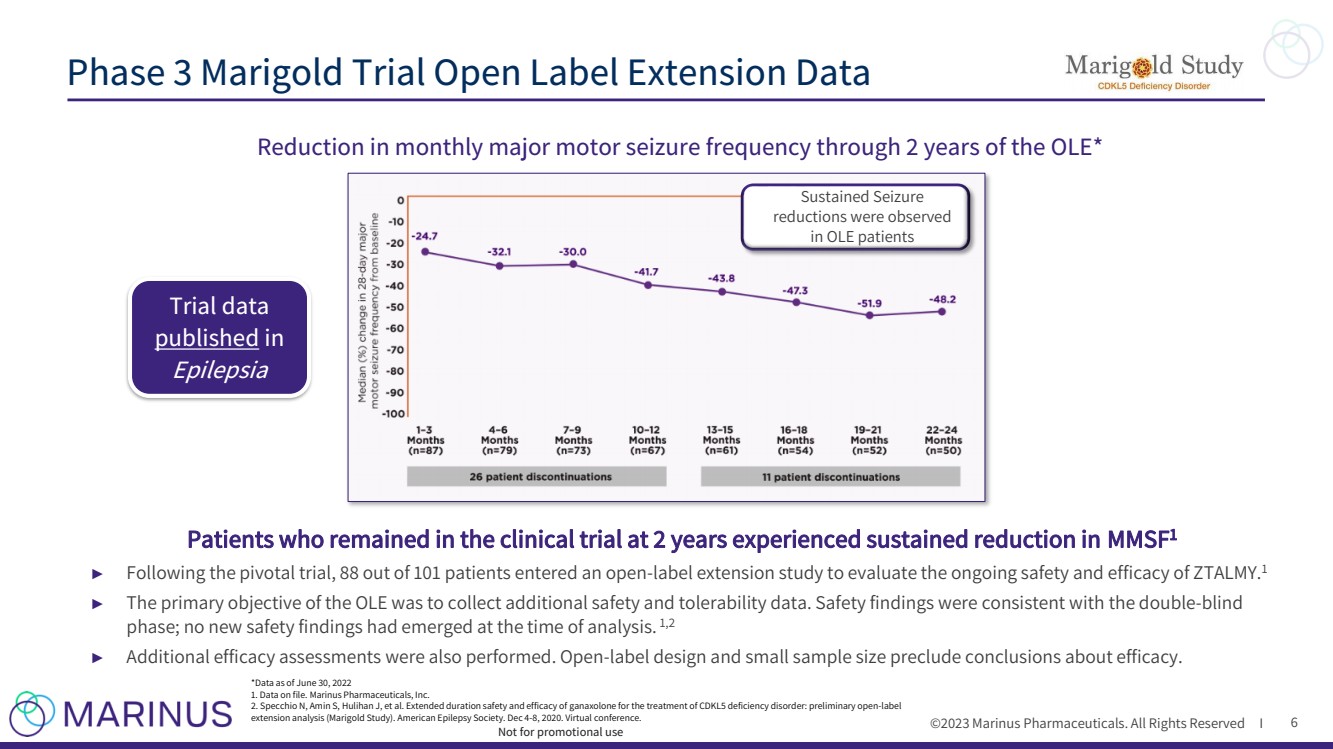
| ©2023 马里纳斯制药公司。版权所有 I 6 在 2 年内降低每月重度运动发作频率 OLE* 继续参加临床试验 2 年的患者 MMSF1 持续减少 ► 关键试验结束后,101 名患者中有 88 名进入了开放标签延期研究,以评估 ZTALMY.1 的持续安全性和有效性 ► OLE 的主要目标是收集额外的安全性和耐受性数据。安全发现与双盲 阶段一致;在分析时没有出现新的安全发现。1,2 ► 还进行了额外的功效评估。开放标签设计和小样本量排除了关于疗效的结论。 万寿菊3期试验开放标签扩展数据 非促销用途 观察到 OLE 患者的持续发作 减少 *截至2022年6月30日的数据 1.存档数据。Marinus Pharmicals, Inc. 2.Specchio N、Amin S、Hulihan J 等ganaxolone 用于治疗 CDKL5 缺乏症的延长疗程安全性和有效性:初步的开放标签 延期分析(万寿菊研究)。美国癫痫协会。2020 年 12 月 4 日至 8 日。虚拟会议。 试验数据 发表于 《癫痫》 |
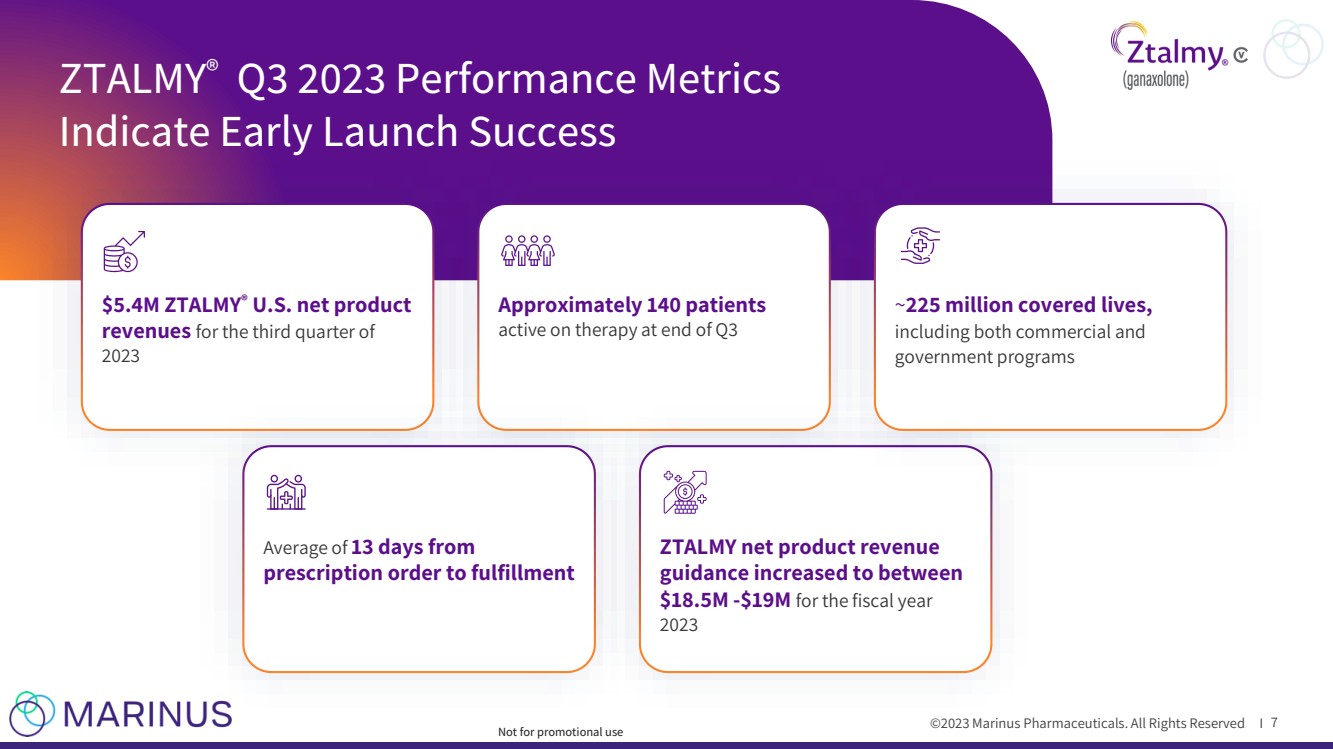
| ©2023 马里纳斯制药公司。版权所有 I ZTALMY® 2023 年第三季度绩效指标 表示提前上市成功 7 个 540 万美元 ZTALMY® 2023 年第三季度的净产品收入 截至第三季度末大约有 140 名患者 处方订单到配送 ZTALMY 净产品收入 指导增加到 2023 财年 1850 万美元至 1900 万美元之间 人寿保障, 包括商业和 政府计划 不用于促销用途 |
| ©2023 马里纳斯制药公司。版权所有 I 发展 ZTALMY® 品牌的全面商业战略 患者识别激活护理人员 社区 对 HCP 进行重点教育,将 ZTALMY 确立为 CDD 癫痫发作管理的护理标准 持续增强 患者体验 • 通过教育医护人员了解 确定 的重要性来提升 br} 难治性癫痫综合征患者的遗传病因 • 增加对第三方 数据的投资预计将允许靶向 多出大约 2 倍的 CDD 患者 • 通过新增的 “Shining Moments™” 教育 项目来激发灵感 直接提供给 护理人员社区 重点关注 ZTALMY 和 CDD • 宣传教育针对 高倾向于 患有 CDD 患者和 处方 ZTALMY • 数据驱动分析和 HCP 细分策略,在正确的时间向正确的 HCP 传递正确的信息 • 完善 ztalMyOne™ patient 支持计划,以满足 CDD 社区 不断变化的需求 在同类中取得最佳成绩实践,将 Marinus 确立为难治性癫痫领域的领导者,并增强未来发布的能力 不用于促销用途 8 |
| 罕见癫痫 口服加那唑酮管道 |
| 结节性硬化症复合体 “尽管混合了多种抗癫痫药物,但许多TSC患者仍会出现不受控制的发作。由于总是需要新的选择, TSC 社区欢迎对新的癫痫疗法进行临床评估” -结节性硬化症联盟总裁兼首席执行官卡里·路德·罗斯贝克 |
| ©2023 马里纳斯制药公司。版权所有 I 11 结节性硬化症复合体 (TSC) 原因 • TSC1 和/或 TSC2 基因缺陷或突变 发生率 • 每6,000例活产中约有1例1 常见 症状 • 癫痫、认知障碍、行为障碍、皮肤/肾脏/肺部异常等 • 大约 80-90% 的 TSCC 癫痫 2 • 三分之二对现有疗法有难治性2 • 癫痫发作通常在出生后的第一年内开始(婴儿痉挛和/或局灶性发作)3 1。Hasbani DM & Crino PB 2018 Hand。Clin。Neurol。 2。Henske EP 等人。2016 年 Nat.Rev. Dis.引物。 3。Chu-Shore CJ 等人。2010 Peilsia TSC 是最常见的遗传性癫痫之一,尽管有现行疗法,但通常表现出高度难治性发作 |
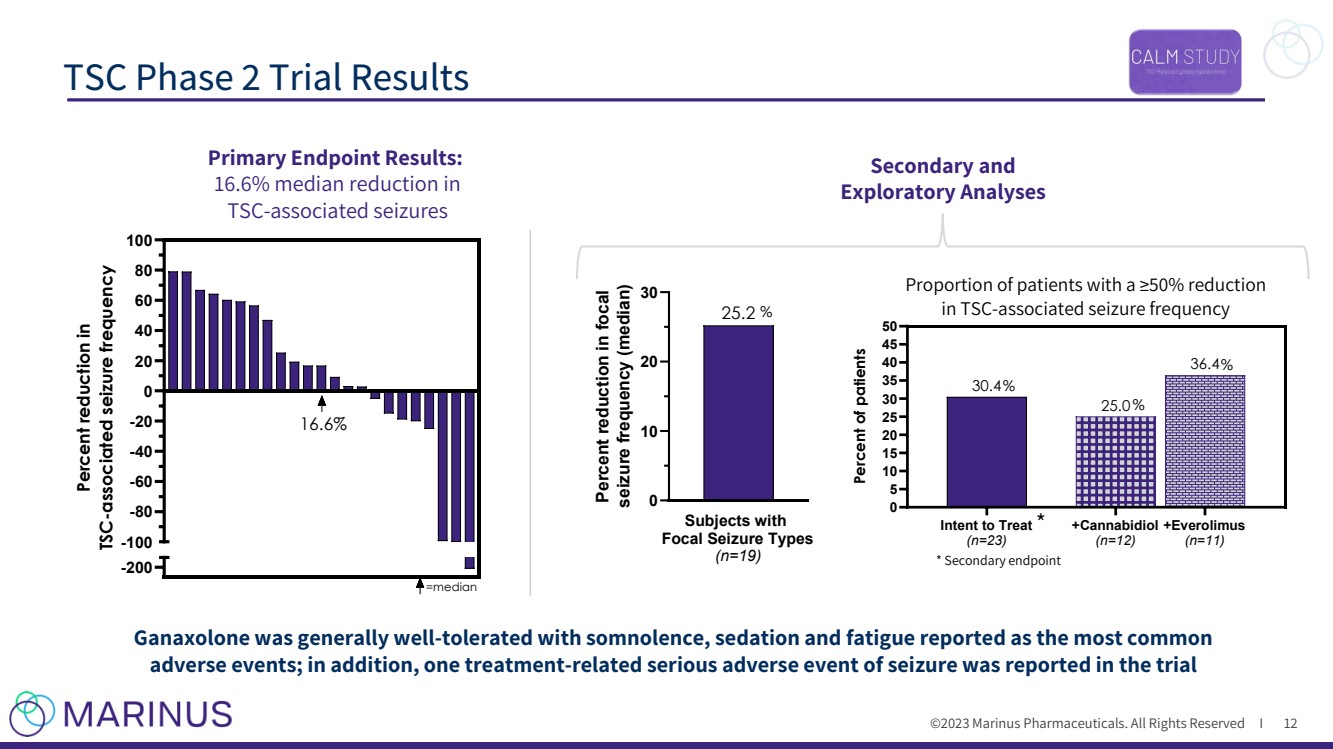
| ©2023 马里纳斯制药公司。版权所有 I TSC 第 2 阶段试验结果 12 * -200 -80 -60 -40 -20 0 40 60 80 100 tsc 相关发作频率降低 100% =median 16.6% 次要分析和 主要终点结果: tsc 相关发作中位数减少 16.6% Ganaxolone 总体耐受性良好,据报告,睡眠、镇静剂和疲劳是最常见的不良事件;此外,试验中报告了一起与治疗相关的严重癫痫不良事件 * 次要终点 比例与tSC相关的发作频率降低≥50% 的患者 有意治疗 (n=23) + Cannabidiol (n=12) + 依维莫司 (n=11) 0 5 10 20 30 35 40 45 45 36.4 25.0 30.4 患者 % 局灶性发作受试者的百分比类型 (n=19) 0 10 20 30 25.2 局灶性发作频率降低百分比(中位数) % |
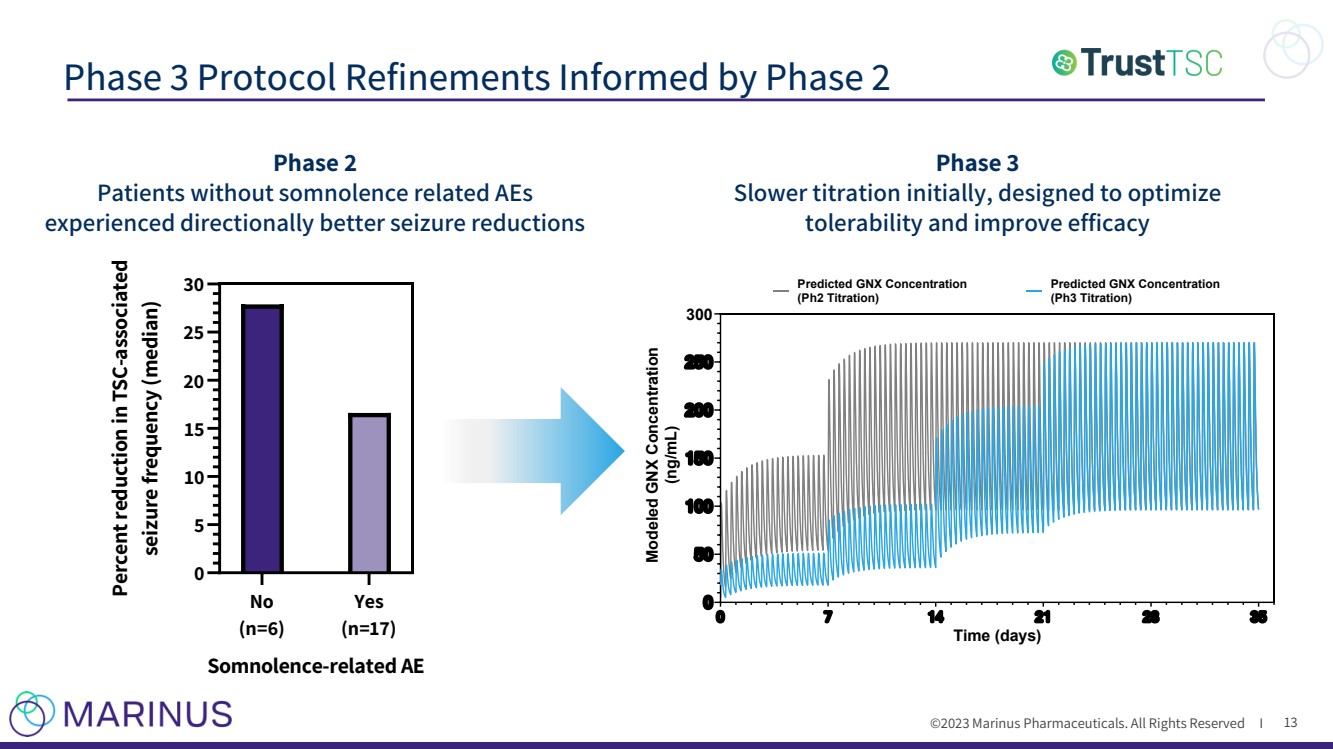
| ©2023 马里纳斯制药公司。版权所有 I 第 3 阶段协议的完善由第 2 阶段提供信息 13 第 3 阶段最初降低滴定速度,旨在优化 耐受性并提高疗效 否 (n=6) 是 (n=17) 0 5 10 15 20 25 30 与睡眠相关的 AE 发作频率降低(中位数) 期 2 没有与睡眠相关的不良反应的患者 的发作减少方向性更好 0 7 14 21 28 35 0 50 10 150 20 250 时间(天) 建模 GNX 浓度 (ng/mL) 预计 GNX 浓度 (Ph2 滴定)GNX 浓度 (pH3 滴定法) |
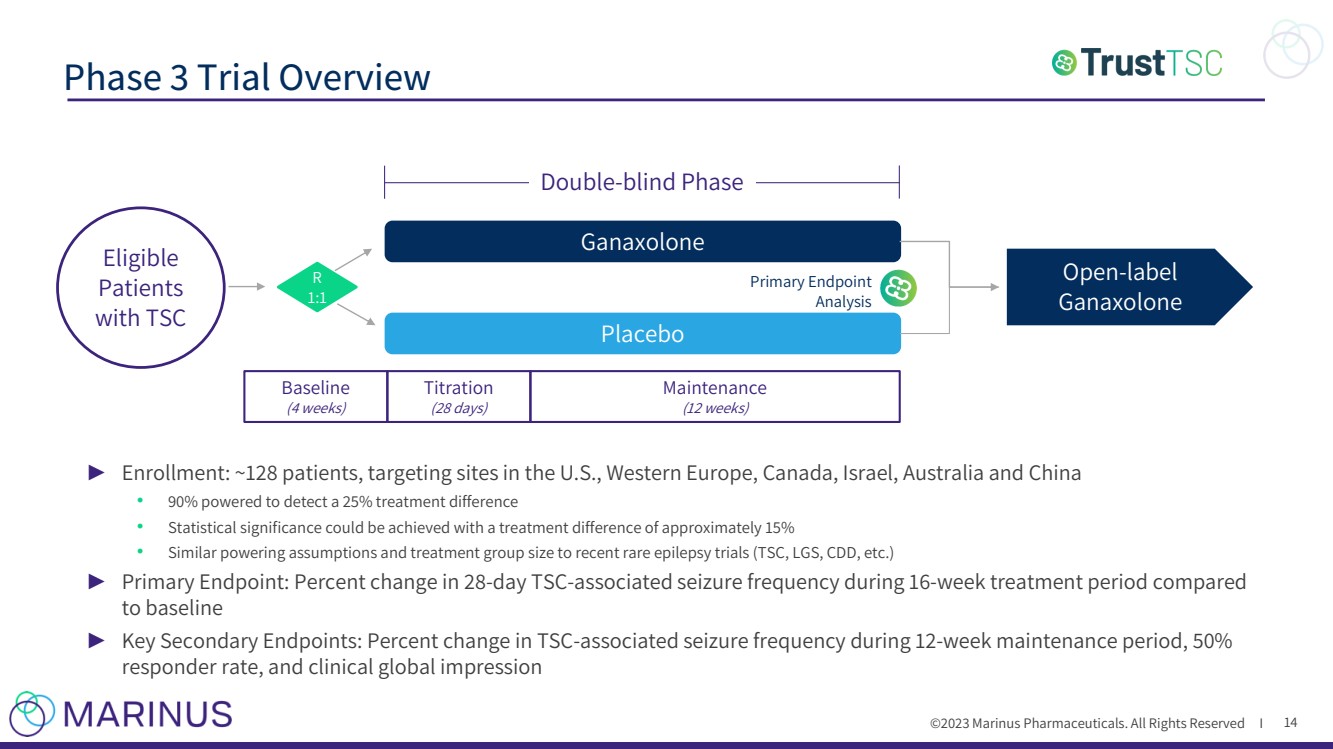
| ©2023 马里纳斯制药公司。版权所有 I 3 期试验概述 14 ► 入组人数:约 128 名患者,针对美国、西欧、加拿大、以色列、澳大利亚和中国 • 90% 的患者有能力检测出 25% 的治疗差异 • 治疗差异约为 15% 可以实现统计学意义 • 与最近的罕见癫痫试验(TSC、LGS、CDD 等)相似的权威假设和治疗组规模。) ► 主要终点:与基线 相比,16 周治疗期间 28 天 tSC 相关发作频率的变化百分比 ► 关键次要终点:12 周维持期内 tSC 相关发作频率的变化百分比、50% 反应率和临床全球印象 安慰剂 基线 (4 周) 滴定 br}(28 天) 维护 (12 周) 符合条件的 患者 R 1:1 主要终点 分析 开放标签 ganaxolone 双盲期 |
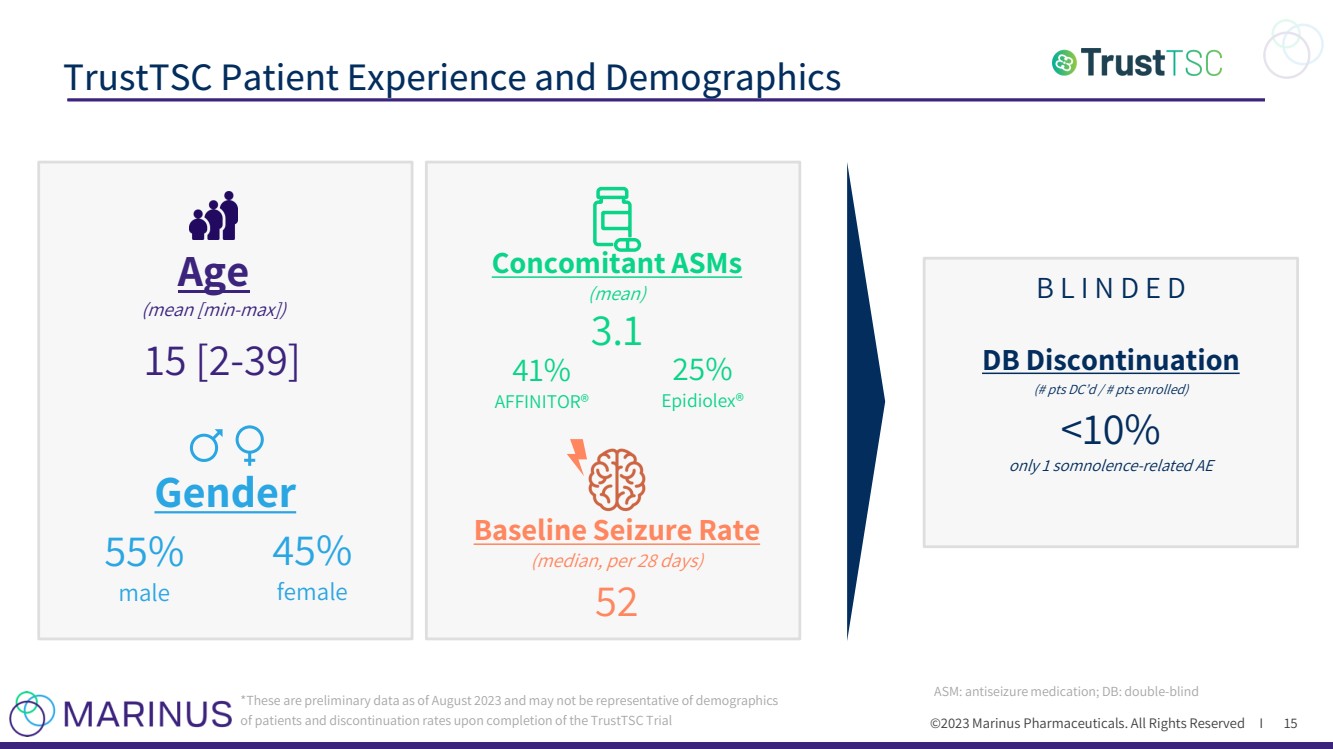
| ©2023 马里纳斯制药公司。版权所有 I TrustTSC 患者体验和人口统计数据 15 *这些是截至 2023 年 8 月的初步数据,可能无法代表 TrustTSC 试验完成后的患者人口统计数据和 年龄 (均值 [最小-最大]) 15 [2-39] 性别 55% 男性 45% 女性 (平均值) 3.1 基准发作率 (中位数,每 28 天) 25% Epidiolex® 41% AFFINITOR® |
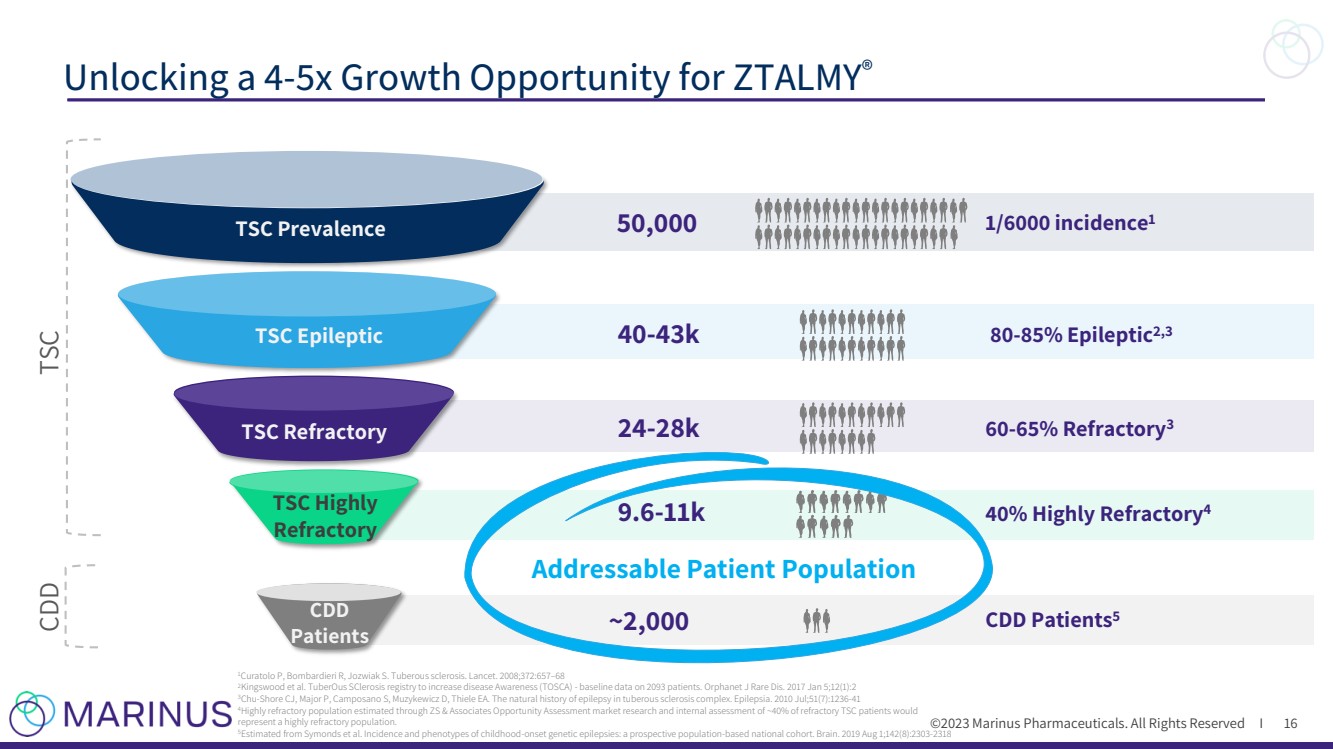
| ©2023 马里纳斯制药公司。版权所有 I 可寻址患者群体 ~2,000 个 9.6-11k 40% 高度难治性4 CDD 患者5 TSC 高 难治性 CDD 患者 TSC 癫痫 TSC 难治性 24-28k 60-65% 难治性 40-43k 癫痫 80-85% tic2,3 50,000 1/6000 发生率1 为 ZTALMY® 16 16 1Curatolo P、Bombardieri R、Jozwiak S. 结节性硬化症解锁 4-5 倍的增长机会。《柳叶刀》。2008;372:657 —68 2Kingswood 等人结节性硬化症登记以提高疾病意识(TOSCA)——2093名患者的基线数据。Orphanet J Rare Dis. 2017 年 1 月 5 日;12 (1): 2 3Chu-Shore CJ、Major P、Camposano S、Muzykewicz D、Thiele EA。结节性硬化症综合征中癫痫的自然病史。癫痫。2010 年 7 月;51 (7): 1236-41 4 通过 ZS & Associates 机会评估市场研究以及对大约 40% 的难治性 TSC 患者的内部评估估算出的高度难治性人群 将代表高度难治性人群。 5 由 Symonds 等人估计。儿童期发作遗传性癫痫的发病率和表型:基于人群的前瞻性全国队列。Brain。2019 年 8 月 1 日;142 (8): 2303-2318 |
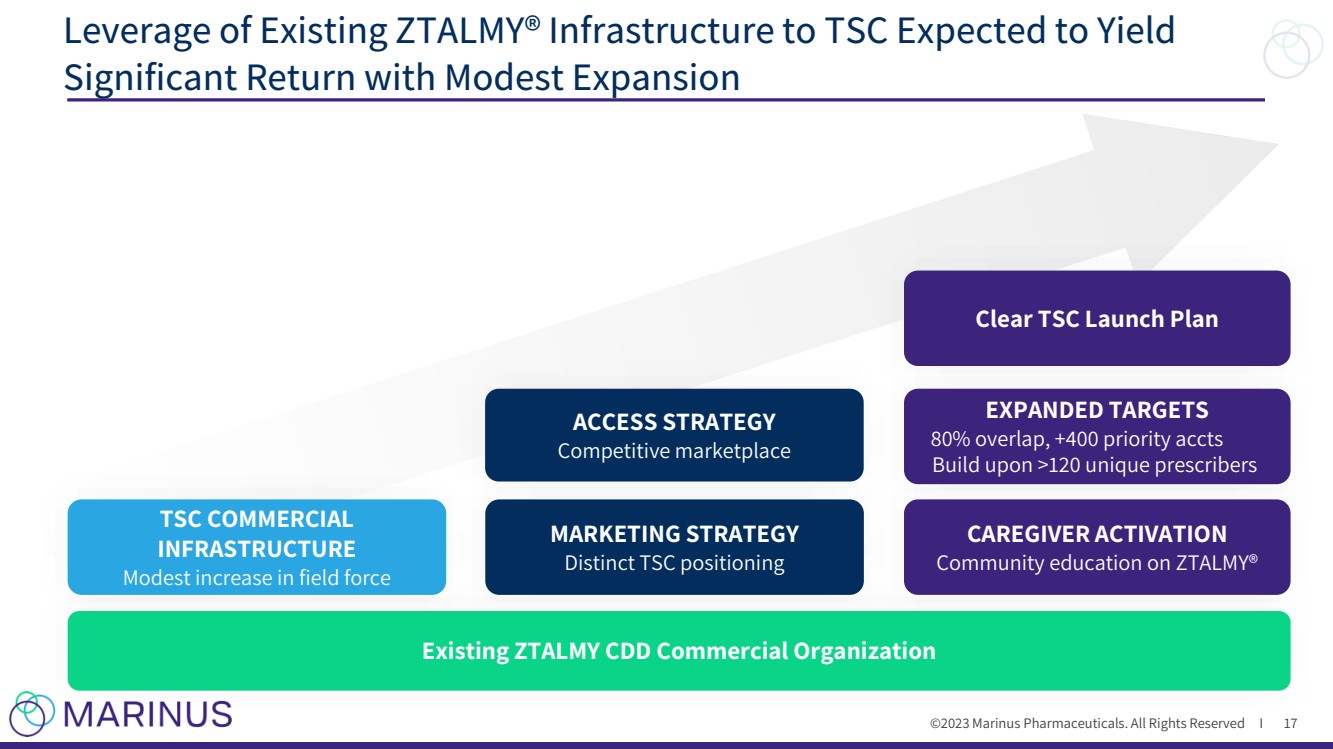
| ©2023 马里纳斯制药公司。版权所有 I 利用现有的 ZTALMY® 基础设施向 TSC 提供有望通过适度扩张获得 17 TSC COMMERCIAL 基础设施 小幅增加 营销策略 TSC 的独特定位 扩展目标 80% 的重叠点,+400 个优先级账户 竞争市场 清除 TSC 启动计划 CAREGIVER ACTIVATIVE 关于 ZTALMY® 的社区教育 现有的 ZTALMY CDD 商业组织 |
| 第二代 产品开发 |
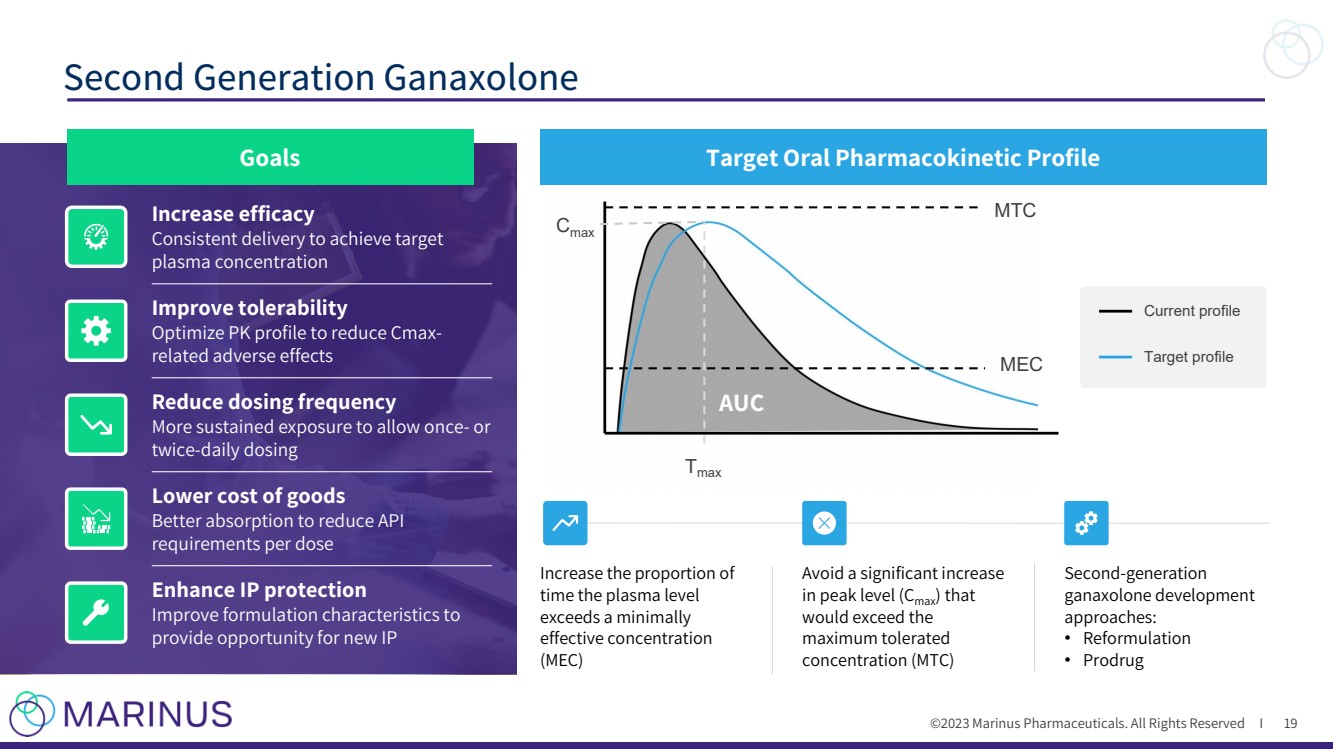
| ©2023 马里纳斯制药公司。版权所有 I 第二代 ganaxolone 19 个目标目标口服药代动力学特征 提高疗效 持续输送以达到目标 血浆浓度 提高耐受性 优化 PK 曲线以减少与 cmax 相关的不良反应 降低商品成本 提高吸收率,降低每剂量 API 的需求 增强 IP 保护 提高配方特性,以 为新 IP AUC Cmax 提供机会Tmax MEC MTC 当前概况 目标概况 提高 超过最低 有效浓度 的时间比例 (MEC) 避免 大幅增加 会超过 最大耐受浓度 (MTC) } 第二代 ganaxolone 开发 方法: • 重新配方 • Prodrug |
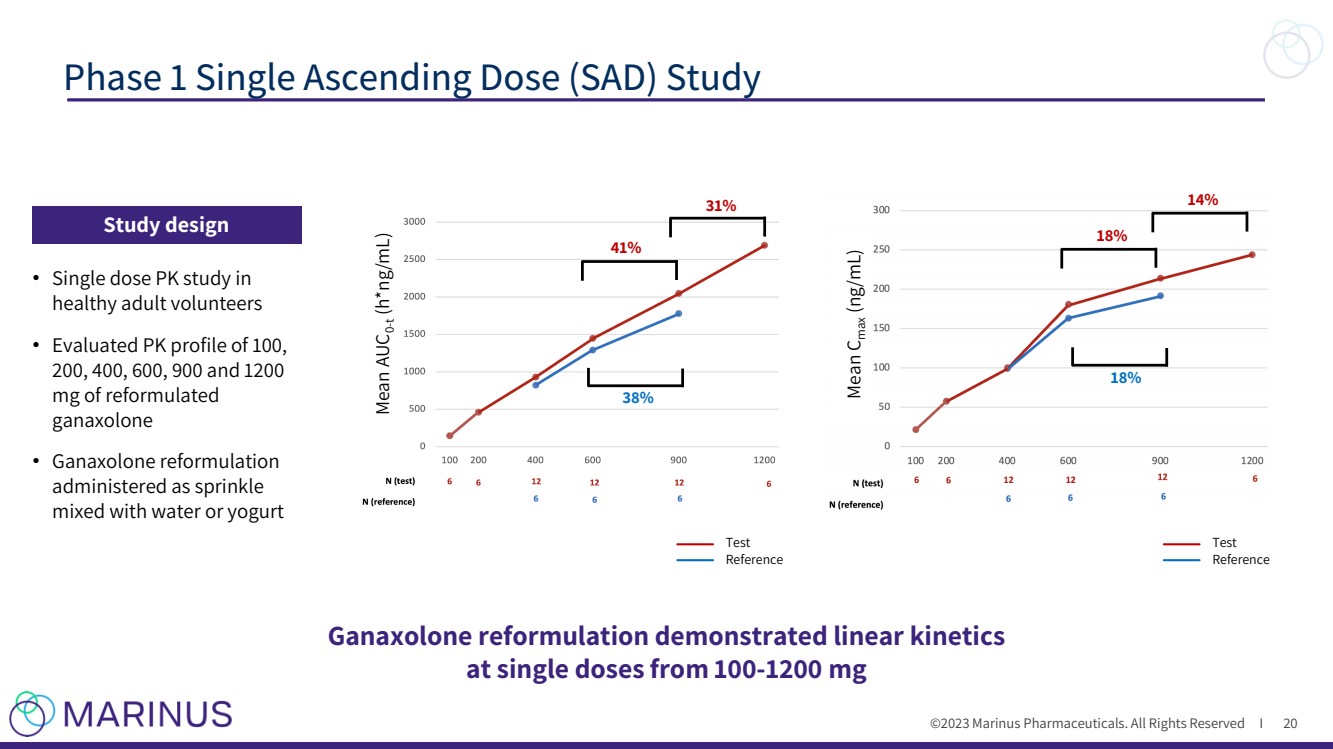
| ©2023 马里纳斯制药公司。版权所有 I 第 1 阶段单剂量递增剂量 (SAD) 研究 20 mean Cmax (ng/mL) mean auc0-T (h*ng/mL) 31% 38% 18% 研究设计 单剂量为 100-1200 mg • 对 健康成年志愿者的单剂量 PK 研究 • 评估了 100、 200、400、600、900 和 1200 mg 的 PK 分布情况 ganaxolone 与水或酸奶混合给药 参考 |
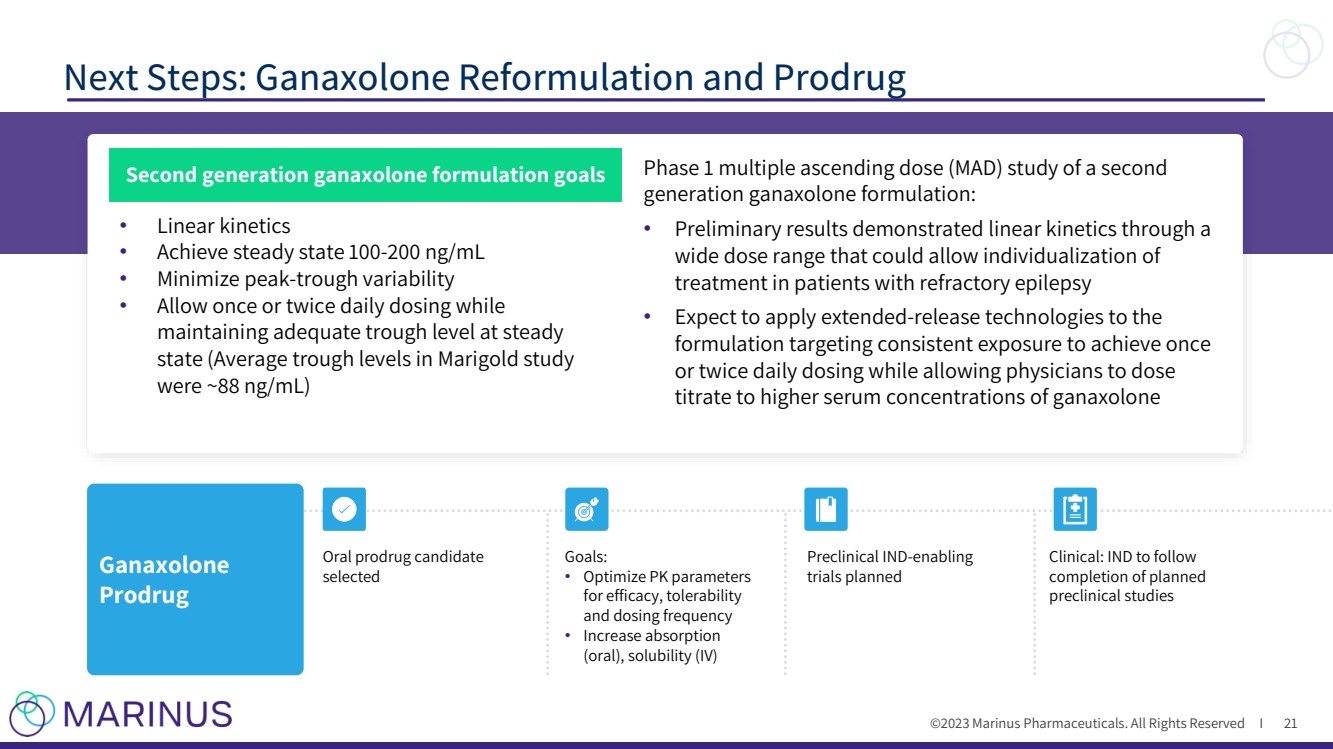
| ©2023 马里纳斯制药公司。版权所有 I 后续步骤:ganaxolone 重新配方和前药 21 Ganaxolone Prodrug 口服前药 已选择 目标: • 优化 PK 参数 以提高疗效、耐受性 和给药频率 • 增加吸收 (口服)、溶解度(IV)计划启用 试验 临床:IND 将在 完成计划中的 临床前研究 第二代加那唑酮配方目标第二代 代加那唑酮配方的第 1 阶段多剂量递增 (MAD) 研究: • 初步研究结果显示 宽剂量范围内的线性动力学,可以对难治性癫痫患者进行 个体化治疗 • 预计将缓释技术应用于 配方,目标是持续暴露,实现每日一次 或两次给药,同时允许医生将 滴定剂量提高到更高的血清浓度加那索龙 • 实现稳定状态 100-200 ng/mL • 最大限度地减少峰谷变异性 • 允许每天给药一到两次,而 将足够的低谷水平保持在稳定 状态(万寿菊研究 中的平均低谷水平约为 88 ng/mL) |
| 急性发作障碍 静脉注射 (IV) 甘那唑酮管道 |
| 癫痫持续状态 |
| ©2023 马里纳斯制药公司。版权所有 I 癫痫状态概述 24 Status Peilepaiticus = 病情是由导致 发作终止的机制失灵或由导致: • 发作时间异常延长(在时间点 t 1 之后) • 可能产生长期后果(时间点 t2 之后) 1。DeLorenzo RJ 等人 1995 年 J Clin Neurophysiol 2.Naylor DE.癫痫公开赛。2023 3 3.Rossetti AO 等人J Neurol Neurosurg 精神病学。2006 4.Jayalakshmi S 等人缉获。2015 5 年 5.Penberthy LT 等人2005 年的扣押 6.Guterman EL 等人JAMA Neurol 2021 • 禁用 认知缺陷3 • 发生 癫痫 的风险增加 2.9 倍3 与幸存者 的显著发病率相关: • 潜在的 SE4 • 治疗性昏迷 暴露3 • 随着 SE 的进展,直接 医疗费用增加5,尤其是 6 美国 SE 的发病率: 每年约 150,000 次 SE 发作 1 • 致残认知 缺陷2 • 发作 癫痫的风险增加2 死亡率增加 与: 显著 医疗保健 利用率: 24 |
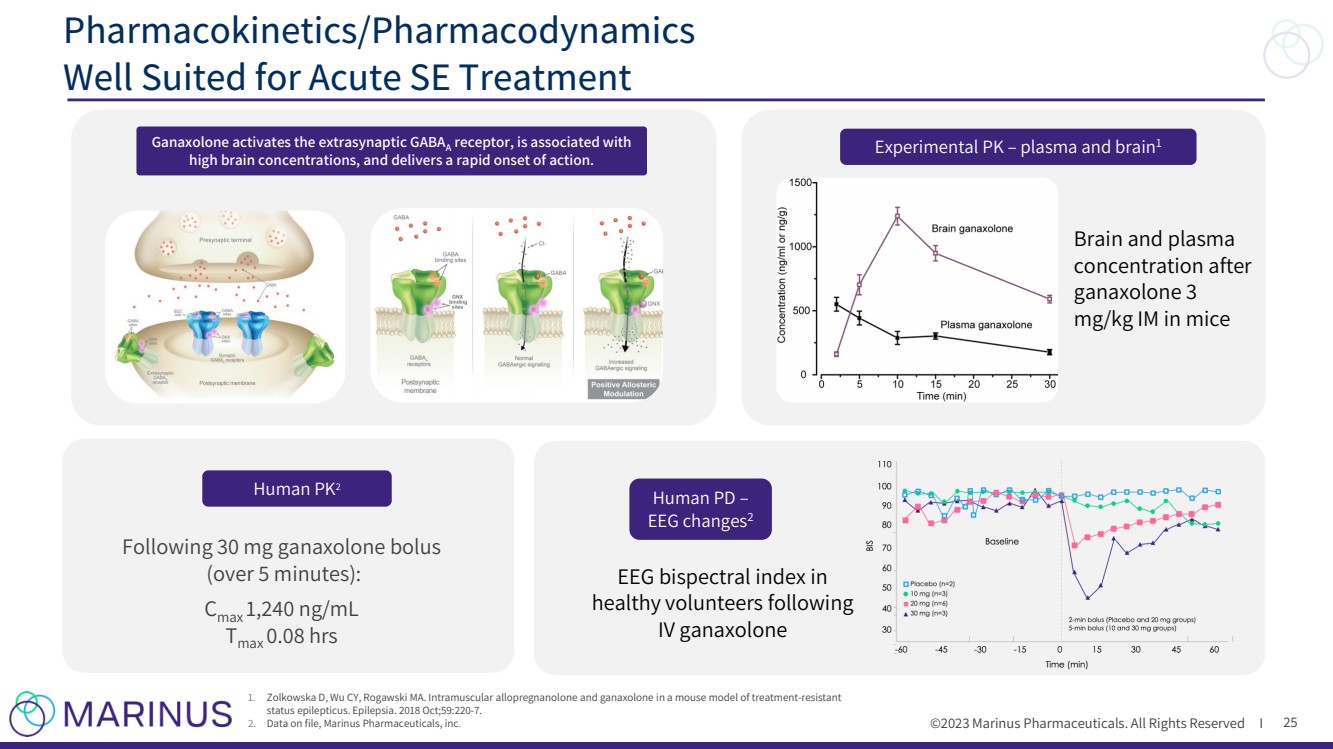
| ©2023 马里纳斯制药公司。版权所有 I 25 药代动力学/药效学 非常适合急性 SE 治疗 实验 PK — 血浆和大脑1 小鼠体内 ganaxolone 3 mg/kg IM 后的脑和血浆 浓度 人类 PD — 脑电图变化2 静脉注射加那索龙 1。Zolkowska D、Wu CY、Rogawski MA.耐药性 癫痫持续状态小鼠模型中的肌肉注射异孕酮和加那唑酮。癫痫。2018 年 10 月;59:220-7。 2。存档数据,Marinus Pharmicals, inc. Human PK2 遵循 30 mg ganaxolone bolus (超过 5 分钟): Cmax 1,240 ng/mL tmax 0.08 小时 ganaxolone 激活突触外 GABAA 受体,与 高脑浓度有关,并迅速起作用。 |
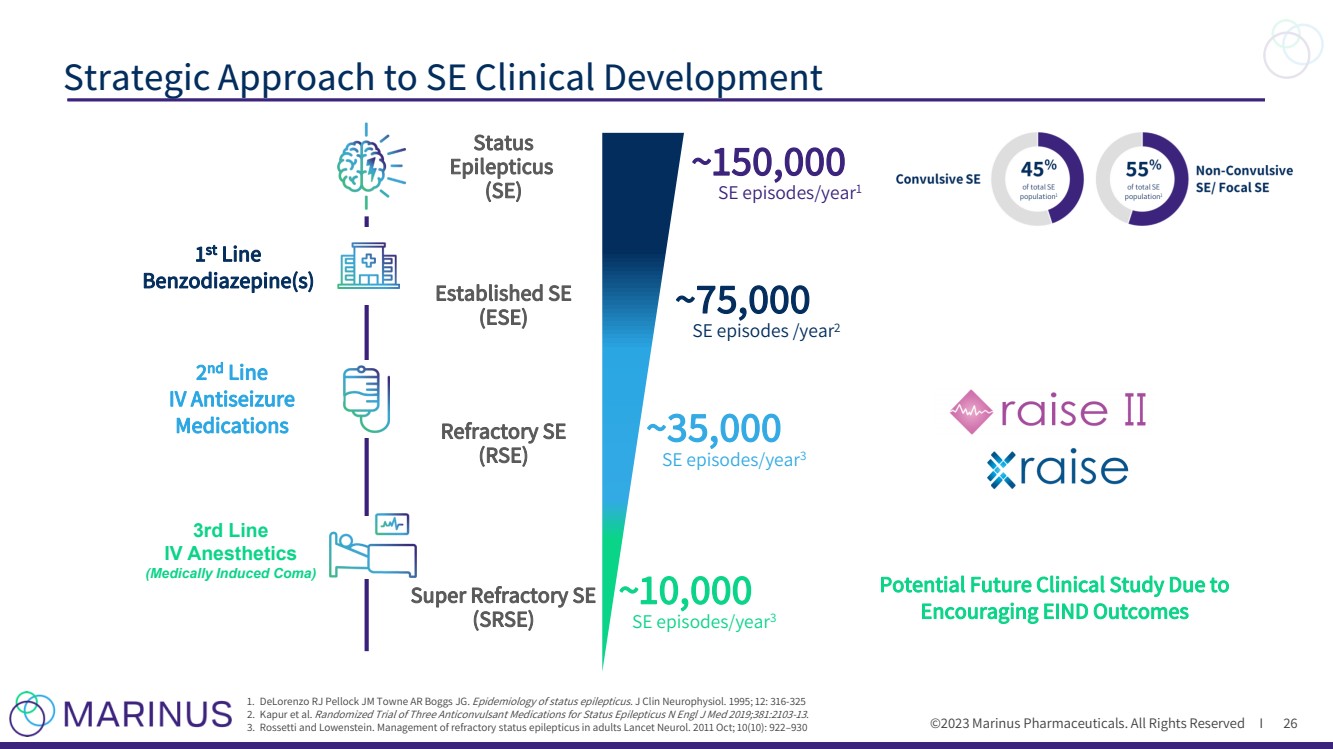
| ©2023 马里纳斯制药公司。版权所有 I SE 临床开发战略方针 26 1.DeLorenzo RJ Pellock JM Towne AR Boggs JG。癫痫持续状态的流行病学。J Clin Neurophysiol。1995 年;12:316-325 2.Kapur 等人。三种治疗癫痫持续状态的抗惊厥药物的随机试验 N Engl J Med 2019;381:2103-13。 3。罗塞蒂和洛文斯坦。成人难治性癫痫持续状态的管理 Lancet Neurol。2011 年 10 月;10 (10):922—930 难治性 SE (RSE) 1 st Line Bendiazepine } (SE) 2 nd Line 静脉抗癫痫 药物 三线 静脉麻醉剂 (药物诱发的昏迷) ~150,000 次东南期发作/年 2 ~35,000 次东南期发作/年 3 由于 令人鼓舞 EIND 结果 26 |
| ©2023 马里纳斯制药公司。版权所有 I 治疗期 加载剂量维持锥度 27 期 2 期难治性癫痫持续状态试验 (RSE) 设计 • 抽搐或非惊厥的诊断 SE • 至少一种二线静脉注射失败但尚未进入第三线静脉注射麻醉剂 加持续 滴注 18 小时逐渐输液 筛查治疗后随访 第 2、3、4 周 SE 患者 每天 ganaxolone 的队列剂量 N 低 500mg/天 5 中等 650mg/天 4 高 713mg/天 8 新疗法的目标当前的局限性治疗终点 • 快速停止 • 保持发作控制 • 防止进展至 静脉麻醉剂 • 一线苯二氮卓类药物在 45%-50% 时无效;受 心血管和呼吸道副作用 的限制 • 二线对已建立的 SE 的 50% 以上无效;难治性 SE 中对 的反应进一步降低 • 三线静脉麻醉剂:高发病率,死亡率约为 35%; 住院时间和医疗费用增加 • 主要:没有 需要升级治疗的患者百分比 ganaxolone 开始使用后的前 24 小时 • 次要:额外的疗效、安全性和 耐受性 8 名男性,9 名女性 平均年龄:57 岁 (范围:23-88) 17 名患者入组 |
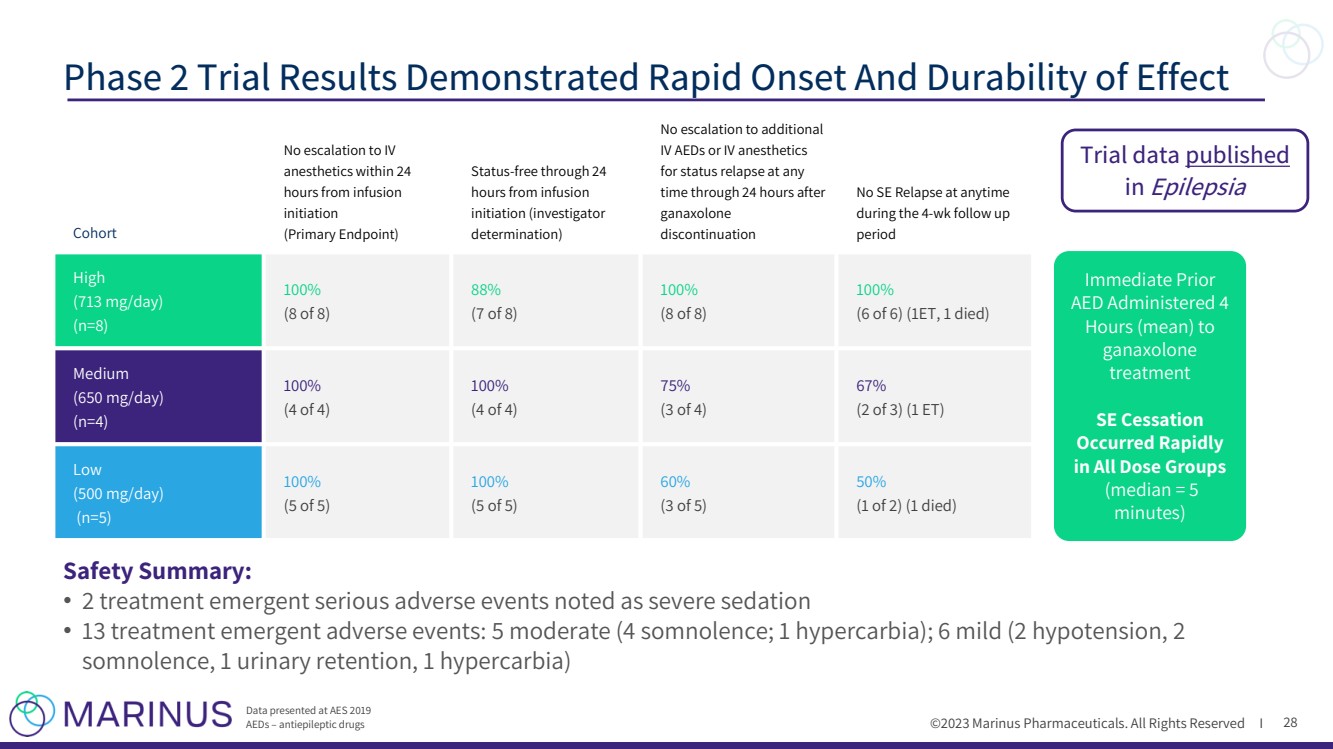
| ©2023 马里纳斯制药公司。版权所有 I 28 期 2 期试验结果显示起效快、效果持久 在 AES 2019 AED 上公布的数据——抗癫痫药物 队列 在开始输液 后的 24 小时内不得升级到静脉注射 麻醉剂 (主要终点) 开始输液 后的 24 小时内无状态(研究者 确定) 在 ganaxolone 停药后的任何 时间或静脉注射麻醉剂 用于状态复发 在 4 周的随访期间随时都没有 SE 复发 br} 周期 高 (713 mg/天) (n=8) 100% (8 中有 8 个) 88% (8 个中的 7 个) (8 个中的 8 个) 100% (6 个 ET,1 个死亡) (n=4) 100% (4 个中的 4 个) 100% (4 个中的 4 个) 75% (4 个中的 3 个) 67% (3 个 2 个)(1 个 ET) (500 mg/天) (5 个) 100% (5 个) 100% br}(五分之五) 60% (五分之三) 50% (二分之一)(1 人死亡) 立即服用 ganaxolone 治疗 se 停药 在所有剂量组 中迅速发生 (中位数 = 5 分钟) 安全摘要: br} • 2治疗紧急严重不良事件被视为严重镇静剂 • 13 次治疗紧急不良事件:5 次中度(4 次睡眠;1 次高碳水化合物);6 次轻度(2 次低血压、2 次睡眠、1 次尿潴留、1 次高碳水化合物) 发表于《癫痫》的试验数据 |
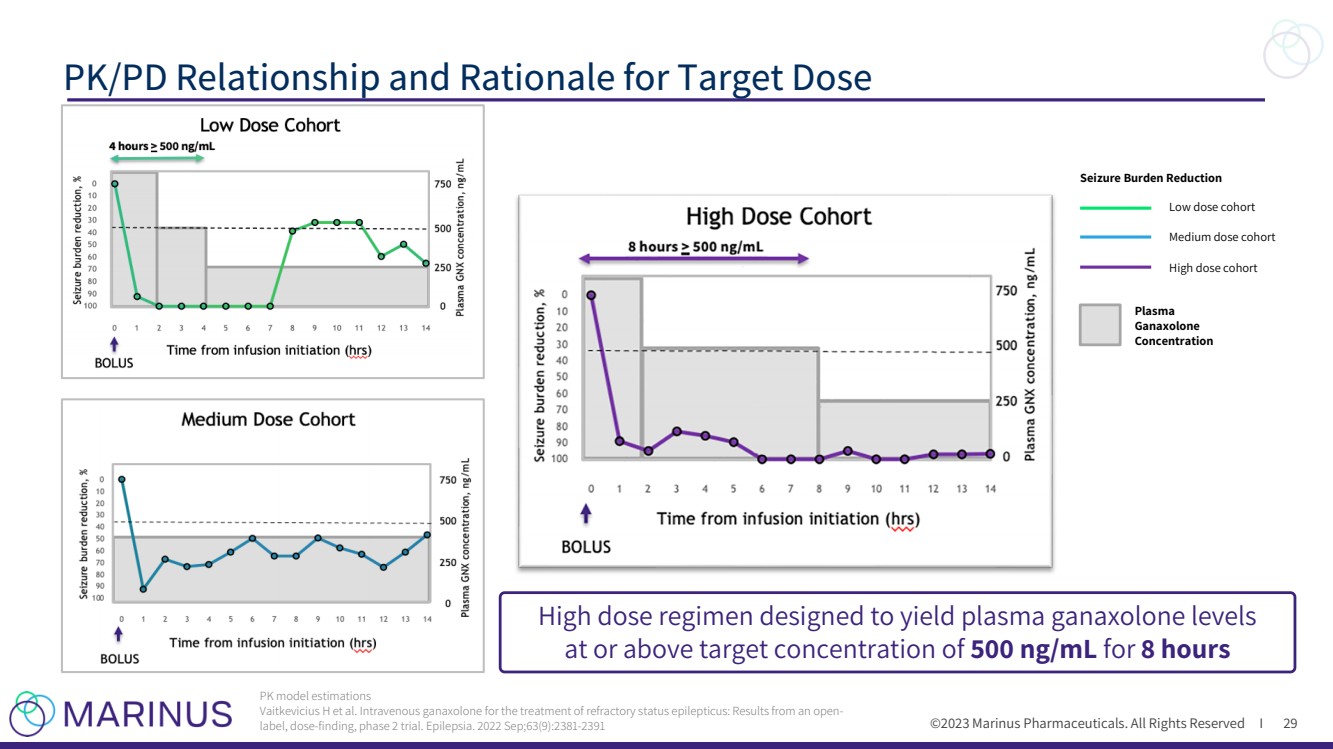
| ©2023 马里纳斯制药公司。版权所有 I PK/PD 目标剂量的关系和依据 29 PK 模型估计 Vaitkevicius H 等人。静脉注射ganaxolone用于治疗难治性癫痫持续状态:来自一项开放标签、剂量发现的2期试验的结果。癫痫。2022 年 9 月;63 (9): 2381-2391 发作负担减轻 低剂量队列 高剂量队列 血浆 Ganaxolone 浓度 高剂量疗法旨在使血浆甘那唑酮水平保持或高于 500 ng/mL 的目标浓度,持续 8 小时 |
| ©2023 马里纳斯制药公司。版权所有 I 患者群体研究治疗 RAISE:难治性癫痫持续状态的第 3 期试验 30 *SE,癫痫持续状态;SRSE,超难治性癫痫持续状态;静脉注射;ASM, 抗癫痫药物;静脉注射 ASM:磷苯妥英/苯妥英、左乙拉西坦、丙戊酸、 lacosamocasoma brivaracetam、brivaracetam、phenobarbital 1:1 随机分配到加那唑酮或安慰剂静脉注射液中 持续的脑电图监测 剂量 30 mg bolus 静脉输液 x 36 小时 主要目标:评估静脉注射加那唑酮在 2 种或更多抗癫痫药物失效后治疗 癫痫持续状态的疗效和安全性 3 期方案旨在使血浆 ganaxolone 水平在 12 小时内达到或高于目标 浓度大于 500 ng/mL 基于临床的关键纳入标准 SE 并且 脑电图发现 在当前 SE 发作中 ≥2 次抗惊厥治疗失败: 苯二氮卓类药物 + > 1 静脉注射 ASM,或 > 2 次静脉注射 ASM 可能是下次静脉麻醉step in SE 治疗 关键排除标准 预期寿命截至2023年11月27日,中期分析入学人数的80%已完成中期分析的注册预计将于2024年第一季度末完成。如果符合预先定义的中期分析停止标准,则预计将在2024年第二季度完成标题读数 https://classic.clinicaltrials.gov/ct2/show/NCT04391569 Ganaxolone的开发部分由生物医学高级研究与开发局(BARDA)资助, 是负责备灾的助理部长办公室的一部分美国卫生与公共服务部的回应,合同编号为 75A50120C00159。BARDA批准将完成RSE 3期临床试验的绩效期免费延长至30/24年9月30日 30 |
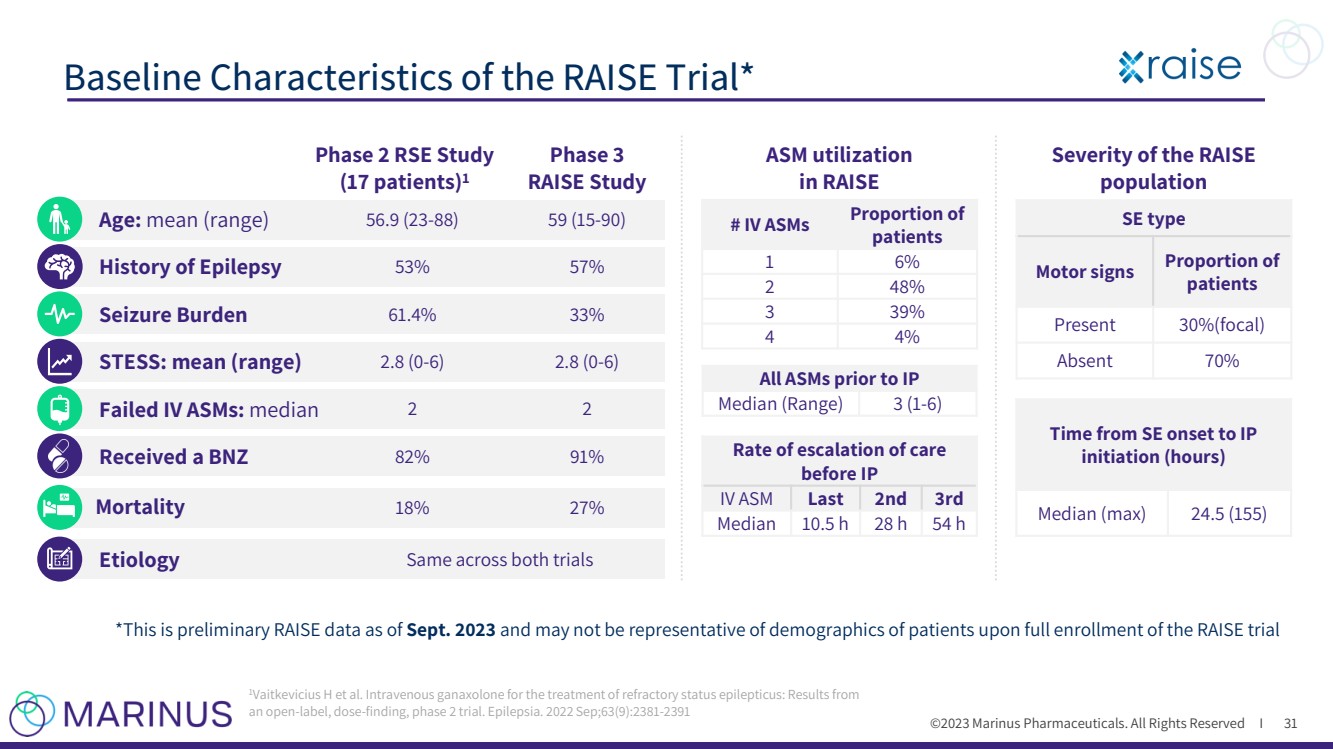
| ©2023 马里纳斯制药公司。版权所有 I RAISE 试验的基线特征* 31 期 RSE 研究 (17 名患者)1 3 期 RAISE 研究 *这是截至 2023 年 9 月的初步RAISE数据,可能无法代表全面参加 RAISE 试验时患者的人口统计数据 STESS:RAISE 人群的平均值(范围) ASM 使用率 在 RAISE # 静脉注射 ASM 中 患者的比例 1 6% 2 48% 3 39% 4 4% IP 之前的所有 ASM 中位数(范围)3 (1-6) 之前的治疗升级率 中位数 10.5 h 28 h 54 h SE 型 运动体征 患者的比例 出现 30%(局灶性) 缺席 70% 从 SE 发作到 IP 开始时间(小时) 中位数(最大值)24.5 (15-155) 癫痫病史 53% 57% 年龄:平均值(范围)56.9(23-88)59(15-90)) 发作负担 61.4% 33% 静脉注射失败 ASM:中位数 2 2 两项试验的病因相同 2.8 (0-6) STESS:平均值(范围)2.8(0-6)2.8(0-6) 获得了 BNZ 82% 91% 1Vaitkevicius H 等人。静脉注射ganaxolone用于治疗难治性癫痫持续状态: 一项开放标签、剂量发现的2期试验的结果。癫痫。2022 年 9 月;63 (9): 2381-2391 31 |
| ©2023 马里纳斯制药公司。版权所有 I RAISE 终点和中期分析 32 个其他次要终点 §根据临床或脑电图证据,用于急性治疗 SE 的药物被定义为用于中止正在进行的 SE 或防止 SE 即将复发的 ASM。该定义不包括维持剂量的ASM 或出于其他原因(例如程序性镇静剂)使用的具有抗惊厥特性的药物。 共同主要终点 起效时间:在研究药物启动后 30 分钟内未使用药物进行急性 治疗 SE§ 效果持续时间:在研究药物启动后 36 小时内未进展为 IV 麻醉的参与者比例 关键次要终点 在研究药物启动后停止 SE 的时间 在 72 小时内没有进展到静脉麻醉研究药物 起始药物 • 正压通气时间 • 重症监护病房住院时间 • 医院住院时长 医疗利用率终点 • 出现 SRSE 的患者比例 • 发作负担减轻 • 最终评估时残疾 32 个关键成分 • 样本 N = 82(样本总数的三分之二,N=124) • 时间 -第 82 名患者完成 72 小时后数据库 “冻结” -启动数据清理然后分析由一位不盲目、独立的 统计学家撰写 -向数据监测委员会提供的临时数据表 临时标线数据 • 94% 的检测能力为 40% 的治疗差异中期分析 • 统计显著性的最小增量 = 19%-27% 统计力 • 共同主要终点 • 关键次要终点 端点中期分析 |
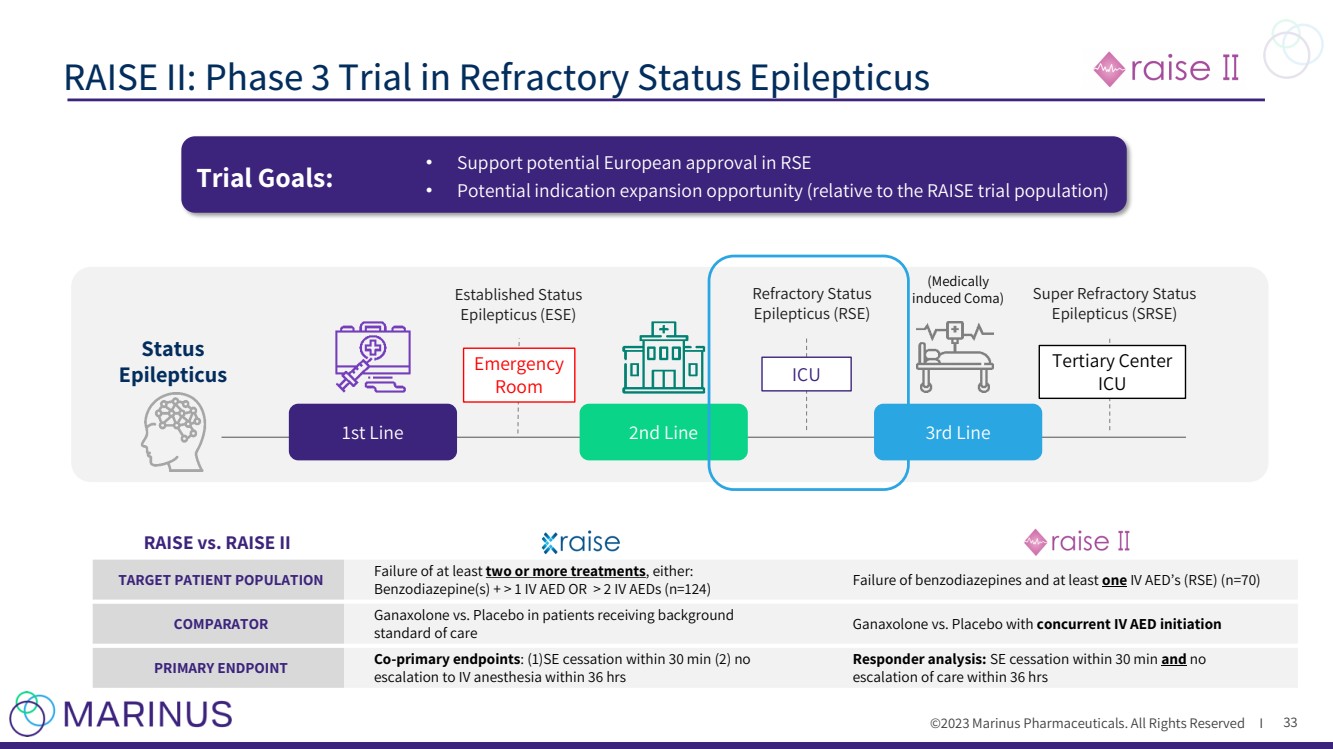
| ©2023 马里纳斯制药公司。版权所有 I RAISE II:难治性癫痫持续状态的第 3 期试验 33 1 Kapur 等人。治疗癫痫持续状态的三种抗惊厥药 的随机试验 N Engl J Med 2019;381:2103-13。 苯二氮卓类药物 给药 静脉注射 AED (抗癫痫药物) (医学上 已确立状态诱发昏迷) 超难治状态 癫痫(SRSE) 第三行 Line 状态 癫痫 第二线 重症监护病房 三级中心 急诊 病房 RAISE vs RAISE II 目标患者群体至少两次或更多治疗失败,包括: 苯二氮卓类药物 + > 1 次静脉注射抗体抗药或 > 2 次静脉注射抗药失效(n=124)epines 和至少一次静脉注射AED (RSE) (n=70) 比较器甘那唑酮与安慰剂在接受背景治疗的患者中 标准治疗与安慰剂的对比 主要终点共同主要终点:(1) SE 在 30 分钟内停止 (2) 没有 升级为静脉麻醉 应答者分析:SE 在 30 分钟内停止,没有 36 小时内升级治疗 试验目标:• 支持欧洲在RSE 中获得潜在的批准 • 潜在的适应症扩展机会(相对于RAISE试验人群) |
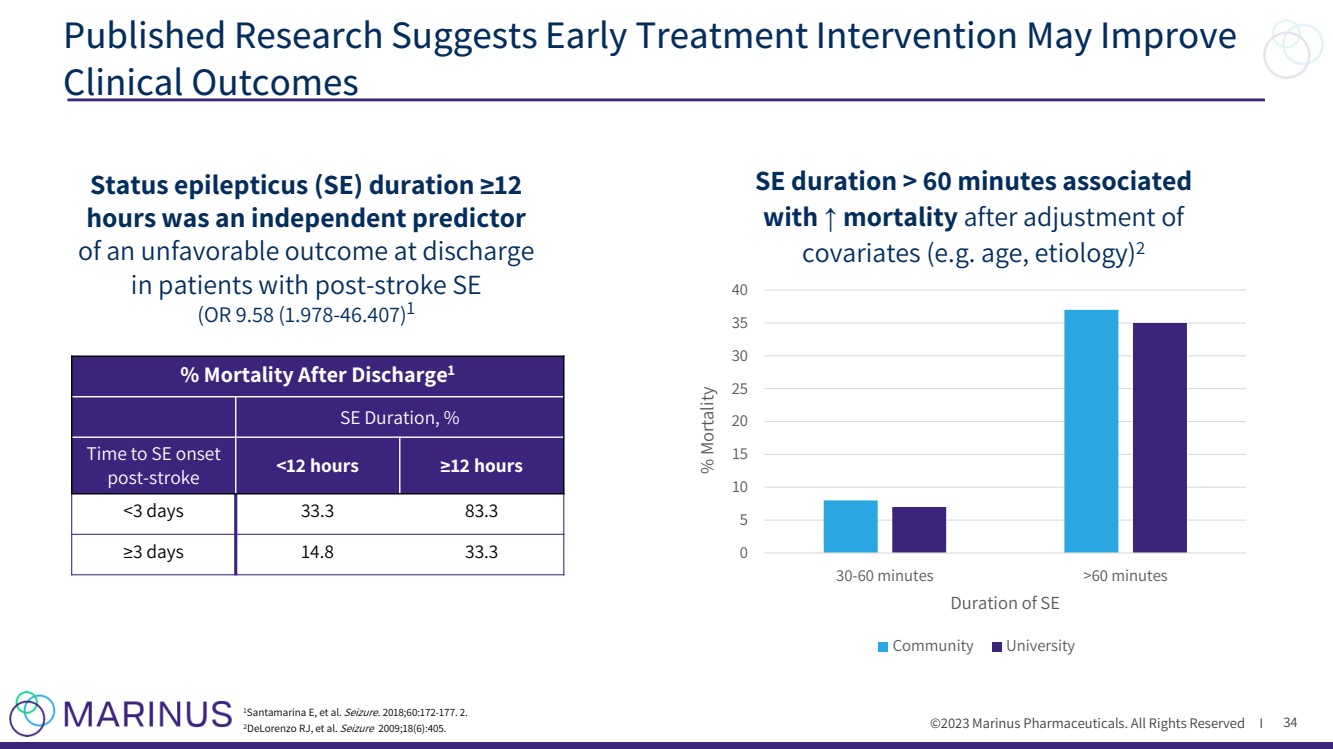
| ©2023 马里纳斯制药公司。版权所有 I 已发表的研究表明,早期治疗干预可以改善 临床结果 34 癫痫持续状态(SE)持续时间 ≥12 小时是中风后患者出院时不利预后 的独立预测指标 (或 9.58 (1.978-46.407) 1% 出院后死亡率1 SE 持续时间,% 发病时间 中风后 60 分钟 % 死亡率 SE 持续时间 > 60 分钟 与 ↑ 调整 协变量(例如年龄、病因)后的死亡率相关 2 社区大学 |
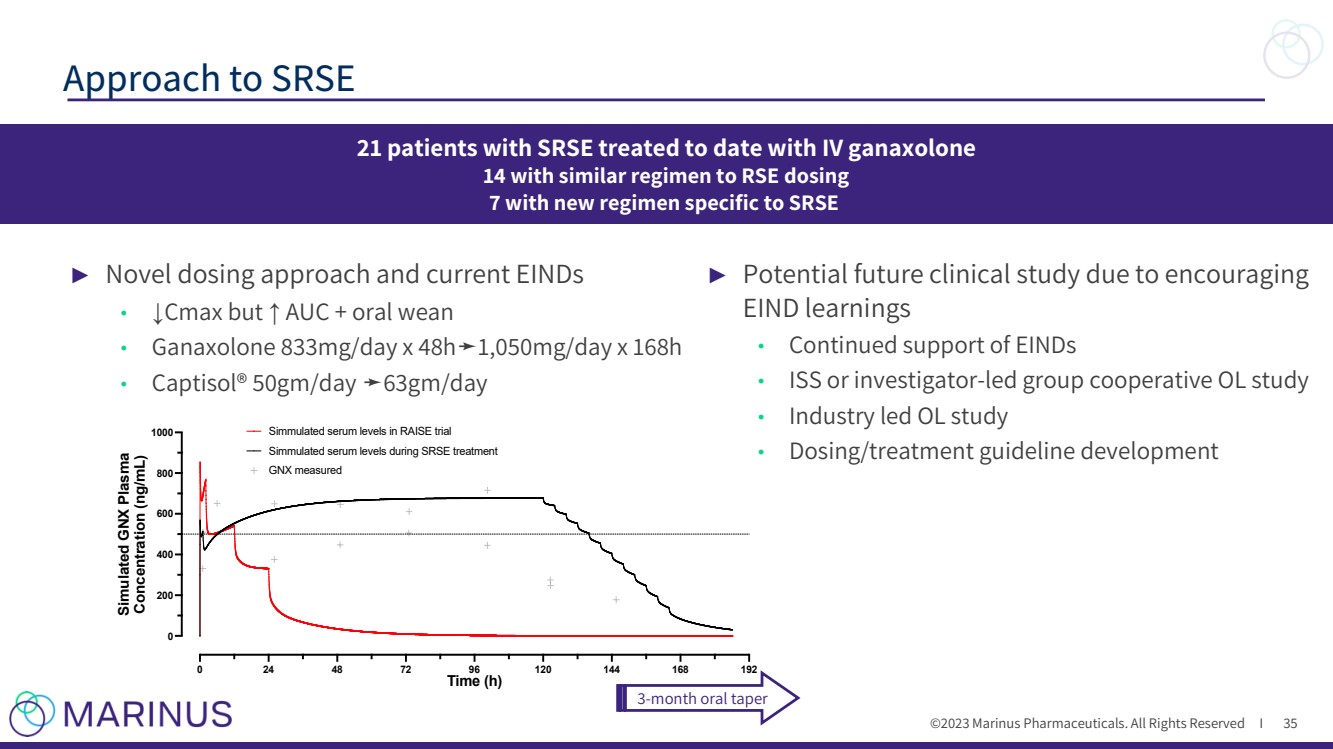
| ©2023 马里纳斯制药公司。版权所有 I ► 新颖的给药方法和当前的 einDs • ↓ Cmax 但是 ↑ AUC + 口服断奶 • ganaxolone 833mg/天 x 48h ➛ 1,050mg/天 x 168h • Captisol® 50gm/天 ➛ 63gm/天 方法 35 21 名 SRSE 患者迄今为止接受静脉注射治疗 axolone 14 采用与 RSE 相似的给药方案 7 使用针对 SRSE 3 个月口服减量的新方案 0 24 48 72 96 120 144 168 192 0 200 400 800 800 1000 时间 (h) 模拟血浆 浓度 (ng/mL) GNX 测得的模拟血清水平 模拟血清水平在 SRSE 治疗期间 ► 由于鼓励 EIND 学习,未来可能进行临床研究 • 持续支持 einD • ISS 或研究者主导的小组合作 OL 研究 • 行业主导的 OL 研究 • 剂量/治疗指南的制定 35 |
| ©2023 马里纳斯制药公司。版权所有 I 超级难治性癫痫持续状态:ganaxolone 迄今为止的经验 36 新发难治性癫痫持续状态 (NORSE) 发热性疾病相关性癫痫综合征 (FIRES) Lennox-Gastaut 综合征 PCDH-19 相关癫痫 自身免疫性脑炎 中风 线粒体炎失调 结果 患者人数 已康复 9 部分康复 4 未康复 8 年龄诊断结果 年龄范围 患者人数 1-3 岁 2 4-12 岁 5 13-17 岁 3 18 岁及以上 11 共计 21 36 7 个中的 5 个接受新疗法治疗的患者疗效良好 |
| 为未来建设商业 基础设施 IV 发布 |
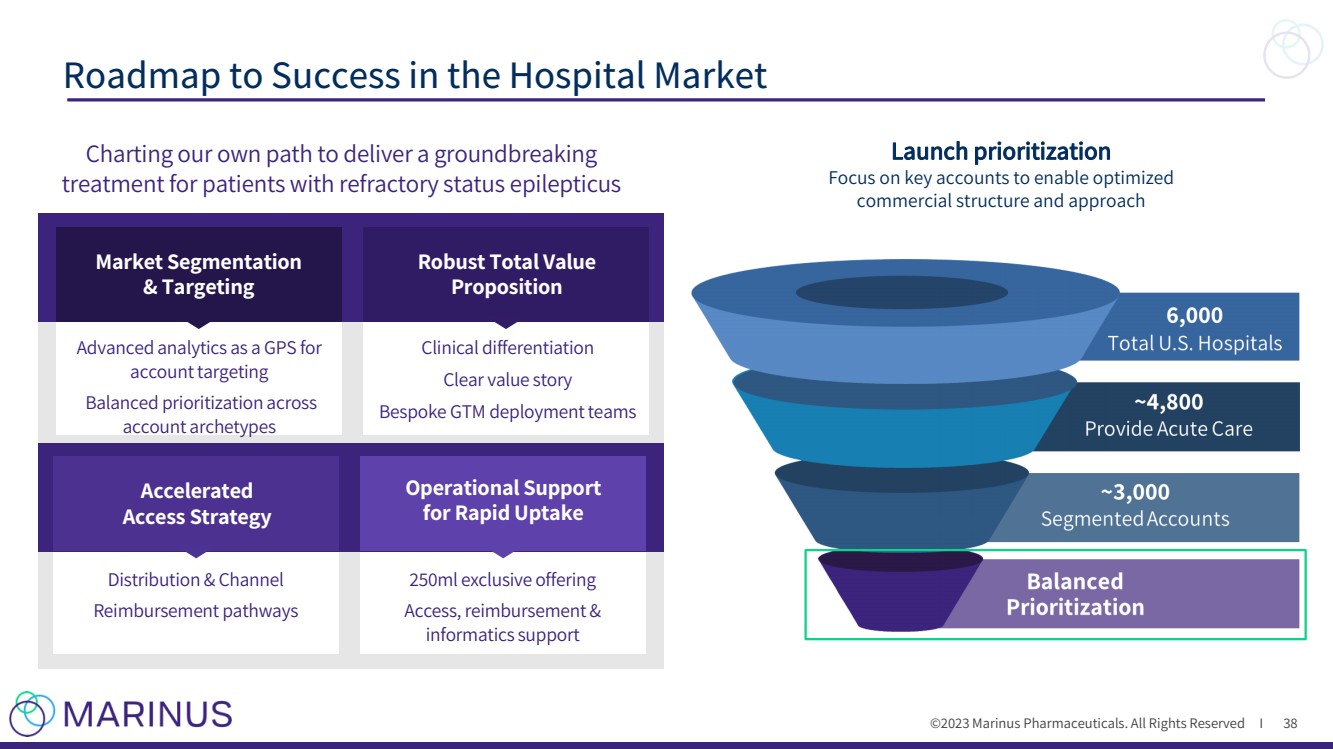
| ©2023 马里纳斯制药公司。版权所有 I 医院市场成功路线图 38 绘制我们自己的路径,为难治性癫痫持续状态患者提供开创性的 治疗 市场细分 和定位 稳健的总价值 提案 提案 以 GPS 为目标进行高级分析 差异化 清晰的价值故事 量身定制 GTM 部署团队 快速吸收运营支持 加速 访问策略 分销和渠道 报销途径 250 毫升独家优惠 访问权限、报销和 信息学支持 启动优先级排序 关注关键客户以实现优化 商业结构和方法 |
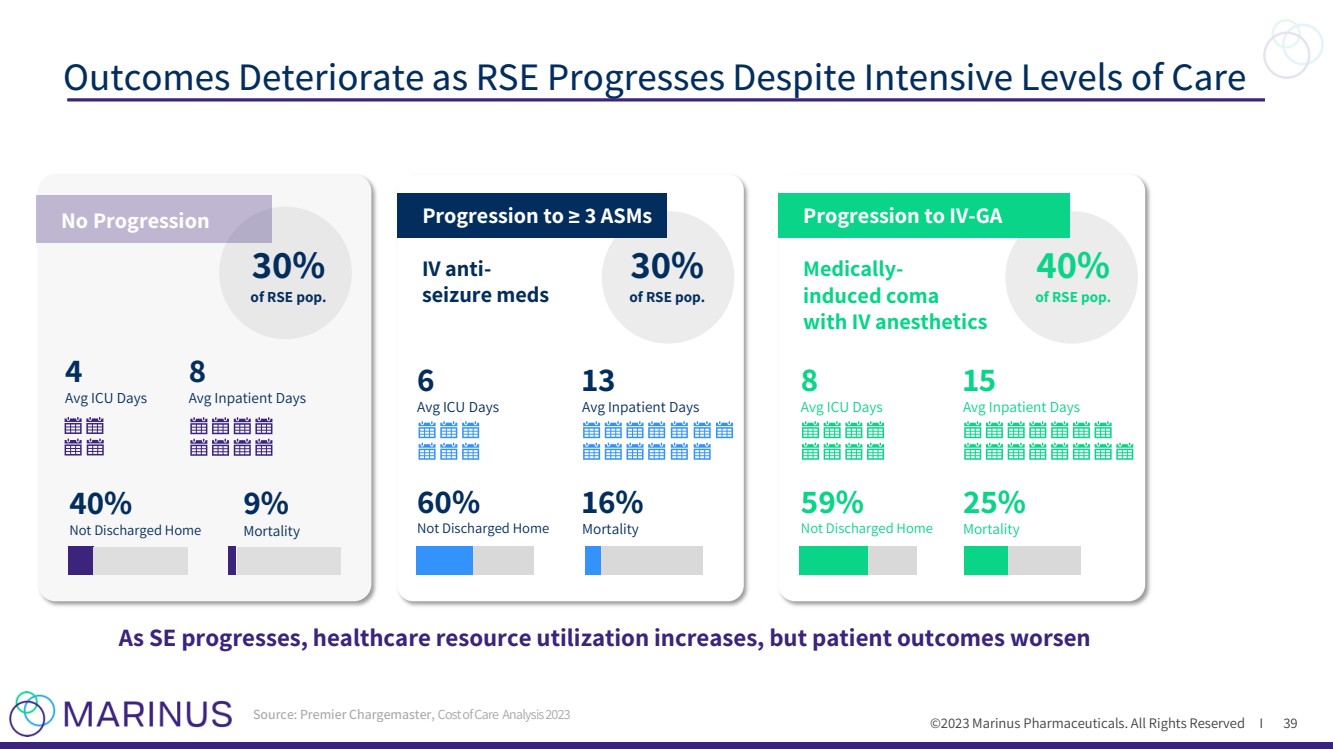
| ©2023 马里纳斯制药公司。版权所有 I 尽管采取了重症监护水平,但随着 RSE 的进展,预后会恶化 随着 SE 的进展,医疗资源利用率的提高,但患者预后会恶化 静脉注射麻醉药物 药物诱发的昏迷 静脉麻醉剂 13 次平均值患者天数 16% 死亡率 8 天平均重症监护病房 59% 未出院回家 15 天平均住院天数 25% 死亡率 pop。 40% RSE pop。 进展至 IV-GA 来源:Premier Chargemaster,《2023 年护理费用分析》39 4 天 8 天平均住院天数 40% 未出院回家 9% 死亡率 pop。 没有进度 39 |
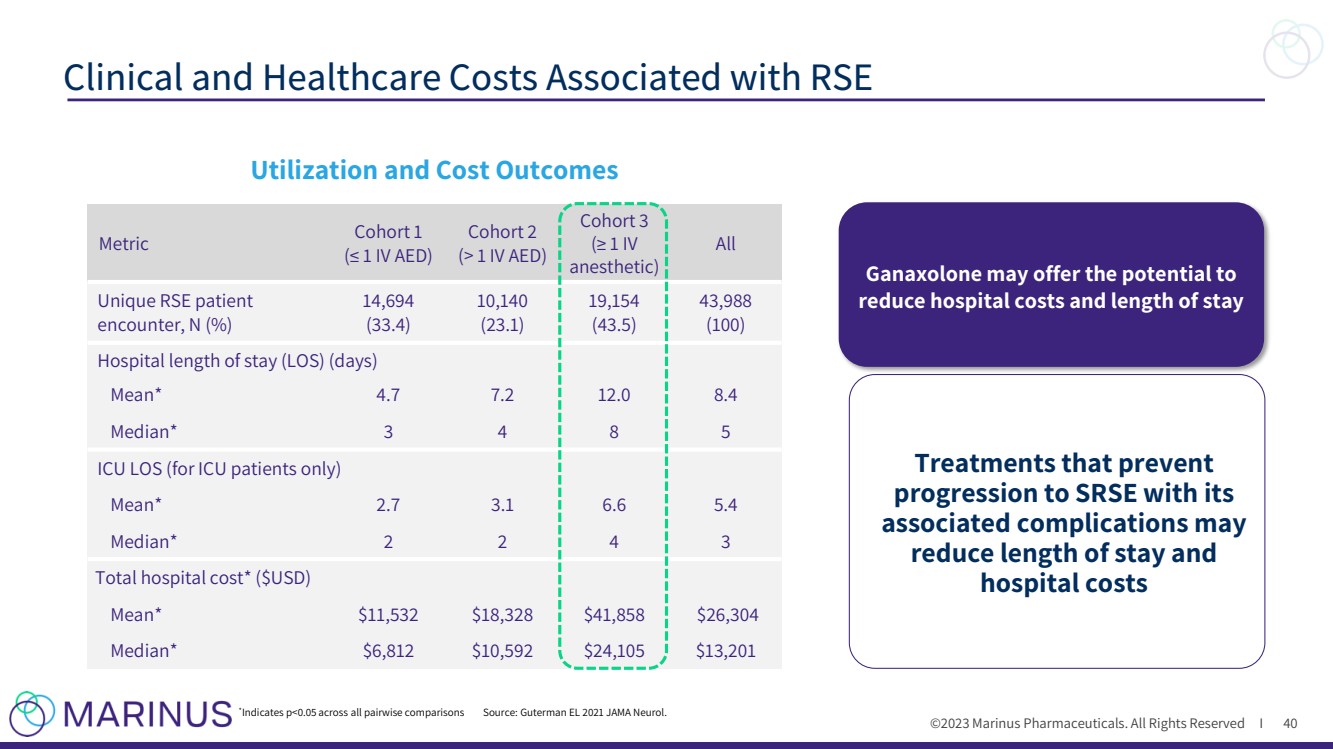
| ©2023 马里纳斯制药公司。版权所有 I 与 RSE 相关的临床和医疗保健成本 40 利用率和成本结果 指标队列 1(≤ 1 静脉注射 AED) 队列 2(> 1 静脉注射 AED) 队列 3(≥ 1 静脉注射 麻醉剂) 10,140 (23.1) 19,154 (43.5) 43,988 (100) 住院时间(LOS)(天) 平均值* 4.7 7.2 12.0 8.4 中位数* 3 4 8 5 重症监护病房工作量(仅限重症监护病房患者) 平均值* 2.7 3.1 6.6 5.4 中位数* 2 2 4 3 总住院费用*(美元) Mean* 11,532 美元 18,328 美元 41,858 美元 26,304 美元 Median* 6,812 美元 10,592 美元 24 美元,105 美元 13,201 * 表示 p |
| 财务更新 |
| ©2023 马里纳斯制药公司。版权所有 I 财务概述 42 位分析师报道*: Cantor Fitzgerald:查尔斯·邓肯博士 Cowen:约瑟夫·托姆博士 H.C. Wainwright & Co:曹道格拉德 杰富瑞:蔡安德鲁 JMP 证券:杰森·巴特勒博士, 拉登堡塔尔曼:迈克尔·海尔曼金斯 奥本海默:杰伊·奥尔森 加拿大皇家银行:布莱恩·亚伯拉罕斯 RW Baird:Brian Skorney SVB Securities:Marc Goodman Truist:Joon Lee,M.D.,Ph.D. *注意:个别分析师对马里努斯的看法、估计和预测不代表观点、估计和对马里努斯的预测。上述 列表并不意味着认可或赞同他们的信息、结论或建议。 投资者关系 — 纳斯达克:MRNS 2023 年全年指引 收入: • ZTALMY® 净产品收入:1850 美元至 1,900 万美元 • BARDA 收入:1100万美元至1200万美元 运营支出 1.58亿美元至1.62亿美元;包括约1,600万美元的非现金股票基于薪酬 财务摘要(截至 2023 年 9 月 30 日): • 1.764 亿美元的现金、现金等价物和短期 投资 • 现金流入 2024 年第四季度 • 7,500 万美元的债务;利息仅至 2024 年 5 月,2026 年到期 • 5,460 万美元已发行股份;按全面 摊薄法计算的6,510万股股票1 1 全面摊薄总额包括预先融资的认股权证和已发行股票期权以及RSU的影响 |
| ©2023 马里纳斯制药公司。版权所有 I 推动ZTALMY®(ganaxolone)的全球准入 43 欧洲:与猎户座公司在CDD、TSC、RSE上签订合作协议 • 高达9000万欧元的开发、商业和销售里程碑1;分级特许权使用费低至青少年(口服停药)和低20多岁(IV) 中国:与Tenacia Biotechology签订合作协议,在CDD、TSC、SE中开发ganaxolone • 高达2.56亿美元的开发、商业和销售里程碑2;分级两位数特许权使用费 MENA:分销协议与Biologix Fzco合作开发ganaxolone • 具有监管里程碑的收益分享安排 日本:目标是在2024年下半年达成合作协议 Marinus 准入计划 计划于2023年第四季度启动,旨在扩大与CDD相关的相应癫痫发作患者在非合作市场进入ZTALMY的机会 1前提是与CDD相关的某些临床和商业上市里程碑的实现, TSC,以及口服和静脉注射产品的RSE和年化销售门槛 2视CDD的监管批准而定TSC |
| 知识产权 |
| ©2023 马里纳斯制药公司。版权所有 I 多层潜在保护 45 种 CDD 和 PCDH19 的孤儿药名称分别在美国和欧盟提供 7 年和 10 年的监管独家经营权。 SE 的孤儿药指定在美国提供 7 年的监管排他性 美国专利/专利申请到期日期 癫痫状态 使用方法 已获准使用更广泛加那唑酮剂量的临床疗法的专利 2040 SRSE 和 ESE 2041/2042 配方给药方案的申请待批 许可证 Sol® 专利 2033 年前,静脉注射配方的申请待批 2036 CDKL5 缺陷症 治疗癫痫疾病的专利已获授予(许可)2037给药方案申请待批 2038/2041/2042 配方专利(口服混悬液)2031(如获得 PTE 批准) 结节性硬化症复合物 治疗中毒相关癫痫的方法获得专利 2040 新给药方案申请待批 2041/2042 配方专利(口服混悬液)2031(如获得 PTE 批准) 第二代 Gant axolone 第二代配方的配方申请待定 2042/2043 |
| 附录 |
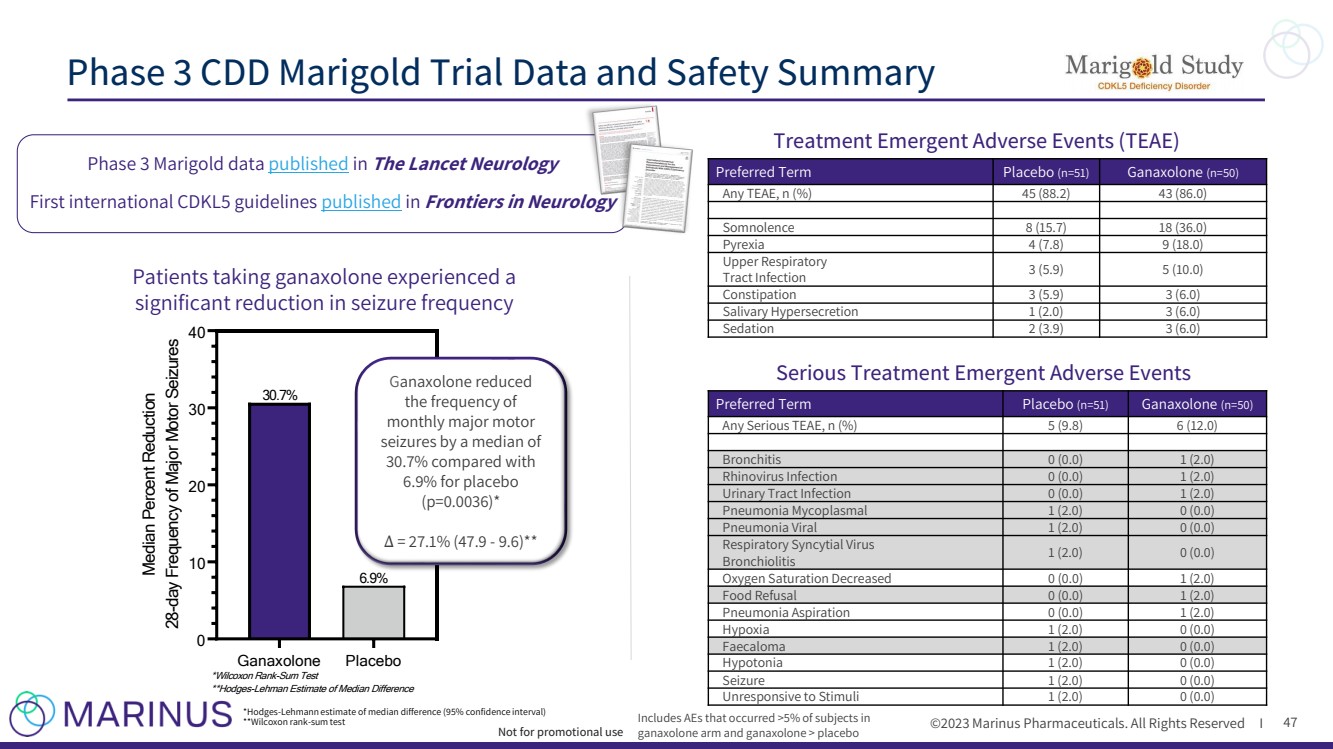
| ©2023 马里纳斯制药公司。版权所有 I 47 Ganaxolone 安慰剂 0 10 20 30 40 中位数降低 28 天严重运动性发作频率 30.7% 6.9% *Wilcoxon 排名和测试 **Hodges-Lehman 对中位数差异的估计 ganaxolone 每月大动作 的发作频率中位数为 30.7%,而安慰剂 的发作频率为 6.9% (p=0.0036) * Δ= 27.1% (47.9-9.6) ** *霍奇斯-莱曼中位数差估计值(95% 置信区间) **Wilcoxon rank-sum test 发表在《柳叶刀神经病学》上的第一份国际 CDKL5 指南 发表在《神经病学前沿》上的首份国际指南 万寿菊试验数据和安全摘要 不用于促销用途 治疗紧急不良事件 (TEAE) 首选术语安慰剂 (n=51) 甘那索龙 (n=50) 任何 TEE AE,n (%) 45 (88.2) 43 (86.0) 睡意 8 (15.7) 18 (36.0) Pyrexia 4 (7.8) 9 (18.0) 上呼吸道感染 3 (5.9) 5 (10.0) 便秘 3 (5.9) 3 (6.0) 唾液分泌过多 1 (2.0) 3 (6.0) 镇静剂 2 (3.9) 3 (6.0) 包括 ganaxolone 组中发生超过 5% 的不良反应和加那索龙 > 安慰剂 首选术语安慰剂 (n=51) ganaxolone (n=50) Any Serious Teae,n (%) 5 (9.8) 6 (12.0) 支气管炎 0 (0.0) 1 (2.0) 鼻病毒感染 0 (0.0) 1 (2.0) 尿路感染 0 (0.0) 1 (2.0) 肺炎支原体 1 (2.0) 0 (0.0) 肺炎病毒 1 (2.0) 0 (0.0) 血氧饱和度降低 0 (0.0) 1 (2.0) 食物拒绝 0 (0.0) 1 (2.0) 肺炎吸入 0(0.0) 1 (2.0) 缺氧 1 (2.0) 0 (0.0) 粪便 1 (2.0) 0 (0.0) 肌张力低下 1 (2.0) 0 (0.0) 发作 1 (2.0) 0 (0.0) 严重治疗紧急不良事件 |
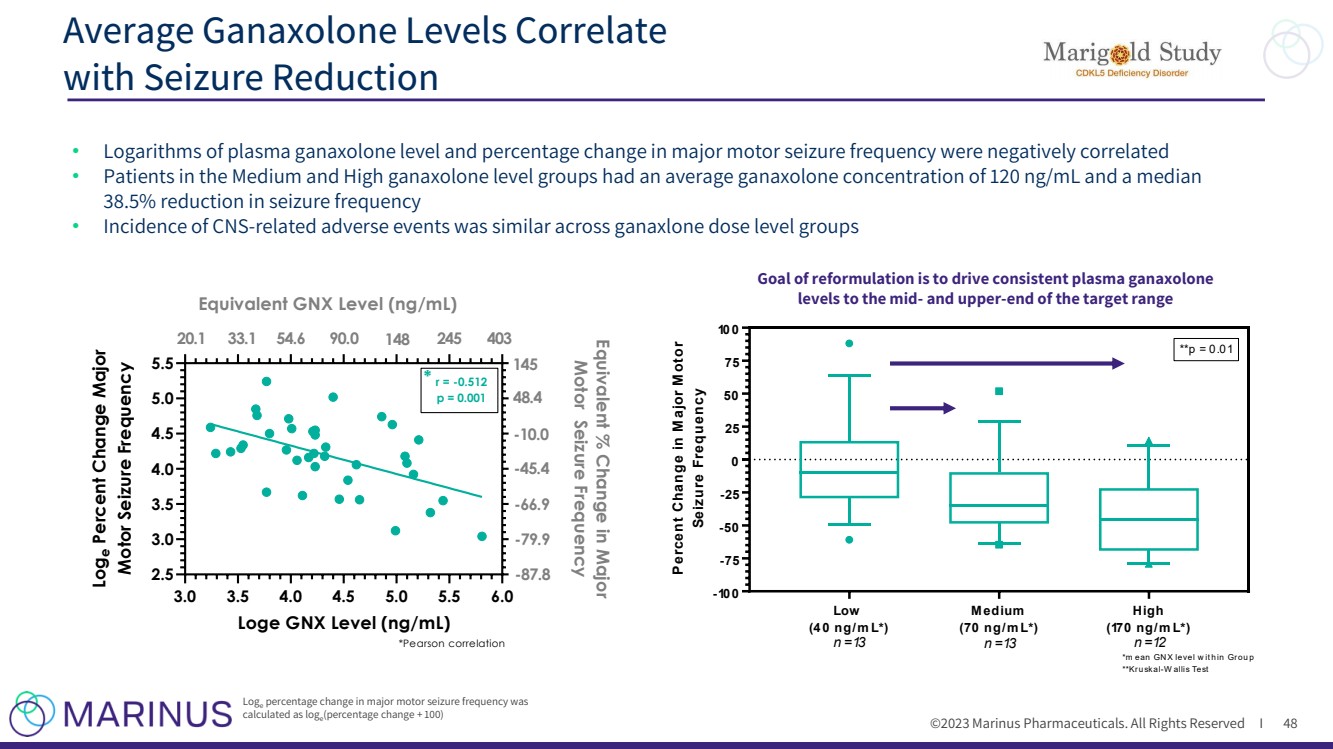
| ©2023 马里纳斯制药公司。版权所有 I ganaxolone 的平均水平与 的发作减少相关 48 • 血浆甘那唑酮水平的对数和主要运动发作频率的变化百分比呈负相关 • 中高水平组患者的平均加那索隆浓度为 120 ng/mL,发作频率中位数降低 38.5% • 发生率的中枢神经系统相关不良事件在ganaxlone剂量水平组中相似 Loge 主要运动发作频率的变化百分比为 ,计算方法为 loge (百分比变化 + 100) 3.0 4.0 4.0 5.0 5.0 2.5 3.0 3.0 4.0 4.0 5.0 5.0 Loge GNX 等级 (ng/mL) Loge 运动发作频率变化百分比 r = -0.512 p = 0.001 *皮尔森相关性 * 145 -10.0 -45.4 -66.9 -89.9 -89.9 7.8 等效 GNX 等级 (ng/mL) 20.1 33.1 54.6 90.0 148 245 403 低 (40 ng/m L*) 中等 (70 ng/m L*) 高 (170 ng/m L*) -100 -75 -50 -25 50 75 100% 的变化 **p = 0.01 *m ean GNX 等级 w it h 在群组 p **Kruskal-w allis 测试 n =13 n =13 n =12 重新配方的目标是将稳定的血浆伽那唑酮 水平提高到目标范围的中端和上端 |
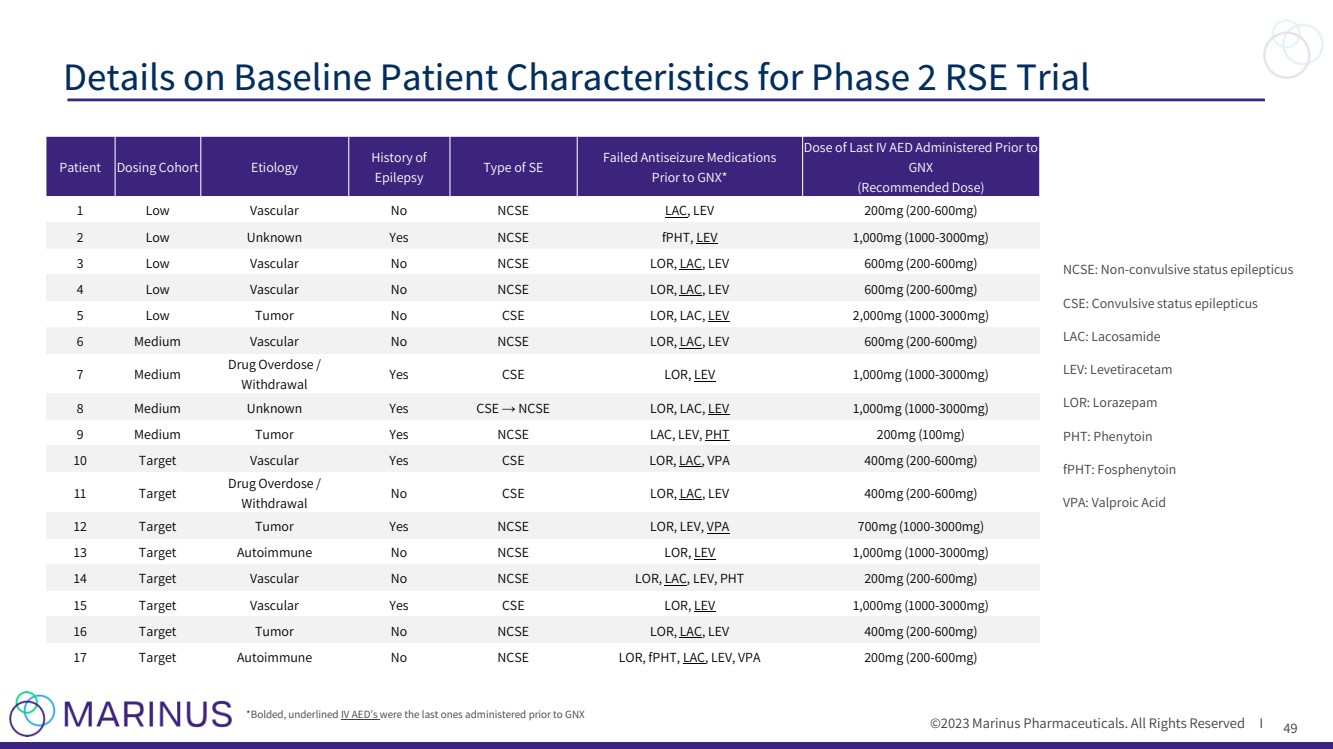
| ©2023 马里纳斯制药公司。版权所有 I 49 第 2 期 RSE 试验基线患者特征详情 NCSE:非惊厥性癫痫持续状态 病例:惊厥癫痫持续状态 LAC:拉科酰胺 LEV:左乙拉西坦 LOR:劳拉西泮 PHT:苯妥英 fpHT:氟苯妥英 } VPA:丙戊酸 *粗体,带下划线的静脉注射 AED 是 GNX 之前最后一次使用的 患者给药队列病因 癫痫病史 在 GNX* 之前 SE 失败的抗惊厥药物类型 * (推荐剂量) 1低血管 NCSE LAC、LEV 200mg (200-600mg) 2 低位未知是 NCSE fpHT、LEV 1,000mg (1000-3000mg) 3 低血管无 ncse LOR、LAC、LEV 600mg(200-600mg) 5 低血管没有 CSE LOR,LAC,LEV 2,000mg(1000-3000mg) 6 中等血管不是 NCSE LOR、LAC、LEV 600mg(200-600mg) 7 中等 药物过量服用/ 戒断 是 CSE LOR,LEV 1,000mg(1000-3000mg) 8 中度未知是的案例 → NCSE LOR、LAC、LEV 1,000mg (1000-3000mg) mg) 9 中型肿瘤是的 NCSE LAC、LEV、PHT 200mg (100mg) 10 目标血管是 CSE LOR、LAC、VPA 400mg (200-600mg) 11 目标 药物过量/ 戒断 没有 CSE LOR、LAC、LEV 400 mg (200-600mg) 12 靶向肿瘤是 NCSE LOR、LEV 700mg (1000-3000mg) 13 靶标自身免疫不是 NCSE LOR、LEV 1,000mg (1000-3000mg) -3000mg) 14 靶血管没有 NCSE LOR、LAC、LEV、PHT 200 mg (200-600mg) 15 靶血管是 CSE LOR、LEV 1,000mg (1000-3000mg) 16 靶肿瘤没有 NCSE LOR、fpHT、LAC、LEV、Vbr} 17 靶向自身免疫没有 NCSE LOR、fpHT、LAC、LEV PA 200mg (200-600mg) |
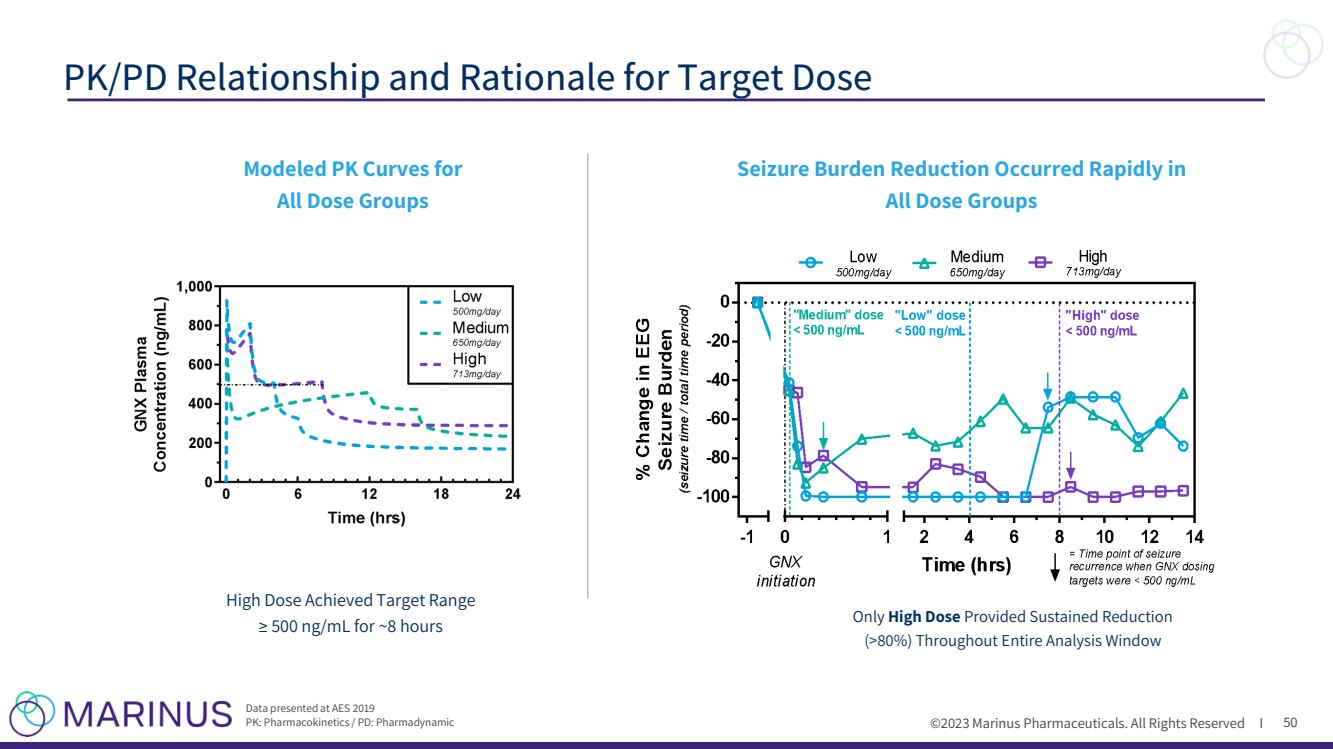
| ©2023 马里纳斯制药公司。版权所有 I 50 PK/PD 的关系和理由 所有剂量组 建模 PK 曲线 高剂量达到目标范围 ≥ 500 ng/mL 持续大约 8 小时只有高剂量持续减少 (> 80%) 在 AES 2019 PK 上公布的数据:药代动力学/PD:Pharmadynamic 发作负担迅速减轻在 所有剂量组中 |
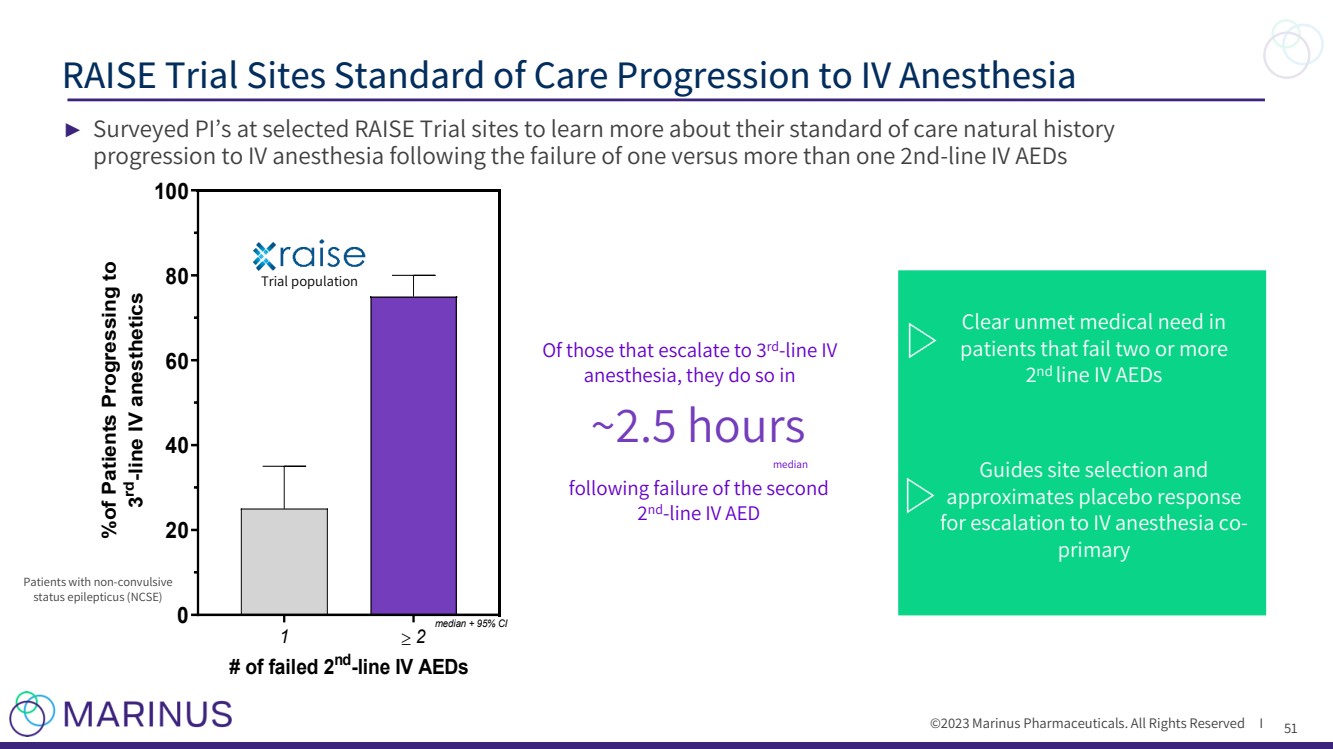
| ©2023 Marinus Pharmaceuticals. All Rights Reserved I 51 RAISE Trial Sites Standard of Care Progression to IV Anesthesia ► Surveyed PI’s at selected RAISE Trial sites to learn more about their standard of care natural history progression to IV anesthesia following the failure of one versus more than one 2nd-line IV AEDs Trial population Of those that escalate to 3rd -line IV anesthesia, they do so in ~2.5 hours following failure of the second 2 nd -line IV AED Clear unmet medical need in patients that fail two or more 2 nd line IV AEDs Guides site selection and approximates placebo response for escalation to IV anesthesia co-primary Patients with non-convulsive status epilepticus (NCSE) median 1 2 0 20 40 60 80 100 # of failed 2 nd -line IV AEDs %of Patients Progressing to 3 rd -line IV anesthetics median + 95% CI |
| ©2023 Marinus Pharmaceuticals. All Rights Reserved I RAISE Protocol Amended to Accelerate Enrollment 52 Original Protocol Amended Protocol Patients excluded IF SE would NOT warrant anesthesia for the next 24 hours IV anesthesia would likely be next treatment if study drug (ganaxolone or placebo) does not control SE Treatment of the current SE episode w/ IV anesthetics at adequate dose and duration to induce anesthesia IV anesthesia (any dose/any indication) for less than 18 hours* Benzodiazepine(s) and two or more second-line IV AEDs At least two or more treatments, either: 1. Benzodiazepine(s) + > 1 IV AED 2. > 2 IV AEDs At least 6 minutes of seizure activity in the 30-minute period prior to study drug initiation (20% seizure burden) At least 6 minutes of seizure activity in any 30 minutes within one hour of study drug initiation Ceribell rapid EEG permitted for screening only Ceribell rapid EEG permitted for study qualification and determination of EEG cessation (1st co-primary endpoint) |
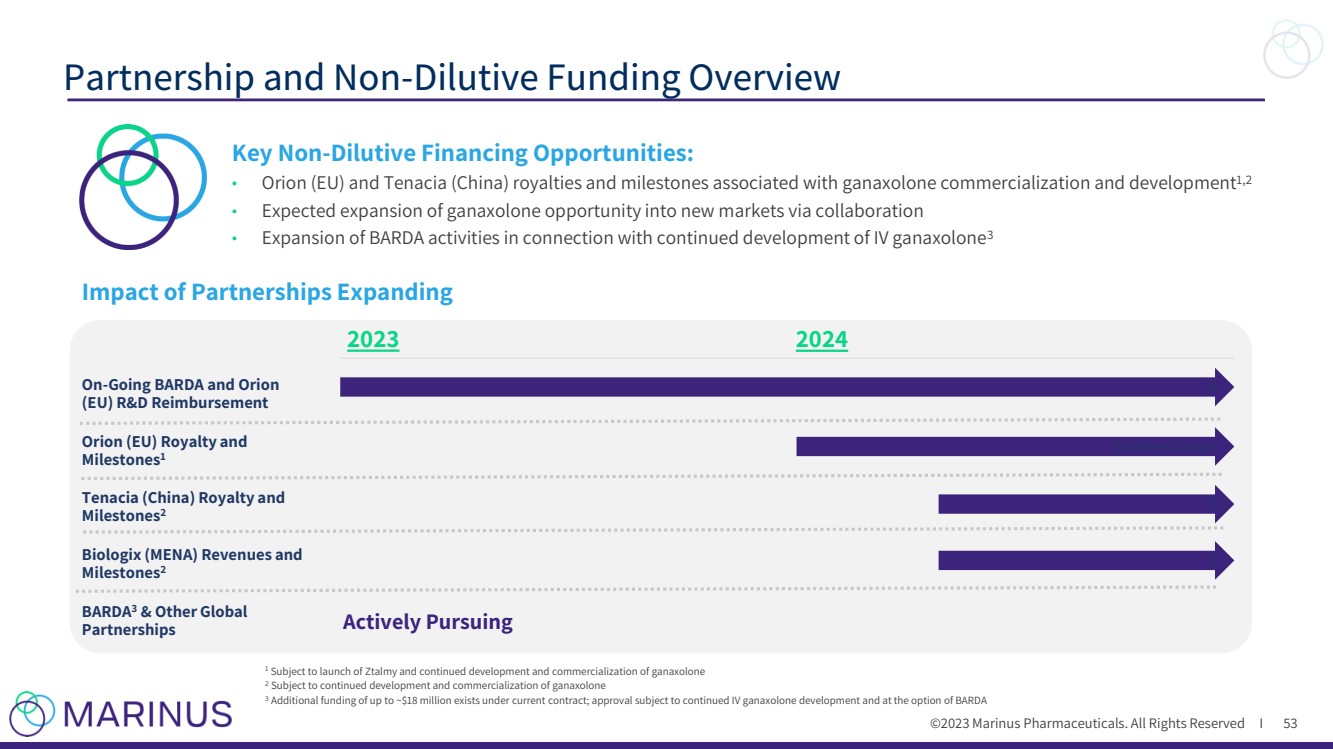
| ©2023 Marinus Pharmaceuticals. All Rights Reserved I Partnership and Non-Dilutive Funding Overview 53 1 Subject to launch of Ztalmy and continued development and commercialization of ganaxolone 2 Subject to continued development and commercialization of ganaxolone 3 Additional funding of up to ~$18 million exists under current contract; approval subject to continued IV ganaxolone development and at the option of BARDA Key Non-Dilutive Financing Opportunities: • Orion (EU) and Tenacia (China) royalties and milestones associated with ganaxolone commercialization and development1,2 • Expected expansion of ganaxolone opportunity into new markets via collaboration • Expansion of BARDA activities in connection with continued development of IV ganaxolone3 Impact of Partnerships Expanding $ 2023 2024 On-Going BARDA and Orion (EU) R&D Reimbursement Orion (EU) Royalty and Milestones1 $Oaktree Capital Tenacia (China) Royalty and Milestones2 $ BARDA3 & Other Global Partnerships Actively Pursuing Biologix (MENA) Revenues and Milestones2 $ |