附录 99.4

1 公司简报 GH Research PLC(纳斯达克股票代码:GHRS)2023 年 11 月 GH Research PLC

关于前瞻性陈述的免责声明本演示文稿
由GH Research PLC(“GH Research”)编写,仅供参考,不用于任何其他目的。本演示文稿中包含的任何内容均不是,也不应被解释为
主持人或 GH Research 的任何董事、员工、代理人或顾问的推荐、承诺或陈述。本演示文稿并不旨在包罗万象,也不是要包含您可能想要的所有信息。本演示文稿不构成
出售要约或招揽购买证券的要约,在根据任何此类州或司法管辖区的证券法进行注册或
资格之前,此类要约、招标或销售属于非法的任何州或司法管辖区,也不得出售这些证券。本演示文稿包含前瞻性陈述,本警示声明对所有这些陈述进行了全面限定。此处包含的许多前瞻性
陈述可以通过使用 “可能”、“预期”、“相信”、“可以”、“期望”、“应该”、“计划”、“打算”、“估计”、“将”、“潜在” 和 “持续” 等前瞻性词语来识别,尽管并非所有前瞻性陈述都包含这些识别词。此处包含的任何未描述历史事实的陈述均为前瞻性陈述,这些陈述基于管理层的预期,并受某些因素、风险和不确定性的影响,这些因素、风险和不确定性可能导致实际业绩、结果、时机和业绩与此类陈述所表达或暗示的存在重大差异。这些因素、风险和不确定性
包括但不限于:与GH Research的研发工作相关的成本和不确定性;与GH Research候选产品的非临床和临床
研究的进行、时间和结果相关的固有不确定性;GH Research 对 GH001 IND 的临床搁置的期望,包括推进任何非临床项目和任何其他提升临床
稳定的工作的计划和预期,解除这种临床控制所需的时机以及与FDA的讨论以及此类讨论的结果和解决方案;GH Research获得、维护、执行和捍卫已颁发专利的能力;
GH Research资本资源的充足性、额外资金的可用性以及GH Research向美国证券交易委员会提交的文件中描述的其他因素、风险和不确定性。
除非另有说明,否则这些前瞻性陈述仅代表截至本演示之日,GH Research没有义务更新或修改任何此类陈述以反映本演示后发生的事件或情况
。由于前瞻性陈述本质上会受到风险和不确定性的影响,其中一些无法预测或量化,有些则超出了GH Research的控制范围,因此
不应依赖这些前瞻性陈述作为对未来事件的预测。任何此类前瞻性陈述中反映的事件和情况都可能无法实现或发生,实际结果可能与前瞻性陈述中预测的
存在重大差异。GH Research 提醒你不要过分依赖本演示文稿中包含的前瞻性陈述。2023© GH Research PLC 2
关于前瞻性陈述的免责声明本演示文稿由GH Research PLC(“GH Research”)编写,仅供参考,不用于任何其他目的。本演示文稿中包含的任何内容都不是或不应被解释为主讲人或GH Research的任何董事、员工、代理人、
或顾问的推荐、承诺或陈述。本演示文稿并不旨在包罗万象,也无意包含您可能想要的所有信息。本演示文稿不构成出售要约或征求购买
证券的要约,在根据任何此类州或
司法管辖区的证券法进行注册或获得资格之前,此类要约、招标或出售属于非法的任何州或司法管辖区也不得出售这些证券。2 本演示文稿包含前瞻性陈述,所有这些陈述均由本警示声明完全限定。此处包含的许多前瞻性陈述可以通过使用
个前瞻性词语来识别,例如 “可能”、“预期”、“可以”、“应该”、“计划”、“打算”、“估计”、“将”、“潜在” 和 “持续” 等,尽管并非所有前瞻性陈述都包含这些识别性词语。此处包含的任何未描述历史事实的陈述均为前瞻性陈述,这些陈述基于管理层的预期,受某些因素、风险和不确定性的影响,这些因素、风险和不确定性可能导致
的实际业绩、结果、时机和业绩与此类陈述所表达或暗示的结果存在重大差异。这些因素、风险和不确定性包括但不限于:与GH
Research的研发工作相关的成本和不确定性;与GH Research候选产品的非临床和临床研究的进行、时间和结果相关的固有不确定性;GH Research获得、维护、
执行和捍卫已颁发专利的能力;GH Research 资本资源的充足性、额外资金的可用性以及 GH Research 的现金渠道;以及描述的其他因素、风险和不确定性在 GH Research 向
美国证券交易委员会提交的文件中。除非另有说明,否则这些前瞻性陈述仅代表截至本演示之日,GH Research没有义务更新或修改任何此类陈述以反映本演示后发生的事件或情况。由于前瞻性陈述本质上会受到风险和不确定性的影响,其中一些无法预测或量化,有些则超出了GH
Research的控制范围,因此您不应依赖这些前瞻性陈述作为对未来事件的预测。任何此类前瞻性陈述中反映的事件和情况都可能无法实现或发生,实际结果可能与前瞻性陈述中的预测存在重大差异。GH Research 提醒你不要过分依赖本演示文稿中包含的前瞻性陈述。2023© GH Research PLC 2

在抑郁症中寻求超快速、持久的缓解 3 2023© GH Research PLC 3

开发阶段项目适应证临床前 1 期
2a 期 2b 期 3 期当前状态 gh001mebufotenin (5-meo-DMT) 用于吸入给药的耐药性抑郁症 (TRD) 2b 期 RDBPC 试验启动 (GH001-TRD-201) 双极 II 型障碍* (BDII) 2a 期 POC 试验
启动 (GH001-BD-202) 产后抑郁症 (PPD) 2a 期 POC 试验已启动 (GH001-PPD-203) 用于静脉注射的 gh002mebufotenin (5-meo-DMT) 精神或神经系统疾病 1 期 HV 试验
已启动 (GH002-HV-105) gh003mebufotenin (5-meo-DMT) 用于鼻腔给药精神或神经系统疾病临床前研发正在进行中 Pipeline 2023© GH Research PLC *目前有重度
抑郁发作的双相情感障碍 5-meo-dmt、5-甲氧基-N、N-二甲基色胺;静脉注射;RDBPC,随机,双盲,安慰剂对照;POC,概念验证;HV,健康志愿者完成中 4
开发阶段项目适应证临床前阶段 1 期 2a 期 2b 期 3 期当前状态 gh001mebufotenin
(5-meo-DMT) 用于吸入给药耐药性抑郁症 (TRD) 2b 期 RDBPC 试验启动 (GH001-TRD-201) 双极 II 型障碍* (BDII) 2a 期 POC 试验启动 (GH001-BD-202) 产后抑郁症 (PPD) 2a 期
POC 试验已启动 (GH001-PPD-203) 用于静脉注射的 gh002mebufotenin (5-meo-DMT) 精神或神经系统疾病 1 期 HV 试验已启动 (GH002-HV-105) gh003mebufotenin (5-meo-DMT) 用于鼻腔给药精神病或
神经系统疾病临床前开发正在进行中 Pipeline 4 2023© GH Research PLC *目前有重度抑郁发作的双相情感障碍 5-meo-dmt、5-甲氧基-N、N-二甲基色胺;静脉注射;RDBPC,随机注射,
双盲,安慰剂对照;POC,概念验证;HV,健康志愿者完整版正在进行中 4

...以 TRD 为单位的缓解率

欧盟和美国庞大而开放的抑郁症市场 6 一线 MDD 二线 MDD 耐药性抑郁症
(TRD) 患者循环使用无效的 TRD 治疗已诊断:约 4,800 万人接受治疗(药物治疗 ± 心理治疗):约 2400 万对第一线无反应:约 1300 万条公司估计,基于:
https://www.nimh.nih.gov/health/statistics/major-depression.shtml;Wittchen 等人,规模和负担《2010 年欧洲精神障碍和其他脑部疾病》,《欧洲神经心理药理学》(2011);Rush 等人,需要一个或多个治疗步骤的抑郁门诊患者的急性和
长期预后:STAR*D 报告,Am J Psychiatry 2006MDD,重度抑郁症 2023© GH Research PLC 6

Mebufotenin(5-甲氧基-N、N-二甲基色胺、5-meo-DMT)来自色胺的天然精神活性物质
类对 5-HT1A 和 5-HT2A 受体 GH001 的高效激动剂(通过专有的肺部吸入方法给药 Mebufotenin)起病速度超快(在几秒钟内)、持续时间短(5 到 30 分钟)极易诱发峰值体验(PE),可能是治疗效果的替代标志物每日个性化给药方案(IDR),可最大限度地提高超快速和持久的缓解效果 Single初次就诊
次治疗,无需结构化心理治疗可能方便且不经常进行二次治疗 Mebufotenin (5-meo-DMT) 和 GH001 7 2023© GH Research PLC 甲布福汀 (5-meo-DMT) 基础 IP 7

GH001 单剂量:人际差异 GH001 个性化给药方案 (IDR):最大限度地提高超快速和耐久性
缓解 MADRS 分数 MADRS 分数 MADRS 分数 MADRS 分数 1 剂量 1 剂量 2 剂量 1 无缓解缓解缓解假设患者 1 假设患者 2 假设患者 2 无缓解无缓解无缓解剂量 1 GH001 — 最大限度地提高超快速和持久缓解的个性化给药方案 (IDR) 8 2023© GH ResearchPLC
MADRS 分数剂量 1 MADRS,蒙哥马利-奥斯伯格抑郁评级量表 8

健康志愿者的 1 期试验 GH001-HV-101(已完成)9 ClinicalTrials.gov ID:NCT04640831 2023© GH Research PLC
9

GH001 第 1 天给药第 7 天 GH001 2 mg (n=4) GH001 6 mg (n=6) GH001 12 mg (n=4) GH001 18 mg (n=4) HV (n=18) 部分
A(单剂量)B 部分(IDR)主要终点:第 7 天之前的安全峰值体验量表(PE 量表)1 HV(n=4)主要终点:第 7 天之前的安全峰值体验量表(PE 量表)) 1 GH001 IDR6、12、18 mg 达到 PE(最多 3 剂,间隔 3 小时)关键评估安全 PE 量表认知功能安全性认知功能 1PE 量表通过将视觉模拟量表标记为 0 到 100 之间的视觉模拟量表来平均受试者得分的答案以下
三个问题:1.体验有多激烈;2.你在多大程度上失去了控制;3.这段经历有多深刻(即深刻和重要)?健康志愿者 (GH001-HV-101) 10 2023© GH
Research PLC HV,健康志愿者;PE,Peak Experience;IDR,个性化给药方案 10

研究安全组综述否所有 ADR 均为轻度,两种中度除外 (*) 所有 ADR 均自发消退吸入
耐受性良好,除了给药 GH001 后不久心率和血压出现暂时性的、与临床无关的升高外,安全实验室
分析、精神安全评估或认知功能测量 ADR A 部分(单剂量)B 部分(IDR)没有临床显著变化 ADRs 2 mg (n=4) 6 mg (n=6) 12 mg (n=4) 18 mg (n=4) IDR1 (n=4) MedDra 的首选术语数
事件 n n n n 异常梦想 1 焦虑 1 1 笨拙 1 混乱状态 1 欣快情绪 1 疲劳 1 1* 感觉
热 1 倒叙 1 幻觉 1 头部不适 1 头痛 2 1 1 心率加快 1* 听觉过敏 1 失眠 1 精神
疲劳 1 恶心 2 1 1 2 视力模糊 1 A 部分(单剂量)和 B 部分(IDR)— 安全 11 2023© GH Research PLC 16 mg (n=1);6-12 mg (n=2);6-12-18 mg (n=1) SAE,严重不良事件;ADR、不良
药物反应、与研究产物关系代码为确定、可能或的不良事件可能,或者缺少代码的地方;IDR,个性化给药方案 11

平均剂量组 PE 量表 peThreshold A 部分 — 峰值体验 (PE) 剂量效应和人际差异 12 PE,
Peak Experience 2023© GH Research PLC 12

peThreshold B 部分 — 盘中个性化给药方案 (IDR) 的峰值体验 (PE) 影响 13 PE,Peak Experience 2023©
GH Research PLC 13

耐药性抑郁症 GH001-TRD-102 的 1/2 期试验(已完成)14 ClinicalTrials.gov ID:NCT04698603 2023© GH
Research PLC 14

关键评估 MADRS H2 PE Scale 安全 MADRS D1 认知功能安全 MADRS D7 认知
功能安全 GH001 管理第 1 天第 7 天 TRD 第 1/2 期试验的设计 (GH001-TRD-102) 15 1定义为对至少两个足够的药物疗程或一个足够疗程的
药物治疗以及至少一个足够的循证心理治疗疗程 2023© GH Research PLC 第 1 阶段(单剂量)第 2 阶段 (IDR) GH001 12 mg (n=4) GH001 18 mg (n=4) TRD1 (n=8) 主要终点:直到天都是安全的
7 TRD1 (n=8)主要终点:MADRS 缓解第 7 天 (MADRS≤10) GH001 IDR6、12、18 mg 达到 PE(最多 3 剂,间隔 3 小时)TRD,耐药性抑郁症;PE,Peak Experience;MADRS,蒙哥马利-奥斯伯格抑郁评级
量表;IDR,个性化给药方案;H,小时;D,第 15 天

第 1 阶段(单剂量)和第 2 阶段(IDR)— Safety 16 2023© GH Research PLC 研究安全小组审查否所有 ADR 均为轻度,
除三种中度外* 所有 ADR 均自发消退吸入耐受性良好,除了
给药 GH001 后不久心率和血压暂时升高无临床意义的安全实验室分析,精神病学安全评估或认知功能测量没有与自杀意念或自杀有关的安全信号行为,基于 C-SSRS
和 MADRS 子评分项目 “自杀念头” ADR 第 1 阶段(单剂量)第 2 阶段(IDR)ADR 12 mg(n=4)18 mg(n=4)IDR1(n=8)MedDra 首选术语事件数量 n n 腹部不适 1 焦虑 2 抑郁
症状 1* 头晕 1 倒叙 1 1 2 头痛 2 1 3 肌肉不适 1 肌肉痉挛 1 恶心 2* 感觉异常 1 感官障碍 3 16-12 mg (n=6);6-12-18 mg
(n=2) SAE,严重不良事件;ADR,药物不良反应,与研究产品相关代码的不良事件明确、可能或可能的,或者代码缺失的地方;IDR,个性化给药方案;
C-SSRS,哥伦比亚自杀严重程度评级量表;MADRS,蒙哥马利-奥斯伯格抑郁评级表 16

MADRS 缓解/反应/改善率第 7 天第 1 阶段(单剂量)— 功效(MADRS)17 PE,峰值体验;MADRS,
蒙哥马利—奥斯伯格抑郁评级 scaleMadrs 缓解率 = MADRS 缓解率 ≤10;MADRS 任何改善 = 与 MADRS 基线相比有任何降低。2023© GH Research PLC 2 of 4 (50%) 在
组中,12 mg 组和 18 mg 组中 4 人中有 1 人(25%)在第 7 天获得 MADRS 缓解,8 名患者中有 2 名患有 PE,且均在第 7 天获得 MADRS 缓解 17

第 2 阶段 (IDR) — 疗效 (MADRS) 18 2023© GH Research PLC MADRS 缓解/反应/改善率第 7 天主要
终点达到:8 名患者中有 7 名(87.5%)在第 7 天获得 MADRS 缓解,p

第 2 阶段 (IDR) — 功效(MADRS 与基线相比有所变化)2023© GH Research PLC Baseline1 Hour 2 Day 1 Day
7 GH001 19 p=0.0018 p

MADRS 和 PE — 观察到第 2 阶段(IDR)与第 1 阶段(单剂量)第 2 阶段(IDR)第 1 阶段(单剂量)的结果有所改善 12 mg 第 1 阶段(单剂量)18 mg MADRS 缓解率第 7 天 87.5%(8 中的 7)50%(4 分之1)平均值 MADRS 变化第 7 天 -24.4(-76%)-21.0(-65%)-12.5 5 (-40%) Peak Experience 87.5%(8 中的 7)50%(4 分中的 2)0%(4 分中的 0)平均值
分数 90.4(最终剂量)58.2 59.1 2023© GH Research PLC 20 PE,Peak Experience;MADRS,蒙哥马利-奥斯伯格抑郁评级量表;IDR,个性化给药方案 20

健康志愿者的 1 期临床药理学试验 GH001-HV-103(已完成)21 2023© GH Research PLC
ClinicalTrials.gov ID:NCT05163691 21

GH001 给药第 7 天 GH001 6 mg(n=8+2 安慰剂)GH001 12 mg(n=8+2 安慰剂)GH001 18 mg(n=8+2 安慰剂)HV(n=30)单剂量部分 IDR HV(n=16)GH001 IDR6、12、18 mg 达到 PE(最多 3 剂,间隔 1 小时,n=8)关键评估安全药代动力学 PE 量表认知功能安全认知
功能安全性 22 天 30 GH001 IDR6、12、18 mg 达到 PE(最多 3 剂,间隔 2 小时,n=8)主要终点:甲布弗汀(5-meo-dmt)和布福汀的药代动力学特征 2023© GH Research PLC 第一期临床
药理学试验的设计健康志愿者 (GH001-HV-103) HV,健康志愿者;体育,峰值体验;IDR,个性化给药方案 22

安全审查 No SAEs 所有 ADR 均为轻度所有 ADR 均自发消退吸入耐受性良好
生命参数无明显变化,但给药 GH001 后不久心率和血压暂时无临床相关变化心电图、安全实验室分析、峰值流量、认知
功能、精神安全性评估,包括 c-SSRS 进一步结果药代动力学分析和精神作用评估 (PE Scale) 支持将个人之间的间隔缩短至 1 小时IDR 剂量
对于未来的临床试验是可行的
单剂量和 IDR — 安全性及进一步结果 23 SAE,严重不良事件;药物不良反应或 ADR,与确定的、可能的或
可能的研究产品有关联或缺失代码的不良事件;IDR,个性化给药方案;C-SSRS,哥伦比亚自杀严重程度评级表;PE,峰值体验 2023© GH Research PLC ADRs 单剂量 IDR 6 mg (n=8) 12 mg (n=8) 18 mg (n=8) 安慰剂
(n=6) 1h 间隔 (n=8) 1 2h 间隔 (n=8) 2 medDra 首选术语事件数 n n n n n n 异常梦想 1 胸部不适 1 哭泣 2 头晕 1 口干
口干 1 运动障碍 1 疲劳 1 2 1 头痛 3 1 1 1 感觉减退口服 1 睡意 1 心动过速 2 紧张 1 震颤 1 16 mg
(n=1),6-12-18 mg (n=3);6-12-18 mg (n=3) =4) 26-12 mg (n=3);6-12-18 mg (n=5) 23

耐药性抑郁症 GH001-TRD-201 的 2b 期试验(已启动)24 2023© GH Research PLC eudract 编号:
2022-000574-26 24
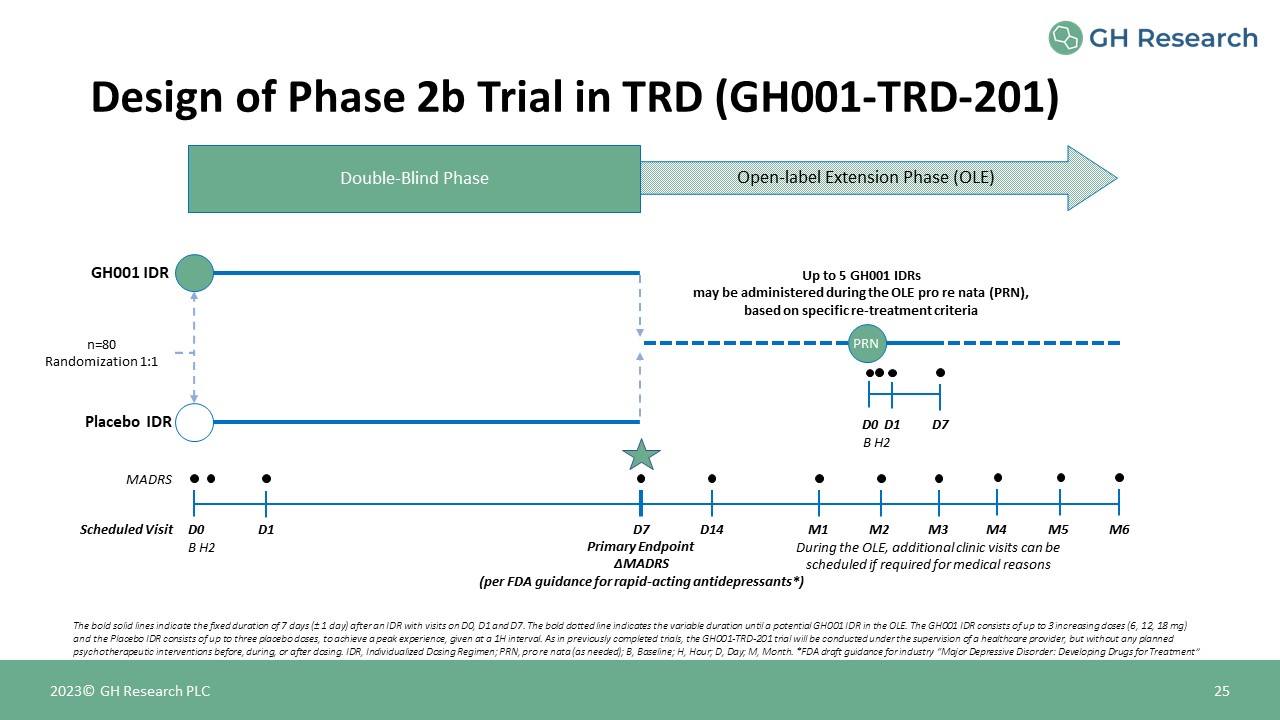
2023© GH Research PLC 25 GH001 IDR 安慰剂 IDR n=80 随机化 1:1 根据特定的再治疗标准 D0 MADRS 主要终点 ΔMADRS(根据美国食品药品管理局的速效抗抑郁药指南*)D1 D7 B H2 定期就诊双盲期开放标签延长期
(OLE) 粗体实线表示在 D0、D1 和 D7 上进行访问的 IDR 之后 7 天(± 1 天)的固定时长。GH001粗体虚线表示 OLE 中可能出现 GH001 IDR 之前的可变持续时间。GH001 IDR 包括最多
至 3 次增加剂量(6、12、18 mg),而安慰剂 IDR 包含最多三剂安慰剂,以达到最佳体验,间隔为 1H。与先前完成的试验一样,GH001-TRD-201 试验将在医疗保健提供者的监督下进行,但在给药之前、期间或之后不进行任何计划的心理治疗干预。IDR,个性化给药方案;PRN,pro re nata(视需要而定);B,基准;H,小时;D,日;M,月。*FDA
行业指南草案 “重度抑郁症:开发治疗药物” D14 M2 M3 M4 M5 M6 M1 在 OLE 期间,如果出于医疗原因需要,可以安排更多诊所就诊 D0 D1 D7 B H2 PRN Design
TRD (GH001-TRD-201)

第 1 层:监管排他性 FDA:5 年(+2.5 年 IV 期限)EMA:10 年(新适应证为 +1 年)
第 3 层:TechnicalComplex 生物等效性,具有较高主体内和受试者间变异性的第 2 层:申请的与甲布福汀(5-meo-DMT)相关的专利家族,包括:
各种新用途疾病(包括吸入、鼻腔、颊部、舌下、静脉注射、静脉注射、静脉注射、静脉注射途径)物质的新型气溶胶成分新型制造方法和新型盐形态新型设备相关方面三层
保护策略 26 2023© GH Research PLC 26

董事会和执行管理层 27 弗洛里安·舍恩哈廷迈克尔·福尔理学硕士董事会主席,
联合创始人文学士、法学学士学位董事会副主席 2023© GH Research PLC 德莫特·汉利·邓肯·摩尔理学士、工商管理硕士、MBA 董事会成员 Theis Terwey PD med Dr.首席执行官、联合创始人 Julie Ryan ACA、macC、bComm 财务副总裁 Magnus
Halle BSc 爱尔兰董事总经理、联合创始人 Aaron Cameron MSc、MBA 技术开发和运营规划副总裁 Velichka (Villy) Valcheva MD、MSc 临床研究和医学事务副总裁 27

科学顾问 28 迈克尔·塞斯医学博士
佩雷尔曼医学院精神病学教授
宾夕法尼亚大学马杜卡尔·特里韦迪医学博士
德克萨斯大学西南医学中心精神病学和人类行为学教授
布朗大学精神病学和人类行为学教授
医院精神病学系主任巴塞罗那教授 Michael Bauer 教授 dr. rer. nat.医学博士。
德累斯顿工业大学精神病学和心理治疗系主任 Malek Bajbouj 教授医学博士
柏林慈善机构情感神经科学中心主任 Johannes Ramaekers 教授马斯特里赫特大学心理学系和神经科学系
教授 2023© GH Research PLC
科学顾问 28 迈克尔·塞斯医学博士宾夕法尼亚大学佩雷尔曼医学院精神病学教授马杜卡尔·特里维迪医学博士德克萨斯大学西南医学中心精神病学教授马克·齐默尔曼医学博士布朗大学精神病学和人类行为学教授爱德华·维塔教授巴塞罗那诊所
精神病学科主任 Michael Bauer 教授 rer. nat.医学博士。德累斯顿工业大学精神病学和心理治疗系主任 Malek Bajbouj 教授医学博士柏林查理特情感神经科学中心主任 Johannes
Ramaekers 教授博士马斯特里赫特大学心理与神经科学系教授 2023© GH Research PLC 28

预期里程碑和财务概述 GH001 将于 2024 年第三季度在 TRD 完成欧洲多中心、随机、
双盲、安慰剂对照的 2b 期试验的双盲阶段,预计将在 2024 年第三季度或第四季度提供有关美国 IND 临床暂停和计划使用专有气雾输送
设备的 1 期临床药理学试验的最新完成时间表提供最新完成时间表 2024 年第一季度在 BDII 中进行 PPD 的 2a 期试验 GH002 在健康志愿者中完成 1 期临床药理学试验2023年第四季度 GH003 完成临床前开发财务概述截至2023年9月30日,现金、现金等价物、其他金融资产和有价证券为2.287亿美元。我们相信,现有的现金、现金等价物、其他
金融资产和有价证券将足以为2026 29年的运营费用和资本支出需求提供资金 2023 年 29 © GH Research PLC 29

在抑郁症中寻求超快速、持久的缓解 30 2023© GH Research PLC 30