
2023 年 11 月公司简报 1

前瞻性陈述 2 本演示文稿包含1995年《私人证券诉讼改革法》所指的前瞻性陈述。任何描述Acumen的目标、预期、财务或其他预测、意图或信念的陈述均为前瞻性陈述,应被视为风险陈述。诸如 “相信”、“期望”、“预期”、“可以”、“会”、“寻求”、“目标”、“计划”、“潜力”、“意愿” 等词语旨在识别前瞻性陈述,尽管并非所有前瞻性陈述都包含这些识别性词语。前瞻性陈述包括有关Acumen业务的陈述,以及Acumen实现其战略和财务目标的能力,包括其现金、现金等价物和有价证券的预计使用情况以及到2026年下半年现金资源的预期充足性、Acumen候选产品 ACU193(包括对抗其他抗体)的治疗潜力、启动 ACU193 2期临床试验的预期时间表以及支持皮下皮下皮下试验的1期试验的预期时间表 ACU 193 的买入期权,以及预期的信贷额度收益的使用。这些陈述基于Acumen管理层当前的信念和期望,受某些因素、风险和不确定性的影响,特别是在发现、开发和商业化安全有效的人类疗法过程中固有的因素、风险和不确定性。COVID-19 疫情的影响可能会加剧此类风险。Acumen向美国证券交易委员会(“SEC”)提交的文件中详细描述了与Acumen计划有关的这些风险和其他风险,包括在Acumen最新的年度报告表10-K以及Acumen未来的文件和报告中。这些文件和其他文件的副本可从Acumen获得。其他信息将在Acumen不时向美国证券交易委员会提交的其他文件中提供。这些前瞻性陈述仅代表截至本文发布之日,Acumen明确表示没有义务更新或修改任何前瞻性陈述,除非法律另有要求,无论是由于新信息、未来事件还是其他原因。在本演示文稿中,提及的现金还包括现金等价物。

3 推进针对早期阿尔茨海默氏病 (AD) 的潜在同类最佳抗体产品 • 市场庞大 • 需求未得到满足 • 最近的科学和监管势头 • β淀粉样低聚物 (AβOS) 被公认为毒性最强的 Aβ 形式 • ACU193:首款选择性靶向 AβOS 的临床阶段单克隆抗体 (maB) • 经验丰富的领导团队 • 来自礼来公司的临床、药物研发和监管负责人 & Co. • 强劲的资产负债表:截至9月23日,现金约为2.83亿美元 • 11月23日宣布了高达5000万美元的信贷额度 • 预计第二阶段ALTITUDE-AD将启动2024 年上半年试验 • 预计在 2024 年年中期启动 1 期皮下试验 • 2023 年 7 月公布的针对早期 AD 患者的第 1 期临床试验结果呈阳性 $ 我们相信 Acumen 拥有组织专业知识和财务资源,可以推进 ACU193 成为早期 AD 的潜在同类最佳抗体产品

Acumen Business Strategy:2023-2026 4 → 通过对早期 AD 患者的临床开发快速推进 ACU193;→ 评估组合方法以补充我们的核心 ACU193 单一疗法战略;→ 通过许可和/或开发更多候选药物和/或替代配方或衍生物 ACU193 来扩大我们的产品组合;→ 优化 ACU193 和未来候选药物在主要市场的价值。

AD、淀粉样蛋白和 Abeta 低聚物
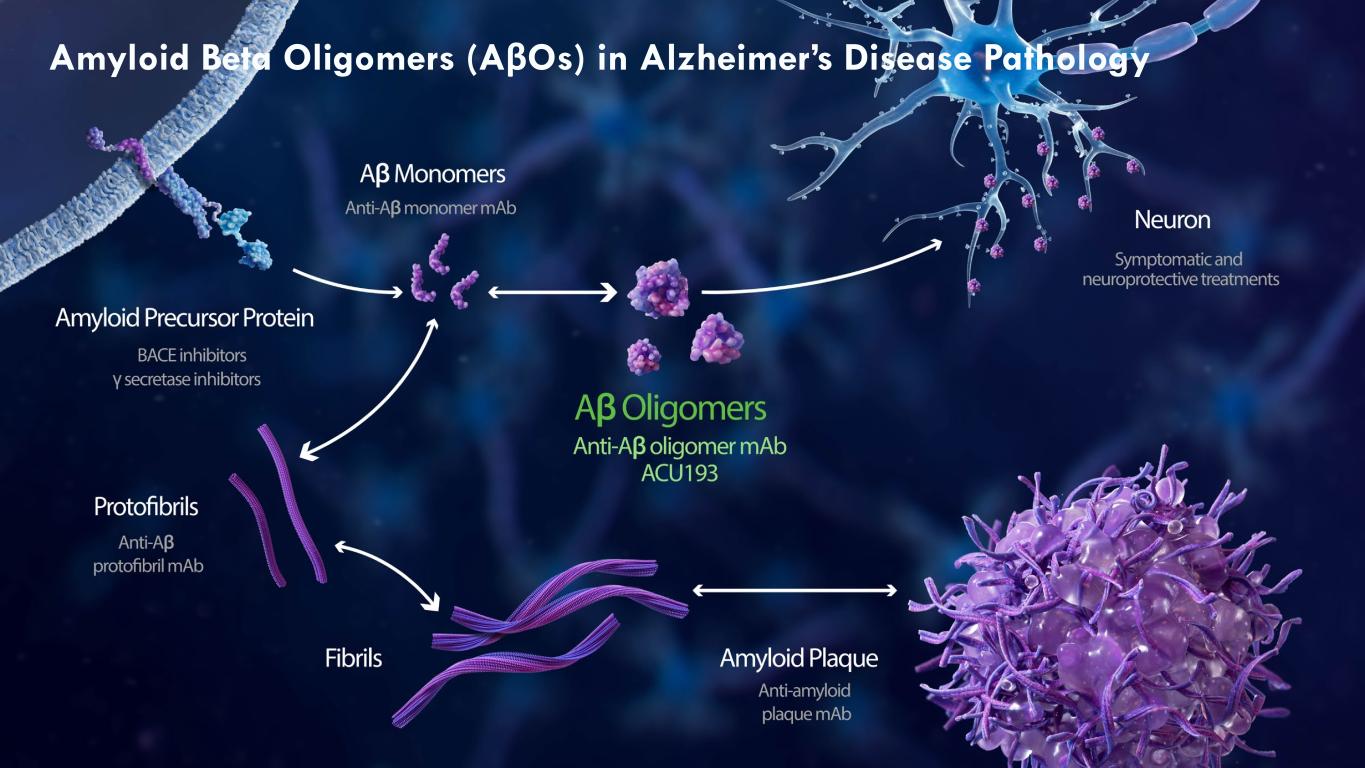
6 阿尔茨海默病病理学中的β淀粉样蛋白低聚物 (AβOS)

毒性 aβO 代表理想的阿尔茨海默病药物靶标 7 AβOS 在 AD 1Cleary 等人,2005 年;Townsend 等人,2006 年;Poling 等人,2008 年;Reed 等人,2011 年;Batista 等人,2018 年。2Shankar 等人,2007 年。3Ferreira,S. T. 和 Klein,W. L.,2011 年。4Lambert 等人,2011 年。4Lambert 等人,2011 年。al.,1998;Walsh 等人,2002 年;Wang 等人,2002 年;Klyubin 等人,2005 年;Townsend 等人,2006 年;Shankar 等人,2007 年、2008 年。5De Felice 等人,2008 年;Zempel 等人,2010 年;Ochalek 等人,2017 年。突触功能受损1 大鼠器官型切片中的金字塔神经元在暴露于 picomolar 水平的可溶性低聚物后,树突刺的密度和电生理活性突触的数量明显下降2 1 导致记忆和认知受损3 已发现可溶性 AβO(但不是单体)会阻断海马长期增强(LTP),a 记忆与学习的突触相关性4 2 诱导 tau 过度磷酸化5 2008 年证明 aβOS 能够诱导 tau 过度磷酸化没有纤维的神经元5 3
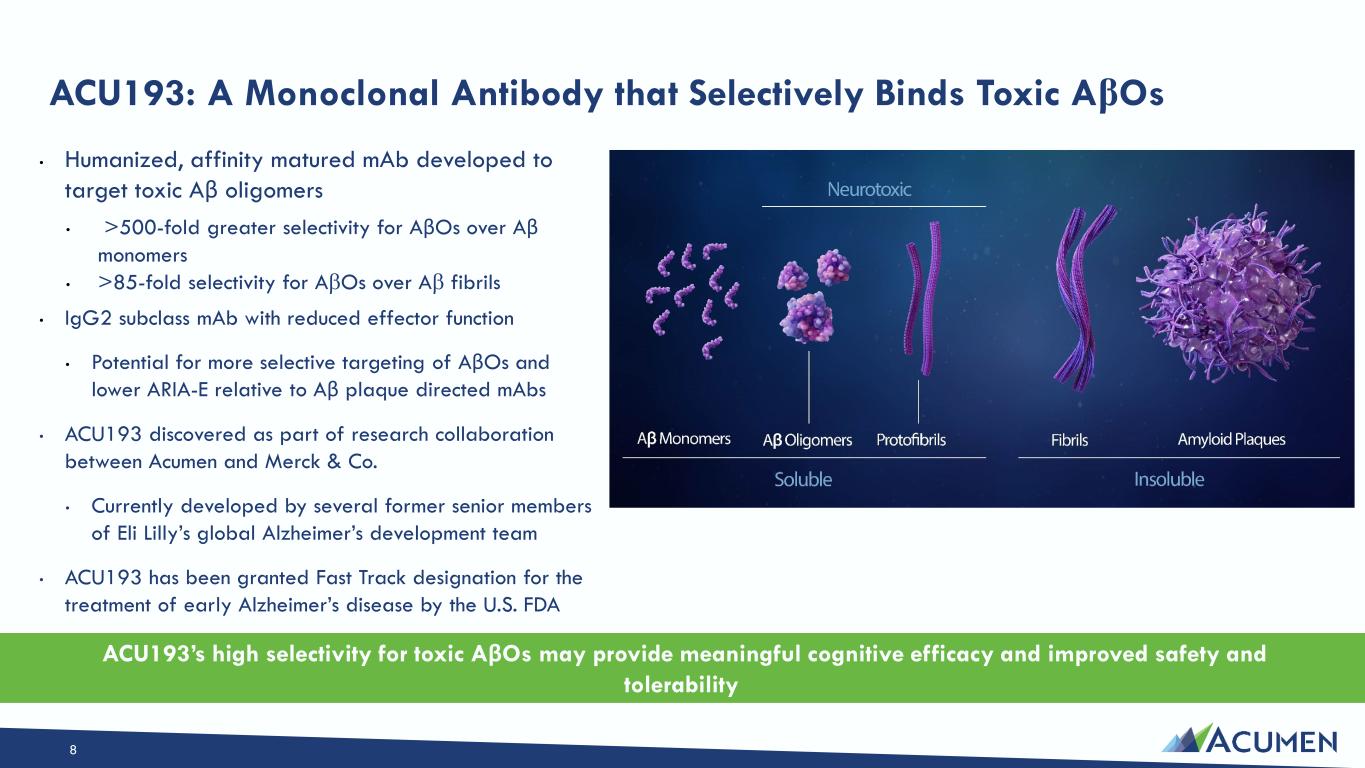
• 针对毒性 Aβ 低聚物而开发的人源化、亲和性成熟单抗体 • AβOS 的选择性比 Aβ 单体高 500 倍以上 • AβOS 的选择性比 Aβ 原纤维高 85 倍 • 效应器功能降低 Igg2 亚类单抗体 • 与 Aβ 斑块靶向单体相比,AβOs 的选择性可能更高,ARIA-E 降低 • 作为一部分发现 Acumen 与默沙东公司的研究合作 • 目前由礼来全球阿尔茨海默氏症开发团队的几位前高级成员开发 • ACU193 已获得 Fast Track 资格 ACU193美国食品药品管理局指定用于治疗早期阿尔茨海默氏病 ACU193:一种选择性结合毒性 AβOS 的单克隆抗体 ACU193 对毒性 AβOS 的高选择性可能提供有意义的认知疗效并提高安全性和耐受性 8

9 AβOS 可能包含 2 到 >200 个 Aβ 肽什么是 Aβ 低聚物?__________________ 来源:凯利等人。2008 年《化学物理学》杂志。图 1。由 3 (a) 和 18 (b) Aβ 肽组成的 aβO 如下所示。__________________ 来源:Relini 等人。2014 年 Biomolecules。图 2。淀粉样蛋白聚集代表性步骤的原子力显微镜图像:(A)低聚物;(B)原原纤维;(C)成熟原纤维。扫描尺寸 1.0 微米。Z 范围 (A) 8.0 nm;(B) 15 nm;(C) 20 nm。Aβ 低聚物、原原纤维和原纤的四元结构 (a) (b)

10 * 结合淀粉样蛋白斑块的 IgG1 单克隆抗体与 ARIA-E 的高发率有关。例如,参见 Plotkin,《疾病神经生物学》,2020 年。• 上面列出的任何候选产品之间没有进行过正面交锋的临床试验。每种候选产品的研究设计和方案不同,候选产品的结果可能无法比较。1 AAP:加速批准 solanezumab igg1、Ph3 停止、A4、DIAN 阴性 lecanemab igg1 Ph3 阳性 3Q22 获得批准 (AAP1) 2023 年 1 月全面批准 aducanumab* igg1 获得批准 (AAP1),CMS CED 商业停止 ACU193 igg2 2、ph1 阳性 3Q23 bapineuzumab* Igg1、ph3 停止 gantenerumab* Igg1 Ph3 阴性 4Q22 crenezumab igg4、ph3 停止、API 阴性 Aβ 低聚物 donanemab* Igg1 Ph2 阳性 CRL 1Q23 (AAP1) Ph3 阳性 2Q23 Aβ与抗斑单克隆抗体相比,protofibrils ACU193 相对于后期和批准的抗 Aβ/Plaque mAbs 的定位 ACU193 对 AβOS 的高选择性以及后续研究中预期的 ARIA 发生率较低,预计将提供更好的安全性和有效性

药物:ACU193 是一种人源化、亲和性成熟的单抗体,对毒性 AβOS 与 Aβ 单体具有很高的选择性(>500 倍),AβOS 的选择性比 Aβ 纤维高 85 倍 ACU193 是一种 IgG2 子类单抗,其效应功能降低。人群:早期 AD-AD 引起的轻度认知障碍和轻度痴呆(PET 淀粉样蛋白阳性)剂量:每 4 周静脉输液持续时间:早期 AD 期间的慢性治疗价值主张:与非选择性抗 Aβ/斑块单抗体相比,选择性可提供有意义的认知疗效并提高安全性和耐受性,包括:• 减缓早期 AD 记忆力和认知能力的下降 • 降低 AβO 诱发的突触和神经元网络毒性 • 减缓疾病进展和对 tau 的下游影响,神经变性和神经炎症 • 在随后的研究中预计 ARIA 的发生率很低 • 作为独立疗法或与其他症状、抗炎和/或 tau 定向疗法联合使用可能有效 ACU193 目标产品简介:同类最佳、一线、抗 AβO、疾病改良免疫疗法,适用于 AD 11 早期

(1) 上面列出的任何候选产品之间没有进行过正面交锋的试验。每种候选产品的研究设计和方案都不同,候选产品的结果可能无法比较。(2) Goure 等人(2014)。靶向适当的β淀粉样蛋白神经元毒素:阿尔茨海默病免疫疗法的前进之路。阿尔茨海默氏症研究与疗法。6:42。DOI:http://alzres.com/content/6/4/42。(3) 由于原发性 AD 适应症,第 3 阶段已停止。(4) van Dyck,C. (2017)。阿尔茨海默病的抗淀粉样蛋白 B 单克隆抗体:陷阱和希望。生物精神病学。83:4,311-319。DOI:https://doi.org/10.1016/j.biopsych.2017.08.010。maB 表位/同型 (4) Aβ 靶向选择性 (1) (2) 安全概况公司资产单体斑块原纤维低聚物 ARIA-E (4) 功效概况 ACU193 N 期,确认 Igg2--+ +++++ 第 2 阶段预计将出现低位卫采/Biogen Leqembitm N-term,确认 Igg1-+++ +++ Protofibrils +++ 低阳性 ph2 和 Ph3 CLARITY-AD Lilly donanemab n3pG igg1-++++ +++-高阳性 ph2 和 Ph.3 开拓者 Biogen aduHelmTM N-term igg1-++++ Protofibrils ++ 高 ph3 出现阳性,参与负面罗氏gantenerumab (3) N-term + mid domain igg1-++++ ++ High ph3 阴性礼来索拉尼珠单抗 (3) 中域 /igg1 ++++---无 Ph3 负值,趋势;A4 负值 /Genentech crenezumab (3) 中域 /igg4 ++++-++ 无 Ph3 负值,无趋势辉瑞/Janssen bapineuzumab (3) n-term igG1 ++ ++ ++ ++ ++ ++ 最近和当前正在开发的抗 Aβ 抗体的高 pH3 阴性比较特征 12

ACU193:价值主张 13 阿尔茨海默氏病市场正处于关键转折点,最近和预期的批准为 AD 的治疗铺平了新的道路... 而 ACU193 完全有望成为潜在的首选治疗方法。随着未来几年Aβ疗法成为主要治疗选择,市场可能会保持稳定,AD 治疗领域的进步令利益相关者感到鼓舞,他们正在共同努力扩大患者获得治疗的机会。AβO 选择性具有潜在的临床和安全优势,ACU193 有机会成为更广泛的早期 AD 人群的首选治疗方案

ACU193 的 INCTERCT-AD 第 1 阶段结果呈阳性

INCERT-AD:AD 早期患者的随机安慰剂对照 1 期 15 Q2W:每两周给药一次;Q4W:每四周给药一次。A 部分:单次递增剂量 n = 每队列 8(总共 32 个)B 部分:多重递增剂量 n = 每队列 10 剂(总共 30 次)3 次药物或安慰剂;每队列 8:2 1:2 mg/kg ACU193 或安慰剂 2mg 队列 2:10 mg/kg ACU193 或安慰剂 10mg 队列 3:25 mg/kg ACU193 或安慰剂 25mg 队列 4:60 mg/kg ACU193 或安慰剂 60mg 队列 5:10 mg/kg ACU193 或安慰剂 (Q4W) 10mg 队列 6:60 mg/kg ACU193 或者安慰剂 (Q4W) 60mg 队列 7:25 mg/kg ACU193 或安慰剂 (Q2W) * ≥ 1wk ≥ 1wk ≥ 1wk ≥ 1wk ≥ 1wk ≥ 1wk ≥ 1wk ≥ 1wk

16 在研究的更高剂量(60 mg/kg Q4W 和 25 mg/kg Q2W 队列)下观察到的快速、剂量相关、具有统计学意义的淀粉样蛋白斑块减少* • 与目前批准的临床开发相似时间点的 Aβ 单克隆抗体可与剂量相关的第一种以剂量相关方式展示靶向参与的抗体 • 血清和脑脊液暴露剂量成正比;抗体浓度明显超过脑脊液中内源性低聚物的水平 • 研究的最高剂量(25 mg/kg Q2W 和 60mg/kg Q4W)接近最大目标参与度(23.2 au/mL Emax)令人信服的总体安全性,ARIA-E 的比率很低 • 没有已知的药物相关的 SAE;治疗新发的 ADAS 滴度一直很低 • 在 10 mg/kg Q4W 剂量时没有出现症状 ARIA-E • 在 Apoe4 纯合子 (n=6) 广泛治疗指数中没有观察到 ARIA-E;通往更方便的每月给药方案的明确途径 1 2 3 4 *群组内从基线到终点的统计学显著降低 (p = 0.01) INCTERCT-AD 结果证实 ACU193 的机制证明以及证明在研究的更高剂量下淀粉样蛋白斑块会减少

机制证据显示 ARIA-E 水平低,与剂量相关的靶点参与度低,脑脊液 ACU193 水平超过 AβO 水平,支持 Q4W 剂量 17 种潜在治疗剂量终点关键成功因子 10mg/kg 25mg/kg 60mg/kg 安全性和耐受性 • 死亡,与研究药物无相关的 SAE 1/14 (7.1%) 1/14 (7.1%) 3/14 (21.4%) • 症状 ARIA-E 0/14 (0.0%) 0/14 (0.0%) 1/14 (7.1%) PK • 持续剂量相关的 PK • 脑脊液暴露量达到内源性脑脊液低聚物水平以上(明显高于报告的 Aβ 低聚物水平)已达到(比报告的 Aβ 低聚物水平高出几个数量级)已达到(比报告的 Aβ 低聚物水平高出几个数量级)• 脑脊液测量中测量 ACU193-Aβ 低聚物复合物达到剂量相关;接近最大目标参与剂量相关;接近最大目标参与度淀粉样蛋白 PET • Centiloids 中淀粉样蛋白 PET 减少在 MAD 队列中未观察到减少 (p = 0.01) MAD 队列中的减少量(p = 0.01)
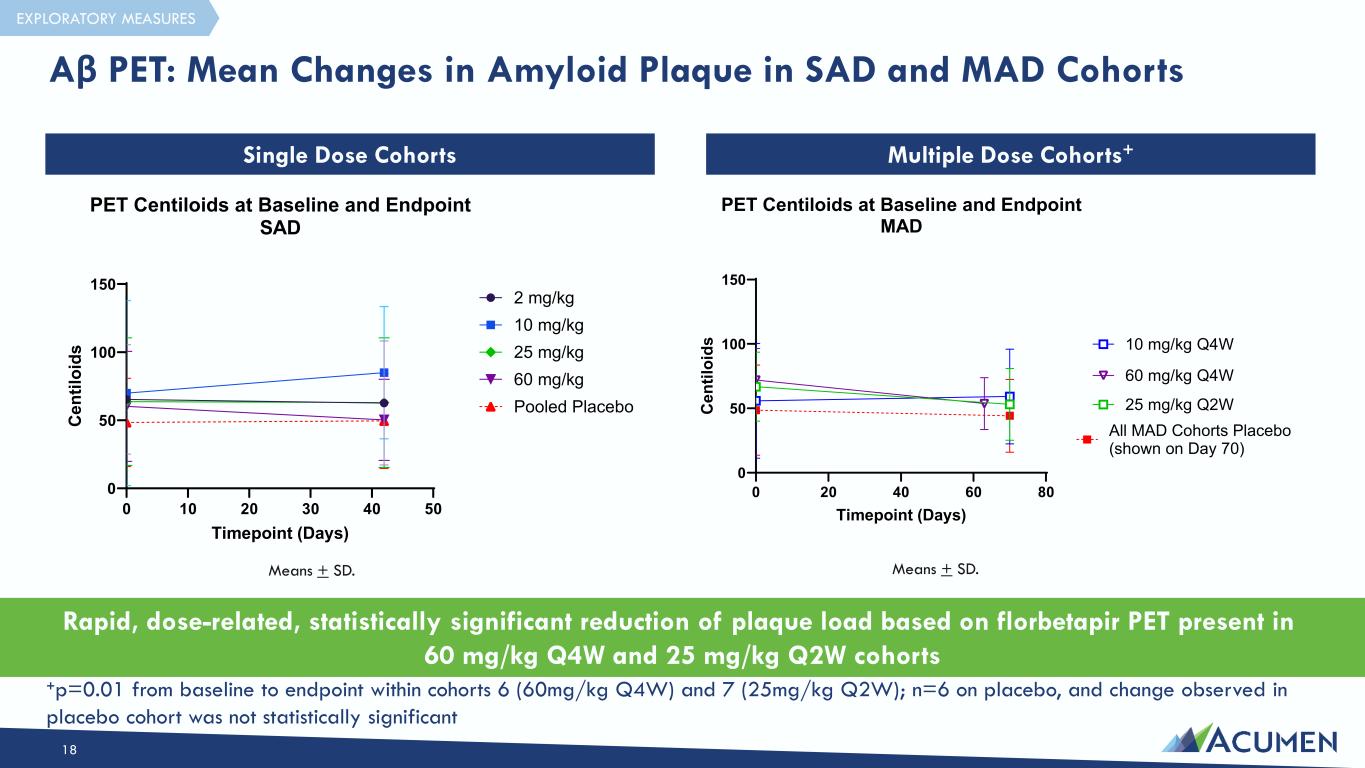
根据 60 mg/kg Q4W 和 25 mg/kg Q2W 队列中存在的 florbetapir PET,可以快速、剂量相关地、统计学上显著地减少斑块负荷。意味着 + SD。+p=0.01 从基线到终点队列 6(60mg/kg Q4W)和 7(25mg/kg Q2W)中;n=6,安慰剂队列中观察到的变化没有统计学意义 Aβ PET:SAD 和 MAD 队列中淀粉样蛋白斑块的平均变化 18 单剂量队列多剂量队列+ 探索性测量 0 20 40 60 80 50 100 150 PET Centiloids 处于基线和终点 MAD 时间点(天)C en til oi ds 所有 MAD 群组安慰剂(如第 70 天所示)25 mg/kg Q2W 60 mg/kg Q4W 10 20 30 40 50 0 100 150 PET Centiloids 在基线和终点 SAD 时点(天)C en til oi ds 2 mg/kg 10 mg/kg 25 mg/kg 60 mg/kg 合并安慰剂

Aβ PET:个体患者在 60 mg/kg Q4W 时的 60 mg/kg Q4W 和 7 队列在 25 mg/kg Q2W 时淀粉样蛋白斑块的变化 19 在 60 mg/kg Q4W 和 25 mg/kg Q2W 队列中,大多数患者在 63 或 70 天后斑块负荷有所减少。探索性措施

30 40 50 60 70 80 90 天 0 天 63 天 70 天 90 最高剂量的 ACU193 表明淀粉样蛋白斑块减少速度快可与 Lecanemab(处于第 3 阶段)相当 20 淀粉样斑块(centiloids)的平均减少 ACU193 60 mg/kg Q4W (n=8) * ACU193 25 mg/kg Q2W (n=8) * Lecanemab 10 mg/kg Q2W (n=344) 索引值绝对值(p=0.01 表示淀粉样蛋白斑块在 ACU193 队列中从基线到终点的变化)-30 -25 -20 -15 -5 0 第 0 天 63 天 70 天 (25.3%) (20.6%) (25.7%) (18.1) (13.7) (20.0) p=0.01P=0.01 *统计学队列内从基线到终点的显著减少(p = 0.01)。资料来源:Acumen Pharmicals,存档数据;van Dyck(2023),NEJM(根据图表估算淀粉样蛋白 PET 减少量);累计给药药物:ACU193 60mg/kg = 180 mg/kg(给药三剂);ACU193 25mg/kg = 75mg/kg(给药三剂)注意:上面列出的候选产品之间没有正面交锋的临床试验。每种候选产品的研究设计和方案都不同,因此,候选产品的结果可能无法比较。探索性措施

SAD MAD 10 mg/kg Cohorts 2、5 25 mg/kg 同组 3、7 60 mg/kg 同组 4、6 NO ARIA-E 无症状 ARIA-E 有症状 ARIA-E 已停产 ApoE D21 3,4 3,4 PBO 3,4 3,4 PBO 3,4 d126 3,4 3,4 PBO D126 3,4 3,4 PBO PBO 3,3 3,4 3,4 3,4 PBO PBO 3,3 Apoe D28 D70 D196 2,3 3,3 3,3 3,3 3,3 PBO PBO 3,4 3,3 3,4 3,4 PBO PBO 3,3 3,3 PBO 3,3 3,3 Apoe D70 98 3,3 3,4 3,4 3,4 3,4 PBO PBO 3,3 3,4 PBO PBO 4,4 4,4 Apoe D21 D140 4,4 PBO 3,4 3,4 PBO 3,3 3,4 2,4 2mg/kg Cohort 1 ApoE D21 D140 3,4 3,3 PBO 3,4 2,3 3,4 PBO 3,3 3,3 ARIA-E INCTERCT-AD 21 没有 ε4 纯合子尽管在研究中占 13% 但仍会出现 ARIA-E;4/5 ARIA-E 病例是 ε4 杂合子,占我们研究人群的 47% PBO:服用安慰剂安全的患者

ACU193 Serum PK 22 单剂量队列多剂量队列血清暴露量与剂量成正比,没有积累 PHARMAKINETICS 估计血清末端 T1/2 为 5-7 天
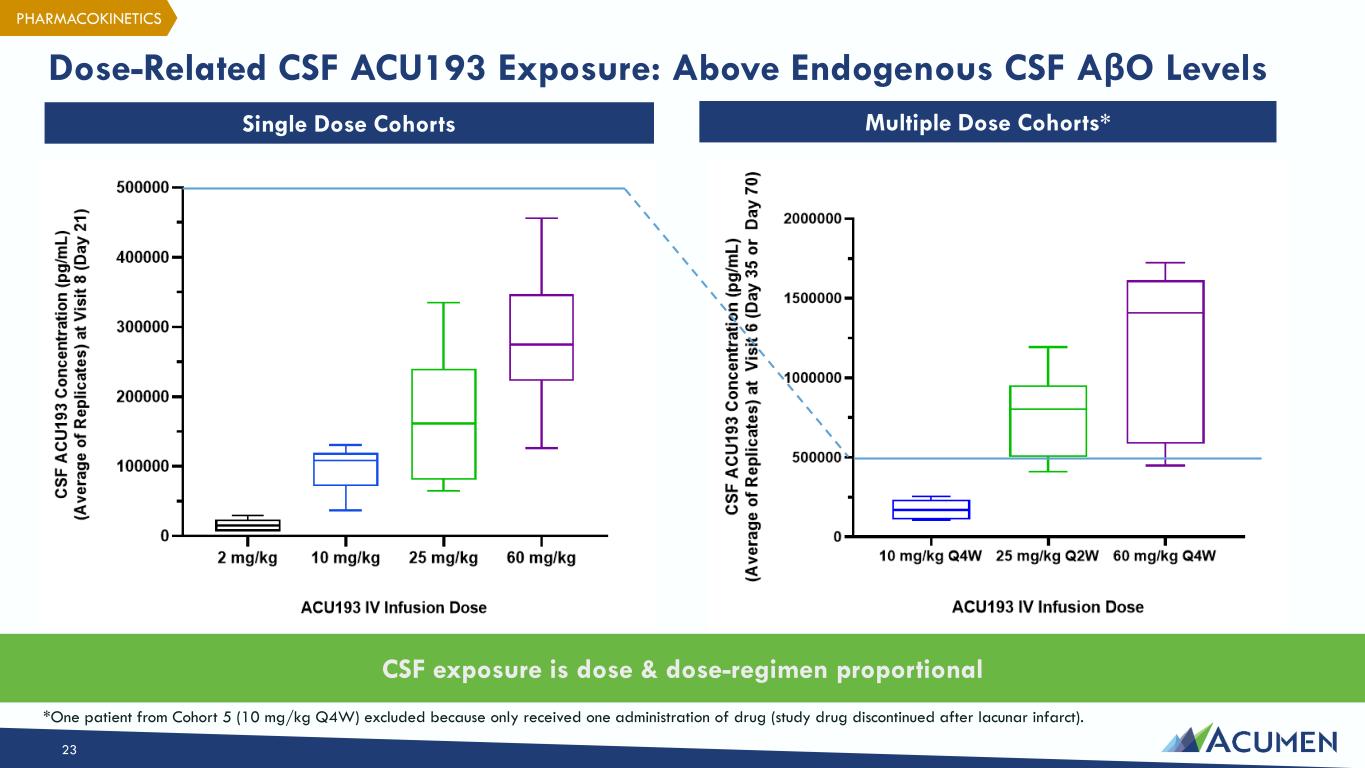
与剂量相关的脑脊液 ACU193 暴露量:高于内源性脑脊液 aβO 水平 23 个单剂量队列多剂量队列* 脑脊液暴露量与剂量方案成正比 *排除了来自队列 5(10 mg/kg Q4W)的一名患者,因为只服用了一次药物(空隙性梗塞后研究药物停用)。药代动力学

ACU193 药物特异性捕获(抗 acu193 特异型单抗体)24 通过测量 CSF 中的 acu193-aβO 复合物来评估靶标参与度 Aβo 选择性检测(抗 Aβ² 单抗)只有药物/AβO 复合物可以测量新的检测配置,用于选择性地检测脑脊液中的 acu193-aβO 复合物 MSD S-Plex(Turbo)免疫分析靶点订婚

ACU193 与 AβOS 的目标参与度为剂量成比例 25 单剂量队列多剂量队列* 2 mg/kg 10 mg/kg 25 mg/kg 60 mg/kg 0 10 20 30 剂量相关靶向参与*排除 5 队列中的一名患者(10 mg/kg Q4W),因为只接受了一次药物给药(研究药物在腔隙性梗死后停药)。目标参与度 p = 0.001 p = 0.03 p = 0.0007没有显著差异

在剂量为 25 mg/kg Q2W 和 60 mg/kg Q4W 时观察到的最大 TE 反应 26 单剂量和多剂量队列——暴露反应关系(Emax 模型)Emax:23.2 au/mL acu193-aβO 复合物 EC50:1.43 x 105 pg/mL ACU193 目标参与度 *不包括第 5 队列中的一名患者(10 mg/kg Q4W),因为只服用过一次药物(研究药物)后停药月球梗塞)。再加上令人信服的安全性和快速减少斑块,接近最大TE的剂量有助于指导下一个研究阶段的剂量选择

在针对脑脊液 phosepho-tau181、Total Tau、Neurogranin 和 Aβ 42/40 Ratio 27 CSF 生物标志物的变化的 INTERCEPT-AD 试验中,观察到的多个剂量递增队列中持续的药物效应 CSF BIOMARKERS ACU193

脑脊液 Neurogranin 的变化与 ptau181 之间的显著相关性 28 p
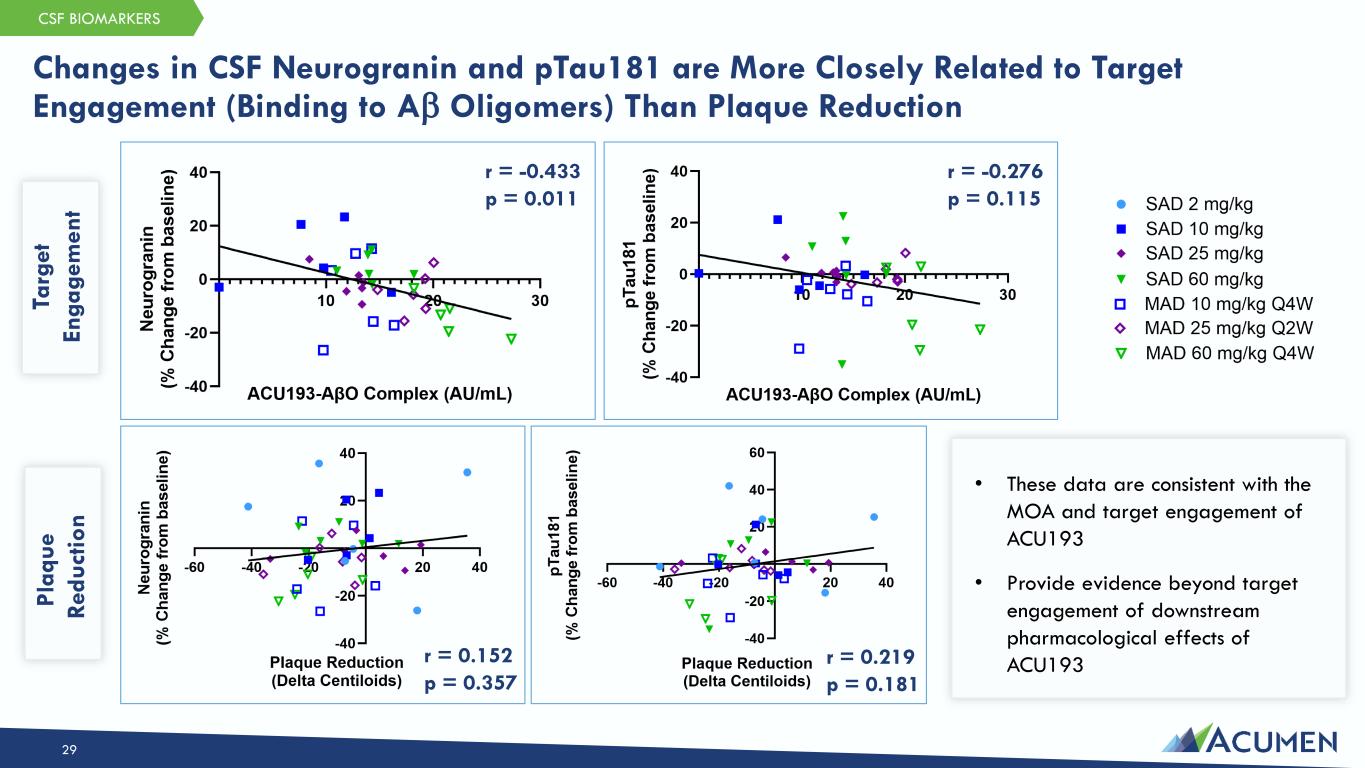
29 r = -0.433 p = 0.011 r = 0.152 p = 0.357 r = 0.219 p = 0.181 脑脊液神经粒蛋白和 ptau181 的变化与靶点参与(与 Aβ 低聚物结合)的关系比斑块减少更为密切 Ta rg et En ga ge m en t Pl aq ue ru du ct io n r = -0.276 p = 0.115 • 这些数据与 ACU193 的 MOA 和靶标参与度 • 除了靶向参与外,还提供 ACU193 脑脊液生物标志物的下游药理作用的证据

未观察到对脑脊液水平的显著药物影响 Neuropentraxin 2 30 要进一步了解这种相对较新的生物标志物 CSF BIOMARKERS

第 1 阶段数据支持进入第 2 期在较高剂量队列中观察到的快速、剂量相关、具有统计学意义的淀粉样蛋白斑块减少 Topline 结果显示 ACU193 的机制证明,第一临床阶段 AβO 靶向抗体 ACU193 在早期 AD 患者中具有良好的耐受性;未出现与药物相关的 SAE;ARIA-E ACU193 的低比率接近毒性 AβOS 的最大中心靶标参与率,建立广泛的治疗指数和便捷的每月给药途径脑脊液阳性生物标志物数据非常重要支持 ACU193 对大脑的下游药理作用最近与美国食品药品管理局的会晤表明 ALTITUDE-AD 探索性措施的研究设计一致:— 正如预期的那样,在这项持续时间较短的小型研究中,没有观察到临床认知测量结果产生任何影响 — 正如预期的那样,在这项持续时间较短的小型研究中,未观察到核磁共振成像 ASL 脉冲序列的影响 31 项令人信服的机制证明后续步骤:预计在 2024 年 1 月 1 日启动

ACU193:临床前数据

ACU193:支持开发的大量数据包 ACU193 是一种有前途的早期 AD 免疫疗法,有望提供有意义的认知和功能益处,减缓疾病进展,并提供有吸引力的安全性。对于 AβOS 的纳米摩尔亲和力,AβOS 的选择性比 Aβ 单体高 500 倍以上,与血管淀粉样蛋白或密集核心淀粉样蛋白斑块的结合有限或无法辨别结合多种内源性 β,从二聚体到高分子量 AβOS 在多个物种中表现出脑渗透和生物分布表现与其他外周给药的中枢神经系统单克隆抗体一样多项体外神经保护测定中的剂量依赖效应 AD Igg2 亚类的多个体内转基因小鼠模型的积极记忆和行为效应缺乏炎症效应功能信号(FcγR 结合)非临床微出血研究显示微出血风险没有增加 GLP 研究显示可接受的安全性支持临床给药计划,包括 Ph 2/3 选择性 Pharmacology PK/LOGY 警局安全 33

与 Aβ 单体相比,Aβ 低聚物具有很高的选择性即使存在大量过量的 Aβ 单体,ACU193 与 AβOS 的结合也不会改变 ACU193 与 AβOS 的结合 >500 倍与 Aβ 单体的结合 Log [竞争抗原]μM ACU193 选择性 ACU193 在存在 5μM 单体 Aβ ACU193 时选择性 Log μM SELECTICITY ACU193 是第一个为选择性靶向 AβOS 而开发的单抗体 ACU193 即使存在大量过量的 Aβ 单体(例如大脑中存在的单体)也能保持不变,从而限制了 “靶点干扰” 34

比较美国证券交易委员会分数上的 Aβ 物种单抗复合信号 SELECTICY ACU193 绑定到 Aβ 的寡聚物种群,这些物种不同于 hu266(solanezumab)或 Hu3d6(bapineuzumab)结合的物种 ACU193 绑定到各种 Aβ 35 的寡聚物种
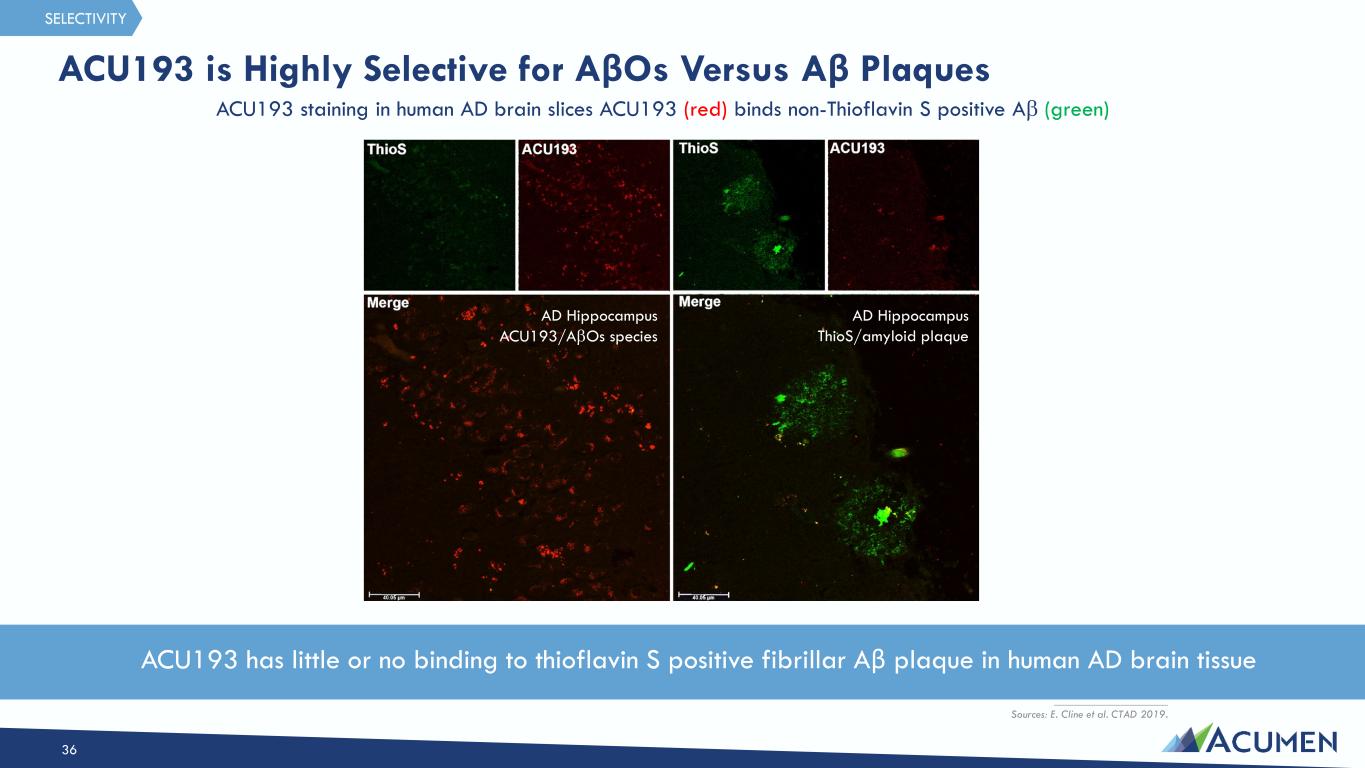
AD Hipocampus thios/Amyloid 斑块 AD Hipcompus acu193/aβOS 物种 __________________ 来源:E. Cline 等人。CTAD 2019。ACU193 对 AβOS 与 Aβ 斑块具有很高的选择性 36 人类 AD 脑切片中的 ACU193 染色 ACU193(红色)结合非硫黄素 S 阳性 Aβ(绿色)选择性 ACU193 与人类 AD 脑组织中的硫黄素 S 阳性纤维 Aβ 斑块结合很少或根本没有

药理选择性与神经元结合后,AβOS 会破坏长期增强作用 (LTP),并导致细胞内钙的病理性增加,从而破坏细胞。AβOS 与神经元结合并具有毒性;ACU193 的小鼠类似物可防止毒性 37 ACU3B3 可防止 aβO 抑制海马 LTP 体外控制 Aβ42 (50 nM) Aβ42 (50 nM) + ACU3B3 (100 pM) ACU3B3 可防止 AβO 介导的 Ca2+ 在细胞培养中升高注意:(1) ACU3B3 是小鼠单克隆抗体的前体,相当于人源化 ACU193 防止 ACU3B3 异常神经元活动的变化被认为是 AD 记忆力丧失的基础,可以防止 AβO 介导的神经元培养中钙动态平衡的中断

ACU193 (ACU3B3) 的小鼠亲本版本用于治疗沉积斑块的年幼小鼠或斑块丰富的老鼠治疗转基因 AD 小鼠模型的结果行为改善 38 治疗后年轻(5-7 个月)转基因小鼠的缺陷显著减少 PHAROLOGYSELOGYSELECTICATION 治疗后,年长(9-10 个月)转基因小鼠的缺陷显著降低 MWM 游泳速度异常(**p

ACU193 以剂量依赖性方式在转基因小鼠大脑 (tg2576) 中激活靶标 AβOs;在患者临床试验中施用更高剂量的能力可以增加靶标覆盖范围 PK/PD ACU193 以剂量依赖方式进入中枢神经系统并与转基因小鼠的 AβOS 结合 39 药理学选择性

临床开发计划和战略考虑

Acumen 领导团队在 AD/Neuro 药物研发方面经验丰富 Acumen 团队在阿尔茨海默氏症药物发现和开发方面拥有数十年的经验 JANICE HITCHCOCK,博士监管事务副总裁 ROBERT DEAN,医学博士,生物标记物和分析方法高级开发顾问 JASNA JERECIC,博士分析方法负责人、研究科学家 ERIC SIEMERS、MD 首席财务官兼首席商务官 MATT ZUGA 首席财务官兼首席商务官罗素·巴顿首席运营官丹尼尔·奥康纳 ELL 总裁兼首席执行官 LIEAN SCHENK 副总裁、CMC 负责人 SIEW TIN GAN 临床主管运营 41 德里克·迈斯纳,京东首席法务官 JULIE BOCKENSTETTE 执行副总裁、人力资源主管

ACU193 开发摘要 42 ⇒ 差异化概况:与 Aβ 低聚物的毒性以及 ACU193 与 Aβ 低聚物的选择性结合一致的非临床和 1 期数据 ⇒ 评估安全性、PK 和靶点参与度的 1 期研究得出的正面结果 ⇒ 预计 2 期临床研究 ALTITUDE-AD 将于 2024 年上半年启动 • 两个治疗组对比安慰剂:50 mg/kg Q4W 和 35 mg/kg Q4W 1期皮下临床研究将于2024年中期启动,比较皮下注射型 ACU193 与静脉注射型的药代动力学

ACU193 知识产权和市场排他性 • 默沙东对其淀粉样蛋白衍生扩散配体 (ADDL) 知识产权的独家、永久、不可撤销、全球免版税许可,包括已颁发的 ACU193 专利 • ACU193 全球知识产权财产:在 19 个国家颁发的专利物质构成专利和使用方法有效期将延至 2031 年 7 月,视司法管辖区而定,专利期限可能延长 3-5 年 • 生物制剂市场独家经营权对于 ACU193 作为一种新型生物药物,美国为新型生物制剂提供 12 年的市场独家经营权,欧洲提供 10 年新型生物制剂的市场排他性 43

2023 年实现的重大里程碑截至 2023 年 9 月 30 日,约 2.83 亿美元现金、现金等价物和有价证券将于 2023 年 11 月从 K2 HealthVentures 获得高达 5000 万美元的债务融资 44 里程碑状态/预计时机机制证明头条结果生物标志物结果预计将启动 ALTITUDE-AD 试验 2024 年中期 1 期皮下试验我们相信 Acumen 拥有将 ACU193 推进 2026 年下半年的专业知识和资源

ABOS:关键要点经验丰富的 AD 药物研发团队 AD 领域大量未得到满足的需求、最近的有利趋势和累积的学习为未来成功做好准备 2023 年 7 月公布了针对有毒的 AβOS 蓝筹股投资者的差异化候选产品和强劲的资产负债表第 2 期研究 ALTITUDE-AD,预计于 2024 年中期启动 45 美元

附录 www.acumenparm.com 46

观察到的药物对Apoe4纯合子中脑脊液生物标志物的明显影响与总参与者群体一致 47 所有参与者个体 Apoe4 纯合子(PBO 的所有患者)*需要更大的样本量才能知道 Apoe4 携带者状态是否对反应有定量影响。

Lecanemab 第 2 期表明,仅减少淀粉样蛋白斑块不足以优化阿尔茨海默病的减缓速度* 48 *治疗后持续减少 ban2401 介导的淀粉样蛋白减少:BAN2401-G000-201 核心期与早期阿尔茨海默病受试者开放标签扩展期基线之间淀粉样蛋白状态的初步比较(1330);Chad J. Swanson 等人。《神经病学》2020年4月,94(15份补编)1330分;*在2020年4月的美国神经病学会(AAN)会议上发表。• Lecanemab(BAN2401)研究201 ——开放标签扩展(OLE)研究开始之前的非治疗 “间隔” 期证实,尽管淀粉样蛋白斑块(Aβ PET SuvR)持续减少,但停用Lecanemab 后,认知结果(CDR-SB)恶化。Aβ PET 可测量大脑中的淀粉样蛋白斑块,但不测量可溶性 Aβ 物种,例如低聚物或原原纤维 CDR-SB 中的变化:研究 201 核心与 OLE 基线的变化:研究 201 核心与 OLE 基线的比较表明,可溶性 Aβ 聚集物种(例如原原纤维、低聚物)在临床下降中起着作用核心基线 18m OLE 基线核心基线 18m OLE Baseline 安慰剂 10 mg/kg 每月 10 mg/kg 每两周一次的治疗关闭治疗时治疗关闭治疗 W 或者 se ni ng 我是 pr ov in g
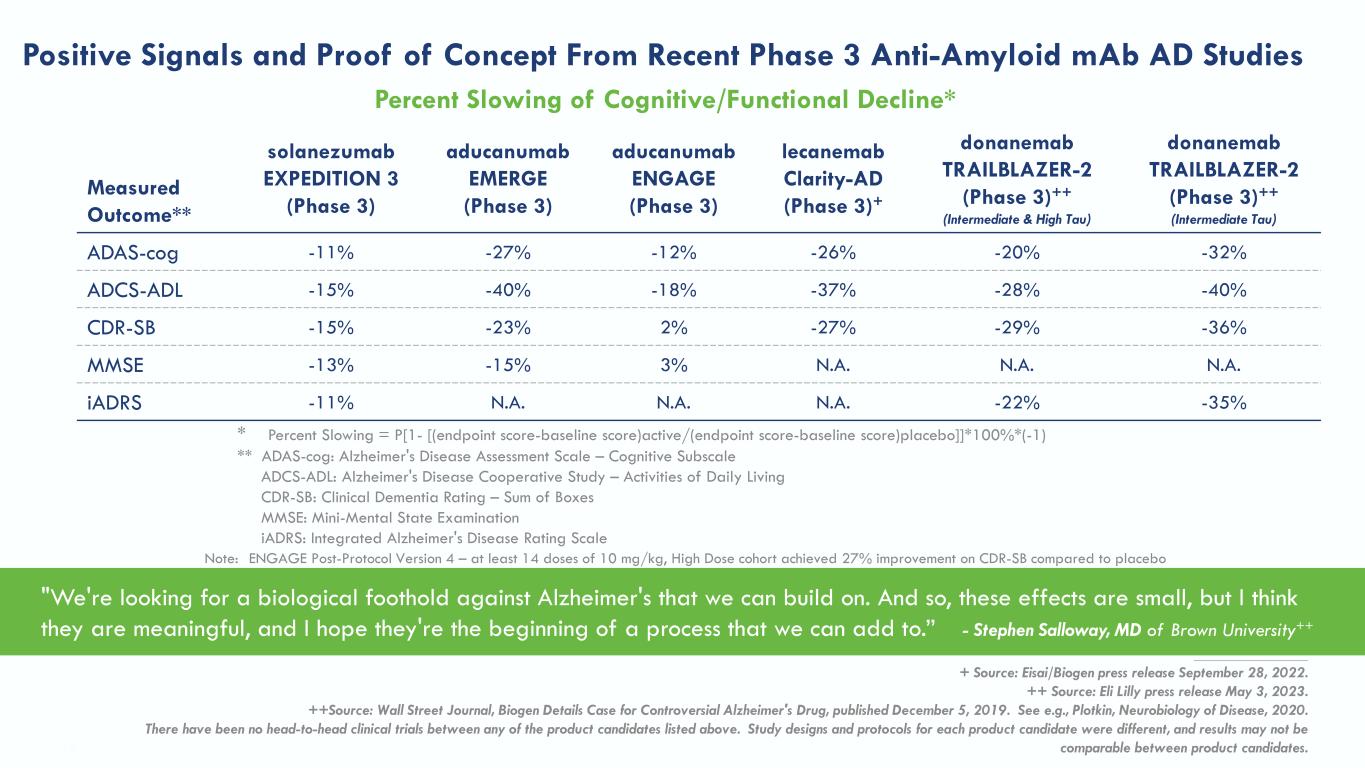
实测结果** solanezumab EXPERTIONAB 3(第 3 阶段)aducanumab EMERGE(第 3 期)aducanumab ENGAG(第 3 期)lecanemab Clarity-ad(第 3 阶段)+ donanemab TRAILBLAZER-2(中级 Tau)adas-CoG -11% -27% -26% -20% -32% S-ADL -15% -40% -18% -37% -28% -40% CDR-SB -15% -23% -29% -36% MMSE -13% -15% N.A. N.A. iadrs -11% N.A. N.A. N.A. N.A. N.A.-A.-A. -11% N.A. N.A. N.A. N.A. N.A. A.A.-A.-A. -22-35% 来自最近 3 期抗淀粉样蛋白单抗体ADRs研究的阳性信号和概念验证认知/功能减缓百分比 TRAILBLAZER-2Decline* 注意:ENGAGE 协议后版本 4 — 至少 14 剂量 10 mg/kg,与安慰剂相比,高剂量队列的 CDR-SB 改善了 27% * 减缓百分比 = P[1- [(终点分数-基线分数)active/(终点分数-基线分数)安慰剂]]* 100% * (-1) ** adas-Cog:阿尔茨海默氏病评估量表-认知子量表 ADCS-ADL:阿尔茨海默氏病合作研究-日常生活活动 CDR-SB:临床痴呆评级-方框总和 MMSE:迷你心理状态检查 iadrs:综合阿尔茨海默氏病评级量表 “我们正在寻找一个可以在此基础上对抗阿尔茨海默氏症的生物学立足点。因此,这些影响很小,但我认为它们是有意义的,我希望它们是一个可以补充的过程的开始。”-斯蒂芬·萨洛威,布朗大学医学博士++ __________________ + 来源:卫材/Biogen 2022年9月28日新闻稿。++ 来源:礼来公司2023年5月3日新闻稿。++来源:《华尔街日报》,《有争议的阿尔茨海默氏症药物的Biogen详情案例》,于2019年12月5日出版。例如,参见普洛特金,《疾病的神经生物学》,2020年。上面列出的任何候选产品之间都没有进行过正面交锋的临床试验。每种候选产品的研究设计和方案都不同,候选产品的结果可能无法比较。49

靶向 AB 单体 solanezumab EXPEDITION 3(第 3 阶段)aducanumab EMERGE(第 3 阶段)aducanumab ENGAGE(第 3 阶段)donanemab(第 3 期)donanemab(第 3 期)++(中级和高 Tau)lecanemab(第 3 期)+ 经过 PC 处理的 PC 低高 PC 处理 ARIA-E 0.2% 0.1% 2.2% 26.1% 34.4% 3.0% 25.7% 0.8% 27.5% 24% 0.8% 9.7% 12.6% 症状 6% 3% ApoE μ4 承运人 1.9% 29.8% 42.5% 28.7% 41.8% 1.2% 14.6% 15.8% 17.9% 27.7% 0.3% 5.4% 任意ARIA E 或 H 10.3% 32.8% 41.2% 9.8% 30.7% 80.3% 8.0% 38.9% 31% 9.5% 21.5% 抗斑单抗体表现出可能限制其使用的剂量相关抗体 50 * PC = 安慰剂,低 = 低剂量;高 = 高剂量表示用靶向 Aβ 单体的抗体(solanezumab)治疗后没有 ARIA,相比之下 ARIA 的存在增加使用靶向淀粉样蛋白斑块(aducanumab、BAN2401 和donanemab)的抗体在增加剂量水平下进行治疗,表明 ARIA 是去除血管周围淀粉样斑块所致,很可能确实如此不是使用靶向其他物种 Aβ(即 Aβ 单体和 AβOs)的抗体进行治疗所致。抗Aβ/Plaque mabs的ARIA事件百分比* ARIA-E对具有淀粉样蛋白斑块结合的单克隆抗体的剂量限制不良作用;我们认为,ARIA-E表现较低的抗体在较高剂量下施用应该更安全、更可行。上面列出的任何候选产品之间没有进行过正面交锋的临床试验。每种候选产品的研究设计和方案不同,候选产品的结果可能无法比较。+ 来源:卫材/Biogen 2022 年 9 月 28 日新闻稿。++ 来源:礼来公司新闻稿 2023.50 靶向淀粉样蛋白斑块的原原纤维