目录
限制。有关Alexion协议的进一步描述,请参阅附注8, 重要协议,以及本10-Q表季度报告其他地方包含的未经审计的简明合并财务报表,标题为 “——Alexion期权和许可协议(前身为辉瑞期权和许可协议)”。
2022 年 3 月,我们与合作伙伴诺华签订了期权和许可协议,即诺华协议。根据诺华协议,我们已授予诺华期权或诺华许可期权,许可TRACER Capsids或诺华许可的Capsids专用于某些靶标,用于开发和商业化某些腺相关病毒基因疗法候选药物,包括诺华许可衣壳和指向该靶标的有效载荷。 自 2023 年 3 月 1 日起,诺华行使诺华许可期权,对我们的 TRACER Capsid 发现平台生成的新型衣壳进行许可,用于针对两个未公开靶标的基因治疗项目。在适用的诺华许可证期权到期之前,诺华选择不为诺华协议下的第三个目标提供上层许可。与该目标有关的所有权都归还给了我们。 有关诺华协议的更多描述,请参阅附注8, 重要协议,以及本10-Q表季度报告其他地方包含的未经审计的简明合并财务报表,标题为 “—诺华期权和许可协议”。
2022 年 11 月,我们与 Touchlight IP Limited(简称 Touchlight)签订了许可协议或《触摸灯许可协议》,授权我们在历史上使用某个 DNA 制备过程或受体 DNA 制备流程,并授权对使用受体 DNA 制备工艺创建的 TRACER Capsids 进行潜在开发。
我们的管道概述
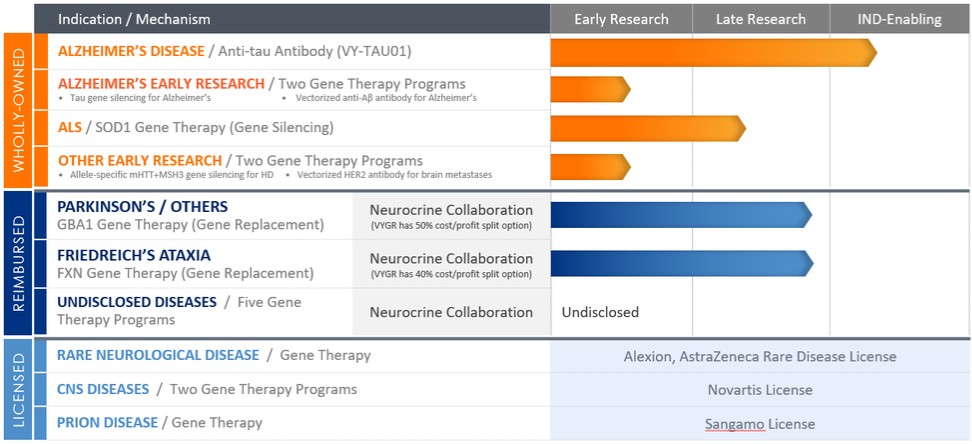
我们利用我们的TRACER发现平台和其他基因治疗平台、我们在专有抗体方面的专业知识以及我们的矢量化抗体平台,组装了一系列专有的AAV基因疗法和其他遗传药物,用于治疗我们认为有大量未得到满足的医疗需求的神经系统疾病。根据疾病的不同,我们正在寻求开发使用基因替代或基因沉默方法的AAV基因疗法,以及使用被动给药或向量化递送方法的抗体。我们的目标是通过显著增加或减少靶组织中相关蛋白质的表达,解决特定疾病的根本原因或主要表现。
下表总结了我们的项目管线,所有这些项目都在临床前开发中:
33