

附录 99.2 INVIVYD 2023 年第三季度财务业绩和业务亮点 2023 年 11 月 9 日 © 2023 Invivyd, Inc. Invivyd 和 Invivyd 徽标是 Invivyd, Inc.的商标。本演示文稿中的所有商标均为其各自所有者的财产。

关于前瞻性陈述的警示说明本演示文稿 包含1995年《美国私人证券诉讼改革法》所指的前瞻性陈述。本演示文稿中不是历史事实陈述的陈述是前瞻性陈述。诸如 “可能”、“将”、“应该”、“预期”、“预期”、“寻找”、“可以”、“打算”、“目标”、“目标”、“目标”、 “项目”、“设计”、“估计”、“相信”、“预测”、“潜力” 或 “继续” 之类的词语或这些术语的否定或其他类似表述意在 识别前瞻性陈述,尽管并非所有前瞻性陈述都包含这些识别性词语。前瞻性陈述包括有关我们正在进行的研究和 临床开发活动的进展和时间等的陈述,包括与 VYD222 有关的陈述;我们的 CANOPY 3 期关键临床试验的预期初始主要终点数据的发布时间;我们对快速生成可能提交的 VYD222 紧急使用许可 (EUA) 的临床数据的期望;我们计划尽快在美国提交 EUA 申请;我们是否能够成功提交未来的 EUA,以及EUA 提交的任何此类抗体的结果; 公司对目标患者群体规模及其候选产品的潜在市场机会的预期;该公司的 INVYMAB 平台方法在快速、连续生产新的 抗体以应对病毒威胁方面的潜力;我们对免疫功能低下的人群需要更多治疗选择以防止 COVID-19 的信念;COVID-19 格局的未来;我们对靶标规模的期望 患者群体和潜在市场我们的候选产品的机会以及我们的市场地位;CANOPY 临床试验的设计;如果获得批准,VYD222 可能在美国商业化;我们认为我们现有的 现金资源将足以支撑到2024年第四季度的预期现金流;以及其他非历史事实的陈述。实际上,我们可能无法实现 前瞻性陈述中披露的计划、意图或预期,您不应过分依赖我们的前瞻性陈述。这些前瞻性陈述涉及风险和不确定性,可能导致我们的实际结果与前瞻性陈述中描述或暗示的结果 存在重大差异,包括但不限于:我们的发现、临床前和临床开发活动的时间和进展;我们从CANOPY 临床试验中快速生成所需数据以支持 EUA 可能提交 VYD222 的能力;我们未来能否成功提交 EUA,以及任何此类EUA提交的结果;在临床前研究或 临床试验中观察到的意想不到的安全性或有效性数据;基于临床前研究的中和活性,VYD222 或其他候选产品的临床成功的可预测性;在不同检测 中测试的候选产品的中和活性的潜在差异;临床前研究或临床试验的结果可能无法预测与当前或未来临床试验相关的未来结果的风险;所用模型中结果的可变性 预测针对值得关注的 SARS-CoV-2 变体的活性;预期或现有竞争的变化;监管环境的变化;监管审批程序的不确定性和时机;我们的平台方法是否使我们 能够快速、连续地产生新的抗体以应对病毒威胁;VYD222 或任何其他候选产品是否能够证明并维持对主要的 SARS-CoV-2 变异体的中和活性,尤其是在病毒面前 br} 演变;以及我们是否有足够的资金来应对未来的运营费用和资本支出需求。可能导致我们的实际业绩与本演示文稿中前瞻性 陈述中表达或暗示的业绩存在重大差异的其他因素,在我们向美国证券交易委员会(SEC)提交的最新10-K表年度报告、向美国证券交易委员会(SEC)提交的其他 文件中,以及我们未来向美国证券交易委员会提交的报告中,网址为www.sec.sec.gov。本演示文稿中包含的前瞻性陈述自该日期起作出,除非适用法律要求,否则我们没有义务更新此类信息,无论是 新信息、未来事件或其他结果。© 2023 Invivyd, Inc. Invivyd、Invymab 和 Invivyd 徽标是 Invivyd, Inc.的商标。本演示文稿中的所有商标均为 其各自所有者的财产。2

议程 1.简介/概述 − Dave Hering,首席执行官 官员 2.CANOPY 试验和最新的 VYD222 体外中和数据-Pete Schmidt,医学博士,首席医学官 3.市场机会和商业准备-杰里米·高勒,首席运营官兼商务官 4.第三季度财务回顾-比尔·杜克,首席财务官 5.问答 3

最近的业务亮点和主要成就已完成 CANOPY 3 期关键临床试验 正在研究 VYD222 以预防出现症状 COVID-19 公司预计将在 2023 年底或 2024 年第一季度初获得初始 CANOPY 主要终点数据公司的目标是在切实可行的情况下尽快在美国提交紧急 使用授权 (EUA) 申请 TM 公司继续推进 INVYMAB,这是其专有平台方法,专为快速、连续生成新抗体而设计应对病毒威胁 4

保护免疫功能低下的人免受 COVID-19 感染的需求显而易见 而且迫切需要评估 COVID-19 的风险和成本在 Omicron 时代 COVID-19 对大量美国人群中免疫功能低下人群的影响:来自 2 1 商业保险健康计划的见解: EPOCH-US 研究基于人群的观察性信息研究 • 在英格兰约 1200 万人的样本中,3.9% 是 • 在大约 1700 万人的样本中在美国大型商业免疫功能低下(IC)健康保险计划中,2.7%是IC • 尽管只有 3.9% 的人口,IC 患者 • 大约 14% 的 IC 患者被诊断患有 COVID-19 占住院人数的 22%,其中 24% 住院,占死亡人数的 24% ——尽管超过 80% 的 人住院时间长,费用高昂的人群接种了 ≥3 支 COVID-19 与 COVID-19 相关的疫苗,平均费用为 • 某些 IC 患者(例如,实体器官和干细胞移植)6美元每位 名患者4,029人(以及接受者以及最近接受血液癌治疗的患者的平均时长),住院时间为15天 COVID-19 COVID-19与没有这些疾病的人相比,风险增加了 10 倍以上尽管有疫苗, 免疫功能低下的人出现严重 COVID-19 结果的风险仍然更高,需要额外的治疗选择来防止 COVID-19 1。Evans Lancet Reg 2023;2.Ketkar Curr Med Res Opin 2023 5

VYD222 已对各种前欧密克龙和 OMICRON 变体 1 变体亚系 VYD222 WT (D614G) WT (D614G) ✓ Delta B.1.617.2 ✓ BA.1 ✓ BA.4/5 ✓ BA.4.6 ✓ BF.7 ✓ Omicron XBB.BB.1 ✓ XBB.1.5 ✓ XBB.1.5.10 和 EG.5(一个 )中的主要变体,表现出广泛的体外中和活性美国) 是 XBB 变体,其 XBB.1.16 ✓ 的刺突糖蛋白序列相同,包括在 XBB.1.5.10/EG.5 2-3 的约 80% 中发现的 F456L 突变体参考文献:1. ✓CRO 使用伪病毒 SARS-CoV-2 中和 ✓ 标准化体外测定抗体测定中和活性生成的 VYD222 数据;2. https://covid.cdc.gov/covid-data-tracker/#variant-proportions(2023 年 10 月 30 日访问);3. covspectrum.org 6
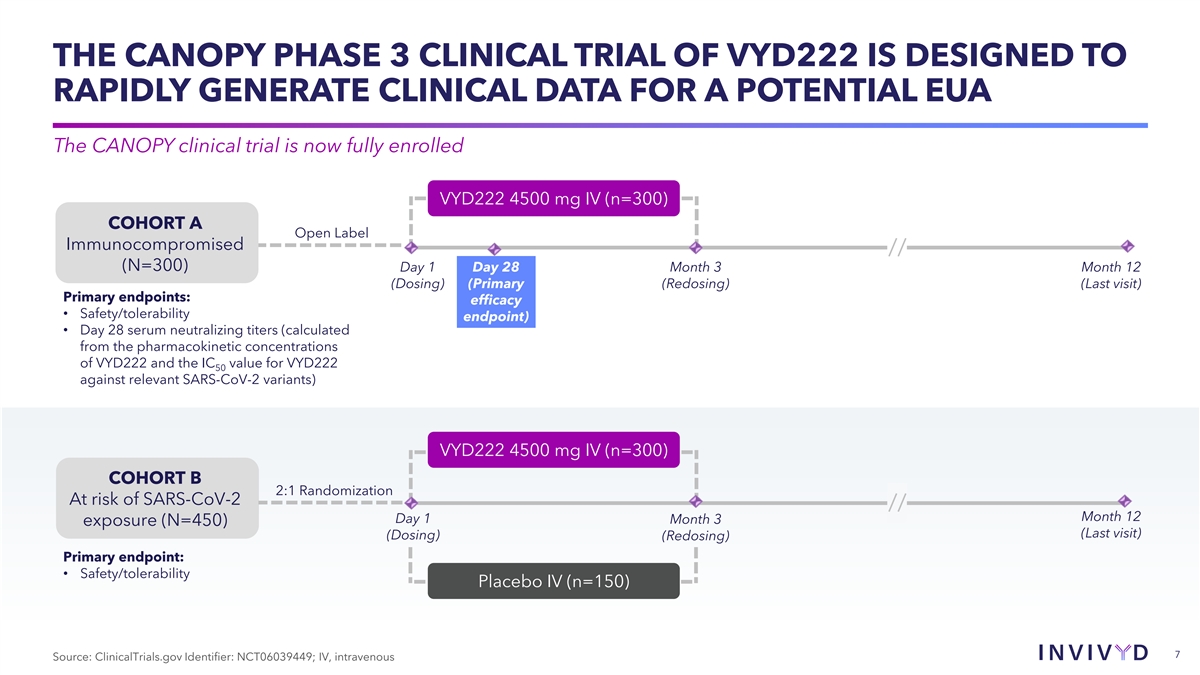
VYD222 的 CANOPY 3 期临床试验旨在为潜在的 EUA 快速 生成临床数据 CANOPY 临床试验现已全面注册 VYD222 4500 mg IV (n=300) 队列 A 开放标签免疫受损者//(N=300) 第 1 天 28 个月 3 个月 12 日(给药)(主要(再给药)(最后一次就诊)主要的 终点:疗效 • 安全性/耐受性终点)• 天 28 个血清中和滴度(根据 VYD222 的药代动力学浓度和 VYD222 50 对照相关 SARS-CoV-2 变体的 IC 值计算)VYD222 4500 mg IV (n=300)队列 B 2:1 随机分组 SARS-CoV-2 风险//月 12 天 1 月 3 日暴露(N=450)(最后一次就诊)(给药)(再给药)主要终点:• 安全性/耐受性 IV(n=150)7 来源:ClinicalTrials.gov 标识符: NCT06039449;静脉注射
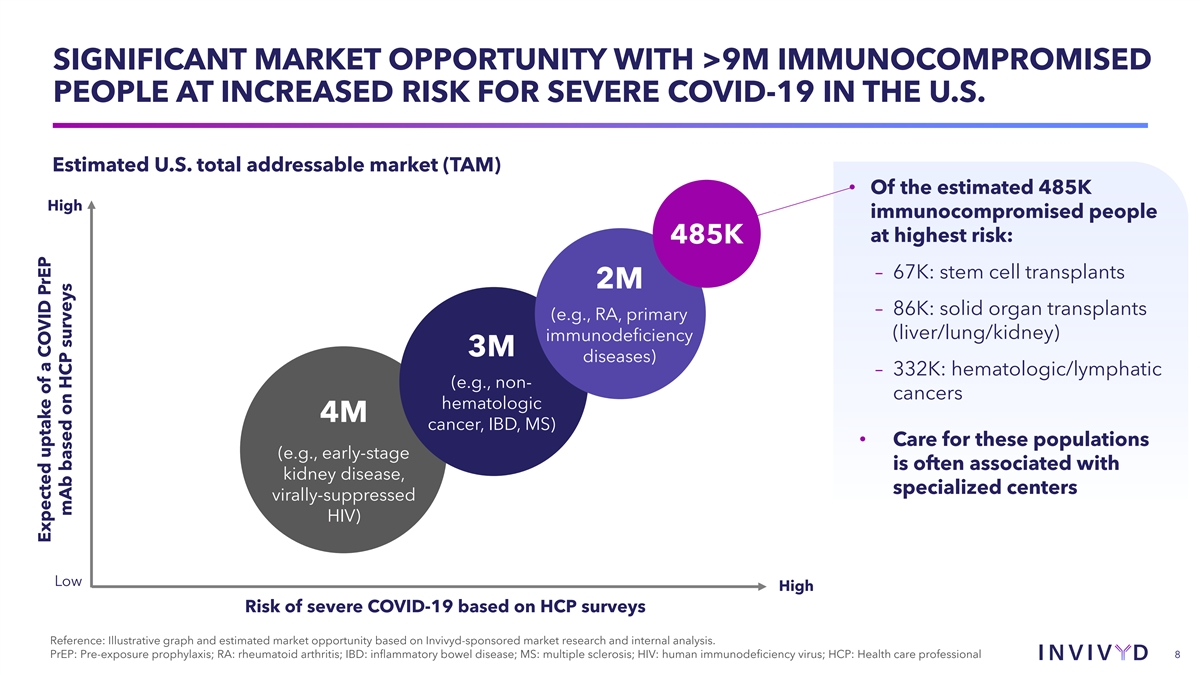
巨大的市场机会,美国超过 900 万免疫功能低下的人患重度 COVID-19 的风险增加。估计的美国潜在市场总数 (TAM) • 在估计的 485 万高免疫功能低下人群中,风险最高:485K — 67K:干细胞移植 2M — 86K:实体器官移植 (例如 RA、原发性(肝/肺/肾)免疫缺陷 3M 疾病)— 332K:血液学 /淋巴管(例如,非癌症,血液学 4M 癌、IBD、MS)• 对这些人群的护理(例如,早期阶段通常与肾脏 疾病有关,专业中心病毒抑制 HIV)基于 HCP 的调查显示,重度 COVID-19 的低高风险参考:基于 Invivyd 赞助的市场研究和内部分析得出的说明性图表和估计的市场机会。PrEP: 暴露前预防;RA:类风湿性关节炎;IBD:炎症性肠病;MS:多发性硬化症;HIV:人类免疫缺陷病毒;HCP:医疗保健专业人员 8 根据 HCP 的调查,COVID PrEP 单抗的预期摄取量

如果获得授权,可能在美国推出 VYD222 的商业化准备工作正在进行中,前提是获得授权的进入市场规划(例如市场研究、市场规模/细分市场、品牌战略、实地部队规模)市场准入活动(例如付款人/定价研究、分销渠道)制造初始商业 库存建立必要的内部系统和技术以支持向商业阶段过渡商业化由经验丰富的团队领导,成功地在 传染病空间,例如:9

2023 年第三季度财务预期现金流道将持续到 2024 年第四季度,如果单克隆抗体候选药物是 2023 年 9 月 30 日获得授权或批准的 mAb:单克隆抗体 10,则截至产品收入中,现金、 现金等价物和有价商品收入为2.649亿美元

谢谢