美国
证券交易委员会
华盛顿特区 20549
表单
(Mark One)
在截至的季度期间
或者
在过渡期内 到
委员会档案编号:
(注册人的确切姓名如其章程所示)
|
||
(州或其他司法管辖区 公司或组织) |
|
(美国国税局雇主 识别码) |
|
||
(主要行政办公室地址) |
|
(邮政编码) |
(注册人的电话号码,包括区号)
(如果自上次报告以来发生了变化,则以前的姓名或以前的地址)
根据该法第12(b)条注册的证券:
每个班级的标题 |
|
交易 符号 |
|
每个交易所的名称 在哪个注册了 |
|
|
用勾号指明注册人 (1) 是否在过去 12 个月内(或在要求注册人提交此类报告的较短时间内)提交了 1934 年《证券交易法》第 13 条或第 15 (d) 条要求提交的所有报告,以及 (2) 在过去的 90 天内是否受到此类申报要求的约束。
用勾号指明注册人是否在过去 12 个月(或在要求注册人提交此类文件的较短时间内)以电子方式提交了根据第 S-T 法规 405(本章第 232.405 节)要求提交的所有交互式数据文件。
用复选标记指明注册人是大型加速申报人、加速申报人、非加速申报人、小型申报公司还是新兴成长型公司。参见《交易法》第12b-2条中 “大型加速申报人”、“加速申报公司”、“小型申报公司” 和 “新兴成长型公司” 的定义。
大型加速过滤器 |
☐ |
|
加速过滤器 |
☐ |
☒ |
|
规模较小的申报公司 |
||
|
|
|
新兴成长型公司 |
如果是新兴成长型公司,请用复选标记表明注册人是否选择不使用延长的过渡期来遵守根据《交易法》第13(a)条规定的任何新的或修订后的财务会计准则。
用复选标记表明注册人是否为空壳公司(定义见《交易法》第12b-2条)。是的 ☐没有
截至2023年11月3日,有
前瞻性陈述
这份10-Q表季度报告包含前瞻性陈述,这些陈述反映了我们目前对运营和财务业绩等的看法。除本10-Q表季度报告中包含的历史事实陈述外,所有陈述,包括有关我们的战略、未来运营、未来财务状况、未来收入、预计成本、前景、计划、管理目标和预期市场增长的陈述,均为前瞻性陈述。这些陈述涉及已知和未知的风险、不确定性和其他重要因素,这些因素可能导致我们的实际业绩、业绩或成就与前瞻性陈述所表达或暗示的任何未来业绩、业绩或成就存在重大差异。
在某些情况下,您可以用 “可能”、“应该”、“预期”、“可能”、“计划”、“预期”、“可能”、“打算”、“目标”、“项目”、“考虑”、“相信”、“估计”、“预测”、“潜力”、“寻求”、“将” 或 “继续” 等术语来识别前瞻性陈述,或者这些术语的负面影响其他类似的表达方式。这份10-Q表季度报告中的前瞻性陈述仅是预测。我们的这些前瞻性陈述主要基于我们当前对未来事件和财务趋势的预期和预测,我们认为这些事件和趋势可能会影响我们的业务、财务状况和经营业绩。尽管我们认为前瞻性陈述中反映的预期是合理的,但我们无法保证前瞻性陈述中反映的未来业绩、活动水平、业绩或事件和情况能够实现或发生。这些前瞻性陈述仅代表截至本10-Q表季度报告发布之日,并受第1A项所述的许多风险、不确定性和假设的影响。“风险因素。”由于前瞻性陈述本质上会受到风险和不确定性的影响,其中一些是无法预测或量化的,因此您不应依赖这些前瞻性陈述作为对未来事件的预测。我们的前瞻性陈述中反映的事件和情况可能无法实现或发生,实际结果可能与前瞻性陈述中的预测存在重大差异。可能导致实际业绩与我们的预期不同的一些关键因素包括:
i
尽管我们可能会选择在未来的某个时候更新这些前瞻性陈述,无论是由于任何新信息、未来事件还是其他原因,但除非适用法律要求,否则我们目前无意这样做。
ii
Cogent Biosciences, Inc
目录
|
|
页面 |
|
第一部分—财务信息 |
|
第 1 项。 |
财务报表(未经审计) |
1 |
|
简明合并资产负债表 |
1 |
|
简明合并运营报表和综合亏损报表 |
2 |
|
股东权益简明合并报表 |
3 |
|
简明合并现金流量表 |
5 |
|
未经审计的简明合并财务报表附注 |
6 |
第 2 项。 |
管理层对财务状况和经营业绩的讨论和分析 |
15 |
第 3 项。 |
关于市场风险的定量和定性披露 |
27 |
第 4 项。 |
控制和程序 |
27 |
|
第二部分——其他信息 |
|
第 1 项。 |
法律诉讼 |
28 |
第 1A 项。 |
风险因素 |
28 |
第 2 项。 |
未注册证券的近期销售和所得款项的使用 |
28 |
第 3 项。 |
优先证券违约 |
28 |
第 4 项。 |
矿山安全披露 |
28 |
第 5 项。 |
其他信息 |
28 |
第 6 项。 |
展品 |
29 |
签名 |
30 |
|
iii
第一部分——财务L 信息
第 1 项。金融之星期限(未经审计)
COGENT BIOSCIENCES, INC
浓缩合并 B资产负债表
(以千计,股票和每股金额除外)
(未经审计)
|
|
9月30日 |
|
|
十二月三十一日 |
|
||
|
|
2023 |
|
|
2022 |
|
||
资产 |
|
|
|
|
|
|
||
流动资产: |
|
|
|
|
|
|
||
现金和现金等价物 |
|
$ |
|
|
$ |
|
||
短期有价证券 |
|
|
|
|
|
|
||
预付费用和其他流动资产 |
|
|
|
|
|
|
||
限制性现金 |
|
|
— |
|
|
|
|
|
流动资产总额 |
|
|
|
|
|
|
||
长期有价证券 |
|
|
|
|
|
— |
|
|
经营租赁、使用权资产 |
|
|
|
|
|
|
||
财产和设备,净额 |
|
|
|
|
|
|
||
其他资产 |
|
|
|
|
|
|
||
总资产 |
|
$ |
|
|
$ |
|
||
负债和股东权益 |
|
|
|
|
|
|
||
流动负债: |
|
|
|
|
|
|
||
应付账款 |
|
$ |
|
|
$ |
|
||
应计费用和其他流动负债 |
|
|
|
|
|
|
||
CVR 责任(注3) |
|
|
— |
|
|
|
|
|
经营租赁责任 |
|
|
|
|
|
|
||
流动负债总额 |
|
|
|
|
|
|
||
经营租赁负债,扣除流动部分 |
|
|
|
|
|
|
||
负债总额 |
|
|
|
|
|
|
||
(注七) |
|
|
|
|
|
|
||
股东权益: |
|
|
|
|
|
|
||
优先股,$ |
|
|
— |
|
|
|
— |
|
A系列无表决权可转换优先股,美元 |
|
|
|
|
|
|
||
普通股,$ |
|
|
|
|
|
|
||
额外的实收资本 |
|
|
|
|
|
|
||
累计其他综合亏损 |
|
|
( |
) |
|
|
( |
) |
累计赤字 |
|
|
( |
) |
|
|
( |
) |
股东权益总额 |
|
|
|
|
|
|
||
负债和股东权益总额 |
|
$ |
|
|
$ |
|
||
所附附附注是这些简明合并财务报表不可分割的一部分。
1
COGENT BIOSCIENCES, INC
简明合并运营报表动作和综合损失
(以千计,股票和每股金额除外)
(未经审计)
|
截至9月30日的三个月 |
|
|
截至9月30日的九个月 |
|
||||||||||
|
2023 |
|
|
2022 |
|
|
2023 |
|
|
2022 |
|
||||
运营费用: |
|
|
|
|
|
|
|
|
|
|
|
||||
研究和开发 |
$ |
|
|
$ |
|
|
$ |
|
|
$ |
|
||||
一般和行政 |
|
|
|
|
|
|
|
|
|
|
|
||||
运营费用总额 |
|
|
|
|
|
|
|
|
|
|
|
||||
运营损失 |
|
( |
) |
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
其他收入: |
|
|
|
|
|
|
|
|
|
|
|
||||
利息收入 |
|
|
|
|
|
|
|
|
|
|
|
||||
其他收入,净额 |
|
— |
|
|
|
|
|
|
|
|
|
|
|||
CVR 负债公允价值的变化 |
|
— |
|
|
|
— |
|
|
|
|
|
|
— |
|
|
其他收入总额,净额 |
|
|
|
|
|
|
|
|
|
|
|
||||
净亏损 |
$ |
( |
) |
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
( |
) |
归属于普通股股东的每股净亏损,基本亏损和摊薄后 |
$ |
( |
) |
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
( |
) |
已发行普通股、基本股和摊薄后加权平均值 |
|
|
|
|
|
|
|
|
|
|
|
||||
综合损失: |
|
|
|
|
|
|
|
|
|
|
|
||||
净亏损 |
$ |
( |
) |
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
( |
) |
其他综合损失: |
|
|
|
|
|
|
|
|
|
|
|
||||
有价证券的未实现净亏损 |
|
( |
) |
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
其他综合损失总额 |
|
( |
) |
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
综合损失 |
$ |
( |
) |
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
( |
) |
所附附附注是这些简明合并财务报表不可分割的一部分。
2
COGENT BIOSCIENCES, INC
简明合并报表 股东权益
(以千计,股票金额除外)
(未经审计)
|
|
A 系列无投票权 |
|
|
普通股 |
|
|
额外 |
|
|
累积其他综合版 |
|
|
累积的 |
|
|
总计 |
|
||||||||||||||
|
|
股份 |
|
|
金额 |
|
|
股份 |
|
|
金额 |
|
|
资本 |
|
|
收入(亏损) |
|
|
赤字 |
|
|
公平 |
|
||||||||
截至2022年12月31日的余额 |
|
|
|
|
$ |
|
|
|
|
|
$ |
|
|
$ |
|
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
|
||||||
首选 A 系列无表决权的转换 |
|
|
( |
) |
|
|
( |
) |
|
|
|
|
|
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|||
在 “员工” 项下发行普通股 |
|
|
— |
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
|
|||
行使时发行普通股 |
|
|
— |
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
|
|||
有价证券的未实现收益 |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
|
||
股票薪酬支出 |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
|
||
净亏损 |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
( |
) |
|
|
( |
) |
截至2023年3月31日的余额 |
|
|
|
|
$ |
|
|
|
|
|
$ |
|
|
$ |
|
|
$ |
|
|
$ |
( |
) |
|
$ |
|
|||||||
在承销公众中发行普通股 |
|
|
— |
|
|
|
— |
|
|
|
|
|
|
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
|
||||
行使时发行普通股 |
|
|
— |
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
|
|||
有价证券的未实现亏损 |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
- |
|
|
|
( |
) |
|
|
— |
|
|
|
( |
) |
股票薪酬支出 |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
|
||
净亏损 |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
- |
|
|
|
— |
|
|
|
( |
) |
|
|
( |
) |
截至2023年6月30日的余额 |
|
|
|
|
$ |
|
|
|
|
|
$ |
|
|
$ |
|
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
|
||||||
首选 A 系列无表决权的转换 |
|
|
( |
) |
|
|
( |
) |
|
|
|
|
|
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|||
行使时发行普通股 |
|
|
— |
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
|
|||
在 “员工” 项下发行普通股 |
|
|
— |
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
|
|||
有价证券的未实现亏损 |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
( |
) |
|
|
— |
|
|
|
( |
) |
股票薪酬支出 |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
|
||
净亏损 |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
( |
) |
|
|
( |
) |
截至2023年9月30日的余额 |
|
|
|
|
$ |
|
|
|
|
|
$ |
|
|
$ |
|
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
|
||||||
3
|
|
A 系列无投票权 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
可转换首选 |
|
|
普通股 |
|
|
额外 |
|
|
累积的 |
|
|
累积的 |
|
|
总计 |
|
||||||||||||||
|
|
股份 |
|
|
金额 |
|
|
股份 |
|
|
金额 |
|
|
资本 |
|
|
损失 |
|
|
赤字 |
|
|
公平 |
|
||||||||
截至2021年12月31日的余额 |
|
|
|
|
$ |
|
|
|
|
|
$ |
|
|
$ |
|
|
$ |
— |
|
|
$ |
( |
) |
|
$ |
|
||||||
首选 A 系列无表决权的转换 |
|
|
( |
) |
|
|
( |
) |
|
|
|
|
|
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|||
发行普通股以结算CVR |
|
|
— |
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
|
|||
发行服务类普通股 |
|
|
— |
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
|
|||
股票薪酬支出 |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
|
||
净亏损 |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
( |
) |
|
|
( |
) |
截至2022年3月31日的余额 |
|
|
|
|
$ |
|
|
|
|
|
$ |
|
|
$ |
|
|
$ |
- |
|
|
$ |
( |
) |
|
$ |
|
||||||
发行普通股并预先筹集资金 |
|
|
— |
|
|
|
— |
|
|
|
|
|
|
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
|
||||
首选 A 系列无表决权的转换 |
|
|
( |
) |
|
|
( |
) |
|
|
|
|
|
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|||
股票薪酬支出 |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
|
||
净亏损 |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
( |
) |
|
|
( |
) |
截至2022年6月30日的余额 |
|
|
|
|
$ |
|
|
|
|
|
$ |
|
|
$ |
|
|
$ |
- |
|
|
$ |
( |
) |
|
$ |
|
||||||
首选 A 系列无表决权的转换 |
|
|
( |
) |
|
|
( |
) |
|
|
|
|
|
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|||
预先拨款的认股权证 |
|
|
— |
|
|
|
— |
|
|
|
|
|
|
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
|
||||
在 “员工” 项下发行普通股 |
|
|
— |
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
|
|||
行使时发行普通股 |
|
|
— |
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
|
|||
有价证券的未实现净亏损 |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
( |
) |
|
|
— |
|
|
|
( |
) |
股票薪酬支出 |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
|
||
净亏损 |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
( |
) |
|
|
( |
) |
截至2022年9月30日的余额 |
|
|
|
|
$ |
|
|
|
|
|
$ |
|
|
$ |
|
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
|
||||||
所附附附注是这些简明合并财务报表不可分割的一部分。
4
COGENT BIOSCIENCES, INC
简明合并报表净现金流
(以千计)
(未经审计)
|
|
九个月已结束 |
|
|||||
|
|
2023 |
|
|
2022 |
|
||
来自经营活动的现金流: |
|
|
|
|
|
|
||
净亏损 |
|
$ |
( |
) |
|
$ |
( |
) |
为使净亏损与经营活动中使用的净现金相一致而进行的调整: |
|
|
|
|
|
|
||
折旧和摊销费用 |
|
|
|
|
|
|
||
股票薪酬支出 |
|
|
|
|
|
|
||
经营租赁、使用权资产的摊销 |
|
|
|
|
|
|
||
CVR 负债公允价值的变化 |
|
|
( |
) |
|
|
— |
|
有价证券溢价(折扣)的净摊销(增加) |
|
|
( |
) |
|
|
( |
) |
使用权资产减值 |
|
|
— |
|
|
|
( |
) |
运营资产和负债的变化: |
|
|
|
|
|
|
||
预付费用和其他流动资产 |
|
|
( |
) |
|
|
( |
) |
其他资产 |
|
|
( |
) |
|
|
( |
) |
应付账款 |
|
|
|
|
|
|
||
应计费用和其他流动负债 |
|
|
|
|
|
|
||
经营租赁责任 |
|
|
( |
) |
|
|
( |
) |
用于经营活动的净现金 |
|
|
( |
) |
|
|
( |
) |
来自投资活动的现金流: |
|
|
|
|
|
|
||
购买财产和设备 |
|
|
( |
) |
|
|
( |
) |
购买有价证券 |
|
|
( |
) |
|
|
( |
) |
有价证券的到期日和销售 |
|
|
|
|
|
— |
|
|
用于投资活动的净现金 |
|
|
( |
) |
|
|
( |
) |
来自融资活动的现金流: |
|
|
|
|
|
|
||
发行普通股的收益,扣除发行成本为美元 |
|
|
|
|
|
— |
|
|
发行普通股和预先注资认股权证的收益,扣除发行成本为美元 |
|
|
— |
|
|
|
|
|
员工股票购买计划中的股票发行收益 |
|
|
|
|
|
|
||
行使股票期权时发行普通股的收益 |
|
|
|
|
|
|
||
预先资助的认股权证行使的收益 |
|
|
— |
|
|
|
|
|
融资活动提供的净现金 |
|
|
|
|
|
|
||
现金、现金等价物和限制性现金净减少 |
|
|
( |
) |
|
|
( |
) |
期初现金、现金等价物和限制性现金 |
|
|
|
|
|
|
||
期末现金、现金等价物和限制性现金 |
|
$ |
|
|
$ |
|
||
现金流信息的补充披露: |
|
|
|
|
|
|
||
为换取新的经营租赁负债而获得的使用权资产 |
|
$ |
— |
|
|
$ |
|
|
非现金投资和融资信息的补充披露: |
|
|
|
|
|
|
||
发行成本包含在应付账款和应计费用中 |
|
$ |
|
|
$ |
|
||
应付账款和应计费用中包含的财产和设备 |
|
$ |
|
|
$ |
|
||
将A系列可转换优先股转换为普通股 |
|
$ |
|
|
$ |
|
||
所附附附注是这些简明合并财务报表不可分割的一部分。
5
COGENT BIOSCIENCES, INC
简明合并附注 财务报表
(未经审计)
1。业务性质和陈述基础
Cogent Biosciences, Inc.(“Cogent” 或 “公司”)是一家专注于开发针对基因定义疾病的精准疗法的生物技术公司。Cogent的方法是设计合理的精准疗法,以治疗疾病的根本原因并改善患者的生活。Cogent 最先进的项目是贝珠克拉替尼,也称为 CGT9486,这是一种高度选择性的酪氨酸激酶抑制剂,旨在有效抑制 KIT D816V 突变以及 KIT 外显子 17 中的其他突变。在绝大多数情况下,KIT D816V 是导致系统性肥大细胞增多症(“SM”)的原因,这是一种由肥大细胞不受控制的增殖引起的严重而罕见的疾病。晚期胃肠道间质瘤(“GIST”)患者中也发现了外显子17突变,这是一种高度依赖致癌KIT信号的癌症。Bezuclastinib 是一种高度选择性和有效的 KIT 抑制剂,有可能为这些患者群体提供新的治疗选择。除贝珠克拉替尼外,该公司的研究团队正在开发一系列新的靶向疗法,以帮助患者对抗严重的基因驱动疾病,最初的靶向是 FGFR2 和 eRbb2。
公司面临生物技术行业早期公司常见的风险和不确定性,包括但不限于竞争对手开发新技术创新、对关键人员的依赖、对专有技术的保护、遵守政府法规以及获得额外资金为运营提供资金的能力。目前正在开发的候选产品将需要大量的额外研发工作,包括在商业化之前进行广泛的临床前和临床测试以及监管部门的批准。这些工作需要大量的额外资本、充足的人员和基础设施以及广泛的合规报告能力。即使该公司的药物开发工作取得了成功,也不确定该公司何时(如果有的话)会从产品销售中获得收入。
所附的简明合并财务报表是在业务连续性、资产变现以及正常业务过程中偿还负债和承诺的基础上编制的。自成立以来,公司经常出现亏损,包括净亏损 $
该公司预计,将继续承担与其持续业务活动相关的巨额费用。公司将需要通过股权发行、债务融资、合作、许可安排或其他营销和分销安排、伙伴关系、合资企业、合并或剥离其一项或多项资产或业务来寻求额外资金。公司可能无法以可接受的条件获得融资,或者根本无法获得融资,公司也可能无法达成合作安排或剥离其资产。任何融资条款都可能对公司股东的持股或权利产生不利影响。与合作者或其他人的安排可能要求公司放弃对其某些技术或候选产品的权利。如果公司无法获得资金,公司可能被迫推迟、减少或取消其研发计划或商业化工作,这可能会对其业务前景产生不利影响,或者公司可能无法继续运营。
6
2。重要会计政策摘要
未经审计的中期财务信息
截至2022年12月31日的合并资产负债表来自经审计的财务报表,但不包括GAAP要求的所有披露。所附的截至2023年9月30日以及截至2023年9月30日和2022年9月30日的三个月和九个月的未经审计的简明合并财务报表由公司根据美国证券交易委员会(“SEC”)中期财务报表的细则和条例编制。根据此类细则和条例,通常包含在根据公认会计原则编制的财务报表中的某些信息和脚注披露已被压缩或省略。这些简明的合并财务报表应与公司截至2022年12月31日止年度的经审计的合并财务报表及其附注一起阅读,这些附注包含在公司10-K表年度报告中 已向美国证券交易委员会备案。管理层认为,所有调整均已完成,仅包括公允列报公司截至2023年9月30日的财务状况以及截至2023年9月30日和2022年9月30日的三个月和九个月的经营业绩以及截至2023年9月30日和2022年9月30日的九个月的现金流所需的正常经常性调整。公司截至2023年9月30日的三个月和九个月的经营业绩不一定代表截至2023年12月31日止年度的预期经营业绩.
整合原则
随附的简明合并财务报表包括公司及其全资子公司Mono, Inc.和Kiq Bio LLC的账目。所有公司间账户和交易均已删除。
估算值的使用
根据公认会计原则编制简明合并财务报表要求管理层做出估算和假设,这些估计和假设会影响报告的资产和负债金额、简明合并财务报表发布之日的或有资产和负债的披露以及报告期内报告的支出金额。这些简明合并财务报表中反映的重要估计和假设包括但不限于研发费用的应计、CVR负债的估值和股票奖励的估值。公司的估算基于历史经验、已知趋势以及其认为在这种情况下合理的其他市场特定因素或其他相关因素。随着情况、事实和经验的变化,管理层不断评估其估计。实际结果可能与这些估计或假设不同。
有价证券
公司的有价证券包括债务证券,被归类为可供出售。可供出售的有价债务证券按公允价值记账,在实现之前,未实现的损益作为股东权益的一部分计入其他综合收益(亏损)。购买时产生的任何溢价或折扣都将摊销和/或计入工具寿命内的利息收入和/或支出。已实现的收益和亏损使用特定的识别方法确定,并计入其他收入(支出)。公司使用定量和定性因素审查其可供出售债务证券投资组合,以确定公允价值低于成本的下降是否是由信贷相关损失或其他因素造成的。如果公允价值下降是信贷相关因素造成的,则亏损记入净收益,如果公允价值的下降不是信贷相关因素造成的,则亏损记入其他综合收益(亏损)。
3。有价证券和金融资产与负债的公允价值
下表汇总了公司的有价证券 (以千计):
|
|
2023年9月30日 |
|
|||||||||||||
|
|
摊销 |
|
|
格罗斯 |
|
|
格罗斯 |
|
|
公平 |
|
||||
美国国库券和票据(一年内到期) |
|
$ |
|
|
$ |
|
|
$ |
( |
) |
|
$ |
|
|||
美国国库券和票据(一至五年后到期) |
|
|
|
|
|
— |
|
|
|
( |
) |
|
|
|
||
|
|
$ |
|
|
$ |
|
|
$ |
( |
) |
|
$ |
|
|||
7
|
|
2022年12月31日 |
|
|||||||||||||
|
|
摊销 |
|
|
格罗斯 |
|
|
格罗斯 |
|
|
公平 |
|
||||
美国国库券和票据(一年内到期) |
|
$ |
|
|
$ |
— |
|
|
$ |
( |
) |
|
$ |
|
||
|
|
$ |
|
|
$ |
— |
|
|
$ |
( |
) |
|
$ |
|
||
截至2023年9月30日,该公司持有
下表显示了公司金融资产和负债的公允价值层次结构,这些资产和负债经常按公允价值计量 (以千计):
|
|
2023 年 9 月 30 日的公允价值衡量方法使用: |
|
|||||||||||||
|
|
第 1 级 |
|
|
第 2 级 |
|
|
第 3 级 |
|
|
总计 |
|
||||
资产: |
|
|
|
|
|
|
|
|
|
|
|
|
||||
现金等价物: |
|
|
|
|
|
|
|
|
|
|
|
|
||||
货币市场基金 |
|
$ |
|
|
$ |
— |
|
|
$ |
— |
|
|
$ |
|
||
有价证券: |
|
|
|
|
|
|
|
|
|
|
|
|
||||
美国国库券和票据 |
|
$ |
— |
|
|
$ |
|
|
$ |
— |
|
|
$ |
|
||
总资产 |
|
$ |
|
|
$ |
|
|
$ |
— |
|
|
$ |
|
|||
|
|
2022 年 12 月 31 日的公允价值衡量标准使用: |
|
|||||||||||||
|
|
第 1 级 |
|
|
第 2 级 |
|
|
第 3 级 |
|
|
总计 |
|
||||
资产: |
|
|
|
|
|
|
|
|
|
|
|
|
||||
现金等价物: |
|
|
|
|
|
|
|
|
|
|
|
|
||||
货币市场基金 |
|
$ |
|
|
$ |
— |
|
|
$ |
— |
|
|
$ |
|
||
有价证券: |
|
|
|
|
|
|
|
|
|
|
|
|
||||
美国国库券和票据 |
|
$ |
— |
|
|
$ |
|
|
$ |
— |
|
|
$ |
|
||
总资产 |
|
$ |
|
|
$ |
|
|
$ |
— |
|
|
$ |
|
|||
负债: |
|
|
|
|
|
|
|
|
|
|
|
|
||||
CVR 责任 |
|
$ |
— |
|
|
$ |
— |
|
|
$ |
|
|
$ |
|
||
负债总额 |
|
$ |
— |
|
|
$ |
— |
|
|
$ |
|
|
$ |
|
||
货币市场基金使用活跃市场的报价进行估值,这代表了公允价值层次结构中的第一级衡量标准。公司使用类似证券活跃市场的报价对美国国库券和票据进行估值,这代表了公允价值层次结构中的第二级衡量标准。
2020年7月6日,公司发行了不可转让的或有价值权(“CVR”),该权已分配给截至2020年7月6日营业结束时的登记股东,也是在发行收购Kiq Bio LLC(“Kiq”)(“Kiq”)(“Kiq收购”)或出售给私募股权投资(“PIPE”)投资者之前。CVR的持有人有权从公司收到的与处置其遗留细胞疗法资产相关的收益(如果有)中获得普通股和/或现金付款,期限为
8
该公司在其简明合并资产负债表上将CVR归类为负债。CVR负债的公允价值是使用概率加权贴现现金流法确定的,用于估算与出售遗留细胞疗法资产相关的未来现金流,包括Bolt-on Chimeric 受体(“BOXR”)技术和自体细胞疗法工业自动化技术(统称为 “BOXR 平台”)、抗体偶联T细胞受体技术和其他固定资产,随后的每个季度结束,减去某些允许的扣除额。对于公司在2020年12月31日之前收到的销售收益,CVR持有人将获得的普通股数量是通过将公司收到的收益除以2020年7月6日公司普通股的收盘价来确定的
2020年8月28日,该公司将其与BOXR平台相关的资产、权益出售给了Sotio。根据BOXR平台购买协议,Sotio已同意向公司支付不超过美元的总现金对价
2022年第四季度,公司更新了概率加权贴现现金流假设,以反映当时在CVR到期之前从Sotio收到里程碑付款的概率。根据公司对可用信息的评估,此更新导致在CVR到期之前获得里程碑付款的可能性降低,CVR负债也相应减少了美元
下表汇总了公司CVR负债公允价值的变化 (以千计):
截至2021年12月31日的余额 |
|
$ |
|
|
|
|
( |
) |
|
截至2022年12月31日的余额 |
|
$ |
|
|
|
|
( |
) |
|
截至 2023 年 9 月 30 日的余额 |
|
$ |
|
在截至2023年9月30日和2022年9月30日的三个月和九个月中,有
4。应计费用和其他流动负债
应计费用和其他流动负债包括以下内容 (以千计):
|
|
9月30日 |
|
|
十二月三十一日 |
|
||
应计员工薪酬和福利 |
|
$ |
|
|
$ |
|
||
应计外部研发费用 |
|
|
|
|
|
|
||
应计外部制造成本 |
|
|
|
|
|
|
||
累积的专业和咨询服务 |
|
|
|
|
|
|
||
其他 |
|
|
|
|
|
|
||
总计 |
|
$ |
|
|
$ |
|
||
9
5。优先股、A系列无表决权可转换优先股和普通股
公司的法定股本包括
A系列无表决权可转换优先股
2020年7月6日,公司向特拉华州国务卿提交了与Kiq收购和PIPE有关的A系列无表决权可转换优先股(“A系列优先股”)的优先权、权利和限制指定证书(“指定证书”)。指定证书规定发行面值为 $ 的 A 系列优先股
A系列优先股的持有人有权获得A系列优先股的股息,股息等于按原样转换为普通股,其形式与实际支付普通股的股息相同。除非法律另有要求,否则A系列优先股没有投票权。但是,只要A系列优先股的任何股票已流通,如果没有A系列优先股大多数持有人的赞成票,公司就不会(a)对赋予A系列优先股的权力、优先权或权利进行不利的改变或改变,(b)修改或修改指定证书,(c)以任何对任何权利产生不利影响的方式修改其公司注册证书或其他章程文件 A系列优先股的持有人,(d)增加A系列优先股的数量A系列优先股的授权股份,(e)在股东批准转换提案之前或至少在任何时候
A系列优先股的每股股票均可根据持有人的选择随时转换为
尚未指定其他类别的优先股,并且
普通股
2022年5月6日,公司向美国证券交易委员会提交了S-3表格的货架注册声明。货架注册声明允许公司不时出售,最高可达美元
此外,2022年5月6日,根据S-3表格,公司与古根海姆证券有限责任公司(“古根海姆证券”)签订了销售协议(“销售协议”),根据该协议,公司可以不时发行和出售总发行价不超过美元的普通股
在六月2022 年 13 月 13 日,公司完成了承销公开发行
10
每份预先注资的认股权证都使持有人有权以美元的行使价购买普通股
2023 年 2 月 10 日,公司向美国证券交易委员会提交了 S-3ASR 表格(“2023 年上架登记”),用于发行普通股、优先股、认股证、权利、债务证券和单位,该表格在提交后立即生效。在2023年上架注册声明所涵盖的任何证券上市出售时,将准备一份招股说明书补充文件并提交给美国证券交易委员会,其中包含有关任何此类发行条款的具体信息。
2023 年 6 月,公司完成了承销公开发行
6。股票薪酬
2018 年股票期权和激励计划
公司的2018年股票期权和激励计划(“2018年计划”)于2018年3月27日生效,规定授予激励性股票期权、非合格股票期权、股票增值权、限制性股票单位、限制性股票奖励、非限制性股票奖励、基于现金的奖励和股息等值权。根据2018年计划最初预留发行的股票数量为
根据2018年计划预留发行的授权股票数量增加了
激励计划
2020 年 10 月 22 日,董事会通过了 Cogent Biosciences, Inc. 2020 年激励计划(“激励计划”)。董事会还通过了一种不合格股票期权协议,用于激励计划。总共是
11
2018 年员工股票购买计划
该公司的2018年员工股票购买计划(“ESPP”)于2018年3月28日生效,当时共有
基于绩效的限制性股票单位
2023 年 2 月,董事会批准的补助金总额不超过
股票薪酬
下表汇总了该期间的股票薪酬支出 截至 2023 年 9 月 30 日的三个月和九个月 (以千计):
|
|
截至9月30日的三个月 |
|
|
截至9月30日的九个月 |
|
||||||||||
|
|
2023 |
|
|
2022 |
|
|
2023 |
|
|
2022 |
|
||||
按奖励类型划分的股票薪酬支出: |
|
|
|
|
|
|
|
|
|
|
|
|
||||
基于时间的股票期权 |
|
$ |
|
|
$ |
|
|
$ |
|
|
$ |
|
||||
员工股票购买计划 |
|
|
|
|
|
|
|
|
|
|
|
|
||||
基于绩效的限制性股票单位 |
|
|
|
|
|
— |
|
|
|
|
|
|
— |
|
||
总计 |
|
$ |
|
|
$ |
|
|
$ |
|
|
$ |
|
||||
公司将股票薪酬支出记入其简明合并运营报表和综合亏损表的以下支出类别 (以千计):
|
截至9月30日的三个月 |
|
|
截至9月30日的九个月 |
|
||||||||||
|
2023 |
|
|
2022 |
|
|
2023 |
|
|
2022 |
|
||||
研究和开发费用 |
|
|
|
$ |
|
|
$ |
|
|
$ |
|
||||
一般和管理费用 |
|
|
|
|
|
|
|
|
|
|
|
||||
总计 |
$ |
|
|
$ |
|
|
$ |
|
|
$ |
|
||||
截至2023年9月30日,与未归属股票期权相关的未确认补偿成本总额为美元
截至2023年9月30日,与未归属PSU的股价障碍相关的未确认补偿成本总额为美元
12
7。承诺和意外开支
许可协议
Plexxikon 许可协议
2020年7月,公司获得了某些专利和其他知识产权的独家、可再许可的全球许可(“许可协议”),用于研究、开发和商业化贝珠克拉替尼。根据许可协议的条款,公司必须向Plexxikon Inc.(“Plexxikon”)支付总额不超过美元的款项
该公司还必须支付Plexxikon的分级特许权使用费,从低的个位数百分比到高个位数的百分比不等。这些特许权使用费义务按产品逐项和逐个国家/地区持续到(i)在该国家/地区没有有效的Plexxikon许可专利申请之日或者(ii)该产品在该国家/地区首次商业销售之日起十周年之日为止。此外,如果公司对许可协议下的权利进行再许可,则公司必须向Plexxikon支付一定比例的分许可收入,从中等的两位数百分比到中等个位数的百分比不等,具体取决于分许可是在某些临床试验事件之前还是之后签订的。
赔偿协议
在正常业务过程中,公司可能会就某些事项向卖方、出租人、业务合作伙伴和其他方提供范围和条款不同的赔偿,包括但不限于因违反此类协议或第三方提出的知识产权侵权索赔而产生的损失。此外,公司已与董事会成员及其执行官签订了赔偿协议,除其他外,要求公司向他们赔偿因董事或高级管理人员身份或服务而可能产生的某些责任。在许多情况下,根据这些赔偿协议,公司未来可能支付的最大潜在款额是无限的。迄今为止,公司尚未因此类赔偿而产生任何物质费用。公司不知道赔偿安排下的任何索赔会对其财务状况、经营业绩或现金流产生重大影响,并且在截至2023年9月30日的简明合并财务报表或截至2022年12月31日的合并财务报表中,也没有应计任何与此类债务相关的负债。
法律诉讼
公司目前不是任何重大法律诉讼的当事方。在每个报告日,公司都会根据涉及意外开支会计的权威指导方针的规定,评估潜在损失金额或潜在损失范围是否可能且是否可以合理估计。公司承担的费用是与此类法律诉讼相关的费用。
13
8。每股净亏损
每股普通股基本净亏损和摊薄后净亏损的计算方法如下 (以千计,股票和每股金额除外):
|
截至9月30日的三个月 |
|
|
截至9月30日的九个月 |
|
||||||||||
|
2023 |
|
|
2022 |
|
|
2023 |
|
|
2022 |
|
||||
分子: |
|
|
|
|
|
|
|
|
|
|
|
||||
净亏损 |
$ |
( |
) |
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
( |
) |
归属于普通股股东的净亏损 |
$ |
( |
) |
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
( |
) |
分母: |
|
|
|
|
|
|
|
|
|
|
|
||||
已发行普通股的加权平均值,基本 |
|
|
|
|
|
|
|
|
|
|
|
||||
每股普通股净亏损,基本亏损和摊薄后 |
$ |
( |
) |
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
( |
) |
公司的潜在摊薄证券已被排除在摊薄后的每股净亏损的计算之外,因为其影响将是反稀释的,并将导致每股净亏损减少。公司在计算上述期间归属于普通股股东的摊薄后每股净亏损时,将以下潜在普通股(根据每个期末的未偿还金额列报)排除在内,因为将其包括在内会产生反稀释作用:
|
|
9月30日 |
|
|||||
|
|
2023 |
|
|
2022 |
|
||
购买普通股的股票期权 |
|
|
|
|
|
|
||
须归属的限制性股票单位 |
|
|
|
|
|
— |
|
|
A 系列优先股 |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
||
根据ASC主题260(每股收益),未偿还的预融资认股权证包含在基本和摊薄后的每股净亏损的计算中,因为行使价可以忽略不计(美元
9。退休计划
根据《美国国税法》(“401(k)计划”)第401(k)条,公司有固定缴款计划。401(k)计划涵盖所有符合规定的最低年龄和服务要求的员工,并允许参与者将年度薪酬的一部分推迟到税前basis。401(k)计划允许酌情对等缴款
14
第 2 项。管理层的讨论和分析 财务状况和经营业绩。
以下对我们财务状况和经营业绩的讨论和分析应与本10-Q表季度报告和10-K表年度报告其他地方出现的简明合并财务报表和相关附注一起阅读。本讨论和分析中包含或本10-Q表季度报告其他地方列出的某些信息,包括与我们的业务计划和战略有关的信息,包括涉及风险和不确定性的前瞻性陈述。由于某些因素,包括但不限于本10-Q表季度报告中 “风险因素” 标题下列出的因素,我们的实际业绩可能与这些前瞻性陈述中的预期存在重大差异。
概述
我们是一家生物技术公司,专注于为基因定义的疾病开发精准疗法。我们的方法是设计合理的精准疗法,以治疗疾病的根本原因并改善患者的生活。我们最先进的项目是贝珠克拉替尼,也称为 CGT9486,这是一种高选择性的酪氨酸激酶抑制剂,旨在有效抑制 KIT D816V 突变以及 KIT 外显子 17 中的其他突变。在绝大多数情况下,KIT D816V 是导致系统性肥大细胞增多症(“SM”)的原因,这是一种由肥大细胞不受控制的增殖引起的严重而罕见的疾病。晚期胃肠道间质瘤(“GIST”)患者中也发现了外显子17突变,这是一种高度依赖致癌KIT信号的癌症。Bezuclastinib是一种高度选择性和有效的KIT抑制剂,有可能为这些患者群体提供新的治疗选择。除贝珠克拉替尼外,Cogent 研究团队正在开发一系列新的靶向疗法,以帮助患者对抗严重的基因驱动疾病,最初的靶向疗法是 FGFR2 和 eRbb2。
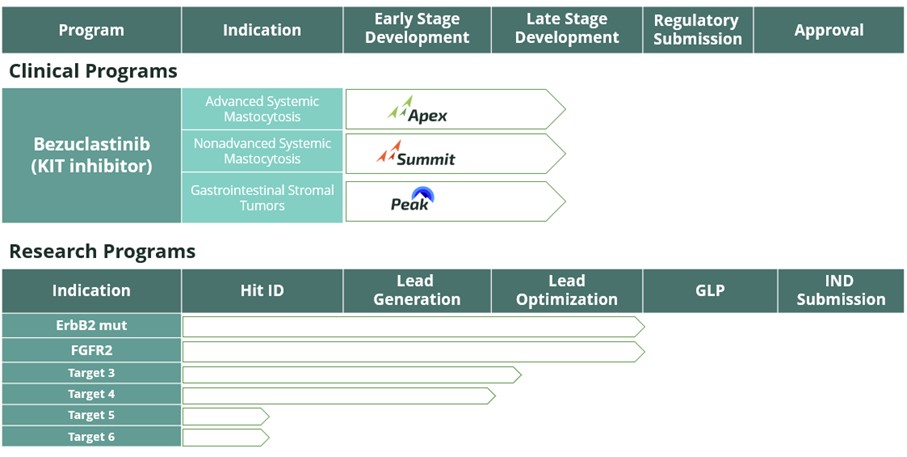
以下是我们当前临床和临床前项目状况的说明:
管道

贝祖克拉替尼
2021 年 10 月,我们在2021 年 AACR-NCI-EORTC 分子靶点和癌症治疗虚拟国际会议上以虚拟海报形式展示了临床前数据,该会议确定贝珠拉斯替尼是一种差异化、强效和选择性的 KIT 突变体抑制剂,对 KIT D816V 具有独特的选择性,并且几乎没有证据表明脑部穿透可以避免靶向 PDGFR 亚型。2022年4月,我们在2022年美国癌症研究协会年会(“AACR”)上公布了更多临床前数据,表明贝珠曲替尼可有效抑制A环突变,对其他密切相关的激酶具有极好的选择性,其区别在于其缺乏大脑穿透力。我们还提供了临床前数据,支持贝珠克拉替尼抑制 KIT 下游信号传导并以临床可达到的剂量推动肿瘤复发。
15
我们正在继续在晚期系统性肥大细胞增多症(“AdvSM”)和非晚期系统性肥大细胞增多症(“非AdvSM”)患者中开发贝珠克拉替尼。绝大多数 advSM 和非 advSM 患者都有 KIT D816V 突变。AdvSM 患者的寿命明显缩短,中位存活率小于 3.5 年。对于非AdvSM患者,尽管他们的寿命不受该疾病的影响,但这些患者的生活质量很差,迫切需要新的治疗选择。美国食品药品管理局已将贝珠克拉替尼指定为用于治疗肥大细胞增多症的孤儿药。
APEX是我们针对advSM患者的全球性、开放标签、多中心、2期临床试验,旨在评估贝珠克拉替尼的安全性、疗效、药代动力学和药效学特征。2022年6月,我们在2022年欧洲血液学协会年会上报告了正在进行的APEX试验的积极初步临床数据,并在2022年12月的美国血液学会(“ASH”)年会上口头报告了最新的阳性临床数据。2023 年 4 月,我们启动了 APEX 试验的第 2 部分,使用贝珠克拉替尼的优化配方,每日剂量为 150 mg,该配方有望在 2024 年底之前完成注册。另一个APEX队列于2023年第三季度启动,旨在允许伴有相关血液肿瘤的全身性肥大细胞增多症患者同时使用贝珠曲替尼和阿扎西他定。最新的临床结果,包括安全性、耐受性、药代动力学、生物标志物和反应评估,将在2023年12月的2023年ASH年会上公布。
SUMMIT 是我们针对非 advSM 患者的随机、全球、多中心、双盲、安慰剂对照、多部分的 2 期临床试验。该研究旨在评估贝祖克拉替尼对中度至重度惰性系统性肥大细胞增多症或闷烧系统性肥大细胞增多症患者的安全性和有效性。基于贝珠克拉替尼优化配方在PEAK引入试验和健康志愿者研究中的表现,SUMMIT试验方案于2022年进行了修订,允许在剂量探索阶段引入优化配方。2023 年 3 月,Cogent 获得了欧洲监管机构的批准,可以在非 advSM 患者中启动 SUMMIT 试验。我们已开始激活欧盟主要国家的临床试验场所。SUMMIT Part 1 于 2023 年第三季度完成了入组,其中 1a 部分和第 1b 部分中超过 54 名患者的入组人数。SUMMIT 第 1a 部分的初步临床数据将在2023年12月举行的2023年ASH年会上以口头陈述形式公布。来自整个第1部分患者群体的临床数据计划在2024年第一季度的科学会议上公布。SUMMIT 第 2 部分是一项以注册为导向的全球随机安慰剂对照试验,有望在 2024 年上半年启动。
根据我们在一项1/2期临床试验中对50多名晚期实体瘤和GIST患者的研究,我们也在寻求在GIST患者中开发贝珠克拉替尼,其中绝大多数患者患有晚期GIST。GIST 是一种经常由 KIT 突变驱动的疾病,对当前可用疗法的耐药性通常与其他 KIT 突变的出现有关。在单药和组合环境中均观察到贝珠克拉替尼的抗肿瘤活性,包括与舒尼替尼联合使用,舒尼替尼是GIST患者的批准治疗方案。1/2期临床试验的临床数据发表在《美国医学会杂志》上,并在多个科学会议上公布,包括Cogent在2020年年度结缔组织肿瘤学会(“CTOS”)会议上,以及此前由第一三共集团(“Plexxikon”)成员Plexxikon Inc. 在2018年美国临床肿瘤学会年度会议和2017年度CTOS会议上公布。在接受贝珠克拉替尼和舒尼替尼联合治疗且之前未接受过贝珠克拉替尼治疗的15名经过大量预治疗的GIST患者中,确认的客观缓解率为20%,包括两项部分反应和一项完全缓解,而该组的估计无进展存活率(“MPF”)中位数为十二个月。在试验结束后,四名受试者继续通过个体患者 IND 接受贝珠克拉替尼。
PEAK是我们的随机开放标签全球3期临床试验,旨在评估贝珠司替尼联合舒尼替尼与单独使用舒尼替尼相比对先前接受过伊马替尼治疗的局部晚期、不可切除或转移性GIST患者的安全性、耐受性和有效性。美国食品药品管理局和欧洲药品管理局已将贝祖克拉替尼指定为用于治疗GIST的孤儿药。
2021年11月,通过与Serán Biosciences的合作,我们宣布开发贝珠克拉替尼的优化配方,该配方最初用于PEAK先导研究。根据PEAK引入研究的数据,我们使用600 mg剂量的贝珠克拉替尼的优化配方启动了PEAK的随机化部分,在研究的开头部分,该配方显示的临床暴露量等同于GIST 1/2期临床试验中使用的1,000毫克原始配方。
16
PEAK 导入研究的初步安全性和药代动力学数据已在 2022 年 11 月的 CTOS 年会上公布。2023年6月,我们在2023年度美国临床肿瘤学会(“ASCO”)上公布了正在进行的贝珠司替尼联合舒尼替尼的3期PEAK试验的积极导入数据。截至2023年3月29日截止日期,贝珠克拉替尼和舒尼替尼的组合总体耐受性良好,安全性令人鼓舞。估计无进展存活率中位数的数据尚不成熟。数据显示,在经过大量预治疗的GIST患者中,疾病控制率(“DCR”)为55%,其中包括疗效可评估的二线GIST患者的DCR和17%的总体反应率。2023 年 11 月,我们在CTOS年会上公布了正在进行的PEAK试验前期部分的最新临床数据。安全性和耐受性数据与先前在ASCO上提供的数据一致。来自二线GIST患者子集的最新临床活动显示,持续的平均治疗持续时间超过14个月时,确诊的总体反应率(“ORR”)为33%。加上先前报告的1/2期试验的临床数据,在接受该组合治疗的十名可评估的二线GIST患者中,有四名已达到确认的部分反应状态。PEAK研究的第三阶段部分仍有望在2024年底之前完成招生。
bezuclastinib的全球开发和商业化权由Plexxikon独家授权。根据许可协议的条款,Plexxikon获得了预付款,如果满足某些临床里程碑,则有资格获得最高750万美元的额外开发里程碑,如果满足某些监管里程碑,则有资格获得最高2,500万美元的额外开发里程碑。在2022年第二季度,由于Peak研究的进展,达到了第一个临床里程碑,从而在2022年6月向Plexxikon支付了250万美元。
保护贝珠克拉替尼的专利包括在美国和其他关键地区发布的物质权利主张的构成,其排他性将持续到2033年甚至可能通过延长专利期限。此外,我们提交了一份临时专利申请,旨在保护我们的贝珠克拉替尼的优化配方,该配方有可能在至少2043年之前提供排他性。
研究计划
Cogent 研究团队位于科罗拉多州博尔德,专注于开创一流的小分子疗法,以扩大我们的产品线,为医疗需求未得到满足的患者提供新的精准疗法。我们的研究团队正在建立小分子抑制剂产品线,我们的第一批努力旨在靶向成纤维细胞生长因子受体(“FGFR”)中目前未被药物治疗的突变。FGFR 突变是多种疾病中公认的致癌驱动因素,但经批准的药物未能全面反映出FGFR改变的肿瘤类型,而FGFR1介导的高磷血症是泛FGFR抑制剂最常见的剂量限制毒性。
2023 年 4 月,我们在美国癌症研究协会(“AACR”)2023 年年会上报告了临床前数据,提供了 CGT4859 的首个已公布证据,这是一种可逆的、选择性的 FGFR2 抑制剂,涵盖了可避免 FGFR1 抑制的激活和新出现的耐药性突变。临床前数据显示,在有效血浆浓度下,该特征可以为关键看门人和分子制动突变(V564X、N549X)提供等效的覆盖范围,同时避免了任何与FGFR1相关的高磷血症的证据。FGFR22023年10月,我们在2023年AACR-NCI-EORTC分子靶点和癌症治疗学国际会议上公布了最新的临床前数据。临床前数据表明,该特征在 WT FGFR2 和 FGFR2 突变中表现出低的纳摩尔效力,并且对基因组和一系列通道和受体具有选择性。对物种进行的探索性药代动力学研究表明,CGT4859 是一种低清除率化合物,具有很高的口服生物利用度。此外,在突变体驱动的小鼠模型中,CGT4859 表现出剂量反应性肿瘤生长抑制作用,在 5 mg/kg PO 时完全回归,耐受性良好。此外,作为一种可逆抑制剂,Cogent计划保留了对潜在的半胱氨酸491突变的酶效力,这些突变已知是接受共价抑制剂治疗的患者的关键耐药性突变。
我们的研究团队还在推进一项新的eRbb2突变体计划,该计划侧重于各种实体瘤适应症中可操作且服务不足的突变。2023年4月,我们在AACR报告了临床前数据,描述了一系列新型化合物,这些化合物可以有效抑制包括YVMA插入在内的几种关键的Erbb2突变,同时避免抑制表皮生长因子的抑制。这些系列中的一种示例化合物在外周的 erbb2 L755S 驱动的突变体模型以及 erbb2 驱动的颅内模型中显示出与经批准的基准化合物图卡替尼抑制肿瘤生长方面的优势。最近一项新型化学型的项目进展进一步提高了Erbb2的突变效力和选择性,将估计的大脑穿透率提高到40%,并将人类全血稳定性提高到近24小时,这表明在最佳临床疗效方面表现良好。
对于 FGFR2 和 erbb2,我们都看到了与现有疗法相比提供更强大分子反应的机会。我们已经选择了 FGFR2 临床候选药物 CGT4859。支持IND的研究正在进行中,我们预计将在2024年启动临床试验。我们预计将在2024年宣布我们的erbb2临床候选药物。
17
自2014年成立以来,我们将大量精力和财务资源集中在建立和保护我们的知识产权组合、对候选产品进行研发、生产用于临床前研究和临床试验的药物产品材料、为公司配备人员以及筹集资金上。我们没有任何产品获准销售,也没有从产品销售中获得任何收入。我们创造足以实现盈利的产品收入的能力将在很大程度上取决于我们的一个或多个候选产品的成功开发和最终商业化。在截至2023年9月30日的九个月中,我们的净亏损为1.38亿美元,而截至2022年9月30日的九个月净亏损为1.006亿美元。截至2023年9月30日,我们的累计赤字为5.493亿美元。我们预计,至少在未来几年内,将继续产生巨额支出和运营亏损。我们预计,与我们的持续活动相关的支出和资本要求将大幅增加,特别是如果我们:
除非我们成功完成临床开发并获得监管部门对候选产品的批准,否则我们不会从产品销售中获得收入。如果我们的任何候选产品获得监管部门的批准,并且没有建立商业化合作伙伴关系,那么我们预计将产生与发展内部商业化能力以支持产品销售、营销和分销相关的巨额费用。
因此,我们将需要大量额外资金来支持我们的持续运营和实施我们的增长战略。在我们能够从产品销售中获得可观收入之前,我们希望通过股票发行、债务融资、合作、战略联盟以及营销、分销或许可安排相结合的方式为我们的运营提供资金。在需要时,我们可能无法以优惠条件筹集更多资金或签订此类其他协议或安排。如果我们未能在需要时筹集资金或签订协议,我们可能不得不大幅推迟、缩减规模或停止一种或多种候选产品的开发和商业化。
由于与药品开发相关的许多风险和不确定性,我们无法准确预测支出增加的时间或金额,也无法准确预测何时或是否能够实现或维持盈利。即使我们能够创造产品销售,我们也可能无法盈利。如果我们未能实现盈利或无法持续维持盈利能力,那么我们可能无法按计划水平继续运营,被迫减少或终止我们的业务。
截至2023年9月30日,我们的现金、现金等价物和有价证券为3.128亿美元。根据我们目前的计划,我们预计我们目前的现金、现金等价物和有价证券将足以为我们在2026年的运营费用和资本支出需求提供资金。
18
我们的经营业绩的组成部分
运营费用
研究和开发费用
研发费用主要包括我们的研究活动(包括我们的药物发现工作)和候选产品的开发所产生的成本,其中包括:
我们将研发成本按实际支出支出。我们为将来收到的用于研发活动的商品或服务支付的预付款记为预付费用。预付金额在相关商品交付或服务执行时记为支出。
我们的某些直接研发费用是逐个项目跟踪的,包括成本,例如向顾问、承包商、首席营销官和首席研究官支付的与我们的发现、临床前和临床开发活动相关的费用。我们不会将员工成本、与贝珠克拉替尼的生产相关的成本、与我们的发现工作相关的成本、实验室用品和设施(包括折旧或其他间接成本)分配给特定的产品开发计划,因为这些成本分散在多个产品开发计划中,因此没有单独分类。
处于临床开发后期阶段的候选产品的开发成本通常高于临床开发早期阶段的候选产品,这主要是由于后期临床试验的规模和持续时间增加。我们预计,在短期和将来,与计划中的临床和临床前开发活动相关的研发费用将大幅增加。目前,我们无法合理地估计或知道完成任何候选产品的临床前和临床开发所需工作的性质、时间和成本。我们的候选产品的成功开发和商业化具有很大的不确定性。这是由于与产品开发和商业化相关的众多风险和不确定性,包括:
19
与开发我们的任何候选产品有关的这些变量的结果发生变化,都可能显著改变与开发该候选产品相关的成本和时间。我们的任何候选产品都可能永远无法成功获得监管部门的批准。
一般和管理费用
一般和管理费用主要包括行政、财务和管理职能人员的工资和相关成本,包括股票薪酬。一般和管理费用还包括直接和分配的设施相关费用,以及法律、专利、咨询、投资者和公共关系、会计和审计服务的专业费用。我们预计,由于为支持我们正在进行的发现、临床前和临床活动而扩大运营所产生的成本,未来我们的一般和管理费用将增加。
利息收入
利息收入包括我们的现金等价物和有价证券余额所得的利息。
其他收入,净额
其他收入包括与我们的核心业务无关的杂项收入和支出,主要是转租部分前总部设施的收入。
CVR负债公允价值的变化
这包括CVR负债公允价值的变化。
所得税
自成立以来,我们没有为每年的净亏损或产生的研发税收抵免记录任何当期或递延税收优惠,因为我们认为,根据现有证据的权重,我们的净营业亏损结转和税收抵免很可能无法实现。因此,截至2022年12月31日,已为递延所得税资产设立了全额估值补贴。我们重新评估了每个报告期净营业亏损结转额和税收抵免的使用情况。截至2022年12月31日,我们的美国联邦和州净营业亏损结转额分别为1.519亿美元和6,510万美元,可用于抵消未来的应纳税收入,并将于2035年开始到期。在截至2022年12月31日的联邦净营业亏损结转额中,1.487亿美元可以无限期结转,但我们每年最多可以抵消80%的应纳税所得额。截至2022年12月31日,我们的美国联邦和州研发税收抵免结转额分别为1,070万美元和190万美元,可用于抵消未来的所得税负债,并将分别于2040年和2035年开始到期。
根据1986年《美国国税法》第382条和州法律的相应规定,由于以前发生或将来可能发生的所有权变更,美国联邦和州净营业亏损结转额和研发税收抵免结转额的使用可能会受到年度限制。这些所有权变更可能会限制每年可用于抵消未来应纳税所得额的结转金额。通常,根据第382条的定义,所有权变更源于交易在三年内将某些股东或公共团体对公司股票的所有权增加50%以上。
我们在每个资产负债表日期都记录了递延所得税净资产的全额估值补贴。
20
运营结果
截至2023年9月30日的三个月与2022年9月30日的比较
下表汇总了截至2023年9月30日和2022年9月30日的三个月的经营业绩:
|
|
截至9月30日的三个月 |
|
|
|
|
||||||
|
|
2023 |
|
|
2022 |
|
|
改变 |
|
|||
|
|
(以千计) |
|
|
|
|
||||||
运营费用: |
|
|
|
|
|
|
|
|
|
|||
研究和开发 |
|
$ |
50,127 |
|
|
$ |
29,936 |
|
|
$ |
20,191 |
|
一般和行政 |
|
|
9,453 |
|
|
|
6,885 |
|
|
|
2,568 |
|
运营费用总额 |
|
|
59,580 |
|
|
|
36,821 |
|
|
|
22,759 |
|
运营损失 |
|
|
(59,580 |
) |
|
|
(36,821 |
) |
|
|
(22,759 |
) |
其他收入: |
|
|
|
|
|
|
|
|
|
|||
利息收入 |
|
|
4,198 |
|
|
|
1,500 |
|
|
|
2,698 |
|
其他收入,净额 |
|
|
— |
|
|
|
259 |
|
|
|
(259 |
) |
其他收入总额,净额 |
|
|
4,198 |
|
|
|
1,759 |
|
|
|
2,439 |
|
净亏损 |
|
$ |
(55,382 |
) |
|
$ |
(35,062 |
) |
|
$ |
(20,320 |
) |
研究和开发费用
下表汇总了我们在截至2023年9月30日和2022年9月30日的三个月中的研发费用:
|
|
截至9月30日的三个月 |
|
|
|
|
||||||
|
|
2023 |
|
|
2022 |
|
|
改变 |
|
|||
|
|
(以千计) |
|
|
|
|
||||||
直接外部研发费用: |
|
|
|
|
|
|
|
|
|
|||
贝祖克拉替尼 |
|
$ |
27,965 |
|
|
$ |
12,824 |
|
|
$ |
15,141 |
|
临床前研究和发现 |
|
|
4,425 |
|
|
|
4,310 |
|
|
|
115 |
|
未分配的费用: |
|
|
|
|
|
|
|
|
|
|||
人事相关(包括股票薪酬) |
|
|
13,850 |
|
|
|
9,289 |
|
|
|
4,561 |
|
实验室用品、设施相关用品及其他 |
|
|
3,887 |
|
|
|
3,513 |
|
|
|
374 |
|
研发费用总额 |
|
$ |
50,127 |
|
|
$ |
29,936 |
|
|
$ |
20,191 |
|
截至2023年9月30日的三个月,总研发费用与截至2022年9月30日的三个月相比增加了2,020万美元,这得益于与贝珠克拉替尼的制造和开发相关的外部研发成本增加,包括与APEX、SUMMIT和PEAK试验相关的成本,以及我们研究渠道的持续发展。此外,由于员工人数增加,人事成本增加,包括股票薪酬支出,在截至2023年9月30日的三个月中,与截至2022年9月30日的三个月相比增加了200万美元,导致未分配支出增加。支持Cogent Research Team的实验室用品和其他设施成本的增加进一步推动了这一增长。
一般和管理费用
截至2023年9月30日的三个月,一般和管理费用为950万美元,而截至2022年9月30日的三个月中,一般和管理费用为690万美元。一般和管理费用的增加主要是由于员工人数增加推动的人事成本增加,包括股票薪酬支出,在截至2023年9月30日的三个月中,与截至2022年9月30日的三个月相比增加了220万美元。
利息收入
截至2023年9月30日的三个月,利息收入为420万美元,而截至2022年9月30日的三个月,利息收入为150万美元。增长是由于平均利率的提高以及现金等价物和有价证券的投资余额的提高。
21
其他收入,净额
截至2023年9月30日的三个月,其他净收入为零,而截至2022年9月30日的三个月中,净收入为30万美元。其他收入是通过转租我们前公司总部空间的一部分而确认的转租收入。其他净收入的减少是由我们以前的公司总部租约和相关的转租将于2023年4月到期所推动的。
截至2023年9月30日的九个月与2022年9月30日的比较
下表汇总了截至2023年9月30日和2022年9月30日的九个月的经营业绩:
|
|
截至9月30日的九个月 |
|
|
|
|
||||||
|
|
2023 |
|
|
2022 |
|
|
改变 |
|
|||
|
|
(以千计) |
|
|
|
|
||||||
运营费用: |
|
|
|
|
|
|
|
|
|
|||
研究和开发 |
|
$ |
125,036 |
|
|
$ |
84,885 |
|
|
$ |
40,151 |
|
一般和行政 |
|
|
24,866 |
|
|
|
19,209 |
|
|
|
5,657 |
|
运营费用总额 |
|
|
149,902 |
|
|
|
104,094 |
|
|
|
45,808 |
|
运营损失 |
|
|
(149,902 |
) |
|
|
(104,094 |
) |
|
|
(45,808 |
) |
其他收入: |
|
|
|
|
|
|
|
|
|
|||
利息收入 |
|
|
9,207 |
|
|
|
1,879 |
|
|
|
7,328 |
|
其他收入,净额 |
|
|
950 |
|
|
|
1,592 |
|
|
|
(642 |
) |
CVR 负债公允价值的变化 |
|
|
1,700 |
|
|
|
— |
|
|
|
1,700 |
|
其他收入总额,净额 |
|
|
11,857 |
|
|
|
3,471 |
|
|
|
8,386 |
|
净亏损 |
|
$ |
(138,045 |
) |
|
$ |
(100,623 |
) |
|
$ |
(37,422 |
) |
研究和开发费用
下表汇总了我们在截至2023年9月30日和2022年9月30日的九个月中的研发费用:
|
|
截至9月30日的九个月 |
|
|
|
|
||||||
|
|
2023 |
|
|
2022 |
|
|
改变 |
|
|||
|
|
(以千计) |
|
|
|
|
||||||
直接外部研发费用: |
|
|
|
|
|
|
|
|
|
|||
贝祖克拉替尼 |
|
|
61,276 |
|
|
|
42,357 |
|
|
|
18,919 |
|
临床前研究和发现 |
|
|
13,761 |
|
|
|
9,280 |
|
|
|
4,481 |
|
未分配的费用: |
|
|
|
|
|
|
|
|
|
|||
人事相关(包括股票薪酬) |
|
|
38,479 |
|
|
|
25,238 |
|
|
|
13,241 |
|
实验室用品、设施相关用品及其他 |
|
|
11,520 |
|
|
|
8,010 |
|
|
|
3,510 |
|
研发费用总额 |
|
$ |
125,036 |
|
|
$ |
84,885 |
|
|
$ |
40,151 |
|
截至2023年9月30日的九个月中,总研发费用与截至2022年9月30日的九个月相比增加了4,020万美元,这得益于与贝珠克拉替尼的制造和开发相关的外部研发成本增加,包括与APEX、SUMMIT和PEAK试验相关的成本,以及我们研究渠道的持续发展。此外,由于员工人数增加,人事成本增加,包括股票薪酬支出,在截至2023年9月30日的九个月中,与截至2022年9月30日的九个月相比增加了440万美元,导致未分配支出增加。支持Cogent Research Team的实验室用品和其他设施成本的增加进一步推动了这一增长。
22
一般和管理费用
截至2023年9月30日的九个月中,一般和管理费用为2490万美元,而截至2022年9月30日的九个月中,一般和管理费用为1,920万美元。一般和管理费用的增加主要是由于员工人数增加推动的人事成本增加,包括股票薪酬支出,在截至2023年9月30日的九个月中,与截至2022年9月30日的九个月相比增加了400万美元。
利息收入
截至2023年9月30日的九个月中,利息收入为920万美元,而截至2022年9月30日的九个月中,利息收入为190万美元。增长是由于平均利率提高以及现金等价物和有价证券的投资余额增加。
其他收入,净额
截至2023年9月30日的九个月中,其他净收入为100万美元,而截至2022年9月30日的九个月为160万美元。其他收入是通过转租我们前公司总部空间的一部分而确认的转租收入。其他净收入的减少是由我们以前的公司总部租约和相关的转租将于2023年4月到期所推动的。
CVR 负债公允价值的变化
截至2023年9月30日的九个月中,CVR负债的公允价值变化为170万美元。CVR负债公允价值的变化是由于在CVR于2023年8月6日到期之前从Sotio获得里程碑付款的可能性降低。
流动性和资本资源
自成立以来,我们已经蒙受了巨大的营业损失。迄今为止,我们通过与前合作伙伴的融资安排获得的收入有限。我们尚未将任何候选产品商业化,我们预计在几年内不会通过销售任何候选产品来创造收入(如果有的话)。我们历来主要通过证券的公开发行和私募以及从合作协议中获得的对价来为我们的运营提供资金。
2022年5月6日,我们向美国证券交易委员会提交了S-3表格的货架注册声明。上架注册声明允许我们在一次或多次发行中不时出售高达3亿美元的普通股、优先股、债务证券、认股权证或由这些证券的任意组合组成的单位,供我们自己的账户使用。上架注册声明下的任何发行的条款将在发行时确定,并将在任何此类发行完成之前向美国证券交易委员会提交的招股说明书补充文件中进行描述。
此外,2022年5月6日,根据S-3表格,我们与古根海姆证券有限责任公司(“古根海姆证券”)签订了销售协议(“销售协议”),根据该协议,我们可以作为销售代理通过古根海姆证券不时发行和出售总发行价不超过7,500万美元的普通股。截至2023年9月30日,尚未根据销售协议出售任何股票。
2022年6月13日,我们完成了17,899,698股普通股的承销公开发行,公开发行价格为每股8.25美元(包括承销商全额行使购买最多273万股普通股的30天期权),并以预先出资的认股权证代替某些投资者购买3,030,302股普通股每股标的收购价为8.24美元。扣除承保折扣和佣金以及预计的发行费用后,此次发行的净收益约为1.619亿美元。
2023 年 2 月 10 日,我们向美国证券交易委员会提交了 S-3ASR 表格(“2023 年上架登记”),用于发行普通股、优先股、认股证、权利、债务证券和单位,该表格在提交后立即生效。在2023年上架注册声明所涵盖的任何证券上市出售时,将准备一份招股说明书补充文件并提交给美国证券交易委员会,其中包含有关任何此类发行条款的具体信息。
2023年6月,我们完成了14,375,000股普通股的承销公开发行,公开发行价格为每股12美元(包括承销商全额行使购买最多187.5万股普通股的30天期权)。扣除承保折扣和佣金以及发行费用后,此次发行的净收益约为1.618亿美元。
23
截至2023年9月30日,我们有105,346,559股按转换后的已发行普通股,其中包括86,124,249股已发行普通股、可行使606,060股普通股的预融资认股权证,以及74,465股可转换为18,616,250股普通股的A系列优先股。
截至2023年9月30日,我们的现金、现金等价物和有价证券为3.128亿美元,我们认为这将足以为我们在2026年的运营费用和资本支出需求提供资金。
现金流
下表汇总了我们在所列每个时期的现金来源和用途:
|
|
截至9月30日的九个月 |
|
|||||
|
|
2023 |
|
|
2022 |
|
||
|
|
(以千计) |
|
|||||
用于经营活动的现金 |
|
$ |
(109,554 |
) |
|
$ |
(89,230 |
) |
用于投资活动的净现金 |
|
|
(108,313 |
) |
|
|
(153,129 |
) |
融资活动提供的净现金 |
|
|
163,536 |
|
|
|
163,243 |
|
现金、现金等价物和限制性现金净减少 |
|
$ |
(54,331 |
) |
|
$ |
(79,116 |
) |
经营活动
在截至2023年9月30日的九个月中,经营活动使用了1.096亿美元的现金,主要来自1.38亿美元的净亏损,部分被用于经营资产和负债变动的640万美元净现金以及2,200万美元的净非现金费用所抵消。在截至2023年9月30日的九个月中,我们的运营资产和负债的变化主要包括应付账款和应计费用以及其他流动负债增加950万美元,部分抵消了预付费用和其他流动资产增加250万美元、运营租赁负债减少50万美元以及其他资产增加0.1美元。
在截至2022年9月30日的九个月中,经营活动使用了8,920万美元的现金,这主要是由于我们的1.006亿美元净亏损以及用于经营资产和负债变动的600万美元净现金,部分被1,740万美元的净非现金费用所抵消。截至2022年9月30日的九个月中,我们的运营资产和负债的变化主要包括预付费用和其他流动资产增加310万美元,其他资产增加100万美元,运营租赁负债减少830万美元,部分被应付账款、应计费用和其他流动负债增加640万美元所抵消。
投资活动
在截至2023年9月30日的九个月中,用于投资活动的净现金为1.083亿美元,其中包括购买房地产和设备以及有价证券,部分被有价证券的到期日和销售所抵消。
在截至2022年9月30日的九个月中,用于投资活动的净现金为1.531亿美元,其中包括购买房地产和设备以及有价证券。
融资活动
在截至2023年9月30日的九个月中,融资活动提供的净现金为1.635亿美元,其中包括在承销公开发行中发行普通股的1.618亿美元收益,扣除已付发行成本,员工股票购买计划下发行普通股的收益以及行使股票期权时发行普通股的收益。
在截至2022年9月30日的九个月中,融资活动提供的净现金为1.632亿美元,其中包括在承销公开发行中发行普通股和预融资认股权证的1.619亿美元收益,扣除已付发行成本,根据员工股票购买计划发行普通股的收益,股票期权行使中发行普通股的收益以及预先融资认股权证行使的收益。
24
资金需求
我们预计,与正在进行的活动相关的支出将增加,尤其是在我们推进当前和未来任何候选产品的临床开发以及开展更多研究、开发和临床前活动之际。我们运营支出的时间和金额将在很大程度上取决于:
根据我们目前的计划,我们认为,截至2023年9月30日,我们现有的现金、现金等价物和有价证券为3.128亿美元,这将使我们能够为2026年的运营费用和资本支出需求提供资金。我们的估计基于可能被证明是错误的假设,我们可以比预期更快地耗尽可用的资本资源。该公司将需要额外的资金来完成计划中的关键活动,以支持正在进行的研发计划。
在此之前,如果有的话,由于我们可以创造可观的产品收入,因此我们希望通过股票发行、债务融资、合作、战略联盟以及营销、分销或许可安排相结合的方式为我们的运营提供资金。如果我们通过出售股权或可转换债务证券筹集额外资金,则现有的所有权权益将被稀释,这些证券的条款可能包括对普通股股东的权利产生不利影响的清算或其他优惠。债务融资和优先股融资(如果有)可能涉及包括契约在内的协议,这些协议限制或限制我们采取具体行动的能力,例如承担额外债务、进行收购或资本支出或宣布分红。如果我们通过合作、战略联盟或与第三方的营销、分销或许可安排筹集更多资金,我们可能不得不放弃对我们的技术、未来收入来源、研究项目或候选药物的宝贵权利,或者以可能不利于我们的条款授予许可。如果我们无法在需要时通过股权或债务融资或其他安排筹集额外资金,我们可能会被要求推迟、限制、减少或终止我们的研究、产品开发或未来的商业化工作,或者授予开发和销售我们本来希望自己开发和销售的候选药物的权利。
关键会计估计
与我们在10-K表年度报告中 “管理层对财务状况和经营业绩的讨论和分析——关键会计政策以及重大判断和估计” 标题下描述的政策相比,在截至2023年9月30日的三个月中,我们的关键会计政策没有重大变化。
资产负债表外安排
在本报告所述期间,我们没有美国证券交易委员会规章制度所定义的任何资产负债表外安排,目前也没有任何表外安排。
25
合同义务和承诺
上文描述了我们的物质现金需求,包括资本支出承付款,并在简明合并财务报表附注7中披露
出现在本季度报告的其他地方。
最近发布的会计公告
本季度报告其他地方的简明合并财务报表附注2披露了最近发布的可能影响我们财务状况和经营业绩的会计公告的描述。
新兴成长型公司地位
2012年《Jumpstart Our Business Startups Act》(“乔布斯法案”)允许像我们这样的 “新兴成长型公司” 利用延长的过渡期,遵守适用于上市公司的新会计准则或修订后的会计准则,直到这些准则适用于私营公司为止。我们已不可撤销地选择 “选择退出” 该条款,因此,当非新兴成长型公司的上市公司需要采用新的或经修订的会计准则时,我们将遵守这些准则。
根据截至2023年6月30日非关联公司持有的普通股的总市值,我们认为自2023年12月31日起,我们将成为 “大型加速申报人”,不再有资格成为新兴成长型公司或小型申报公司。由于我们认为我们的新兴成长型公司和非加速申报人身份将于2023年12月31日到期,因此根据2002年《萨班斯-奥克斯利法案》第404(b)条,我们将被要求在截至2023年12月31日止年度的10-K表年度报告中纳入一份证明报告,说明我们对财务报告的内部控制的有效性,该报告由我们的独立注册会计师事务所发布。此外,从截至2024年3月31日的季度10-Q表季度报告开始,我们预计将不再被允许利用适用于小型申报公司的较低报告要求。
26
第 3 项。定量和定性ve 关于市场风险的披露。
根据经修订的1934年《证券交易法》第12b-2条的规定,在本报告期内,我们是一家规模较小的申报公司,无需提供本项目所要求的信息。
第 4 项控件 和程序。
评估披露控制和程序
截至2023年9月30日,我们的管理层在首席执行官兼总裁和首席财务官(分别为我们的首席执行官和首席财务官)的参与下,评估了我们披露控制和程序的有效性。1934年《证券交易法》(修订版)或《交易法》第13a-15(e)条和第15d-15(e)条中定义的 “披露控制和程序” 一词是指公司的控制和其他程序,旨在确保在美国证券交易委员会规定的时限内,记录、处理、汇总和报告公司在根据《交易法》提交或提交的报告中要求披露的信息规则和表格。披露控制和程序包括但不限于控制和程序,旨在确保公司在根据《交易法》提交或提交的报告中要求披露的信息得到积累并酌情传达给公司管理层,包括其主要执行官和首席财务官或履行类似职能的人员,以便及时就所需的披露做出决定。
管理层认识到,任何控制措施和程序,无论设计和运作如何良好,都只能为实现其目标提供合理的保证,管理层在评估可能的控制措施和程序的成本效益关系时必须运用其判断力。根据对截至2023年9月30日的披露控制和程序的评估,我们的首席执行官和首席财务官得出结论,截至该日,我们的披露控制和程序在合理的保证水平上是有效的。
财务报告内部控制的变化
在截至2023年9月30日的三个月中,我们对财务报告的内部控制(定义见《交易法》第13a-15(f)条和第15d-15(f)条)没有发生任何对我们的财务报告内部控制产生重大影响或合理可能产生重大影响的变化。
27
第二部分——其他 信息
第 1 项。法律 诉讼程序。
我们目前没有受到任何实质性的法律诉讼。我们可能会不时受到在正常业务活动过程中出现的各种法律诉讼和索赔。无论结果如何,由于辩护和和解费用、管理资源的转移和其他因素,诉讼都可能对我们产生重大不利影响。
第 1A 项。Risk 个因子。
与2023年3月14日向美国证券交易委员会提交的截至2022年12月31日止年度的10-K表年度报告中描述的风险因素相比,没有重大变化。10-K表格中描述的风险并不是我们公司面临的唯一风险。我们目前不知道或我们目前认为不重要的其他风险和不确定性也可能对我们的业务、财务状况和/或经营业绩产生重大不利影响。
第 2 项。取消注册的近期销量ed 证券和所得款项的使用
没有。
第 3 项。默认 Upon 高级证券
不适用。
第 4 项。Mine Saftey 披露
不适用。
第 5 项。其他信息
没有。
28
第 6 项。前hibits。
展览 数字 |
|
描述 |
31.1* |
|
根据根据2002年《萨班斯-奥克斯利法案》第302条通过的《1934年证券交易法》第13a-14 (a) 条或第15d-14 (a) 条对首席执行官进行认证 |
|
|
|
31.2* |
|
根据根据2002年《萨班斯-奥克斯利法案》第302条通过的《1934年证券交易法》第13a-14 (a) 条或第15d-14 (a) 条对首席财务官进行认证 |
|
|
|
32.1* |
|
根据根据2002年《萨班斯-奥克斯利法案》第906条通过的《美国法典》第18节第1350条对首席执行官进行认证 |
|
|
|
32.2* |
|
根据根据2002年《萨班斯-奥克斯利法案》第906条通过的《美国法典》第18条第1350节对首席财务官进行认证 |
|
|
|
101.INS |
|
行内 XBRL 实例文档 — 实例文档未出现在交互式数据文件中,因为其 XBRL 标签嵌入在行内 XBRL 文档中。 |
|
|
|
101.SCH |
|
内联 XBRL 分类扩展架构文档。 |
|
|
|
101.CAL |
|
内联 XBRL 分类扩展计算链接库文档。 |
|
|
|
101.DEF |
|
内联 XBRL 分类法扩展定义链接库文档 |
|
|
|
101.LAB |
|
内联 XBRL 分类法扩展标签 Linkbase 文档。 |
|
|
|
101.PRE |
|
内联 XBRL 分类扩展演示链接库文档 |
|
|
|
104 |
|
公司10-Q表季度报告的封面已采用Inline XBRL格式并包含在附录101中 |
# 表示管理合同或任何补偿计划、合同或安排。
* 随函提交
本10-Q表季度报告所附作为附录32.1和32.2所附的证书不被视为已向美国证券交易委员会提交,也不得以提及方式纳入Cogent Biosciences, Inc.根据经修订的1933年《证券法》或经修订的1934年《证券交易法》提交的任何文件,无论该季度报告在10-Q表季度报告发布之日之前还是之后提交备案。
29
签名URES
根据1934年《证券交易法》的要求,注册人已正式促使经正式授权的下列签署人代表其签署本报告。
|
COGENT BIOSCIENCES, INC |
|
|
|
|
日期:2023 年 11 月 7 日 |
来自: |
/s/安德鲁·罗宾斯 |
|
|
安德鲁·罗宾斯 |
|
|
总裁兼首席执行官 |
|
|
(首席执行官) |
|
|
|
日期:2023 年 11 月 7 日 |
来自: |
/s/ 约翰·格林 |
|
|
约翰·格林 |
|
|
首席财务官 |
|
|
(首席会计和财务官) |
30