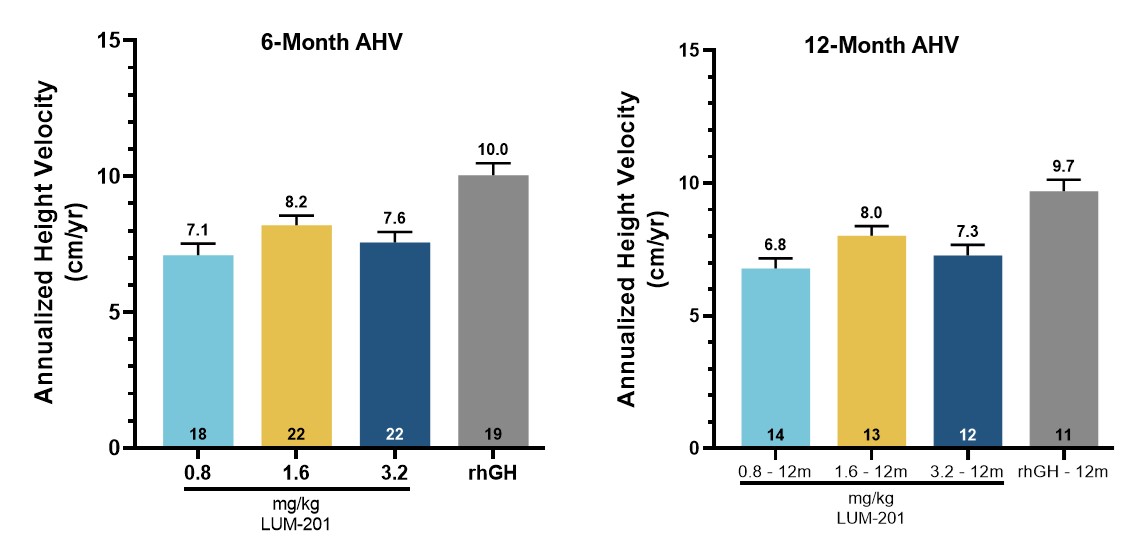
•Oragrowth210 结果显示,1.6 mg/kg 的 LUM-201 剂量在 6 个月时达到了 8.2 厘米/年的年化身高速度 (AHV),12 个月时达到了 8.0 厘米/年,与中等 PGHD 人群的增长率相当
•在最佳 LUM-201 剂量 1.6 mg/kg 和 rhGH 比较器臂之间 6 个月和 12 个月的增量处于非劣势区间内 (
•来自 oraGrowth210 和 Oragrowth212 合并试验的初始 24 个月的 LUM-201 数据表明,从第 1 年到第 2 年,AHV 效应持续
•达到预先指定的预测性富集标记 (PEM) 验证主要终点和次要终点,证明 PEM 阳性分类可重复性为 100%
•Oragrowth212 证明,在注射用 rhGH 浓度仅为 20% 的情况下,LUM-201 达到了预期的 AHV,同时展示了 LUM-201 独特的脉动作用机制
•迄今为止 LUM-201 还没有安全信号
公司将于美国东部时间明天上午 8:30 举行电话会议
德克萨斯州奥斯汀,2023年11月7日——Lumos Pharma, Inc.(纳斯达克股票代码:LUMO)今天宣布,其2期Oragrowth210剂量发现试验和2期Oragrowth212药代动力学/药效学(PK/PD)试验的最终结果符合所有主要和次要终点。来自Oragrowth210试验的数据显示,口服1.6 mg/kg剂量的 LUM-201 在治疗六个月时年化身高速度为8.2厘米/年,12个月时为8.0厘米/年,*与中度儿科生长激素缺乏症(PGHD)患者的历史数据一致,在比较注射重组生长激素(rhGH)组的目标2厘米/年范围内。数据还初步验证了预测性富集标记(PEM)策略,其中预先指定了主要策略
并且次要结果得到满足,降低了我们为第三阶段计划选择患者的风险。来自 Oragrowth212 试验的数据证实,LUM-201 独特的脉动机制可提高生长率,同时将生长激素和 IGF-1 的分泌恢复到正常范围†,其水平大大低于外源注射 rhGHH 产生的水平。†† 此外,在 Oragrowth210 和 Oragrowth212 试验中,来自一小部分 10 名受试者的数据表明 AHV up 具有持续的有效性到 24 个月。LUM-201此外,LUM-201 的安全性在两项 2 期研究中都保持清晰明了,在我们迄今为止进行的两项 2 期试验中均未发现任何安全问题。
“我们的 OragroWth 试验结果为我们提供了明确的概念证明,即口服 LUM-201 有可能作为中度生长激素缺乏患者的注射疗法的可行替代方案。Lumos Pharma董事长兼首席执行官里克·霍金斯说,我们的数据表明,LUM-201 可以根据接受生长激素治疗的中度PGHD患者的既定标准增强AHV,从而显示出强大而持久的反应。“我们期待在预计于2024年上半年举行的第二阶段会议结束时与FDA讨论这些数据并最终确定我们的3期关键试验计划。”
著名儿科内分泌学家罗恩·罗森菲尔德博士也是我们的临床和科学顾问委员会主席,他对数据发表了见解,他说:“这些发现不仅符合治疗的历史增长预期,而且凸显了 LUM-201 独特脉动机制的独特优势。与每天注射生长激素相比,口服 LUM-201 能够实现预期的生长激素,而患者每天只接触 20% 的生长激素,这是一项重大的科学突破,有可能彻底改变治疗中度生长激素缺乏症儿童的方法。”
Oragrowth210 头条业绩亮点
OraGrowth210试验实现了其主要目标,6个月的AHV数据为8.2 cm/年,支持将1.6 mg/kg作为3期临床试验的最佳剂量。* 6个月和12个月的AHV为1.6 mg/kg/日,符合增长预期,与注射用rhGH队列相比,不逊于2.0厘米/年的目标范围。
ANCOVA 示范条款:治疗、剂量 1 的年龄、性别、基线 HT SDS、基准体重指数 SDS、基线 IGF-1 SDS、LUM-201 PEM、
基线 BA 延迟,HT SDS-MPH SDS 条代表最小二乘均值 (LSM),误差条表示 LSM 的标准误差
•剂量为 1.6 mg/kg 时,LUM-201 AHV 在六个月零 12 个月时最高
•1.6 mg/kg LUM-201 剂量与 rhGH 对照组在 12 个月时的年差异为 1.7 厘米/年,属于历史非劣势阶段 3 的幅度
•LUM-201 AHV 与具有相似特征的患者群体中 rhGH 的历史增长率一致。
•针对50/81名受试者提供12个月的AHV数据:增长率维持在12个月内
在 1.6 mg/kg 剂量的 LUM-201 组中观察到的 6 个月和 12 个月时的平均 AHV 分别为 8.2 cm/yr 和 8.0 cm/年。这些 AHV 符合该公司预期,即在中度 PGHD 患者群体中接受了 rhGH 治疗 12 个月后观察到的每年 8.3-8.6 cm/AHV。1,2,3
在Oragrowth210试验的rhGH控制组中接受治疗的中度PGHD人群中,AHV高于预期,这与多项历史试验不一致,这些试验预测中度 PGHD1-4 的增长幅度在8.3-8.6厘米/年区间内。在这项研究的每日生长激素组中观察到的这种独特的生长模式可能是由于更高的剂量和异常值的存在。我们预计,在一项规模更大、统计学上更可靠的3期试验中,与rhGH治疗相关的AHV将更接近中等患者群体的历史值。
Oragrowth210试验满足了预先设定的响应者富集百分比,提供了对PEM策略的初步验证。此外,我们在满足预先确定的结果方面实现了 100% 的成功率,从而实现了积极的 PEM 规格分类的可重复性。
oragrowth212 头条业绩亮点
Oragrowth212 试验的最高结果显示,使用注射 rHGH 观察到的生长激素 (GH) 浓度仅为 20%,LUM-201 达到了预期的 AHV。这一结果是通过 LUM-201 的自然脉动机制实现的,促进了符合历史规范的中等 PGHD 受试者的生长。值得注意的是,LUM-201 将循环中的生长激素水平提高到接近正常生理范围的水平,而使用注射性生长激素治疗已被证明可以将生长激素水平提高到普通健康儿童的四到五倍。此外,必须强调的是,在 LUM-201 治疗的前 12 个月中,没有任何 IGF-1 值与平均值超过 2 个标准差。
来自 oragrowth210 和 oragrowth212 试验的 24 个月合并数据
•来自Oragrowth210和Oragrowth212试验的10名受试者的18个月和24个月的生长数据可供选择,这些受试者在12个月时符合每个方案的AHV标准。
•来自两项试验的1.6 mg/kg和3.2 mg/kg队列的综合数据表明,与之前在辉瑞第四阶段 KIGS 数据集中观察到的 rhGH AHV 从 12 个月到 24 个月内下降约 20% 相比,生长速度没有显著下降。3
安全性和耐受性亮点
Oragrowth210和Oragrowth212试验的最高结果均显示出无明显的安全记录,其特征是没有与治疗相关的严重不良事件(SAE),没有参与者因不良事件(AE)而停止治疗的情况,并且在实验室值、不良事件数据或心电图(ECG)读数等各种参数中没有任何重大安全问题。
† Zadik 等人 Horm Res 1992
†† 改编自 Albertson-Wikland 等人 JCEM 1994 中的数据;列出的 24 小时暴露量反映了给药剂量约 60% 的吸收率/生物利用度,
* 对于所有 OragroWth 试验 AHV 值,ANCOVA 模型术语:治疗、剂量年龄 1、性别、基线 HT SDS、基线 BMI SDS、基线 IGF-1 SDS、LUM-201 PEM、基线 BA 延迟,对于图表 HT SDS-MPH SDS 条表示最小二乘均值 (LSM),误差条表示 LSM 的标准误差
1 Blum 等人 JES 2021,
2 Lechuga-Sancho 等人 JPEM 2009,
3 Ranke 等人 JCEM 2010、4 Bright 等人 JES 2021
电话会议和网络直播详情
日期:2023 年 11 月 8 日
时间:美国东部时间上午 8:30
拨入:1-877-407-9716 或 1-201-493-6779(国际)
会议编号:13742617
或者拨号注册(在预定开始时间前 15 分钟可用):https://callme.viavid.com/viavid/?callme=true&passcode=13742617&h=true&info=company-email&r=true&B=6
网络直播链接:https://viavid.webcasts.com/starthere.jsp?ei=1642841&tp_key=d9efda8a69
幻灯片可在Lumos Pharma网站上的 “投资者与媒体” 部分的 “活动和演示” 链接下找到:https://investors.lumos-pharma.com/events-presentations。
电话重播将在通话结束大约两小时后播出,并且可以在通话结束后的两周内使用与上述相同的号码进行重播。
虚拟KOL活动已计划
该公司计划在12月6日举办一场虚拟的KOL活动,更详细地讨论Oragrowth210和Oragrowth212试验的主要结果,并提供临床和企业战略的最新信息。以下三位内分泌学领域备受尊敬的思想领袖将加入管理层的行列:
•安德鲁·道伯,医学博士,华盛顿特区国家儿童医学中心内分泌科主任
•费尔南多·卡索拉,医学博士,智利大学母婴研究所儿科内分泌科主任
•Leslie A. Soyka,医学博士,麻省大学纪念医学中心儿科内分泌科主任;马萨诸塞州伍斯特麻省大学陈医学院副教授
有关KOL活动的访问信息将在稍后提供。
Oragrowth210 试用设计
Oragrowth210 试验是一项全球性的多地点研究,评估了在三种不同剂量水平(0.8、1.6、3.2 mg/kg/天)下口服给药与每天注射 34 微克/天的重组人类生长激素 (rhGH) 的效果。LUM-201该试验涉及82名被诊断患有中度儿科生长激素缺乏症(PGHD)的参与者。为了丰富试验人群,增加可能对 LUM-201 有反应的个体,在筛选过程中应用了特定的 PEM 标准。这些标准包括将 IGF-1 的基线值高于 30 纳克/毫升,以及在给未接受治疗的 PGHD 患者服用 0.8 mg/kg 剂量的 LUM-201 后,生长激素的峰值达到 5 纳克/毫升或更高。值得注意的是,与每日生长激素治疗相比,这项研究的主要目的不是确定疗效或证明其不逊色。
oragrowth212 试用版设计
Oragrowth212 试验是一项单点开放标签研究,旨在评估口服 LUM-201 的药代动力学 (PK) 和药效学 (PD) 影响。该试验包括多达 24 名未接受过儿科生长激素缺乏症 (PGHD) 治疗的人,他们按两种不同的剂量水平服用 LUM-201,
具体来说是 1.6 和 3.2 毫克/千克/天。Oragrowth212 试验的每位参与者都符合患者 PEM 阳性的标准,从而确保了他们对 LUM-201 的潜在反应。
关于 Lumos Phar
Lumos Pharma, Inc. 是一家临床阶段的生物制药公司,专注于罕见病疗法的开发和商业化。该公司成立并由一支在罕见病药物开发方面拥有长期经验的管理团队领导。Lumos Pharma的主要候选治疗药物 LUM-201 是一种新型的口服生长激素(GH)促分泌剂,旨在将约34亿美元的全球生长激素市场从注射疗法转变为口服疗法。LUM-201 目前正在多项儿科生长激素缺乏症 (PGHD) 的 2 期临床研究中进行评估,并已在美国和欧盟获得孤儿药认定。欲了解更多信息,请访问 https://lumos-pharma.com/。
关于前瞻性陈述的警示说明
本新闻稿包含Lumos Pharma, Inc.的前瞻性陈述,涉及重大风险和不确定性。本新闻稿中包含的所有此类声明均为1995年《私人证券诉讼改革法》所指的前瞻性陈述。如果事实证明我们的预测不正确,这项法律在一定程度上使我们有机会分享我们的未来展望,而不必担心会提起诉讼。
我们对我们的业务充满热情,包括 LUM-201 及其可能为临床患者提供帮助的潜力。这种激情使我们感到乐观,相信我们的努力将取得成功,为患者带来有意义的改变。请记住,实际业绩或事件可能与我们在前瞻性陈述中披露的计划、意图和预期存在重大差异。
我们试图通过使用 “预期”、“即将到来”、“将”、“计划”、“打算”、“预期”、“大约”、“预期”、“潜力”、“临近” 等词语来识别前瞻性陈述,以及对未来时期或这些术语的负面提法的类似提法。并非所有前瞻性陈述都包含这些识别性词语。除其他外,前瞻性陈述的示例包括我们就第二阶段数据发表的声明,为口服 LUM-201 推进到第 3 期提供了支持证据,明确证明口服 LUM-201 有可能作为中度生长激素缺乏患者的注射疗法的可行替代方案,LUM-201 有可能根据接受生长激素治疗的中度 PGHD 患者的既定标准提高 AHV,期待讨论这些数据并最终确定我们的阶段计划 3 项关键试验美国食品药品管理局在预计将于2024年上半年举行的第二阶段会议结束时表示,这是一项重大的科学突破,有可能彻底改变治疗中度生长激素缺乏症患儿的方法,来自Oragrowth210试验的数据支持将1.6 mg/kg剂量作为3期试验的最佳剂量,该研究的每日生长激素组中观察到的这种独特的生长模式可能是由于剂量较高和存在异常情况 liers,在一项规模更大、统计学上更可靠的 3 期试验中,AHV LUM-201与生长激素治疗相关的中等患者群体的历史价值以及除历史事实陈述以外的任何其他陈述将更加一致。
我们希望我们能够以 100% 的准确度预测未来,但这是不可能的。我们的前瞻性陈述既不是历史事实,也不是对未来表现的保证。您不应依赖任何这些前瞻性陈述,为了帮助您自己确定风险,我们对可能导致实际结果与我们的前瞻性陈述存在重大差异的风险进行了广泛讨论,包括与持续分析 LUM-201 试验数据相关的风险、我们未来与监管机构互动(包括我们与美国食品药品管理局的第二阶段会议结束)的时机和结果、Lumos 根据需要筹集额外股权资本的时机和能力我们的 3 期试验,我们预测未来或有负债和业务运营所需的现金使用情况和储备的能力,有效和及时地组织我们的三期试验的能力,成功开发候选产品的能力,大流行的影响,其他普遍的健康问题或军事冲突,包括乌克兰-俄罗斯冲突和
中东冲突和其他可能导致实际结果与此类前瞻性陈述中表达或暗示的事项存在重大差异的风险,包括 “风险因素” 部分和Lumos Pharma截至2023年6月30日的10-Q表季度报告以及向美国证券交易委员会提交的其他报告,包括我们随后的10-Q表季度报告和8-K表的最新报告。所有这些文件都可以在我们的网站上找到。在就我们的股票做出任何决定之前,您应该阅读并理解这些文件。
我们预计,随后的事件和事态发展将导致我们的看法发生变化。我们可能会选择在未来的某个时候更新这些前瞻性陈述,但是,我们不承担任何这样做的义务。因此,在本新闻稿发布之日之后的任何日期,您都不应依赖这些前瞻性陈述来代表我们的观点。
###
投资者和媒体联系人:
丽莎米勒
Lumos Parma 投资者关系
512-792-5454
ir@lumos-pharma.com