
根据第 433 条提交
发行人免费写作招股说明书,日期为2023年10月5日
与2023年9月29日的初步招股说明书有关
注册号 333-274562

AVENUE THERAPEUTICS, INC. 纳斯达克:ATXI 2023 年 10 月 Avenue Th

2 免责声明关于前瞻性陈述的警示声明本演示文稿是Avenue Therapeutics, Inc.(“我们”、“我们”、“我们的”、“Avenue” 或 “公司”)包含1995年《私人证券诉讼改革法》所指的预测性或 “前瞻性陈述”。除本演示文稿中包含的当前或历史事实陈述外,所有陈述,包括表达我们的意图、计划、目标、信念、期望、战略、预测或与我们的未来活动或其他未来事件或条件有关的任何其他陈述,均为前瞻性陈述。“预期”、“相信”、“继续”、“可以”、“估计”、“期望”、“打算”、“可能”、“计划”、“预测”、“项目”、“将”、“应该”、“将” 等词语旨在识别前瞻性陈述。这些报表基于管理层对我们的业务、行业和其他影响我们财务状况、经营业绩或业务前景的状况的当前预期、估计和预测。这些陈述并不能保证未来的业绩,并且涉及难以预测的风险、不确定性和假设。因此,由于存在许多风险和不确定性,实际结果和结果可能与前瞻性陈述中表达或预测或暗示的结果存在重大差异。可能导致此类结果和结果出现差异的因素包括但不限于由以下原因产生的风险和不确定性:我们目前没有待售的药物,我们的成功取决于我们的候选产品获得监管部门的批准并成功商业化;在我们当前或未来的候选产品的开发过程中有可能发现严重的不良或不可接受的副作用,因此我们需要放弃或限制某些候选产品的开发。我们的成功整合 Baergic Bio, Inc. 或开发 BAER-101 或 AJ 201 的能力;人们对我们继续作为持续经营企业的能力产生了重大怀疑,这可能会阻碍我们获得未来融资的能力;自成立以来我们蒙受的巨额亏损以及我们对在可预见的将来将继续蒙受亏损的预期;我们需要大量额外资金,这些资金可能无法以可接受的条件提供,或者根本无法以可接受的条件向我们提供,不可用可能会迫使我们推迟、减少或取消我们的产品开发计划或商业化工作;我们在运营的多个方面依赖第三方;我们依赖第三方获得的临床数据和结果,这些数据和结果最终可能被证明是不准确或不可靠的;我们的任何或所有候选产品可能无法获得监管部门的批准,或者由于科学或监管原因此类批准可能会被严重延迟。事实上,即使我们的一个或多个候选产品获得监管部门的批准,他们也会获得监管部门的批准仍受严格的监管审查;当前和未来与欺诈和滥用、虚假索赔、透明度、健康信息隐私和安全以及其他医疗保健法律和法规有关的法律和法规的影响;竞争对我们候选产品的影响以及出现为我们的目标适应症提供不同或更好的治疗替代方案的新产品的可能性;政府或第三方付款人未能为我们的候选产品或任何未来的产品提供足够的保险和支付费率的可能性。我们的有能力建立销售和营销能力,或者与第三方签订协议,推销和销售我们的候选产品;我们面临潜在产品责任索赔的风险;我们有能力确保我们的知识产权得到充分保护,以及我们可能无法为我们的技术和产品维持足够的专利保护。我们的

3 免责声明关于前瞻性陈述的警示声明(续)能够继续遵守我们的知识产权许可和与第三方的融资安排所规定的义务,没有这些许可和安排,我们可能会失去对我们的业务至关重要的权利;Fortress控制着我们普通股的投票多数并有权每年获得大量股票补助;我们有能力遵守适用的上市标准并维持我们目前在The的普通股上市纳斯达克资本市场;以及我们在向美国证券交易委员会(“SEC”)提交的文件中讨论的风险。任何具有前瞻性的陈述仅代表其发表之日,除非适用法律要求,否则我们没有义务公开更新或修改任何具有前瞻性的陈述以反映本演示之日之后可能发生的事件或情况。投资者应根据这些重要因素评估我们发表的任何声明。此处包含的信息旨在全面审查,适用于本演示文稿某一部分中给定信息的任何规定、条件或附带条件均应理解为比照适用于此处出现的此类信息的所有其他实例。重要信息公司已就本来文所涉及的发行向美国证券交易委员会提交了注册声明(包括招股说明书)。在投资之前,您应阅读该注册声明中的招股说明书以及发行人向美国证券交易委员会提交的其他文件,以获取有关公司和本次发行的更完整信息。你可以通过访问美国证券交易委员会网站上的 EDGAR 来免费获得这些文件,网址为 www. sec. gov。或者,如果您向syndicate @maximgrp. com发送电子邮件或致电 (212) 895-3745提出要求,公司、任何配售代理或任何参与此次发行的交易商都将安排向您发送招股说明书。

4 发行摘要发行人:Avenue Therapeutics, Inc.(“Avenue” 或 “公司”)交易所/代码:NasdaqCM:ATXI 发行规模:最高1,200万美元发行类型:最佳努力 S-1 关注-发行证券:由一股普通股(或代替预融资认股权证)和一份购买一股普通股的认股权证组成的单位预期收益用途:• 推进临床试验 • 营运资金和一般公司用途联合配售代理:Maxim Group LLC和Lake Street Capital Markets预期定价:2023 年 10 月 9 日当周

5 内容提要有两种药物预计将在2024年提供数据,包括静脉曲马多3期开发计划 • Avenue Therapeutics是一家专注于开发治疗神经系统疾病的疗法的公司,包括急性住院疼痛和罕见的神经肌肉疾病 • IV tramadol已经完成了两项3期疗效试验,还有一项安全性试验——3期安全试验可能在2024年初启动,并在7-8个月内报告数据,以支持美国食品药品管理局可能在2025年获得批准 − 几十年来,IV 曲马多已在全球范围内使用,除美国以外解决了美国术后疼痛市场在强效阿片类药物和非甾体抗炎药/对乙酰氨基酚之间未得到满足的需求 • AJ201 目前正处于 1b/2a 期,并已在 2024 年读出用于治疗一种罕见的神经系统疾病的概念数据,该疾病在日本以外尚无批准——2024 年上半年的 SBMA(脊柱和延髓肌萎缩症)数据读出,也称为肯尼迪病注意:曲马多3期试验的启动和数据取决于足够的资金和/或合作

6 多元化的投资组合,包括高价值神经系统领域的同类首创项目以及大量未得到满足的患者需求来源:1.根据DelveInsight的评估,在研究期间(2019-2032年),急性疼痛市场将以8.3%的复合年增长率增长。2.M. Zanovello 等人,牛津大学出版社代表大脑保障者。2023 3. www.orpha.net,肯尼迪病... 4. www.who.int,癫痫。5. www.ourworldindata.org,焦虑管道资产 IV 曲马多 AJ201 BAER-101 适应症术后疼痛脊柱和延髓肌萎缩(sbma/Kennedy 病)癫痫和急性焦虑机制阿片类药物激动剂去甲肾上腺素和血清素再摄取抑制剂激活 Nrf1 和 Nrf2 并促进 AR 降解选择性 GABA-A α2 和 α3 受体阳性变构调节剂 Key治疗价值主张附表 IV 用于急性护理术后疼痛的药物没有 FDA 批准的 SBMA 患者治疗更安全、更耐受的苯二氮卓类药物可解决人群美国约有 1 亿急性疼痛病例 1 估计差异很大,从 ~ 1:6887 2 到 1:30000 3 ~50000 4 名癫痫患者和约 2.8 亿焦虑症患者 5

7 中枢神经系统中有多种潜在的短期催化剂以中枢神经系统为重点的产品线适应症第 1 阶段 2 期第 3 阶段下一步 Milestone Rights IV 曲马多术后疼痛开始并完成 3 期安全研究美国 AJ201 脊柱和延髓肌萎缩症 (SBMA) /肯尼迪病 1b/2a 期顶线结果 2024 年上半年美国、欧盟、英国、加拿大和以色列 BAER-101 个癫痫合作伙伴已完成/计划进行中的研究研究 3 期疼痛模型研究确认性安全性研究 2a 期 1b/2a 期

8 执行具有多种价值的计划——推动里程碑向前迈进 BAER——SBMA 中癫痫和急性焦虑症的 101 个令人信服的 1 期安全数据健康志愿者引人注目的 1 期安全数据自 23 年第 3 季度第一例患者以来,在 SBMA 中对 AJ201 进行的 1b/2a 期研究的最终结果预计将于 2024 年出现 SBMA 中 AJ201 的最终结果令人信服的 10 项临床试验支持性临床安全数据正在发布和发布 BAER 的临床前数据-101 靶点选择 2a 期为癫痫做好准备 IV 曲马多治疗疼痛安全性和有效性强 AJ201多项后期临床试验的概况与美国食品药品管理局会面,讨论研究设计以解决该机构对阿片类药物堆叠的担忧与美国食品药品管理局最终确定第三阶段安全性研究的试验设计启动第三阶段安全性研究;预计在试验启动后的7-8个月内将获得顶线数据;结果将构成向FDA重新提交保密协议的依据注:M ilestones基于管理层的最佳估计

9 曲马多在静脉注射镇痛药中具有独特的双重作用机制,旨在阻断患者的疼痛信号,减少滥用可能性。注:附表四物质被定义为滥用可能性低和依赖风险低的药物。附表 II subs tan ces 被定义为滥用可能性很高的药物,使用可能会导致严重的心理或身体依赖。来源:https://www.dea.gov/drug-信息/药物-附表 IV 曲马多在欧洲安全使用了 30 年 — 2010 年至 2019 年,欧洲共服用了大约 3.7 亿剂阿片类药物疗效且滥用可能性较小的传统麻醉品(附表四)(附表二)
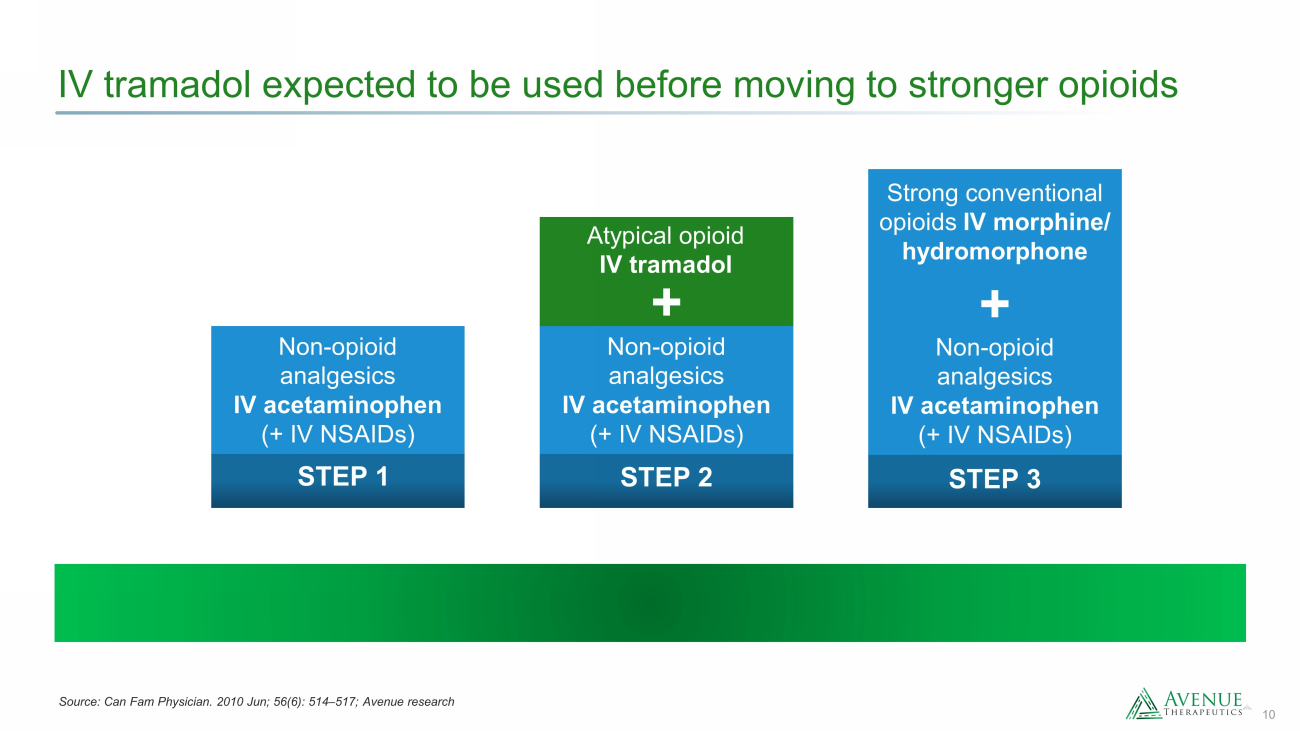
10 在转向更强的阿片类药物之前预计会使用曲马多 STEP 1 非阿片类镇痛药 IV 对乙酰氨基酚(+ IV NSAID)第 2 步非典型阿片类药物 IV 曲马多 + 非阿片类镇痛药 IV 对乙酰氨基酚(+ IV NSAID)+ 强效传统阿片类药物 IV 吗啡/氢吗啡酮 STEP 3 非阿片类镇痛药 esics IV 对乙酰氨基酚(+ IV NSAID)来源:Can Fam Physician。2010 年 6 月;56 (6):514 — 517;Avenue research

11 对 700 多名患者进行的 3 期疗效研究骨科模型(拇囊炎切除术)405 名患者安慰剂(n=135)静脉曲马多 25 mg(n=135)静脉曲马多 50 mg(n=135)软组织模型(腹部整形术)360 名患者安慰剂(n=135)静脉曲马多 50 mg(n=135)吗啡(n=90)主要终点疼痛总和第一次给药后 48 小时内的强度差异 (SPID) 主要终点第一次给药后 24 小时疼痛强度差异 (SPID) 总和 (SPID) 注意:静脉曲马多是一种在研药物,仍有待美国食品药品管理局批准

12 静脉曲马多 50 mg 达到主要终点和所有关键次要终点研究 AVE-901-103(腹部整形术)SPID24 研究 AVE-901-102(拇囊炎切除术)SPID24 两个缓解疼痛的研究模型都显示曲马多优于安慰剂

13 监管历史和现在是2022年8月与美国食品药品管理局麻醉、镇痛和成瘾产品司(DAAAP)举行的2022年静脉曲马多NDA 2024+的前进道路会议,探讨了安全研究设计的潜在前进道路,该设计可以解决美国食品药品管理局在之前的完整回复信(CRL)中提出的担忧。与美国食品药品管理局讨论了一项临床方案,以评估与静脉注射吗啡相比,静脉曲马多上叠加阿片类药物相关的呼吸抑制风险。宣布就第三阶段安全性研究的关键要素与美国食品药品管理局保持一致,包括非劣质研究的主要终点和统计分析方法。美国食品和药物管理局同意,一项成功的研究将支持提交CRL的申请,并可能导致静脉曲马多的批准。有了融资,Avenue认为,一项试验可以在试验启动后的7-8个月内报告第三阶段的安全数据,并有可能支持在2025年批准静脉曲马多。注意:有关静脉曲马多监管历史的更详细披露可在美国证券交易委员会EDGAR上查阅 Avenue的公开文件

14 第三阶段安全性研究表明,在阿片类药物诱发的呼吸抑制终点中,静脉曲马多与静脉注射吗啡相比并不逊色 • 当患者需要救援药物来治疗任何一只手臂的突破性疼痛(静脉曲马多或静脉注射吗啡)时,他们将接受静脉注射氢吗啡从而产生阿片类药物堆积 • 在整个 48 小时的研究中,将对患者进行阿片类药物诱发的呼吸抑制事件的监测,包括索莫尔诺便士、呼吸频率和血氧饱和度水平 • 执行将静脉曲马多与静脉注射进行比较的安全性研究的风险是鉴于有大量的临床知识,吗啡可以治疗非劣质:— 欧盟静脉曲马多与吗啡的经验——已发表的与曲马多 3 期安全研究相关的文献:骨科模型(拇囊炎切除术)(n=300)IV 曲马多(n=150)静脉曲马多(n=150)静脉曲马多(n=150)注:试验样本量根据当前假设估算,尚待最终方案审查

15 AJ201 正在开发作为 SBMA 的新型、同类首创的治疗方法 * 孤儿药名称 SBMA 是脊柱和延髓肌萎缩症,也被称为 PolyQ 疾病的肯尼迪病潜力 “产品管线” 有望获得临床前疗效和临床安全数据新型蛋白质降解作用机制在没有美国食品药品管理局批准的治疗方法的疾病中具有先发优势 1b/2a 期临床试验的结果预计将于 2024 年获得 ODD* 来自美国美国食品药品管理局有多种罕见的神经适应症,来自EMA的SBMA

16 SBMA:毁灭性、罕见的神经退行性疾病,没有美国食品药品管理局批准的患者治疗方法来源:1.M. Zanovello 等人,牛津大学出版社代表大脑保障者。2023 年。• 罕见的、与 X 有关的 PolyQ 疾病主要影响男性 • 延髓肌肉减弱会影响咀嚼、言语和吞咽;SBMA 还会影响四肢肌肉,导致行走困难并经常导致使用轮椅 • 最近的研究使用基因分析估计 1:6,887 名男性的疾病患病率 1 • 发病年龄从 18 岁起-64 • 患者目前在物理治疗、类固醇和疼痛管理方面往往管理不善 Brainstem(bulbar)下运动神经元舌臂肌肉腿部肌肉脊柱下运动神经元

17 AJ201 在 SBMA、HD 和精选 SCA 适应症中获得 ODD* 奖项 PolyGlutamine (PolyQ) 疾病的特征是突变蛋白聚集和进行性神经变性 * 孤儿药称号 • 9+ 神经退行性疾病 (NDD) 是由受影响基因中编码 polyQ 区域的 CAG 重复序列扩张引起的,导致大脑和其他组织中的突变蛋白聚集 • 错误折叠/聚集的蛋白质会导致毒性以及神经和肌肉死亡 • AJ201 的创新作用机制具有潜在的治疗作用由相似途径驱动的多种 PolyQ 疾病:-亨廷顿舞蹈症-六种脊髓小脑共济失调症-脊柱和延髓肌萎缩-牙齿苍白萎缩正常聚谷氨酰胺扩张天然蛋白健康个体 polyQ 疾病关闭折叠途径正常蛋白质折叠的途径翻译错误折叠/聚集蛋白翻译 polyQ 膨胀蛋白的聚合蛋白翻译

18 AJ201 的潜在治疗活性包括增强突变体 AR 蛋白降解和减少神经炎症来源:Bott 等人,Hum Mol Genet。2016 年 SBMA 疾病途径 nrf1 途径激活 nrf2 途径激活突变雄激素受体 (AR) 降解 AJ201 通过三种机制的潜在活性泛素功能失调 — 蛋白酶体系统 (UPS) 雄激素受体聚合错误折叠蛋白核神经炎症 POL II tmfS CBP pcaf CAF CRE

19 在 SBMA 患者中进行 AJ201 的 1b/2a 期研究预计将在 2024 年上半年报告数据 1b/2a 期多中心双盲随机临床试验概述 4 周筛查 AJ201、600mg、QD、12 周治疗 (n=15) 4 周随访安慰剂、QD、12 周治疗 (n=5) 主要目标评估临床和基因定义的 SBMA 受试者对 AJ201 的安全性和耐受性继发目的评估 AJ201 在骨骼肌中的药代动力学 (PK) 和药效学 (PD) 生物标志物探索性目标评估拟议的临床对将 SBMA 作为未来疗效研究潜在临床结果衡量标准的受试者进行评估六位点假设:AJ201 降解突变 AR 蛋白并激活肌肉中的抗氧化反应,因此未来的疗效研究可能会显示对 SBMA 患者的临床益处 1b/2a 期研究设计杰克逊维尔罗切斯特

20 AJ201 目前是针对 SBMA 产品 MoA 临床前 I 期 II 期 II 期 II 期 III 期批准的亮丙瑞林促性腺激素释放激素仅限日本且疗效有限 AJ201 激活 nrf1/Nrf2 和促进 AR 降解 NIDO361 AR BF3 调节剂 AAV-miRNA 基因疗法击倒突变体 AR

21 AJ201 拥有多个孤儿病名称,获得批准后可提供监管排他性孤儿药地位获得知识产权概述 • 孤儿药认定 (ODD) 在美国提供 7 年的市场独家经营权,在欧盟提供 10 年的市场独家经营权 • 在 2040 年之前为其他神经退行性疾病提供市场保护的专利适应症美国食品药品管理局 EMA EMA SBMA x x 亨廷顿氏病 x spinocerebellar 共济失调 x

22 BAER-101 作为治疗癫痫的差异化靶向疗法正在开发中 2a 期就绪临床前疾病模型疗效降低滥用风险选择性体外分析旨在提高安全性现有疗法有许多影响治疗的 AE 在超过 700 名患者的临床试验中证明了人体安全性 BAER-101 具有 alpha 2/3 亚型——更喜欢可以提高耐受性和安全性的选择性

23 BAER-101 靶向超过 α1 和 α5 的 GABA α2 和 α3 亚型,与非选择性苯二氮卓类药物相比,有可能改善副作用特征来源:Jacob 等人,《自然评论》神经科学,2008 年;Luo,Y. 和 Balle,T. 基础和临床药理学与毒理学,2 022;McKerNan 等人,《自然神经科学》,2000;Möhler,H.,《神经化学杂志》,2007 年治疗效果 GABA A 亚型 α 1 α 2 α 3 α 5 阳性抗惊厥抗惊厥抗惊厥抗焦虑镇痛肌肉松弛阴性镇静认知障碍耐受成瘾的预测效果靶向 GABA α 亚型 • BAER-101 旨在抑制 α 2 和 α 3 亚基 • BAER-101 的目标是通过最大限度地减少不良事件以及耐受和滥用的风险来提供抗惊厥和抗焦虑活性

24 BAER-101 与 alpha 2/3 亚型新开发候选药物有所区别——更喜欢选择性,这是提高耐受性和安全性的重要区别因素公司资产选择性阶段适应症 Avenue Therapeutics BAER-101 α2/3——更喜欢2期就绪的癫痫Cerevel(纳斯达克股票代码:CERE)darigabat α2/3/5——更喜欢2期癫痫和恐慌症 Saniona(OMX:Sanion)SAN711 α3-首选 1 期偏头痛和疼痛 respirerX(非处方药:RSPI)KRM-II-81 α2/3-更喜欢临床前多发性神经疾病

25 执行具有多种价值的计划——推动里程碑向前迈进 BAER——SBMA 中癫痫和急性焦虑 AJ201 令人信服的 1 期安全数据健康志愿者引人注目的 1 期安全数据自 23 年第 3 季度首例患者以来在 SBMA 中对 AJ201 进行的 1b/2a 期研究的最终结果预计将于 2024 年上半年出现 SBMA 中 AJ201 的最终结果令人信服的 10 项临床试验支持性临床安全数据正在发布和发布 BAA 的临床前数据 ER-101 2a 期为癫痫做好准备 IV 曲马多缓解疼痛安全性和有效性非常强多项后期临床试验与美国食品和药物管理局会面,讨论研究设计以解决该机构对阿片类药物堆叠的担忧,与FDA敲定最终的第三阶段安全研究的试验设计启动3期安全性研究;预计在试验启动后的7-8个月内将获得顶线数据;结果将构成向FDA重新提交保密协议的依据

26 由经验丰富的管理团队和董事会杰伊·克兰兹勒医学博士首席执行官 Urica Therapeutics 博士首席执行官林赛·罗森瓦尔德医学博士首席执行官丰泽生物技术公司创始人尼尔·赫斯科维茨创始人 Regen Capital Curtis Oltmans Faith Charlean 合伙人、Thompson Hine LLP Aleandra MacLean 首席执行官 Avenue Therapeutics 管理董事会首席执行官亚历山德拉·麦克莱恩医学博士首席执行官金大卫首席财务官迈克尔·瑞安临床运营和项目管理副总裁

AVENUE THERAPEUTICS, INC. 纳斯达克:ATXI 2023 年 10 月