
1 2023年第二季度财务业绩和临床更新 2023年8月9日

2 前瞻性陈述本演示文稿包含 Lumos Pharma, Inc.(“Lumos”、“我们” 和 “我们的”)的专有和机密信息,此类内容应被视为 “机密信息”,并受您对 Lumos 的保密义务的保护。本演示文稿仅供参考,Lumos或其任何代表对这些材料中包含的信息或在任何相关演示或讨论中披露的信息不作任何明示或暗示的陈述或保证。本演示文稿包含Lumos的前瞻性陈述,这些陈述涉及重大风险和不确定性。本演示文稿中包含的所有此类陈述均为1995年《私人证券诉讼改革法》所指的前瞻性陈述。我们对自己的业务充满热情,包括 LUM-201 以及它可能为临床患者提供帮助的潜力。这种热情激发了我们的乐观情绪,即我们的努力将取得成功,并带来安全、有效的治疗方法,并为患者带来有意义的改变。请记住,实际结果或事件可能与我们在前瞻性陈述中披露的计划、意图和预期存在重大差异。我们试图通过使用 “预期”、“即将到来”、“将”、“将”、“计划”、“打算”、“预期”、“近似”、“预期”、“预期”、“潜在”、“迫在眉睫” 之类的词语以及对未来时期的类似提法或这些术语的负面提法来识别前瞻性陈述。并非所有前瞻性陈述都包含这些识别词。前瞻性陈述的例子包括我们就临床工作进展发表的陈述,包括有关试验筛查和入组的评论、PGHD LUM-201 计划的势头增强、试验中期分析的预期时间、对特发性或中度生长激素缺乏症的儿科受试者使用 LUM-201 时的治疗潜力、临时样本量应足以初步指示 LUM 201 的影响,预计主要结果数据会读出对于我们的试验,LUM-201 的市场规模潜力,对 LUM-201 的预测,LUM-201 的目标,将我们的 LUM-201 平台扩展到其他指标的可能性,未来的财务业绩,经营业绩,现金状况,现金使用率以及通过Oragrowth210和Oragrowth212试验读出的主要结果数据以及历史事实陈述以外的任何其他陈述来为运营需求提供资金的现金资源充足性。我们希望我们能够以100%的准确度预测未来,但这是不可能的。我们的前瞻性陈述既不是历史事实,也不是对未来业绩的保证。实际结果或事件可能与我们在前瞻性陈述中披露的计划、意图和预期存在重大差异,这是由于许多重要因素,包括我们 LUM-201 试验的中期结果与目前尚不清楚的试验最终结果之间的潜在重大差异、流行病(包括 COVID-19)的影响、其他广泛的健康问题、乌克兰-俄罗斯冲突、我们未来与监管机构互动的结果、我们预测未来的能力现金未来或有负债和业务运营所需的利用率和储备金、及时为我们的候选产品获得必要的患者登记的能力、成功开发候选产品的能力、Lumos根据需要筹集额外股权资本的时机和能力,以及其他可能导致实际业绩与此类前瞻性陈述中表达或暗示的事项存在重大差异的风险。您不应依赖这些前瞻性陈述中的任何一项,为了帮助您自己确定风险,我们在截至2022年12月31日止年度的10-K表年度报告中的 “风险因素” 部分和其他地方对可能导致实际业绩与前瞻性陈述存在重大差异的风险进行了广泛的讨论,以及向美国证券交易委员会提交的其他报告,包括我们在年度报告之后提交的10-Q表季度报告。所有这些文件都可以在我们的网站上找到。在就我们的股票做出任何决定之前,您应该阅读并理解这些文件。我们预计,随后的事件和事态发展将导致我们的看法发生变化。我们可能会选择在未来的某个时候更新这些前瞻性陈述;但是,我们不承担任何这样做的义务。因此,在本演示之日后的任何日期,您都不应依赖这些前瞻性陈述来代表我们的观点。此处包含的数据来自各种内部和外部来源。演示文稿中的所有市场数据都涉及许多假设和局限性,无法保证此类假设的准确性或可靠性。此外,对于其中所作假设的合理性,也未就此处包含的任何预测或建模或任何其他信息的准确性或完整性作出任何陈述。此处包含的任何有关过去性能或建模的数据均不能表明未来的表现。8.9.2023

3 议程 • 丽莎·米勒,投资者关系高级总监 • 里克·霍金斯,首席执行官兼董事长 • 里克·霍金斯,首席执行官兼董事长 • 约翰·麦考博士,总裁兼首席科学官 • 洛里·劳利,首席财务官 • 杜克·皮图奇瓦诺特,医学博士,临床开发和医疗事务高级副总裁 • 洛里·劳利,首席财务官
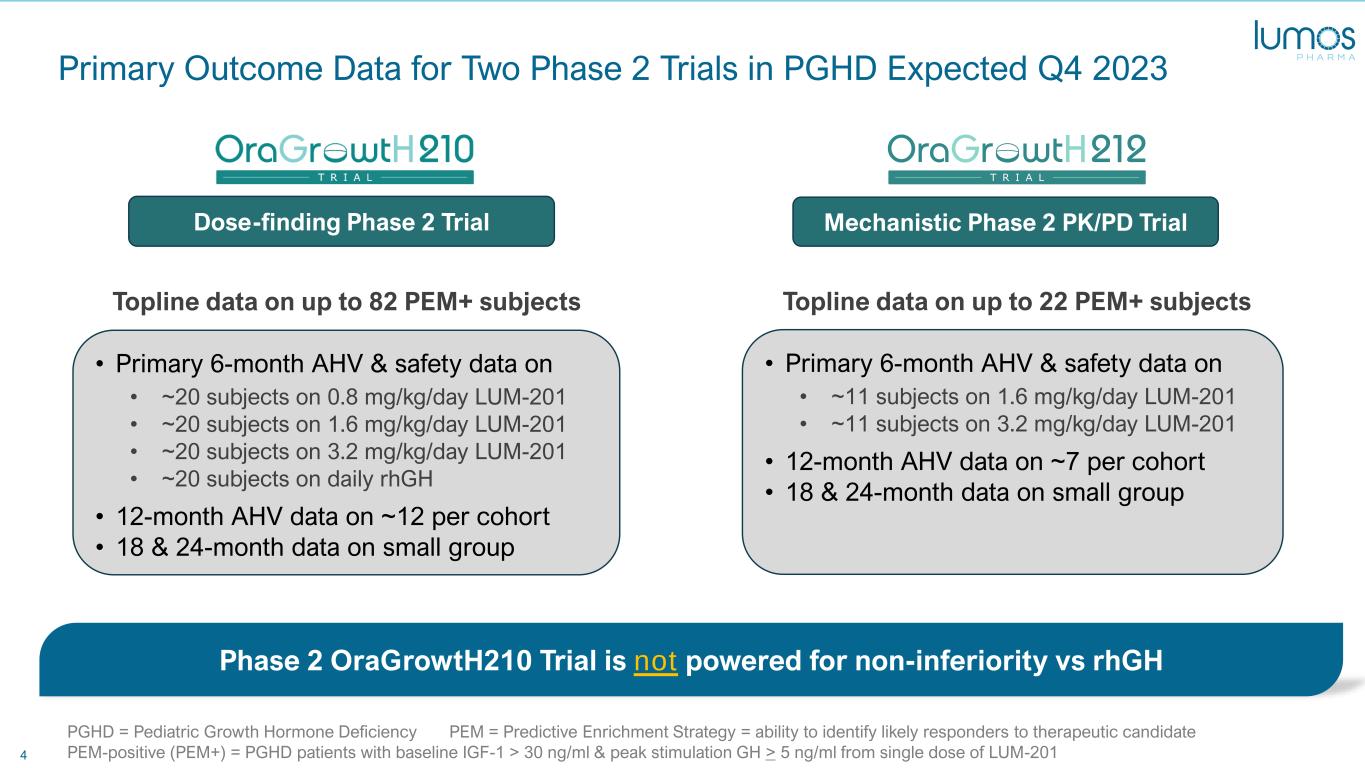
4 PGHD 中两项二期试验的主要结果数据预计在 2023 年第四季度 • 大约 20 名受试者 6 个月的 AHV 和安全数据 • 大约 20 名受试者每天服用 0.8 mg/kg LUM-201 • 大约 20 名受试者服用 3.2 mg/kg /天 LUM-201 • 大约 20 名受试者每天服用 rhGH • 每组 12 个月的 AHV 数据 • 小组 6 个月和 24 个月的主要数据 • 6 个月的 AHV 和安全数据 • 大约 11 名受试者服用 1.6 mg/kg/day LUM-201 • 大约 11 名受试者服用 3.2 mg/kg /天 LUM-201 • 12 个月的 AHV 数据,每个队列约 7 个 • 小组剂量发现第 2 阶段试验机制阶段的 18 个月和 24 个月数据 LUM-2012 PK/PD 试验 PGHD = 儿科生长激素缺乏 PEM = 预测性富集策略 = 能够识别出治疗候选药物 PEM-阳性 (PEM+) 的可能反应者 = 基线 IGF-1 > 30 ng/ml 且刺激峰值 GH > 5 ng/ml 的 PGHD 患者 Topline 多达 82 名 PEM+ 受试者的数据 Opline 关于多达 22 名 PEM+ 受试者的第二阶段数据 oraGroth210 与 rhGH 相比,试用版不支持非劣势 LUM-201
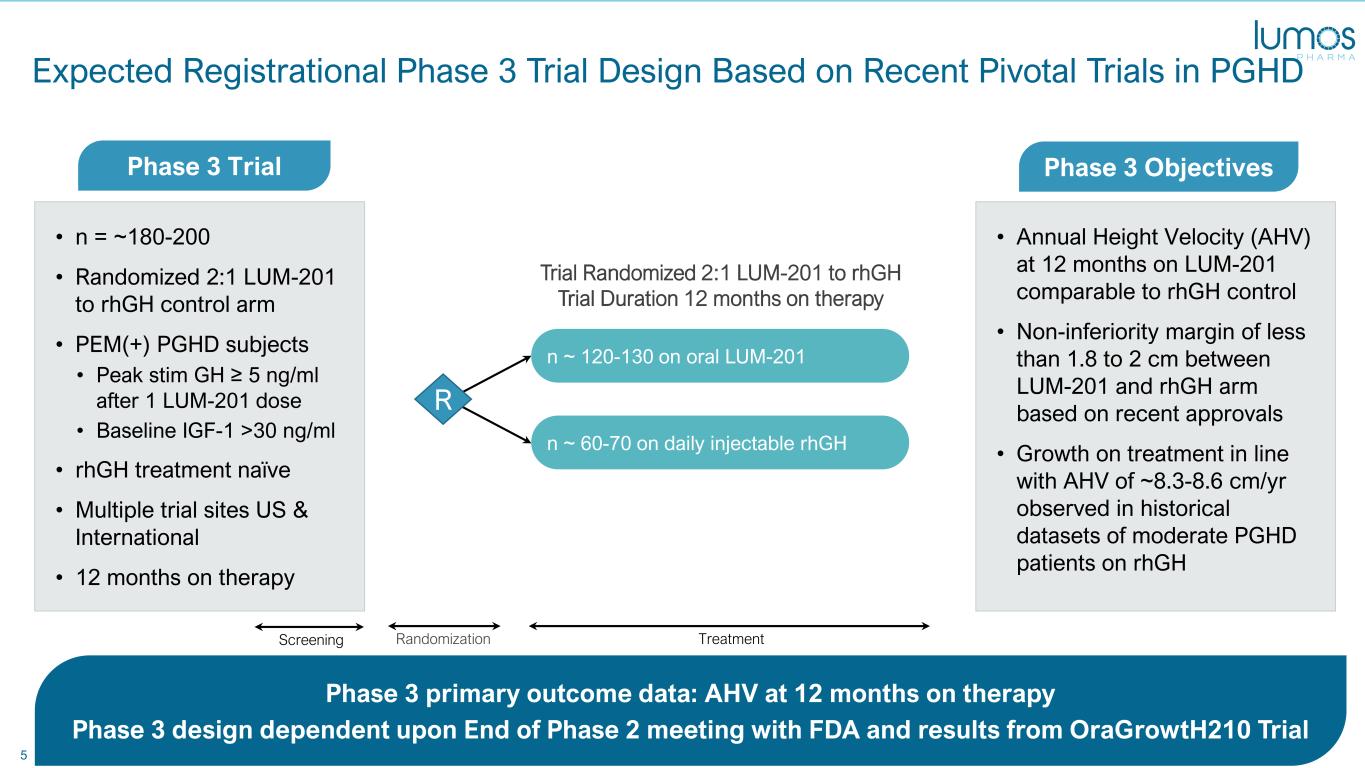
5 • n = ~180-200 • 随机分配 2:1 LUM-201 到 rhGH 对照组 • PEM (+) PGHD 受试者 • 1 剂 LUM-201 剂量后 stim GH 峰值 ≥ 5 ng/ml • rhGH 治疗天真 • 美国和国际多个试验地点 • 12 个月治疗预期注册 3 期试验设计基于最近的 PGHD 3 期关键试验主要结果数据:AHV at 12 个月治疗 3 期设计取决于第 2 阶段结束时与美国食品药品管理局会面以及 oraGrowth210 第三阶段试验的结果 n ~ 60-70 每日注射 rhGH n ~ 120-130 口服 LUM-201 R IGF-1TreatmentRandomization 试验随机化 2:1 LUM-201 到 rhGH 试验持续时间 12 个月治疗 3 期试验 • LUM-201 在 12 个月时的年身高速度 (AHV) 与 rhGH 对照相当 • 根据最近的批准,LUM-201 和 rhGH 组之间的非劣势幅度小于 1.8 至 2 cm • 在 rhGH 中度患者的历史数据集中观察到治疗与 AHV 一致的增长约为 8.3-8.6 cm/年 GH 筛查
6 适用于第 3 期和商业用途的新型 LUM-201 配方新型 LUM-201 配方 • 胶囊内的迷你片剂 • 独特的 LUM-201 制造技术实现了新配方的优势 • 最大限度地减少了服药患者体重范围内的剂量差异 • 便于年轻和老年患者口服给药 • 新配方已申请专利 • 美国专利商标局可能在今年晚些时候做出回应 • 预计在 2042 年底之前具有知识产权保护的橙皮书上市图片并不能实际代表新型 LUM-201 配方
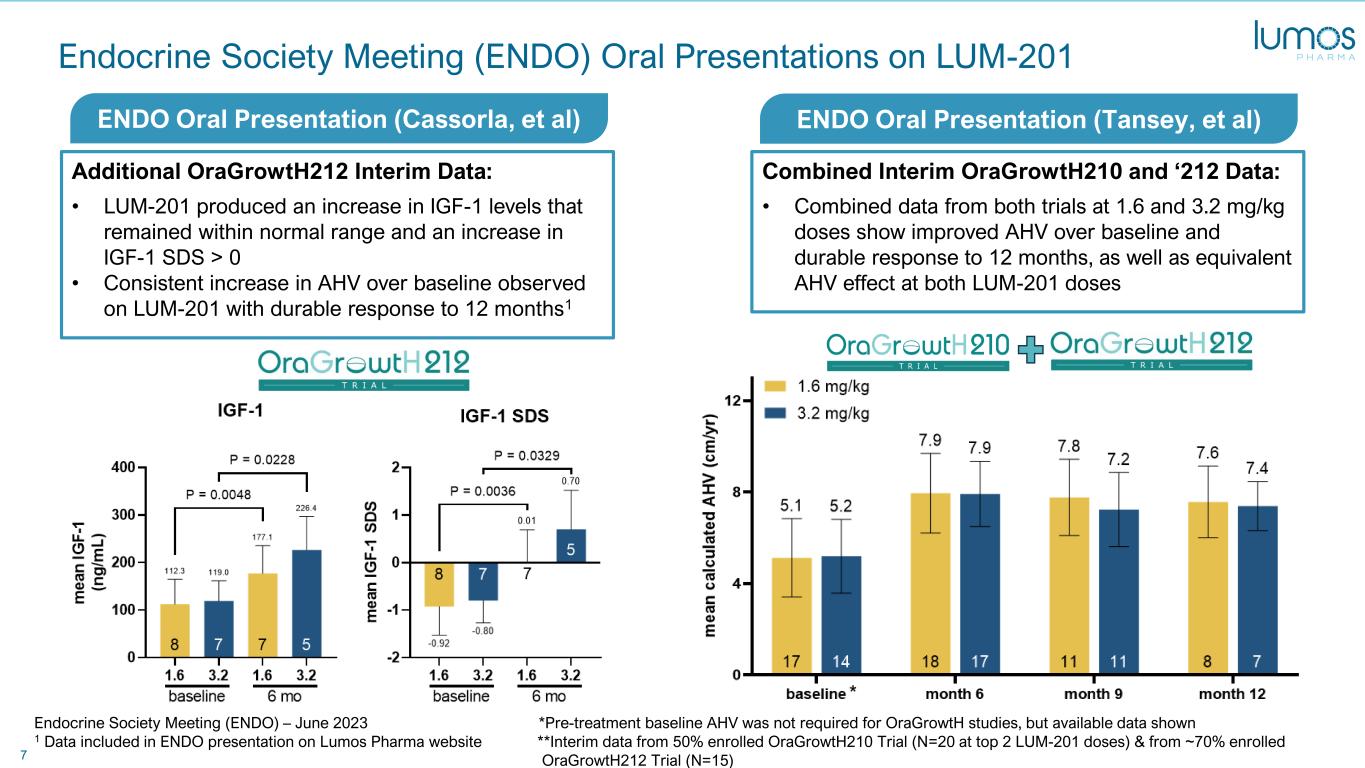
7 内分泌学会会议 (ENDO) 关于 LUM-201 的口头陈述其他 oraGrowth212 中期数据:• LUM-201 使保持在正常范围内的 IGF-1 水平升高,IGF-1 SDS 升高> 0 • 在 LUM-201 上观察到的 AHV 持续高于基线,反应持续到 12 个月 1 中期 oraGrowth210 和 '212 合并数据:• 两项试验在 1.6 和 3.2 mg/kg 剂量下的合并数据显示 AHV 比基线有所改善 12 个月的持久反应,以及两次 LUM-201 剂量内分泌学会会议上的同等抗逆转录病毒效应 (ENDO) — 2023 年 6 月 * OraGrowth 研究不需要治疗前基线 AHV,但现有数据显示 1 Lumos Pharma 网站上的 ENDO 演示中包含的数据 **来自 50% 注册的 oraGrowth210 试验(前 2 个 LUM-201 剂量为 N=20)和大约 70% 注册的 oraGrowth212 试验(N=15)ENDO 口服陈述(Tansey 等人)ENDO 口服陈述(Cassorla)的中期数据,等)

8 个其他亮点 • 最新摘要接受口头陈述:解卷积分析:生长激素分泌物(LUM-201)通过增强内源性生长激素分泌和增加 IGF-1、Cassorla、F. 来促进中度特发性儿科生长激素缺乏症(iPGHD)患者的生长发育 • 数据显示生长激素可减少肥胖受试者的肝脏脂肪变性在没有恶化血糖测量值的情况下使用 NAFLD • 这些数据支持 MGH 与 Lumos Pharma 合作在 NAFLD 中评估口服 LUM-201 • MGH 发起的 NAFLD 中 LUM-201 的试点试验继续招收欧洲儿科内分泌学会(ESPE)— 2023 年 9 月 JCEM 上发布生长激素支持 MGH 对 LUM-201 的评估 • 将 LUM-201 的下一个适应症目标缩小到国际空间站和 PWS,分析仍在继续。LUM-201NAFLD = 非酒精性脂肪肝病 MGH = 马萨诸塞州综合医院 ISS 特发性矮小 PWS Prader-Willi综合征

9 Lumos Pharma财务信息截至2023年6月30日的美元现金、等价物和短期投资价值5,090万美元债务 0股2023年每季度未偿还800万美元现金使用量为950万美元至1,050万美元截至12月31日财年12月31日的LUMO现金、现金等价物和短期投资,以支持运营至2024年第三季度,此外还包括Oragrowth210和Oragrowth212 Trials的主要业绩数据读数 4Growth212 Trials的主要业绩数据 2023 年季度

10 概述以生长障碍儿童为目标的领先资产新型口服罕见病资产管线,财务状况稳健 • 用于治疗生长激素缺乏 (GHD) 疾病的新型口服治疗资产 LUM-201 • LUM-201 在天然内分泌途径内起作用,与注射疗法不同 • 全球生长激素失调症注射市场为34亿美元,不包括中国* • 初始口服 LUM-201 适应症儿科 GHD (PGHD) 市场为12亿美元* • 截至2023年第二季度末,现金余额为5,090万美元 • 现金流入2024年第三季度,超越 2 期 orAgrowth 试验的主要结果数据 PGHD 的后期试验 • 预计2023年第四季度将有两项第 2 期 orAgrowth 试验的主要结果数据 • PEM 策略通过识别和招募可能的 LUM-201 受试者来降低风险试验** PGHD = 儿科生长激素缺乏症 * 美国、德国、法国、意大利、西班牙、英国、日本(Grandview Research,生长激素市场预测,2019 年)** PEM(预测性富集标记)策略包括 PEM+ PGHD 患者的筛查率 = 基线 IGF-1 > 30 ng/ml,单次口服 LUM 后峰值刺激 GH ≥ 5 ng/ml-201