

附录 99.2 PALTUSOTINE 3 期 PATHFNDR-1 研究的 TOPLINE 结果一项 随机、安慰剂对照、多中心研究,旨在评估巴妥西汀对接受长效生长抑素受体配体治疗的肢端肥大症受试者的安全性和有效性

安全港声明本演示文稿包含前瞻性 陈述。Crinetics Pharmicals, Inc.(“Crinetics”)提醒您,本演示文稿中包含的关于非历史事实的事项的陈述是前瞻性陈述。这些陈述基于 公司当前的信念和期望。此类前瞻性陈述包括但不限于以下方面的陈述:巴妥西汀对肢端肥大症患者和类癌综合征患者的潜在益处;PATHFNDR 计划支持所有需要药物治疗的肢端肥大症患者注册帕妥西汀的可能性;PATHFNDR-2 研究以及 类癌综合征患者的 2 期和 3 期研究的预期头条数据发布时间以及提交用于治疗巴妥西汀的新药申请的预期时间肢端肥大症和相关的开放标签扩展研究。在某些情况下,你可以用 等术语来识别前瞻性陈述,例如 “可能”、“相信”、“预期”、“可以”、“应该”、“估计”、“预期”、“打算”、“计划”、“项目”、“将”、 “预测”、“奠定基础”、“有抱负”、“目标” 和类似的术语。这些陈述涉及已知和未知的风险、不确定性和其他重要因素,这些因素可能导致我们的实际结果、 业绩或成就与前瞻性陈述所表达或暗示的任何未来业绩、业绩或成就存在重大差异,包括但不限于:在 对与临床研究相关的数据进行更全面的审查之后,我们报告的顶线数据可能会发生变化,这些数据可能无法准确反映临床研究的完整结果,而美国食品药品管理局和其他监管当局可能不同意我们对这些 结果的解释;临床前研究或临床研究的初步结果不一定能预测最终结果,并且随着患者入组的继续、对数据进行更全面的审查以及更多患者数据的获得,一个或多个临床结果可能会发生重大变化;临床研究的开始、注册和完成以及由此产生的数据的报告可能会出现延迟;美国食品药品管理局或其他监管机构可能需要额外 在批准新药申请或适用的外国监管机构批准之前,对帕妥西汀进行临床研究或建议更改我们计划的 3 期临床研究;COVID-19 疫情可能会扰乱我们的 业务和我们所依赖的第三方的业务,包括延迟或以其他方式干扰我们的临床研究和临床前研究、制造和供应链,或者损害员工的工作效率;我们在产品方面对第三方的依赖 制造、研究和临床前以及临床试验;我们对巴妥西汀的临床研究、非临床研究和临床前研究的成功;美国 州和国外的监管发展或价格限制;我们的候选产品出现意想不到的不良副作用或疗效不足,可能会限制其开发、监管部门批准和/或商业化;我们获得和维持候选产品的知识产权 保护的能力;我们可能比预期更快地使用我们的资本资源;以及下文所述的其他风险标题”风险因素” 出现在我们不时向美国证券交易委员会 (“SEC”)提交的文件中。由于前瞻性陈述本质上会受到风险和不确定性的影响,其中一些风险和不确定性无法预测或量化,有些是我们无法控制的,因此您不应依赖这些前瞻性 陈述作为对未来事件的预测。我们的前瞻性陈述中反映的事件和情况可能无法实现或发生,实际结果可能与前瞻性陈述中的预测存在重大差异。所有 前瞻性陈述均受本警示声明的全部限制,该声明是根据1995年《私人证券诉讼改革法》的安全港条款作出的,除非适用法律要求,否则我们不计划 公开更新或修改此处包含的任何前瞻性陈述,无论是由于任何新信息、未来事件、情况变化还是其他原因。本演示文稿还包含 独立方和我们做出的与市场规模和增长有关的估计值和其他统计数据,以及有关我们行业的其他数据。这些数据涉及许多假设和局限性,提醒您不要过分重视此类估计。此外, 对我们未来业绩和我们运营所在市场的未来表现的预测、假设和估计必然会受到高度的不确定性和风险的影响。CRINETICS 药品 | 2

达到主要终点和所有次要终点而帕图索汀是 耐受性良好的主要终点 83% 服用帕图索汀的参与者维持 IGF-1 ≤ 1.0xULN,而安慰剂的受试者为 4% ✓ (p

什么是肢端肥大症?肢端肥大症是由良性垂体肿瘤引起的 分泌物 • 高血压 • 头痛 • 面部过量生长激素 (GH) 改变 • 垂体功能减退 • 视力缺陷特征肢端肥大症不受控制会使人衰弱并增加过早死亡的风险 • 肝肿大 • 汗水 • 产前症 • 受损 • 关节痛 • 手部肿大 • 葡萄糖 • 肿胀 • 心脏隧道 • 甲状腺 • 呼吸 • 关节炎肥大问题 Somatotroph 腺瘤生长抑素受体配体 (SRL) 抑制生长激素分泌生长激素肝脏垂体分泌过多的生长激素是由垂体引起的肝脏分泌过多 IGF-1 IGF-I CRINETICS PHARMICALS | 4 个来源:http://www.fipapatients.org;Bex M、Abs R、 T'sJoen G 等Eur J Endocrinol。2007;157 (4): 399-409
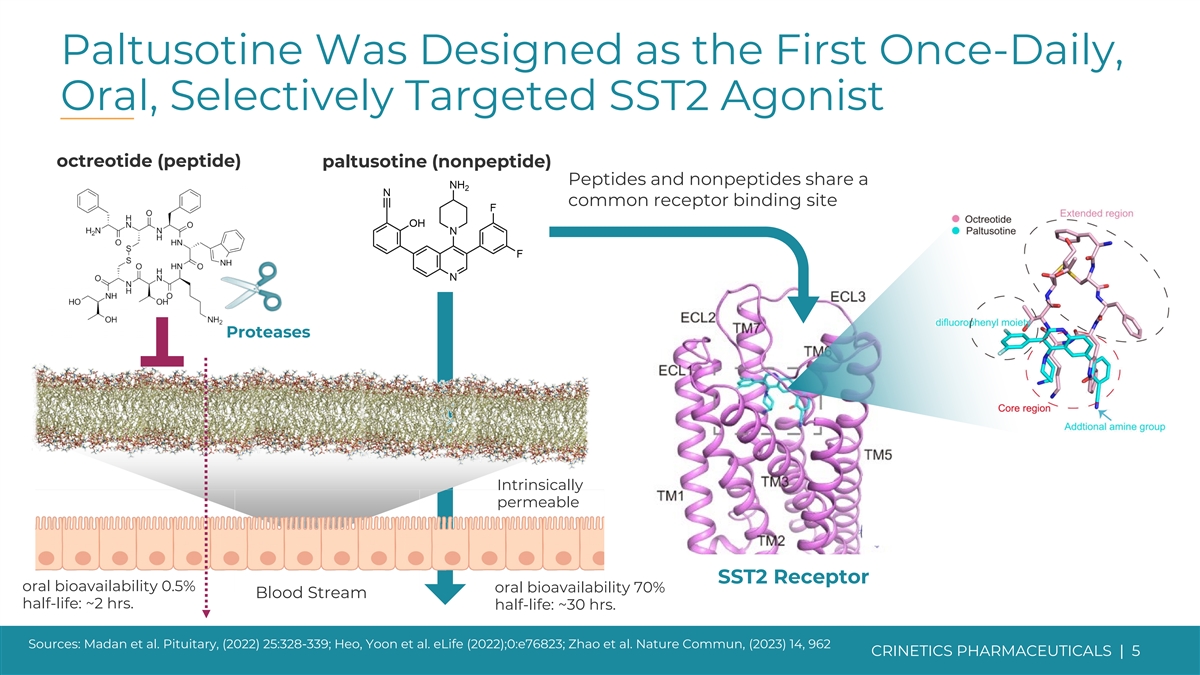
Paltusotine 被设计为第一种每日一次、口服、选择性 靶向 SST2 激动剂奥曲肽(肽)paltusotine(非肽)肽和非肽具有共同的受体结合位点蛋白酶本质可渗透性 SST2 受体口服生物利用度 0.5% 口服生物利用度 70% 血流 半衰期:约 2 小时。半衰期:约 30 小时。资料来源:Madan 等人。垂体,(2022) 25:328-339;Heo、Yoon 等人。eLife (2022);0:e76823;Zhao 等人Nature Commun,(2023) 14、962 CRINETICS PHARMICALS | 5
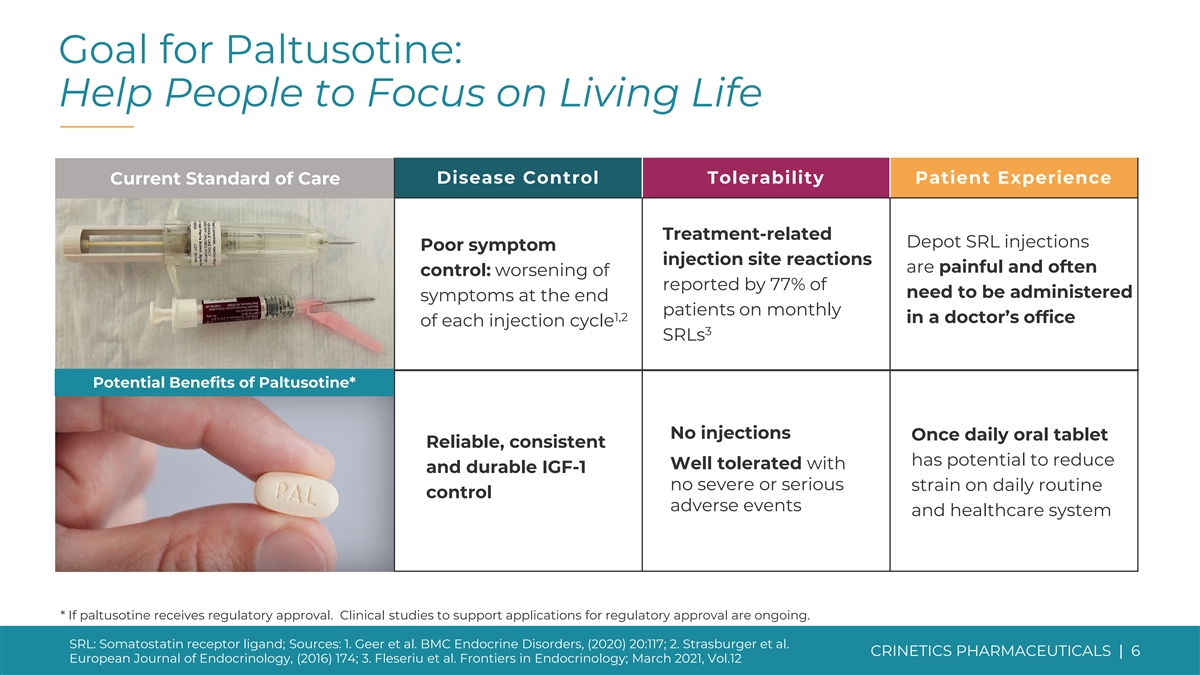
Paltusotine 的目标:帮助人们专注于生活疾病 控制耐受性患者体验当前的护理标准治疗相关的 Depot SRL 注射不良症状注射部位反应很痛苦而且往往会得到控制:77% 的患者每月 1,2 在每个注射周期的医生办公室 3 SRL 巴妥西汀的潜在益处*不注射每天口服一次平板电脑可靠、一致有可能降低耐受性良好且耐用 IGF-1 不严重或 如果paltusotine获得监管部门的批准,则日常控制不良事件和医疗保健系统将面临严重压力。支持监管部门批准申请的临床研究正在进行中。SRL:生长抑素受体配体;来源:1. Geer 等人BMC 内分泌失调,(2020) 20:117;2.Strasburger 等人CRINETICS PHARMICALS | 6《欧洲内分泌学杂志》,(2016)174;3.Fleseriu 等人《内分泌学前沿》;2021年3月,第12卷
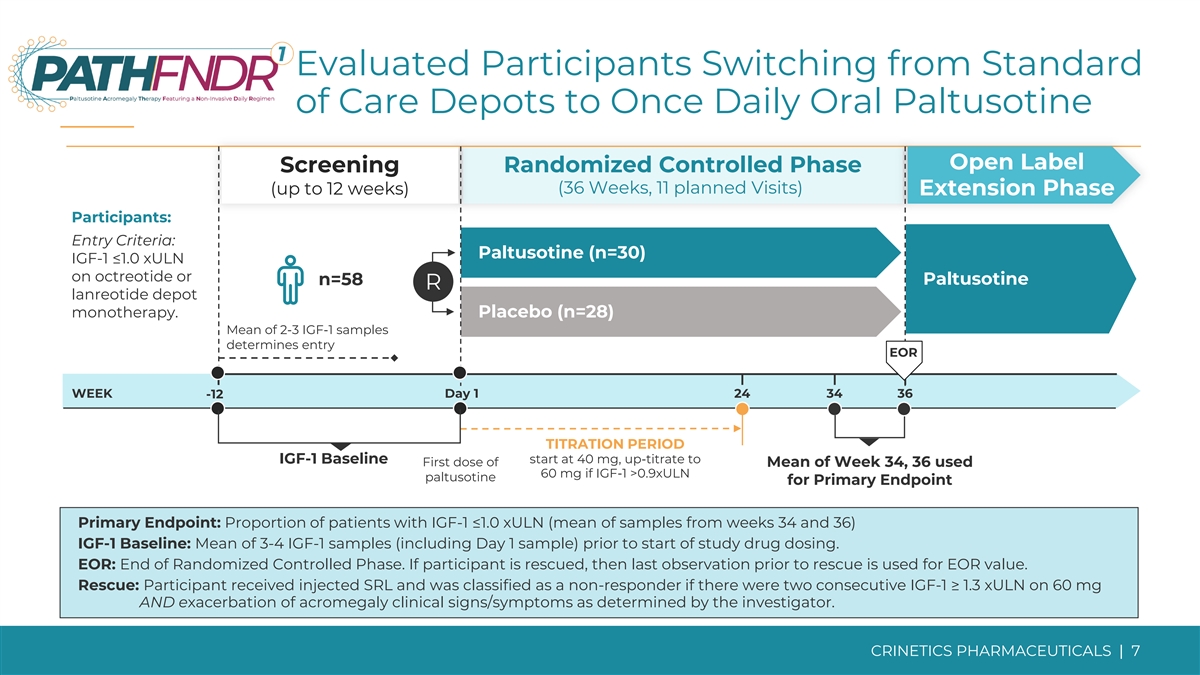
评估了从标准护理仓库切换到每日一次 口服帕图西汀开放标签筛查随机对照期(36 周,11 次计划就诊)(最长 12 周)延期参与者:入学标准:帕图西汀(n=30)使用奥曲肽或 n=58 Paltusotine R 兰瑞肽库单一疗法 IGF-1 ≤1.0 xULN 或 n=58 Paltusotine R lanreotide depot 单一疗法。安慰剂 (n=28) 2-3 个 IGF-1 样本的平均值决定了入口 EOR 第 1 天 24 34 36 -12 滴定期 IGF-1 基线起始于 40 mg,上滴至第 34 周平均值的第一剂量,36 个使用 60 mg 如果 IGF-1 >0.9xULN paltusotine 作为主要终点主要终点:IGF-1 ≤1.0 xuLN 的患者比例(第 34 周和第 36 周样本的平均值)IGF-1 基线:在研究开始给药之前,平均有 3-4 IGF-1 个样本(包括第 1 天的样本)。EOR: 随机对照阶段结束。如果参与者获救,则使用救援前的最后一次观察来计算 EOR 值。救援:参与者接受了注射 SRL,如果连续两次 IGF-1 ≥ 1.3 xuLN 服用 60 mg,且研究人员确定肢端肥大症临床体征/症状恶化,则被归类为无反应者。CRINETICS 药品 | 7
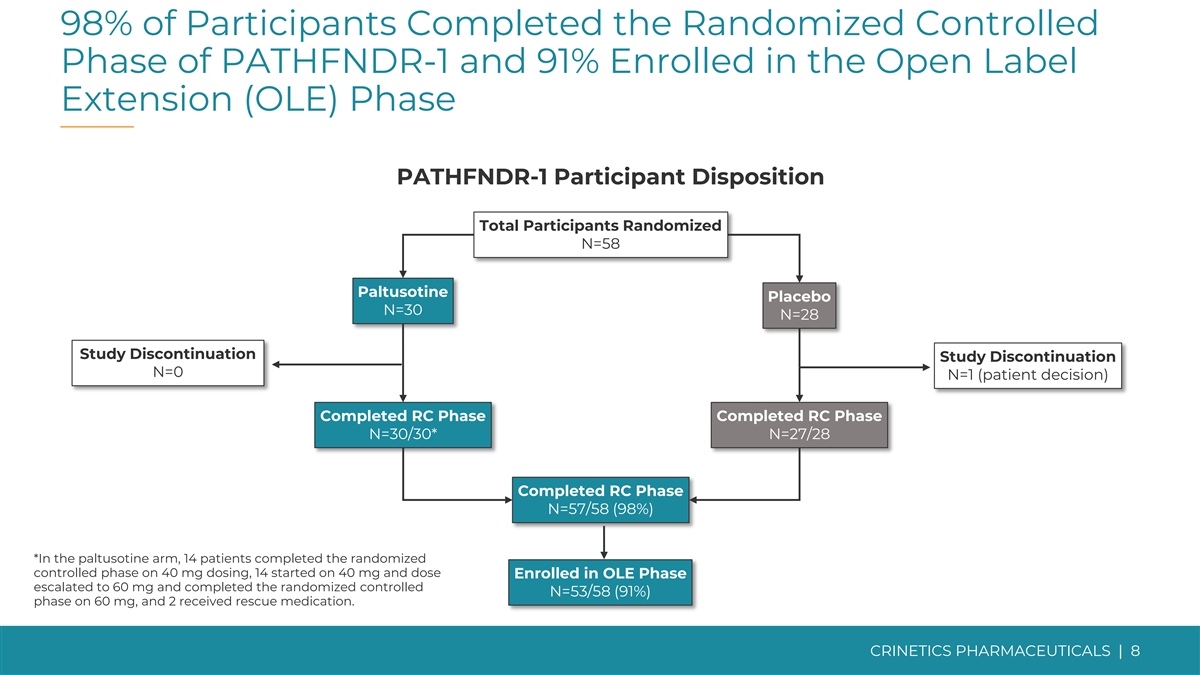
98% 的参与者完成了 PATHFNDR-1 的随机对照阶段,91% 的参与者进入了开放标签扩展 (OLE) 阶段 PATHFNDR-1 受试者性格总参与者随机化 N=58 Paltusotine 安慰剂 N=30 N=28 研究停止 N=0 N=1(患者决定)已完成 RC 阶段已完成 RC 阶段 N=30/30* N=27/28 已完成 RC 期 N=57/58 (9=57/58) 8%) *在帕图西汀组中,有14名患者在给药40毫克时完成了随机对照期,14名患者开始服用40 mg,剂量进入OLE期的患者升级到60 mg而且 服用 60 mg 完成了随机对照 N=53/58 (91%) 阶段,2 人接受了救援药物。CRINETICS 药品 | 8
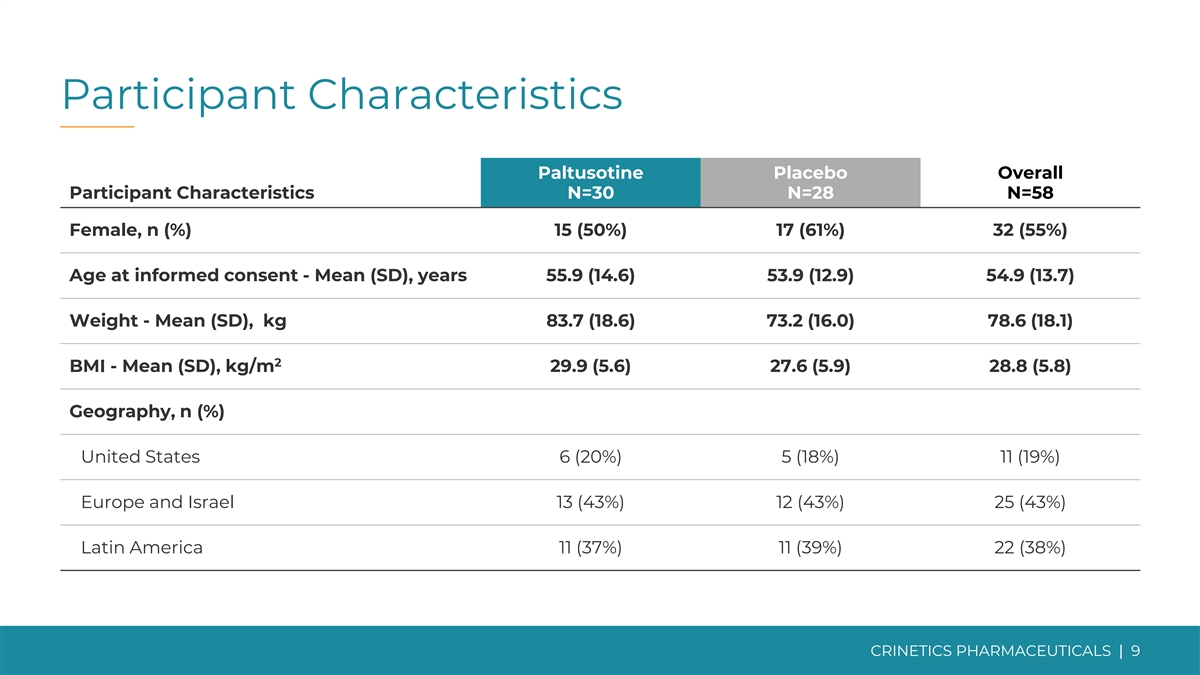
参与者特征帕尔图索汀安慰剂总体参与者 特征 N=30 N=28 N=58 女性,n (%) 15 (50%) 17 (61%) 32 (55%) 知情同意年龄——平均值 (SD),55.9 (14.6) 53.9 (12.9) 54.9 (12.9) 54.9 (13.7) 体重-平均值 (SD),kg 83.7 (18.6) 78.0 (16.0) 78.8 6 (18.1) 2 体重指数——平均值 (SD),kg/m 29.9 (5.6) 27.6 (5.9) 28.8 (5.8) 地理,n (%) 美国 6 (20%) 5 (18%) 11 (19%) 欧洲和以色列 13 (43%) 12 (43%) 25 (43%) 拉丁美洲 11 (37%) 11 (39%) 22 (38%) CRINETICS | 9
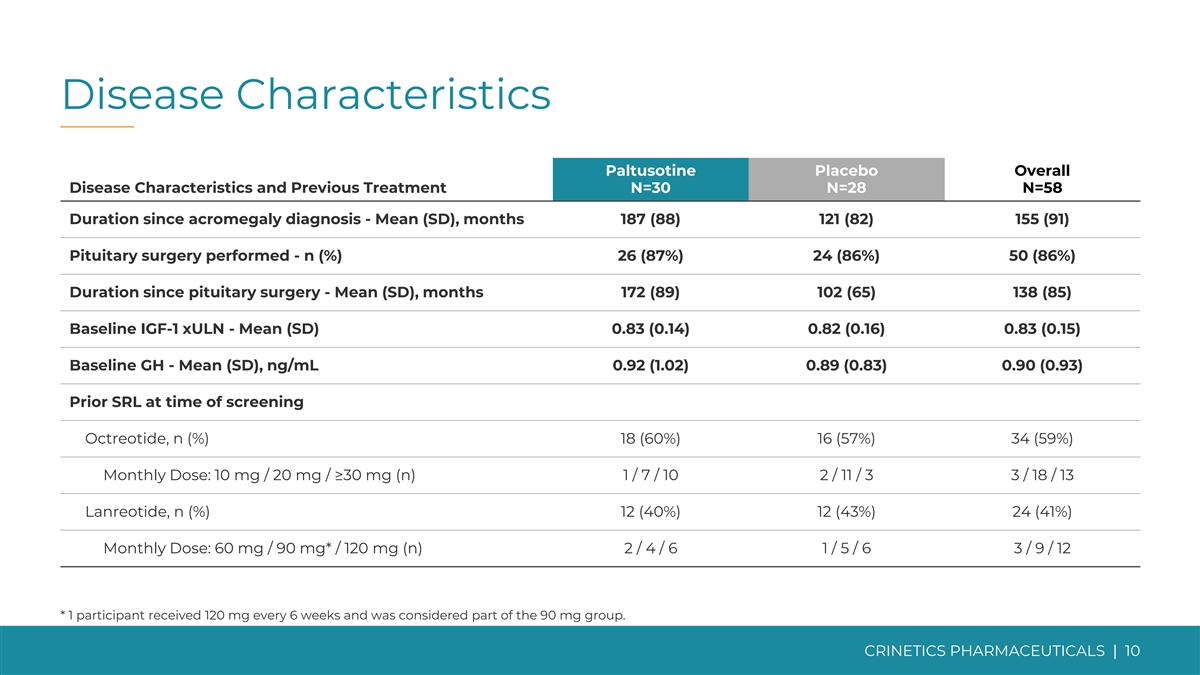
疾病特征帕图索汀安慰剂总体疾病 特征和既往治疗 N=30 N=28 N=58 肢端肥大症诊断以来的持续时间——平均值(SD),187(88)121(82)155(91)进行的垂体手术——n(%)26(87%)24(86%)50(86%)垂体手术以来的持续时间——平均值(SD), 个月(172)89) 102 (65) 138 (85) 基线 IGF-1 xULN——平均值 (SD) 0.83 (0.14) 0.82 (0.16) 0.83 (0.15) 基线 GH——平均值 (SD),ng/mL 0.92 (1.02) 0.89 (0.83) 0.90 (0.93) 筛选奥曲肽时先前的 SRL,n (%) 18 (60%) 16 (57%) 34 (57%) 34 (57%) 9%) 每月一次剂量:10 mg/20 mg/≥30 mg (n) 1/ 7/ 10 2/ 11/3 3/ 18/13 兰瑞肽,n (%) 12 (40%) 12 (43%) 24 (41%) 每月剂量:60 mg/90 mg*/120 mg (n) 2/ 4/ 6 1/ 5/6 3/ 9/ 12 * 1 名参与者每 6 周服用 120 毫克而且 被认为是 90 mg 组的一部分。CRINETICS 药物 | 10
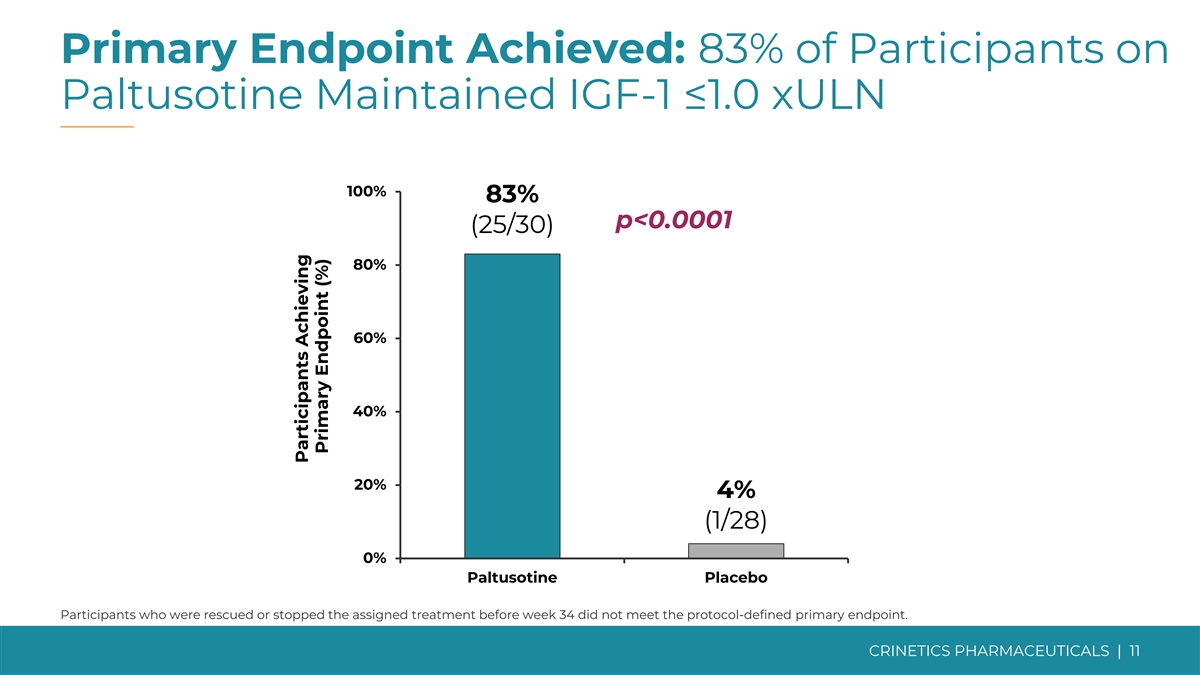
主要终点已实现:服用 Paltusotine 的参与者中有 83% 维持 IGF-1 ≤1.0 xuLN 100% 83% p
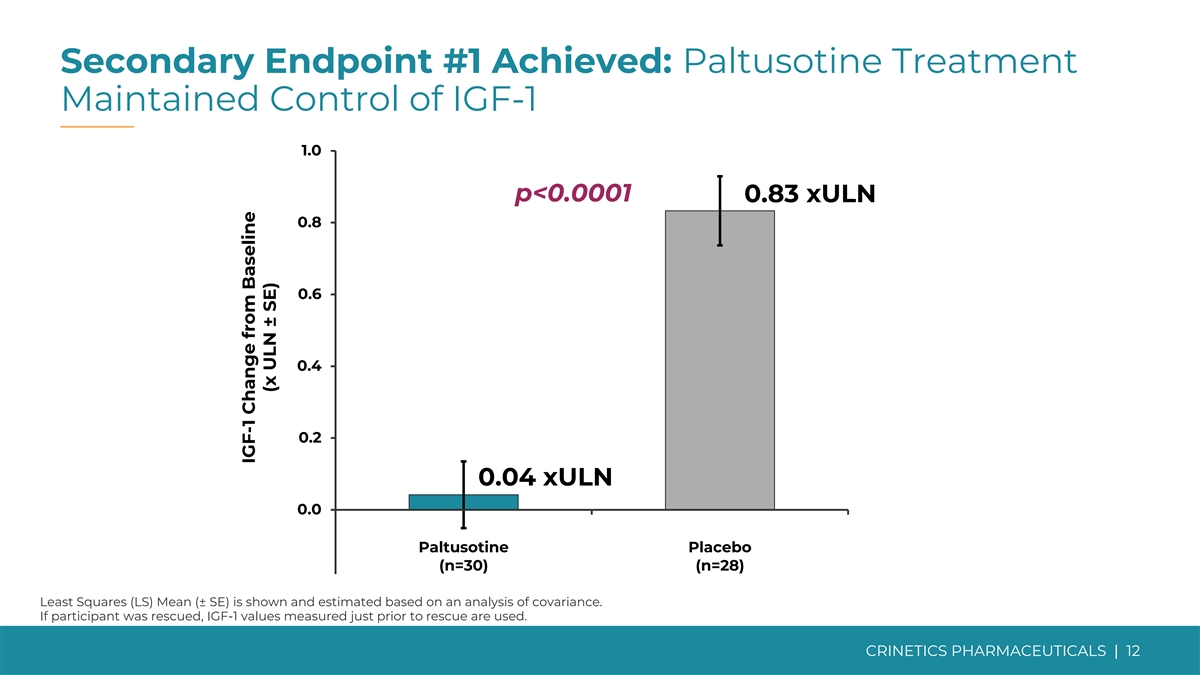
次要终点 #1 已实现:Paltusotine 治疗维持 对 IGF-1 1.0 p 的控制
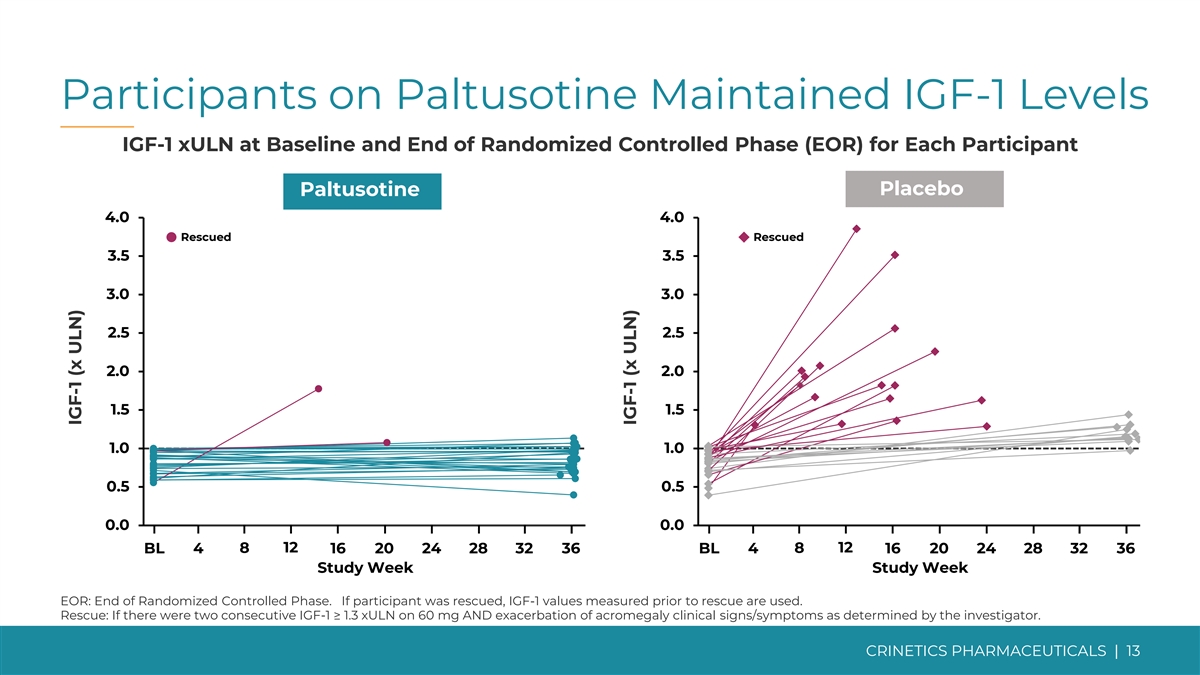
Paltusotine 的参与者将 IGF-1 水平 IGF-1 xULN 维持在 基线和每位参与者的随机对照阶段 (EOR) 结束安慰剂 paltusotine 4.0 4.0 获救 3.5 3.0 3.0 2.5 2.0 2.0 1.5 1.0 1.0 0.5 0.0 0.0 0.0 12 12 BL 4 8 16 20 24 28 32 36 研究周 EOR:随机对照结束 研究周 EOR:随机对照结束阶段。如果参与者获救,则使用救援前测量的 IGF-1 值。救援:如果研究人员确定,如果连续出现两次 IGF-1 ≥ 1.3 xuLN,且肢端肥大症临床体征/症状恶化 CRINETICS PHARMICALS | 13 IGF-1 (x ULN) IGF-1 (x ULN)

患者使用肢端肥大症状日记 (ASD) 报告症状严重程度在 ASD 中评估的症状 • ASD 是根据美国食品药品管理局头痛指南制定的,用于评估关节疼痛临床研究中的肢端肥大症症状 * 出汗疲劳 • 七种症状的评分从 0(无症状)到 10(最严重的症状);ASD 总分为 0 到 70 腿部无力肿胀 • 之前收集了每日症状清单到麻木/刺痛以及研究期间的治疗总分 (0-70) 数字量表(每个症状)没有最坏症状症状 0 1 2 3 4 5 6 7 89 10 *Martin 等人患者报告结果杂志 (2023) 7:15;https://doi.org/10.1186/s41687-023-00541-7 CRINETICS PHARMICALS | 14
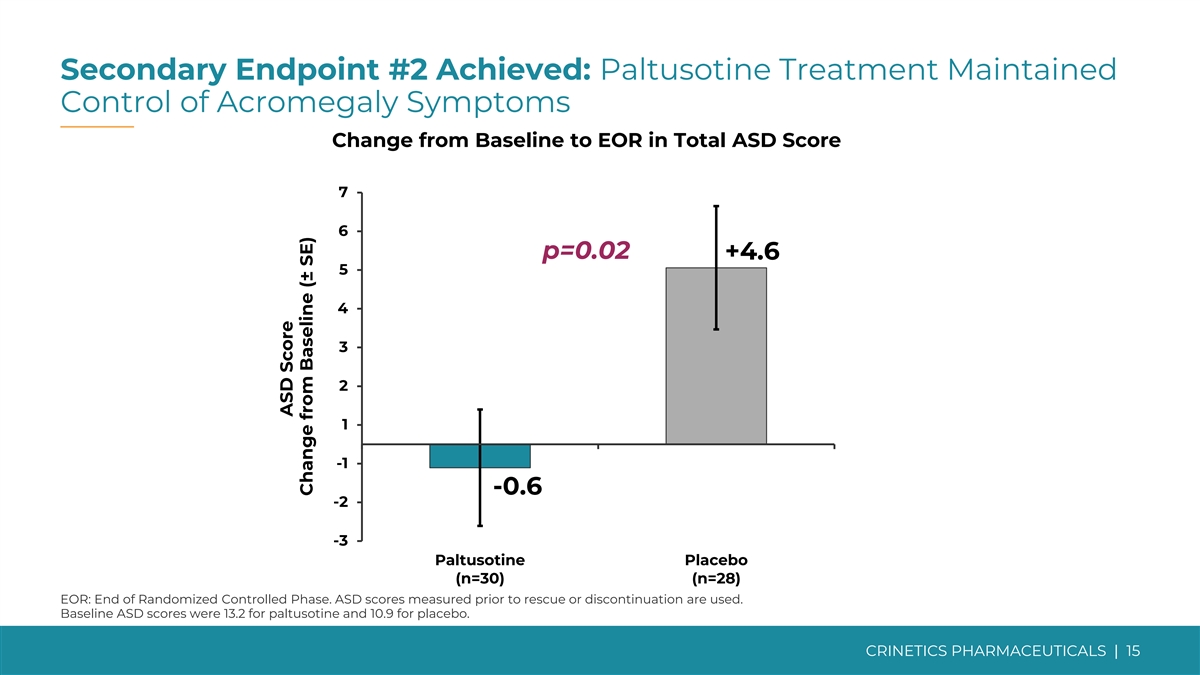
次要终点 #2 已实现:帕图索汀治疗维持 控制肢端肥大症状从基线变为 EOR 的自闭症总分为 7 6 p=0.02 +4.6 5 4 3 2 1 -0.6 -0.6 -2 -3 帕图索汀安慰剂 (n=30) (n=28) EOR:随机对照阶段结束。使用在抢救或停药之前测量的 ASD 分数 。paltusotine的基线自闭症障碍评分为13.2,安慰剂的基线ASD评分为10.9。CRINETICS PHARMICALS | 自闭症障碍评分较基线变化 15 (± SE)
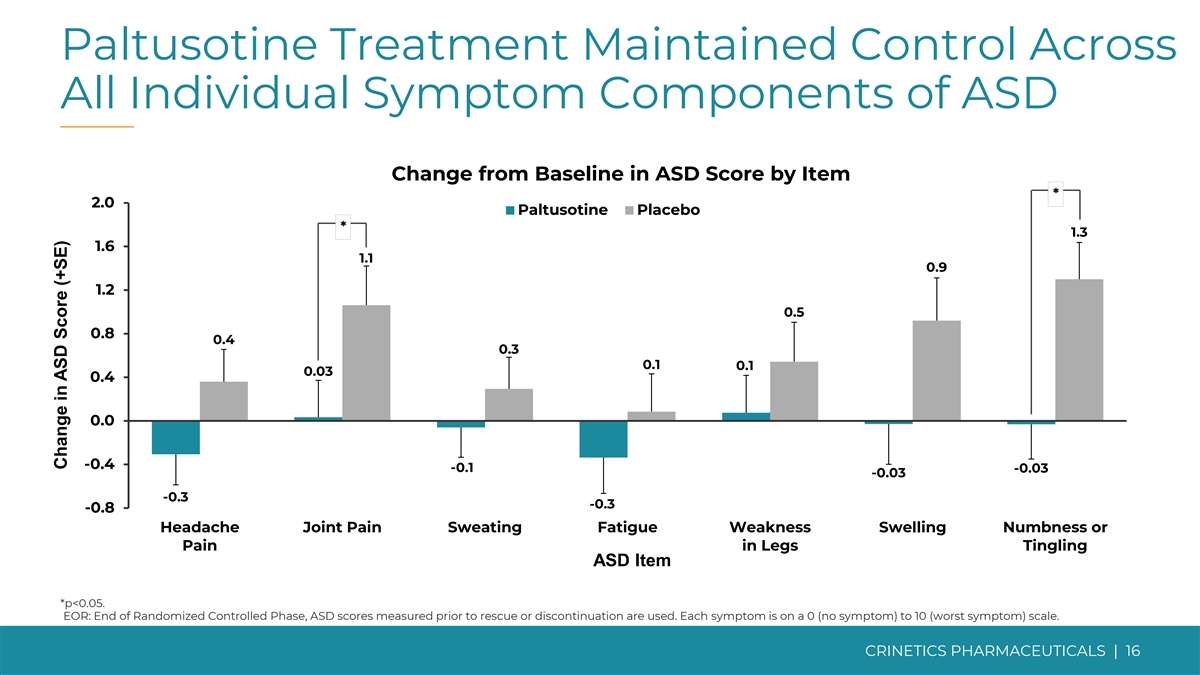
帕图西汀治疗维持了对所有个体症状的控制 自闭症障碍成分与基线相比的变化 2.0 帕图索汀安慰剂 1.3 1.6 1.1 0.9 1.2 0.5 0.8 0.4 0.1 0.1 0.1 0.1 0.3 0.1 0.3 0.3 -0.3 -0.8 头痛关节疼痛出汗疲劳无力肿胀麻木或疼痛 腿部刺痛自闭症障碍项目 *p
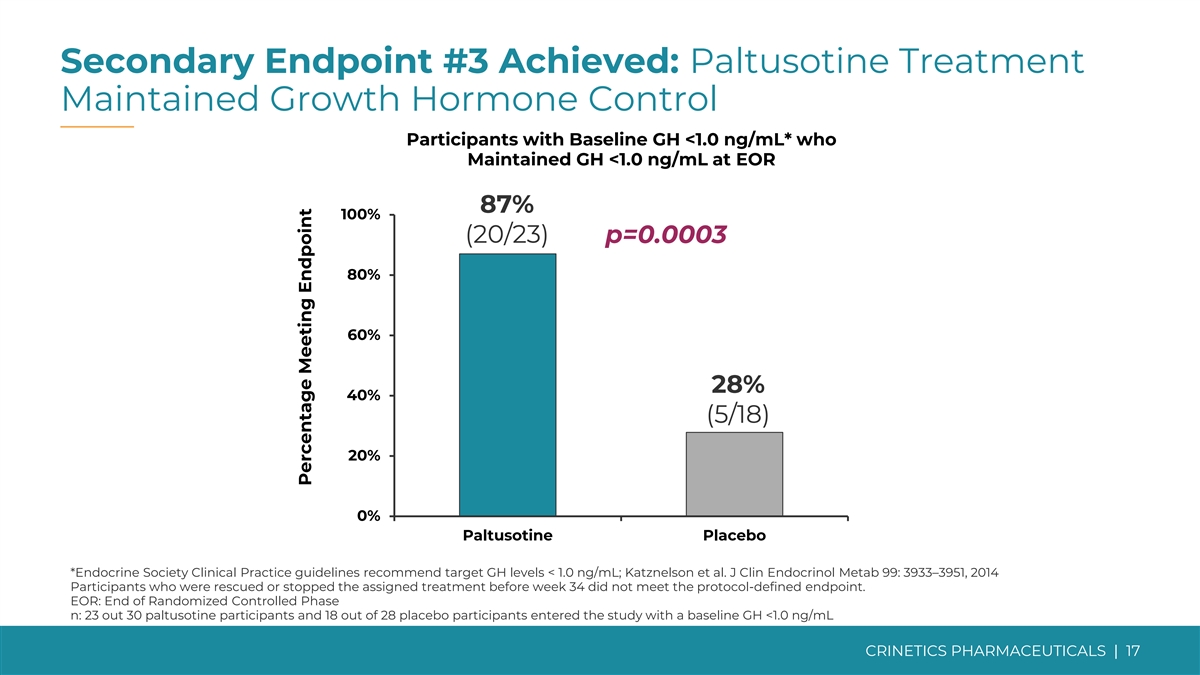
次要终点 #3 已实现:巴妥西汀治疗维持生长 基线 GH 的激素控制参与者
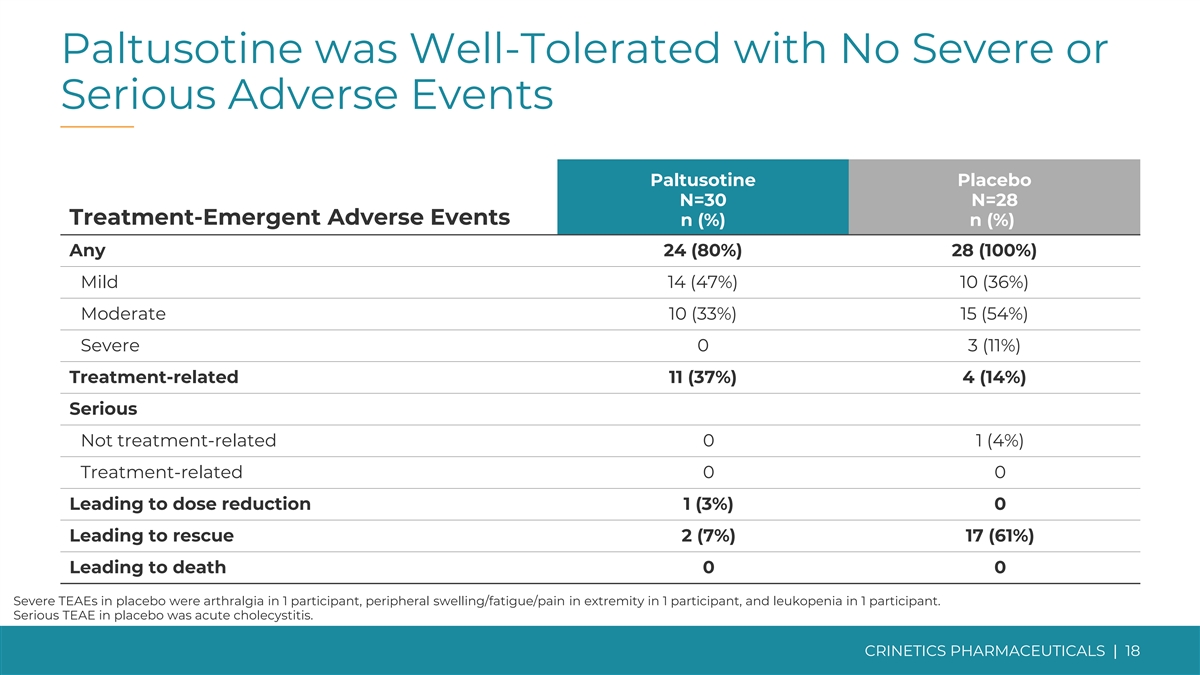
帕图索汀耐受性良好,无严重或严重不良事件 帕图西汀安慰剂 N=30 N=28 治疗紧急不良事件 n (%) n (%) 任何 24 (80%) 28 (100%) 轻度 14 (47%) 10 (36%) 中度 10 (33%) 15 (54%) 严重 0 3 (11%) 治疗相关 11 (37%) 4 (14%) 严重与治疗无关 0 1 (4%) 治疗相关 0 0 导致剂量减少 1 (3%) 0 导致救援 2 (7%) 17 (61%) 导致死亡 0 0 安慰剂中的严重 TEAE 是 1 名受试者的关节痛、1 名参与者的外周肿胀/疲劳/四肢疼痛以及白细胞减少症 在 1 名参与者中。安慰剂中严重的TEAE为急性胆囊炎。CRINETICS 药品 | 18

PATHFNDR-1 不良事件摘要帕图索汀安慰剂治疗 Emergent N=30 N=28 不良事件 ≥ 5% n (%) n (%) 常见肢端肥大症症状关节痛 8 (27%) 16 (57%) 头痛 6 (20%) 10 (36%) 外周肿胀 2 (7%) 10 (36%) 疲劳 2 (7%) 5 (18%) 肌肉无力 1 (3%) 3 (11%)) 感觉异常 0 7 (25%) 不良事件发生频率多汗症 0 4 (14%) 被认为与腹泻相关的常见 SRL 副作用 7 (23%) 4 (14%) 肢端肥大症在腹痛中明显较低 5 (17%) 3 (11%) 恶心 3 (10%) 2 (7%) 腹部治疗的受试者扩张 2 (7%) 1 (4%) paltusotine 与安慰剂 Flatulence 2 (7%) 1 (4%) 其他(分别为 30% 对 86%)。便秘 2 (7%) 4 (14%) 尿路感染 2 (7%) 2 (7%) 鼻咽炎 2 (7%) 1 (4%) 呼吸困难 1 (3%) 2 (7%) 高血糖 1 (3%) 2 (7%) 头晕 1 (3%) 2 (7%) 背痛 1 (3%) 2 (7%) COVID-19 0 6 (21%) 乏力 0 4 (14%) 四肢疼痛 0 3 (11%) 包括在救援期间发生的 AE。如果不包括救援期,则费率相似。CRINETICS PHARMICALS | 19

PATHFNDR-1 安全摘要 • Paltusotine 耐受性良好, 活跃组未报告严重或严重的不良事件 • 最频繁(> 10%)报告的不良事件包括关节痛、腹泻、头痛、腹痛和恶心 • 在使用帕图西汀治疗期间,生命体征、 心电图或实验室值中未观察到安全信号 • 测量的垂体肿瘤大小未观察到临床上显著的变化核磁共振成像 • PATHFNDR-1 的安全性结果与迄今为止在整个临床 项目中观察到的结果相当 CRINETICS药品 | 20
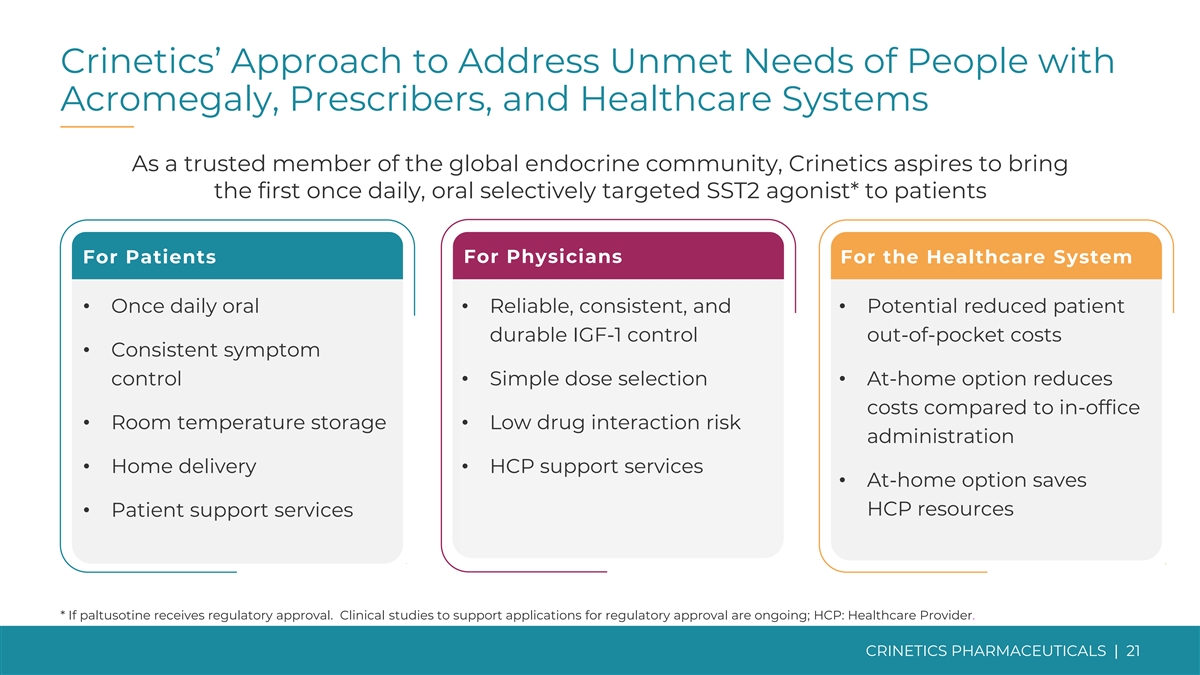
Crinetics 解决肢端肥大症患者、处方者和医疗保健系统未满足需求的方法作为全球内分泌界值得信赖的成员,Crinetics 渴望为患者带来第一款每日一次的口服选择性靶向 SST2 激动剂*功效商业潜力 Crinetics Approack Crinetics 今天为什么是内分泌学?患者供医师用于医疗保健系统 • 每天口服一次 • 可靠、一致且 • 有可能降低患者耐用 IGF-1 控制自付费用 • 一致的症状控制 • 简单的剂量选择 • 与办公室相比,在家选项可降低成本 • 室温储存 • 药物相互作用风险管理低 • 送货上门 • HCP 支持服务 • 在家选项可节省 HCP 资源 • 患者支持服务 * 如果帕图西汀获得监管部门的批准。支持监管部门批准申请的临床研究正在进行中;HCP:医疗保健提供者。CRINETICS PHARMICALS | 21
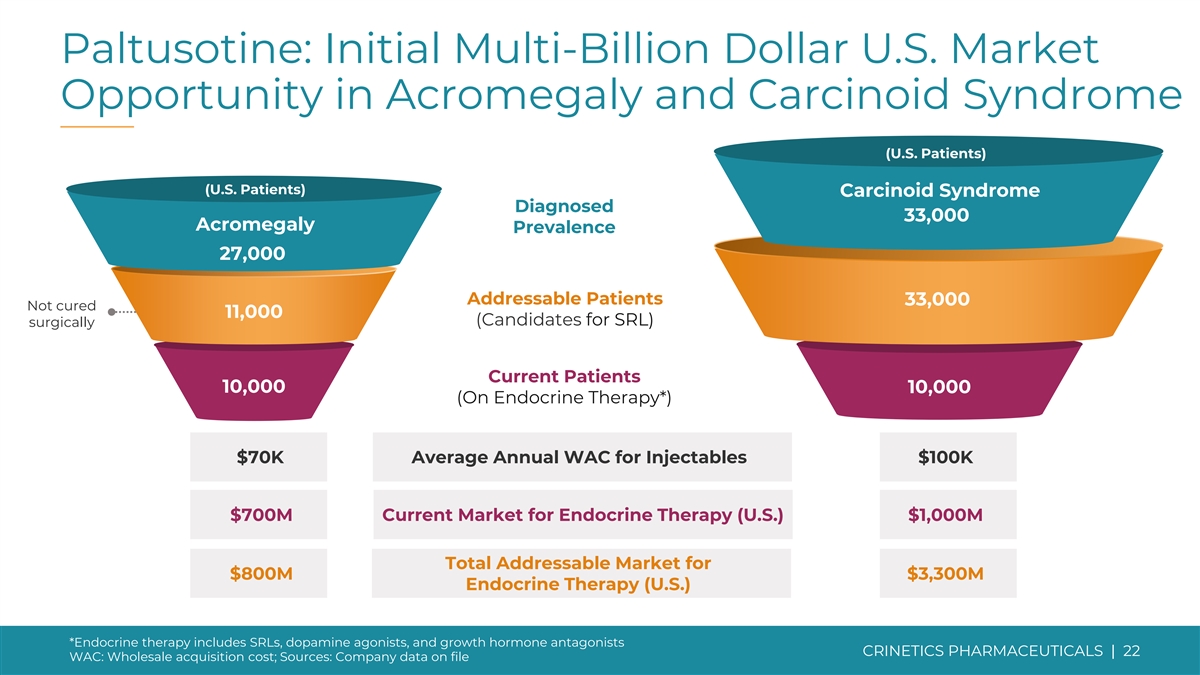
Paltusotine: 肢端肥大症和类癌综合征(美国患者)(美国患者)的初始市场机会数十亿美元被诊断为类癌综合征 33,000 例肢端肥大症患病率 27,000 名可治疗患者 33,000 名未治愈患者 11,000(SRL 候选人)目前正在接受手术的患者 10,000 名(在 内分泌治疗*)注射剂每年 WAC 平均为 7 万美元 7亿美元当前内分泌疗法市场(美国)10亿美元总潜在市场8亿美元33亿美元内分泌疗法(美国)*内分泌疗法包括 SRL、多巴胺激动剂和 生长激素拮抗剂 CRINETICS PHARMICALS | 22 WAC:批发收购成本;来源:公司存档的数据

Paltusotine 的预期里程碑 • 23 年第 4 季度类癌综合征 2 期研究的初步结果 • 2014 年第 1 季度未经治疗的肢端肥大症患者的 PATHFNDR-2 3 期研究结果 • 2024 年肢端肥大症新药上市申请已提交 • 2024 年预期类癌综合征第 3 期开始 • 正在进行中:肢端肥大症 开放标签扩展研究 • N > 120 且还在增加 • 一些 2 期患者接受了长达 paltusotine 的治疗 3 年 CRINETICS PHARMICALS | 23

问答斯科特·斯特鲁瑟斯,博士创始人兼首席执行官 Dana Pizzuti,医学博士首席开发官艾伦·克拉斯纳,医学博士首席医学官