

2023 年 9 月公司简报附录 99.1

免责声明以下演示文稿, ,包括这些幻灯片的任何印刷版或电子版、演讲者的演讲、在任何演示和问答环节中传达的信息以及在 上分发的与演示文稿相关的任何文件或材料(统称为 “演示文稿”)均由 Cabaletta Bio, Inc.(“我们”、“我们”、“我们的”、“Cabaletta” 或 “公司”),仅供参考 。本演示文稿并不声称是招股说明书、完整性或包含您可能想要的所有信息。除非另有说明,否则此处包含的声明均自本演示文稿发布之日起作出, 和本演示文稿在任何情况下均不得暗示此处包含的信息在该日期之后的任何时候都是正确的,也不得暗示将更新或修订信息以反映随后 可用的信息或在本演示日期之后发生的变化。本演示文稿可能包含1995年《私人证券诉讼改革法》所指的与我们的业务、运营和 财务状况有关的 “前瞻性陈述”,包括但不限于关于我们当前的信念、期望和假设的明示或暗示陈述:我们的业务、CAAR T 和 CARTA 技术以及 CABA™ 平台的未来计划和战略;我们发展以自身免疫为重点的产品线的能力;能力利用由此产生的潜在好处与 Georg Schett 教授的转化研究合作以及与 IASO Bio 的独家许可协议;我们对 CABA-201 的潜在成功和治疗益处的期望,包括我们相信 CABA-201 可以实现 “免疫系统重置” 并为自身免疫 疾病患者提供深刻而持久的反应;我们 (i) 在系统性红斑狼疮患者中进行 CABA-201 的 1/2 期临床试验,包括我们的预期进展、临床试验设计、利用能力我们在自身免疫细胞疗法和狼疮产品方面的经验开发和 (ii) 在肌炎患者中进行 CABA-201 的 1/2 期临床试验,包括我们的预期进展、临床试验设计以及利用我们在自身免疫细胞治疗方面的经验的能力;我们计划在 2024 年上半年读出接受 CABA-201 治疗的患者的初步临床数据;我们有能力招募必要数量的患者,按预期方式给每个给药队列服药,并按计划推进本阶段的试验 CABA-201 的 1/2 临床试验; 保留和识别预期激励措施的能力由 CABA-201 的任何 Fast Track 指定授予;我们为开发计划提交任何计划监管文件的时机;我们的 Descaartes™ 1 期试验的进展和结果,包括 围绕我们的 Descaartes™ 试验中报告的队列的安全性、临床和转化数据的重要性和影响,以及我们推进剂量递增和启动联合队列以及优化靶向细胞 疗法的能力;我们实施预治疗方案、这种预处理方案的结果以及潜在的能力增强 DSG3-CAART 在体内的暴露;我们的候选产品的治疗潜力和临床益处; 期望 Cabaletta 可以改善患有系统性红斑狼疮、肌炎、寻常型粘膜天疱疮、重症肌无力或其他自身免疫性疾病的患者的预后;我们有能力在队列 a6m 中将剂量提升至 150 亿 个细胞,开始给药在组合队列或其他队列中;我们评估 DSG3-CAART 持久性与潜力之间关系的能力及其潜在意义mPV 患者的临床反应;我们 安全撤退更多患者的能力,以及我们在对患者进行再治疗和重复给药后是否会继续观察到免疫介导的 DSG3-CAART 细胞清除率不足;我们成功完成候选产品的临床前和临床 研究的能力,包括我们招收必要数量的患者、按预期方式给每个给药队列剂量以及推进试验的能力;能力 musk-caart 靶向分化成 抗体的 B 细胞分泌细胞,产生针对肌肉特异性激酶的自身抗体;我们获得和维持候选产品的监管部门批准的能力,包括我们对候选产品提供的预期激励措施的期望以及 保留候选产品孤儿药称号和快速通道称号的能力(如适用);进一步扩展和发展我们的模块化CABA™ 平台涵盖一系列自身免疫性疾病;我们与第三方供应商和制造商签订合同的能力 ,实施增强型制造处理并进一步发展我们的内部制造战略、能力和设施;我们潜在的商业机会,包括候选产品的价值和可开发的 市场;我们对资本使用和其他财务业绩的预期;以及我们为2025年第四季度的运营提供资金的能力。诸如但不限于 “期待”、 、“相信”、“期望”、“预期”、“估计”、“打算”、“计划”、“将”、“应该” 和 “可以” 之类的词语以及类似的表达方式或词语可以识别 前瞻性陈述。各种风险、不确定性和假设可能导致实际结果与我们前瞻性陈述中的预期或暗示存在重大差异。此类风险和不确定性包括但不限于 与我们的候选产品开发活动以及临床前研究和临床试验的成功、成本和时机相关的风险,以及与我们能够在 的 CABA-201、DSG3-CAART 和 musk-caart 的临床前研究和临床试验中证明足够的安全性、有效性和耐受性证据相关的风险,以及使用类似设计的结构观察到的结果的风险,包括但不限于由于给药方案,这并不能代表我们 寻求的结果为了实现 CABA-201 的目标,我们计划在 Descaartes™ 试验中评估其他队列,包括实施预治疗方案的队列、生物活性或持续性迹象可能无法为长期 结果提供依据的风险、通过有效的 CART-19 肿瘤学研究观察到的持续性与淋巴枯竭相结合的风险并不能表明或不适用于 mPV 患者的临床反应,与临床试验站点激活相关的风险 {} 或者入学率低于预期,我们的保护能力和维护我们的知识产权地位、与第三方关系相关的风险、与监管机构评估 监管文件相关的不确定性以及与我们的候选产品相关的其他信息、我们保留和认可任何孤儿药指定和快速通道指定所赋予的预期激励措施的能力、与监管申报和 潜在许可相关的风险、我们的任何一个或多个候选产品无法成功开发和商业化的风险,结果的风险的临床前研究或临床研究无法预测 与未来研究相关的未来结果,以及与动荡的市场和经济状况以及公共卫生危机相关的风险。新的风险和不确定性可能会不时出现,因此不可能预测所有的风险和不确定性。除非适用法律要求 ,否则我们不打算公开更新或修改此处包含的任何前瞻性陈述,无论是由于任何新信息、未来事件、情况变化还是其他原因。尽管我们认为此类前瞻性陈述中反映的 预期是合理的,但我们无法保证这种预期会被证明是正确的。因此,提醒您不要过分依赖这些前瞻性陈述。对于任何此类前瞻性陈述的准确性,不作出 陈述或担保(明示或暗示)。有关这些风险和不确定性以及其他重要因素的讨论,其中任何一个因素都可能导致我们的实际 业绩与前瞻性陈述中包含的业绩存在重大差异,请参阅我们最新的10-K表年度报告中标题为 “风险因素” 的部分,以及我们随后向美国证券交易委员会提交的其他文件中关于潜在风险、不确定性和其他重要 因素的讨论。本演示文稿中包含的某些信息涉及或基于从第三方来源获得的研究、出版物、调查和其他数据以及 公司自己的内部估算和研究。尽管公司认为截至本演示文稿发布之日,这些第三方来源是可靠的,但它没有独立核实,也没有对从第三方来源获得的任何信息的充分性、公平性、准确性或完整性作出任何陈述。该公司是各种商标、商品名称和服务标志的所有者。本 演示文稿中出现的某些其他商标、商品名称和服务标志是第三方的财产。仅为方便起见,本演示文稿中提及的商标和商品名称不带® 和 TM 符号,但此类提法不应被解释为表示其 各自所有者不会在适用法律的最大范围内主张其权利。
为自身免疫性疾病患者开发并推出首款治疗性 靶向细胞疗法

利用多年来在自身免疫领域的 细胞疗法经验,启动 CABA-201 临床试验 Cabaletta®:寻求各种自身免疫性疾病的治疗方法 CARTA — 用于自身免疫的嵌合抗原受体 T 细胞;CAART — 嵌合自身抗体 受体 T 细胞;IND — 在研新药;SLE — 系统性红斑狼疮;DM — 皮肤肌炎;ASYs — 抗体合成酶综合征;IMNM — 免疫介导的坏死性肌病;流感 — 氟达拉滨;Cy — 环磷酰胺 Mackensen、Andreas 等“抗CD19 CAR T细胞疗法治疗难治性系统性红斑狼疮。”《自然医学》(2022):1-9。Müller、Fabian 等“难治性抗合成酶 综合征中靶向CD19的CAR T细胞。”《柳叶刀》(2023)。戴振宇等“用于T细胞治疗的新型全人源抗CD19 CAR的开发和功能表征。”《细胞生理学杂志》236.8 (2021):5832-5847。假设队列中未观察到剂量限制 毒性,并且试验中出现不间断的入组。截至2023年第二季度10季度报告。通过有效的设计推进肌炎和系统性红斑狼疮试验,包括起始剂量和平行队列 1.0 x 106 个细胞/kg CABA-201 的初始剂量与学术性肌炎和系统性红斑狼疮研究中使用的剂量相同 1,2 各有 6 名患者的平行队列 — 1) DM、2) ASYs 和 3) IMNM 的系统性红斑狼疮研究;1) LN 和 2) 非肾脏系统性红斑狼疮 CABA-201 的肌炎研究 专为自身免疫性疾病患者设计的全人类 CD19 粘合剂,包含大约 20 名肿瘤患者的数据 — 支持进一步评估自身免疫的临床安全性 Same 4-1BB共刺激域和类似的 CD19 粘合剂 affinity3 用于学术性肌炎和系统性红斑狼疮研究1,2 有可能治愈各种自身免疫性疾病,其中 B 细胞起着引发或维持疾病的作用。学术机构提供的其他临床数据强化了 CD19-CAR T 在自身免疫中的潜力,早期的行业研究正在进行中。有机会解决风湿病学以及其他治疗领域(包括神经病学、肾病)未得到满足的需求病学和皮肤病学 Descaartes™ 在寻常型粘膜天疱疮中试验 DSG3-CAART —iViG/Flu/Cy 队列报名参加 MusCaartes™ 重症肌无力试验 — 利用 DSG3-CAART CARTA 策略经验的见解 | CABA-201(4-1BB CD19-CAR T)将在肌炎和系统性红斑狼疮 1/2 期研究中同时进行评估 CAART 策略 | DSG3-CAART 和 musk-Caart 临床研究评估联合疗法初始 CABA-201 3 个月临床疗效和耐受性数据 1H244 | 1766美元 M cash5 将进入二零二五年第四季度
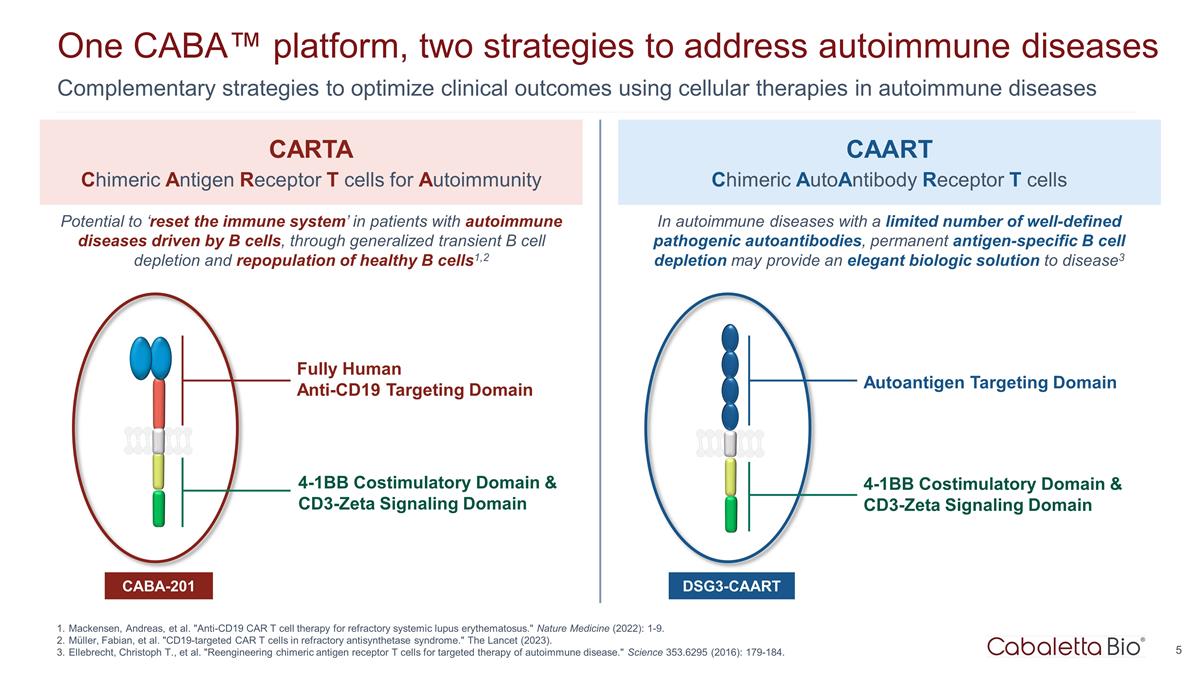
一个 CABA™ 平台,两个 应对自身免疫性疾病的策略使用细胞疗法来优化自身免疫性疾病的临床结果的互补策略 Mackensen、Andreas 等“抗CD19 CAR T细胞疗法治疗难治性系统性红斑狼疮。” 自然医学 (2022):1-9。穆勒、法比安等“难治性抗合成酶综合征中的CD19靶向CAR T细胞。”《柳叶刀》(2023)。Ellebrecht、Christoph T. 等。“重新设计嵌合抗原受体 T 细胞,用于 自身免疫性疾病的靶向治疗。”Science 353.6295 (2016):179-184。用于自身免疫的全人抗 CD19 靶向域 CARTA 嵌合抗原受体 T 细胞 CAART 嵌合抗体受体 T 细胞 CABA-201 4-1BB 共刺激结构域和 cd3-zeta 信号域 DSG3-CAART 有可能 “重置免疫系统”,通过普遍短暂的 B 细胞消耗和健康 B 细胞的再种群,1,2 在自身免疫性 疾病中明确的致病性自身抗体,永久性抗原特异性 B 细胞耗尽可能提供优雅的生物制剂disease3 自身抗原靶向域 4-1BB 共刺激域和 cd3-zeta 信号域
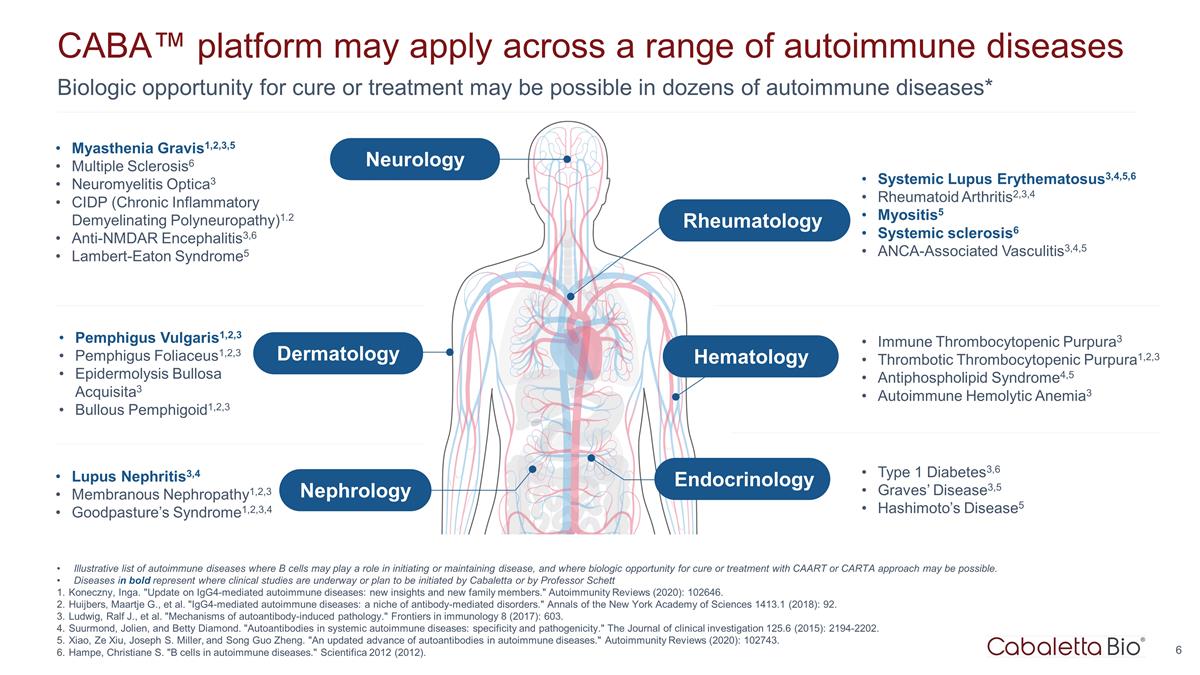
数十种自身免疫性疾病可能有机会治愈或 治疗* CABA™ 平台可能适用于一系列自身免疫性疾病 pemphigus vulgaris1,2,3 Pemphigus Foliaceus1,2,3 表皮松解大疱性天疱疮1,2,3 狼疮 肾炎3,4 膜性肾病 1,2,3 Goodpasture 综合征1,2,3,4 重症肌无力1,2,3,5 多发性硬化症6 神经脊髓炎 optica3 CIDP(慢性炎症性脱髓鞘性多发性神经病)1.2 抗 nmdar 脑炎3,6 Lambert-Eaton Syndrome5 系统性红斑狼疮3,4,5,6类风湿性关节炎2,3,4 肌炎5 系统性硬化症6 ANCA 相关性血管炎3,4,5 免疫性血小板减少性紫癜3 血栓性血小板减少性紫斑1,2,3 抗磷脂综合征4,5 自身免疫 溶血性贫血3 1 型糖尿病3,6 Graves病3,5 桥本氏病5 说明性清单自身免疫性疾病,其中 B 细胞可能在引发或维持疾病方面发挥作用,并且可能有机会使用 CAART 或 CARTA 方法进行治愈或 治疗。粗体显示的疾病表示正在进行或计划由卡巴莱塔或英加的谢特·科内奇尼教授发起的临床研究。“IgG4介导的自身免疫性疾病的最新情况:新的 见解和新的家庭成员。”自身免疫评论 (2020):102646。Huijbers、Maartje G. 等“IgG4介导的自身免疫性疾病:抗体介导的疾病的利基市场。”《纽约科学院年鉴》1413.1 (2018):92。Ludwig, Ralf J.,等“自身抗体诱发的病理机制。”《免疫学前沿》8 (2017):603。Suurmond、Jolien 和 Betty Diamond。“系统性自身免疫性疾病中的自身抗体:特异性和致病性。”《临床 调查杂志》125.6 (2015):2194-2202。Xiao、Ze Xiu、Joseph S. Miller 和宋国正。“自身免疫性疾病中自身抗体的最新进展。”自身免疫评论 (2020):102743。Hampe,Christiane S. “自身免疫性疾病中的 B 细胞。” Scientifica 2012 (2012)。皮肤科肾脏病学神经病学风湿病学血液学内分泌学
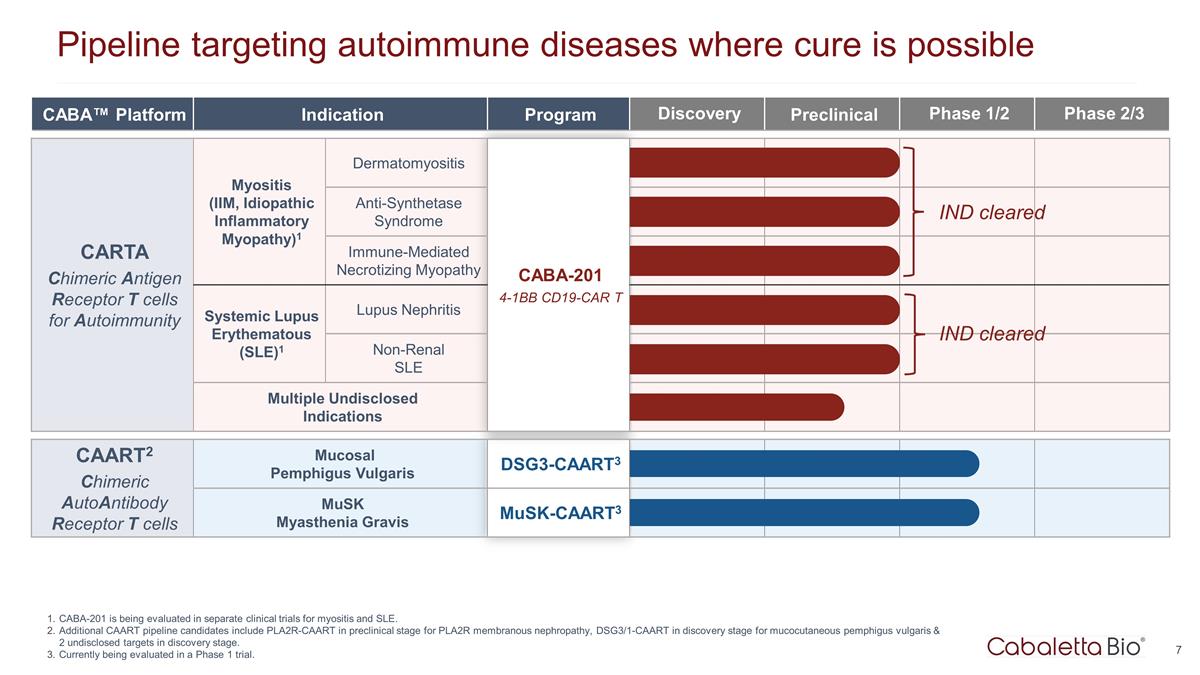
CABA™ 平台适应症 项目发现临床前 1/2 期 2/3 期 CARTA 嵌合抗原受体 T 细胞用于自身免疫性肌炎(IIM,特发性炎性肌病)1 皮肌炎 CABA-201 4-1BB CD19-CAR T 抗合成酶综合征免疫介导 坏死性肌病 CARTA 嵌合抗原受体 T 细胞用于自身免疫系统性红斑狼疮 Matous (SLE) 1 狼疮性肾炎 CABA-201 4-1BB CD19-CAR T 非肾脏系统性红斑狼疮多种未公开适应症 CAART2 嵌合自身抗体受体 T 细胞 寻常型粘膜天疱疮 DSG3-CAART3 musk重症肌无力 Musk-caart3 Pipeline 靶向可能治愈的自身免疫性疾病 CABA-201 正在单独的肌炎和系统性红斑狼疮临床试验中进行评估。其他 CAART 管线 候选药物包括 PLA2R 膜性肾病处于临床前阶段的 PLA2R-CAART、寻常型皮肤粘膜天疱疮处于发现阶段的 DSG3/1-CAART 以及 2 个处于发现阶段的未公开靶标。目前正在1期试验中进行评估。 IND 已通过 IND 已获批准

用于 自身免疫的嵌合抗原受体 T 细胞 CABA-201
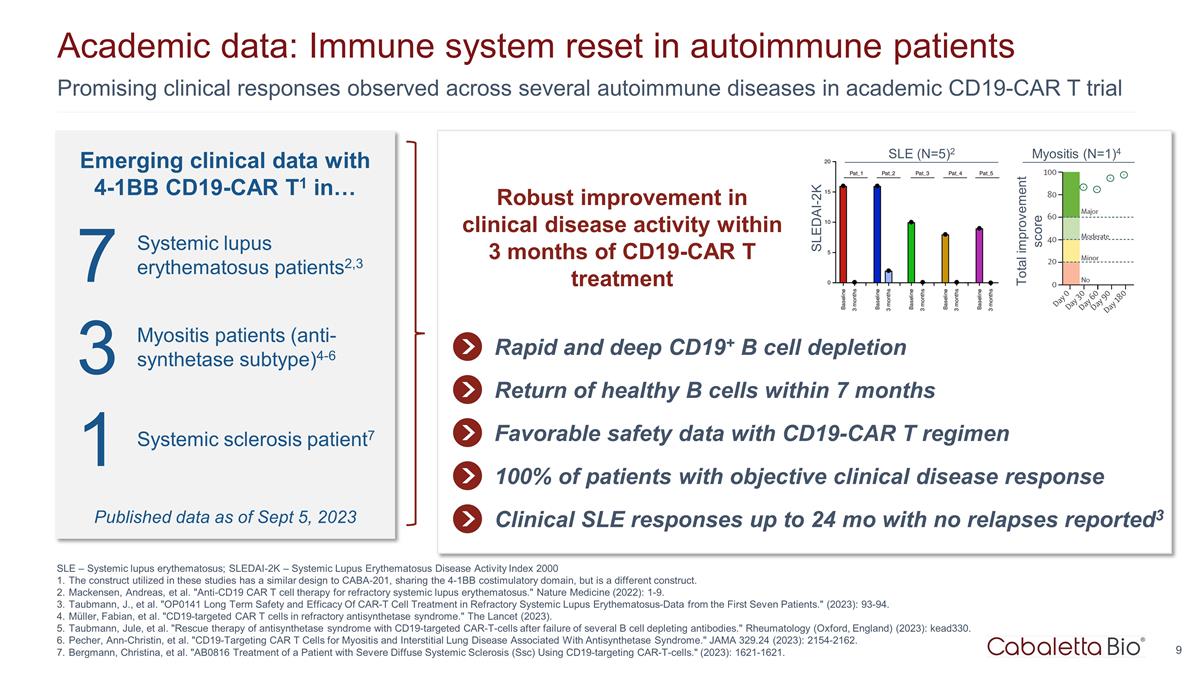
新出现的 4-1BB CD19-CAR T1 在... SLE — 系统性红斑狼疮;SLEDAI-2K — 系统性红斑狼疮疾病活动指数 2000 这些研究中使用的结构与 CABA-201 相似,共享 4-1BB 共刺激 结构域,但结构不同。麦肯森、安德烈亚斯等“抗CD19 CAR T细胞疗法治疗难治性系统性红斑狼疮。”《自然医学》(2022):1-9。Taubmann,J. 等“OP0141 CAR-T 细胞 治疗难治性系统性红斑狼疮的长期安全性和有效性——来自前七名患者的数据。”(2023):93-94。Müller、Fabian 等“难治性抗合成酶综合征中靶向CD19的CAR T细胞。”《柳叶刀》(2023)。Taubmann、Jule 等“在几种B细胞消耗抗体失效后,使用CD19靶向的Car-T细胞拯救 抗合成酶综合征的治疗。”风湿病学(英格兰牛津)(2023):kead330。Pecher、Ann-Christin 等“靶向 CD19 的 CAR T 细胞治疗与抗合成酶综合征相关的肌炎和 间质性肺病。”JAMA 329.24 (2023):2154-2162。伯格曼、克里斯蒂娜等“AB0816 使用靶向 CD19 的 car-T 细胞治疗严重弥漫性系统性硬化症 (Ssc) 患者。” (2023): 1621-1621。9 在学术性 CD19-CAR T 试验中观察到的几种自身免疫性疾病的临床反应令人鼓舞学术数据:自身免疫性患者的免疫系统重置 CD19-CAR T 治疗后 3 个月内临床疾病活动得到显著改善 CD19+ B 细胞快速而深度消耗健康 B 细胞的恢复 7 个月内 CD19-CAR T 方案的良好安全性数据临床系统性红斑狼疮反应长达 24 个月,无复发已报告3 7 系统性红斑狼疮患者2,3 3 肌炎患者(抗合成酶亚型)4-6 1 系统性硬化症患者7 系统性红斑狼疮(N=5)2 SLEDAI-2K 截至2023年9月5日公布的数据截至2023年9月5日 100% 有客观临床疾病反应的患者总改善评分肌炎(N=1)4
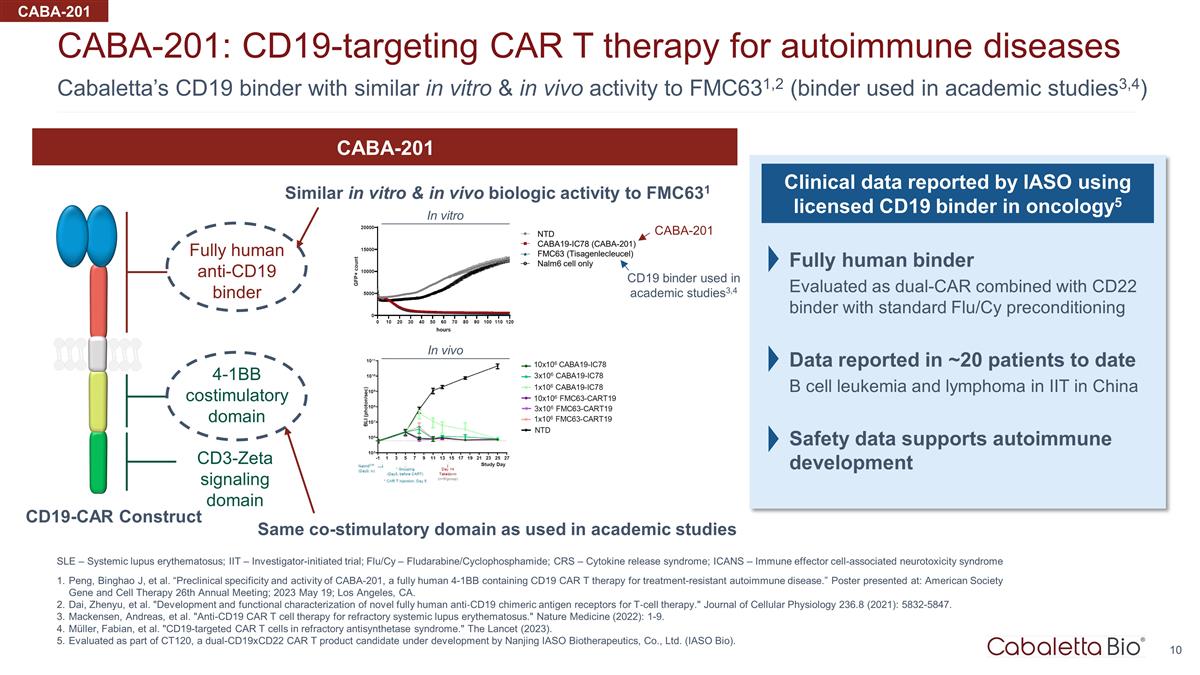
Cabaletta 的 CD19 粘合剂 在体外和体内活性与 FMC631,2 相似(学术研究中使用的粘合剂3,4)CABA-201:靶向 CD19 的 CAR T 疗法治疗自身免疫性疾病 SLE — 系统性红斑狼疮;IT — 研究者发起的试验;Flu/Cy — 氟达拉宾/环磷酰胺;CRS — 细胞因子释放综合征;ICS — 细胞因子释放综合征;ICS ANS — 免疫效应细胞相关神经毒性综合征 Peng、Binghao J 等“CABA-201 的临床前特异性和活性,这是一种全人类 4-1BB ,含有 CD19 CAR T 疗法,用于治疗耐药性自身免疫性疾病。”海报发表于:美国学会基因与细胞疗法第26届年会;2023年5月19日;加利福尼亚州洛杉矶。戴振宇等“用于T细胞疗法的新型全人类抗CD19嵌合抗原受体的开发和功能表征。”《细胞生理学杂志》236.8 (2021):5832-5847。麦肯森、安德烈亚斯等“用于难治性系统性 红斑狼疮的抗 CD19 CAR T 细胞疗法。”《自然医学》(2022):1-9。Müller、Fabian 等“难治性抗合成酶综合征中靶向CD19的CAR T细胞。”《柳叶刀》(2023)。作为 CT120 的一部分,南京 IASO Biotherapeutics, Ltd. (IASO Bio) 正在开发 的双 CD19xCD22 CAR T 候选产品。全人类抗 CD19 粘合剂 4-1BB 共刺激域 CD3-zeta 信号域 CABA-201 体外和体内生物活性与 FMC631 相似学术研究中使用的 相同的共刺激域 CD19-CAR 在肿瘤学中使用获得许可的 CD19 粘合剂构建 IASO 报告的临床数据 5 全人类粘合剂评估为双CAR 与 CD22 粘合剂结合使用标准 Flu/Cy 预处理数据 中国理工学院的日期 B 细胞白血病和淋巴瘤安全数据支持自身免疫发育 CABA-201 体外 CABA-201 CD19学术研究中使用的活页夹3,4

大约 66K 美国患有 IIM 亚型并有 B 细胞受累的患者;通常很严重,治疗选择有限 Myositis:有充分的科学依据和沉重的疾病负担 Lundberg、Ingrid E. 等“特发性炎症性肌病。”《自然评论》疾病 Primers 7.1 (2021):86。Kronzer、Vanessa L. 等“皮肌炎的发病率、患病率和死亡率:一项基于人群的队列研究。”关节炎护理与研究 75.2 (2023):348-355。Badshah、Aliena 等“表现为间质性肺病的抗合成酶 综合征:病例报告。”《医学案例报告杂志》13.1(2019):1-6。Coffey、Caitryn 等“以人群为基础的队列中抗合成酶综合征的发病率和恶性肿瘤风险 (1998-2019)” [抽象]。风湿性关节炎。2021;73(补编 9)。Shelly、Shahar 等。“明尼苏达州奥尔姆斯特德县成人中免疫介导的坏死性肌病的发病率和患病率。”肌肉与神经 65.5 (2022):541-546。 ~6K 美国 pts5 免疫介导的坏死性肌病 (IMNM) ~17K 美国 pts3,4 抗合成酶综合征 (ASYs) ~43K 美国 pts2 皮肤肌炎 (DM) 基于潜在免疫机制和临床特征的关键肌炎亚型1 潜在的 表现和亚型患病率 1 伴有 B 细胞的自身免疫性疾病参与 2 功能和生活质量负担沉重1 特发性炎性肌病(IIM 或肌炎)是一组以 炎症和肌肉无力为特征的自身免疫性疾病。通常,发病于中年,更常见于女性的症状可能包括虚弱、疲劳、疼痛、呼吸急促和吞咽困难治疗的主要方法是使用不含类固醇的 药物(即甲氨蝶呤、硫唑嘌呤、霉酚酸盐、利妥昔单抗)的糖皮质激素只有经美国食品药品管理局批准的治疗是皮肌炎亚型的 iViG(静脉注射免疫球蛋白)许多患者患有仍然难治的疾病疗法具有潜在的长期副作用 间质性肺病 (ILD)、心血管疾病和/或恶性肿瘤导致的高死亡率 CABA-201

12 CABA-201 将在 活动性肌炎患者中进行评估,包括 DM、ASYS 和 IMNM 针对肌炎患者 CABA-201 的 1/2 期研究设计 DM — 皮肌炎;ASYS — 抗合成酶综合征;IMNM — 免疫介导的坏死性肌病受试者 将使用由氟达拉滨和环磷酰胺组成的标准预处理方案进行治疗单剂量 CABA-201。麦肯森、安德烈亚斯等“抗CD19 CAR T细胞疗法治疗难治性系统性红斑狼疮。”Nature Medicine (2022):1-9。Müller、Fabian 等“难治性抗合成酶综合征中靶向CD19的CAR T细胞。”《柳叶刀》(2023)。CABA-201 开放标签试验的1/2期研究评估活动性特发性炎性炎症 肌病(IIM 或肌炎)受试者的 CABA-201 CABA-201 关键纳入标准年龄 ≥ 18 至 65 岁尽管以前或目前接受过标准护理治疗但仍有活动性疾病的证据关键排除标准癌症相关的 肌炎严重的肺部或心脏损伤在大约 6 个月内使用 B 细胞消耗剂治疗使用生物制剂治疗大约 3 个月内平行队列筛查 CABA-201 输液监测下一页患者研究终点和 目标主要目标:输液后 28 天内活动性肌炎受试者中 CABA-201 的安全性和耐受性关键次要目标包括 CABA-201 对以下疾病的影响:肌炎临床疾病活动;功能和射线照相 疾病证据;肌炎血清学;以及药代动力学/药效学 1x106 细胞/kg1 的剂量相当于最近使用的含有 4-1BB 的 CD19-CAR T 剂量学术研究 2,3 ASYs (N = 6) IMNM (N = 6) DM (N = 6) DM (N = 6) 多个临床团队执行记录一致 评估自身免疫性疾病患者新候选细胞疗法的研究
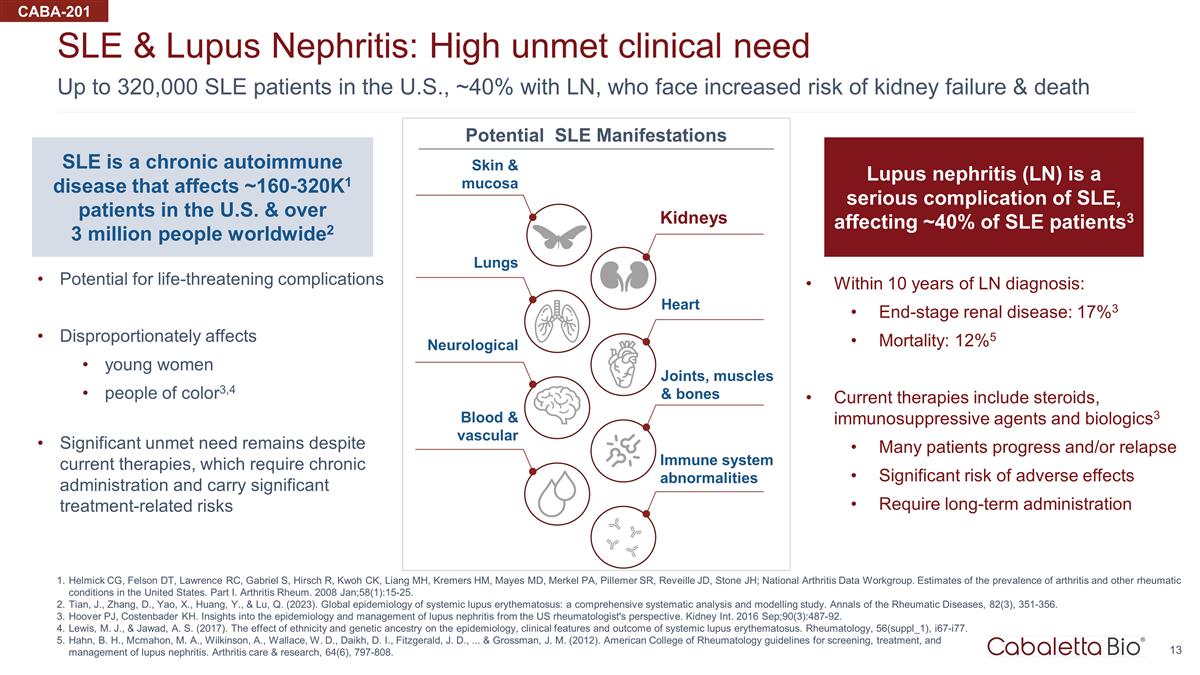
美国有多达 32 万名系统性红斑狼疮患者,约 40% 患有 LN,他们面临着更高的肾衰竭和死亡风险系统性红斑狼疮和狼疮肾炎:高度未得到满足的临床需求 Helmick CG、Felson DT、Lawrence RC、Gabriel S、Hirsch R、Kwoh CK、Liang MH、Kremers HM、Mayes MD、Merkel PA、Pillemer SR、 Reveille JD、Stone JH; 全国关节炎数据工作组。美国关节炎和其他风湿性疾病患病率的估计。第一部分关节炎类风湿病。2008 年 1 月;58 (1): 15-25。Tian、J.、Zhang、D.、Yao、X.、Huang、Y. 和 Lu, Q. (2023)。系统性红斑狼疮的全球流行病学:一项全面的系统分析和建模研究。《风湿病年鉴》,82(3),351-356。Hoover PJ,Costenbader KH从美国风湿病学家的角度对 狼疮肾炎的流行病学和管理的见解。Kidney Int. 2016 年 9 月;90 (3): 487-92。M.J. Lewis 和 A.S. Jawad(2017)。种族和遗传血统对系统性红斑狼疮 的流行病学、临床特征和预后的影响。风湿病学,56(suppl_1),i67-i77。Hahn,B.H.、M.A. Mcmahon、A.、Wilkinson、W. Wallace、W.D.、D.I. Daikh、J.D. Fitzgerald、... 以及 J.M. Grossman(2012)。美国风湿病学会狼疮肾炎筛查、治疗、 和管理指南。关节炎护理与研究,64 (6),797-808。CABA-201 脊髓灰质炎诊断后 10 年内:终末期肾脏疾病:17% 3 死亡率:12% 5 目前的疗法包括类固醇、免疫抑制剂和生物制剂3 许多患者进展和/或复发严重的不良反应风险需要长期服用 SLE 是一种慢性自身免疫性疾病,影响美国约 160-320K1 患者和全球超过 300 万人2 可能出现危及生命的并发症对年轻女性的影响尤其严重 of color3,4 尽管目前的疗法要求,但仍有大量需求未得到满足长期服药并带来显著的治疗相关风险狼疮肾炎 (LN) 是系统性红斑狼疮的严重并发症,影响了大约 40% 的系统性红斑狼疮患者3 皮肤和粘膜肾脏心脏关节、肌肉和骨骼免疫系统异常血液和血管神经系统肺部潜在的系统性红斑狼疮表现
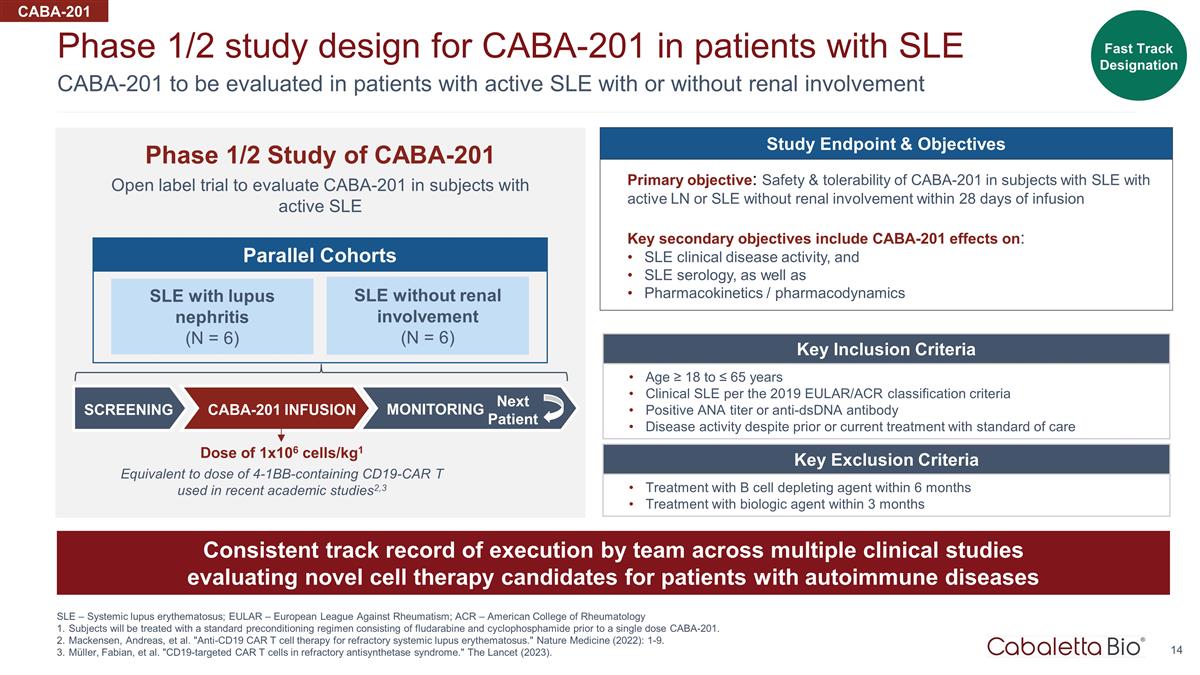
14 CABA-201 待评估 伴有或没有肾脏受累的活动性系统性红斑狼疮患者 CABA-201 的 1/2 期研究设计系统性红斑狼疮 — 系统性红斑狼疮;EULAR — 欧洲抗风湿病联盟;ACR — 美国 风湿病学学会受试者将在单剂量 CABA-201 之前接受由氟达拉滨和环磷酰胺组成的标准预处理方案。麦肯森、安德烈亚斯等“抗CD19 CAR T细胞疗法治疗难治性系统性红斑狼疮 。”《自然医学》(2022):1-9。Müller、Fabian 等“难治性抗合成酶综合征中靶向CD19的CAR T细胞。”《柳叶刀》(2023)。CABA-201 开放标签试验的1/2期研究旨在评估活性 SLE 的受试者的 CABA-201 CABA-201 关键纳入标准年龄 ≥ 18 至 ≤ 65 岁根据 2019 年 EULAR/ACR 分类标准临床系统性红斑狼疮阳性 ANA 滴度或抗 dsDNA 抗体尽管以前或目前接受过标准护理治疗,但仍存在疾病活性 关键排除标准 6 个月内使用 B 细胞消耗剂治疗 3 个月内使用生物制剂治疗各团队一致的执行记录评估新型细胞疗法的多项临床研究 自身免疫性疾病患者的候选人快速通道指定伴狼疮肾炎(N = 6)无肾脏受累的系统性红斑狼疮(N = 6)平行队列筛查 CABA-201 输液监测下一个患者研究终点和目标主要目标: 在输液后 28 天内具有活动性 LN 或无肾脏受累的系统性红斑狼疮受试者中 CABA-201 的安全性和耐受性关键次要目标包括 CABA-201 对以下系统性红斑狼疮临床疾病活动的影响,以及系统性红斑狼疮血清学以及 药代动力学/药效学 1x106 细胞/kg 的剂量1 相当于最近学术研究中使用的含有 4-1BB 的 CD19-CAR T 的剂量2,3

我们的候选产品和 具有独特经验的人为我们的开发道路提供了信息。加速开发治疗自身免疫性疾病 SLE 的 CABA-201 — 系统性红斑狼疮 Peng、Binghao J 等。“CABA-201 的临床前特异性和活性,这是一种完全 人类 4-1BB,含有 CD19 CAR T 疗法,用于治疗耐药性自身免疫性疾病。”海报发表于:美国基因与细胞疗法学会第26届年会;2023年5月19日;加利福尼亚州洛杉矶。戴振宇等“用于T细胞治疗的新型全人源抗CD19嵌合抗原受体的开发和 功能表征。”《细胞生理学杂志》236.8 (2021):5832-5847。麦肯森、安德烈亚斯等“用于难治性 系统性红斑狼疮的抗 CD19 CAR T 细胞疗法。”《自然医学》(2022):1-9。Müller、Fabian 等“难治性抗合成酶综合征中靶向CD19的CAR T细胞。”《柳叶刀》(2023)。CABA-201 CABA-201 的高效临床试验设计促进了快速 和广泛的开发计划加速开发独家转化合作伙伴关系提供了对时间表有影响的早期见解针对多种自身免疫性疾病的高效临床试验设计具有潜在的治疗起始剂量 剂量并行队列对自身免疫患者的复杂细胞治疗计划有深刻的理解和经验 CABA-201 全人类粘合剂降低了免疫原性的风险基于在大约 20 名肿瘤患者中使用的临床耐受性特征 4-1BB costim 结构域与学术 CD19-CAR T 研究中使用的结构域相同1,2 具有 4-1BB costim 结构域且结合活性与学术界 CD19-CAR T1-4 相似的候选产品 4 份自身免疫细胞疗法 IND 申请,每份申请均在常规 30 天窗口中获得批准的经验为 CABA-201 多种适应症的高效临床策略提供信息 CMO 领导团队成员在过去 65 年中仅有的两款获得 FDA 批准的系统性红斑狼疮产品的开发领导团队成员广泛的 建立细胞疗法供应的经验人物 Singular 专注于潜在的治愈细胞自 2018 年以来的自身免疫性疾病疗法

嵌合自身抗体受体 T 细胞 DSG3-CAART 和 musk-caart

目前的治疗需要广泛的 免疫抑制与安全风险和短暂疗效相关的寻常型天疱疮概述和当前治疗格局图片来源:D @nderm。http://www.vgrd.org/archive/cases/2004/pv/DSCN4996%20copy.JPG Joly、Pascal 等。 “一线利妥昔单抗联合短期泼尼松对比单独使用泼尼松治疗天疱疮(Ritux 3):一项前瞻性、多中心、平行组、开放标签的随机试验。”《柳叶刀》389.10083 (2017):2031-2040。 Werth、Victoria P. 等。“寻常型天疱疮患者的利妥昔单抗与吗替麦考酚酯。”新英格兰医学杂志(2021)。利妥昔单抗标签,2020 年 8 月修订版。库什纳、Carolyn J. 等。“与利妥昔单抗治疗天疱疮后完全缓解相关的因素。”JAMA 皮肤科(2019)。托尼、汉斯-彼得等。“利妥昔单抗治疗对不同自身免疫性疾病患者的安全性和临床结果:来自国家注册机构 (GRAID)的经验。”关节炎研究与治疗 13.3 (2011):1-14。CROT = 非全身治疗时无病变8周以上 mucosal PV1 (25%) 相关抗体 Anti-dsg3 + Anti-dsg1 临床症状粘膜疼痛水泡 (口、鼻、喉、食道、眼睛、生殖器、直肠)鼻孔和皮肤上有水泡美国疾病患病率 3,250 至 4,750 9,750 至 14,250 皮肤 PV2 (75%) DSG3-CAART 暂时缓解广泛免疫抑制3,6 利妥昔单抗加类固醇 (~3,500 mg/年) 4 有效性适中且耐受性差 8 周以上 6 16 周以上 4,5% 的患者未能达到任何 8 周或 16 周以上没有病变或药物未实现在 1 年内复发约 30%,2 年内复发 > 50% 6 Safety 风险 22% 年度严重不良事件 (SAE) 发生率4 4-9% 3,4,5 每年 PV 严重感染风险 ~ 1.9% 终身发生致命感染的风险7
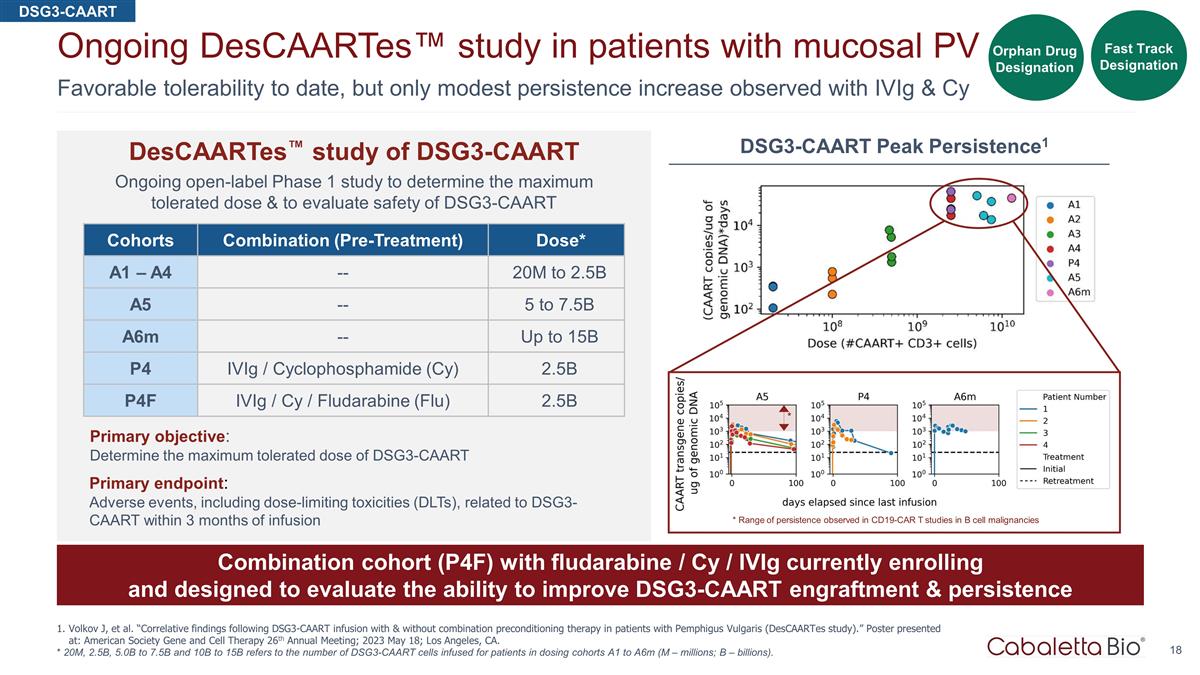
迄今为止,耐受性良好,但是 通过对粘膜 PV 患者 Volkov J 等人的 iViG & Cy 正在进行的 Descaartes™ 研究,观察到的持续性仅略有增加。“寻常型天疱疮患者输注 DSG3-CAART 和不使用联合预处理 治疗后的相关发现(DescaArtes 研究)。”海报发表于:美国基因与细胞疗法学会第26届年会;2023年5月18日;加利福尼亚州洛杉矶。* 2000万、25B、50B至75B和10B至15B是指在给药队列A1至A6m中为患者注入的 DSG3-CAART 细胞数量(M — 数百万;B — 十亿)。队列组合(预治疗)剂量* A1 — A4 — 20M 到 2.5B A5 — 5 到 7.5B a6m — 最高 15B P4 iViG /环磷酰胺 (Cy) 2.5B P4F iVIg/Cy /氟达拉滨(流感)2.5B 主要目标:确定 DSG3-CAART 的最大耐受剂量主要终点:不良事件,包括输液 3 个月内与 DSG3-CAART 相关的剂量限制毒性 (DLT) DSG3-CAART descaartes™ 研究 DSG3-CAART 正在进行的开放标签 1 期研究,以确定最大耐受剂量并评估 DSG3-CAART Fast Track 指定孤儿药的安全性名称 * 在 CD19-CAR T B 细胞恶性肿瘤研究中观察到的持续性范围 * DSG3-CAART Peak Persistence1 目前正在注册的氟达拉滨/Cy/iViG 的组合队列 (P4F),旨在评估改善 DSG3-CAART 植入和持久性的能力

正在根据来自 Descaartes™ 研究的新兴数据评估研究时间表 musk 重症肌无力 (MG) MuscaArtes™ Musk-caart 的研究正在进行开放标签研究,以确定最大耐受剂量并评估 musk-caart Part 群组受试者的安全性 A — 单一疗法剂量升级7 剂量从 5 亿增加使用 2 (+4) 设计 A1-A3 2 (+4) 每个队列 A — 自适应组合队列 7 组合队列 8,从 A2 剂量开始 A2 剂量 A4+ 2 (+4) 每个队列 B — Expansion 在最终选定剂量下扩大受试者注册人数 B ~12 musk-caart以IgG4为主的疾病利妥昔单抗1,2 利妥昔单抗未完全消灭后自身抗体滴度下降并在复发期间持续存在3 循环抗麝香抗体 滴度可能比PV4,5,6 中的抗 dsg3 抗体低约 90% 1 2 研究终点和目标主要终点:不良事件,包括 DLT 次要和三级目标:CAART 扩展/持久性,对血清抗麝香抗体的影响 滴度、同时使用全身性药物、对临床症状的影响、制造成功率令人信服的生物学理由,类似于PV 差异化市场机会美国 MG 总患病率 50,000 至 80,000 名患者 musk+ MG 占总数 MG 的 6-7.5% 与 achr+ MG 相比,musk+ 病通常更为严重,治疗选择有限 musk+ 疾病发病早,7:1 女性 MG — 重症肌无力 * 500M 是指给药队列 A1 (M —) 中为患者注入的 musk-caart 细胞数量百万)。Hain、Berit 等“用利妥昔单抗成功治疗Musk抗体阳性MG。”肌肉与神经。33.4 (2006):575-580。Illa、Isabel 等。“抗 ACHR 和抗马斯克阳性的重症肌无力患者对 利妥昔单抗的持续反应。”《神经免疫学杂志》201 (2008):90-94。Jiang、Ruoyi 等“单细胞库追踪可识别重症肌无力复发期间耐利妥昔单抗的B细胞。” JCI Insight 5.14 (2020)。Matthews、Ian 等。“肌肉特异性受体酪氨酸激酶自身抗体——一种新的免疫沉淀测定法。”Clinica chimica acta 348.1-2 (2004):95-99。McConville、John 等“血清阴性重症肌无力中 musK 抗体的检测和表征。”《神经病学年鉴》55.4(2004):580-584。Marino、Mariapaola 等“长期利妥昔单抗诱导的重症肌无力 重症肌无力 的特异性(但不是总量)IgG4降低。”《免疫学前沿》11 (2020):613。在研究的A部分中,共有6名受试者需要接受最终选择的剂量。在队列 A2 耐受性良好、 倾向于 A4 入学 A4 之后,A3 和 A4 队列将同时入学。快速通道认定孤儿药认定

公司摘要
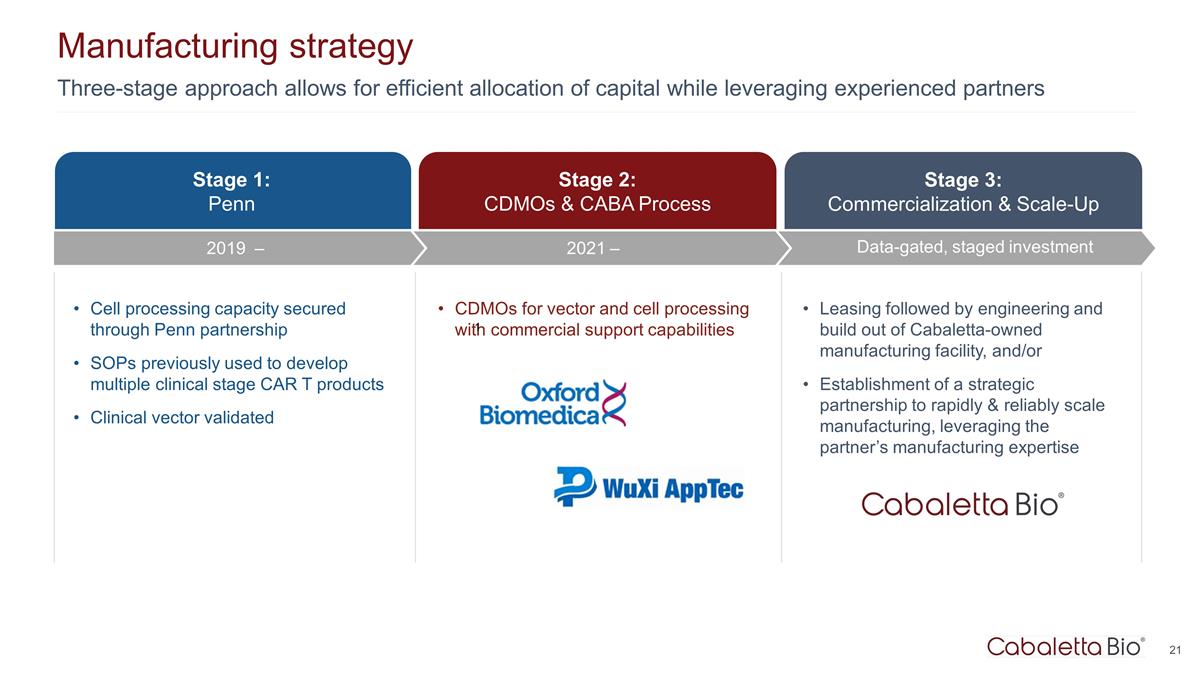
三阶段方法允许 高效分配资本,同时利用经验丰富的合作伙伴制造战略第 3 阶段:商业化和扩大规模数据门控、分阶段投资第 1 阶段:宾夕法尼亚大学第 2 阶段:通过宾夕法尼亚大学的合作伙伴关系 SOP 确保细胞处理能力 以前用于开发多个临床阶段 CAR T 产品经过临床载体验证的用于载体和细胞处理的 CDMO 具有商业支持能力租赁然后是 cabaTaleTaLeta 的工程和构建 TA 拥有的制造工厂,和/或建立战略合作伙伴关系,利用合作伙伴的制造专业知识,快速可靠地扩大制造规模 2021 — 2019 — 1

董事会 Cabaletta Bio 领导团队 Anup Marda 首席财务官阿伦·达斯,医学博士,首席商务官 David J. Chang,医学博士,M.P.,FACR 首席医学官玛莎·奥康纳首席人力资源官迈克尔·杰拉德总法律顾问史蒂芬·尼希特伯格, 医学博士总裁、首席合规官兼董事长 Heather Harte-Hall 首席合规官萨米克·巴苏,医学博士警官 Gwendolyn Binder,科学与技术科学顾问委员会主席 Gwendolyn Binder 博士在评估新型细胞疗法候选药物方面的运营成功记录 临床前、临床、制造和监管领域的自身免疫艾米·佩恩,医学博士,博士联合创始人兼联席主席 Michael C. Milone,医学博士,联合创始人兼联席主席 Carl June,医学博士 Jay Siegel,医学博士 Steven Nichtberger,医学博士 Richard Henriques,M.B.A. Scott Brun,医学博士 Mark Simon,M.B.. Catherine Bollard,医学博士 Drew Weissman,医学博士,伊恩·麦金尼斯博士,FRCP,FRSE,FMedSci Georg Schett,医学博士 Shawn Tomasello, M.B.A.

利用多年来在自身免疫领域的 细胞疗法经验,启动 CABA-201 临床试验 Cabaletta®:寻求各种自身免疫性疾病的治疗方法 CARTA — 用于自身免疫的嵌合抗原受体 T 细胞;CAART — 嵌合自身抗体 受体 T 细胞;IND — 在研新药;SLE — 系统性红斑狼疮;DM — 皮肤肌炎;ASYs — 抗体合成酶综合征;IMNM — 免疫介导的坏死性肌病;流感 — 氟达拉滨;Cy — 环磷酰胺 Mackensen、Andreas 等“抗CD19 CAR T细胞疗法治疗难治性系统性红斑狼疮。”《自然医学》(2022):1-9。Müller、Fabian 等“难治性抗合成酶 综合征中靶向CD19的CAR T细胞。”《柳叶刀》(2023)。戴振宇等“用于T细胞治疗的新型全人源抗CD19 CAR的开发和功能表征。”《细胞生理学杂志》236.8 (2021):5832-5847。假设队列中未观察到剂量限制 毒性,并且试验中出现不间断的入组。截至2023年第二季度10季度报告。通过有效的设计推进肌炎和系统性红斑狼疮试验,包括起始剂量和平行队列 1.0 x 106 个细胞/kg CABA-201 的初始剂量与学术性肌炎和系统性红斑狼疮研究中使用的剂量相同 1,2 各有 6 名患者的平行队列 — 1) DM、2) ASYs 和 3) IMNM 的系统性红斑狼疮研究;1) LN 和 2) 非肾脏系统性红斑狼疮 CABA-201 的肌炎研究 专为自身免疫性疾病患者设计的全人类 CD19 粘合剂,包含大约 20 名肿瘤患者的数据 — 支持进一步评估自身免疫的临床安全性 Same 4-1BB共刺激域和类似的 CD19 粘合剂 affinity3 用于学术性肌炎和系统性红斑狼疮研究1,2 有可能治愈各种自身免疫性疾病,其中 B 细胞起着引发或维持疾病的作用。学术机构提供的其他临床数据强化了 CD19-CAR T 在自身免疫中的潜力,早期的行业研究正在进行中。有机会解决风湿病学以及其他治疗领域(包括神经病学、肾病)未得到满足的需求病学和皮肤病学 Descaartes™ 在寻常型粘膜天疱疮中试验 DSG3-CAART —iViG/Flu/Cy 队列报名参加 MusCaartes™ 重症肌无力试验 — 利用 DSG3-CAART CARTA 策略经验的见解 | CABA-201(4-1BB CD19-CAR T)将在肌炎和系统性红斑狼疮 1/2 期研究中同时进行评估 CAART 策略 | DSG3-CAART 和 musk-Caart 临床研究评估联合疗法初始 CABA-201 3 个月临床疗效和耐受性数据 1H244 | 1766美元 M cash5 将进入二零二五年第四季度

2023 年 9 月公司简报