| PBGM01 在 Infantile GM1 神经节苷脂中毒的研究 1-4 队列的中期临床结果和 Imagine-1 临床研究的项目更新 2023 年 8 月 7 日 |
| 2 前瞻性陈述 本演示文稿包括1995年 《私人证券诉讼改革法》所指并根据其安全港条款作出的 “前瞻性陈述”,包括但不限于:我们对预期 里程碑的时间和执行的期望,包括Imagine-1临床研究的进展和研究临床数据的可用性;我们对 合作者和合作伙伴执行能力的期望关键举措;我们对制造计划的期望还有策略;我们 对现金跑道的期望;以及我们的主要候选产品治疗各自靶向单基因中枢神经系统疾病的能力。 这些前瞻性陈述可能附有 “目标”、“预期”、“相信”、“可能”、“估计”、“预期”、 “预测”、“目标”、“打算”、“可能”、“可能”、“计划”、“潜在”、“可能”、“可能”、“将” 等词语以及其他含义相似的词语和术语。 这些陈述涉及风险和不确定性,可能导致实际结果与这类 陈述中反映的结果存在重大差异,包括:我们开发候选产品并获得监管部门批准的能力; 临床前研究和临床试验的时间和结果;与临床试验相关的风险,包括我们充分管理临床活动的能力, 监管机构可能要求的在临床试验期间获得的其他数据或分析可能引起的意想不到的问题 额外信息或进一步研究,或者可能未能批准或可能推迟批准我们的候选药物; 不良安全事件的发生;临床前研究或临床试验的积极结果可能无法在随后的试验中复制或成功进行 早期临床试验的成功可能无法预测后期临床试验的结果;未能保护和执行我们的知识产权 和其他专有权利;我们对合作者和其他人的依赖用于开发和制造 产品的第三方候选人以及我们业务中其他不受我们完全控制的方面;与冠状病毒疫情造成的当前和潜在的 延误、停工或供应链中断相关的风险;以及公司不时向美国证券交易委员会 (SEC) 提交的文件中 以及向美国证券交易委员会提交的其他报告中 部分描述的其他风险和不确定性。Passage Bio没有义务公开更新可能不时发表的任何前瞻性陈述,无论是书面陈述还是口头陈述,无论是由于新信息、未来发展还是其他原因。 |
| 3 内容提要 Mark Forman,医学博士,博士 |
| 4 欢迎和议程 欢迎 Will Chou,医学博士 内容提要 Mark Forman,医学博士,博士 Imagine-1 中期临床结果和项目更新 Samiah Al-Zaidy,医学博士 闭幕词 Will Chou,医学博士 Passage Bio 首席执行官 Mark Forman,医学博士,博士 Passage Bio Samiah Al-Zaidy,医学博士 临床开发副总裁 Passage Bio Passage Bio |
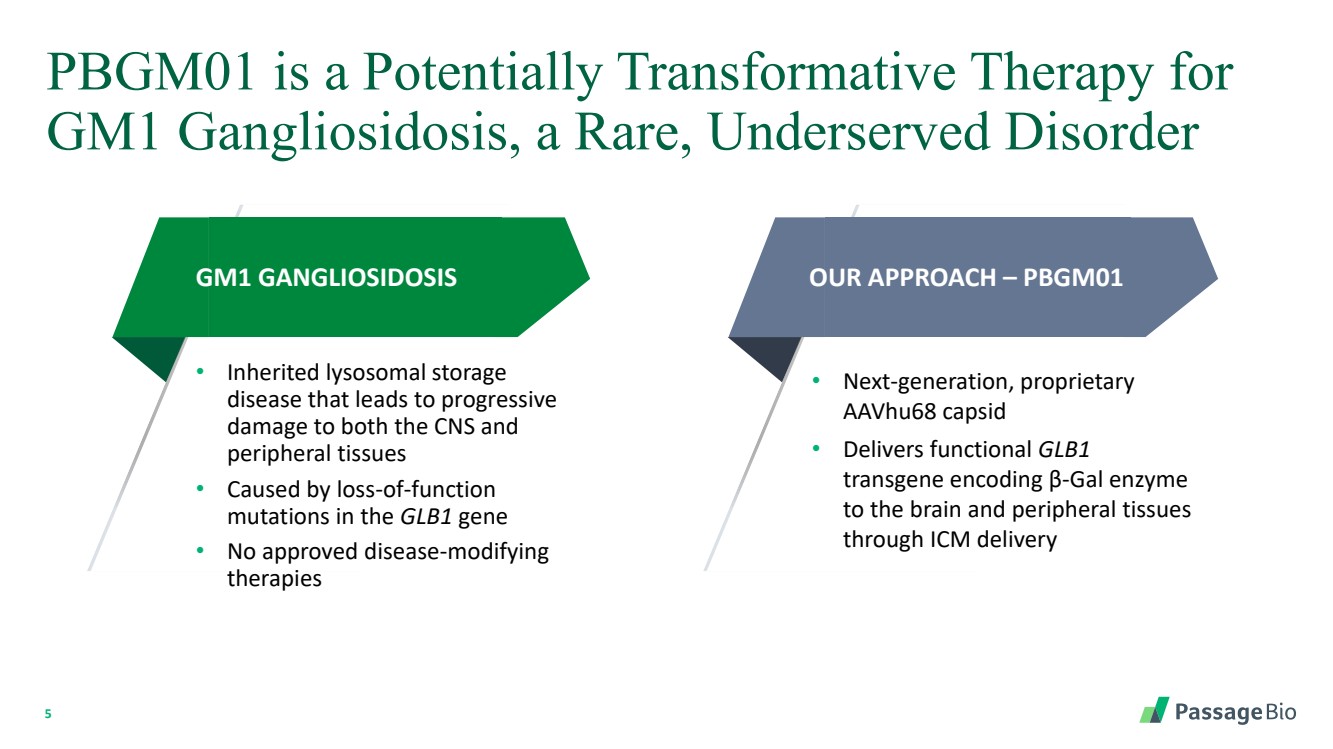
| 5 PBGM01 是 GM1 神经节苷脂中毒的潜在变革性疗法,这是一种罕见、服务不足的疾病 GM1 神经节苷脂沉积症 • 遗传性溶酶体储存 疾病会导致中枢神经系统和 外周组织进行性 损伤 • 由 GLB1 基因的功能丧失 突变引起 br} • 尚无获批准的疾病改善 疗法 我们的方法 — PBGM01 • 下一代专有 aavHu68 capsid • 通过 ICM 输送向大脑和外周组织 提供编码 β-gal 酶的功能性 GLB1 转基因 |
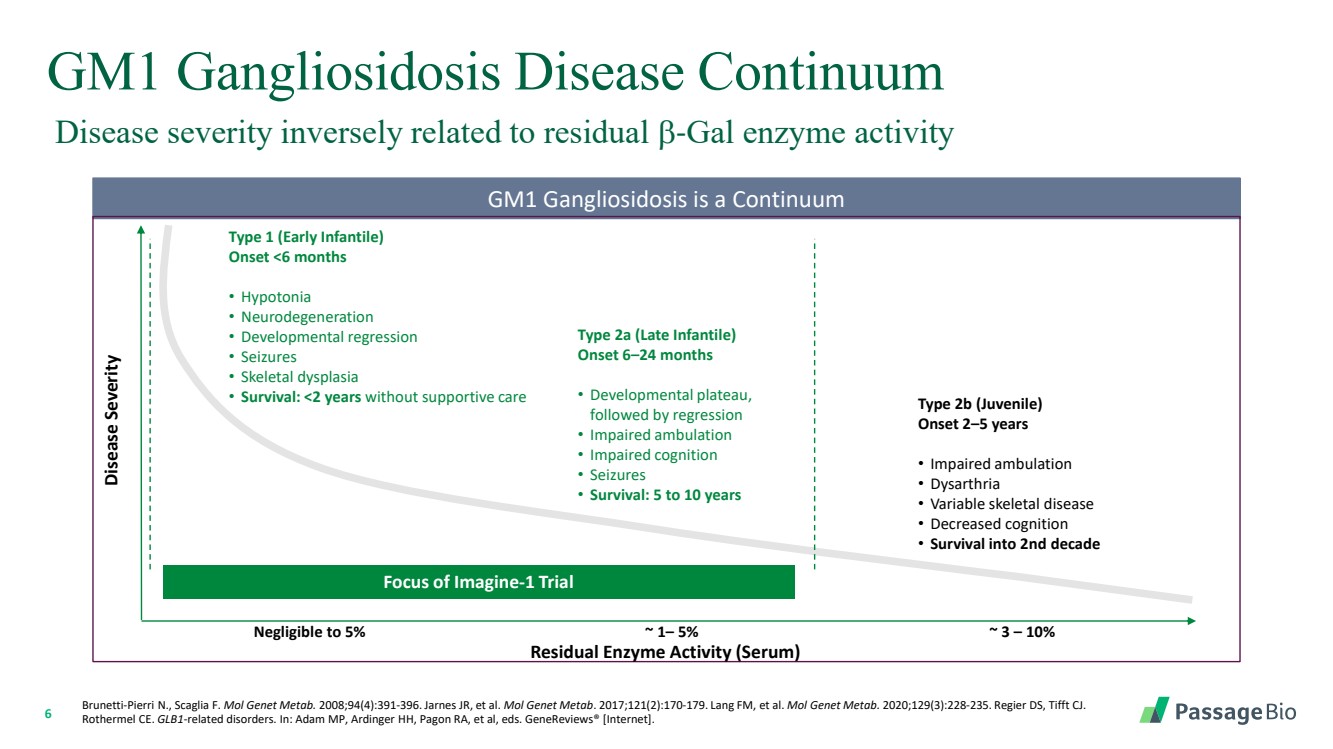
| 6 GM1 神经节苷脂沉积症疾病连续体 GM1 神经节苷脂中毒是一种连续性 疾病严重程度 残留酶活性(血清) Imagine-1 试验的焦点 可以忽略到 5% ~ 1— 5% ~ 3 — 10% 1 型(婴儿早期) 发作 |
| Imagine-1 研究的 7 个关键目标 建立 PBGM01 的安全概况 确定治疗效果的最佳 剂量 了解 PBGM01 在婴儿 GM1 患者 人群中的益处 |
| 来自前 8 名接受治疗的患者的 8 份有希望的中期数据 良好的安全性和耐受性良好 研究参与者的存活率提高的初步证据 脑脊液 β-gal 活性因剂量依赖性增加,持续增加 脑脊液中 β-gal 底物(GM1 神经节苷脂)的剂量依赖性降低, 剂量 2 能够达到健康的控制水平 |
| 9 Imagine-1 中期临床结果 Samiah Al-Zaidy,医学博士 |
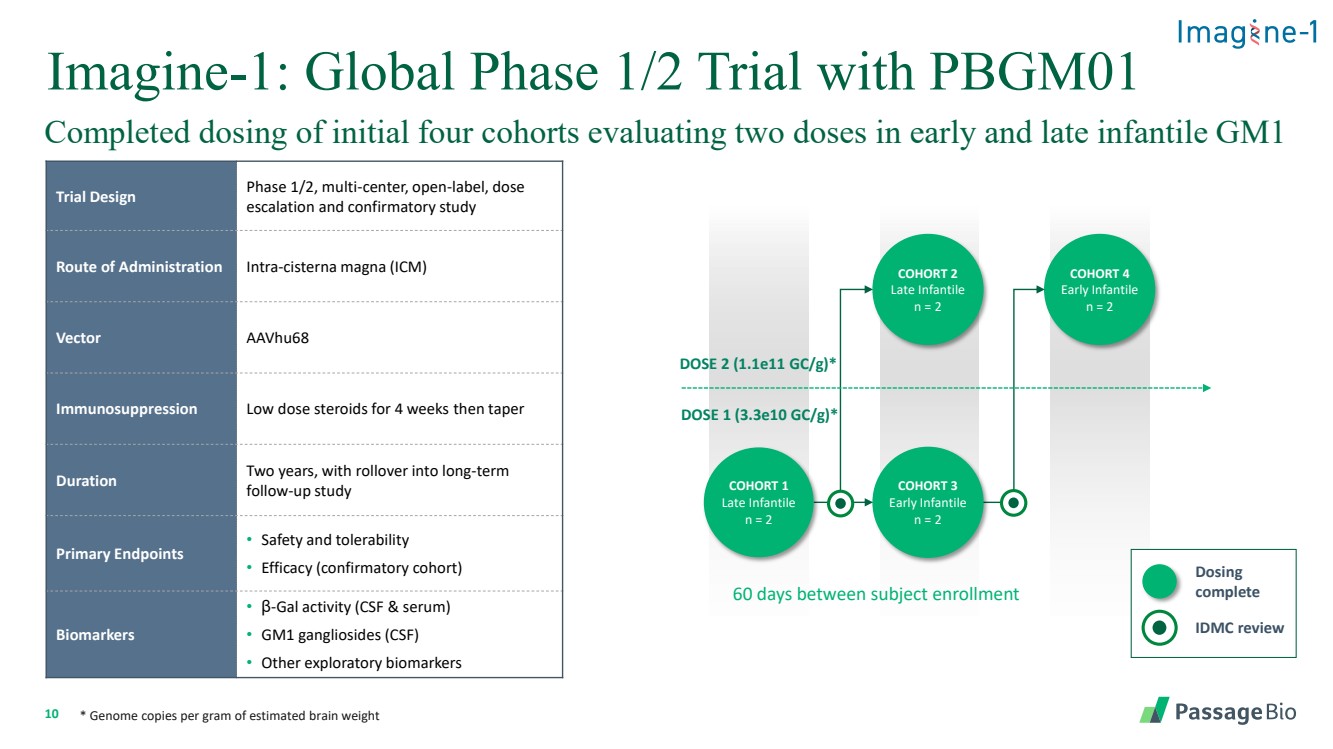
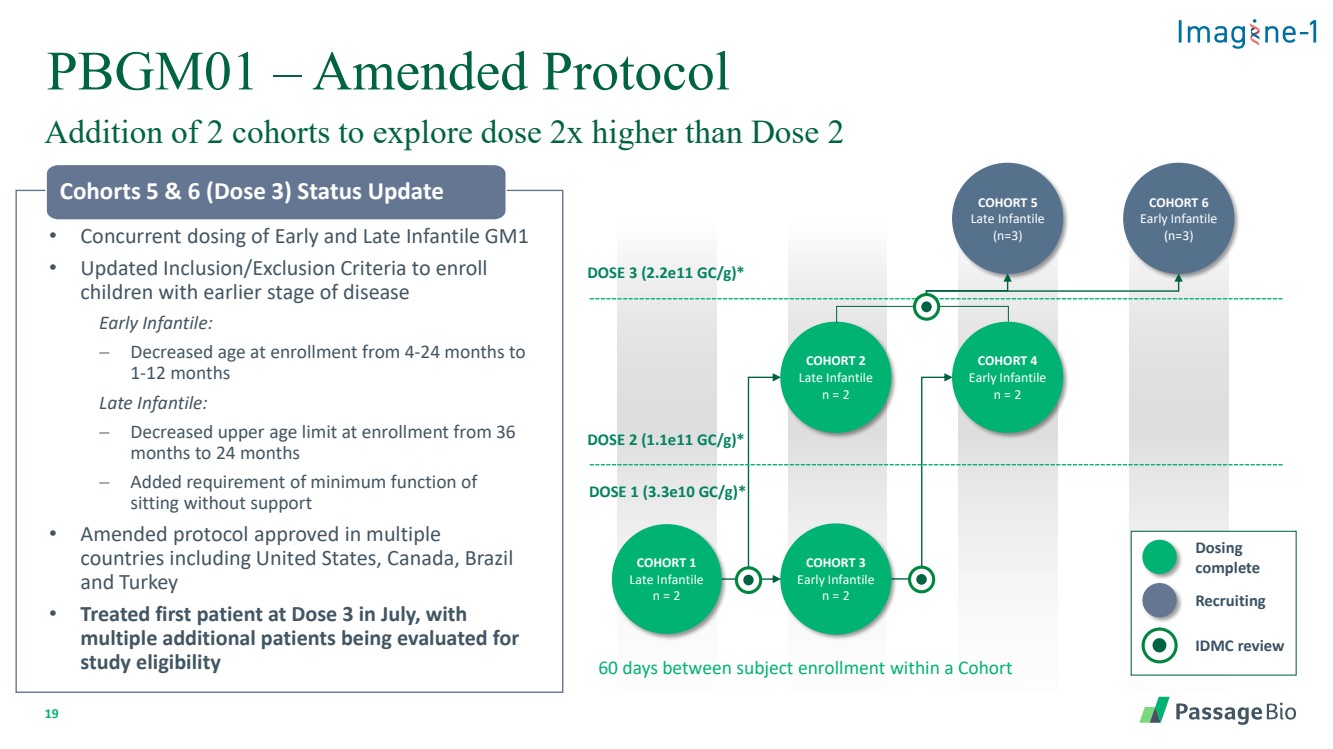
| 10 Imagine-1:PBGM01 队列 4 早期婴儿 n = 2 剂量 2 (1.1e11 gc/g) * DOSE 1 (3.3e10 gc/g) * 群组 2 晚期 Infantile n = 2 队列 3 早期婴儿 n = 2 队列 1 个晚期 infantile n = 2 个队列 1 个晚期 infantile n = 2 个队列在受试者入组之间 IDMC review 给药 完成 * 每克估计脑重的基因组拷贝 完成了最初四个队列的剂量,评估了婴儿早期和晚期的两个剂量 GM1 试验设计阶段 1/2,多中心,开放标签,剂量 递增和确认性研究 途径给药 intra-cisterna magna (ICM) Vector aavhu68 免疫抑制低剂量类固醇持续 4 周然后逐渐减少 持续时间两年,延续到长期 后续研究 • 主要终点 • 安全性和耐受性 • 疗效(确认性队列) • 生物标志物 • β-gal 活性(脑脊液和血清) • GM1 神经节苷脂 (CSF) • 其他探索性生物标志物 |
| 11 Imagine-1 基线患者特征 患者 1 患者 2 患者 3 患者 4 患者 5 患者 6 患者 7 患者 8 诊断发病迟发早起发迟发早起早发作 接受的剂量水平剂量 1 剂量 1 剂量 1 剂量 2 剂量 2 剂量 2 队列 1 1 3 3 2 2 4 性别男性女性男性男性女性男性 症状发作 (月) 14 12 5 13 出生 12 4 出生 年龄 基线 (月) (月) 14 31 15 18 6 17 7 6 DBS β-gal 活性 (nmol/ml/hr) (1) 0.0 0.2 0.0 0.0 0.1 0.0 0.4 0 Genotype c.601c>t, c.601c>t c.601c>t, c.1733aa>g c.694dupc, c.694dupc c.1370g>a, c.168c>g c.1577dup, c.1577dup, c.1577dup c.1733a>g, c.802g>c c.765g>c, c.841c>t c.176g>a, c.176g>a DBS,干血斑。 1正常值下限: |
| 12 Imagine-1 研究:群组 1-4 安全性与耐受性 没有与治疗相关的严重不良事件 (SAE) 所有与治疗相关的不良事件 (AE) 的严重程度均为轻度至中度 肝功能没有临床上显著的变化需要干预 没有通过神经传导研究衡量的 DRG 毒性的证据 没有与 ICM 给药相关的并发症 免疫学特征良好没有临床上显著的免疫反应1 PBGM01 耐受性良好,在中期分析中具有良好的安全性* *患者截至2023年6月26日的数据截止日期,随访时间为给药后的8至28个月 1 没有患者需要调整免疫抑制方案。 |
| 13 项研究 参与者存活率与自然历史相比提高的初步证据 * 来自 Lang FM 等人Mol Genet Metab。2020;129 (3): 228-235。Lang 等人的荟萃分析将 GM1 I 型定义为 获得 PBGM01 关键点的 20 个月大(n=3)发病 |
| 14 剂量 1 对关键脑脊液 生物标志物的影响不大 0 500 1,000 1,500 2,500 2,500 3,500 3,500 0 0 0 30 60 90 120 180 240 270 300 330 360 420 420 450 神经节苷脂,表现 nM 时间(天) 剂量 1 GM1 神经节苷脂、脑脊液 P1 晚婴儿 P2 晚婴儿 P3 P5 Early Infantile Late Infantile:Circle 早期婴儿:Square 健康成人平均值 CSF= 脑脊液 0 1 2 3 4 5 6 0 30 60 90 120 240 300 330 360 390 420 450 β-gal,nmol/ml/3HR 时间(天) 剂量 1 半乳糖苷酶,脑脊液 P1Late Infantile P2 晚期婴儿 P3 早期婴儿 P5 早期婴儿 健康成人平均值 GM1 NHS 平均值 b-gal • 剂量 1 PBGM01 导致第 30 天脑脊液 b-gal 活性相对于 基线略有增加(1.5 至 4.8倍)• 没有患者保持正常的成人 b-gal 活性水平 神经节苷脂 • 剂量 1 PBGM01 未导致 GM1 神经节苷脂降低 • 患者 3(br} 活性适度增加): GM1 神经节苷脂水平升高与 临床恶化有关 关键点 — 剂量 1 |
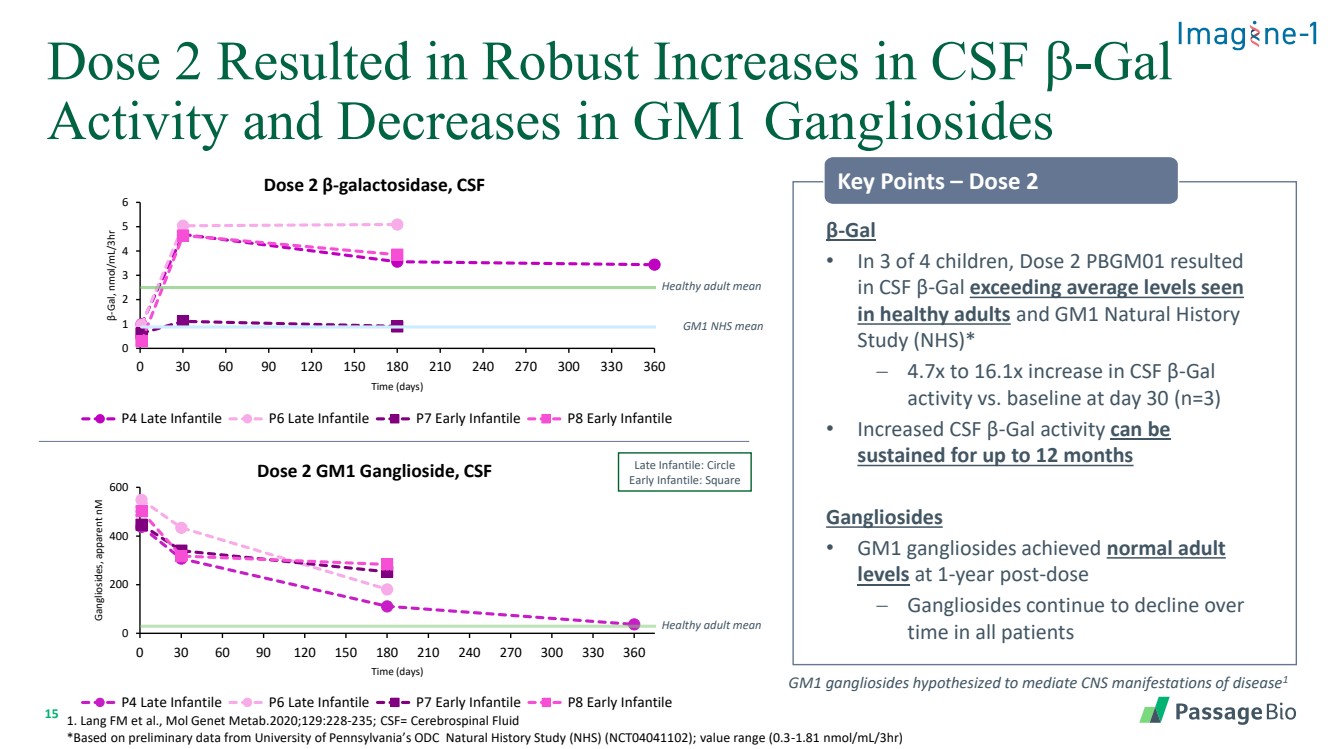
| 15 剂量 2 导致脑脊液 b-gal 活性大幅增加,GM1 神经节苷脂活性降低 0 200 600 0 30 60 90 90 120 180 210 240 270 300 330 360 神经节苷脂,表现 nM 时间(天) 剂量 2 GM1 神经节苷脂、CSF P4 晚期婴儿 P6 晚期婴儿 P7 婴儿早期 P7 Le P8 Early Infantile • 在 4 名儿童中,剂量 2 PBGM01 导致 脑脊液 β-gal 超过了健康成人 和 GM1 自然史 研究 (NHS) * − 第 30 天脑脊液 β-gal 活性与基线相比增加 4.7 倍至 16.1 倍 (n=3) •脑脊液 β-gal 活性的增加可以持续长达 12 个月 神经节苷脂 • GM1 神经节苷脂在给药 1 年后达到正常的成人 水平 − 所有患者的神经节苷脂在 时间内持续下降健康成人平均值 1。Lang FM 等人,Mol Genet Metab.2020;129:228-235;CSF= 脑脊液 *基于宾夕法尼亚大学 ODC 自然历史研究 (NHS) (NCT04041102) 的初步数据;值范围 (0.3-1.81 nmol/ml/3HR) GM1 神经节苷脂假设可以介导疾病的中枢神经系统表现 1 0 1 2 3 4 5 6 0 30 60 60 90 120 180 210 240 270 300 330 360 β-gal,nmol/ml/3HR 时间(天) 剂量 2 β-半乳糖苷酶,脑脊液 P4 晚期婴儿 P6 晚婴儿 P7 早期婴儿 P8 早期婴儿 健康成人 mean GM1 key Key 积分 — 剂量 2 延迟Infantile:圆圈 Early Infantile:Square |
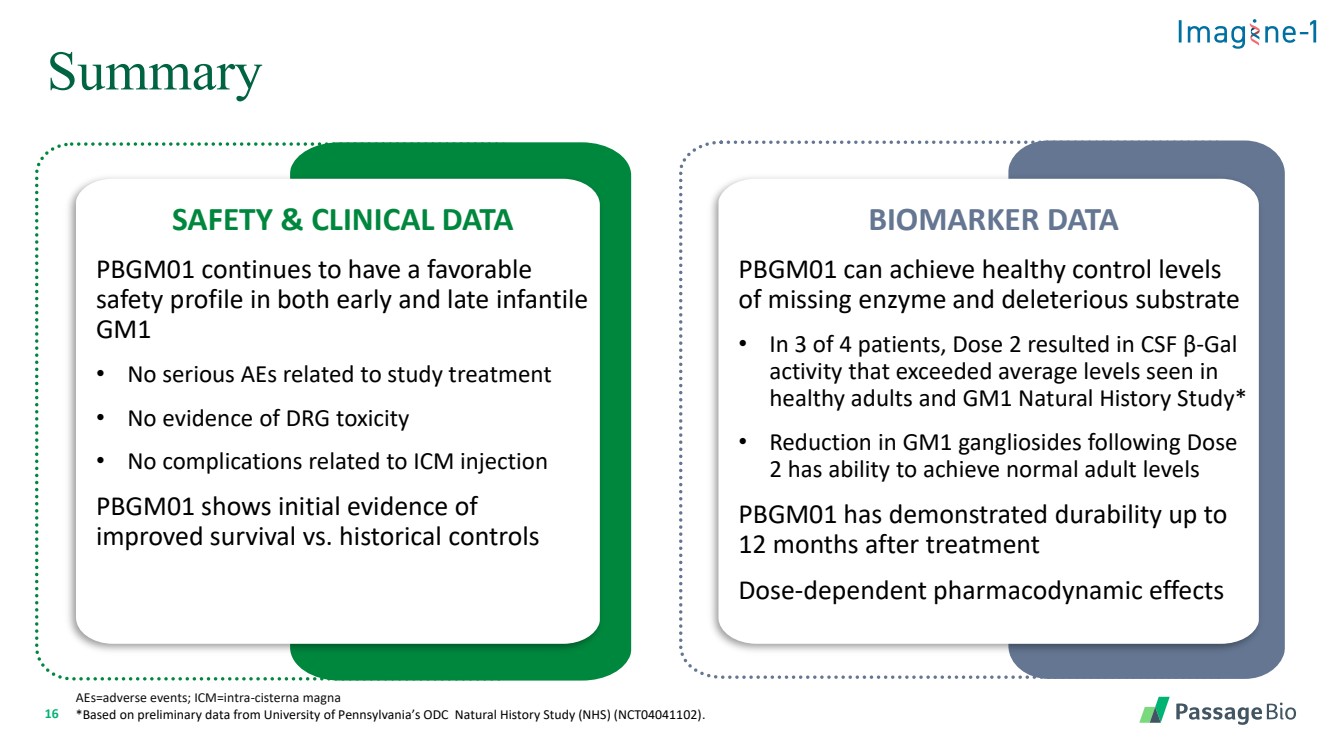
| 16 摘要 aes=不良事件;icm=intra-cisterna magna *基于宾夕法尼亚大学ODC自然历史研究(NHS)(NCT04041102)的初步数据。 安全和临床数据 PBGM01 在婴儿早期和晚期仍然具有良好的 安全性 GM1 • 没有与研究治疗相关的严重不良事件 • 没有药物毒性的证据 • 没有与ICM注射相关的并发症 PBGM01 显示 与历史对照组相比,存活率有所提高的初步证据 BIOMARKER DATA PBGM01 可以实现健康控制酶缺失水平 和有害底物 • 在 4 名患者中,有 3 名患者中,剂量 2 导致脑脊液 β-gal 活性超过 健康成年人和 GM1 的平均水平自然史研究* • 剂量后 GM1 神经节苷脂的减少 2 能够达到正常的成人水平 PBGM01 在治疗 12 个月后已显示出耐久性 剂量依赖性药效学效学作用 |
| 17 节目更新 Samiah Al-Zaidy,医学博士 |
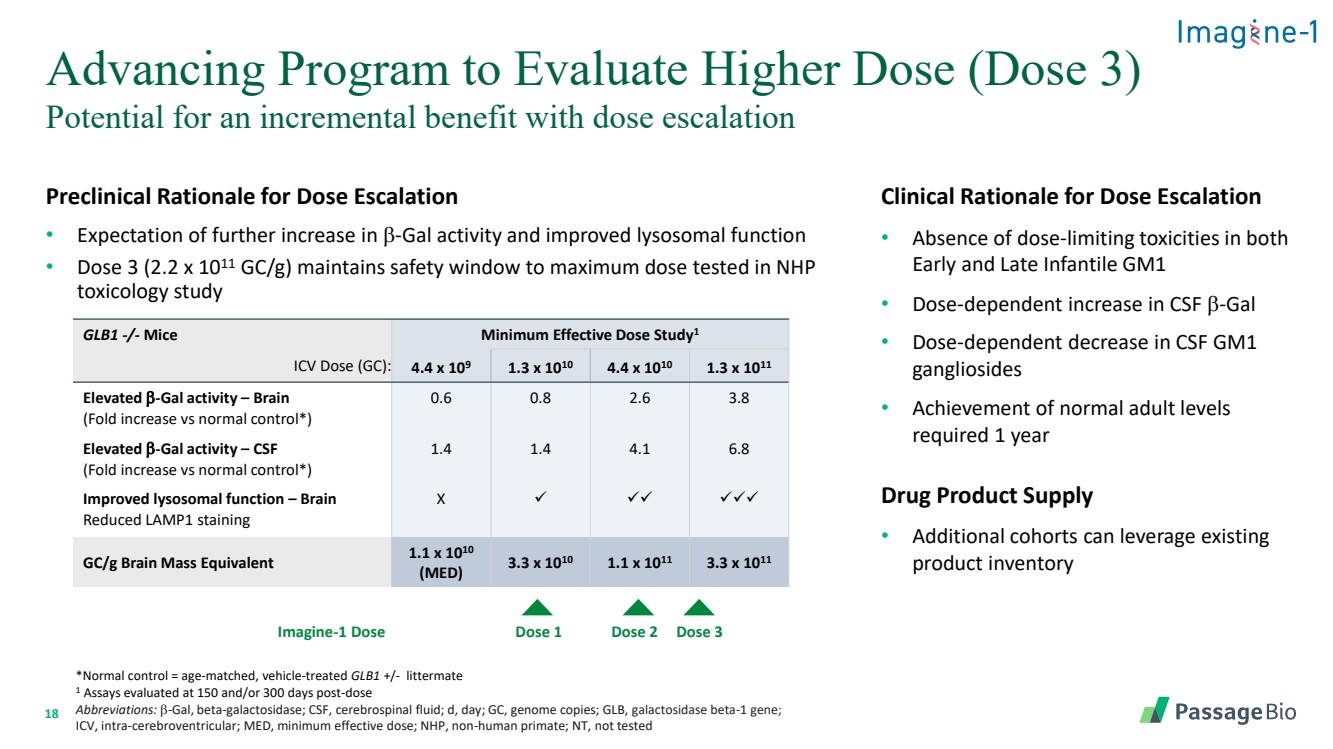
| 18 剂量递增的临床前理由 • 预期 b-gal 活性进一步增加和溶酶体功能得到改善 • 剂量 3(2.2 x 1011 gc/g)将安全窗口保持在 NHP 毒理学研究中测试的最大剂量 评估更高剂量(剂量 3)的推进计划 GLB1-/-小鼠最小有效剂量 stub dy1 ICV 剂量 (GC):4.4 x 109 1.3 x 1010 4.4 x 1010 x 1010 1.3 x 1011 b-gal 活性升高 — 大脑 (与正常对照相比折叠增加*) 0.6 0.8 2.6 3.8 b-gal 活性升高 —脑脊液 (与正常对照相比折叠增加*) 1.4 1.4 4.1 6.8 改善溶酶体功能 — 大脑 减少 LAMP1 染色 X ✓ ✓✓ ✓✓✓ gc/g 脑质量当量 1.1 x 1010(MED)3.3 x 1010 1.1 x 1011 3.3 x 1011 剂量 1 剂量 2 剂量 3 *正常对照 = 年龄匹配、车辆治疗的 GLB1 +/-litterleter mate 1 在给药后 150 天和/或 300 天评估的测定 缩写:b-gal,β-半乳糖苷酶;脑脊液;d,天;GC,基因组拷贝;GLB,半乳糖苷酶 β-1 基因; ICV,脑室内;MED,最低有效剂量;NHP,非人类灵长类动物;NT,未经过测试 剂量递增的临床依据 • 婴儿早期和晚期 GM1 均无剂量限制毒性 • 脑脊液 b-gal 的剂量依赖性增加 • 脑脊液 GM1 神经节苷脂的剂量依赖性降低 • 需要一年 药品供应 • 额外补充 horts 可以利用现有的 产品库存 Imagine-1 Dose |
| 19 PBGM01 — 修订后的协议 增加 2 个队列以探索剂量比 2 剂量高 2 倍 • 同时服用早期和晚期婴儿 GM1 • 更新了纳入/排除标准,以招收患有早期疾病的 儿童 早期婴儿: − 入学年龄从 4-24 个月降至 1-12 个月 晚期 降低 − 入学年龄上限从 36 个月到 24 个月 − 增加了在没有支撑的情况下坐着的最低功能要求 • 修订后的协议已在包括美国在内的多个 国家获得批准,加拿大、巴西 和土耳其 • 7 月份在第 3 剂量治疗了第一位患者, 另外还有多名患者正在接受评估 第 5 和 6 组(剂量 3)状态更新 队列 4 早期婴儿 n = 2 剂量 2 (1.1e11 gc/g) * 剂量 1 (3.3e10 gc/g) * COHORT 6 Early Infantile (n=3) 群组 5 Late Infantile (n=3) 群组 2 晚期婴儿 n = 2 群组 3 早期婴儿 n = 2 IDMC 评论 招募 完成 br {} 队列中受试者入学间隔 60 天 剂量 3 (2.2e)11 gc/g) * |
| 20 闭幕词 Will Chou,医学博士 |
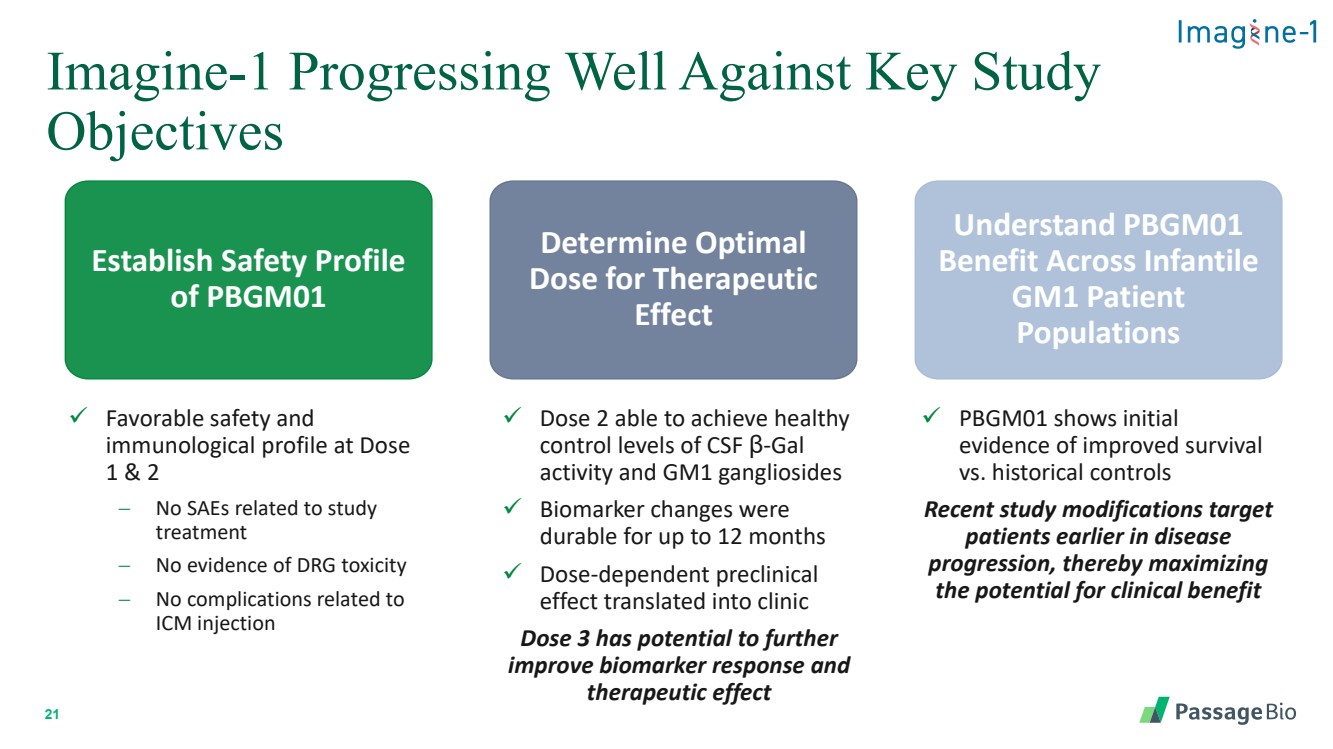
| 21 Imagine-1 在关键研究 目标方面进展良好 建立 PBGM01 的安全概况 确定治疗效果的最佳 剂量 了解 PBGM01 对婴儿的益处 GM1 患者 人群 ✓ 剂量 1 和 2 时的安全性和 免疫学特征 − 没有与研究 治疗相关的 SAE 没有证据的 DRG 毒性 − 没有与 ICM 注射相关的并发症 ✓ 剂量 2 能够达到健康的 脑脊液 β-gal 活性和 GM1 神经节苷脂 控制水平 ✓ 生物标志物的变化在 的持续时间长达12 个月 ✓ 剂量依赖性临床前 效应转化为临床 剂量 3 有可能进一步改善生物标志物反应而 治疗效果 ✓ PBGM01 显示了存活率与历史对照组相比提高的初始 证据 最近的研究修改针对的是疾病 进展早期的 患者,从而最大限度地提高了 获得临床益处的潜力 |
| 22 PBGM01 Program Anticipated Next Steps • Treated first patient at Dose 3 in July • Plan to share initial safety and biomarker data from Dose 3 by mid-2024 Complete enrollment of Cohorts 5 and 6 • Analyze data from Cohorts 1-6 to establish safety/tolerability profile and therapeutic potential of each dose Determine optimal dose for confirmatory study • Continued interactions with regulatory authorities as data set matures to align on design of confirmatory study and pathway to Biologics License Application Continue engagement with regulatory authorities |
| Q&A |